Similar presentations:
α-Аминокислоты. Биологически важные реакции α-аминокислот. Строение пептидов и белков (Лекция 26)
1. Лекция 26
Тема: α-Аминокислоты. Биологическиважные реакции α-аминокислот. Строение
пептидов и белков
2.
АМИНОКИСЛОТЫ. ПЕПТИДЫ И БЕЛКИАминокислоты – это гетерофункциональные соединения, имеющие в своих
молекулах одновременно две функциональые группы ٫а именно карбоксильную
–COOH и амино(-NH2) группы. Ни один из известных нам живых организмов не
обходится без α -аминокислот. α –Аминокислоты, как правило, входят в состав
полимеров-белков. Белки служат питательными веществами, регулирующими
обмен веществ, способствуют поглощению кислорода, играют важную роль в
функционировании нервной системы, являются механической основой мышечного
сокращения . Они участвуют в передаче генетической нформации. α –Аминокислоты
занимают ключевое положение в азотистом обмене. Многие из них используются в
качестве лекарственных веществ, влияющих на тканевой обмен ٫например ٫
глутаминовая кислота применяется для лечения заболеваний центральной нервной
системы, метионин и гистидин- глазных болезней и т.д.
Классификация аминокислот
Аминокислоты классифицируются несколькими способами:
1. В зависимости от расположения амино- и карбоксильной группы различаются α-,
β-, γ- и другие аминокислоты.
CH3-CH2-CH-COOH
NH
2
α – аминомасляная
(2- аминобутановая)
кислота
CH3-CH-CH2-COOH
NH2
β-аминомасляная
(3- аминобутановая)
кислота
CH2-CH2-CH2-COOH
NH
2
γ-аминомасляная
(4-аминобутановая)
кислота
3.
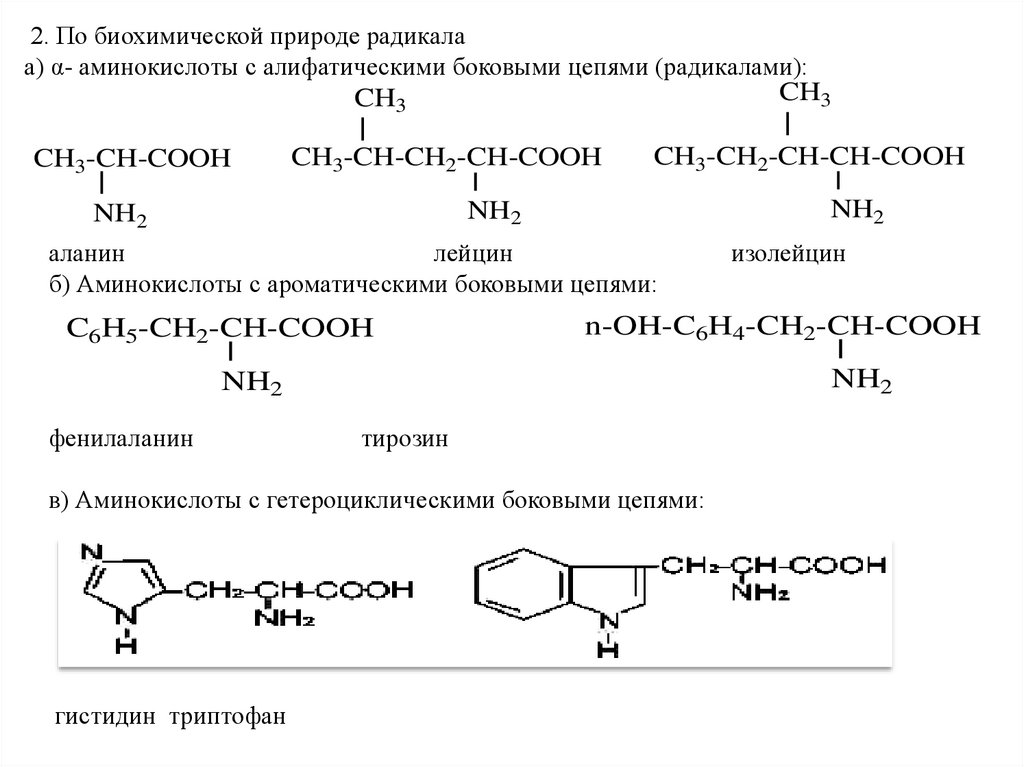
2. По биохимической природе радикалаа) α- аминокислоты с алифатическими боковыми цепями (радикалами):
CH3
CH3
CH3-CH-COOH
CH3-CH-CH2-CH-COOH
CH3-CH2-CH-CH-COOH
NH2
NH2
аланин
лейцин
б) Аминокислоты с ароматическими боковыми цепями:
C6H5-CH2-CH-COOH
NH2
тирозин
в) Аминокислоты с гетероциклическими боковыми цепями:
гистидин триптофан
изолейцин
n-OH-C6H4-CH2-CH-COOH
NH2
фенилаланин
NH2
4.
3. По числу карбоксильных и аминогруппВ зависимости от общего числа карбоксильных и
аминогрупп в молекуле, аминокислоты разделяют на
нейтральные, основные и кислотные.
Многие α-аминокислоты синтезируются в организме, а
некоторые, необходимые для синтеза белков не синтезируются в
организме и должны поступать из вне. Такие аминокислоты
называют незаменимыми: валин, лизин, изолейцин, лейцин,
треонин, метионин, фенилаланин, триптофан.
При
некоторых, чаще всего врожденных заболеваниях нарушается
обмен веществ. Перечень
незаменимых аминокислот
расширяется.
Например
при фенилкетонурии (нарушение
обмена веществ, каким-то образом связанное с некоторыми
умственными расстройствами) человеческий организм не
синтезирует еще одну α-аминокислоту- тирозин, который в
организме здоровых людей получается при гидроксилировании
фенилаланина.
5.
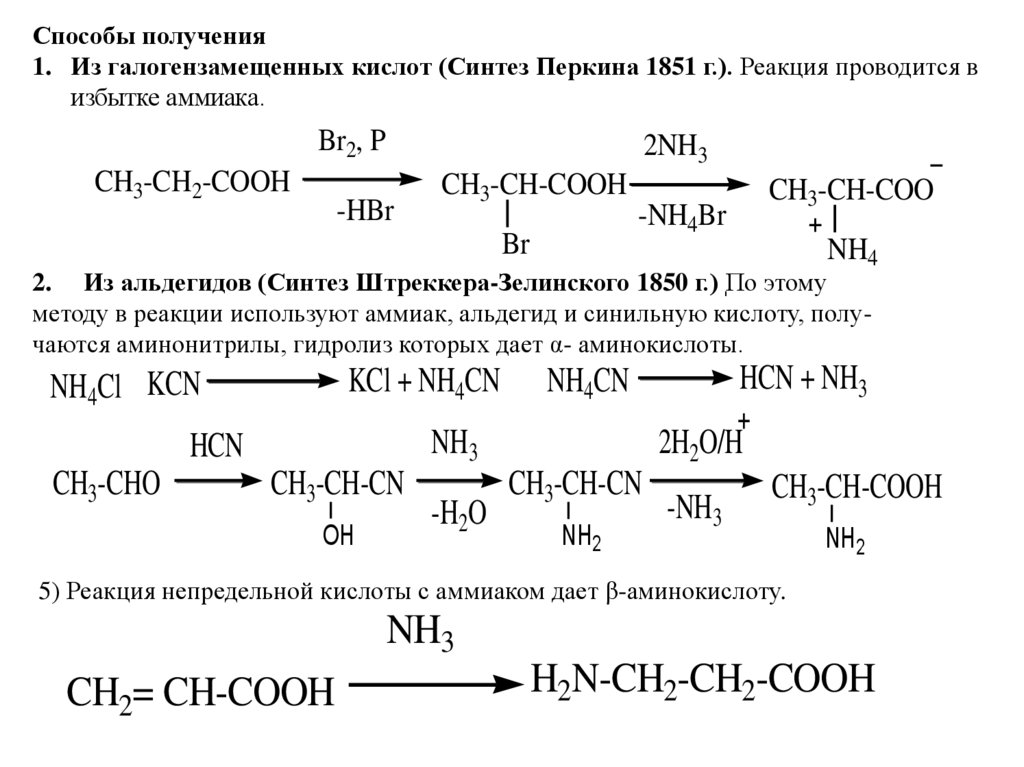
Способы получения1. Из галогензамещенных кислот (Синтез Перкина 1851 г.). Реакция проводится в
избытке аммиака.
Br2, P
CH3-CH2-COOH
2NH3
-HBr
CH3-CH-COOH
Br
CH3-CH-COO
-NH4Br
NH4
2. Из альдегидов (Синтез Штреккера-Зелинского 1850 г.) ֽПо этому
методу в реакции используют аммиак, альдегид и синильную кислоту, получаются аминонитрилы, гидролиз которых дает α- аминокислоты.
KCl + NH4CN
NH4Cl KCN
NH3
HCN
CH3-CHO
CH3-CH-CN
OH
-H2O
HCN + NH3
NH4CN
2H2O/H
CH3-CH-CN
NH2
-NH3
CH3-CH-COOH
NH2
5) Реакция непредельной кислоты с аммиаком дает β-аминокислоту.
NH3
CH2= CH-COOH
H2N-CH2-CH2-COOH
6.
Химические свойстваОбразование солей. α-Аминокислоты образуют соли как со щелочами, и так и с
кислотами.
R-CH-COOH
HCl
R-CH-COOH
NaOH
R-CH-COONa
Cl
NH3
NH2
+ H2O
NH2
Со многими ионами тяжелых металлов α-аминокислоты образуют хелатные
комплексы (внутрикомплексные соединения, например, с гидроксидом меди (II) в
мягких условиях получаются малорастворимые хелаты меди II синего цвета, они
устойчивы в щелочной среде и используются для обнаружения α-аминокислот).
O
C
H2N
C
R
CH
Cu
HC
R
NH2
C
O
O
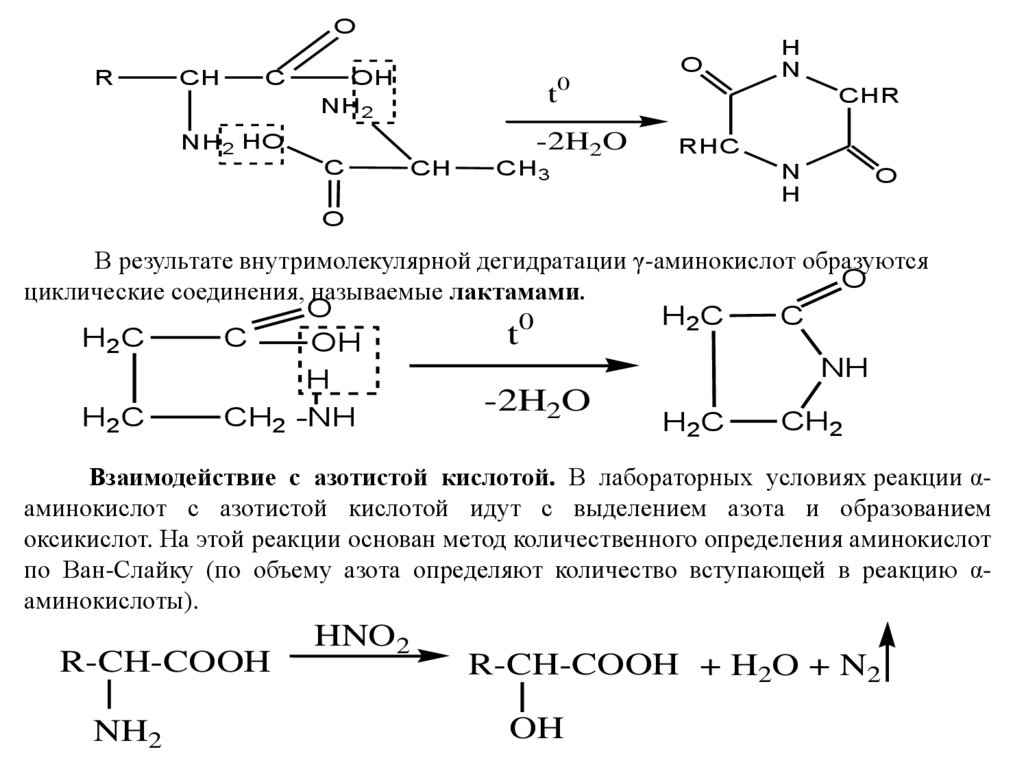
Образование дикетопиперазинов
В результате межмолекулярной дегидратации из двух молекул α-аминокислот
образуются циклические соединения, называемые 2‚5-дикетопиперазинами
7.
OR
CH
C
O
OH
NH2
t0
-2H2O
NH2 HO
C
CH
CH3
H
N
CHR
RHC
N
H
O
O
В результате внутримолекулярной дегидратации γ-аминокислот образуются
O
циклические соединения, называемые лактамами.
O
H2C
C
0
t
H2C
C
OH
NH
H
-2H2O
H2C
CH2 -NH
CH2
H2C
Взаимодействие с азотистой кислотой. В лабораторных условиях реакции αаминокислот с азотистой кислотой идут с выделением азота и образованием
оксикислот. На этой реакции основан метод количественного определения аминокислот
по Ван-Слайку (по объему азота определяют количество вступающей в реакцию αаминокислоты).
R-CH-COOH
NH2
HNO2
R-CH-COOH + H2O + N2
OH
8.
Взаимодействие с формальдегидом. При взаимодействии α-аминокислот сальдегидами образуются замещенные имины ( основания Шиффа), карбоксильная
группа при этом оказывается свободной и может
быть оттитрована щелочью. Эту реакцию используют для количественного
определения α-аминокислот.
R-CH-COOH + O= CH - R
NH2
R-CH-COOH
NH-CHR
R-CH-COOH
H2O
N = CHR
OH
карбиноламин
замещенный
имин (основание Шиффа)
Реакция с формальдегидом лежит в основе количественного определения
аминокислот методом формольного титрования (метод Серенсена).
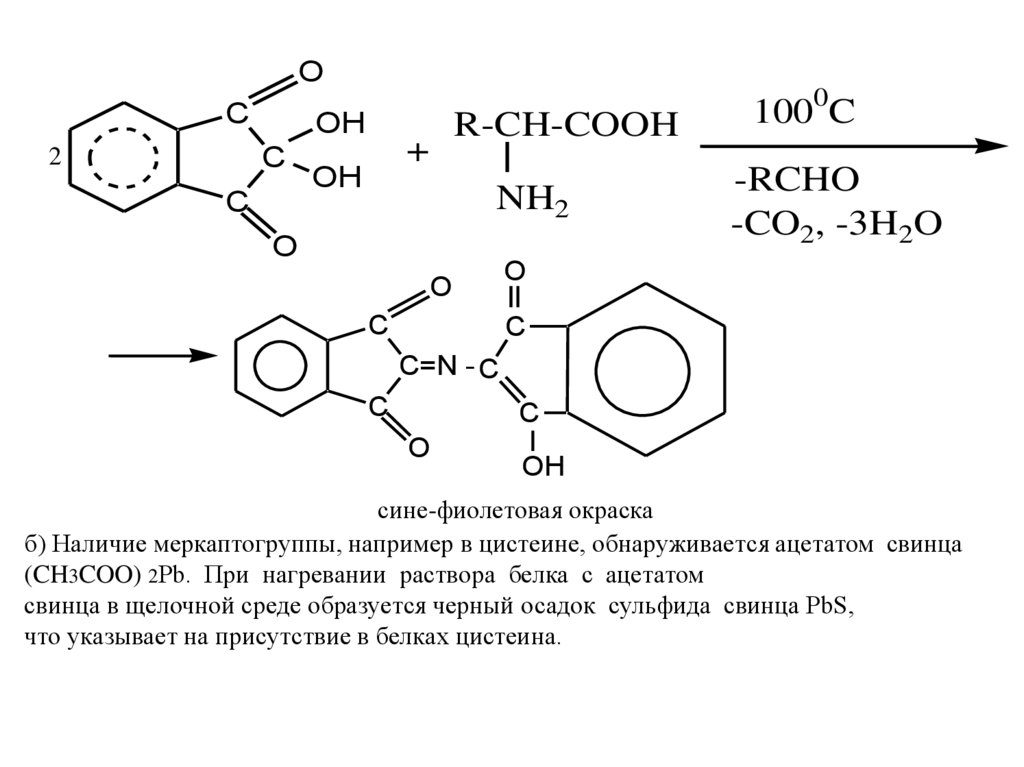
Качественные реакции
а) Общая качественная реакция α-аминокислот- реакция с нингидрином.
Продукты реакции α-аминокислот с нингидрином имеют сине-фиолетовый
цвет, что используются для визуального обнаружения аминокислот на хроматограммах (на бумаге, в тонком слое).
9.
OC
OH
C
2
C
R-CH-COOH
+
OH
NH2
O
O
C
1000C
-RCHO
-CO2, -3H2O
O
C
C=N - C
C
C
O
OH
сине-фиолетовая окраска
б) Наличие меркаптогруппы, например в цистеине, обнаруживается ацетатом свинца
(CH3COO) 2Pb. При нагревании раствора белка с ацетатом
свинца в щелочной среде образуется черный осадок сульфида свинца PbS,
что указывает на присутствие в белках цистеина.
10.
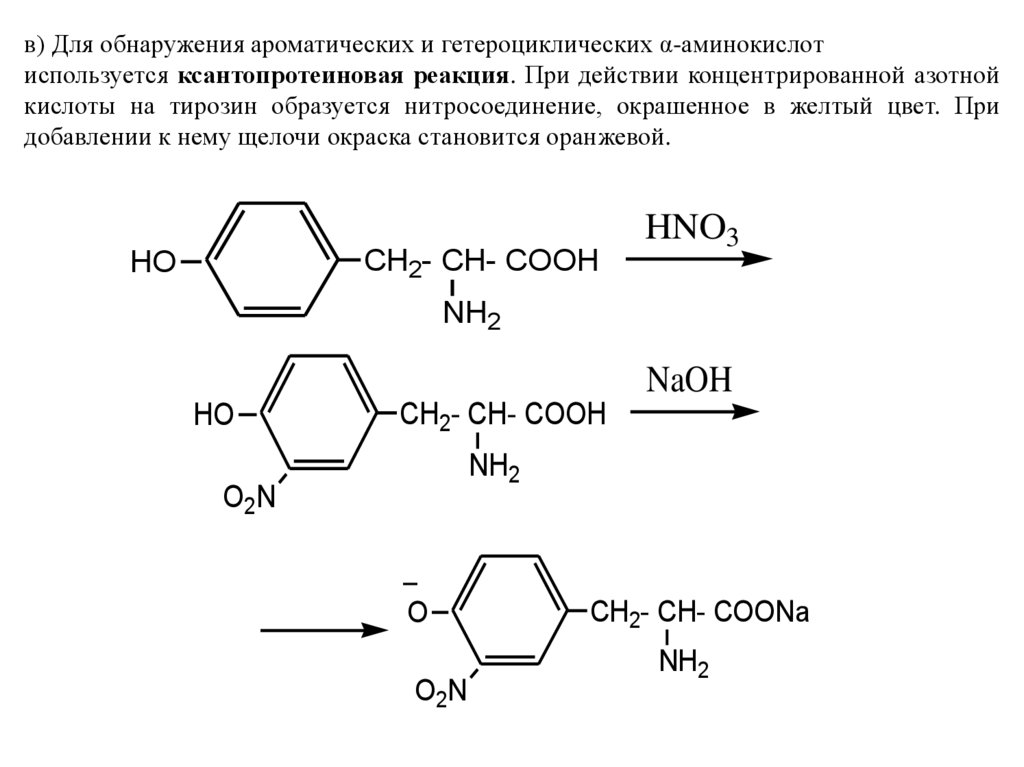
в) Для обнаружения ароматических и гетероциклических α-аминокислотиспользуется ксантопротеиновая реакция. При действии концентрированной азотной
кислоты на тирозин образуется нитросоединение, окрашенное в желтый цвет. При
добавлении к нему щелочи окраска становится оранжевой.
CH2- CH- COOH
HO
HNO3
NH2
NaOH
HO
CH2- CH- COOH
NH2
O2 N
O
O2 N
CH2- CH- COONa
NH2
11.
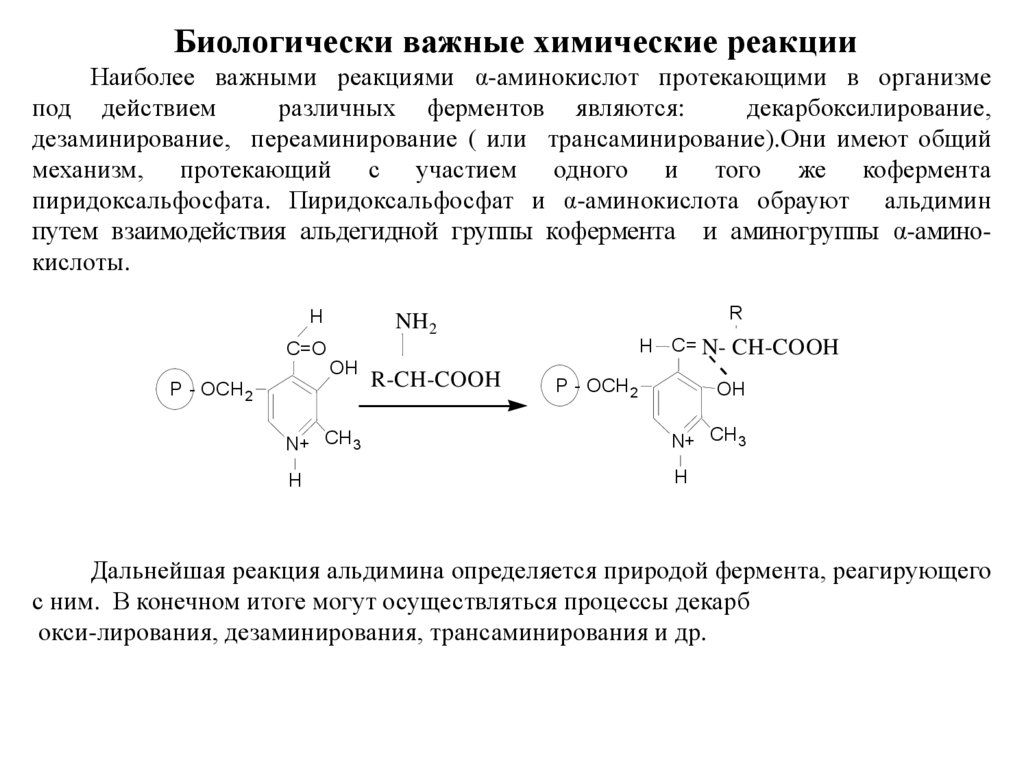
Биологически важные химические реакцииНаиболее важными реакциями α-аминокислот протекающими в организме
под действием
различных ферментов являются:
декарбоксилирование,
дезаминирование, переаминирование ( или трансаминирование).Οни имеют общий
механизм, протекающий с участием одного и того же кофермента
пиридоксальфосфата. Пиридоксальфосфат и α-аминокислота обрауют альдимин
путем взаимодействия альдегидной группы кофермента и аминогруппы α-аминокислоты.
H
R
NH2
H
C=O
OH
P - OCH 2
R-CH-COOH
C= N-
P - OCH 2
CH-COOH
OH
N+ CH 3
N+ CH 3
H
H
Дальнейшая реакция альдимина определяется природой фермента, реагирующего
с ним. В конечном итоге могут осуществляться процессы декарб
окси-лирования, дезаминирования, трансаминирования и др.
12.
Реакция декарбоксилирования.В результате декарбоксилирования αаминокислот в организме образуются биогенные амины (первичные амины):R-CH-COO
декарбоксилаза, пиридоксалфосфат
NH3
R - CH2 - NH2
-CO2
Биогенный амин
α-Аминокислоты в виде цвиттер-иона легко декарбоксилируются. В
лабораторных условиях эта реакция протекает при нагревании α-аминокислот в
присутствии Ba(OH)2
Биогенные амины в организме выполняют важные биологические функции.
Например, при декарбоксилировании гистидина образуется биогенный амин
гистамин, который обладает широким спектром биологического действия и, в
частности, его избытка в организме приводит к аллергию.
N
N
CH2- CH -COOH
N
H
NH2
-CO2
CH2- CH2
N
H
NH2
13.
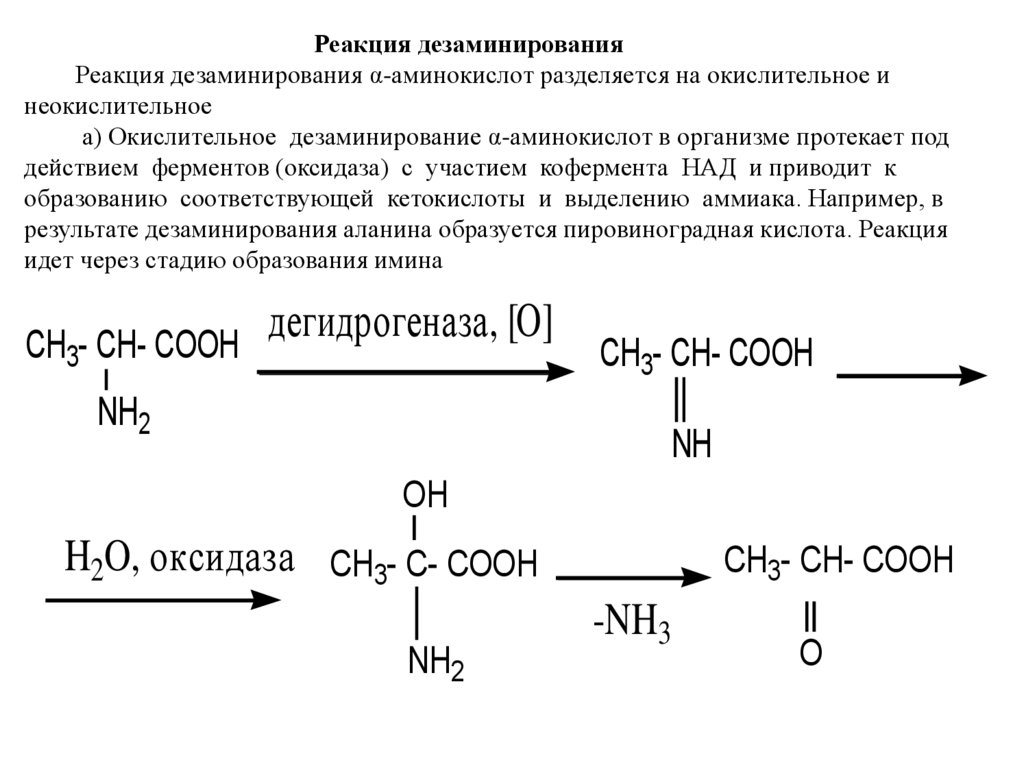
Реакция дезаминированияРеакция дезаминирования α-аминокислот разделяется на окислительное и
неокислительное
а) Окислительное дезаминирование α-аминокислот в организме протекает под
действием ферментов (оксидаза) с участием кофермента НАД и приводит к
образованию соответствующей кетокислоты и выделению аммиака. Например, в
результате дезаминирования аланина образуется пировиноградная кислота. Реакция
идет через стадию образования имина
дегидрогеназа,
[O]
CH3- CH- COOH
CH3- CH- COOH
NH2
NH
OH
H2O, оксидаза CH3- C- COOH
NH2
CH3- CH- COOH
-NH3
O
14.
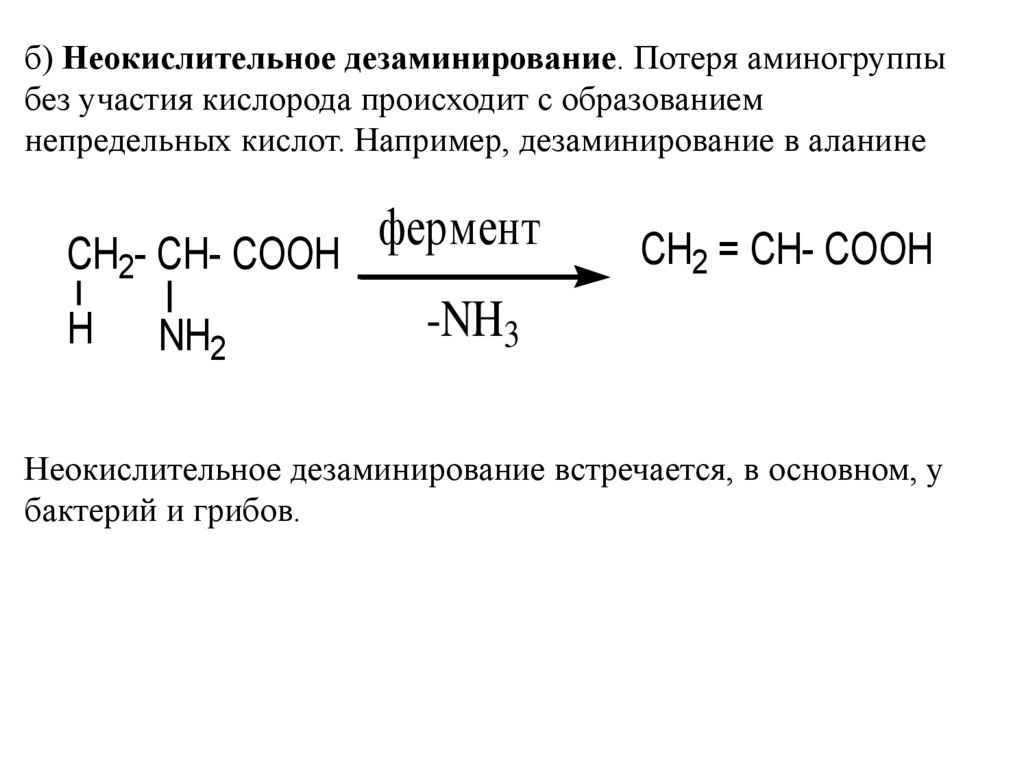
б) Неокислительное дезаминирование. Потеря аминогруппыбез участия кислорода происходит с образованием
непредельных кислот. Например, дезаминирование в аланине
фермент
CH2- CH- COOH
-NH3
H NH2
CH2 = CH- COOH
Неокислительное дезаминирование встречается, в основном, у
бактерий и грибов.
15.
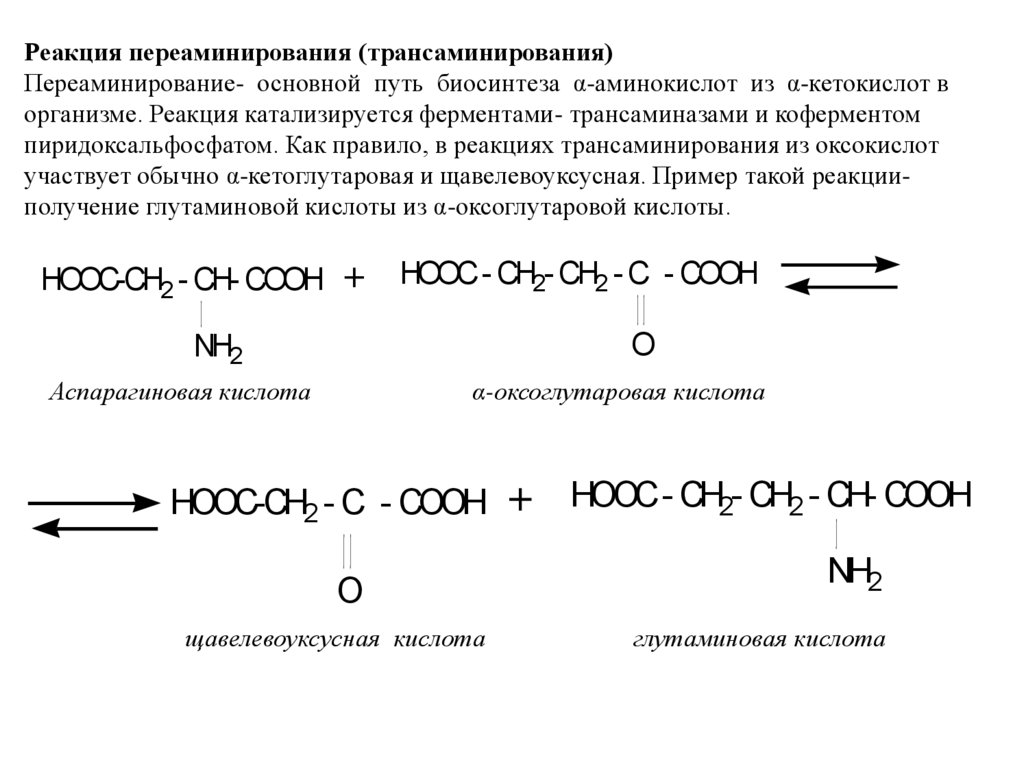
Реакция переаминирования (трансаминирования)Переаминирование- основной путь биосинтеза α-аминокислот из α-кетокислот в
организме. Реакция катализируется ферментами- трансаминазами и коферментом
пиридоксальфосфатом. Как правило, в реакциях трансаминирования из оксокислот
участвует обычно α-кетоглутаровая и щавелевоуксусная. Пример такой реакцииполучение глутаминовой кислоты из α-оксоглутаровой кислоты.
HOOC-CH2 - CH- COOH
+ HOOC- CH2- CH2 - C - COOH
O
NH2
Аспарагиновая кислота
α-оксоглутаровая кислота
HOOC-CH2 - C - COOH
O
щавелевоуксусная кислота
+ HOOC- CH2- CH2 - CH- COOH
NH2
глутаминовая кислота
16.
Пептиды и белки. Первичная структура пептидов и белковАминокислоты способны к поликонденсации, в результате которой
образуется полипептид. Амидная группа (-CO-NH-) в таких соединениях
называется пептидной группой. В зависимости от числа аминокислотных
остатков в молекуле пептиды классифицируются как дипептиды,
трипептиды и т.д. вплоть до полипептидов. Условно считают, что пептиды имеют молекулярную массу менее 10000,
а белки более 10000.
Природные гетерополимеры - белки это полипептиды с очень сложной
аминокислотной последовательностью, самое незначительное изменение которой приводит к нарушению или даже полному исчезновению биологической активности полипептида.
Аминокислота со свободной аминогруппой на конце полипептида называется «N-концевой аминокислотой», аминокислота со свободной карбоксильной группой на другом конце этого полипептида -«С- концевой аминокислотой».
17.
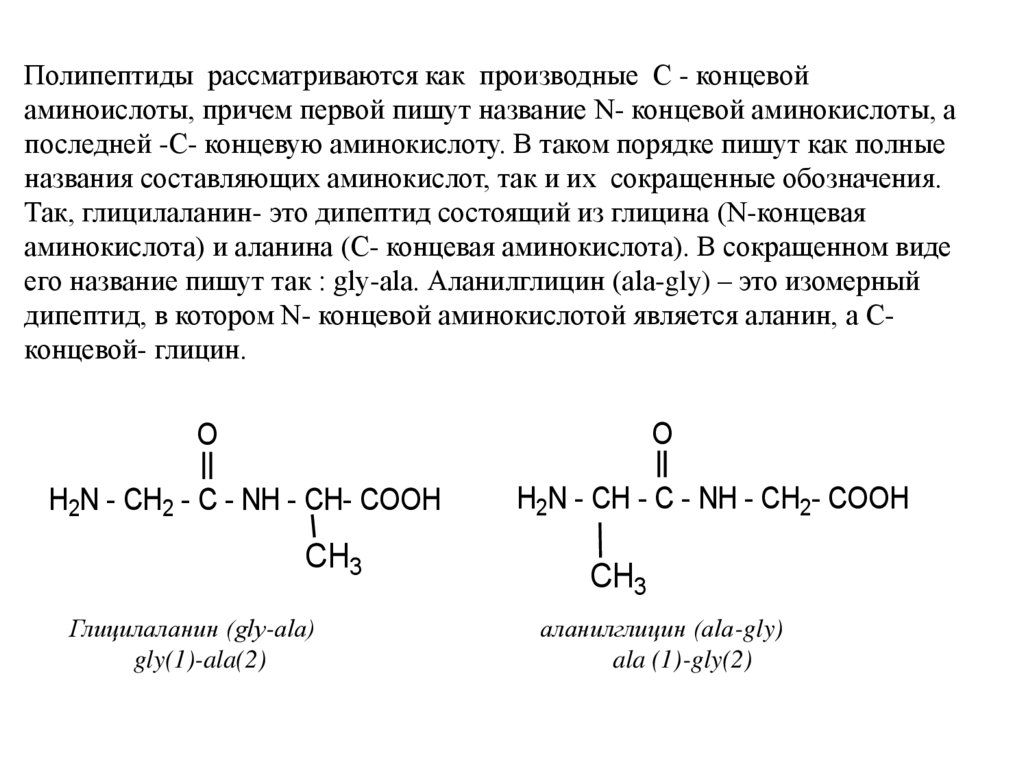
Полипептиды рассматриваются как производные С - концевойаминоислоты, причем первой пишут название N- концевой аминокислоты, а
последней -С- концевую аминокислоту. В таком порядке пишут как полные
названия составляющих аминокислот, так и их сокращенные обозначения.
Так, глицилаланин- это дипептид состоящий из глицина (N-концевая
аминокислота) и аланина (С- концевая аминокислота). В сокращенном виде
его название пишут так : gly-ala. Аланилглицин (ala-gly) – это изомерный
дипептид, в котором N- концевой аминокислотой является аланин, а Сконцевой- глицин.
O
O
H2N - CH2 - C - NH - CH- COOH
CH3
Глицилаланин (gly-ala)
gly(1)-ala(2)
H2N - CH - C - NH - CH2- COOH
CH3
аланилглицин (ala-gly)
ala (1)-gly(2)
18.
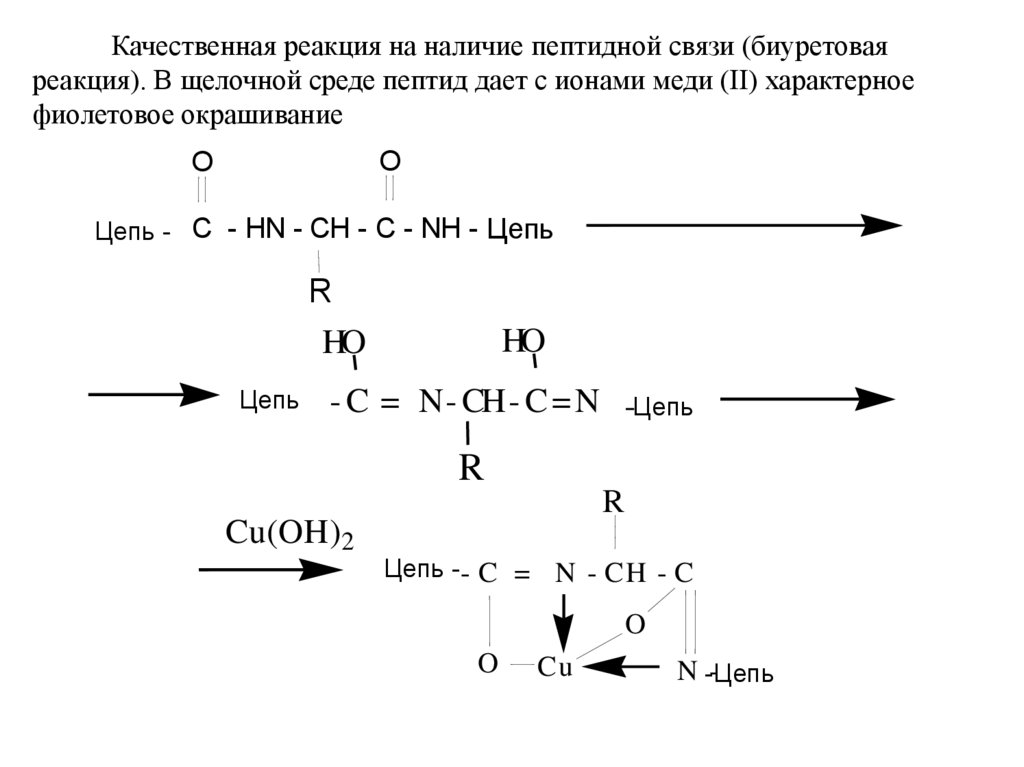
Качественная реакция на наличие пептидной связи (биуретоваяреакция). В щелочной среде пептид дает с ионами меди (II) характерное
фиолетовое окрашивание
O
O
Цепь - C - HN - CH - C - NH - Цепь
R
HO
HO
Цепь
- C = N- CH- C = N -Цепь
R
R
Cu(OH)2
Цепь -- C = N - CH - C
O
O
Cu
N -Цепь
-







 chemistry
chemistry








