Similar presentations:
Аминокислоты. Пептиды. Белки
1.
Федеральное государственное бюджетное образовательное учреждениевысшего образования
Кемеровский государственный медицинский университет
Министерства здравоохранения Российской Федерации
Кафедра фармацевтической и общей химии
АМИНОКИСЛОТЫ.
ПЕПТИДЫ. БЕЛКИ
2.
ПЛАН ЛЕКЦИИ:1. Аминокислоты (строение, классификация).
2. Химические свойства (амфотерность,
образование внутренних солей, реакция
поликонденсации – образование пептидной
связи). Изоэлектрическая точка.
3. Биологически важные реакции аминокислот.
Декарбоксилирование. Дезаминирование.
Трансаминирование (переаминирование).
4. Пептиды, белки (строение, классификация).
2
3.
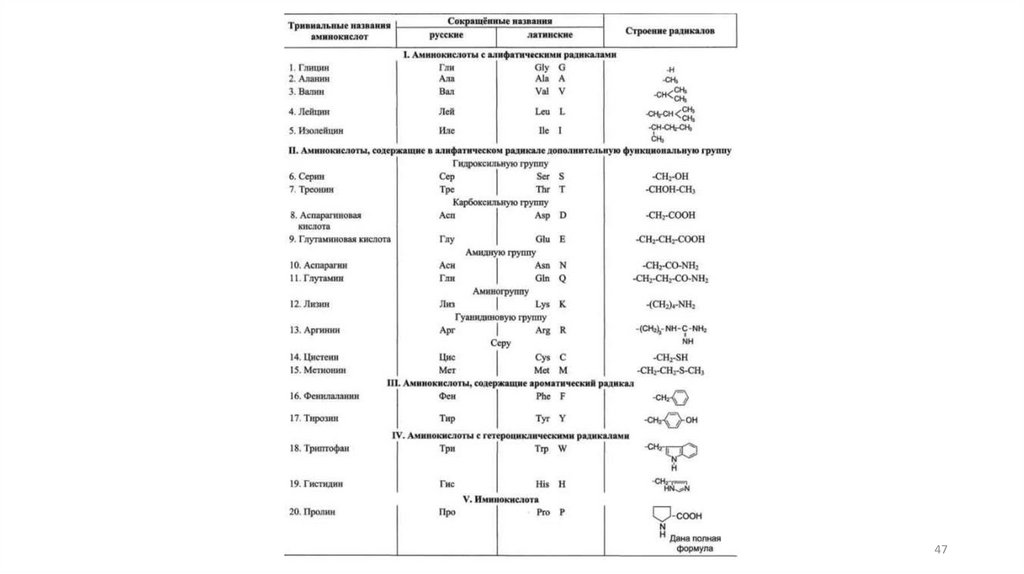
1. Аминокислоты (строение, классификация)3
4.
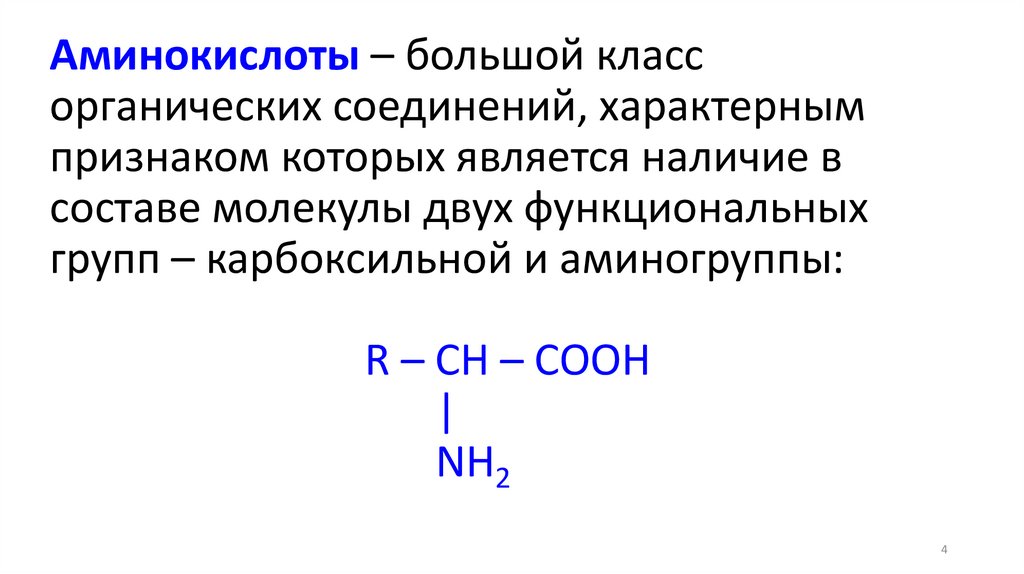
Аминокислоты – большой классорганических соединений, характерным
признаком которых является наличие в
составе молекулы двух функциональных
групп – карбоксильной и аминогруппы:
R – CH – COOH
|
NH2
4
5.
Аминокислоты (АмК) делят на:– природные;
– синтетические.
5
6.
АмК условно делятся на:1.АмК, которые участвуют в образовании
пептидов и белков. Для них характерно
только а-строение и все принадлежат к
L-стереоряду.
2.АмК, которые обладают биологической
активностью, но не являются мономерами
природных полимеров белков и пептидов.
6
7.
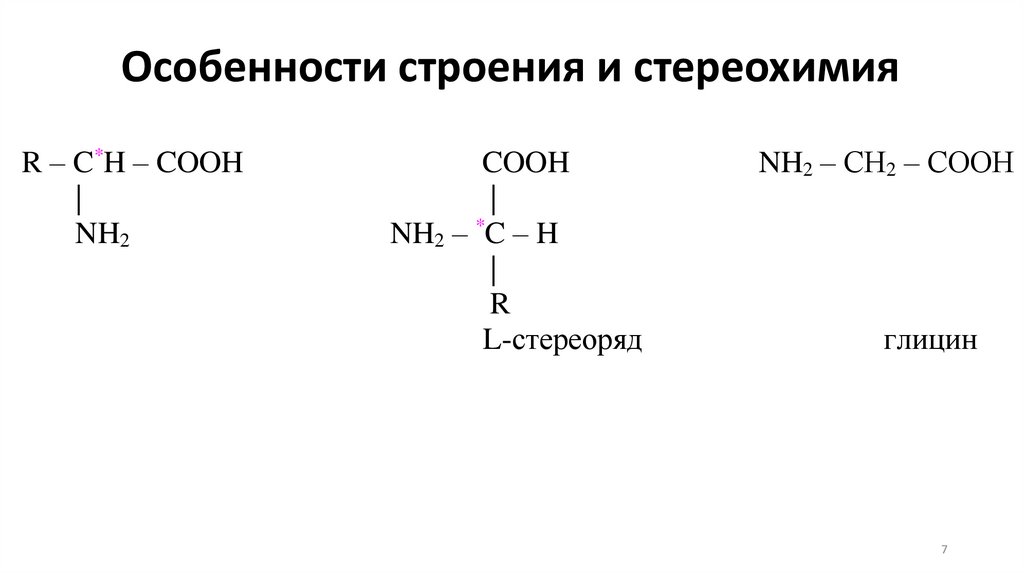
Особенности строения и стереохимияR – C*H – COOH
|
NH2
COOH
|
NH2 – *C – H
|
R
L-стереоряд
NH2 – СН2 – СООН
глицин
7
8.
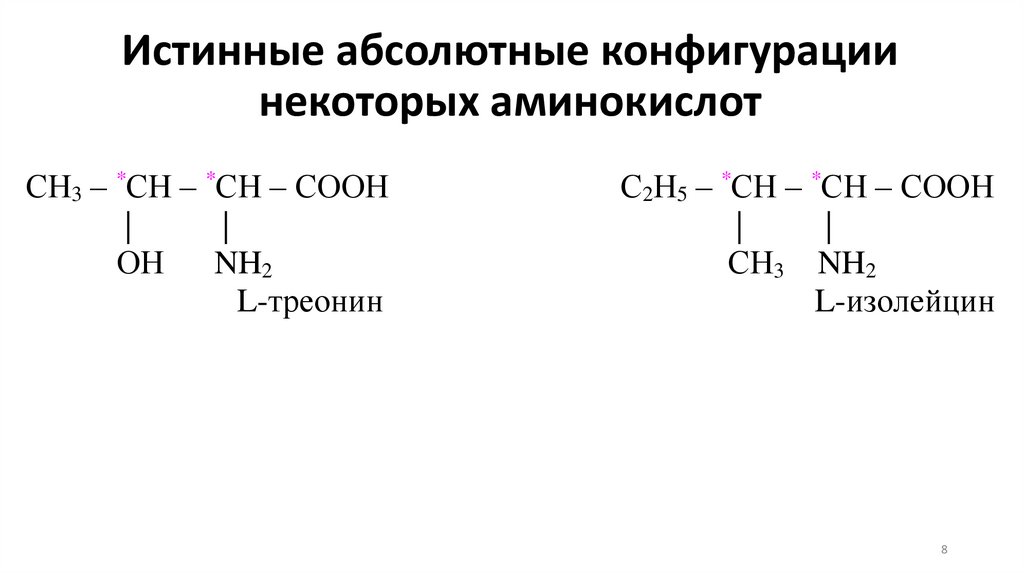
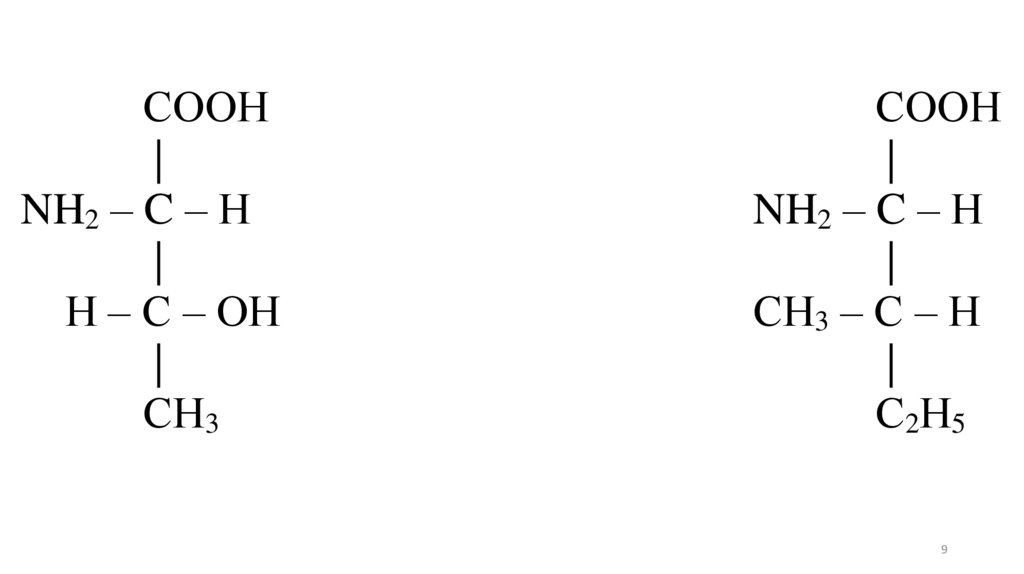
Истинные абсолютные конфигурациинекоторых аминокислот
СН3 – *СН – *СН – СООН
|
|
ОН
NH2
L-треонин
С2Н5 – *СН – *СН – СООН
|
|
СН3 NH2
L-изолейцин
8
9.
СООН|
NH2 – C – Н
|
Н – С – ОН
|
СН3
СООН
|
NH2 – C – Н
|
СН3 – С – Н
|
С2Н5
9
10.
Классификация аминокислот по:– значению изоэлектрической точки – нейтральные,
основные, кислые;
– числу аминогрупп – моноамино-, диаминокарбоновые
кислоты;
– количеству карбоксильных групп – одно-,
двухкарбоновые;
– взаимному расположению функциональных групп –
α, β, γ, δ, ε-аминокислоты;
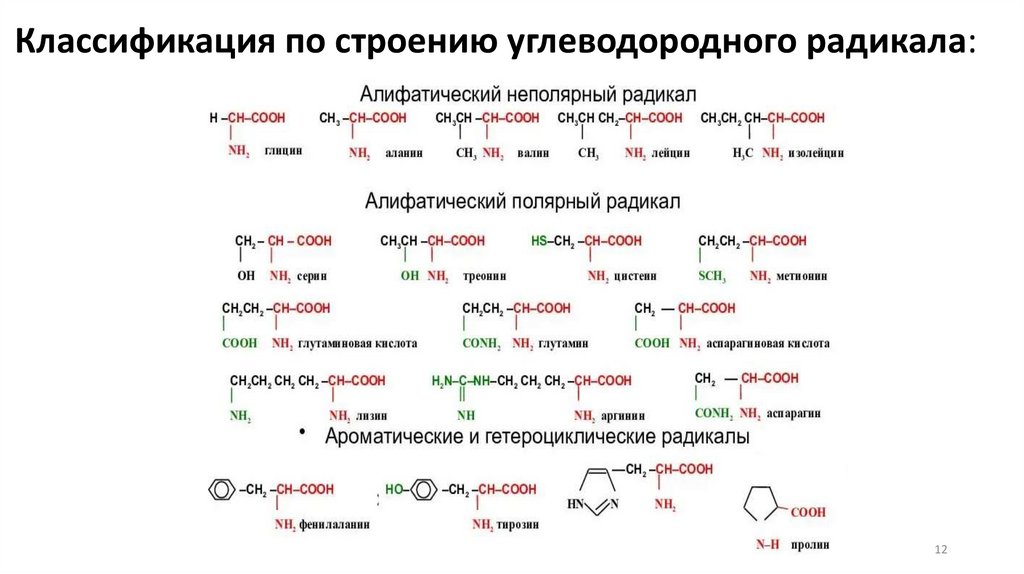
– строению углеводородного радикала –
алифатические, ароматические, гетероциклические.
10
11.
Классификация в зависимости от числа карбоксильных иаминогрупп:
–
нейтральные
(моноамино-,
одна NH2 и одна СООН группы
–
монокарбоновые)
– СН3 – СН – СООН
|
NН2 Аланин
основные
(диамино-, H2N – CH2 – CH2 – CH2 – CH2 – CH – COOH
|
монокарбоновые) – две NH2 и одна
NH2 Лизин
СООН группы
– кислые (моноамино-, дикарбоновые) – HООС – CH2 – CH – COOH
|
одна NH2 и две СООН группы
NH2
Аспарагиновая
кислота
11
12.
Классификация по строению углеводородного радикала:12
13.
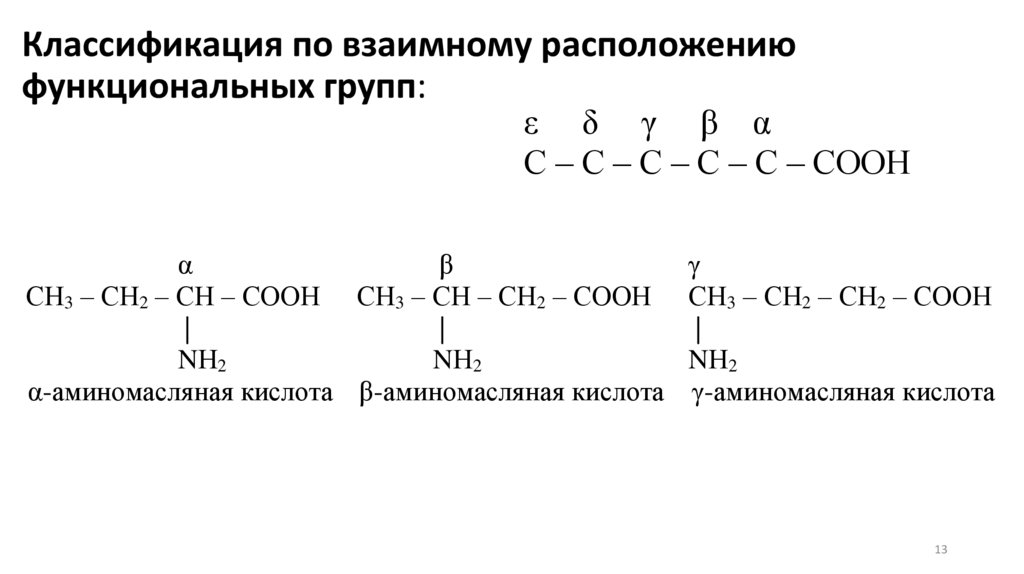
Классификация по взаимному расположениюфункциональных групп:
ε δ γ β α
С – С – С – С – С – СООН
α
β
СН3 – СН2 – СН – СООН СН3 – СН – СН2 – СООН
|
|
NН2
NН2
α-аминомасляная кислота β-аминомасляная кислота
γ
СН3 – СН2 – СН2 – СООН
|
NН2
γ-аминомасляная кислота
13
14.
2. Химические свойства(амфотерность, образование внутренних солей,
реакция поликонденсации – образование
пептидной связи).
Изоэлектрическая точка
14
15.
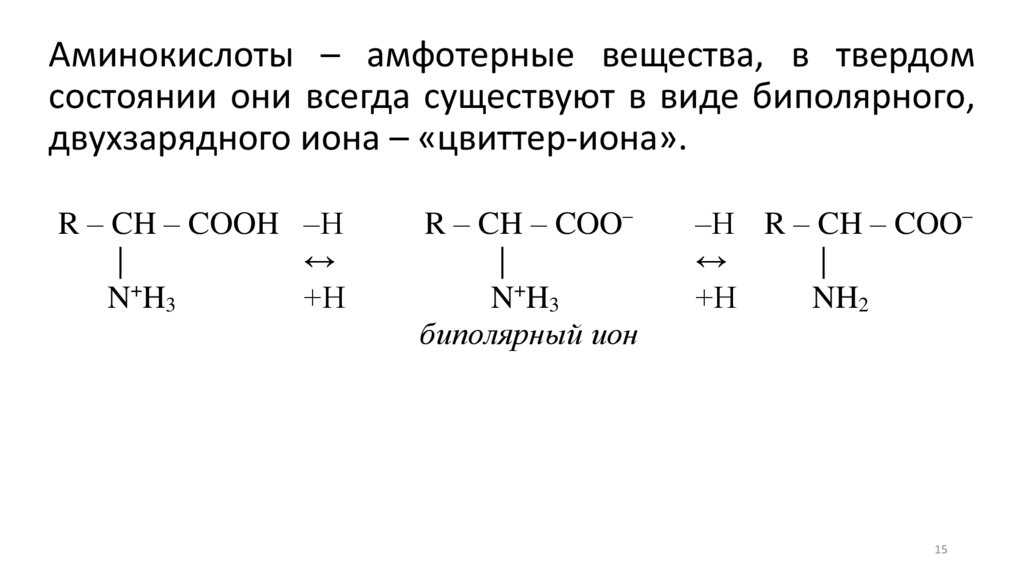
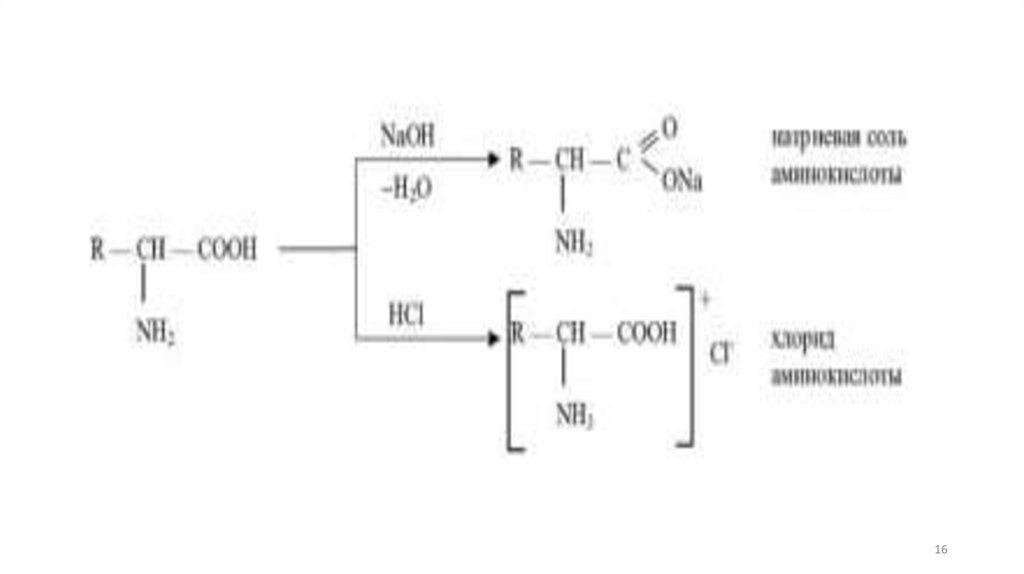
Аминокислоты – амфотерные вещества, в твердомсостоянии они всегда существуют в виде биполярного,
двухзарядного иона – «цвиттер-иона».
R – CH – COOH –Н
|
↔
N+H3
+Н
R – CH – COO–
|
N+H3
биполярный ион
–Н R – CH – COO–
↔
|
+Н
NH2
15
16.
1617.
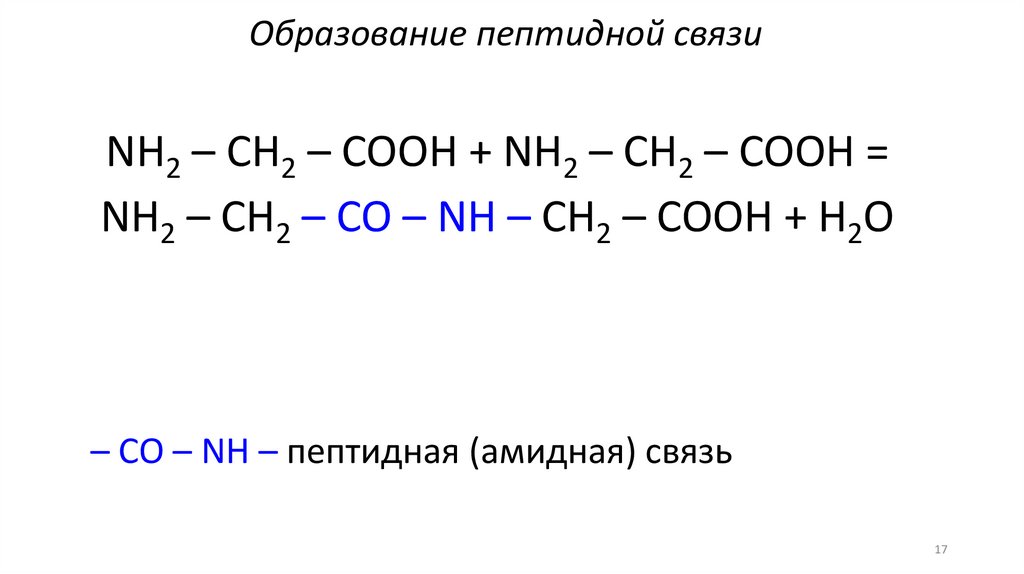
Образование пептидной связиNH2 – CH2 – COOH + NH2 – CH2 – COOH =
NH2 – CH2 – CO – NH – CH2 – COOH + H2O
– CO – NH – пептидная (амидная) связь
17
18.
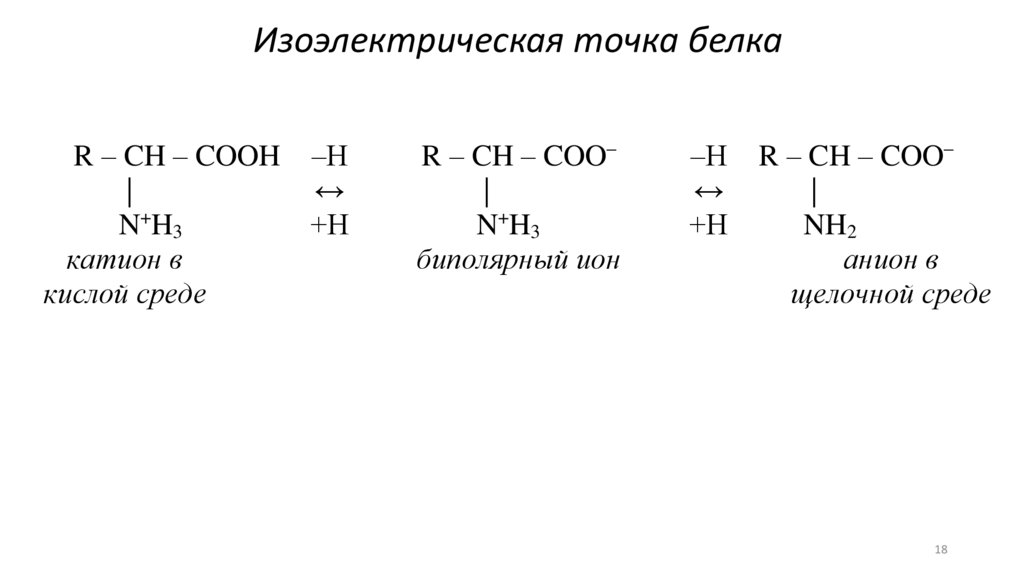
Изоэлектрическая точка белкаR – CH – COOH –Н
|
↔
N+H3
+Н
катион в
кислой среде
R – CH – COO–
|
N+H3
биполярный ион
–Н
↔
+Н
R – CH – COO–
|
NH2
анион в
щелочной среде
18
19.
Изоэлектрическая точка (pI) – значениерН, при котором аминокислота находится
в виде биполярного иона.
19
20.
Водные растворы аминокислот обладаютбуферными свойствами. При добавлении
кислоты
или
щелочи
аминокислоты
приобретают тот или иной заряд: если рН
раствора больше, чем рI, преобладают
анионы кислоты, если меньше, чем рI, то
преобладают катионы кислоты.
20
21.
3. Биологически важные реакцииаминокислот.
Декарбоксилирование. Дезаминирование.
Трансаминирование (переаминирование)
21
22.
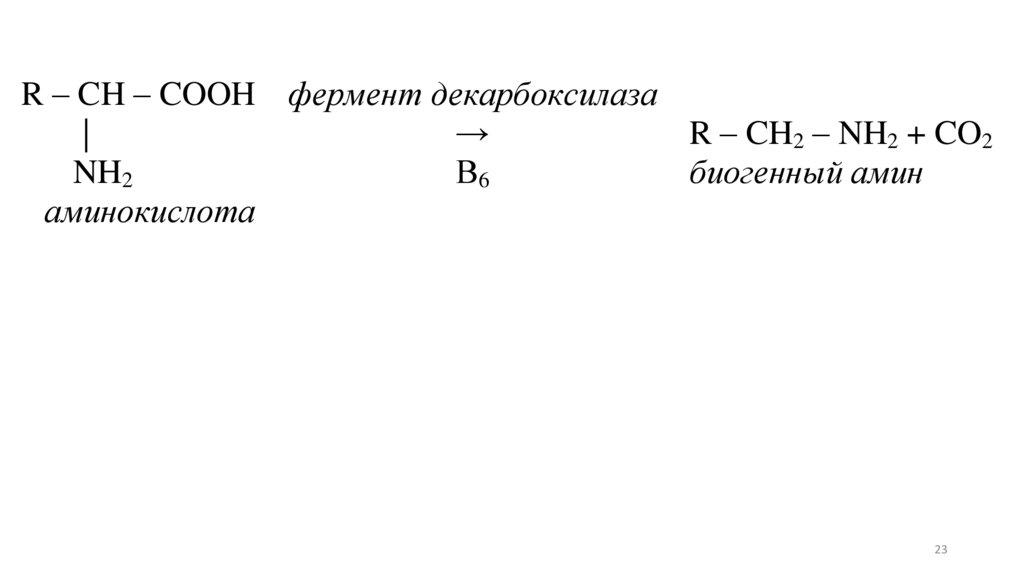
Декарбоксилирование – это путьобразования биогенных аминов. В организме
эта реакция катализируется ферментами –
декарбоксилазами.
22
23.
R – CH – COOH фермент декарбоксилаза|
→
R – CH2 – NH2 + CO2
NH2
В6
биогенный амин
аминокислота
23
24.
В организме дезаминированиеосуществляется неокислительным и
окислительным путями.
24
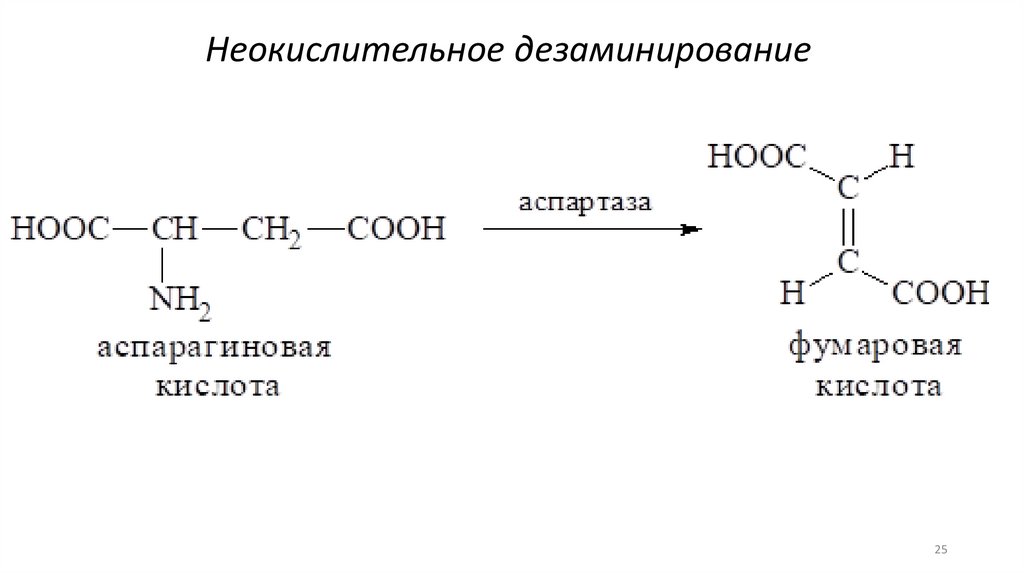
25.
Неокислительное дезаминирование25
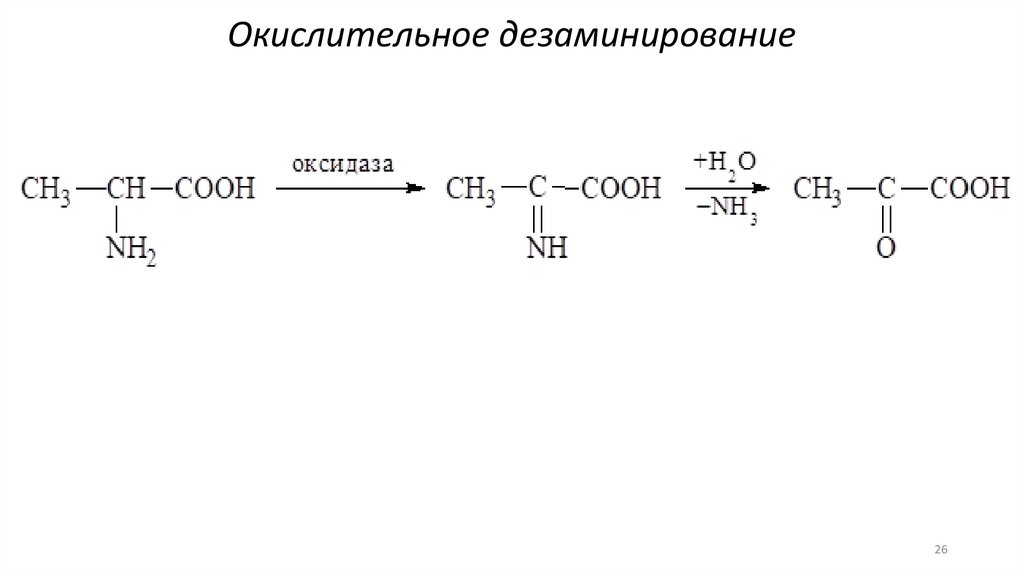
26.
Окислительное дезаминирование26
27.
2728.
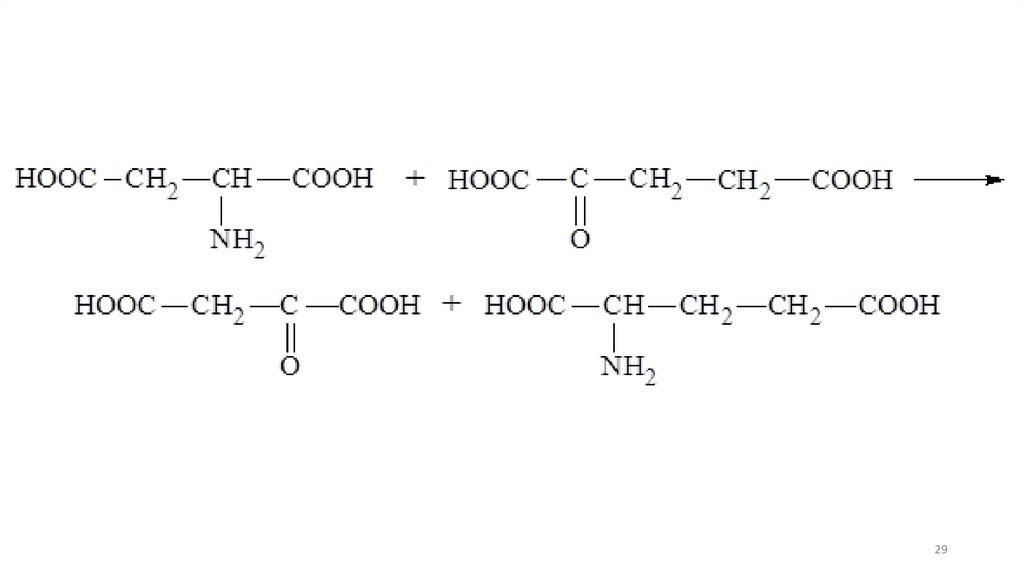
Трансаминирование(переаминирование) служит не только
для разрушения аминокислот, но и для
их биосинтеза. Реакция сводится к
взаимопревращению аминогруппы и
карбонильной группы под действием
ферментов трансаминаз.
28
29.
2930.
4. Пептиды, белки(строение, классификация)
30
31.
Пептиды, белки, или протеины –высокомолекулярные,
азотсодержащие
органические
полимеры,
построенные
из
остатков α-аминокислот.
31
32.
Структура белков:первичная,
вторичная,
третичная,
четвертичная
32
33.
Первичная структура определяетсяфакторами:
1) природой АмК, входящих в состав
белков;
2) количеством АмК;
3) последовательностью АмК.
33
34.
3435.
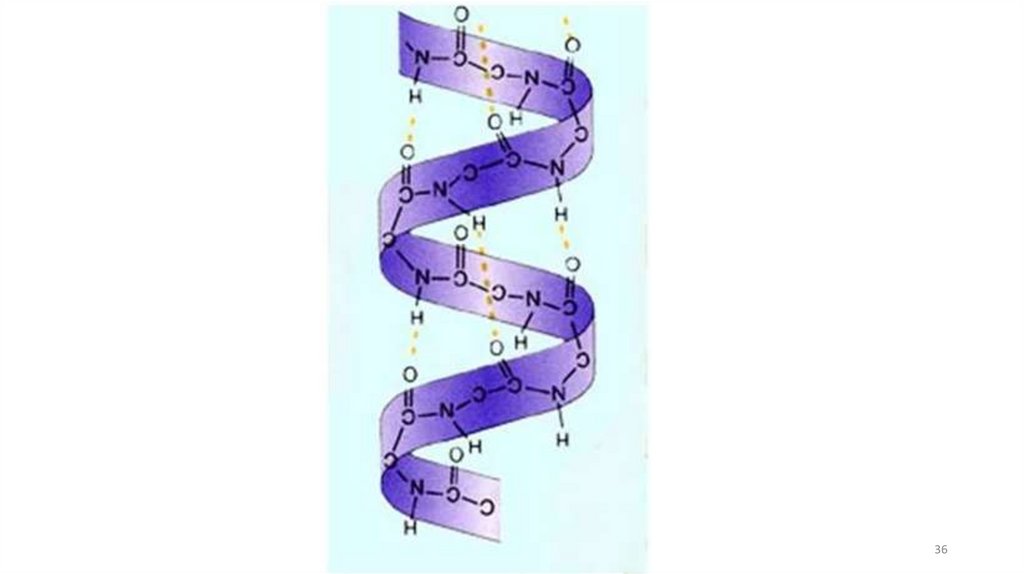
Вторичная структура белка –полипептидная цепь, скрученная в
спираль, которая удерживается
посредством образования слабых, но
многочисленных водородных связей
между остатками карбоксильной (С = О) и
аминогруппами (NH2) различных АмК.
35
36.
3637.
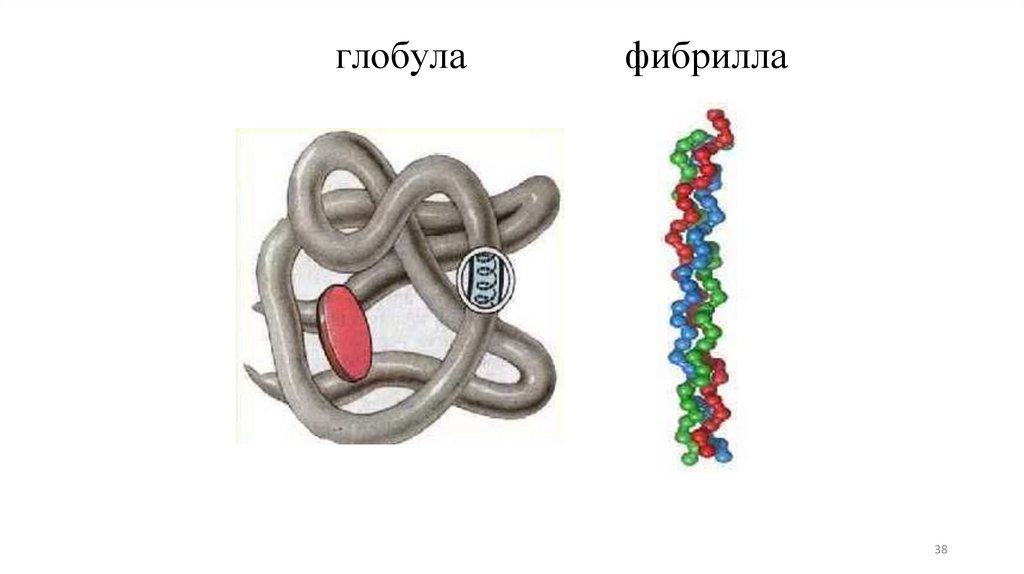
Третичная структура белка – ещеболее компактная молекула. Нить
АмК далее свертывается, образуя
клубок или фибриллу, для
каждого белка специфичную.
37
38.
глобулафибрилла
38
39.
Четвертичная структура белкахарактерна не для всех белков.
Она возникает в результате
соединения нескольких глобул в
сложный комплекс. Например,
гемоглобин человека (белковая
часть – глобин).
39
40.
4041.
По функциям белки классифицируют:1. Ферменты.
2. Регуляторные (инсулин, ДНК-связывающие
белки).
3. Транспортные (гемоглобин).
4. Структурные (коллаген, эластин).
5. Защитные (иммуноглобулины, фибронектин).
6. Сократительные (актин, миозин).
7. Рецепторные и др.
41
42.
По составу белки различают:1. Протеины, состоящие только из аминокислот.
2. Протеиды – содержащие небелковую часть.
3. Простые белки – состоят из аминокислот.
4. Сложные белки – могут включать углеводы
(гликопротеиды), жиры (липопротеиды),
нуклеиновые кислоты (нуклеопротеиды).
5. Полноценные – содержат весь набор
аминокислот.
6. Неполноценные – какие-то аминокислоты в них
отсутствуют.
42
43.
По числу аминокислотныхостатков в пептиде различают:
– олигопептиды – меньше 10;
– полипептиды – до 50;
– белки – больше 50.
43
44.
Простые белки (протеины):1) Альбумины.
2) Глобулины.
3) Гистоны.
4) Протамины.
5) Проламины.
6) Кератины.
7) Коллагены.
8) Элластины.
44
45.
Сложные белки (протеиды)Это системы, состоящие из простого белка и небелкового
соединения (простетическая группа). Функцию этой
группы выполняют углеводы, липиды, витамины,
гормоны. В настоящее время группу сложных белков
принято разделять на две большие подгруппы:
– стабильные – с прочными химическими связями
между белком и простетической группой;
– лабильные – имеющие непрочные связи белка с
простетической группой (например, водородные связи).
45
46.
1) Фосфопротеиды.2) Гликопротеиды.
3) Хромопротеиды.
4) Нуклеопротеиды.
5) Липопротеиды.
46
47.
4748.
БЛАГОДАРЮ ЗА ВНИМАНИЕ!48































 chemistry
chemistry