Similar presentations:
Нуклеофильное замещение галогена и других функциональных групп
1. НУКЛЕОФИЛЬНОЕ ЗАМЕЩЕНИЕ ГАЛОГЕНА И ДРУГИХ ФУНКЦИОНАЛЬНЫХ ГРУПП
1.Нуклеофильное замещение галогена вмолекуле органического соединения
(Механизмы SN1, SN2, SNAr, SNEA )
2.Нуклеофильное замещение гидроксильной
группы
(Механизмы SN1, SN2, SNAr, SNi )
3.Нуклеофильное замещение сульфогруппы
в аренах
(Механизм SNAr)
2. Механизм SN1 (мономолекулярный)
МЕХАНИЗМ SN1 (мономолекулярный)C X
+ –
C X
a
+
–
–
Х
b
–
+
Nu
–Х
C Nu + <<Nu
C
c
• включает две стадии: диссоциация алкилгалогенида
на ионы и взаимодействие катиона с нуклеофилом;
• во многих случаях, алкилгалогенид диссоциирует с
последовательным образованием:
- контактной ионной пары (а),
- сольватно-разделенной ионной пары (b)
- сольватированных ионов (с).
• Каждый из продуктов диссоциации может
взаимодействовать с реагентом.
2
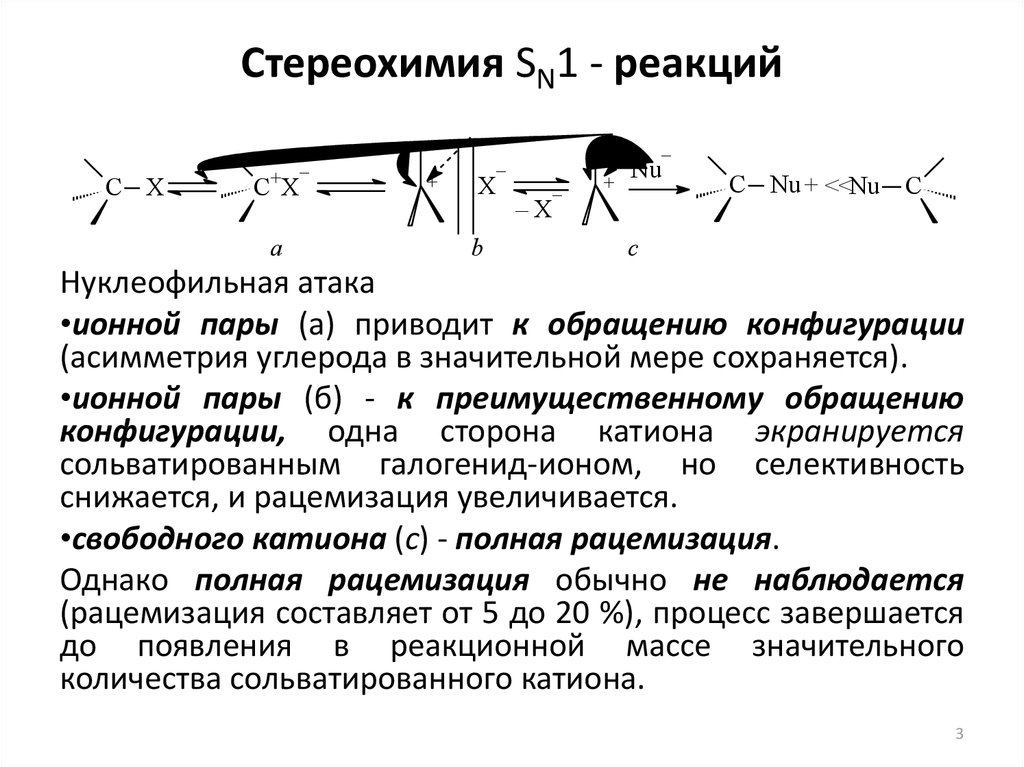
3. Стереохимия SN1 - реакций
C X+ –
C X
a
+
–
–
Х
b
–
+
Nu
–Х
C Nu + <<Nu
C
c
Нуклеофильная атака
•ионной пары (а) приводит к обращению конфигурации
(асимметрия углерода в значительной мере сохраняется).
•ионной пары (б) - к преимущественному обращению
конфигурации, одна сторона катиона экранируется
сольватированным галогенид-ионом, но селективность
снижается, и рацемизация увеличивается.
•свободного катиона (с) - полная рацемизация.
Однако полная рацемизация обычно не наблюдается
(рацемизация составляет от 5 до 20 %), процесс завершается
до появления в реакционной массе значительного
количества сольватированного катиона.
3
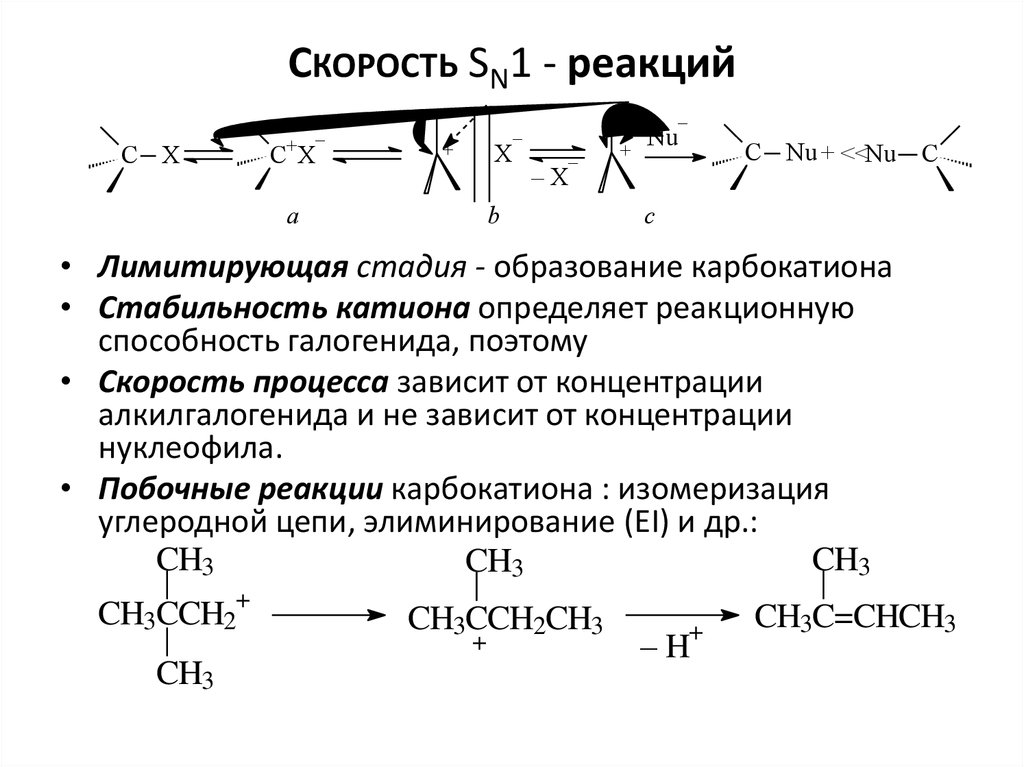
4. Скорость SN1 - реакций
СКОРОСТЬ SN1 - реакций+ –
C X
C X
–
–
+
Х
a
–
+
Nu
C Nu + <<Nu
–Х
b
C
c
• Лимитирующая стадия - образование карбокатиона
• Стабильность катиона определяет реакционную
способность галогенида, поэтому
• Скорость процесса зависит от концентрации
алкилгалогенида и не зависит от концентрации
нуклеофила.
• Побочные реакции карбокатиона : изомеризация
углеродной цепи, элиминирование (EI) и др.:
CH3
CH3
CH3
+
CH3CCH2
CH3
CH3CCH2CH3
+
+
–H
CH3C=CHCH3
5. Механизм SN2 — одностадийное синхронное (бимолекулярное) замещение :
МЕХАНИЗМ SN2 — одностадийное синхронное(бимолекулярное) замещение :
+
–
Nu +
–
C Y
–
–
Nu...C...Y
Nu
C
–
+Y
• Нуклеофил Nu– атакует субстрат «с тыла» с образованием
переходного состояния. При этом атом углерода
изменяет sp3-гибридизацию на sp2-. Одна доля р-орбитали
перекрывается с нуклеофилом, а вторая — с уходящей
группой. Связь С–Nu образуется одновременно с
разрывом связи С–Y, поэтому реакция всегда
сопровождается обращением конфигурации.
• Побочная реакция - элиминирования Е2.
• Скорость реакции зависит: от пространственных
факторов, величины положительного заряда на атоме
углерода субстрата, силы нуклеофила и в кинетической
области от концентрации как нуклеофила, так и
алкилгалогенида.
5
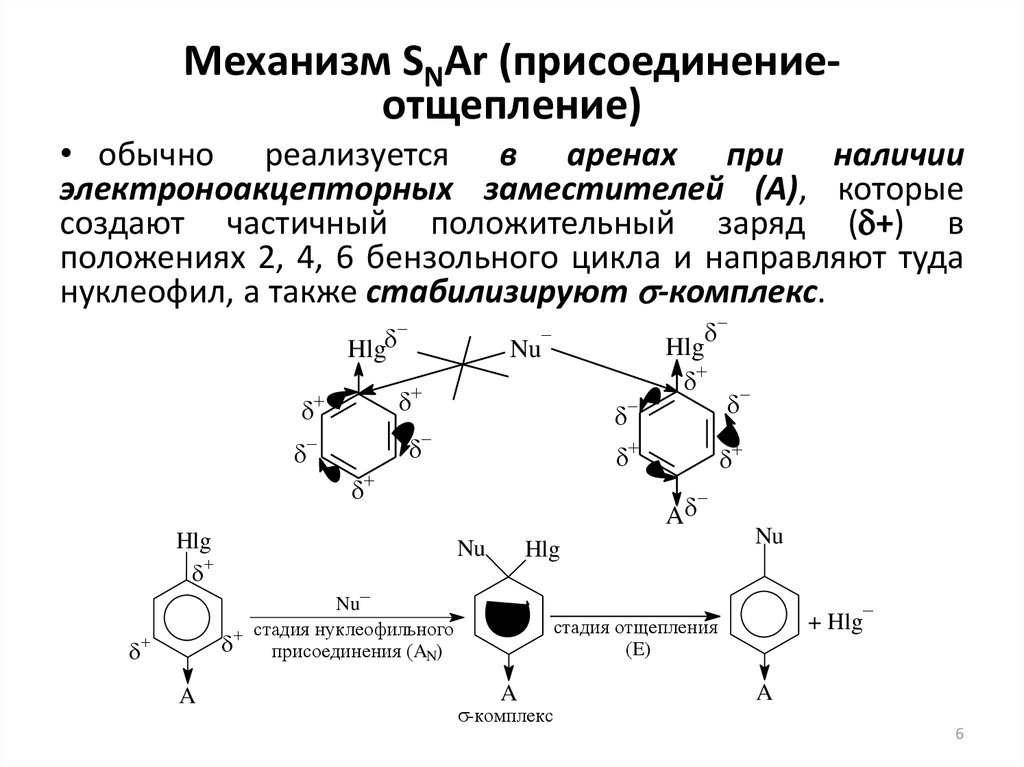
6. Механизм SNAr (присоединение-отщепление)
Механизм SNAr (присоединениеотщепление)• обычно реализуется в аренах при наличии
электроноакцепторных заместителей (А), которые
создают частичный положительный заряд ( +) в
положениях 2, 4, 6 бензольного цикла и направляют туда
нуклеофил, а также стабилизируют s-комплекс.
Hlg
Nu
A
A
Nu
Nu–
стадия нуклеофильного
присоединения (AN)
Hlg
Hlg
–
Hlg
Nu
_
–
+ Hlg
стадия отщепления
(E)
A
s-комплекс
A
6
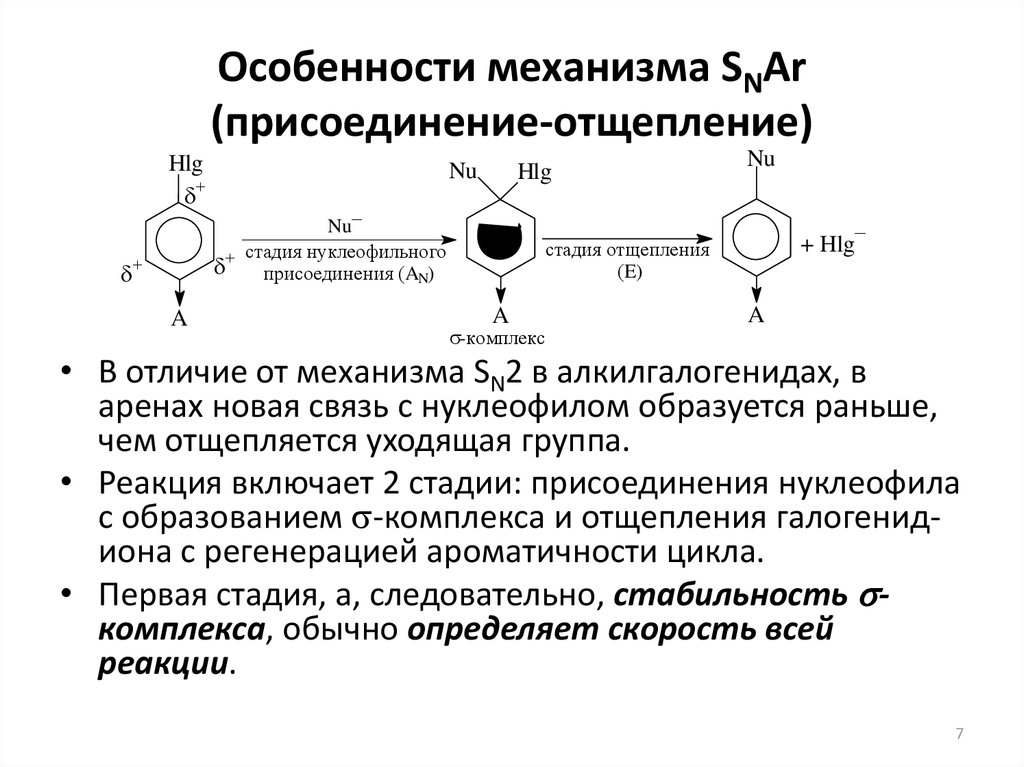
7. Особенности механизма SNAr (присоединение-отщепление)
HlgA
Nu
Nu–
стадия нуклеофильного
присоединения (AN)
Hlg
Nu
_
–
+ Hlg
стадия отщепления
(E)
A
s-комплекс
A
• В отличие от механизма SN2 в алкилгалогенидах, в
аренах новая связь с нуклеофилом образуется раньше,
чем отщепляется уходящая группа.
• Реакция включает 2 стадии: присоединения нуклеофила
с образованием s-комплекса и отщепления галогенидиона с регенерацией ароматичности цикла.
• Первая стадия, а, следовательно, стабильность sкомплекса, обычно определяет скорость всей
реакции.
7
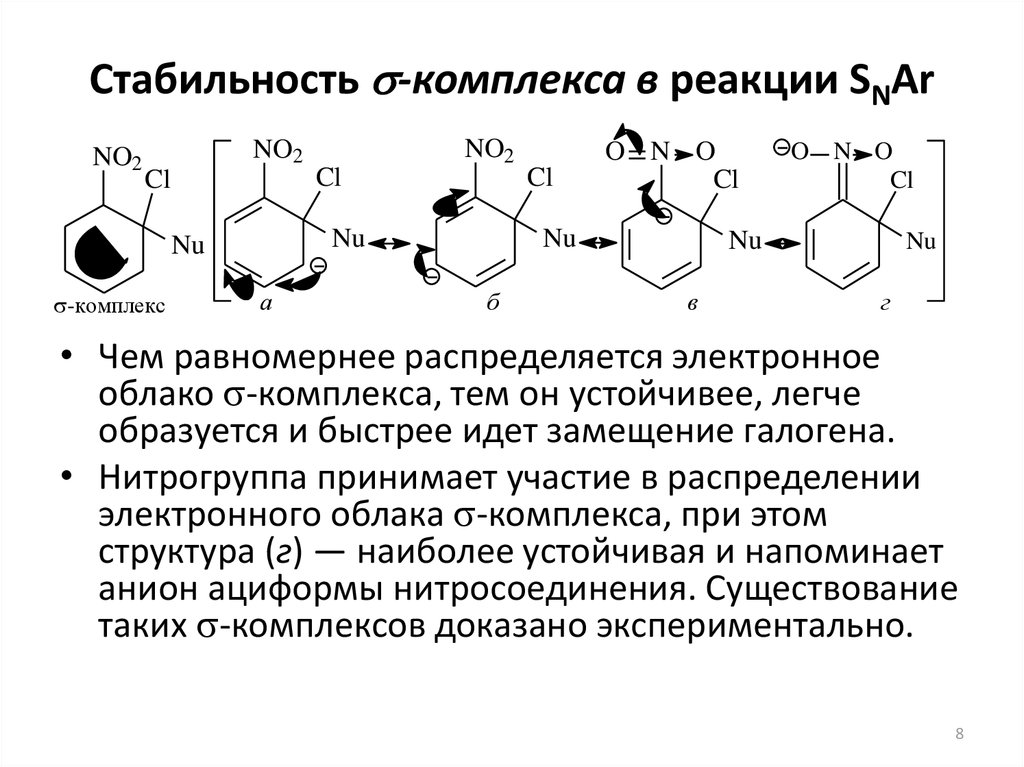
8. Стабильность -комплекса в реакции SNAr
Стабильность s-комплекса в реакции SNArNO2
NO2
NO2
_
s-комплекс
Cl
Cl
Cl
Nu
Nu
Nu
а
O N O
Cl
б
O N O
Cl
Nu
в
Nu
г
• Чем равномернее распределяется электронное
облако s-комплекса, тем он устойчивее, легче
образуется и быстрее идет замещение галогена.
• Нитрогруппа принимает участие в распределении
электронного облака s-комплекса, при этом
структура (г) — наиболее устойчивая и напоминает
анион ациформы нитросоединения. Существование
таких s-комплексов доказано экспериментально.
8
9. Механизм SNEA (отщепления-присоединения)
++
CH3
Cl
CH3
–
CH3
Cl
CH3
–
Nu
Nu
– HNu
H+
Nu
CH3
+
–
– Cl
Nu
CH3
CH3
HNu
Nu
Nu-
и
Nu
• Хлор за счет индукционного эффекта создает на атомах
водорода в орто- положениях бензольного кольца
наибольший заряд +. Нуклеофил атакует эти положения и
отщепляет
хорошо
уходящую
группу
–
протон.
Образовавшийся
отрицательный
заряд
в
кольце
нуклеофильно
вытесняет
хлорид-анион,
образуя
дегидробензол.
• Нуклеофил присоединяется по тройной связи к обоим
атомам углерода в равной степени.
9
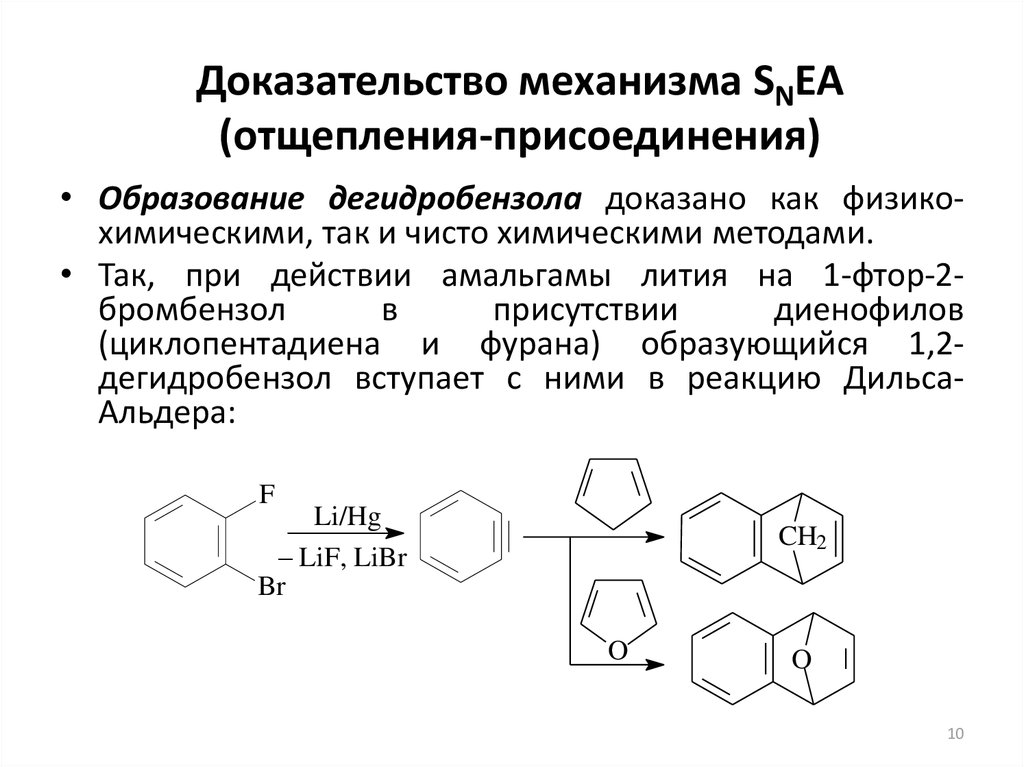
10. Доказательство механизма SNEA (отщепления-присоединения)
• Образование дегидробензола доказано как физикохимическими, так и чисто химическими методами.• Так, при действии амальгамы лития на 1-фтор-2бромбензол
в
присутствии
диенофилов
(циклопентадиена и фурана) образующийся 1,2дегидробензол вступает с ними в реакцию ДильсаАльдера:
F
Li/Hg
– LiF, LiBr
Br
CH2
O
O
10
11. Влияние строения алифатического субстрата на механизм замещения галогена
RCH3X
SN2
R–CH2X
SN2
R–CHX–R
SN2 и SN1
R–CX–R
SN1
R–CH=CHCH2X и PhCH2X
SN2 и SN1
Увеличение разветвленности радикала создаёт
стерические препятствия для прямой нуклеофильной
атаки и увеличивает стабильность промежуточного
карбкатиона, поэтому при переходе от первичного
алкилгалогенида к третичному в одних и тех же
условиях механизм реакции изменяется от
бимолекулярного до мономолекулярного.
Этот процесс не является резким и зависит от ряда
конкретных условий. Принципиально возможно
протекание реакции по двум механизмам
одновременно.
11
12. Влияние аллил- и бензилгалогенидов на механизм замещения галогена
• Первичные аллил- и бензилгалогениды образуюточень устойчивые карбокатионы и легко реагируют как
по SN1, так и по SN2 механизму (преимущественно
реализуется SN1-механизм). Разветвленные радикалы –
только по SN1-механизму.
• При этом возможна аллильная перегруппировка. Если
для первичных аллилгалогенидов создать условия для SN2
механизма, она не имеет место:
R
CH
CH
R CH
CH2Hlg
– R
– Hlg
CH
R
CH
–
CH CH2Hlg + Nu
CH
+
CH2
–
+
R
CH
CH
–
Nu
Nu
CH
CH2Nu
Nu...CH2...Hlg
CH CHR
R
CHNu
–
– Hlg
CH2
CH
CH2
Nu CH2
CH
CHR
12
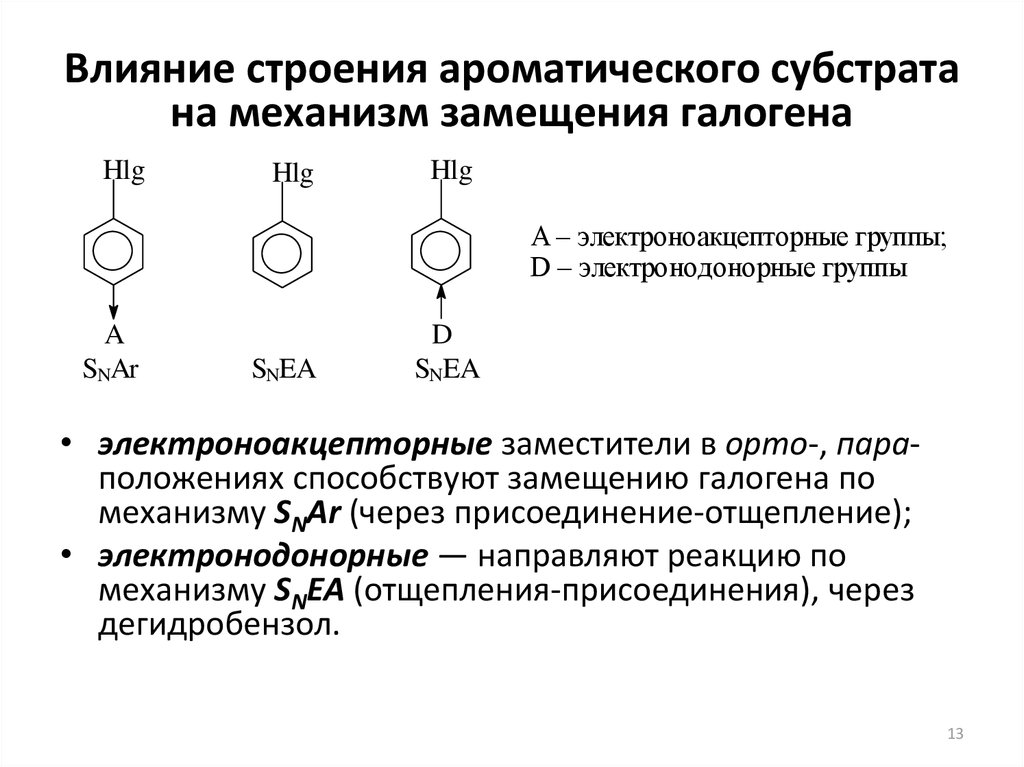
13. Влияние строения ароматического субстрата на механизм замещения галогена
HlgHlg
Hlg
A – электроноакцепторные группы;
D – электронодонорные группы
A
SNAr
SNEA
D
SNEA
• электроноакцепторные заместители в орто-, параположениях способствуют замещению галогена по
механизму SNAr (через присоединение-отщепление);
• электронодонорные — направляют реакцию по
механизму SNEA (отщепления-присоединения), через
дегидробензол.
13
14. Влияние строения алифатического субстрата на скорость SN1 реакции
Увеличение скорости SN1реакцииK
~
1
10
CH3
6
10
CH3
CH2=CHCH2Br CH3Br < CH3CH2Br < CH3CHBr < CH3CBr << CH2=CHCBr Ph
;
>>
>
>
>
и PhCH2Br
CH3
Увеличение скорости SN2реакции
CBr
- Скорость SN1 реакции алкилгалогенидов возрастает по
мере увеличения устойчивости карбкатиона в ряду от
метилгалогенида к первичному, вторичному, третичному,
аллильному и бензильному
- Находящиеся в α-положении к реакционному центру
предельные, фенильные и винильные радикалы, а также
атомы, имеющие неподеленную пару электронов,
способствуют распределению электронного облака
частицы, стабилизируют катион и ускоряют реакцию.
14
15. Влияние строения алифатического субстрата на скорость SN2 реакции
Увеличение скорости SN1реакцииK
~
1
10
CH3
6
10
CH3
CH2=CHCH2Br CH3Br < CH3CH2Br < CH3CHBr < CH3CBr << CH2=CHCBr Ph
;
>>
>
>
>
и PhCH2Br
CH3
Увеличение скорости SN2реакции
CBr
• Скорость SN2 реакции алкилгалогенидов возрастает в
прямо противоположном направлении, наблюдаемом
при SN1 замещении, если не учитывать наибольшую
активность первичных аллил- и бензилгалогенидов.
• Метильные и первичные галогениды реагируют очень
гладко, вторичные — значительно хуже, а третичные
часто не реагируют вообще, что объясняется, в
основном, пространственными препятствиями для атаки
нуклеофила, которые играют в SN2 замещении важную
роль.
15
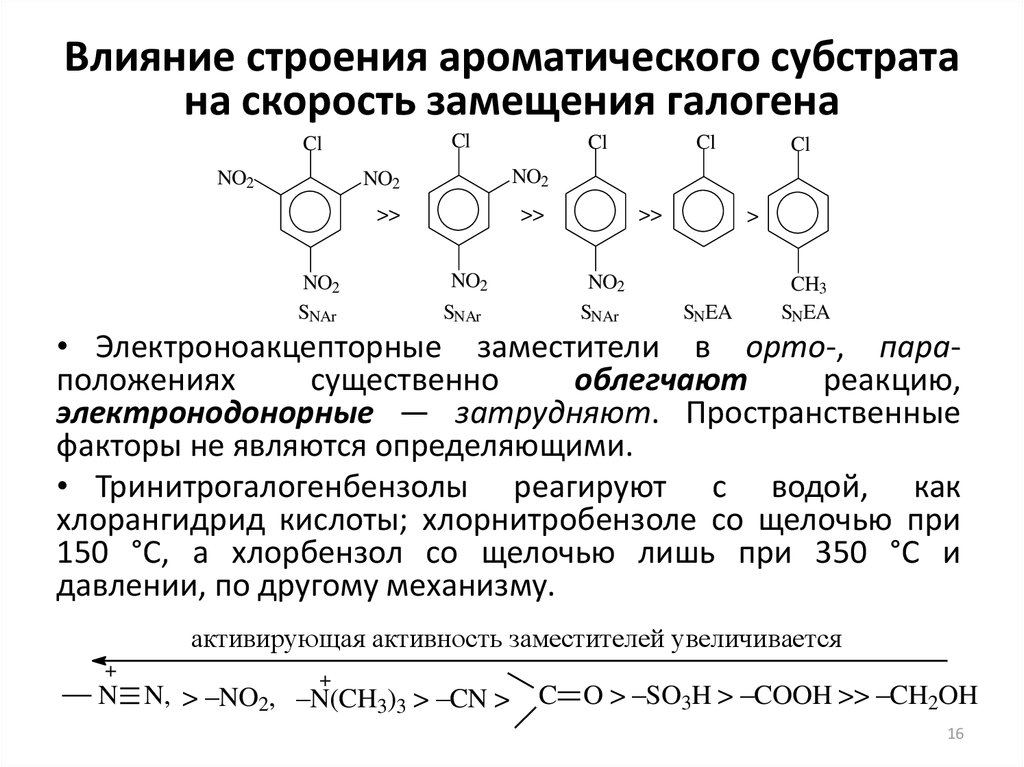
16. Влияние строения ароматического субстрата на скорость замещения галогена
ClCl
NO2
NO2
SNAr
Cl
NO2
NO2
>>
>>
NO2
SNAr
Cl
>>
NO2
SNAr
Cl
>
SNEA
CH3
SNEA
• Электроноакцепторные заместители в орто-, параположениях
существенно
облегчают
реакцию,
электронодонорные — затрудняют. Пространственные
факторы не являются определяющими.
• Тринитрогалогенбензолы реагируют с водой, как
хлорангидрид кислоты; хлорнитробензоле со щелочью при
150 °С, а хлорбензол со щелочью лишь при 350 °С и
давлении, по другому механизму.
активирующая активность заместителей увеличивается
+
+
N N, > –NO2, –N(CH3)3 > –CN >
C O > –SO3H > –COOH >> –CH2OH
16
17. Влияние галогена на реакционную способность галогенидов
- Галоген является уходящей группой и акцепторомэлектронов. Способность галогена «уходить» уменьшается
(снижается
стабильность
аниона),
а
электроноакцепторные свойства, наоборот, увеличивается
в ряду:
способность галогена
"уходить" увеличивается
I,
Br,
Cl,
F
электроноакцепторные свойства
увеличиваются
- В алкилгалогенидах большее значение имеет
способность
группы
уходить,
и
реакционная
способность их уменьшается в ряду: RI > RBr > RCl > RF.
- В галогенаренах величина положительного заряда
реакционного центра зависит не только от заместителей в
ядре, но и от электроотрицательности замещаемого
галогена. Поэтому их реакционная способность
возрастает в ряду ArI < ArBr < ArCl < ArF.
17
18. Влияние нуклеофила на реакцию
• чем выше нуклеофильность (активность) реагента, темвероятнее
механизм
SN2,
слабые
нуклеофилы
способствуют протеканию реакции по механизму SN1;
• при повышении активности нуклеофила скорость
реакций SN2, SNAr и SNEA увеличивается, а SN1 — не
меняется;
• при увеличении силы нуклеофила возрастает
вероятность побочных реакций (например, реакции
элиминирования), особенно в реакциях, реализующих
механизм SN1.
На практике часто приходится сравнивать
нуклеофильность частиц, но она зависит от многих
факторов и невозможно построить некий постоянный ряд
их активности. Так, в протонных растворителях
нуклеофильность анионов Hlg– увеличивается от фторида
к иодиду, а в апротонных — наоборот.
18
19. Влияние растворителя на нуклеофильное замещение
- столь велико, что часто определяет механизм реакции.• Полярные протонные растворители (вода, спирты,
аммиак, карбоновые кислоты) способствуют SN1
механизму, т.к. они сольватируют и ускоряют
диссоциацию алкилгалогенида и стабилизируют ионы.
С увеличением полярности и кислотности
растворителя скорость SN1 реакции увеличивается.
Многие
процессы,
протекающие
в
апротонных
растворителях по SN2 механизму, в растворах
минеральных кислот идут по SN1 механизму.
• Апротонные нуклеофильные растворители (ацетон,
ацетонитрил, диметилсульфоксид и др.), сольватируют
главным образом катион и способствуют SN2 механизму.
Они не содействуют диссоциации галогенида, но
отсутствие сольватации увеличивает активность
нуклеофила.
19
20. Выбор растворителя для SN2 реакции
Необходимо учитывать:• распределение зарядов в переходном состоянии. Если
оно полярнее исходных реагентов, повышение полярности
растворителя увеличивает скорость реакции, и наоборот
(теория Хьюза - Ингольда):
Nu + RHlg
–
Nu + RHlg
[Nu...R...Hlg]
– увеличение полярности растворителя
увеличивает скорость
[Nu...R...Hlg] – увеличение полярности растворителя
уменьшает скорость
• специфическую сольватацию нуклеофила, которая
уменьшает активность атакующей частицы.
• растворяющую
способность
растворителя
по
отношению к реагенту и субстрату. Применяют растворители,
которые проявляют липофильные и гидрофильные свойства
(метанол, ацетон, диоксан); их смеси с водой; диполярные,
апротонные диметилсульфоксид, диметилформамид.
20
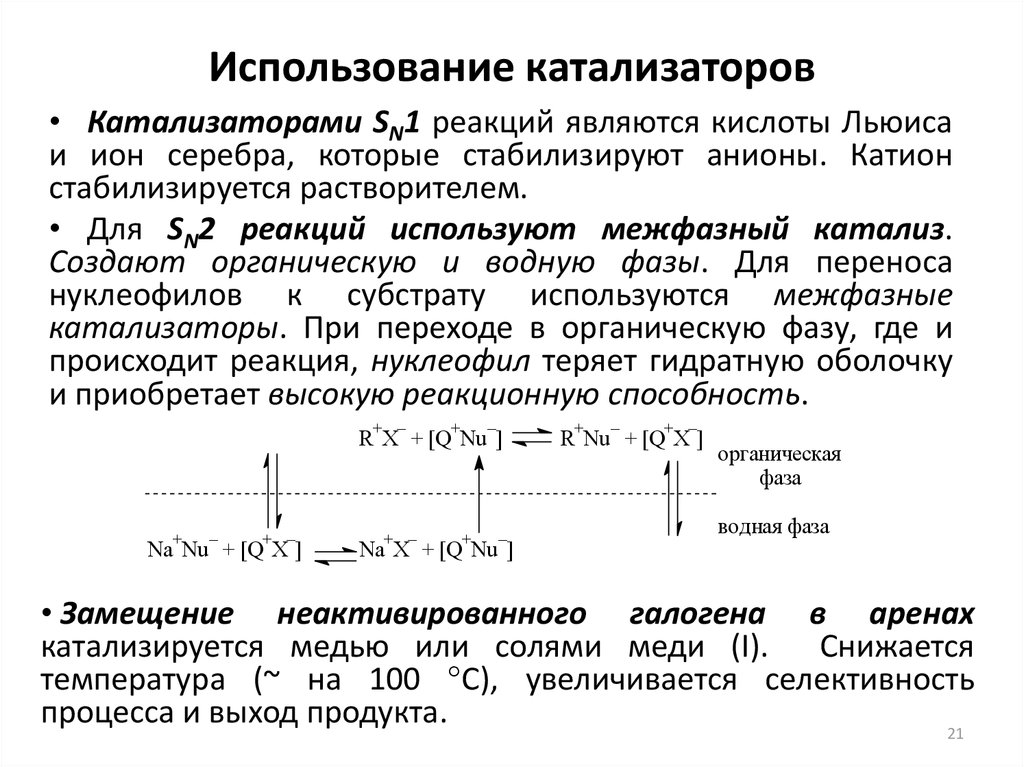
21. Использование катализаторов
• Катализаторами SN1 реакций являются кислоты Льюисаи ион серебра, которые стабилизируют анионы. Катион
стабилизируется растворителем.
• Для SN2 реакций используют межфазный катализ.
Создают органическую и водную фазы. Для переноса
нуклеофилов к субстрату используются межфазные
катализаторы. При переходе в органическую фазу, где и
происходит реакция, нуклеофил теряет гидратную оболочку
и приобретает высокую реакционную способность.
+ –
+
–
R X + [Q Nu ]
+
–
+ –
Na Nu + [Q X ]
+ –
+
–
Na X + [Q Nu ]
+
–
+ –
R Nu + [Q X ]
органическая
фаза
водная фаза
• Замещение неактивированного галогена в аренах
катализируется медью или солями меди (I). Снижается
температура (~ на 100 °С), увеличивается селективность
процесса и выход продукта.
21
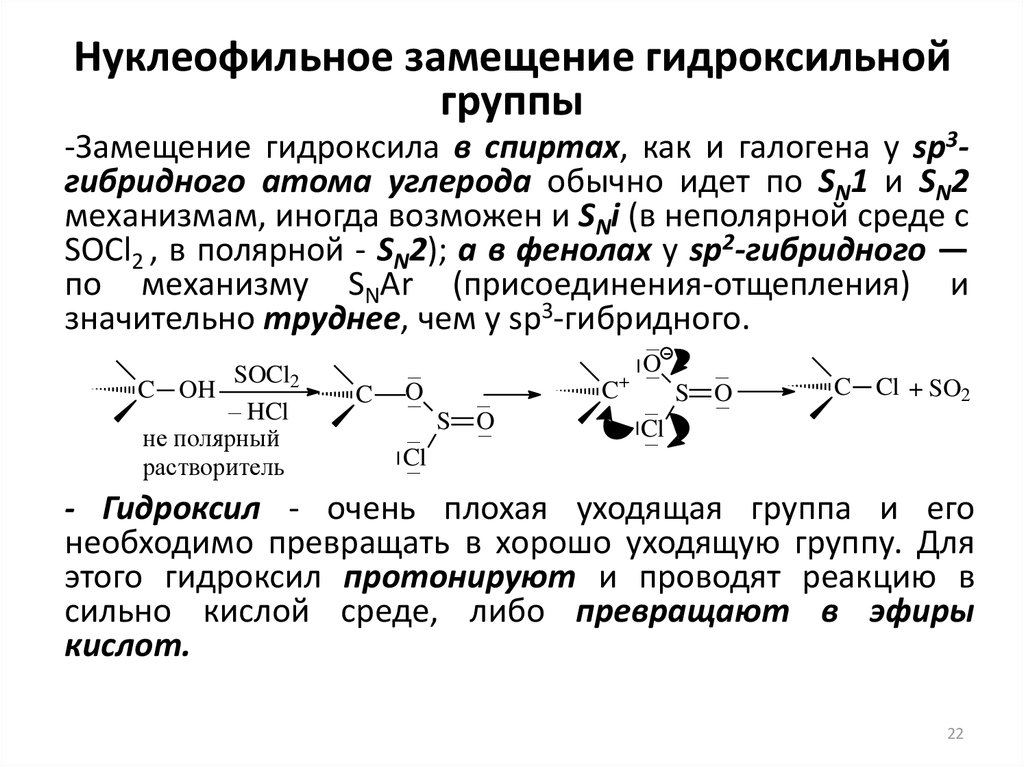
22. Нуклеофильное замещение гидроксильной группы
-Замещение гидроксила в спиртах, как и галогена у sp3гибридного атома углерода обычно идет по SN1 и SN2механизмам, иногда возможен и SNi (в неполярной среде с
SOCl2 , в полярной - SN2); а в фенолах у sp2-гибридного —
по механизму SNAr (присоединения-отщепления) и
значительно труднее, чем у sp3-гибридного.
SOCl2
– HCl
не полярный
растворитель
C OH
C
–
O
–
S
–
Cl
–
–
O
–
–
O
–
C+
S
–
Cl
–
–
O
–
C Cl + SO2
- Гидроксил - очень плохая уходящая группа и его
необходимо превращать в хорошо уходящую группу. Для
этого гидроксил протонируют и проводят реакцию в
сильно кислой среде, либо превращают в эфиры
кислот.
22
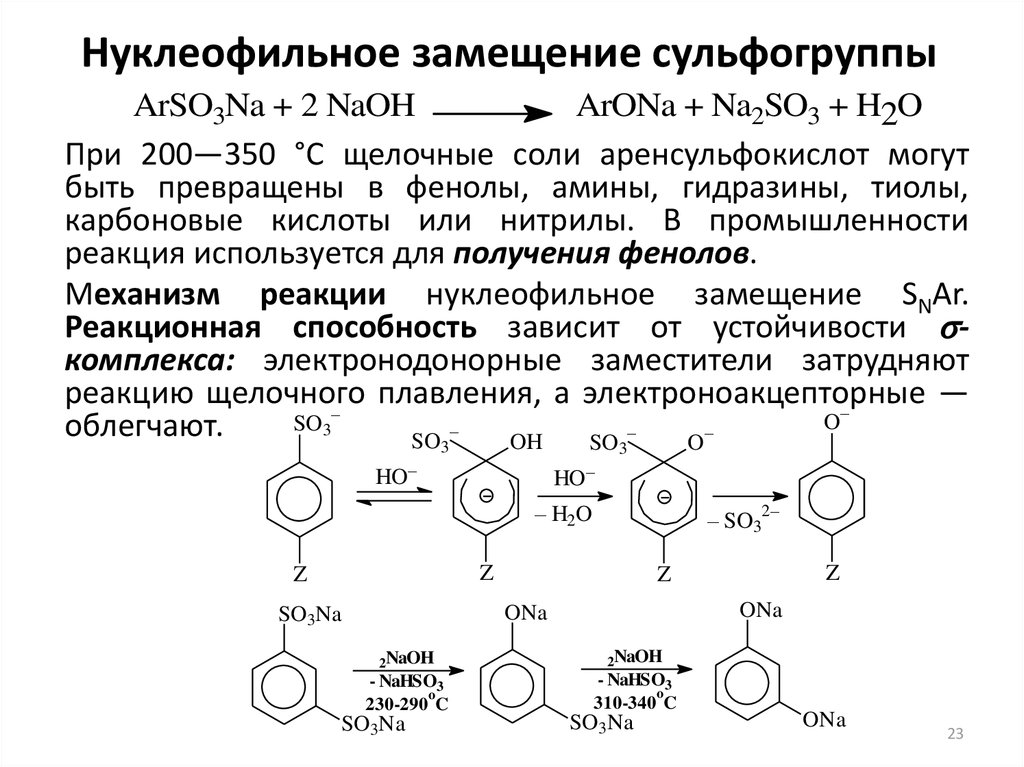
23. Нуклеофильное замещение сульфогруппы
ArSO3Na + 2 NaOHArONa + Na2SO3 + H2O
При 200—350 °С щелочные соли аренсульфокислот могут
быть превращены в фенолы, амины, гидразины, тиолы,
карбоновые кислоты или нитрилы. В промышленности
реакция используется для получения фенолов.
Механизм реакции нуклеофильное замещение SNAr.
Реакционная способность зависит от устойчивости sкомплекса: электронодонорные заместители затрудняют
реакцию щелочного
плавления, а электроноакцепторные
—
–
–
O
SO3
облегчают.
–
–
–
SO3
OH
SO
O
3
HO–
HO–
– H2O
2–
– SO3
Z
Z
ONa
ONa
SO3Na
2NaOH
2NaOH
- NaHSO3
o
230-290 C
- NaHSO3
o
310-340 C
SO3Na
Z
Z
SO3Na
ONa
23
24. Самостоятельно
Гидролиз галогенидов
Получение простых эфиров
Получение тиоспиртов, тиоэфиров
Получение аминов
Получение цианидов
Получение сульфокислот
24
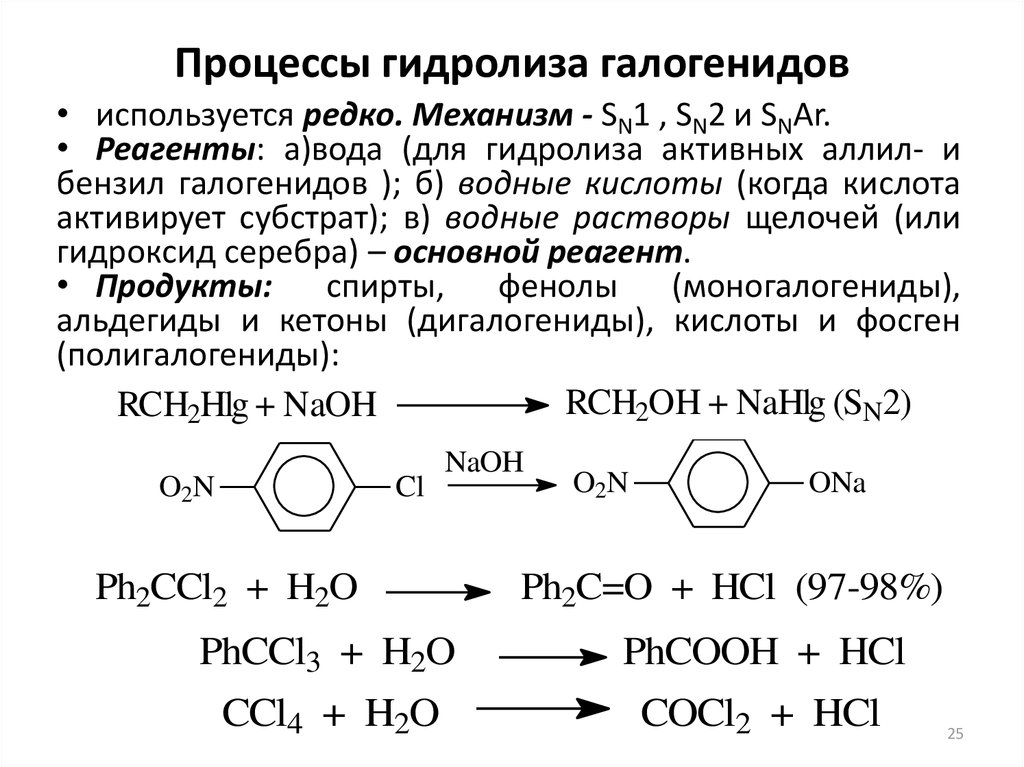
25. Процессы гидролиза галогенидов
• используется редко. Механизм - SN1 , SN2 и SNAr.• Реагенты: а)вода (для гидролиза активных аллил- и
бензил галогенидов ); б) водные кислоты (когда кислота
активирует субстрат); в) водные растворы щелочей (или
гидроксид серебра) – основной реагент.
• Продукты:
спирты,
фенолы
(моногалогениды),
альдегиды и кетоны (дигалогениды), кислоты и фосген
(полигалогениды):
RCH2OH + NaHlg (SN2)
RCH2Hlg + NaOH
O2N
Cl
NaOH
Ph2CCl2 + H2O
O2N
ONa
Ph2C=O + HCl (97-98%)
PhCCl3 + H2O
PhCOOH + HCl
CCl4 + H2O
COCl2 + HCl
25
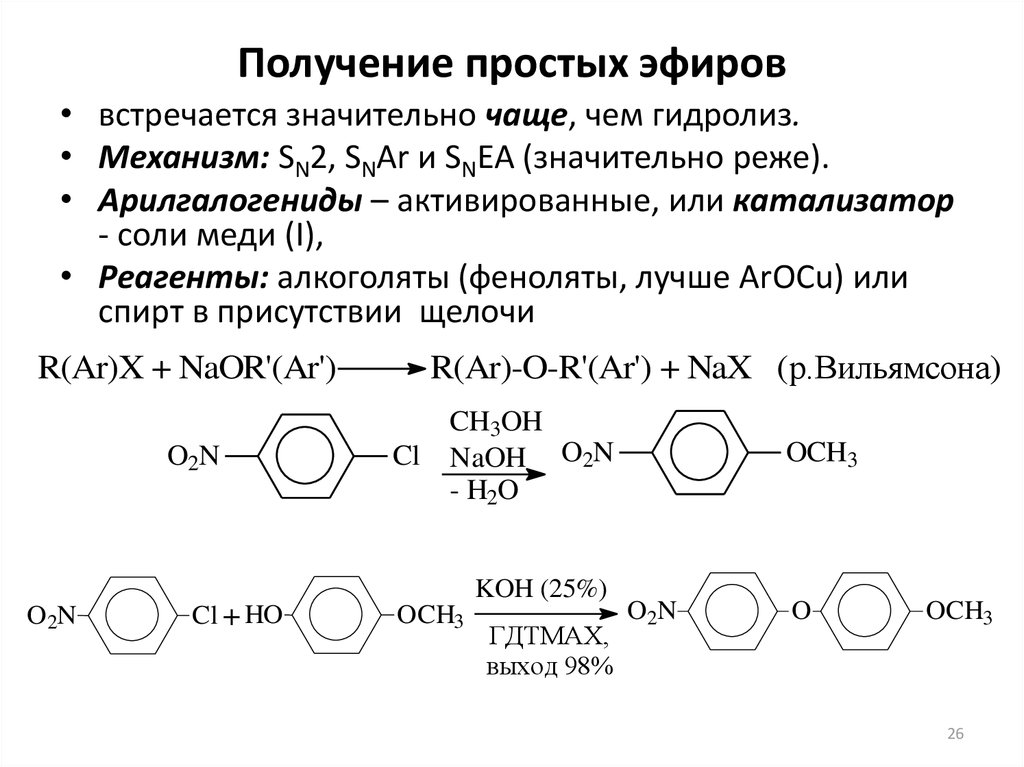
26. Получение простых эфиров
• встречается значительно чаще, чем гидролиз.• Механизм: SN2, SNAr и SNEA (значительно реже).
• Арилгалогениды – активированные, или катализатор
- соли меди (I),
• Реагенты: алкоголяты (феноляты, лучше ArOCu) или
спирт в присутствии щелочи
R(Ar)X + NaOR'(Ar')
O2N
R(Ar)-O-R'(Ar') + NaX (р.Вильямсона)
Cl
CH3OH
NaOH O2N
- H2O
KOH (25%)
O2N
Cl + HO
OCH3
ГДТМАХ,
выход 98%
OCH3
O2N
O
OCH3
26
27. Синтез тиоспиртов и тиоэфиров
• Субстраты: алкил и арилгалогениды.• Реагенты: гидросульфид-, сульфид- и алкил(арил)тиоионы; мочевина. Механизм: SN2, SNAr и SNEA
R(Ar)X + NaSH
R(Ar)SH + NaX
R(Ar)X + NaSR'(Ar')
R(Ar)–S–R'(Ar') + NaX
NH2
PhCH2Cl + S
C
NH2
PhCH2
S C
NH2
NaOH
– NaCl, NH2CN,
H2O
ClCH2COONa + Na2S
+
–
Cl
NH2
PhCH2SH
S(CH2COONa)2
C2H5SNa
CH2 CHBr
– NaBr
CH2 CH S C2H5
27
28. Замена атома галогена на аминогруппы
• Особенность реакции первичных, вторичных итретичных алкилгалогенидов с аммиаком и аминами
(механизм, условия реакции,
полиалкилирование,
выход, побочные реакции). Селективные методы
получения аминов (из сульфамидов, реакция Габриэля,
из азометинов).
RX
RX 2NH3 RNH2 RX, NH3 R2NH RX, NH3 R3N
R4N+XNH4X
NH4X
NH4X
R'X
R
ArNH2
RX
Ar NH R
Ar N
R'
– HX
– HX
• Особенности
реакций
неактивированных
галогенаренов
с аммиаком и аминами (механизм,
условия реакции, катализаторы)
• Особенности реакций активированных галогенаренов
с аммиаком и аминами (механизм, условия реакции,
катализаторы)
28
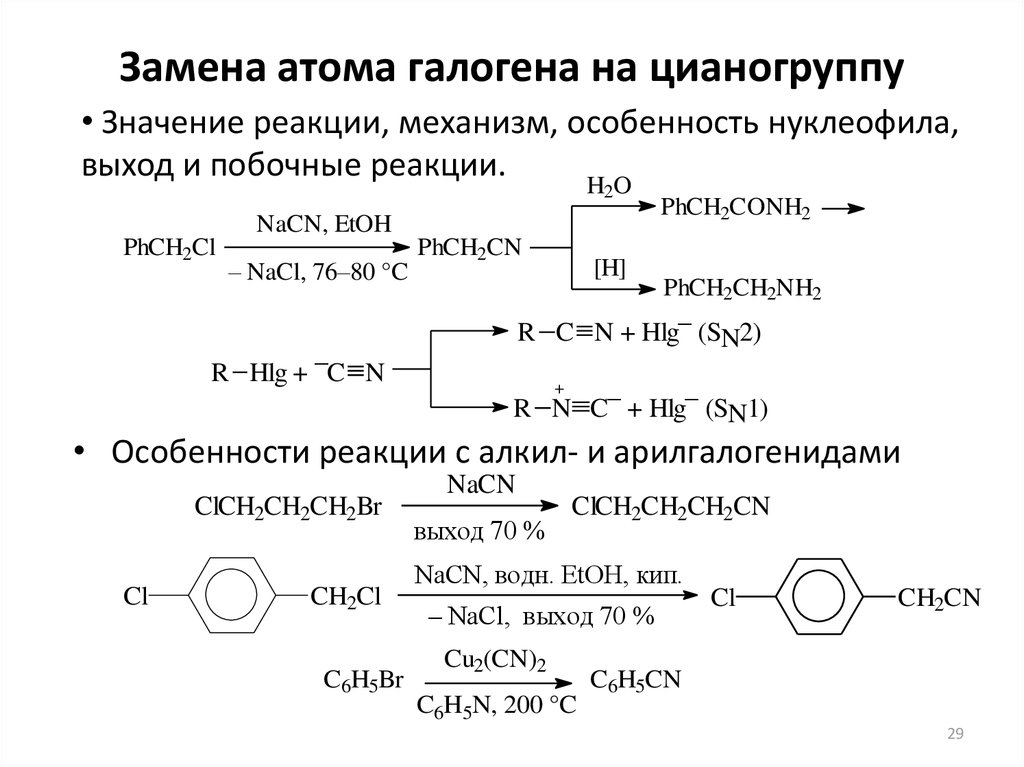
29. Замена атома галогена на цианогруппу
• Значение реакции, механизм, особенность нуклеофила,выход и побочные реакции.
HO
2
NaCN, EtOH
PhCH2Cl
– NaCl, 76–80 °C
R Hlg + –C N
PhCH2CN
[H]
PhCH2CONH2
PhCH2CH2NH2
R C N + Hlg– (SN2)
+
R N C– + Hlg– (SN1)
• Особенности реакции с алкил- и арилгалогенидами
ClCH2CH2CH2Br
Cl
CH2Cl
C6H5Br
NaCN
выход 70 %
ClCH2CH2CH2CN
NaCN, водн. EtOH, кип.
– NaCl, выход 70 %
Cu2(CN)2
C6H5N, 200 °C
Cl
CH2CN
C6H5CN
29
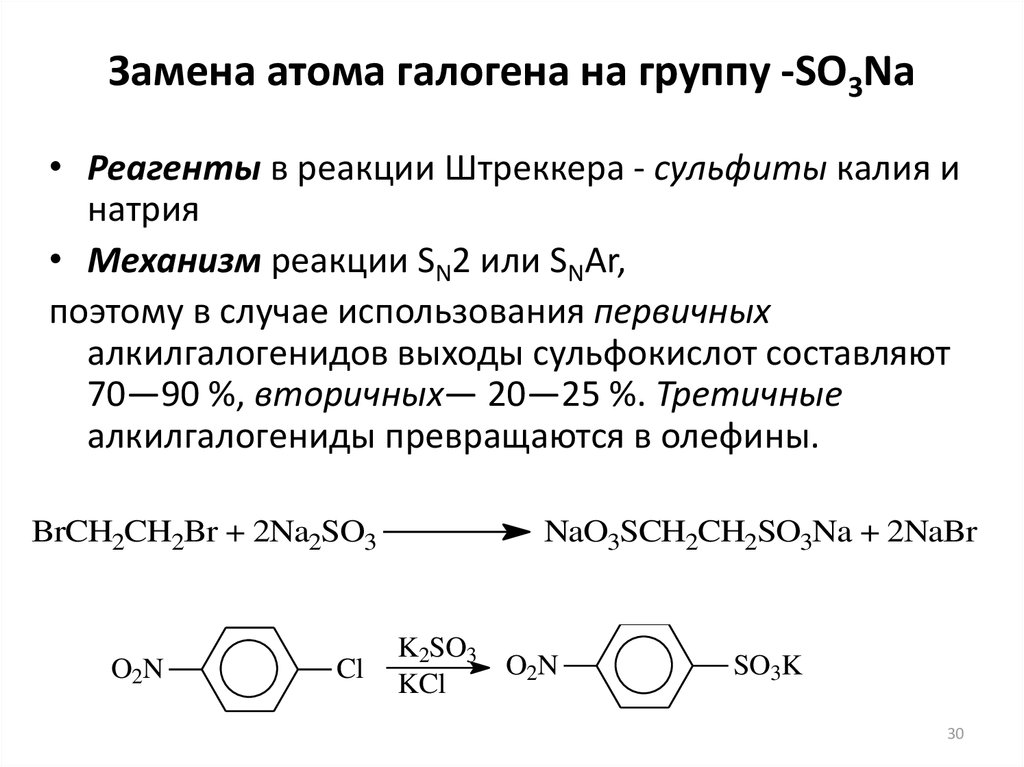
30. Замена атома галогена на группу -SO3Na
• Реагенты в реакции Штреккера - сульфиты калия инатрия
• Механизм реакции SN2 или SNAr,
поэтому в случае использования первичных
алкилгалогенидов выходы сульфокислот составляют
70—90 %, вторичных— 20—25 %. Третичные
алкилгалогениды превращаются в олефины.
BrCH2CH2Br + 2Na2SO3
O2N
Cl
NaO3SCH2CH2SO3Na + 2NaBr
K2SO3
O2N
KCl
SO3K
30















 chemistry
chemistry