Similar presentations:
Реакции, применяемые в синтезах гетероциклов
1. Реакции, применяемые в синтезах гетероциклов
РЕАКЦИИ, ПРИМЕНЯЕМЫЕ В СИНТЕЗАХГЕТЕРОЦИКЛОВ
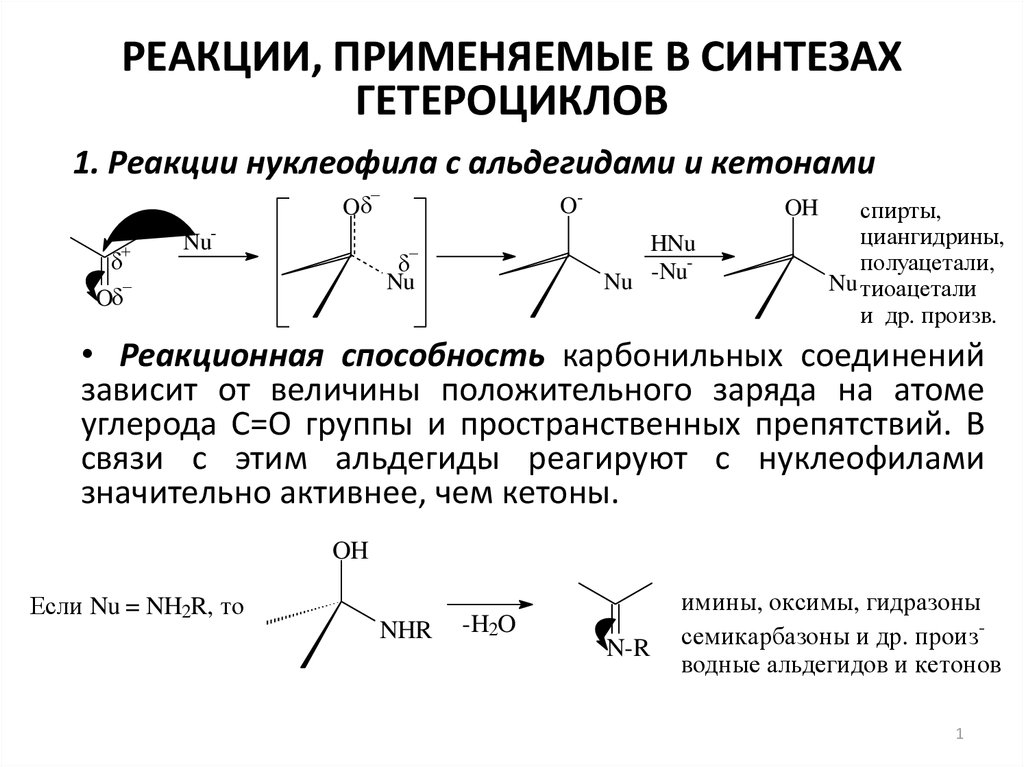
1. Реакции нуклеофила с альдегидами и кетонами
O
Nu-
OHNu
Nu -Nu
Nu
O
OH
спирты,
циангидрины,
полуацетали,
Nu тиоацетали
и др. произв.
• Реакционная способность карбонильных соединений
зависит от величины положительного заряда на атоме
углерода С=О группы и пространственных препятствий. В
связи с этим альдегиды реагируют с нуклеофилами
значительно активнее, чем кетоны.
OH
Если Nu = NH2R, то
NHR
-H2O
N-R
имины, оксимы, гидразоны
семикарбазоны и др. производные альдегидов и кетонов
1
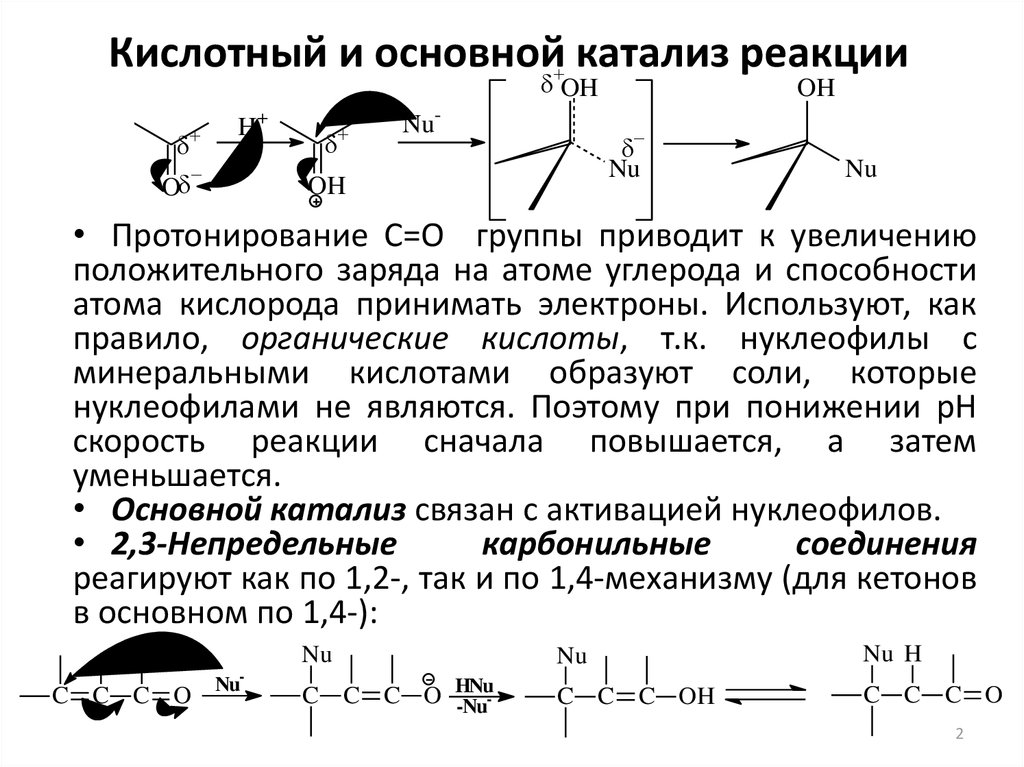
2. Кислотный и основной катализ реакции
OHO
H+
Nu-
OH
Nu
OH
Nu
• Протонирование С=О группы приводит к увеличению
положительного заряда на атоме углерода и способности
атома кислорода принимать электроны. Используют, как
правило, органические кислоты, т.к. нуклеофилы с
минеральными кислотами образуют соли, которые
нуклеофилами не являются. Поэтому при понижении рН
скорость реакции сначала повышается, а затем
уменьшается.
• Основной катализ связан с активацией нуклеофилов.
• 2,3-Непредельные
карбонильные
соединения
реагируют как по 1,2-, так и по 1,4-механизму (для кетонов
в основном по 1,4-):
-
C C C O
Nu
Nu
Nu
Nu H
C C C O HNu
-Nu-
C C C OH
C C C O
2
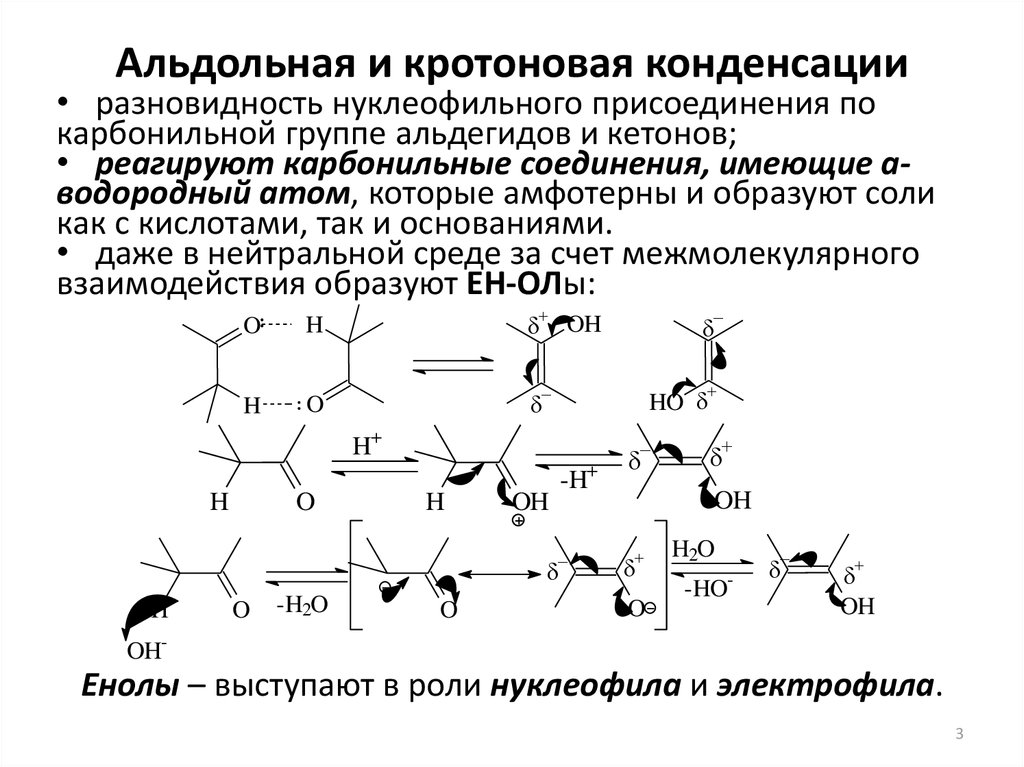
3. Альдольная и кротоновая конденсации
• разновидность нуклеофильного присоединения покарбонильной группе альдегидов и кетонов;
• реагируют карбонильные соединения, имеющие aводородный атом, которые амфотерны и образуют соли
как с кислотами, так и основаниями.
• даже в нейтральной среде за счет межмолекулярного
взаимодействия образуют ЕН-ОЛы:
O
H
H
O
HO
H+
O
H
H
-H+
OH
H
O
-H2O
OH
O
OH
O
H2O
-
-HO
OH
OH-
Енолы – выступают в роли нуклеофила и электрофила.
3
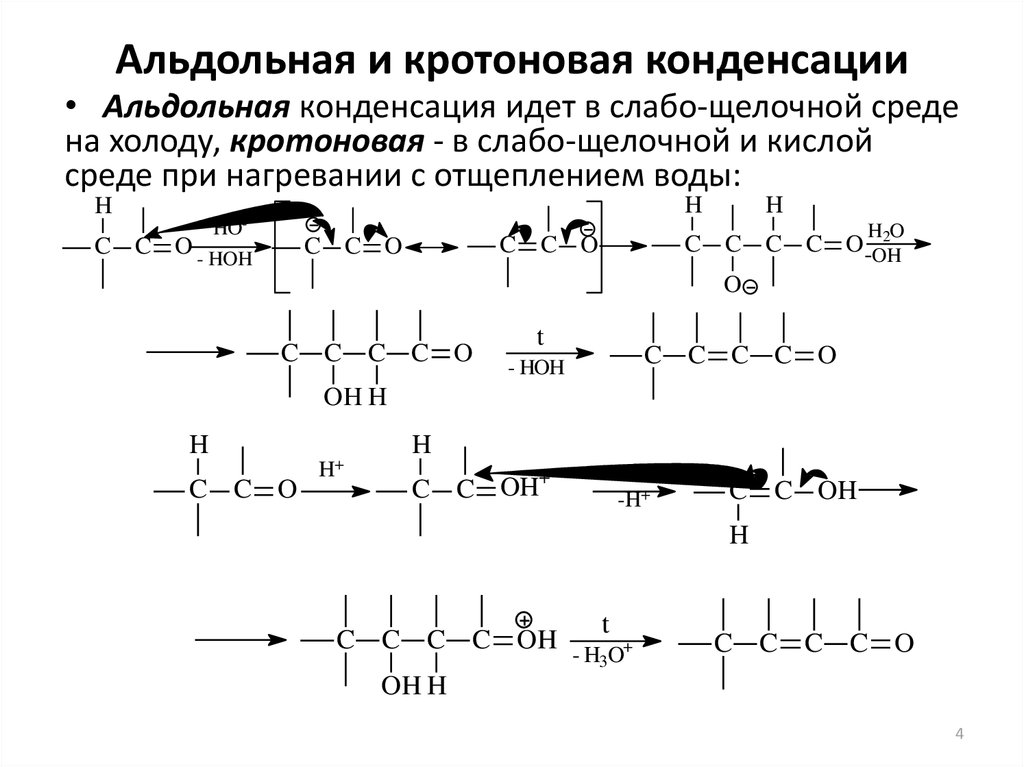
4. Альдольная и кротоновая конденсации
• Альдольная конденсация идет в слабо-щелочной средена холоду, кротоновая - в слабо-щелочной и кислой
среде при нагревании с отщеплением воды:
H
H
HO-
C C O - HOH
HO
2
C C C C O-OH
O
C C O
C C O
C C C C O
H
t
C C C C O
- HOH
OH H
H
C C O
H+
H
+
C C OH
-H+
C C OH
H
t
C C C C OH - H O+
3
OH H
C C C C O
4
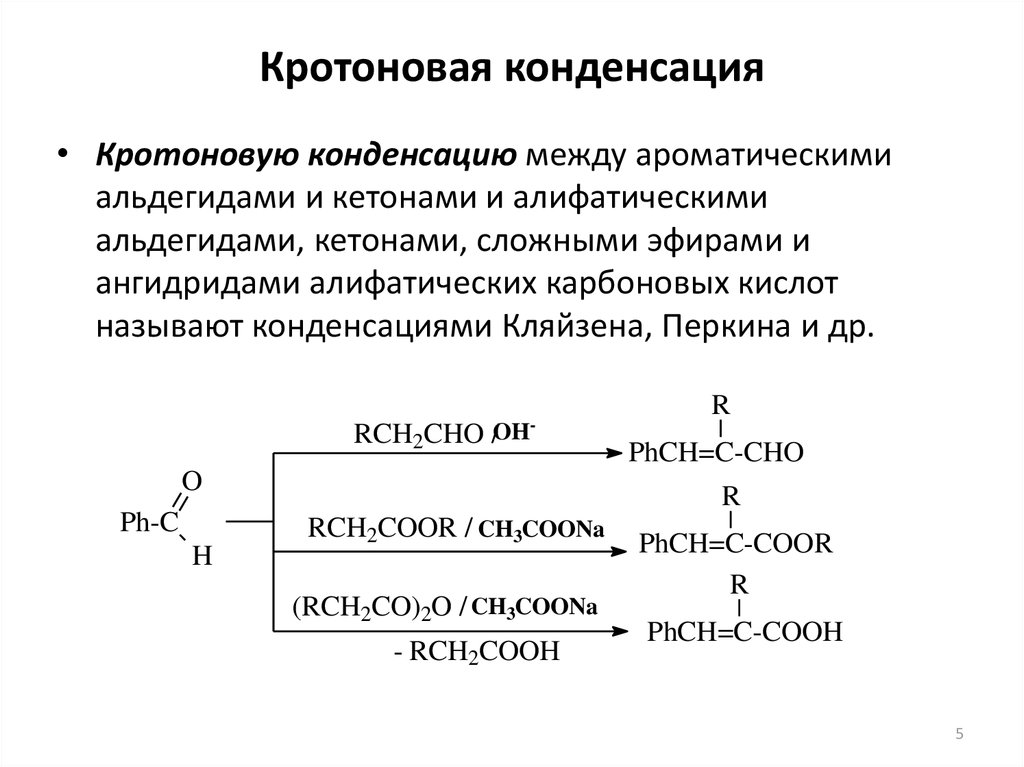
5. Кротоновая конденсация
• Кротоновую конденсацию между ароматическимиальдегидами и кетонами и алифатическими
альдегидами, кетонами, сложными эфирами и
ангидридами алифатических карбоновых кислот
называют конденсациями Кляйзена, Перкина и др.
OH-
RCH2CHO /
O
Ph-C
H
R
PhCH=C-CHO
R
RCH2COOR / CH3COONa
(RCH2CO)2O / CH3COONa
- RCH2COOH
PhCH=C-COOR
R
PhCH=C-COOH
5
6. Взаимодействия нуклеофила с ацильными соединениями (SNAE)
присоединение нуклеофила (AN)O
Y
Nu-
Nu
O
O-Y
Nu
Y
Nu
O
Y
отщепление уходящей группы (E)
Y= Hlg, RCOO, OH, OR, NH2, NHR, NR2 и др.
• Реакционная способность ацильных соединений
зависит от величины положительного заряда и
пространственных факторов (как и у альдегидов и кетонов,
т.к. реакция одна и та же), а также от способности
уходящей группы «уходить», т.к. весь процесс состоит из
двух стадий: присоединение и отщепление.
индукционный эфект - увеличивает
O
Y
эфект сопряжения - уменьшает
6
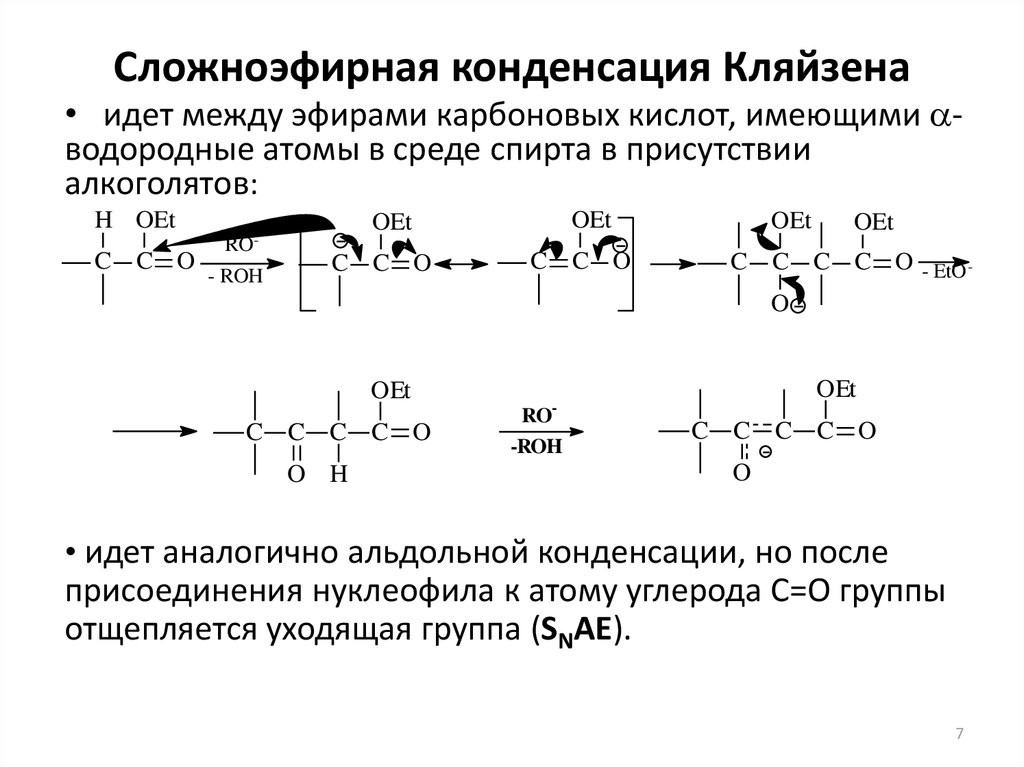
7. Сложноэфирная конденсация Кляйзена
• идет между эфирами карбоновых кислот, имеющими aводородные атомы в среде спирта в присутствииалкоголятов:
H OEt
C C O
RO- ROH
OEt
OEt
C C O
OEt
C C C C O
O H
C C O
OEt
C C C C O - EtO O
OEt
-
RO
-ROH
OEt
C C C C O
O
• идет аналогично альдольной конденсации, но после
присоединения нуклеофила к атому углерода С=О группы
отщепляется уходящая группа (SNAE).
7
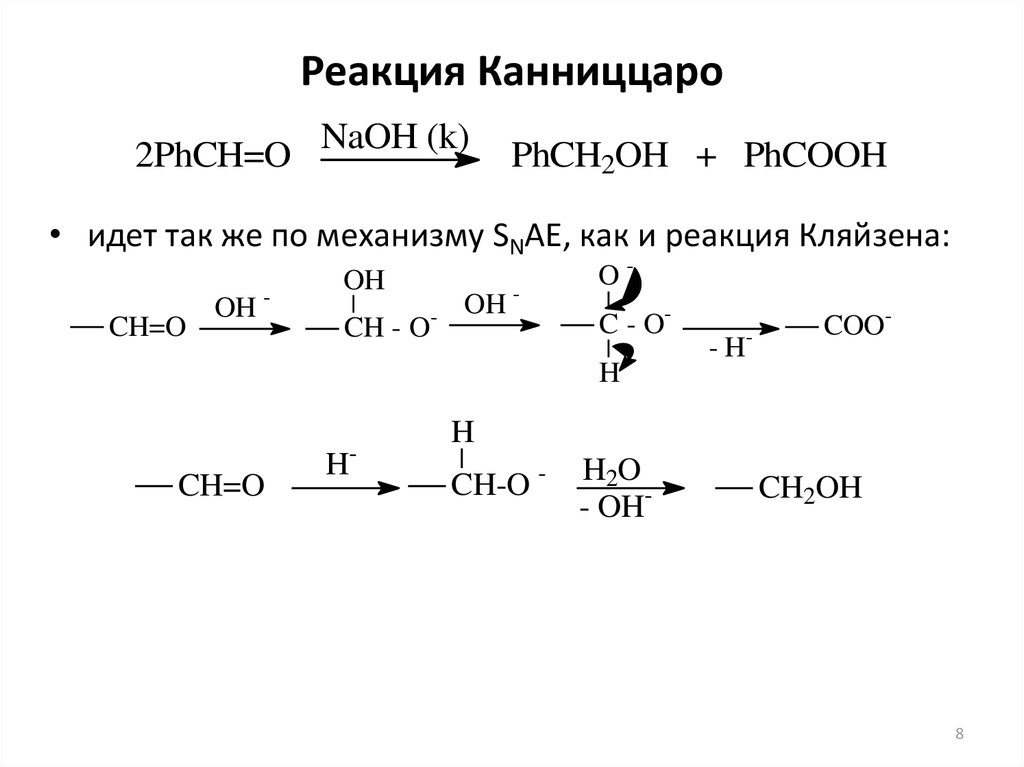
8. Реакция Канниццаро
2PhCH=ONaOH (k)
PhCH2OH + PhCOOH
• идет так же по механизму SNAE, как и реакция Кляйзена:
CH=O
OH
-
OH
CH - O-
OH -
O-
C - OH
-
CH=O
H
- H-
COO-
H
CH-O -
H2O
- OH-
CH2OH
8
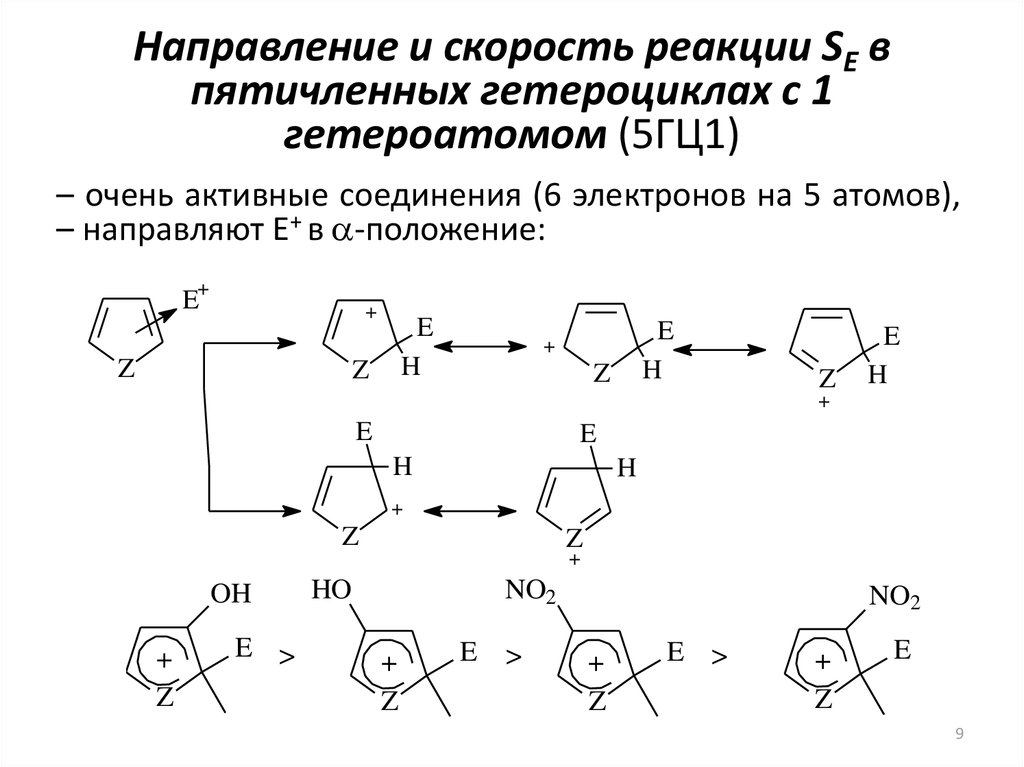
9. Направление и скорость реакции SE в пятичленных гетероциклах с 1 гетероатомом (5ГЦ1)
– очень активные соединения (6 электронов на 5 атомов),– направляют E+ в a-положение:
+
E
+
Z
E
H
Z
E
H
+
Z
Z
E
H
+
E
E
H
H
+
Z
OH
+
Z
E >
Z
+
HO
NO2
+
Z
E
>
NO2
+
Z
E >
+
Z
E
9
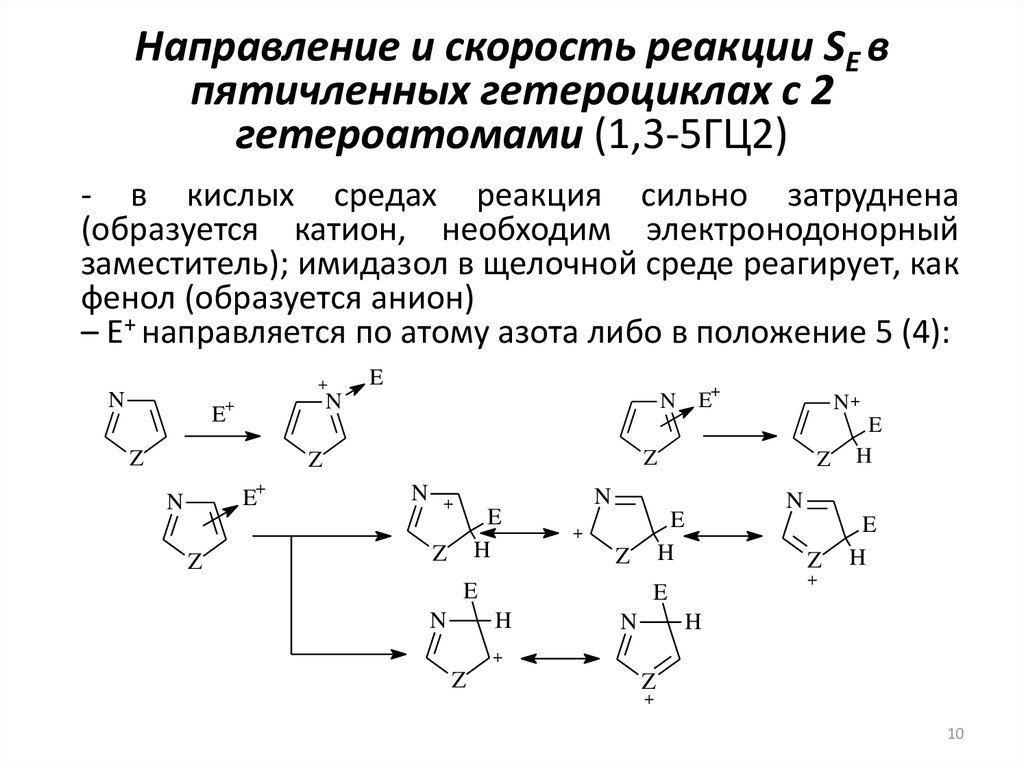
10. Направление и скорость реакции SE в пятичленных гетероциклах с 2 гетероатомами (1,3-5ГЦ2)
- в кислых средах реакция сильно затруднена(образуется катион, необходим электронодонорный
заместитель); имидазол в щелочной среде реагирует, как
фенол (образуется анион)
– E+ направляется по атому азота либо в положение 5 (4):
+
N
E
+
N E
N
+
E
Z
Z
Z
+
E
N
Z
N+
N
+
E
H
Z
N
N
E
H
+
Z
E
N
Z
Z
N
E
H
+
E
H
E
H
H
+
Z
Z
+
10
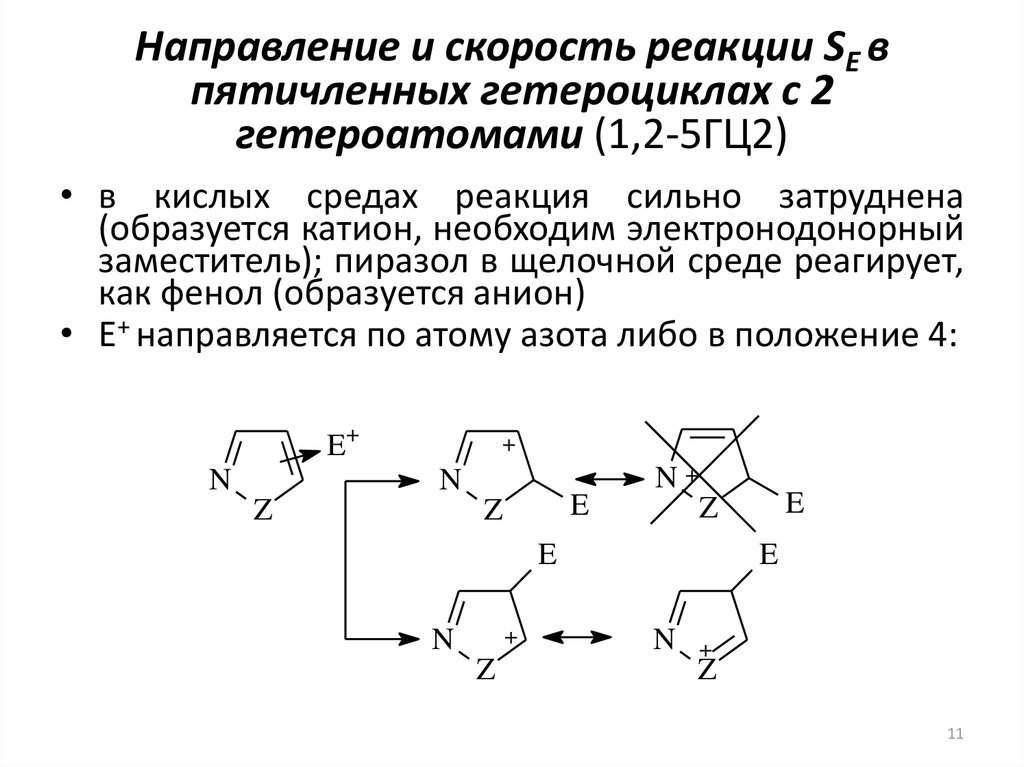
11. Направление и скорость реакции SE в пятичленных гетероциклах с 2 гетероатомами (1,2-5ГЦ2)
• в кислых средах реакция сильно затруднена(образуется катион, необходим электронодонорный
заместитель); пиразол в щелочной среде реагирует,
как фенол (образуется анион)
• E+ направляется по атому азота либо в положение 4:
E+
N
+
N
Z
E
Z
N+
E
+
N
Z
E
Z
E
N
+
Z
11
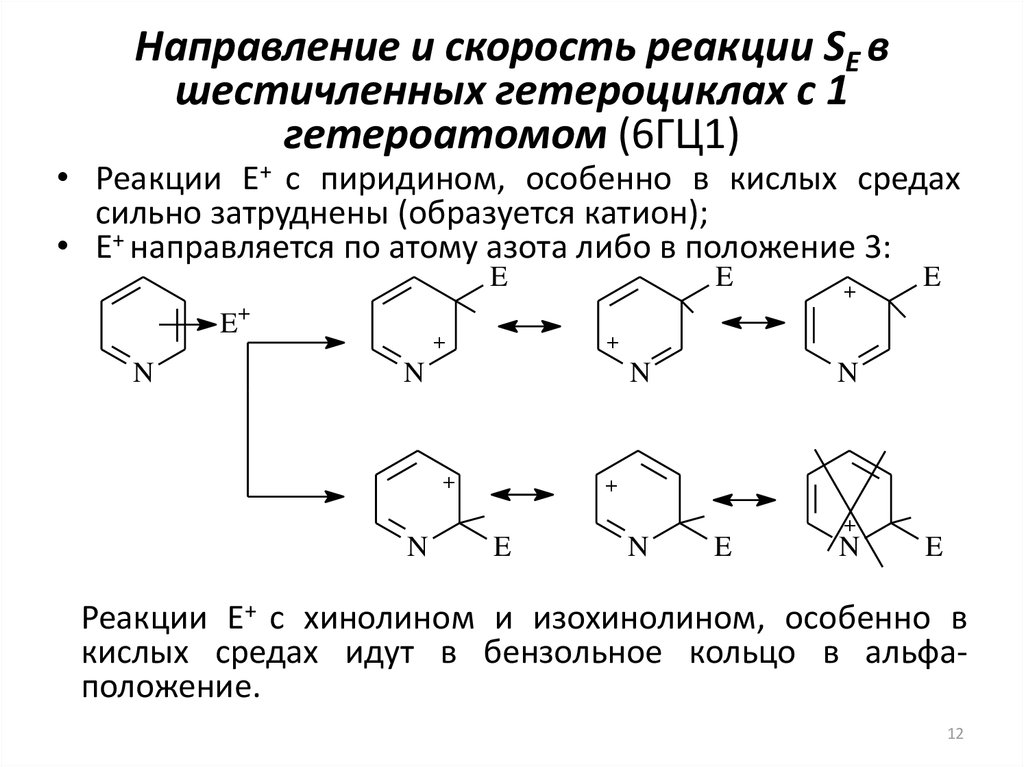
12. Направление и скорость реакции SE в шестичленных гетероциклах с 1 гетероатомом (6ГЦ1)
• Реакции E+ с пиридином, особенно в кислых средахсильно затруднены (образуется катион);
• E+ направляется по атому азота либо в положение 3:
E
E+
N
+
E
+
E
+
N
N
+
N
+
+
N
E
N
E
N
E
Реакции E+ с хинолином и изохинолином, особенно в
кислых средах идут в бензольное кольцо в альфаположение.
12
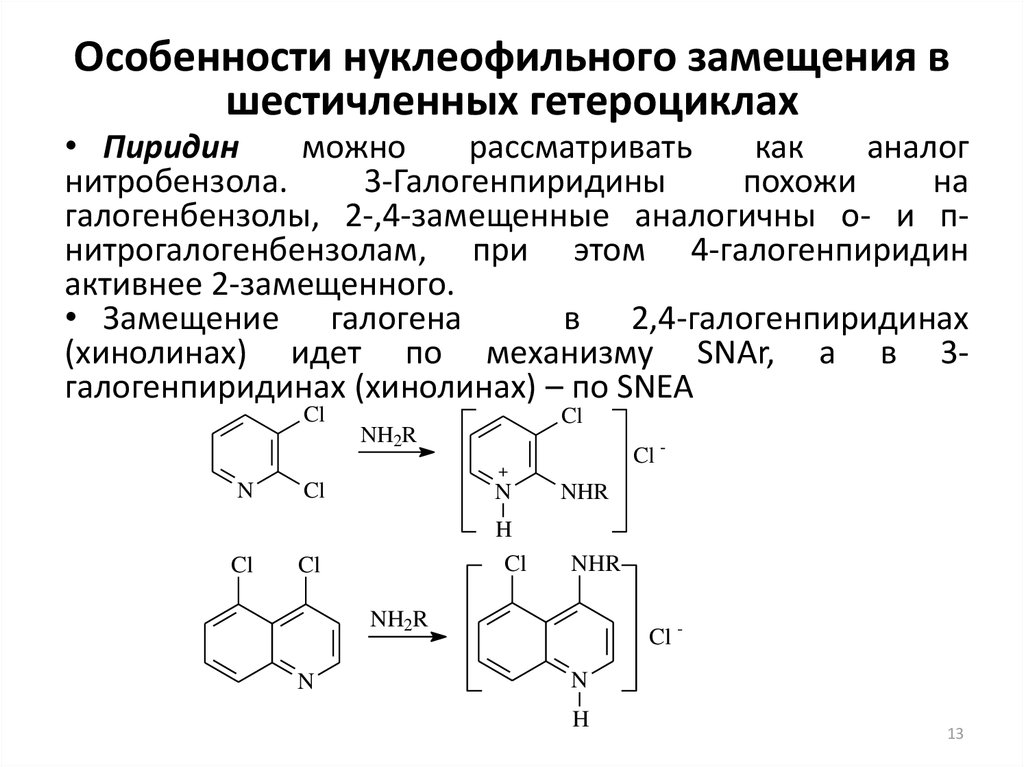
13. Особенности нуклеофильного замещения в шестичленных гетероциклах
• Пиридинможно
рассматривать
как
аналог
нитробензола.
3-Галогенпиридины
похожи
на
галогенбензолы, 2-,4-замещенные аналогичны о- и пнитрогалогенбензолам, при этом 4-галогенпиридин
активнее 2-замещенного.
• Замещение галогена
в 2,4-галогенпиридинах
(хинолинах) идет по механизму SNAr, а в 3галогенпиридинах (хинолинах) – по SNEA
Cl
Cl
NH2R
Cl -
+
N
Cl
N
NHR
H
Cl
Cl
Cl
NHR
NH2R
N
Cl N
H
13
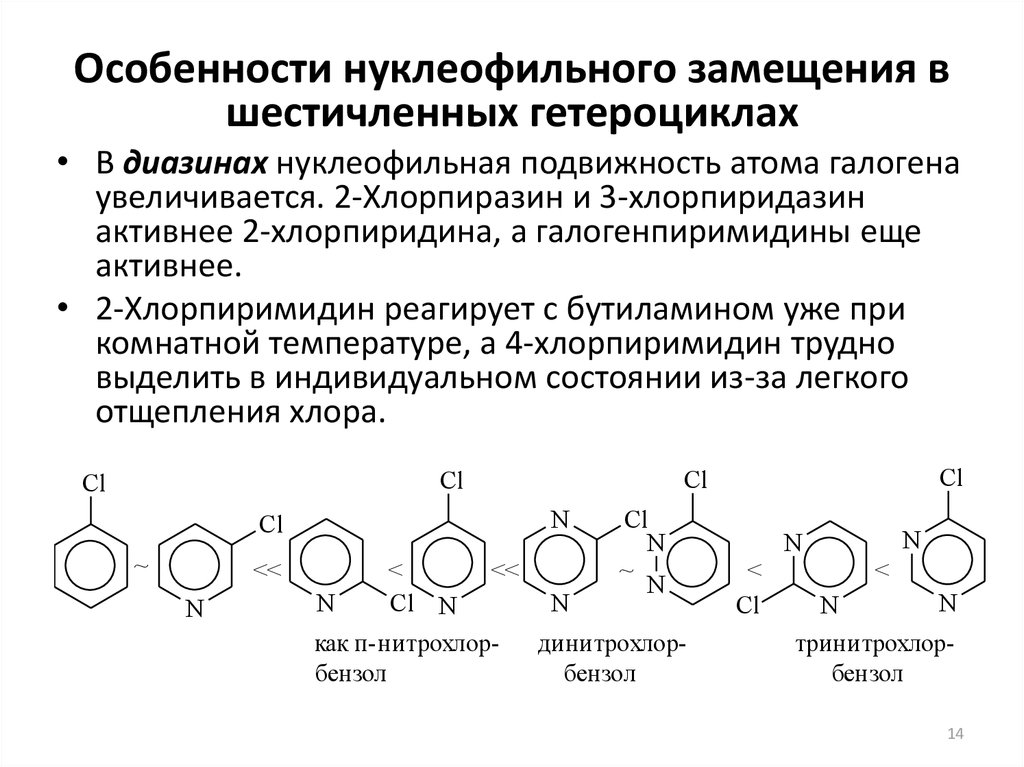
14. Особенности нуклеофильного замещения в шестичленных гетероциклах
• В диазинах нуклеофильная подвижность атома галогенаувеличивается. 2-Хлорпиразин и 3-хлорпиридазин
активнее 2-хлорпиридина, а галогенпиримидины еще
активнее.
• 2-Хлорпиримидин реагирует с бутиламином уже при
комнатной температуре, а 4-хлорпиримидин трудно
выделить в индивидуальном состоянии из-за легкого
отщепления хлора.
Cl
~
<<
N
Cl
Cl
Cl
Cl
N
Cl
N
~
N
<
<<
N
N
Cl N
как п-нитрохлординитрохлорбензол
бензол
<
Cl
N
N
<
N
N
тринитрохлорбензол
14

 chemistry
chemistry








