Similar presentations:
6-членные гетероциклы с одним гетероатомом
1. 6-членные гетероциклы с одним гетероатомом
12. 6-членные гетероциклы с одним гетероатомом азота Азины
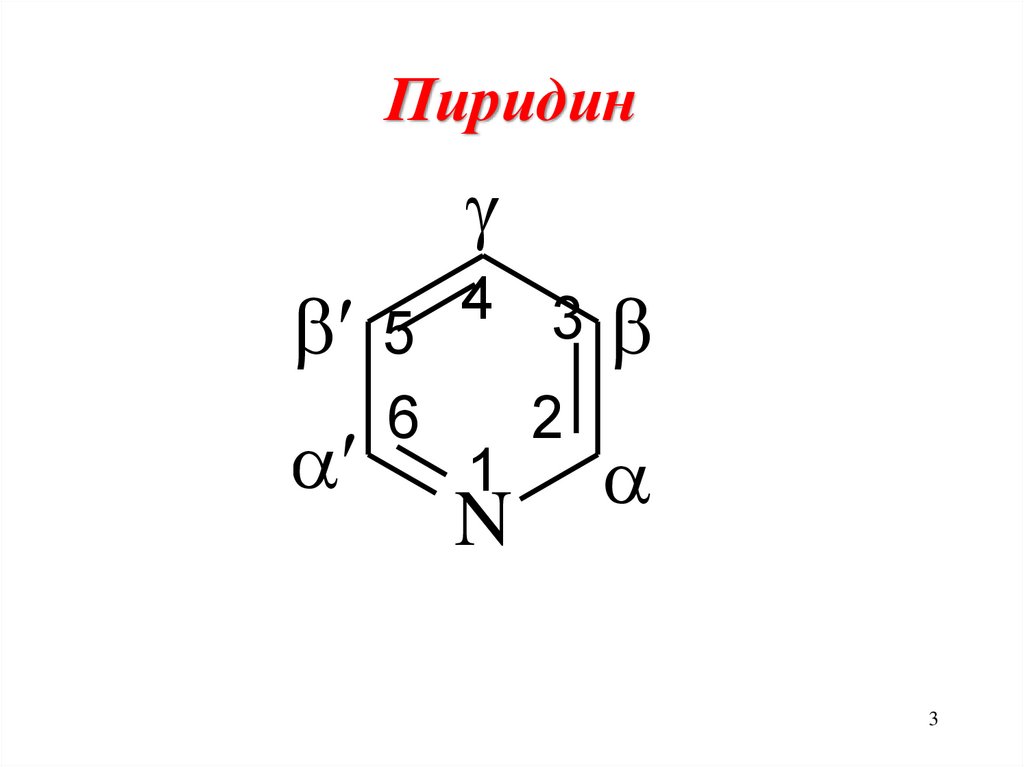
4γ5
6
1
3β
2
N α
пиридин
6
7
5
4
8
1
N
хинолин
3
2
6
7
5
4
8
1
3
2
N
изохинолин
7
6
8
9
1
5
10
4
N
акридин
2
3
2
3. Пиридин
4 35
6
2
1
N
3
4. Получение. Методы синтеза
1. Конденсация ацетилена с НCN:HC
CH
HC
HC
N
CH
t, kat
N
2. Из акролеина и NH3:
CH3
0
2 CH2
CH
C
O
H
Al2O3, 350
NH3
3. Из природных источников
2H2O
N
β-пиколин
4
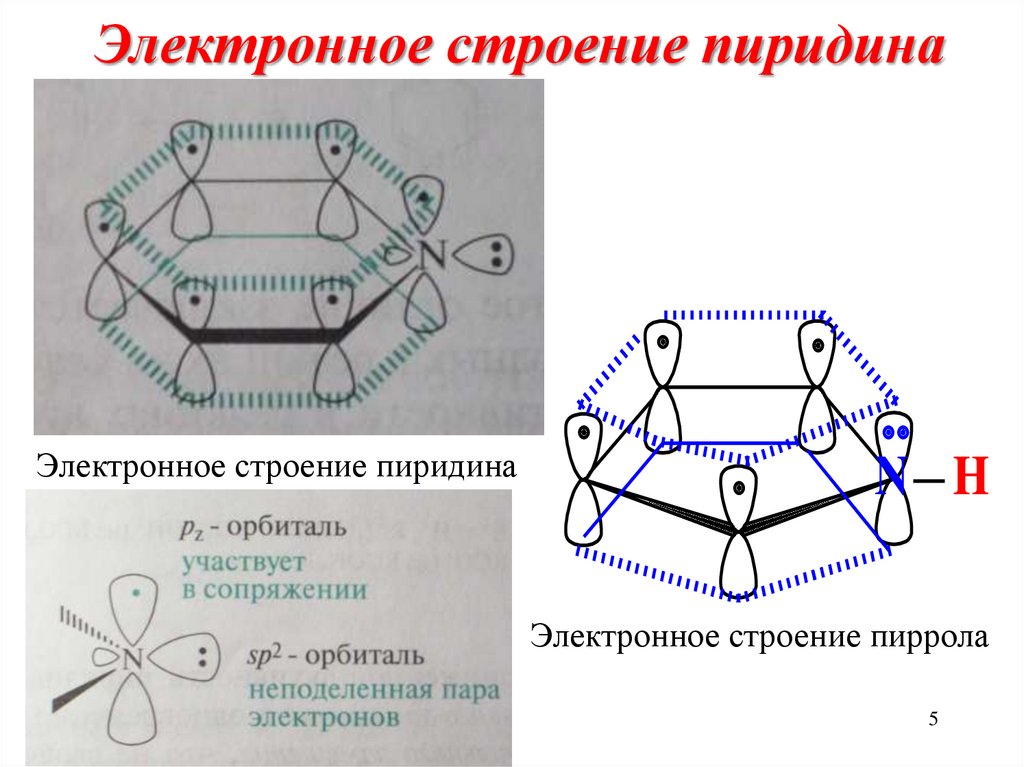
5. Электронное строение пиридина
Электронное строение пиридинаN H
Электронное строение пиррола
5
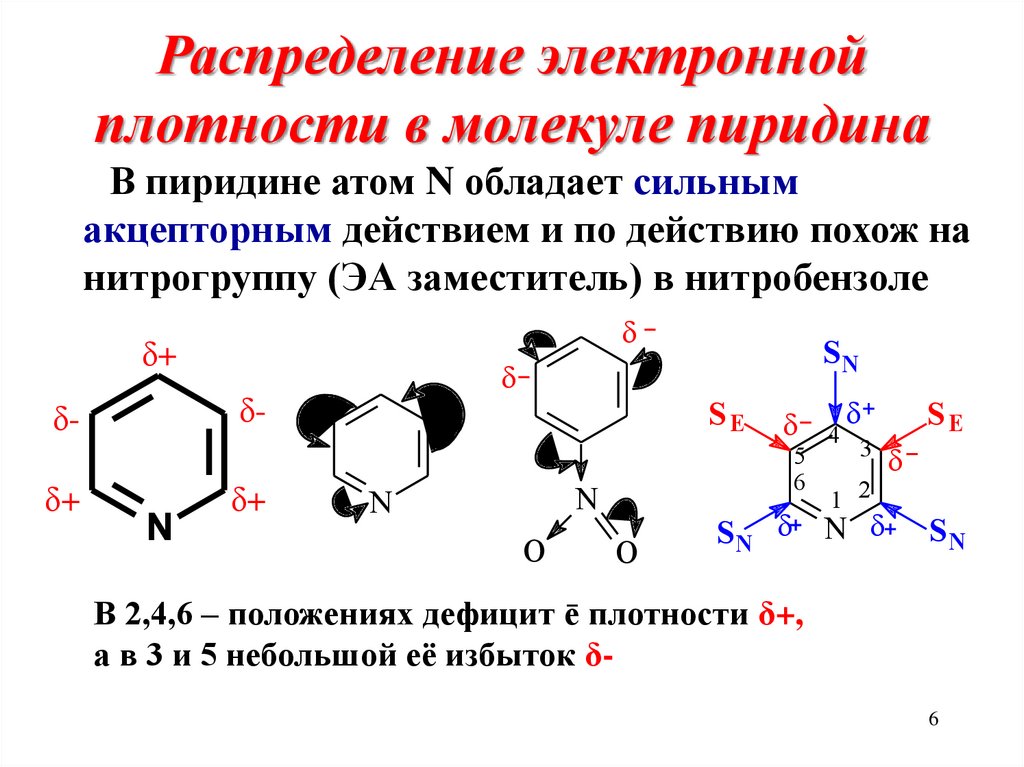
6. Распределение электронной плотности в молекуле пиридина
В пиридине атом N обладает сильнымакцепторным действием и по действию похож на
нитрогруппу (ЭА заместитель) в нитробензоле
δ+
δ+
δ-
δ-
N
δ+
SN
SE
5
6
N
N
O
O
4
3
1 2
SN N
SE
SN
В 2,4,6 – положениях дефицит ē плотности δ+,
а в 3 и 5 небольшой её избыток δ6
7. Химические свойства пиридина
1. Оснόвность пиридина2. Реакции по атому азота
3. Реакции SE
4. Реакции SN
5. Окисление
6. Восстановление пиридина
7
8. 1. Оснόвность пиридина рКb=8,8 (рКа=14 - 8,8 =5,2)
OHH2O
N H пиридиний гидроксид
N
соль пиридиний хлорид-
HCl
+
NH
N
Cl
O
OH
NO2
O2N
N
N
H
NO2
NO2
O2N
NO2
соль пикрат пиридина
8
9.
2. Реакции с электрофильнымиреагентами
N-алкилирование и N-ацилирование
(нуклеофильные свойства атома N)
CH3I
иодид метил-пиридиния
I- метилпиридиний иодид
N+
CH3
N
CH3COCl
+
N
C
CH3
Cl
O
N-ацетилпиридинийхлорид
9
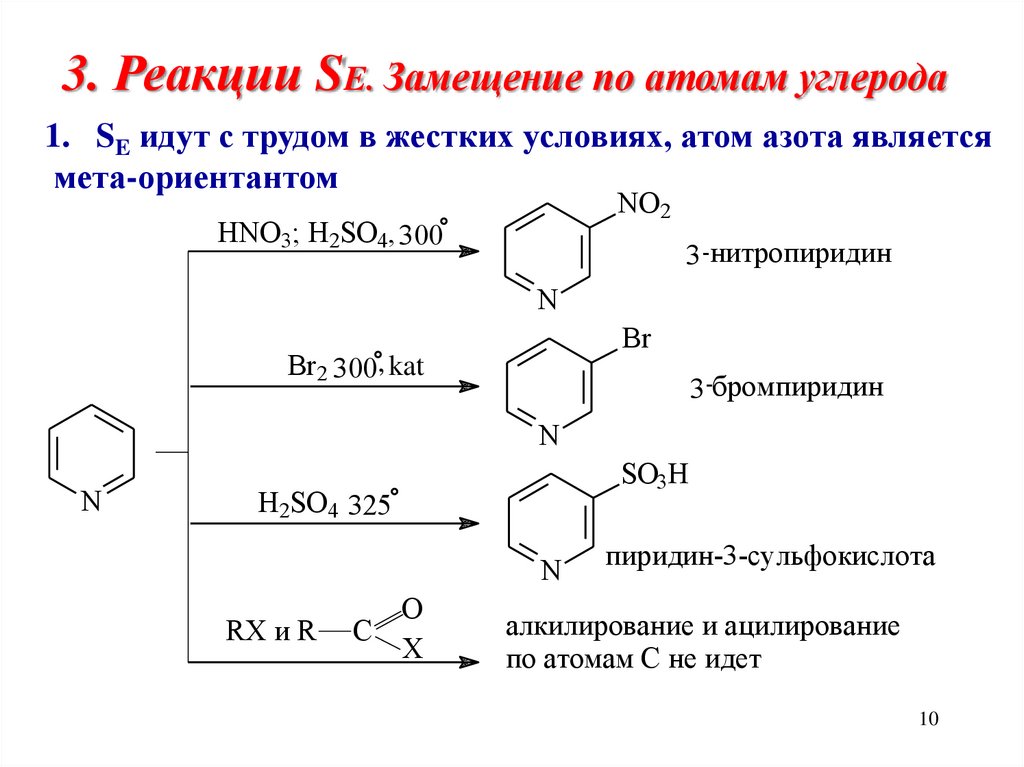
10. 3. Реакции SE. Замещение по атомам углерода
1. SE идут с трудом в жестких условиях, атом азота являетсямета-ориентантом
NO2
HNO3; H2SO4, 300
3 -нитропиридин
N
Br
Br2 300, kat
3 -бромпиридин
N
N
SO3H
H2SO4 325
N
RX и R
O
C
X
пиридин-3-сульфокислота
алкилирование и ацилирование
по атомам С не идет
10
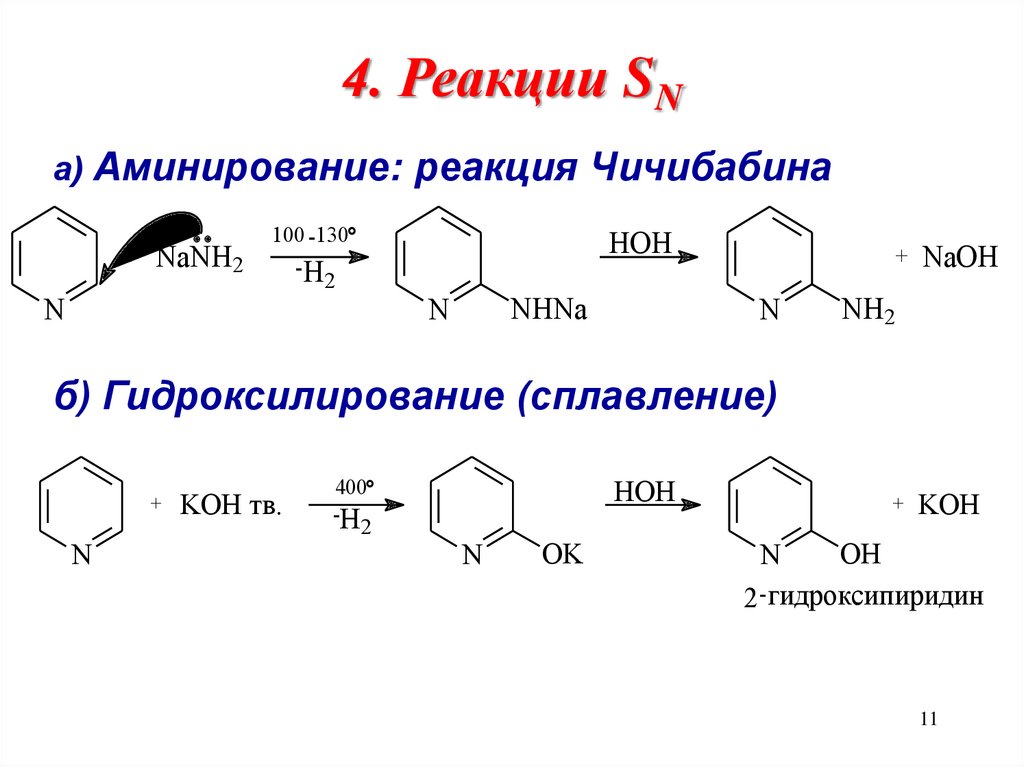
11.
4. Реакции SNа) Аминирование: реакция Чичибабина
+
NaNH2
N
100 -130
-H
2
HOH
NHNa
N
N
+
NaOH
+
KOH
NH2
б) Гидроксилирование (сплавление)
+
N
KOH тв.
400
-H
2
HOH
N
OK
OH
N
2 -гидроксипиридин
11
12.
Чичибабин, Алексей Евгеньевич1871 —1945] — рус. химик-органик.
В 1892 окончил Московский ун-т.
в 1928 —член АН СССР
В 1930 уехал за границу,
где и жил до конца жизни
• Основные работы посвящены химии пиридина
и др. азотистых гетероциклов.
• Разработал способ получения производных
пиридина путем конденсации альдегидов и
кетонов с аммиаком.
• В 1914 открыл способ получения αаминопиридина действием на пиридин амида
натрия (реакция Чичибабина) и распространил
эту реакцию на гомологи пиридина, хинолин и
изохинолин;
• Изучил галоидирование, сульфирование и
нитрование α-аминопиридина.
• Действием на пиридин едкого кали Ч. получил
α-оксипиридин
• Исследовал таутомерию аминопиридинов и
оксипиридинов.
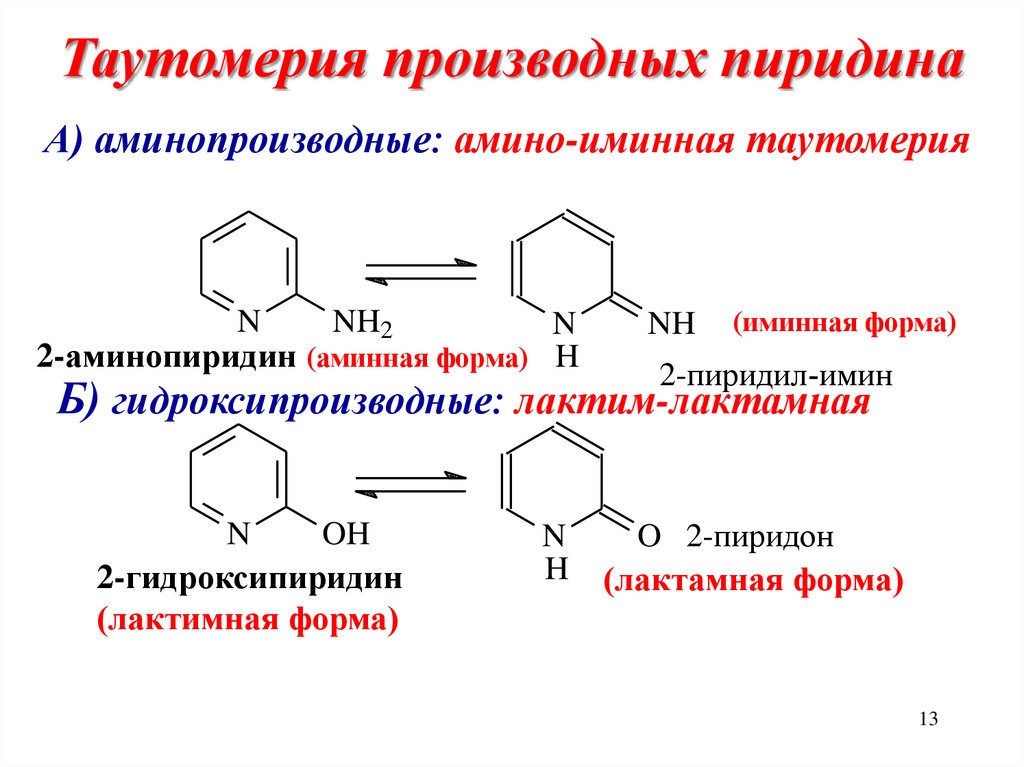
13. Таутомерия производных пиридина
А) аминопроизводные: амино-иминная таутомерияN
NH2
N
2-аминопиридин (аминная форма) H
NH
(иминная форма)
2-пиридил-имин
Б) гидроксипроизводные: лактим-лактамная
N
OH
2-гидроксипиридин
(лактимная форма)
N
H
O 2-пиридон
(лактамная форма)
13
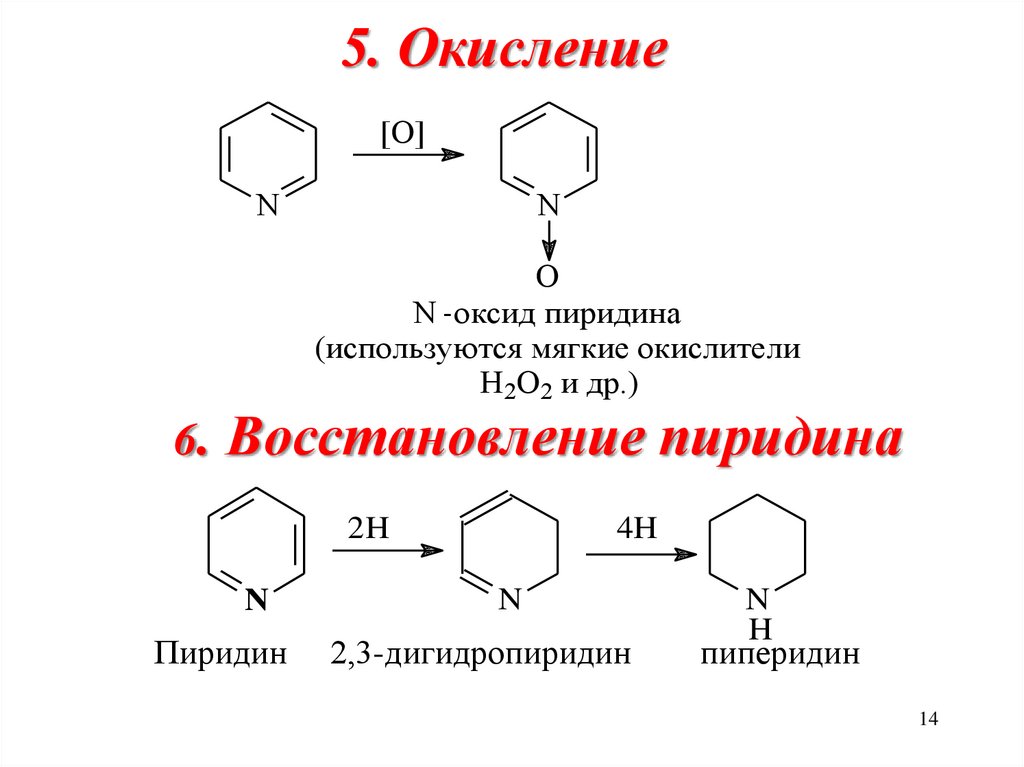
14. 5. Окисление
[O]N
N
O
N - оксид пиридина
(используются мягкие окислители
H2O2 и др.)
6.
Восстановление пиридина
2H
N
Пиридин
4H
N
2,3-дигидропиридин
N
H
пиперидин
14
15. Производные пиридина
• α,β,γ-Пиколины окисляются до кислот[O]
• Кислотно-снόвные
свойства кислот
[O]
[O]
16.
Препараты на основе β-пиколина1. Никотиновая кислота
CH3
COOH
NH3
[O]
N
-пиколин
N
никотиновая кислота
CONH2
N никотинамид
2. Изоникотиновая кислота, фтивазид
CH3
COOH
[O]
N
-пиколин
NH2 NH2
N
изоникотиновая
кислота
C
O
NH NH
2
N
изониазид
(ГИНК)
C
O
NH N СH
N
OCH3
фтивазид
OH
16
17. Никотинамидадениндинуклеотид никотинамидные коферменты НАДН и НАДФН)
СН3СН
COOH
НАД+
CH3
C
COOH
НАД Н
OH
O
СН3
СН
OH
COOH
НАД+
CH3
C
O
COOH
НАД Н + H +
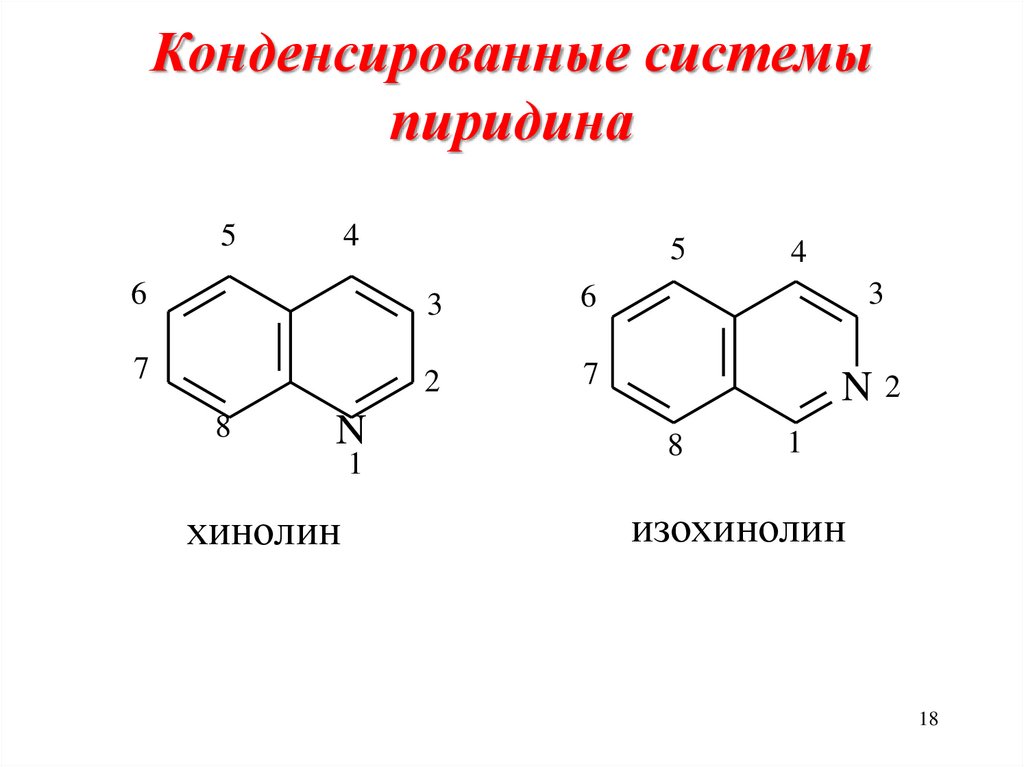
18. Конденсированные системы пиридина
54
5
4
6
3
6
3
7
2
7
N2
8
N
1
хинолин
8
1
изохинолин
18
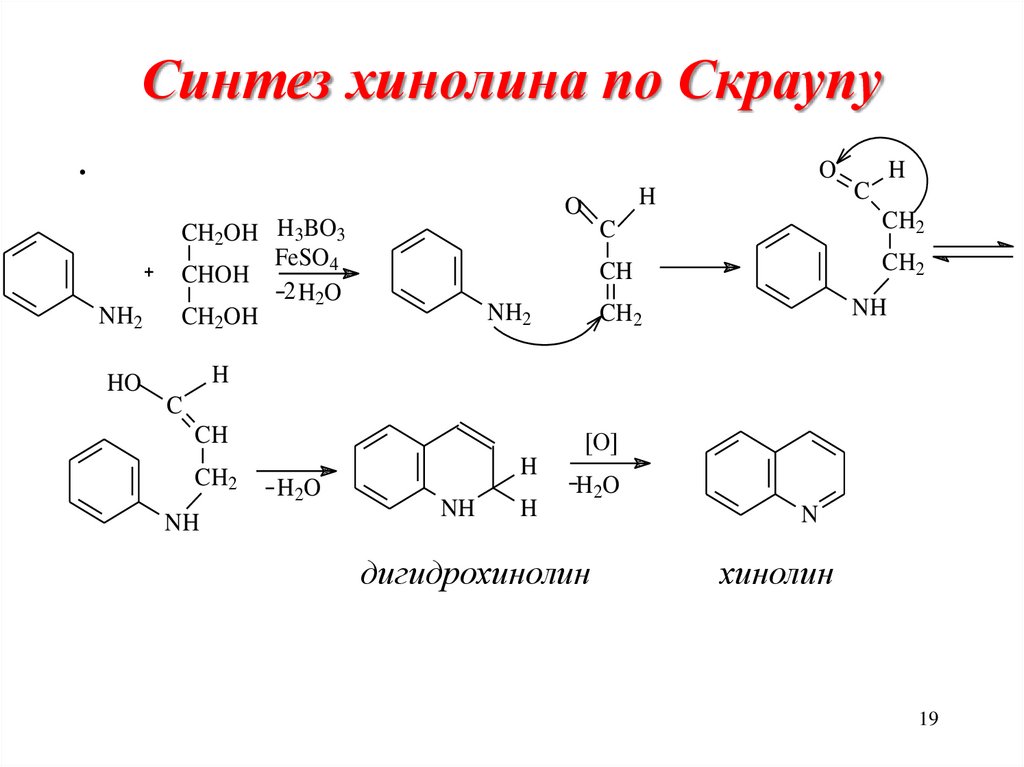
19. Синтез хинолина по Скраупу
.O
NH2
H
O
CH2OH H3BO3
FeSO4
CHOH
2 H 2O
CH2OH
NH2
H
C
C
CH2
CH
CH2
NH
CH2
H
HO
C
CH
CH2
NH
[O]
H 2O
H
NH
H
H 2O
дигидрохинолин
N
хинолин
19
20. Химические свойства хинолина и изохинолина
1. Оснόвные свойства2. Реакции по атому азота
3. Реакции SE
4. Реакции SN
5. Окисление
6. Восстановление
20
21. Оснόвные свойсва. N-Алкилирование, N-ацилирование
метилхинолиний йодид21
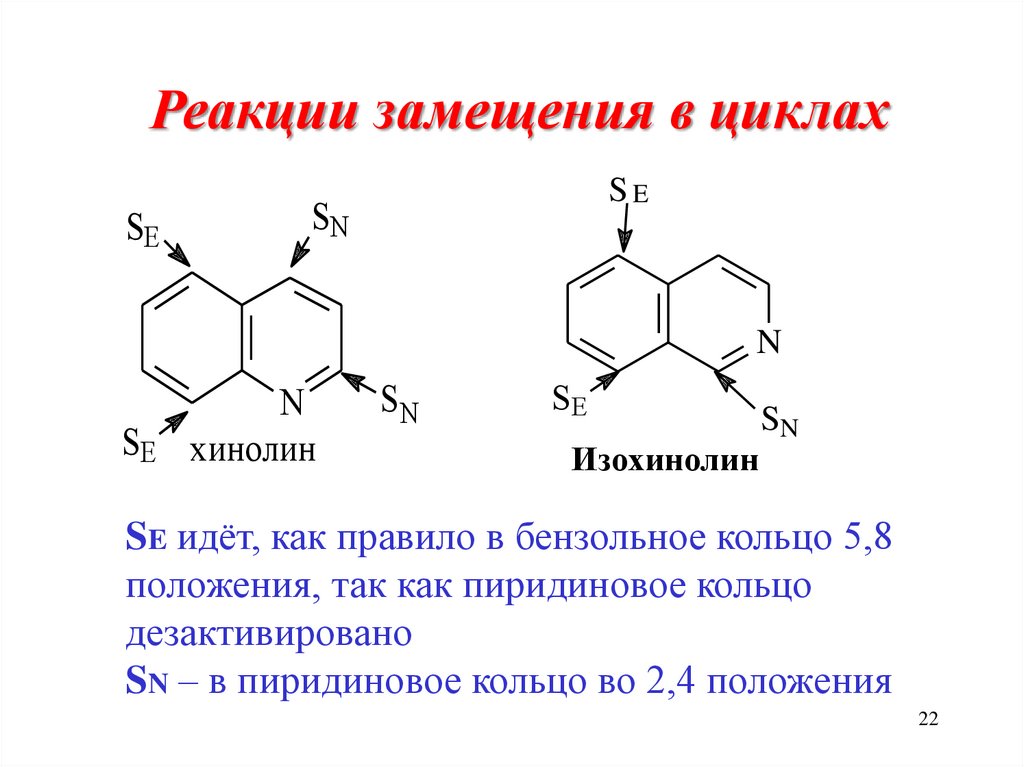
22.
Реакции замещения в циклахSE
SE
SN
N
SE
N
хинолин
SN
SE
Изохинолин
SN
SE идёт, как правило в бензольное кольцо 5,8
положения, так как пиридиновое кольцо
дезактивировано
SN – в пиридиновое кольцо во 2,4 положения
22
23. Реакции электрофильного замещения SE
24. Реакции нуклеофильного замещения SN
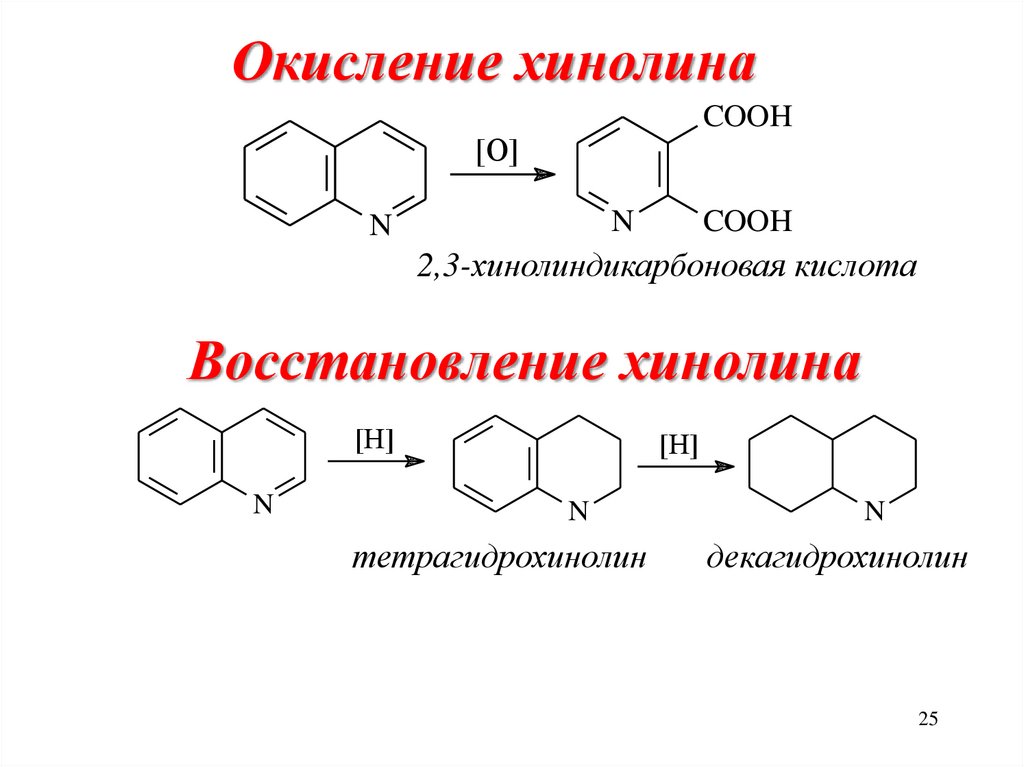
• Реакции аминирования, гидроксилирования25.
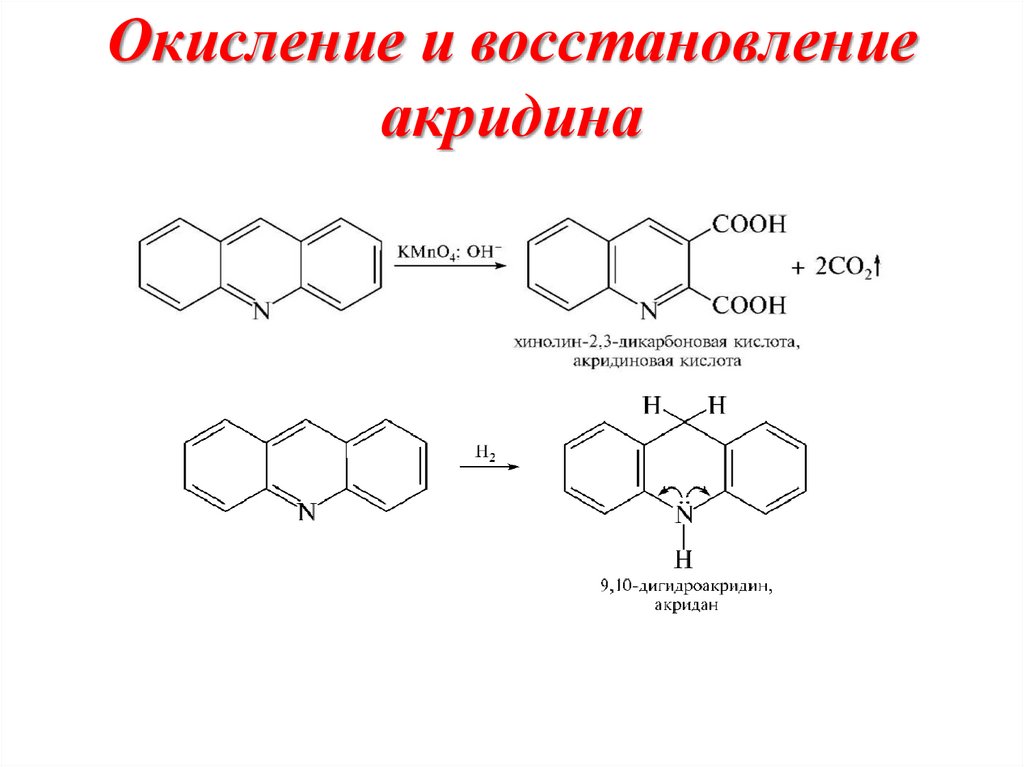
Окисление хинолинаCOOH
[O]
N
N
COOH
2,3-хинолиндикарбоновая кислота
Восстановление хинолина
[H]
N
[H]
N
тетрагидрохинолин
N
декагидрохинолин
25
26. Производные 8-oксихинолина
H2SO4OH
N
2
хинозол
Производные
8-oксихинолина
NO2
N
OH Нитроксолин
Получение
хинозола
Комплексообразование с солями Мg2+
Zn2+, AI3+
(5-НОК)
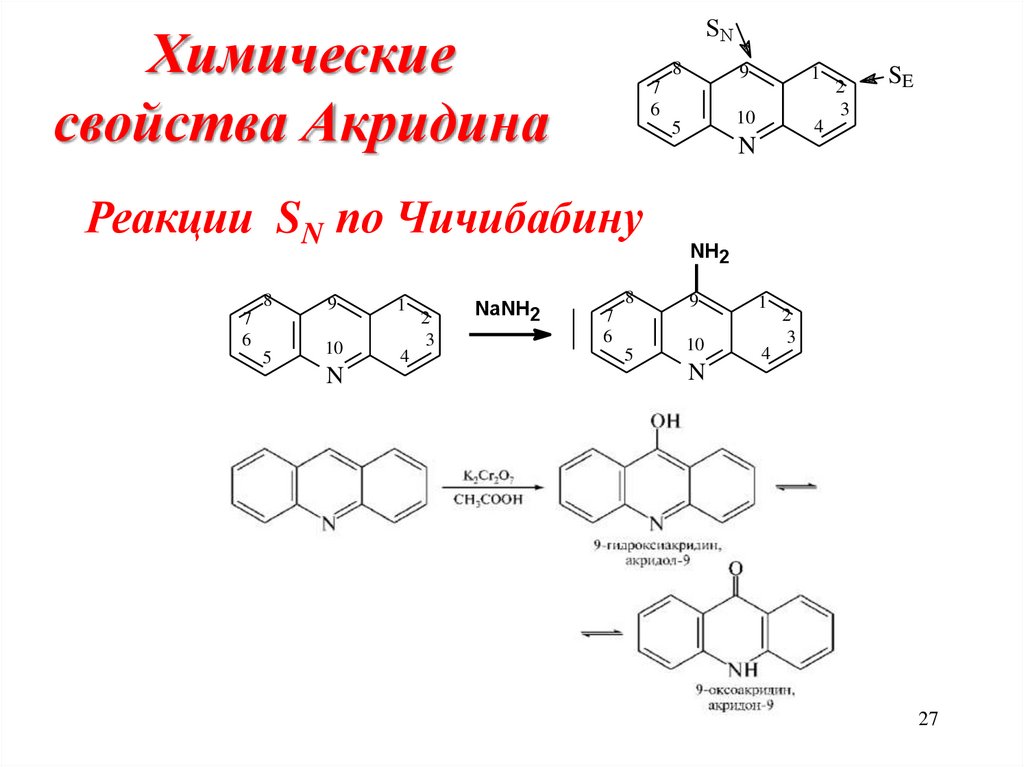
27. Химические свойства Акридина
SNХимические
свойства Акридина
8
7
6
5
Реакции SN по Чичибабину
8
7
6
5
9
1
10
4
N
2
3
NaNH2
8
7
6
5
9
1
10
4
2
3
SE
N
NH2
9
1
10
4
2
3
N
27
28. Реакции акридина по азоту
• Оснόвные свойства. Окисление.N-алкилирование
29. Окисление и восстановление акридина
30. 6-членные гетероциклы с атомом кислорода
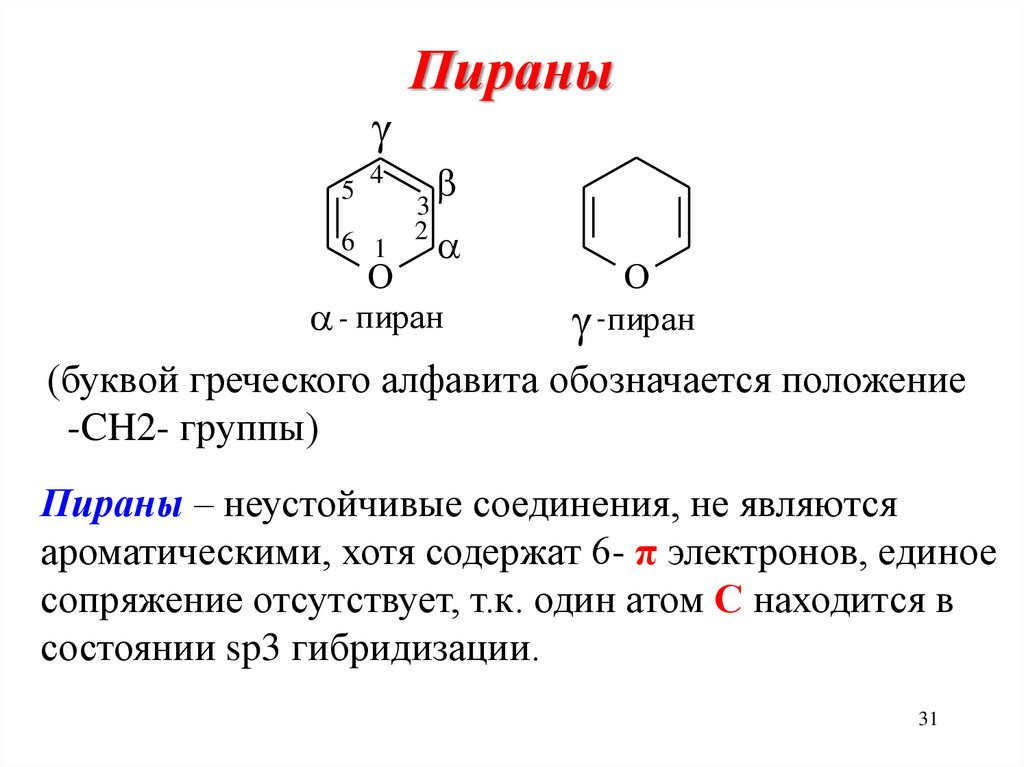
Пираны, пироны31. Пираны
5Пираны
4
6 1
3
2
O
- пиран
O
-пиран
(буквой греческого алфавита обозначается положение
-CH2- группы)
Пираны – неустойчивые соединения, не являются
ароматическими, хотя содержат 6- π электронов, единое
сопряжение отсутствует, т.к. один атом С находится в
состоянии sp3 гибридизации.
31
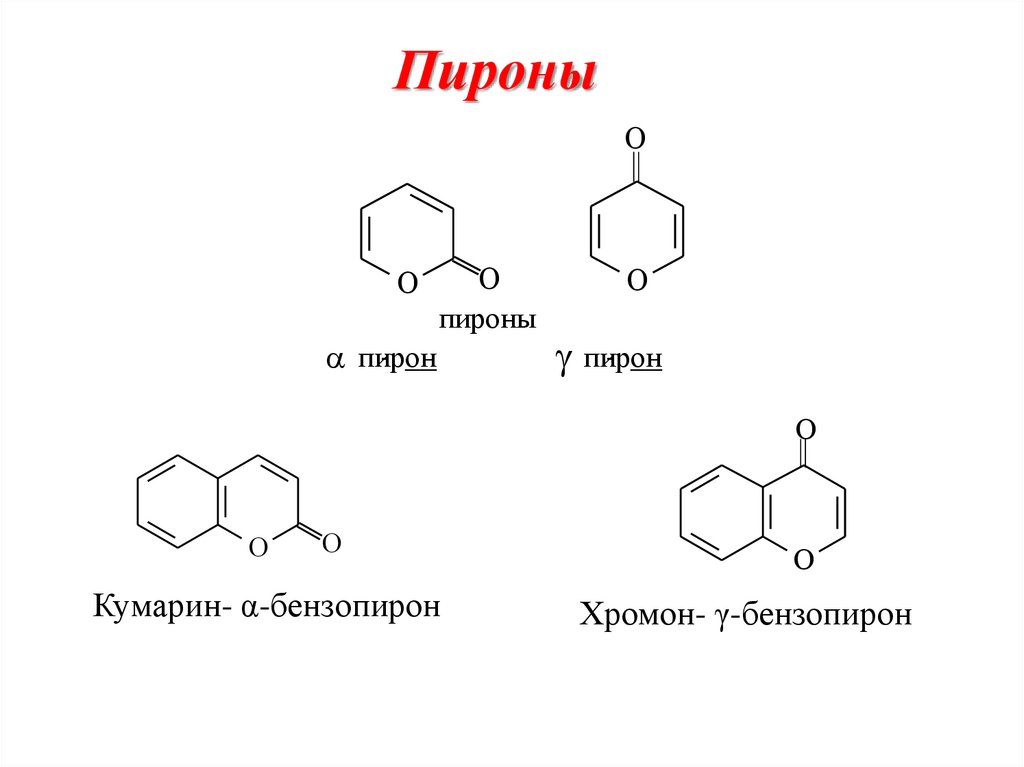
32. Пироны
OO
O
пироны
пирон
O
пирон
O
O
O
Кумарин- α-бензопирон
O
Хромон- γ-бензопирон
33. Пироны образуют пирилиевые соли
OHO
HCl
+
O
O
O
4 - гидроксипирилия хлорид
или хлорид пирилия (пироксония)
ClCH3
CH3I
I- иодид 4 - метоксипирилия
O+
основные свойства
эфирный O
Устойчивы, ароматичны
Реакции SE
O
O
Br2
O
Br
FeCl3
-HBr
O
33
34. Кумарины и хромоны в щелочной среде раскрывают пироновый цикл
OH-кумарин
O
O
C
O
OH
OH
O
O
OH-
хромон
O
OH
CHOH
халкон
34
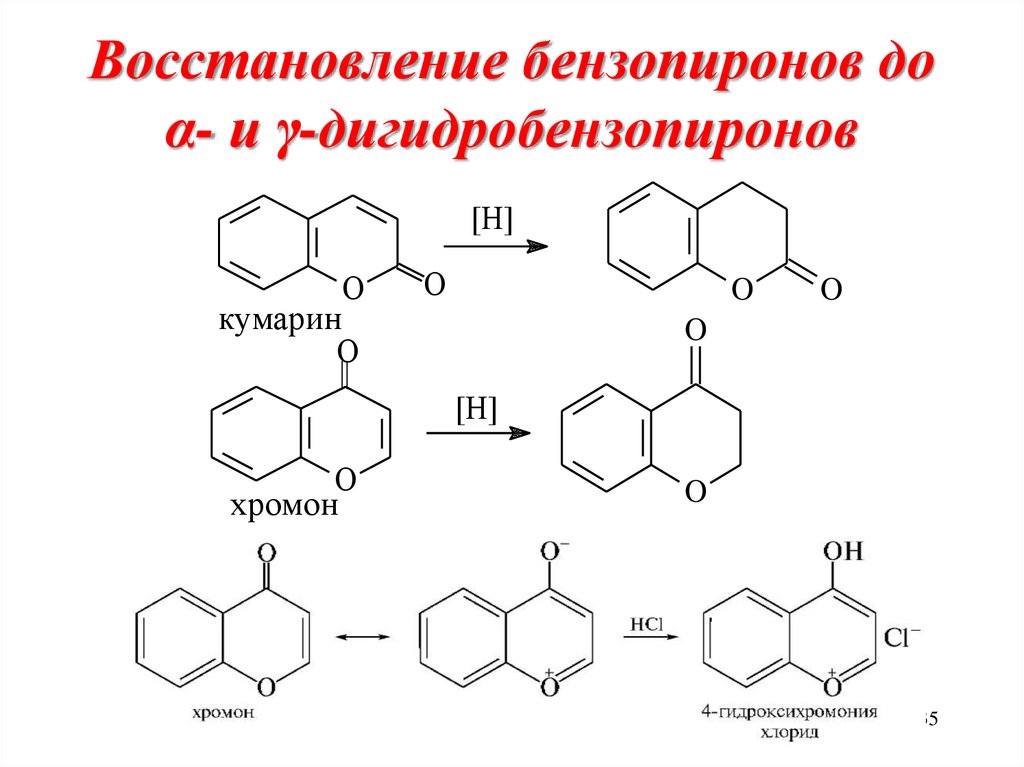
35. Восстановление бензопиронов до α- и γ-дигидробензопиронов
[H]кумарин
O
O
O
O
O
O
[H]
O
хромон
O
35
36. Производные пирана
OO
O
O
Кумарин (бензо-α-пирон), Хромон (бензо-γ-пирон),
SE
SE
O
O
O
O
O
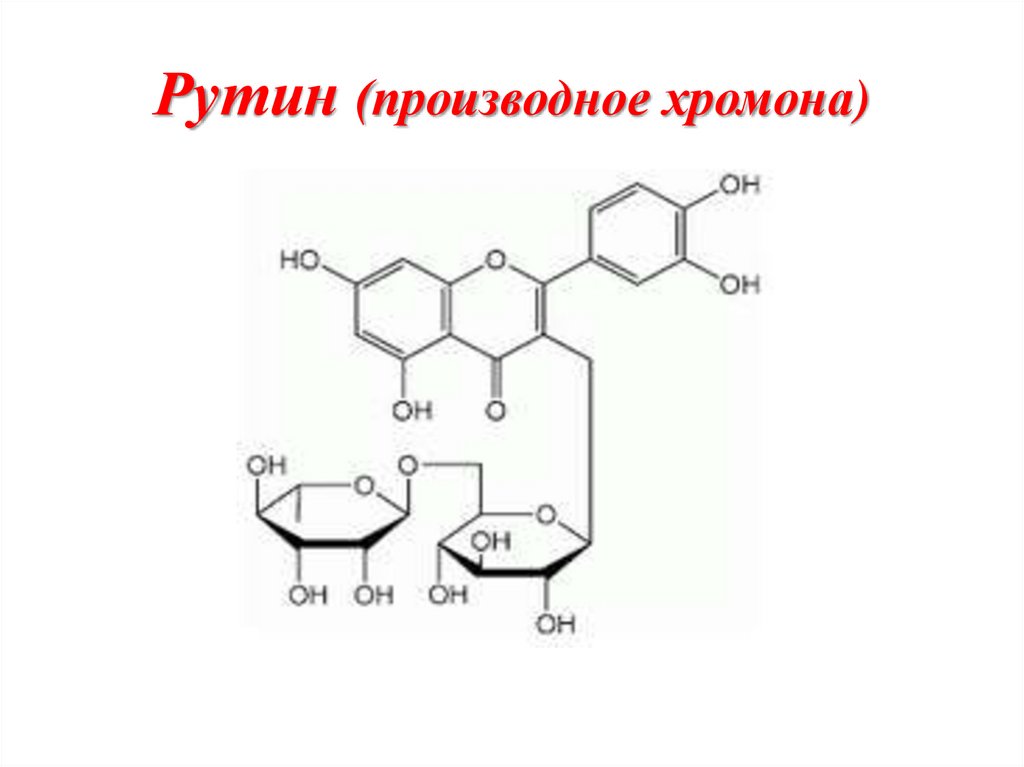
Флавон (2-фенилхромон)
O
36




















 chemistry
chemistry