Similar presentations:
Гетероциклические соединения
1.
Гетероциклические соединения - органическиесоединения циклического строения, содержащие в цикле
не только атомы углерода, но и атомы других элементов,
например, O, N,S,P.
Гетероциклы широко представлены в природе: входят
в состав
- алкалоидов, витаминов, пигментов;
-играют важную роль в биохимических процессах;
-являются составными частями фармацевтических
препаратов, нуклеиновых кислот, красителей.
Большинство современных лекарственных средств
получают на основе активных ингредиентов, 70% из
которых являются гетероциклическими соединениями.
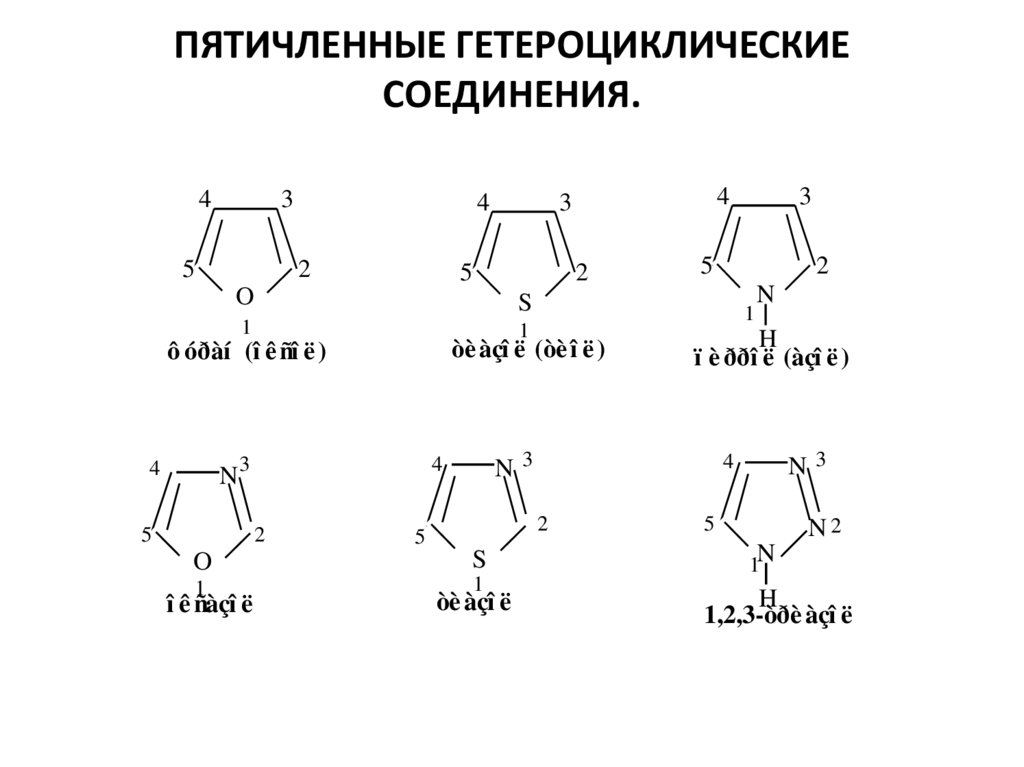
2. ПЯТИЧЛЕННЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ.
43
5
4
2
5
2
O
N
1
3
5
O
S
1
1
òè àçî ë
N3
4
2
5
N
H
ï è ððî ë (àçî ë )
N3
4
2
î ê ñàçî ë
2
1
òè àçî ë (òè î ë )
ô óðàí (î ê ñî ë )
3
5
S
1
4
4
3
5
N2
1N
H
1,2,3-òðè àçî ë
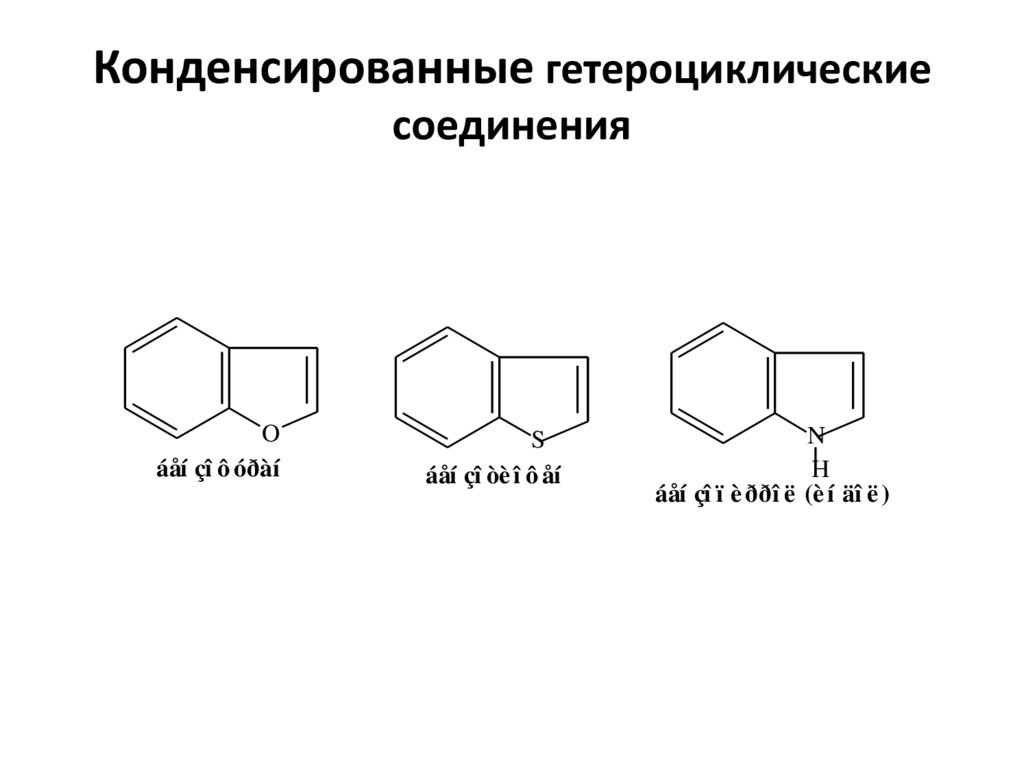
3. Конденсированные гетероциклические соединения
Oáåí çî ô óðàí
S
áåí çî òè î ô åí
N
H
áåí çî ï è ððî ë (è í äî ë )
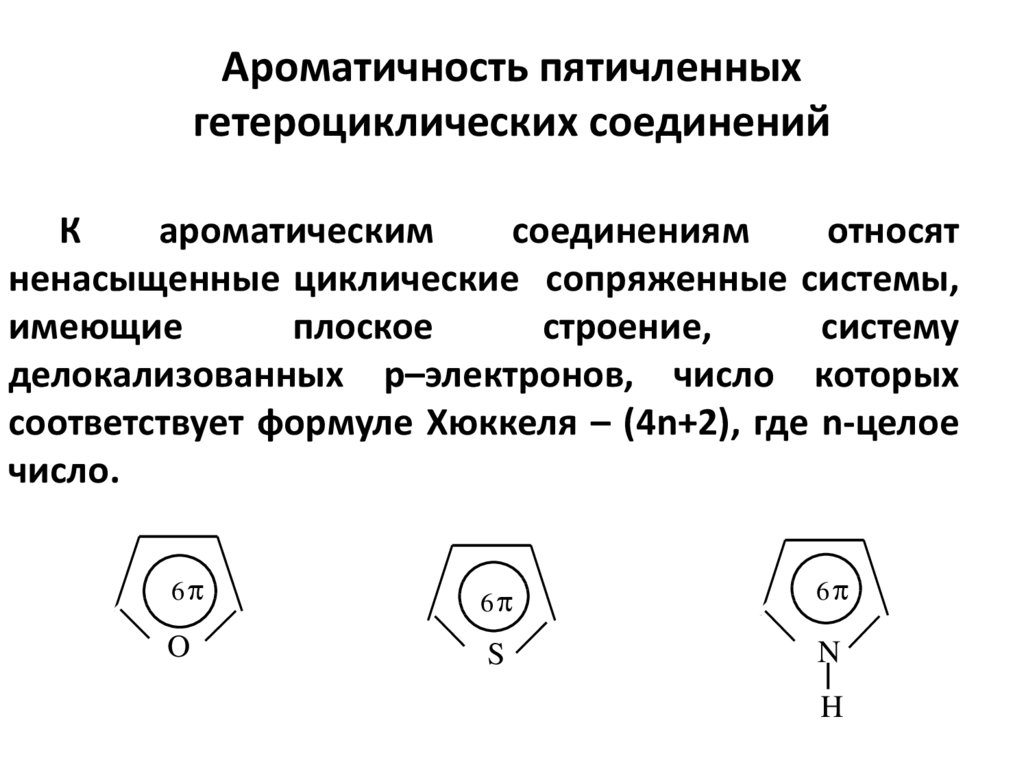
4. Ароматичность пятичленных гетероциклических соединений
Кароматическим
соединениям
относят
ненасыщенные циклические сопряженные системы,
имеющие
плоское
строение,
систему
делокализованных р–электронов, число которых
соответствует формуле Хюккеля – (4n+2), где n-целое
число.
6
6
6
O
S
N
H
5.
Вследствиеучастия
электронной
пары
гетероатомов в общей системе сопряжения в
тиофене, фуране, пирроле имеет место
достаточно
высокая
делокализация
р–
электронов, что
стабилизирует молекулу.
Энергия
ароматичности
пятичленных
гетероциклов меньше, чем у бензола и
уменьшается в ряду: Бензол – 36 ккал/моль;
тиофен – 28.6 ккал/моль; пиррол – 26 ккал/моль;
фуран – 19 ккал/моль
Меньше всего стабилизирован фуран.
Наиболее
стабилен
тиофен
вследствие
особенностей строения атома серы, которая для
делокализации может предоставить d-орбитали.
6.
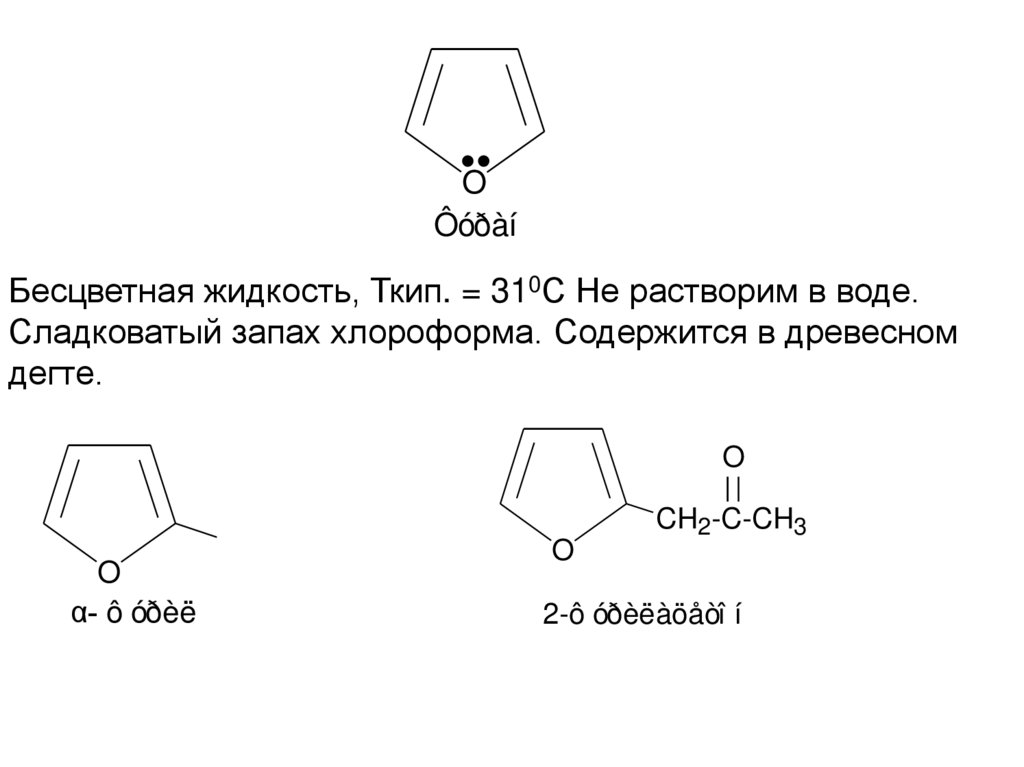
OÔóðàí
Бесцветная жидкость, Ткип. = 310С Не растворим в воде.
Сладковатый запах хлороформа. Содержится в древесном
дегте.
O
O
α- ô óðèë
O
CH2-C-CH3
2-ô óðèëàöåòî í
7.
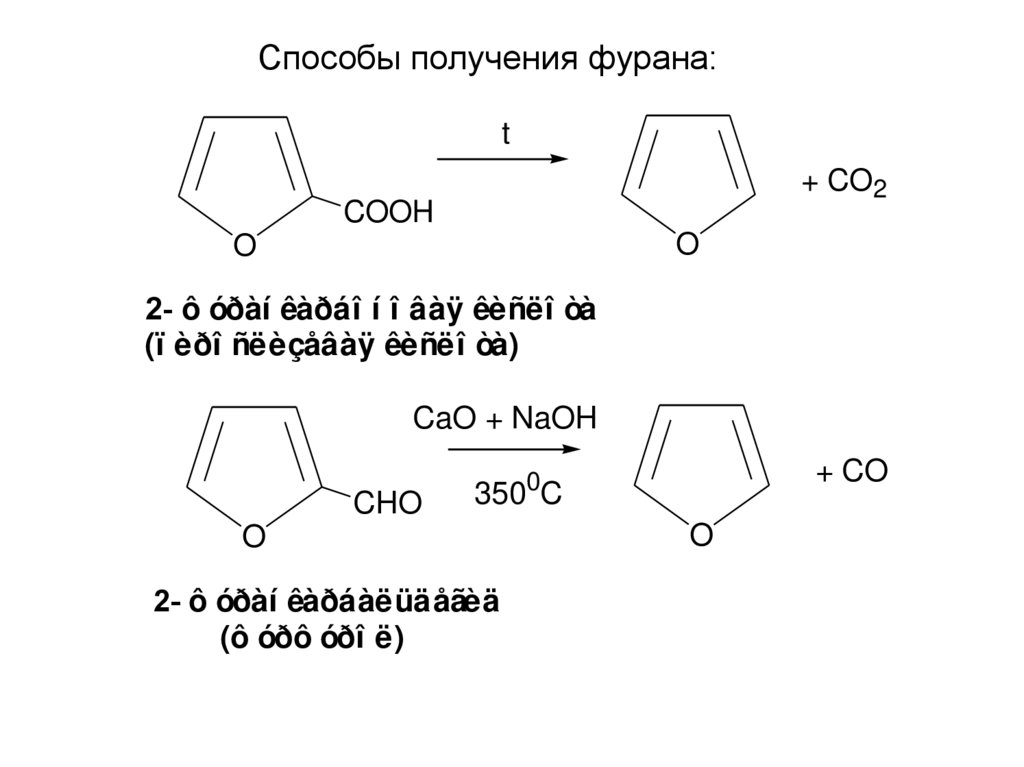
Способы получения фурана:t
+ CO2
COOH
O
O
2- ô óðàí êàðáî í î âàÿ êèñëî òà
(ï èðî ñëèçåâàÿ êèñëî òà)
CaO + NaOH
CHO
+ CO
0
350 C
O
2- ô óðàí êàðáàëüäåãèä
(ô óðô óðî ë)
O
8.
ONO 2
+
δ
OH
δ-
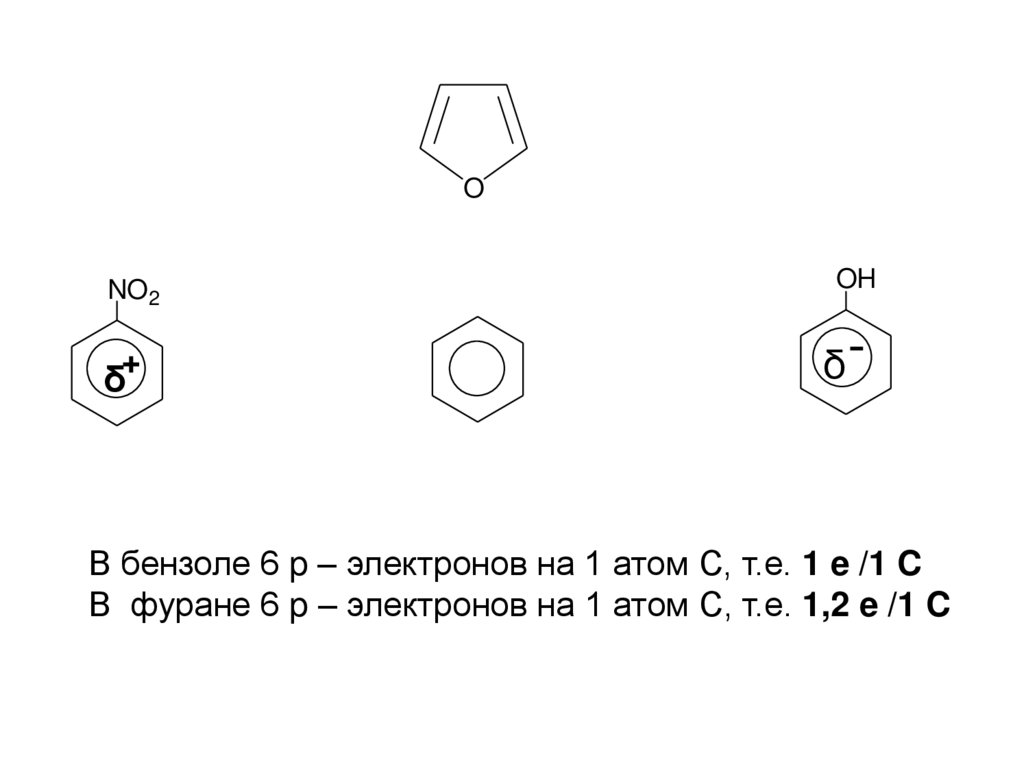
В бензоле 6 p – электронов на 1 атом С, т.е. 1 e /1 C
В фуране 6 p – электронов на 1 атом С, т.е. 1,2 e /1 C
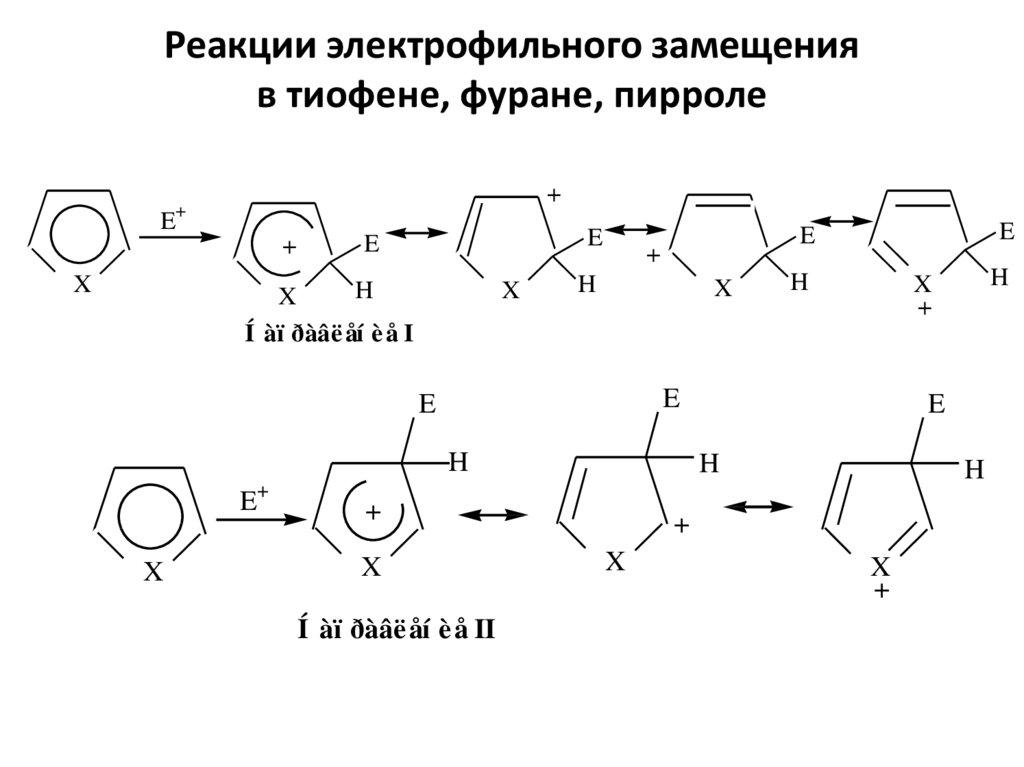
9. Реакции электрофильного замещения в тиофене, фуране, пирроле
E+
+
+
X
E
E
H
X
Í àï ðàâë åí è å I
X
+
H
X
H
E
X
H
X
Í àï ðàâë åí è å II
E
H
+
H
+
X
H
X
+
E
E
+
E
E
X
+
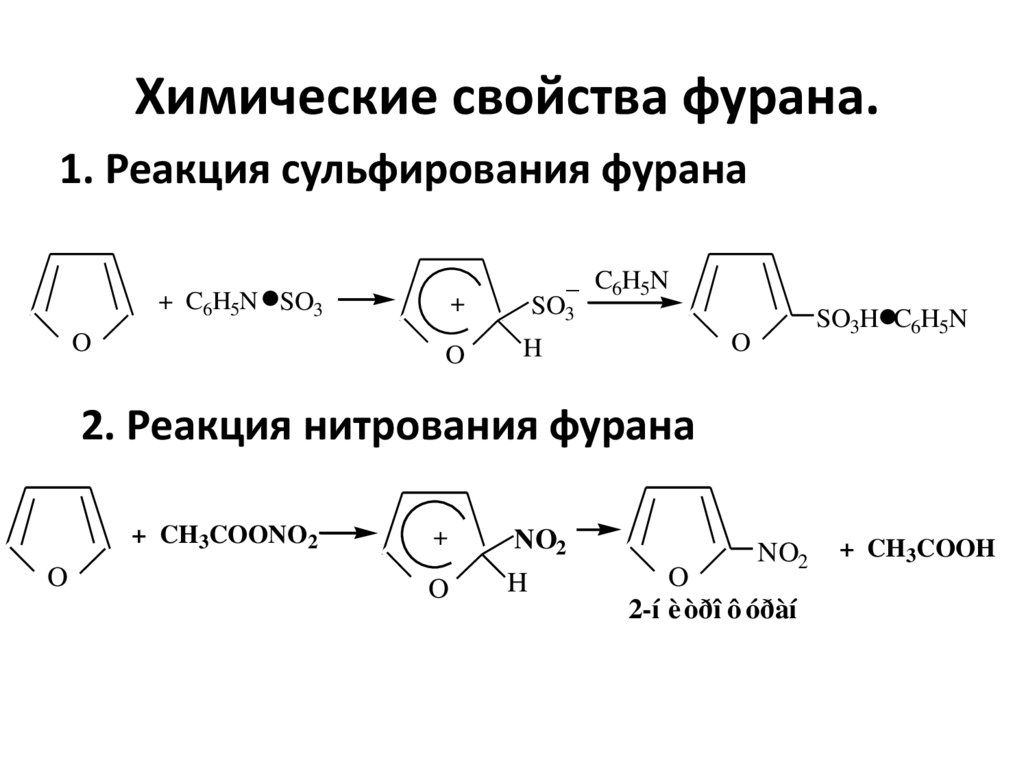
10. Химические свойства фурана.
1. Реакция сульфирования фурана.
+ C6H5N SO3
O
+
O
.
_ C6H5N
SO3
SO3H C6H5N
O
H
2. Реакция нитрования фурана
+ CH3COONO2
O
+
NO2
O
H
NO2
O
2-í è òðî ô óðàí
+ CH3COOH
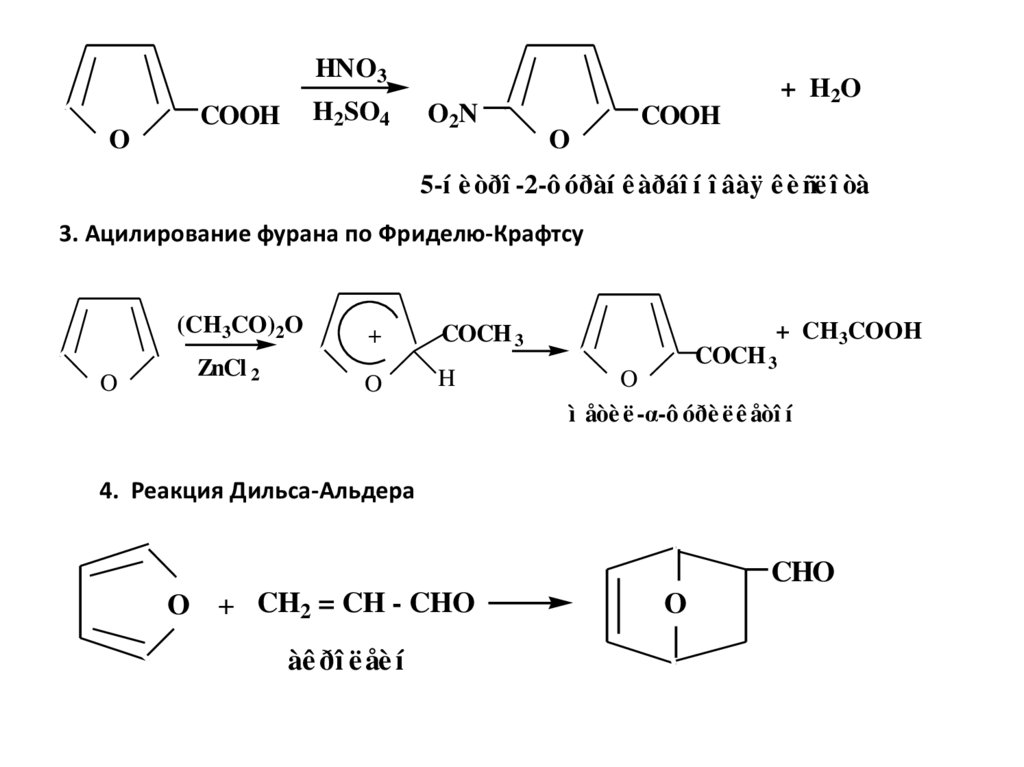
11.
HNO3O
H2SO4
COOH
O2N
O
+ H2O
COOH
5-í è òðî -2-ô óðàí ê àðáî í î âàÿ ê è ñë î òà
3. Ацилирование фурана по Фриделю-Крафтсу
(CH3CO)2O
O
ZnCl 2
+
COCH 3
O
H
+ CH3COOH
COCH 3
O
ì åòè ë -α-ô óðè ë ê åòî í
4. Реакция Дильса-Альдера
CHO
O + CH2 = CH - CHO
àê ðî ë åè í
O
12.
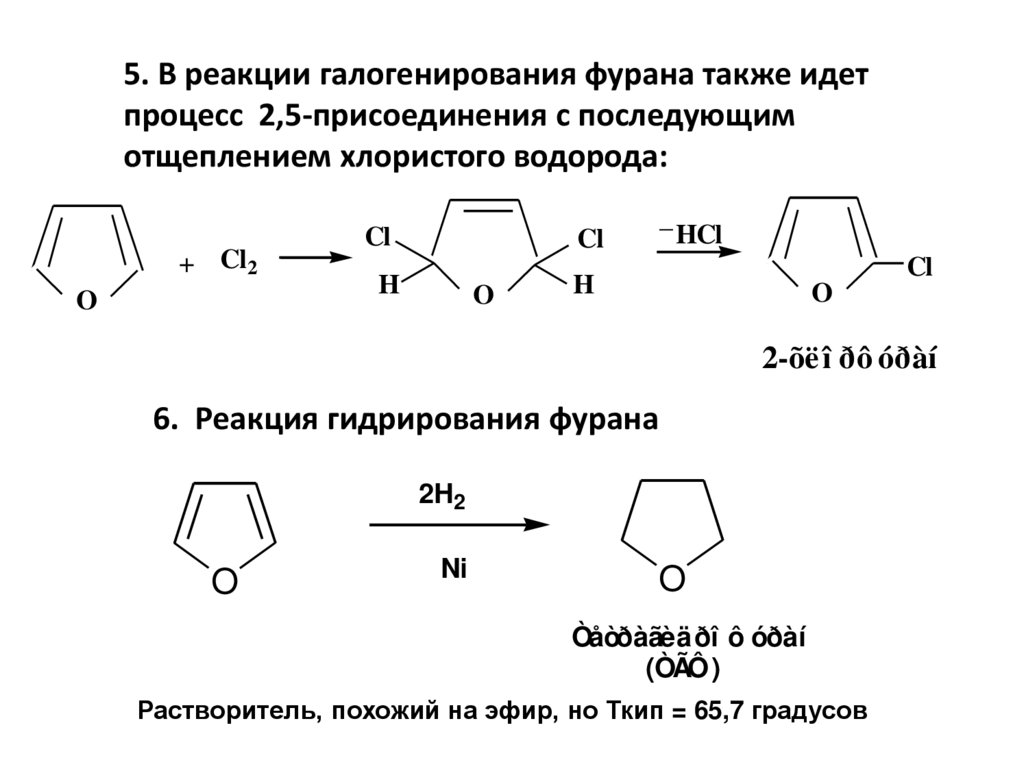
5. В реакции галогенирования фурана также идетпроцесс 2,5-присоединения с последующим
отщеплением хлористого водорода:
+ Cl 2
O
Cl
_
Cl
H
O
HCl
Cl
H
O
2-õë î ðô óðàí
6. Реакция гидрирования фурана
2H2
O
Ni
O
Òåòðàãèäðî ô óðàí
(ÒÃÔ)
Растворитель, похожий на эфир, но Ткип = 65,7 градусов
13.
7. Реакция ЮрьеваNH3
H2O
O
H2O
H2S
NH3
N
H
H2S
S
Между фураном, тиофеном и пирролом происходит взаимный переход
при 450 градусах над Al2O3
14.
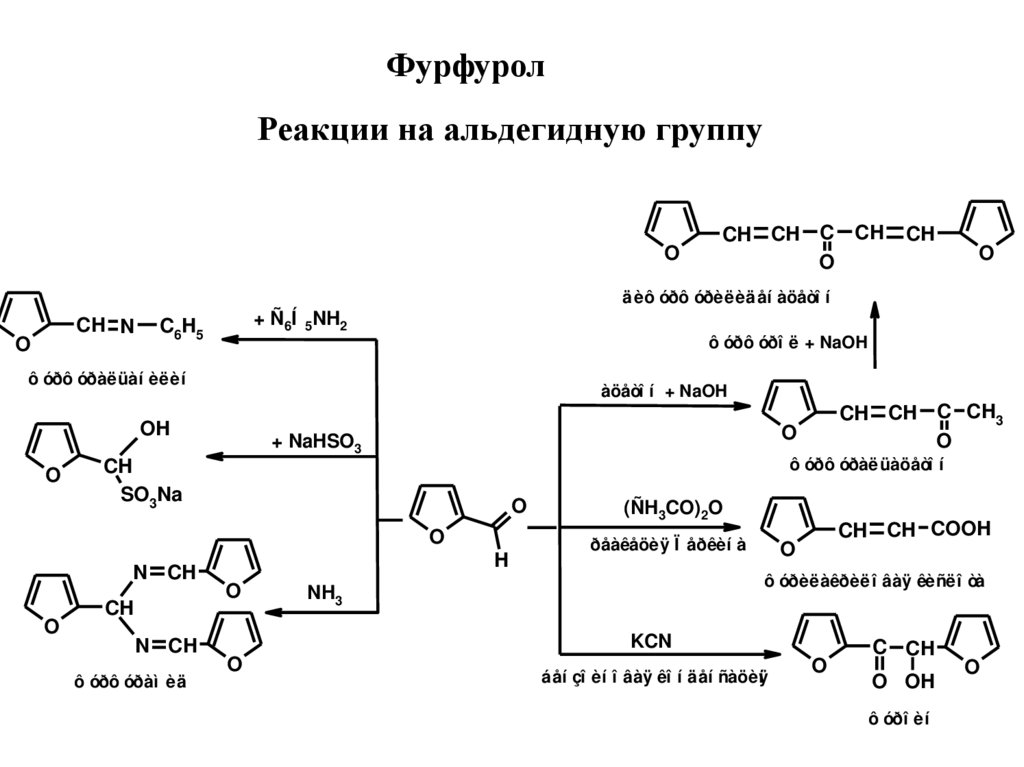
ФурфуролРеакции на альдегидную группу
O
CH CH C CH
O
CH
O
äèô óðô óðèëèäåí àöåòî í
CH N
O
+ Ñ6Í 5NH2
C6 H5
ô óðô óðî ë + NaOH
ô óðô óðàëüàí èëèí
àöåòî í + NaOH
OH
O
O
+ NaHSO3
ô óðô óðàëüàöåòî í
CH
SO3Na
O
O
H
N CH
O
CH
O
N CH
ô óðô óðàì èä
CH CH C CH3
O
(ÑH3CO)2O
CH CH COOH
ðåàêåöèÿ Ï åðêèí à
O
ô óðèëàêðèëî âàÿ êèñëî òà
NH3
KCN
O
áåí çî èí î âàÿ êî í äåí ñàöèÿ
í
O
C CH
O OH
ô óðî èí
O
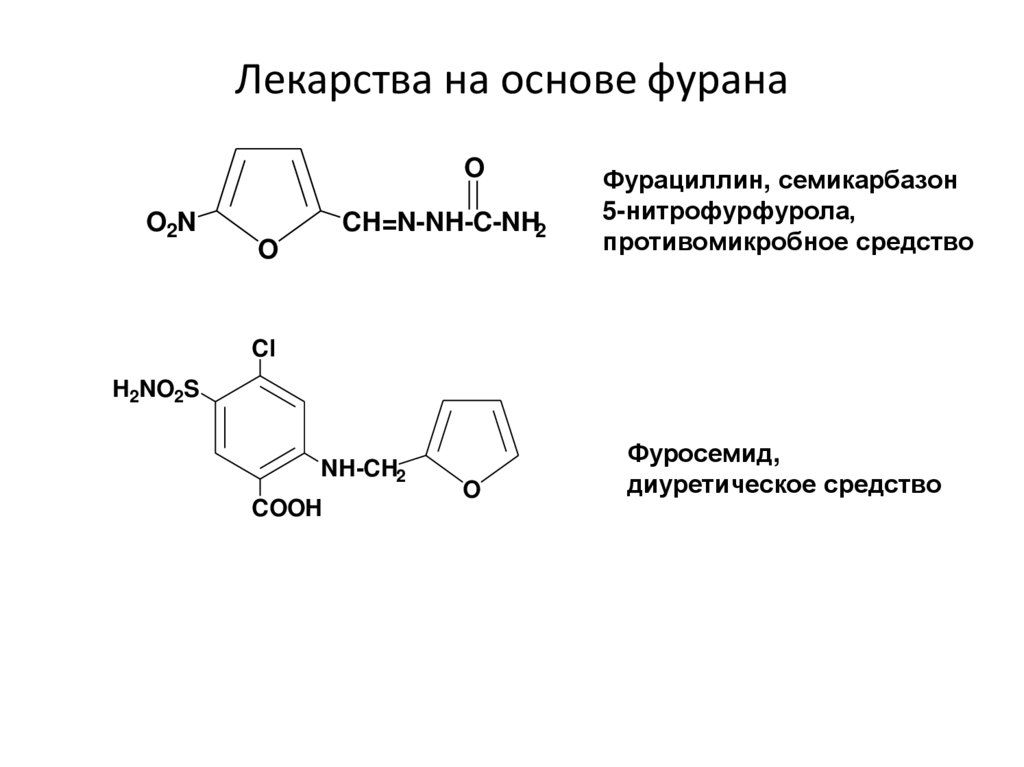
15. Лекарства на основе фурана
OO2N
CH=N-NH-C-NH2
O
Фурациллин, семикарбазон
5-нитрофурфурола,
противомикробное средство
Cl
H2NO2S
NH-CH2
COOH
O
Фуросемид,
диуретическое средство
16.
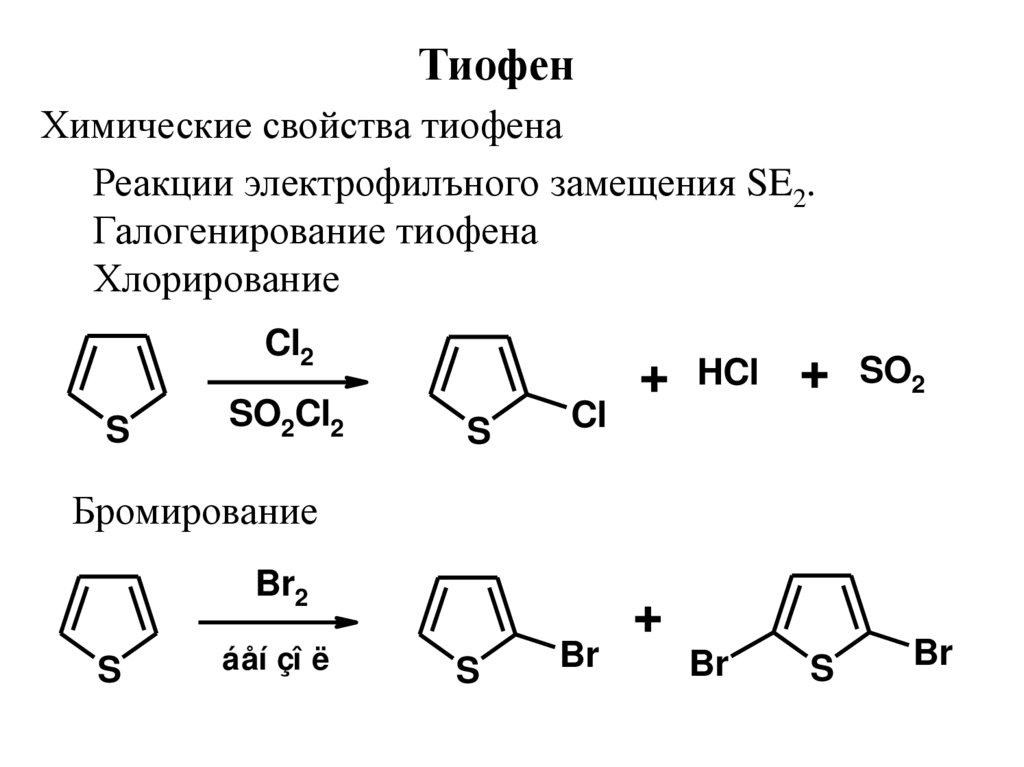
ТиофенХимические свойства тиофена
Реакции электрофилъного замещения SE2.
Галогенирование тиофена
Хлорирование
Cl2
S
SO2Cl2
S
Cl
+
HCl
+
Br
S
SO2
Бромирование
Br2
S
áåí çî ë
S
Br
+
Br
17.
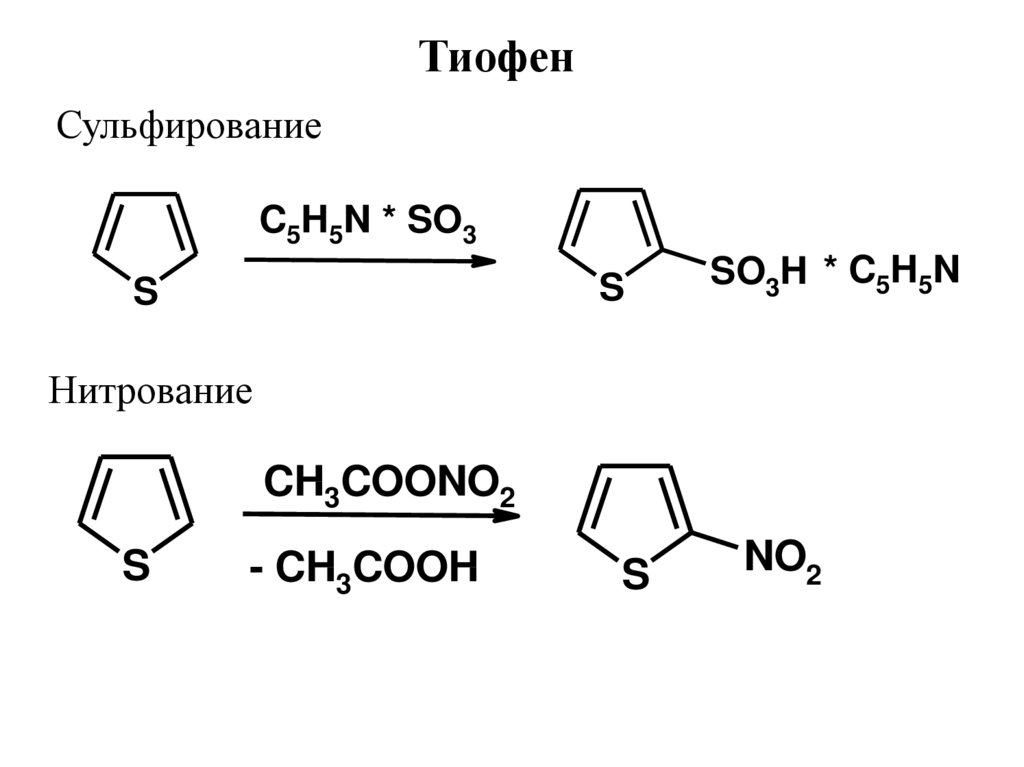
ТиофенСульфирование
C5H5N * SO3
S
S
SO3H * C5H5N
Нитрование
CH3COONO2
S
- CH3COOH
S
NO2
18.
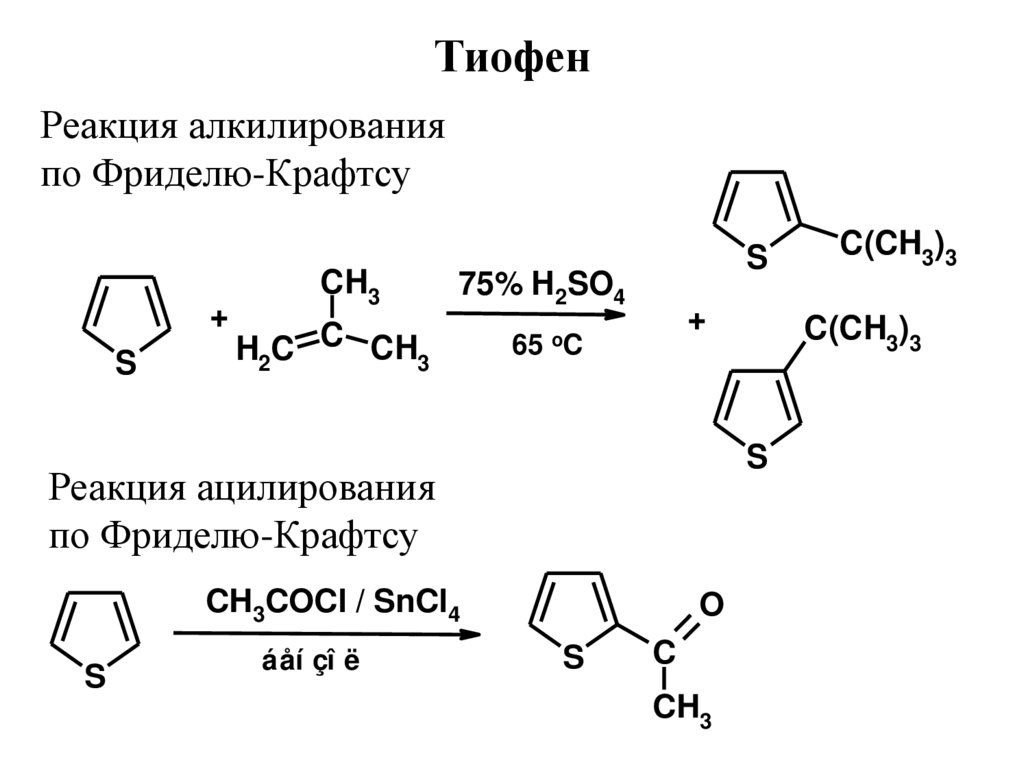
ТиофенРеакция алкилирования
по Фриделю-Крафтсу
+
S
CH3
S
75% H2SO4
H2C C CH3
65
+
oC
CH3COCl / SnCl4
S
áåí çî ë
C(CH3)3
S
Реакция ацилирования
по Фриделю-Крафтсу
O
S
C
CH3
C(CH3)3
19.
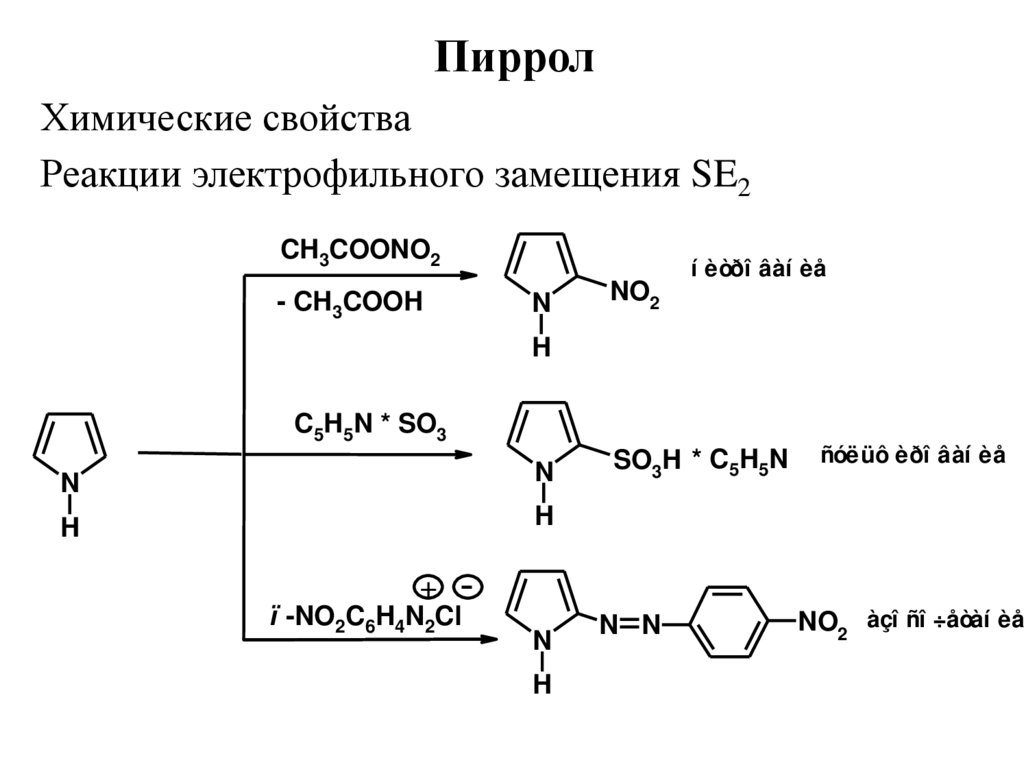
ПирролХимические свойства
Реакции электрофильного замещения SE2
CH3COONO2
- CH3COOH
N
NO2
í èòðî âàí èå
H
C5H5N * SO3
N
N
H
H
SO3H * C5H5N
ñóëüô èðî âàí èå
+
ï -NO2C6H4N2Cl
N
H
N N
NO2 àçî ñî ÷åòàí èå
20.
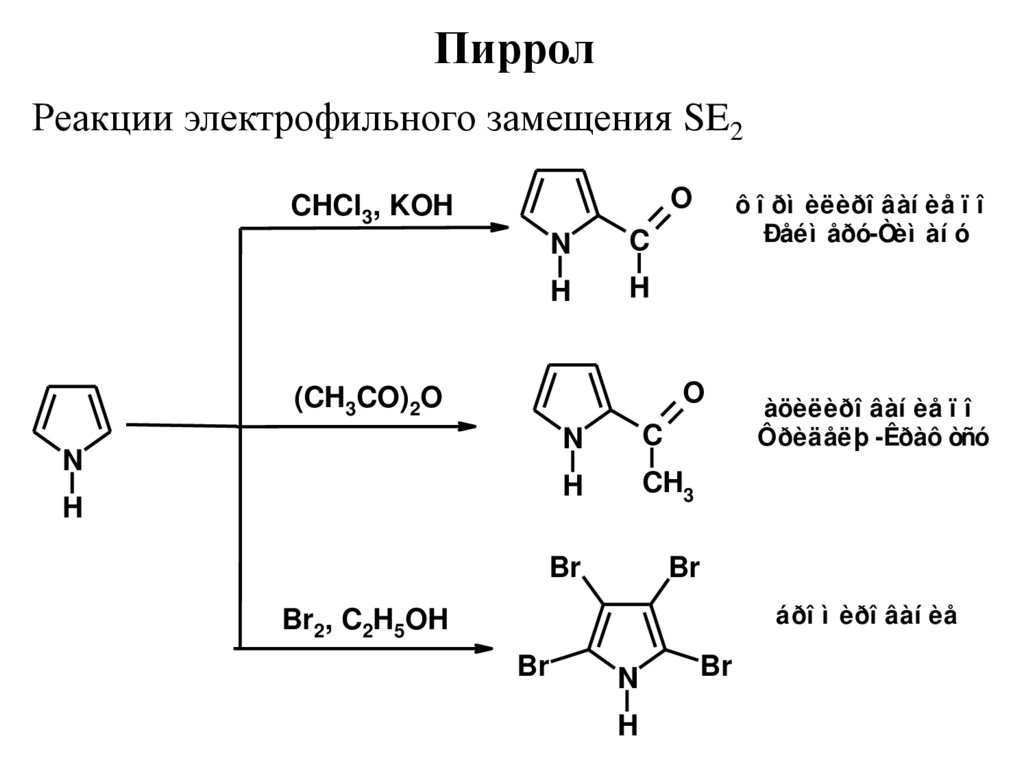
ПирролРеакции электрофильного замещения SE2
O
CHCl3, KOH
N
C
H
H
ô î ðì èëèðî âàí èå ï î
Ðåéì åðó-Òèì àí ó
O
(CH3CO)2O
N
C
H
CH3
Br
Br
N
H
àöèëèðî âàí èå ï î
Ôðèäåëþ -Êðàô òñó
áðî ì èðî âàí èå
Br2, C2H5OH
Br
N
H
Br
21.
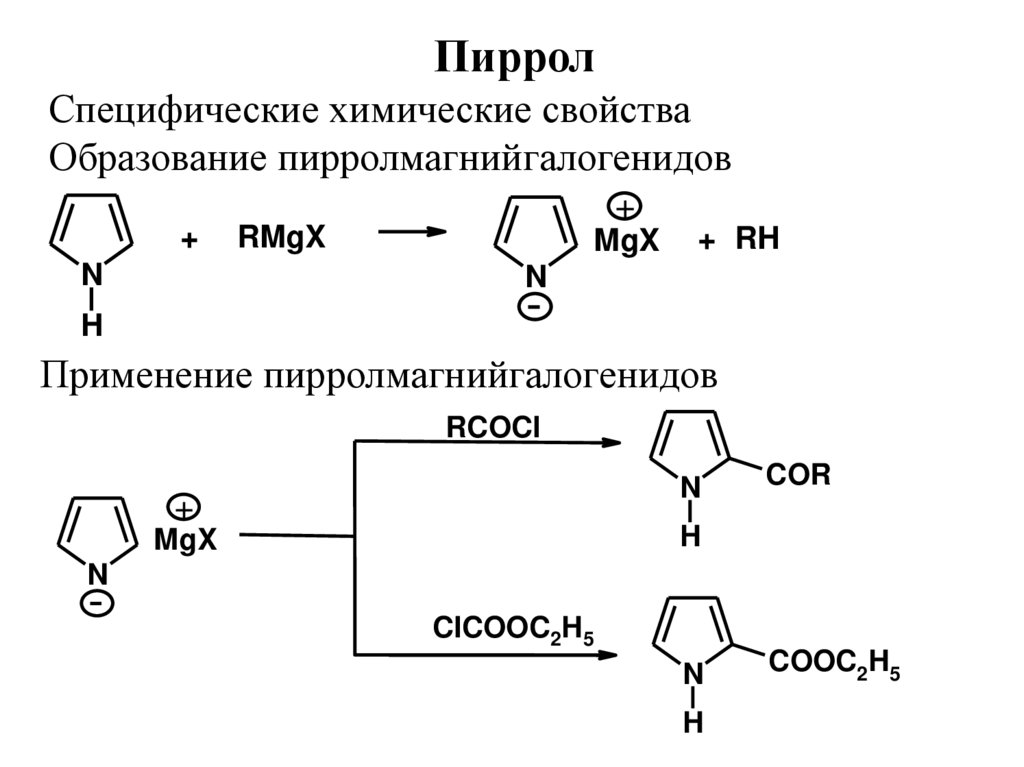
ПирролСпецифические химические свойства
Образование пирролмагнийгалогенидов
+
N
+
RMgX
MgX
+ RH
N
H
Применение пирролмагнийгалогенидов
RCOCl
N
+
COR
H
MgX
N
ClCOOC2H5
N
H
COOC2H5
22.
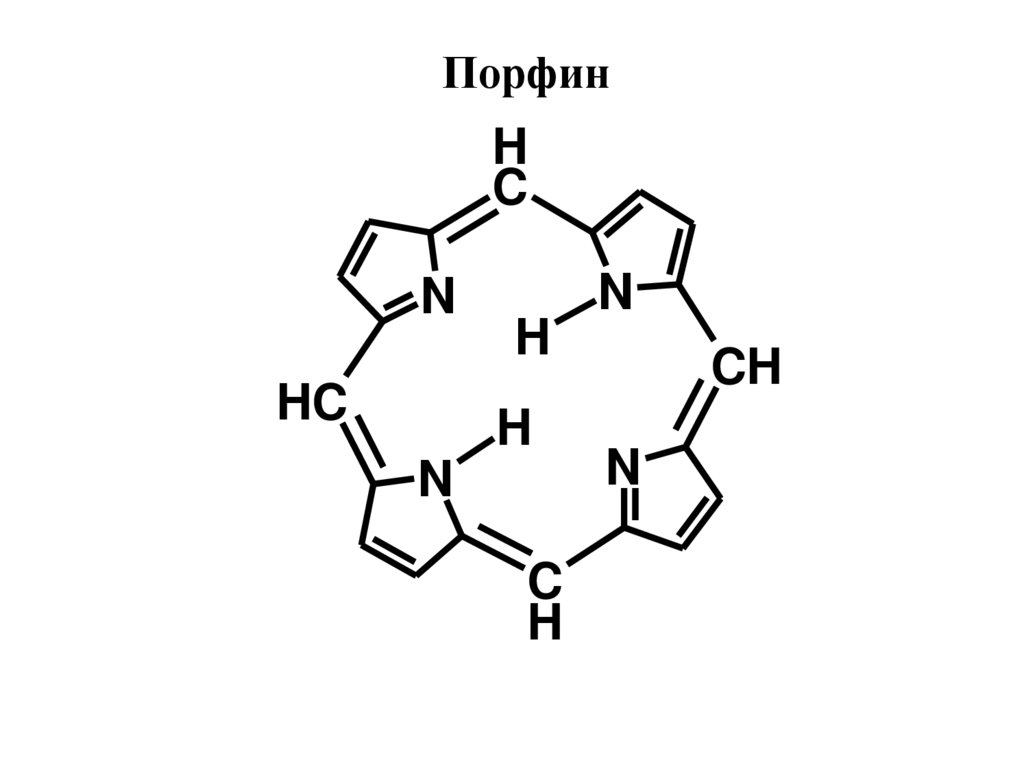
ПорфинH
C
N
HC
H
H
N
C
H
N
CH
N
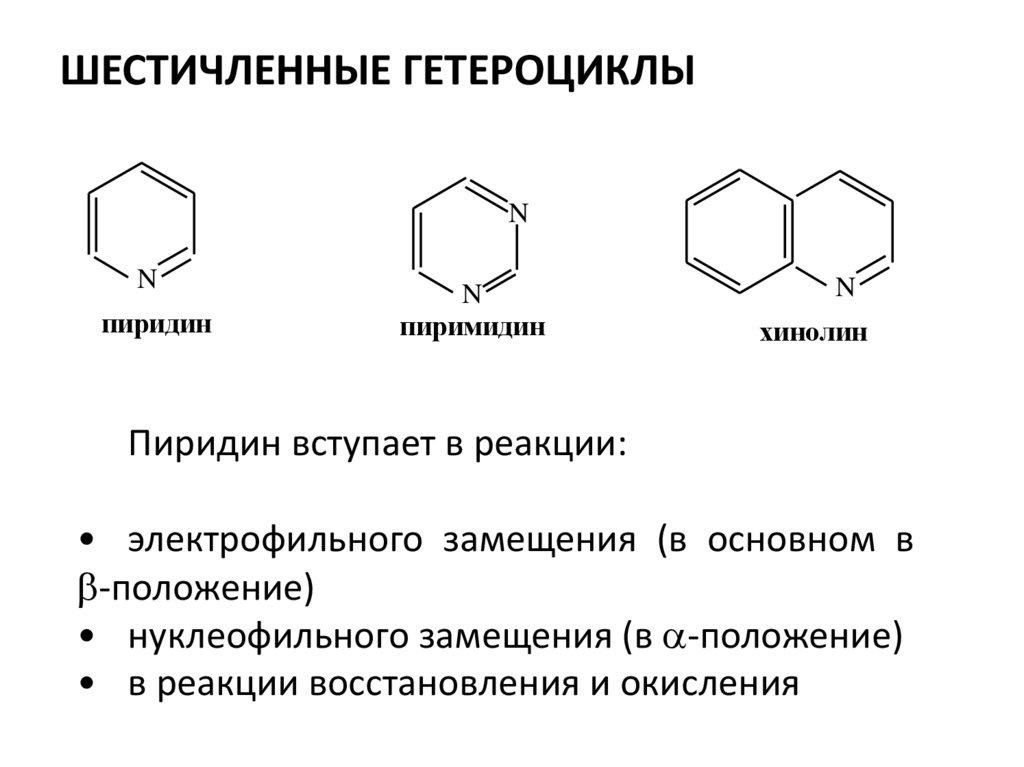
23. ШЕСТИЧЛЕННЫЕ ГЕТЕРОЦИКЛЫ
NN
пиридин
N
пиримидин
N
хинолин
Пиридин вступает в реакции:
• электрофильного замещения (в основном в
-положение)
• нуклеофильного замещения (в -положение)
• в реакции восстановления и окисления
24.
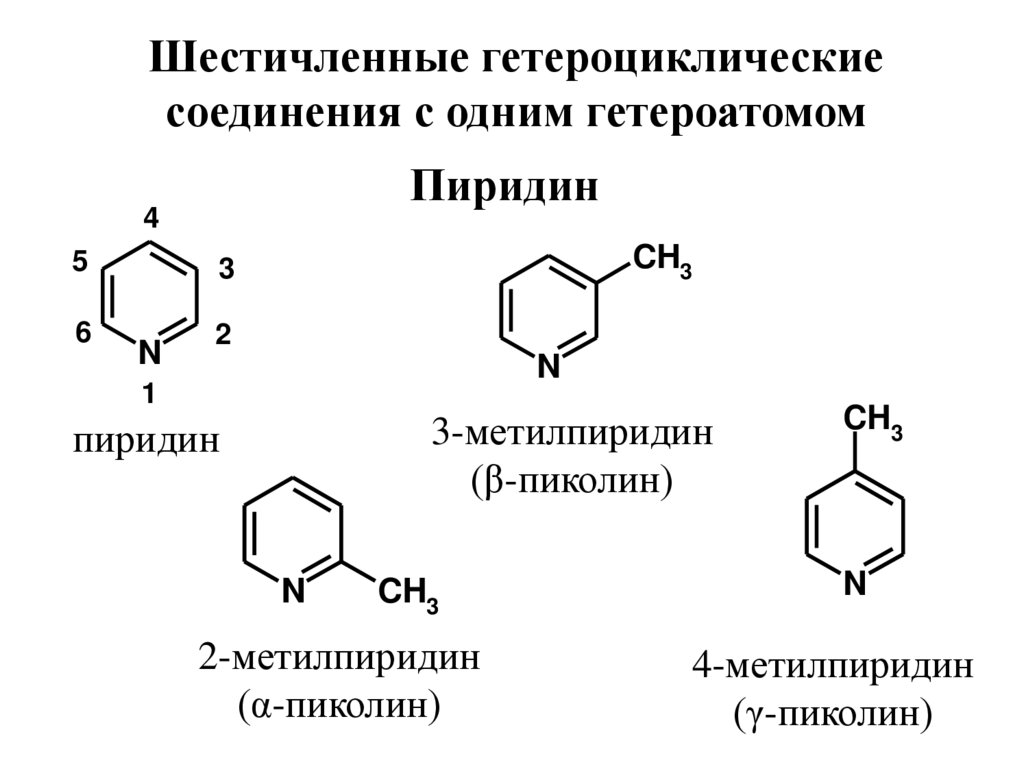
Шестичленные гетероциклическиесоединения с одним гетероатомом
Пиридин
4
5
3
6
2
N
CH3
N
1
пиридин
3-метилпиридин
(β-пиколин)
N
CH3
2-метилпиридин
(α-пиколин)
CH3
N
4-метилпиридин
(γ-пиколин)
25.
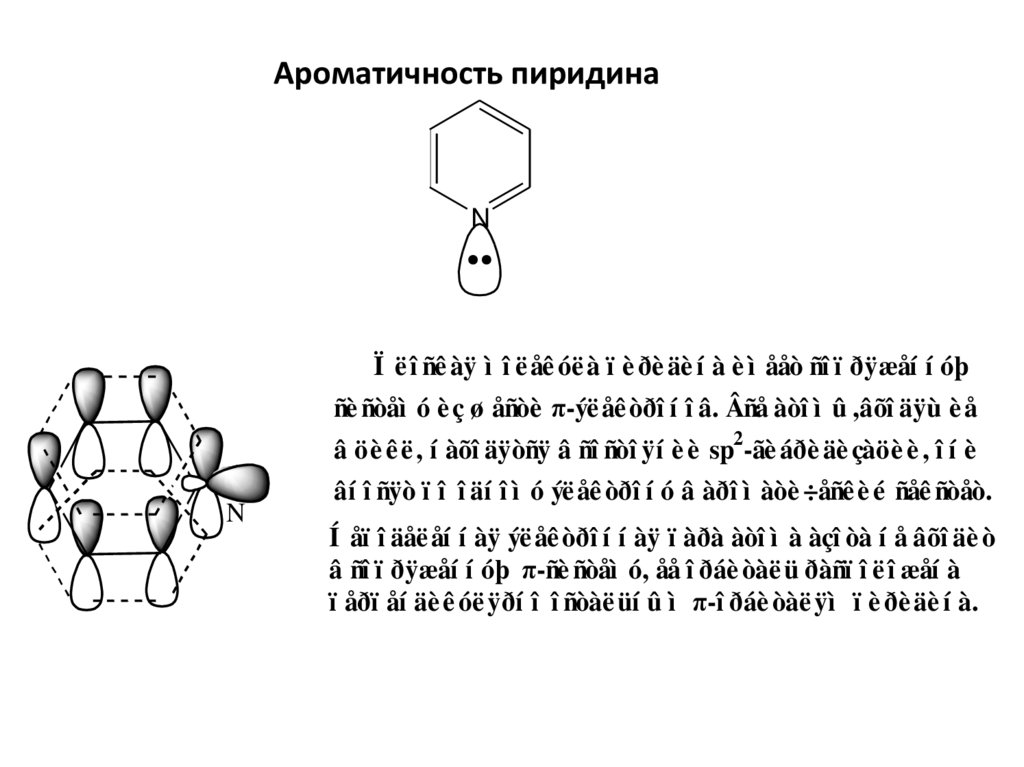
Ароматичность пиридинаN
Ï ë î ñê àÿ ì î ë åê óë à ï è ðè äè í à è ì ååò ñî ï ðÿæåí í óþ
ñè ñòåì ó è ç ø åñòè π-ýë åê òðî í î â. Âñå àòî ì û ,âõî äÿù è å
â öè ê ë , í àõî äÿòñÿ â ñî ñòî ÿí è è sp2-ãè áðè äè çàöè è , î í è
N
âí î ñÿò ï î î äí î ì ó ýë åê òðî í ó â àðî ì àòè ÷åñê è é ñåê ñòåò.
Í åï î äåë åí í àÿ ýë åê òðî í í àÿ ï àðà àòî ì à àçî òà í å âõî äè ò
â ñî ï ðÿæåí í óþ π-ñè ñòåì ó, åå î ðáè òàë ü ðàñï î ë î æåí à
ï åðï åí äè ê óë ÿðí î î ñòàë üí û ì π-î ðáè òàë ÿì ï è ðè äè í à.
26.
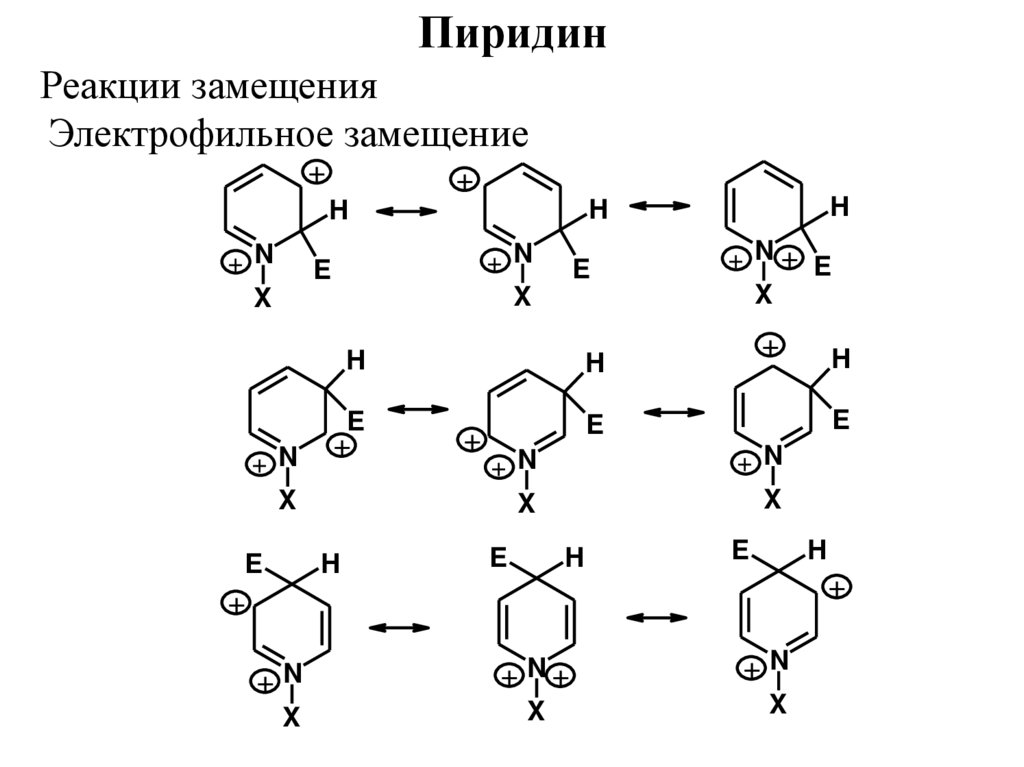
ПиридинРеакции замещения
Электрофильное замещение
+
+
+ N
X
+ N
X
E
+ N
X
E
H
E
H
H
E
E
+
H
H
H
+
+
E
H
E
H
+
+
+N
X
H
+ N
X
+ N
X
E
+ N+ E
X
+ N+
X
+N
X
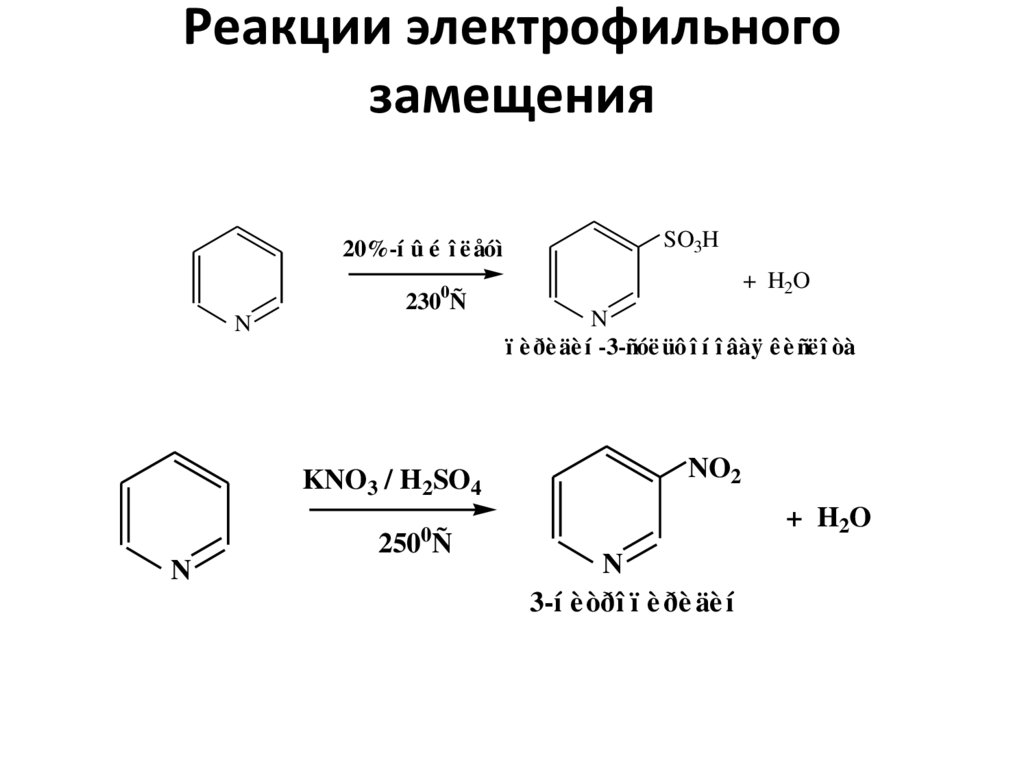
27. Реакции электрофильного замещения
20%-í û é î ë åóìSO3H
+ H2O
0
230 Ñ
N
KNO3 / H2SO4
N
ï è ðè äè í -3-ñóë üô î í î âàÿ ê è ñë î òà
NO2
+ H2O
0
250 Ñ
N
N
3-í è òðî ï è ðè äè í
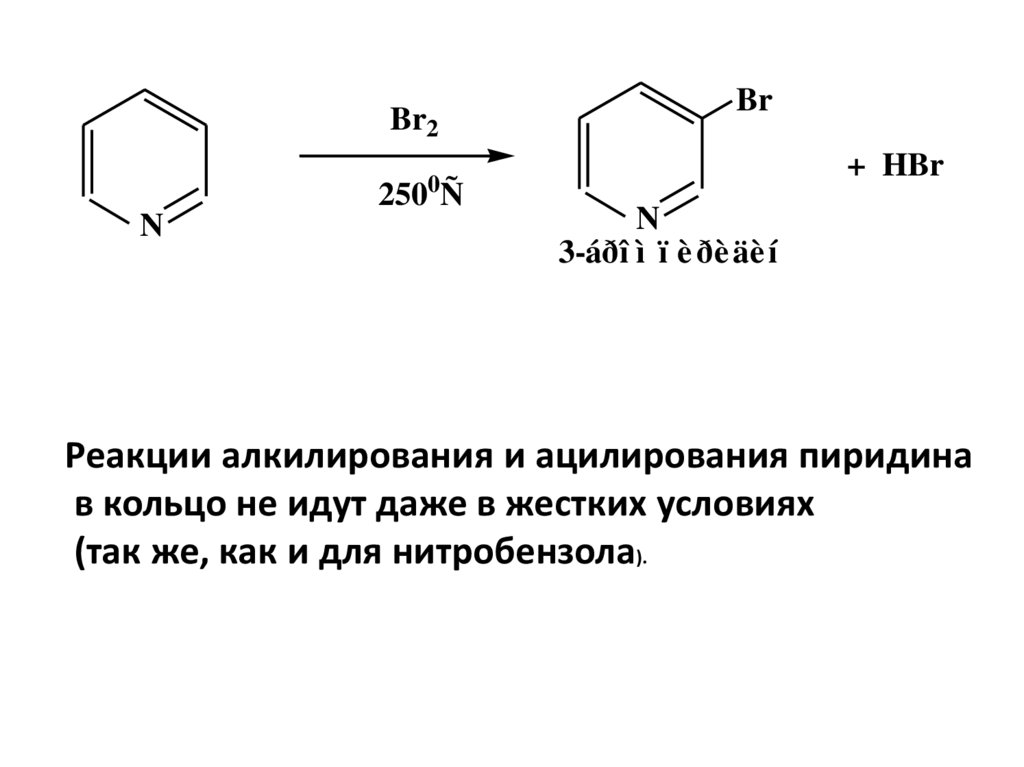
28.
Br2Br
+ HBr
0
250 Ñ
N
N
3-áðî ì ï è ðè äè í
Реакции алкилирования и ацилирования пиридина
в кольцо не идут даже в жестких условиях
(так же, как и для нитробензола).
29. Реакции нуклеофильного замещения
NaNH21100Ñ
N
NH2
N
2-àì è í î ï è ðè äè í
(реакция Чичибабина)
C6H5Li
1100Ñ
N
C6 H 5
N
2-ô åí è ë ï è ðè äè í
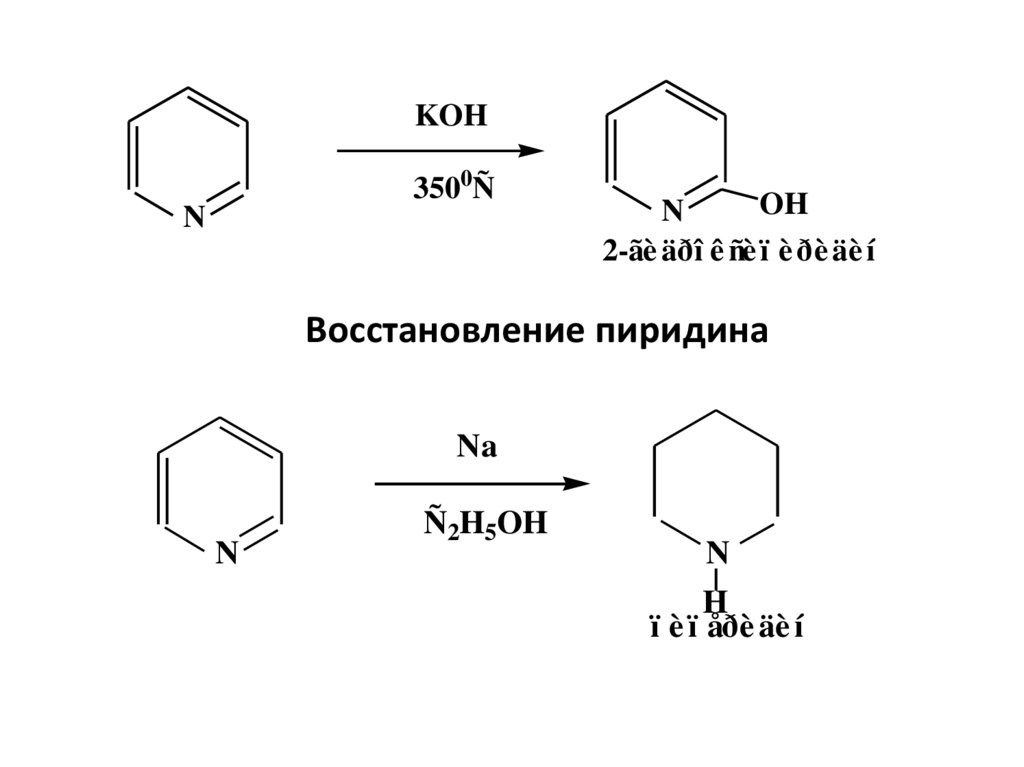
30.
KOH3500Ñ
N
OH
N
2-ãè äðî ê ñè ï è ðè äè í
Восстановление пиридина
Na
N
Ñ2H5OH
N
H
ï è ï åðè äè í
31. Окисление пиридина
H2O2N
N
O
N-î ê ñè ä ï è ðè äè í à
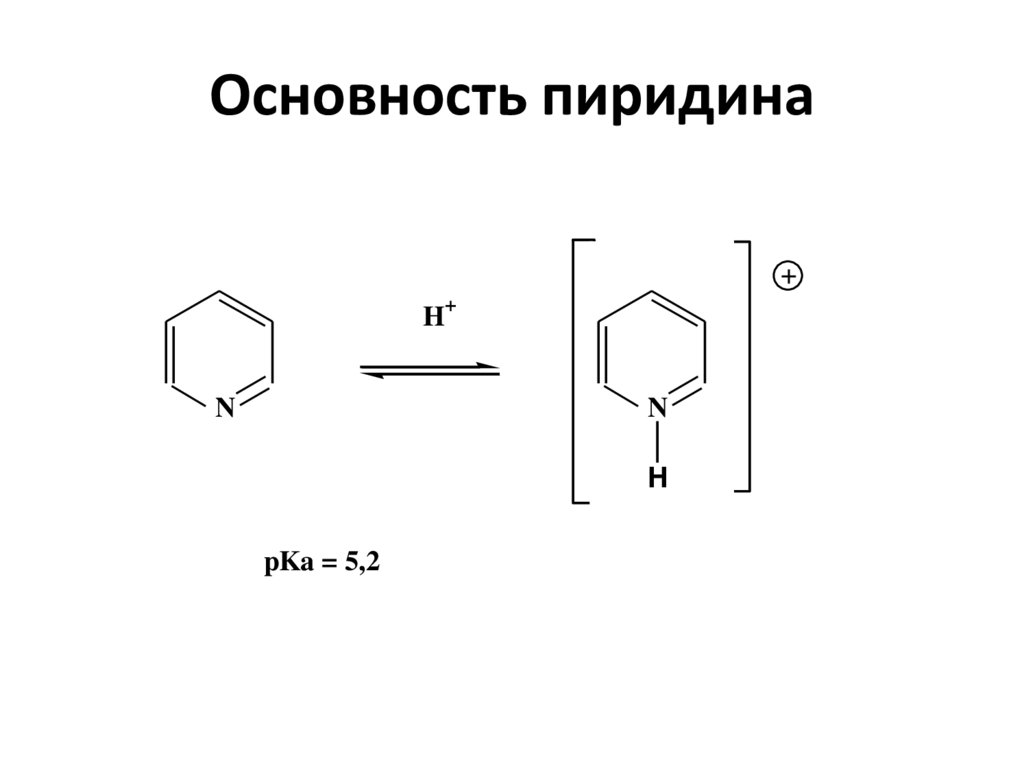
32. Основность пиридина
HN
+
N
H
pKa = 5,2
33.
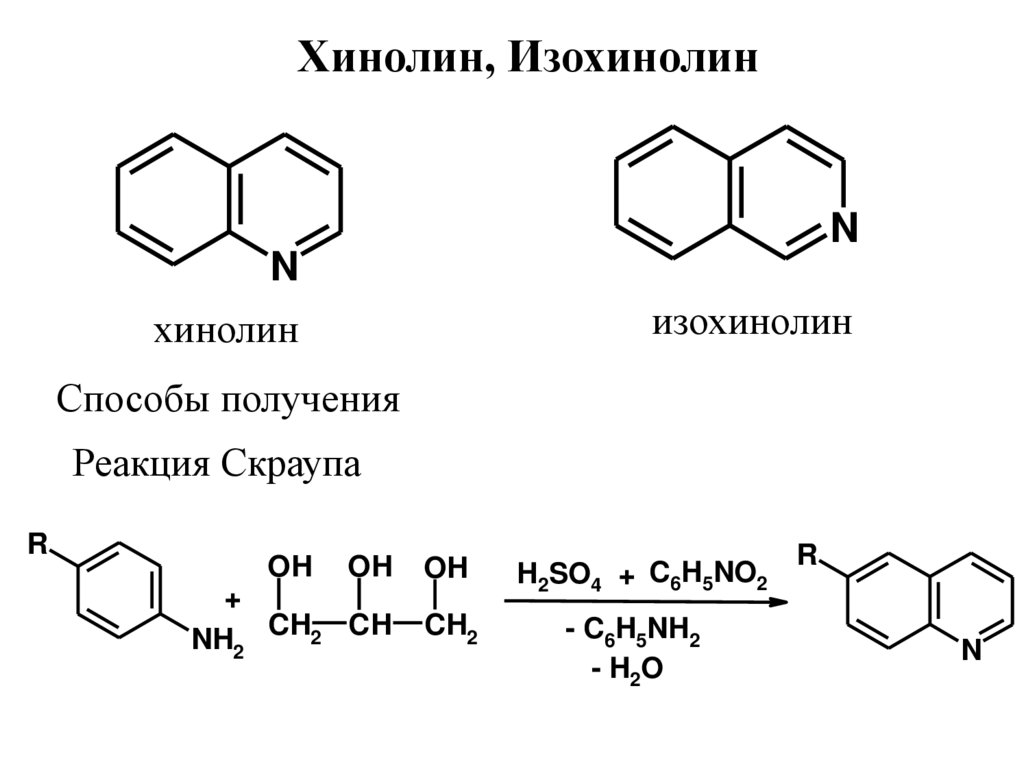
Хинолин, ИзохинолинN
N
изохинолин
хинолин
Способы получения
Реакция Скраупа
R
OH
OH
+
CH2 CH
NH2
OH
CH2
H2SO4 + C6H5NO2
- C6H5NH2
- H2O
R
N
34.
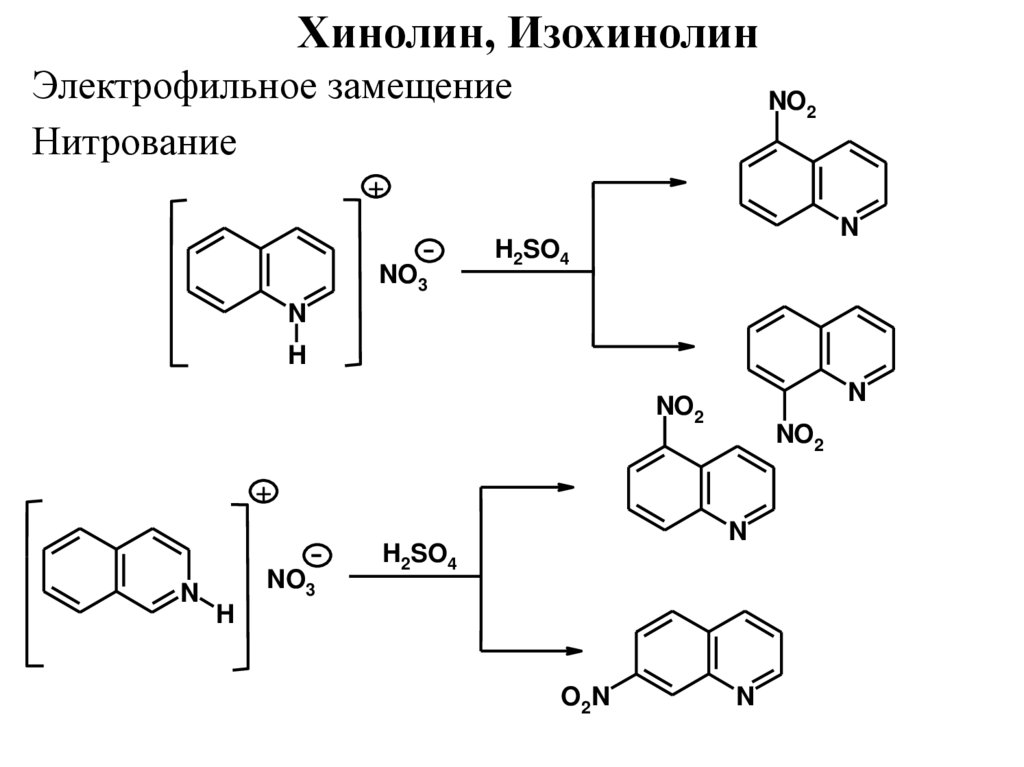
Хинолин, ИзохинолинЭлектрофильное замещение
Нитрование
NO2
+
NO3
N
H2SO4
N
H
N
NO2
NO2
+
N
NO3
N
H2SO4
H
O2 N
N
35.
Хинолин, ИзохинолинОкисление
[O]
HOOC
HOOC
N
N
COOH
COOH
[O]
N
HOOC
HOOC
N
36.
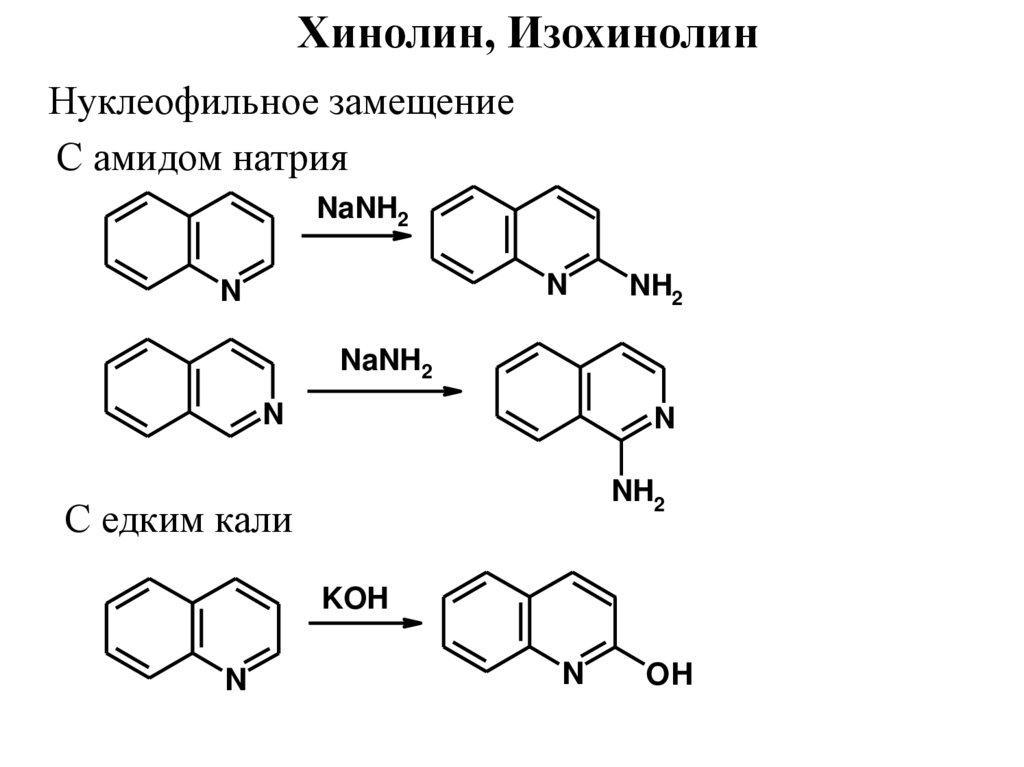
Хинолин, ИзохинолинНуклеофильное замещение
С амидом натрия
NaNH2
N
N
NH2
NaNH2
N
N
NH2
С едким кали
KOH
N
N
OH






 chemistry
chemistry