Similar presentations:
Биологически активные гетероциклические соединения. Нуклеотиды. Нуклеиновые кислоты. (Лекция 4)
1. Биологически активные гетероциклические соединения.
Нуклеотиды.Нуклеиновые кислоты.
2.
• Гетероциклическими называютсоединения, молекулы которых содержат
циклы, включающие наряду с атомами
углерода один или несколько гетероатомов.
• Классификация
• Номенклатура
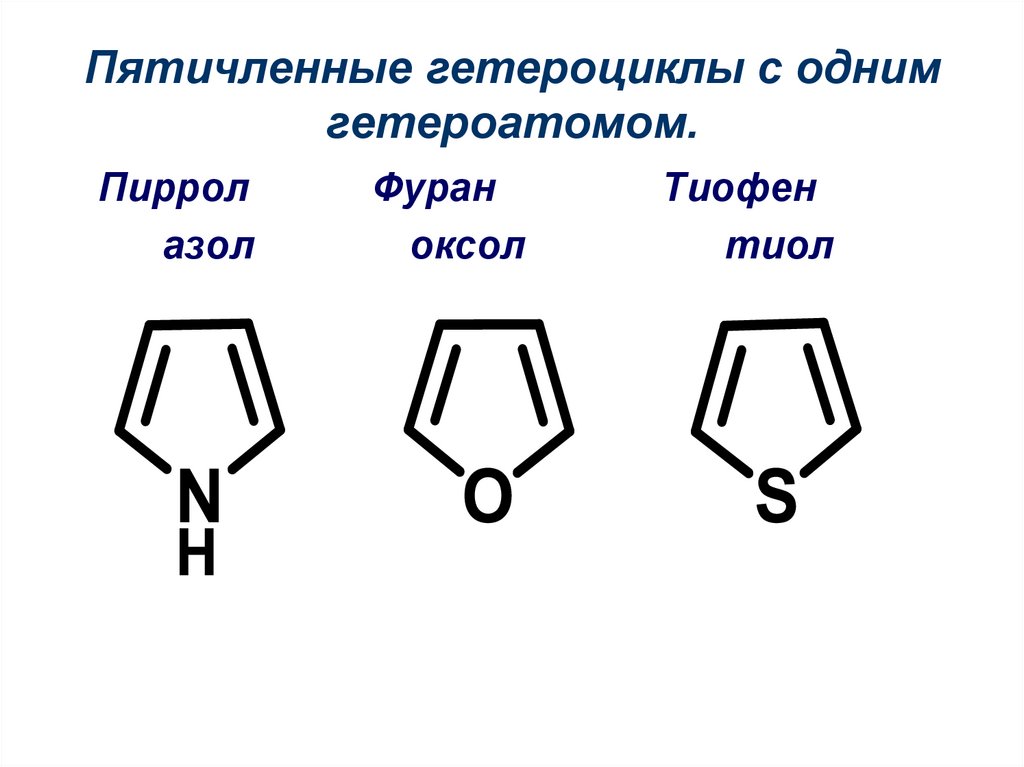
3. Пятичленные гетероциклы с одним гетероатомом.
Пирролазол
Фуран
оксол
Тиофен
тиол
4.
ГЕНЕТИЧЕСКАЯ СВЯЗЬH2O, Al2O3, to
N
O
NH3
H
NH3
H2 O
H2 S
H2S
S
4
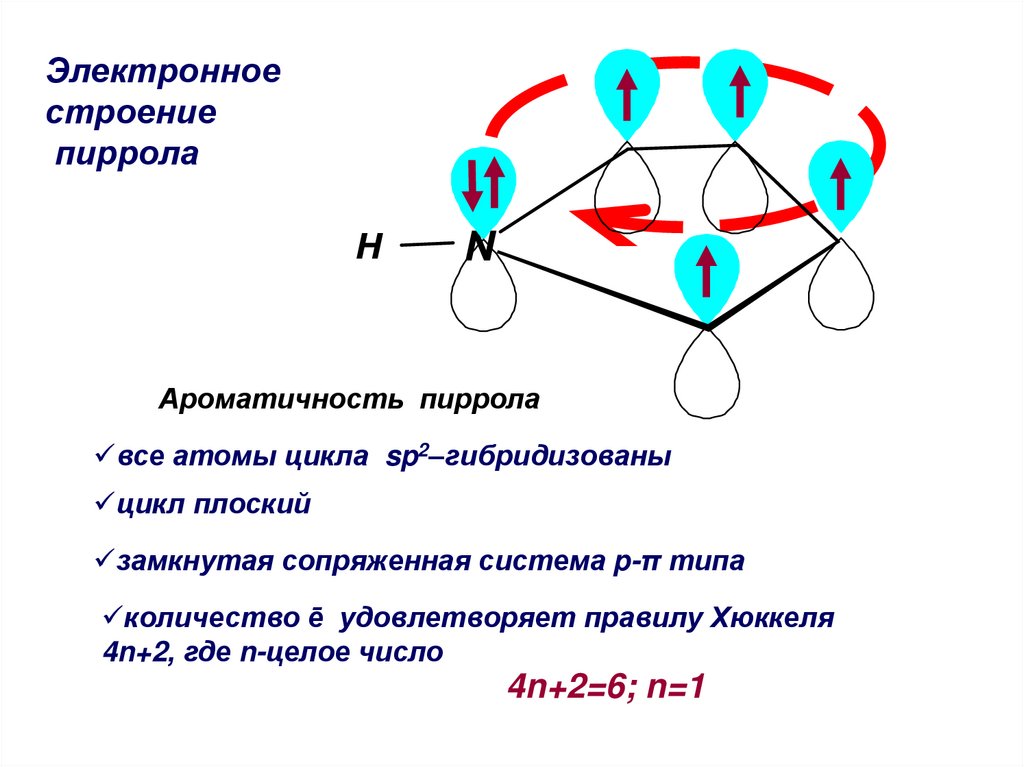
5.
Электронноестроение
пиррола
Ароматичность пиррола
все атомы цикла sp2–гибридизованы
цикл плоский
замкнутая сопряженная система p-π типа
количество ē удовлетворяет правилу Хюккеля
4n+2, где n-целое число
4n+2=6; n=1
6.
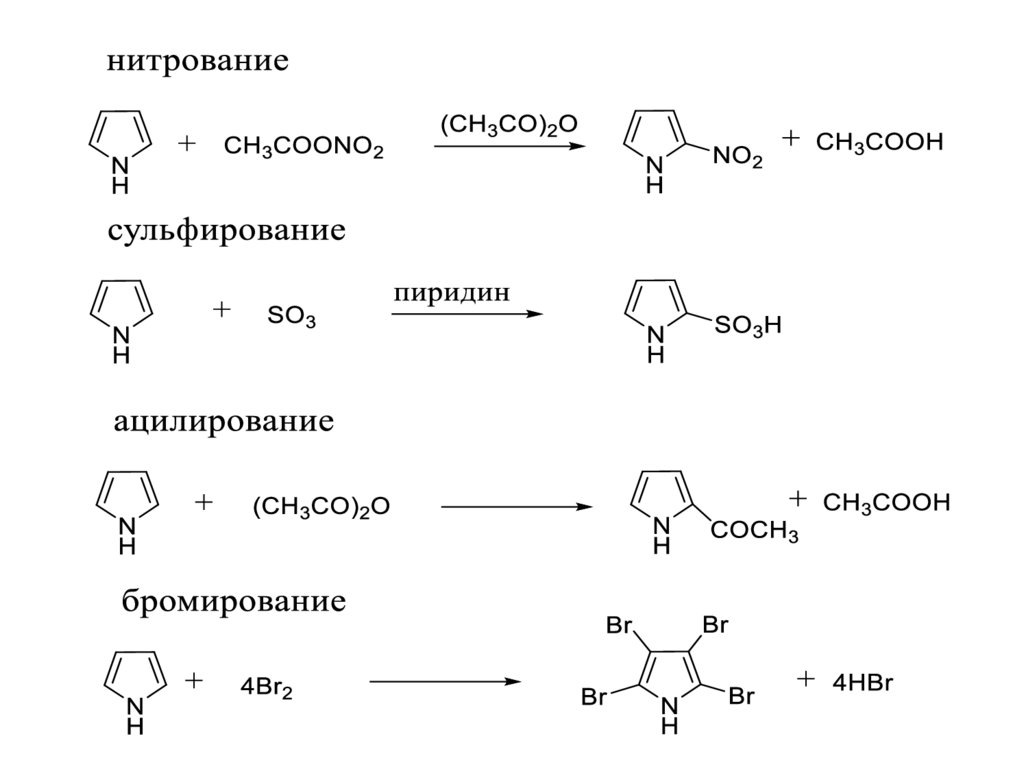
Химические свойстваРеакции,
протекающие
с участием
гетероатомов
Реакции,
протекающие
с участием
углерода цикла
SE
ацилирование
галогенирование
нитрование
сульфирование
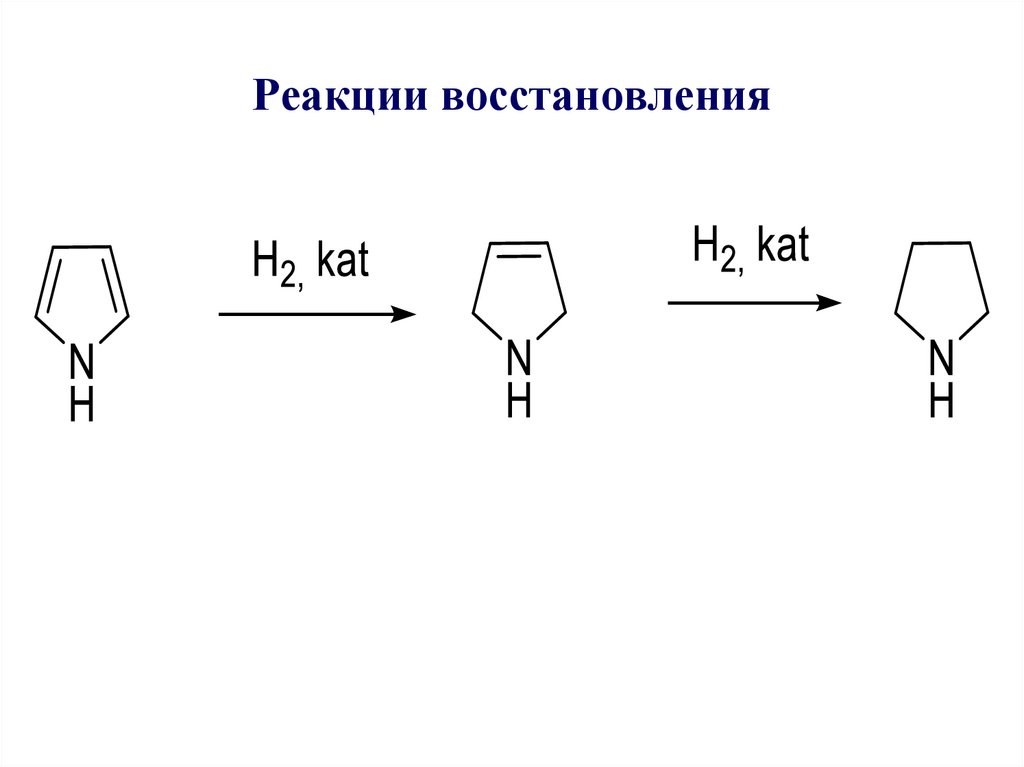
Реакции
восстановления
7.
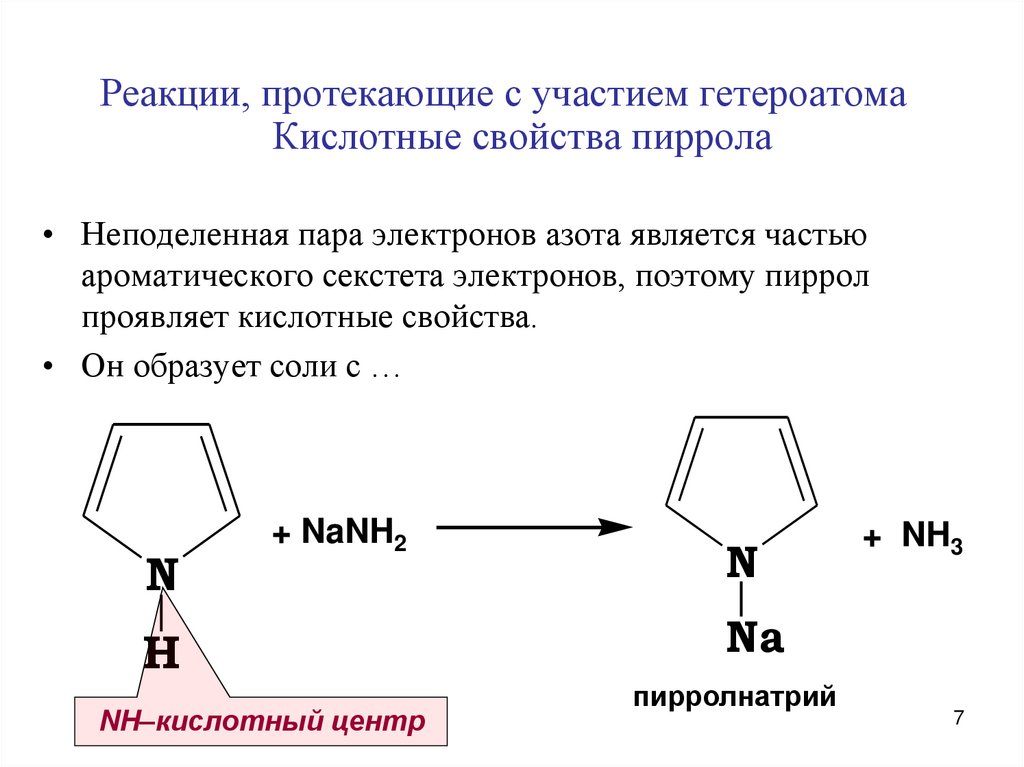
Реакции, протекающие с участием гетероатомаКислотные свойства пиррола
• Неподеленная пара электронов азота является частью
ароматического секстета электронов, поэтому пиррол
проявляет кислотные свойства.
• Он образует соли с …
N
+ NaNH2
H
NH–кислотный центр
N
+ NH3
Na
пирролнатрий
7
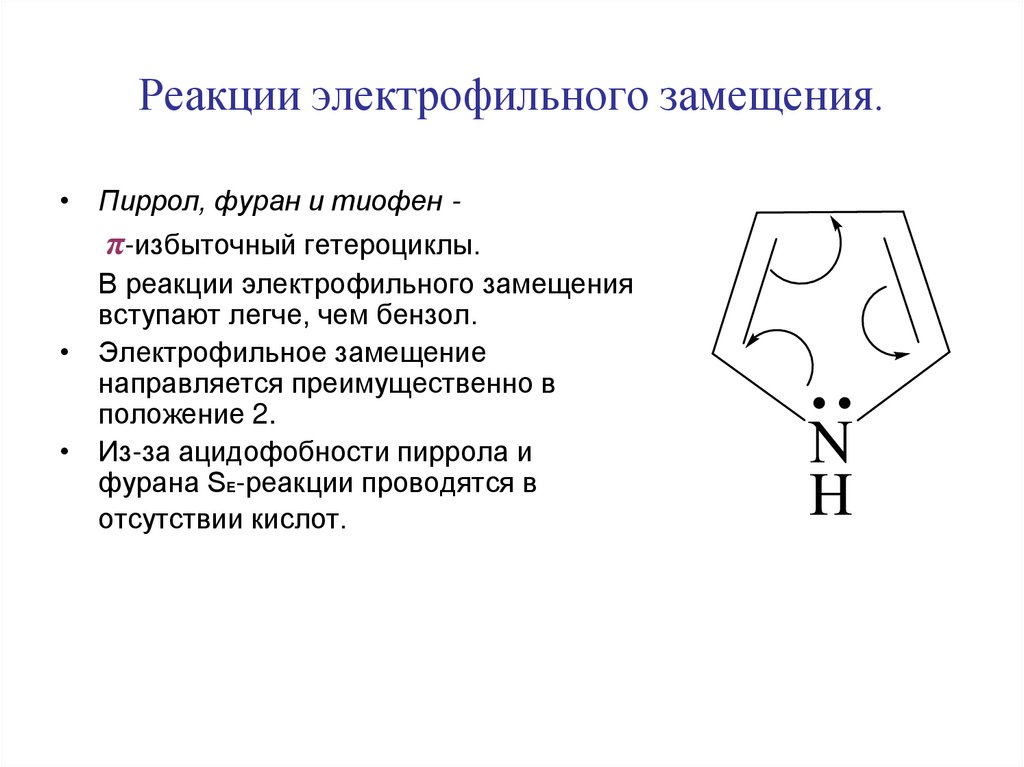
8. Реакции электрофильного замещения.
• Пиррол, фуран и тиофен -π-избыточный гетероциклы.
В реакции электрофильного замещения
вступают легче, чем бензол.
• Электрофильное замещение
направляется преимущественно в
положение 2.
• Из-за ацидофобности пиррола и
фурана SE-реакции проводятся в
отсутствии кислот.
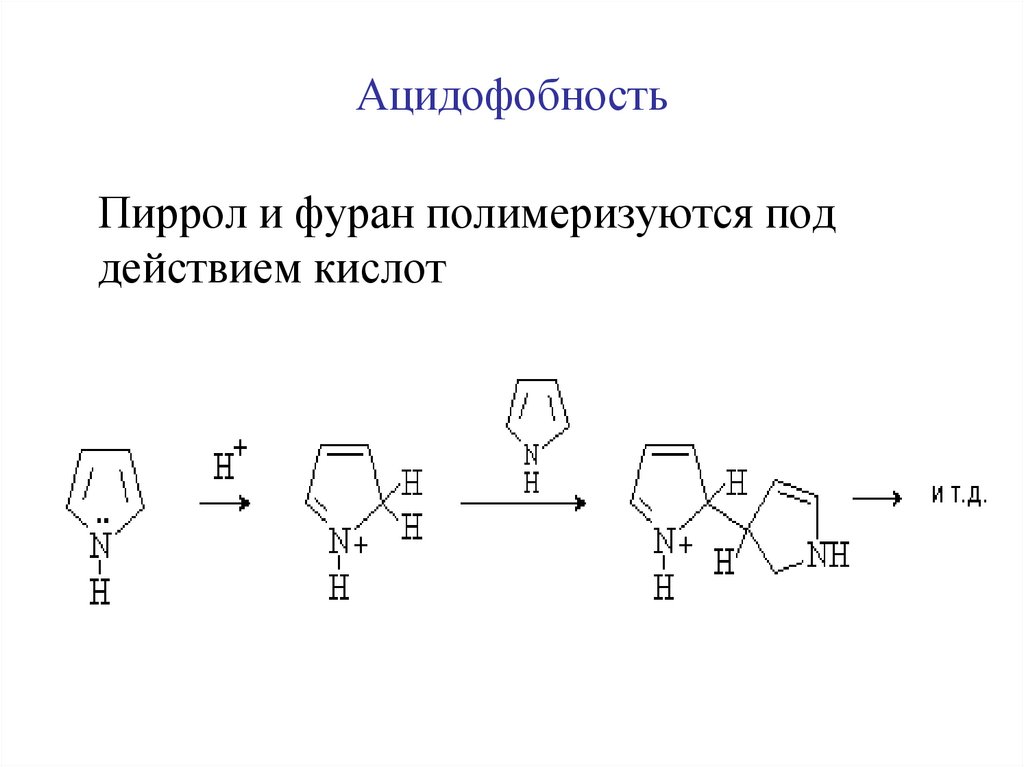
9. Ацидофобность
Пиррол и фуран полимеризуются поддействием кислот
10.
11. Реакции восстановления
12.
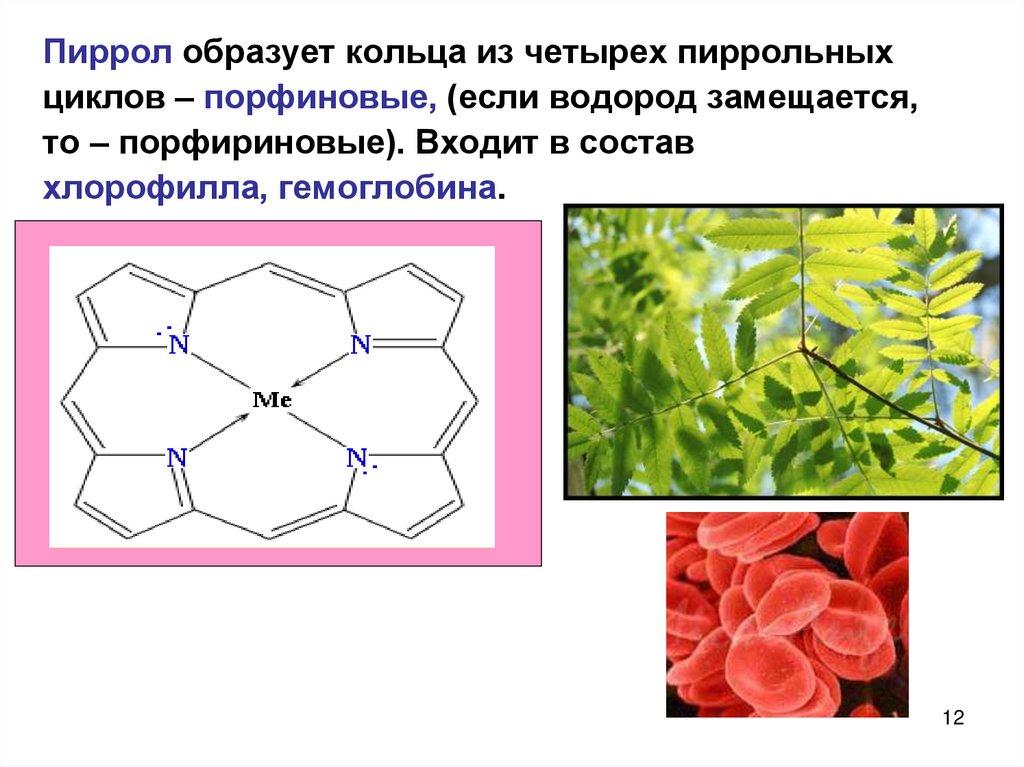
Пиррол образует кольца из четырех пиррольныхциклов – порфиновые, (если водород замещается,
то – порфириновые). Входит в состав
хлорофилла, гемоглобина.
12
13.
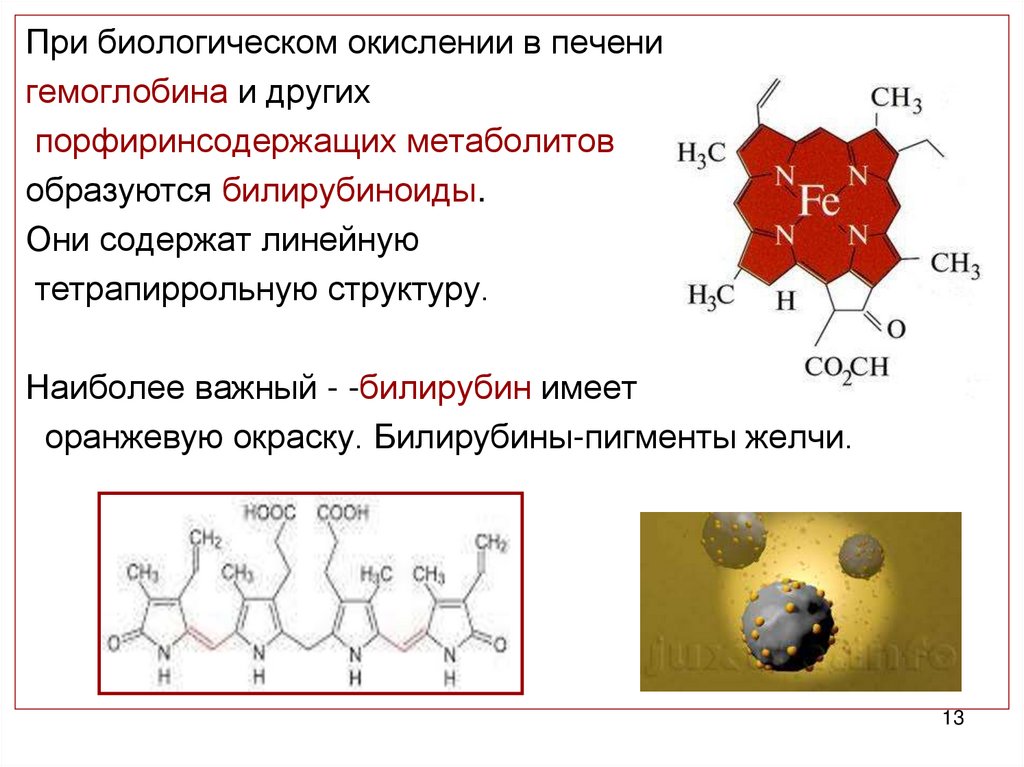
При биологическом окислении в печенигемоглобина и других
порфиринсодержащих метаболитов
образуются билирубиноиды.
Они содержат линейную
тетрапиррольную структуру.
Наиболее важный - -билирубин имеет
оранжевую окраску. Билирубины-пигменты желчи.
13
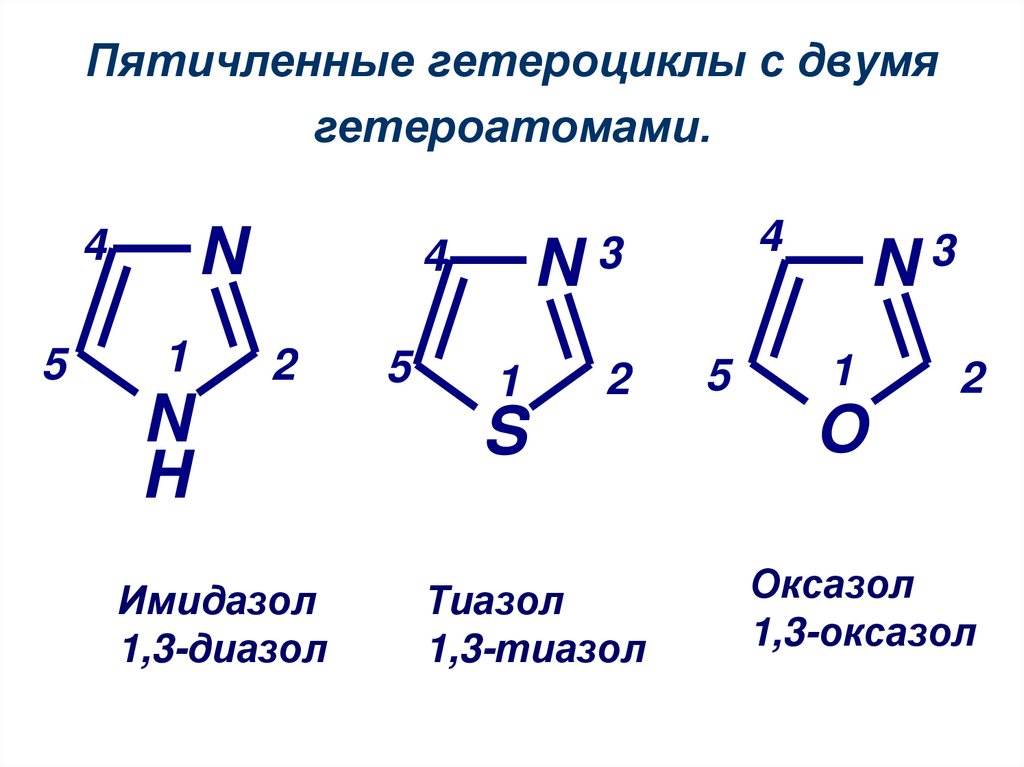
14. Пятичленные гетероциклы с двумя гетероатомами.
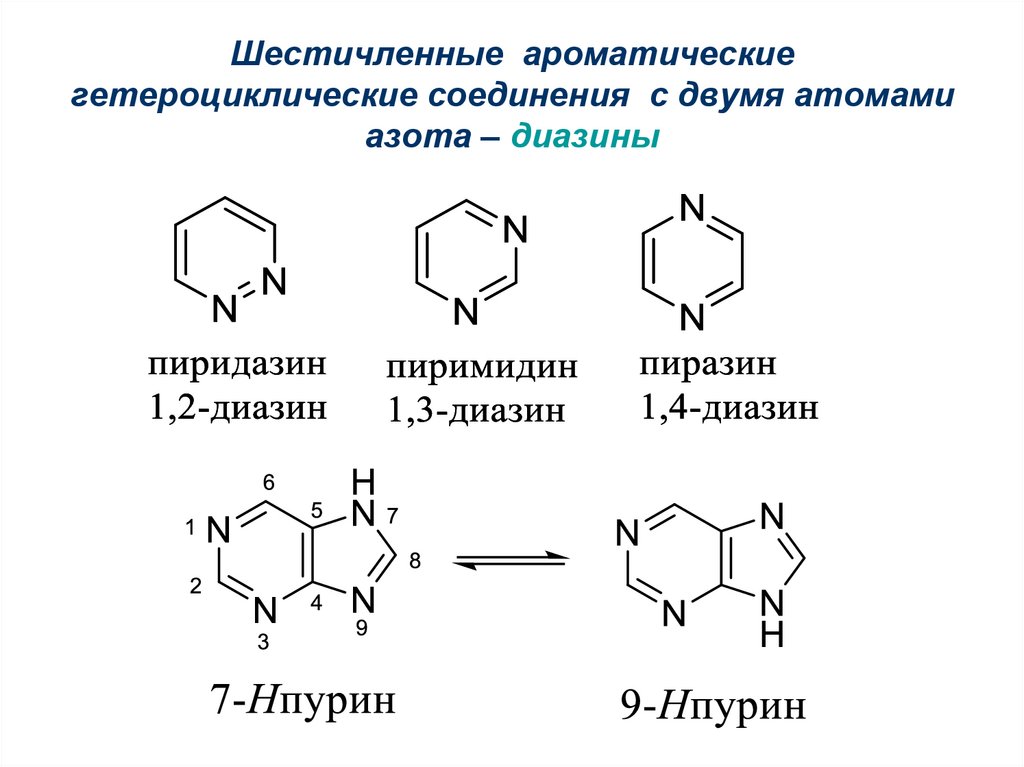
N4
5
1
N
4
2
N
H
Имидазол
1,3-диазол
5
1
4
3
2
S
Тиазол
1,3-тиазол
5
3
N
1
2
O
Оксазол
1,3-оксазол
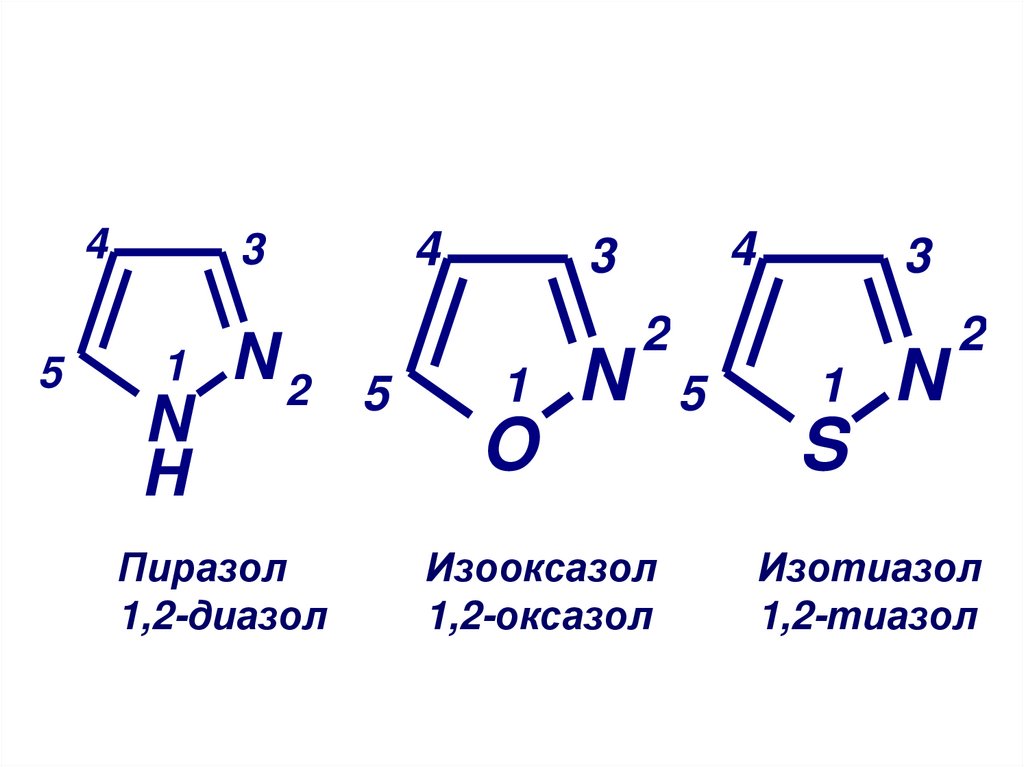
15.
45
4
3
1
N
H
N2
Пиразол
1,2-диазол
5
4
3
1
N
3
2
O
Изооксазол
1,2-оксазол
5
1
N
2
S
Изотиазол
1,2-тиазол
16.
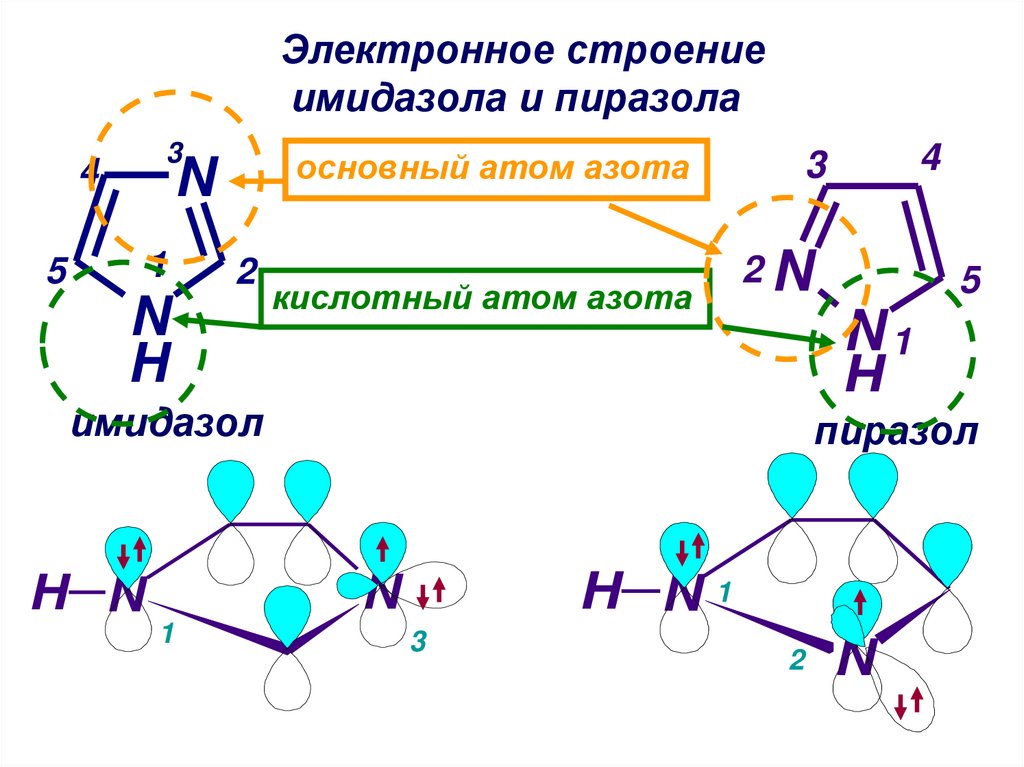
Электронное строениеимидазола и пиразола
3
основный атом азота
N
4
1
5
2
N
H
кислотный атом азота
2N
пиразол
H N1
N
1
5
N1
H
имидазол
H N
4
3
3
2
N
17.
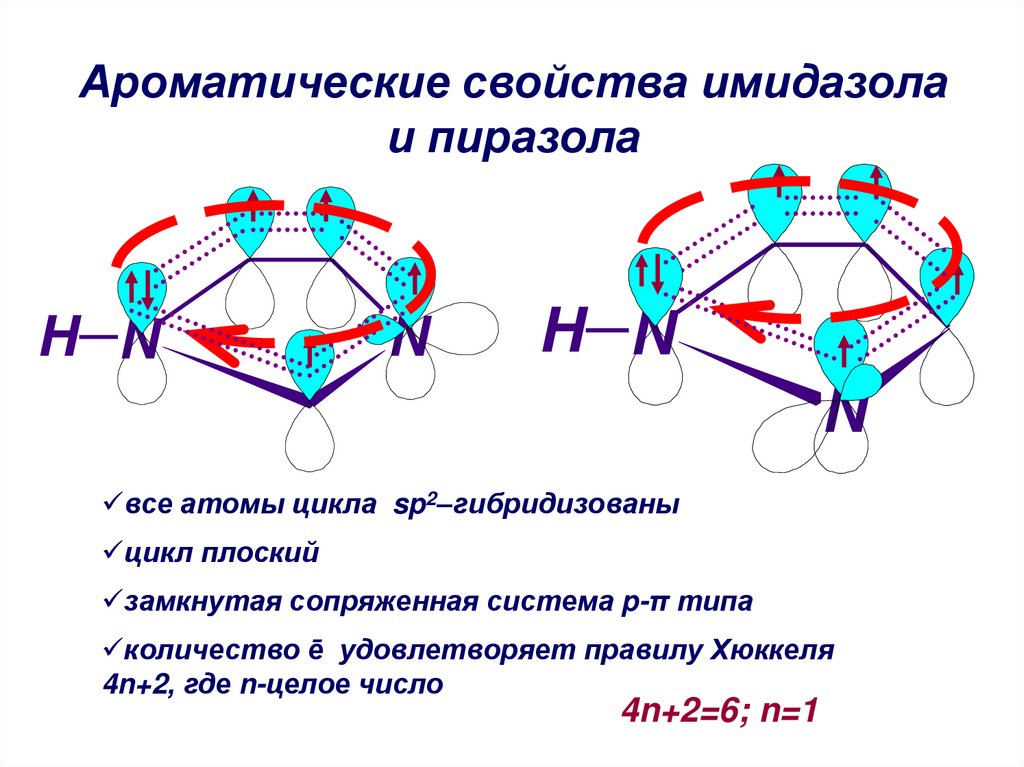
Ароматические свойства имидазолаи пиразола
H N
N
H N
N
все атомы цикла sp2–гибридизованы
цикл плоский
замкнутая сопряженная система p-π типа
количество ē удовлетворяет правилу Хюккеля
4n+2, где n-целое число
4n+2=6; n=1
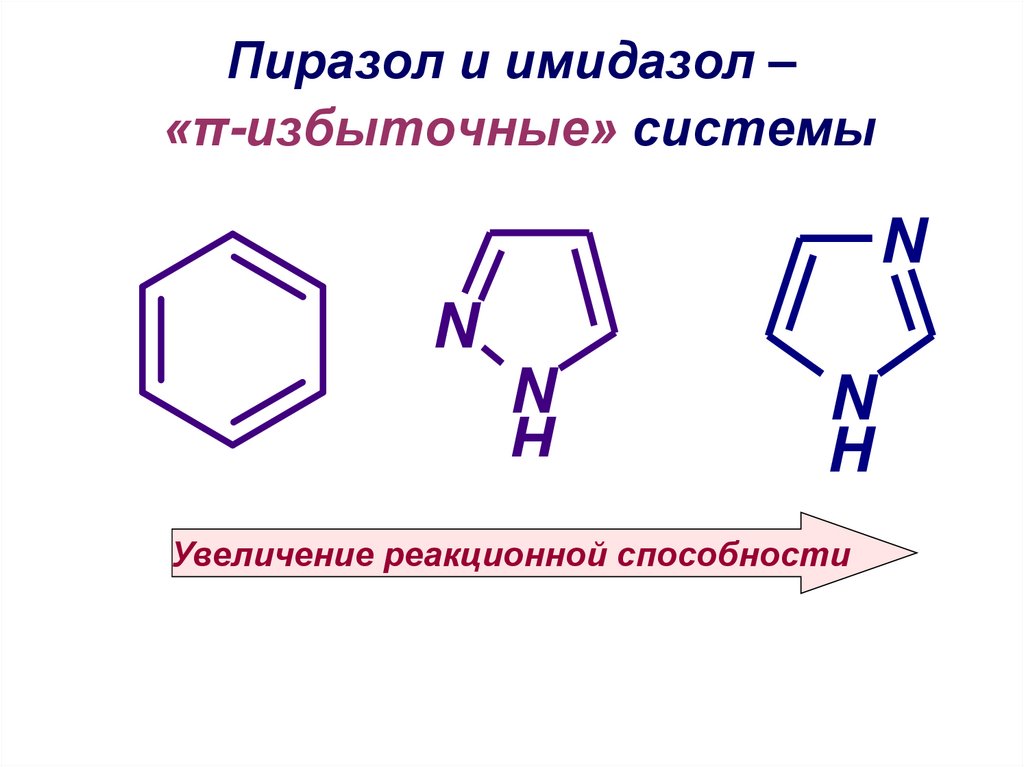
18. Пиразол и имидазол – «π-избыточные» системы
NN
N
H
N
H
Увеличение реакционной способности
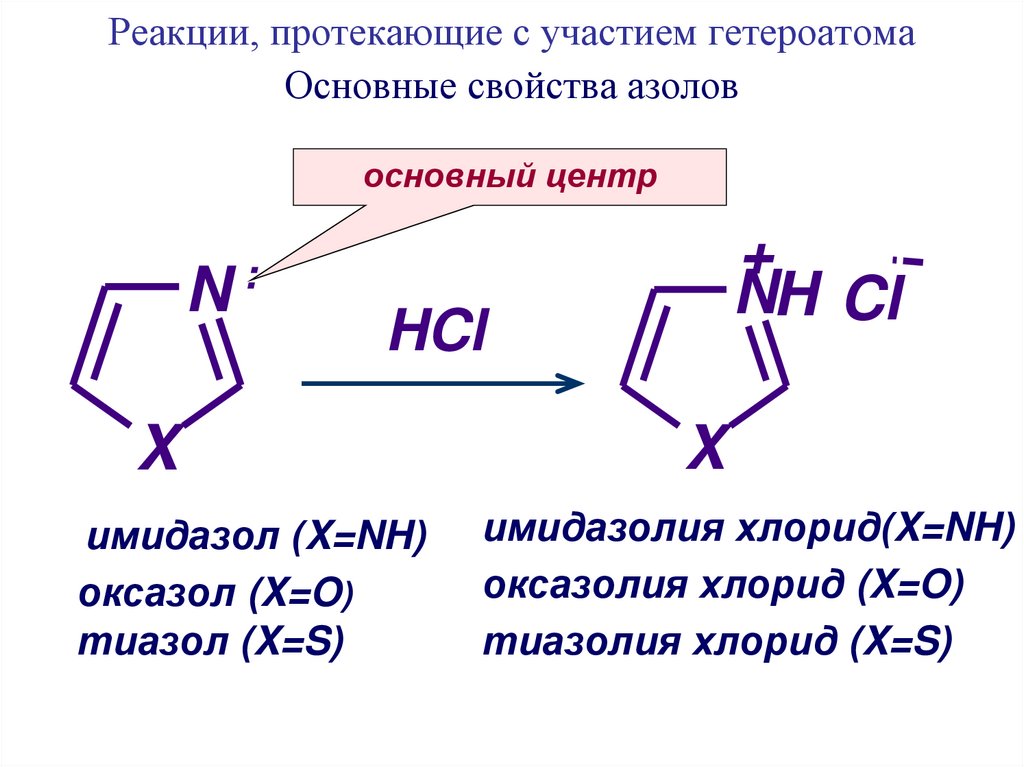
19. Реакции, протекающие с участием гетероатома Основные свойства азолов
основный центрN
+
NH Cl
:
HCl
X
имидазол (X=NH)
оксазол (X=O)
тиазол (X=S)
X
имидазолия хлорид(X=NH)
оксазолия хлорид (X=O)
тиазолия хлорид (X=S)
20.
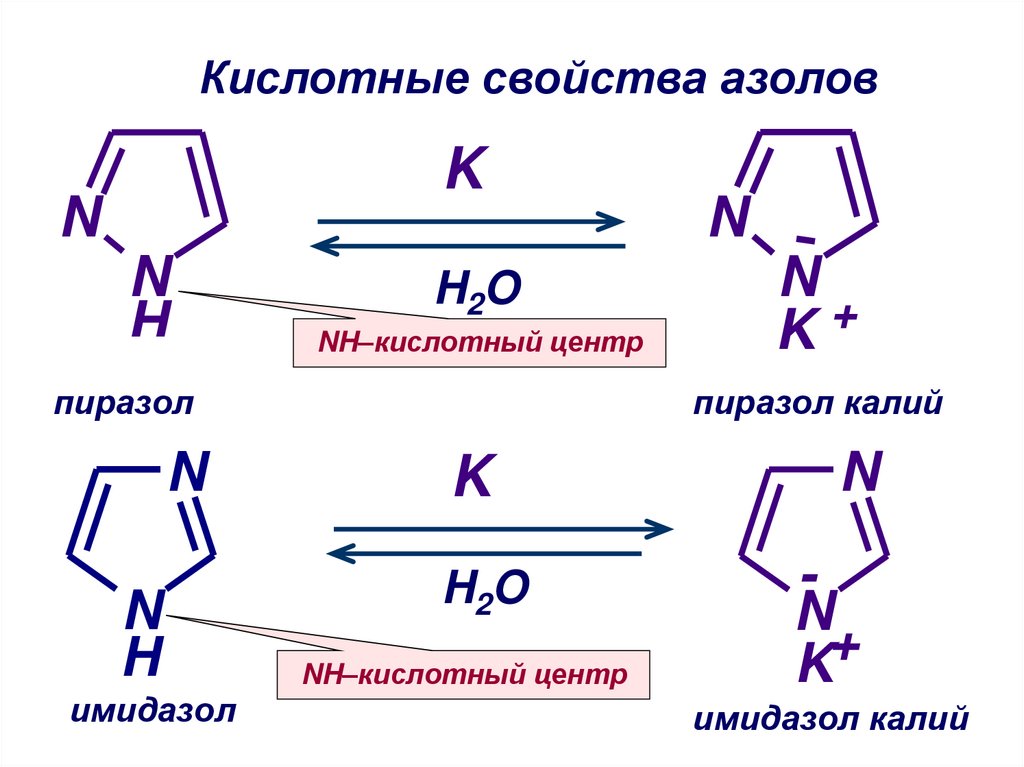
Кислотные свойства азоловK
N
N
H
H 2O
NH–кислотный центр
пиразол
N
N
H
имидазол
N
N
+
K
пиразол калий
K
H 2O
NH–кислотный центр
N
N
+
K
имидазол калий
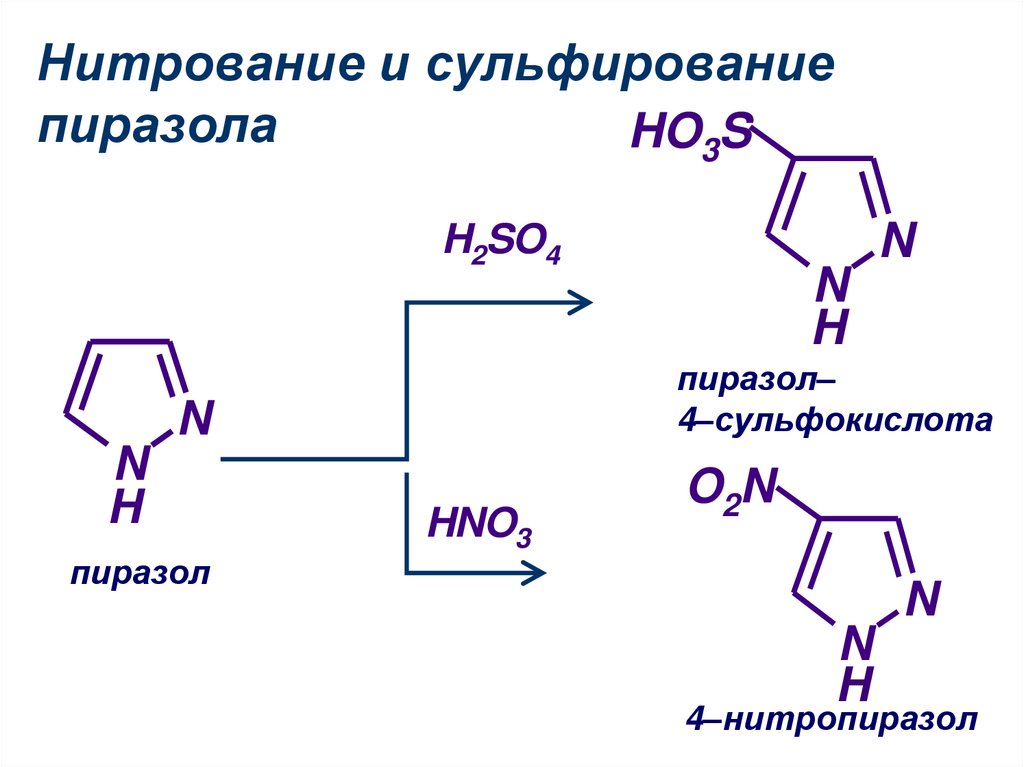
21. Нитрование и сульфирование пиразола
HO3SN
H2SO4
пиразол–
4–сульфокислота
N
N
H
пиразол
N
H
HNO3
O2N
N
N
H
4–нитропиразол
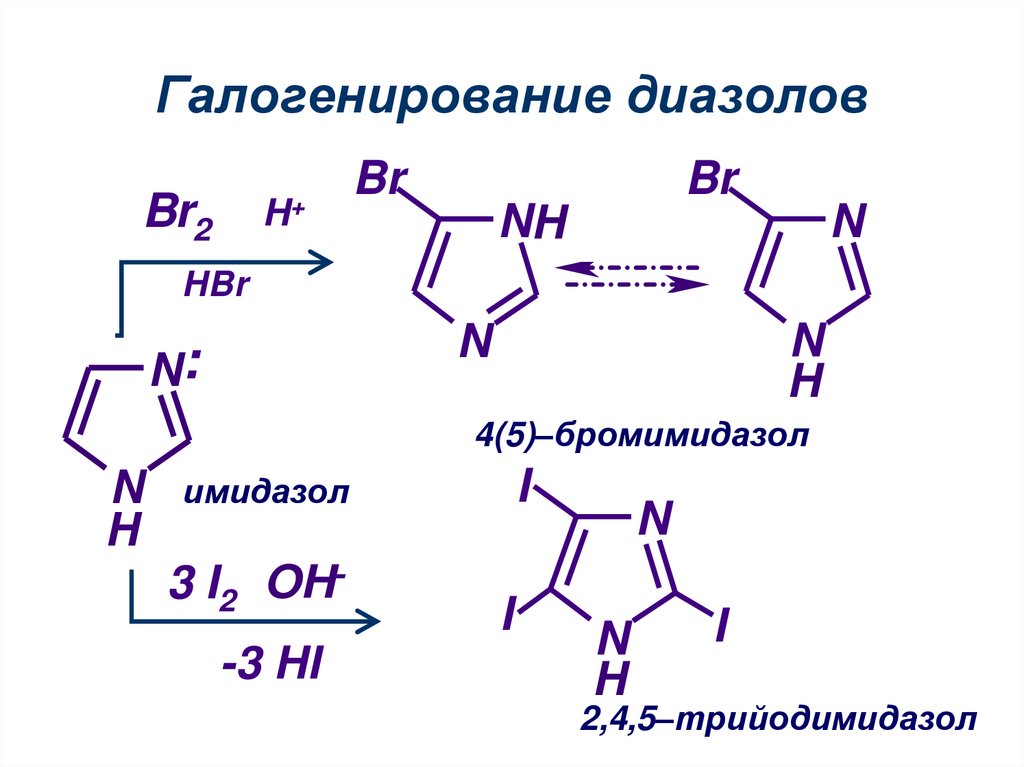
22. Галогенирование диазолов
Br2H+
Br
Br
N
NH
HBr
N
H
N
N:
4(5)–бромимидазол
N
H
I
имидазол
3 I2 OH-3 HI
I
N
N
H
I
2,4,5–трийодимидазол
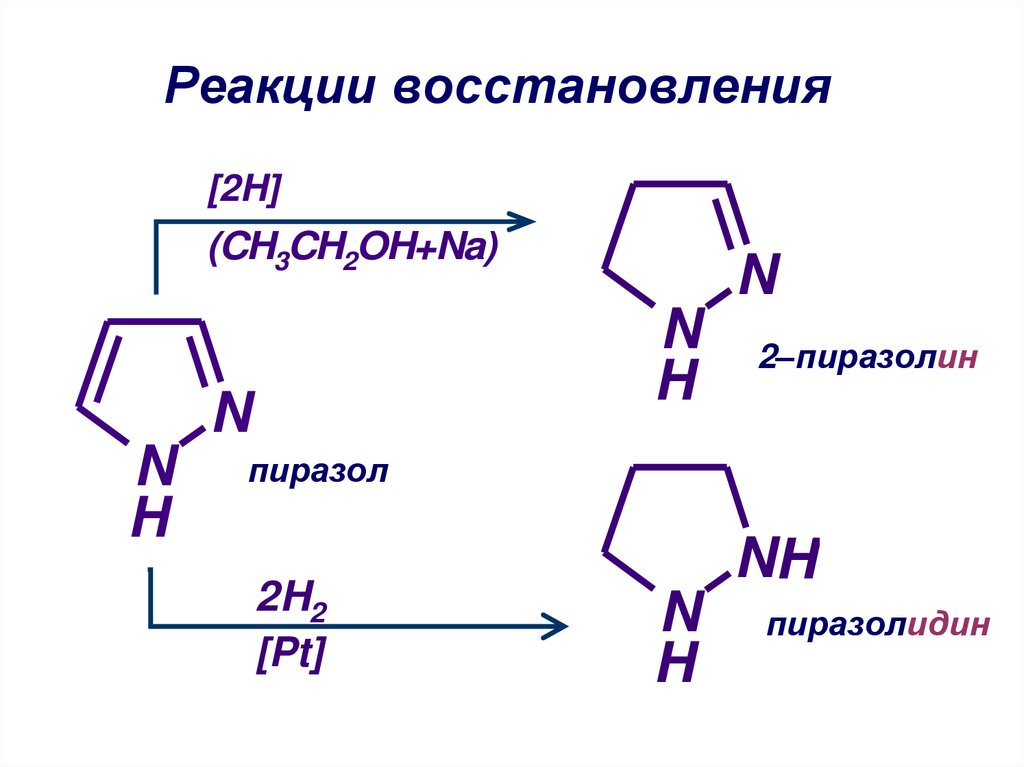
23. Реакции восстановления
[2H](CH3CH2OH+Na)
N
H
N
N
H
N
2–пиразолин
пиразол
2H2
[Pt]
NH
N
H
пиразолидин
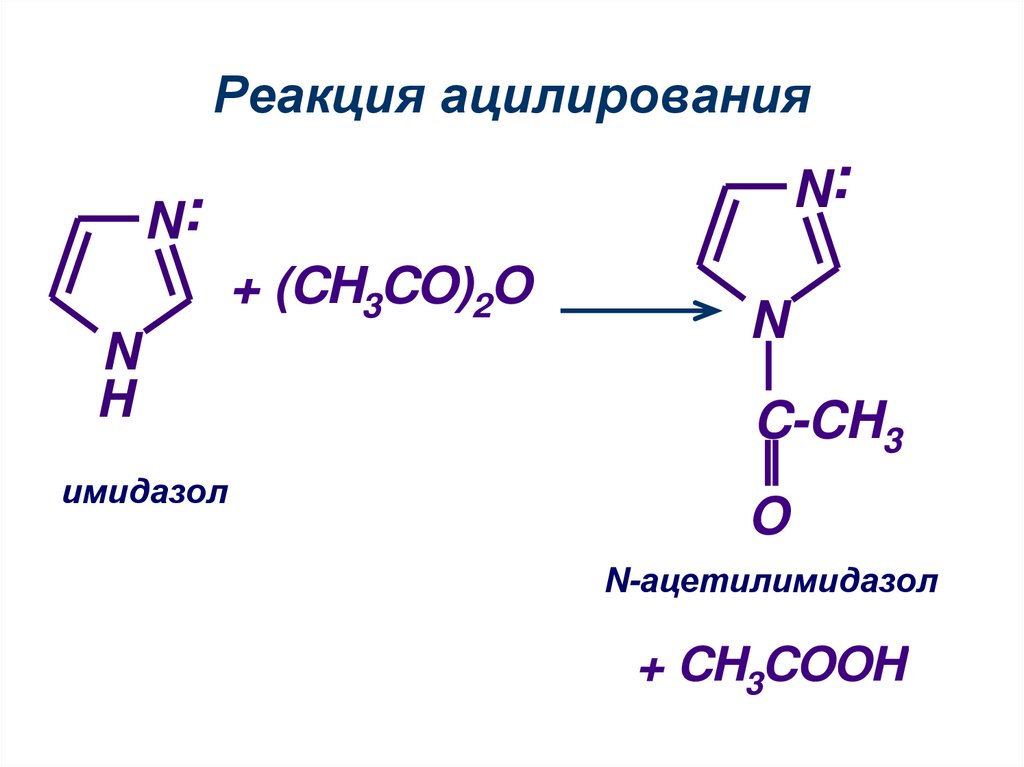
24. Реакция ацилирования
N:N:
+ (CH3CO)2O
N
H
имидазол
N
C-CH3
O
N-ацетилимидазол
+ CH3COOH
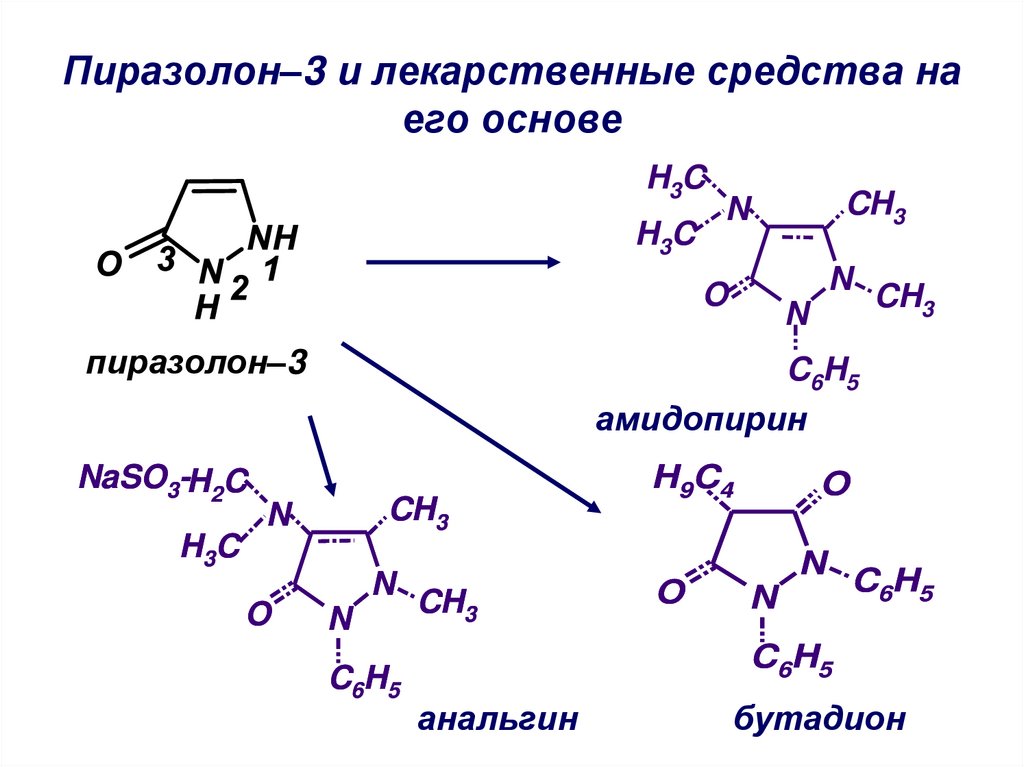
25. Пиразолон–3 и лекарственные средства на его основе
H3CH3C
CH3
N
N
O
N
пиразолон–3
CH3
C6H5
амидопирин
NaSO3-H2C
CH3
N
H3C
N
O
N
C6H5
CH3
H9C4
O
O
N
N
C6H5
C6H5
анальгин
бутадион
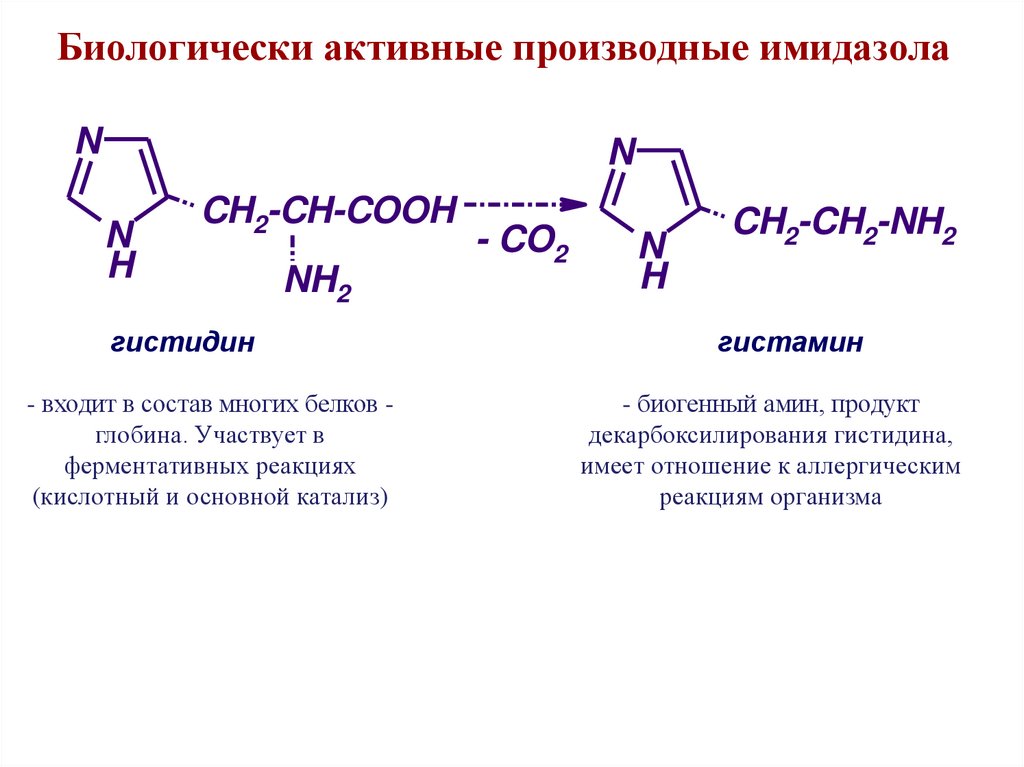
26.
Биологически активные производные имидазолаN
N
N
H
CH2-CH-COOH
NH2
гистидин
- входит в состав многих белков глобина. Участвует в
ферментативных реакциях
(кислотный и основной катализ)
- CO2
N
H
CH2-CH2-NH2
гистамин
- биогенный амин, продукт
декарбоксилирования гистидина,
имеет отношение к аллергическим
реакциям организма
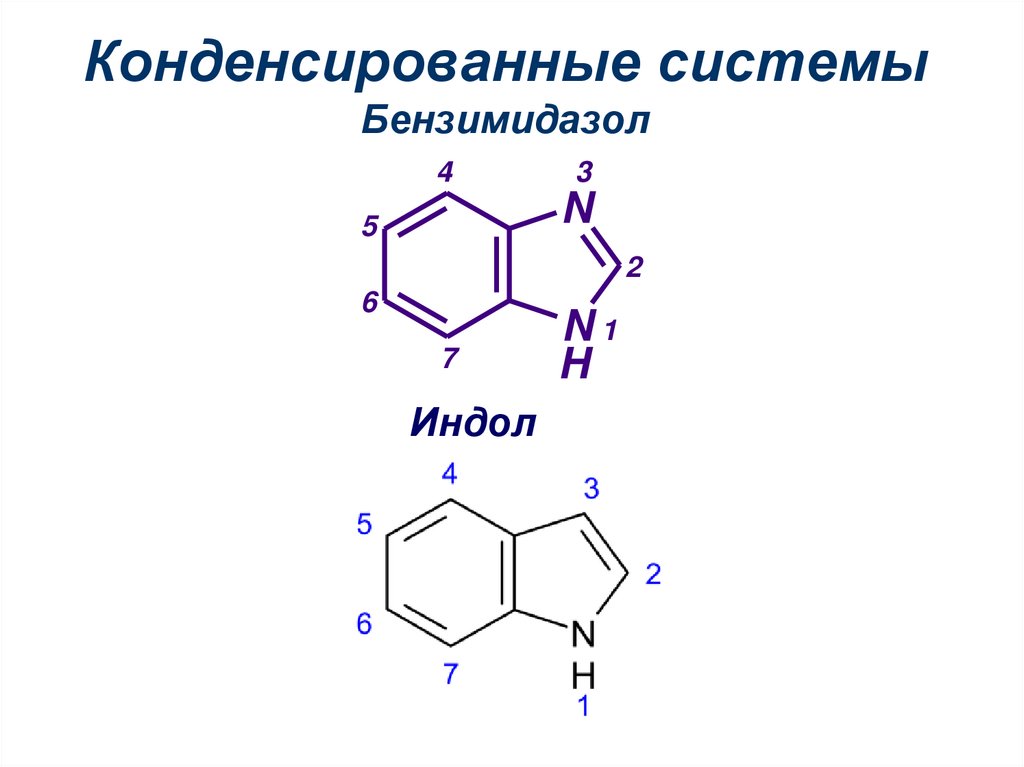
27. Конденсированные системы Бензимидазол
43
N
5
2
6
7
Индол
N1
H
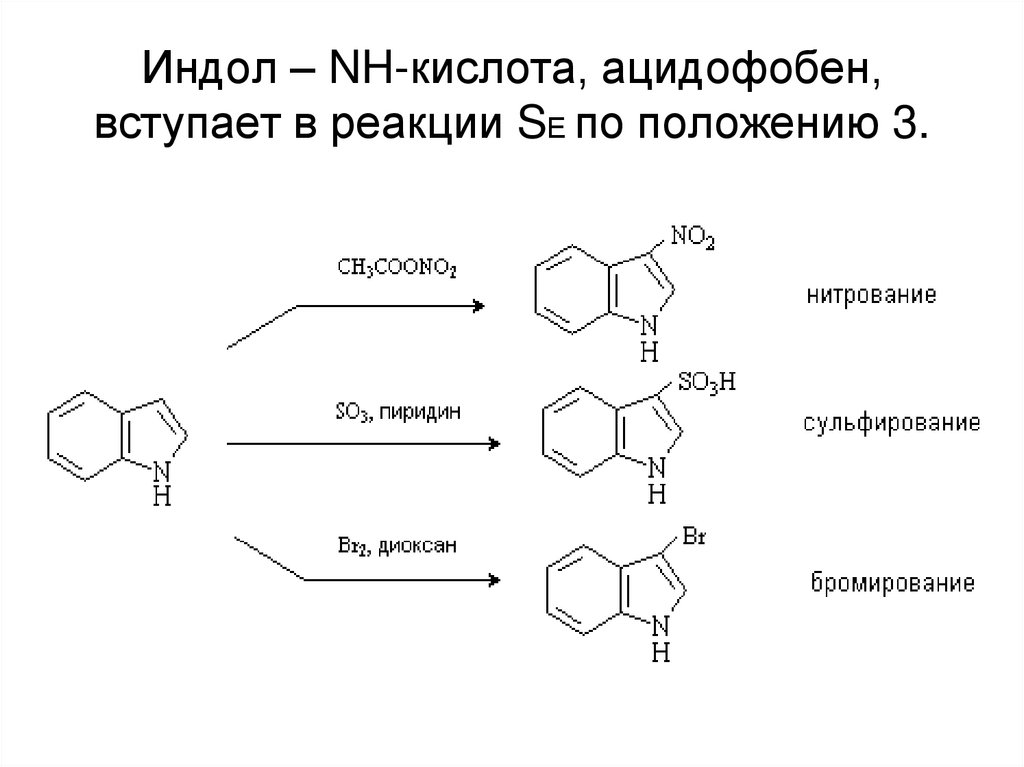
28. Индол – NH-кислота, ацидофобен, вступает в реакции SЕ по положению 3.
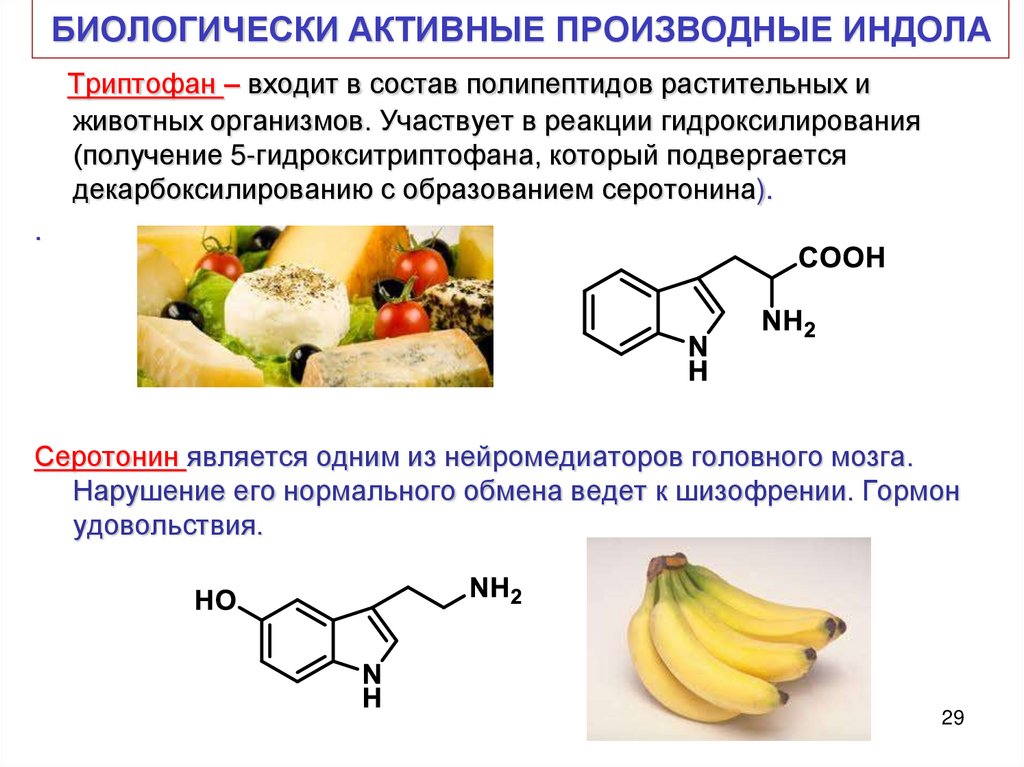
29. БИОЛОГИЧЕСКИ АКТИВНЫЕ ПРОИЗВОДНЫЕ ИНДОЛА
Триптофан – входит в состав полипептидов растительных иживотных организмов. Участвует в реакции гидроксилирования
(получение 5-гидрокситриптофана, который подвергается
декарбоксилированию с образованием серотонина).
.
Серотонин является одним из нейромедиаторов головного мозга.
Нарушение его нормального обмена ведет к шизофрении. Гормон
удовольствия.
29
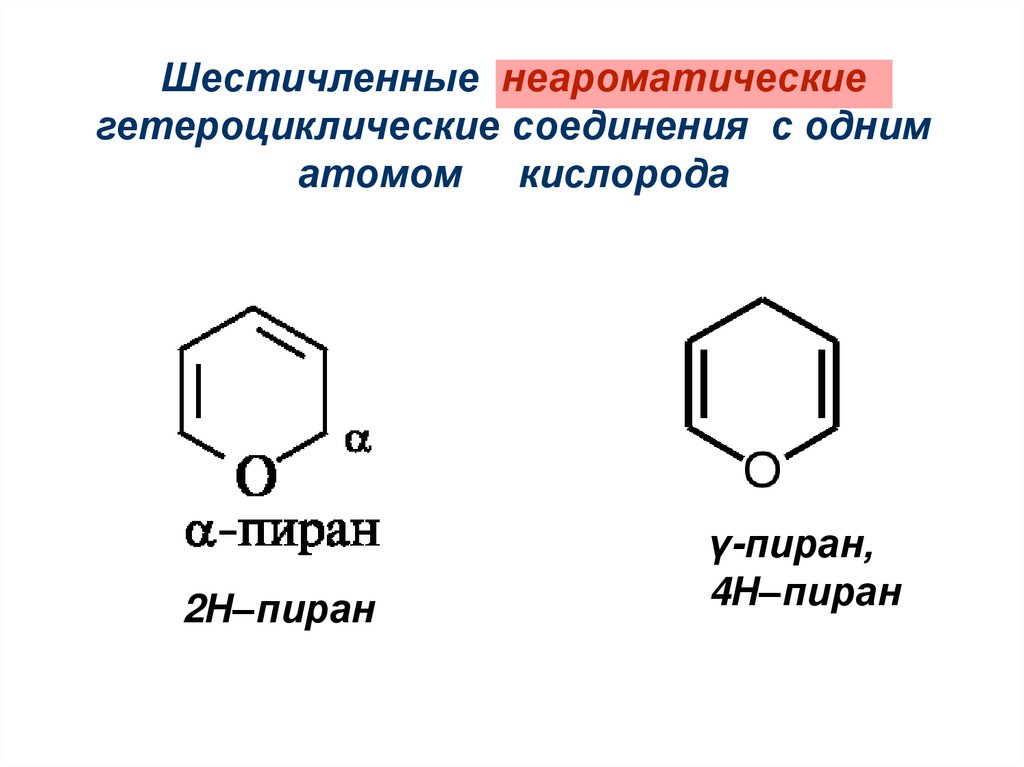
30.
Шестичленные неароматическиегетероциклические соединения с одним
атомом кислорода
2Н–пиран
γ-пиран,
4Н–пиран
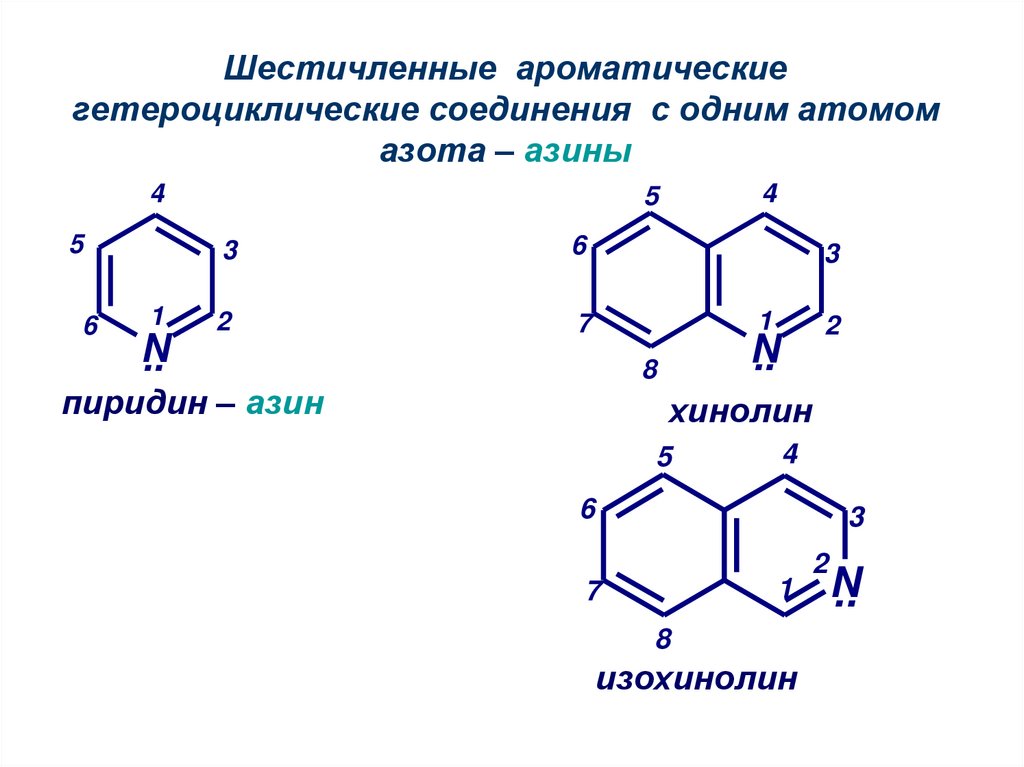
31. Шестичленные ароматические гетероциклические соединения с одним атомом азота – азины
45
6
1
N
..
4
5
3
6
2
7
3
1
N
..
8
пиридин – азин
2
хинолин
5
4
6
3
1
7
8
изохинолин
2
N
..
32. Шестичленные ароматические гетероциклические соединения с двумя атомами азота – диазины
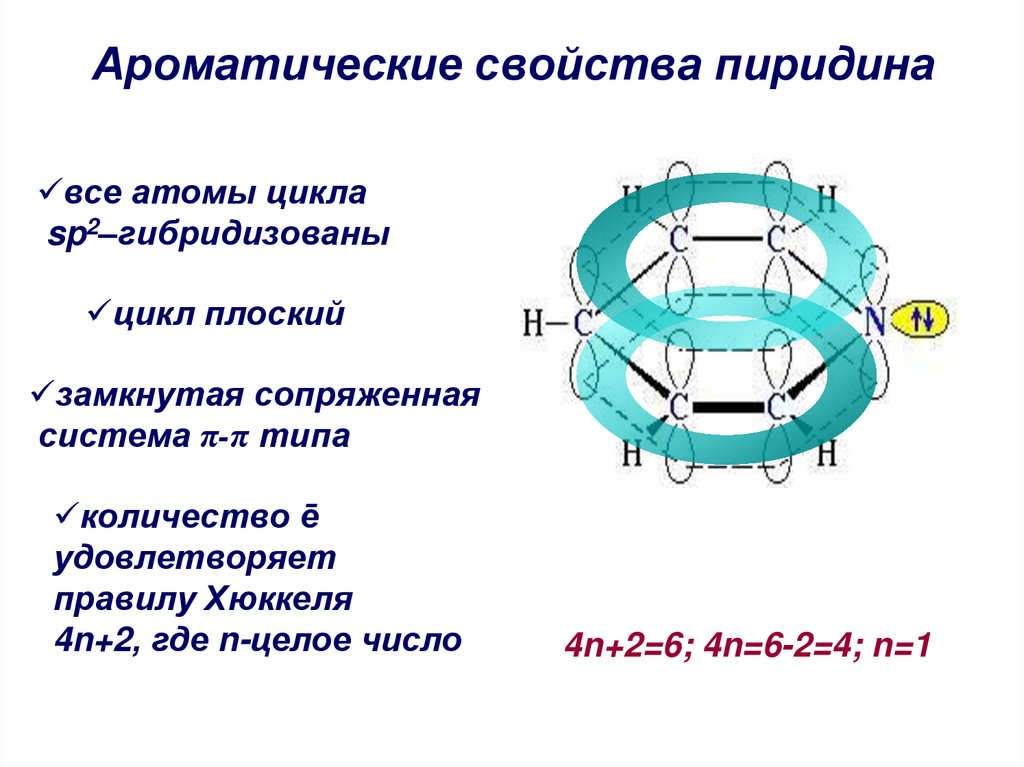
33. Ароматические свойства пиридина
все атомы циклаsp2–гибридизованы
цикл плоский
замкнутая сопряженная
система π-π типа
количество ē
удовлетворяет
правилу Хюккеля
4n+2, где n-целое число
4n+2=6; 4n=6-2=4; n=1
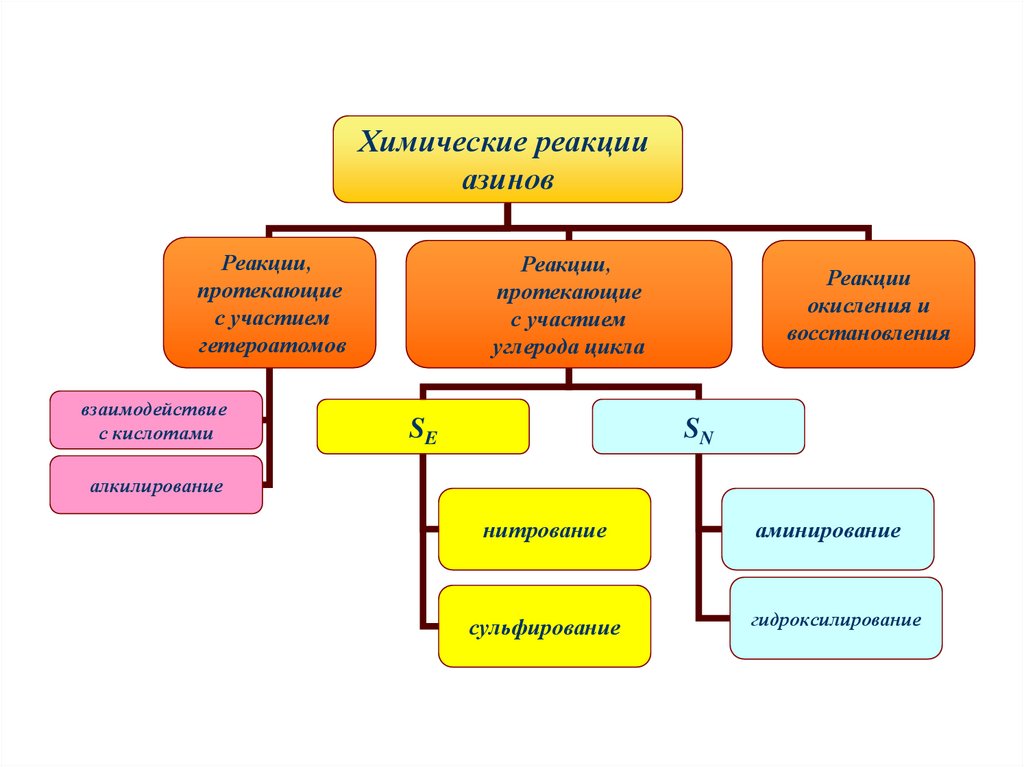
34.
Химические реакцииазинов
Реакции,
протекающие
с участием
гетероатомов
взаимодействие
с кислотами
Реакции,
протекающие
с участием
углерода цикла
SE
Реакции
окисления и
восстановления
SN
алкилирование
нитрование
сульфирование
аминирование
гидроксилирование
35.
Реакции,протекающие
с участием
гетероатомов
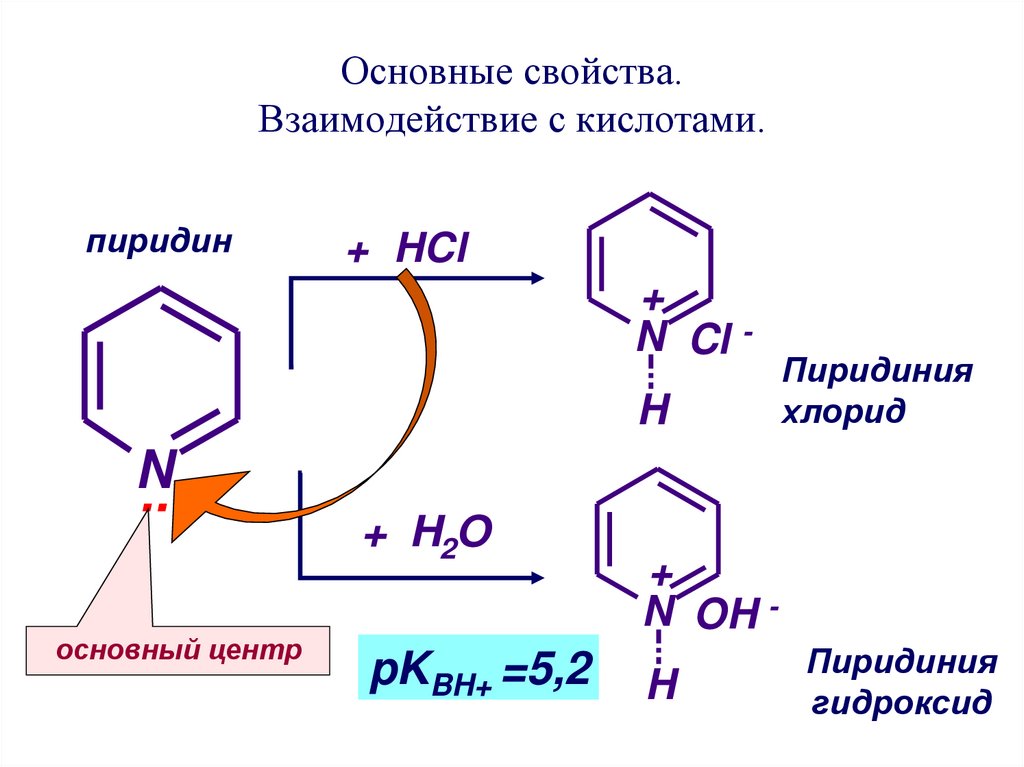
36. Основные свойства. Взаимодействие с кислотами.
пиридин+ HCl
+
N Cl H
N
..
основный центр
+ H2O
pKBH+ =5,2
Пиридиния
хлорид
+
N OH H
Пиридиния
гидроксид
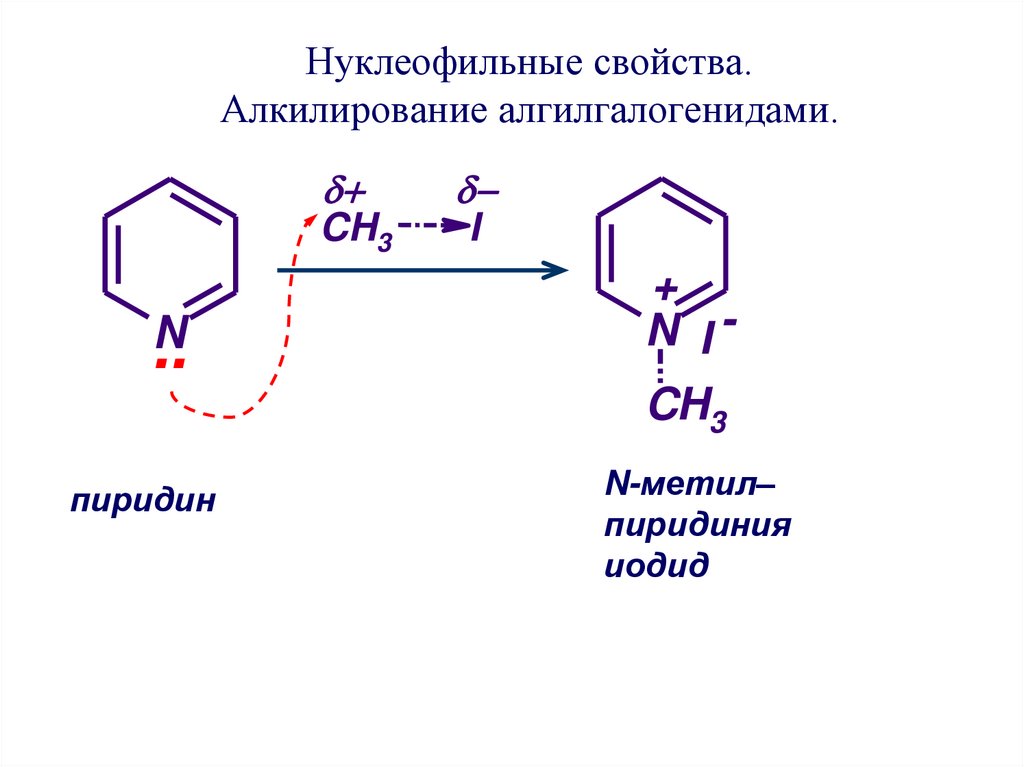
37. Нуклеофильные свойства. Алкилирование алгилгалогенидами.
CH3N
..
пиридин
I
+
N ICH3
N-метил–
пиридиния
иодид
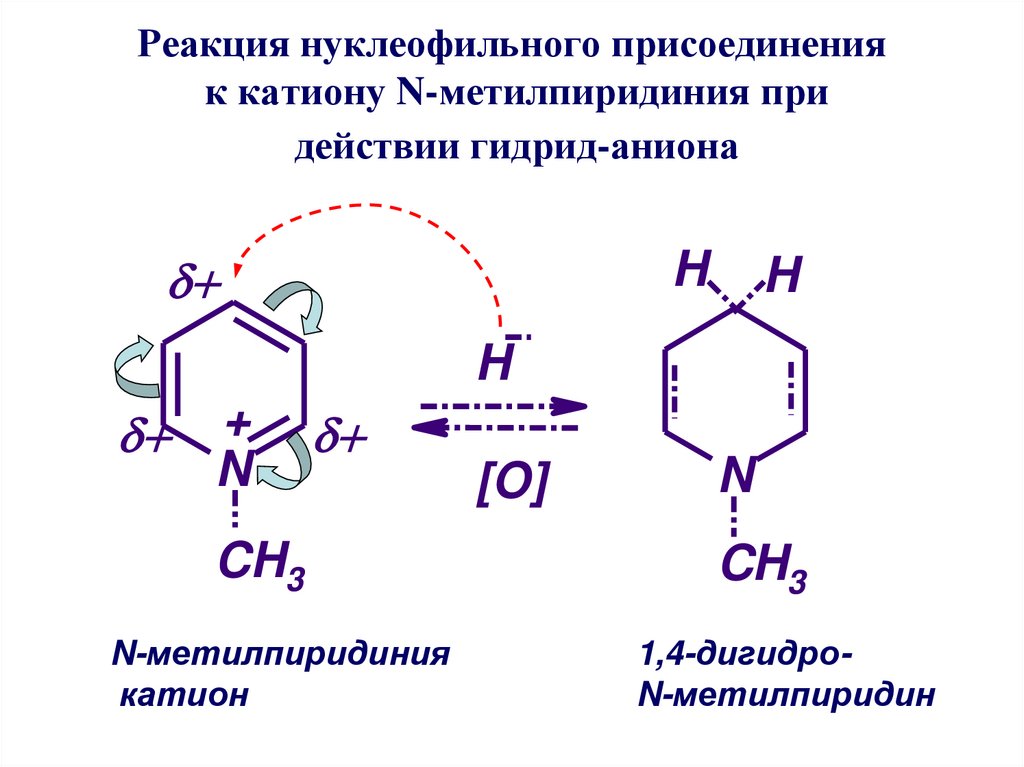
38. Реакция нуклеофильного присоединения к катиону N-метилпиридиния при действии гидрид-аниона
HH
H
+
N
CH3
N-метилпиридиния
катион
[O]
N
CH3
1,4-дигидроN-метилпиридин
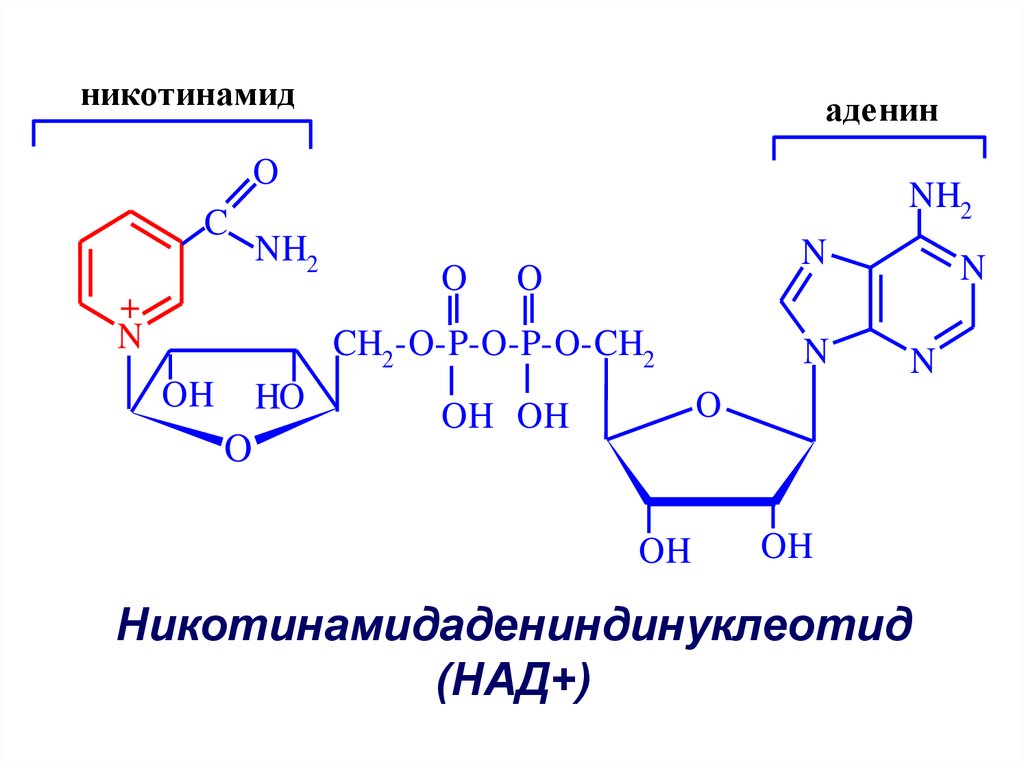
39. Никотинамидадениндинуклеотид (НАД+)
никотинамидаденин
O
C
NH2
+
N
NH2
O
N
O
CH2 -O-P-O-P-O-CH2
OH
HO
O
N
N
N
O
OH OH
OH
OH
Никотинамидадениндинуклеотид
(НАД+)
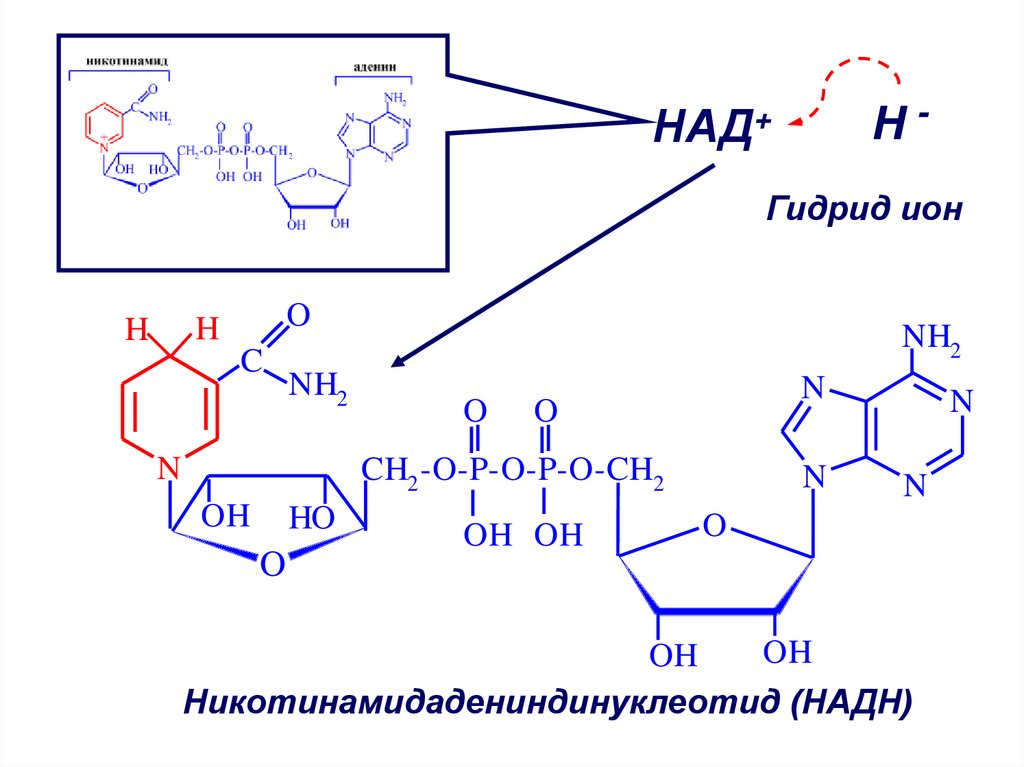
40.
H-НАД+
Гидрид ион
O
H
H
C
NH2
N
NH2
O
N
O
CH2 -O-P-O-P-O-CH2
OH
HO
O
OH OH
N
N
N
O
OH
OH
Никотинамидадениндинуклеотид (НАДН)
41.
Реакции,протекающие
с участием
углерода цикла
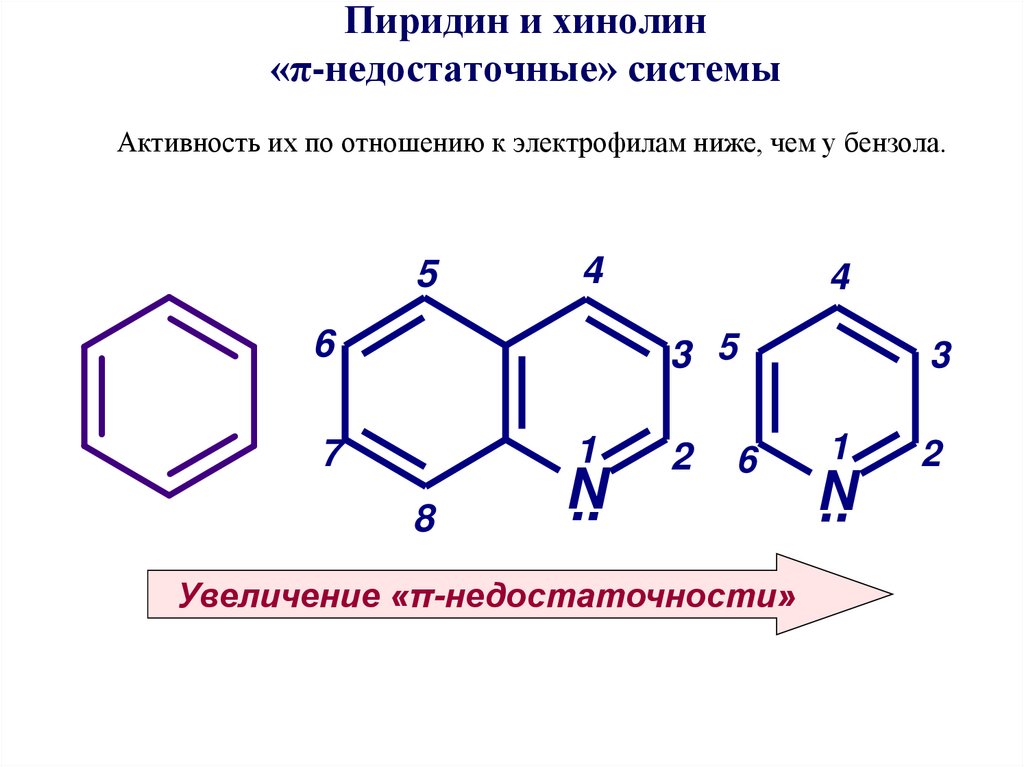
42. Пиридин и хинолин «π-недостаточные» системы Активность их по отношению к электрофилам ниже, чем у бензола.
54
6
4
3 5
1
7
8
N
..
2
6
Увеличение «π-недостаточности»
3
1
N
..
2
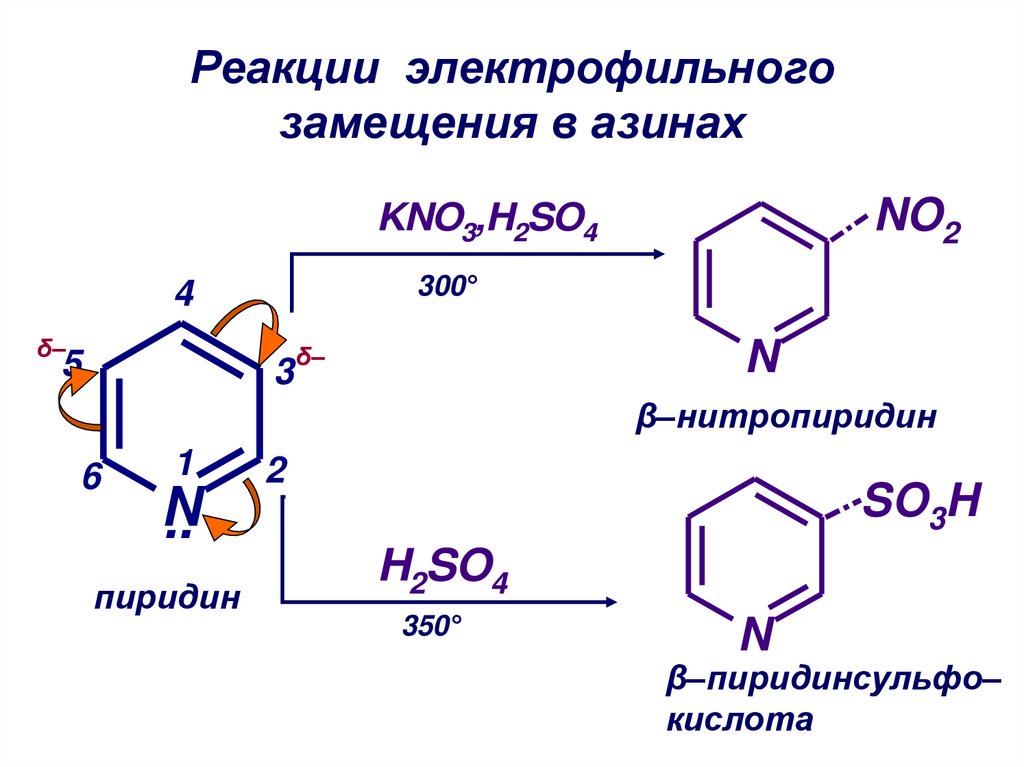
43. Реакции электрофильного замещения в азинах
NO2KNO3,H2SO4
300°
4
δ–
5
3
N
δ–
β–нитропиридин
6
1
N
..
пиридин
2
SO3H
H2SO4
350°
N
β–пиридинсульфо–
кислота
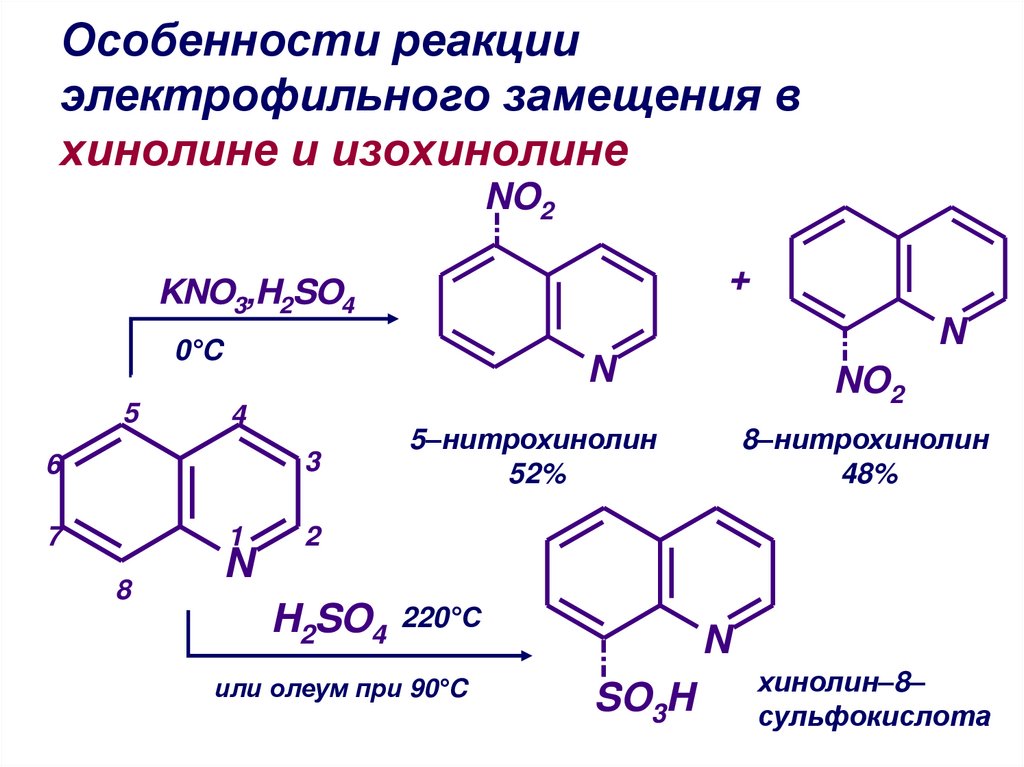
44. Особенности реакции электрофильного замещения в хинолине и изохинолине
NO2+
KNO3,H2SO4
N
0°C
5
N
4
3
6
7
1
8
N
NO2
5–нитрохинолин
52%
8–нитрохинолин
48%
2
H2SO4
220°С
или олеум при 90°C
N
SO3H
хинолин–8–
сульфокислота
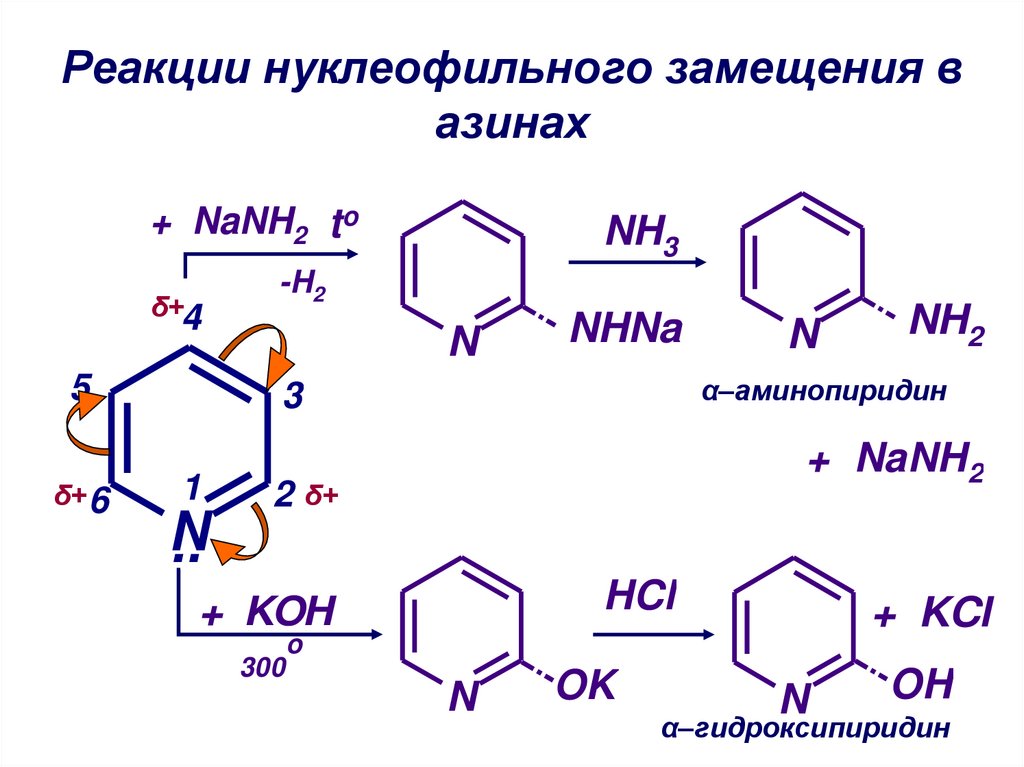
45. Реакции нуклеофильного замещения в азинах
+ NaNH2 toδ+4
5
δ+ 6
NH3
-H2
N
NHNa
N
..
+ NaNH2
2 δ+
HCl
+ KOH
300
NH2
α–аминопиридин
3
1
N
+ KCl
o
N
OK
N
OH
α–гидроксипиридин
46. Реакции окисления и восстановления
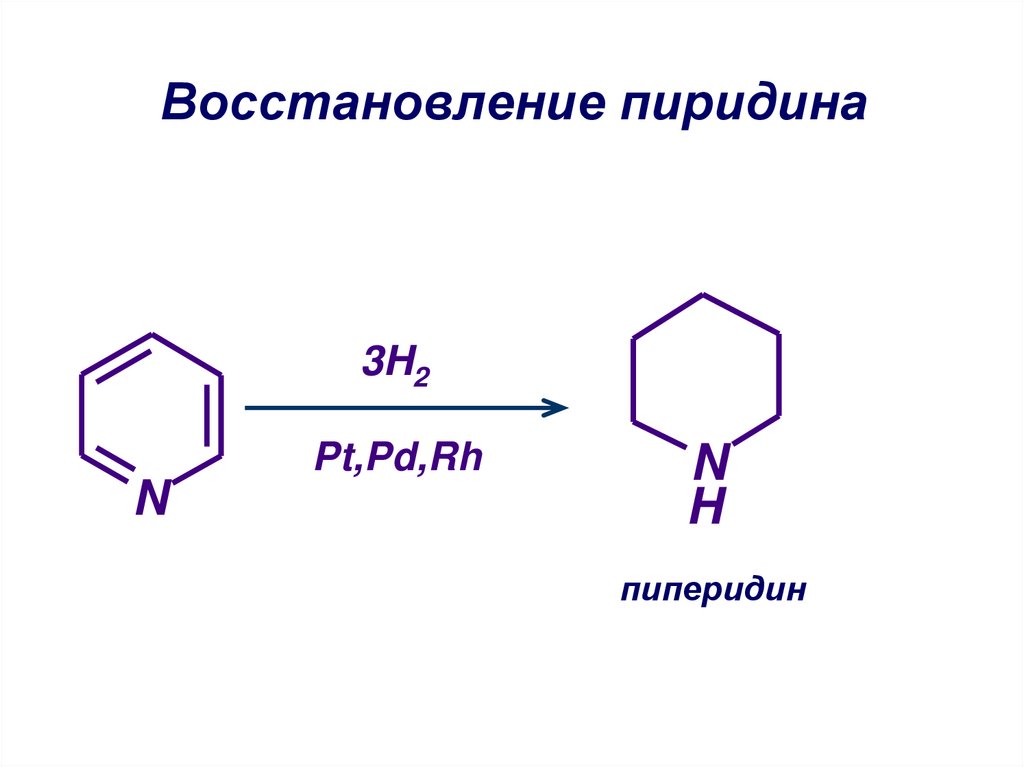
47. Восстановление пиридина
3H2Pt,Pd,Rh
N
N
H
пиперидин
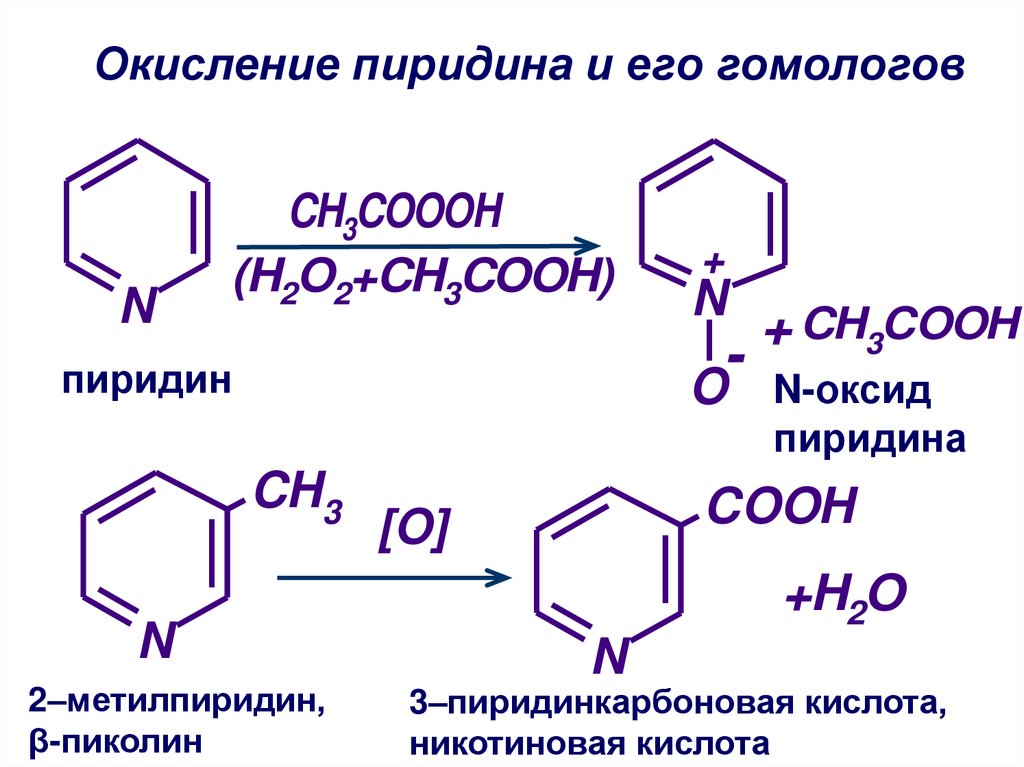
48. Окисление пиридина и его гомологов
NCH3COOOH
(H2O2+CH3COOH)
+
N
-
пиридин
+ CH3COOH
O N-оксид
пиридина
CH3
N
2–метилпиридин,
β-пиколин
COOH
[O]
+H2O
N
3–пиридинкарбоновая кислота,
никотиновая кислота
49. Важнейшие представители шестичленных гетероциклов
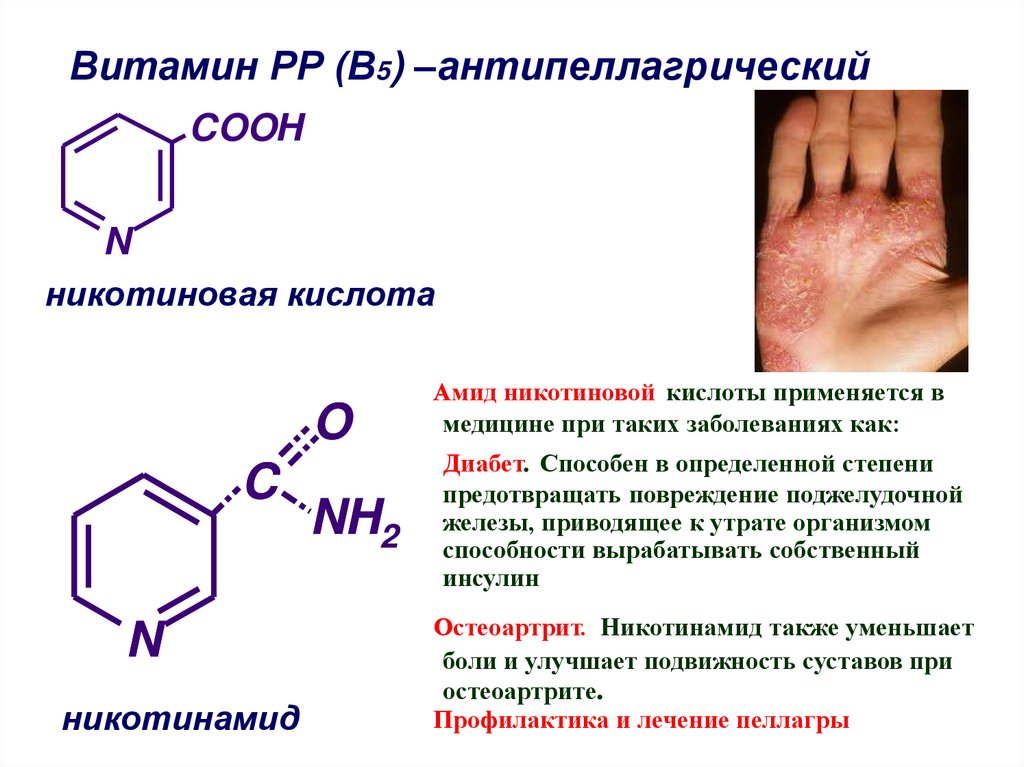
50.
Витамин РР (В5) –антипеллагрическийCOOH
N
никотиновая кислота
O
C
N
никотинамид
NH2
Амид никотиновой кислоты применяется в
медицине при таких заболеваниях как:
Диабет. Способен в определенной степени
предотвращать повреждение поджелудочной
железы, приводящее к утрате организмом
способности вырабатывать собственный
инсулин
Остеоартрит. Никотинамид также уменьшает
боли и улучшает подвижность суставов при
остеоартрите.
Профилактика и лечение пеллагры
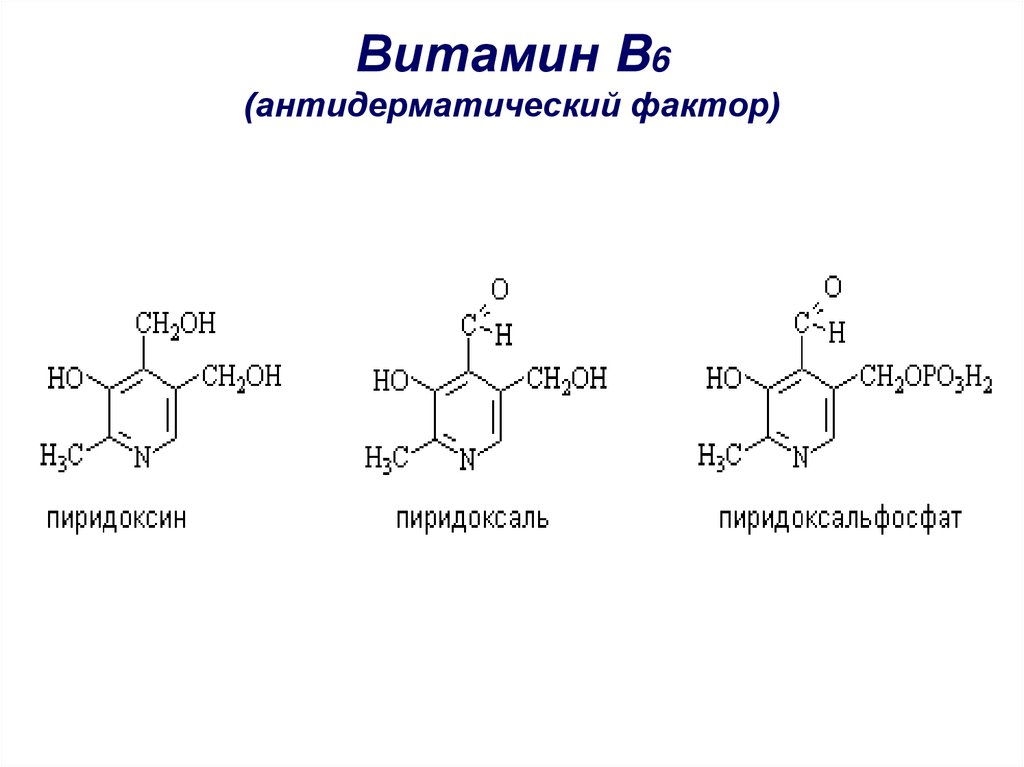
51. Витамин B6 (антидерматический фактор)
52.
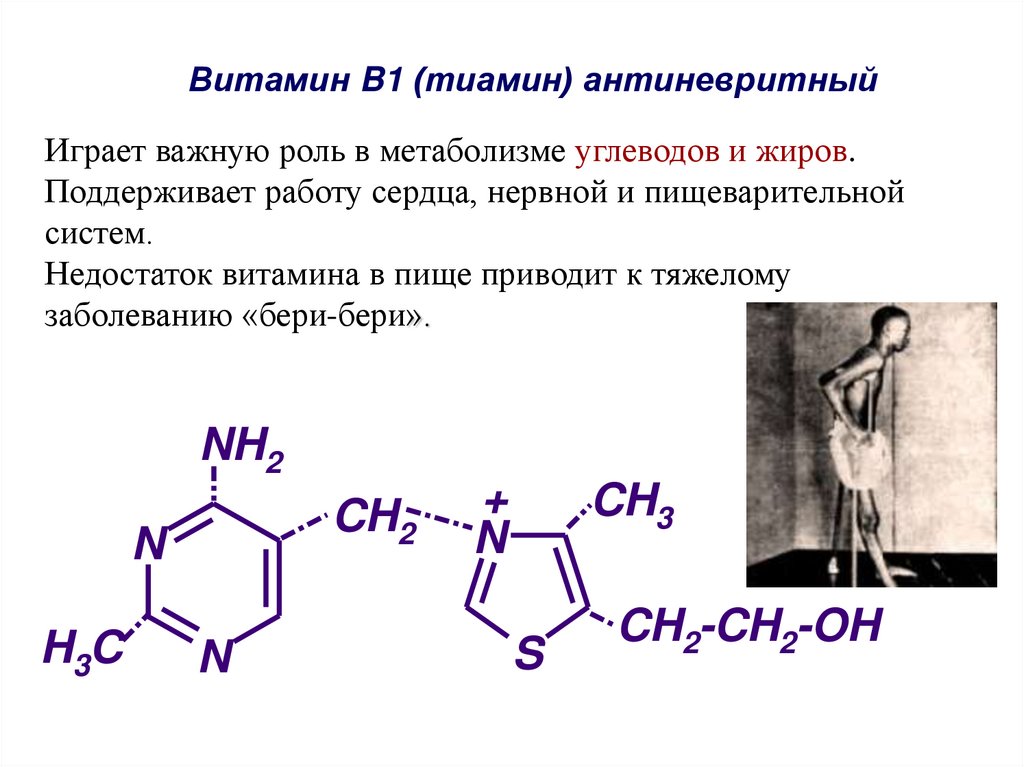
Витамин B1 (тиамин) антиневритныйИграет важную роль в метаболизме углеводов и жиров.
Поддерживает работу сердца, нервной и пищеварительной
систем.
Недостаток витамина в пище приводит к тяжелому
заболеванию «бери-бери».
NH2
CH2
N
H3C
N
+
N
CH3
S
CH2-CH2-OH
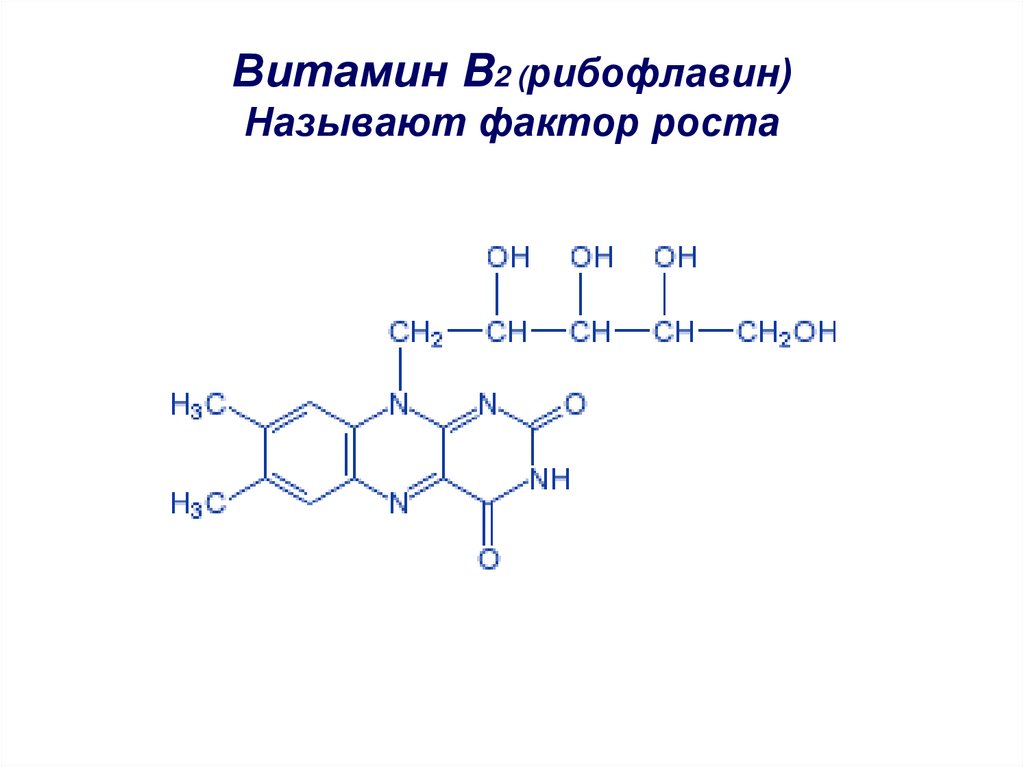
53. Витамин B2 (рибофлавин) Называют фактор роста
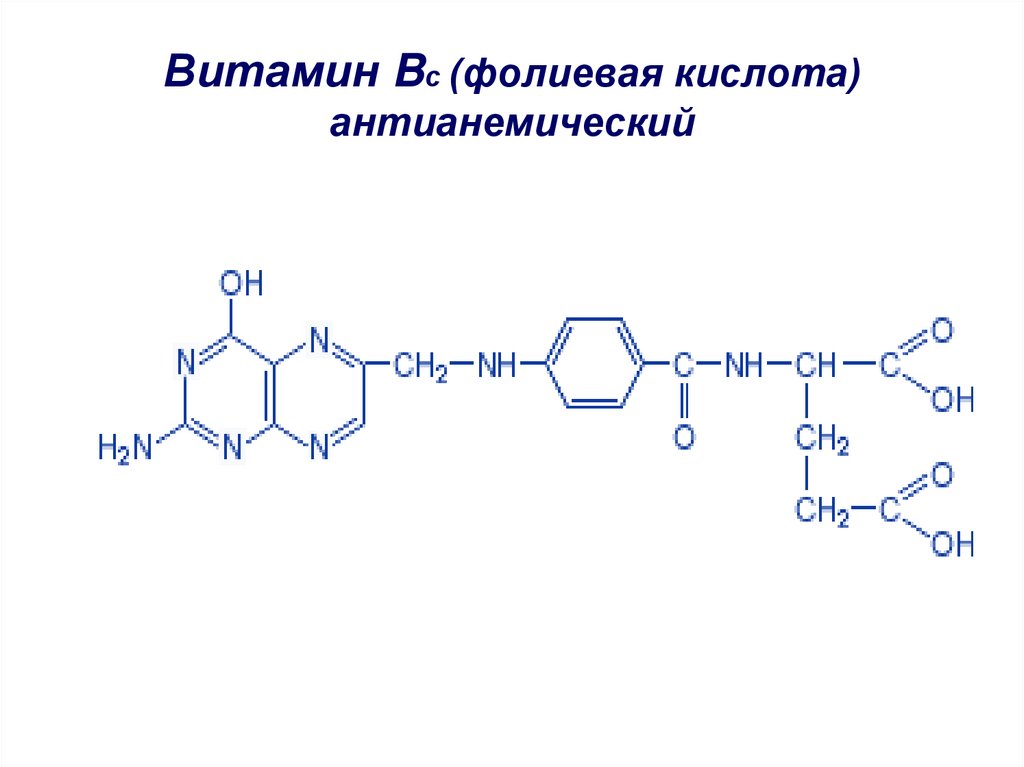
54. Витамин Bс (фолиевая кислота) антианемический
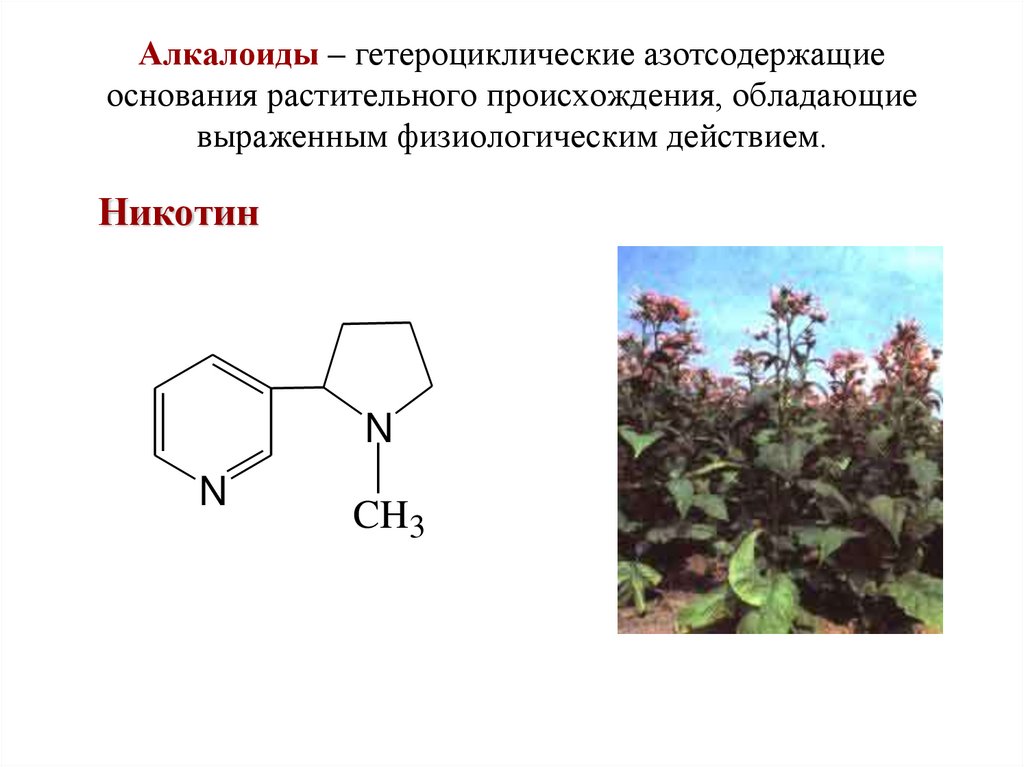
55. Алкалоиды – гетероциклические азотсодержащие основания растительного происхождения, обладающие выраженным физиологическим
действием.Никотин
N
N
CH3
56.
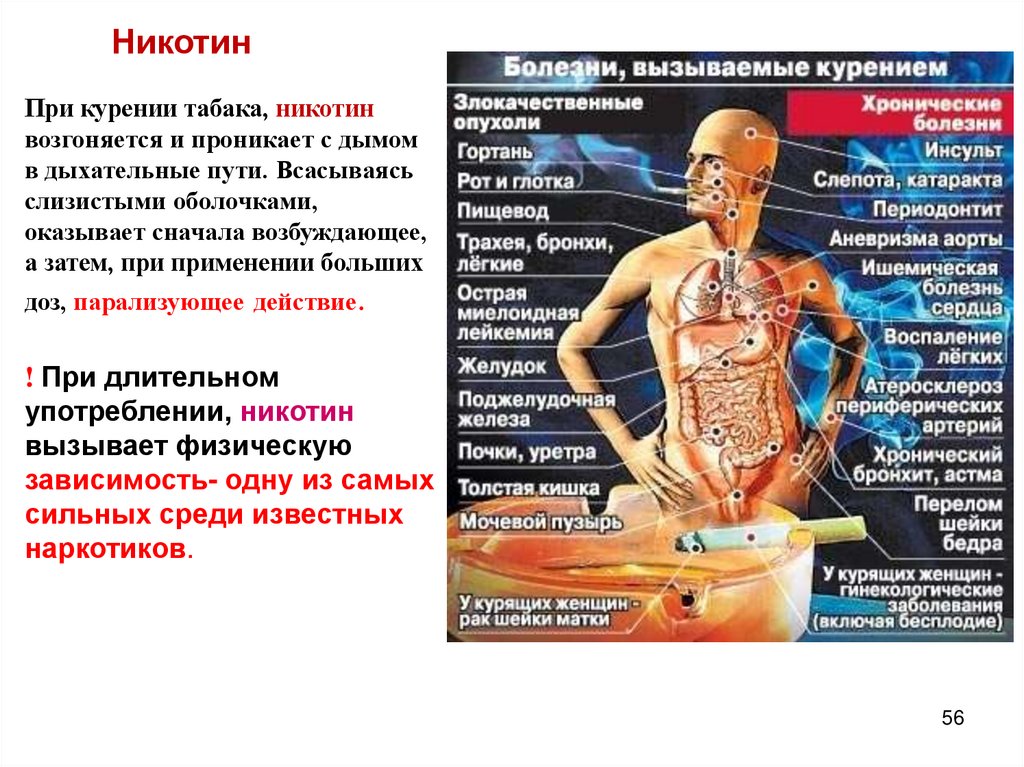
НикотинПри курении табака, никотин
возгоняется и проникает с дымом
в дыхательные пути. Всасываясь
слизистыми оболочками,
оказывает сначала возбуждающее,
а затем, при применении больших
доз, парализующее действие.
! При длительном
употреблении, никотин
вызывает физическую
зависимость- одну из самых
сильных среди известных
наркотиков.
56
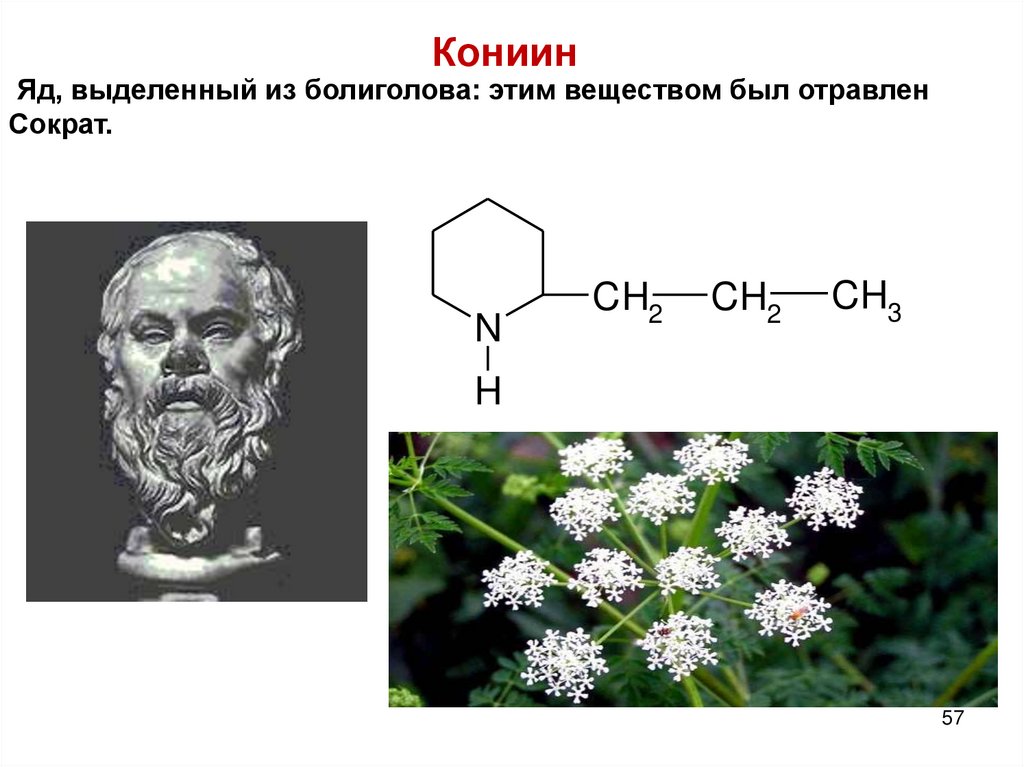
57. Кониин
Яд, выделенный из болиголова: этим веществом был отравленСократ.
N
CH2
CH2
CH3
H
57
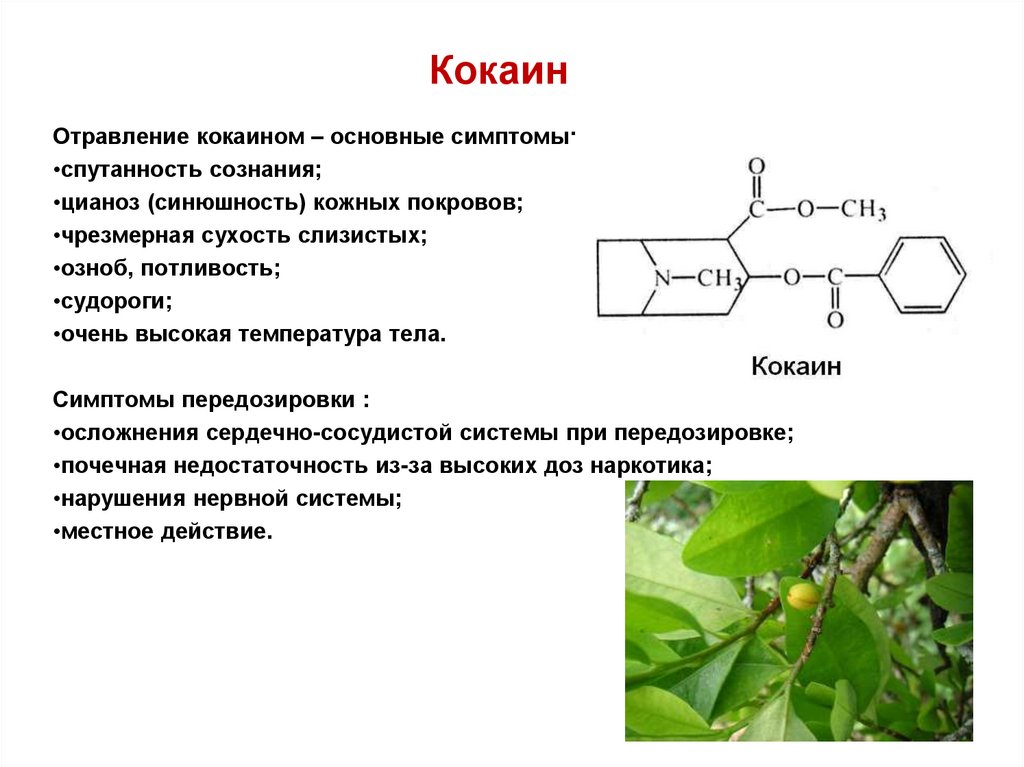
58. Кокаин
Отравление кокаином – основные симптомы:•спутанность сознания;
•цианоз (синюшность) кожных покровов;
•чрезмерная сухость слизистых;
•озноб, потливость;
•судороги;
•очень высокая температура тела.
Симптомы передозировки :
•осложнения сердечно-сосудистой системы при передозировке;
•почечная недостаточность из-за высоких доз наркотика;
•нарушения нервной системы;
•местное действие.
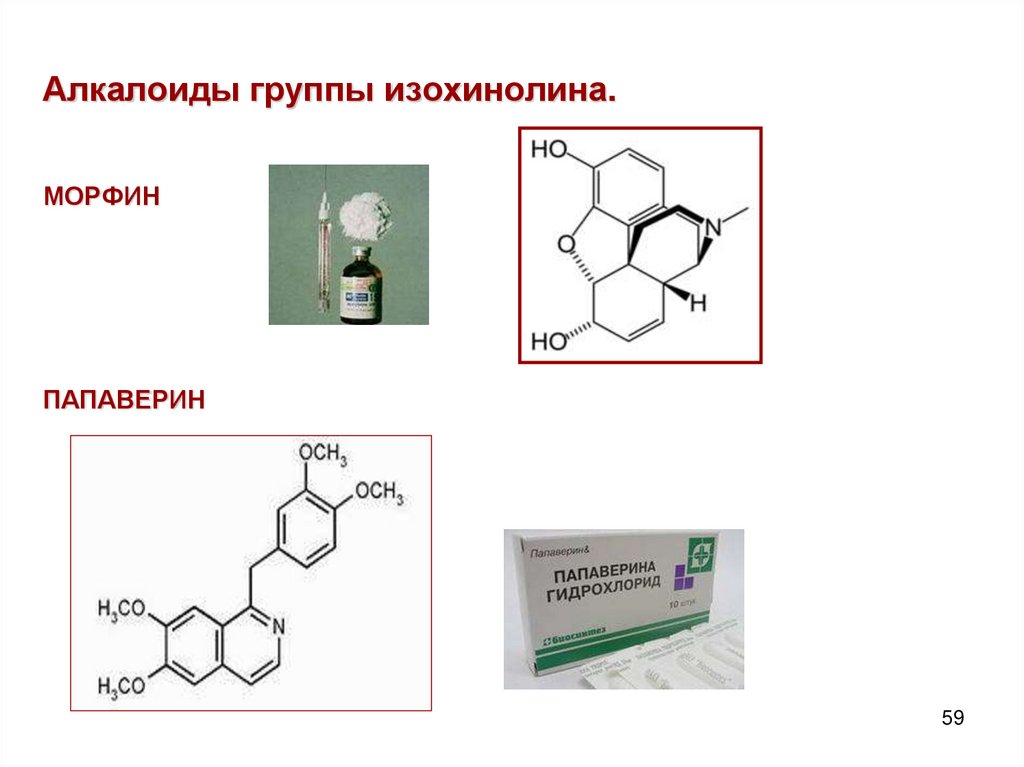
59.
Алкалоиды группы изохинолина.МОРФИН
ПАПАВЕРИН
59
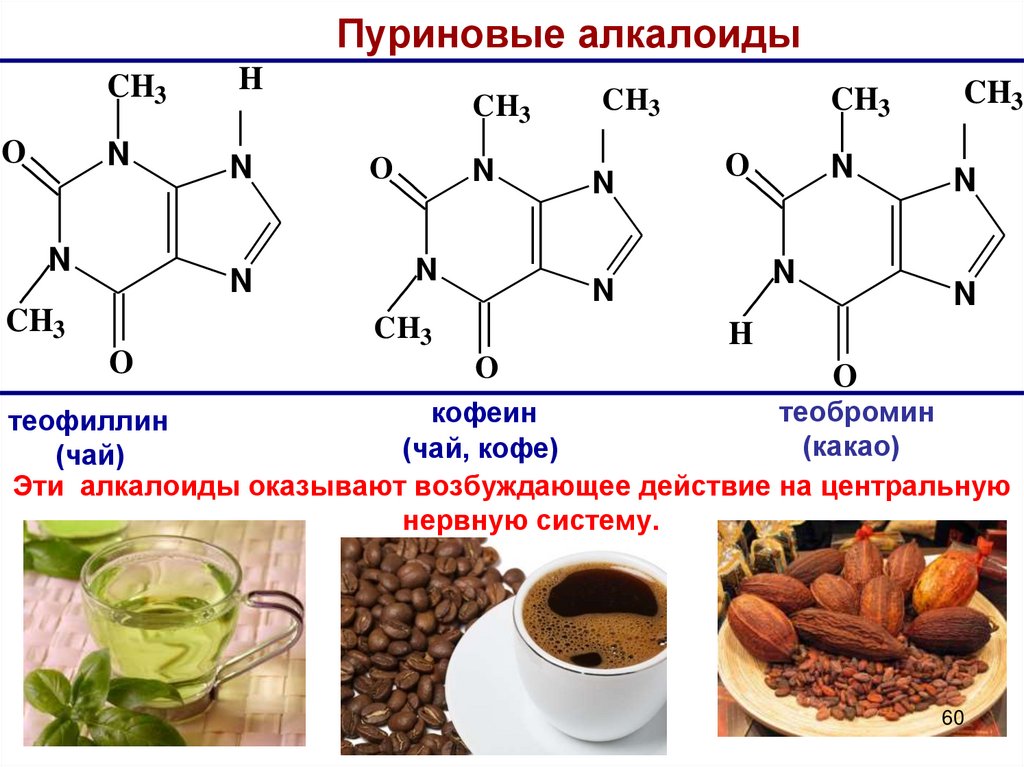
60.
Пуриновые алкалоидыO
CH3
H
N
N
N
N
CH3
CH3
O
N
N
N
O
N
N
N
CH3
O
CH3
CH3
CH3
N
N
H
O
O
теобромин
кофеин
теофиллин
(какао)
(чай, кофе)
(чай)
Эти алкалоиды оказывают возбуждающее действие на центральную
нервную систему.
60
61.
Нуклеотиды.Нуклеиновые кислоты.
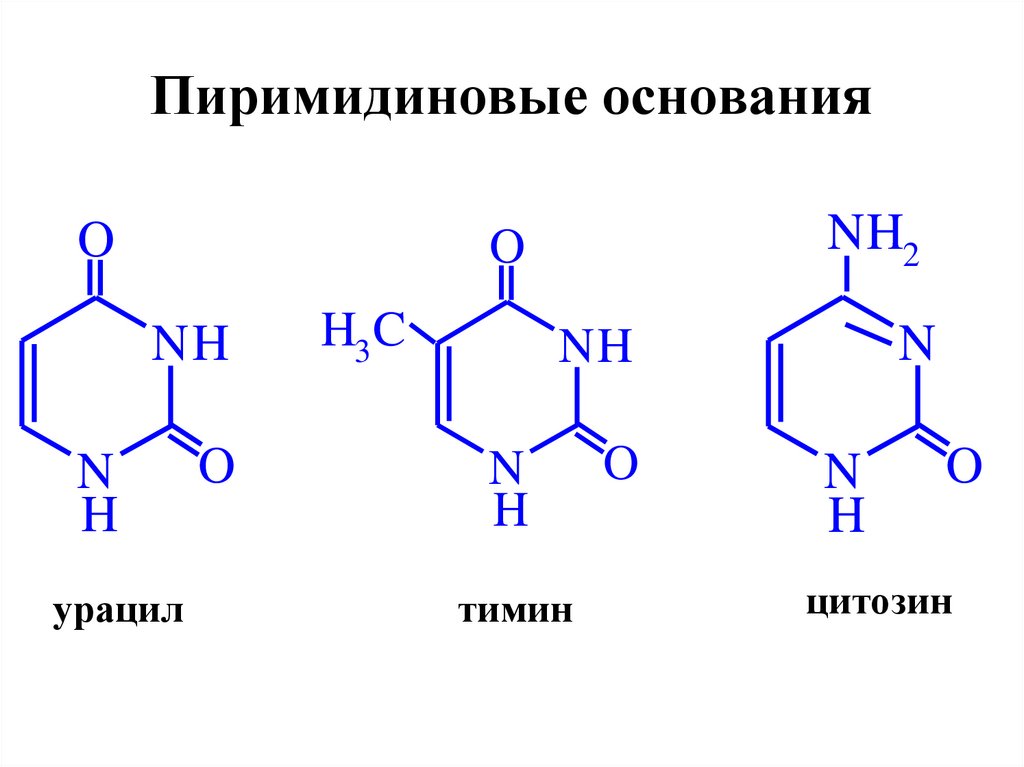
62. Пиримидиновые основания
ONH2
O
NH
N
H
урацил
O
H3 C
N
NH
N
H
тимин
O
N
H
O
цитозин
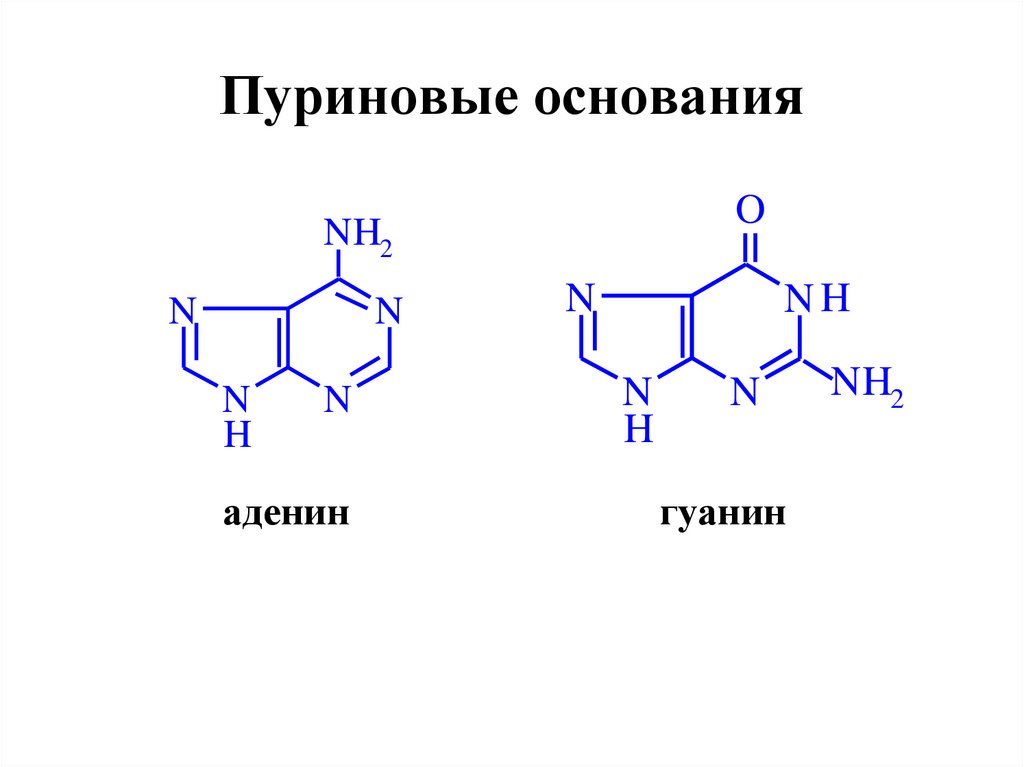
63. Пуриновые основания
ONH2
N
N
N
H
N
аденин
N
NH
N
H
N
гуанин
NH2
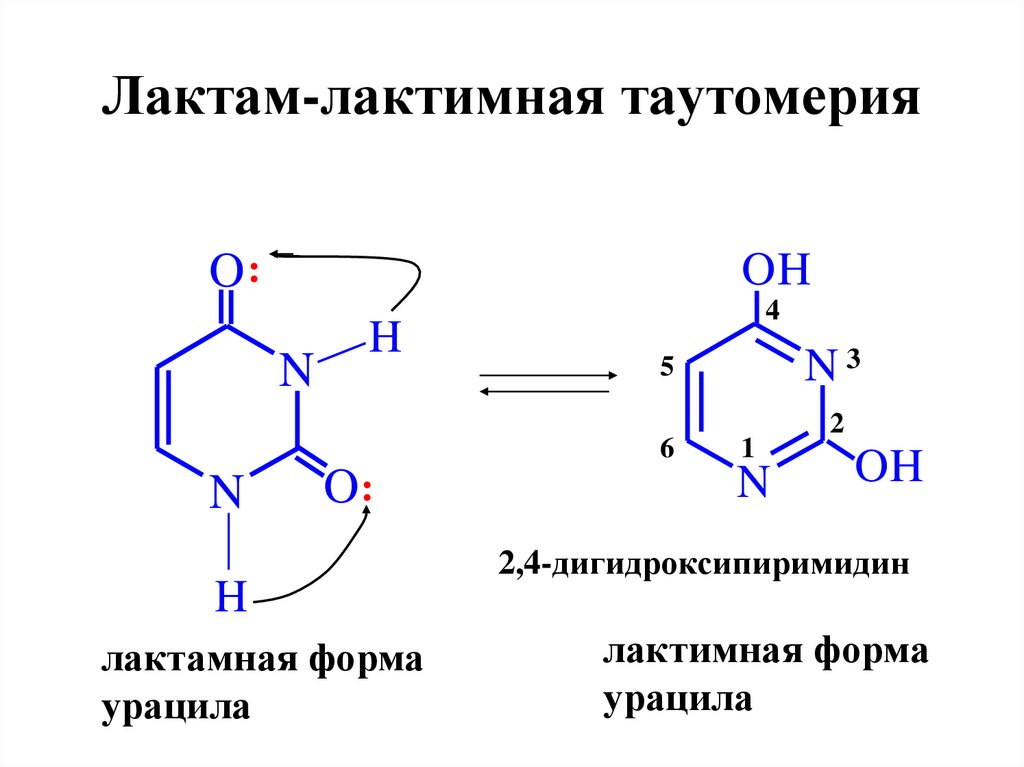
64. Лактам-лактимная таутомерия
OHO:
N
H
4
6
N
O:
H
лактамная форма
урацила
N3
5
1
N
2
OH
2,4-дигидроксипиримидин
лактимная форма
урацила
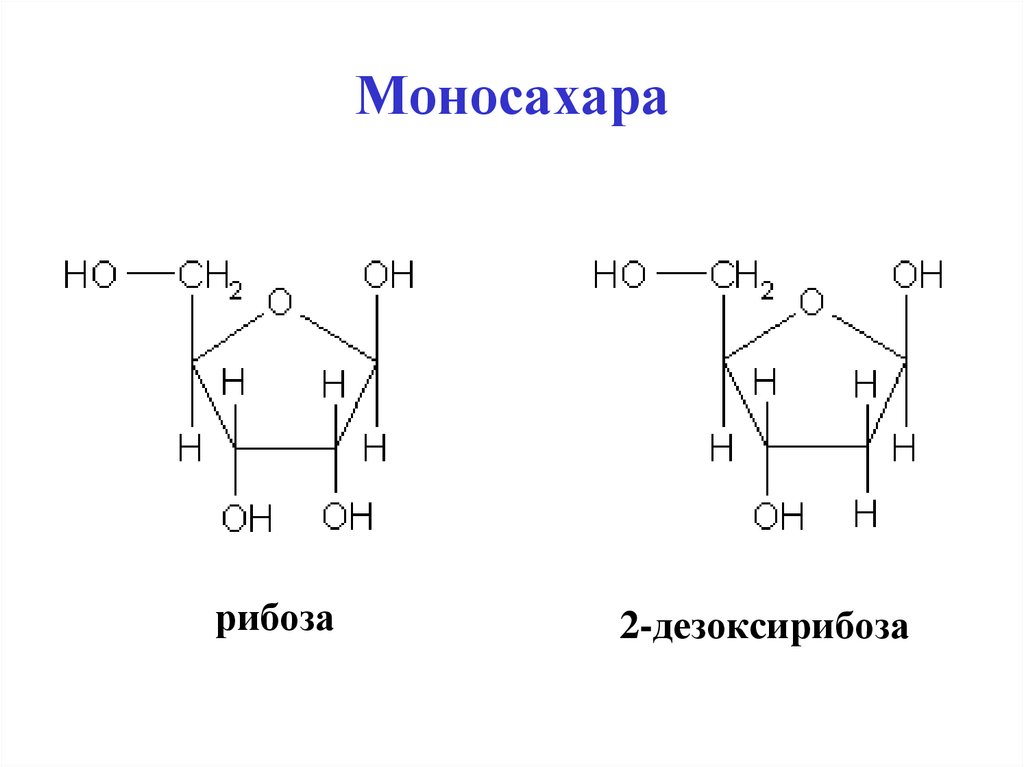
65. Моносахара
рибоза2-дезоксирибоза
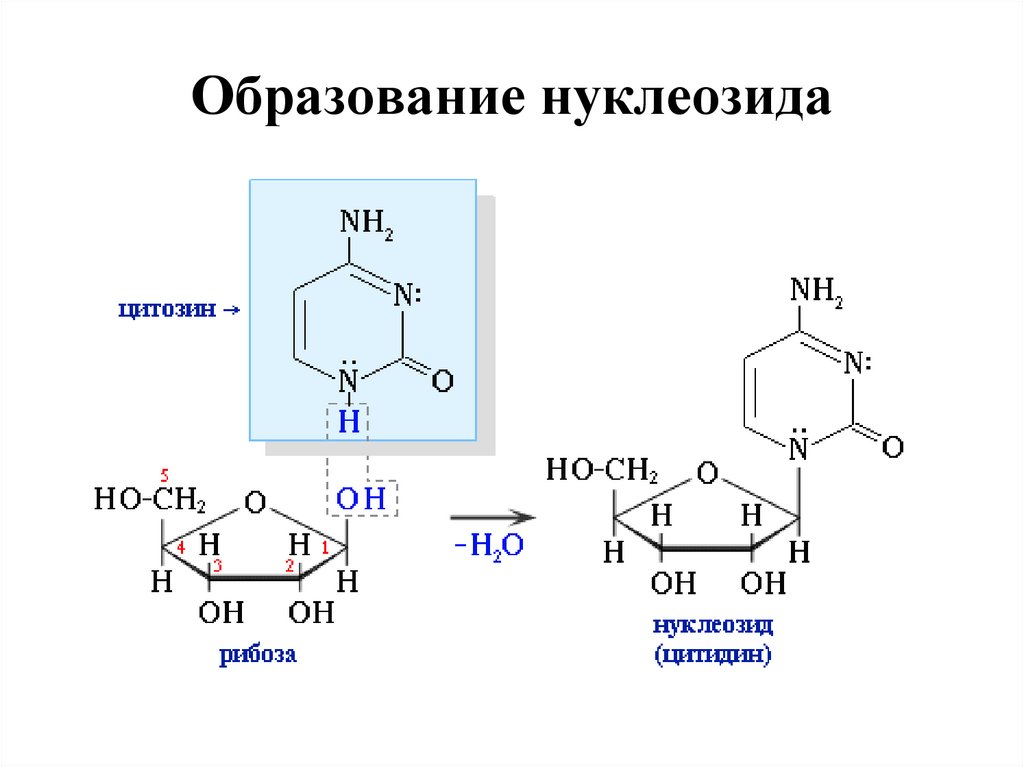
66. Образование нуклеозида
67.
Нуклеотиды –сложные эфиры нуклеозидов и фосфорной кислоты
O
O
NH
5'
N
HO-CH2
1'
4'
3'
OH
HO
H3PO4
O
2'
OH
уридин
3N H
6 1 2
5
O
HO
5'
N
P-O-CH2
O
4
O
1'
4'
3'
OH
2'
OH
уридин-5ʹ-фосфат
или
5ʹ-уридиловая кислота
O
68.
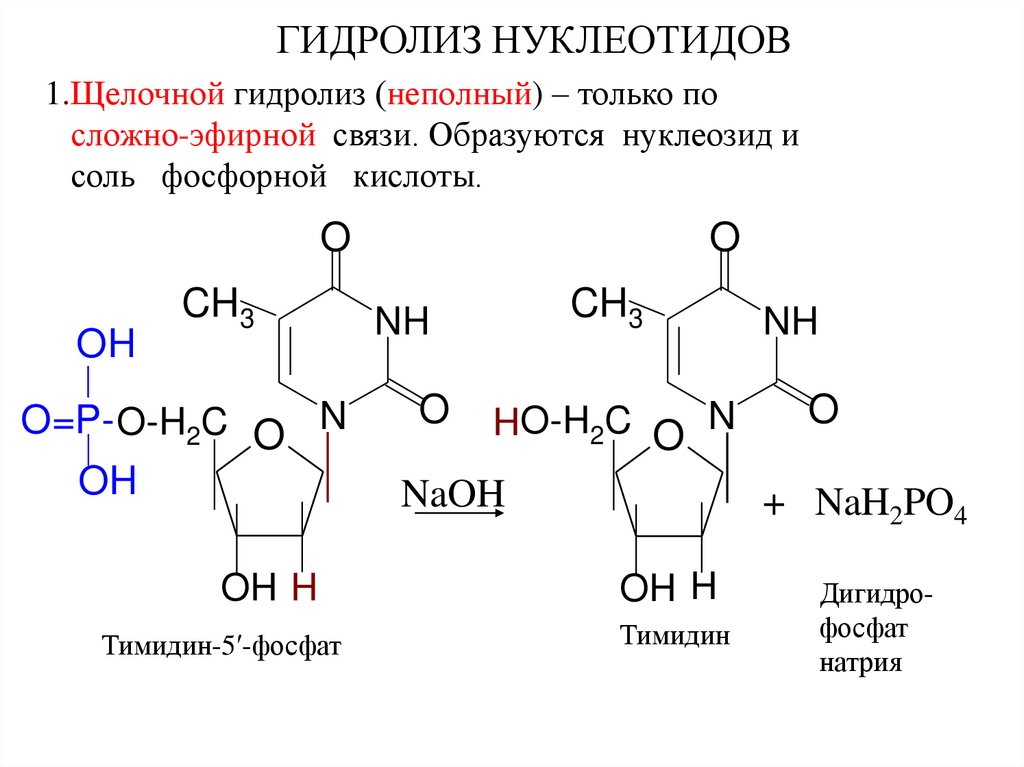
ГИДРОЛИЗ НУКЛЕОТИДОВ1.Щелочной гидролиз (неполный) – только по
сложно-эфирной связи. Образуются нуклеозид и
соль фосфорной кислоты.
O
OH
CH3
O=P- O-H2C O N
OH
OH H
Тимидин-5ʹ-фосфат
O
CH3
NH
O
HO-H2C O N
NaOH
NH
O
+ NaH2PO4
OH H
Тимидин
Дигидрофосфат
натрия
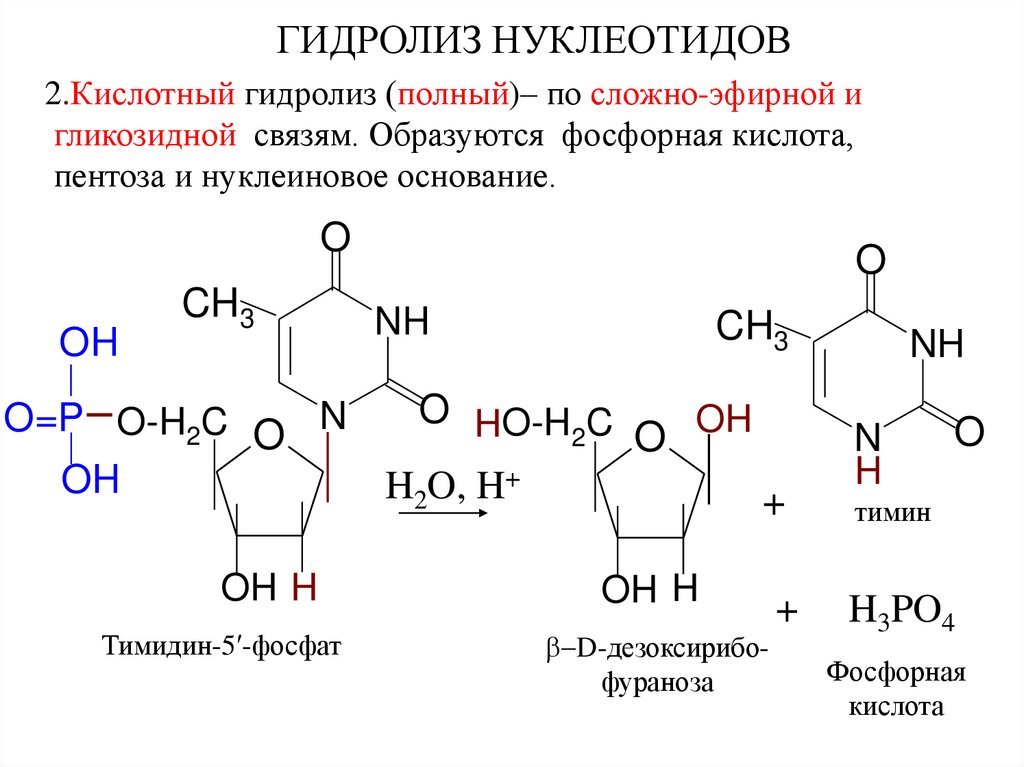
69.
ГИДРОЛИЗ НУКЛЕОТИДОВ2.Кислотный гидролиз (полный)– по сложно-эфирной и
гликозидной связям. Образуются фосфорная кислота,
пентоза и нуклеиновое основание.
O
OH
CH3
O
NH
CH3
O HO-H C
O=P O-H2C O N
2
O OH
OH
H2O, H+
+
OH H
Тимидин-5ʹ-фосфат
OH H
b D-дезоксирибофураноза
+
NH
N
H
O
тимин
H3PO4
Фосфорная
кислота
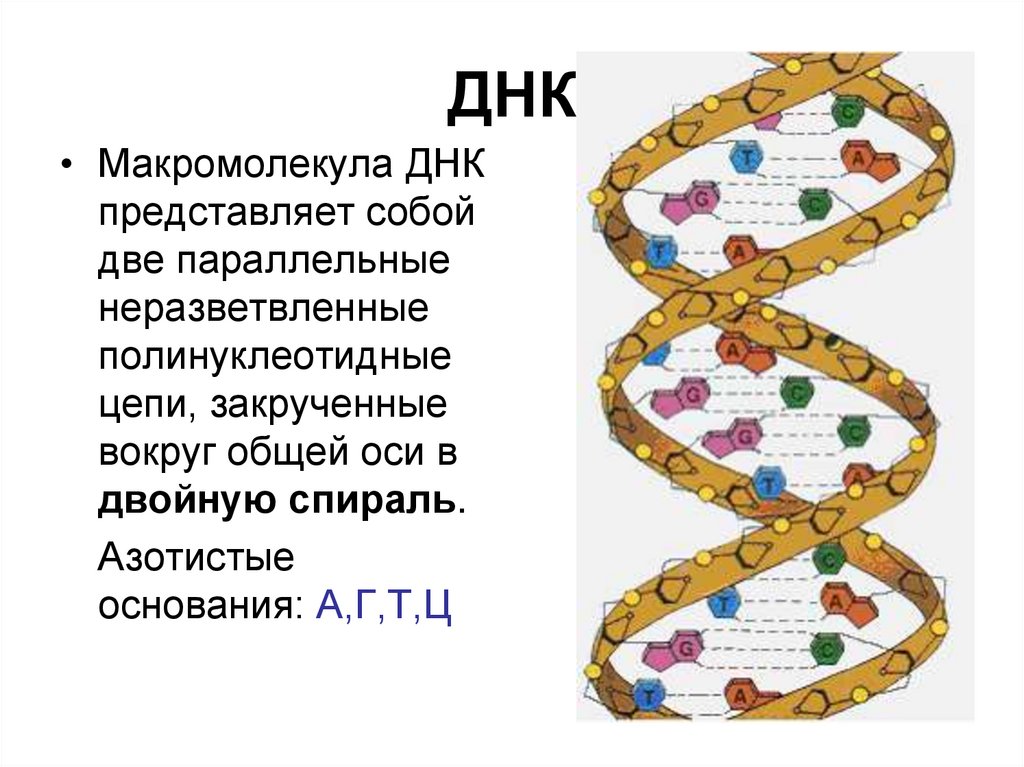
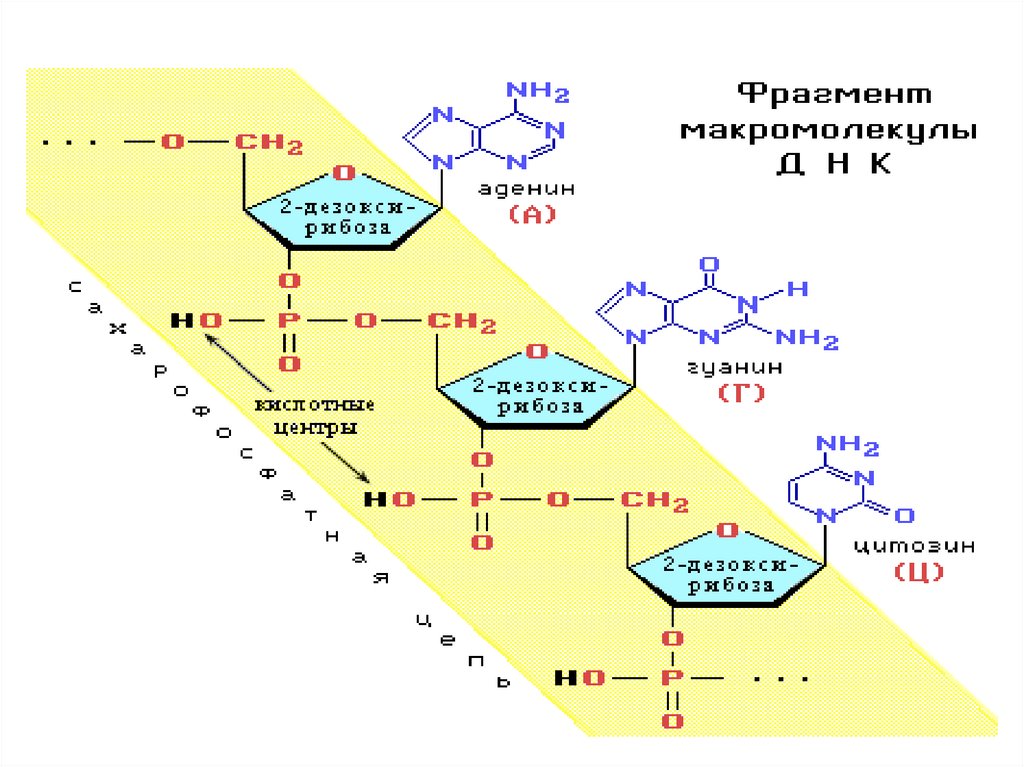
70. ДНК
• Макромолекула ДНКпредставляет собой
две параллельные
неразветвленные
полинуклеотидные
цепи, закрученные
вокруг общей оси в
двойную спираль.
Азотистые
основания: А,Г,Т,Ц
71.
72.
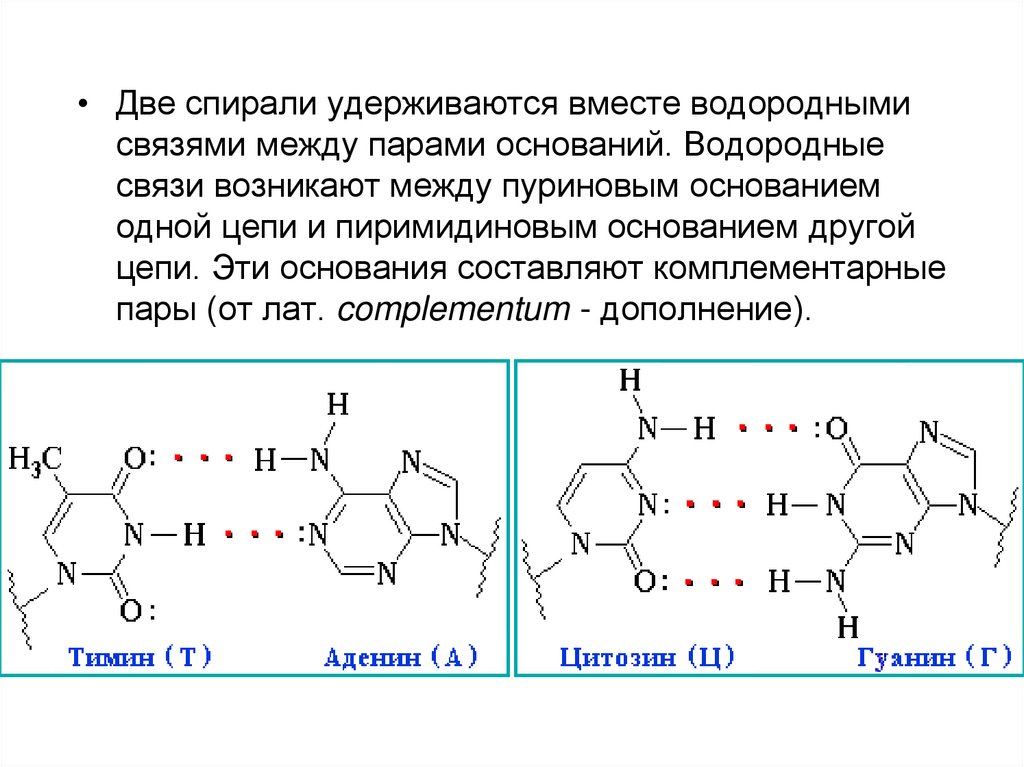
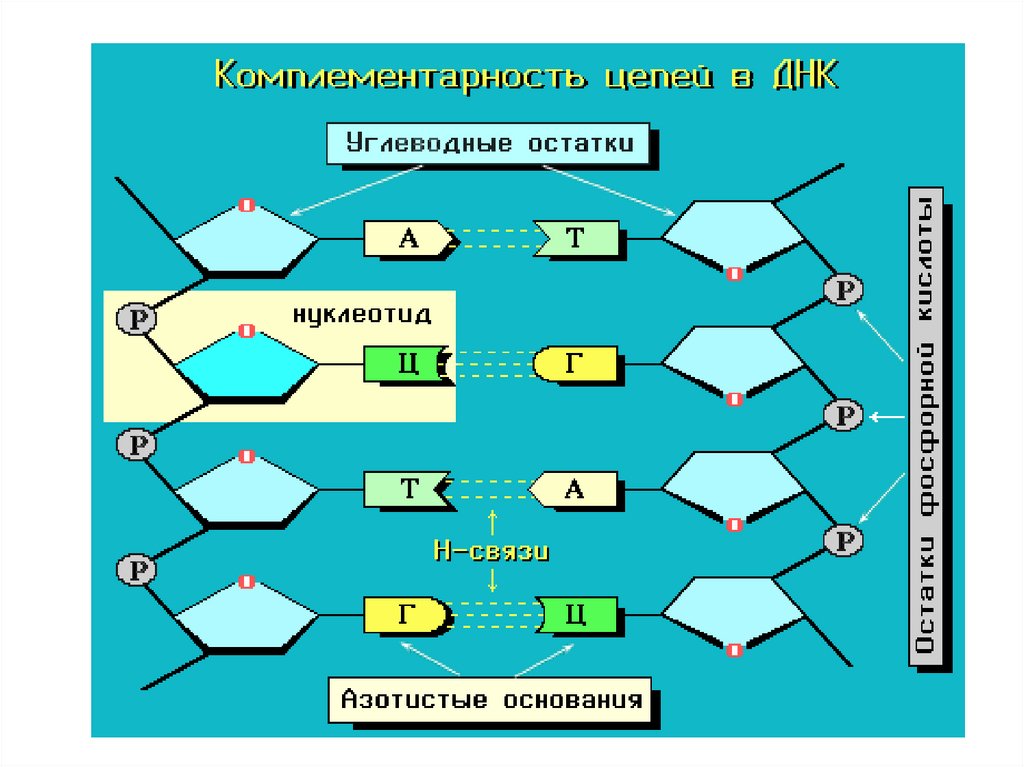
• Две спирали удерживаются вместе водороднымисвязями между парами оснований. Водородные
связи возникают между пуриновым основанием
одной цепи и пиримидиновым основанием другой
цепи. Эти основания составляют комплементарные
пары (от лат. complementum - дополнение).
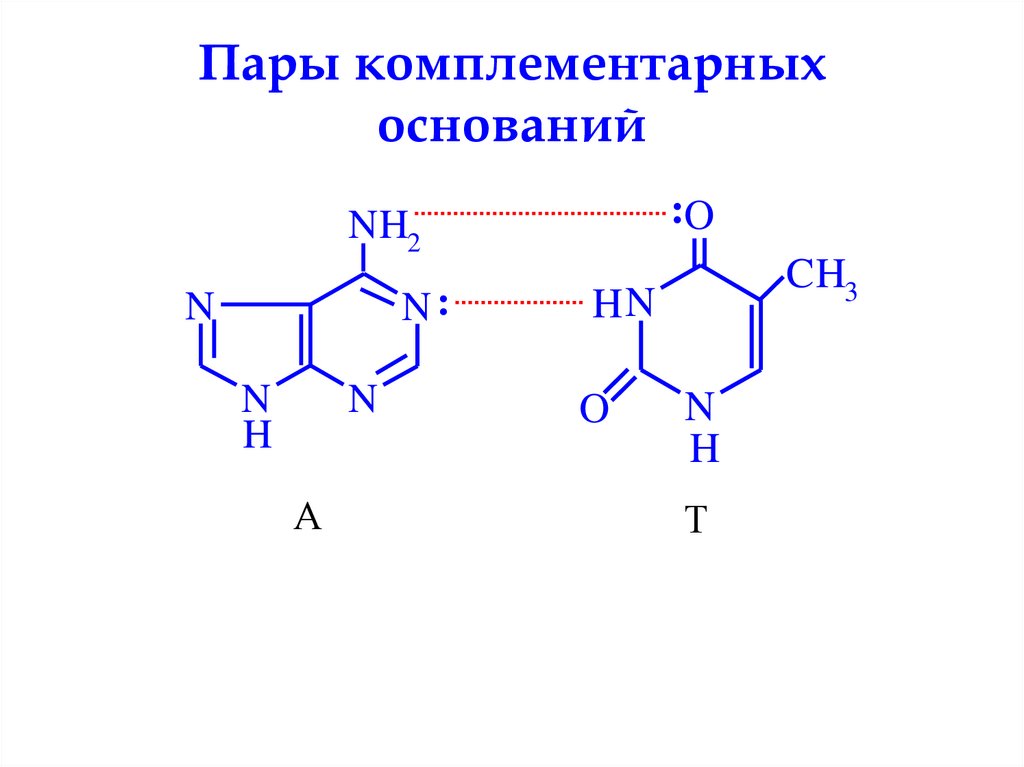
73. Пары комплементарных оснований
:ONH2
N:
N
N
H
N
А
CH3
HN
O
N
H
Т
74. Пары комплементарных оснований
H2 NO:
N
:N
NH
N
H
N
Г
NH2
:O
N
H
Ц
75.
76. РНК
• молекулы РНК состоят из однойполинуклеотидной цепи.
• Азотистые основания: А,Г,У,Ц
Пары комплементарных оснований
А –У
Г-Ц
77.
Виды РНК1. Транспортная (т-РНК) (10% всей РНК клетки)
Функция: перенос аминокислоты к месту синтеза
белка
2. Рибосомная РНК (р-РНК) (90% всей РНК клетки)
Функция: входят в состав рибосомы, синтез белка
3. Информационная, или матричная РНК (м-РНК)
(0.5-1% всей РНК клетки)
Функция: перенос информации о структуре белка от
ДНК к месту синтеза белка
78.
Контрольные вопросы:1. Назовите пятичленные гетероциклы с одним
гетероатомом.
2. Назовите пятичленные гетероциклы с двумя
гетероатомами
3. Назовите
шестичленные
ароматические
гетероциклы
4. Назовите пуриновые и пиримидиновые основания
5. Назовите виды РНК














 biology
biology chemistry
chemistry








