Similar presentations:
Гетероциклические соединения
1.
2.
3.
4.
5.
6.
7.
8.
9. Гетероциклические соединения
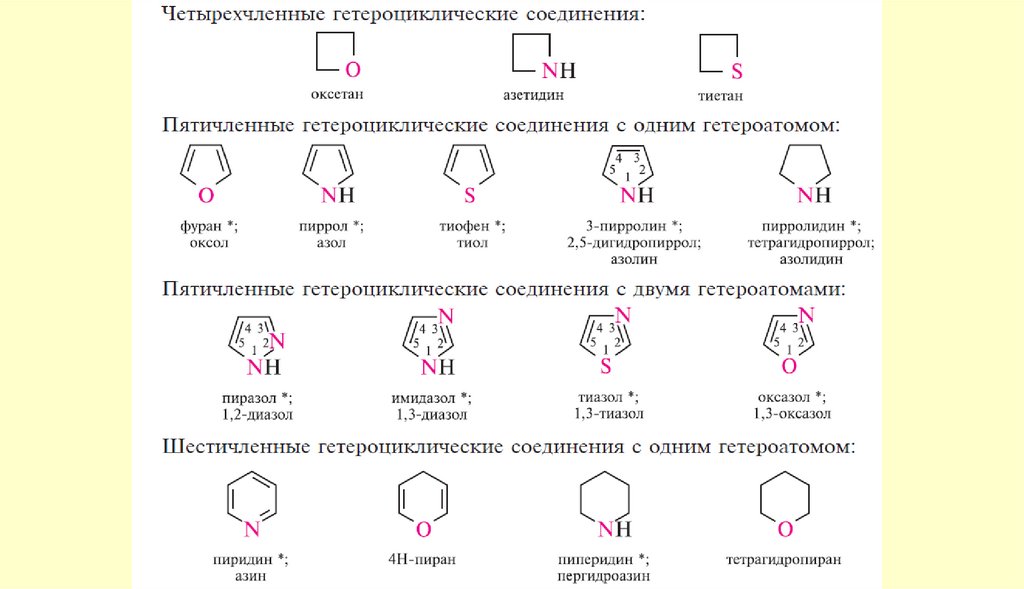
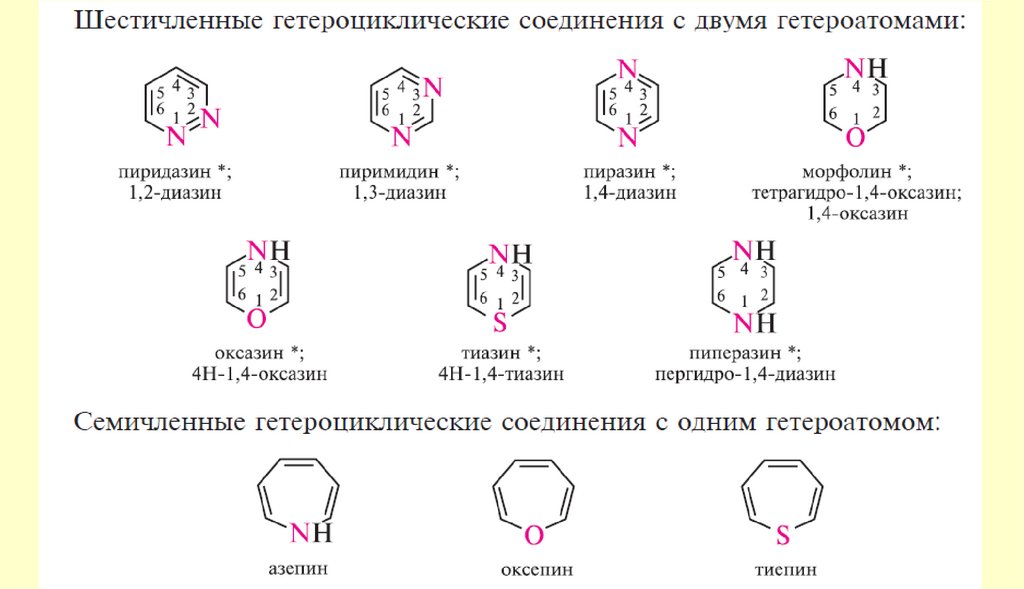
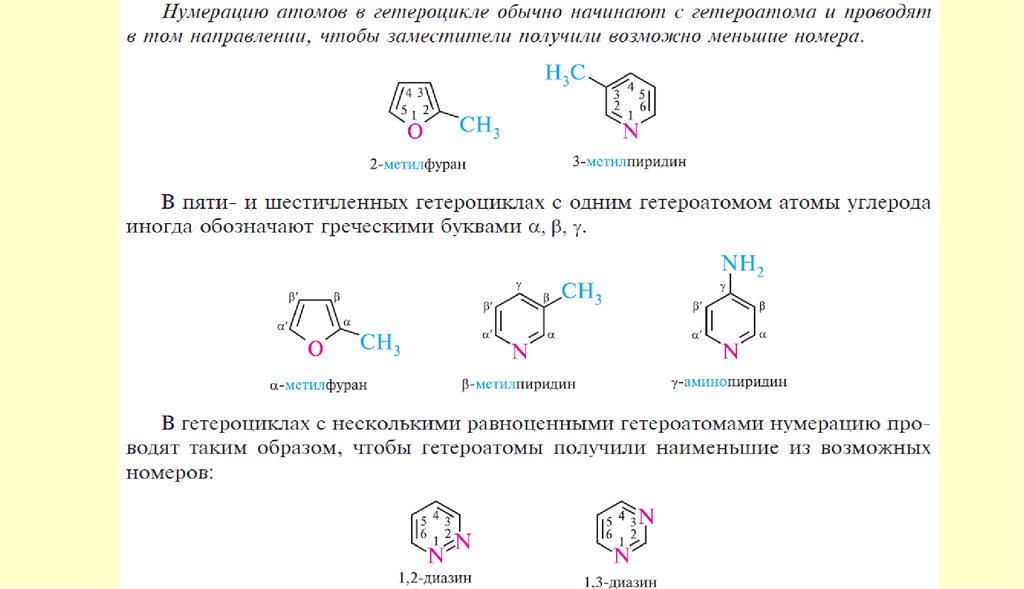
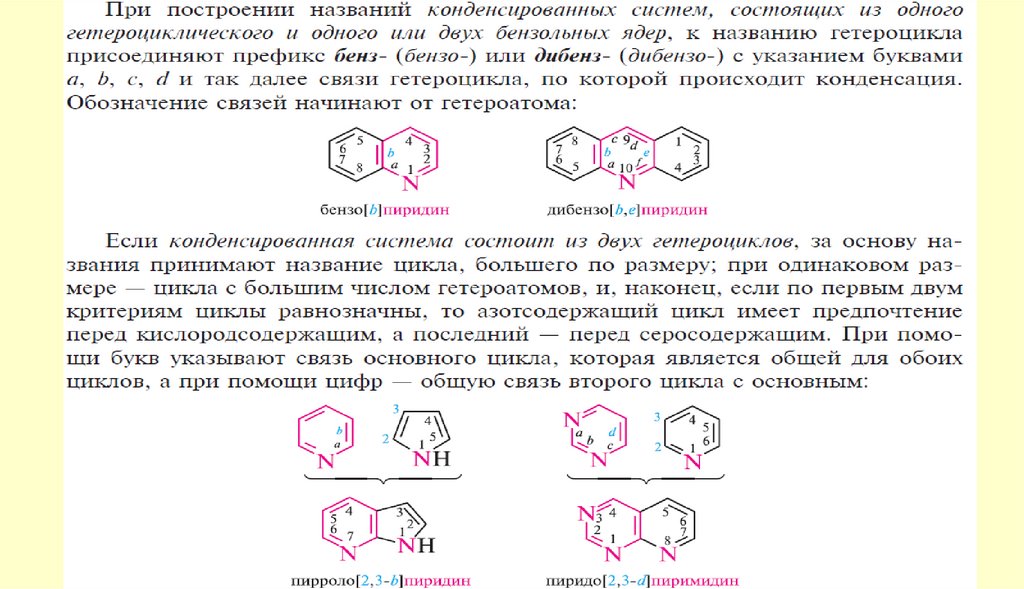
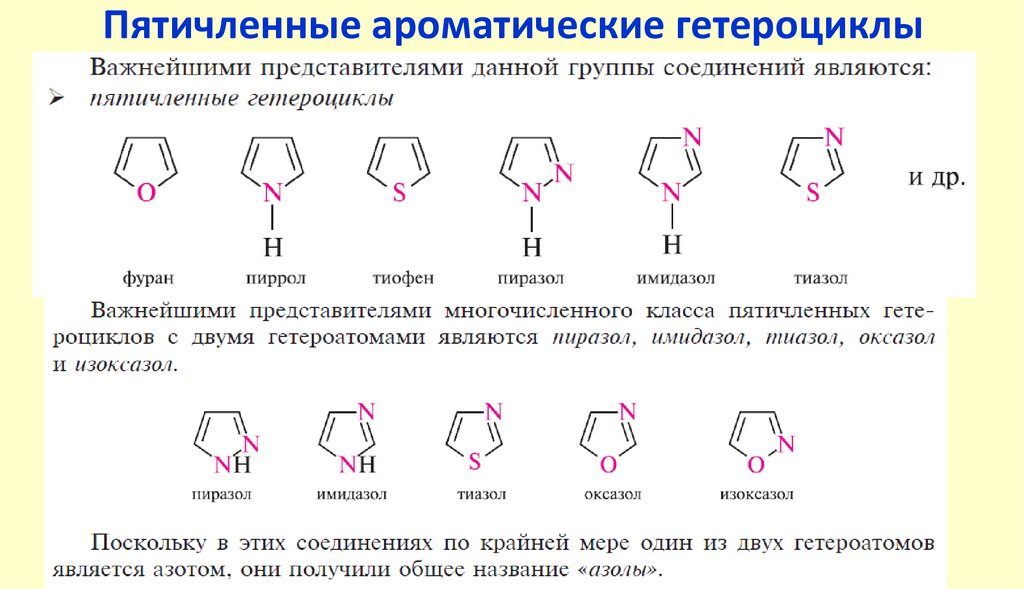
Пятичленные ароматические гетероциклыГетероциклические
соединения
10.
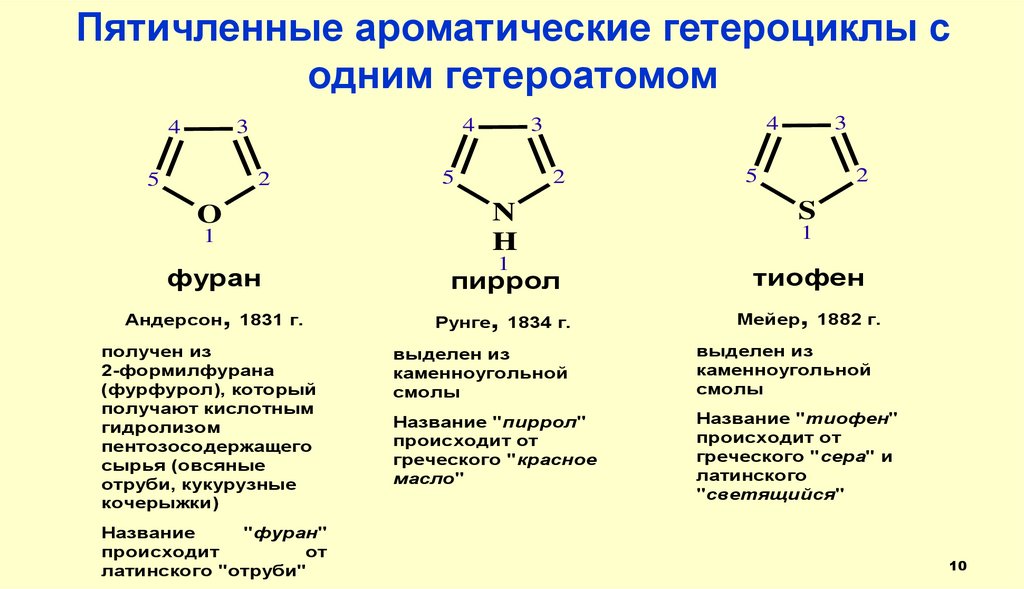
Пятичленные ароматические гетероциклы содним гетероатомом
2
5
2
5
3
4
3
4
3
4
2
5
N
H
S
фуран
1
пиррол
тиофен
Андерсон, 1831 г.
Рунге, 1834 г.
Мейер, 1882 г.
O
1
получен из
2-формилфурана
(фурфурол), который
получают кислотным
гидролизом
пентозосодержащего
сырья (овсяные
отруби, кукурузные
кочерыжки)
Название
"фуран"
происходит
от
латинского "отруби"
1
выделен из
каменноугольной
смолы
выделен из
каменноугольной
смолы
Название "пиррол"
происходит от
греческого "красное
масло"
Название "тиофен"
происходит от
греческого "сера" и
латинского
"светящийся"
10
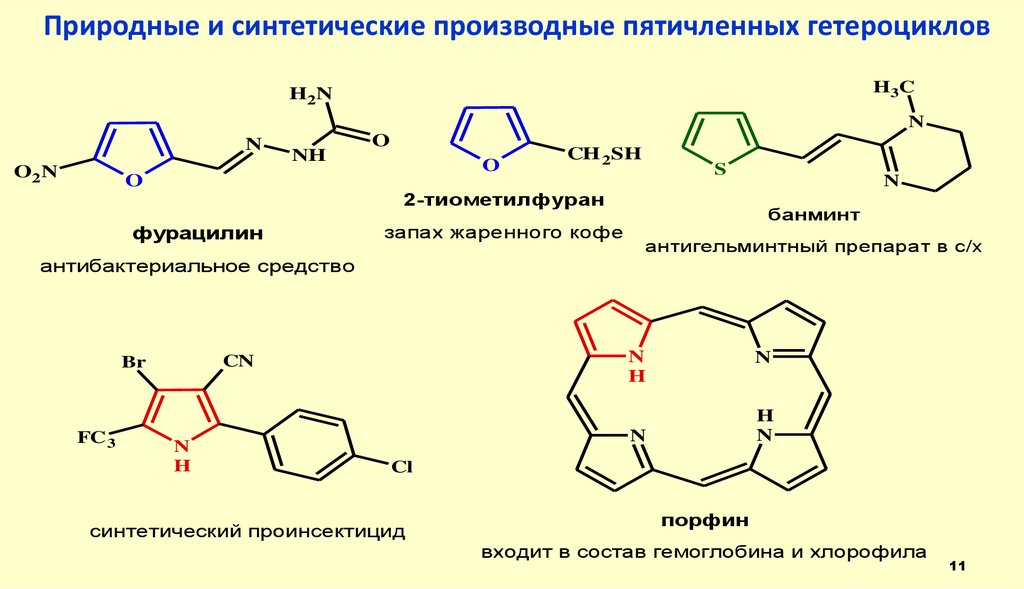
11. Природные и синтетические производные пятичленных гетероциклов
H 3CH2N
N
N
O2N
NH
O
O
O
CH 2SH
S
2-тиометилфуран
фурацилин
запах жаренного кофе
N
банминт
антигельминтный препарат в с/х
антибактериальное средство
FC 3
N
H
CN
Br
N
H
N
H
N
N
Cl
синтетический проинсектицид
порфин
входит в состав гемоглобина и хлорофила
11
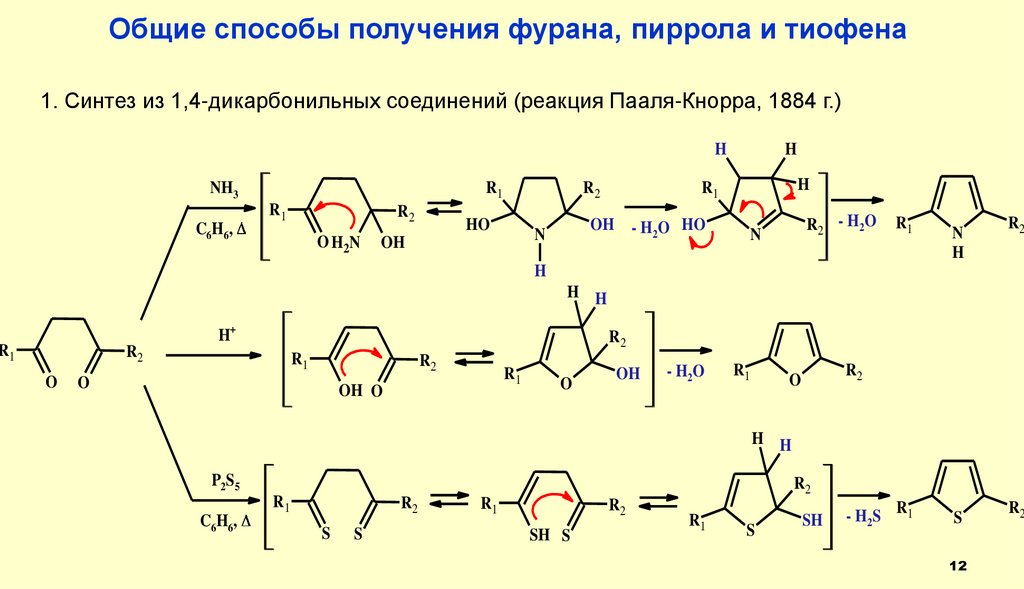
12.
Общие способы получения фурана, пиррола и тиофена1. Синтез из 1,4-дикарбонильных соединений (реакция Пааля-Кнорра, 1884 г.)
H
R1
NH3
C6H6,
R1
R2
O H 2N
R2
HO
OH
H
R1
OH
N
H
- H 2 O HO
R 2 - H2 O
N
R1
N
H
R2
H
H H
H+
R1
R2
R2
O
R1
R2
O
R1
OH O
O
OH
- H2 O
R1
R2
O
H H
P2S5
C6H6,
R2
R1
R2
S
S
R1
R2
SH S
R1
S
SH
- H2 S R 1
S
12
R2
13.
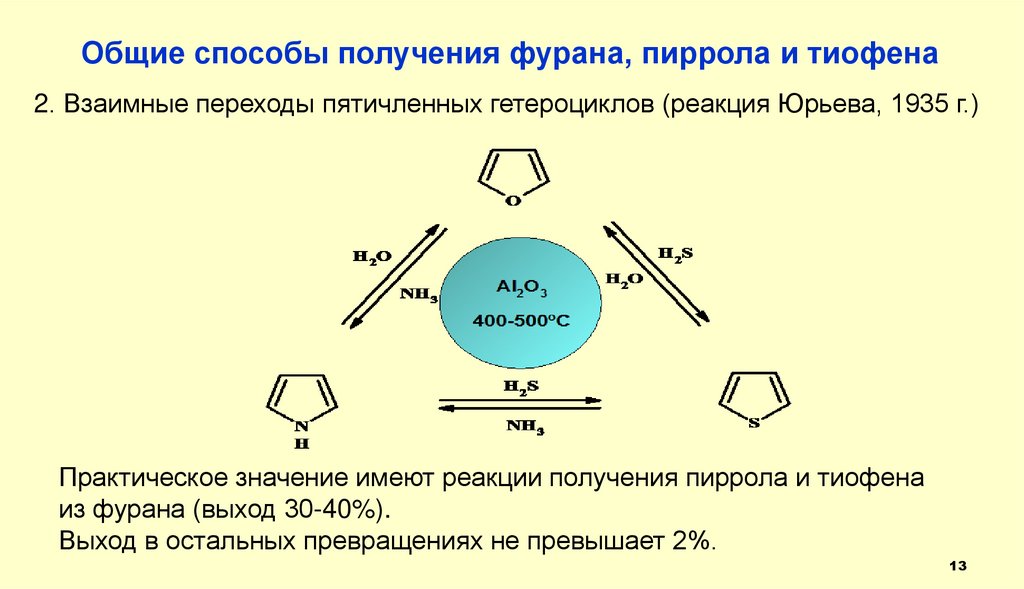
Общие способы получения фурана, пиррола и тиофена2. Взаимные переходы пятичленных гетероциклов (реакция Юрьева, 1935 г.)
Практическое значение имеют реакции получения пиррола и тиофена
из фурана (выход 30-40%).
Выход в остальных превращениях не превышает 2%.
13
14.
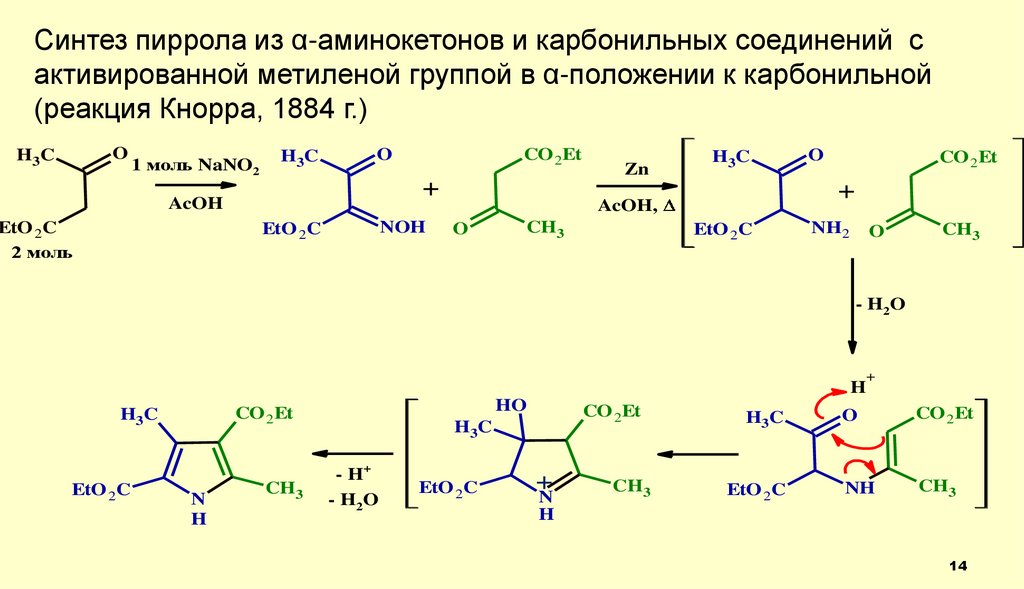
Синтез пиррола из α-аминокетонов и карбонильных соединений сактивированной метиленой группой в α-положении к карбонильной
(реакция Кнорра, 1884 г.)
O
H3C
1 моль NaNO2
H 3C
O
+
AcOH
EtO 2C
2 моль
CO 2Et
NOH
EtO 2C
Zn
H3C
CH3
CO 2Et
+
AcOH,
O
O
EtO 2C
NH2
O
CH3
- H2 O
H
EtO 2C
HO
CO 2Et
H3C
N
H
CH3
CO 2Et
H 3C
- H+
- H2 O
EtO 2C
+
N
H
CH3
H 3C
EtO 2C
+
O
CO 2Et
NH
CH3
14
15.
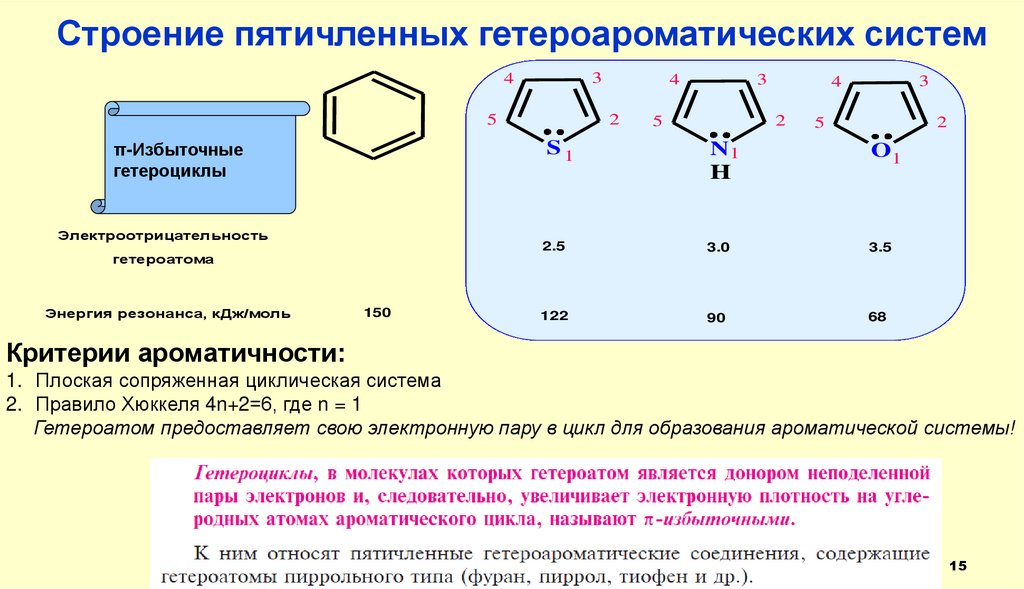
Строение пятичленных гетероароматических систем3
4
2
5
π-Избыточные
гетероциклы
S1
Электроотрицательность
гетероатома
Энергия резонанса, кДж/моль
150
3
4
2
5
3
4
2
5
N1
H
O1
2.5
3.0
3.5
122
90
68
Критерии ароматичности:
1. Плоская сопряженная циклическая система
2. Правило Хюккеля 4n+2=6, где n = 1
Гетероатом предоставляет свою электронную пару в цикл для образования ароматической системы!
15
16.
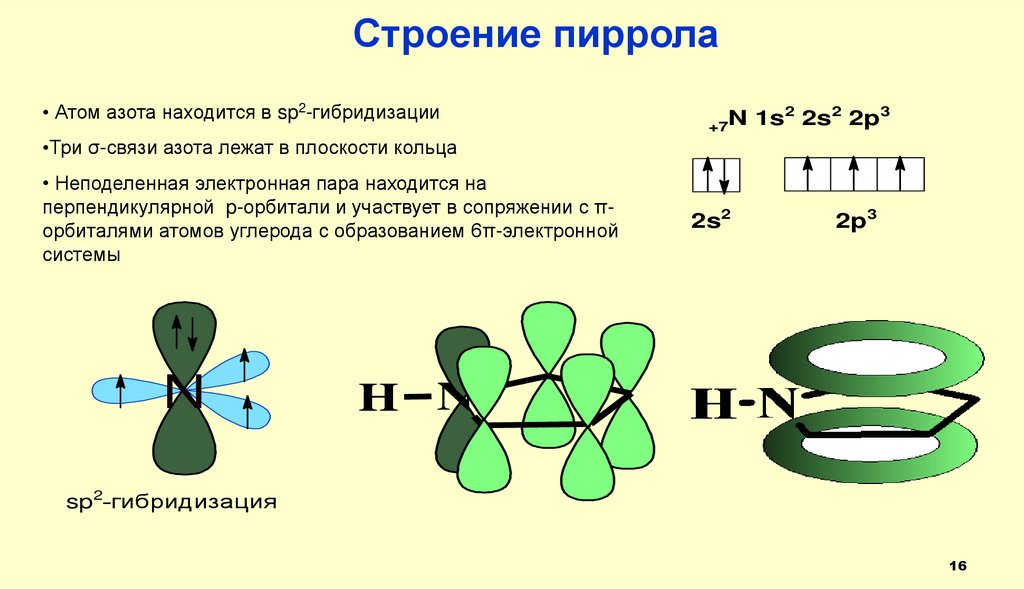
Строение пиррола• Атом азота находится в sp2-гибридизации
2
2
3
N
1s
2s
2p
+7
•Три σ-связи азота лежат в плоскости кольца
• Неподеленная электронная пара находится на
перпендикулярной p-орбитали и участвует в сопряжении с πорбиталями атомов углерода с образованием 6π-электронной
системы
N
2s2
2p3
H N
sp2-гибридизация
16
17.
18.
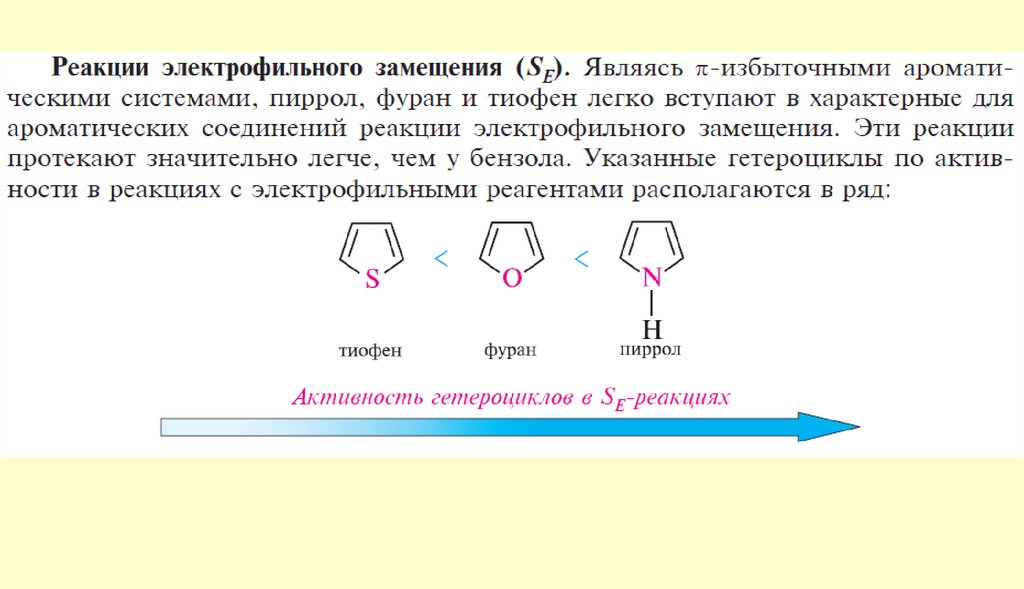
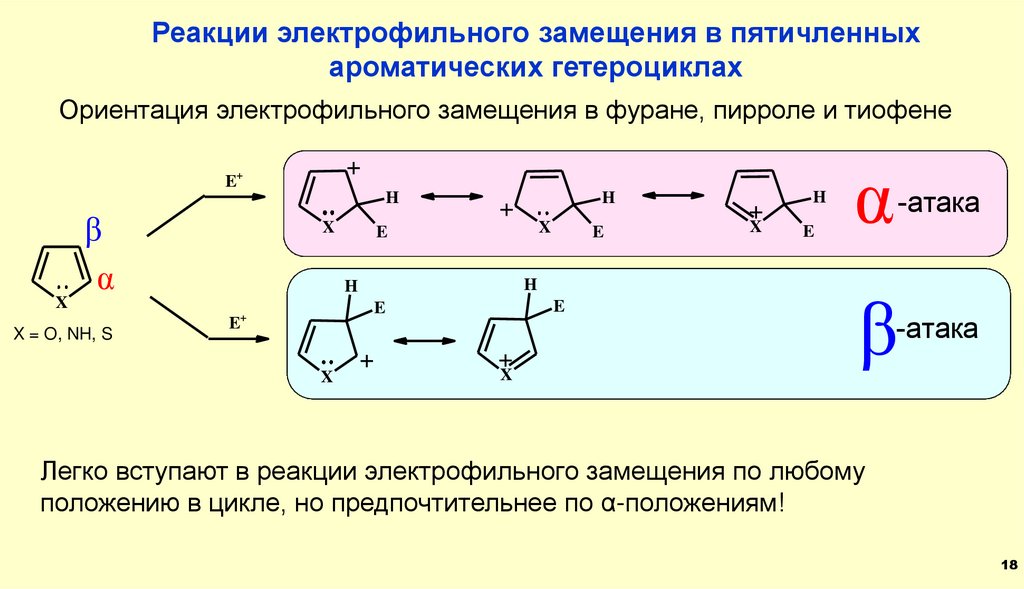
Реакции электрофильного замещения в пятичленныхароматических гетероциклах
Ориентация электрофильного замещения в фуране, пирроле и тиофене
+
E+
H
β
α
X
X = O, NH, S
E
X
E
H
E
E
+
X
E
H
X
H
+
+
+
X
+
X
H
E
α
-атака
β
-атака
Легко вступают в реакции электрофильного замещения по любому
положению в цикле, но предпочтительнее по α-положениям!
18
19.
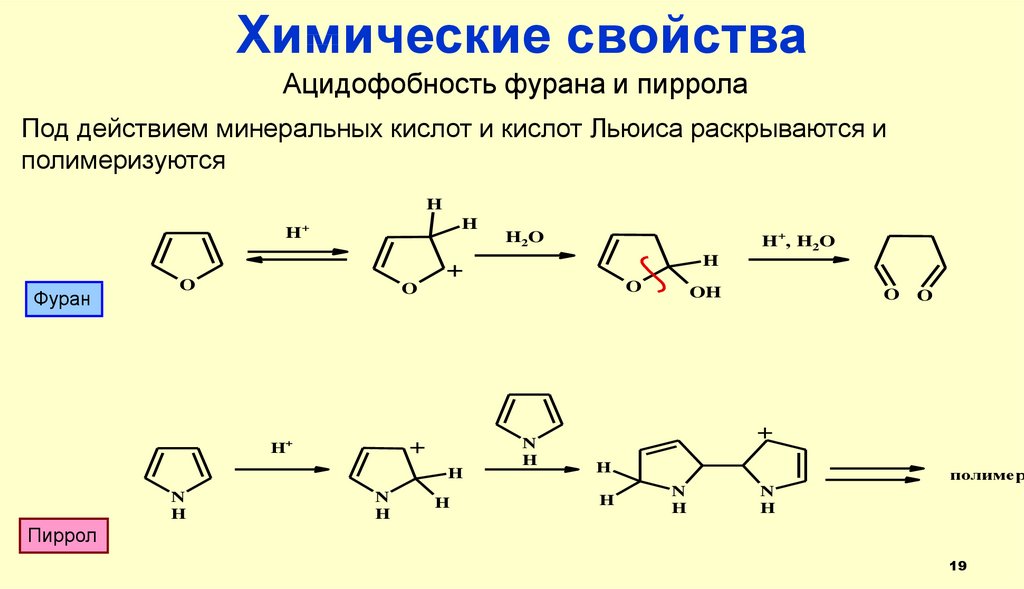
Химические свойстваАцидофобность фурана и пиррола
Под действием минеральных кислот и кислот Льюиса раскрываются и
полимеризуются
H
H
H+
Фуран
H+, H2O
H
+
O
O
O
+
H+
H
N
H
H2O
N
H
H
N
H
OH
O
O
+
H
H
полимер
N
H
N
H
Пиррол
19
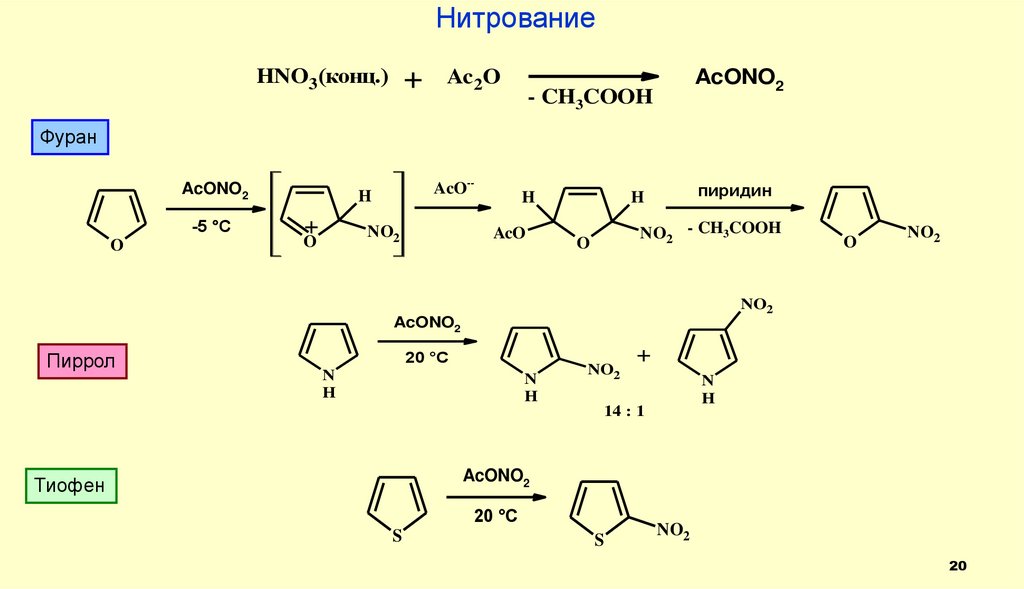
20.
НитрованиеHNO3(конц.)
+
Ac 2O
AcONO2
- CH3COOH
Фуран
AcONO2
-5 °C
O
AcO--
H
+
NO2
O
H
AcO
пиридин
H
NO2 - CH3COOH
O
O
NO2
NO2
AcONO2
Пиррол
20 °C
N
H
N
H
NO2
+
N
H
14 : 1
AcONO2
Тиофен
20 °C
S
S
NO2
20
21.
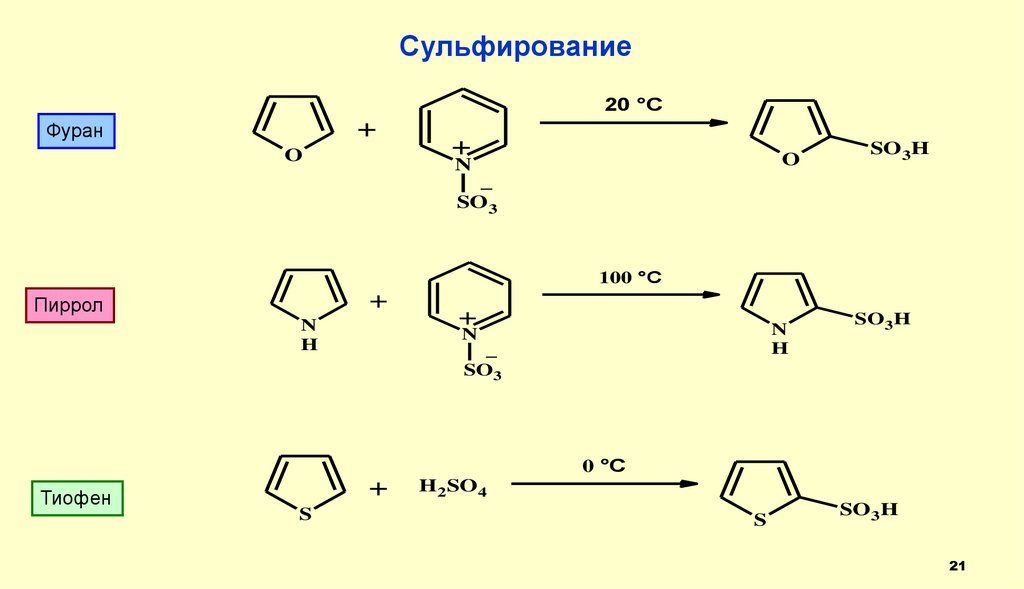
Сульфирование20 °C
+
Фуран
O
+
O
N
SO3H
_
SO3
100 °C
+
Пиррол
N
H
+
N
H
N
_
SO3
SO3H
0 °C
Тиофен
+
S
H2SO 4
S
SO3H
21
22.
ГалогенированиеBr2,
диоксан
Фуран
0 °C
O
Br--
H
+
O
H
Br
Br
H
O
Br
- HBr
Br
N
H
0 °C
Br
Br
Br2, EtOH
NBS
Пиррол
Br
O
Br
N
H
N
H
Br
Br2, Et2O
Тиофен
-10 °C
S
S
Br
22
23.
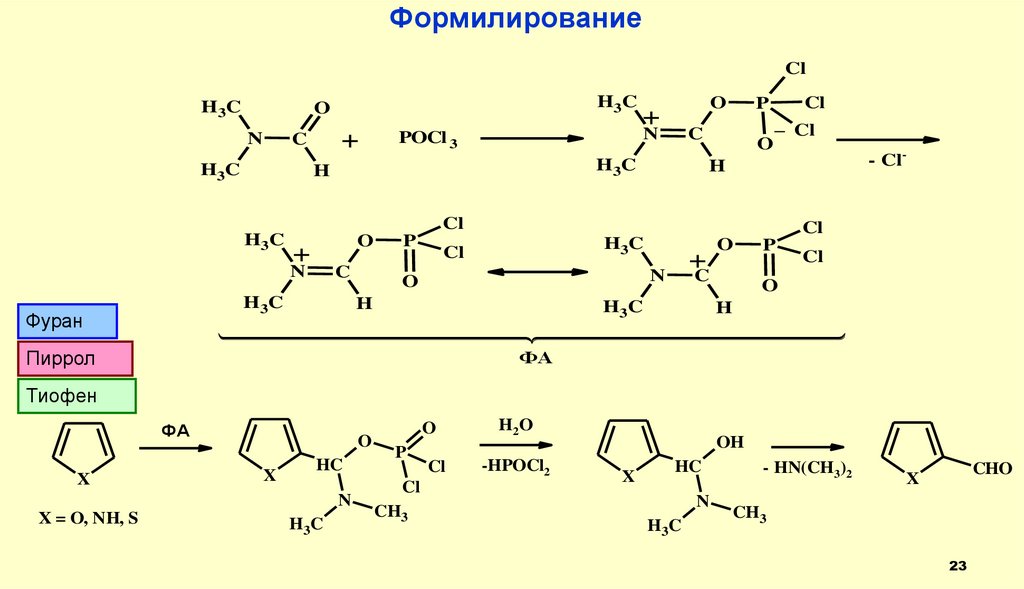
ФормилированиеCl
H3C
H3C
O
N
+
C
H3C
O
+
N
POCl 3
C
H3C
H
Cl
P
O
_ Cl
Cl
H3C
O
+
N
C
H3C
Фуран
P
Cl
H 3C
Cl
+
N
O
H
O
C
H3C
Пиррол
- Cl-
H
P
Cl
O
H
ФА
Тиофен
ФА
X
O
X
HC
N
X = O, NH, S
H3C
O
P
Cl
CH3
Cl
H2O
-HPOCl2
OH
X
HC
N
H3C
- HN(CH3)2
CHO
X
CH3
23
24.
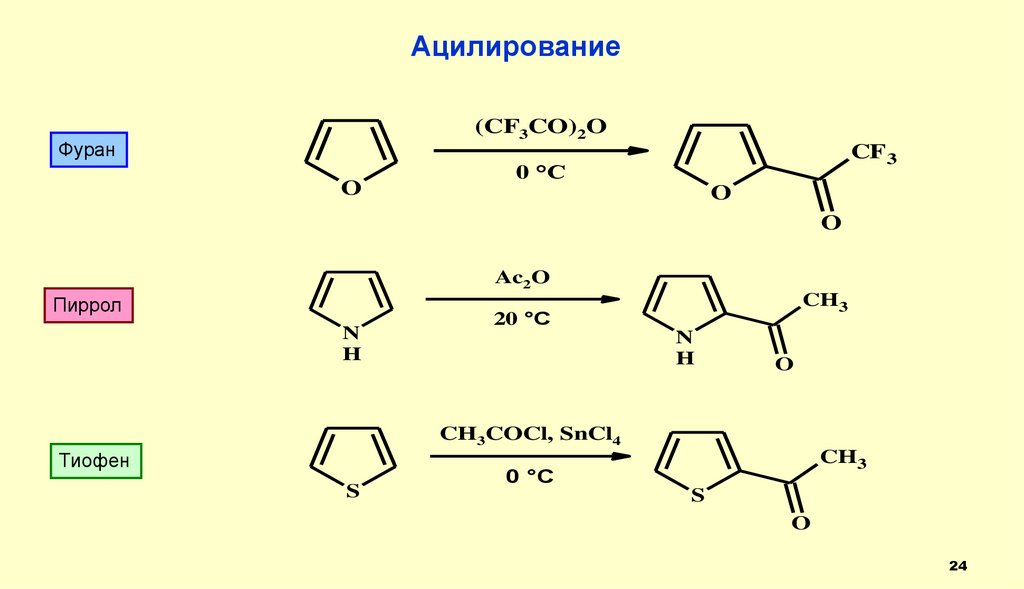
Ацилирование(CF3CO)2O
Фуран
O
CF 3
0 °C
O
O
Ac2O
Пиррол
N
H
CH3
20 °C
N
H
O
CH3COCl, SnCl4
Тиофен
S
CH3
0 °C
S
O
24
25.
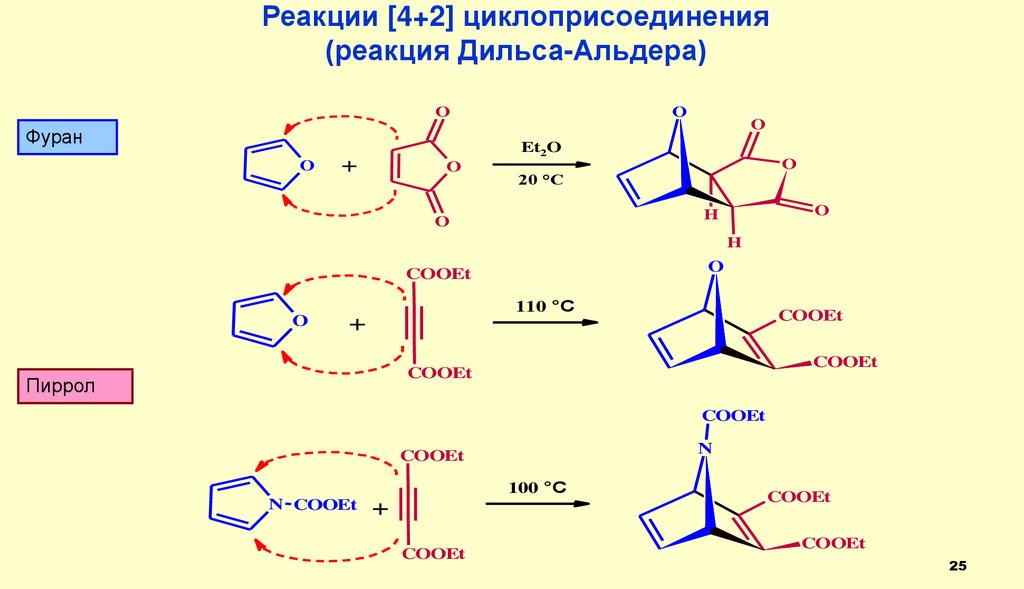
Реакции [4+2] циклоприсоединения(реакция Дильса-Альдера)
O
Фуран
O
O
O
Et2O
+
O
O
20 °C
O
H
O
H
O
COOEt
O
110 °C
+
COOEt
COOEt
COOEt
Пиррол
COOEt
N
COOEt
100 °C
N COOEt
+
COOEt
COOEt
COOEt
25
26.
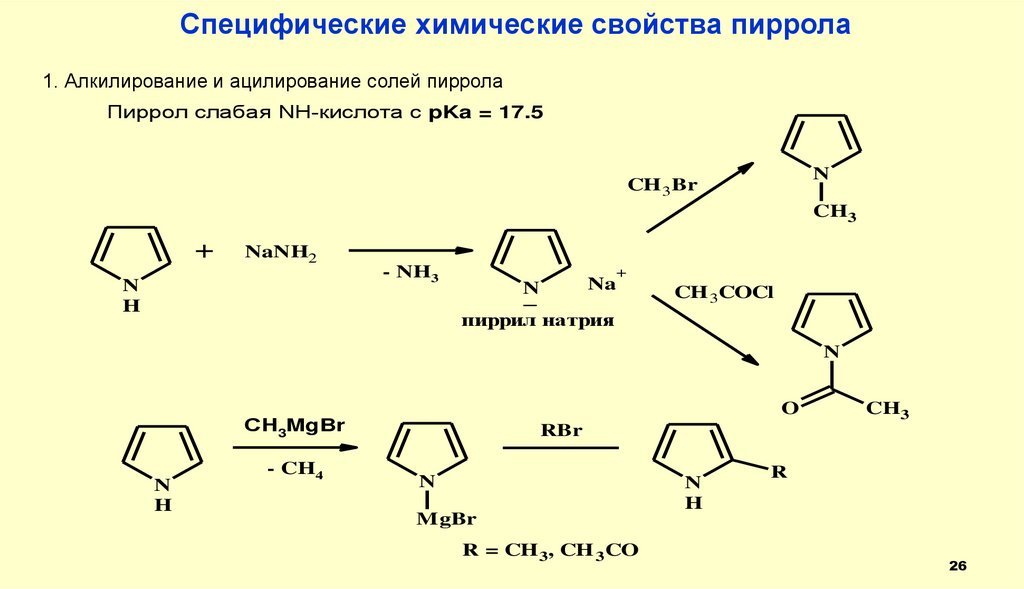
Специфические химические свойства пиррола1. Алкилирование и ацилирование солей пиррола
Пиррол слабая NH-кислота с pKa = 17.5
N
CH 3Br
CH3
+
NaNH2
N
H
- NH3
+
Na
N
_
CH 3COCl
пиррил натрия
N
O
СH3MgBr
N
H
- CH4
CH3
RBr
N
N
H
R
MgBr
R = CH 3, CH 3CO
26
27.
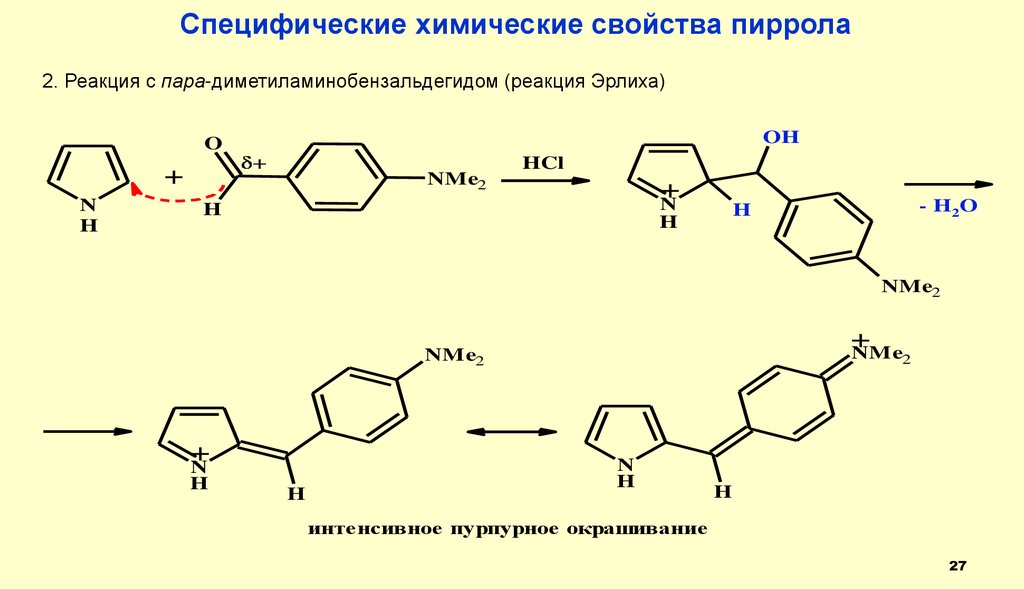
Специфические химические свойства пиррола2. Реакция с пара-диметиламинобензальдегидом (реакция Эрлиха)
OH
O
+
N
H
NMe2
HCl
+
N
H
- H2 O
H
H
NMe2
+
NMe
NMe2
+
N
H
H
2
N
H
H
интенсивное пурпурное окрашивание
27
28.
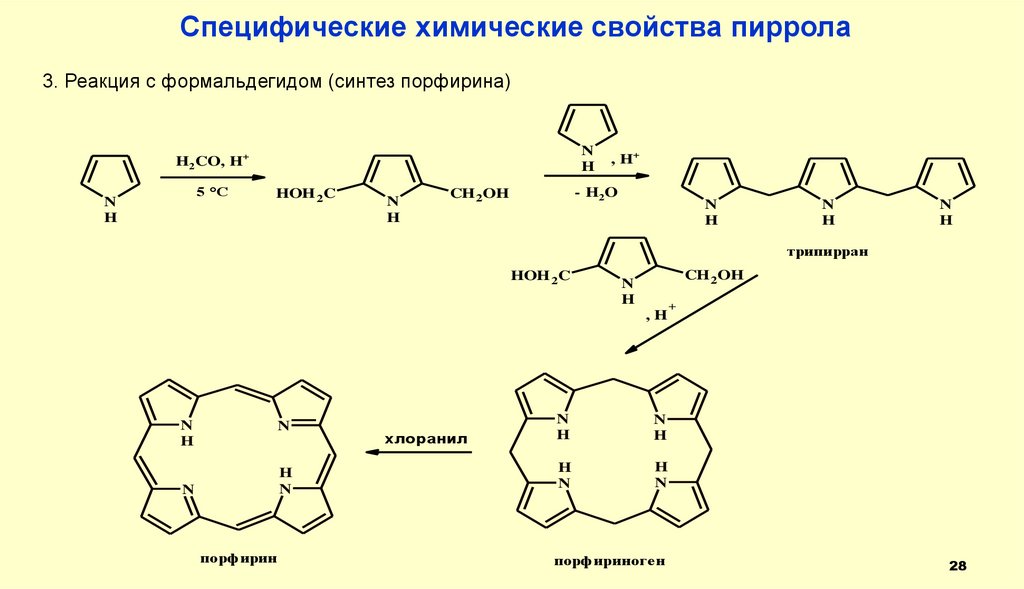
Специфические химические свойства пиррола3. Реакция с формальдегидом (синтез порфирина)
N
H
H2CO, H+
5 °C
N
H
HOH 2C
N
H
, H+
- H2 O
CH 2OH
N
H
N
H
N
H
трипирран
HOH 2C
CH 2OH
N
H
,H
N
H
N
H
N
N
порфирин
хлоранил
N
H
N
H
H
N
H
N
порфириноген
+
28
29.
43
5
2
6
N1
H
7
индол
1866 г.
выделен из продуктов химического расщепления красителя индиго
Название "индол" происходит от слова Индия, откуда с 16 века
импортировался синий краситель индиго
29
30.
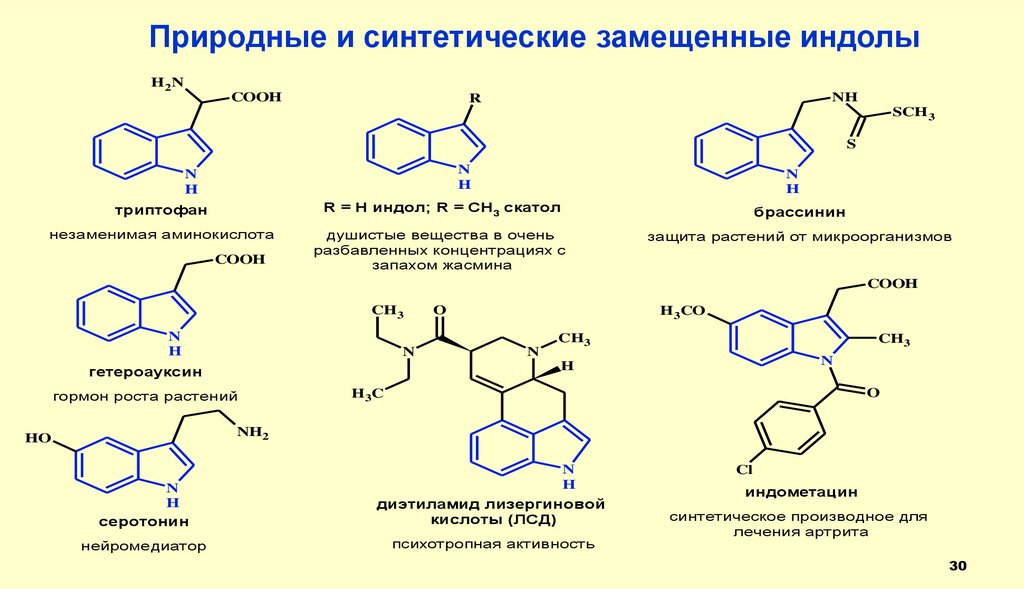
Природные и синтетические замещенные индолыH2N
COOH
NH
R
SCH 3
S
N
H
N
H
N
H
триптофан
R = H индол; R = CH3 скатол
брассинин
незаменимая аминокислота
душистые вещества в очень
разбавленных концентрациях с
запахом жасмина
защита растений от микроорганизмов
COOH
COOH
CH3
N
H
N
O
H3CO
N
CH3
CH3
N
H
гетероауксин
гормон роста растений
O
H3C
NH2
HO
N
H
N
H
серотонин
диэтиламид лизергиновой
кислоты (ЛСД)
нейромедиатор
психотропная активность
Cl
индометацин
синтетическое производное для
лечения артрита
30
31.
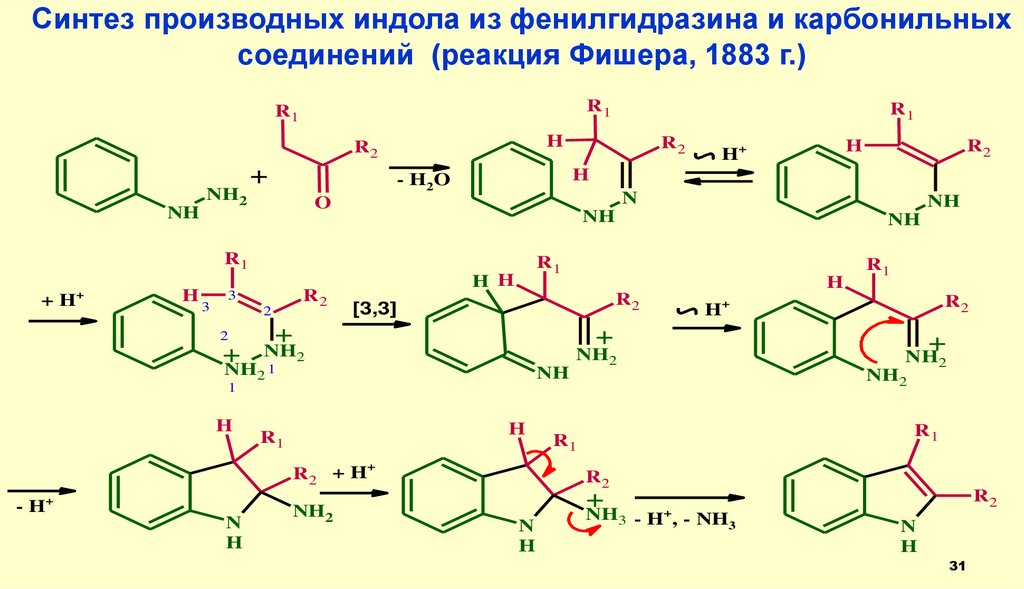
Синтез производных индола из фенилгидразина и карбонильныхсоединений (реакция Фишера, 1883 г.)
R1
R1
H
R2
NH
NH2
+
+H
H
3
R2
2
+
NH
NH
NH
R1
H H
H
R2
[3,3]
+
21
NH
H
+
R2 + H
- H+
N
H
NH2
R1
R2
H+
+
NH2
R1
R2
NH
+
NH2
NH2
NH2
1
H
H
H+
N
O
3
2
R2
H
- H2 O
R1
+
R1
R1
R1
R2
N
H
+
NH
3
- H+, - NH3
R2
N
H
31
32.
Несимметричные карбонильные соединения в реакции ФишераMe
Me
Me
H
H
Me
H
Me
+
N
NH
NH
NH
NH
NH
Me
Me
+
N
H
N
H
Уксусная к-та
100
:
0
Полифосфорная к-та
50
:
50
Метансульфокислота
22
:
78
Me
32
33.
Строение индола (бензо[b]пиррола)π-Избыточный
гетероцикл
N
H
N
H
Энергия резонанса,
кДж/моль
150
255
90
196
Критерии ароматичности:
1. Плоская сопряженная циклическая система
2. Правило Хюккеля 4n+2=10, где n = 2
Атом азота предоставляет свою электронную пару в цикл для образования ароматической
системы!
33
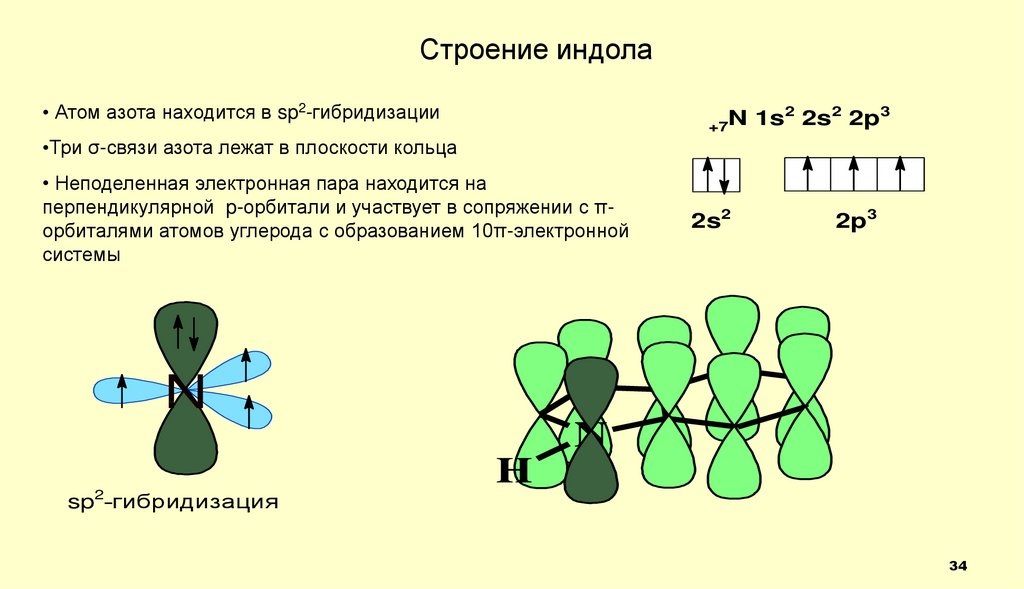
34.
Строение индола• Атом азота находится в sp2-гибридизации
2
2
3
N
1s
2s
2p
+7
•Три σ-связи азота лежат в плоскости кольца
• Неподеленная электронная пара находится на
перпендикулярной p-орбитали и участвует в сопряжении с πорбиталями атомов углерода с образованием 10π-электронной
системы
2s2
2p3
N
N
sp2-гибридизация
H
34
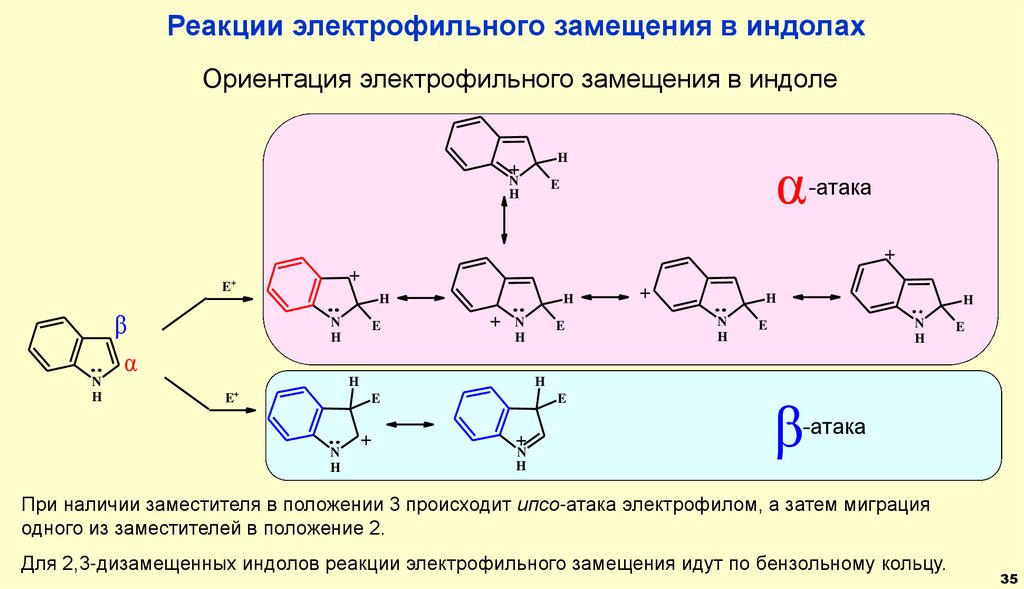
35.
Реакции электрофильного замещения в индолахОриентация электрофильного замещения в индоле
α
H
+
N
H
E
-атака
+
+
E+
H
β
α
N
H
N
H
E
H
+
N
H
H
+
E
H
N
H
H
N
H
E
E
H
E
N
H
E
+
+
E
+
N
H
β
-атака
При наличии заместителя в положении 3 происходит ипсо-атака электрофилом, а затем миграция
одного из заместителей в положение 2.
Для 2,3-дизамещенных индолов реакции электрофильного замещения идут по бензольному кольцу.
35
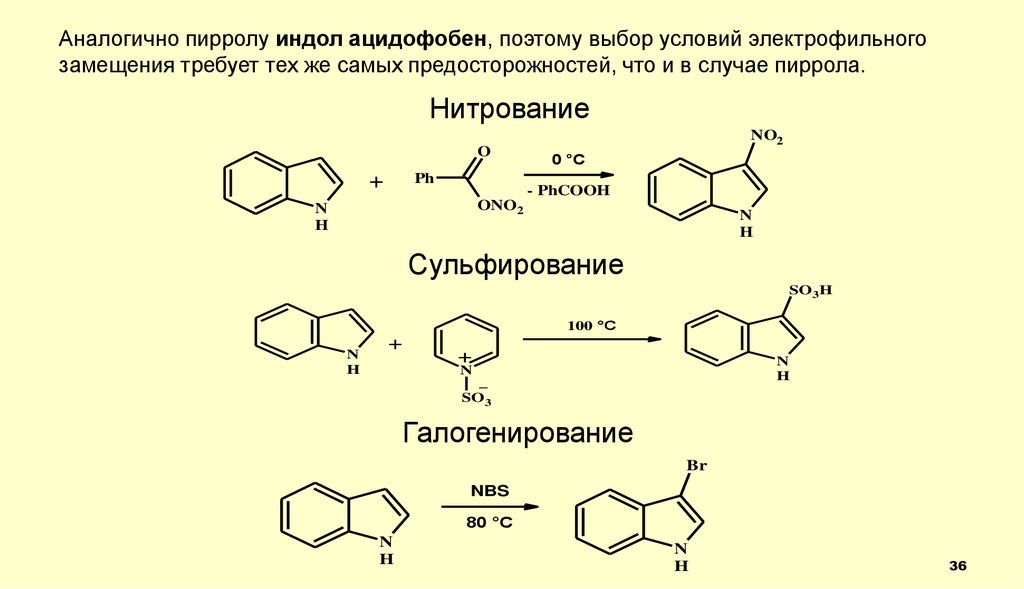
36.
Аналогично пирролу индол ацидофобен, поэтому выбор условий электрофильногозамещения требует тех же самых предосторожностей, что и в случае пиррола.
Нитрование
O
+
Ph
NO2
0 °C
- PhCOOH
ONO2
N
H
N
H
Сульфирование
SO3H
100 °C
N
H
+
+
N
H
N
_
SO3
Галогенирование
Br
NBS
80 °C
N
H
N
H
36
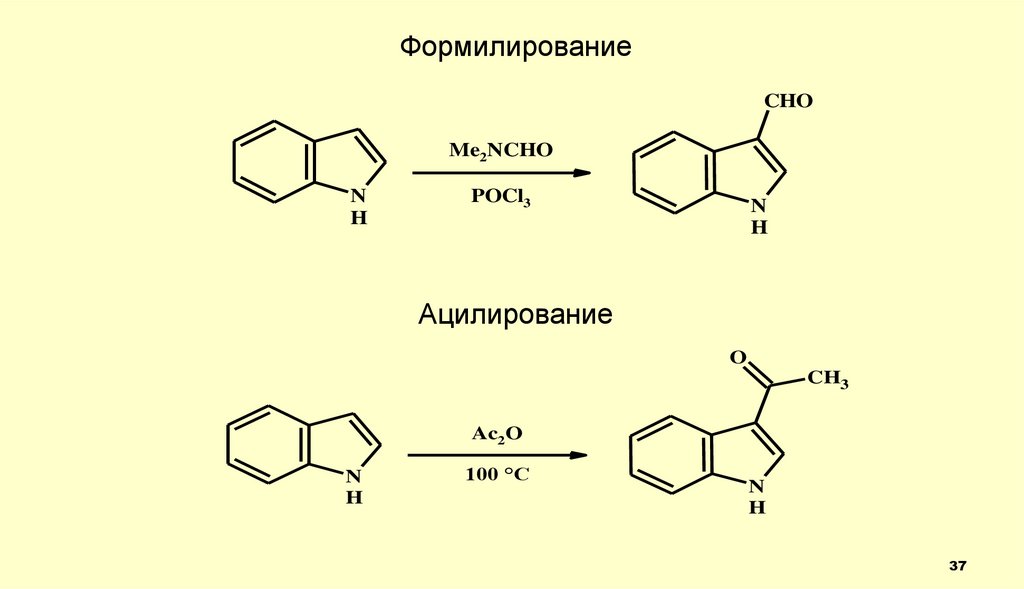
37.
ФормилированиеCHO
Me2NCHO
N
H
POCl3
N
H
Ацилирование
O
CH3
Ac2O
N
H
100 °C
N
H
37
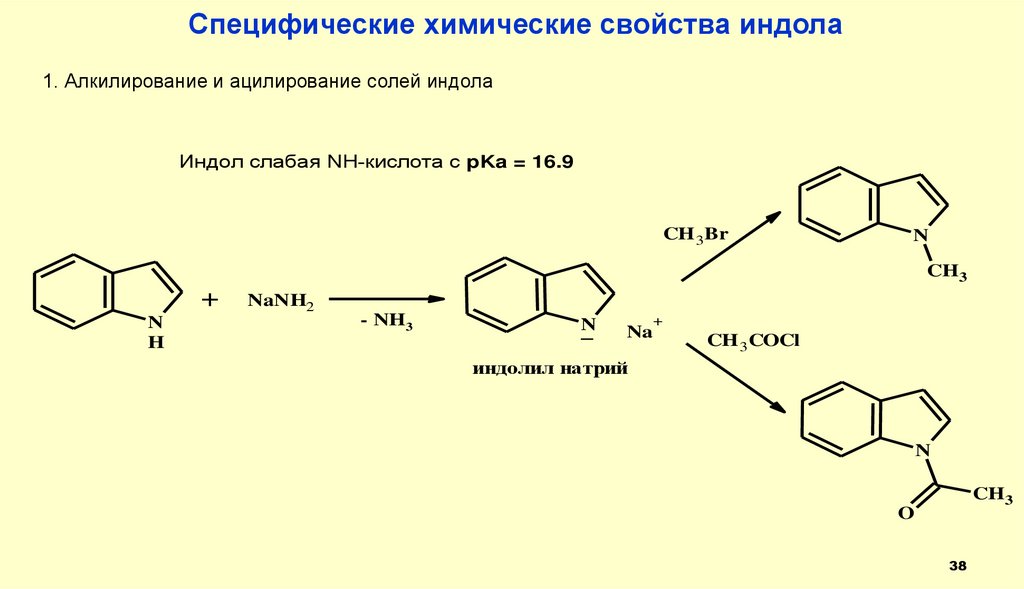
38.
Специфические химические свойства индола1. Алкилирование и ацилирование солей индола
Индол слабая NH-кислота с pKa = 16.9
CH 3Br
N
CH3
+
N
H
NaNH2
- NH3
N
_
+
Na
CH 3COCl
индолил натрий
N
CH3
O
38
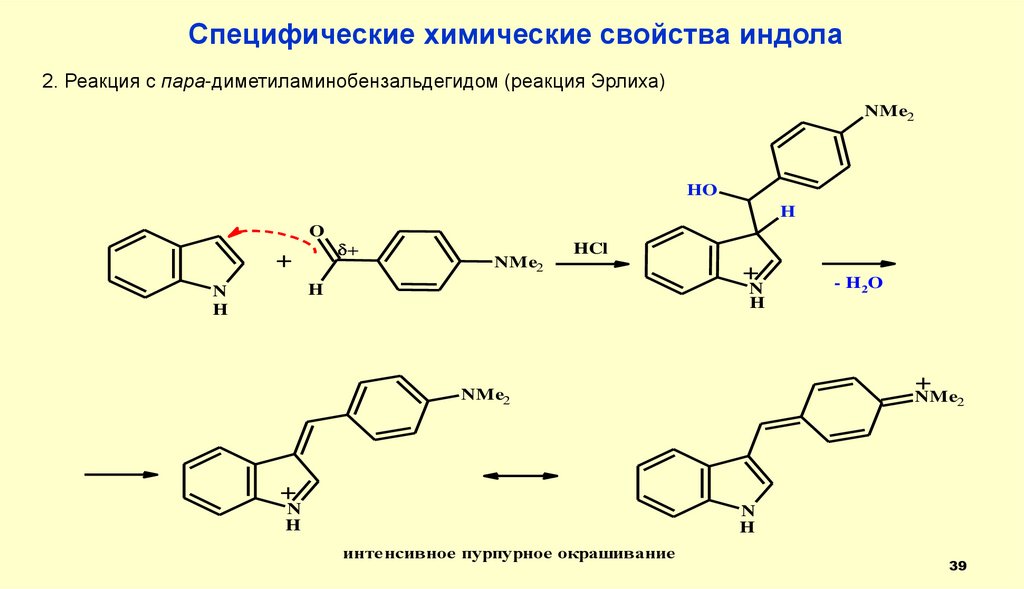
39.
Специфические химические свойства индола2. Реакция с пара-диметиламинобензальдегидом (реакция Эрлиха)
NMe2
HO
H
O
+
NMe2
HCl
+
N
H
H
N
H
- H2 O
+
NMe2
NMe2
+
N
H
N
H
интенсивное пурпурное окрашивание
39
40.
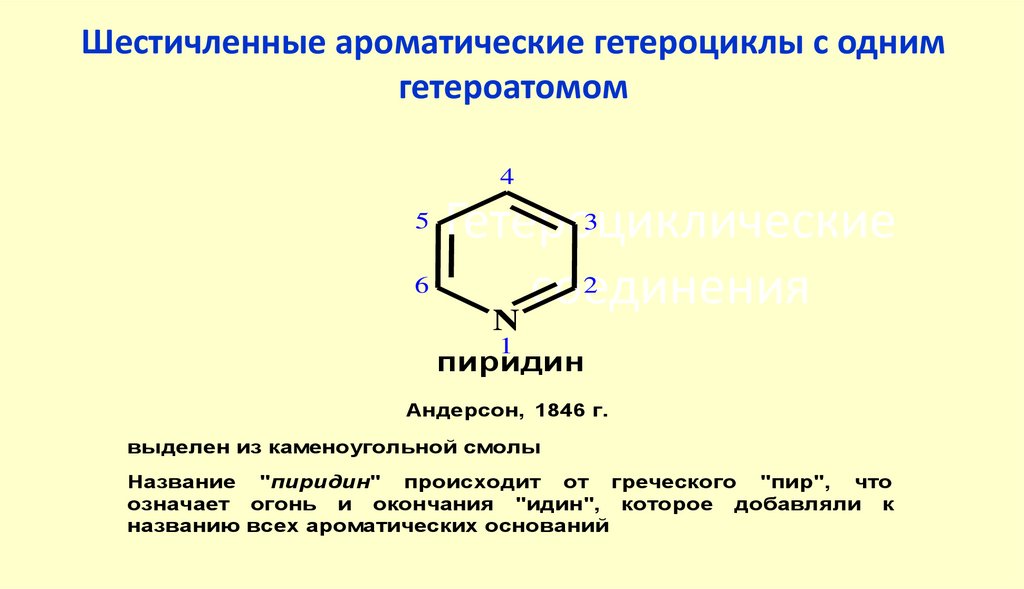
4041. Гетероциклические соединения
Шестичленные ароматические гетероциклы с однимгетероатомом
4
3
Гетероциклические
6
2
соединения
N
5
1
пиридин
Андерсон, 1846 г.
выделен из каменоугольной смолы
Название "пиридин" происходит от греческого "пир", что
означает огонь и окончания "идин", которое добавляли к
названию всех ароматических оснований
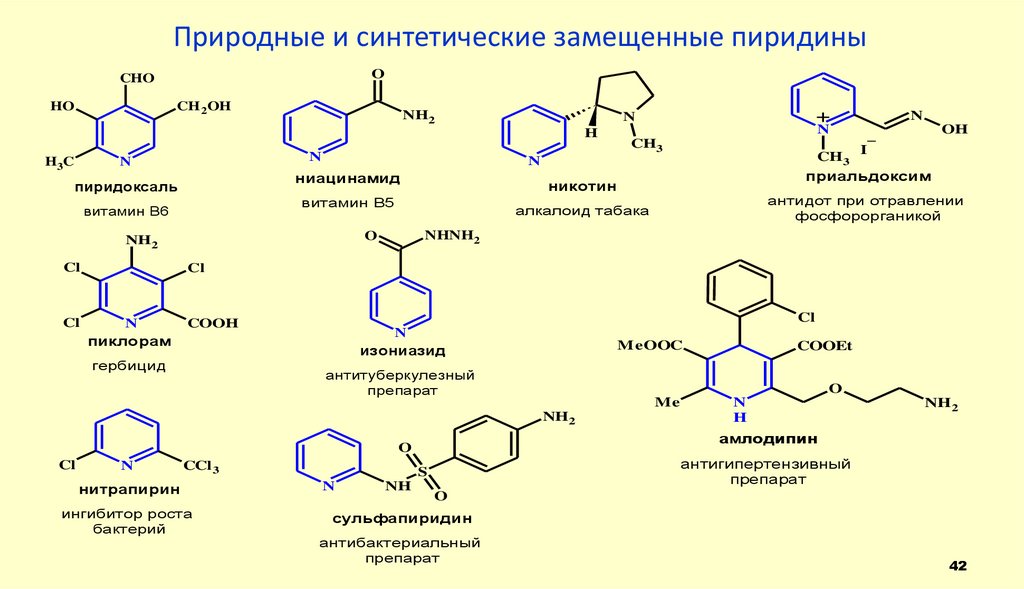
42. Природные и синтетические замещенные пиридины
OCHO
HO
CH 2OH
NH2
H
H 3C
N
N
Cl
OH
_
I
приальдоксим
антидот при отравлении
фосфорорганикой
NHNH2
Cl
N
пиклорам
Cl
COOH
гербицид
N
изониазид
MeOOC
антитуберкулезный
препарат
CCl 3
нитрапирин
ингибитор роста
бактерий
NH
NH2
антигипертензивный
препарат
S
N
N
H
амлодипин
O
N
COOEt
O
Me
NH2
Cl
CH3
алкалоид табака
O
NH2
Cl
CH3
никотин
витамин B5
витамин B6
N
N
N
ниацинамид
пиридоксаль
+
N
O
сульфапиридин
антибактериальный
препарат
42
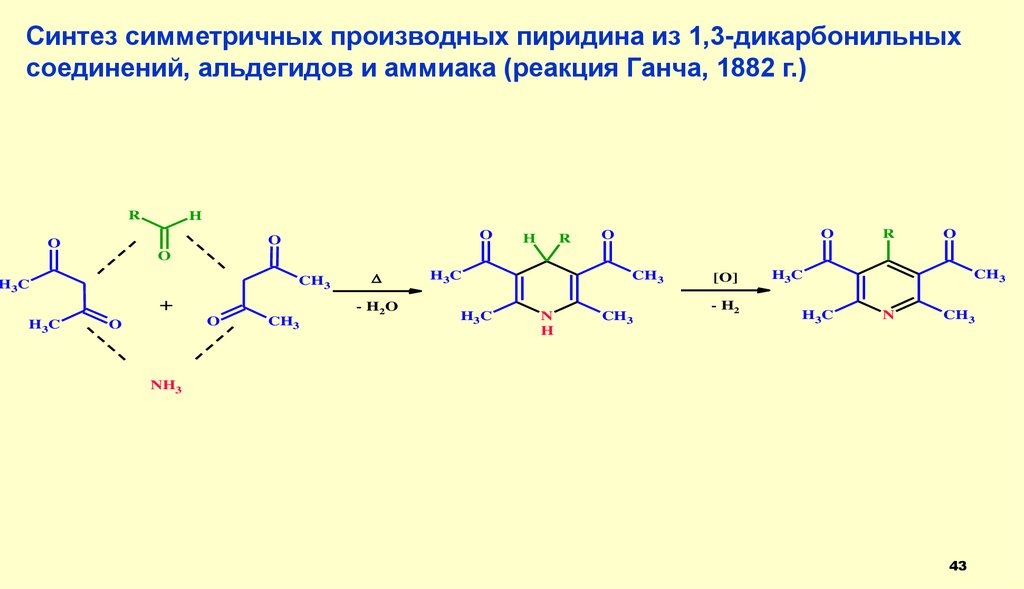
43.
Синтез симметричных производных пиридина из 1,3-дикарбонильныхсоединений, альдегидов и аммиака (реакция Ганча, 1882 г.)
R
H
O
O
O
H
R
O
O
R
O
O
CH3
H3 C
+
H3C
- H2 O
O
O
CH3
H3C
H3C
CH3
N
H
CH3
[O]
- H2
CH3
H3C
H3C
N
CH3
NH3
43
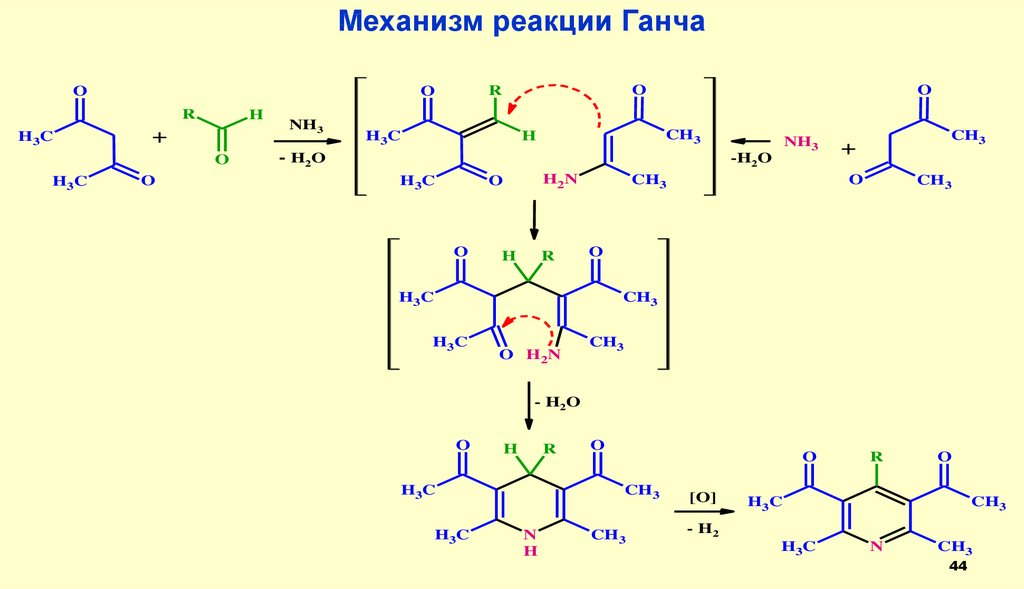
44.
Механизм реакции ГанчаR
H3C
H
+
O
H3C
O
NH3
O
R
O
O
CH3
H
H 3C
O
- H2 O
NH3
-H2O
H2N
O
H3C
O
H
R
CH3
CH3
+
O
CH3
O
H 3C
CH3
H3C
O H 2N
CH3
- H2 O
O
H
R
H3C
H3C
O
O
CH3
N
H
CH3
[O]
R
O
CH3
H 3C
- H2
H3C
N
CH3
44
45.
Синтез несимметричных дигидропиридинов Ганча в две стадииPh
O2N
H
+
beta-аланин
O2N
-H2O
O
O
Ph
Ph
Ph
Ph
X
O2N
+
Ph
O
O
Ph
AcOH
O2N
X
25 °C
H2N
CH3
Ph
N
H
CH3
X = CN, Ac, COPh
45
46.
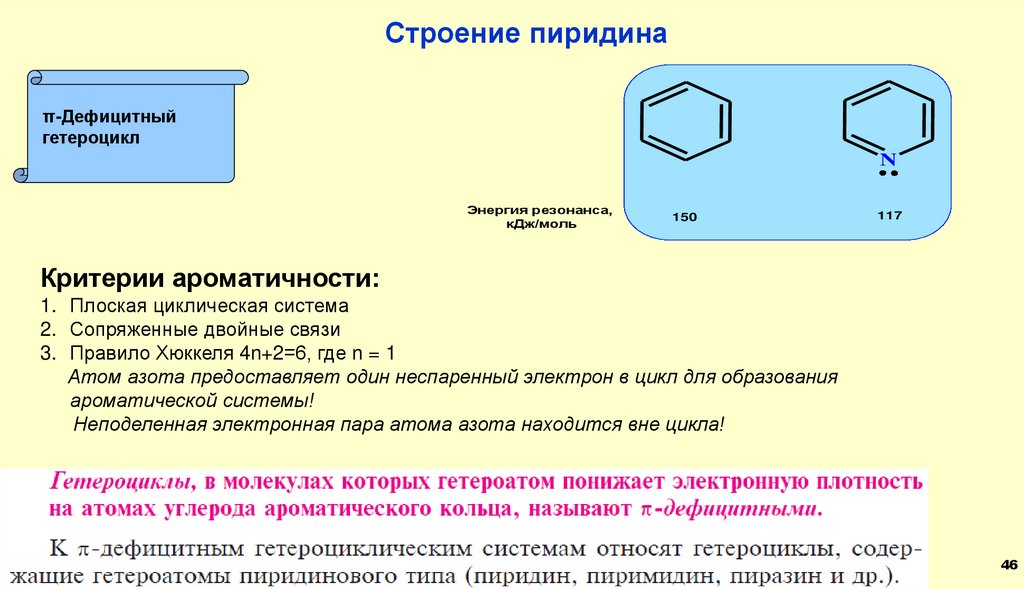
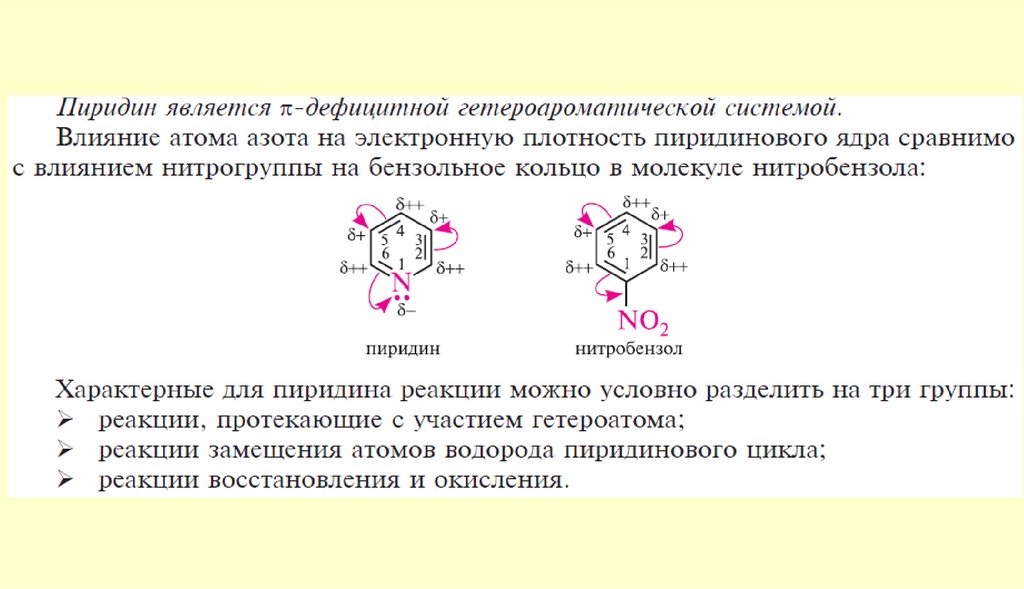
Строение пиридинаπ-Дефицитный
гетероцикл
N
Энергия резонанса,
кДж/моль
150
117
Критерии ароматичности:
1. Плоская циклическая система
2. Сопряженные двойные связи
3. Правило Хюккеля 4n+2=6, где n = 1
Атом азота предоставляет один неспаренный электрон в цикл для образования
ароматической системы!
Неподеленная электронная пара атома азота находится вне цикла!
46
47.
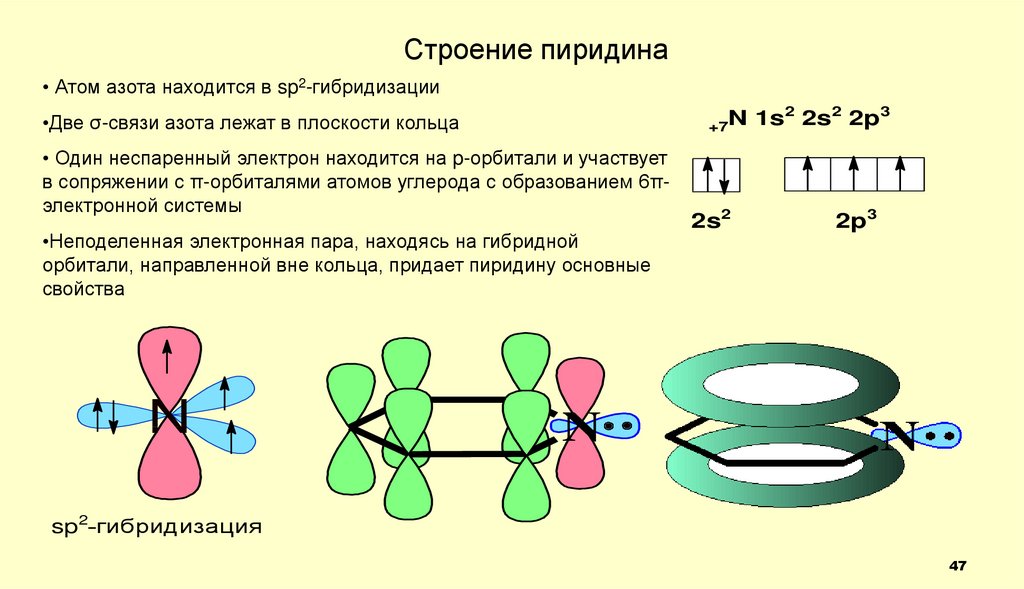
Строение пиридина• Атом азота находится в sp2-гибридизации
2
2
3
N
1s
2s
2p
+7
•Две σ-связи азота лежат в плоскости кольца
• Один неспаренный электрон находится на p-орбитали и участвует
в сопряжении с π-орбиталями атомов углерода с образованием 6πэлектронной системы
•Неподеленная электронная пара, находясь на гибридной
орбитали, направленной вне кольца, придает пиридину основные
свойства
N
2s2
2p3
N
sp2-гибридизация
47
48.
Сравнение строения пиридина и пиррола+7N
1s2 2s2 2p3
N
H
N
2s2
N
N
sp2-гибридизация
• Неподеленная электронная пара не участвует в
сопряжении
• Пиридин слабое основание c pKb = 8.96
• π-дефицитный гетероцикл
• Электрофильное замещение протекает в жестких
условиях по β-положению
• Нуклеофильное замещение протекает по α- и γположениям
2p3
N
H N
sp2-гибридизация
• Неподеленная электронная пара участвует в сопряжении
с π-орбиталями атомов углерода с образованием 6πэлектронной системы
•Пиррол слабая NH-кислота с pKa = 16.5
• π-избыточный гетероцикл
• Электрофильное замещение протекает легко по всем
положениям (преимущественно по α-положению)
• Нуклеофильное замещение не характерно
48
49.
50.
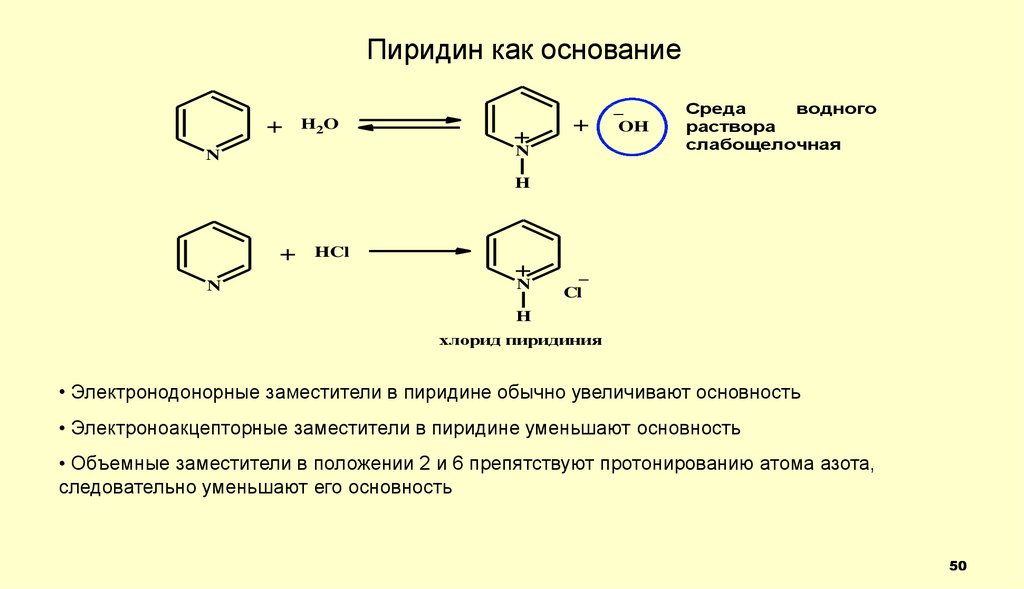
Пиридин как основание+
H2O
+
+
N
N
_
OH
Среда
водного
раствора
слабощелочная
H
+
N
HCl
+
N
_
Cl
H
хлорид пиридиния
• Электронодонорные заместители в пиридине обычно увеличивают основность
• Электроноакцепторные заместители в пиридине уменьшают основность
• Объемные заместители в положении 2 и 6 препятствуют протонированию атома азота,
следовательно уменьшают его основность
50
51.
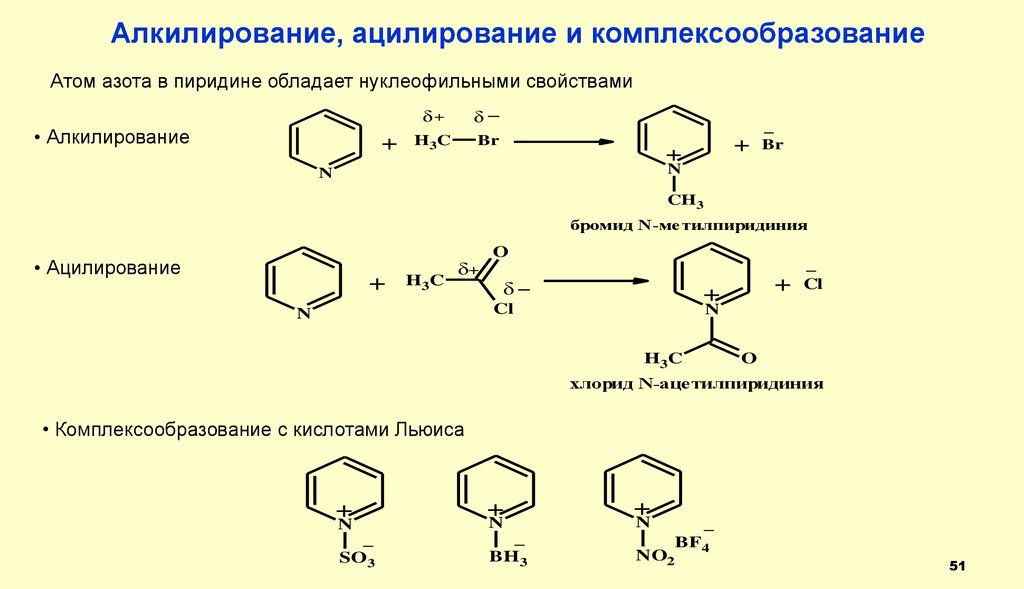
Алкилирование, ацилирование и комплексообразованиеАтом азота в пиридине обладает нуклеофильными свойствами
• Алкилирование
+
δ+
δ_
H3C
Br
+
+
_
Br
N
N
CH3
бромид N-метилпиридиния
• Ацилирование
+
H3C
δ+
O
δ_
Cl
N
+
+
_
Cl
N
H3C
O
хлорид N-ацетилпиридиния
• Комплексообразование с кислотами Льюиса
+
+
_
SO3
_
BH3
N
N
+
N
NO2
_
BF4
51
52.
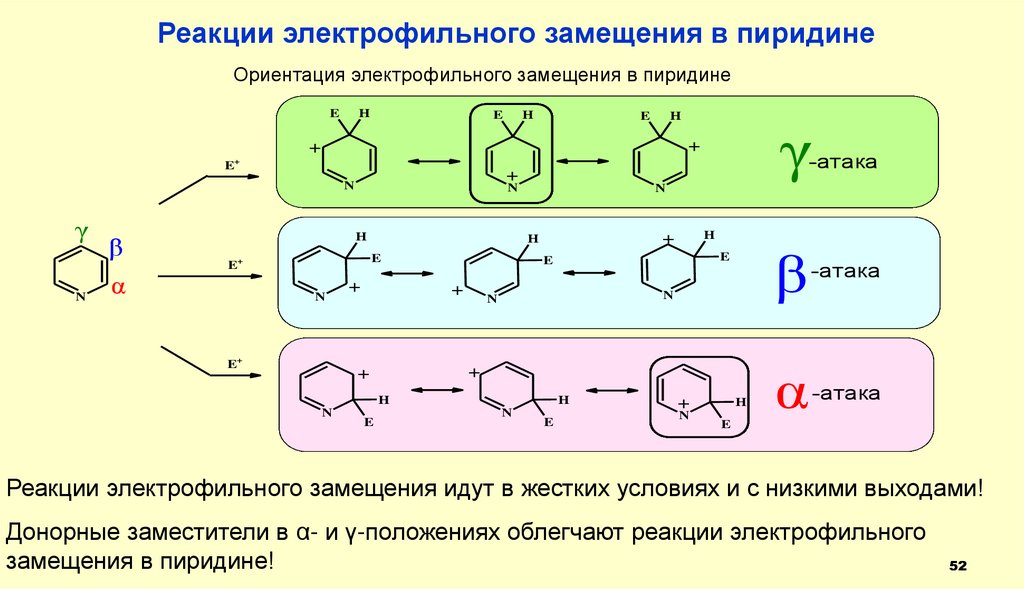
Реакции электрофильного замещения в пиридинеОриентация электрофильного замещения в пиридине
E
H
E
H
E
H
γ
+
+
-атака
+
E
+
N
γ
N
β
N
H
α
N
E+
+
N
N
+
H
E
E
E
+
+
N
H
+
H
E
E+
N
H
N
E
+
N
H
β
-атака
α
-атака
E
Реакции электрофильного замещения идут в жестких условиях и с низкими выходами!
Донорные заместители в α- и γ-положениях облегчают реакции электрофильного
замещения в пиридине!
52
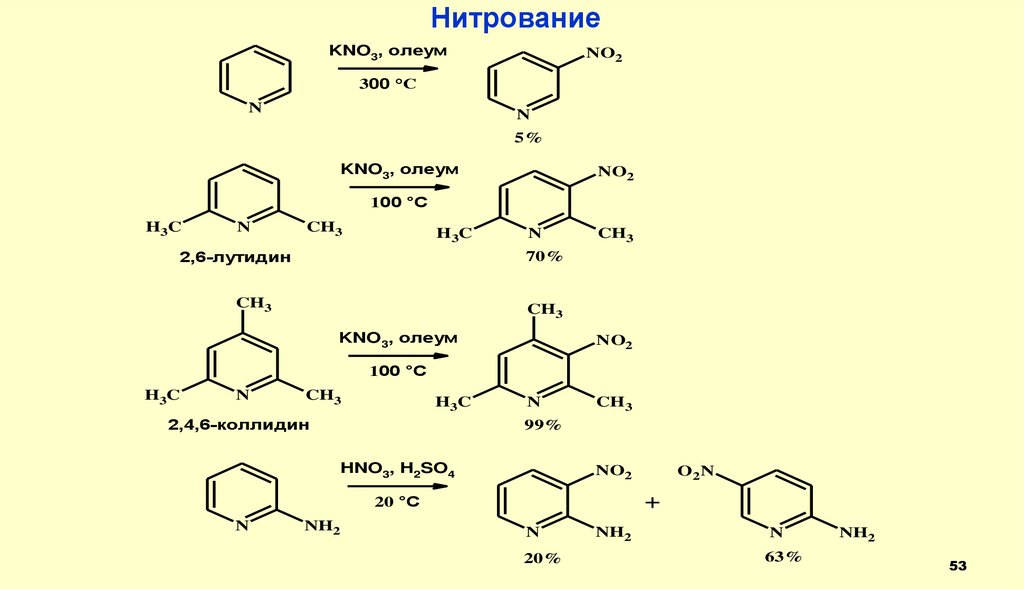
53.
НитрованиеKNO3, олеум
NO2
300 °C
N
N
5%
KNO3, олеум
NO2
100 °C
H3C
N
CH3
H3C
2,6-лутидин
N
CH3
70%
CH3
CH3
KNO3, олеум
NO2
100 °C
H3C
N
CH3
H3C
2,4,6-коллидин
N
CH3
99%
HNO3, H2SO4
NO2
+
20 °C
N
NH2
O2N
N
20%
NH2
N
63%
NH2
53
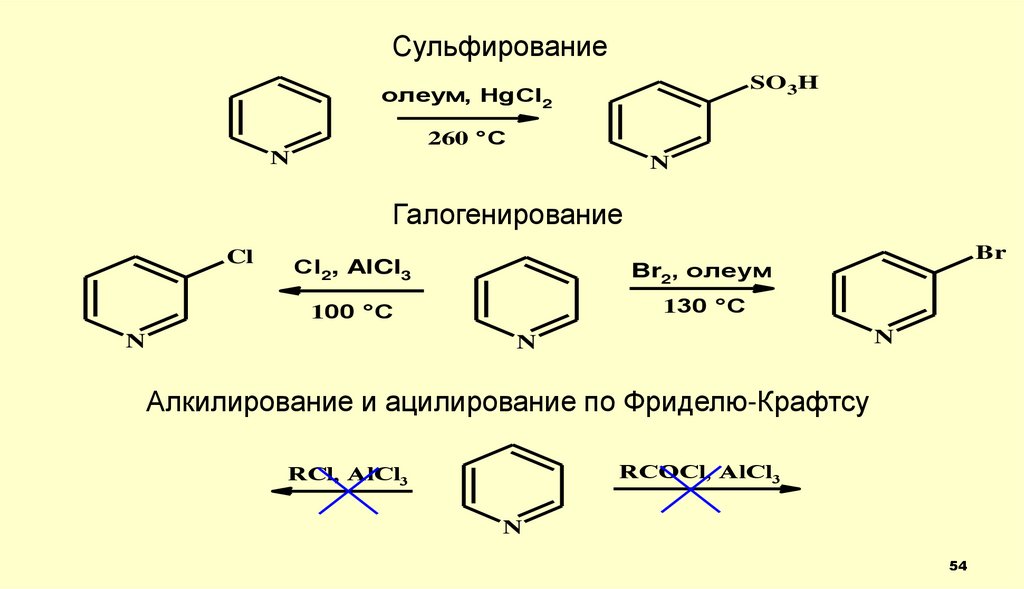
54.
СульфированиеSO3H
олеум, HgCl2
260 °C
N
N
Галогенирование
Cl
Сl2, AlCl3
Br2, олеум
100 °C
130 °C
N
Br
N
N
Алкилирование и ацилирование по Фриделю-Крафтсу
RCOCl, AlCl3
RСl, AlCl3
N
54
55.
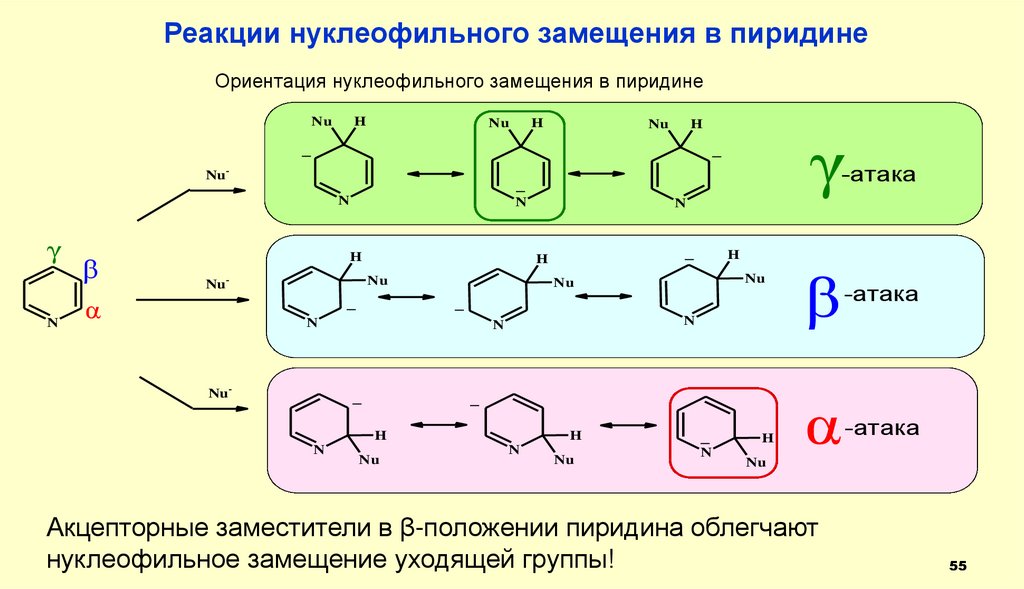
Реакции нуклеофильного замещения в пиридинеОриентация нуклеофильного замещения в пиридине
Nu
H
Nu
H
Nu
H
_
Nu-
N
β
N
H
_
H
Nu
_
N
N
_
_
H
N
_
Nu
N
Nu-
N
H
Nu
Nu-
α
-атака
_
N
γ
γ
_
Nu
H
N
Nu
_
N
H
β
-атака
α
-атака
Nu
Акцепторные заместители в β-положении пиридина облегчают
нуклеофильное замещение уходящей группы!
55
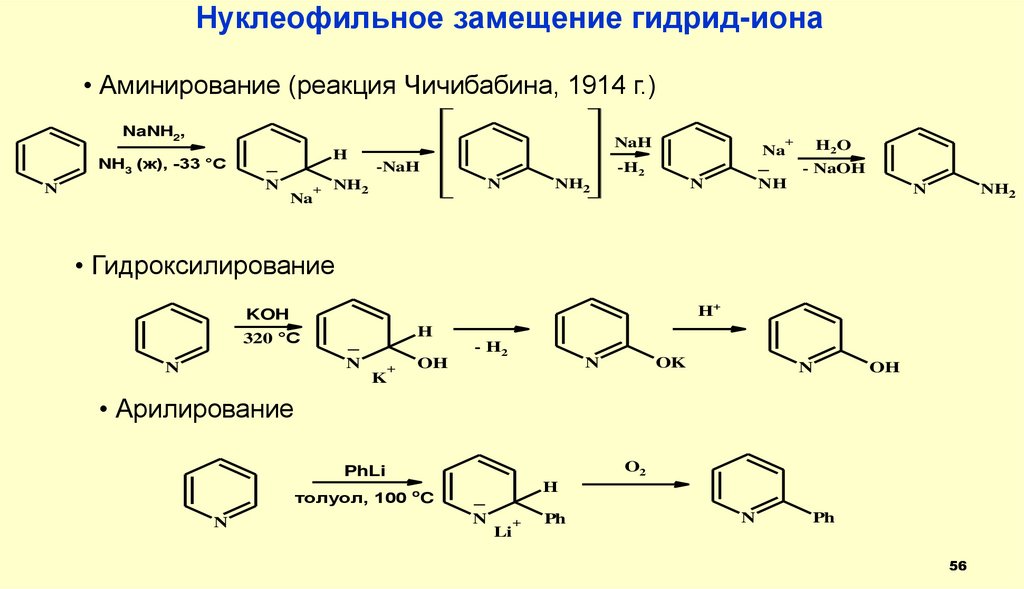
56.
Нуклеофильное замещение гидрид-иона• Аминирование (реакция Чичибабина, 1914 г.)
NaNH2,
NH3 (ж), -33 °C
H
_
N
N
+
Na
NaH
-NaH
+
_
-H2
N
NH2
H2O
Na
N
NH2
- NaOH
NH
N
NH2
• Гидроксилирование
H+
KOH
320 °C
H
_
N
N
K
+
OH
- H2
N
OK
N
OH
• Арилирование
O2
PhLi
толуол, 100 oC
N
H
_
N
+
Li
Ph
N
Ph
56
57.
Нуклеофильное замещение хорошо уходящей группы в α- и γположенияхСН3ONa
СН3OH,
N
O2N
N
Cl
СН3ONa
- NaCl
_
N
Cl
N+
Na
O2N
O
Cl
+
OCH 3
O
_
_
N
OCH 3
+
Na
O2N
СН3OH,
N
Cl
_
Cl
OCH 3
N
Br
- NaCl
N
OCH 3
OCH 3
NH2
Br
Br
NH3 (водн.)
160 oC
N
CH3
N
Et2O, 20 oC
N
F
CH3
CH3
PhLi
F
_
N
+
Li
Ph
- LiF
N
Ph
57
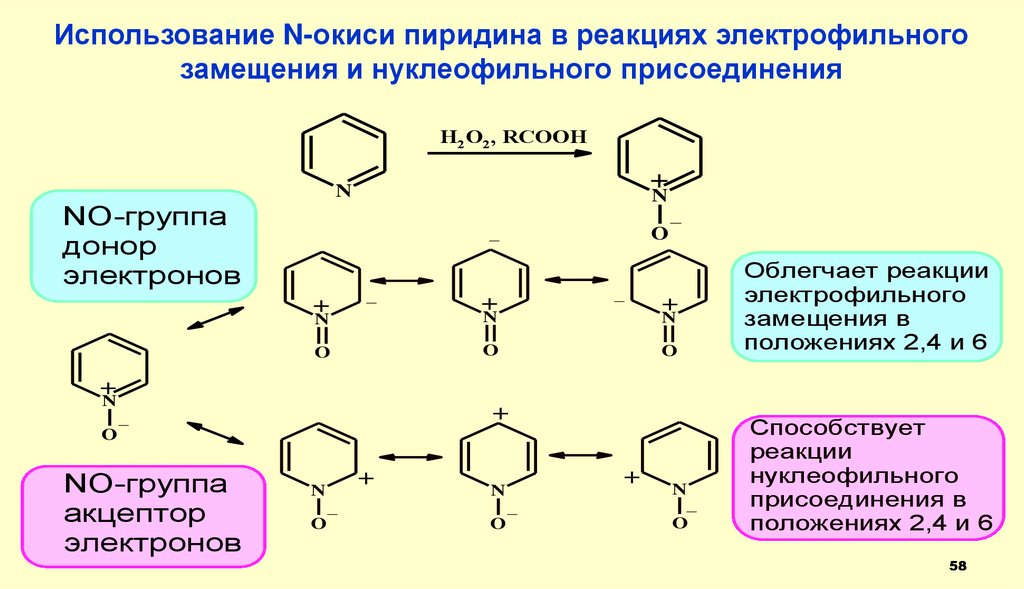
58.
Использование N-окиси пиридина в реакциях электрофильногозамещения и нуклеофильного присоединения
H2O2, RCOOH
+
N
N
NO-группа
донор
электронов
_
O
_
+
_
_
+
N
N
+
N
O
O
Облегчает реакции
электрофильного
замещения в
положениях 2,4 и 6
O
+
N
+
_
O
NO-группа
акцептор
электронов
+
N
_
O
+
N
_
O
N
_
O
Способствует
реакции
нуклеофильного
присоединения в
положениях 2,4 и 6
58
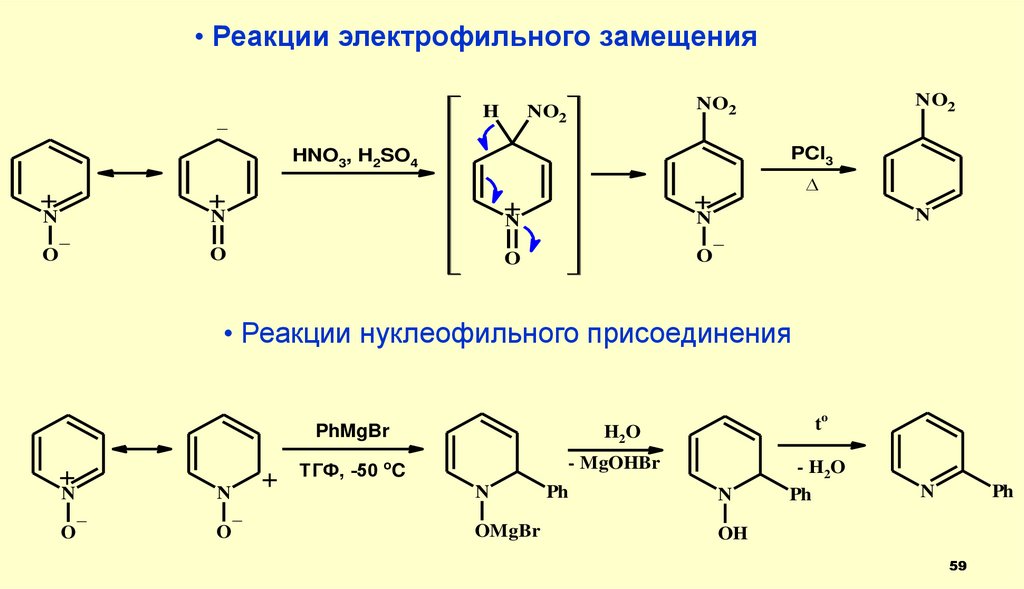
59.
• Реакции электрофильного замещенияH
_
PCl3
HNO3, H2SO4
+
+
+
+
N
N
N
NO2
NO2
NO2
N
N
_
_
O
O
O
O
• Реакции нуклеофильного присоединения
PhMgBr
+
N
N
H2O
- MgOHBr
ТГФ, -50 oC
N
Ph
N
- H2O
Ph
N
Ph
_
_
O
+
to
O
OMgBr
OH
59
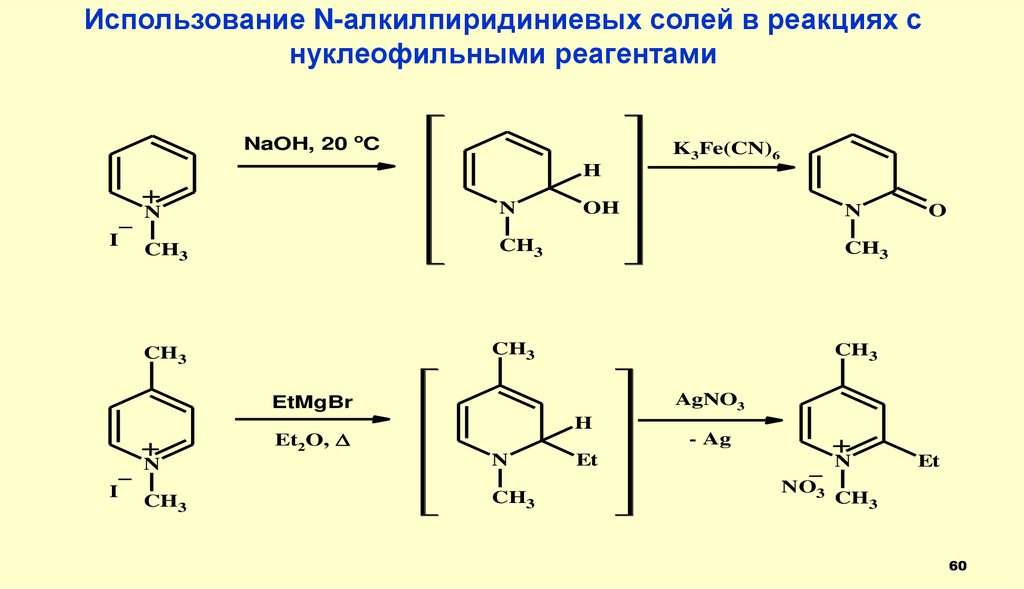
60.
Использование N-алкилпиридиниевых солей в реакциях снуклеофильными реагентами
NaOH, 20 oC
K3Fe(CN)6
H
+
N
CH3
CH3
_ N
I
OH
CH3
AgNO3
EtMgBr
_ N
I
CH3
O
CH3
CH3
CH3
+
N
H
Et2O,
N
CH3
Et
- Ag
+
_ N
NO3
Et
CH3
60
61.
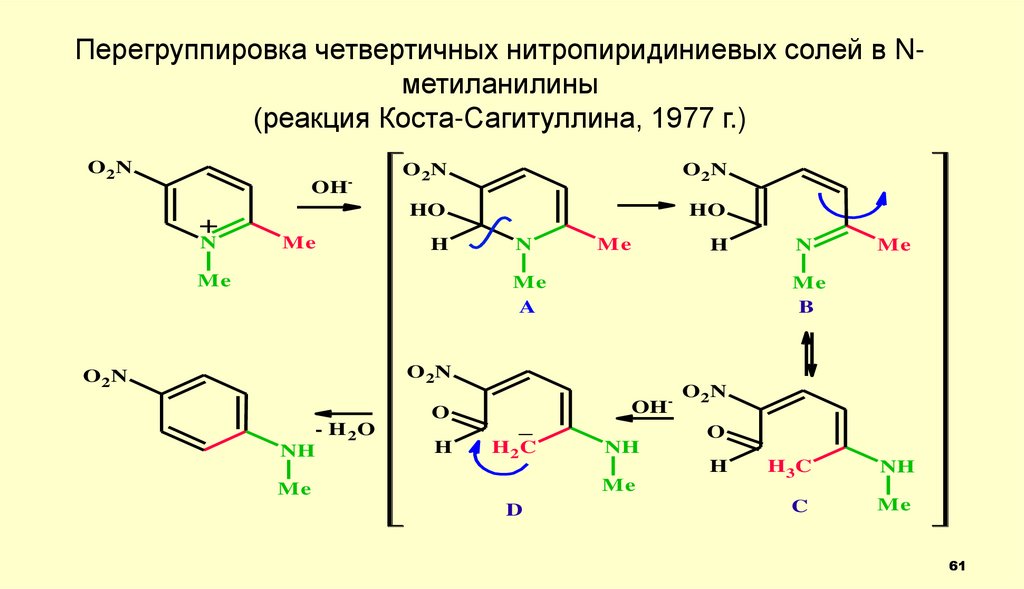
Перегруппировка четвертичных нитропиридиниевых солей в Nметиланилины(реакция Коста-Сагитуллина, 1977 г.)
O2N
OH
+
N
-
Me
O2N
O2N
HO
HO
H
Me
N
Me
H
Me
A
O
- H 2O
NH
H
OH
_
H2C
NH
D
-
O2N
O
H
Me
Me
Me
Me
B
O2N
O2N
N
H3C
NH
C
Me
61
62.
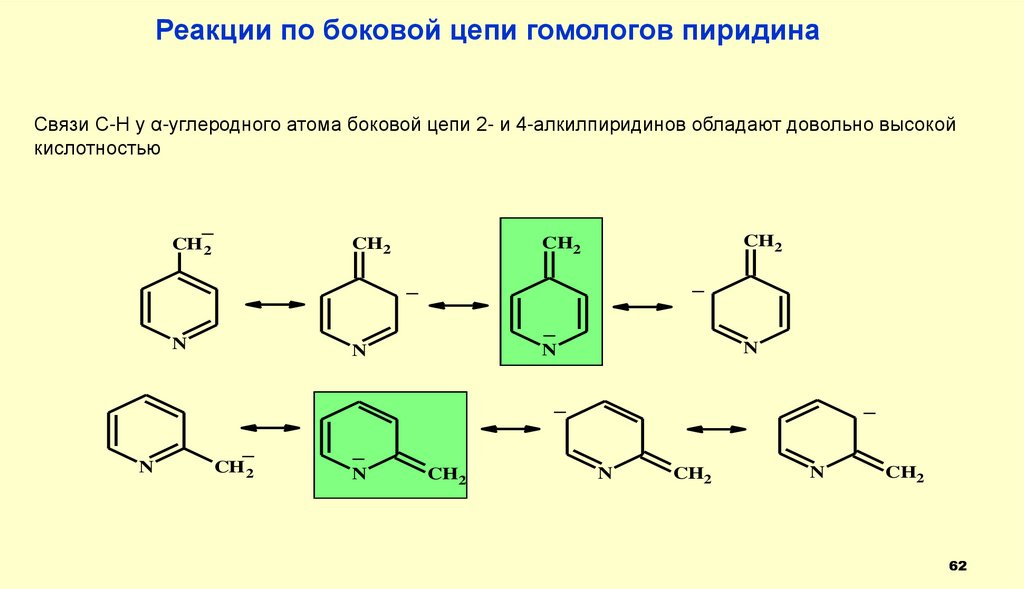
Реакции по боковой цепи гомологов пиридинаСвязи С-Н у α-углеродного атома боковой цепи 2- и 4-алкилпиридинов обладают довольно высокой
кислотностью
_
CH2
CH2
CH2
CH 2
_
_
_
N
N
N
N
_
_
N
CH 2
_
_
N
CH2
N
CH2
N
CH2
62
63.
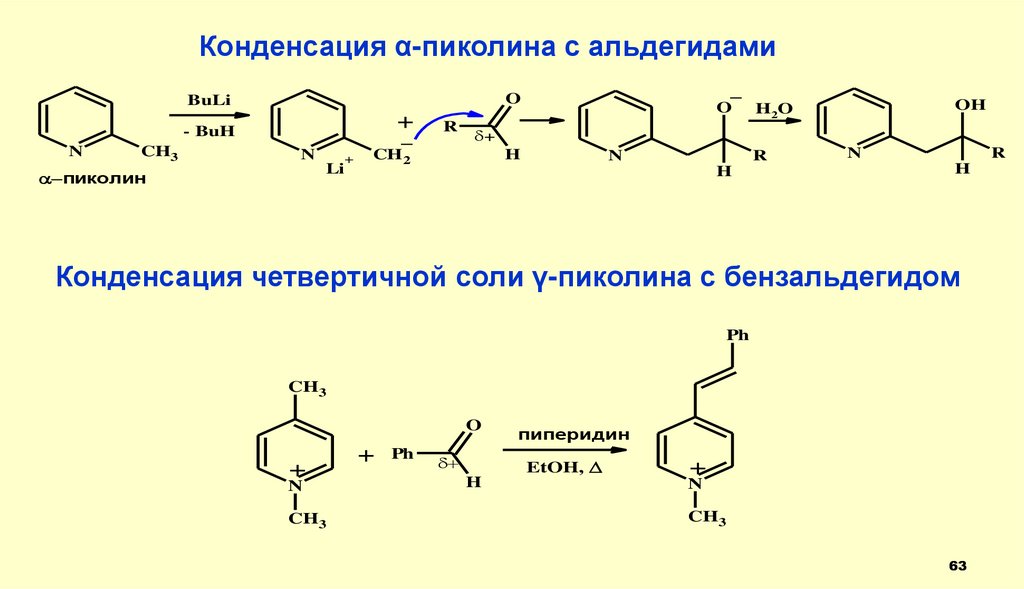
Конденсация α-пиколина с альдегидами+
- BuH
N
CH3
_
O
BuLi
_
N
Li
пиколин
+
R
O
OH
H2O
+
H
CH 2
N
R
H
N
R
H
Конденсация четвертичной соли γ-пиколина с бензальдегидом
Ph
CH3
O
+
N
CH3
+
Ph
пиперидин
EtOH,
H
+
N
CH3
63
64.
Окислительно-восстановительные реакции пиридина и его гомологовCH3 KMnO
4
COOK
COOH
HCl
KOH, to
N
N
N
пиколин
никотиновая кислота
H2, Pt
1 атм, 20 oC
N
N
H
пиперидин
H
_
Na, NH3 (ж)
H
EtOH
_
N
N
N
H
1,4-дигидропиридин
64
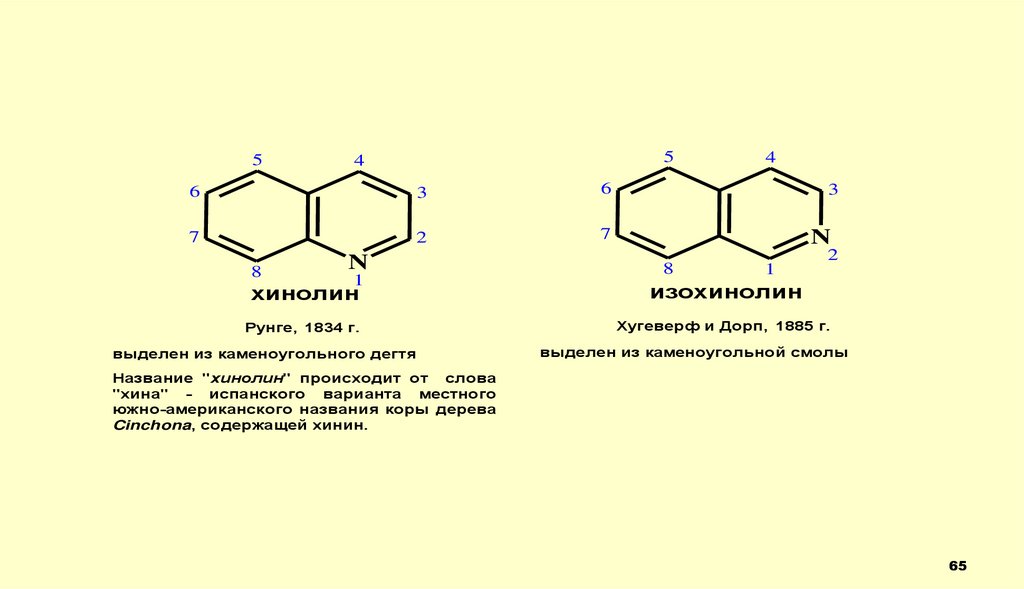
65.
55
4
6
3
6
7
2
7
8
N
1
4
3
N
8
1
2
хинолин
изохинолин
Рунге, 1834 г.
Хугеверф и Дорп, 1885 г.
выделен из каменоугольного дегтя
выделен из каменоугольной смолы
Название "хинолин" происходит от слова
"хина" - испанского варианта местного
южно-американского названия коры дерева
Cinchona, содержащей хинин.
65
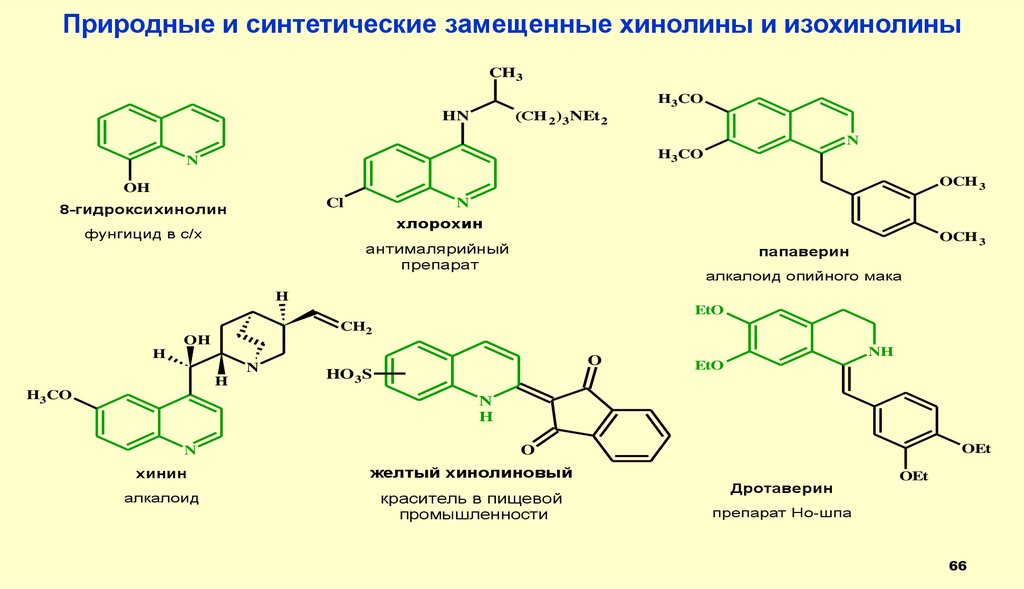
66.
Природные и синтетические замещенные хинолины и изохинолиныCH3
(СH 2) 3NEt 2
HN
H3CO
N
H3CO
N
OCH 3
OH
Cl
8-гидроксихинолин
N
хлорохин
фунгицид в с/х
антималярийный
препарат
OCH 3
папаверин
алкалоид опийного мака
H
EtO
CH2
OH
H
N
H
H 3CO
O
HO 3S
NH
EtO
N
H
N
хинин
алкалоид
OEt
O
желтый хинолиновый
краситель в пищевой
промышленности
Дротаверин
OEt
препарат Но-шпа
66
67.
Синтез хинолинов из ариламинов и глицерина в присутствииконц. серной кислоты (синтез Скраупа, 1880 г.)
HO
1. H2SO4
+
NH2
OH
2. PhNO2
HO
N
O
HO
O
H2SO4
H2SO4
OH
- H2O
HO
HO
H
- H2O
H2C
H
H+
NH2
O
H
H+
PhNO2
N
- H2O
N
H
NH
67
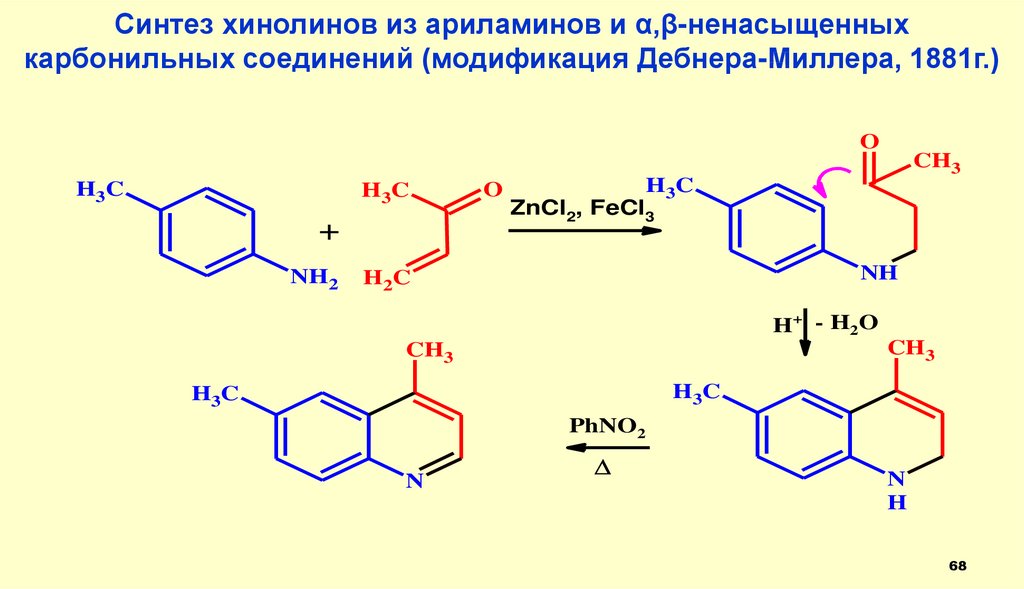
68.
Синтез хинолинов из ариламинов и α,β-ненасыщенныхкарбонильных соединений (модификация Дебнера-Миллера, 1881г.)
O
CH3
H3C
H 3C
+
NH2
O
H3C
ZnCl2, FeCl3
NH
H 2C
H+ - H 2 O
CH3
CH3
H 3C
H3C
PhNO2
N
N
H
68
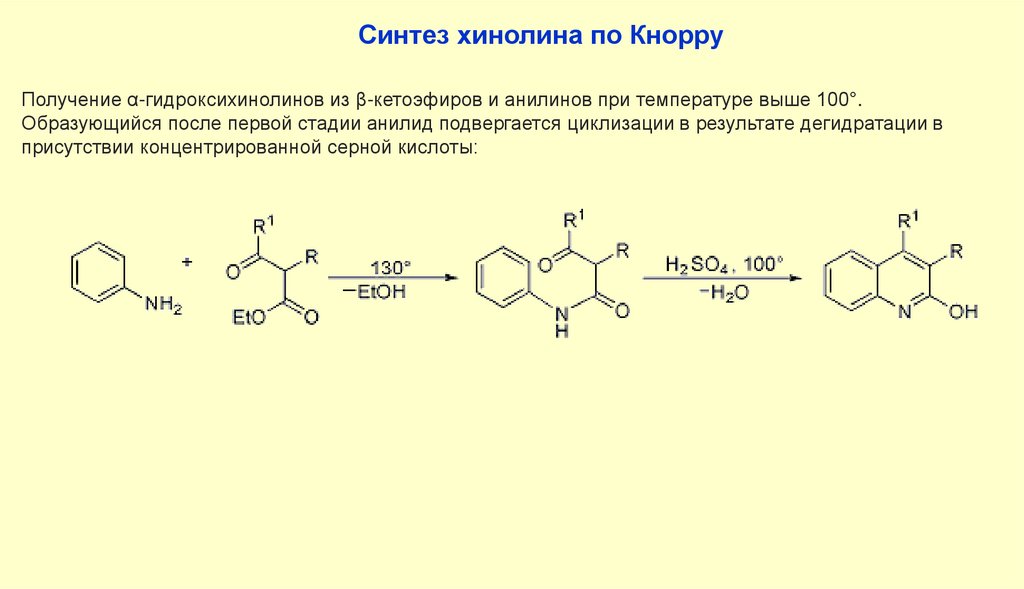
69.
Синтез хинолина по КнорруПолучение α-гидроксихинолинов из β-кетоэфиров и анилинов при температуре выше 100°.
Образующийся после первой стадии анилид подвергается циклизации в результате дегидратации в
присутствии концентрированной серной кислоты:
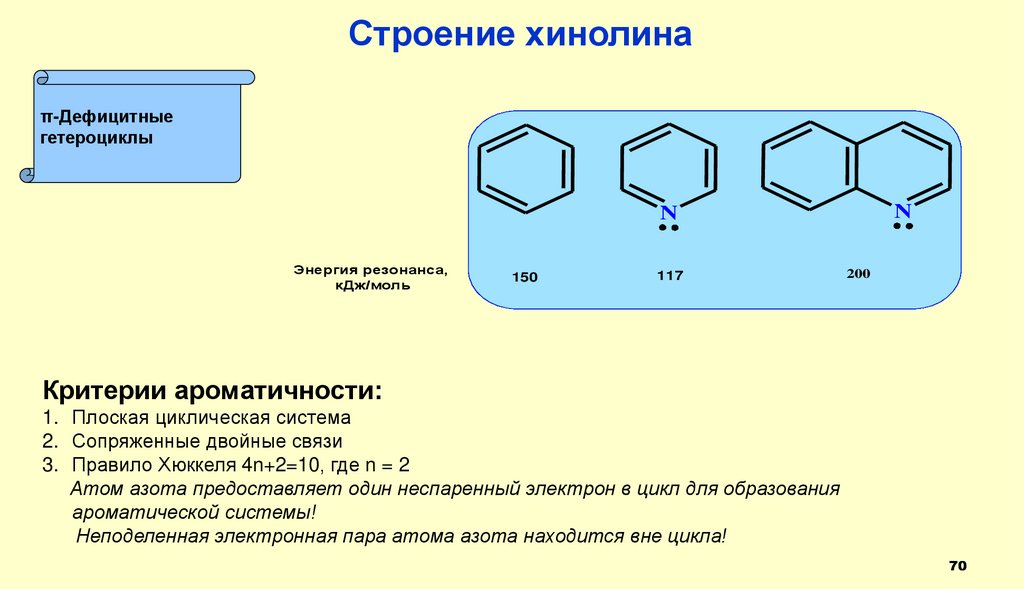
70.
Строение хинолинаπ-Дефицитные
гетероциклы
N
N
Энергия резонанса,
кДж/моль
150
117
200
Критерии ароматичности:
1. Плоская циклическая система
2. Сопряженные двойные связи
3. Правило Хюккеля 4n+2=10, где n = 2
Атом азота предоставляет один неспаренный электрон в цикл для образования
ароматической системы!
Неподеленная электронная пара атома азота находится вне цикла!
70
71.
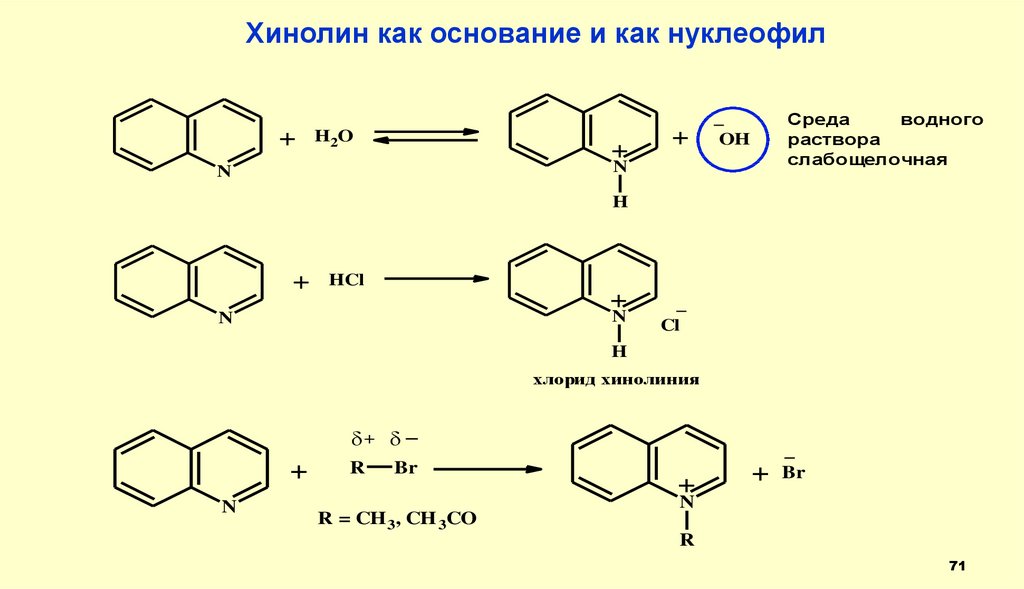
Хинолин как основание и как нуклеофил+
H2O
+
+
Среда
водного
раствора
слабощелочная
_
OH
N
N
H
+
HCl
+
N
N
_
Cl
H
хлорид хинолиния
δ+ δ _
+
N
R
Br
R = CH 3, CH 3CO
+
+
_
Br
N
R
71
72.
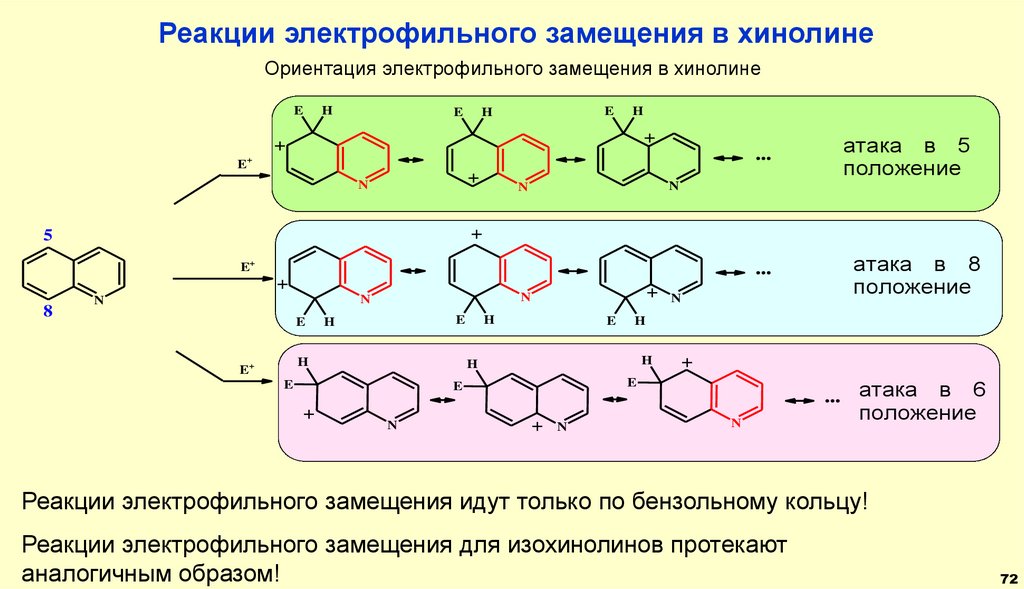
Реакции электрофильного замещения в хинолинеОриентация электрофильного замещения в хинолине
E
H
E
E
H
H
+
+
...
E+
+
N
N
N
+
5
E+
...
+
N
N
N
E
E
H
H
E+
+
8
атака в 5
положение
H
E
H
N
+
E
E
+
H
H
E
N
+
N
атака в 8
положение
N
... атака в 6
положение
Реакции электрофильного замещения идут только по бензольному кольцу!
Реакции электрофильного замещения для изохинолинов протекают
аналогичным образом!
72
73.
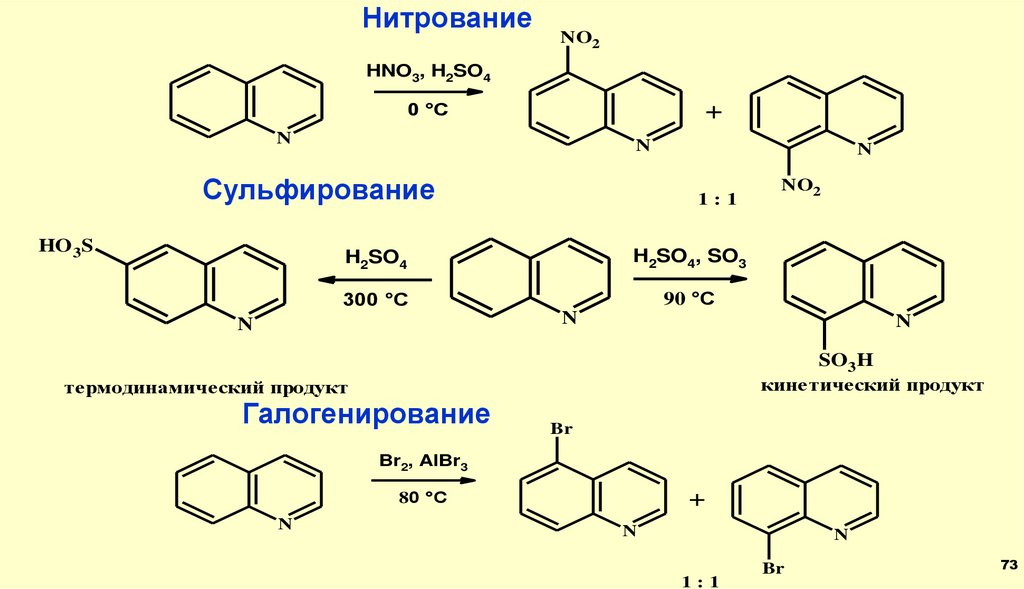
НитрованиеNO2
HNO3, H2SO4
+
0 °C
N
N
Сульфирование
HO 3S
N
1:1
H2SO4
H2SO4, SO3
300 °C
90 °C
NO2
N
N
N
SO3H
кинетический продукт
термодинамический продукт
Галогенирование
Br
Br2, AlBr3
+
80 °C
N
N
N
1:1
Br
73
74.
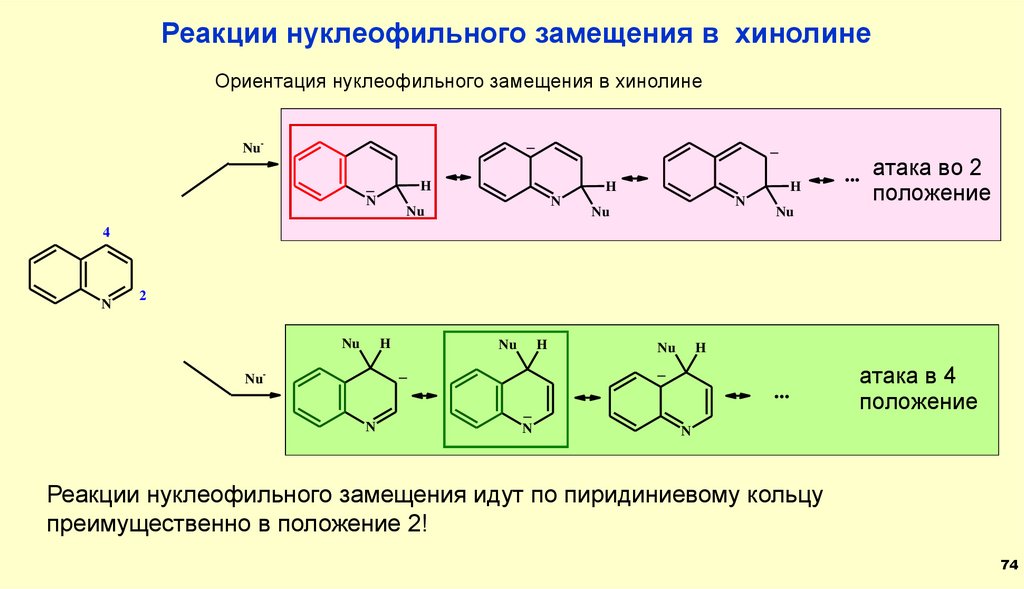
Реакции нуклеофильного замещения в хинолинеОриентация нуклеофильного замещения в хинолине
_
Nu-
_
_
H
N
H
N
Nu
H
N
Nu
... атака во 2
положение
Nu
4
N
2
Nu
H
Nu
H
H
_
_
Nu-
Nu
...
_
N
N
атака в 4
положение
N
Реакции нуклеофильного замещения идут по пиридиниевому кольцу
преимущественно в положение 2!
74
75.
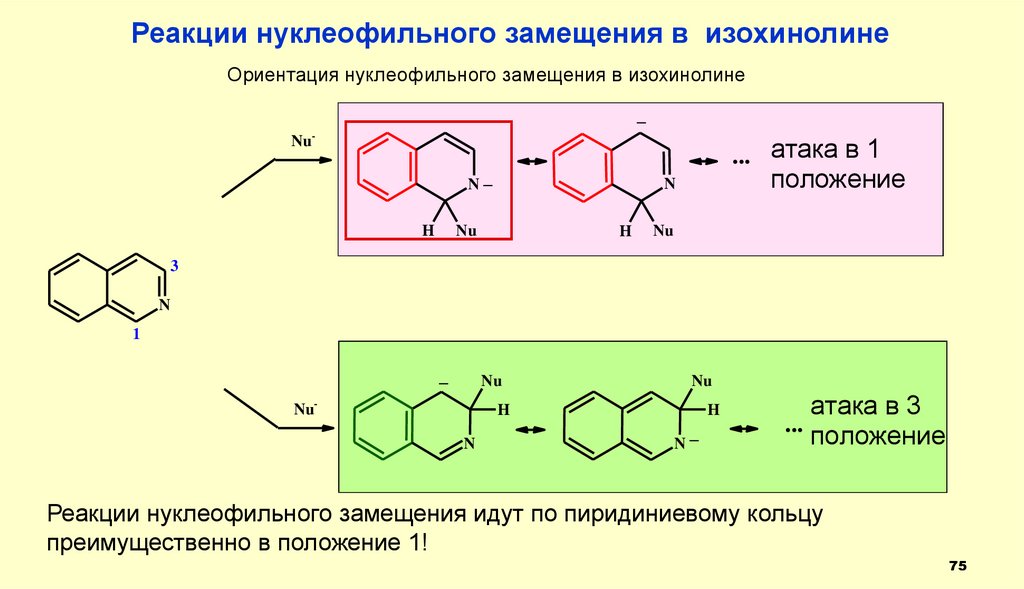
Реакции нуклеофильного замещения в изохинолинеОриентация нуклеофильного замещения в изохинолине
_
Nu-
... атака в 1
N_
H
положение
N
Nu
H
Nu
3
N
1
_
Nu
Nu-
Nu
H
N
H
N
_
атака в 3
...
положение
Реакции нуклеофильного замещения идут по пиридиниевому кольцу
преимущественно в положение 1!
75
76.
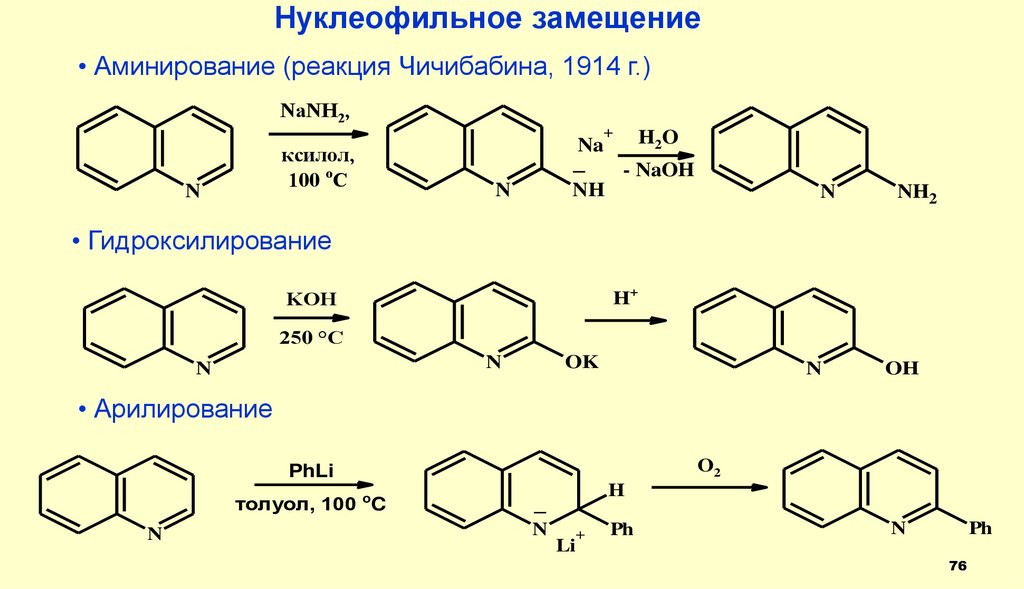
Нуклеофильное замещение• Аминирование (реакция Чичибабина, 1914 г.)
NaNH2,
+
ксилол,
100 oC
N
H2O
Na
_
N
- NaOH
NH
N
NH2
• Гидроксилирование
H+
KOH
250 °C
N
N
OK
N
OH
• Арилирование
O2
PhLi
толуол, 100 oC
N
H
_
N
+
Ph
N
Ph
Li
76
77.
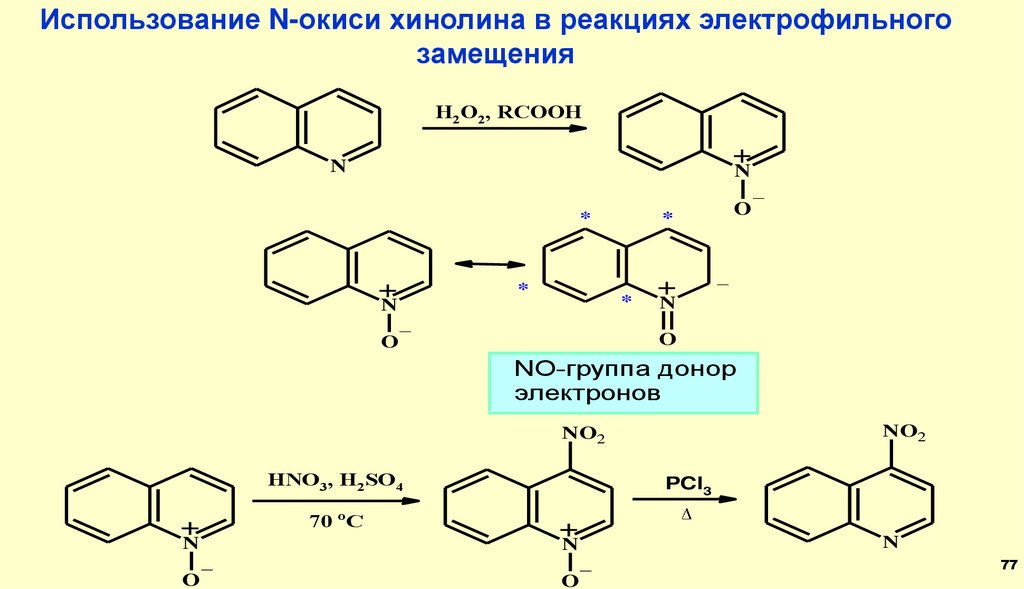
Использование N-окиси хинолина в реакциях электрофильногозамещения
H2O2, RCOOH
+
N
N
_
*
+
*
*
N
O
*
+
_
N
_
O
O
NO-группа донор
электронов
NO2
NO2
HNO3, H2SO4
70 oC
+
N
PCl3
+
_
O
N
N
_
O
77
78.
Реакции по боковой цепи гомологов хинолинаСвязи С-Н у α-углеродного атома боковой цепи 2- и 4-алкилхинолинов обладают довольно высокой
кислотностью
Ph
CH3
O
+
HCl,
Ph
H
N
N
O
+
N
CH3
+
CH3
Ph
пиперидин
EtOH,
H
+
N
Ph
CH3
78
79.
Окислительно-восстановительные реакции хинолинаKMnO4
KOOC
HCl
HOOC
KOH, to
N
KOOC
N
HOOC
N
хинолиновая кислота
H
H
Na, NH3 (ж)
-33 oC
N
N
H
1,4-дигидрохинолин
CH3
CH3
H2, Pt
140 oC
N
CH3
N
CH3
5,6,7,8-тетрагидрохинолин
79















 biology
biology chemistry
chemistry