Similar presentations:
Гетероциклические соединения
1.
Гетероциклическиесоединения
2.
Гетероциклическими соединенияминазывают циклические органические
соединения, в состав цикла которых
кроме атомов C входят один или
несколько гетероатомов.
К данному классу относятся
соединения, играющие
первостепенную роль в природе,
медицине, технике ( нуклеиновые
кислоты, ряд витаминов, алкалоиды,
гем крови, хлорофилл, красители,
органические полупроводники и др.).
3. Ароматические гетероциклические соединения
• «Ароматические cв-ва» или«ароматичность» - это cвва соединений при видимой
ненасыщенности проявлять
св-ва предельных
соединений.
4.
• Ароматические ГЦ соединенияобладают всеми признаками
ароматичности.
• В соответствии с правилом
Хюккеля явл-ся плоскими
циклическими сопряженными
системами с числом
сопряженных π- и n-электронов,
равным N=4n+2, где n=0, 1, 2,
любое целое число.
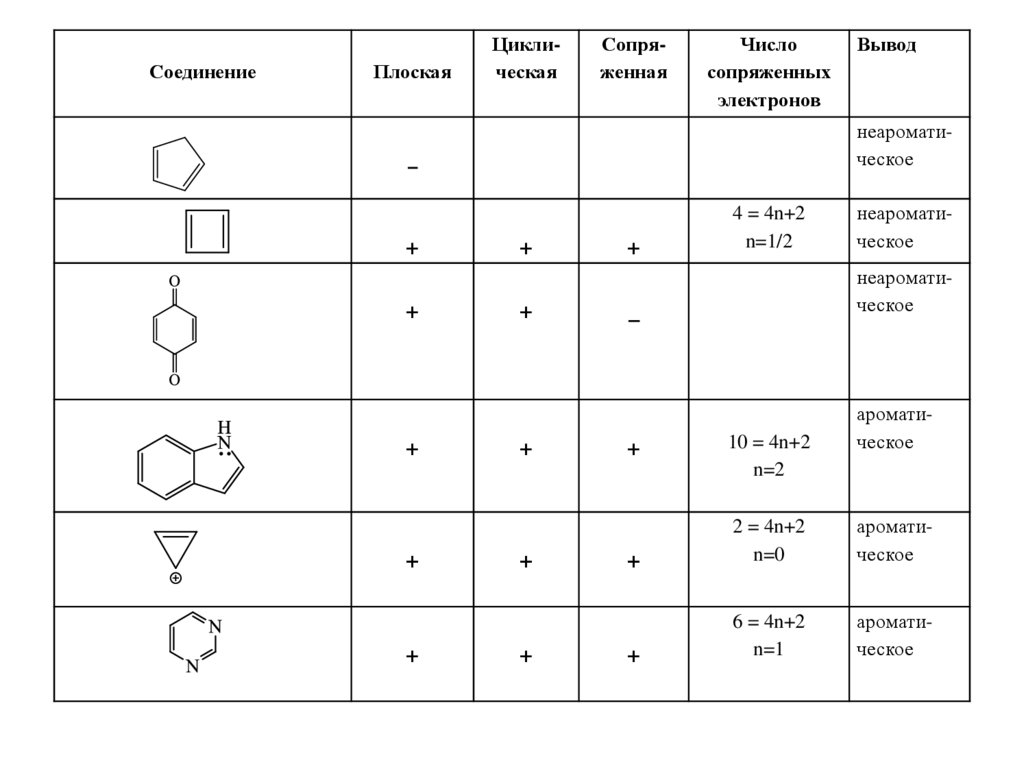
5.
СоединениеПлоская
Циклическая
Сопряженная
Число
сопряженных
электронов
неароматическое
_
+
+
+
+
+
Вывод
+
+
+
+
+
+
4 = 4n+2
n=1/2
неароматическое
_
неароматическое
+
ароматическое
10 = 4n+2
n=2
+
2 = 4n+2
n=0
ароматическое
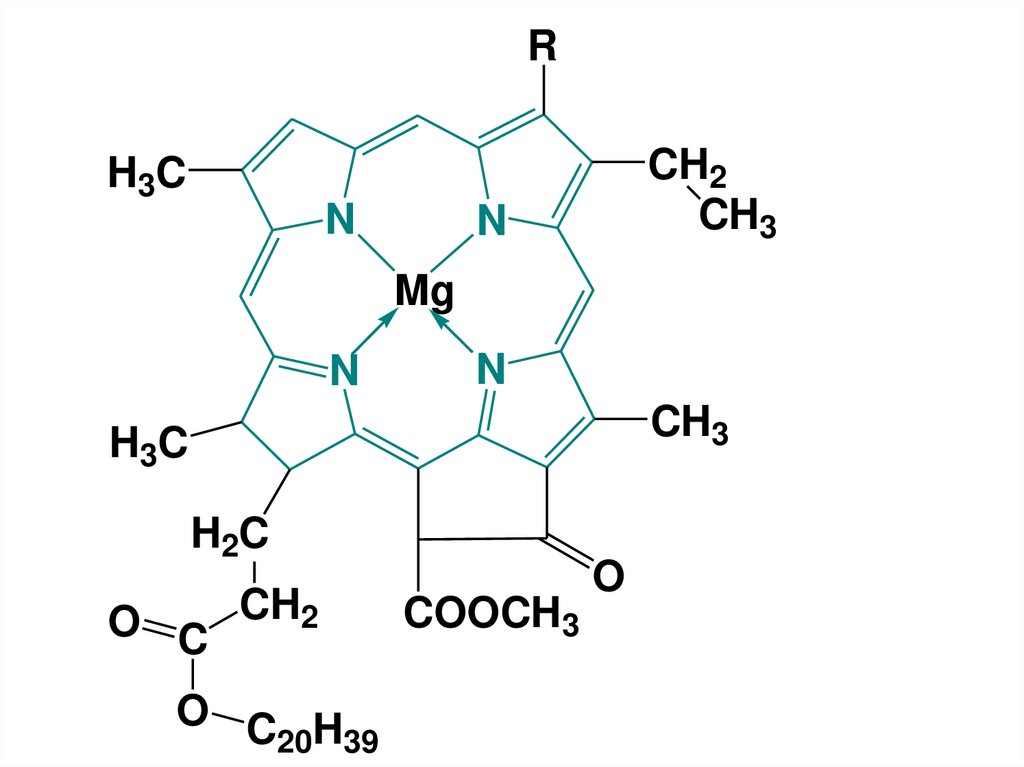
+
6 = 4n+2
n=1
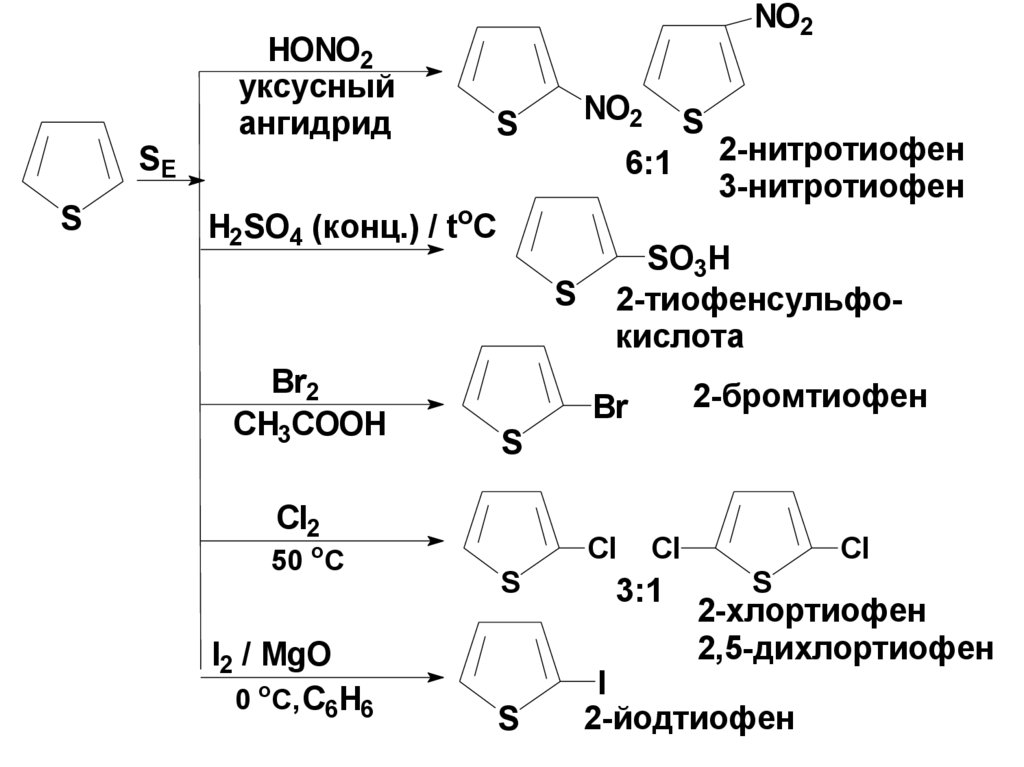
ароматическое
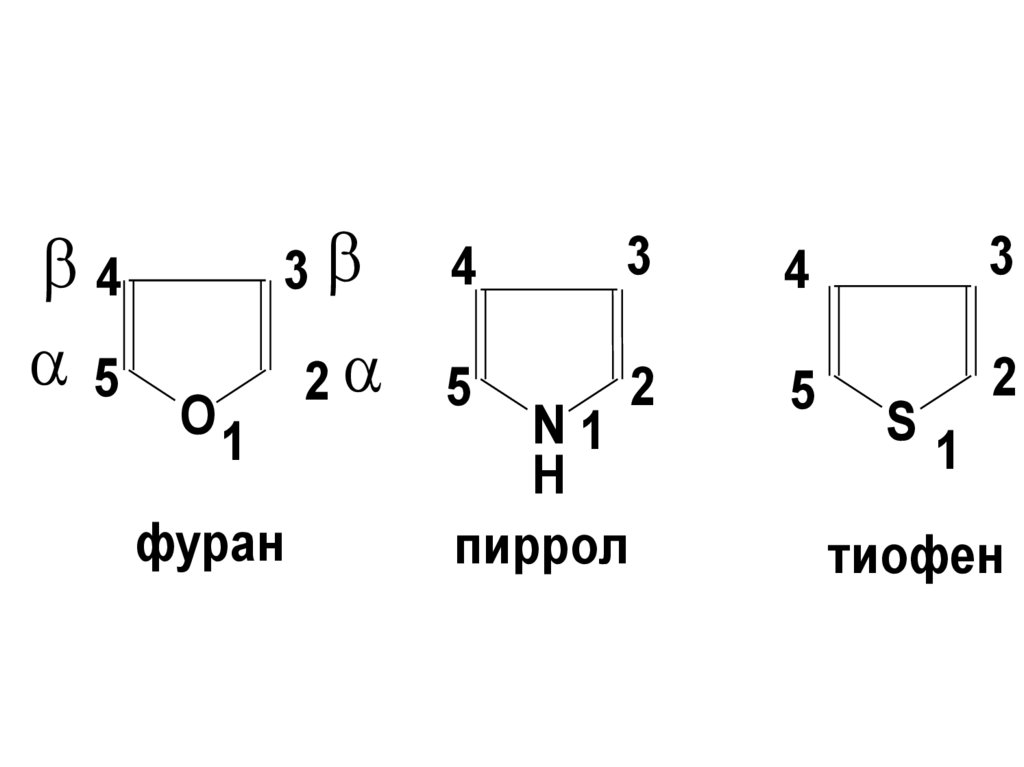
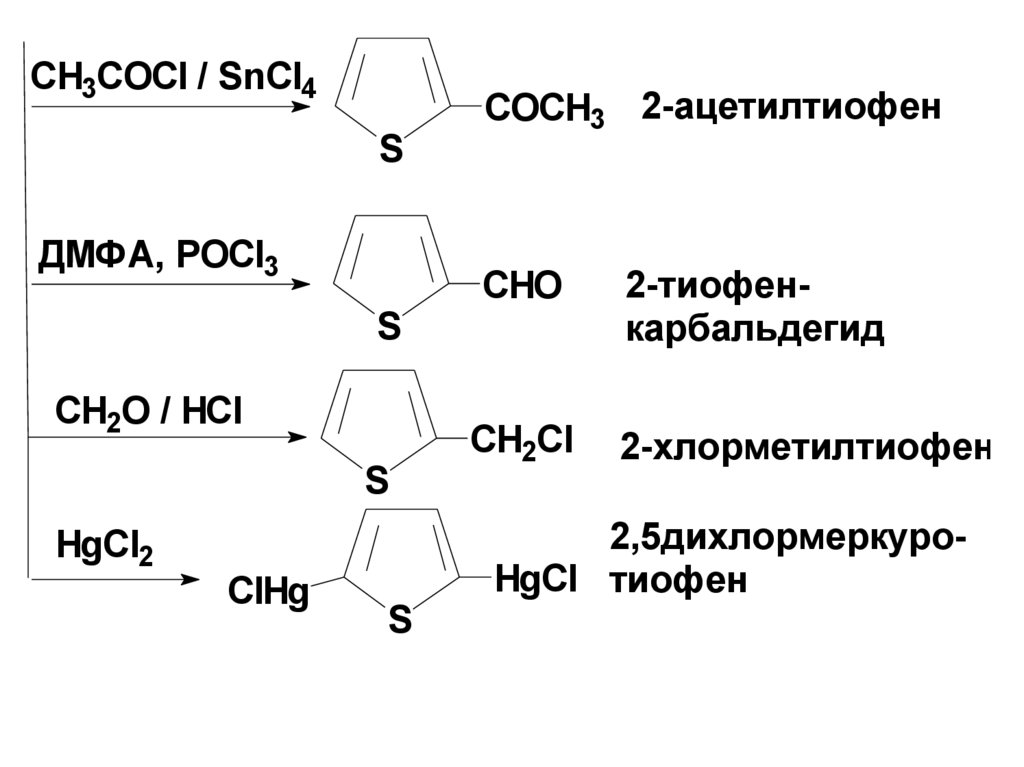
6.
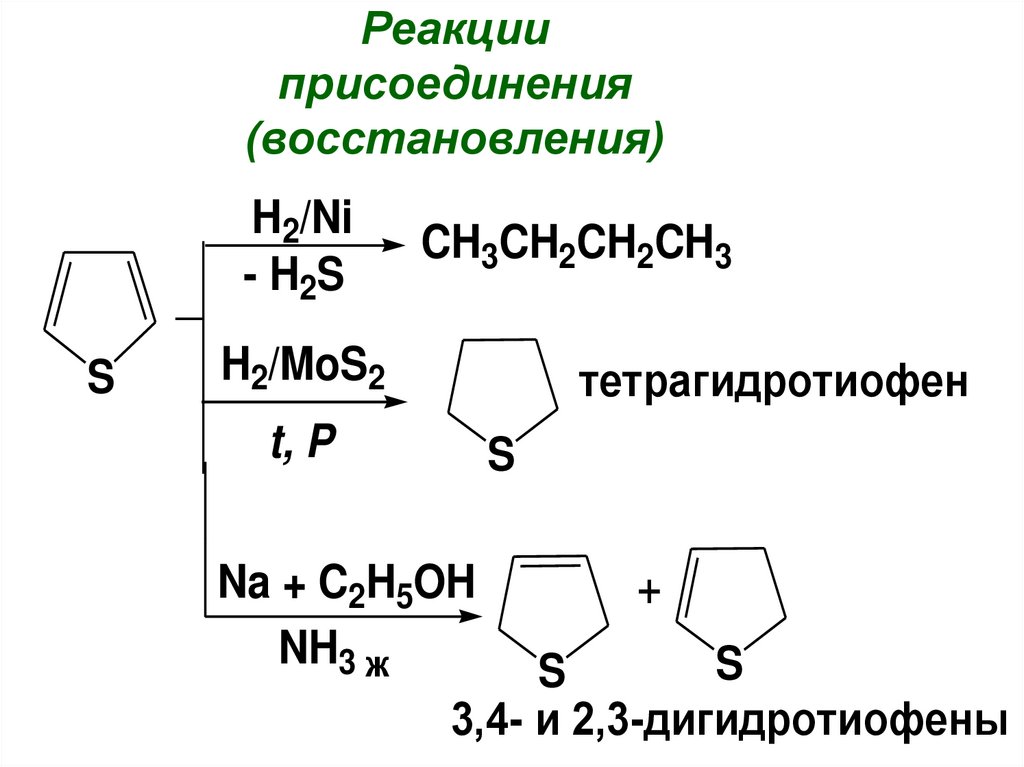
пятичленныегетероциклические
соединения
7.
45
3
4
3
4
3
2
5
2
5
2
O1
фуран
N1
H
пиррол
S
1
тиофен
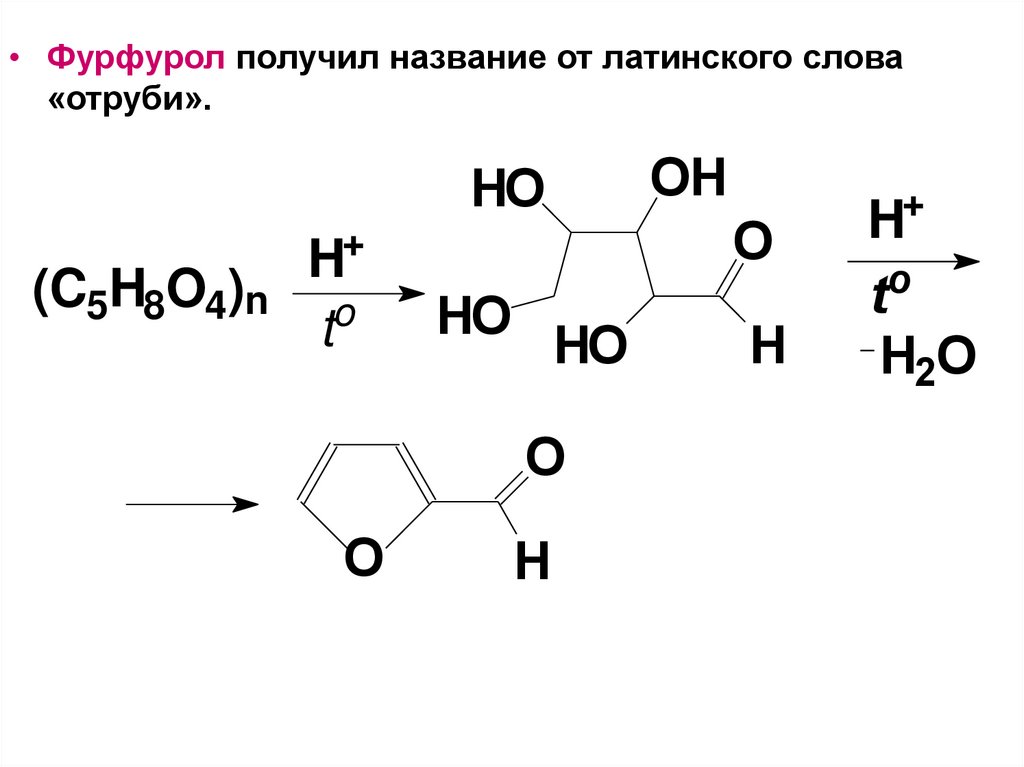
8. СПОСОБЫ ПОЛУЧЕНИЯ
• 1.Промышленные способы• Фуран и его производные – из
легкодоступного пентозансодержащего
растительного сырья (отходы
древесины, кукурузные кочерыжки,
рисовые отруби).
• ПС пентозаны в присутствии кислот при
нагревании подвергаются гидролизу до
МС пентоз, которые затем превращаются
в 2-фуранальдегид (фурфурол).
9.
• Фурфурол получил название от латинского слова«отруби».
OH
HO
O
+
(C5H8O4)n
H
to
HO
HO
O
O
H
H
H+
o
t
H2O
10.
• Пиррол – при фракционнойперегонке каменноугольной смолы.
• Тиофен – смесь бутана, бутенов и
бута-1,3-диена с серой подвергают
высокотемпературной обработке.
o
S
н-бутан
600 C
H 2S
S
тиофен
11.
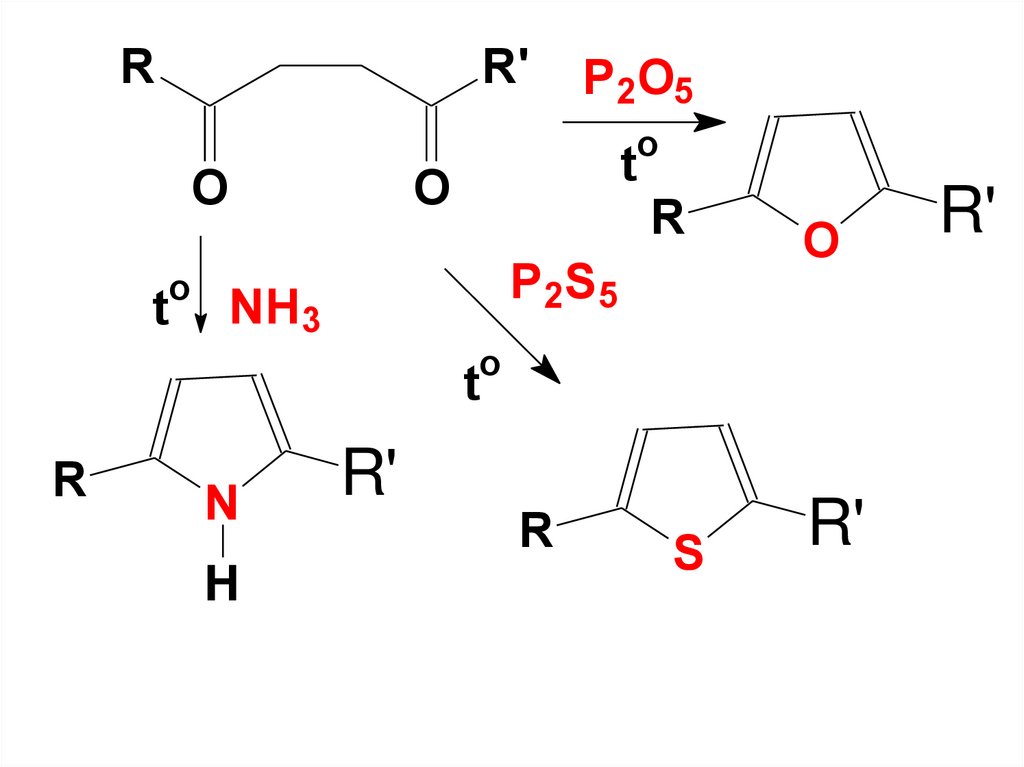
• 2. Лабораторные способы• а) из алифатических 1,4-дикарбонильных
соединений.
• При нагревании этих соединений в
присутствии дегидратирующих реагентов
(Р2О5, Н2SO4 ) образуются производные
фурана,
в присутствии NH3 или аминов –
производные пиррола,
фосфорных соединений серы (Р2S5, P2S3) –
производные тиофена.
12.
RR'
O
o
t
P2O5
o
t
O
R
O
S
R'
P2S5
NH3
o
t
R
N
H
R'
R
R'
13.
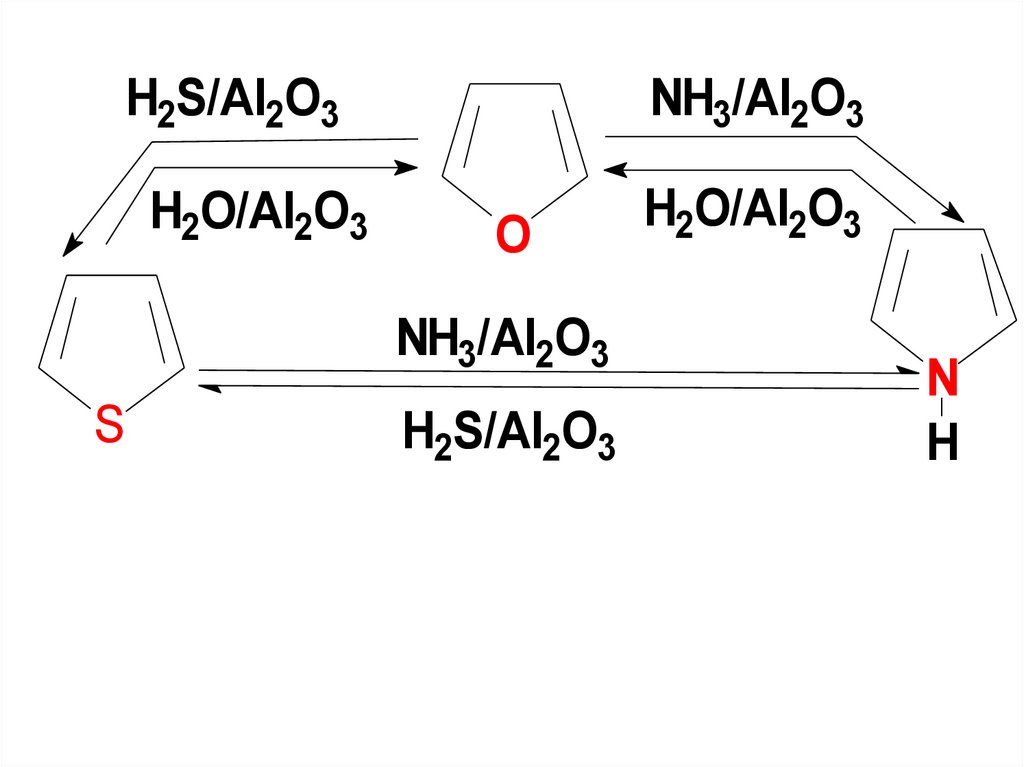
• б) Взаимопревращения фурана,пиррола и тиофена: цикл Юрьева.
Превращения происходят под
д-ем соответствующих реагентов
при т-ре ~400oC в присутствии катра Al2O3.
• Однако эту р-цию можно рассматривать только как
метод синтеза пиррола и тиофена из фурана, т.к.
выход фурана низкий.
14.
H2S/Al2O3NH3/Al2O3
H2O/Al2O3
H2O/Al2O3
O
NH3/Al2O3
S
H2S/Al2O3
N
H
15.
• г) Из бутин-1,4-диола и аммиака вприсутствии катализатора
H2C C
OH
C CH2
OH
o
300
C
NH3,
Al2O3 (95% )
ThO2 (5 % )
N
H
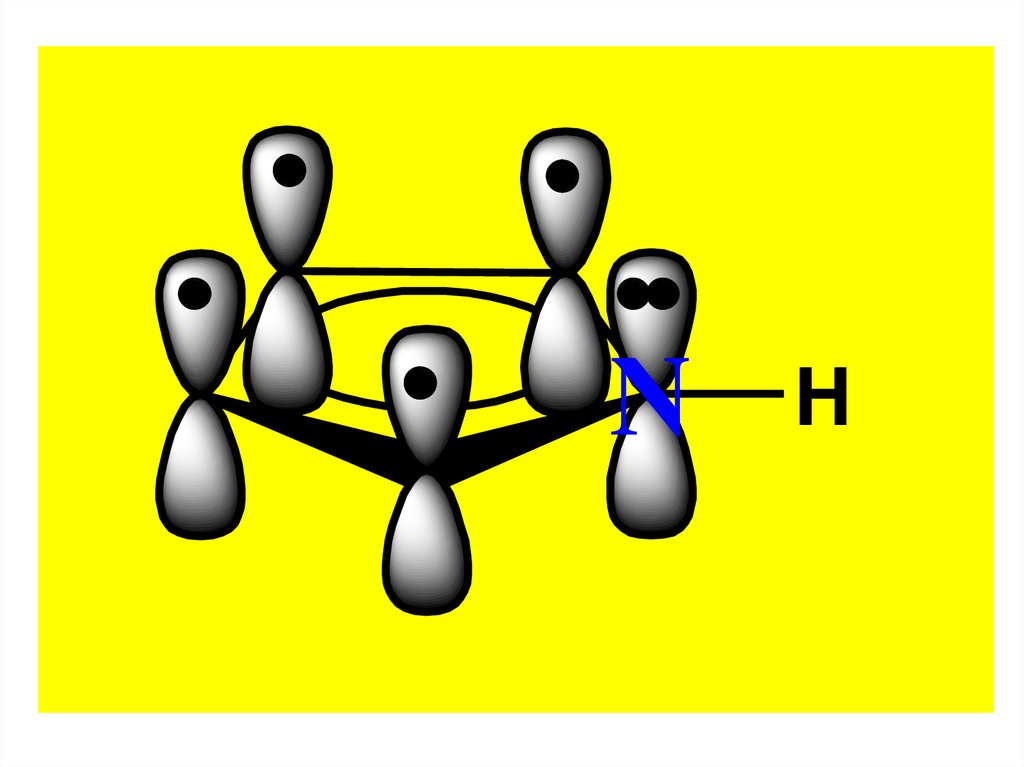
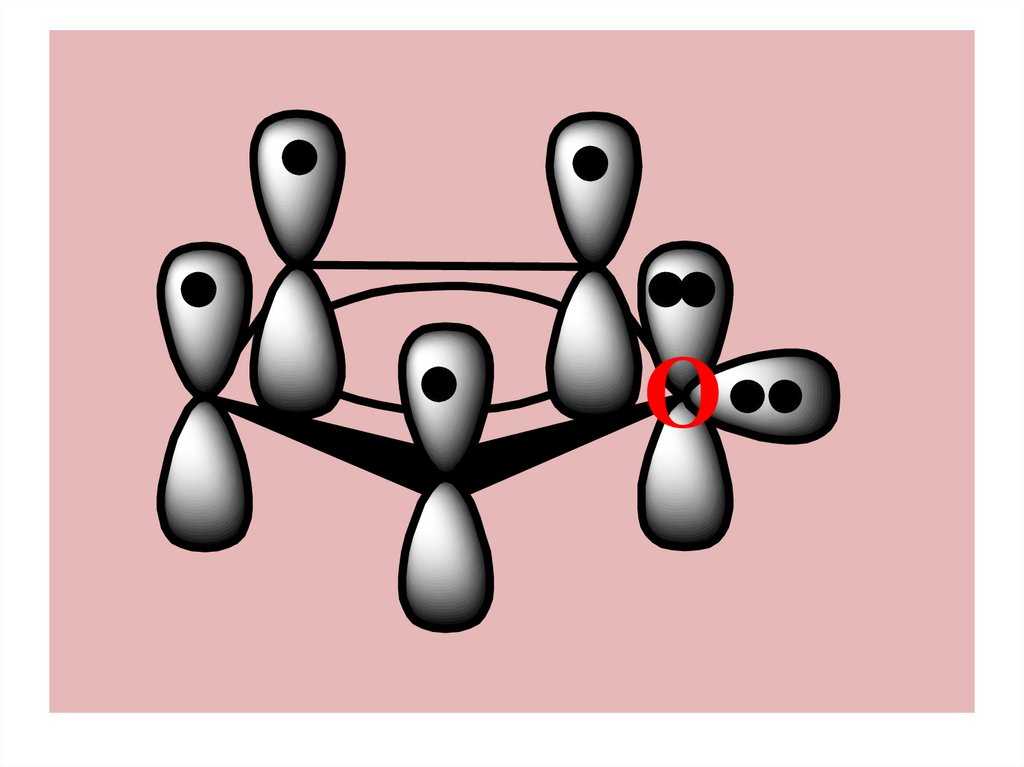
16. СТРОЕНИЕ
Молекулы всех этих гетероцикловимеют плоское строение.
Ароматический секстет πэлектронов образуется за счет 4
электронов атомов С и
2-х неподеленных электронов
гетероатомов, находящихся на
негибридизованных pz-орбиталях.
17.
NH
18.
O19.
• Теория резонанса подтверждаетароматический характер фурана,
пиррола и тиофена.
X
X
X
а
в
с
X
X
d
e
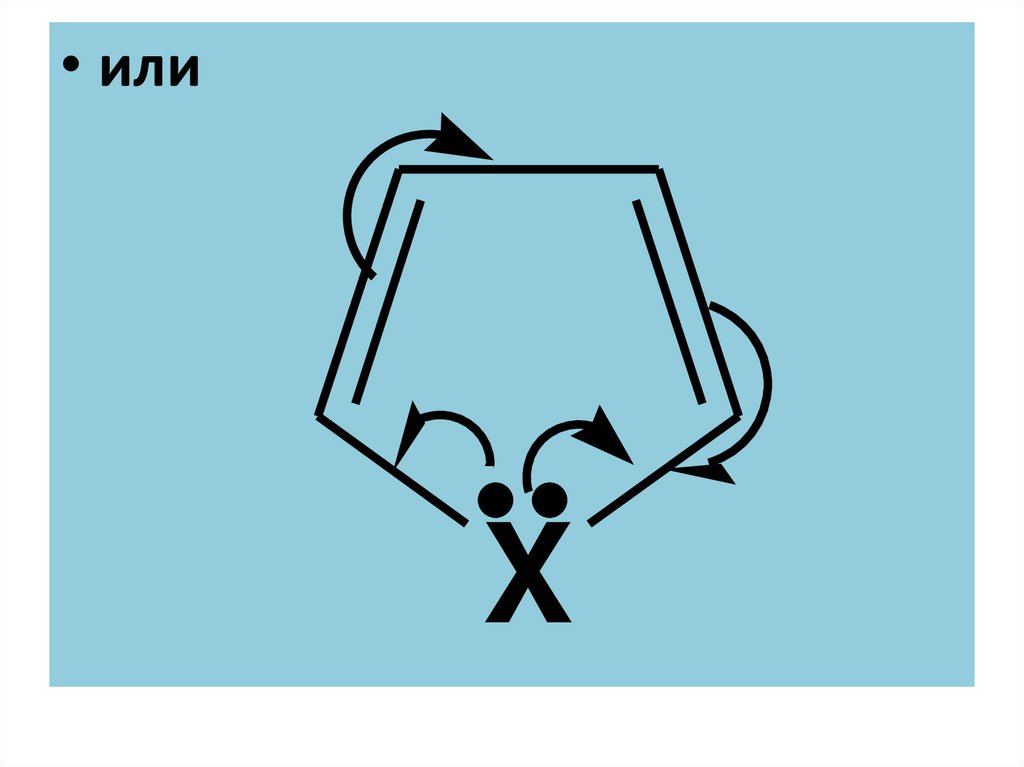
20.
• илиX
21.
• Наблюдается отклонение от принципааддитивности параметров связей и
молекулы в этих системах – сокращены
длины связей С-С, С-О, C-N, C-S,
удлинены С=С-связи, не равны ∆Нс и
∆На экспериментальные и расчетные,
т. е. для них характерна Ест (кДж/моль).
22.
Ест (кДж/моль)Фуран
92,4
Пиррол Тиофен Бензол
109,2
130,2
152
• По сравнению с бензолом у ГЦ
вследствие несимметричности
системы стабильность ниже и
электронная плотность
распределена неравномерно.
23.
• Все три гетероаренаотносятся к числу
электроноизбыточных
гетероциклов:
6 π-электронов
распределены между 5
атомами С
24.
У ароматических 5-членных ГЦнаряду с –I-эффектом действует
+M-эффект, направленный в
противоположную сторону.
• В целом электронная плотность
смещена от гетероатома на Сатомы цикла, в результате чего на
них возникает повышенная эл-ая
плотность, больше в αположении.
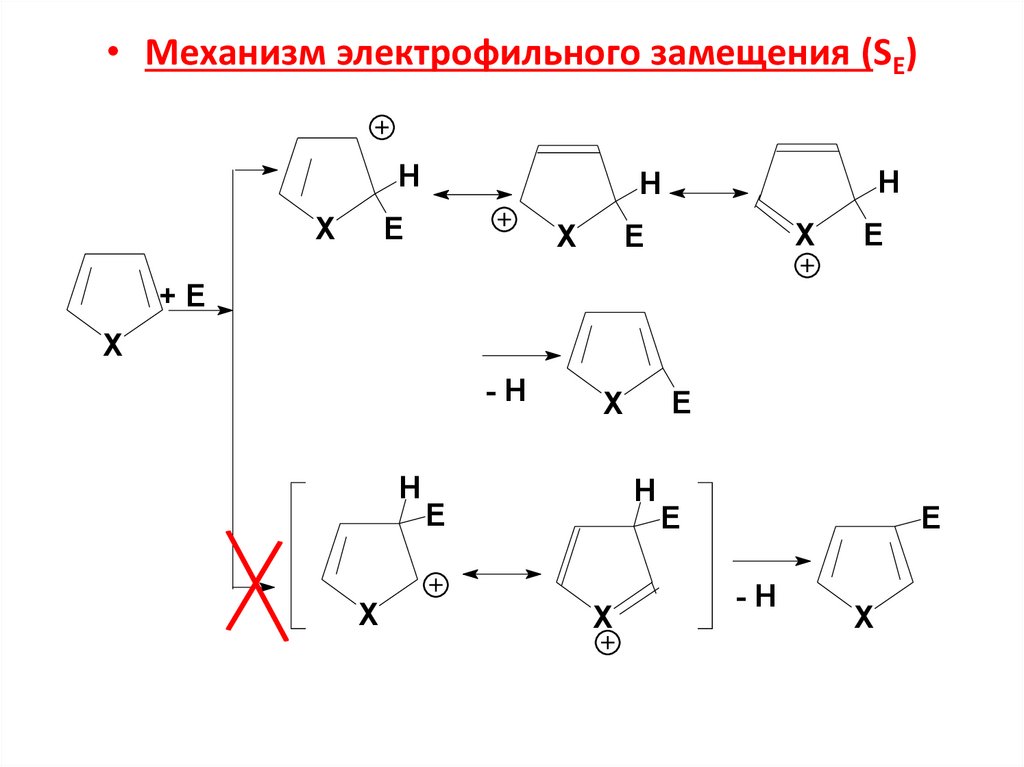
25. ХИМИЧЕСКИЕ СВОЙСТВА
• 1) 5-членные ГЦ обладают«ароматическими cв-вами», т. е. обладая
относительной устойчивостью к р-ям
присоединения склонны к SЕ-р-ям.
• По сравнению с бензолом они
обладают более высокой реакционной
способностью в SЕ-р-ях.
• Подобны в SЕ-р-ях на фенолы и
ароматические амины.
26.
• Относительнаяактивность
гетероаренов в SE
реакциях:
• пиррол > фуран > тиофен
27.
• Т.к. в α-положении δ- -заряд больше,то электрофил атакует
• α-положение, (если оба α-положения
заняты, то β).
• Направление замещения
объясняется также большей
стабильностью σ-аддукта
образующегося в lim стадии.
28.
• Механизм электрофильного замещения (SЕ)H
E
X
H
H
X
E
X
E
+E
X
-H
H
X
E
X
H
E
X
E
E
-H
X
29.
• 2) Пятичленныегетероароматические
соединения
ацидофобны (дословно
– боятся к-т). В присутствии
сильных кислот они
протонируются с нарушением
сопряжения π-электронной
системы.
30.
HH
N
H
N
H
H
H
H
N
H
H
N
H
H
H
N
H
H
31.
• С-протонирование энергетически болеевыгодно, чем N-протонирование.
Протонированные молекулы ведут
себя, как сопряженные диены,
полимеризуются и осмоляются.
• В этой связи для осуществления
SЕ-р-ий используют более мягкие
условия, исключающие сильно кислую
среду.
32.
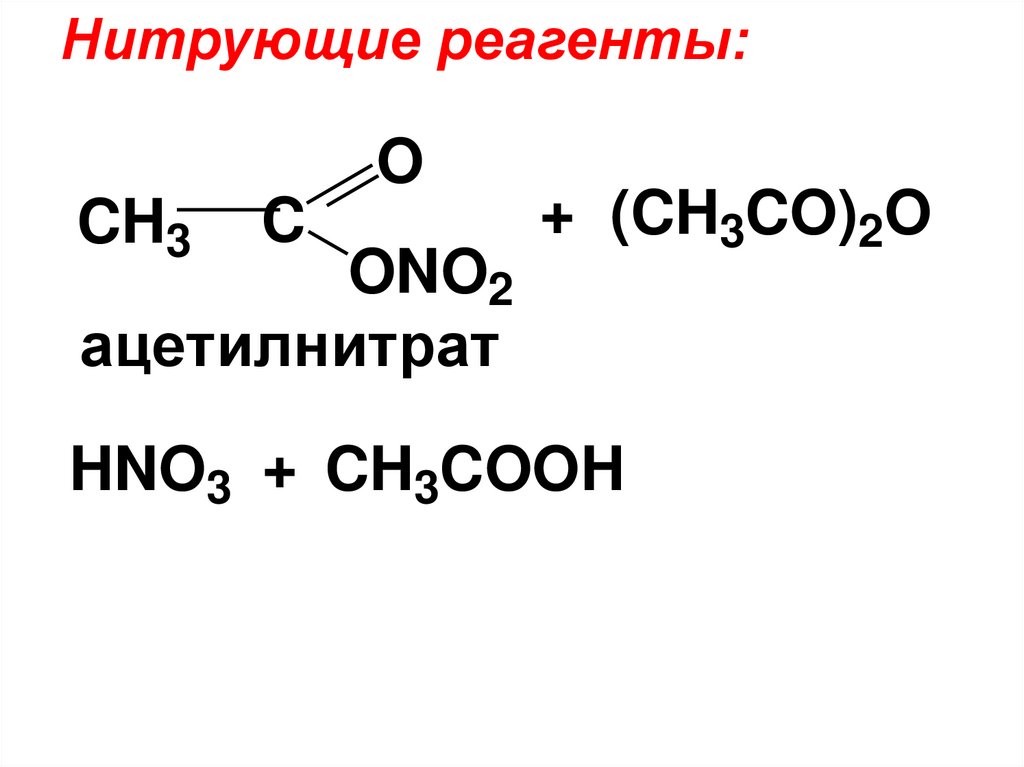
Нитрующие реагенты:O
CH3
C
ONO2
ацетилнитрат
+ (CH3CO)2O
HNO3 + CH3COOH
33.
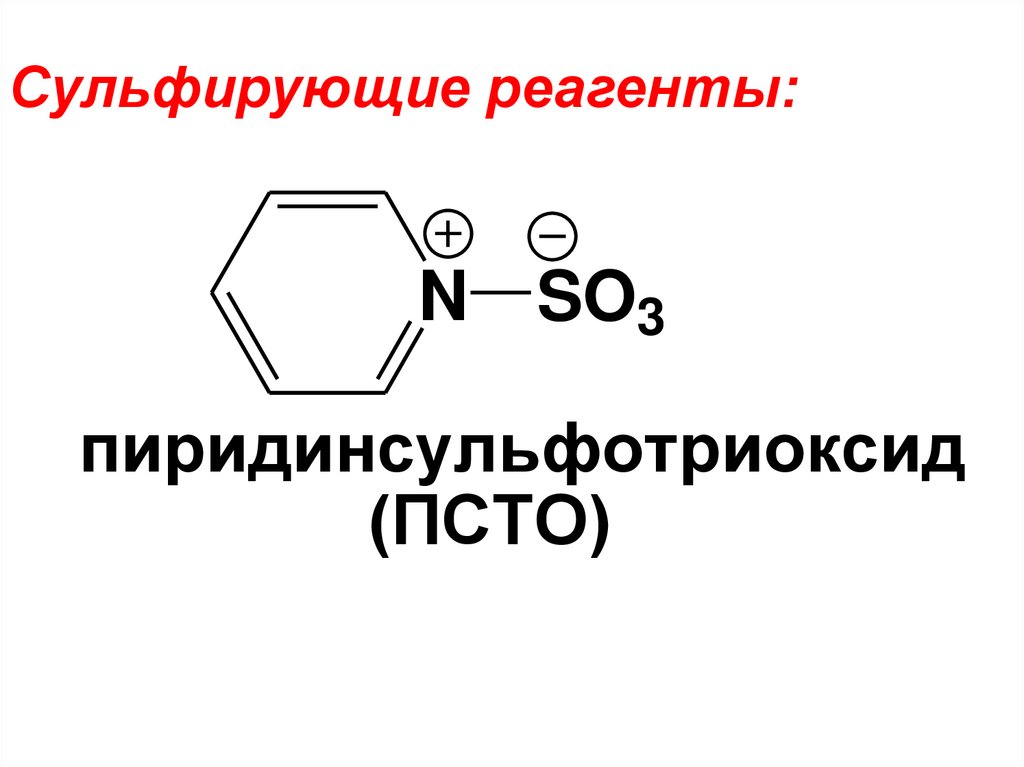
Сульфирующие реагенты:N SO3
пиридинсульфотриоксид
(ПСТО)
34.
Ацетилирующие реагенты:(CH3CO)2O + кислота Льюиса
BF3, SnCl4, ZnCl2
35.
• 3) Основность - низкая, т.к.пара эл-ов гетероатома
занимает р-орбиталь, к-рая
участвует в образовании
5-центровой МО, т.е. эта пара
делокализована и не
принадлежит в полной мере
гетероатому.
36.
• 4) Реакции нуклеофильногозамещения мало характерны.
• Фуран, тиофен, N-алкилзамещенные
пирролы под д-ем очень сильных
оснований (С4Н9Li) способны
металлироваться по α-положению.
• Пиррол под д-ем сильных оснований
(С4Н9Li, NaNH2, KOH, RMgX) ведет себя
как NH-кислота и депротонируется.
37.
• 5) Склонность вступать в рции 1,4-циклоприсоединения(как сопряженного диена) снижается в ряду
• Фуран > пиррол > тиофен
• Это согласуется с изменением
ароматичности этих
гетероциклов.
38.
• 6) Окисление - можноосуществлять разл.
окислителями.
39. Фуран
Бесц. Ж., Тк.= 31оС, имеет запаххлороформа.
В воде н/р.
Фуран и его гомологи сод-ся в древесном
дегте.
Обладает cв-вами, промежуточными
между cв-ами ароматических соединений
и обычного диена.
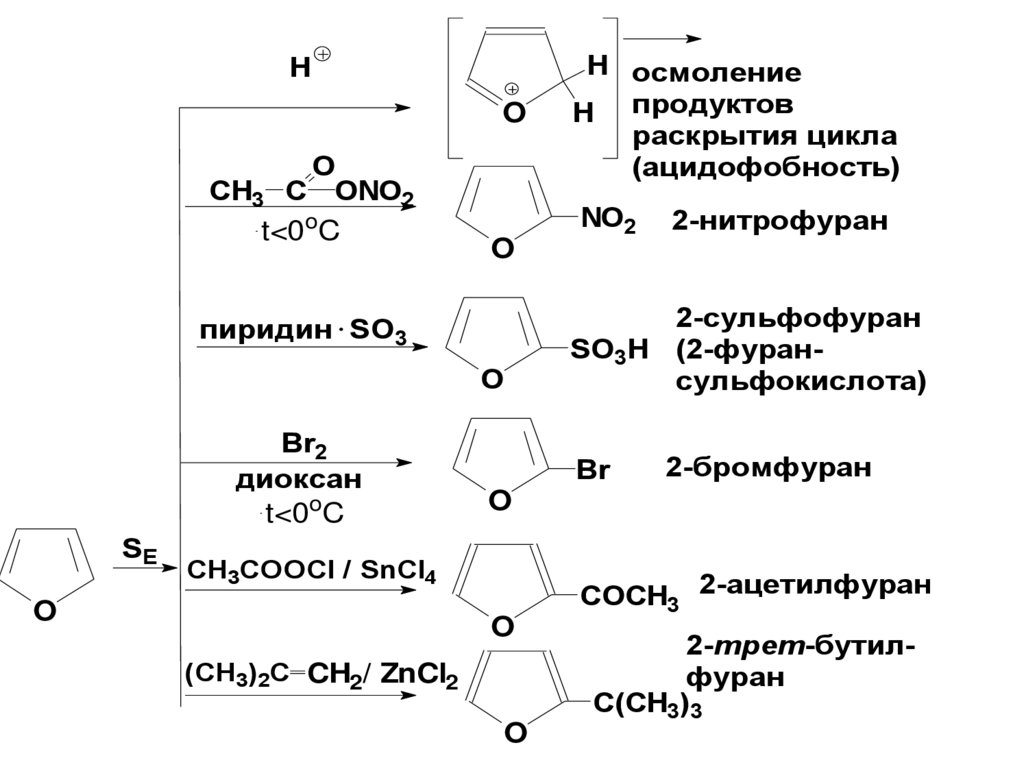
40.
Реакцииэлектрофильного
замещения
41.
HO
O
CH3 C ONO2
t<0oC
O
пиридин SO3
О
Br2
диоксан
t<0oC
SE
NO2
2-нитрофуран
2-сульфофуран
SO3H (2-фурансульфокислота)
Br
2-бромфуран
O
CH3COOCl / SnCl4
O
H осмоление
H продуктов
раскрытия цикла
(ацидофобность)
O
(CH3)2C CH2/ ZnCl2
O
COCH3 2-ацетилфуран
2-трет-бутилфуран
C(CH3)3
42.
HCON(CH3)2, POCl3O
O
CH3 C СН3
H+
O
2-фуранкарбальдегид
CНO (фурфурол)
CH3
C OH
CH3
2-(2-гидроксипропил)фуран
43.
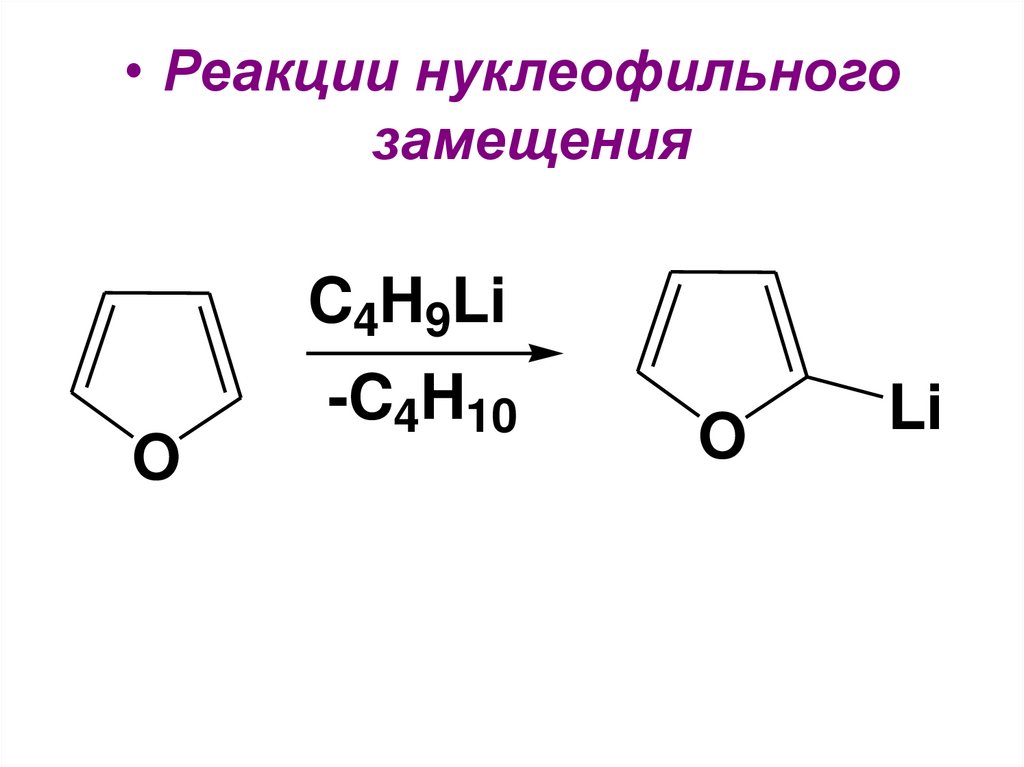
• Реакции нуклеофильногозамещения
C4H9Li
O
-C4H10
O
Li
44.
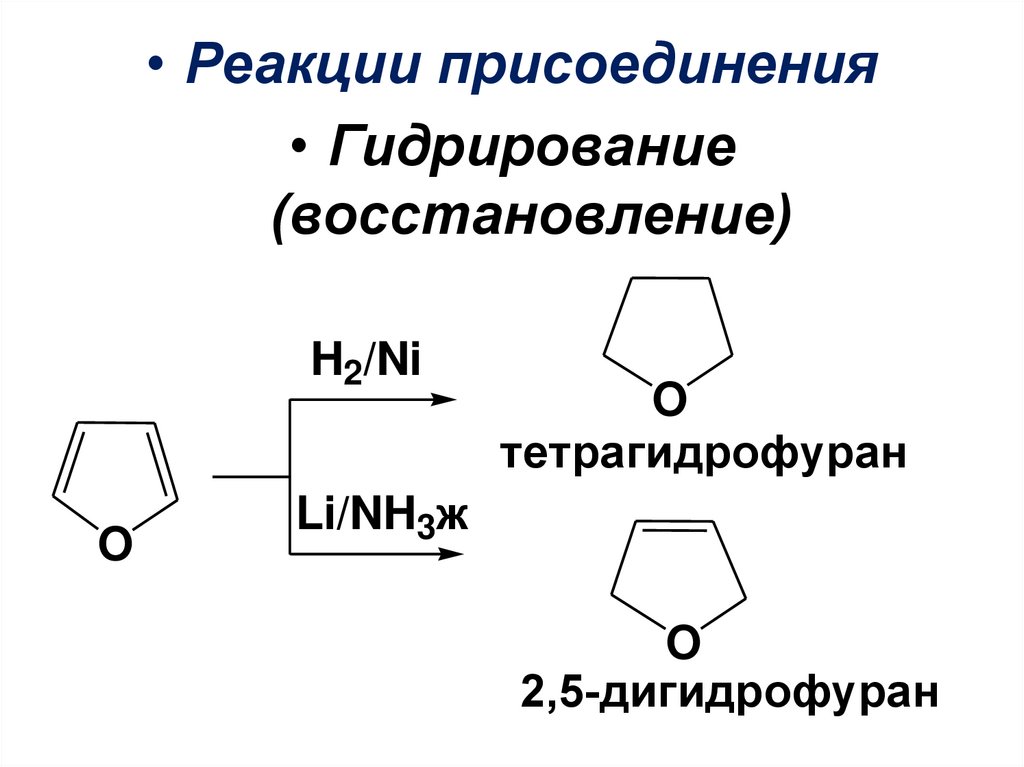
• Реакции присоединения• Гидрирование
(восстановление)
H2/Ni
O
O
тетрагидрофуран
Li/NH3ж
O
2,5-дигидрофуран
45.
• Реакции 1,4циклоприсоединенияO
O
+
O
O
малеиновый
ангидрид
O
O
O
O
46.
• Производные ФУРАНА• Наибольшее значение имеет
альдегид фурфурол.
• Его получают из растительного
сырья в результате кислотного
гидролиза пентозанов и
последующей дегидратации пентоз
(см. выше).
• По своему хим. поведению он
напоминает бензальдегид.
47.
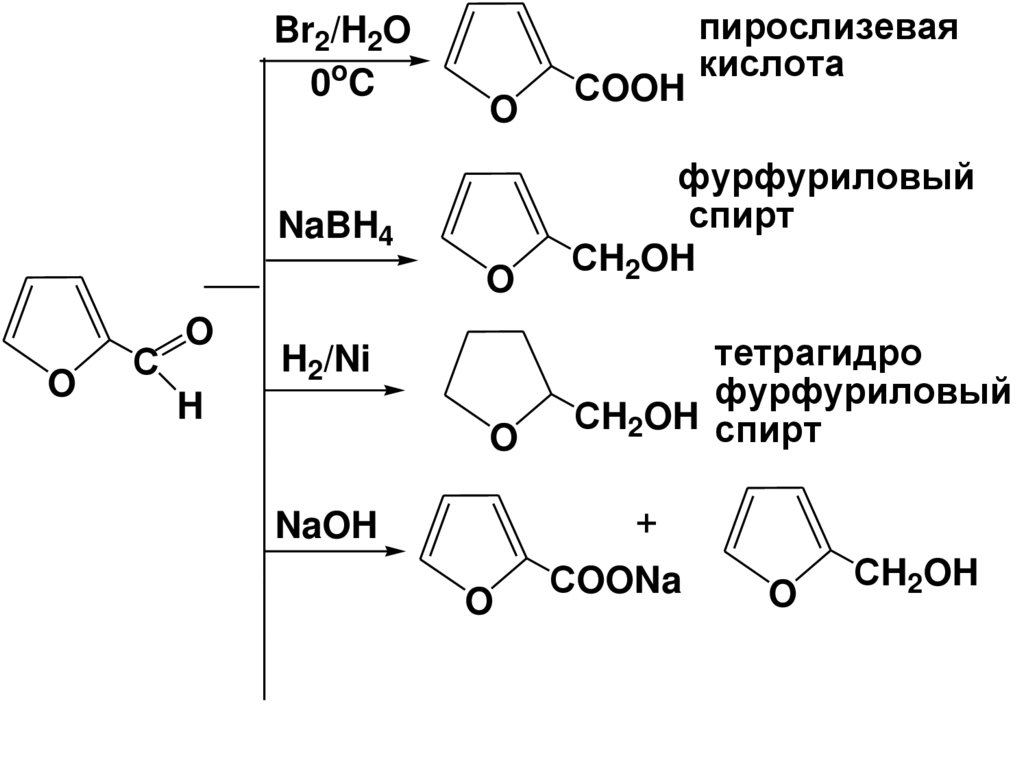
Br2/H2O0oC
O
O
фурфуриловый
спирт
СH2OH
O
тетрагидро
фурфуриловый
СH2OH спирт
NaBH4
O
С
O
H2/Ni
H
СOOH
пирослизевая
кислота
+
NaOH
O
СOONa
O
СH2OH
48.
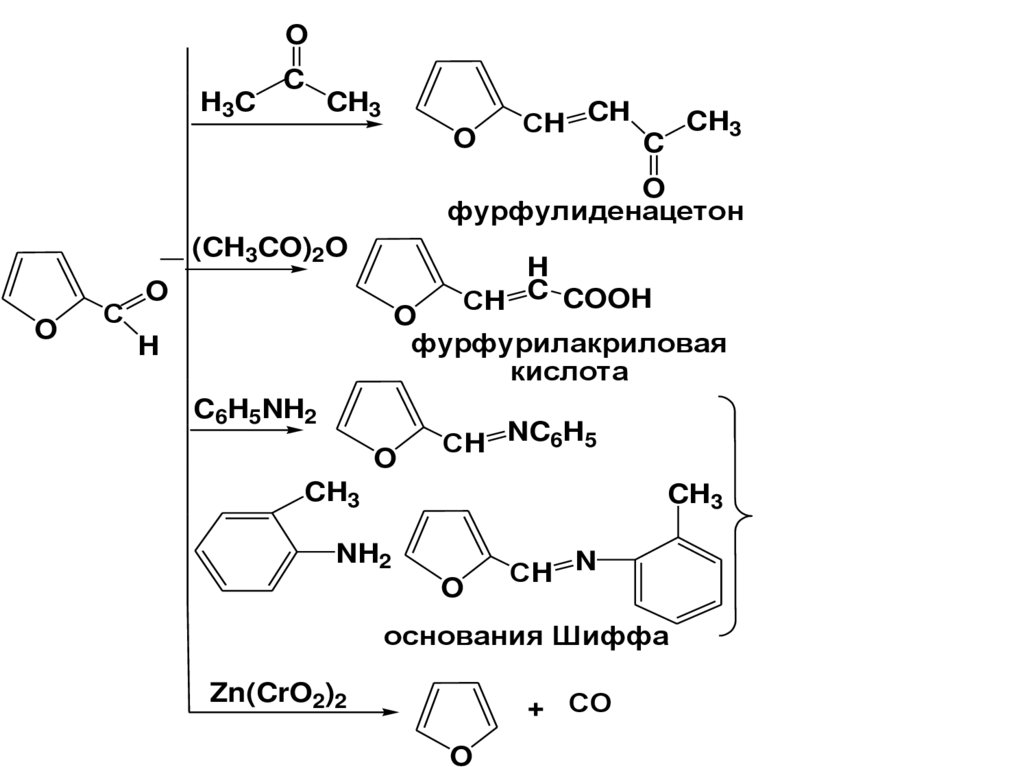
OH3C
C
CH3
O
СH CH
CH3
C
O
фурфулиденацетон
(CH3CO)2O
O
С
H
СH C COOH
O
O
фурфурилакриловая
кислота
H
C6H5NH2
O
СH NC6H5
CH3
CH3
NH2
O
СH N
основания Шиффа
Zn(CrO2)2
+ СО
O
49.
• Применение фуранаФуран очень ценный хим.
продукт, к-рый широко
используется в пром-сти:
50.
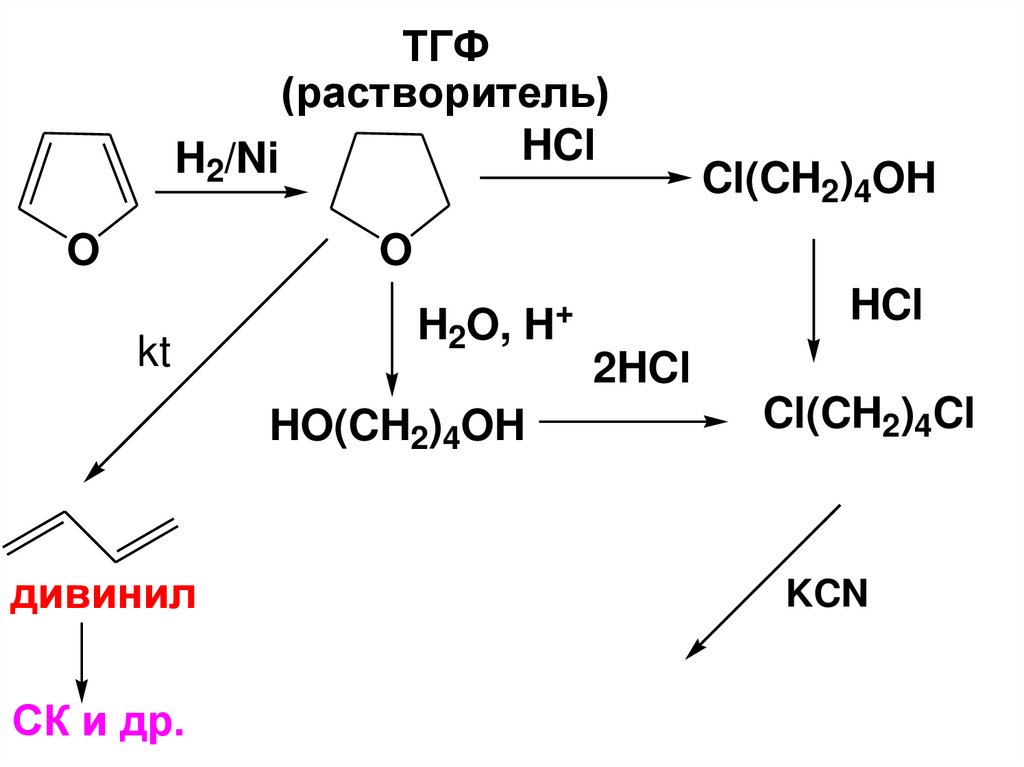
ТГФ(растворитель)
HCl
H /Ni
2
O
Cl(CH2)4OH
O
kt
H2O, H+
HO(CH2)4OH
дивинил
СК и др.
HCl
2HCl
Cl(CH2)4Cl
KCN
51.
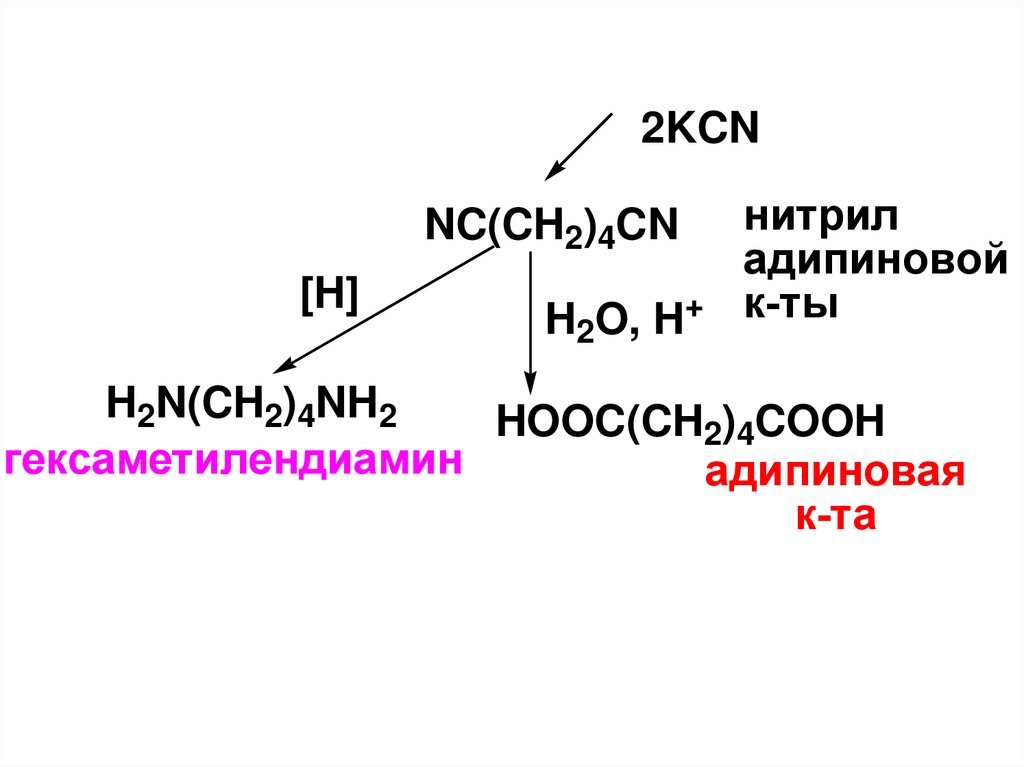
2KCNNC(CH2)4CN
[H]
H2O, H+
нитрил
адипиновой
к-ты
H2N(CH2)4NH2
HOOC(CH2)4COOH
гексаметилендиамин
адипиновая
к-та
52.
• Производные фурана довольно широкораспространены в природе. Фурановые
производные входят в состав многих
душистых в-в, биологически активных
в-в.
• Тетрагидрофурановый цикл входит в
состав микотоксинов ( мускарин – яд
красного мухомора).
• Вспомним, что тетрагидрофурановый
цикл образует основу углеводов,
имеющих фуранозное строение.
53.
• ПИРРОЛ• Жидкость, Тк=130оС, в воде
растворим плохо.
• Реакции электрофильного
замещения
54.
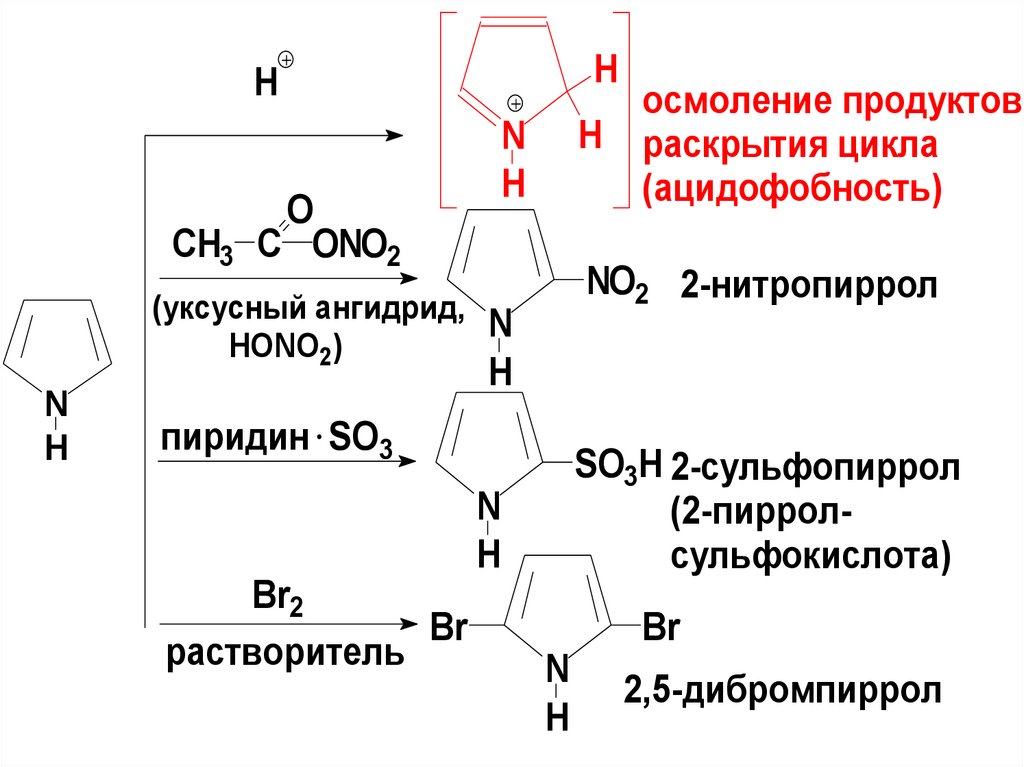
HH
O
CH3 C ONO2
H
N
H
NO2 2-нитропиррол
(уксусный ангидрид,
N
HONO2)
N
H
осмоление продуктов
раскрытия цикла
(ацидофобность)
H
пиридин SO3
Br2
Br
растворитель
SO3H 2-сульфопиррол
(2-пирролсульфокислота)
N
H
N
H
Br
2,5-дибромпиррол
55.
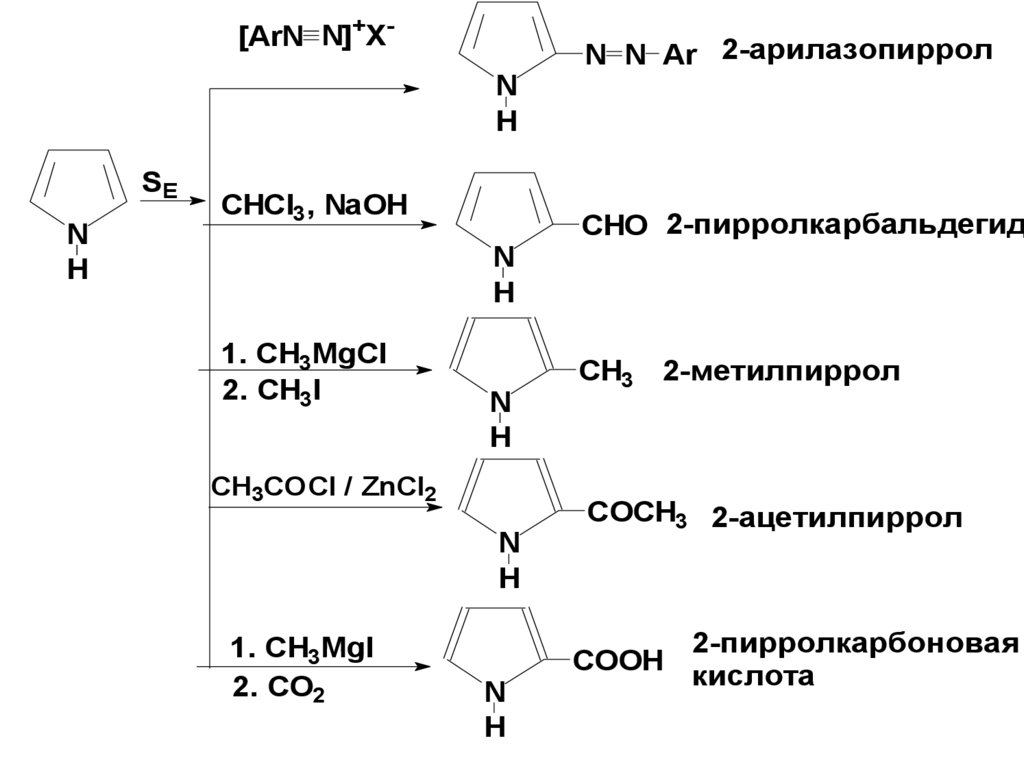
[ArN N]+XNH
SE
N
H
CHCl3, NaOH
N
H
1. СH3MgCl
2. CH3I
N
H
CH3COCl / ZnCl2
N
H
1. CH3MgI
2. CO2
N
H
N N Ar 2-арилазопиррол
CHO 2-пирролкарбальдегид
CH3 2-метилпиррол
COCH3 2-ацетилпиррол
COOH
2-пирролкарбоновая
кислота
56.
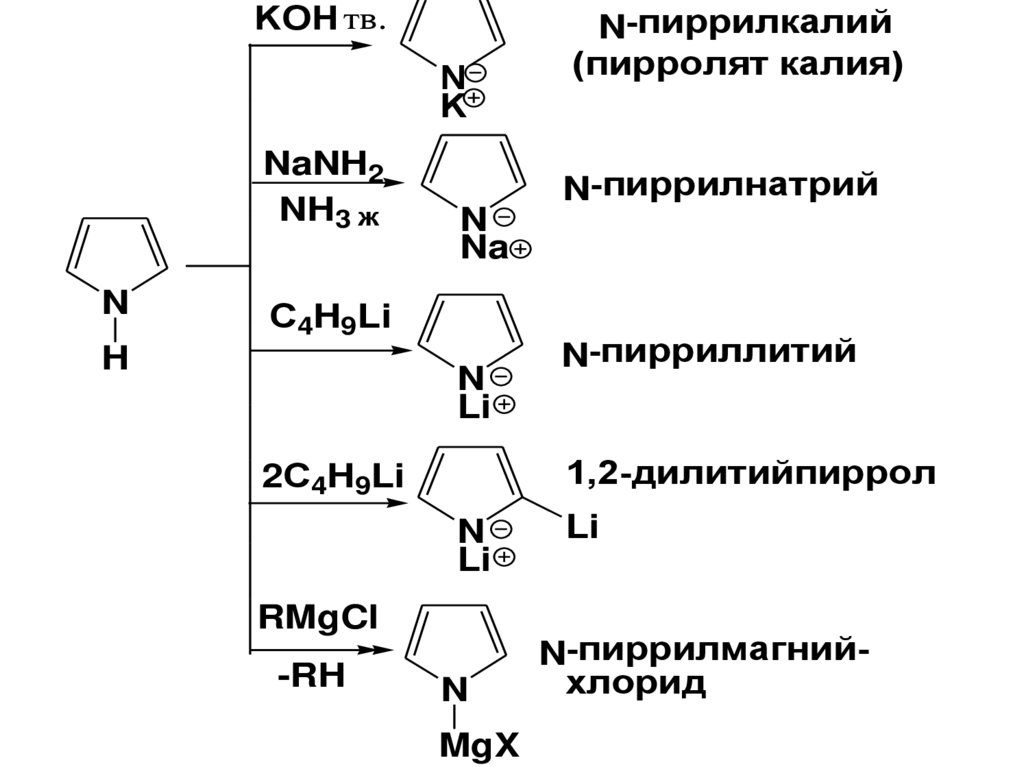
• Кислотность и реакциинуклеофильного замещения
• Пиррол имеет особые свойства – он
проявляет не только основные, но и
кислотные свойства, т.е. является
амфотерным.
• При действии сильных оснований пиррол
образует пирролят –ион.
• Является слабой к-той - Ка=5,4∙10-15 –
слабее, чем фенол, но сильнее анилина.
57.
KOH тв.N
K
NaNH2
NH3 ж
N
N
Na
С4H9Li
H
N
Li
N-пиррилнатрий
N-пирриллитий
1,2-дилитийпиррол
2С4H9Li
N
Li
RMgCl
-RH
N-пиррилкалий
(пирролят калия)
N
MgX
Li
N-пиррилмагнийхлорид
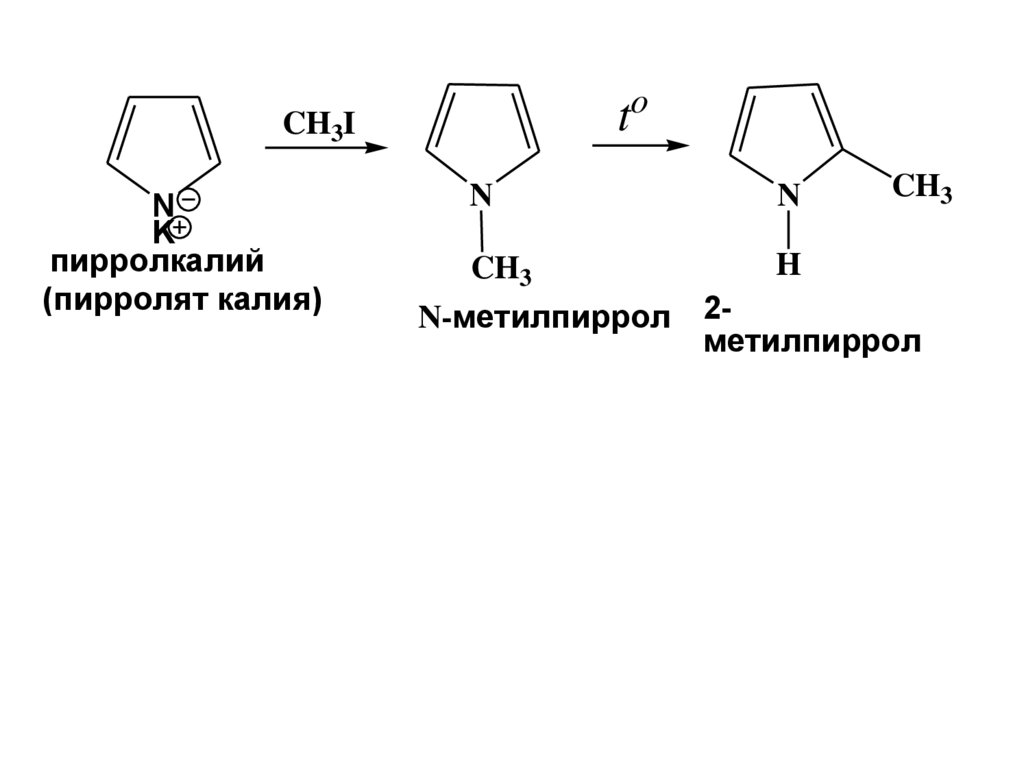
58.
toCH3I
N
K
пирролкалий
(пирролят калия)
N
N
CH3
H
CH3
N-метилпиррол 2метилпиррол
59.
• Реакции присоединения• (восстановления)
H2/Ni
CH3COOH
N
H
Zn
CH3COOH
пирролидин
N
H
2,5-дигидропиррол
N
H
60.
• Значение пиррола и егопроизводных
• Производные пиррола имеют большое
биологическое значение.
• Пиррольные ядра образуют основу
многих биологически важных пигментов
(красящих в-в) – пигментов крови
(гемоглобин) и зеленых частей растений
(хлорофилл), желчи, витамина В12.
61.
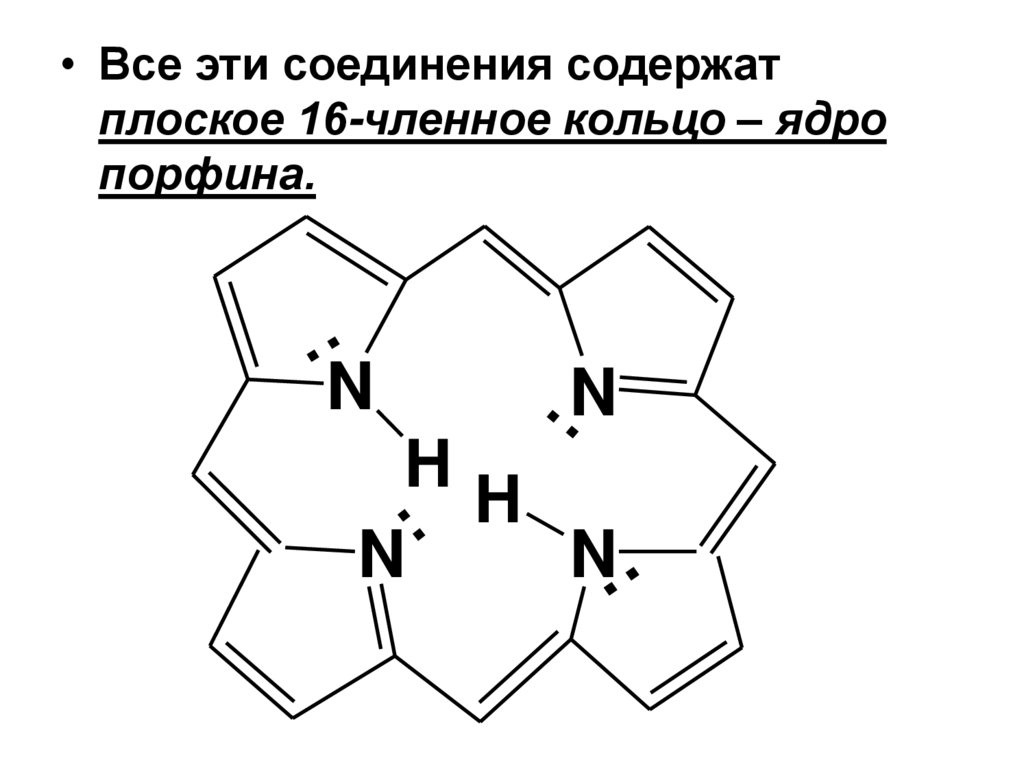
• Все эти соединения содержатплоское 16-членное кольцо – ядро
порфина.
..N
..N
..
H
H
N
N..
62.
• В порфине пиррольные остатки связаныметиновыми мостиками.
• Плоский макроцикл порфина является
ароматическим – сопряженная система
из 26 эл-ов. Ест=840кДж/моль, что
свидетельствует о высокой
стабильности порфина.
63.
• Порфины, входящие в составприродных пигментов имеют
заместители в пиррольных ядрах
(порфирины).
• Порфирины в природе находятся
в виде комплексов с ионами
металлов. Комплекс с ионом
железа явл-ся основой
гемоглобина, с ионом магния –
хлорофилла.
64.
HC CH2CH3
H3C
N
N
CH
CH2
Fe
N
N
CH3
H3C
H2C
CH2
COOH
H2C CH
2
COOH
65.
RCH2
CH3
H3C
N
N
Mg
N
N
CH3
H3C
H2C
O C CH2
O C H
20 39
COOCH3
O
66.
• Гемоглобин отвечает за обеспечениетканей кислородом, хлорофилл
принимает участие в трансформации
солнечной энергии в процессе
фотосинтеза.
Восстановленное пиррольное ядро
входит в состав природных АК и
алкалоидов.
67.
• ТИОФЕН• Жидкость, Тк=84оС, н/р в воде.
Спутник бензола, сод-ся в
каменноугольном бензоле (0,5%). В нем
он был и открыт Мейером.
• Это самый ароматический 5членный ГЦ.
• Р-ции сходны с SE -р-ми бензола, но
для тиофена протекают значительно
легче. (с. 540)
68.
SES
HONO2
уксусный
ангидрид
NO2
NO2
S
S
6:1
H2SO4 (конц.) / toC
S
Br2
CH3COOH
S
Сl2
50 oC
I2 / MgO
0 oC, C6H6
S
S
2-нитротиофен
3-нитротиофен
SO3H
2-тиофенсульфокислота
2-бромтиофен
Br
Cl
Cl
3:1
S
Cl
2-хлортиофен
2,5-дихлортиофен
I
2-йодтиофен
69.
CH3COCl / SnCl4S
ДМФА, POCl3
S
CH2O / HCl
S
HgCl2
ClHg
S
COCH3 2-ацетилтиофен
CHO
2-тиофенкарбальдегид
CH2Cl
2-хлорметилтиофен
2,5дихлормеркуроHgCl тиофен
70.
Реакцииприсоединения
(восстановления)
H2/Ni
- H2S
S
CH3CH2CH2CH3
H2/MoS2
тетрагидротиофен
t, P
S
Na + C2H5OH
NH3 ж
+
S
S
3,4- и 2,3-дигидротиофены
71.
Производные тиофена• В природе встречаются реже, чем
фурана и пиррола.
• Гидрированное
тетрагидротиофеновое кольцо
входит в состав витаминов гр. Н –
α- и β-биотинов ( есть в печени,
яичном желтке). Недостаток
биотинов в организме вызывает
выпадение волос, дерматит и т.д.












































 chemistry
chemistry