Similar presentations:
Гетероциклические соединения
1.
Гетероциклическиесоединения
2.
- циклические органические соединения,в состав цикла которых кроме атомов C
входят один или несколько
гетероатомов.
К данному классу относятся
соединения, играющие первостепенную
роль в природе, медицине, технике
(нуклеиновые кислоты, ряд витаминов,
алкалоиды, гем крови, хлорофилл,
красители, органические полупроводники
и др.).
3. Ароматические гетероциклическиесоединения (ГЦ)
«Ароматические cв-ва» или«ароматичность» - это cв-ва
соединений при видимой
ненасыщенности проявлять
св-ва предельных соединений.
4.
Ароматические соединения всоответствии с правилом
Хюккеля явл-ся
плоскими
циклическими
сопряженными системами
с числом сопряженных
π- и n-электронов,
равным N=4n+2, где n=0, 1, 2,
любое целое число.
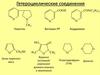
5.
Пятичленныегетероциклические
соединения
4
5
3
4
3
4
3
2
5
2
5
2
O1
фуран
N1
H
пиррол
S
1
тиофен
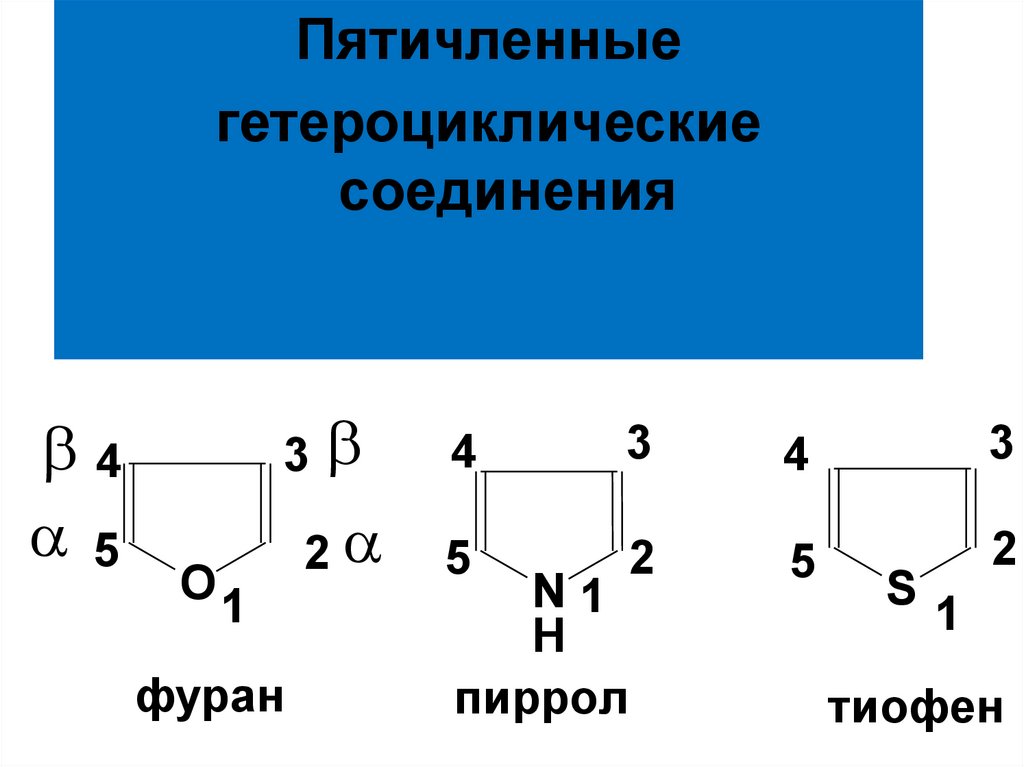
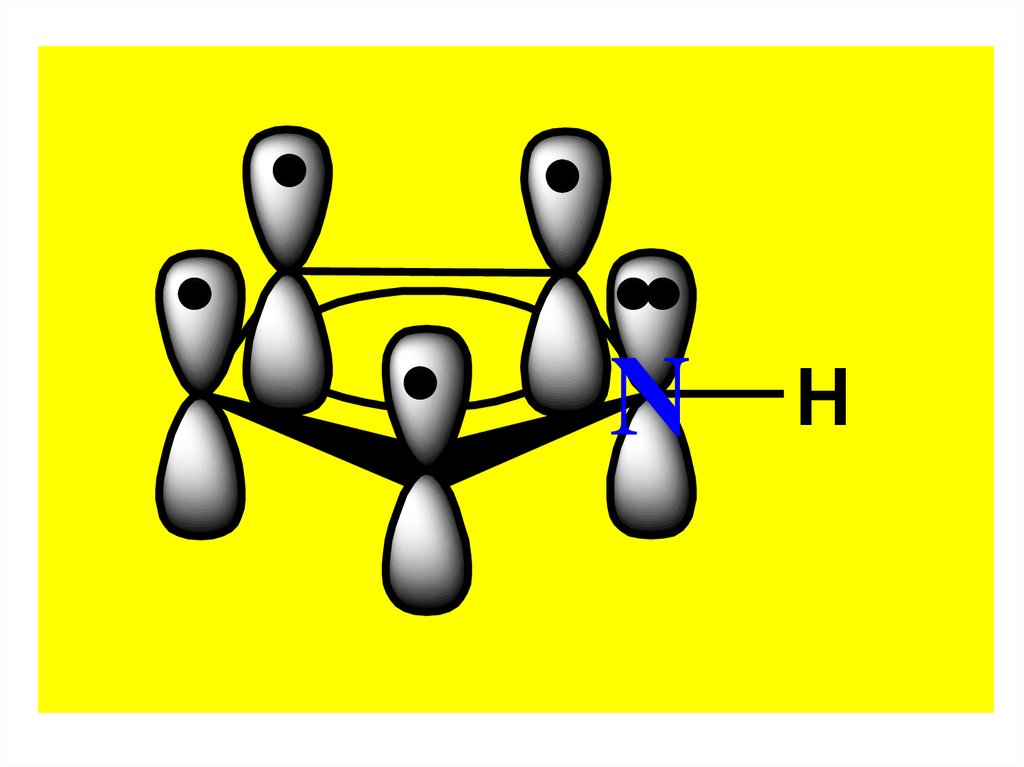
6. СТРОЕНИЕ
Молекулы всех этих ГЦ имеют плоскоестроение.
Ароматический секстет πэлектронов образуется за счет 4
электронов атомов С и
2-х неподеленных электронов
гетероатомов, находящихся на
негибридизованных pz-орбиталях.
7.
NH
8.
O9.
• илиX
10.
Ест (кДж/моль)Фуран
92,4
Пиррол Тиофен Бензол
109,2
130,2
152
• По сравнению с бензолом у ГЦ вследствие
несимметричности системы стабильность
ниже и электронная плотность распределена
неравномерно.
В целом электронная плотность
смещена от гетероатома на С-атомы цикла, в
результате чего на них возникает
повышенная эл-ая плотность, больше в αположении.
11.
• Все три гетероаренаотносятся к числу
электроноизбыточных
гетероциклов:
6 π-электронов
распределены между 5
атомами С
12. ХИМИЧЕСКИЕ СВОЙСТВА
1) 5-членные ГЦ обладая относительнойустойчивостью к р-ям присоединения
склонны к SЕ-р-ям.
По сравнению с бензолом они более
реакционноспособны в SЕ-р-ях. Подобны в SЕр-ях на фенолы и ароматические амины.
Т.к. в α-положении δ- -заряд больше, то
электрофил атакует α-положение.
Направление замещения объясняется
также большей стабильностью σ-аддукта
образующегося в lim стадии.
13.
Относительнаяактивность
гетероаренов в SE
реакциях:
пиррол > фуран > тиофен
14.
2) Пятичленные ГЦ ацидофобны(дословно – боятся к-т). В присутствии
сильных кислот они протонируются с
нарушением сопряжения π-электронной
системы. Протонированные молекулы
ведут себя, как сопряженные диены,
полимеризуются и осмоляются.
В этой связи для осуществления
SЕ р-ий используют более мягкие условия,
исключающие сильно кислую среду.
15.
3) Основность - низкая, т.к. пара эл-овгетероатома делокализована и не
принадлежит в полной мере гетероатому.
4) Реакции нуклеофильного замещения
мало характерны.
5) Склонность вступать в р-ции 1,4циклоприсоединения (как сопряженного
диена) - снижается в ряду
Фуран > пиррол > тиофен
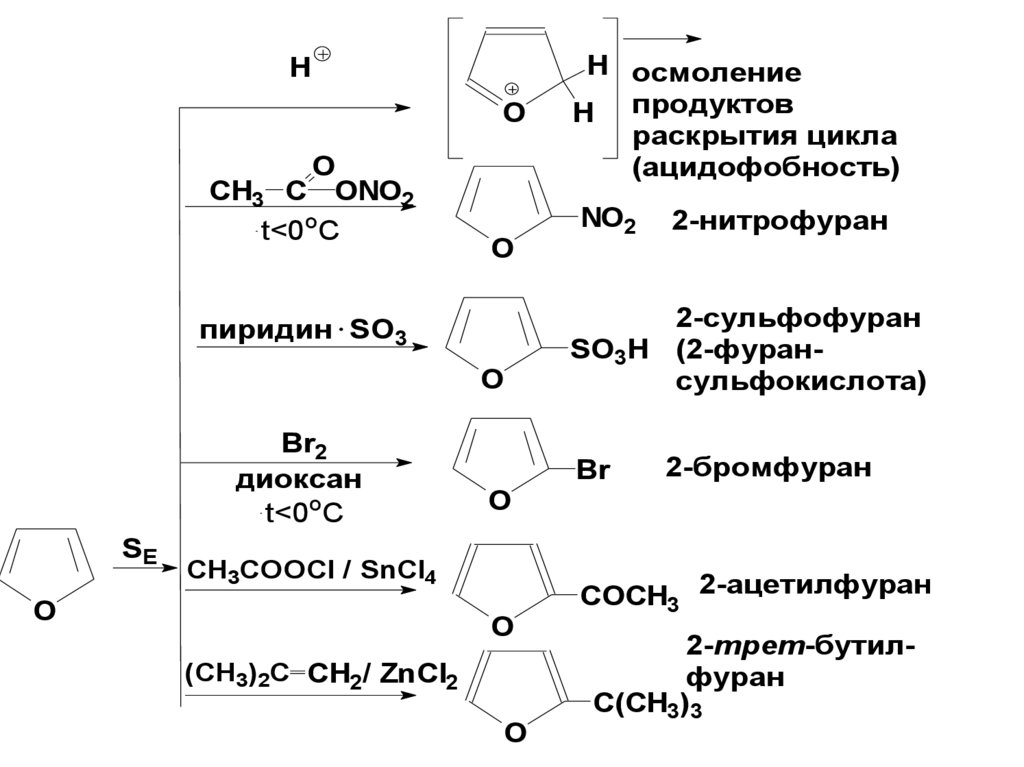
16. Фуран
Бесц. Ж., Тк.= 31оС, имеет запах хлороформа.В воде н/р.
Фуран и его гомологи сод-ся в древесном дегте.
Обладает cв-вами, промежуточными между cв-ами
ароматических соединений и обычного диена.
17.
Реакцииэлектрофильного
замещения (с.539)
18.
HO
O
CH3 C ONO2
t<0oC
O
пиридин SO3
О
Br2
диоксан
t<0oC
SE
NO2
2-нитрофуран
2-сульфофуран
SO3H (2-фурансульфокислота)
Br
2-бромфуран
O
CH3COOCl / SnCl4
O
H осмоление
H продуктов
раскрытия цикла
(ацидофобность)
O
(CH3)2C CH2/ ZnCl2
O
COCH3 2-ацетилфуран
2-трет-бутилфуран
C(CH3)3
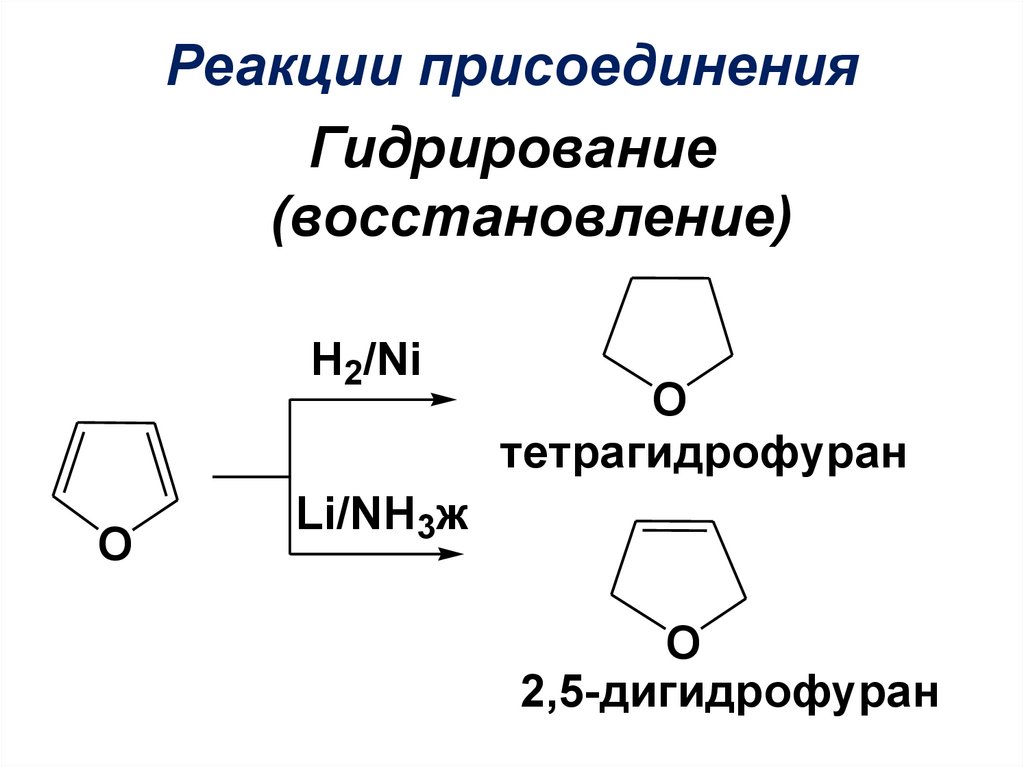
19.
Реакции присоединенияГидрирование
(восстановление)
H2/Ni
O
O
тетрагидрофуран
Li/NH3ж
O
2,5-дигидрофуран
20.
Применение фуранаФуран очень ценный хим. продукт, к-рый широко
используется в пром-сти.
• Производные фурана довольно широко
распространены в природе. Фурановые
производные входят в состав многих душистых
в-в, биологически активных в-в.
• Тетрагидрофурановый цикл входит в состав
микотоксинов ( мускарин – яд красного
мухомора).
• Вспомним, что тетрагидрофурановый цикл
образует основу углеводов, имеющих
фуранозное строение.
21.
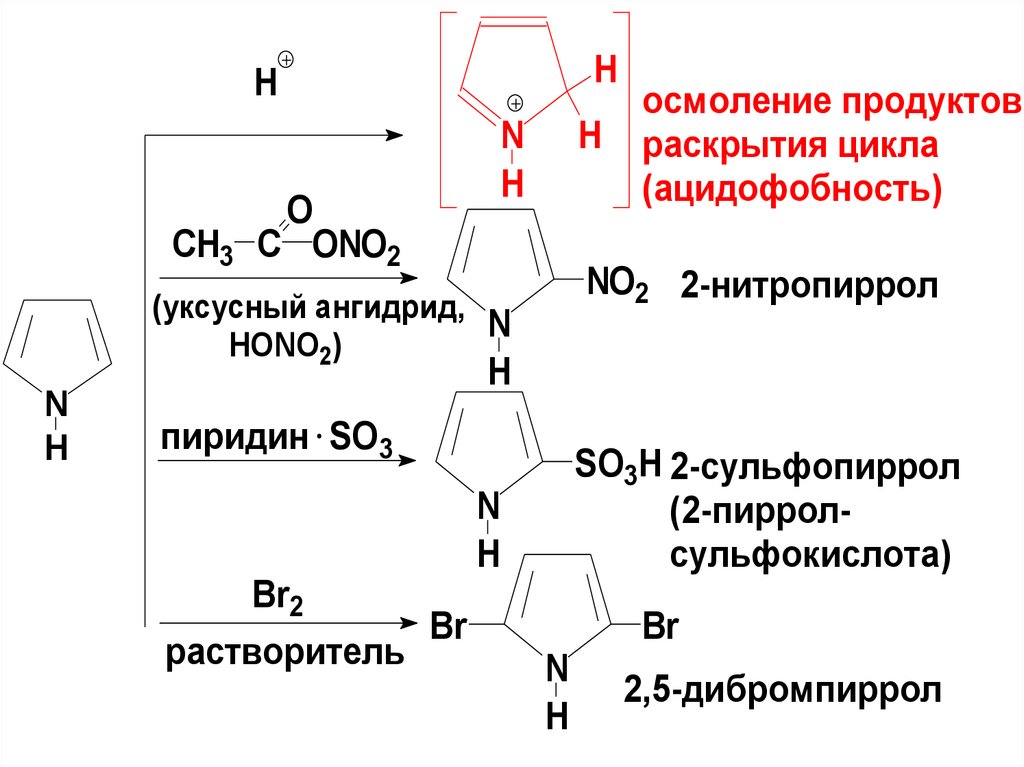
ПИРРОЛРеакции электрофильного
замещения (с. 538)
22.
HH
O
CH3 C ONO2
H
N
H
NO2 2-нитропиррол
(уксусный ангидрид,
N
HONO2)
N
H
осмоление продуктов
раскрытия цикла
(ацидофобность)
H
пиридин SO3
Br2
Br
растворитель
SO3H 2-сульфопиррол
(2-пирролсульфокислота)
N
H
N
H
Br
2,5-дибромпиррол
23.
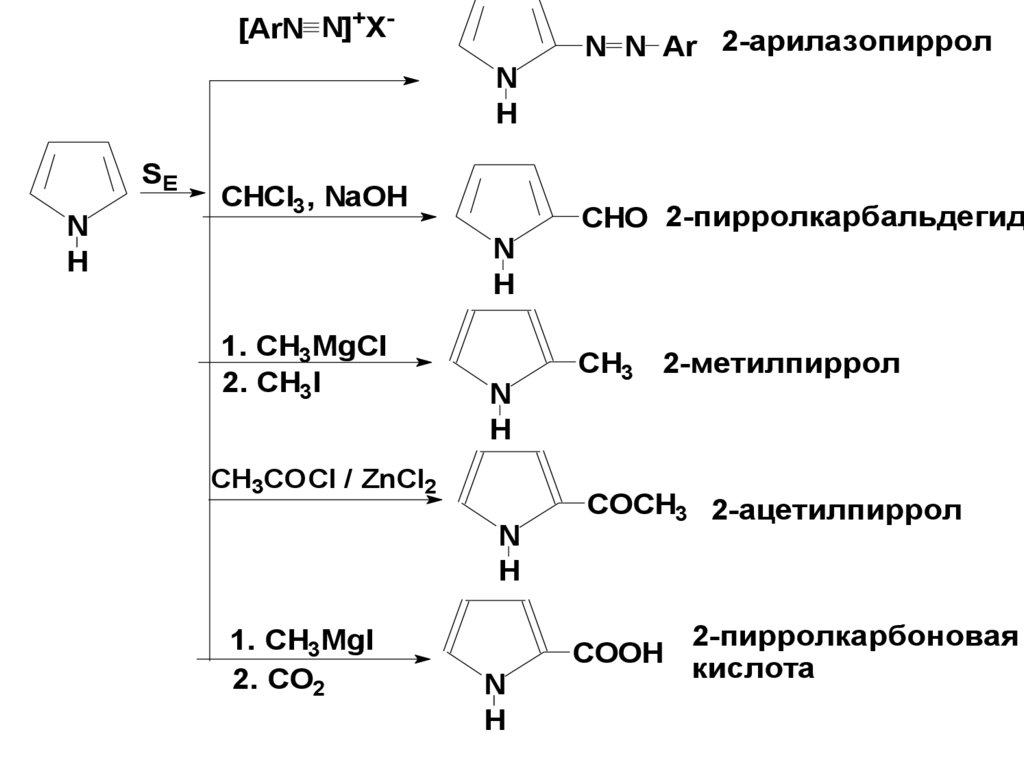
[ArN N]+XNH
SE
N
H
CHCl3, NaOH
N
H
1. СH3MgCl
2. CH3I
N
H
CH3COCl / ZnCl2
N
H
1. CH3MgI
2. CO2
N
H
N N Ar 2-арилазопиррол
CHO 2-пирролкарбальдегид
CH3 2-метилпиррол
COCH3 2-ацетилпиррол
COOH
2-пирролкарбоновая
кислота
24.
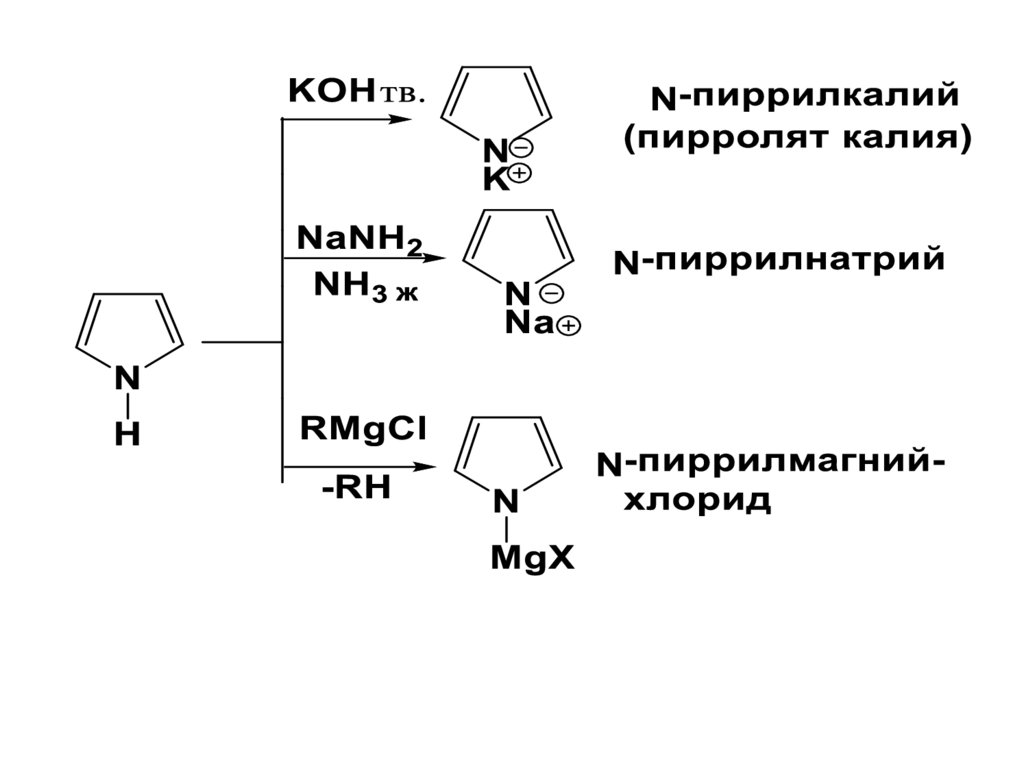
Кислотность и реакциинуклеофильного замещения
Пиррол проявляет не только
основные, но и кислотные свойства,
т.е. является амфотерным.
При действии сильных оснований
пиррол образует пирролят –ион.
Является слабой к-той – слабее, чем
фенол, но сильнее анилина.
25.
26.
Реакции присоединения(восстановления)
H2/Ni
CH3COOH
N
H
Zn
CH3COOH
пирролидин
N
H
2,5-дигидропиррол
N
H
27.
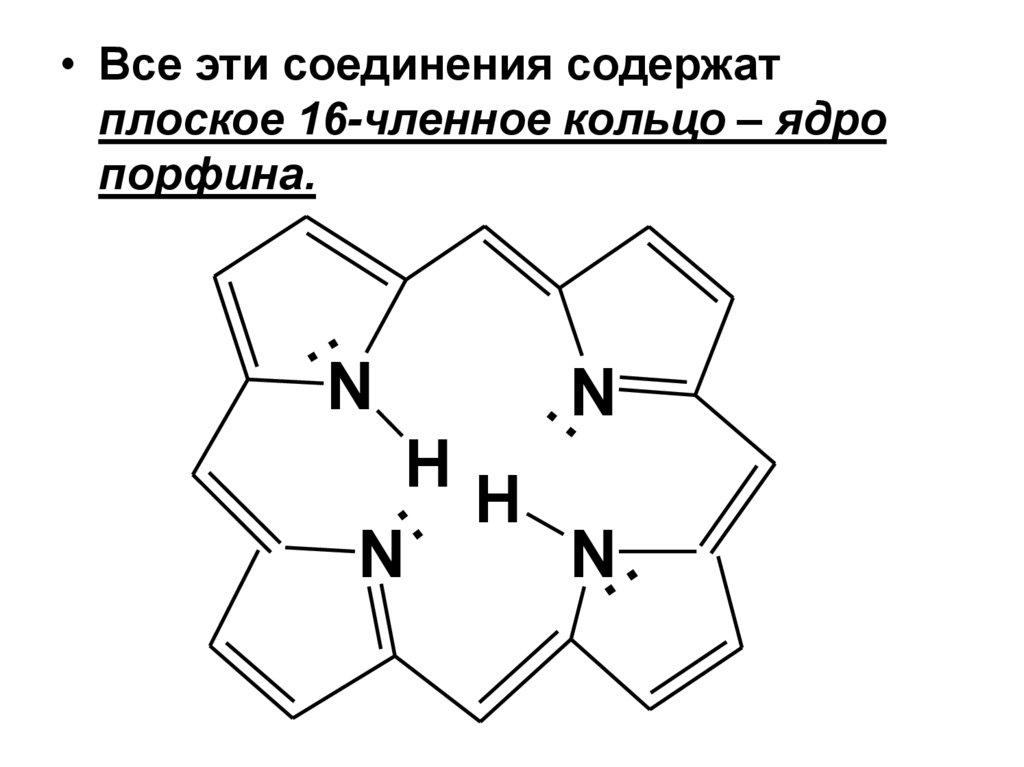
Значение пиррола и его производныхПроизводные пиррола имеют большое
биологическое значение.
Пиррольные ядра образуют основу многих
биологически важных пигментов (красящих вв) – пигментов крови (гемоглобин) и зеленых
частей растений (хлорофилл), желчи,
витамина В12.
28.
• Все эти соединения содержатплоское 16-членное кольцо – ядро
порфина.
..N
..N
..
H
H
N
N..
29.
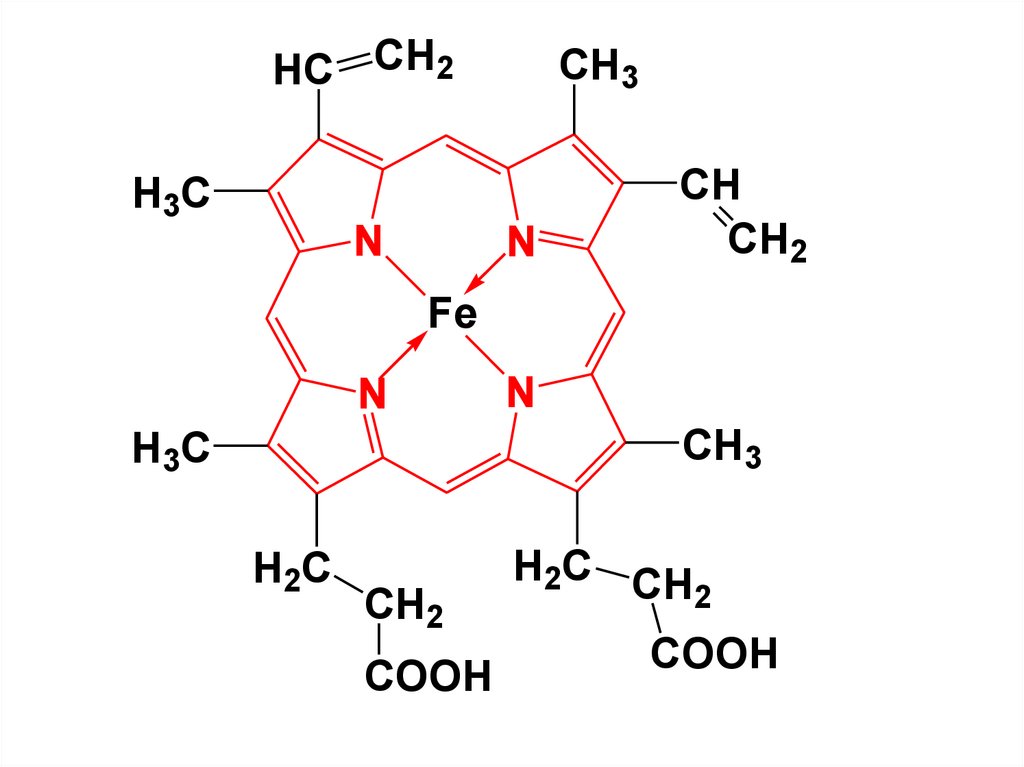
• Порфирины в природе находятсяв виде комплексов с ионами
металлов. Комплекс с ионом
железа явл-ся основой
гемоглобина, с ионом магния –
хлорофилла.
30.
HC CH2CH3
H3C
N
N
CH
CH2
Fe
N
N
CH3
H3C
H2C
CH2
COOH
H2C CH
2
COOH
31.
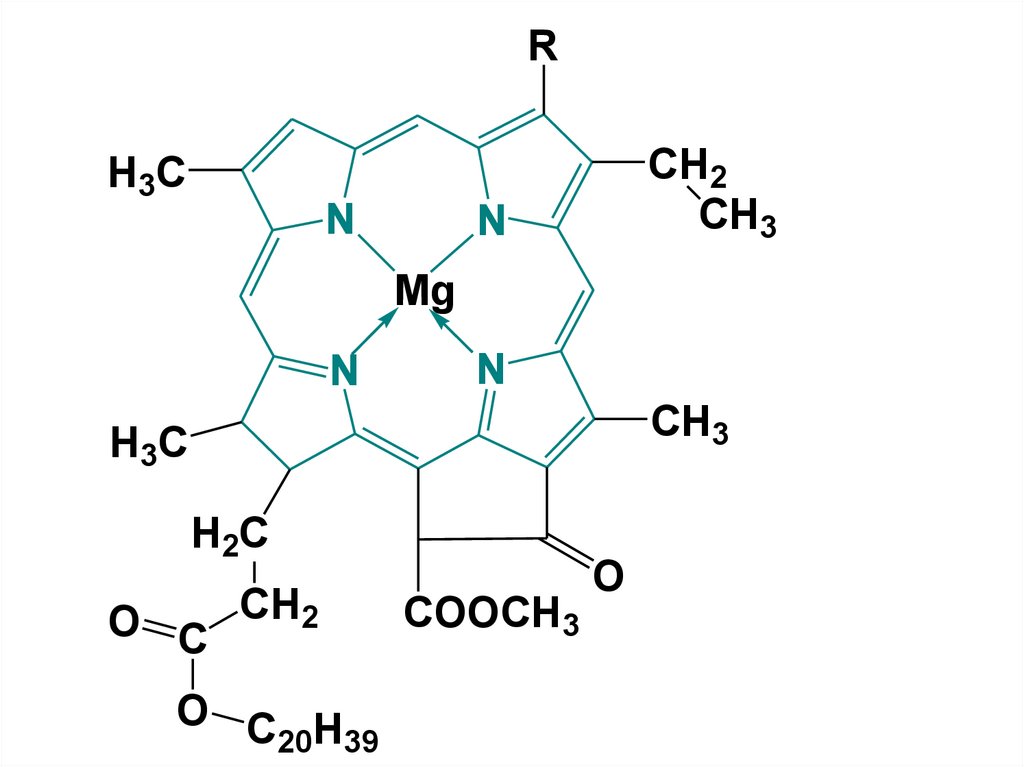
RCH2
CH3
H3C
N
N
Mg
N
N
CH3
H3C
H2C
O C CH2
O C H
20 39
COOCH3
O
32.
• Гемоглобин отвечает за обеспечениетканей кислородом, хлорофилл
принимает участие в трансформации
солнечной энергии в процессе
фотосинтеза.
Восстановленное пиррольное ядро
входит в состав природных АК и
алкалоидов.
33.
ТИОФЕНЭто самый ароматический 5членный ГЦ.
Р-ции сходны с SE -р-ми бензола, но
для тиофена протекают значительно
легче. (с. 540)
34.
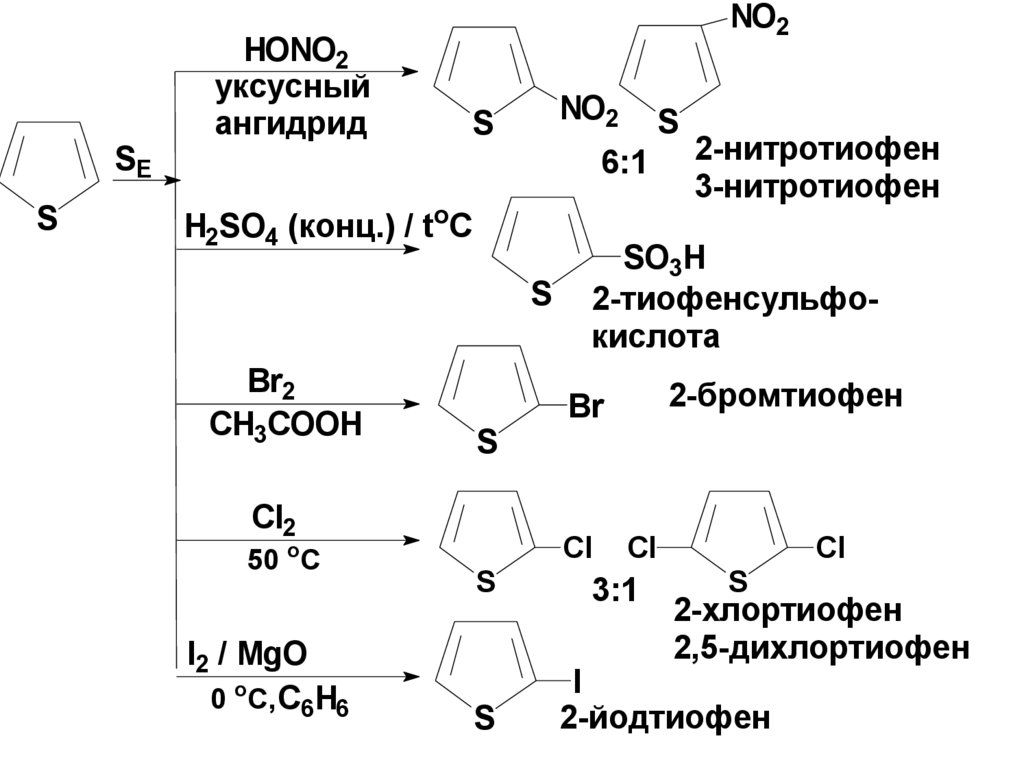
SES
HONO2
уксусный
ангидрид
NO2
NO2
S
S
6:1
H2SO4 (конц.) / toC
S
Br2
CH3COOH
S
Сl2
50 oC
I2 / MgO
0 oC, C6H6
S
S
2-нитротиофен
3-нитротиофен
SO3H
2-тиофенсульфокислота
2-бромтиофен
Br
Cl
Cl
3:1
S
Cl
2-хлортиофен
2,5-дихлортиофен
I
2-йодтиофен
35.
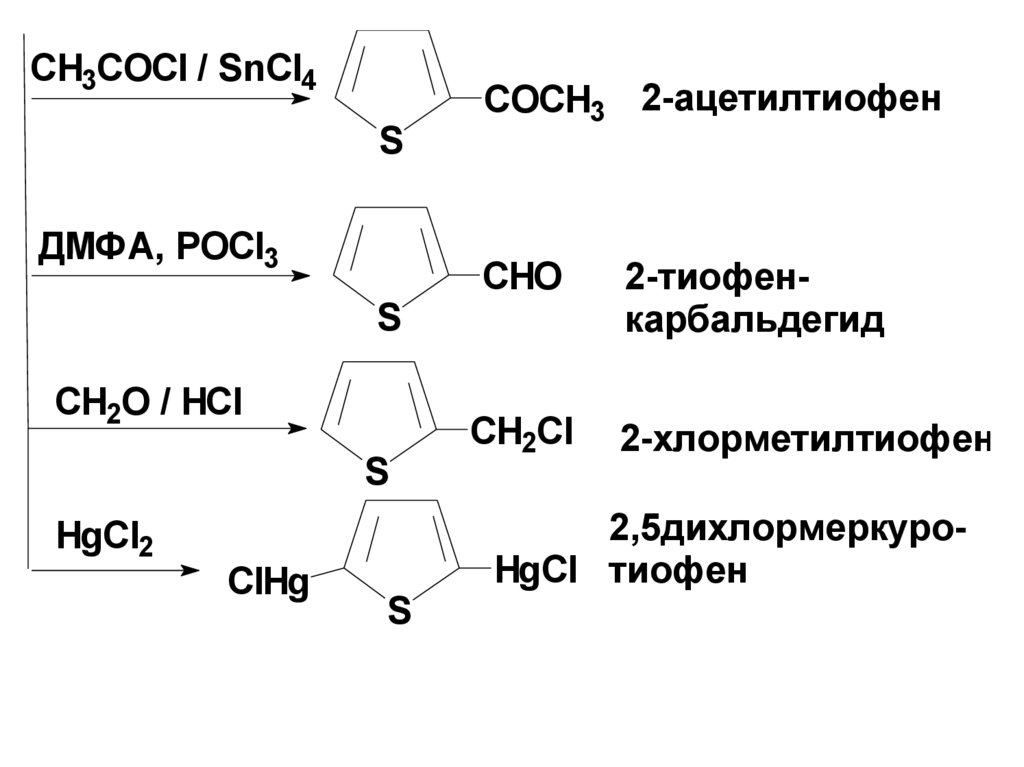
CH3COCl / SnCl4S
ДМФА, POCl3
S
CH2O / HCl
S
HgCl2
ClHg
S
COCH3 2-ацетилтиофен
CHO
2-тиофенкарбальдегид
CH2Cl
2-хлорметилтиофен
2,5дихлормеркуроHgCl тиофен
36.
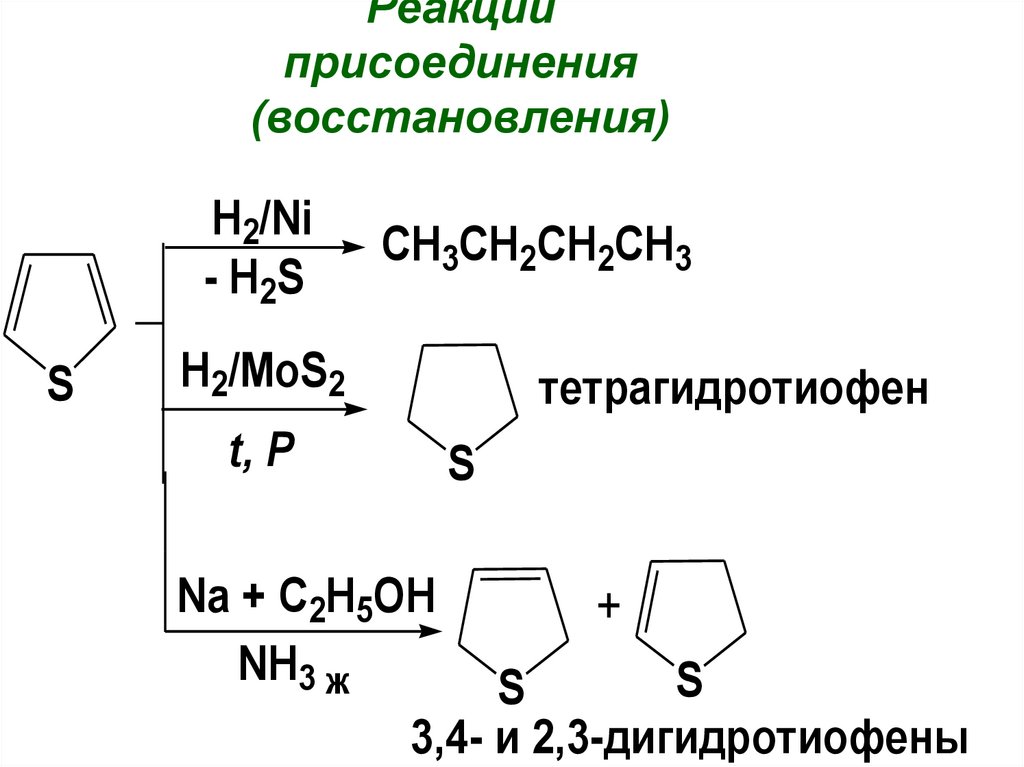
Реакцииприсоединения
(восстановления)
H2/Ni
- H2S
S
CH3CH2CH2CH3
H2/MoS2
тетрагидротиофен
t, P
S
Na + C2H5OH
NH3 ж
+
S
S
3,4- и 2,3-дигидротиофены
37.
Производные тиофенаВ природе встречаются реже, чем фурана и
пиррола.
Гидрированное тетрагидротиофеновое
кольцо входит в состав витаминов гр. Н –
α- и β-биотинов ( есть в печени, яичном
желтке). Недостаток биотинов в организме
вызывает выпадение волос, дерматит и т.д.
38.
ШЕСТИЧЛЕННЫЕГЕТЕРОЦИКЛИЧЕСКИЕ
СОЕДИНЕНИЯ
39.
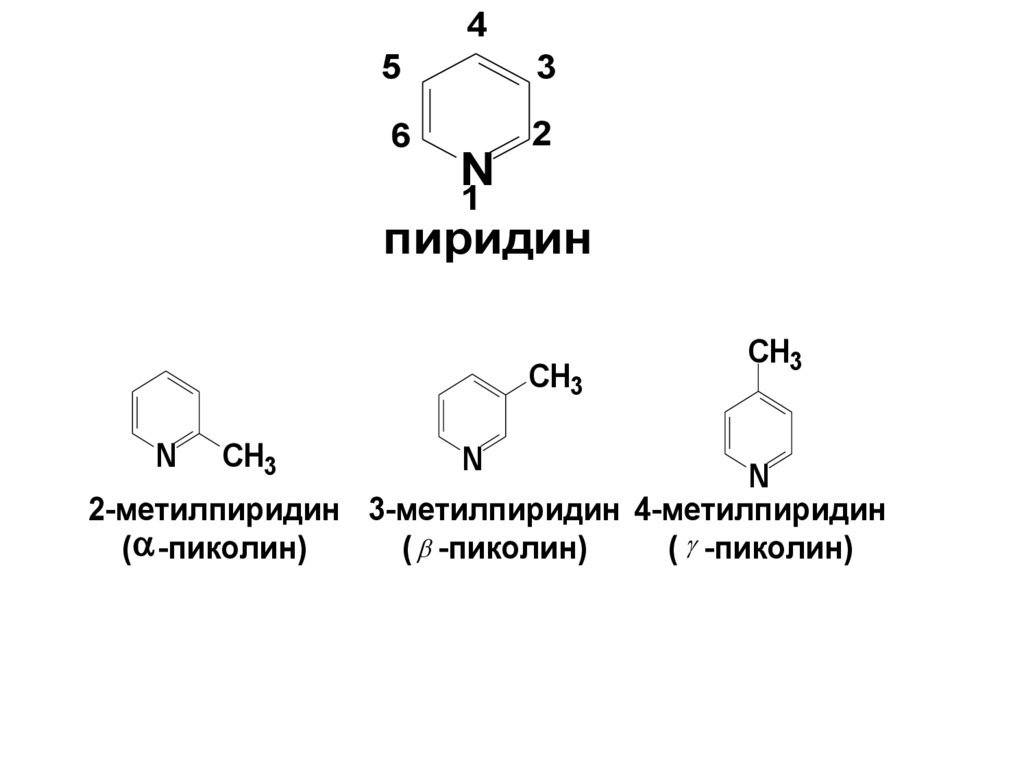
45
3
6
2
N
1
пиридин
CH3
N
CH3
N
CH3
N
2-метилпиридин 3-метилпиридин 4-метилпиридин
( -пиколин)
( -пиколин)
( -пиколин)
40.
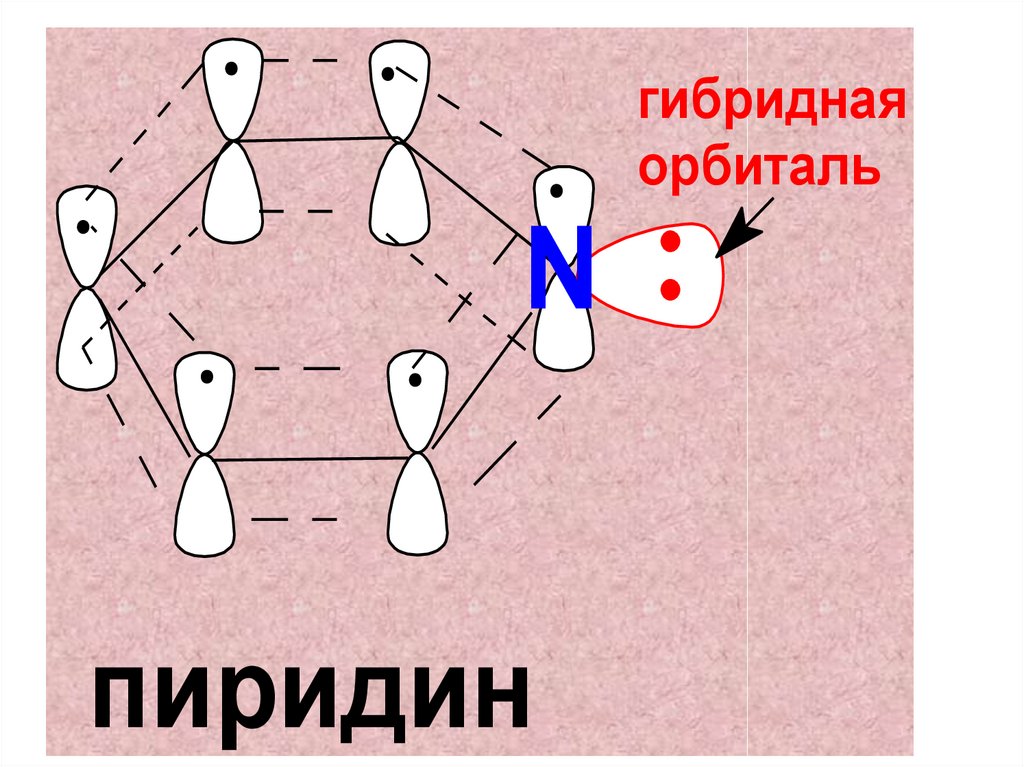
СтроениеПиридин является 6-членным
гетероароматическим аналогом бензола.
Все атомы цикла находятся в состоянии
sp2-гибридизации и вносят по 1-ому
π-электрону в ароматический секстет.
Плоская молекула имеет сопряжённую
систему из 6-ти π-электронов.
41.
гибриднаяорбиталь
N
пиридин
42.
НЭП атома азота находится внесопряженной системы и занимает
гибридную sp2 –орбиталь,
ориентированную в плоскости
цикла перпендикулярно осям
негибридных орбиталей атомов С
и N.
43.
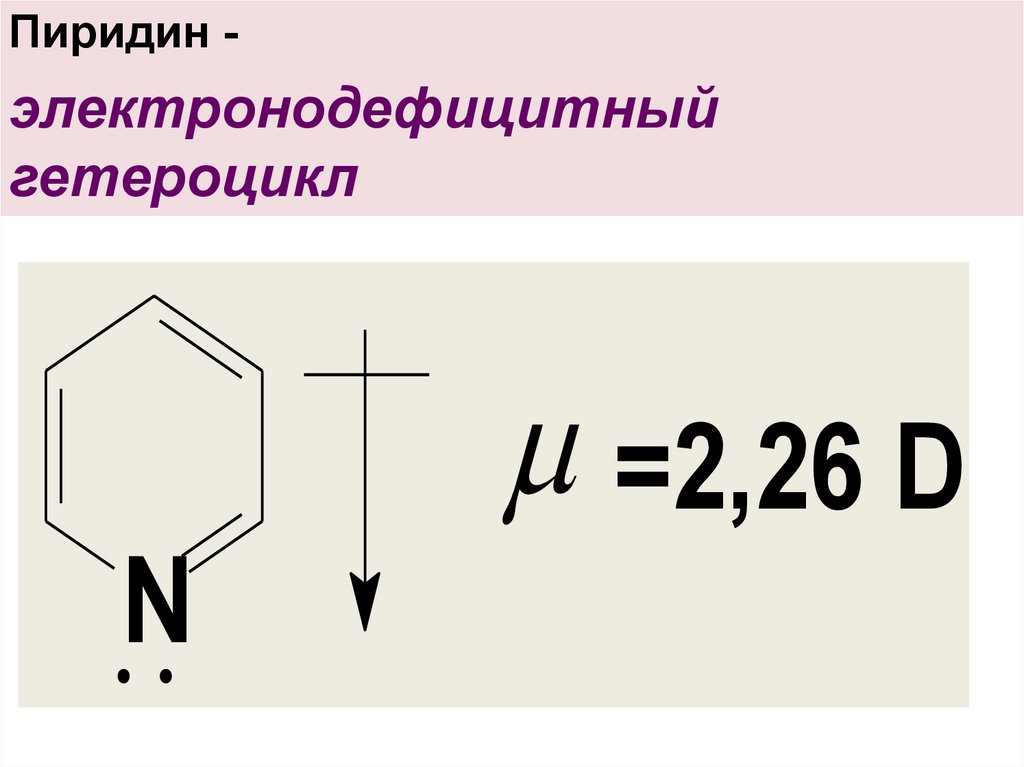
Пиридин -электронодефицитный
гетероцикл
=2,26 D
N
44. Химические свойства
1. Пиридин обнаруживаетосновные и
нуклеофильные св-ва,
т.к. НЭП азота в его молекуле не
входит в ароматический секстет,
45.
• Пиридин более сильное основание, чеманилин.
• Водный р-р его имеет щелочную р-цию на
лакмус.
• Это обусловлено тем, что у анилина электронная пара
N смещена вследствие сопряжения в сторону кольца, а
у пиридина на N эл-ая плотность повышена за счет
стягивания эл-ов с кольца.
• Однако основность пиридина значительно
ниже, чем у жирных аминов Alk→NH2.
46.
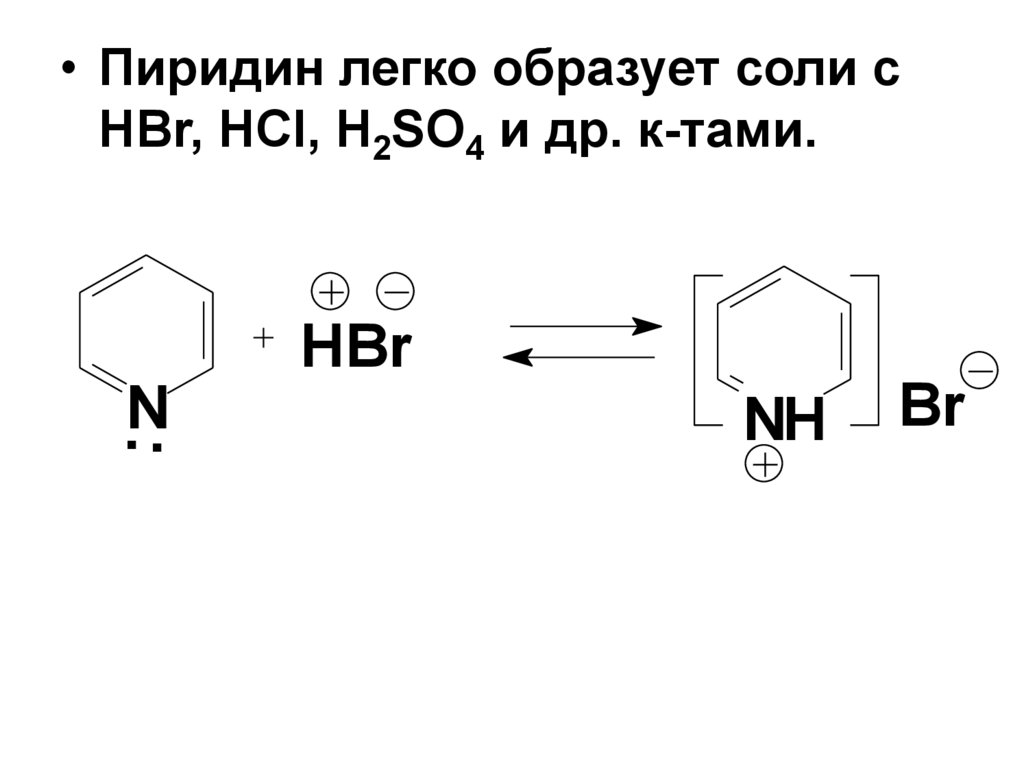
• Пиридин легко образует соли сHBr, HCl, H2SO4 и др. к-тами.
.N.
HBr
NH
Br
47. 2. Электрофильное ароматическое замещение
SE-реакции в пиридине протекают с трудом, взначительно более ж. у., чем в бензоле., т. к.:
1) понижена электронная плотность в кольце
(дезактивирующее действие N),
2) при взаимодействии П с электрофилами атака
их направлена на N, что приводит к
образованию соли - N становится аммонийным,
что еще больше дезактивирует кольцо.
Пиридин по cв-вам напоминает нитробензол.
Электрофильное замещение идет в
β-положение (3-)
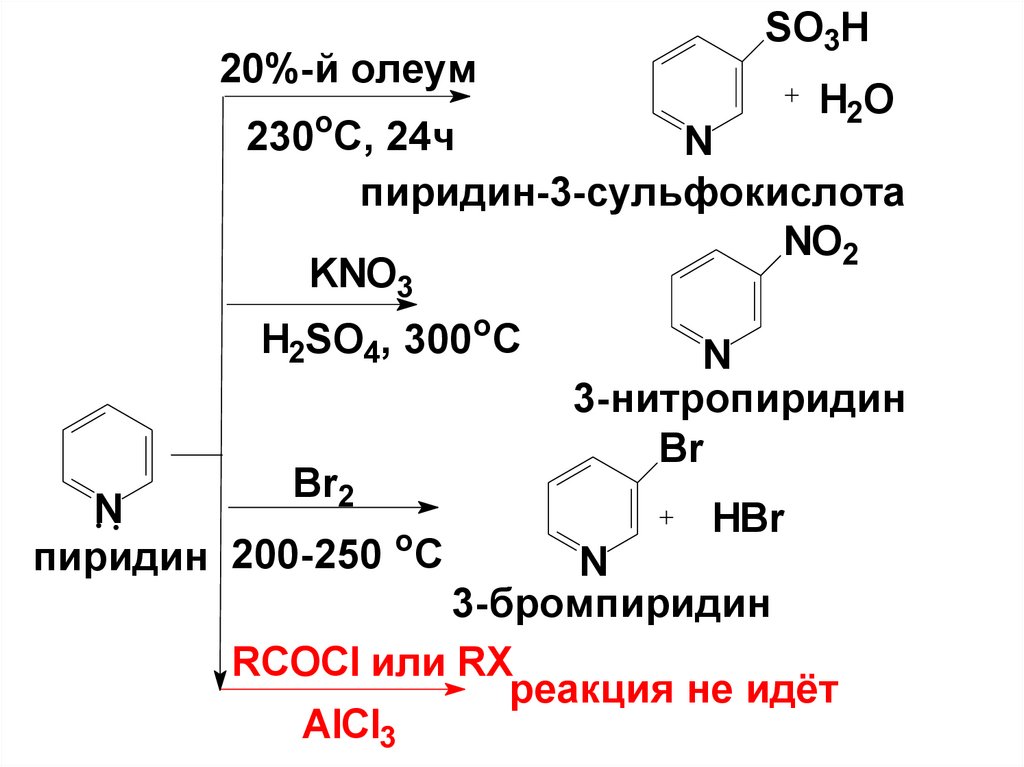
48.
20%-й олеумSO3H
H2O
о
230 С, 24ч
N
пиридин-3-сульфокислота
NO2
KNO3
H2SO4, 300oC
Br2
N
o
200-250
C
пиридин
N
3-нитропиридин
Br
HBr
N
3-бромпиридин
RCOCl или RX
реакция не идёт
AlCl3
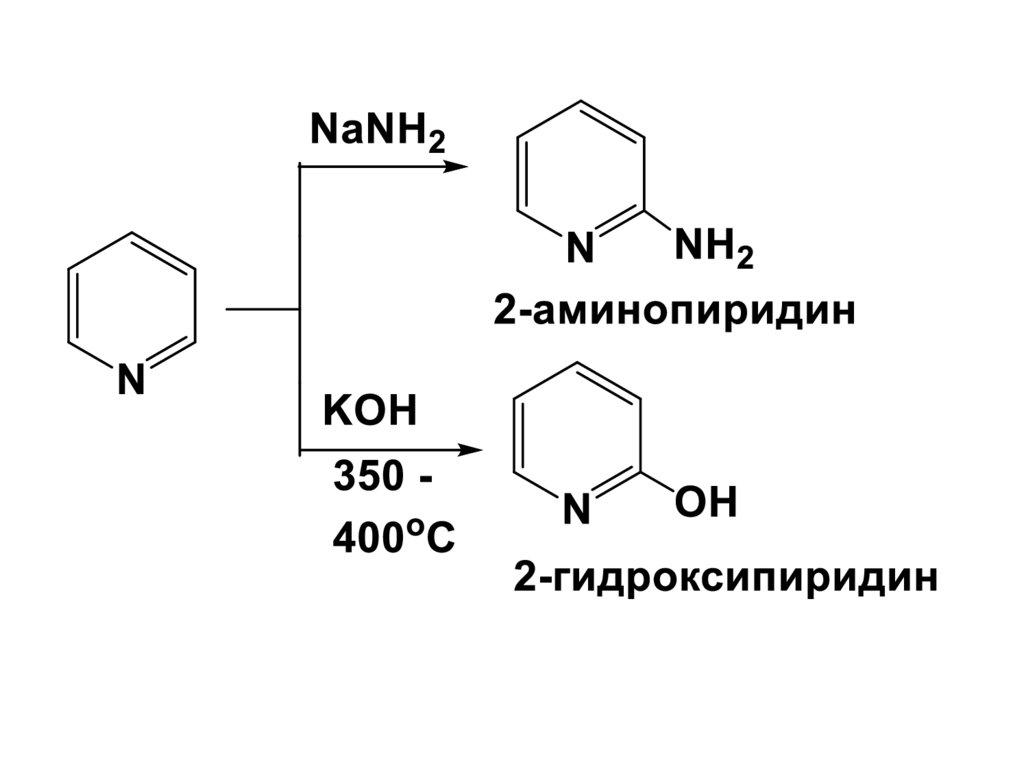
49. 3. Реакции нуклеофильного замещения
Пиридин, явл-ся электронодефицитнымГЦ, что способствует особой склонности
его к реакциям с нуклеофильными
реагентами
Нуклеофил атакует α- положение (2).
50.
51.
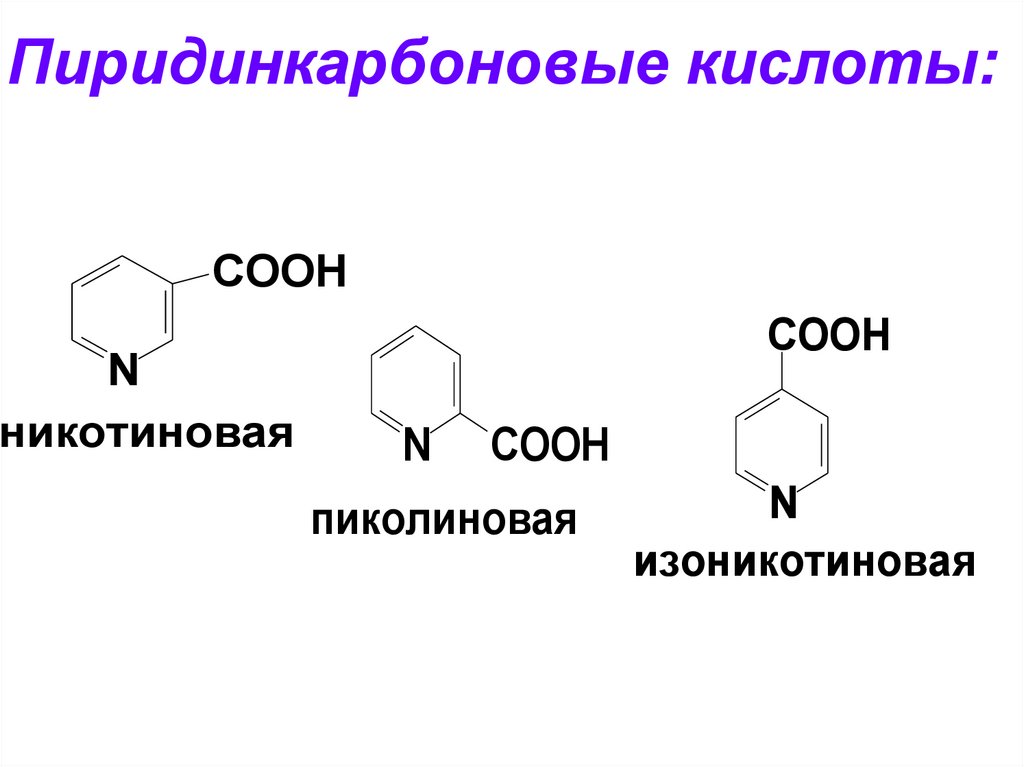
Пиридинкарбоновые кислоты:COOH
N
никотиновая
COOH
N
COOH
пиколиновая
N
изоникотиновая
52.
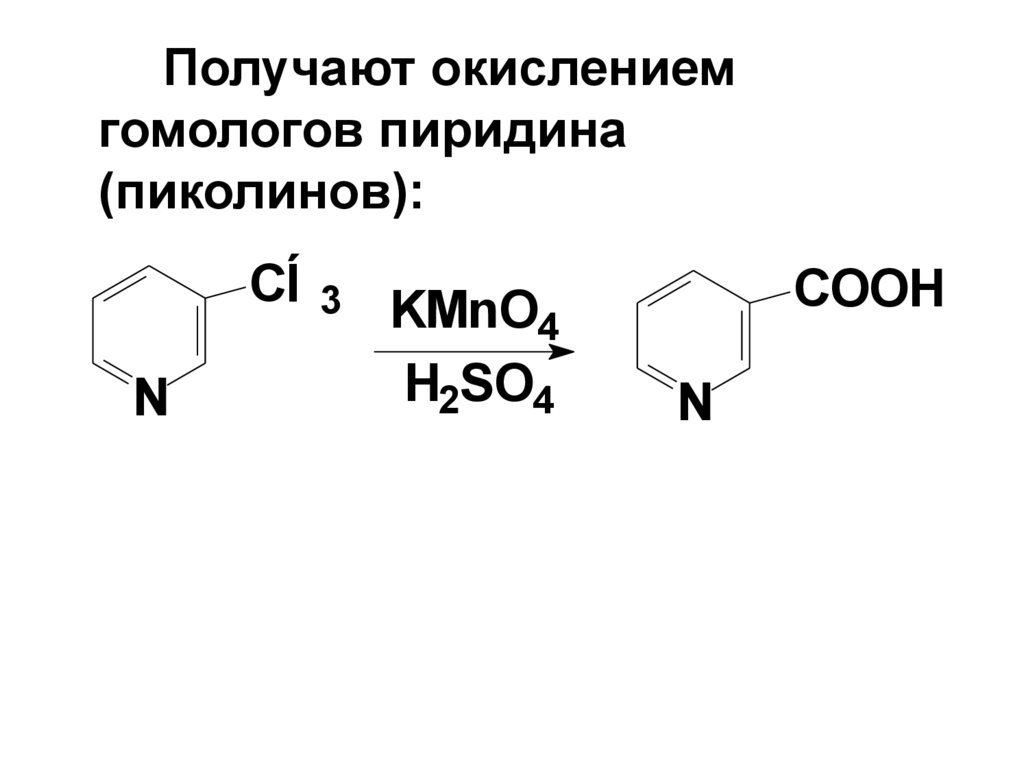
Получают окислениемгомологов пиридина
(пиколинов):
CÍ 3
N
KMnO4
H2SO4
COOH
N
53.
• Никотиновая к-та – широко распространена в природе– сод-ся в печени, экстракте дрожжей, в молоке,
зародыше пшеницы.
• Получают окислением гомологов пиридина и
никотина.
• Никотиновая к-та и ее амид - (витамины РР)
используются для витаминизации хлеба и др.
пищевых продуктов (потребность в ней человека 2030 мг в сутки).
54.
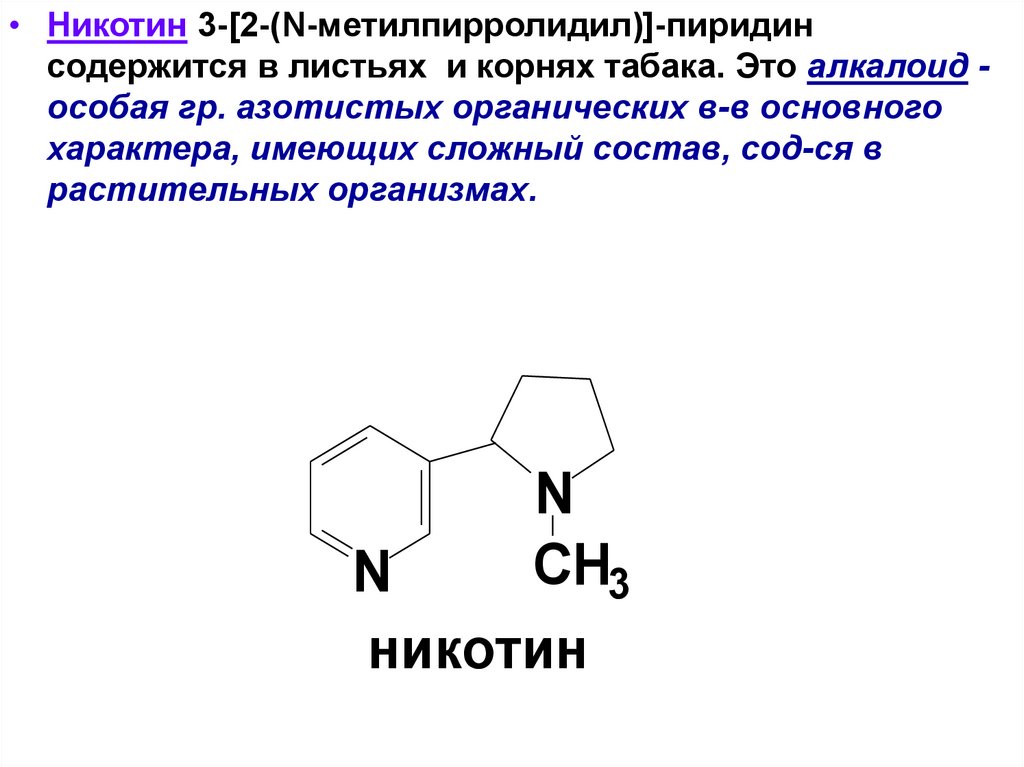
• Никотин 3-[2-(N-метилпирролидил)]-пиридинсодержится в листьях и корнях табака. Это алкалоид особая гр. азотистых органических в-в основного
характера, имеющих сложный состав, сод-ся в
растительных организмах.
N
CH3
N
никотин






























 chemistry
chemistry