Similar presentations:
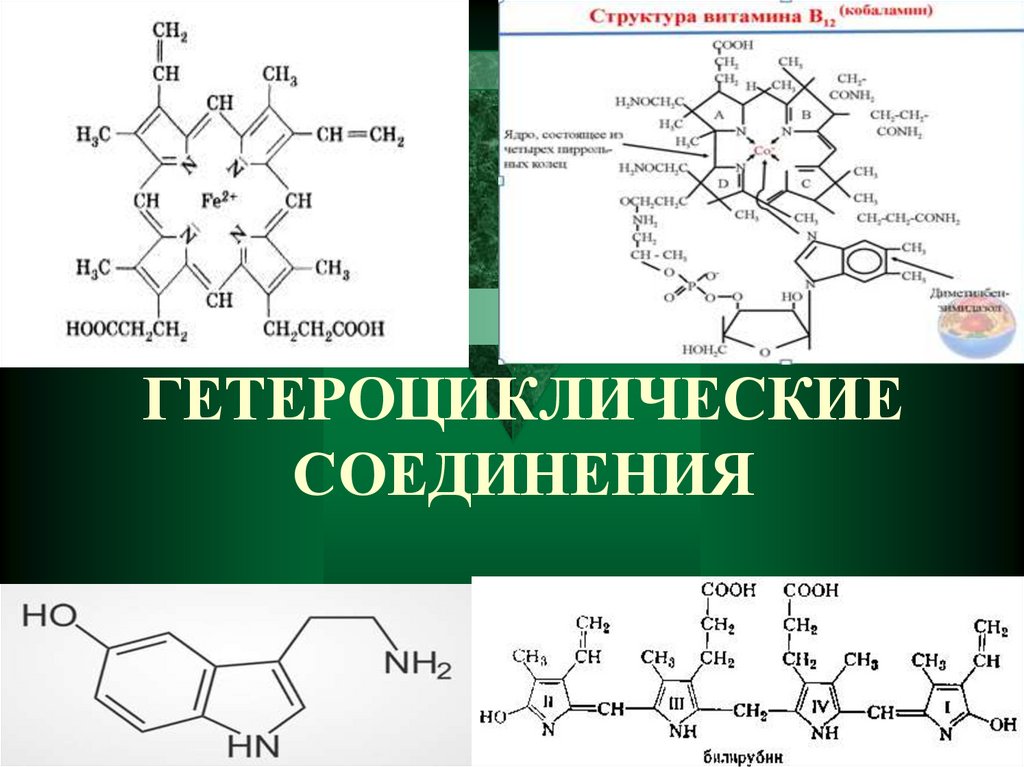
Гетероциклические соединения
1. ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ
2. ГЕТЕОИКЛИЧСКИЕ СОЕДИНЕНИЯ
ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯГетероциклическими
называются
органические
соединения, в состав которых входит одна или несколько
циклических группировок, в которых один или несколько
атомов углерода замещены атомами других элементов
(гетероатомами).
Гетероатомами могут быть любые элементы, имеющие
валентность не менее двух. Наиболее распространены и
изучены
гетероциклические
системы,
в
которых
гетероатомами являются O, S, N.
ГЕТЕОИКЛИЧСКИЕ
Гетероциклические
соединения различают:
СОЕДИНЕНИЯ
1) по размеру цикла (трех-, четырех-, пяти-, шестичленные циклы,
конденсированные циклы);
2) по гетероатому (азотсодержащие, серо- , кислородсодержащие);
3) по количеству гетератомов (один, два, три, четыре и т.д.).
3.
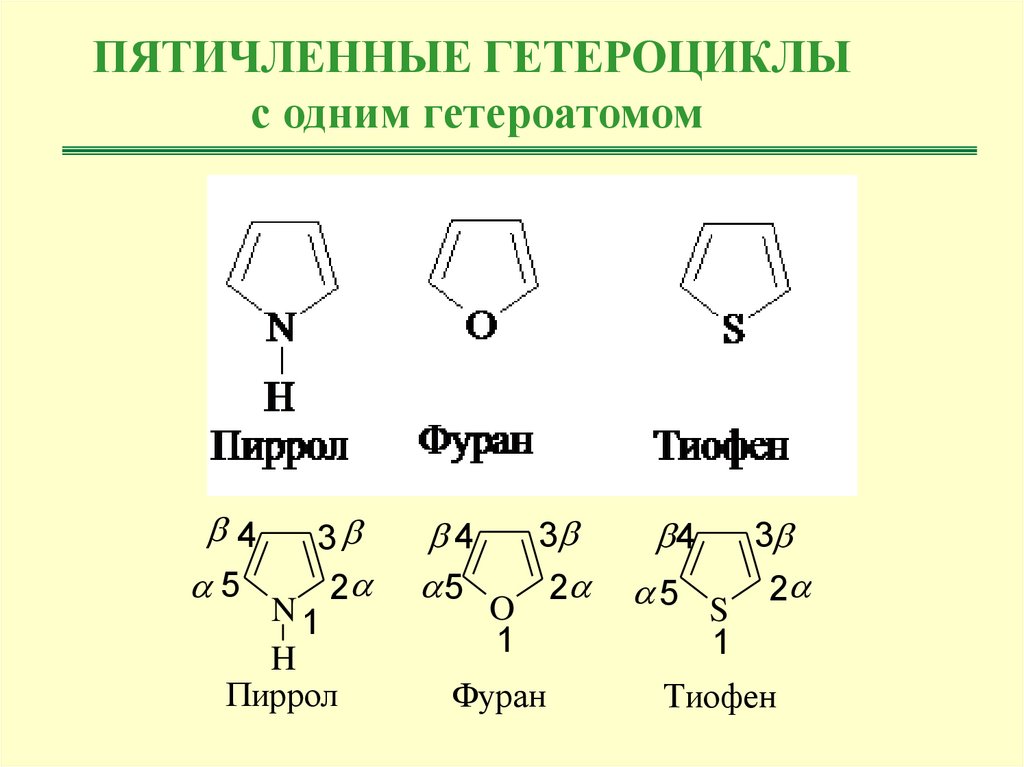
ПЯТИЧЛЕННЫЕ ГЕТЕРОЦИКЛЫс одним гетероатомом
4
3
5
2
N1
H
Пиррол
4
5
3
4
3
2
5 S
2
O
1
Фуран
1
Тиофен
4.
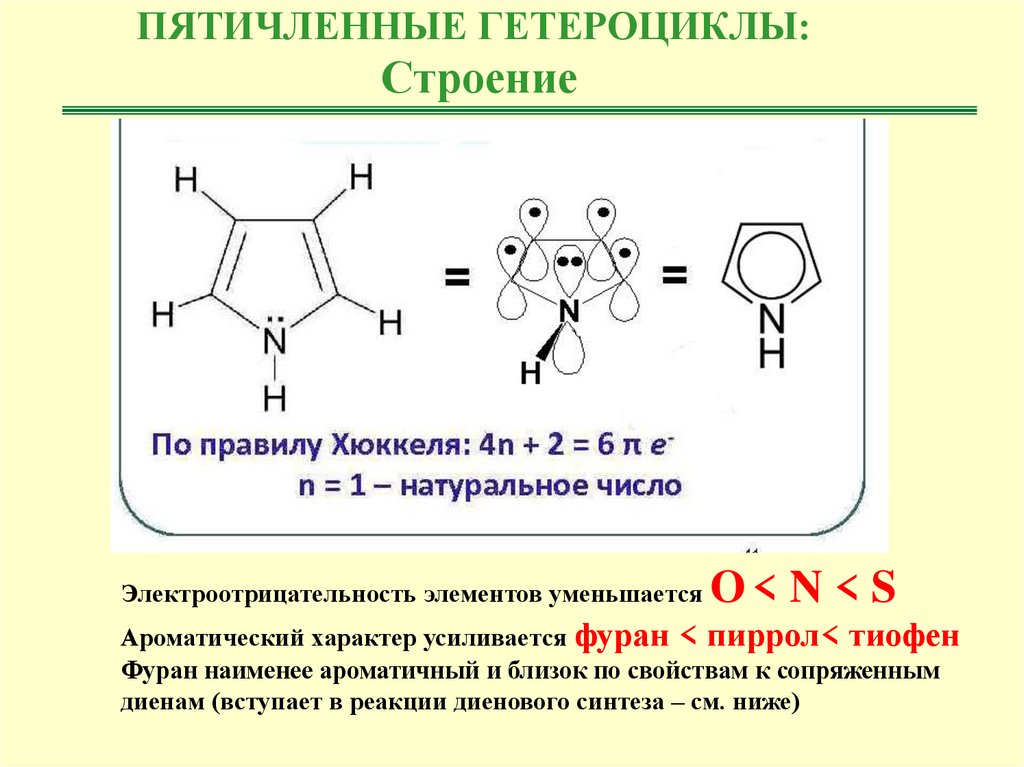
ПЯТИЧЛЕННЫЕ ГЕТЕРОЦИКЛЫ:Строение
Электроотрицательность элементов уменьшается
O< N < S
Ароматический характер усиливается фуран < пиррол< тиофен
Фуран наименее ароматичный и близок по свойствам к сопряженным
диенам (вступает в реакции диенового синтеза – см. ниже)
5.
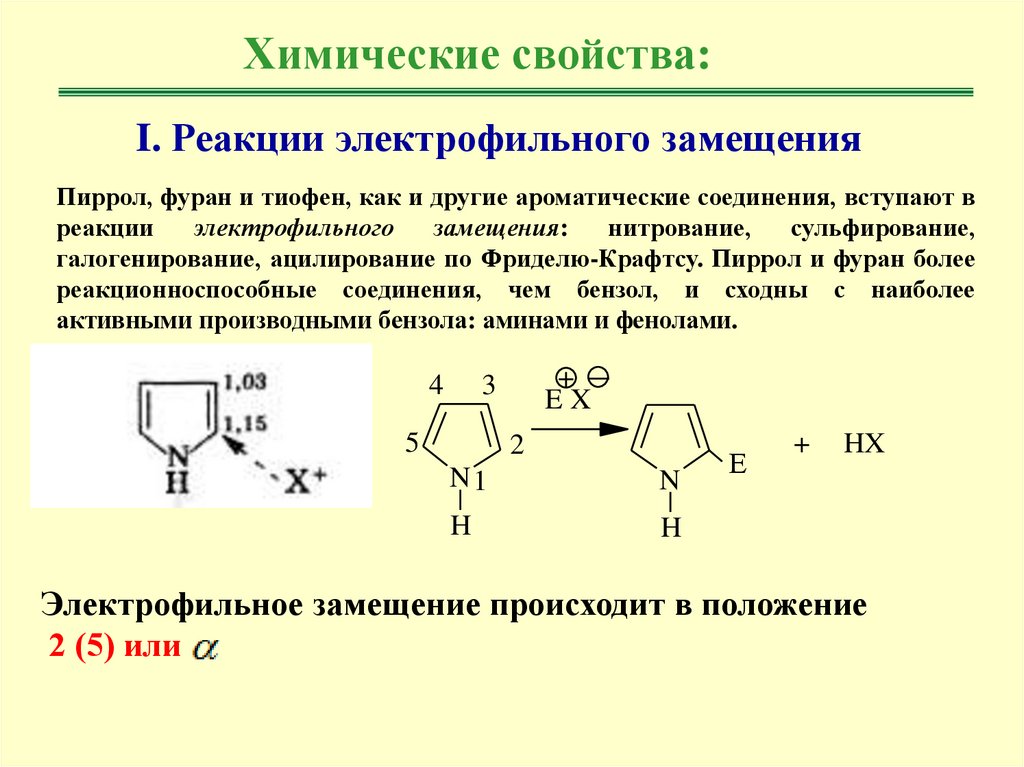
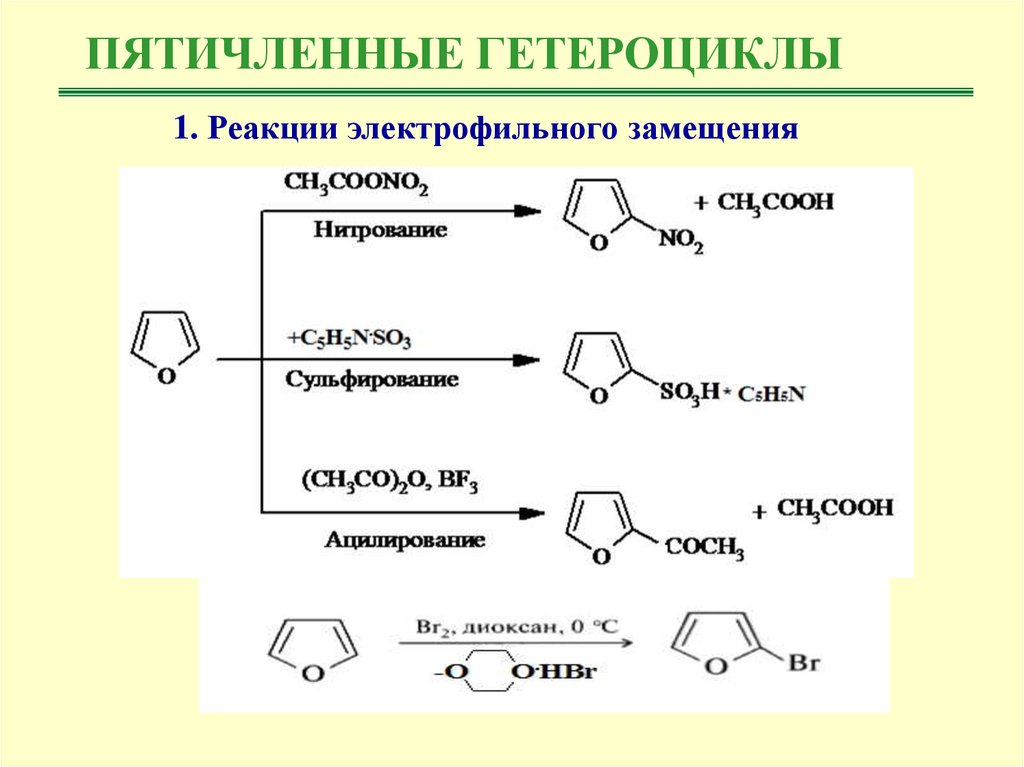
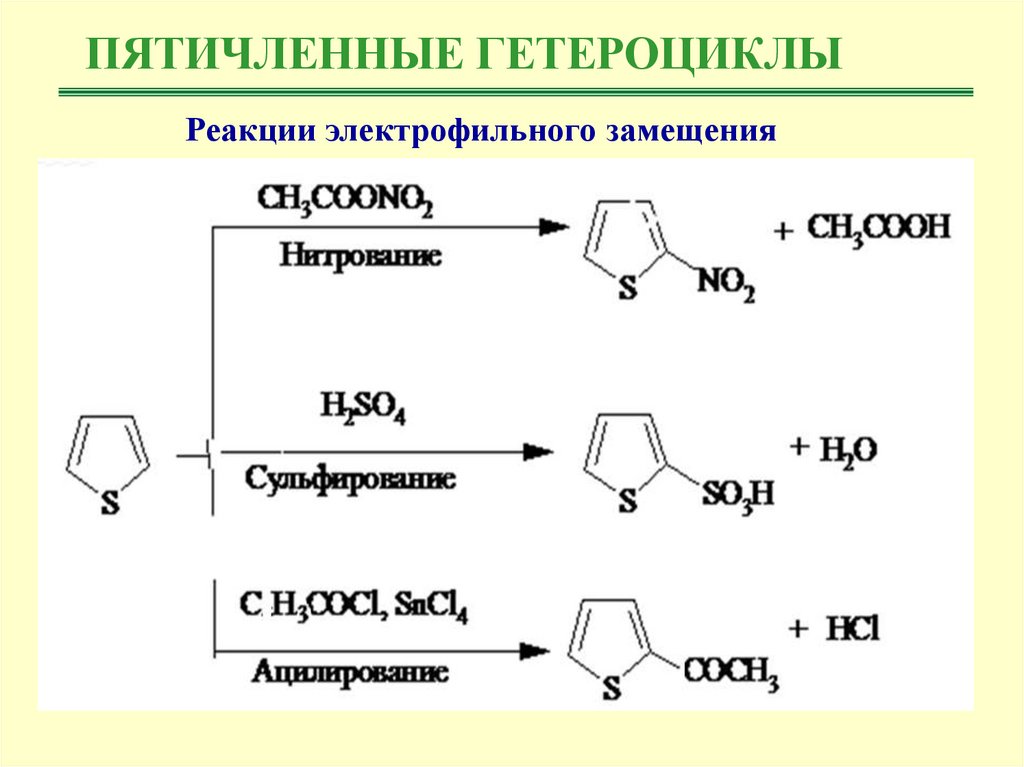
Химические свойства:I. Реакции электрофильного замещения
Пиррол, фуран и тиофен, как и другие ароматические соединения, вступают в
реакции
электрофильного
замещения:
нитрование,
сульфирование,
галогенирование, ацилирование по Фриделю-Крафтсу. Пиррол и фуран более
реакционноспособные соединения, чем бензол, и сходны с наиболее
активными производными бензола: аминами и фенолами.
+
EX
3
4
5
2
N1
N
H
H
Е
+
HX
Электрофильное замещение происходит в положение
2 (5) или
6.
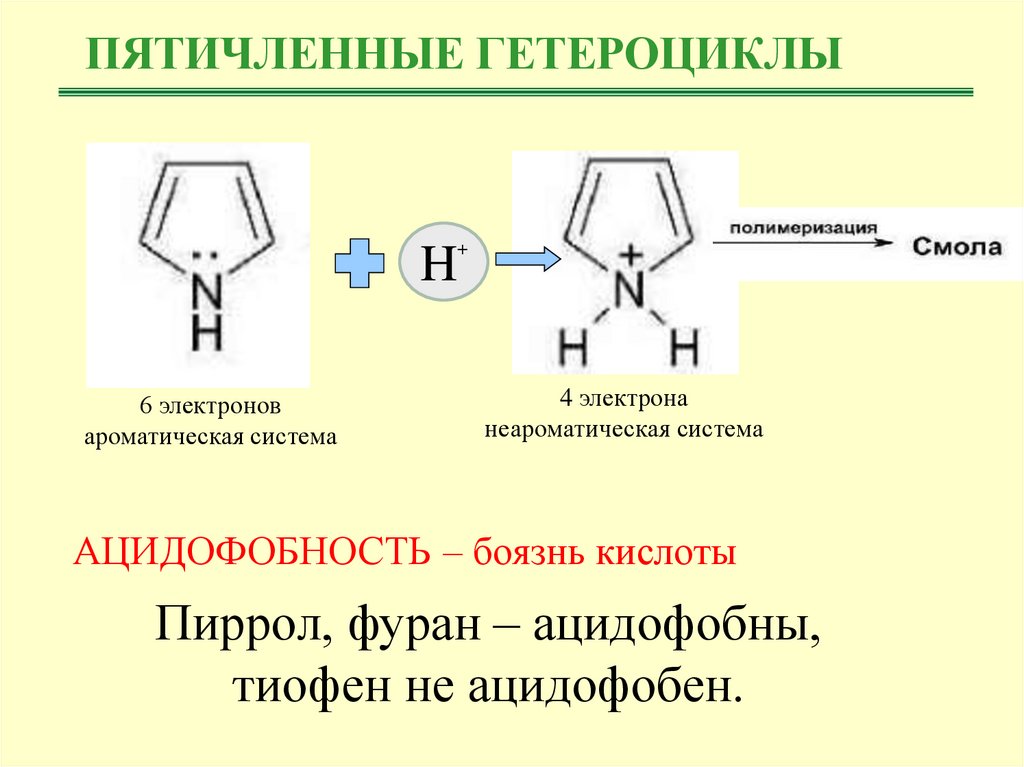
ПЯТИЧЛЕННЫЕ ГЕТЕРОЦИКЛЫH
6 электронов
ароматическая система
+
4 электрона
неароматическая система
АЦИДОФОБНОСТЬ – боязнь кислоты
Пиррол, фуран – ацидофобны,
тиофен не ацидофобен.
7.
ПЯТИЧЛЕННЫЕ ГЕТЕРОЦИКЛЫ1. Реакции электрофильного замещения
8.
ПЯТИЧЛЕННЫЕ ГЕТЕРОЦИКЛЫРеакции электрофильного замещения
9.
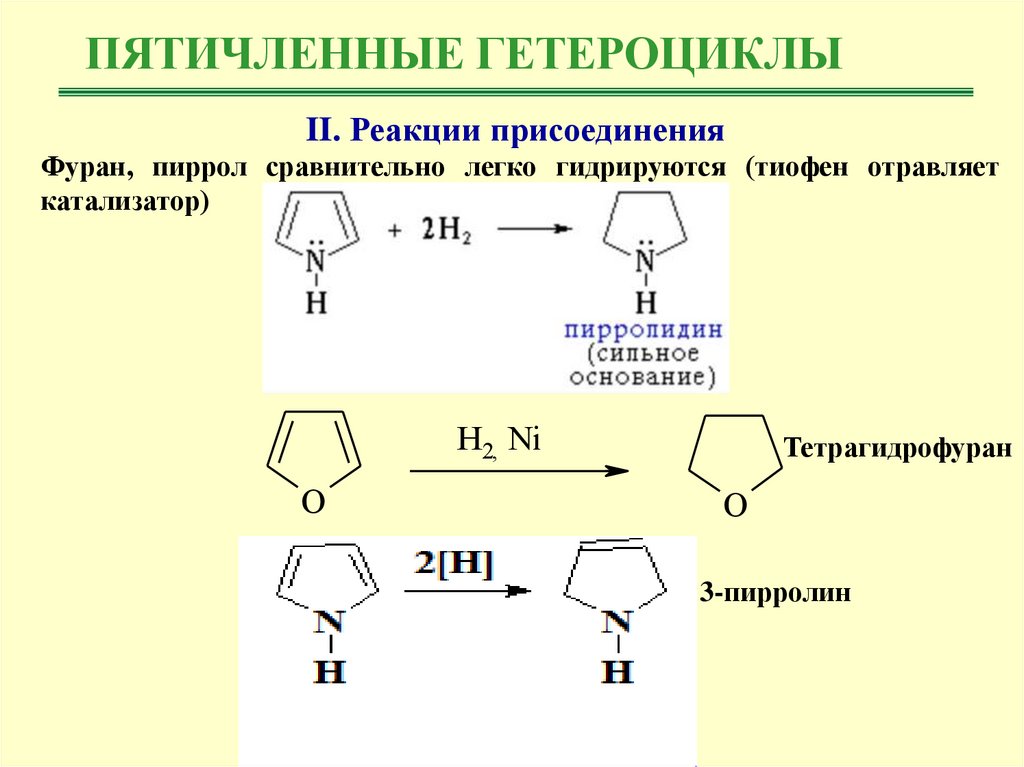
ПЯТИЧЛЕННЫЕ ГЕТЕРОЦИКЛЫII. Реакции присоединения
Фуран, пиррол сравнительно легко гидрируются (тиофен отравляет
катализатор)
H2, Ni
O
Тетрагидрофуран
O
3-пирролин
10.
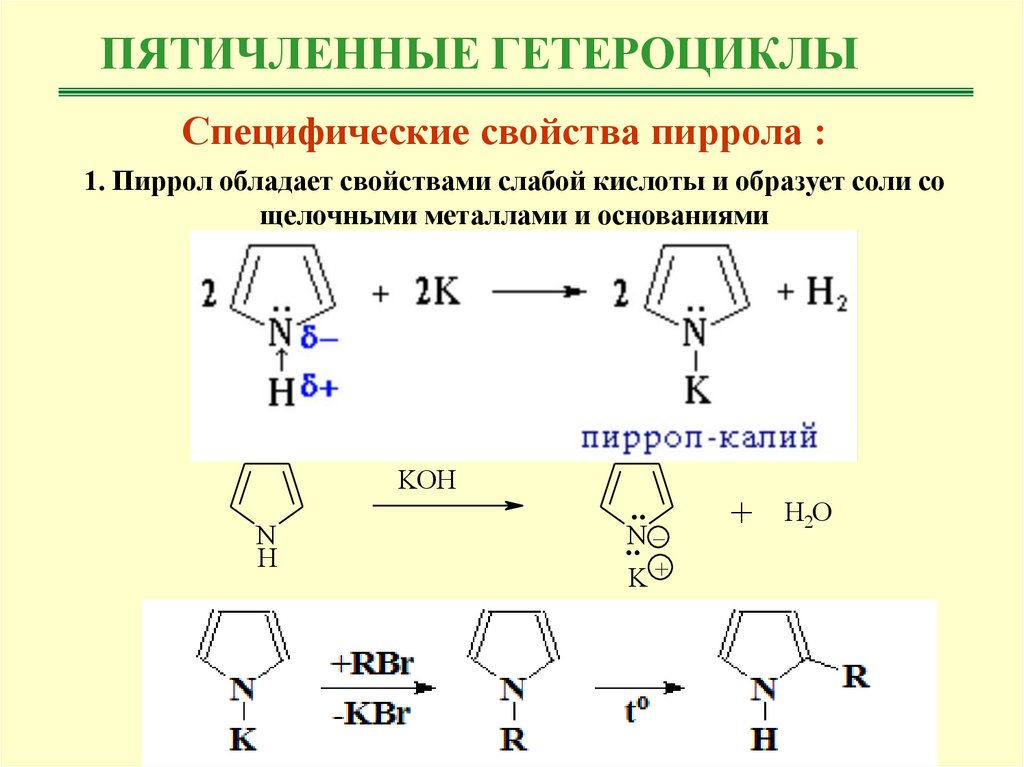
ПЯТИЧЛЕННЫЕ ГЕТЕРОЦИКЛЫСпецифические свойства пиррола :
1. Пиррол обладает свойствами слабой кислоты и образует соли со
щелочными металлами и основаниями
KOH
N
H
..
_
..N
K+
+
H2O
11.
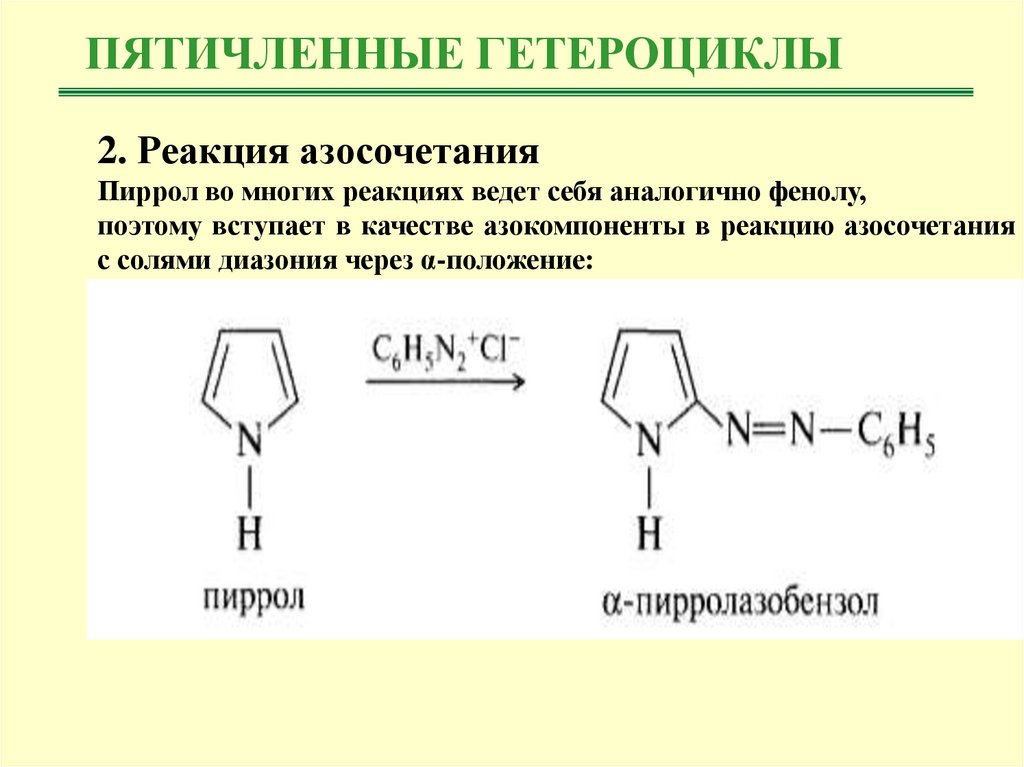
ПЯТИЧЛЕННЫЕ ГЕТЕРОЦИКЛЫ2. Реакция азосочетания
Пиррол во многих реакциях ведет себя аналогично фенолу,
поэтому вступает в качестве азокомпоненты в реакцию азосочетания
с солями диазония через α-положение:
12.
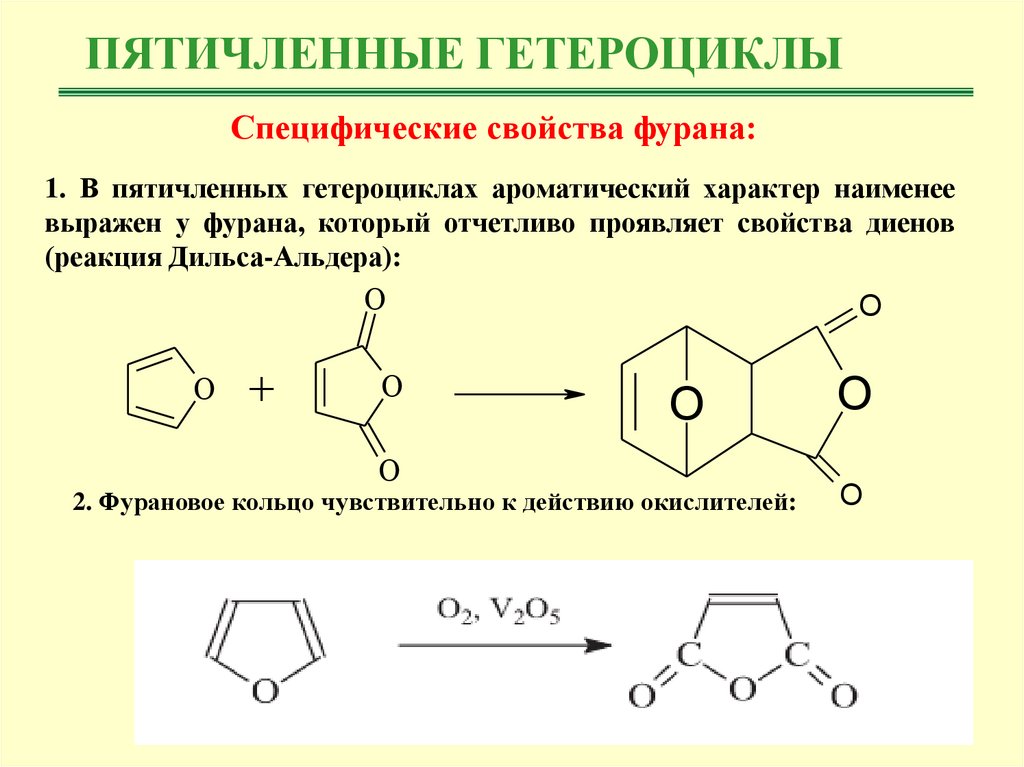
ПЯТИЧЛЕННЫЕ ГЕТЕРОЦИКЛЫСпецифические свойства фурана:
1. В пятичленных гетероциклах ароматический характер наименее
выражен у фурана, который отчетливо проявляет свойства диенов
(реакция Дильса-Альдера):
O
O
+
O
O
O
O
2. Фурановое кольцо чувствительно к действию окислителей:
O
O
13.
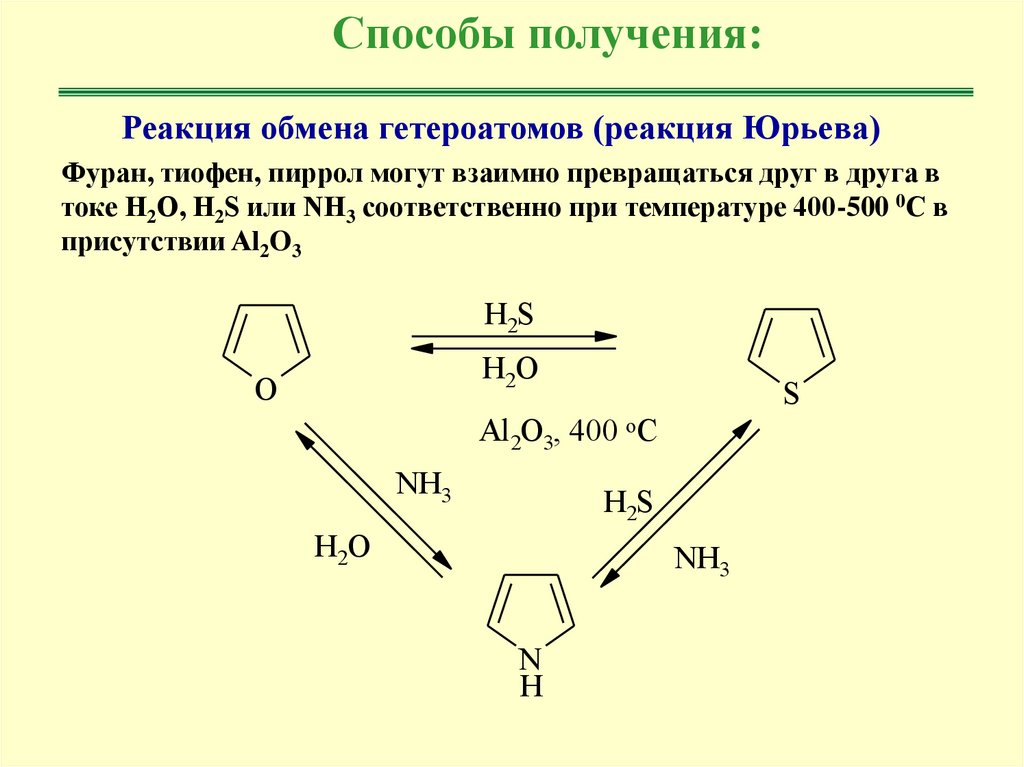
Способы получения:Реакция обмена гетероатомов (реакция Юрьева)
Фуран, тиофен, пиррол могут взаимно превращаться друг в друга в
токе Н2О, Н2S или NH3 соответственно при температуре 400-500 0С в
присутствии Al2O3
H2S
H2O
O
S
Al2O3, 400 oC
NH3
H2S
H2O
NH3
N
H
14.
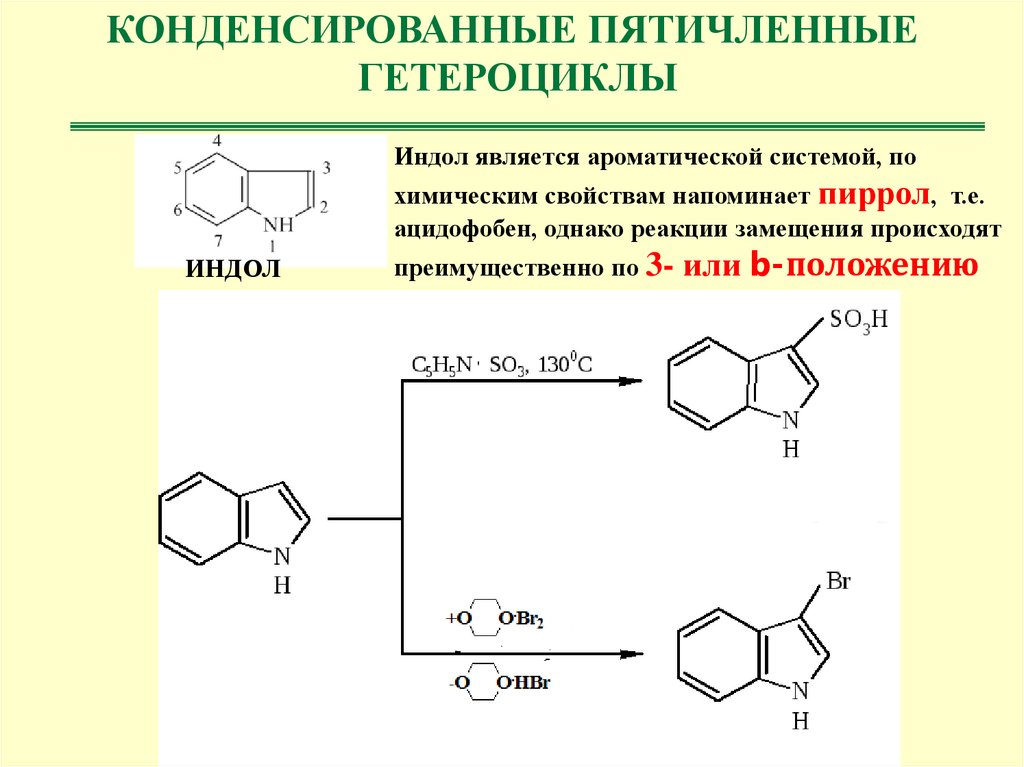
КОНДЕНСИРОВАННЫЕ ПЯТИЧЛЕННЫЕГЕТЕРОЦИКЛЫ
Индол является ароматической системой, по
химическим свойствам напоминает пиррол, т.е.
ацидофобен, однако реакции замещения происходят
ИНДОЛ
преимущественно по 3- или b-положению
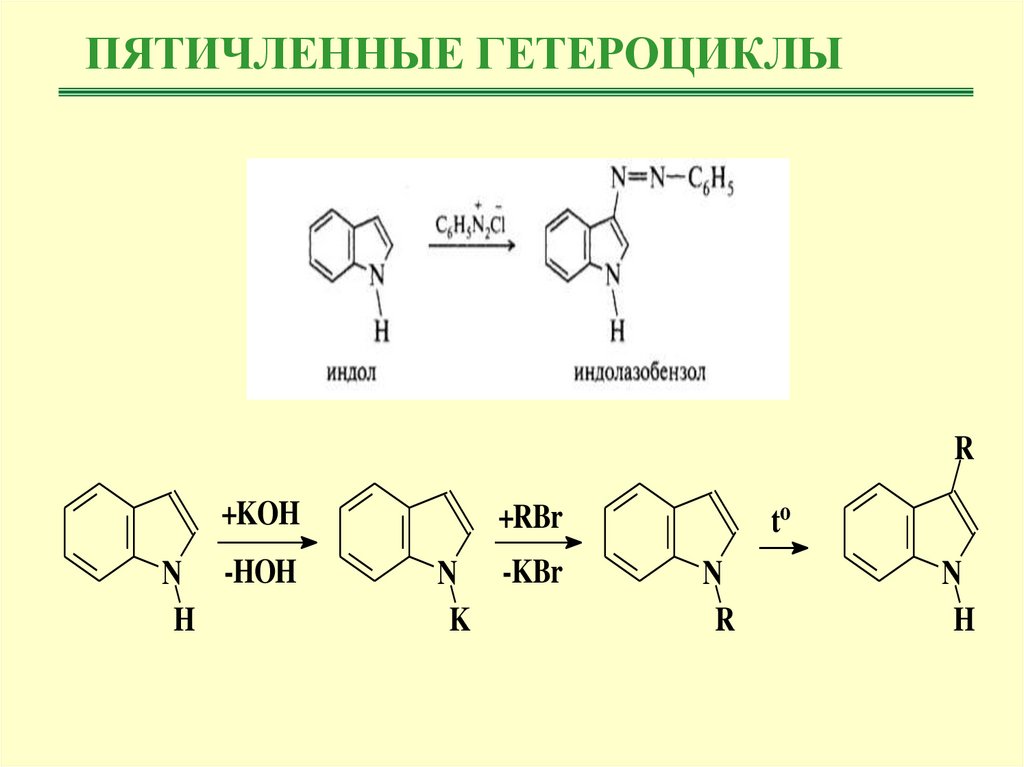
15.
ПЯТИЧЛЕННЫЕ ГЕТЕРОЦИКЛЫR
+KOH
+RBr
N -HOH
H
N -KBr
K
to
N
R
N
H
16.
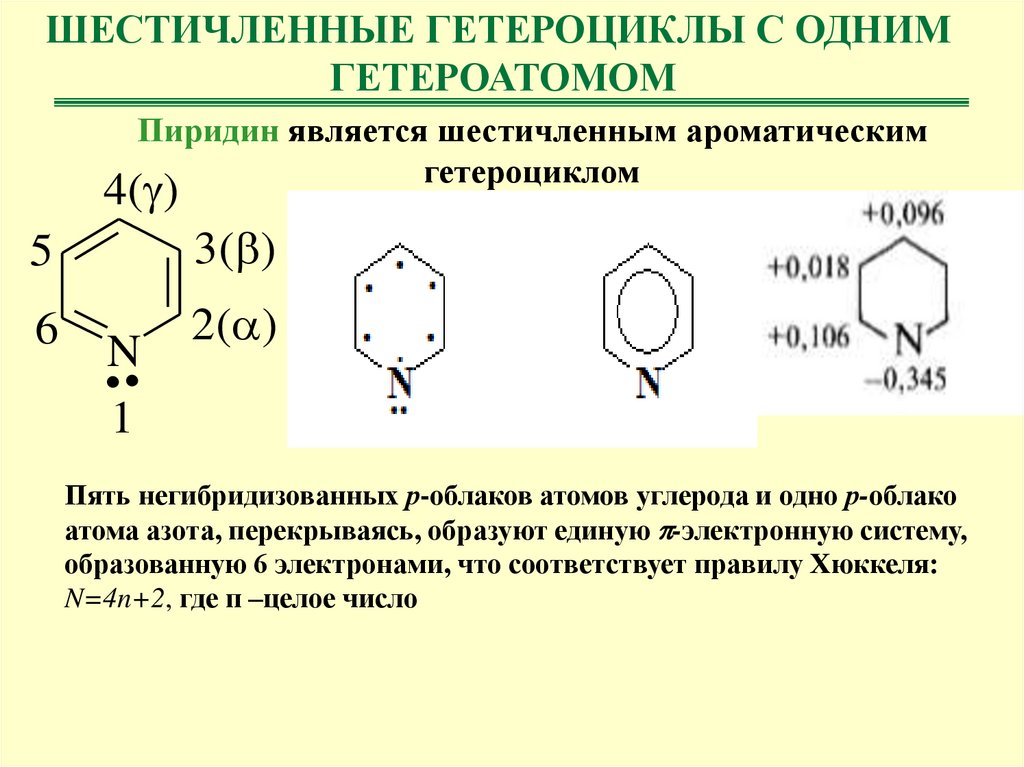
ШЕСТИЧЛЕННЫЕ ГЕТЕРОЦИКЛЫ С ОДНИМГЕТЕРОАТОМОМ
Пиридин является шестичленным ароматическим
гетероциклом
4( )
5
3( )
6
2( )
..
N
1
Пять негибридизованных р-облаков атомов углерода и одно р-облако
атома азота, перекрываясь, образуют единую -электронную систему,
образованную 6 электронами, что соответствует правилу Хюккеля:
N=4n+2, где п –целое число
17.
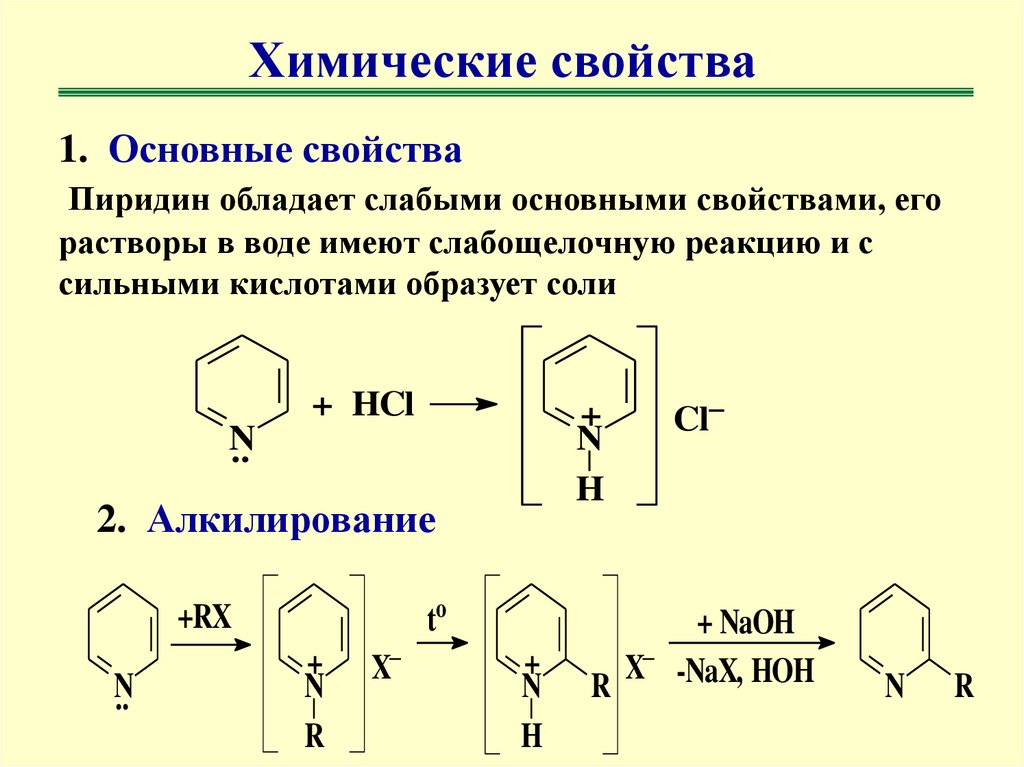
Химические свойства1. Основные свойства
Пиридин обладает слабыми основными свойствами, его
растворы в воде имеют слабощелочную реакцию и с
сильными кислотами образует соли
+ HCl
+
N
H
N
..
2. Алкилирование
to
+RX
N
..
+
N
R
X
+
N
H
Cl
+ NaOH
X -NaX, HOH
R
N
R
18.
3. Реакции электрофильного замещения SEВ реакциях электрофильного замещения пиридин ведет себя как сильно
дезактивированное производное бензола, подобно нитробензолу. Он
нитруется, сульфируется и галогенируется только в очень жестких
условиях (боле жестких, чем нитробензол). Замещение происходит в 3(b)положение
19.
4. Реакции нуклеофильного замещения SNРеакции нуклеофильного замещения в пиридине
происходят легко из-за обеднения кольца электронной
плотностью и наиболее легко – в 2- (a)положение
20.
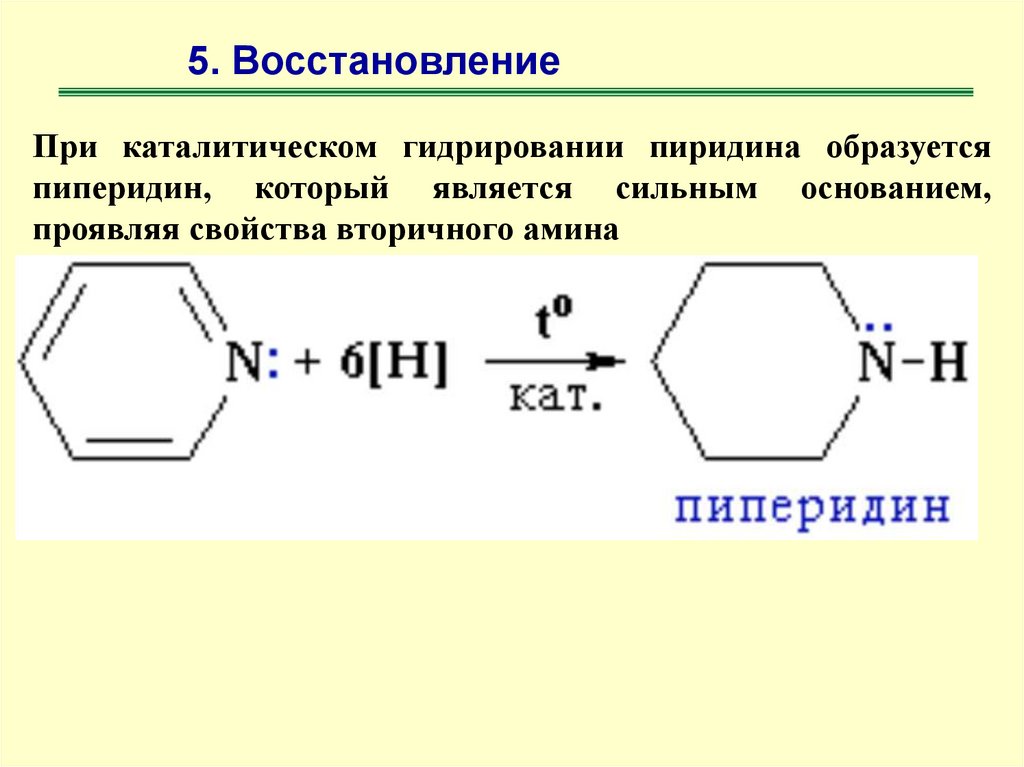
5. ВосстановлениеПри каталитическом гидрировании пиридина образуется
пиперидин, который является сильным основанием,
проявляя свойства вторичного амина
21.
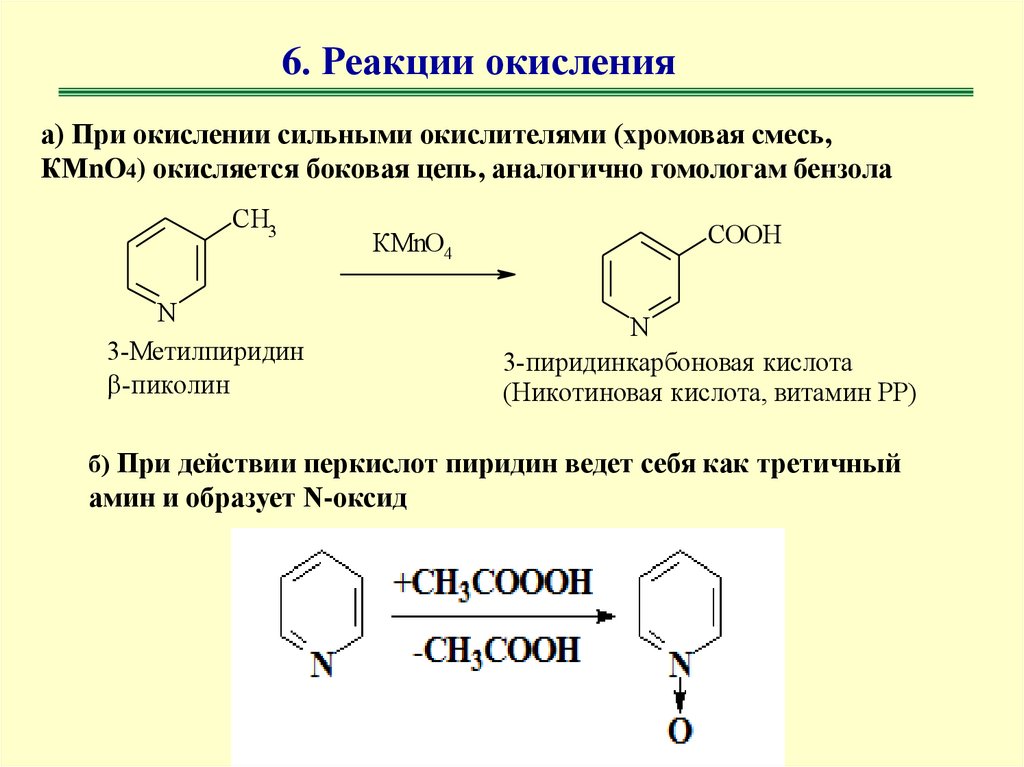
6. Реакции окисленияа) При окислении сильными окислителями (хромовая смесь,
КМnO4) окисляется боковая цепь, аналогично гомологам бензола
CH3
КMnO4
N
3-Мeтилпиридин
-пиколин
COOH
N
3-пиридинкарбоновая кислота
(Никотиновая кислота, витамин РР)
б) При действии перкислот пиридин ведет себя как третичный
амин и образует N-оксид
22.
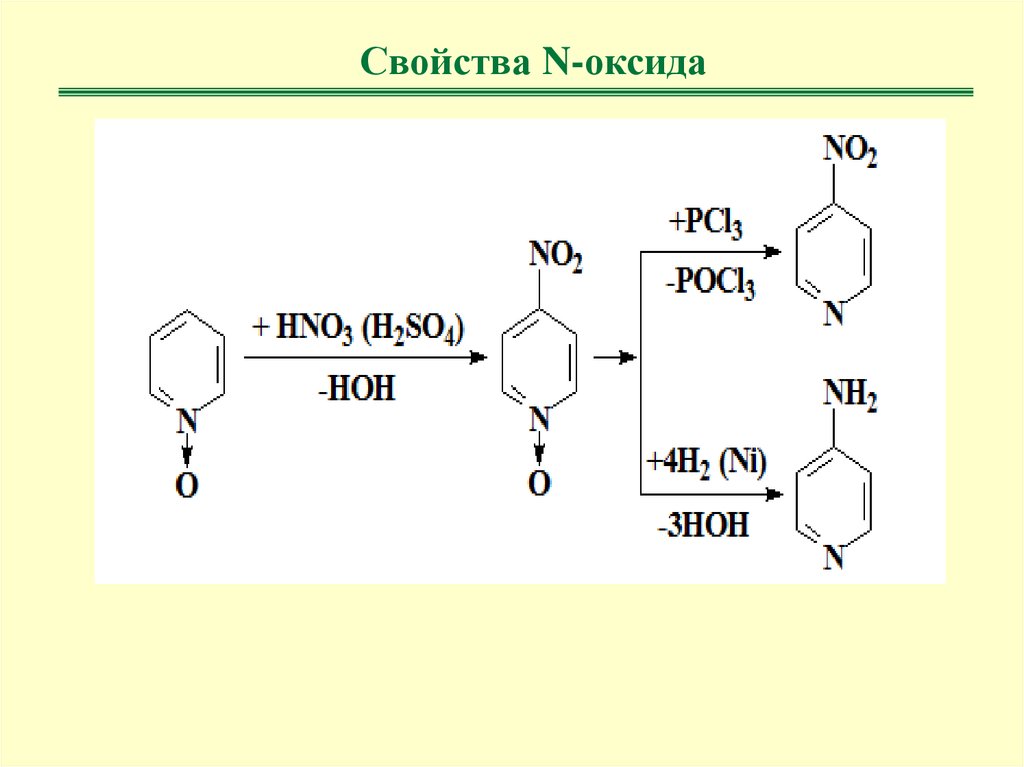
Свойства N-оксида23.
ХИНОЛИНХинолин представляет собой конденсированную систему, содержащую
бензольное и пиридиновое кольца
5
4
3
6
7
8
N
1
1. Основные свойства
2
24.
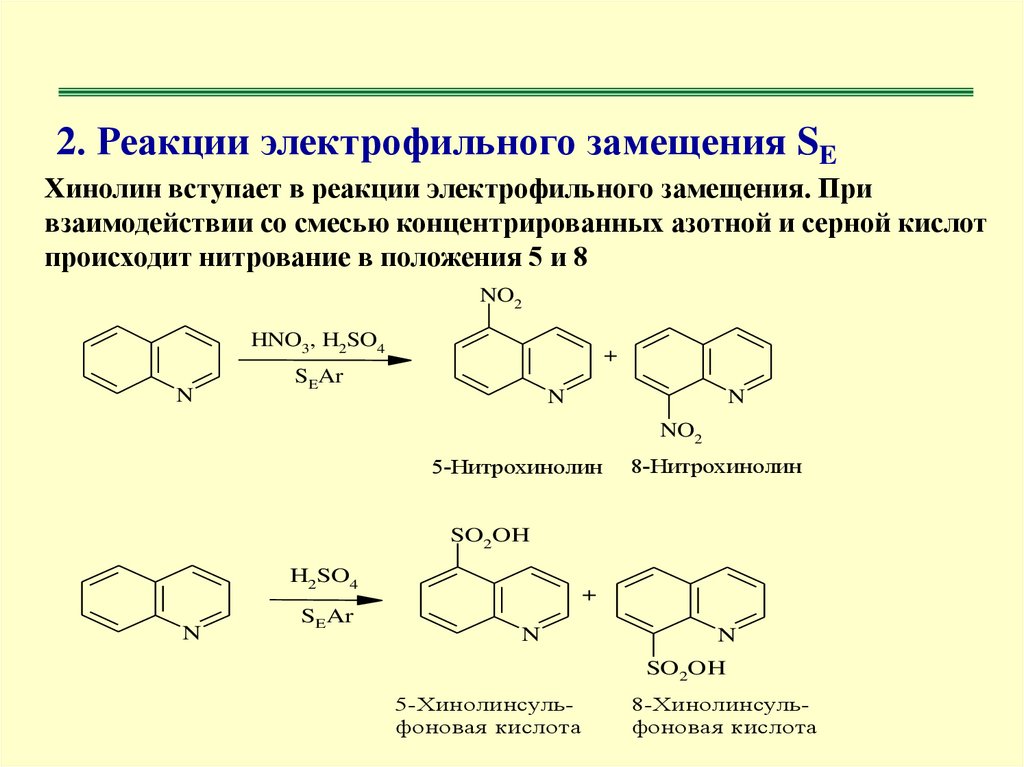
2. Реакции электрофильного замещения SEХинолин вступает в реакции электрофильного замещения. При
взаимодействии со смесью концентрированных азотной и серной кислот
происходит нитрование в положения 5 и 8
NO2
HNO3, H2SO4
N
+
SEAr
N
N
NO2
5-Нитрохинолин
8-Нитрохинолин
SO2OH
H2SO4
N
SEAr
+
N
N
SO2OH
5-Хинолинсульфоновая кислота
8-Хинолинсульфоновая кислота
25.
3. Реакции нуклеофильного замещения SNХинолин так же, как и пиридин, вступает в реакции нуклеофильного
замещения: взаимодействует с амидом натрия и фениллитием
NaNH2, NH3
нагревание
N
+ NaH + NH3
SN
N
NH2
2-Аминохинолин
H2+ NaNH2
Li
нагревание
N
SN
+ LiH
N
2-Фенилхинолин
26.
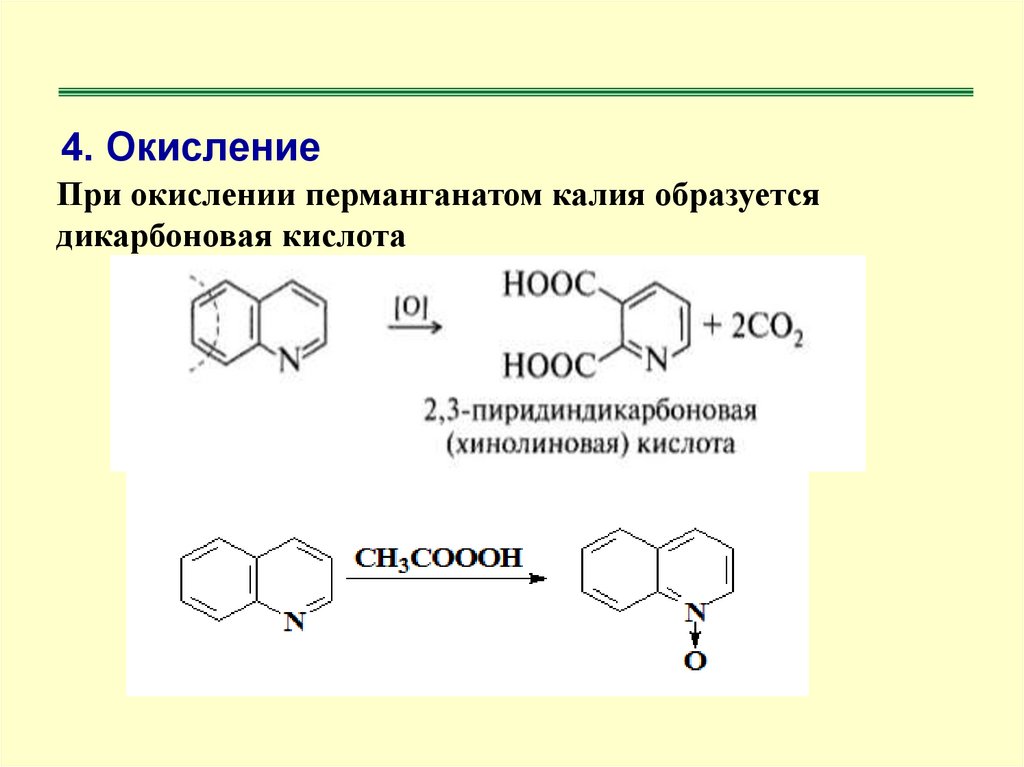
4. ОкислениеПри окислении перманганатом калия образуется
дикарбоновая кислота





 chemistry
chemistry








