Similar presentations:
Гетероциклические соединения (лекции)
1.
ШЕСТИЧЛЕННЫЕГЕТЕРОЦИКЛИЧЕСКИЕ
СОЕДИНЕНИЯ
2.
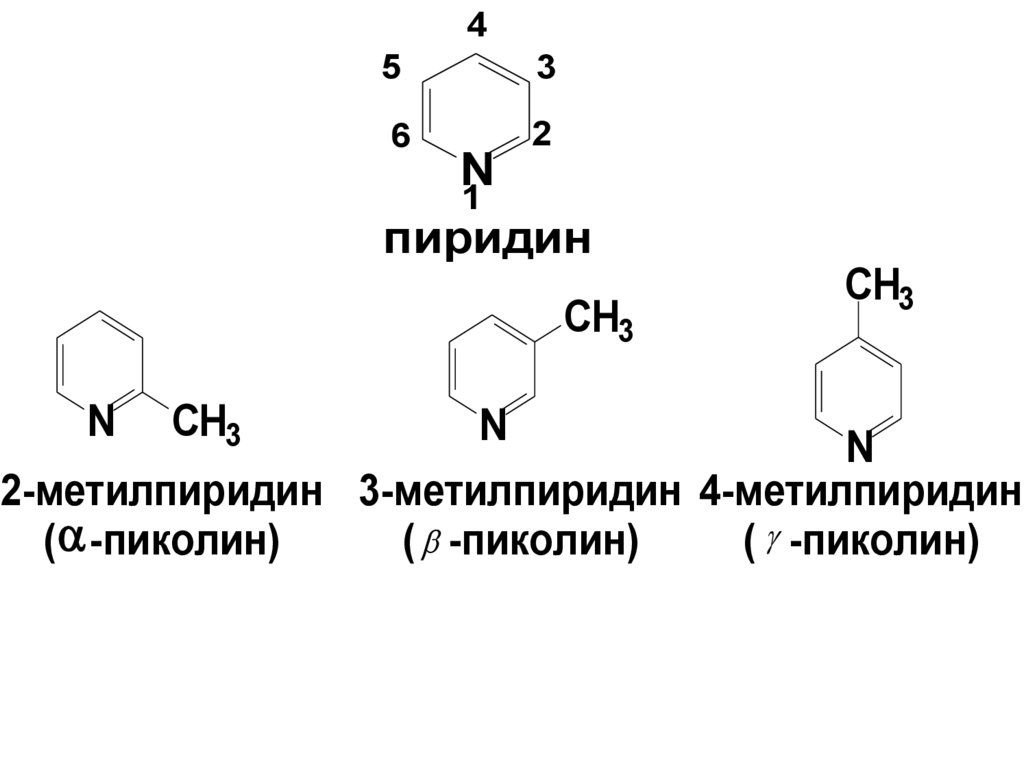
45
3
6
2
N
1
пиридин
CH3
N
CH3
N
CH3
N
2-метилпиридин 3-метилпиридин 4-метилпиридин
( -пиколин)
( -пиколин)
( -пиколин)
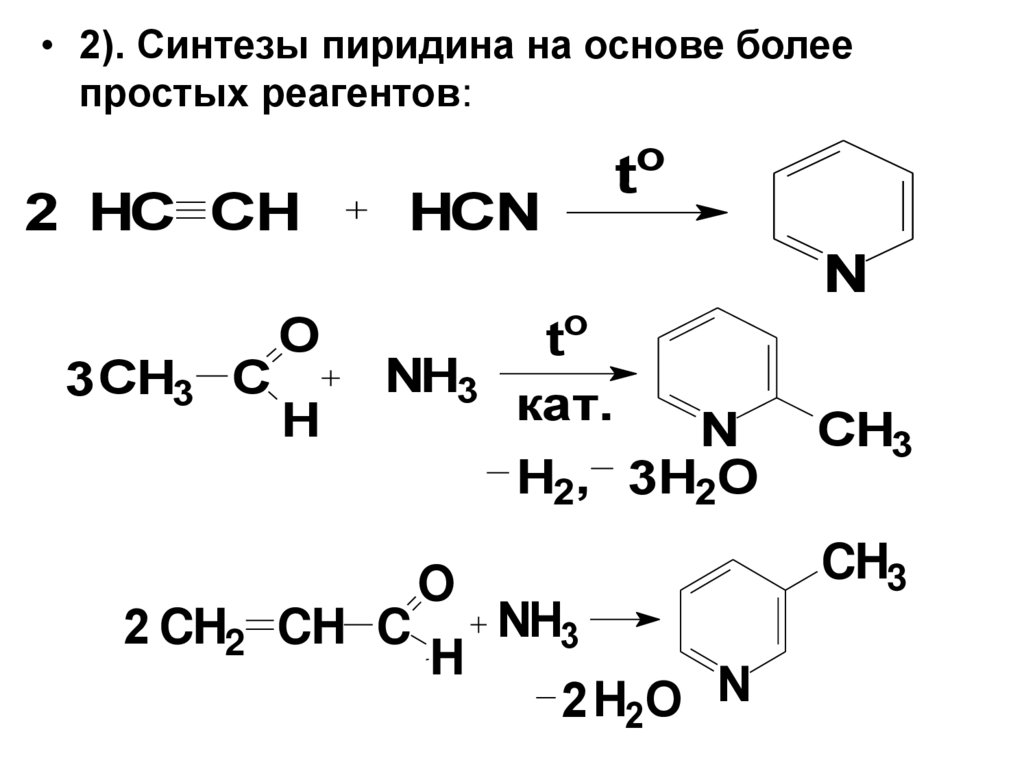
3. Способы получения
• 1. В промышленных масштабах пиридин иего гомологи получают при
коксохимической переработке каменного
угля.
2. Лабораторные методы:
1). Наиболее известный метод синтеза Ганча. См.
уч.
4.
• 2). Синтезы пиридина на основе болеепростых реагентов:
o
2 HC СH
3 CH3 C
O
H
t
HCN
NH3
2 CH2 CH C
O
H
to
кат.
N
H2, 3H2O
NH3
2 H2O N
N
CH3
CH3
5. Физические свойства
• Пиридин представляет собойбесц. жидкость с Т.кип. 115оС.
• Он обладает характерным
неприятным запахом,
смешивается во всех
отношениях с водой, этанолом,
диэтиловым эфиром; устойчив
при хранении.
6.
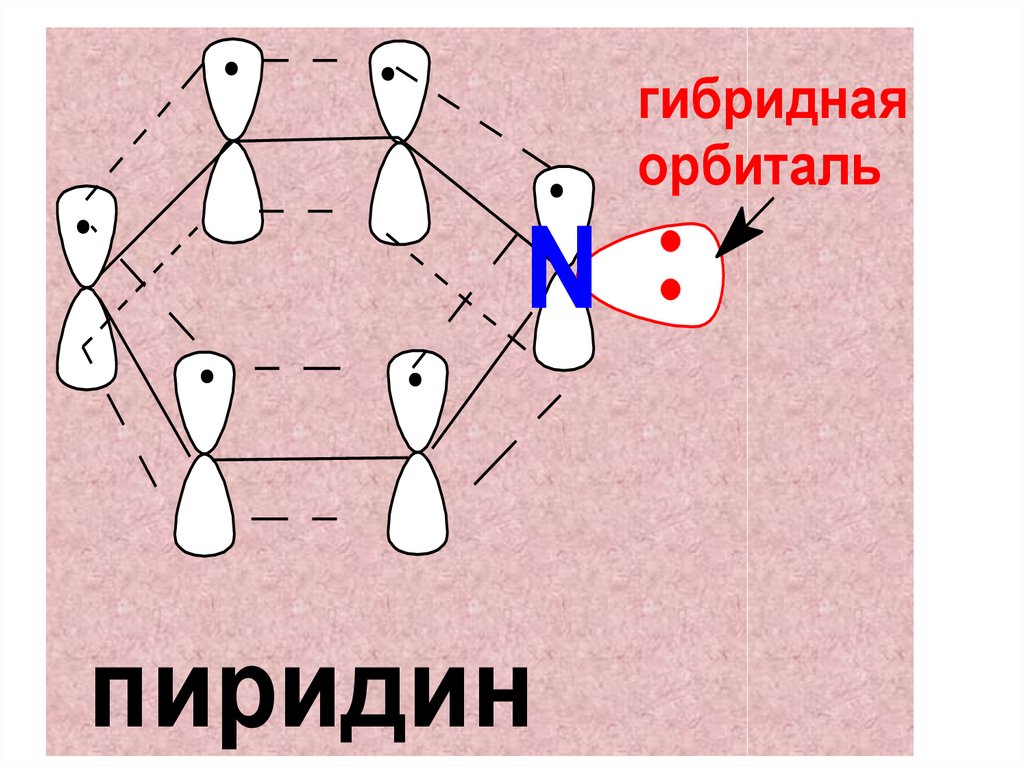
• Строение• Пиридин является шестичленным
гетероароматическим аналогом бензола.
Все атомы цикла находятся в состоянии
sp2-гибридизации и вносят по одному
π-электрону в ароматический секстет.
• Плоская молекула имеет сопряжённую
систему из шести π-электронов.
7.
гибриднаяорбиталь
N
пиридин
8.
• НЭП атома азота находится внесопряженной системы и занимает
гибридную sp2 –орбиталь,
ориентированную в плоскости
цикла перпендикулярно осям
негибридных орбиталей атомов
С и N.
9.
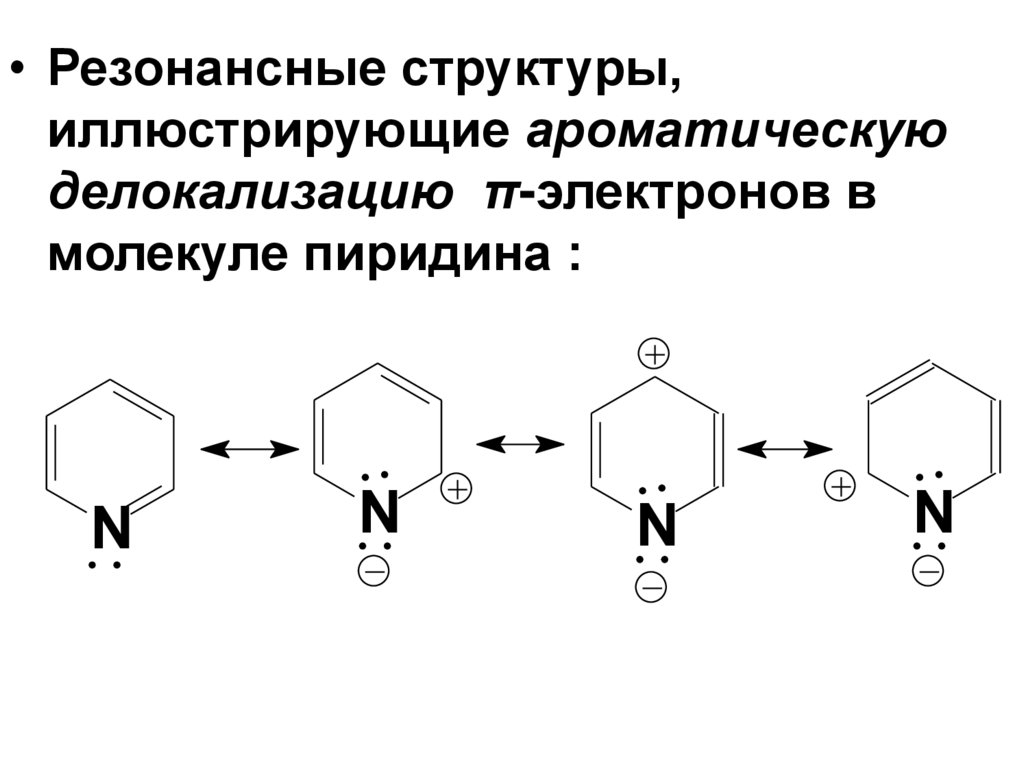
• Резонансные структуры,иллюстрирующие ароматическую
делокализацию π-электронов в
молекуле пиридина :
N
N
N
N
10.
• В большей части этих структур атомазота имеет отрицательный заряд, что
соответствует его большей
электроотрицательности. Степень
разделения зарядов в молекуле пиридина
характеризует сравнительно высокий
дипольный момент.
11.
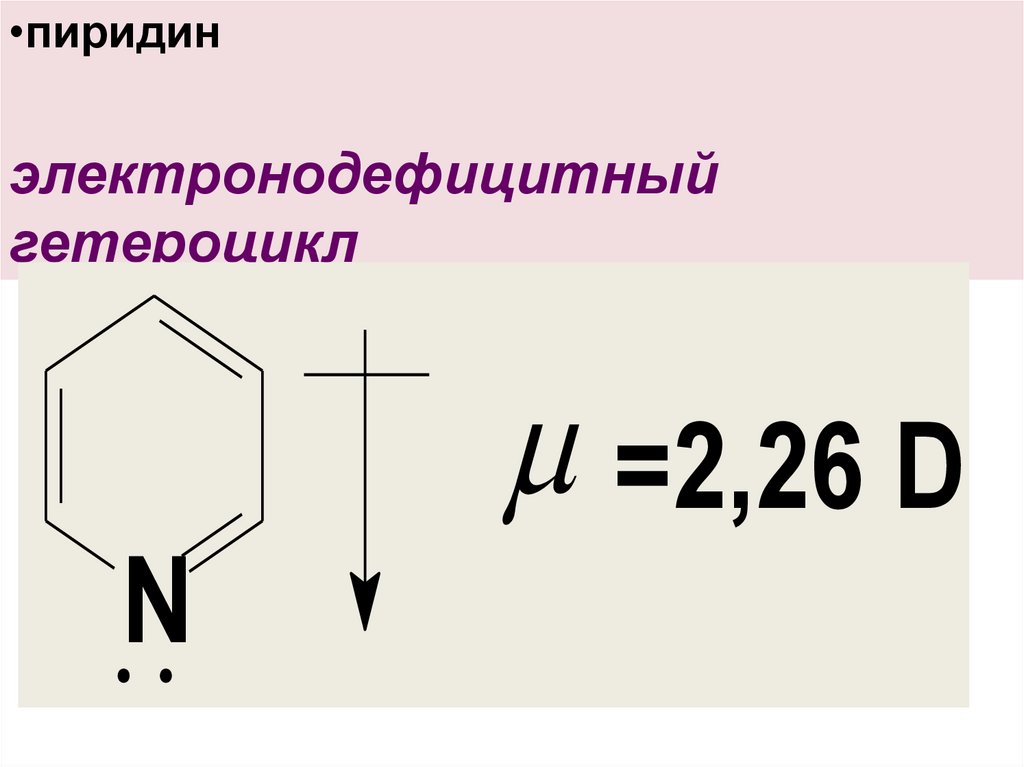
•пиридинэлектронодефицитный
гетероцикл
=2,26 D
N
12. Химические свойства
1. Основные инуклеофильные свойства
• Поскольку НЭП азота в молекуле
пиридина не входит в
ароматический секстет, пиридин
обнаруживает и основные, и
нуклеофильные свойства.
13.
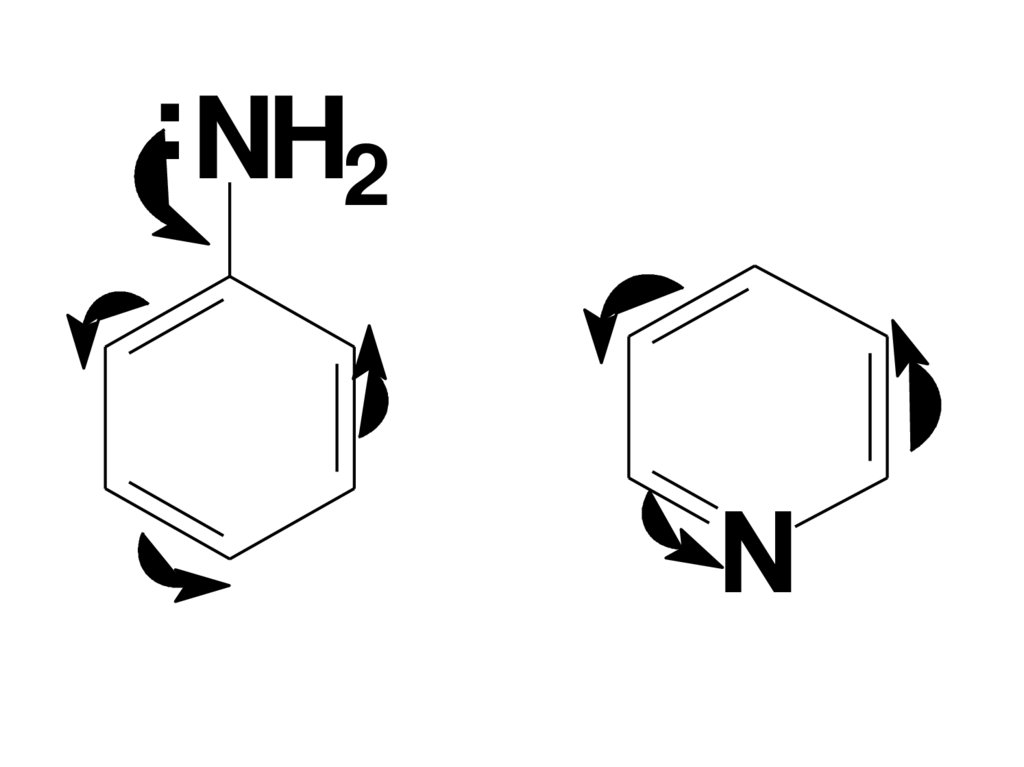
• Пиридин более сильное основание, чеманилин.
• Водный р-р его имеет щелочную р-цию на
лакмус. Это обусловлено тем, что у
анилина электронная пара N смещена
вследствие сопряжения в сторону
кольца, а у пиридина на N эл-ая
плотность повышена за счет стягивания
эл-ов с кольца (подобно нитро-группе в
бензольном кольце – ЭА заместителю II
рода).
14.
..NH2N
15.
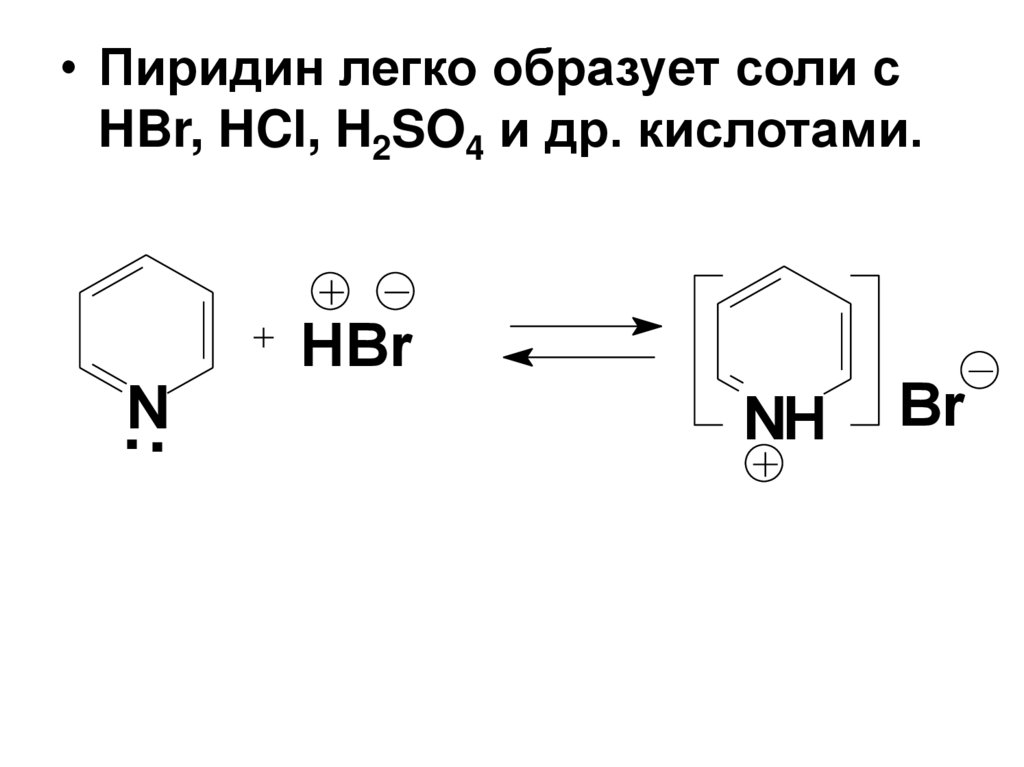
• Пиридин легко образует соли сHBr, HCl, H2SO4 и др. кислотами.
.N.
HBr
NH
Br
16.
• Однако основность пиридиназначительно ниже, чем у
жирных аминов Alk→NH2.
• Это можно объяснить тем, что
пара эл-ов N, обусловливающая
основность пиридина, занимает
sp2-орбиталь, она удерживается
прочнее и менее доступна для
обобществления с протоном
кислоты
17.
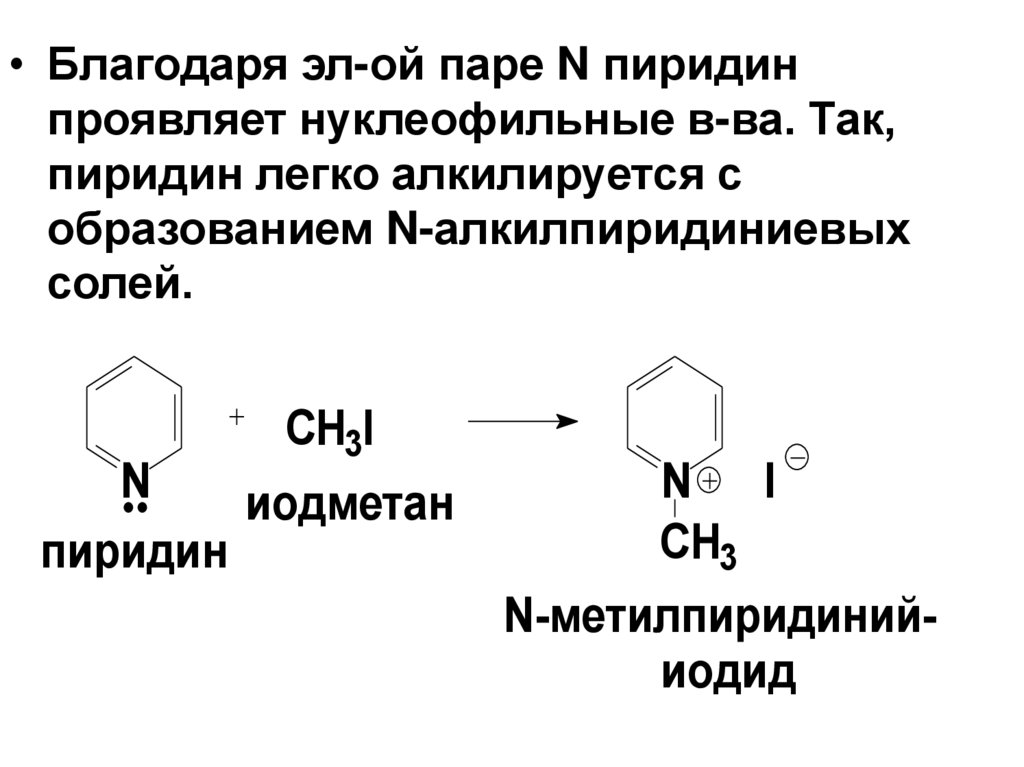
• Благодаря эл-ой паре N пиридинпроявляет нуклеофильные в-ва. Так,
пиридин легко алкилируется с
образованием N-алкилпиридиниевых
солей.
CH3I
N
иодметан
пиридин
N I
CH3
N-метилпиридинийиодид
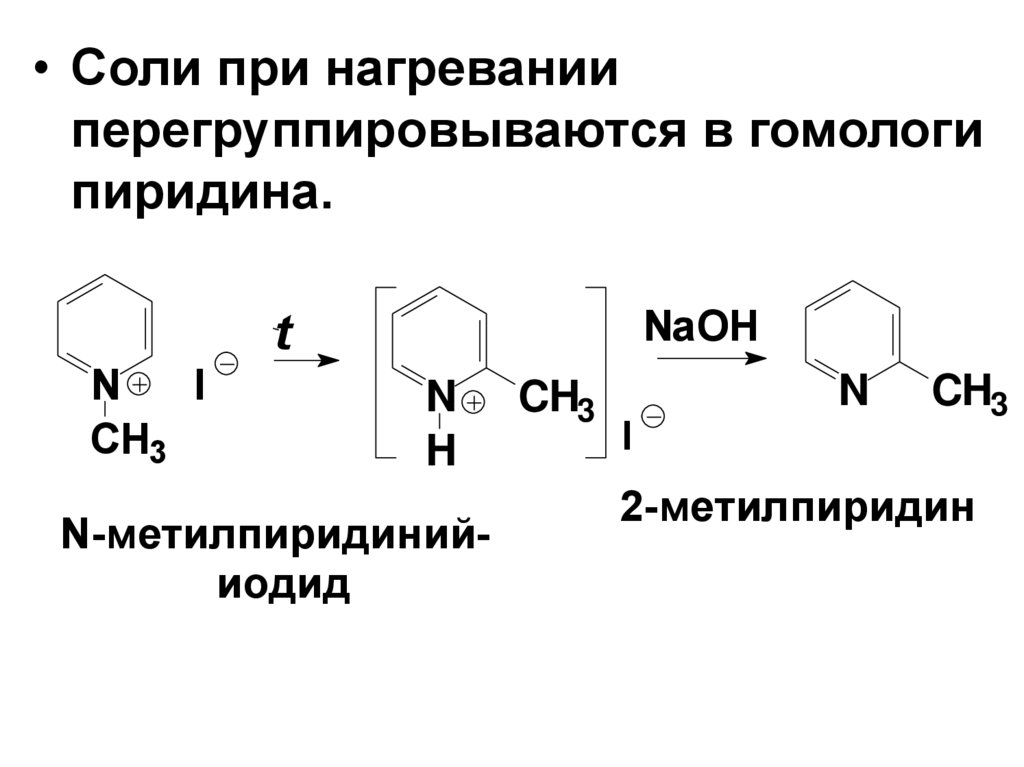
18.
• Соли при нагреванииперегруппировываются в гомологи
пиридина.
NaOH
t
N
I
CH3
N
H
N-метилпиридинийиодид
CH3
I
N
CH3
2-метилпиридин
19.
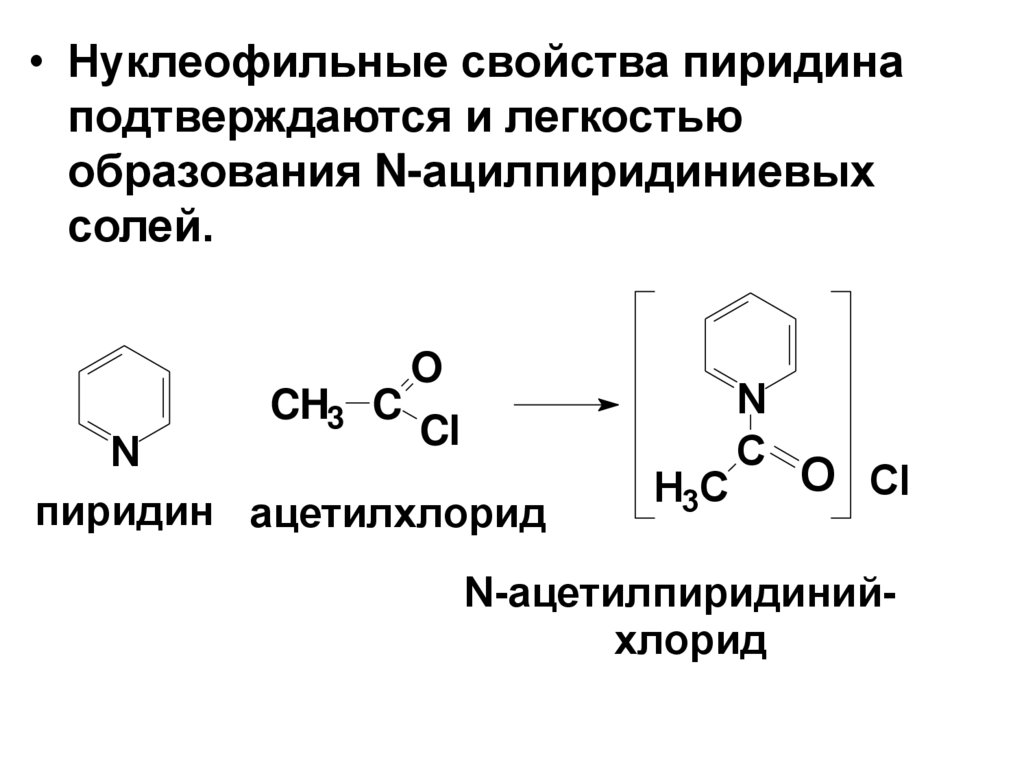
• Нуклеофильные свойства пиридинаподтверждаются и легкостью
образования N-ацилпиридиниевых
солей.
CH3 C
O
Cl
N
пиридин ацетилхлорид
H3C
N
C
O Cl
N-ацетилпиридинийхлорид
20.
• П с SO3 образует комплекс С6H5N∙SO3,используемый для сульфирования
ацидофобных соединений. Это
мягкий сульфирующий агент,
не содержащий свободной Н2SO4.
21. 2. Электрофильное ароматическое замещение
• Пиридин обладает ярко выраженнымиароматическими cв-вами благодаря
наличию устойчивого секстета πэлектронов. Следовательно, для него
характерны SE-реакции.
• Однако SE-реакции протекают с
трудом, в значительно более
жестких условиях, чем в бензоле.
22.
• Это обусловлено двумя причинами:• 1) понижена электронная плотность в
кольце (дезактивирующее действие N),
• 2) при взаимодействии П с
электрофилами атака их направлена на N,
т.к. на нем выше электронная плотность,
он более нуклеофилен, что приводит к
образованию соли.
N становится аммонийным, что еще
больше дезактивирует кольцо.
23.
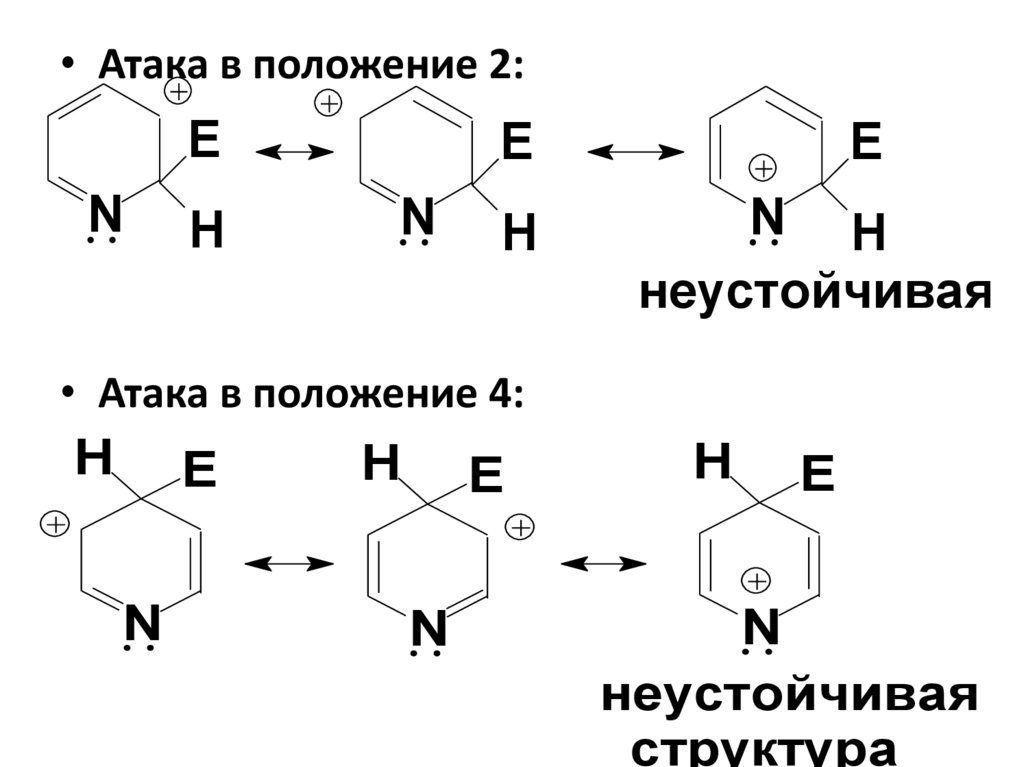
• Пиридин по cв-вам напоминаетнитробензол.
• Электрофильное замещение идет в
β-положение (3-), что легко
объясняется резонансными
структурами. Только при замещении
в β-положении +заряд σ-комплекса
делокализован между тремя Сатомами и отсутствует структура с +
зарядом на N-атоме.
24.
• Атака в положение 2:E
N
H
E
N
H
E
N H
неустойчивая
• Атака в положение 4:
H
E
N
H
E
N
H
E
N
неустойчивая
структура
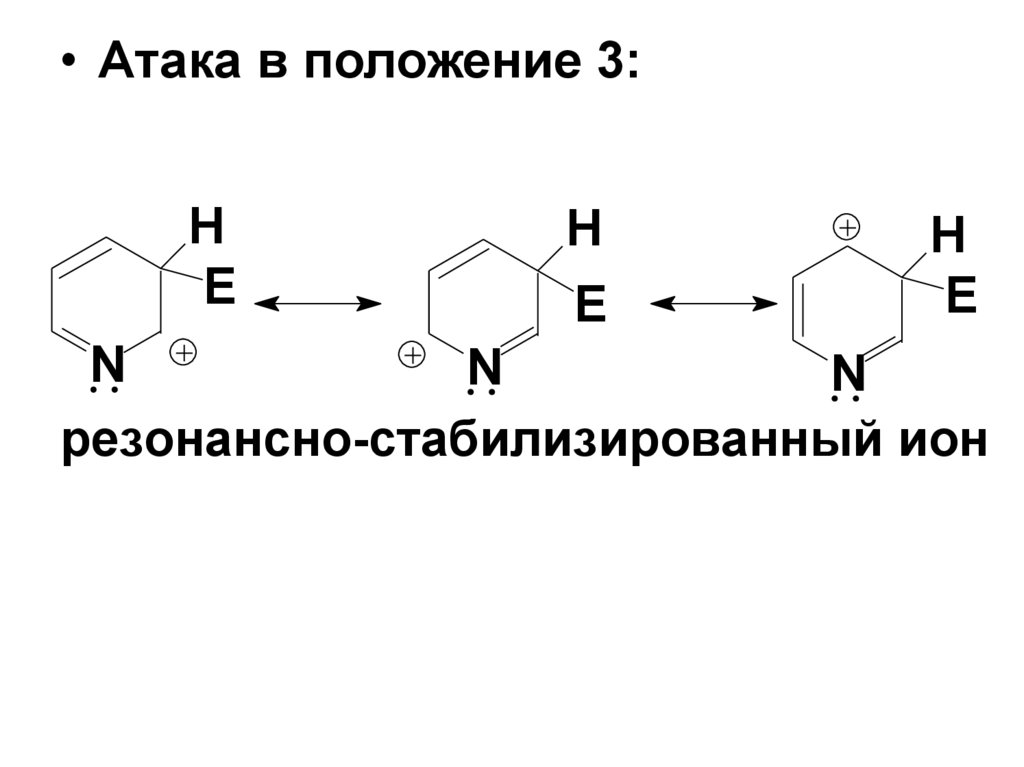
25.
• Атака в положение 3:H
E
H
E
H
E
N
N
N
резонансно-стабилизированный ион
26.
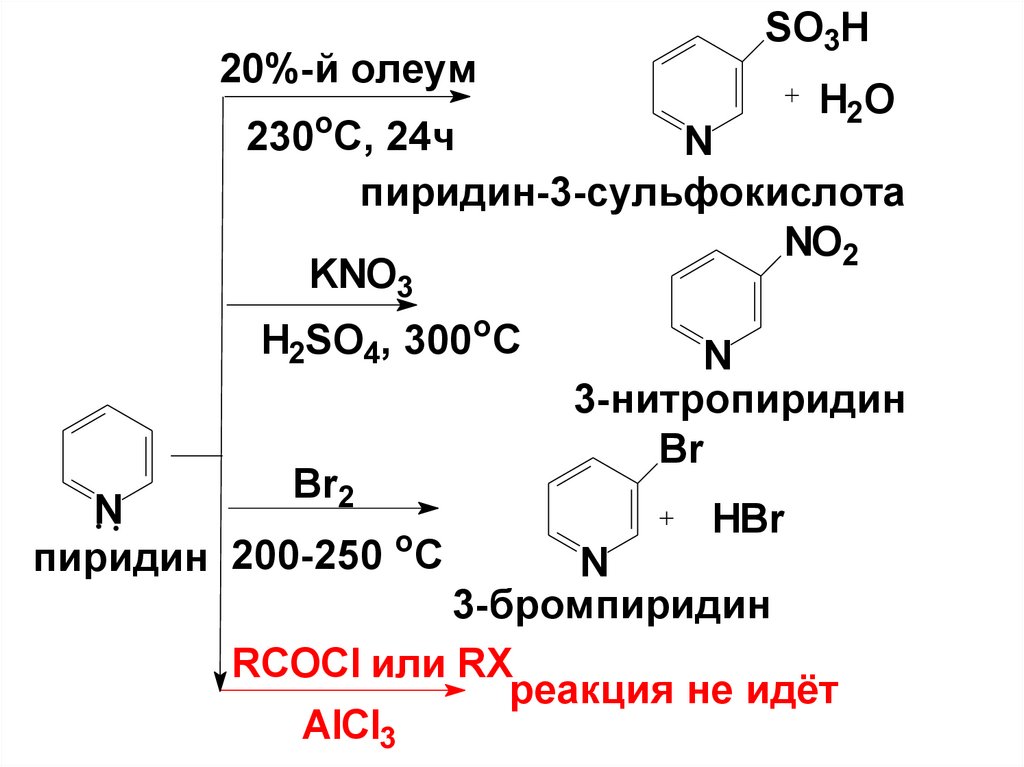
20%-й олеумSO3H
H2O
о
230 С, 24ч
N
пиридин-3-сульфокислота
NO2
KNO3
H2SO4, 300oC
Br2
N
o
200-250
C
пиридин
N
3-нитропиридин
Br
HBr
N
3-бромпиридин
RCOCl или RX
реакция не идёт
AlCl3
27. 3. Реакции нуклеофильного замещения
• Пиридин, являясьэлектронодефицитным гетероциклом,
обладает высоким сродством к
электрону. Это способствует особой
склонности пиридина к реакциям с
нуклеофильными реагентами
(SN-реакции). Нуклеофил атакует αположение (2).
28.
Классическим примером такой реакции является
реакция Чичибабина . В этой реакции пиридин
обрабатывают амидом натрия при нагревании в
N,N-диметиланилине или толуоле в качестве
растворителя. Подобно протекает и реакция с
литийорганическими соединениями.
• Однако реакция с КОН протекает лишь в очень ж. у.
29.
NaNH2o
(C6H5N(CH3)2) t
N
NH2
2-аминопиридин
C6H5Li
N
пиридин
110оС, толуол
N
С6H5
2-фенилпиридин
KOH
350-400oC
N OH
2-гидроксипиридин
30.
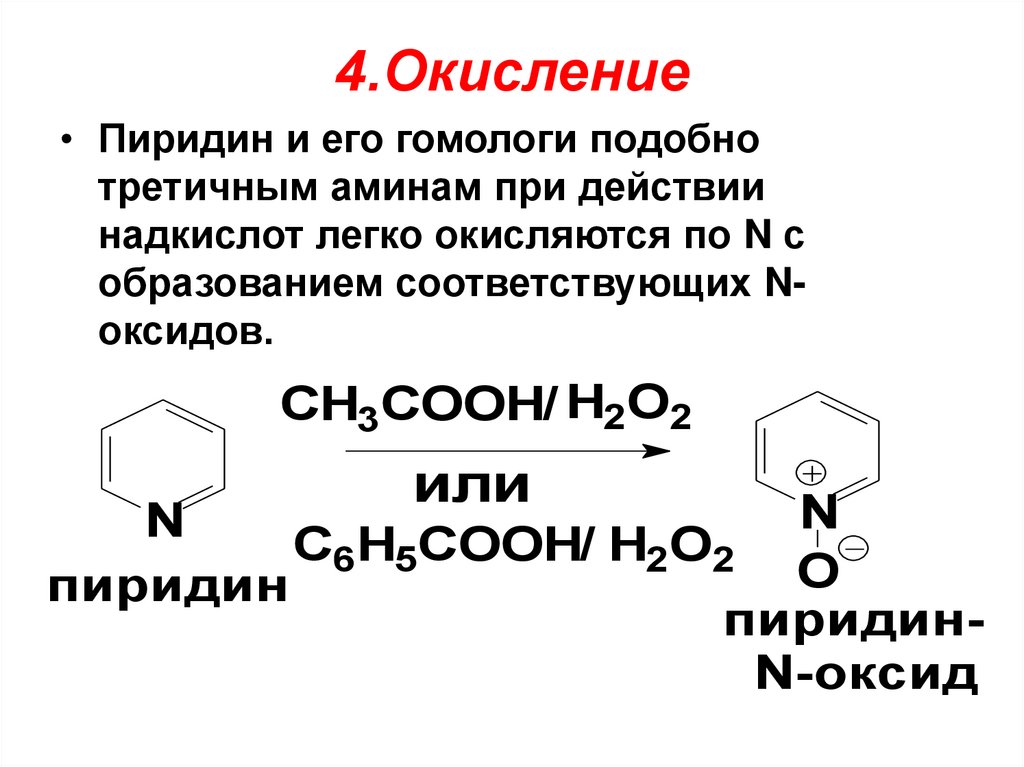
4.Окисление• Пиридин и его гомологи подобно
третичным аминам при действии
надкислот легко окисляются по N с
образованием соответствующих Nоксидов.
CH3COOH/ H2O2
или
N
N
C6H5COOH/ H2O2
O
пиридин
пиридинN-оксид
31.
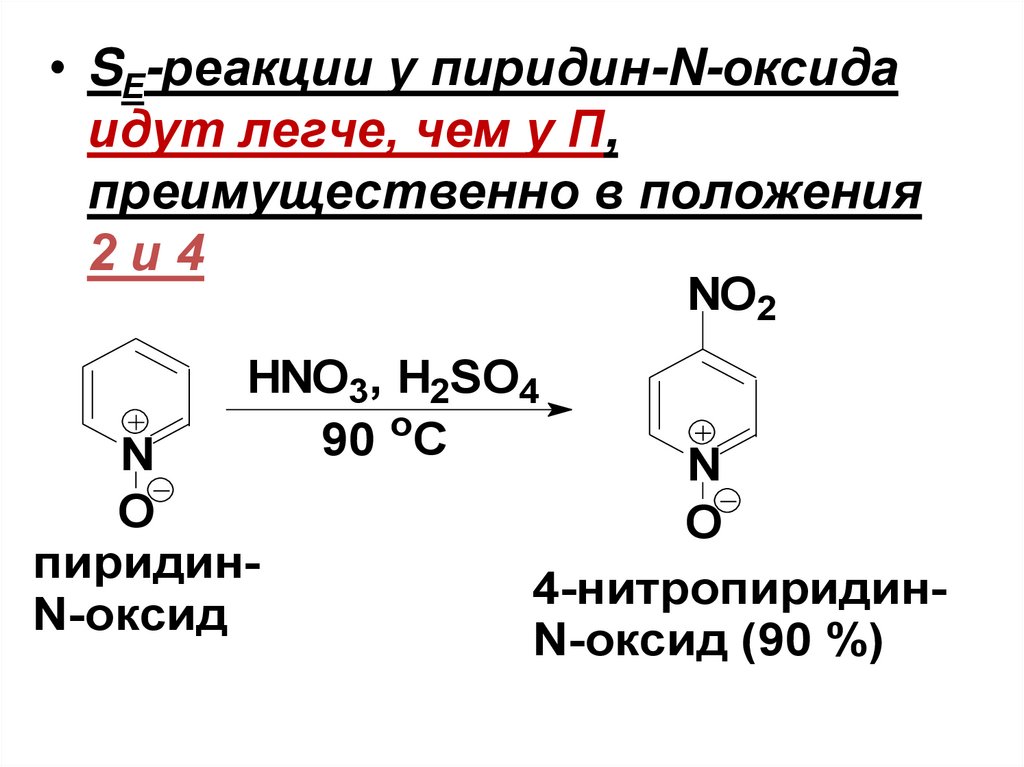
• SЕ-реакции у пиридин-N-оксидаидут легче, чем у П,
преимущественно в положения
2и4
NO2
HNO3, H2SO4
o
90 C
N
O
пиридинN-оксид
N
O
4-нитропиридинN-оксид (90 %)
32.
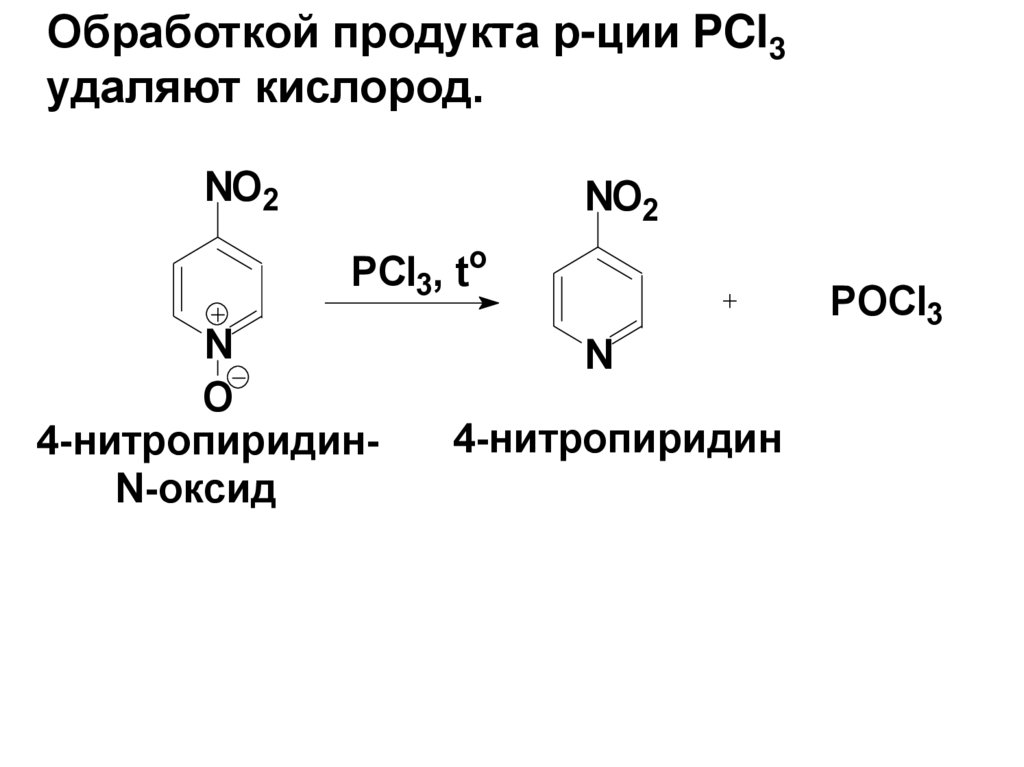
Обработкой продукта р-ции PCl3удаляют кислород.
NO2
NO2
PCl3, to
N
O
4-нитропиридинN-оксид
N
4-нитропиридин
POCl3
33.
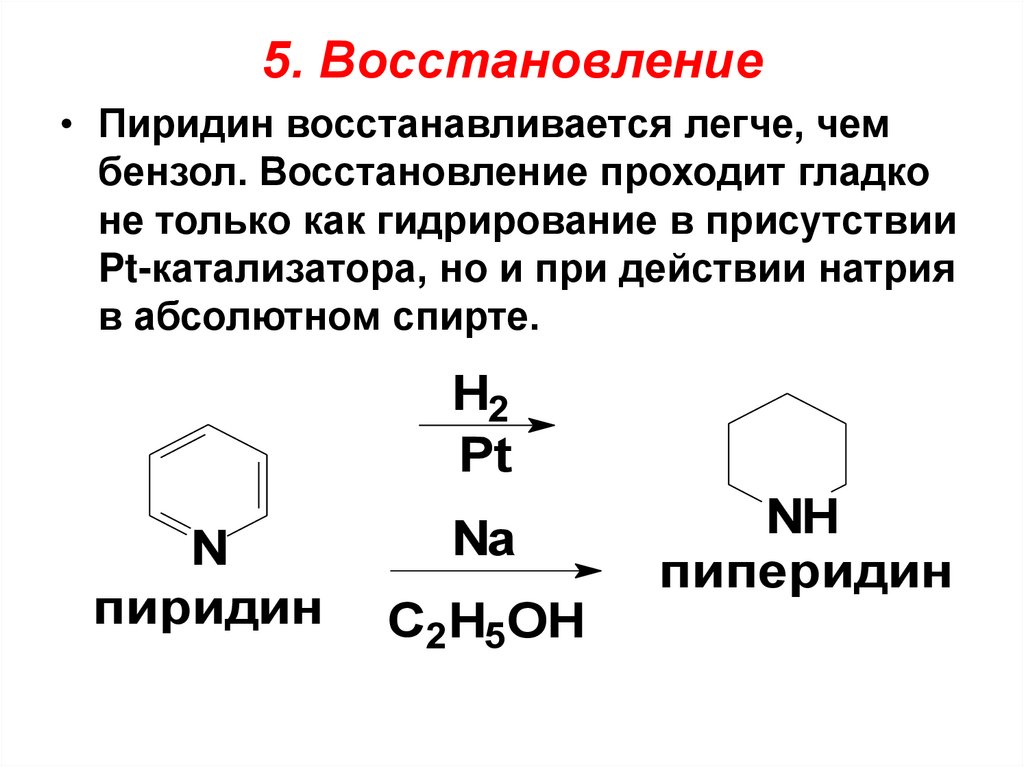
5. Восстановление• Пиридин восстанавливается легче, чем
бензол. Восстановление проходит гладко
не только как гидрирование в присутствии
Pt-катализатора, но и при действии натрия
в абсолютном спирте.
H2
Pt
N
пиридин
Na
C2H5OH
NH
пиперидин
34. Производные пиридина
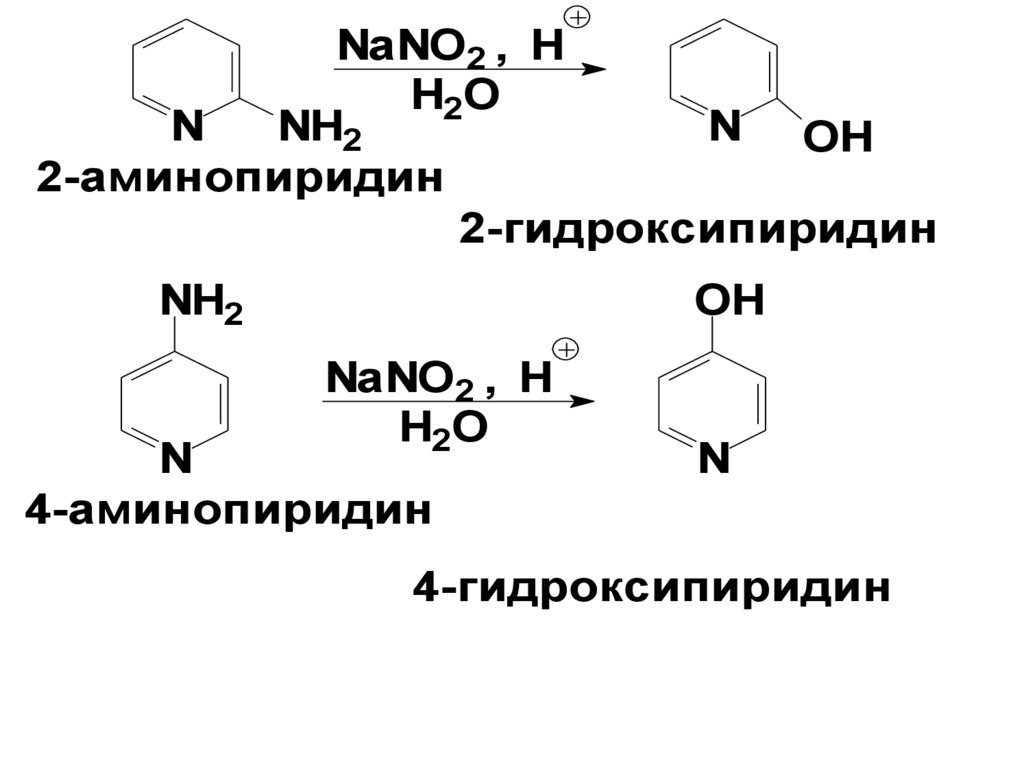
Производные пиридина• 2- и 4-гидроксипиридины легко
получаются при обработке
2- и 4-аминопиридинов нитритом
натрия в присутствии
минеральных кислот
35.
NaNO2 , HH2O
N
NH2
N OH
2-аминопиридин
2-гидроксипиридин
NH2
OH
NaNO2 , H
H2O
N
4-аминопиридин
N
4-гидроксипиридин
36.
• 2- и 4 -гидрокси- и аминопиридинырезко отличаются от
3-производных по cв-вам.
• 3-гидроксипроизводные подобно
фенолам дают с FeCl3 окрашивание,
обладают слабокислыми cв-вами.
• 2- и 4-гидроксипроизводные этих
св-в не обнаруживают.
37.
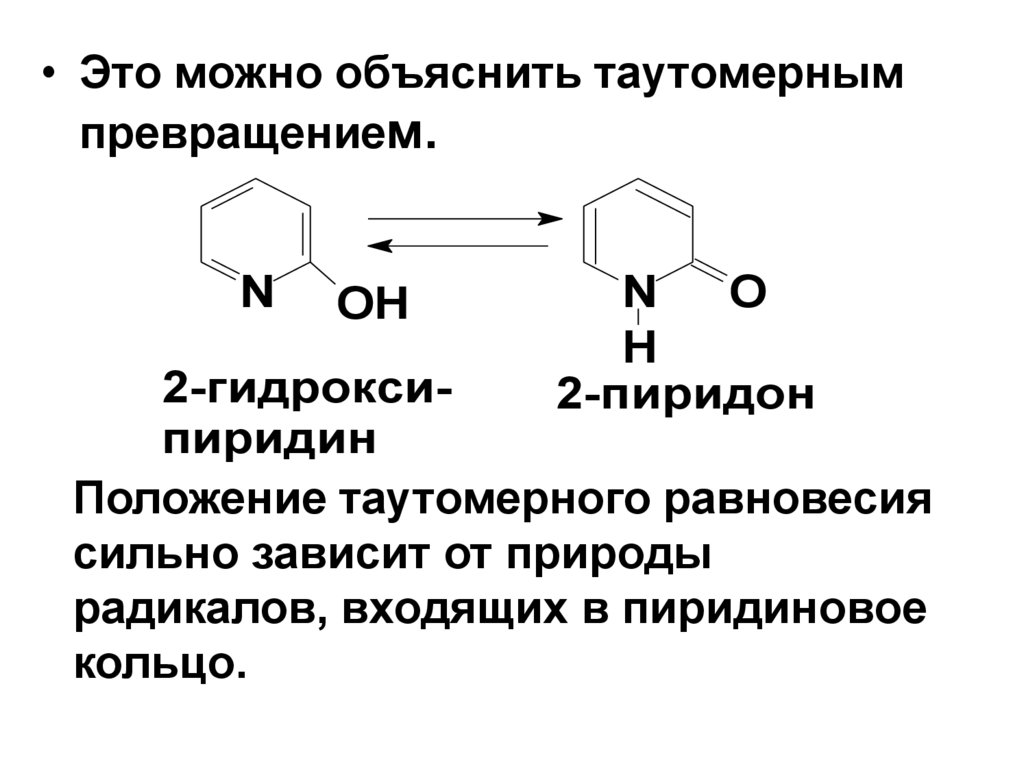
• Это можно объяснить таутомернымпревращением.
N
OH
N
O
H
2-пиридон
2-гидроксипиридин
Положение таутомерного равновесия
сильно зависит от природы
радикалов, входящих в пиридиновое
кольцо.
38.
• Анологично и у аминопроизводных.β-аминопиридины подобно первичным
ароматическим аминам диазотируются –
образующиеся соли диазония вступают
во все превращения, характерные для
арилдиазониев;
• если две NH2-гр. в обоих β-положениях,
соль с кислотами образуется по обеим
гр.
39.
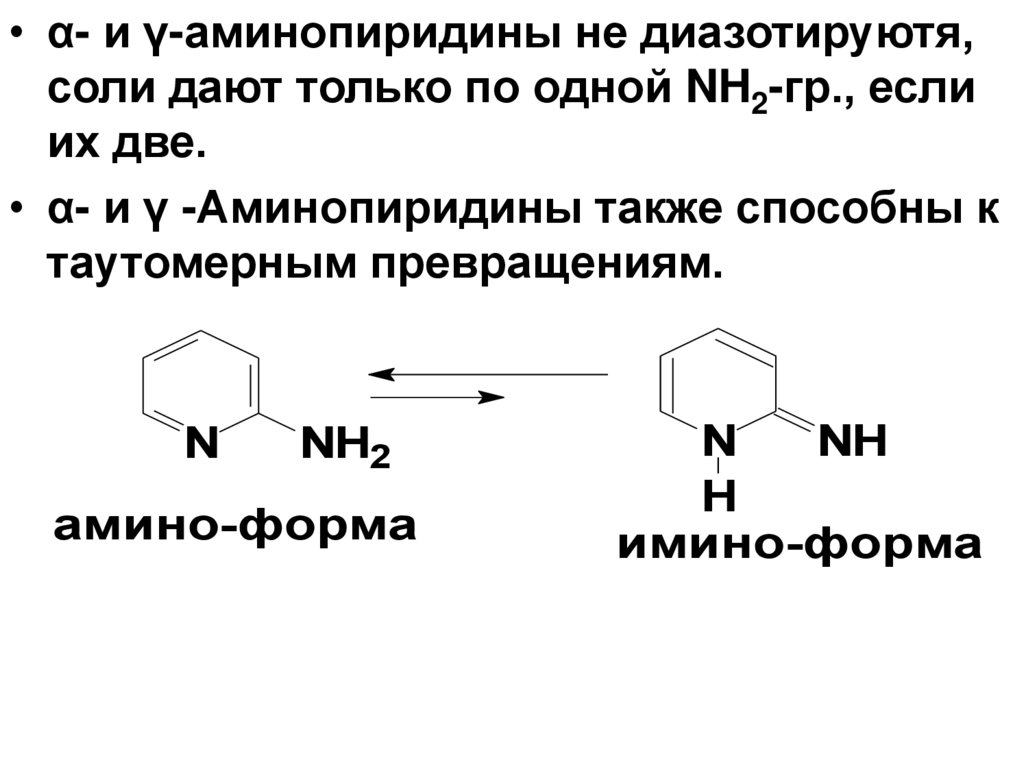
• α- и γ-аминопиридины не диазотируютя,соли дают только по одной NH2-гр., если
их две.
• α- и γ -Аминопиридины также способны к
таутомерным превращениям.
N
NH2
амино-форма
N
NH
H
имино-форма
40.
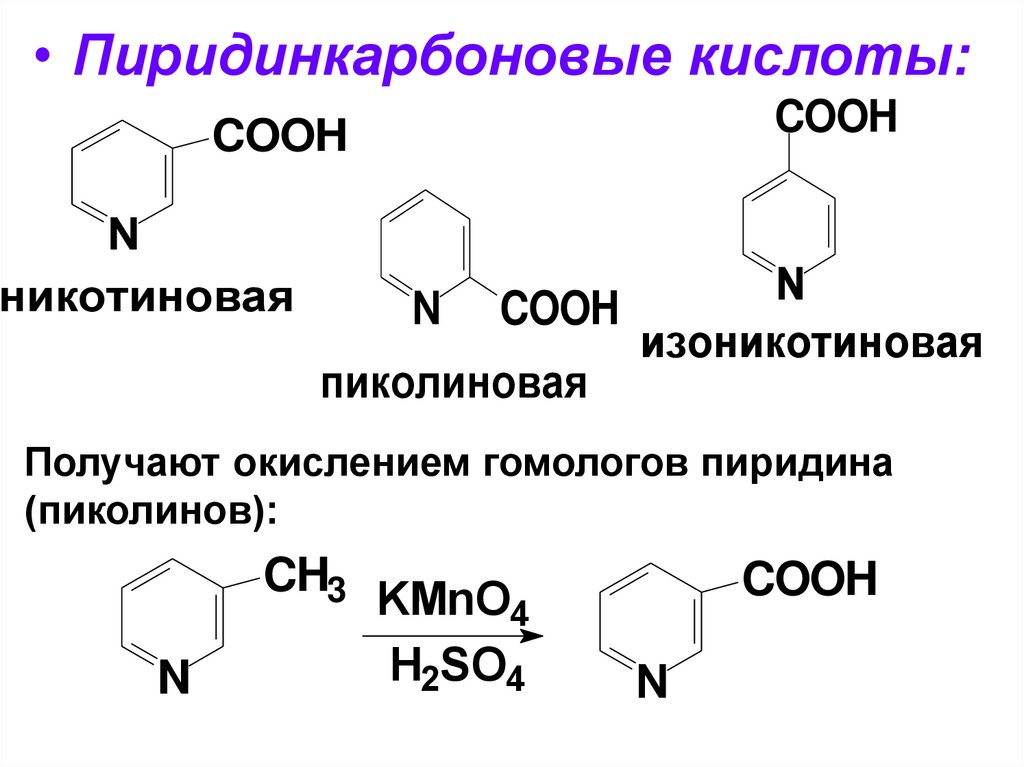
• Пиридинкарбоновые кислоты:COOH
COOH
N
никотиновая
N
N COOH
изоникотиновая
пиколиновая
Получают окислением гомологов пиридина
(пиколинов):
CH3
N
KMnO4
H2SO4
COOH
N
41.
• Никотиновая к-та – широко распространена вприроде – сод-ся в печени, экстракте дрожжей,
в молоке, зародыше пшеницы.
• Получают окислением гомологов пиридина и
никотина.
• Никотиновая к-та и ее амид - (витамины РР)
используются для витаминизации хлеба и др.
пищевых продуктов (потребность в ней
человека 20-30 мг в сутки).
42.
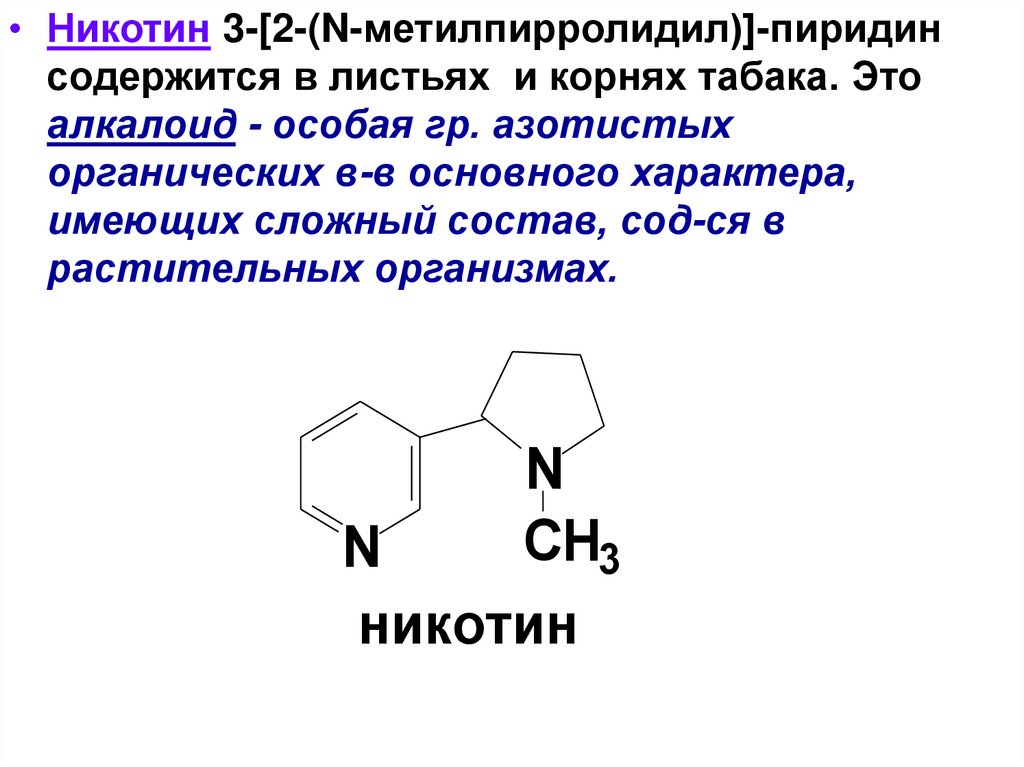
• Никотин 3-[2-(N-метилпирролидил)]-пиридинсодержится в листьях и корнях табака. Это
алкалоид - особая гр. азотистых
органических в-в основного характера,
имеющих сложный состав, сод-ся в
растительных организмах.
N
CH3
N
никотин




















 chemistry
chemistry