Similar presentations:
Введение в химию гетероциклических соединений
1.
ФГБОУ ВО «Ивановский государственныйхимико-технологический университет»
Кафедра Технологии тонкого
органического синтеза
Введение в химию
гетероциклических соединений
2.
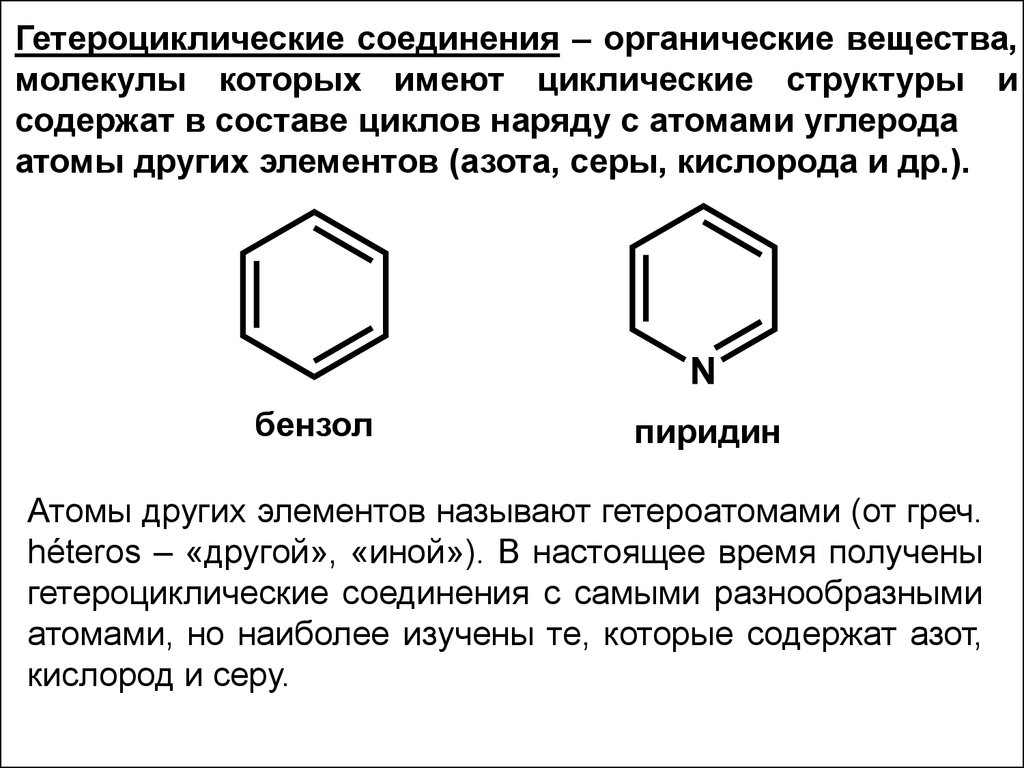
Гетероциклические соединения – органические вещества,молекулы которых имеют циклические структуры и
содержат в составе циклов наряду с атомами углерода
атомы других элементов (азота, серы, кислорода и др.).
бензол
пиридин
Атомы других элементов называют гетероатомами (от греч.
héteros – «другой», «иной»). В настоящее время получены
гетероциклические соединения с самыми разнообразными
атомами, но наиболее изучены те, которые содержат азот,
кислород и серу.
3.
Применение и роль гетероциклических соединенийМногочисленные гетероциклические соединения играют
важную роль в биологии, медицине, сельском хозяйстве и
других областях. Они входят в состав важнейших
природных продуктов: красящих веществ крови и растений
(гемина и хлорофилла), нуклеиновых кислот, многих
витаминов, антибиотиков и алкалоидов. Можно без
преувеличения считать, что почти вся фармацевтическая
химия является химией гетероциклических соединений.
Многие яркие красители (индиго, индантрен) также
содержат гетероциклические кольца. В сельском
хозяйстве используются инсектициды, вещества для
ускорения роста, имеющие гетероциклическую природу.
4.
анальгин5.
В зависимости от числа атомов, образующих гетероциклы,различают
трех-,
четырех-,
пяти-,
шестичленные
гетероциклические соединения, содержащие один, два и
более гетероатомов, одинаковых или разных. Трех- и
четырехчленные гетероциклические соединения обычно
неустойчивы.
Класс
гетероциклических
соединений
составляют преимущественно пяти- и шестичленные
гетероциклические соединения.
6.
Номенклатурагетероциклических соединений
ТРИВИАЛЬНАЯ
НОМЕНКЛАТУРА
ЗАМЕНИТЕЛЬНАЯ
НОМЕНКЛАТУРА
СИСТЕМАТИЧЕСКАЯ
НОМЕНКЛАТУРА
(номенклатура
Ганча — Видмана)
7.
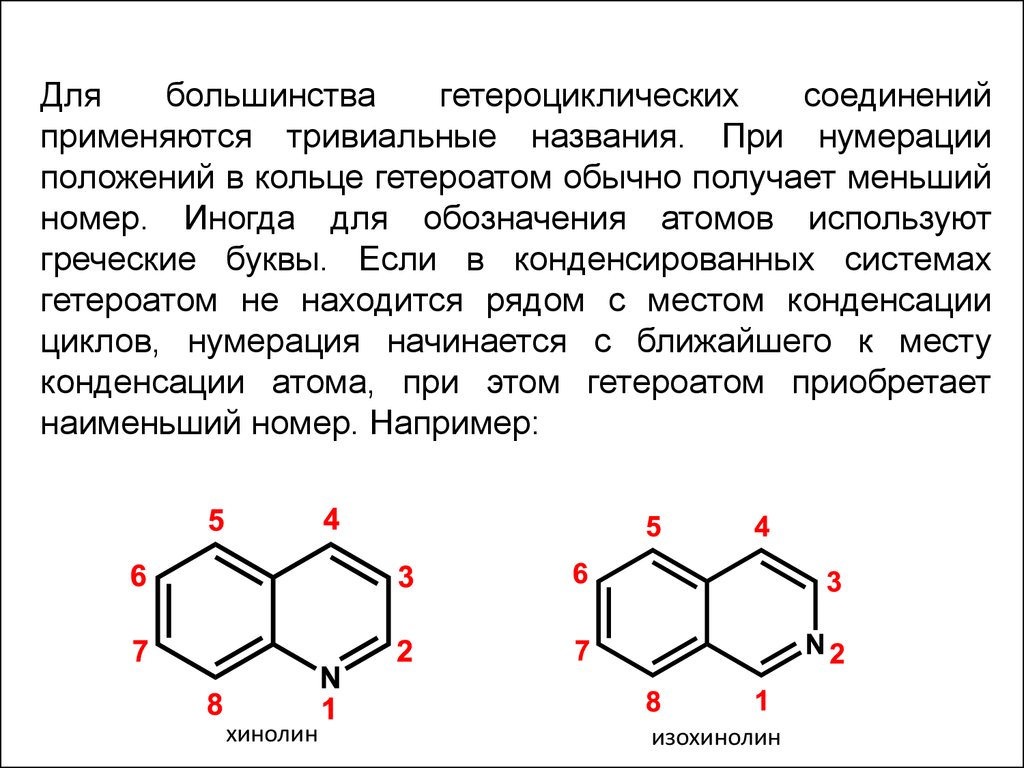
Длябольшинства
гетероциклических
соединений
применяются тривиальные названия. При нумерации
положений в кольце гетероатом обычно получает меньший
номер. Иногда для обозначения атомов используют
греческие буквы. Если в конденсированных системах
гетероатом не находится рядом с местом конденсации
циклов, нумерация начинается с ближайшего к месту
конденсации атома, при этом гетероатом приобретает
наименьший номер. Например:
хинолин
изохинолин
8.
Молекулы простейших гетероциклов содержат трехчленныециклы:
Этиленоксид
(оксиран)
Этиленсульфид
(тииран)
Этиленимин
(азиридин)
Наиболее
широко
распространены
и
изучены
моноциклические пяти- и шестичленные циклы, а также
бициклические (состоящие из гетероциклического кольца и
конденсированного
с
ним
бензольного
или
гетероциклического ядра).
Гетероциклы с одним гетероатомом в кольце:
фуран
тиофен
пиррол
пиридин
9.
Гетероциклы с двумя гетероатомами:имидазол
оксазол
тиазол
пиримидин
пиразол
Бициклические гетероциклы:
пурин
индол
10.
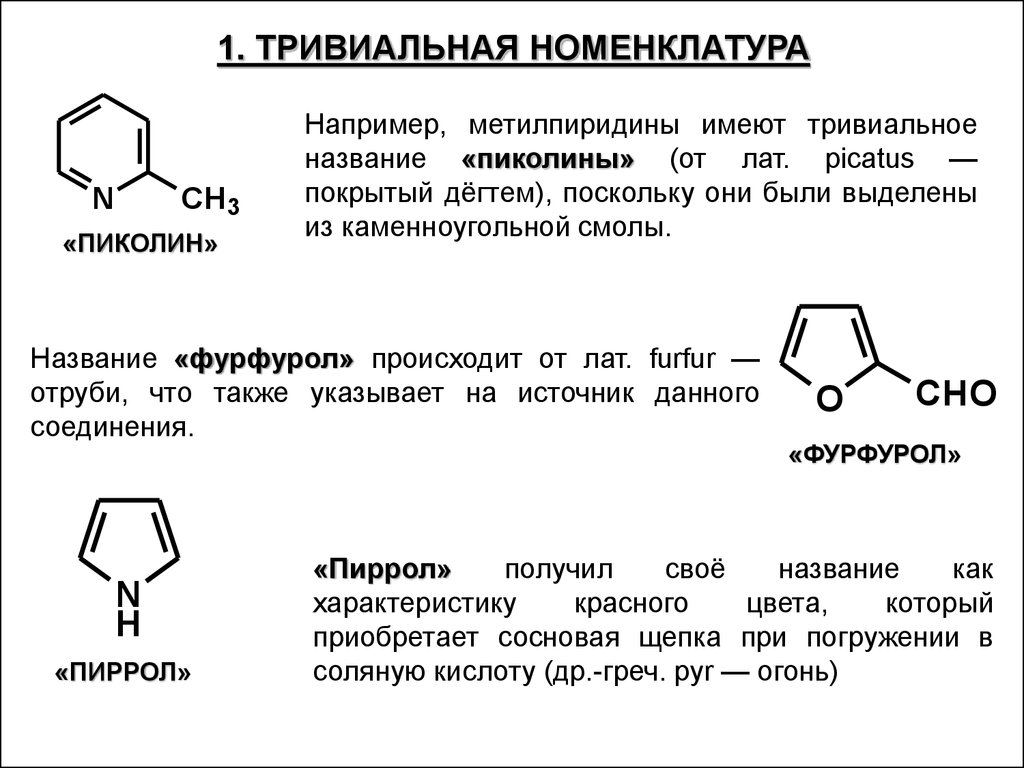
1. ТРИВИАЛЬНАЯ НОМЕНКЛАТУРАN
СH3
«ПИКОЛИН»
Например, метилпиридины имеют тривиальное
название «пиколины» (от лат. picatus —
покрытый дёгтем), поскольку они были выделены
из каменноугольной смолы.
Название «фурфурол» происходит от лат. furfur —
отруби, что также указывает на источник данного
соединения.
N
H
«ПИРРОЛ»
O
CHO
«ФУРФУРОЛ»
«Пиррол»
получил
своё
название
как
характеристику
красного
цвета,
который
приобретает сосновая щепка при погружении в
соляную кислоту (др.-греч. pyr — огонь)
11.
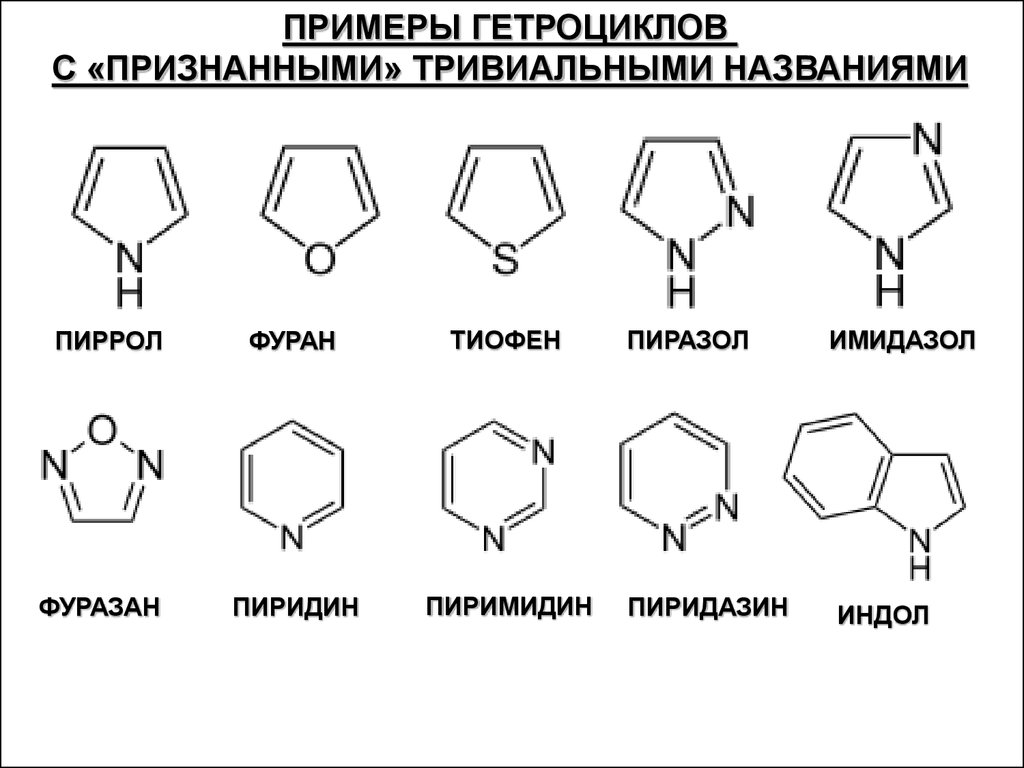
ПРИМЕРЫ ГЕТРОЦИКЛОВС «ПРИЗНАННЫМИ» ТРИВИАЛЬНЫМИ НАЗВАНИЯМИ
ПИРРОЛ
ФУРАЗАН
ФУРАН
ТИОФЕН
ПИРИДИН
ПИРИМИДИН
ПИРАЗОЛ
ПИРИДАЗИН
ИМИДАЗОЛ
ИНДОЛ
12.
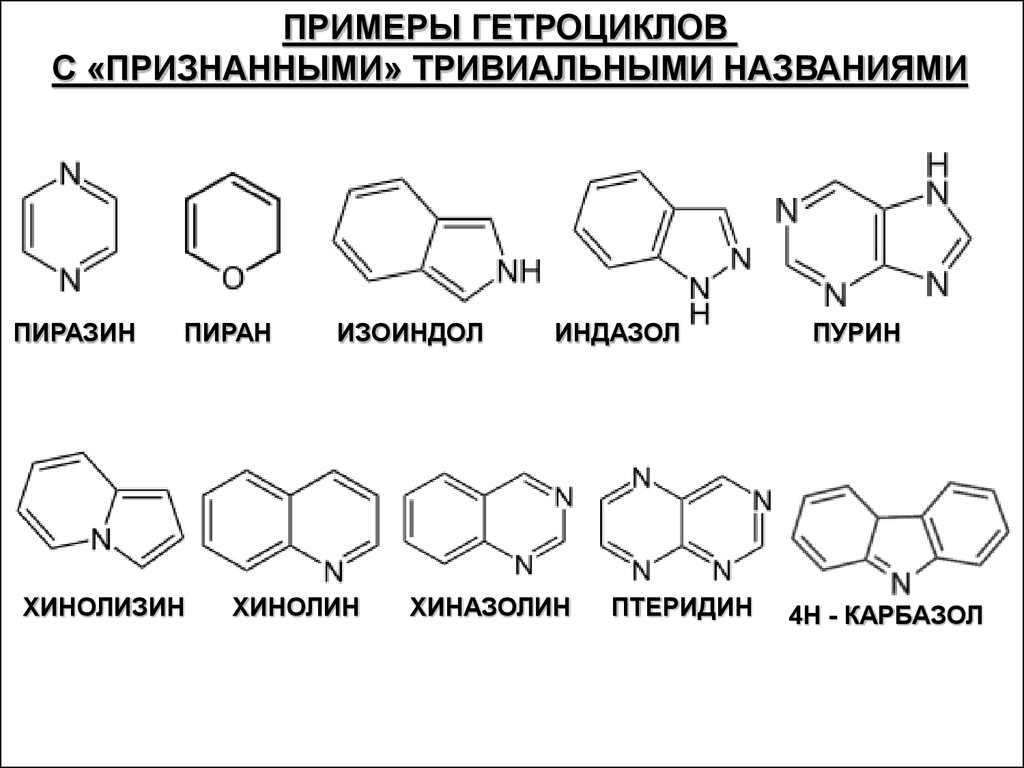
ПРИМЕРЫ ГЕТРОЦИКЛОВС «ПРИЗНАННЫМИ» ТРИВИАЛЬНЫМИ НАЗВАНИЯМИ
ПИРАЗИН
ПИРАН
ХИНОЛИЗИН
ИЗОИНДОЛ
ХИНОЛИН
ИНДАЗОЛ
ХИНАЗОЛИН
ПТЕРИДИН
ПУРИН
4Н - КАРБАЗОЛ
13.
ПРИМЕРЫ ГЕТРОЦИКЛОВС «ПРИЗНАННЫМИ» ТРИВИАЛЬНЫМИ НАЗВАНИЯМИ
ФЕНАНТРИДИН
ФЕНОТИАЗИН
АКРИДИН
ФЕНОКСАЗИН
ПЕРИМИДИН
ФЕНАЗИН
14.
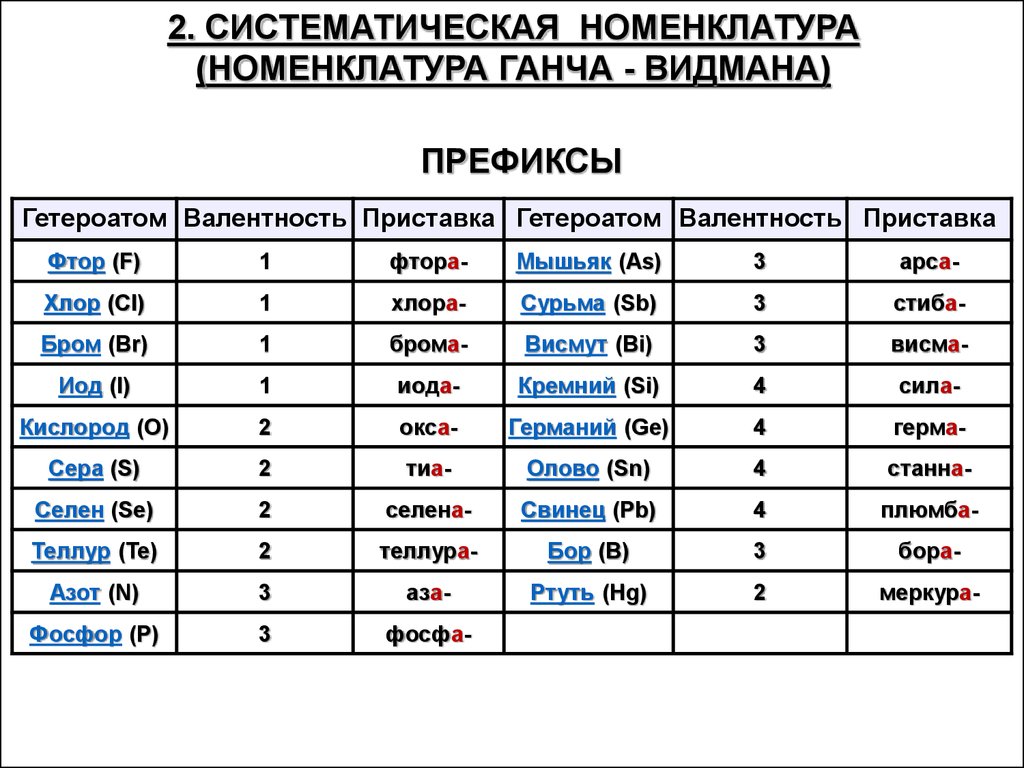
2. СИСТЕМАТИЧЕСКАЯ НОМЕНКЛАТУРА(НОМЕНКЛАТУРА ГАНЧА - ВИДМАНА)
ПРЕФИКСЫ
Гетероатом Валентность Приставка Гетероатом Валентность Приставка
Фтор (F)
1
фтора-
Мышьяк (As)
3
арса-
Хлор (Cl)
1
хлора-
Сурьма (Sb)
3
стиба-
Бром (Br)
1
брома-
Висмут (Bi)
3
висма-
Иод (I)
1
иода-
Кремний (Si)
4
сила-
Кислород (O)
2
окса-
Германий (Ge)
4
герма-
Сера (S)
2
тиа-
Олово (Sn)
4
станна-
Селен (Se)
2
селена-
Свинец (Pb)
4
плюмба-
Теллур (Te)
2
теллура-
Бор (B)
3
бора-
Азот (N)
3
аза-
Ртуть (Hg)
2
меркура-
Фосфор (P)
3
фосфа-
15.
КОРНИ ДЛЯ СИСТЕМАТИЧЕСКОЙ НОМЕНКЛАТУРЫРАЗМЕР
ЦИКЛА
НЕНАСЫЩЕННЫЙ
ЦИКЛ
НАСЫЩЕННЫЙ
ЦИКЛ
3
4
5
6
7
8
9
10
ирен
ет
ол
ин
епин
оцин
онин
ецин
иран
етан
олан
инан
епан
окан
онан
екан
3
2
1
оксиран
оксетан
оксолан
3Н-индол
2
1
2Н-азол
16.
3. ЗАМЕНИТЕЛЬНАЯ НОМЕНКЛАТУРАЗаменительная номенклатура рассматривает гетероциклическое
соединение как соответствующее карбоциклическое, в котором
один или несколько атомов углерода замещены на гетероатомы.
При таком рассмотрении гетероцикл получает название данного
карбоцикла с приставками, называющими гетероатомы, и
локантами (номерами), обозначающими их положение. Например,
пиридин по данной номенклатуре называется азабензолом. В
отличие от номенклатуры Ганча — Видмана, локанты по
заменительной
номенклатуре
указываются
перед
каждой
приставкой по отдельности, а не все вместе в начале названия.
Данный тип номенклатуры также используется для составления
названий
гетероциклов
с
положительно
заряженными
гетероатомами. Отличие состоит в том, что приставки типа окса-,
аза-, тиа- заменяются на оксониа-, азониа-, тиониа- и т. д. В
названии эти приставки следуют непосредственно за приставками,
обозначающими незаряженные гетероатомы (оксониа- после окса-,
тиониа- после тиа- и т. д.)
17.
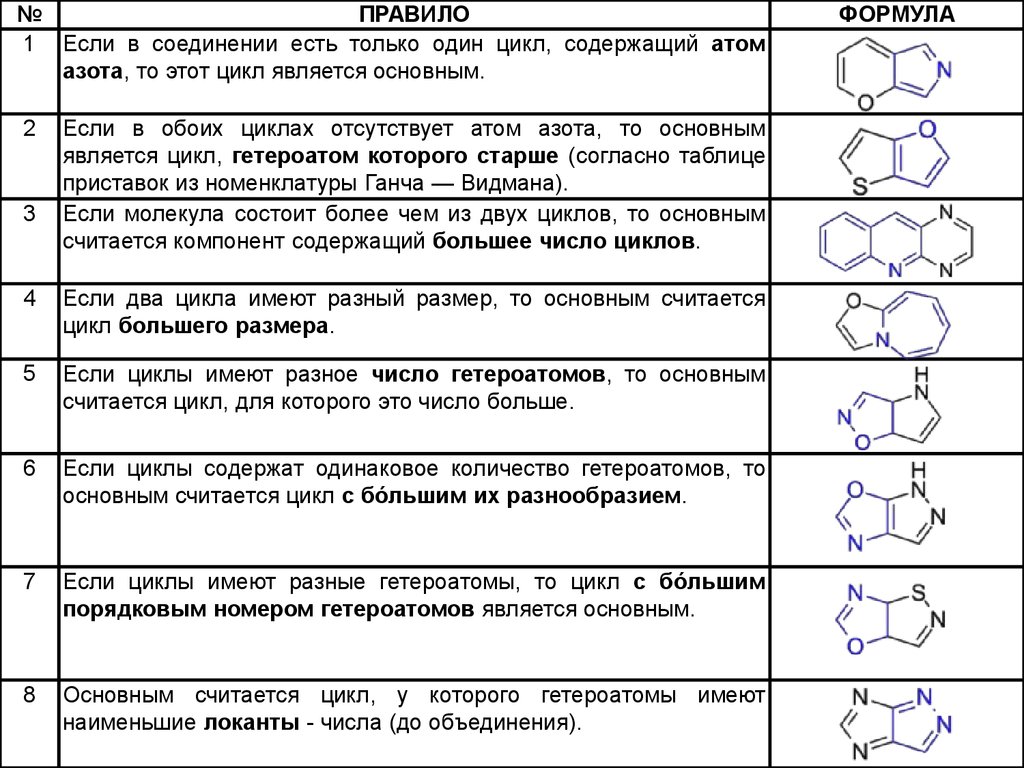
№ПРАВИЛО
1 Если в соединении есть только один цикл, содержащий атом
азота, то этот цикл является основным.
2
3
Если в обоих циклах отсутствует атом азота, то основным
является цикл, гетероатом которого старше (согласно таблице
приставок из номенклатуры Ганча — Видмана).
Если молекула состоит более чем из двух циклов, то основным
считается компонент содержащий большее число циклов.
4
Если два цикла имеют разный размер, то основным считается
цикл большего размера.
5
Если циклы имеют разное число гетероатомов, то основным
считается цикл, для которого это число больше.
6
Если циклы содержат одинаковое количество гетероатомов, то
основным считается цикл с бо́льшим их разнообразием.
7
Если циклы имеют разные гетероатомы, то цикл с бо́льшим
порядковым номером гетероатомов является основным.
8
Основным считается цикл, у которого гетероатомы имеют
наименьшие локанты - числа (до объединения).
ФОРМУЛА
18.
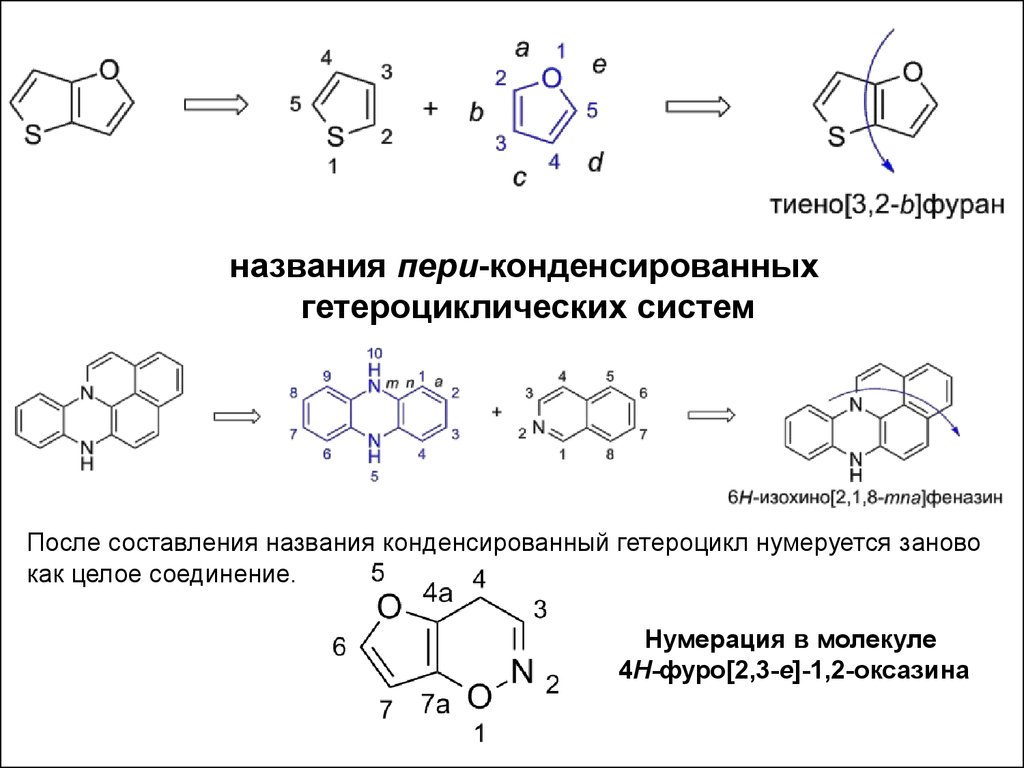
НАЗВАНИЕ КОНДЕНСИРОВАННЫХ СИСТЕМНазвание цикла, который выбран основным, становится корнем
нового названия, а название побочного цикла — приставкой.
Приставка образуется путём добавления гласной -о к названию
побочного гетероцикла, например, пиразин становится пиразино-.
Существуют исключения, для которых приставка образуется с
сокращением названия:
•изохинолин → изохино-;
•имидазол → имидазо-;
•пиридин → пиридо-;
•тиофен → тиено-;
•фуран → фуро-;
•хинолин → хино-
19.
названия пери-конденсированныхгетероциклических систем
После составления названия конденсированный гетероцикл нумеруется заново
как целое соединение.
Нумерация в молекуле
4H-фуро[2,3-e]-1,2-оксазина
20.
Практическое занятие21.
ПИРРОЛ3
1
2
N
H
пиррол
Пиррол
и
простые
алкилпирролы
представ-ляют собой бесцветные
жидкости с относительно
слабым запахом, напоми-нающим запах аммиака.
Они легко окисляются на
воздухе и при хранении
темнеют
в
результате
самопроизвольного
окисления.
21
22.
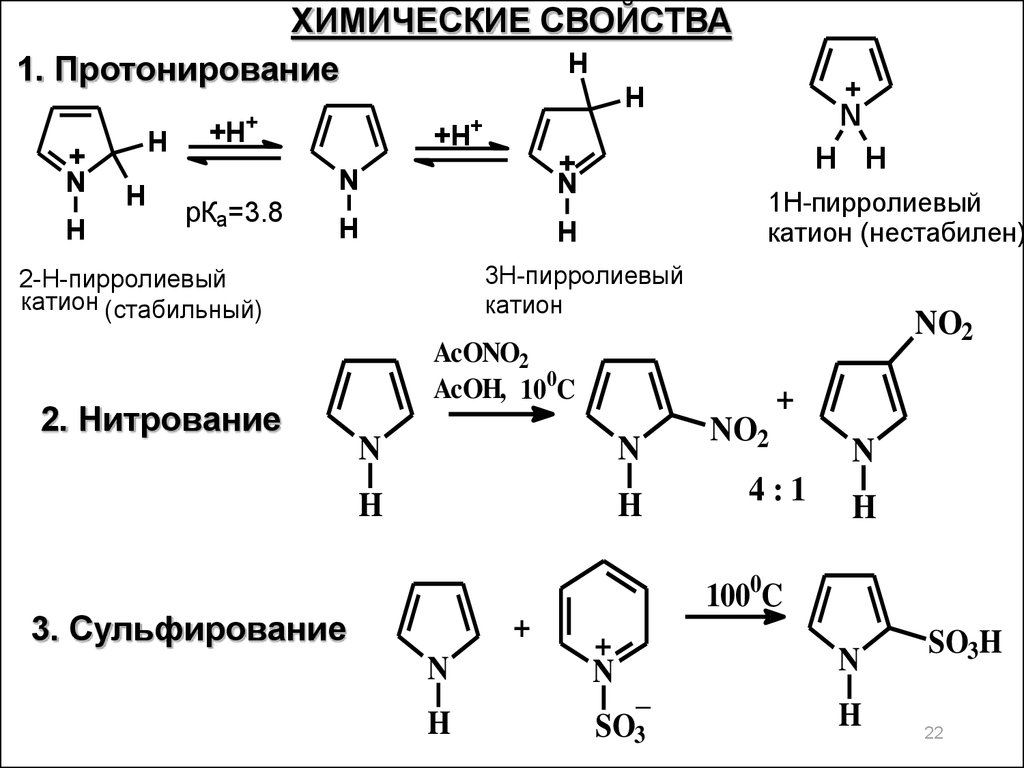
ХИМИЧЕСКИЕ СВОЙСТВАH
1. Протонирование
+
N
H
H
H
+H+
рКа=3.8
+
N
H
+H+
N
+
N
H
H
1Н-пирролиевый
катион (нестабилен)
3Н-пирролиевый
катион
2-Н-пирролиевый
катион (стабильный)
2. Нитрование
H H
NO2
AcONO2
AcOH, 100C
+
N
N
H
H
NO2
4:1
N
H
1000C
3. Сульфирование
+
N
H
+
N
_
SO3
N
H
SO3H
22
23.
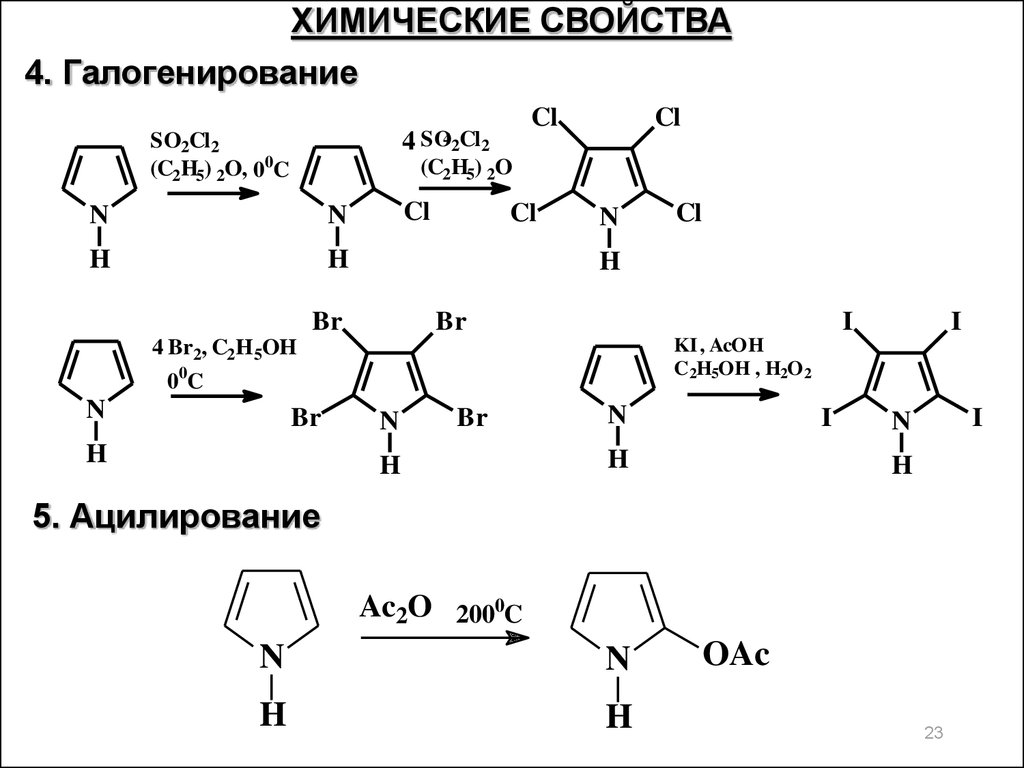
ХИМИЧЕСКИЕ СВОЙСТВА4. Галогенирование
4 SO42Cl2
(C2H5) 2O
SO2Cl2
(C2H5) 2O, 00C
N
N
H
H
Cl
Cl
Cl
Cl
N
H
Br
Br
I
00C
Br
H
I
KI , AcOH
C2H5OH , H2O 2
4 Br2, C2H 5OH
N
Cl
N
Br
H
N
I
H
I
N
H
5. Ацилирование
Ac2O 2000C
N
N
H
H
OAc
23
24.
ХИМИЧЕСКИЕ СВОЙСТВАH3C
CH3
5. Ацилирование
N
H3C
AcOH
кипячение
CH3
AcO
H
2,3,4-триметилпиррол
CH3
CH3
N
H
O2N
Cl3CCOCl
(C2H5) 2O, 200C
N
N
C
H
H
O
CCl3
HNO3, -500C
N
C
H
O
CCl3
NaOCH3
CH3OH , 200C
O2N
NaOCH3
CH3OH , 200C
N
C
H
O
OCH3
24
25.
ХИМИЧЕСКИЕ СВОЙСТВА6. Конденсация с иминиевыми ионами(аминометилирование)
+ CH2=N +(C2H5)2
_
AcO
N
+ AcOH
CH2NC2H5
N
H
H
α-(N,N-диэтиламинометил)-пиррол
7. Полимиризация
H
6 н HCl
00C, 30 c
N
H
H
+
H H
H
H
+H
H
H
H
N
+
N
H
H
H
N
H
H
H
_ H+
+
H
N
H
H
H
N
H
+
N
N
H
+
полимер
N
H
H
N
H
H
N
H
тример пиррола
2:1 транс:цис
25
26.
ХИМИЧЕСКИЕ СВОЙСТВА8. Сочетание с солями диазония
N
+ 0
C6H5N2, 0 C
водн. NaOAc , C2H5OH
N
H
N N C6H5
H
+ KOH
высокая
+
температура N+
N
K
H
Реакция с реактивом Гриньяра
NaNH 2
NH3 (ж)
N
H
_
NH3
H2O
CH3MgI
(C2H5) 2O
+ CH4
_
N
N
N
+
Na
H
MgI
26
27.
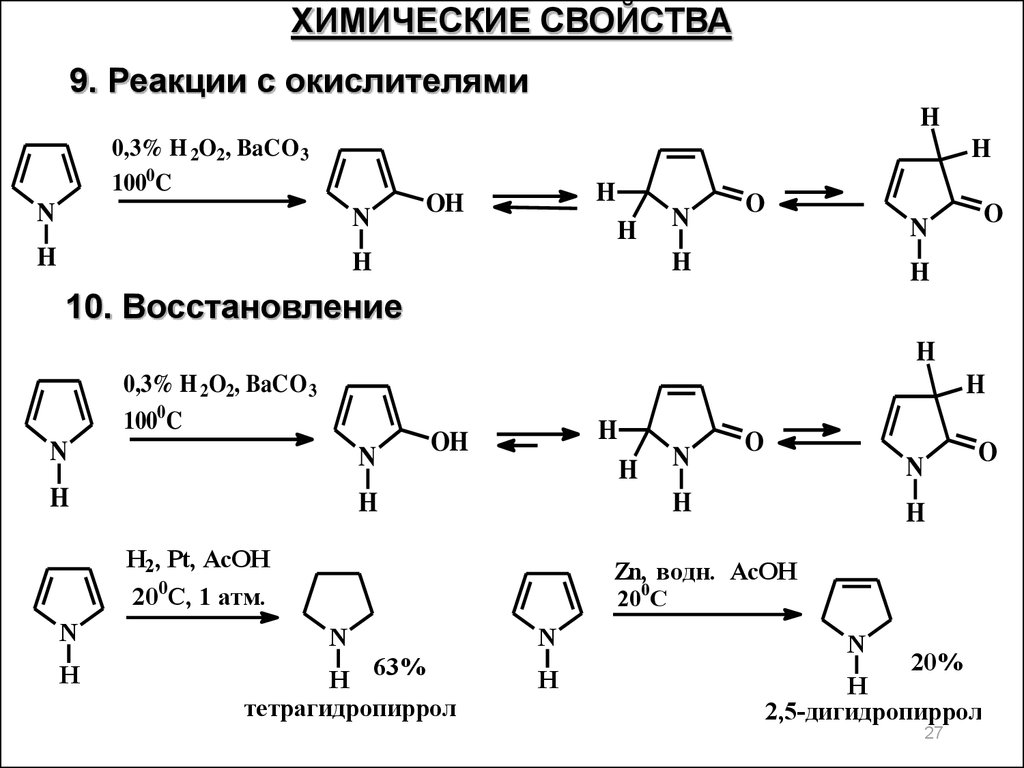
ХИМИЧЕСКИЕ СВОЙСТВА9. Реакции с окислителями
H
H
0,3% H 2O2, BaCO 3
1000C
N
N
H
H
H
OH
H
N
O
O
N
H
H
10. Восстановление
H
H
0,3% H 2O2, BaCO 3
1000C
N
N
H
H
H
OH
H
H
O
O
N
H
H2, Pt, AcOH
200C, 1 атм.
N
N
H
Zn, водн. AcOH
200C
N
63%
H
тетрагидропиррол
N
H
N
20%
H
2,5-дигидропиррол
27
28.
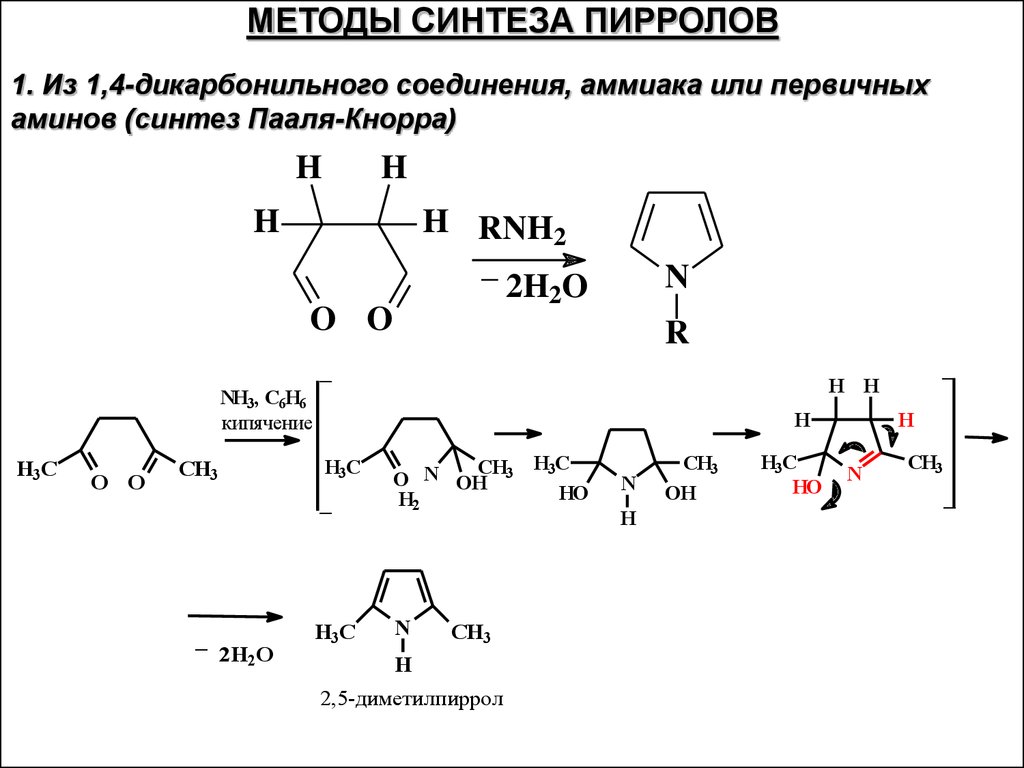
МЕТОДЫ СИНТЕЗА ПИРРОЛОВ1. Из 1,4-дикарбонильного соединения, аммиака или первичных
аминов (синтез Пааля-Кнорра)
H
H
H
H RNH2
_
2H2O
O O
N
R
_
NH3, C6H6
кипячение
H3C
O O
_
H
H3C
CH3
2H2O
_
H H
_
CH
O N OH 3
H2
H3C
N
CH3
H
2,5-диметилпиррол
H3C
HO
N
H
CH3
OH
H3C
HO
H
N
CH3
_
29.
МЕТОДЫ СИНТЕЗА ПИРРОЛОВ2. Из α-аминокарбонильных соединений и активированных кетонов (синтез
CO2R
Кнорра)
H
H
O
H
H
O
H
H
H
NH2
N
H
CO2C2H5
водн. КОН, 200С
CO2CH3
O
2H2O
эфир
кето-кислоты
_
+
NH2
O
H
H3C
CO2C2H5
H
H
_
α-аминокарбонильное
соединение
H3C
CO2R
2H2O
N
H
COOH H3C
H3C
водн. КОН
кипячение
перегонка
N
N
H
H
4-метилпиррол3-метилпиррол
3-карбоновая кислота
COOH
водн. КОН
кипячение
30.
МЕТОДЫ СИНТЕЗА ПИРРОЛОВ3. Из α-галогенокарбонильных соединений (синтез Ганча)
H
Cl
H
H
H
COOR
COOR
+
H
O
галоген-кетон
H
Cl
H
H
H
O
H
эфир
β-кетокислоты
_
COOC2H5 NH3 600C
NH3
_
2H2O
_ HCl
Cl
O
O
CH3
H
H3C
_
H
H
COOC2H5
_
O H2N
_
H
H
+
H3C
N
COOC2H5
H
HCl
CH3
H3C
O N
H2
CH3
_
COOC2H5
_ 2H O
2
H3C
N
CH3
H
H
H
4. Из 1,3-дикарбонильных
соединений и эфиров глицина
H
H
O
O +
H2N
_ 2H O
2
COOR
N
H
COOR
31.
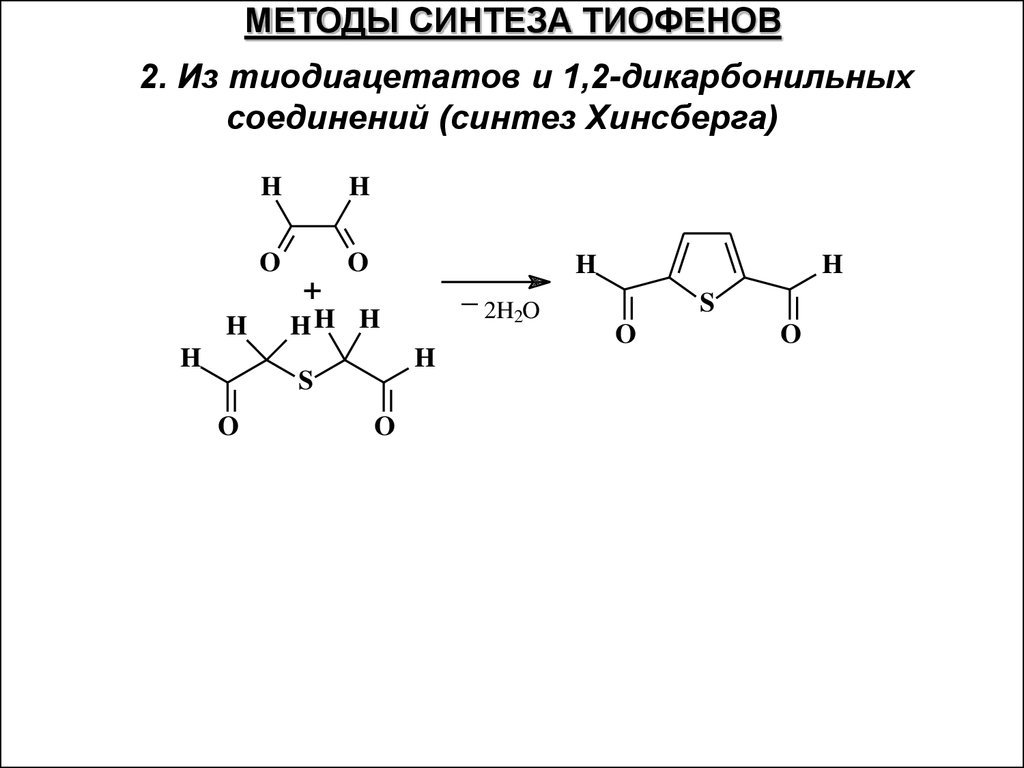
МЕТОДЫ СИНТЕЗА ТИОФЕНОВ2. Из тиодиацетатов и 1,2-дикарбонильных
соединений (синтез Хинсберга)
H
H
H
H
O
O
+
_
HH H
H
S
O
O
H
2H2O
H
S
O
O
32.
ТИОФЕН3
1
S
2
Тиофен и его простейшие алкилпроизводные
представляют собой устойчивые жидкости, по
температурам кипения и по запаху напоминающие
производные бензола. Они сопровождают бензол
и его производные в продуктах перегонки
каменноугольной смолы.
O
HN
H
биотин
S
(витамин Н)
CH3
NH
N
H
H
S
банминт
(CH2)4COOH
Тиоиндиго – кубовый краситель
красного цвета
N
O
S
S
O
33.
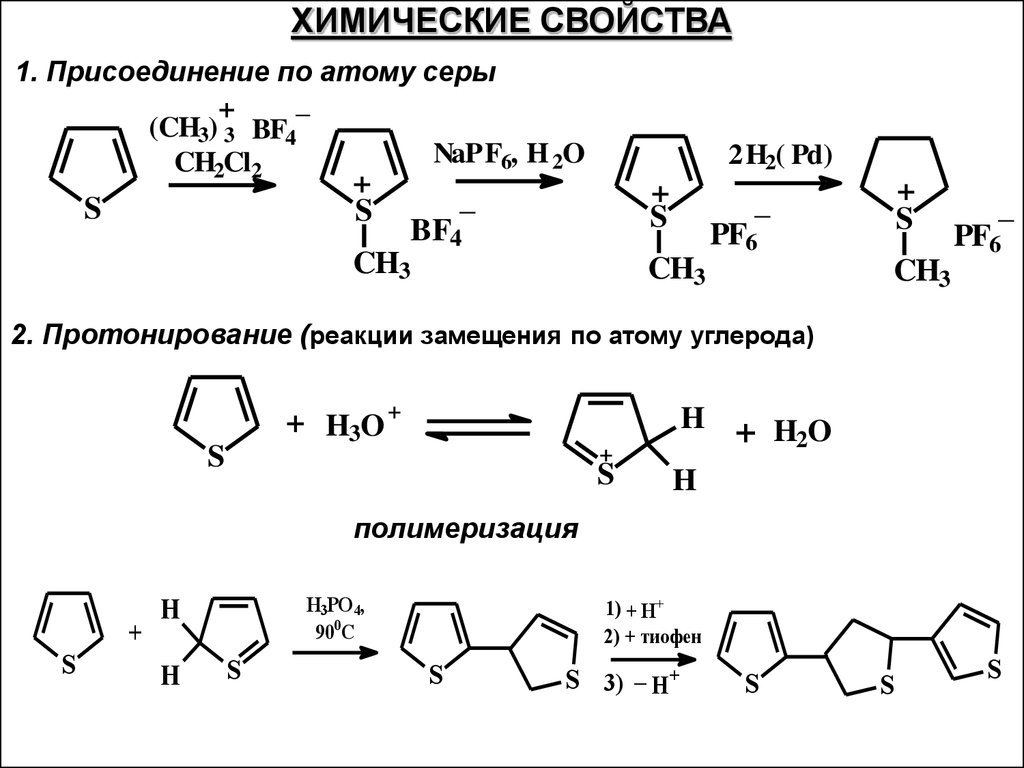
ХИМИЧЕСКИЕ СВОЙСТВА1. Присоединение по атому серы
_
+
(CH3) 3 BF4
NaPF6, H 2O
CH2Cl2
+
S
S
2H2( Pd)
+
S
_
BF4
CH3
+
S
_
PF6
CH3
_
PF6
CH3
2. Протонирование (реакции замещения по атому углерода)
+ H3O +
S
H + HO
2
+
S
H
полимеризация
+
S
H3PO 4,
900C
H
H
S
1) + H+
2) + тиофен
S
S 3) _ H+
S
S
S
34.
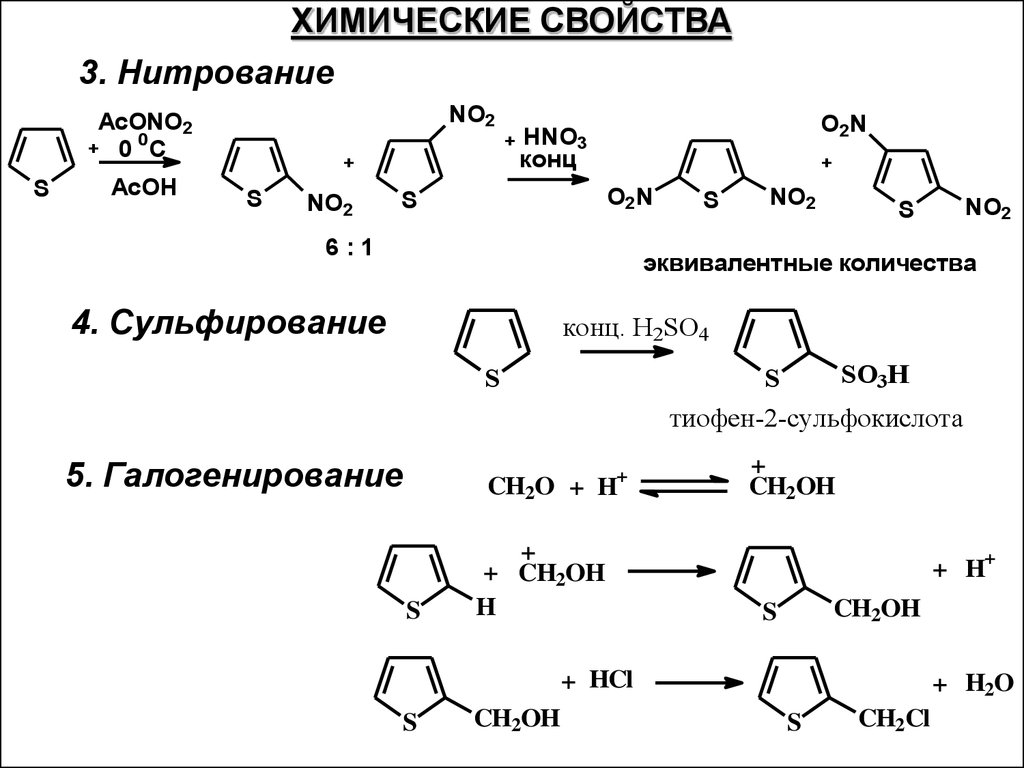
ХИМИЧЕСКИЕ СВОЙСТВА3. Нитрование
NO2
АсONO2
0
+ 0 C
S
AcOH
+
+
S
NO2
O2N
HNO3
конц
+
O2N
S
6:1
S
NO2
NO2
S
эквивалентные количества
4. Сульфирование
конц. H2SO4
S
SO3H
S
тиофен-2-сульфокислота
5. Галогенирование
CH2O + H+
S
+
+ CH2OH
H
+
CH2OH
+
+ H
CH2OH
S
+ HCl
S
CH2OH
+ H2O
S
CH2Cl
35.
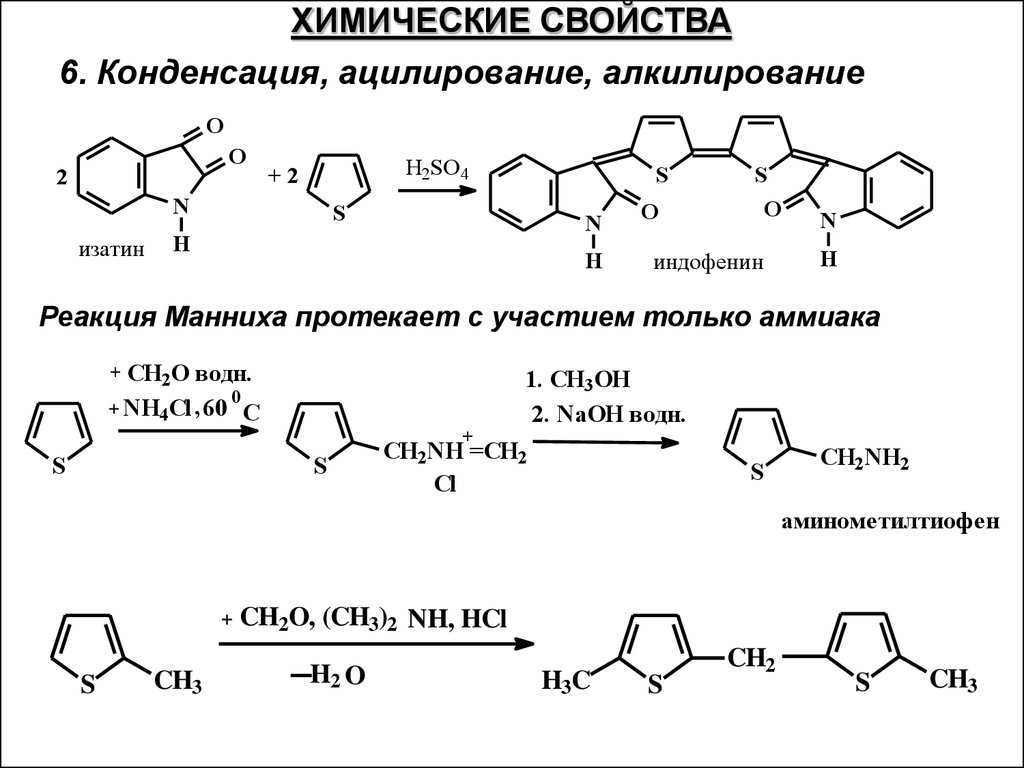
ХИМИЧЕСКИЕ СВОЙСТВА6. Конденсация, ацилирование, алкилирование
O
O
2
H2SO4
+2
N
изатин
S
S
N
H
H
O
S
O
индофенин
N
H
Реакция Манниха протекает с участием только аммиака
CH2O водн.
0
+ NH4Cl , 60 C
+
+
S
S
1. CH3OH
2. NaOH водн.
CH2NH =CH2
Cl
S
CH2NH2
аминометилтиофен
+
S
CH3
CH2O, (CH3)2 NH, HCl
H2 O
H3C
S
CH2
S
CH3
36.
ХИМИЧЕСКИЕ СВОЙСТВА7. Восстановление
Na, NH3 (ж)
S
+
S
2-тиолен
S
3-тиолен
Pt/C (MoS2)
S
S
тетрагидротиофен
(тиофан)
37.
МЕТОДЫ СИНТЕЗА ТИОФЕНОВ1. Из 1,4-дикарбонильных соединений и источника серы
H3C
H3C
H3C
P2S5, 170 0 C
O O
CH3
H3C
H3C
0
CH3
S
H3C
P2S3, 180 C
H3C
O O
ONa
H3C
S
38.
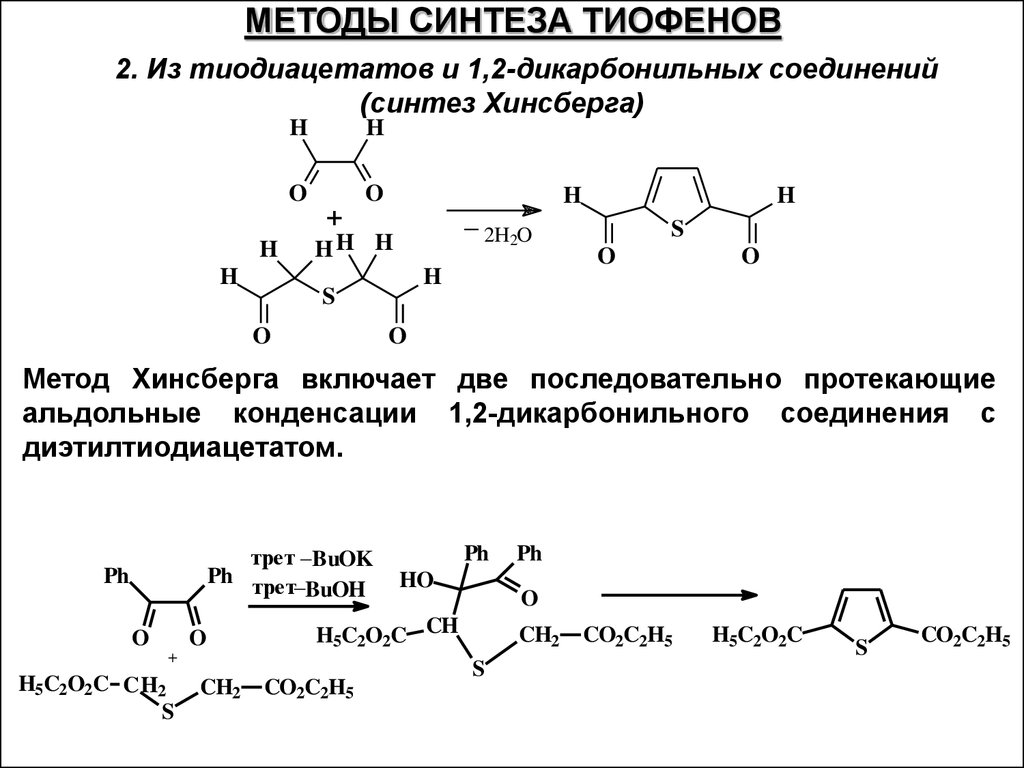
МЕТОДЫ СИНТЕЗА ТИОФЕНОВ2. Из тиодиацетатов и 1,2-дикарбонильных соединений
(синтез Хинсберга)
H
H
H
H
O
O
+
_
HH H
2H2O
H
S
O
H
H
S
O
O
O
Метод Хинсберга включает две последовательно протекающие
альдольные конденсации 1,2-дикарбонильного соединения с
диэтилтиодиацетатом.
трет _BuOK
Ph трет_
BuOH
Ph
O
O
CH2
HO
CO2C2H5
Ph
O
H5C2O2C CH
+
H5C2O2C C H2
S
Ph
CH2
S
CO2C2H5
H5C2O2C
S
CO2C2H5
39.
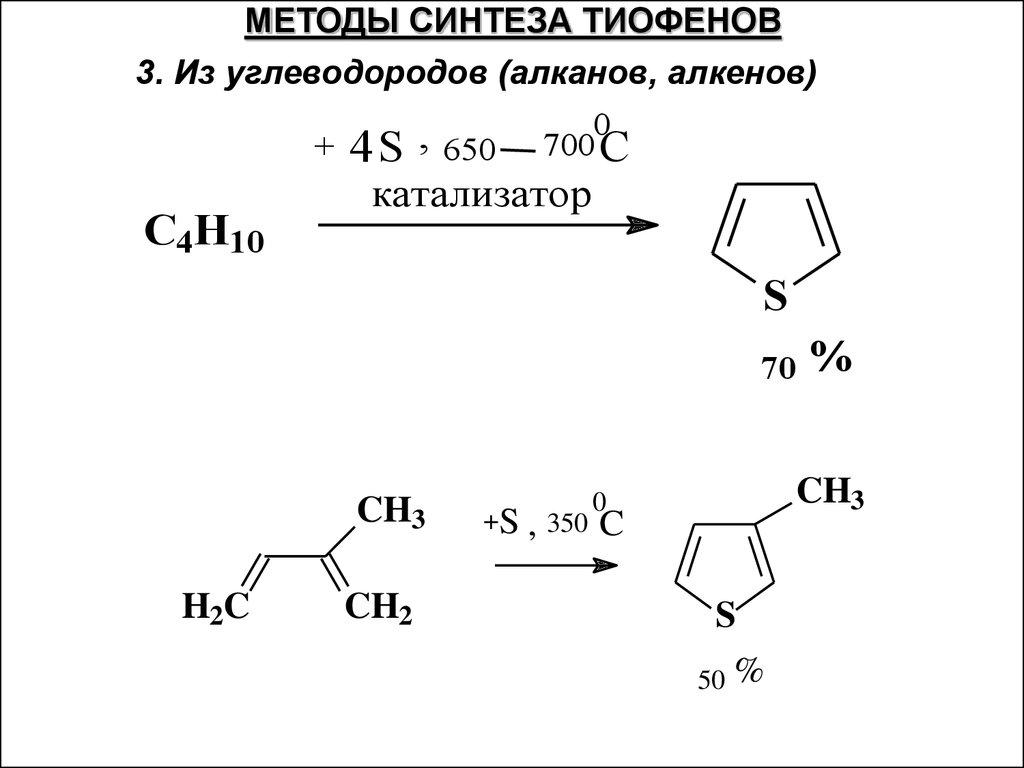
МЕТОДЫ СИНТЕЗА ТИОФЕНОВ3. Из углеводородов (алканов, алкенов)
+
C4H10
4S ,
650
0
700 C
катализатор
S
70
CH3
H2C
CH2
+S , 350
%
CH3
0
C
S
50
%
40.
ФУРАНЫ3 (
4
5
1
2 (
Фуран(оксол-2,4-диен) — органическое соединение с
формулой C4H4O. Пятичленный гетероцикл с одним
атомом кислорода. Представляет собой бесцветную
жидкость с характерным запахом. Родоначальник
большой группы органических соединений, многие из
которых имеют практическое значение, например
фурфурол, тетрагидрофуран, α-метилфуран (сильван).
HO
O
фуран
O
H2
H
C
C
C
H2
C
CH3
H
HOH2C
CH3
+
Ткип.=1620С
O
O
OH
H
аскорбиновая кислота
(витамин С)
периллен
CHO
O
фурфурол
OH
гетерогенный
катализ
кат. МnО2 440-4600С
O
O
CH2SH
фурфурилтиол
Обычно
соединения,
содержа-щие тиольные группы, обладают
неприятным
запахом,
однако
аромат жареного кофе обусловлен
присутствием в нем фурфурил-тиола, а запах свежеиспеченного
хлеба обусловлен фурфуролом.
41.
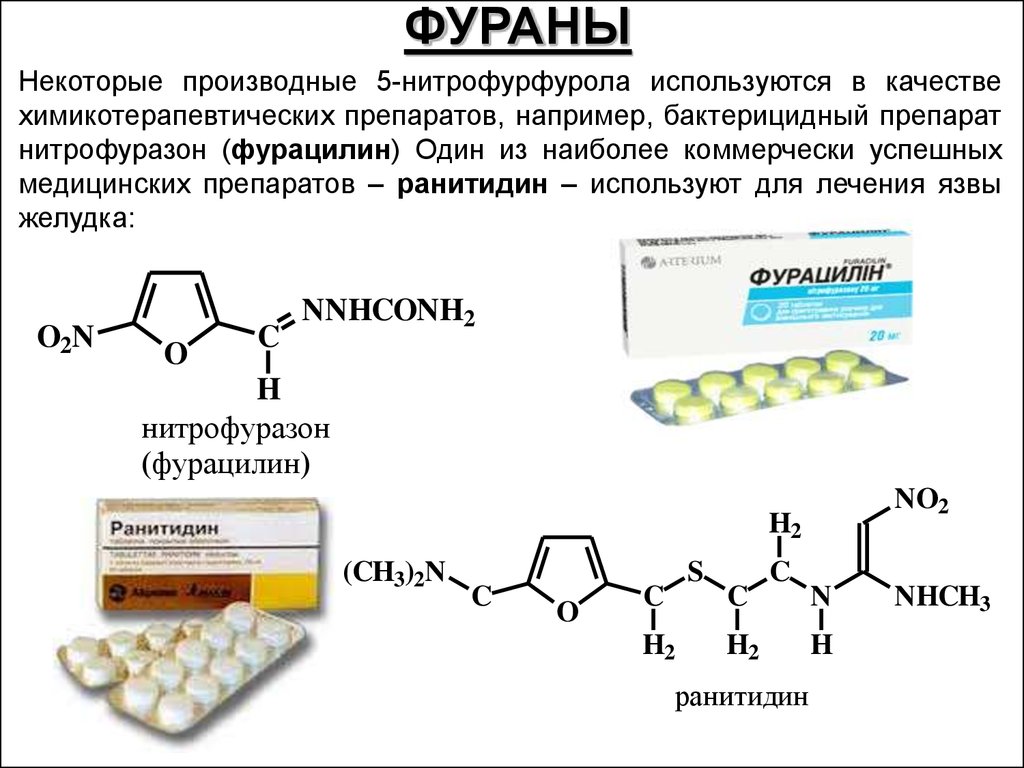
ФУРАНЫНекоторые производные 5-нитрофурфурола используются в качестве
химикотерапевтических препаратов, например, бактерицидный препарат
нитрофуразон (фурацилин) Один из наиболее коммерчески успешных
медицинских препаратов – ранитидин – используют для лечения язвы
желудка:
O2N
O
C
NNHCONH2
H
нитрофуразон
(фурацилин)
NO2
H2
(CH3)2N
C
O
S
C
H2
C
C
H2
ранитидин
N
H
NHCH3
42.
ХИМИЧЕСКИЕ СВОЙСТВАФуран является ароматическим соединением с шестью p-электронами
Реакции с электрофильными реагентами
1. Протонирование
H
+ HBr водн.
AcOH ,
H3C
O
CH3
100 0
C
H
H
H
+ OH
OH
+
H3C
O
CH3
H3C
O
H3C
CH3
O O
CH3
2. Нитрование
+
AcONO2
50 C
H
+AcO
H
+
O
O
NO2
σ - комплекс
H
AcO
O
NO2
N
H
AcOH
O
NO2
43.
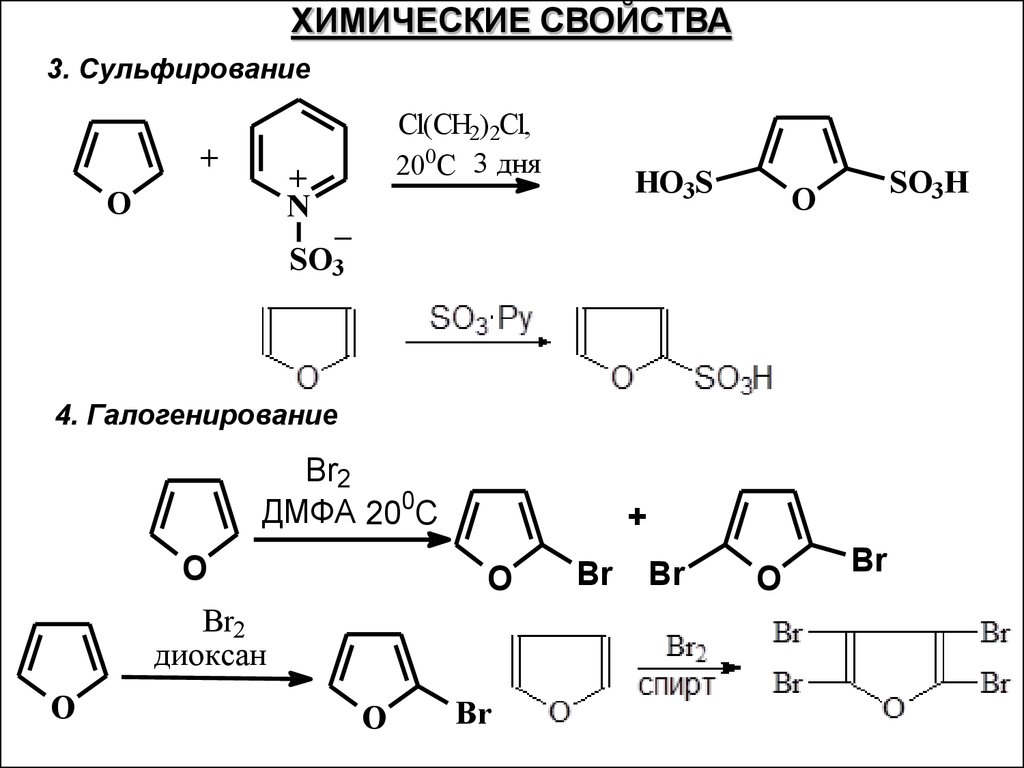
ХИМИЧЕСКИЕ СВОЙСТВА3. Сульфирование
+
+
N
O
Cl(CH2)2Cl,
200C 3 дня
HO3S
SO3H
O
_
SO3
4. Галогенирование
Br2
ДМФА 200C
O
+
O
Br2
диоксан
O
O
Br
Br
Br
O
Br
44.
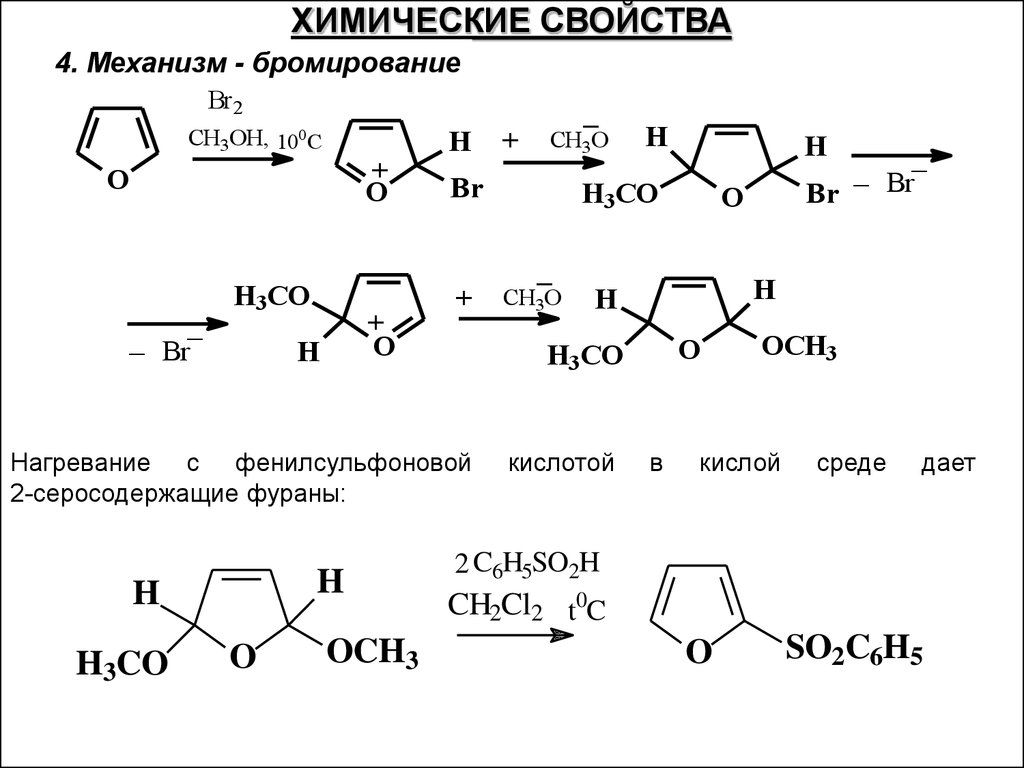
ХИМИЧЕСКИЕ СВОЙСТВА4. Механизм - бромирование
Br2
СH3OH, 10 C
0
+
O
O
_
_ Br
H3CO
+
O
H
H
H
H3CO
O
OCH3
CH3O
Br
+
H
H
H3CO
_
CH3O
кислотой
_
_ Br
Br
O
H
H
O
H3CO
Нагревание с фенилсульфоновой
2-серосодержащие фураны:
H
+
_
в
OCH3
кислой
среде
дает
2 C6H5SO2H
CH2Cl2 t0C
O
SO2C6H5
45.
5. АцилированиеХИМИЧЕСКИЕ СВОЙСТВА
CH3
CH3
(CH3CO)2O 0
0C
BF3, (CH3)2O
O
O
C
CH3
O
6. Алкилирование
Алкилирование фурана и его производных по Фриделю-Крафтсу обычно не
проводят, так как в присутствии катализатора они полимеризуются и, кроме того,
подвергаются полиалкилированию.
Примеры препаративного использования реакции включают: получение
2,5-ди-трет-бутилфурана
из
фурана
или
фуранкарбоновой
кислоты
и изопропилирование метилфуроата с двойным замещением по положениям
3 и 4.
46.
ХИМИЧЕСКИЕ СВОЙСТВАРеакции с нуклеофильными реагентами
1. Нитрозаместители активируют замещение атома галогена:
Cl
CH2SO2C6H5
ClCH2SO2C6H5
KOH, NH3 (ж)
NO2
O
O
NO2
Фуран играет роль диена и образует аддукты Дильса-Альдера:
H
+
O
O
O
H
H
O
H
O
O
O
O
90
%
47.
ХИМИЧЕСКИЕ СВОЙСТВАСХЕМА ВЗАИМОПРЕВРАЩЕНИЯ ГЕТЕРОЦИКЛОВ –
- РЕАКЦИЯ ЮРЬЕВА
NH3
H2S
S
H2O
NH3
N
кат. Al2O3
H
4500C
H2O
H2S
O
48.
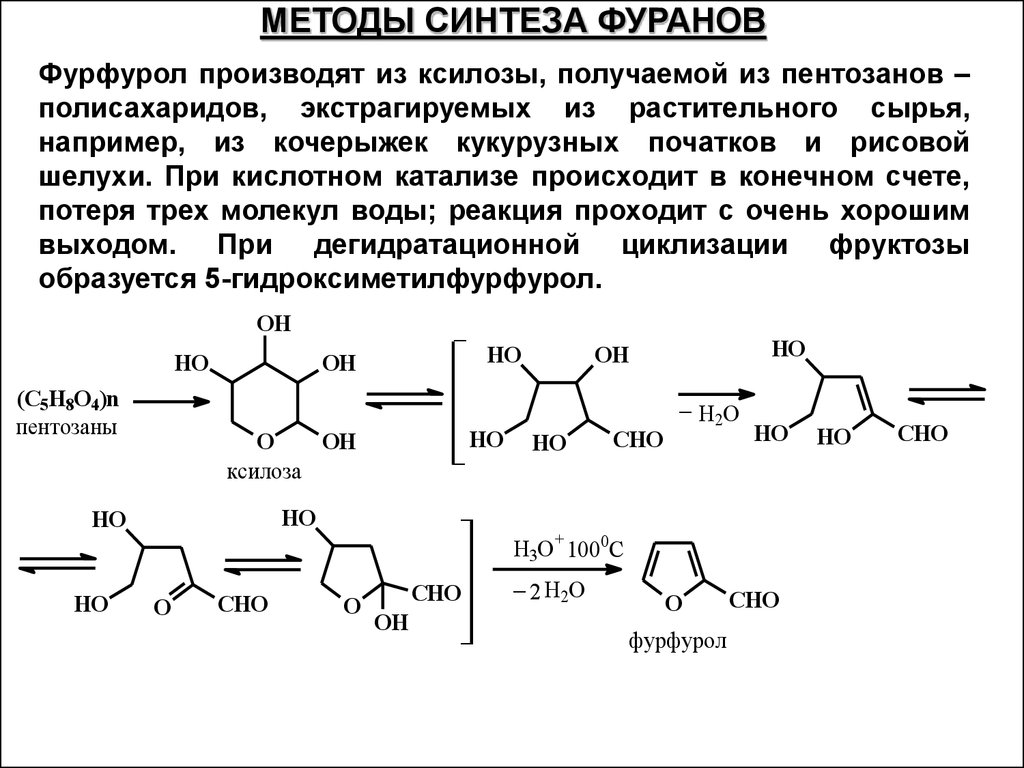
МЕТОДЫ СИНТЕЗА ФУРАНОВФурфурол производят из ксилозы, получаемой из пентозанов –
полисахаридов, экстрагируемых из растительного сырья,
например, из кочерыжек кукурузных початков и рисовой
шелухи. При кислотном катализе происходит в конечном счете,
потеря трех молекул воды; реакция проходит с очень хорошим
выходом. При дегидратационной циклизации фруктозы
образуется 5-гидроксиметилфурфурол.
OH
HO
(C5H8O4)n
пентозаны
HO
OH
HO
OH
_
O
OH
ксилоза
_
O
CHO
HO
HO
CHO
H2O
HO
_
HO
HO
HO
_
O
CHO
OH
_
H3O+ 1000C
_ 2H O
2
O
фурфурол
CHO
HO
CHO
49.
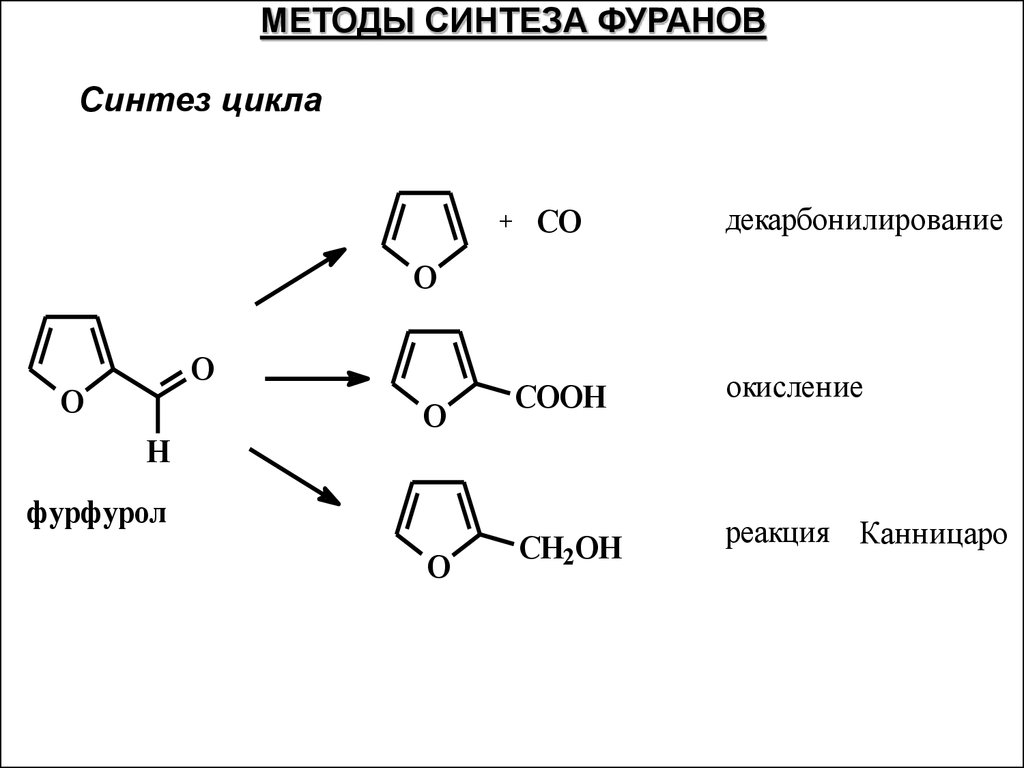
МЕТОДЫ СИНТЕЗА ФУРАНОВСинтез цикла
+
CO
декарбонилирование
O
O
O
H
O
фурфурол
O
COOH
окисление
CH2OH
реакция Канницаро
50.
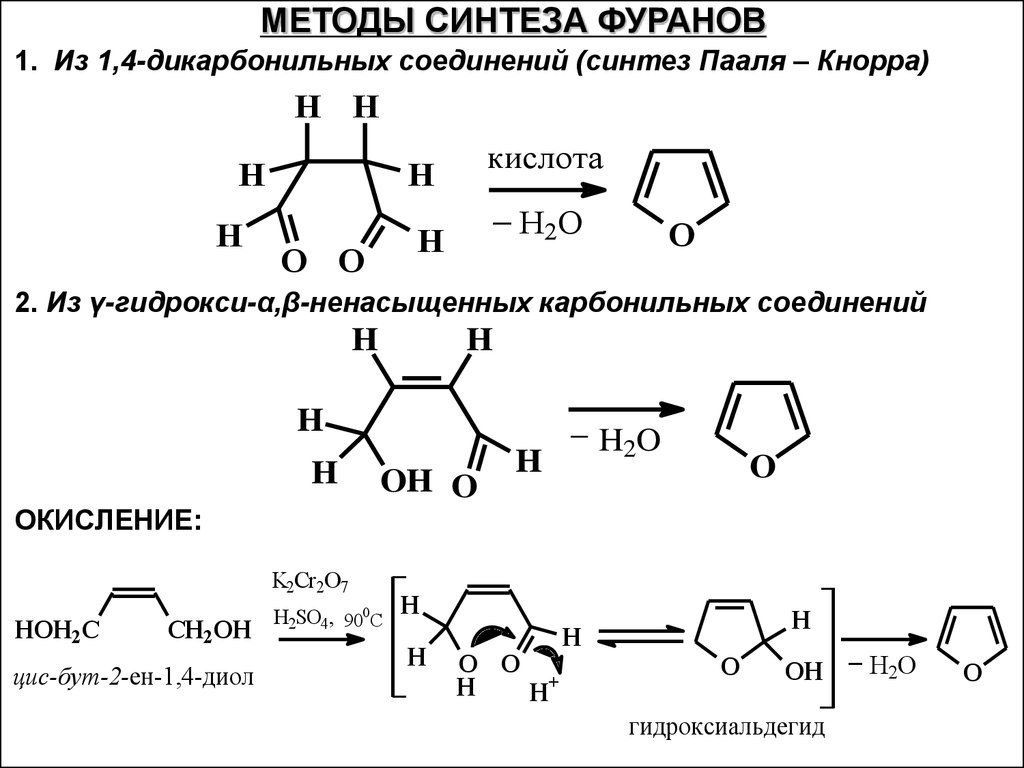
МЕТОДЫ СИНТЕЗА ФУРАНОВ1. Из 1,4-дикарбонильных соединений (синтез Пааля – Кнорра)
H H
H
H
кислота
H
_H O
2
H
O O
O
2. Из γ-гидрокси-α,β-ненасыщенных карбонильных соединений
H
H
H
H
ОКИСЛЕНИЕ:
_
OH O
K2Cr2O7
HOH2C
CH2OH
цис-бут-2-ен-1,4-диол
H2SO4, 900C
H
H2O
O
_
_
H
_
H
O O
H
H+
H
H
O
OH
_
гидроксиальдегид
_
H2O
O
51.
МЕТОДЫ СИНТЕЗА ФУРАНОВ3. Из α-галогенокарбонильных и 1,3-дикарбонильных соединений
(синтез Фейста- Бенари)
O
O
H
O
H
+
Hal
H
H
H основание
_H O
2
_ HCl
H
H
O
H
O
ЦИКЛИЗАЦИЯ:
O
O
H
H
Hal
H
H
H
O
O
O
OC2H5
CH3
H
водн. NaOH
200C
_H O
2
_ HCl
HO
OC2H5
O
CH3
OC2H5
_
H2O
O
CH3
52.
ХИНОЛИНЫ И ИЗОХИНОЛИНЫ5
8
4
N
1
5
4
3
3
2
N2
pKa = 4.9
pKa = 5.4
8
1
Хинолин и изохинолин представляют собой стабильные
соединения, хинолин – высококипящая жидкость, изохинолин
– твердое соединение с низкой температурой плавления
(2380С), оба эти соединения обладают сладковатым запахом.
Хинолин и изохинолин были выделены из каменноугольной
смолы.
53.
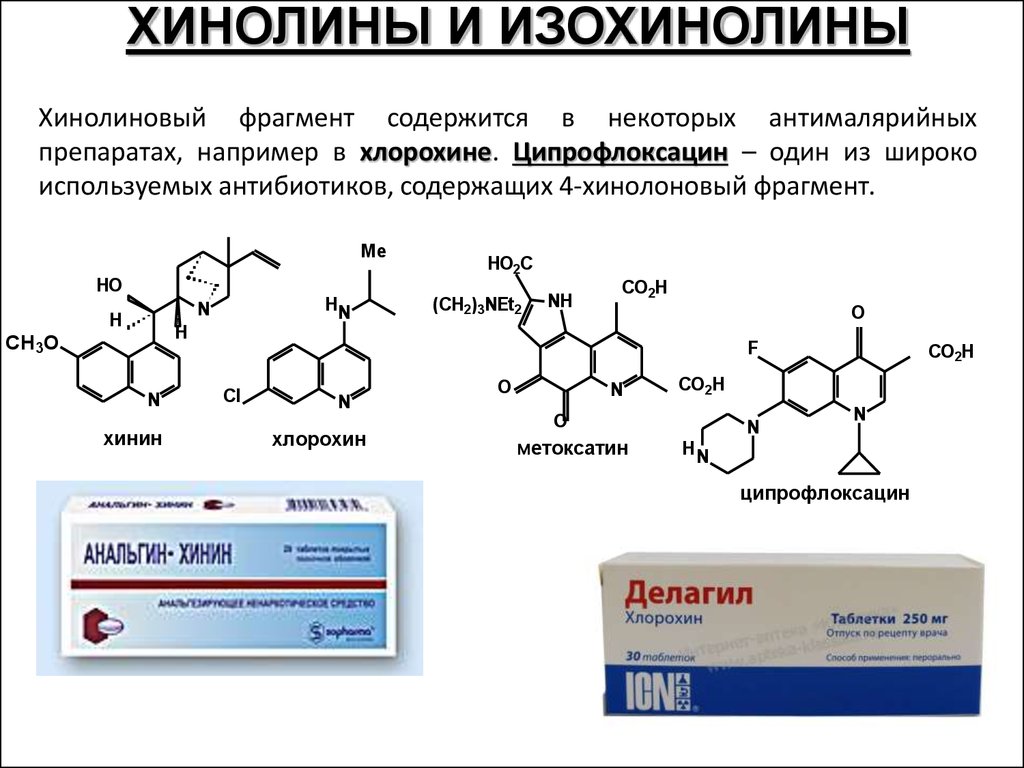
ХИНОЛИНЫ И ИЗОХИНОЛИНЫХинолиновый фрагмент содержится в некоторых антималярийных
препаратах, например в хлорохине. Ципрофлоксацин – один из широко
используемых антибиотиков, содержащих 4-хинолоновый фрагмент.
Me
HO
HN
N
H
H
CH3O
N
хинин
HO2C
(CH2)3NEt2
NH
CO2H
O
F
Cl
N
хлорохин
O
N
CO2H
O
метоксатин
CO2H
N
N
HN
ципрофлоксацин
54.
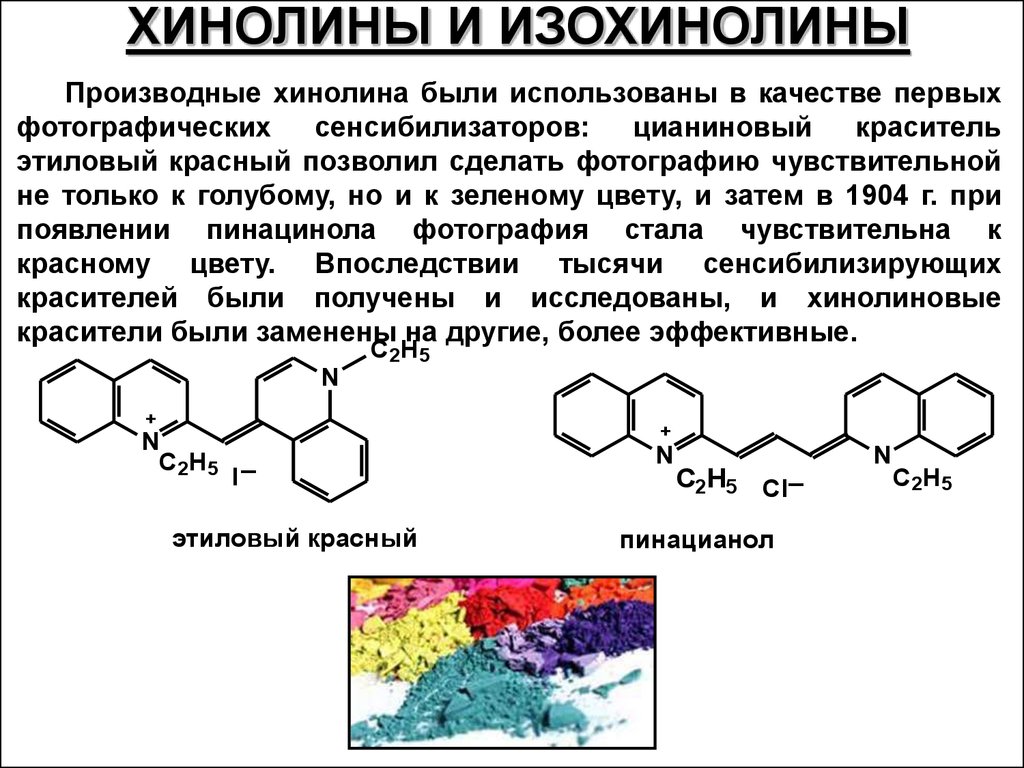
ХИНОЛИНЫ И ИЗОХИНОЛИНЫПроизводные хинолина были использованы в качестве первых
фотографических
сенсибилизаторов:
цианиновый
краситель
этиловый красный позволил сделать фотографию чувствительной
не только к голубому, но и к зеленому цвету, и затем в 1904 г. при
появлении пинацинола фотография стала чувствительна к
красному цвету. Впоследствии тысячи сенсибилизирующих
красителей были получены и исследованы, и хинолиновые
красители были заменены на другие, более эффективные.
N
C2H5
+
N
C2H5 _
I
этиловый красный
+
N
C2H5 Cl
пинацианол
_
N
C 2H 5
55.
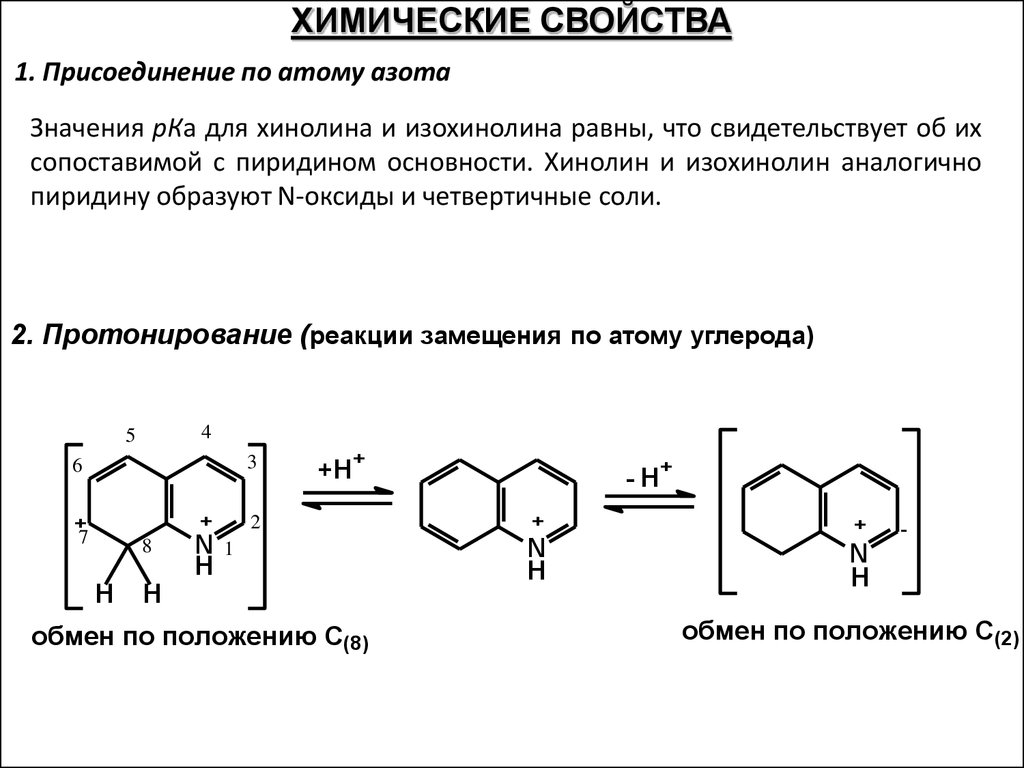
ХИМИЧЕСКИЕ СВОЙСТВА1. Присоединение по атому азота
Значения рКа для хинолина и изохинолина равны, что свидетельствует об их
сопоставимой с пиридином основности. Хинолин и изохинолин аналогично
пиридину образуют N-оксиды и четвертичные соли.
2. Протонирование (реакции замещения по атому углерода)
4
5
3
6
+
+
7
8
H
H
N
H
+H+
2
1
обмен по положению С(8)
- H+
+
N
H
+
N
H
-
обмен по положению С(2)
56.
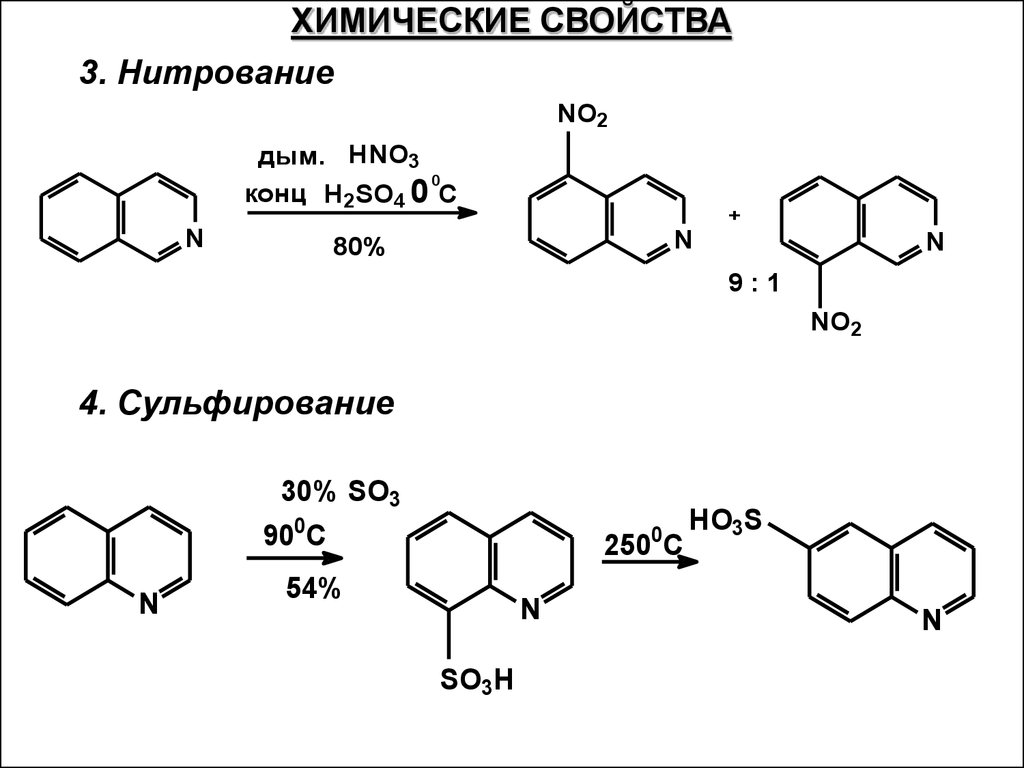
ХИМИЧЕСКИЕ СВОЙСТВА3. Нитрование
NO2
дым. HNO3
0
конц H2SO4 0 C
N
N
80%
+
N
9:1
NO2
4. Сульфирование
30% SO3
900C
N
0
250 C
54%
N
SO3H
HO3S
N
57.
ХИМИЧЕСКИЕ СВОЙСТВА5. Галогенирование
Br - Br
HCl,Br2
PhNO2, 800C
N
Br2,AlCl3
0
N
40%
+
N
H
-
Br
H
..
Br
H
75 C
Br
78%
N
Br
Br
H
N
+
N
H
H Br
Br
H
Br
- HBr
H
N
58.
ХИМИЧЕСКИЕ СВОЙСТВА6. Арилирование и алкилирование
2-CH3C6H4Li
PhNO2
0
(C2H5)2O, 20 C
N
N
Li
2000C
H2O
H
Ar
N
H
H
N
Ar
7. Аминирование и нитрование
45.C
-
N
66.C
NH2
H
KNH2
NH3
-
N+
K
NH2
-
H
N
+
K
.
KMnO4 -66 C
50%
NH2
KMnO4
- 40.C
60%
N
NH2
N
Ar
59.
ХИМИЧЕСКИЕ СВОЙСТВА7. Аминирование и нитрование
Для хинолинов и изохинолинов возможно также окислительное аминирова-ние, причем
даже в бензольное кольцо при наличии нитрогруппы, активирующей нуклеофильное
присоединение.
NO2
KMnO4
NH3, -33.C
N
H3N
+
NO2
NO2
-
H2N
H
66%
N
N
Введение нитрогруппы в положение 1 изохинолина возможно при действии на него
смеси нитрита калия, диметилсульфоксида и уксусного ангидрида. На ключевой стадии
этого процесса происходит нуклеофильное присоединение нитрит-аниона к
предварительно образовавшейся соли с участием атома азота изохинолина и комплекса
диметилсульфоксид – уксусный ангидрид:
ДМСО, Ас2О
KNO2, HMPA, 20.C
[Me2SOAc]
N
-Me2S
-AcOH
88%
NS(Me)2OAc
H
NO2
N
NO2
60.
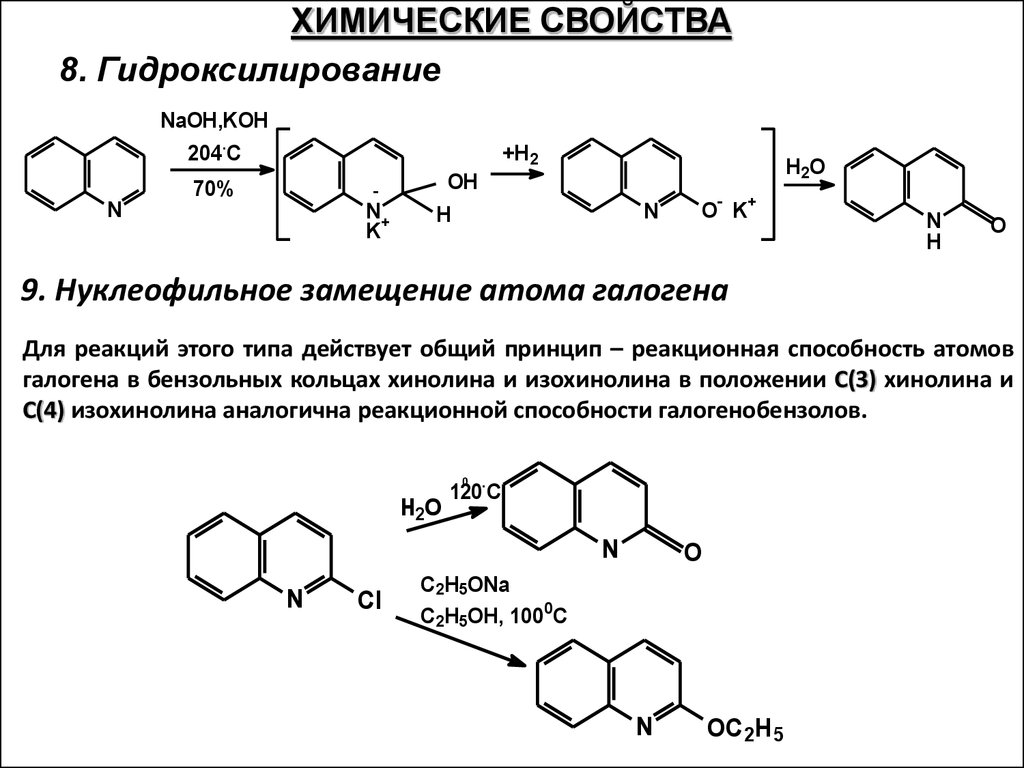
ХИМИЧЕСКИЕ СВОЙСТВА8. Гидроксилирование
NaOH,KOH
.
+H2
204 C
N
70%
-
N+
K
H2O
OH
N
H
-
O K
+
N
H
O
9. Нуклеофильное замещение атома галогена
Для реакций этого типа действует общий принцип – реакционная способность атомов
галогена в бензольных кольцах хинолина и изохинолина в положении С(3) хинолина и
С(4) изохинолина аналогична реакционной способности галогенобензолов.
0
H2O
.
120 C
N
N
Cl
O
C2H5ONa
C2H5OH, 1000C
N
OC2H5
61.
ХИМИЧЕСКИЕ СВОЙСТВА9. Нуклеофильное замещение атома галогена
Cl
N
MeONa
MeOH
100.C
Cl
60%
N
OMe
MeONa,
Cl MeOH
.
DMSO,100 C
P,HI
AcOH
100.C
60%
N
87%
N
Cl
10. Реакции с восстановителями
Для хинолина и изохинолина возможно восстановление как пиридинового цикла, так и
бензольного кольца.
H2, Pt
H2,Pt
0
MeOH,20.C,1 aтм.
.0
10н. HCl, 20 C,1 aтм.
N
70%
N
87%
N
H
62.
КЛАСС ХИНОЛИНОВ. ТИПЫ.ОКСИХИНОЛИНЫ И
ОКСИИЗОХИНОЛИНЫ
АМИНОХИНОЛИНЫ И
АМИНОИЗОХИНОЛИНЫ
+
NH
NH
O
1-изохинолон
O
NH2
+
OH
N
H
H2N
NH
CH2COCO2Et
+
NH
АЛКИЛХИНОЛИНЫ И
АЛКИЛИЗОХИНОЛИНЫ
EtONa,EtOH,Et2O
20. 0C 90%
N
+
2Н-3-изохинолинол
(желтый)
(CO2Et)2
N
H
H 2N
NH
3-изохинолинол
(бесцветный)
NH2
_
O
N
+
PhCHO
Ac2O,100. 0C
N
CH3
57%
N
Ph
63.
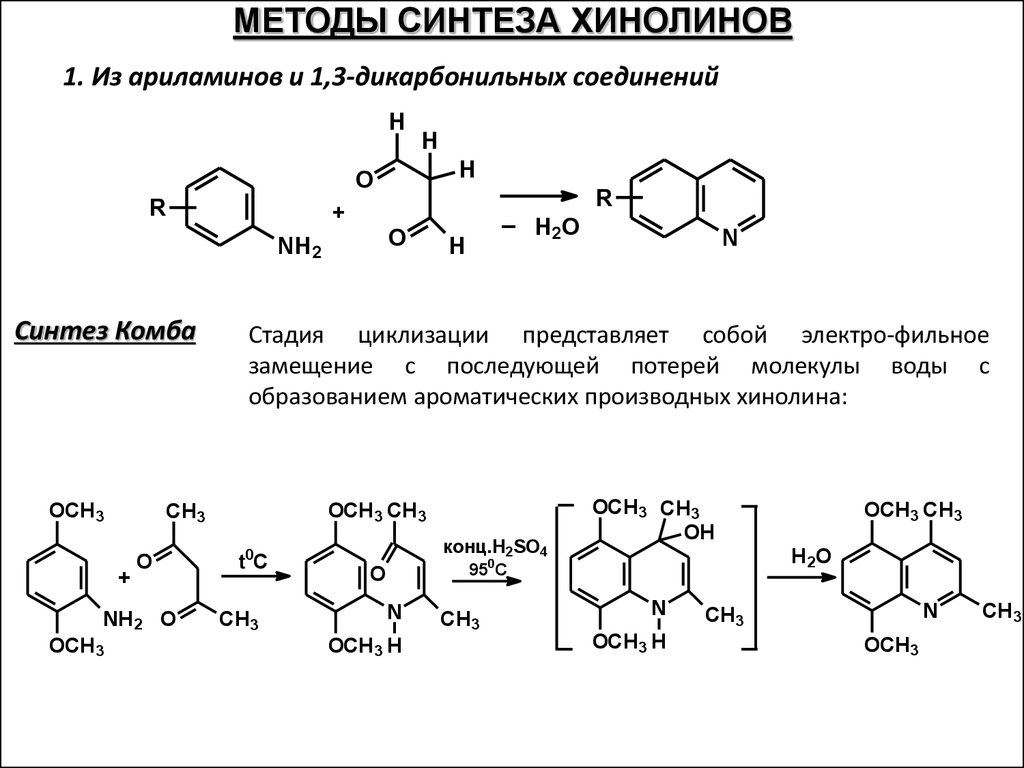
МЕТОДЫ СИНТЕЗА ХИНОЛИНОВ1. Из ариламинов и 1,3-дикарбонильных соединений
H
H
H
O
R
+
O
NH2
Синтез Комба
OCH3
+
NH2 O
OCH3
H
R
N
Стадия циклизации представляет собой электро-фильное
замещение с последующей потерей молекулы воды с
образованием ароматических производных хинолина:
OCH3 CH3
CH3
O
_ H O
2
t0C
CH3
конц.H2SO4
OCH3 CH3
OH
H2O
950C
O
N
OCH3 H
CH3
OCH3 CH3
N
OCH3 H
N
CH3
OCH3
CH3
64.
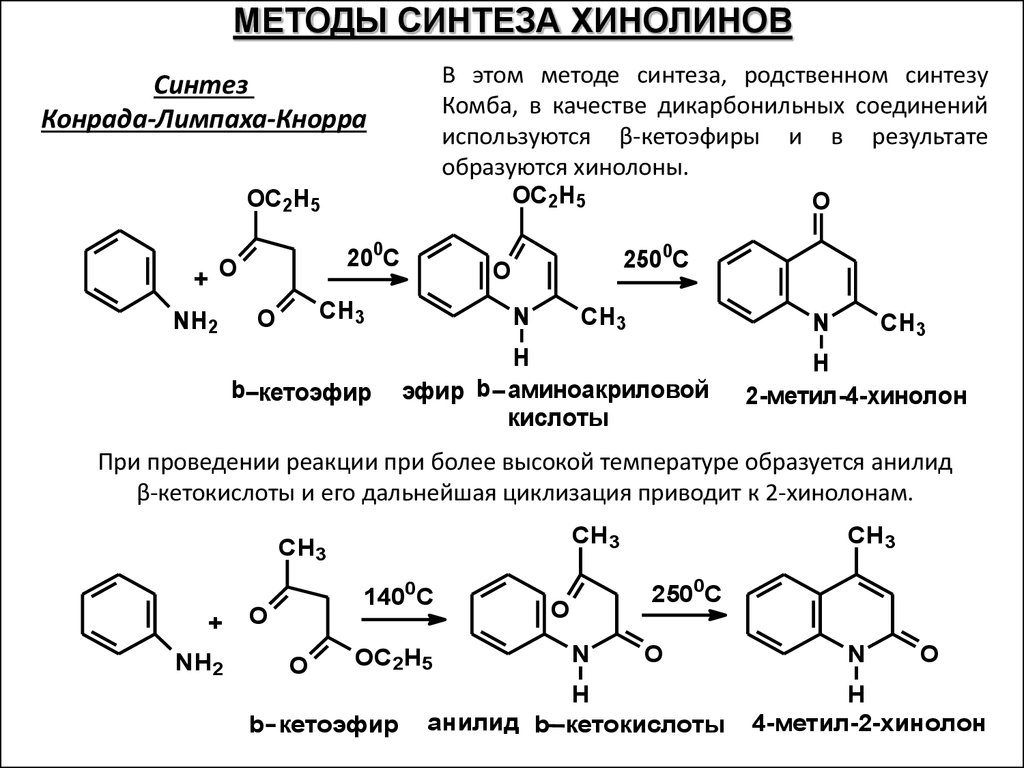
МЕТОДЫ СИНТЕЗА ХИНОЛИНОВВ этом методе синтеза, родственном синтезу
Комба, в качестве дикарбонильных соединений
используются β-кетоэфиры и в результате
образуются хинолоны.
OC2H5
O
Синтез
Конрада-Лимпаха-Кнорра
OC2H5
200C
O
+
NH2
O
CH3
O
b кетоэфир
2500C
N
CH3
N
H
эфир b аминоакриловой
кислоты
CH3
H
2-метил-4-хинолон
При проведении реакции при более высокой температуре образуется анилид
β-кетокислоты и его дальнейшая циклизация приводит к 2-хинолонам.
CH3
CH3
+
NH2
1400C
O
O
OC2H5
b кетоэфир
CH3
2500C
O
N
O
H
анилид b кетокислоты
N
O
H
4-метил-2-хинолон
65.
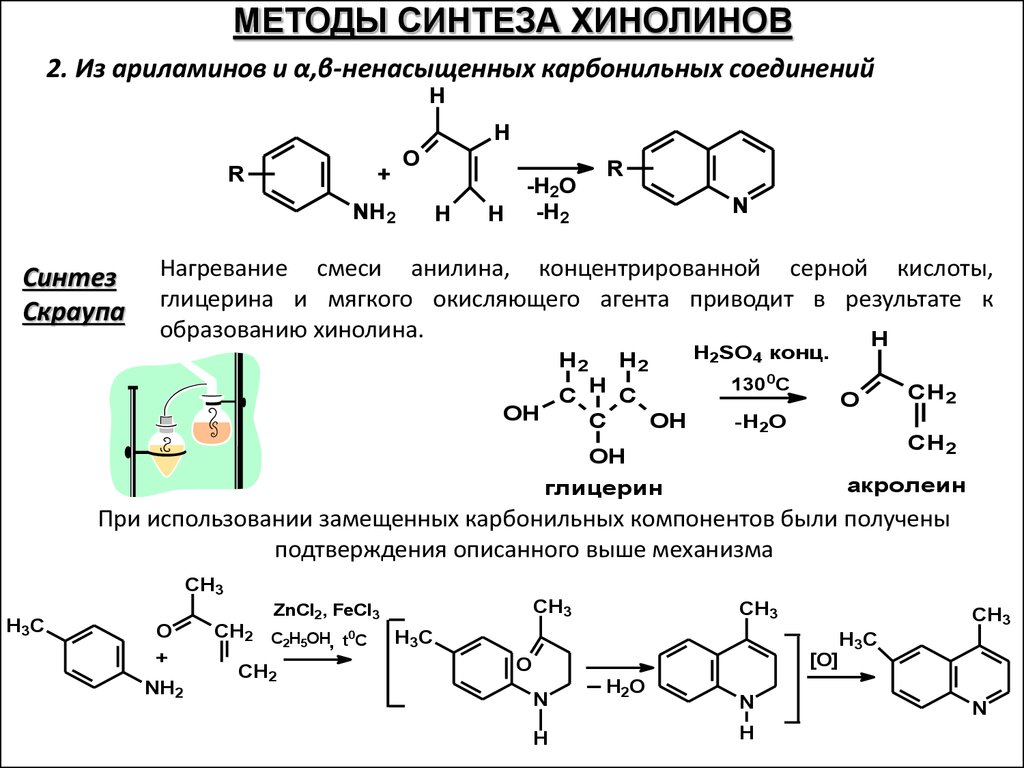
МЕТОДЫ СИНТЕЗА ХИНОЛИНОВ2. Из ариламинов и α,β-ненасыщенных карбонильных соединений
H
H
R
O
+
NH2
Синтез
Скраупа
H
-H2O
H -H2
R
N
Нагревание смеси анилина, концентрированной серной кислоты,
глицерина и мягкого окисляющего агента приводит в результате к
образованию хинолина.
H
H2
H2
C H C
OH
C
OH
H2SO4 конц.
1300С
O
-H2O
CH 2
CH 2
OH
глицерин
акролеин
При использовании замещенных карбонильных компонентов были получены
подтверждения описанного выше механизма
CH3
H3C
O
+
NH2
CH3
ZnCl2, FeCl3
CH2 C H OH t0C
2 5
,
CH2
CH3
H3C
CH3
[O]
O
N
H
H2O
N
H
H 3C
N
66.
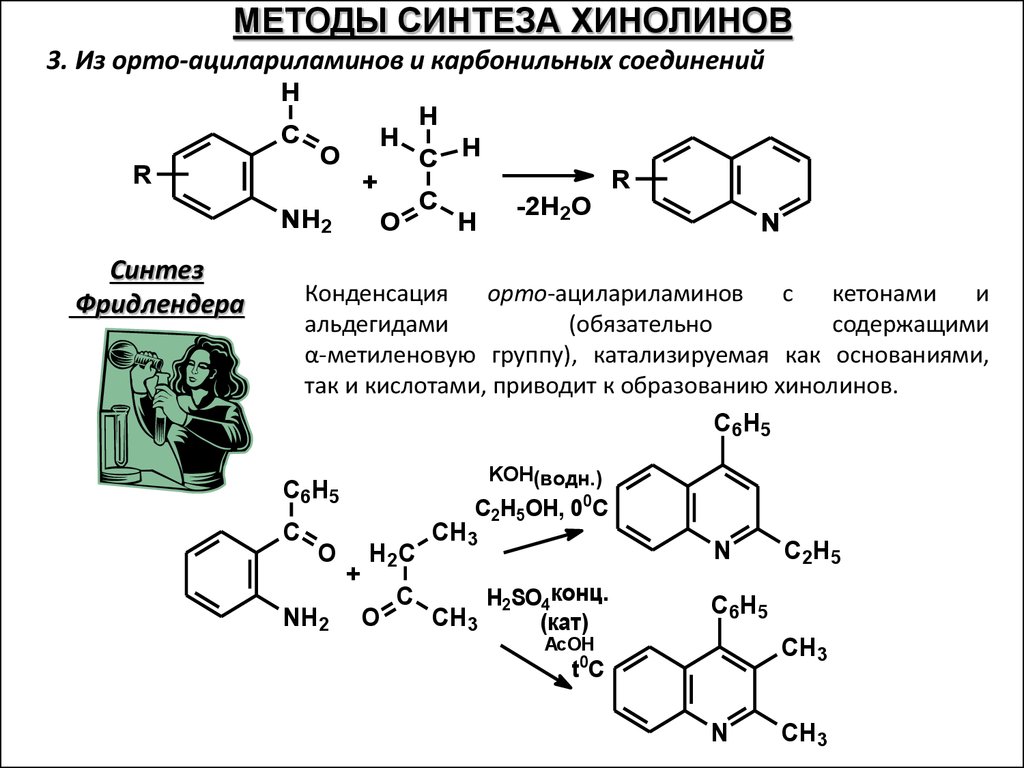
МЕТОДЫ СИНТЕЗА ХИНОЛИНОВ3. Из орто-ацилариламинов и карбонильных соединений
H
C
R
H
O
+
NH2
Синтез
Фридлендера
O
H
C H
C
H
-2H2O
R
N
Конденсация
орто-ацилариламинов
с
кетонами
и
альдегидами
(обязательно
содержащими
α-метиленовую группу), катализируемая как основаниями,
так и кислотами, приводит к образованию хинолинов.
C6H 5
KOH(водн.)
C6H5
C
O
NH2
C2H5OH, 00C
+
H2C
O
C
CH3
N
H2SO4конц.
CH3
(кат)
C2H5
C6H5
CH3
AcOH
0
tC
N
CH3
67.
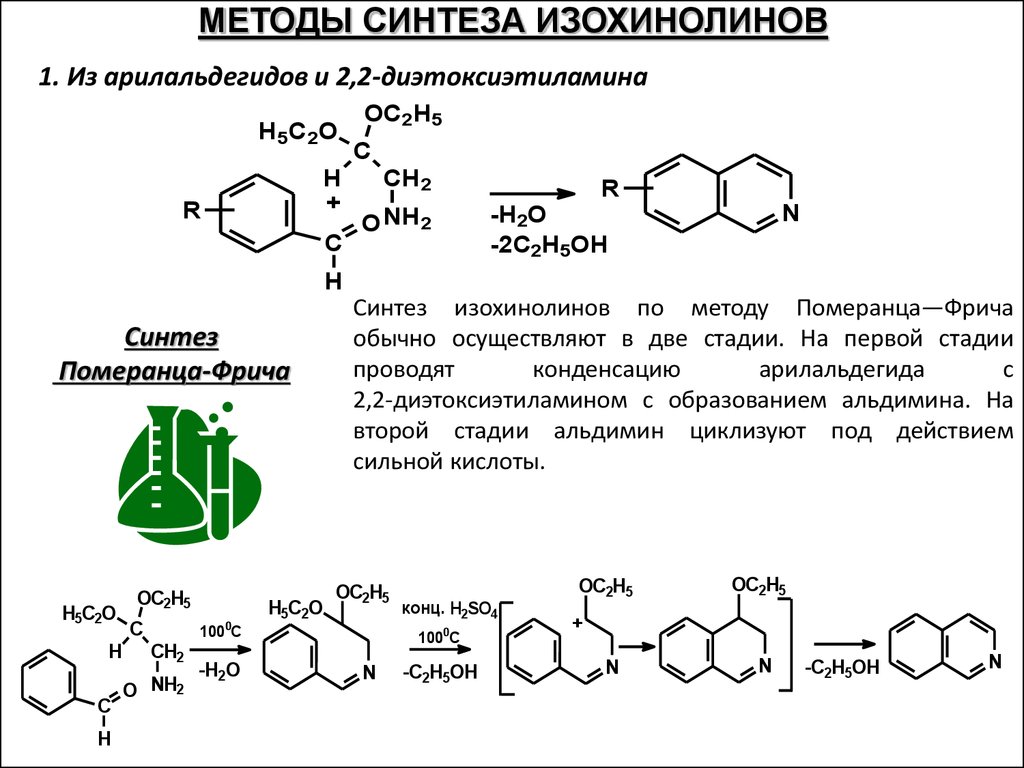
МЕТОДЫ СИНТЕЗА ИЗОХИНОЛИНОВ1. Из арилальдегидов и 2,2-диэтоксиэтиламина
H 5C 2O
H
+
R
C
OC2H5
C
CH2
O NH2
R
N
-H2O
-2C2H5OH
H
Синтез
Померанца-Фрича
H5C2O
H
C
H
OC2H5
C
0
H5C2O
Синтез изохинолинов по методу Померанца—Фрича
обычно осуществляют в две стадии. На первой стадии
проводят
конденсацию
арилальдегида
с
2,2-диэтоксиэтиламином с образованием альдимина. На
второй стадии альдимин циклизуют под действием
сильной кислоты.
OC2H5
100 C
CH2
O NH2
-H2O
конц. H2SO4
1000C
N
-C2H5OH
OC2H5
OC2H5
+
N
N
-C2H5OH
N
68.
МЕТОДЫ СИНТЕЗА ИЗОХИНОЛИНОВ2. Из фенилэтиламидов
Амид,
полученный
при
реакции
2-фенилэтиламина с хлорангидридом или
ангидридом карбоновой кислоты, циклизуется с
потерей молекулы воды с образованием 3,4дигидроизохинолина,
который
легко
дегидрируется при действии палладиевого
катализатора, серы или дифенилдисульфида.
Синтез
Бишлера-Напиральского
CH3COCl
NH2
P4O10
O
Pd/C
0
тетралин , t C
NH
CH3
1000C
N
CH3
1-метил-3,4-дигидроизохинолин
N
CH3
1-метил-изохинолин

































 chemistry
chemistry