Similar presentations:
Биоорганическая химия
1. БИООРГАНИЧЕСКАЯ ХИМИЯ
Мария ЕвгеньевнаКлюева
1
2. Учебники
1. Тюкавкина Н.А., Бауков Ю.И.Биоорганическая химия (2012, 2008,
1985г.)
2. Степаненко Б.Н. Курс органической
химии, том 1 и том 2, 1981 г.
2
3.
Органические соединения - углеводороды иих функциональных производных
(соединений, содержащих функциональные
группы).
Биоорганическая химия изучает строение и
свойства веществ, участвующих в процессах
жизнедеятельности, в непосредственной связи с
познанием их биологических функций.
Основные объекты изучения:
- биополимеры (белки, углеводы, нуклеиновые
кислоты)
- биорегуляторы (витамины, гормоны, лекарственные
вещества)
3
4.
Функциональные группы:- атомные группировки – атомы
металлов и неметаллов (CH3Cl, CH3Na)
- молекулярные группировки – остатки
молекул неорганических веществ
(CH3NO2, CH3OH)
- -электронные группировки – двойные
и тройные связи.
4
5. Классификация углеводородов
УглеводородыЦиклические
Алифатические
Насыщенные
(предельные)
Ненасыщенные
(непредельные)
(карбоциклические)
Алициклические
Вспомнить номенклатуру!!
Ароматические
5
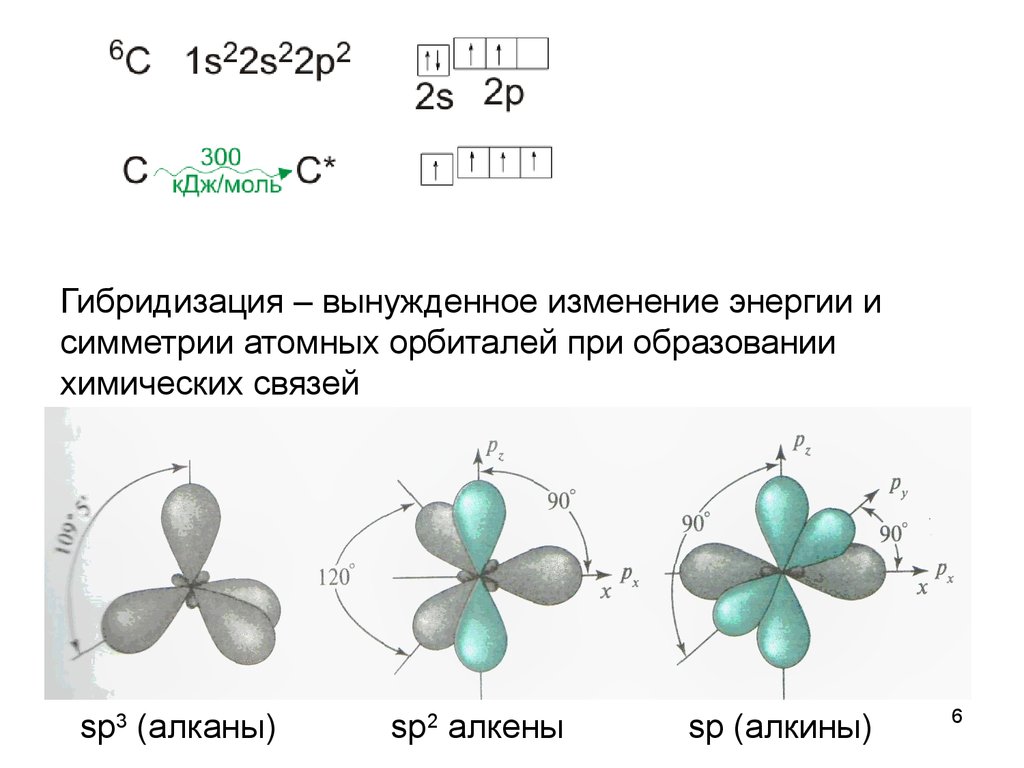
6.
Гибридизация – вынужденное изменение энергии исимметрии атомных орбиталей при образовании
химических связей
sp3 (алканы)
sp2 алкены
sp (алкины)
6
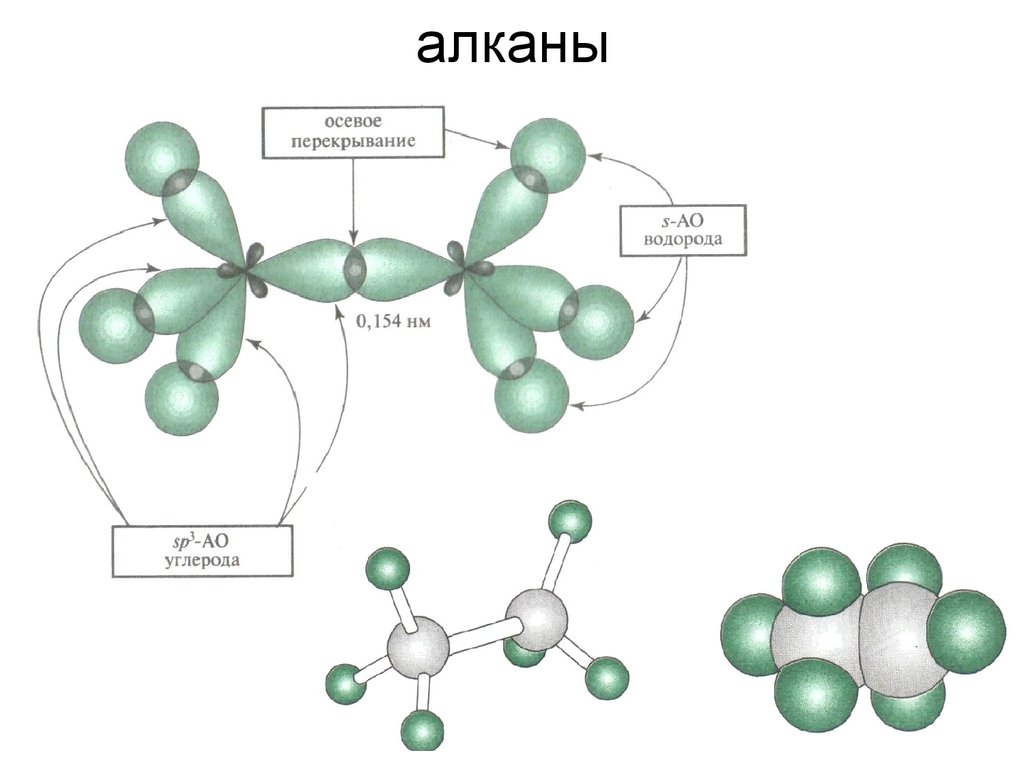
7. алканы
78.
• Алканы – малореакционноспособныесоединения, «химические мертвецы».
С трудом вступают в реакции
радикального замещения атома Н.
Для образования радикалов нужны
жёсткие условия (облучение УФ светом,
нагревание выше 3000С).
• Радикал – частица, имеющая неспаренный
электрон. Образуется при гомолитическом
разрыве ковалентной связи:
8
9.
CH3 CH2 CH3CH3 CH2 CH3
CH3 CH2 CH3
Cl
Cl2
ClCH2
hv
Br2
hv
CH2 CH3
+ CH3
CH CH3
Br
CH3
HNO3
ðàçá
p, t
CH CH3
NO 2
CH3
CH CH3
9
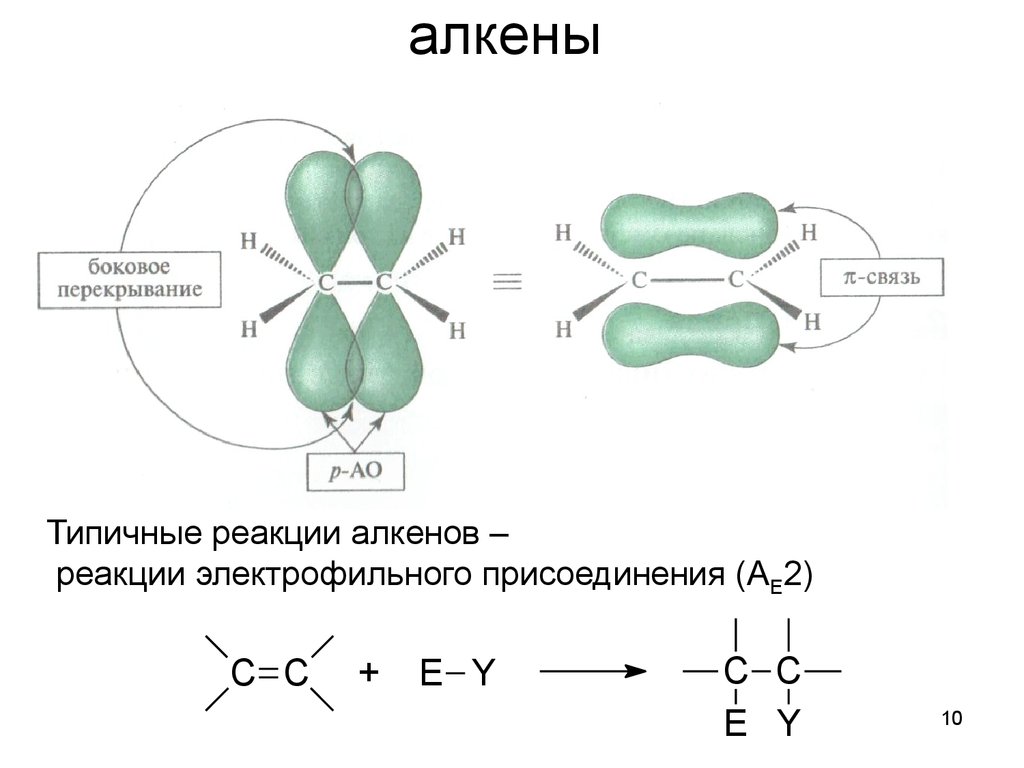
10. алкены
Типичные реакции алкенов –реакции электрофильного присоединения (AE2)
C C
+
E Y
C C
E Y
10
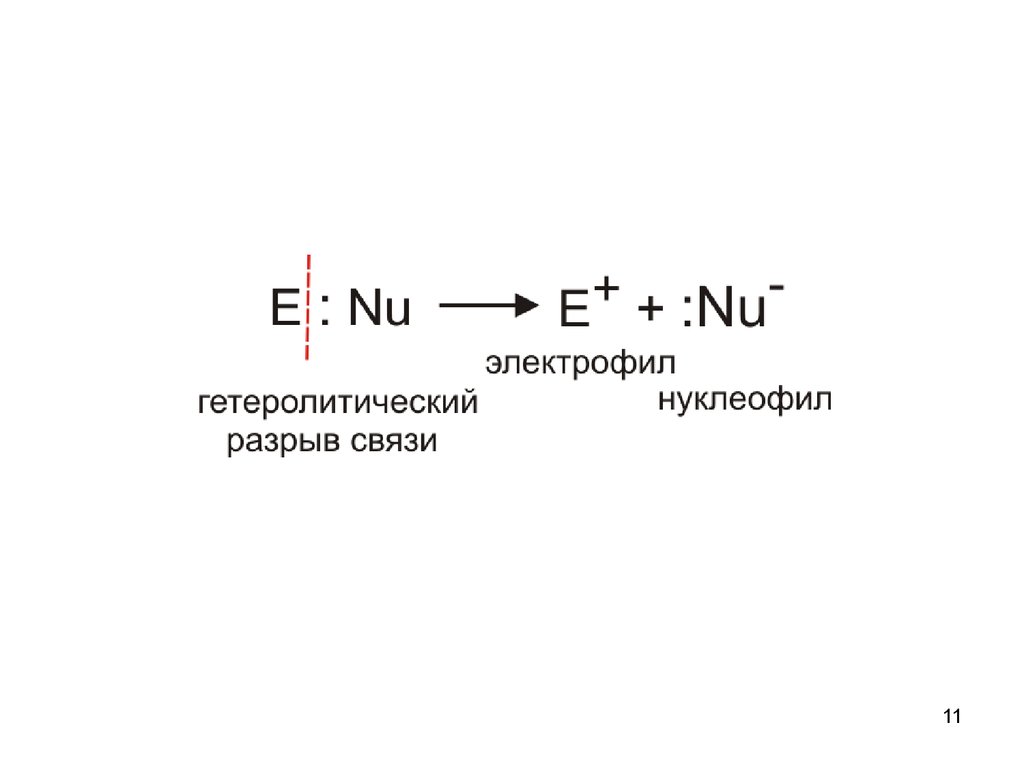
11.
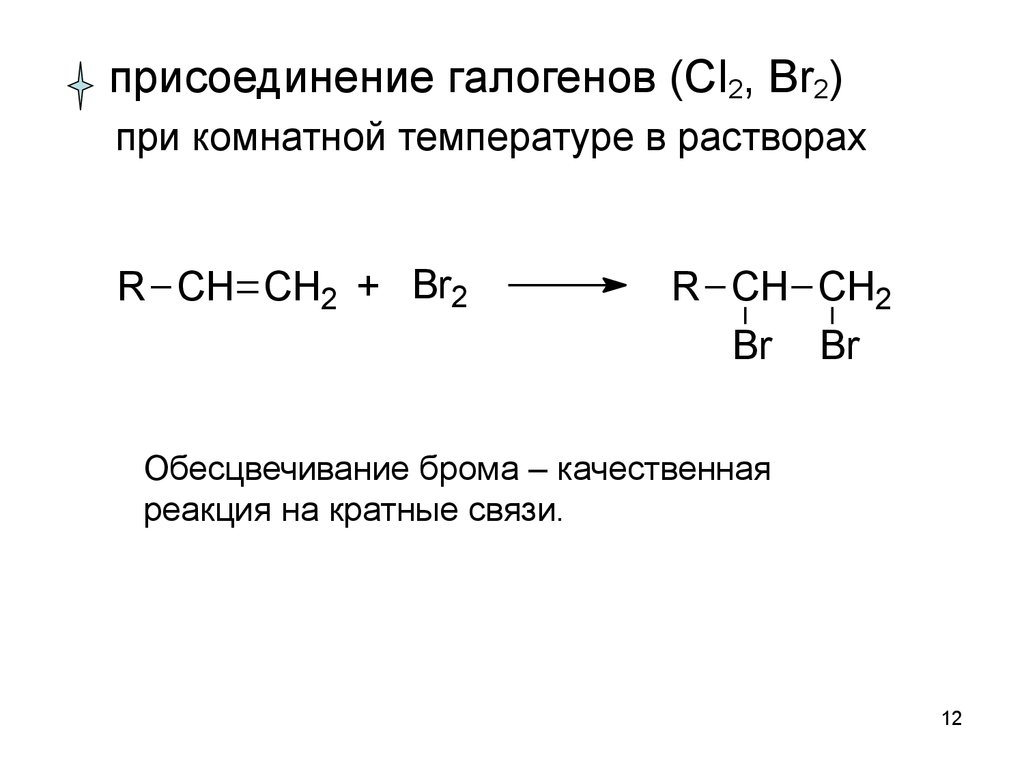
1112.
присоединение галогенов (Cl2, Br2)при комнатной температуре в растворах
R CH CH2 + Br2
R CH CH2
Br Br
Обесцвечивание брома – качественная
реакция на кратные связи.
12
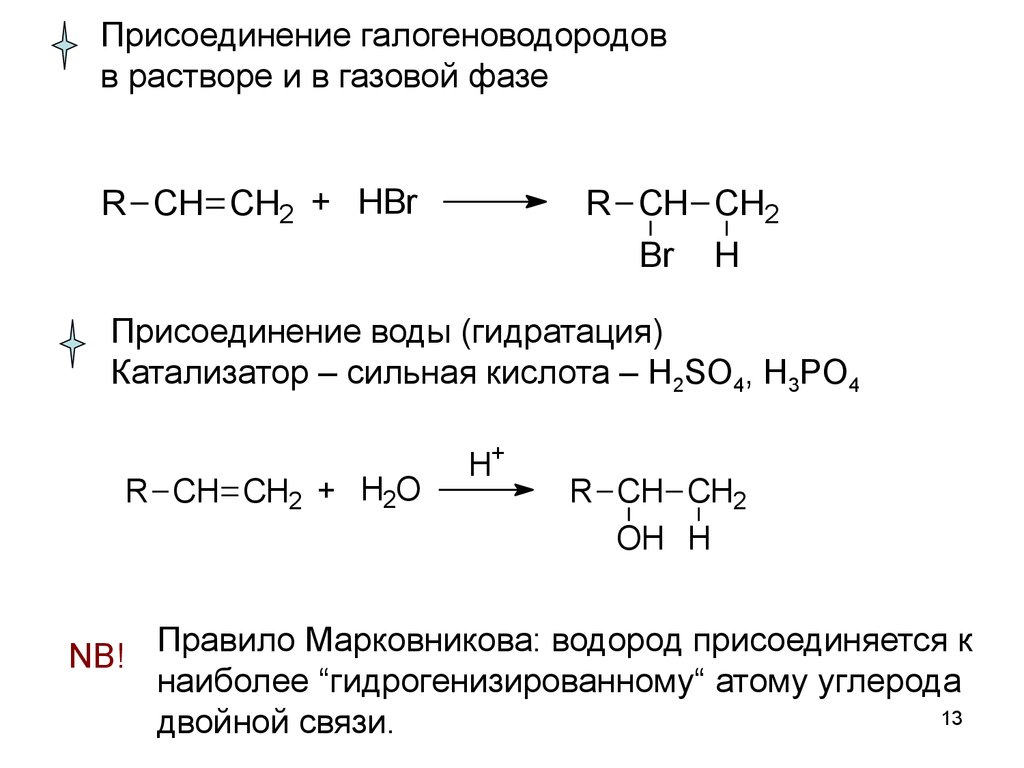
13.
Присоединение галогеноводородовв растворе и в газовой фазе
R CH CH2 + HBr
R CH CH2
Br H
Присоединение воды (гидратация)
Катализатор – сильная кислота – H2SO4, H3PO4
R CH CH2 + H2O
H+
R CH CH2
OH H
NB! Правило Марковникова: водород присоединяется к
наиболее “гидрогенизированному“ атому углерода
13
двойной связи.
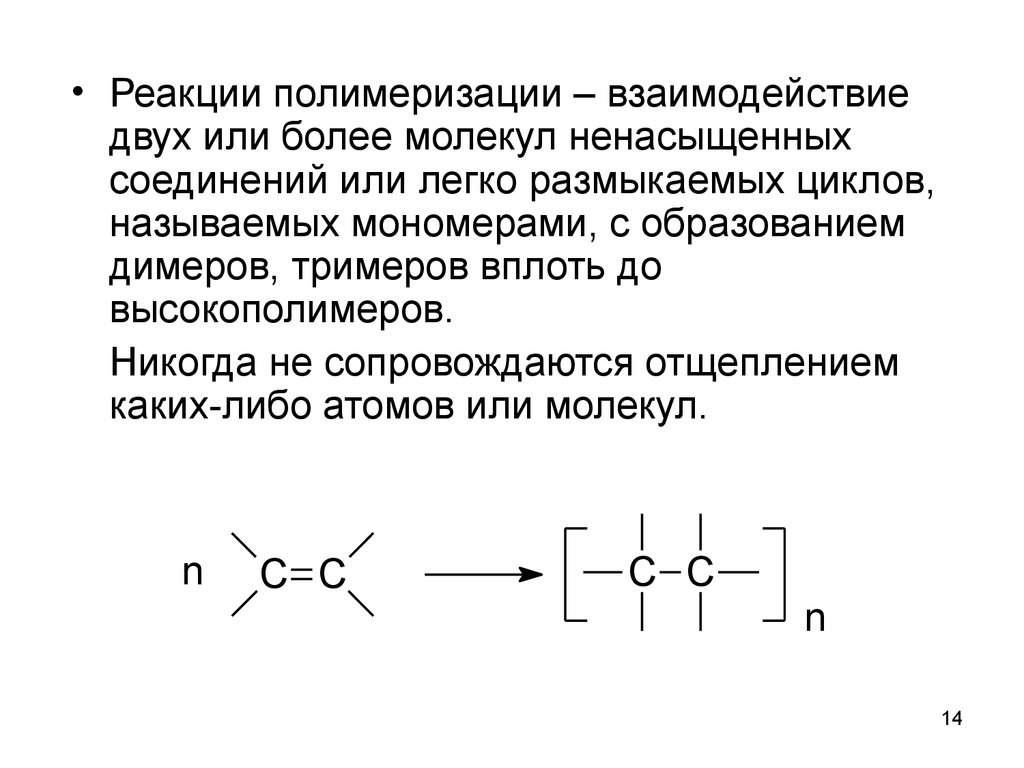
14.
• Реакции полимеризации – взаимодействиедвух или более молекул ненасыщенных
соединений или легко размыкаемых циклов,
называемых мономерами, с образованием
димеров, тримеров вплоть до
высокополимеров.
Никогда не сопровождаются отщеплением
каких-либо атомов или молекул.
n
C C
C C
n
14
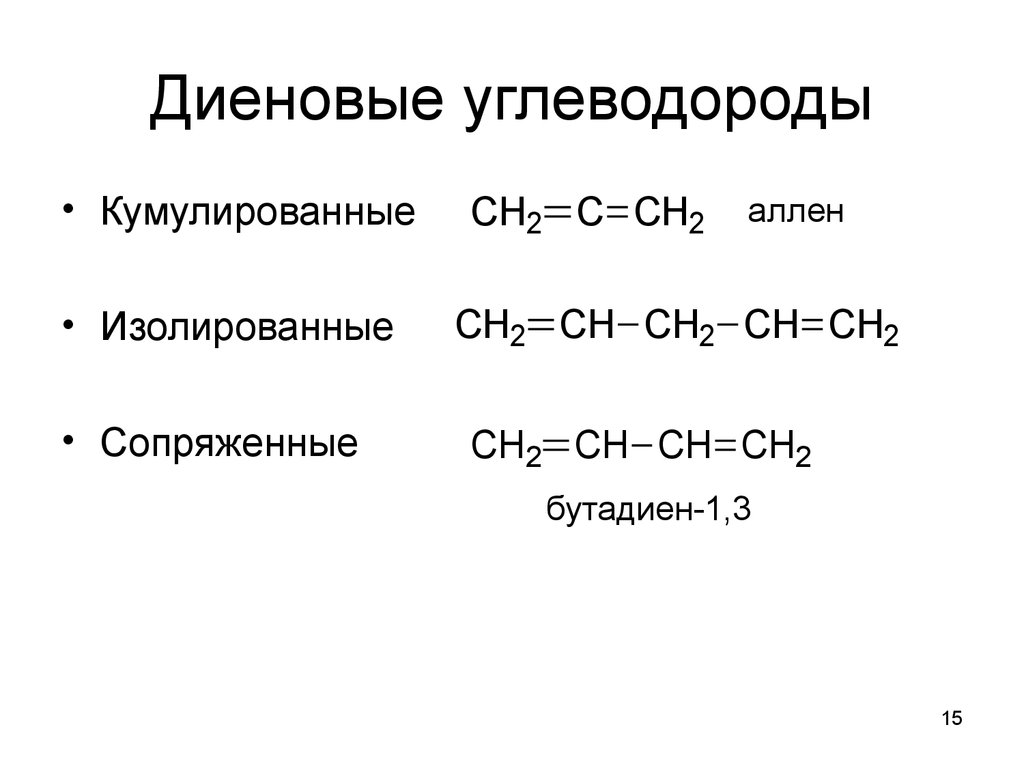
15. Диеновые углеводороды
• Кумулированные• Изолированные
• Сопряженные
CH2 C CH2
аллен
CH2 CH CH2 CH CH2
CH2 CH CH CH2
бутадиен-1,3
15
16.
Единая -система охватывает 4 атома углерода.• Делокализованная связь – ковалентная связь,
молекулярная орбиталь которой охватывает более
двух атомов.
• Наряду с реакциями 1,2-присоединения идут реакции
1,4 присоединения (с переносом двойной связи в
центр)
16
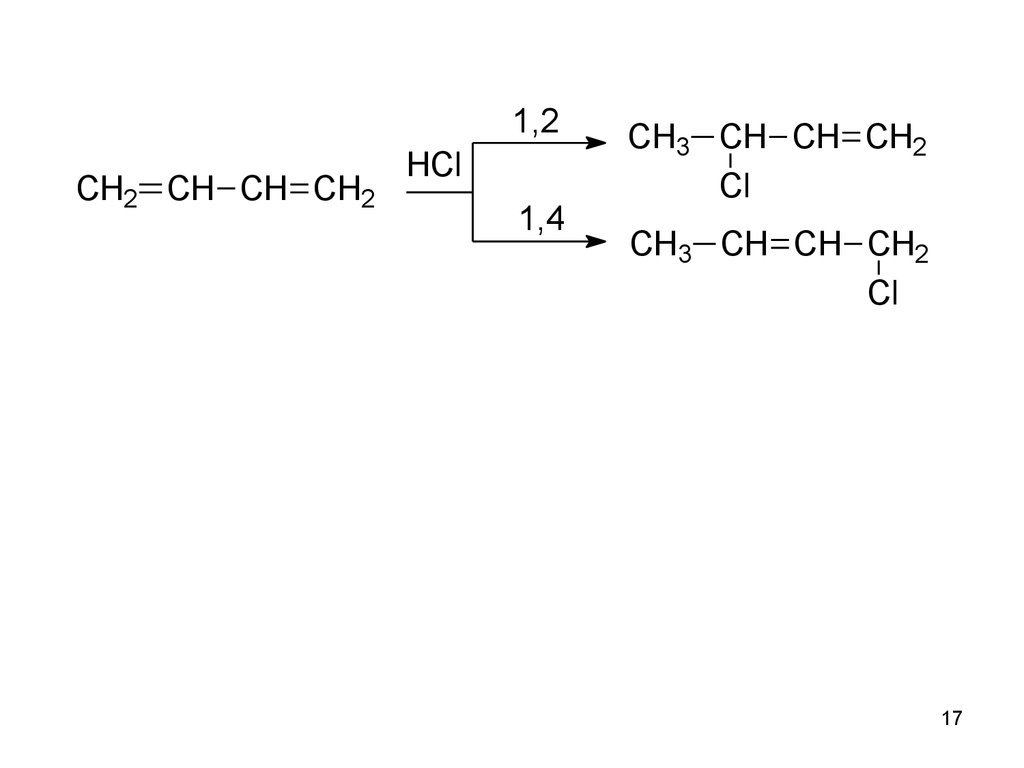
17.
1,2CH2 CH CH CH2
HCl
1,4
CH3 CH CH CH2
Cl
CH3 CH CH CH2
Cl
17
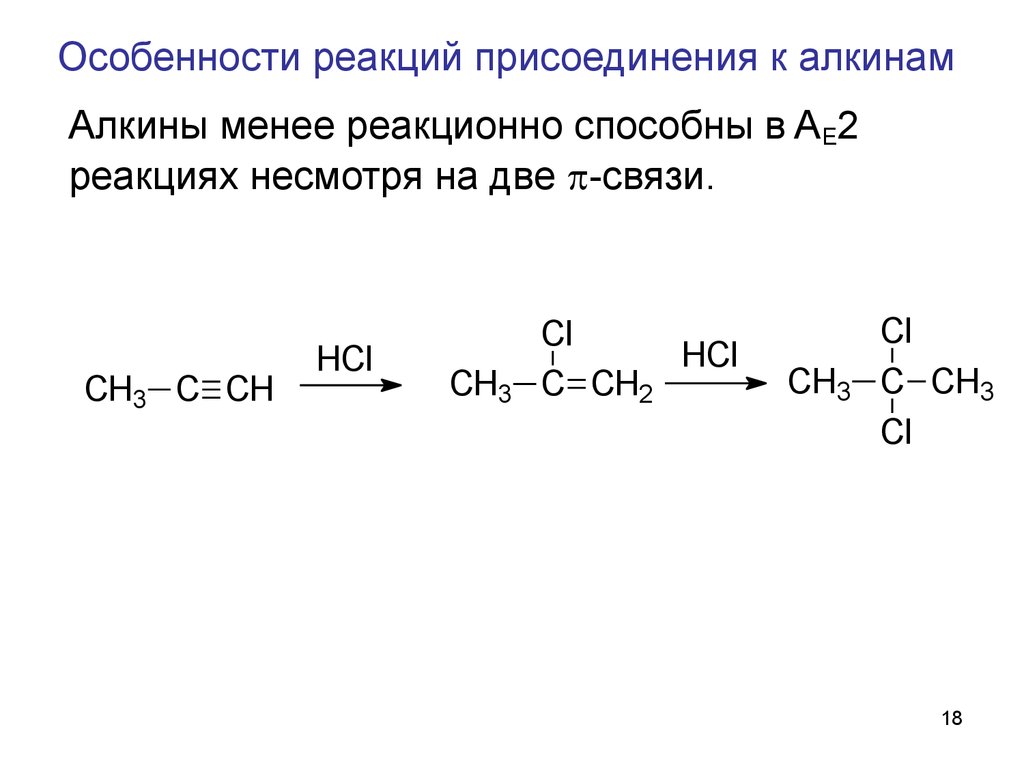
18. Особенности реакций присоединения к алкинам
Алкины менее реакционно способны в AE2реакциях несмотря на две -связи.
CH3 C CH
HCl
+ H+
CH3
Cl
HCl
C CH2
+ Cl-
CH3
Cl
C CH3
Cl
2
sp
+
CH3 C CH2
sp
êàðáî êàòèî í âèí èëüí î ãî òèï à
CH2 CH
âèí èë
18
19. Гидратация алкинов
Hg2+CH CH + H2O
CH2 CH
OH
H2SO4
âèí èëî âû é
ñï èðò
Hg2+
CH3 C CH + H2O
H2SO4
CH3 C CH2
OH
CH3 C
O
H
óêñóñí û é àëüäåãèä
CH3 C CH3
O
àöåòî í
19
20.
• Более важной in vivo является двойнаясвязь. Возникновение двойной связи и
её превращения характерны для многих
биохимических процессов.
20
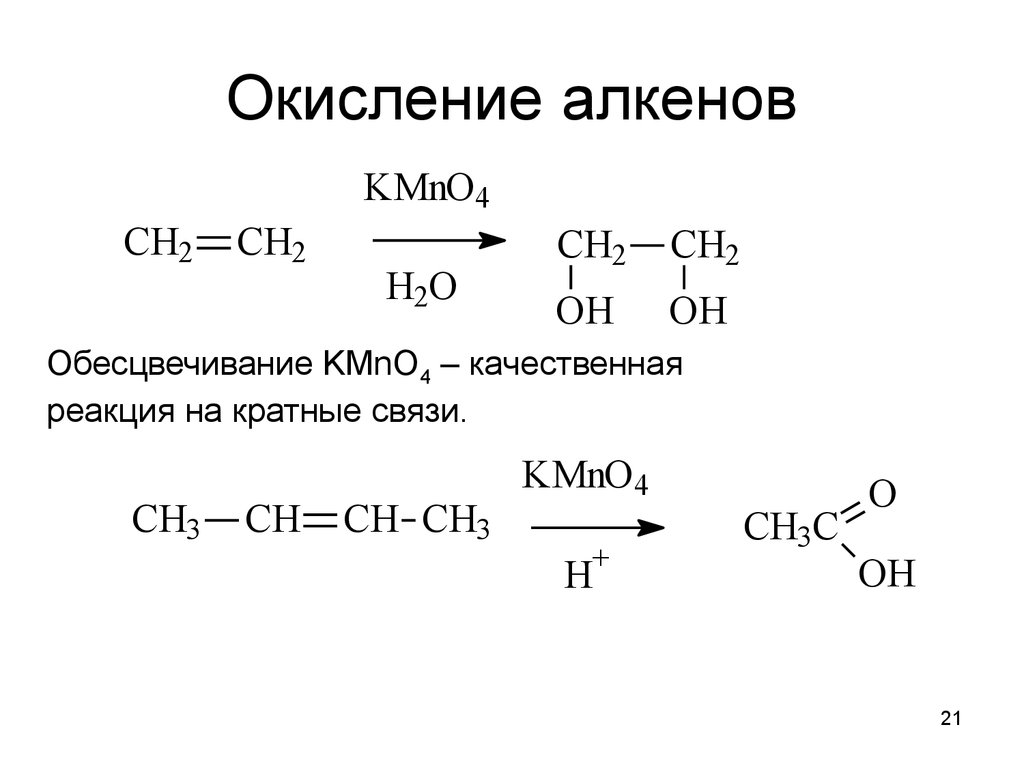
21. Окисление алкенов
KMnO4CH2
CH2
H2O
CH2
CH2
OH
OH
Обесцвечивание KMnO4 – качественная
реакция на кратные связи.
CH3
CH
CH CH3
KMnO4
+
H
CH3C
O
OH
21
22.
Способы получения алканов,алкенов, алкинов, алкадиенов
самостоятельно
22
23. Циклические углеводороды
I.Алициклические углеводороды:
- полиметиленовые углеводороды
- производные ментана
По числу циклов: - моноциклические
- бициклические
- полициклические
23
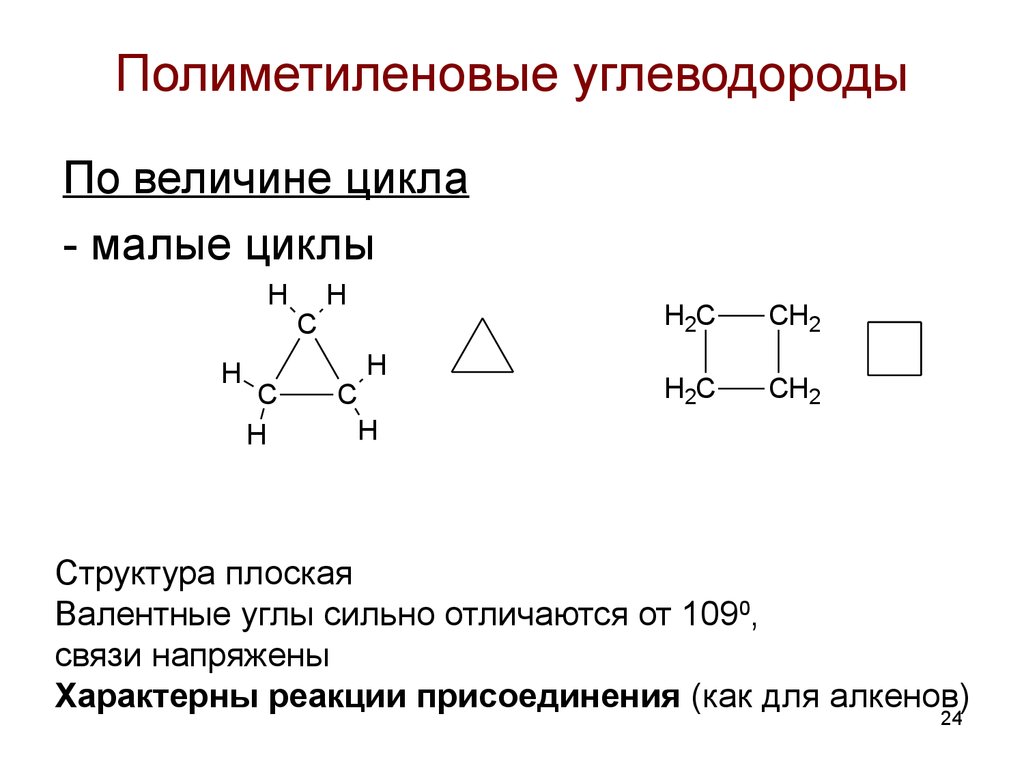
24. Полиметиленовые углеводороды
По величине цикла- малые циклы
H
H
C
H
C
H
H
C
H
öèêëî ï ðî ï àí
H2C
CH2
H2C
CH2
öèêëî áóòàí
Структура плоская
Валентные углы сильно отличаются от 1090,
связи напряжены
Характерны реакции присоединения (как для алкенов)
24
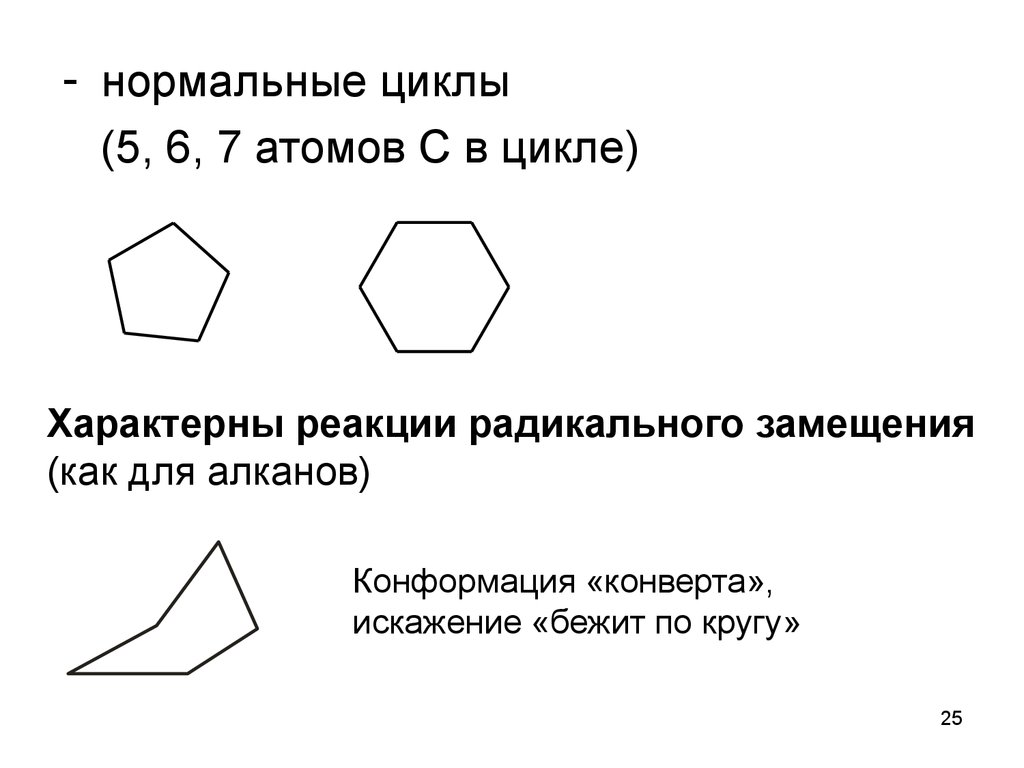
25.
- нормальные циклы(5, 6, 7 атомов С в цикле)
Характерны реакции радикального замещения
(как для алканов)
Конформация «конверта»,
искажение «бежит по кругу»
25
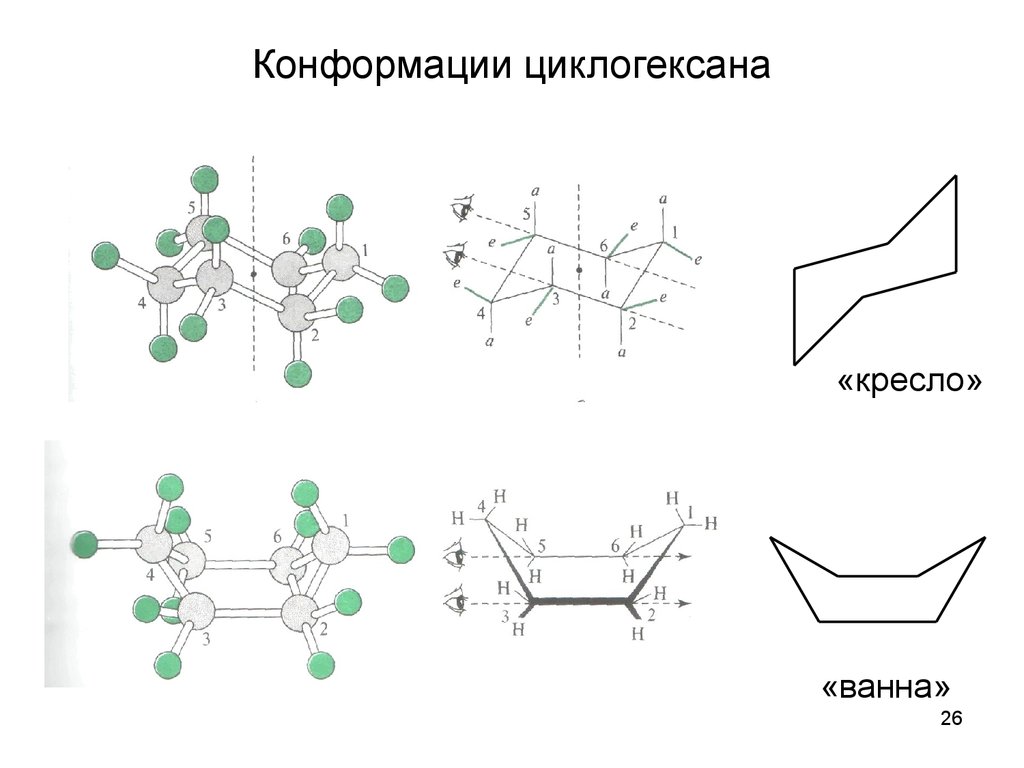
26. Конформации циклогексана
«кресло»«ванна»
26
27.
- средние циклы (8 – 11 атомов С)- макроциклы (12 и больше атомов С)
27
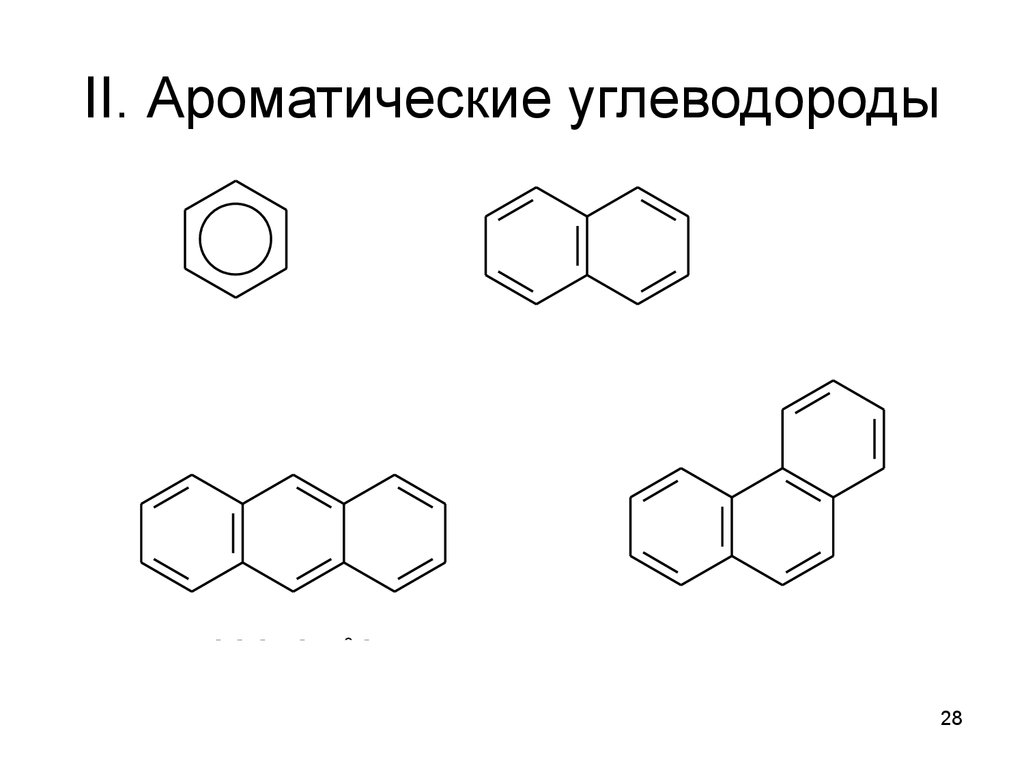
28. II. Ароматические углеводороды
áåí çî ëàí òðàöåí
í àô òàëèí
ô åí àí òðåí
28
29. Критерии ароматичности
• Геометрический: все ароматические системыимеют плоскую замкнутую в цикл
сопряжённую систему -электронов
• Электронный: число -электронов
N=4n+2 (n=0,1,2 и т.д.) – правило Хюккеля
• Химический: ароматические молекулы в
обычных условиях несмотря на свою
ненасыщенность не вступают в реакции
присоединения, а склонны к реакциям
замещения по связям С-Н
29
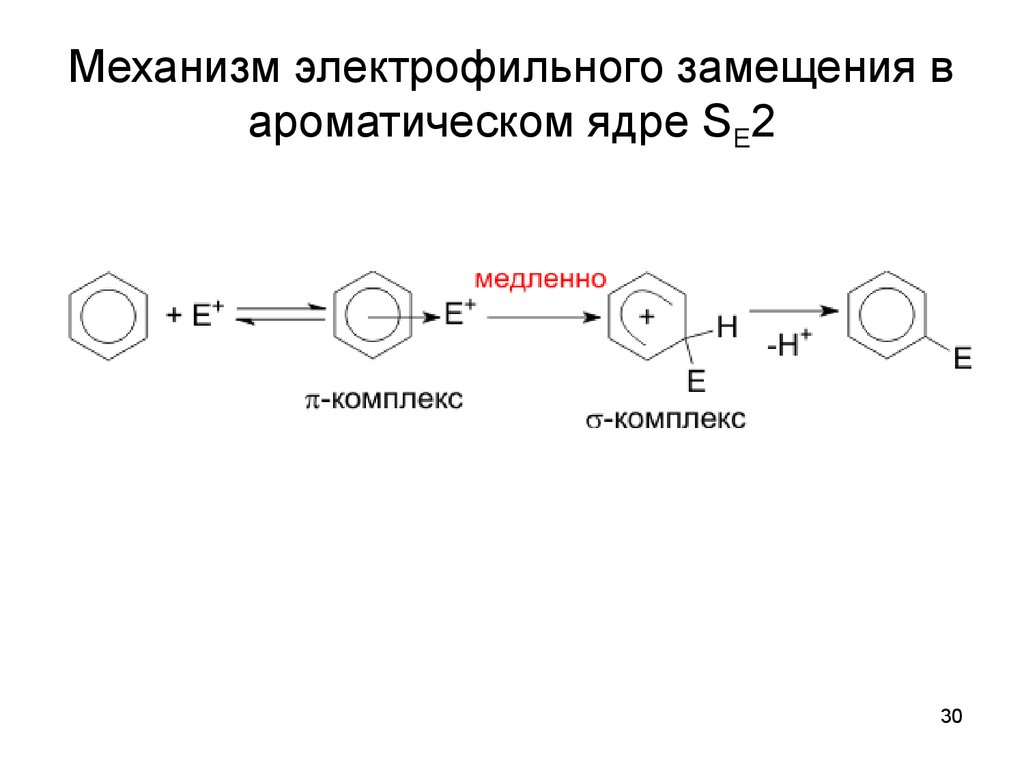
30. Механизм электрофильного замещения в ароматическом ядре SE2
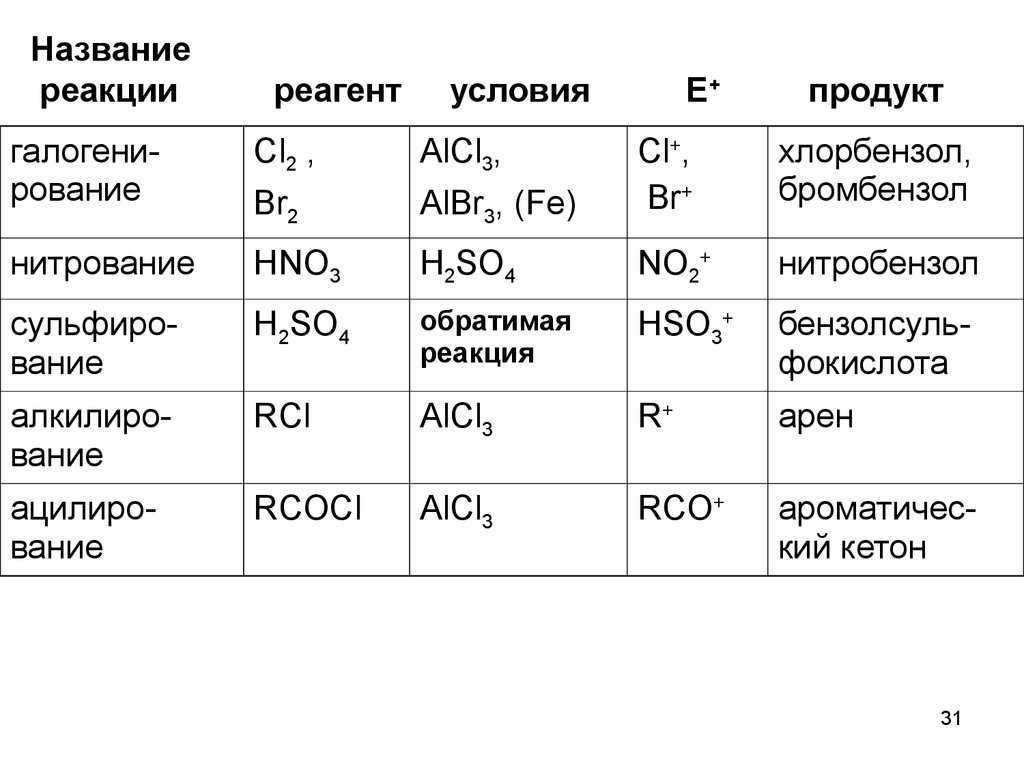
3031.
Названиереакции
реагент
условия
галогенирование
Cl2 ,
AlCl3,
Br2
нитрование
Е+
продукт
AlBr3, (Fe)
Cl+,
Br+
хлорбензол,
бромбензол
HNO3
H2SO4
NO2+
нитробензол
сульфирование
H2SO4
обратимая
реакция
HSO3+
бензолсульфокислота
алкилирование
RCl
AlCl3
R+
арен
ацилирование
RCOCl
AlCl3
RCO+
ароматический кетон
31
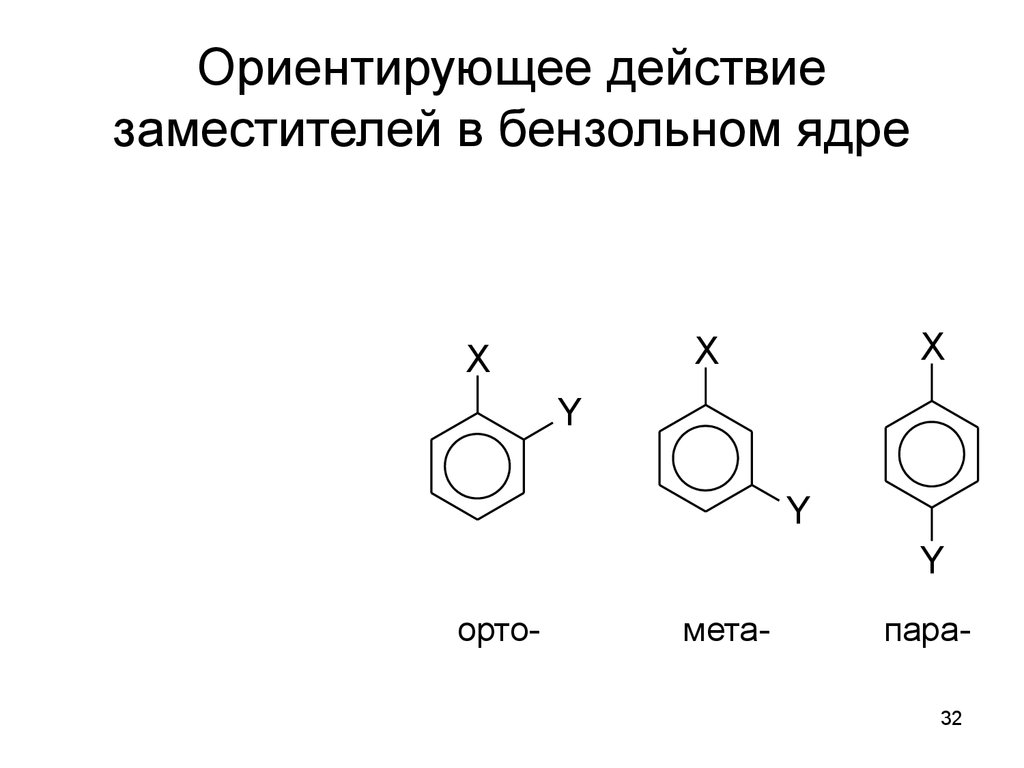
32. Ориентирующее действие заместителей в бензольном ядре
Xî ðòî -
ì åòà-
1
6
2 î ðòî -
5
3
4
X
X
X
Y
ì åòà-
ï àðà-
Y
Y
орто-
мета-
пара32
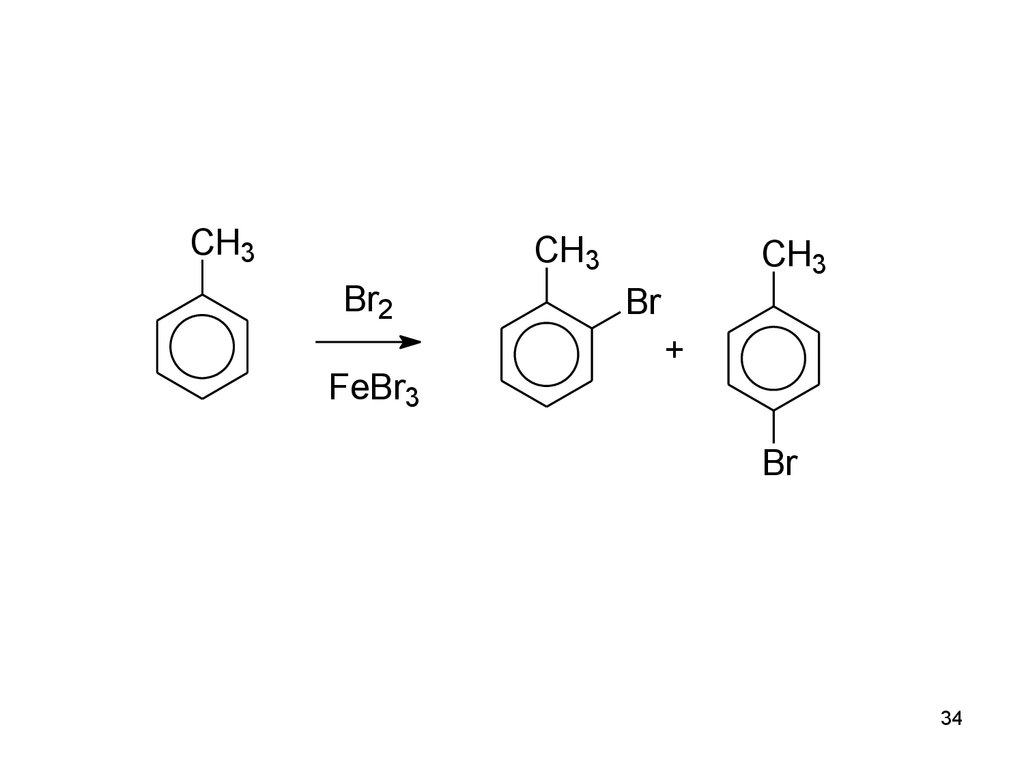
33. Заместители
• I. Активирующие ЭД-заместители. ОблегчаютЭФ-замещение по сравнению с
незамещённым бензолом, и направляют
входящую группу в орто- и пара-положения.
NR2, NHR, NH2, OH, OR, NH C R, O C R, Alk (CH3, C2H5)
O
O
33
34.
CH3CH3
Br2
FeBr3
CH3
Br
+
Br
34
35.
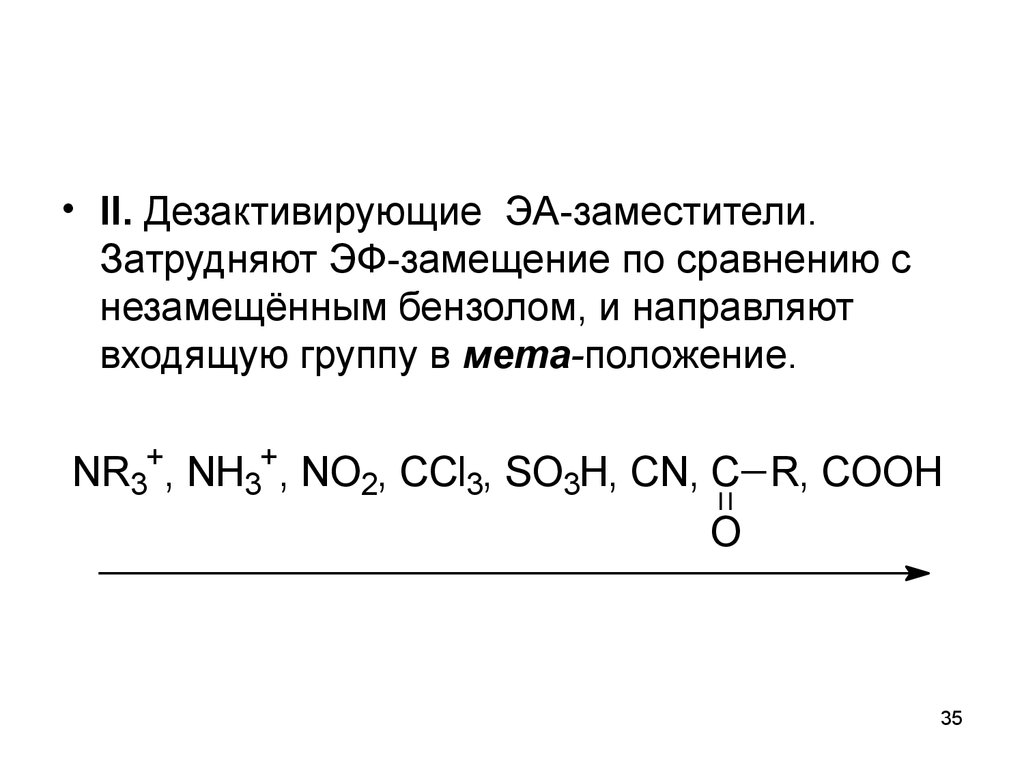
• II. Дезактивирующие ЭА-заместители.Затрудняют ЭФ-замещение по сравнению с
незамещённым бензолом, и направляют
входящую группу в мета-положение.
NR3+, NH3+, NO2, CCl3, SO3H, CN, C R, COOH
O
35
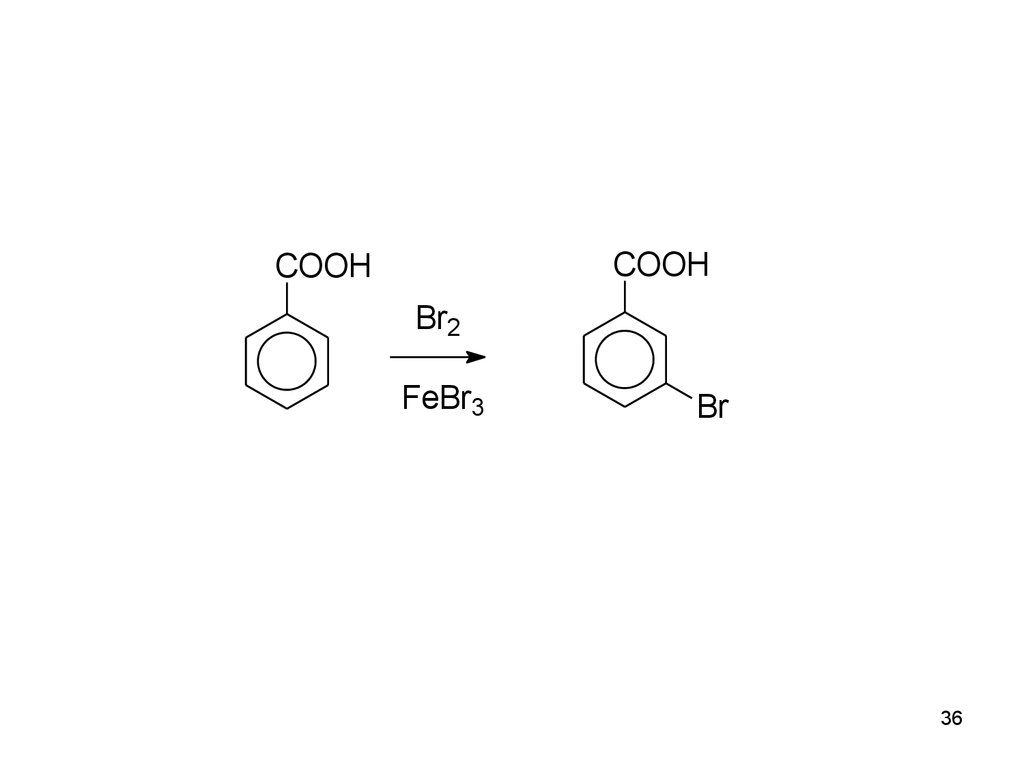
36.
COOHCOOH
Br2
FeBr3
Br
36
37.
• III. Дезактивирующие орто- и параориентанты: F, Cl, Br, I(-I), (+C)
37
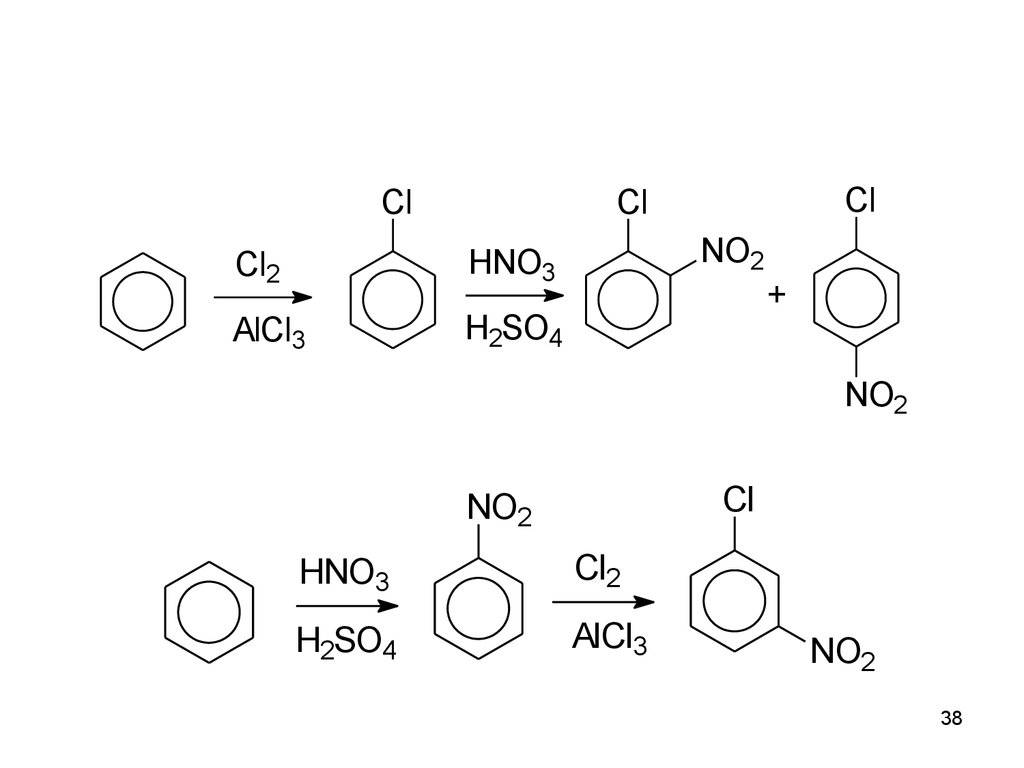
38.
ClCl
Cl
Cl2
HNO3
AlCl3
H2SO4
NO2
+
NO2
Cl
NO2
HNO3
Cl2
H2SO4
AlCl3
NO2
38
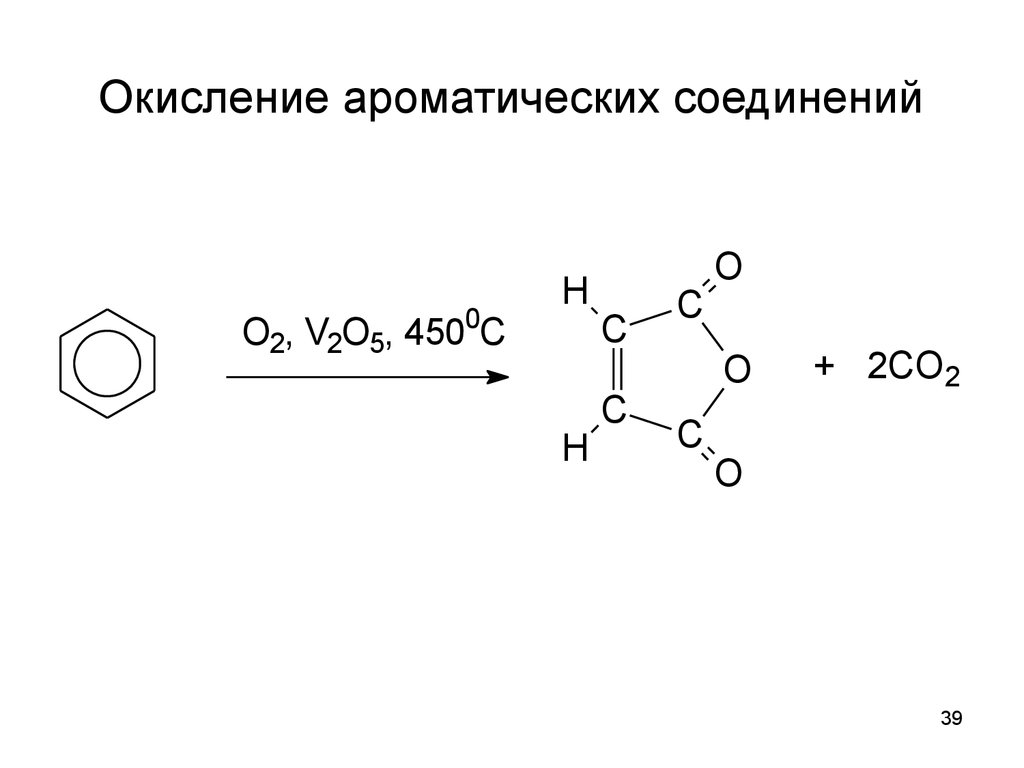
39. Окисление ароматических соединений
0O2, V2O5, 450 C
H
H
C
C
C
O
O
C
+ 2CO2
O
ì àëåèí î âû é
àí ãèäðèä
39
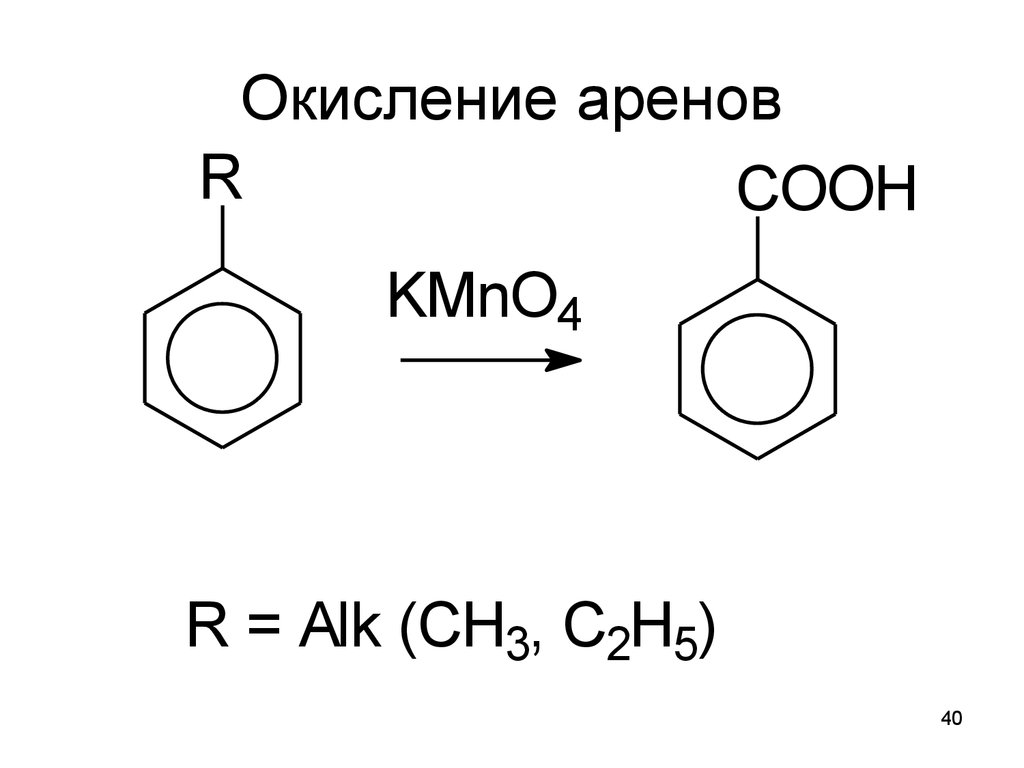
40. Окисление аренов
RCOOH
KMnO4
R = Alk (CH3, C2H5)
40
41.
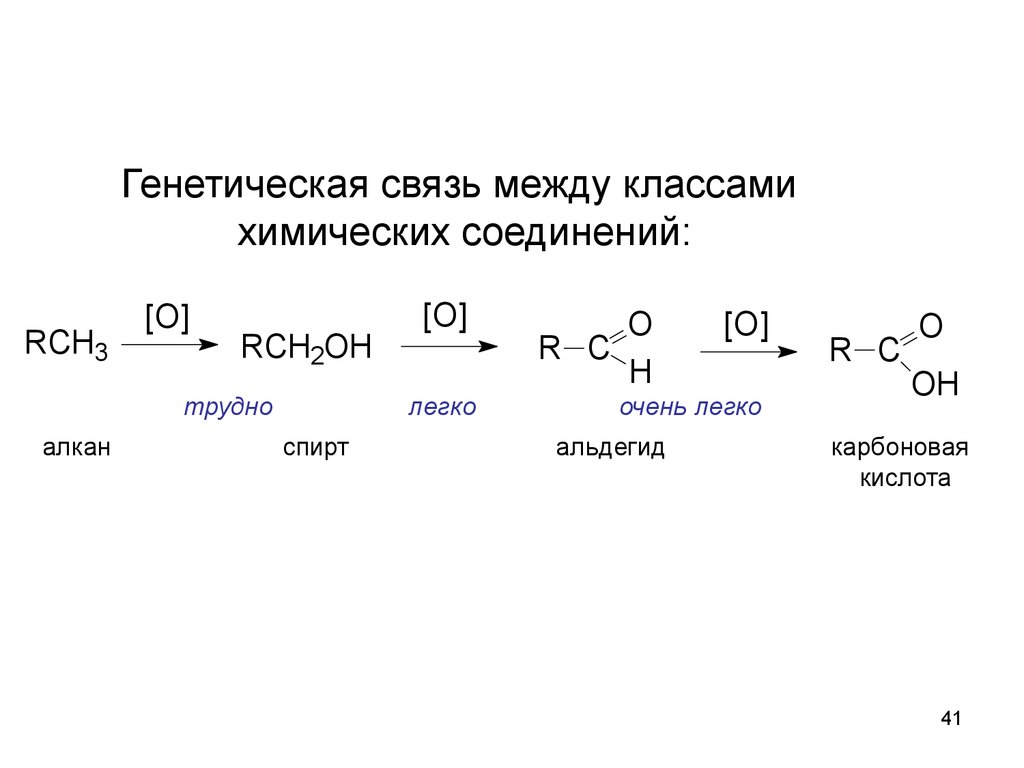
Генетическая связь между классамихимических соединений:
RCH3
[O]
RCH2OH
трудно
алкан
[O]
легко
спирт
O
R C
H
[O]
очень легко
альдегид
R C
O
OH
карбоновая
кислота
41
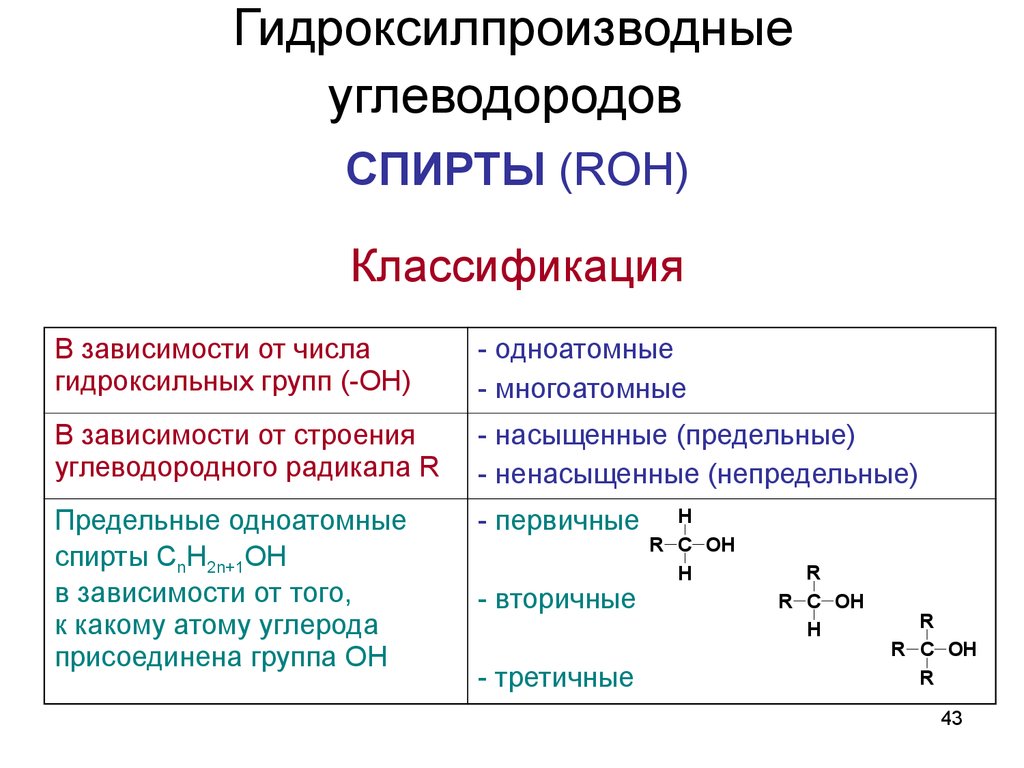
42. Гидроксилпроизводные углеводородов
Спирты. Фенолы.42
43. Гидроксилпроизводные углеводородов
СПИРТЫ (ROH)Классификация
В зависимости от числа
гидроксильных групп (-OH)
- одноатомные
- многоатомные
В зависимости от строения
углеводородного радикала R
- насыщенные (предельные)
- ненасыщенные (непредельные)
Предельные одноатомные
спирты CnH2n+1OH
в зависимости от того,
к какому атому углерода
присоединена группа OH
- первичные
- вторичные
- третичные
H
R C OH
H
R
R C OH
H
R
R C OH
R
43
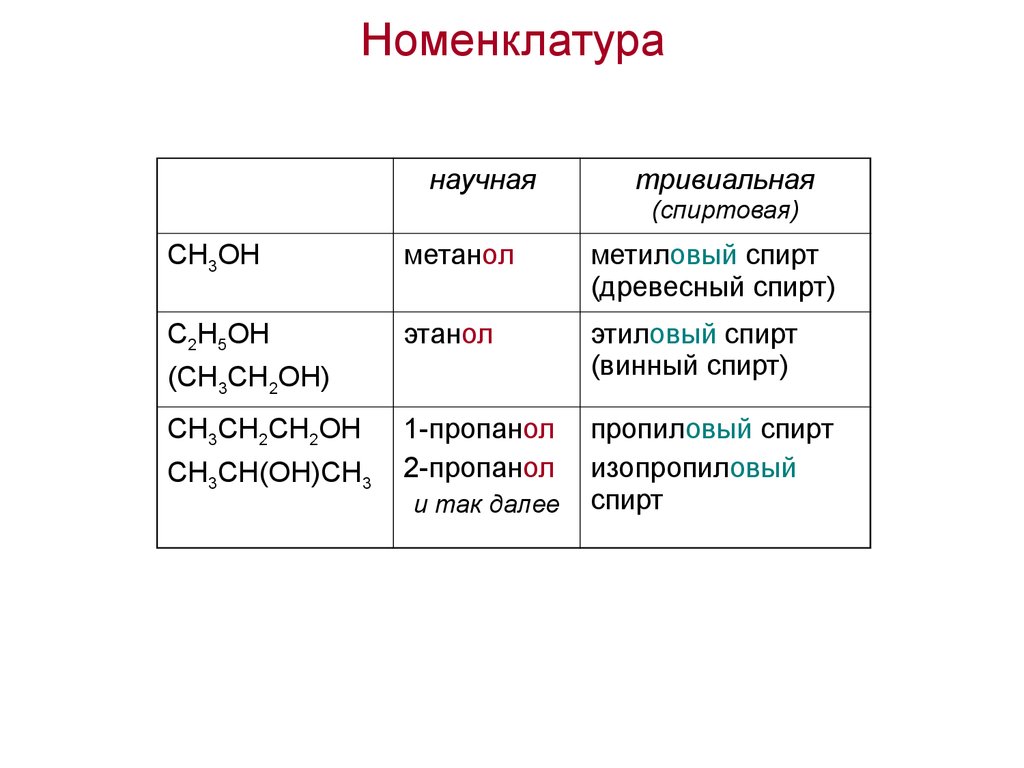
44. Номенклатура
научнаятривиальная
(спиртовая)
CH3OH
метанол
метиловый спирт
(древесный спирт)
C2H5OH
этанол
этиловый спирт
(винный спирт)
1-пропанол
2-пропанол
пропиловый спирт
изопропиловый
спирт
(CH3CH2OH)
CH3CH2CH2OH
CH3CH(OH)CH3
и так далее
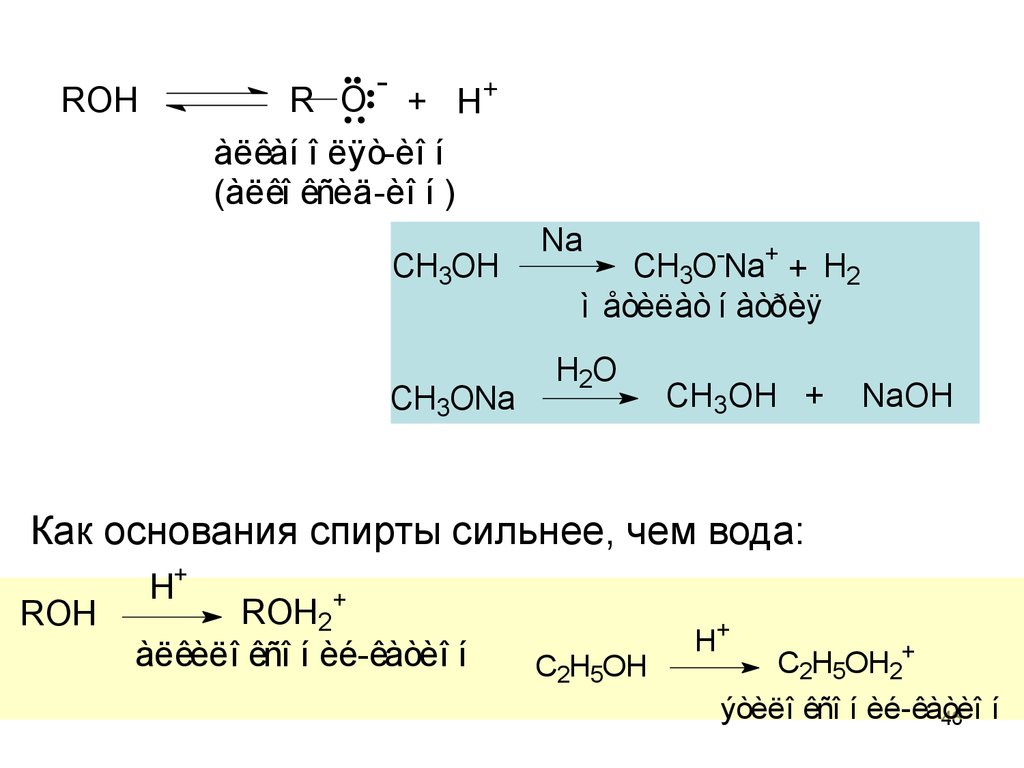
45. Химические свойства спиртов
I. Реакции с сохранением атома кислорода в
молекуле спирта
1) кислотно-основные свойства спиртов.
Спирты – производные воды, обладают слабо
выраженными кислотными и основными свойствами.
45
46.
-+ H+
àëêàí î ëÿò-èî í
(àëêî êñèä-èî í )
R O
ROH
CH3OH
CH3ONa
Na
CH3O-Na+ + H2
ì åòèëàò í àòðèÿ
H2O
CH3OH +
NaOH
Как основания спирты сильнее, чем вода:
ROH
H+
ROH2+
àëêèëî êñî í èé-êàòèî í
C2H5OH
H+
C2H5OH2+
ýòèëî êñî í èé-êàòèî
46 í
47.
2) образование простых эфиров через алканолятыNaCl + CH3 O CH2 CH3
CH3ONa + CH3CH2Cl
ì åòèëýòèëî âû é ýô èð
3) образование сложных эфиров карбоновых кислот
CH3OH
+
CH3 C
ì åòèëî âû é
ñï èðò
O
H2SO4 êî í ö.
CH3 C O CH3
O
ì åòèëî âû é ýô èð óêñóñí î é êèñëî òû
(ì åòèëàöåòàò)
H2O +
OH
óêñóñí àÿ
êèñëî òà
4) окисление
CH3CH2OH
[O]
CH3 CH OH
O H
-H2O
CH3 C
O
H
[O]
CH3 C
O
OH
í åñòàáèëüí î å
ñî åäèí åí èå
CH3 CH CH3
OH
[O]
CH3 C
O
CH3
47
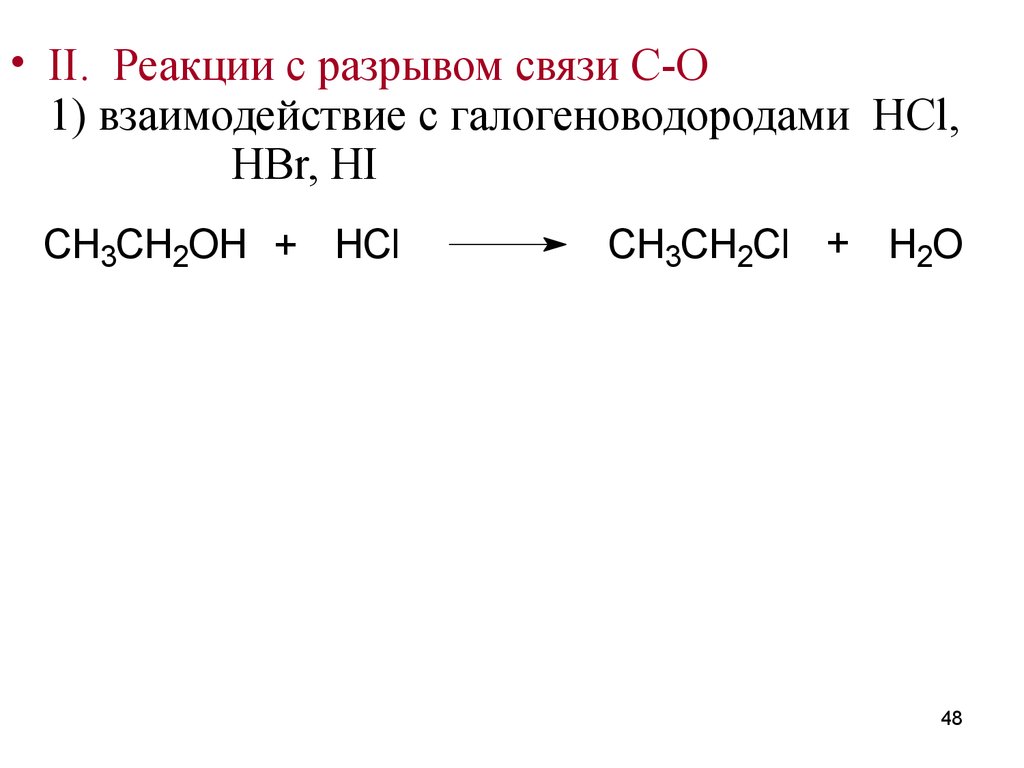
48.
• II. Реакции с разрывом связи C-O1) взаимодействие с галогеноводородами HCl,
HBr, HI
CH3CH2OH + HCl
CH3CH2Cl + H2O
48
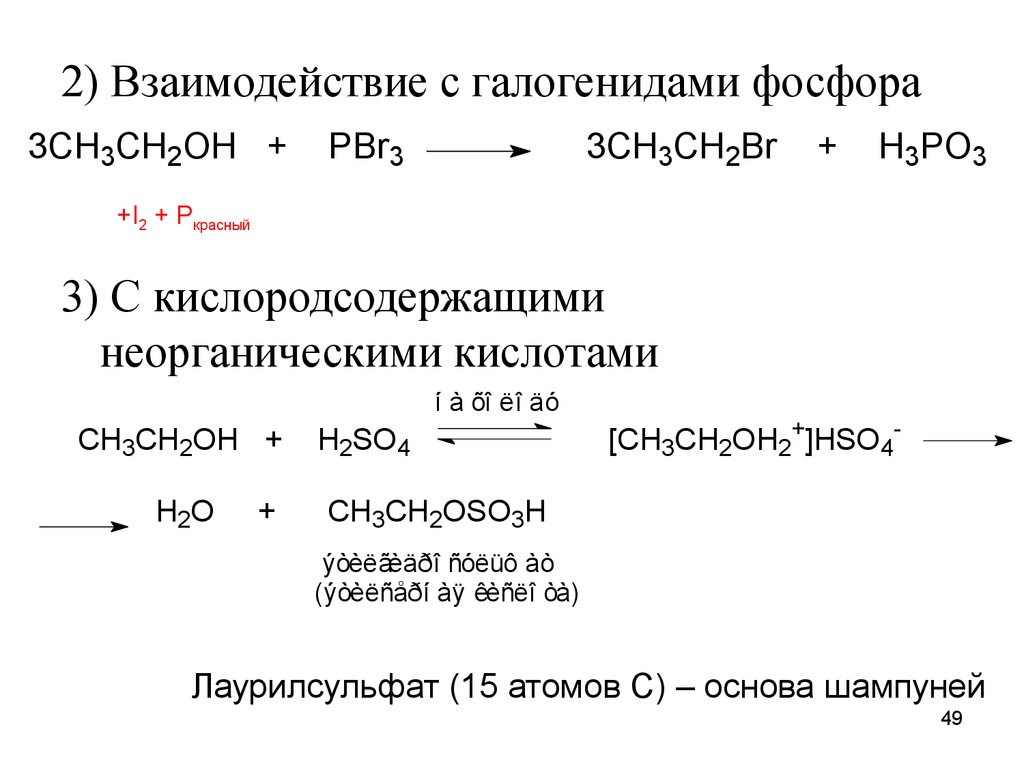
49.
2) Взаимодействие с галогенидами фосфора3CH3CH2OH +
PBr3
3CH3CH2Br
+
H3PO3
+I2 + Pкрасный
3) С кислородсодержащими
неорганическими кислотами
í à õî ëî äó
CH3CH2OH +
H2O
+
H2SO4
[CH3CH2OH2+]HSO4-
CH3CH2OSO3H
ýòèëãèäðî ñóëüô àò
(ýòèëñåðí àÿ êèñëî òà)
Лаурилсульфат (15 атомов С) – основа шампуней
49
50.
4) образование простых эфиров(межмолекулярное отщепление H2O)
2CH3CH2OH
èçáû òî ê
ñï èðòà
H2SO4
~1400C
H2O +
CH3-CH2-O-CH2-CH3
äèýòèëî âû é ýô èð
5) дегидратация (внутримолекулярное
отщепление H2O)
ÑH3CH2OH
H2SO4
t0
ì í î ãî êèñëî òû
H2O + CH2=CH2
50
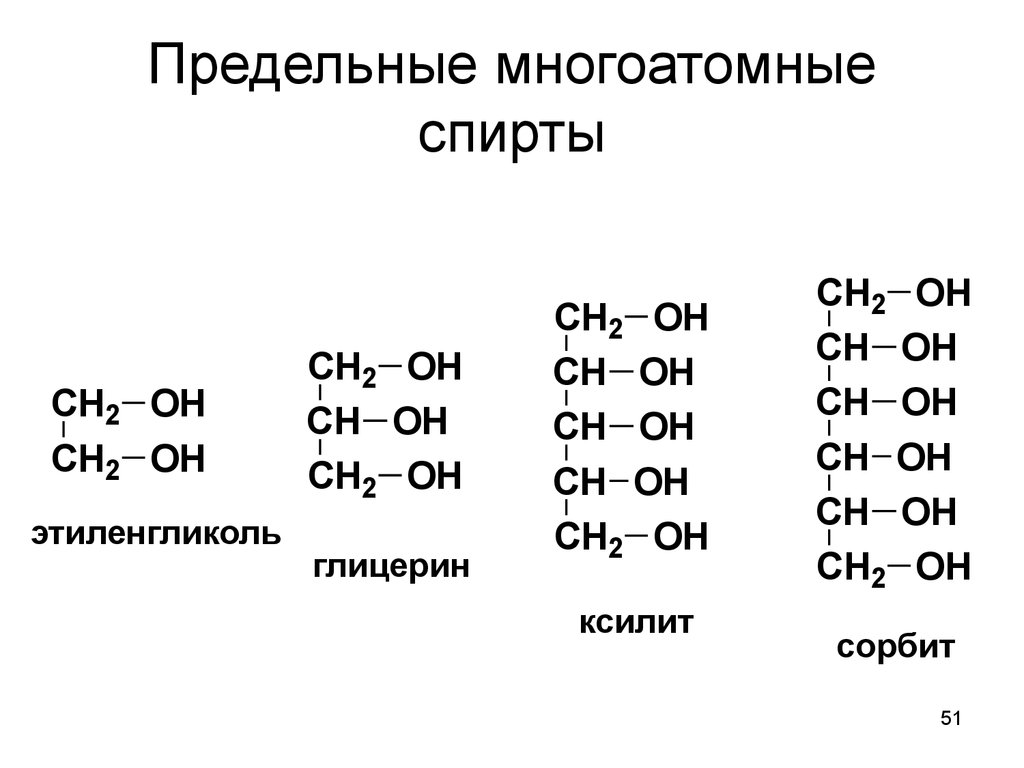
51. Предельные многоатомные спирты
CH2 OHCH2 OH
этиленгликоль
CH2 OH
CH OH
CH2 OH
глицерин
CH2 OH
CH OH
CH OH
CH OH
CH2 OH
ксилит
CH2 OH
CH OH
CH OH
CH OH
CH OH
CH2 OH
сорбит
51
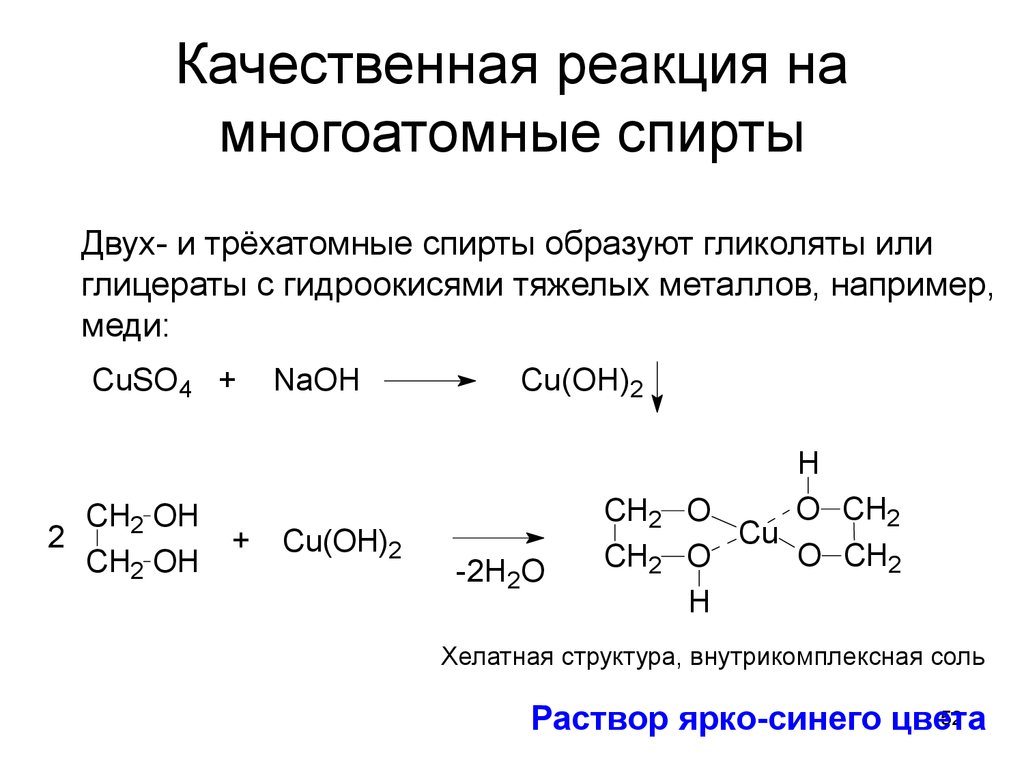
52. Качественная реакция на многоатомные спирты
Двух- и трёхатомные спирты образуют гликоляты илиглицераты с гидроокисями тяжелых металлов, например,
меди:
CuSO4 +
CH2 OH
2
CH2 OH
+
NaOH
Cu(OH)2
Cu(OH)2
-2H2O
CH2
CH2
H
O CH2
O
Cu
O CH2
O
H
Хелатная структура, внутрикомплексная соль
52
Раствор ярко-синего цвета
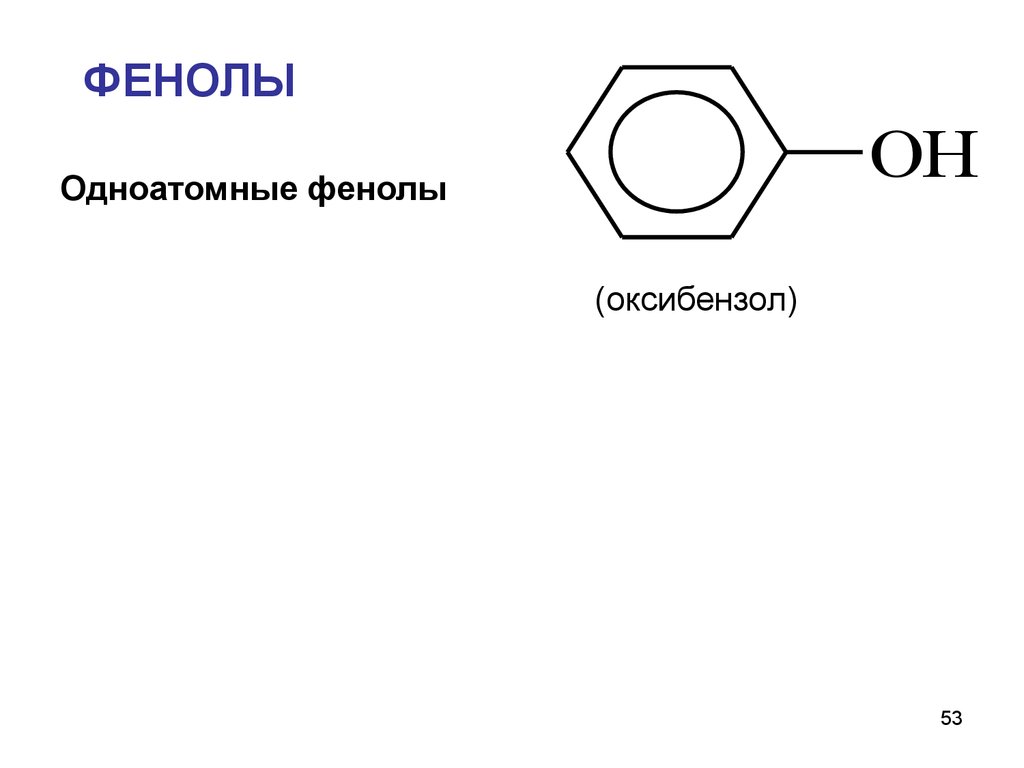
53.
ФЕНОЛЫOH
Одноатомные фенолы
(оксибензол)
53
54. Химические свойства фенолов
5455. I. Реакции электрофильного замещения (SE) (характерны для ароматического ядра) OH – электронодонор
1. ГалогенированиеBr
OH
+
3Br2
OH
H2O
áðî ì í àÿ âî äà
Br
+ 3HBr
Br
2,4,6-òðèáðî ì ô åí î ë
áåëû é î ñàäî ê
OH
 âî äå:
O-
O- >> OH
ï î ýëåêòðî í î äî í î ðí î ì ó
äåéñòâèþ
55
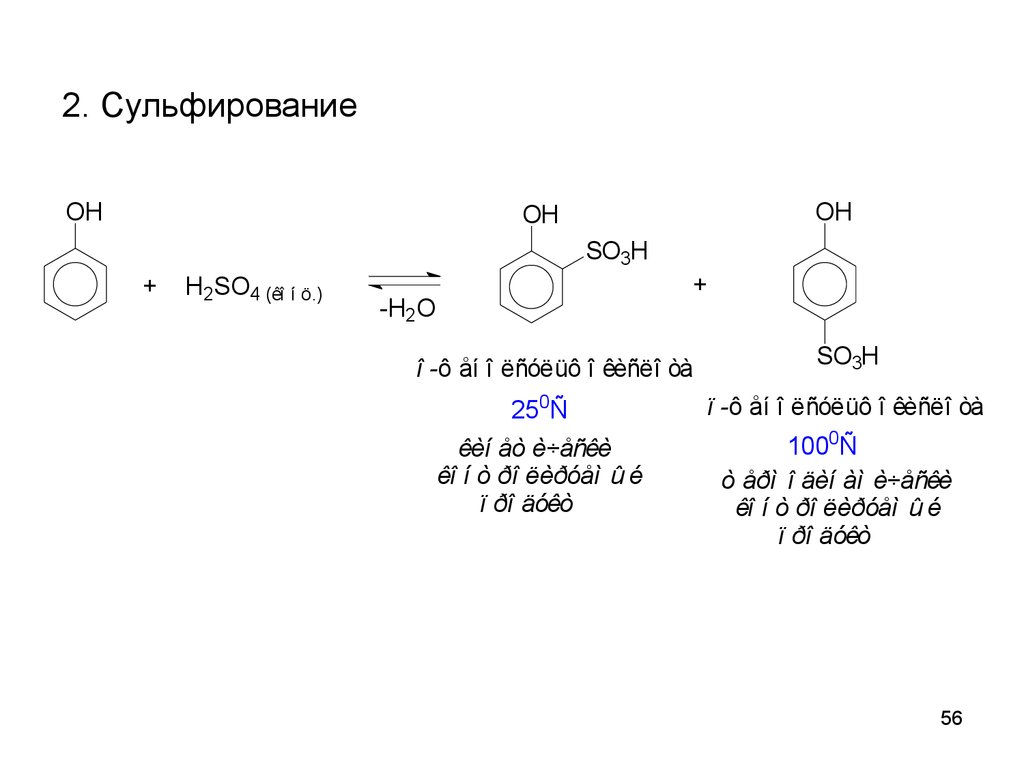
56.
2. СульфированиеOH
OH
OH
SO3H
+
H2SO4 (êî í ö.)
+
-H2O
î -ô åí î ëñóëüô î êèñëî òà
250Ñ
êèí åò è÷åñêè
êî í ò ðî ëèðóåì û é
ï ðî äóêò
SO3H
ï -ô åí î ëñóëüô î êèñëî òà
1000Ñ
ò åðì î äèí àì è÷åñêè
êî í ò ðî ëèðóåì û é
ï ðî äóêò
56
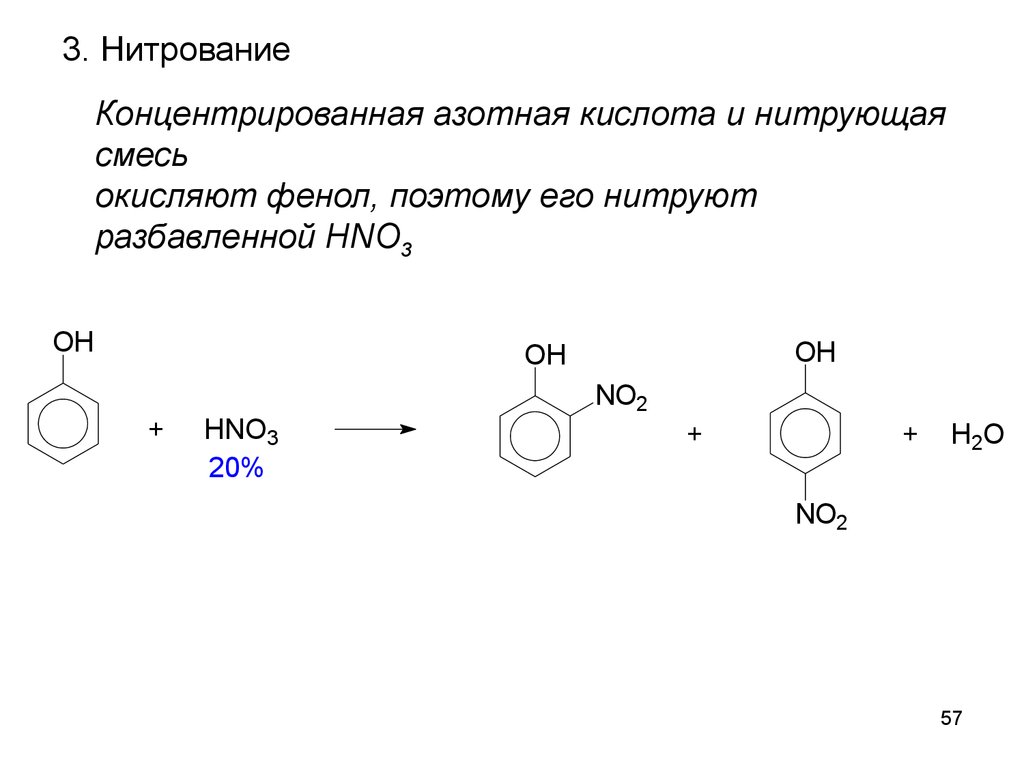
57.
3. НитрованиеКонцентрированная азотная кислота и нитрующая
смесь
окисляют фенол, поэтому его нитруют
разбавленной HNO3
OH
OH
OH
+
HNO3
20%
NO2
+
+
H 2O
NO2
57
58.
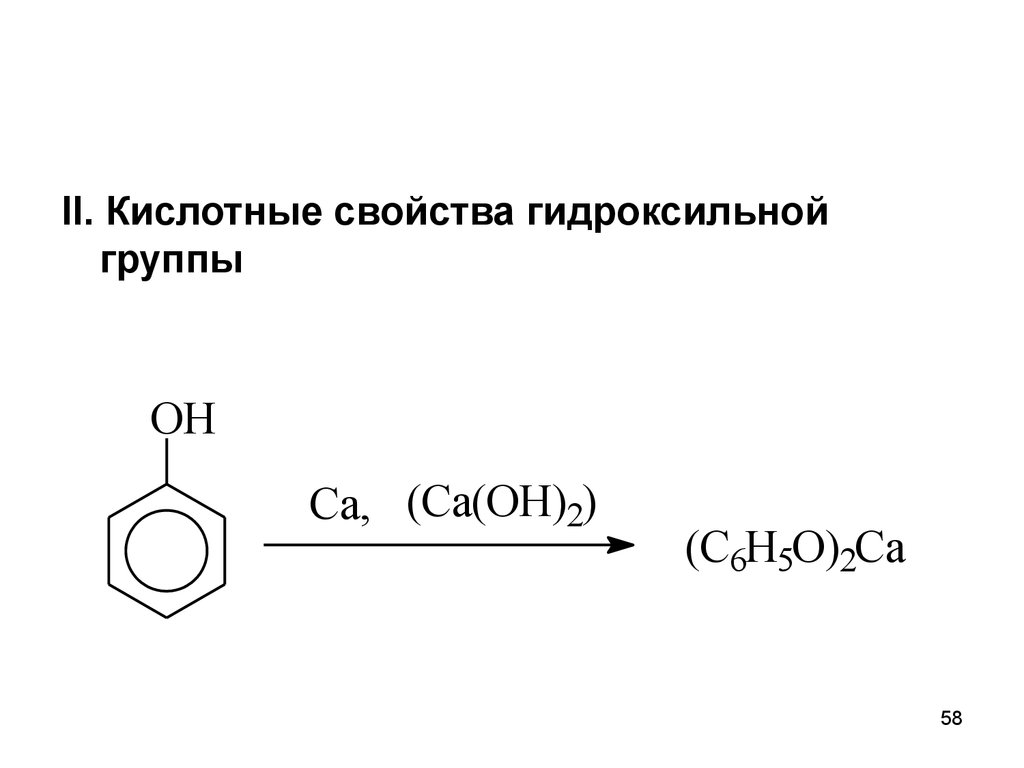
II. Кислотные свойства гидроксильнойгруппы
OH
Ca, (Ca(OH)2)
(C6H5O)2Ca
58
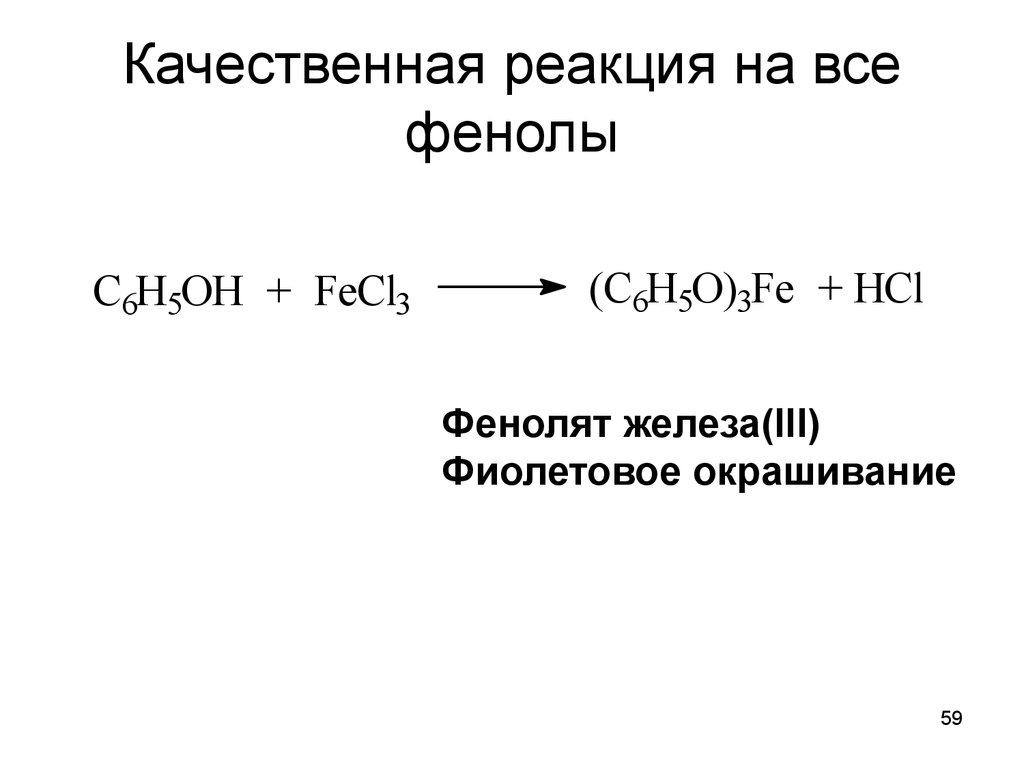
59. Качественная реакция на все фенолы
C6H5OH + FeCl3(C6H5O)3Fe + HCl
Фенолят железа(III)
Фиолетовое окрашивание
59
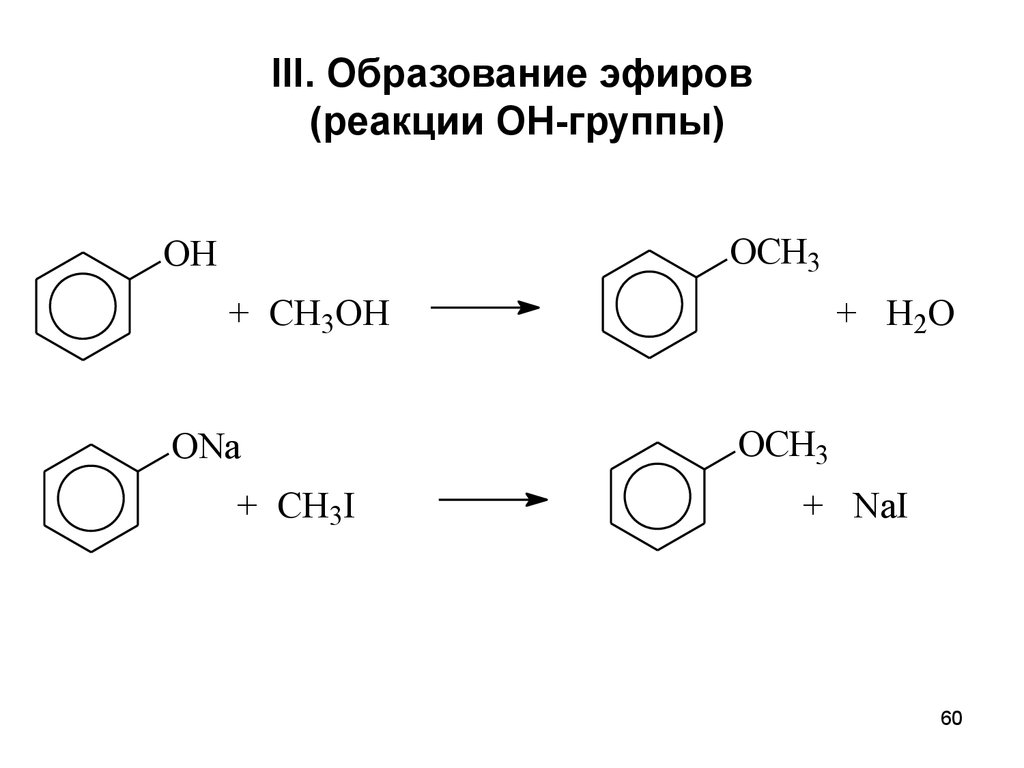
60. III. Образование эфиров (реакции ОН-группы)
OCH3OH
+ CH3OH
ONa
+ CH3I
+ H2O
OCH3
+ NaI
60
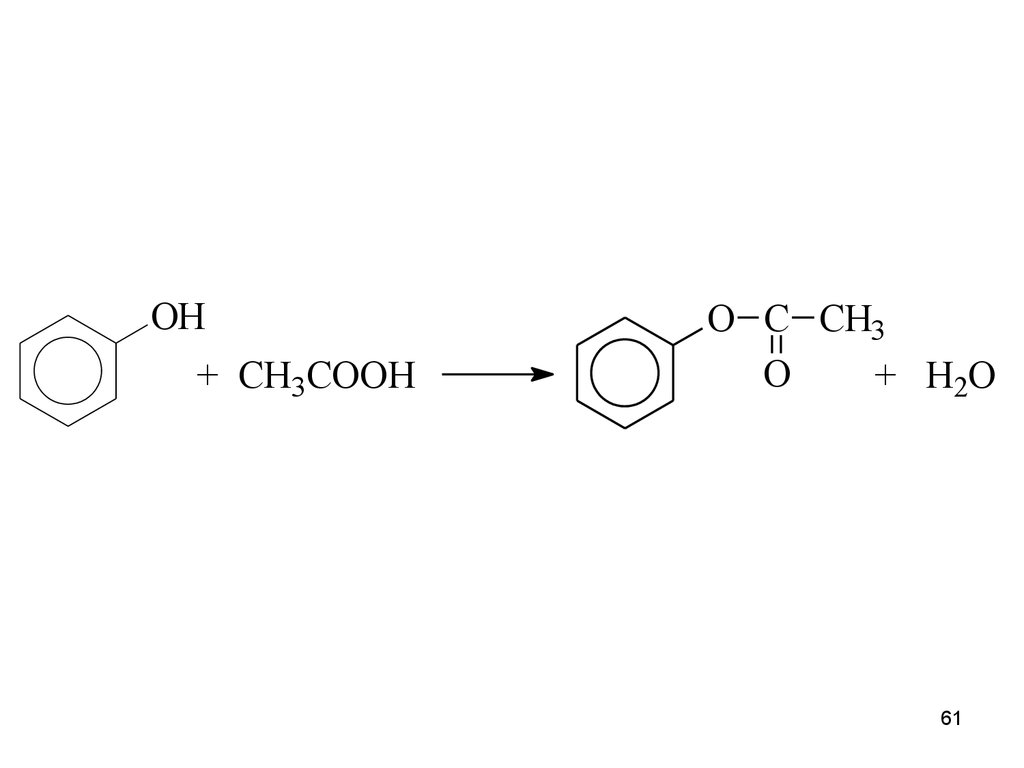
61.
OH+ CH3COOH
O C CH3
O
+ H2O
61
62.
ПРОСТЫЕ ЭФИРЫR-O-R, Ar-O-R, Ar-O-Ar
(Ar – ароматический радикал)
CH3 O CH3
äèì åòèëî âû é ýô èð
(ãàç)
C2H5 O C2H5
äèýòèëî âû é ýô èð
(têèï åí èÿ = 360Ñ)
CH3 O C2H5
ì åòèëýòèëî âû é ýô èð
O
äèô åí èëî âû é ýô èð
(òâåðäî å âåù åñòâî )
Изомерны соответствующим спиртам
62
63.
Малореакционноспособные соединения.Устойчивы к гидролизу, действию
разбавленных кислот,
сильных оснований.
63
64. Карбонильные производные
6465.
OR C
H
O
R C
R
65
66.
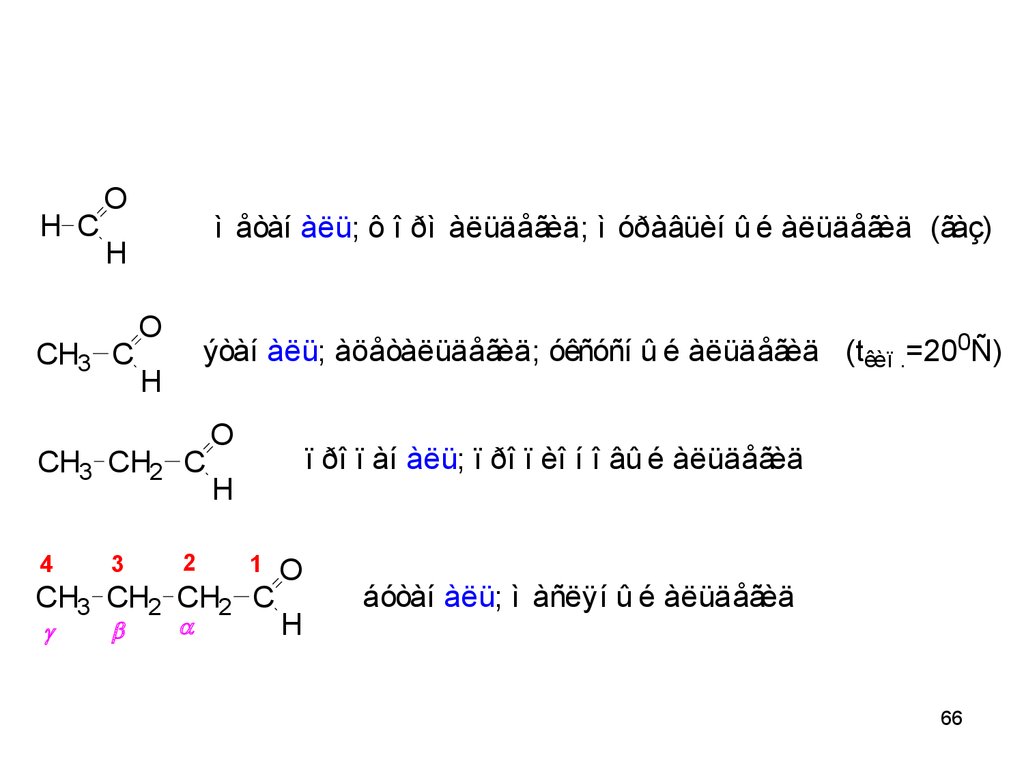
H CO
ì åòàí àëü; ô î ðì àëüäåãèä; ì óðàâüèí û é àëüäåãèä (ãàç)
H
CH3 C
O
ýòàí àëü; àöåòàëüäåãèä; óêñóñí û é àëüäåãèä (têèï .=200Ñ)
H
CH3 CH2 C
4
3
2
O
ï ðî ï àí àëü; ï ðî ï èî í î âû é àëüäåãèä
H
1
CH3 CH2 CH2 C
O
H
áóòàí àëü; ì àñëÿí û é àëüäåãèä
66
67.
- ароматические альдегидыO
C
H
бензальдегид
67
68.
- алифатические кетоны СnH2nOCH3 C CH3
O
ï ðî ï àí î í ; äèì åòèëêåòî í ; àöåòî í
CH3 CH2 CH2 C CH3
O
2-ï åí òàí î í ; ì åòèëï ðî ï èëêåòî í
CH3 CH2 C CH3
O
áóòàí î í ; ì åòèëýòèëêåòî í
CH2 C CH3
O
1-ô åí èë-2-ï ðî ï àí î í ; ì åòèëáåí çèëêåòî í
68
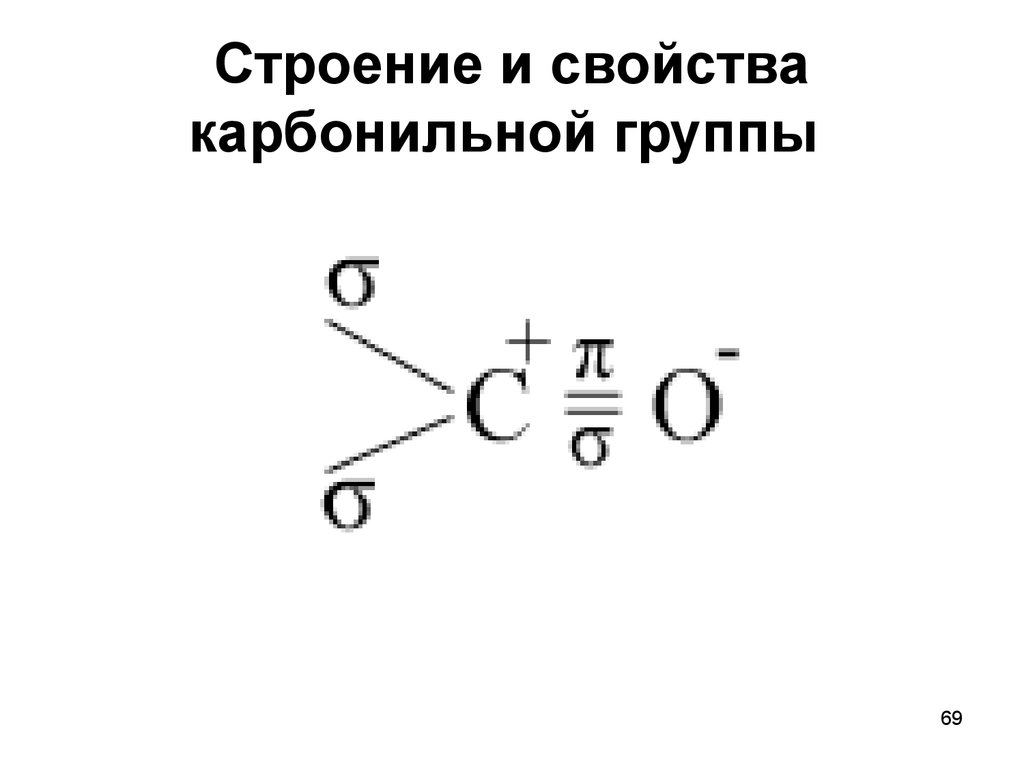
69. Строение и свойства карбонильной группы
6970. Химические свойства альдегидов и кетонов
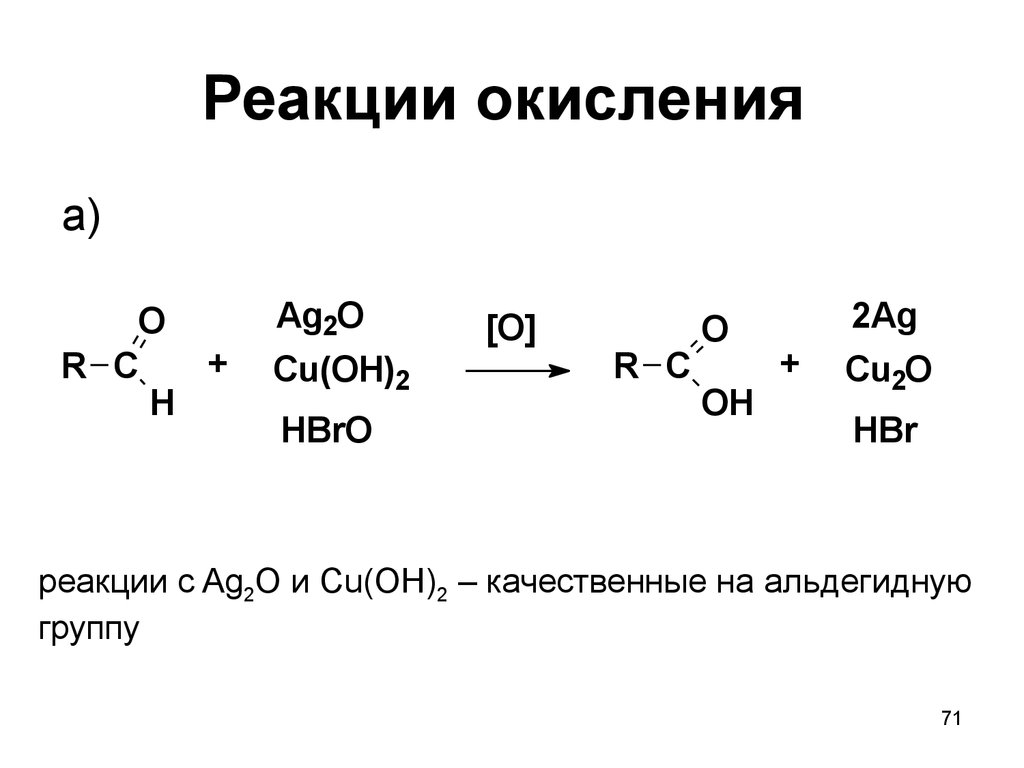
7071. Реакции окисления
a)O
+
R C
H
Ag2O
Cu(OH)2
HBrO
[O]
R C
O
OH
2Ag
+
Cu2O
HBr
реакции с Ag2O и Cu(OH)2 – качественные на альдегидную
группу
71
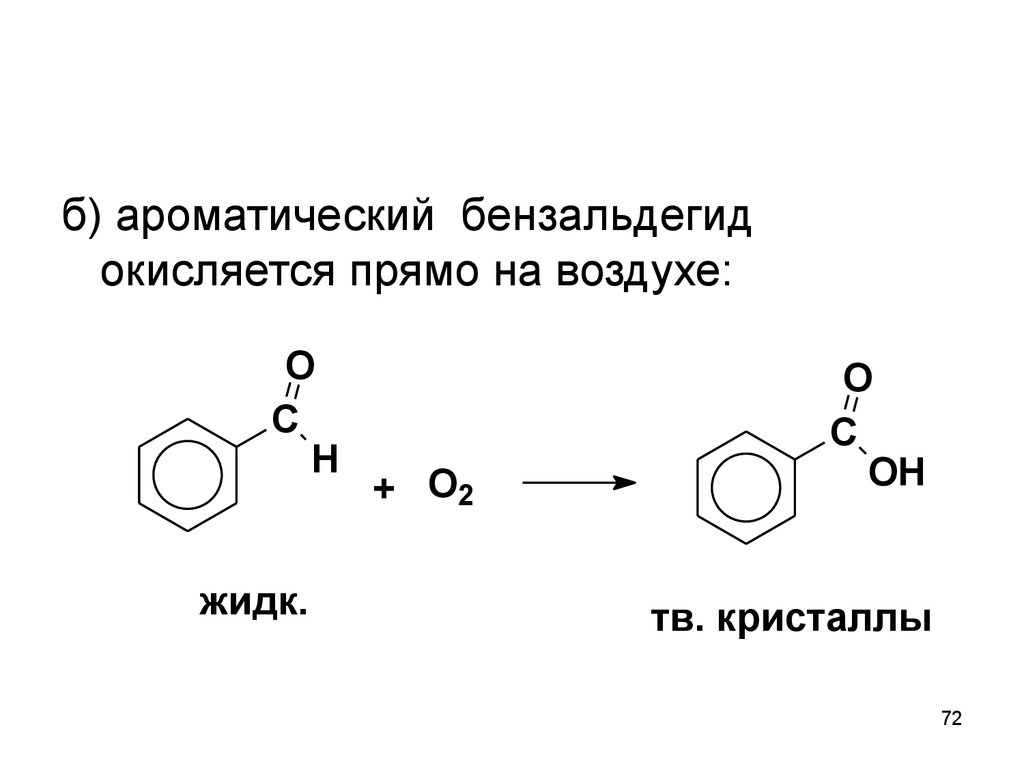
72.
б) ароматический бензальдегидокисляется прямо на воздухе:
O
C
H
жидк.
+ O2
O
C
OH
тв. кристаллы
72
73.
в) кетоны не окисляются, а в жесткихусловиях разрушаются.
73
74.
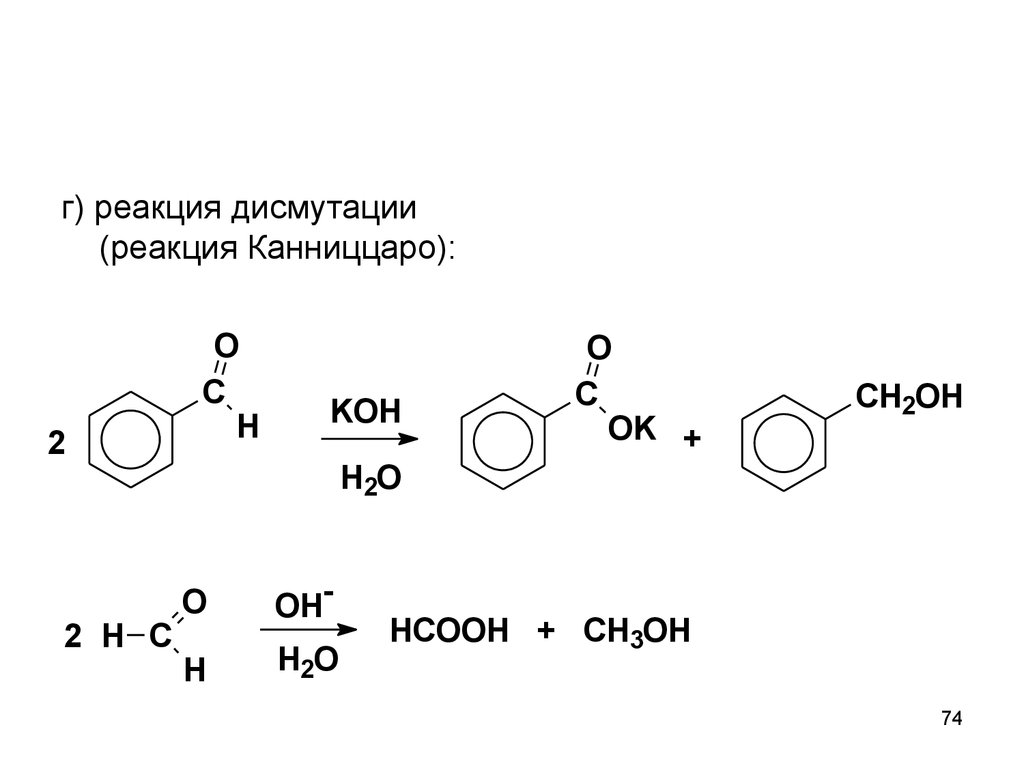
г) реакция дисмутации(реакция Канниццаро):
2
2 H C
O
C
H
KOH
O
C
OK +
CH2OH
H2O
O
OH-
H
H2O
HCOOH + CH3OH
74
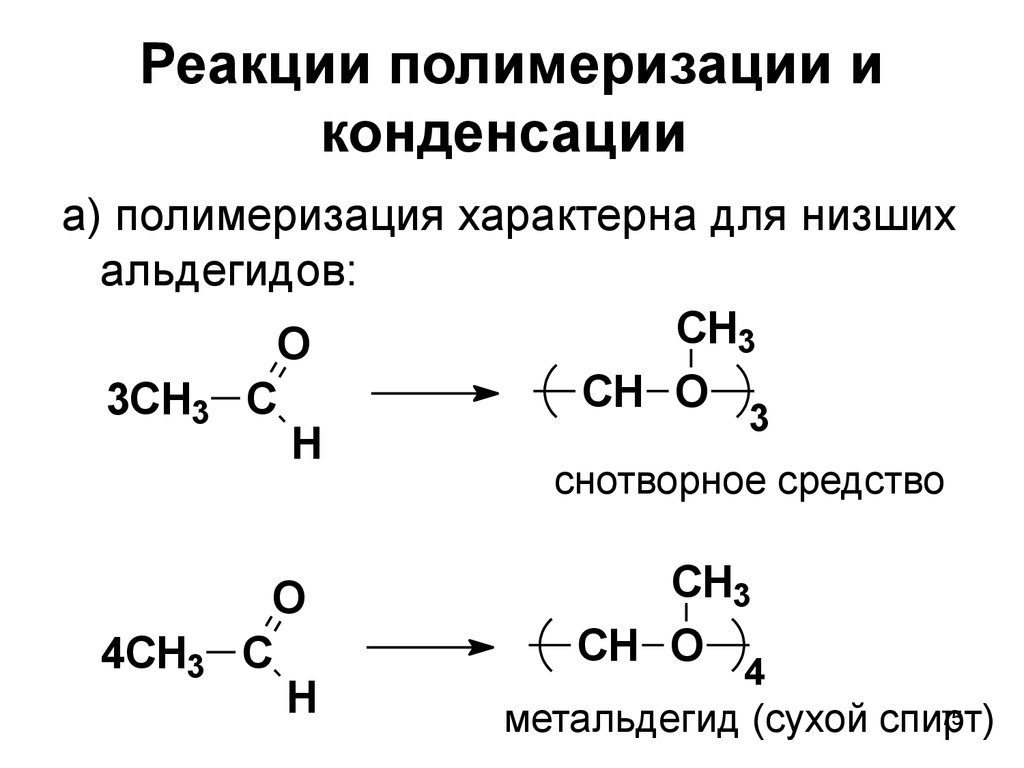
75. Реакции полимеризации и конденсации
а) полимеризация характерна для низшихальдегидов:
CH3
O
CH O
3CH3 C
3
H
снотворное средство
4CH3
O
C
H
CH3
CH O
4
75
метальдегид (сухой спирт)
76.
б) сложно-эфирная конденсация (реакцияТищенко):
2CH3
C
O
H
(C2H5O)3Al
CH3
C O C 2H5
O
76
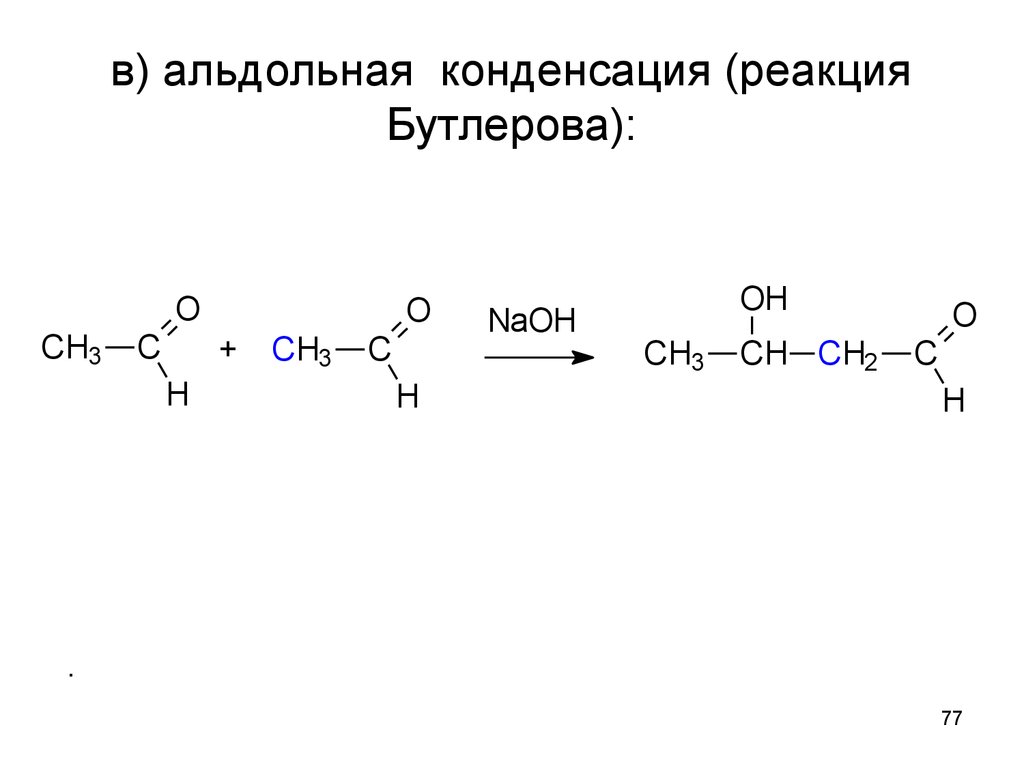
77. в) альдольная конденсация (реакция Бутлерова):
OCH3
C
O
+
H
CH3
C
H
NaOH
OH
CH3
CH CH2
O
C
H
.
77
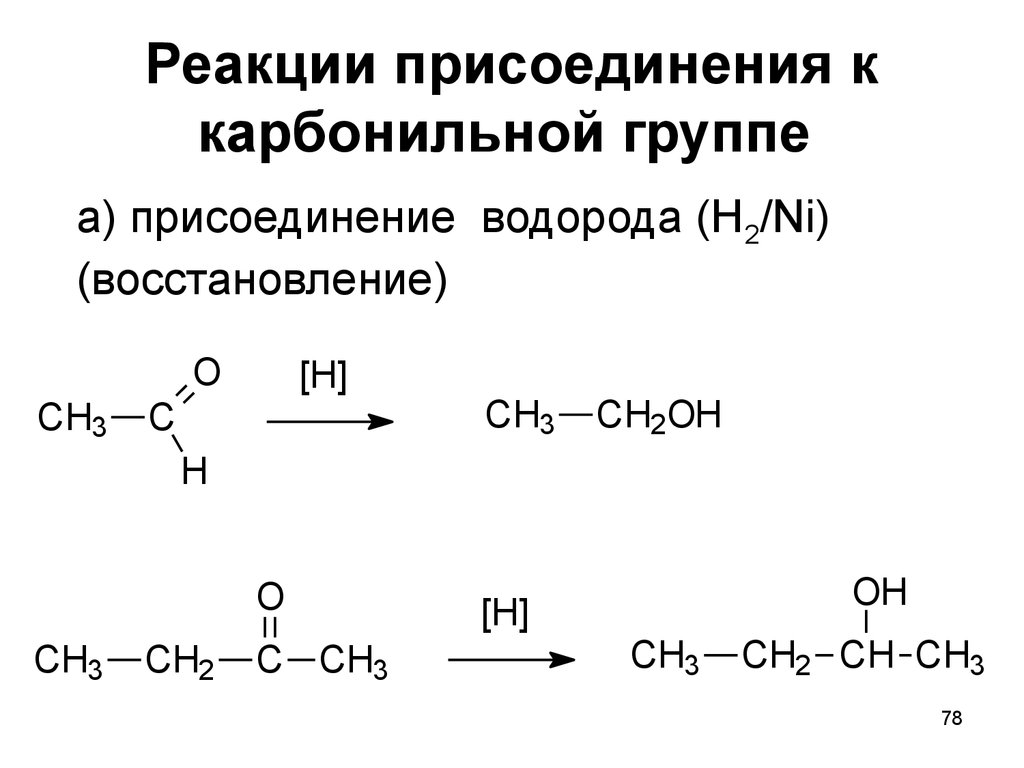
78. Реакции присоединения к карбонильной группе
а) присоединение водорода (H2/Ni)(восстановление)
O
CH3
[H]
C
CH3
CH2OH
H
O
CH3
CH2
C CH3
OH
[H]
CH3
CH2 CH CH3
78
79.
б) +HCNHCN – очень слабая кислота. Анион любой слабой
кислоты является сильным нуклеофилом.
OH
O
C
H
O
CH3
C
CH3
C CN
HCN
H
HCN
OH
CH3
C CN
H
79
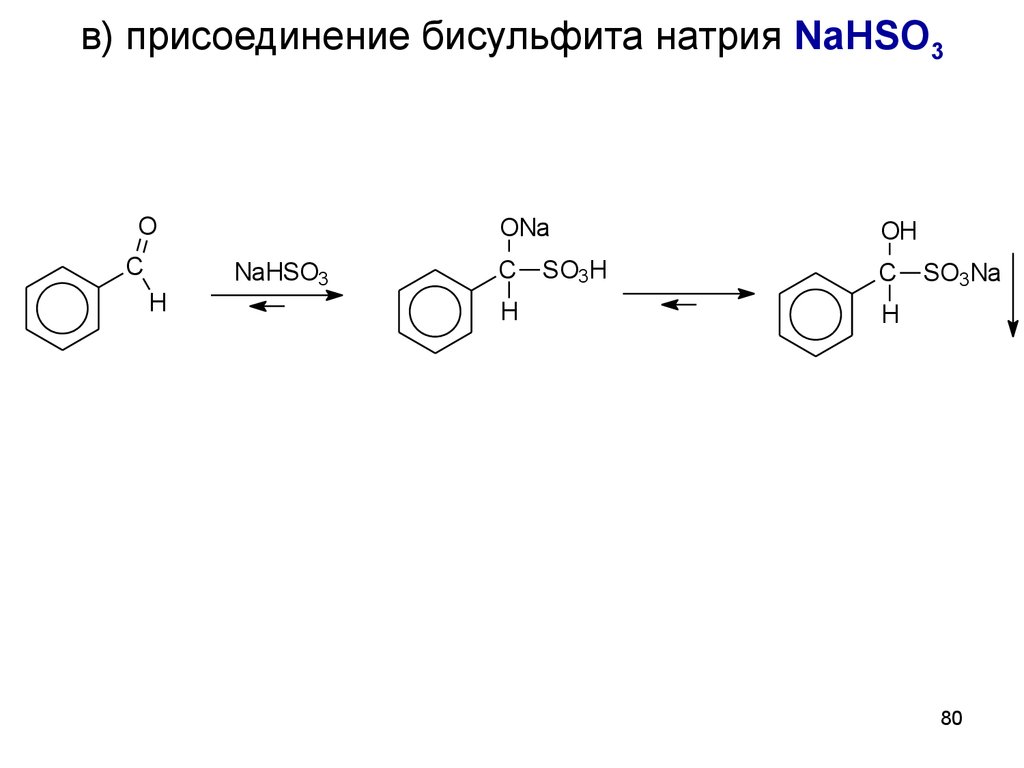
80. в) присоединение бисульфита натрия NaHSO3
OC
H
NaHSO3
ONa
OH
C
C
H
SO3H
SO3Na
H
.
80
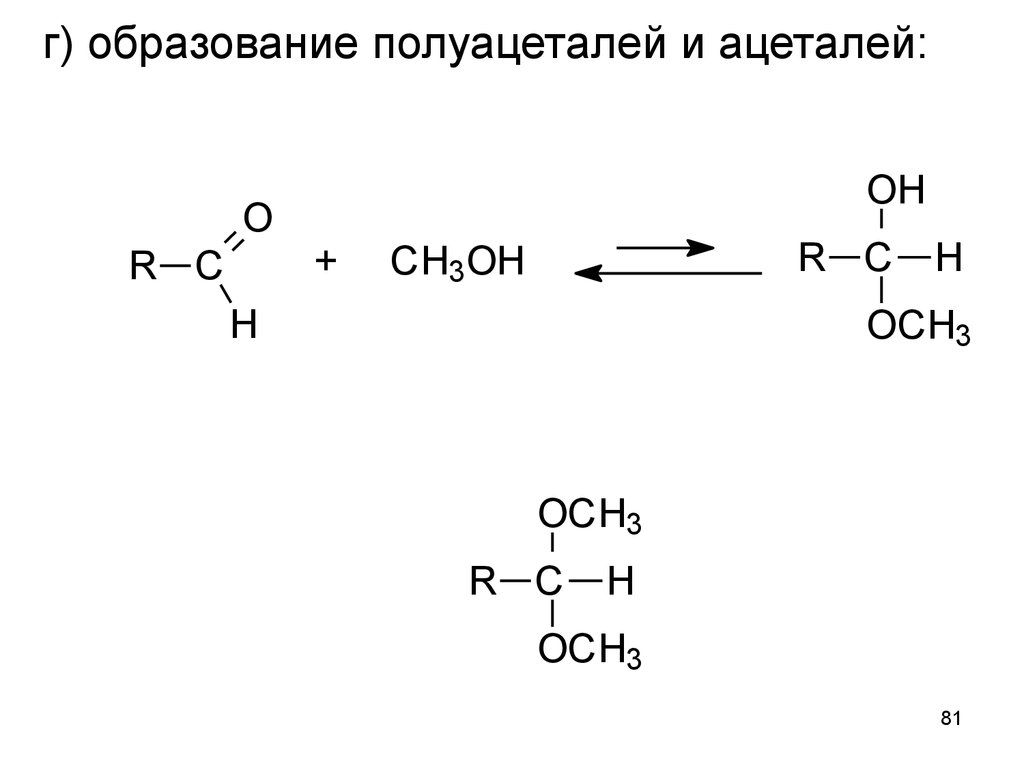
81. г) образование полуацеталей и ацеталей:
OR C
OH
+
R C
CH3OH
H
H
OCH3
OCH3
R C
H
OCH3
81
82.
д) аналогично для кетонов идетобразование полукеталей и кеталей
82
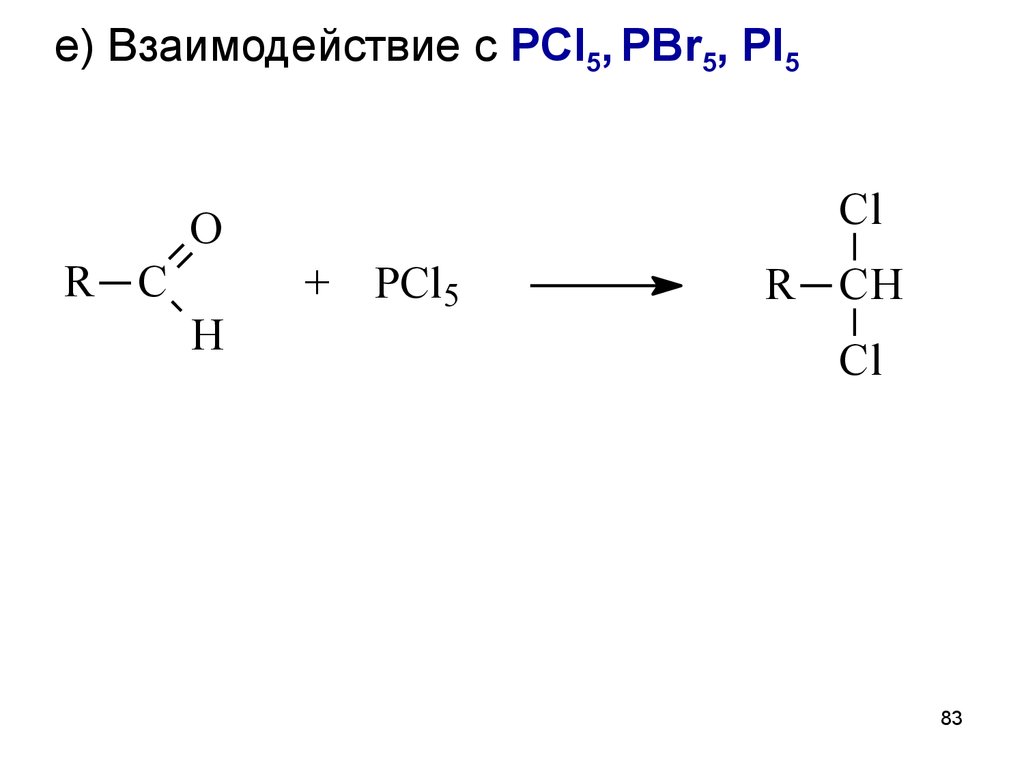
83.
е) Взаимодействие с PCl5, PBr5, PI5Cl
O
R C
H
+ PCl5
R CH
Cl
83
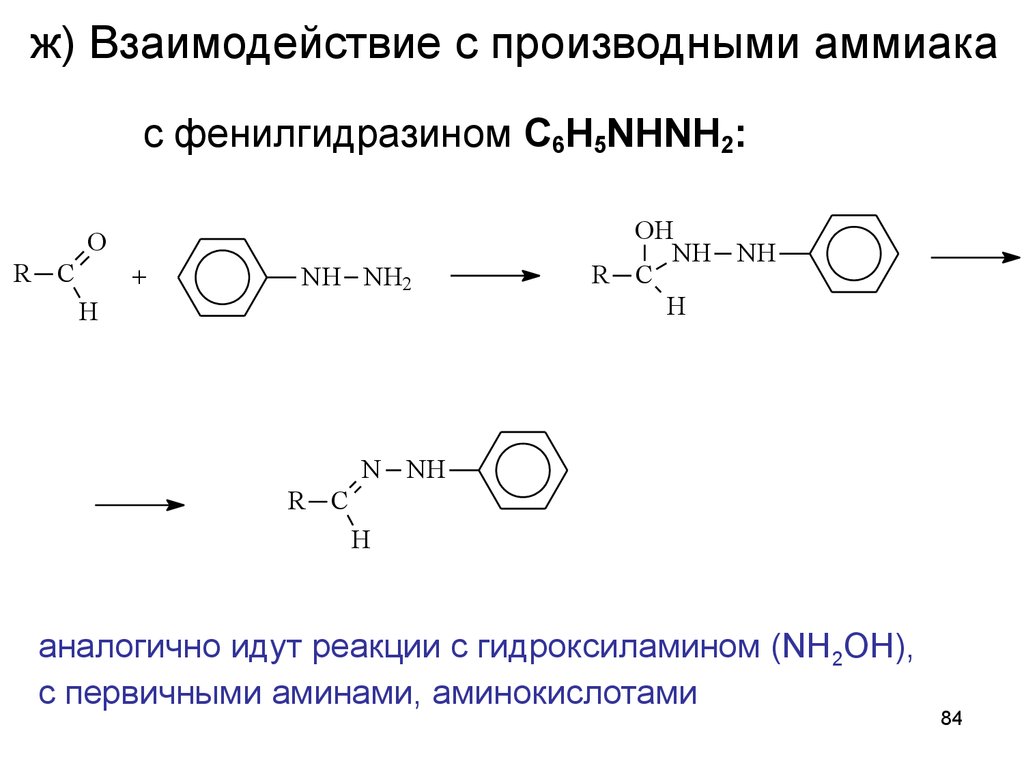
84. ж) Взаимодействие с производными аммиака
с фенилгидразином C6H5NHNH2:O
R C
+
NH NH2
H
OH
NH NH
R C
H
N NH
R C
H
аналогично идут реакции с гидроксиламином (NH2OH),
с первичными аминами, аминокислотами
84
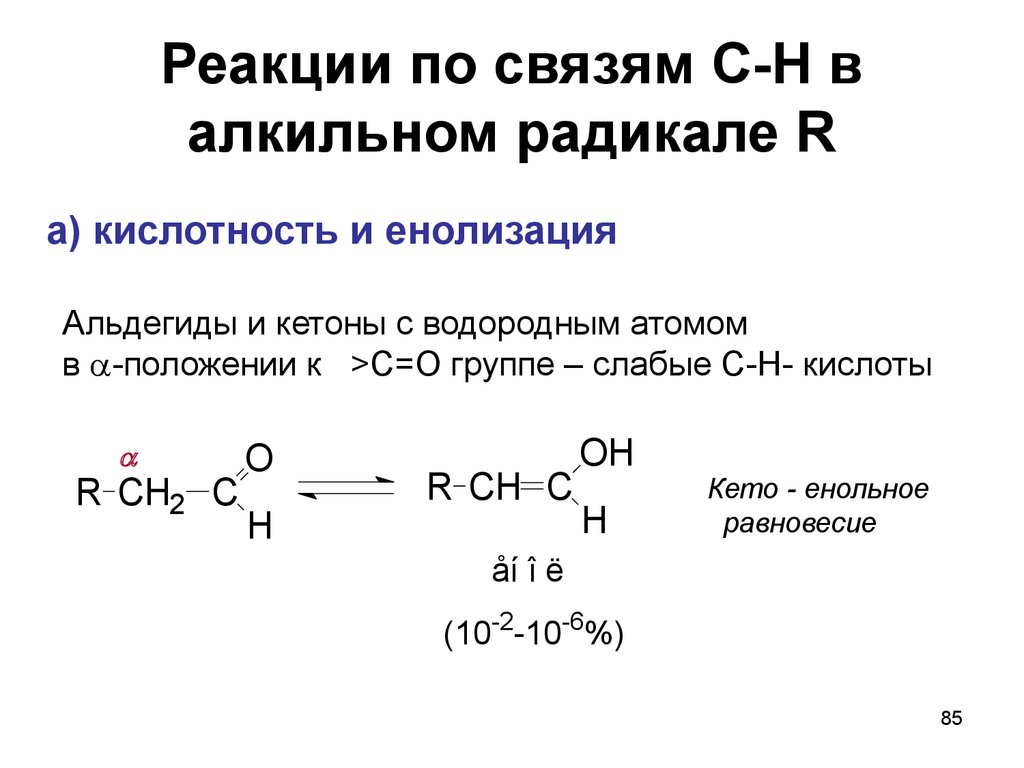
85. Реакции по связям С-Н в алкильном радикале R
а) кислотность и енолизацияАльдегиды и кетоны с водородным атомом
в -положении к >C=O группе – слабые C-H- кислоты
R CH2 C
O
H
R CH C
OH
H
Кето - енольное
равновесие
åí î ë
(10-2-10-6%)
85
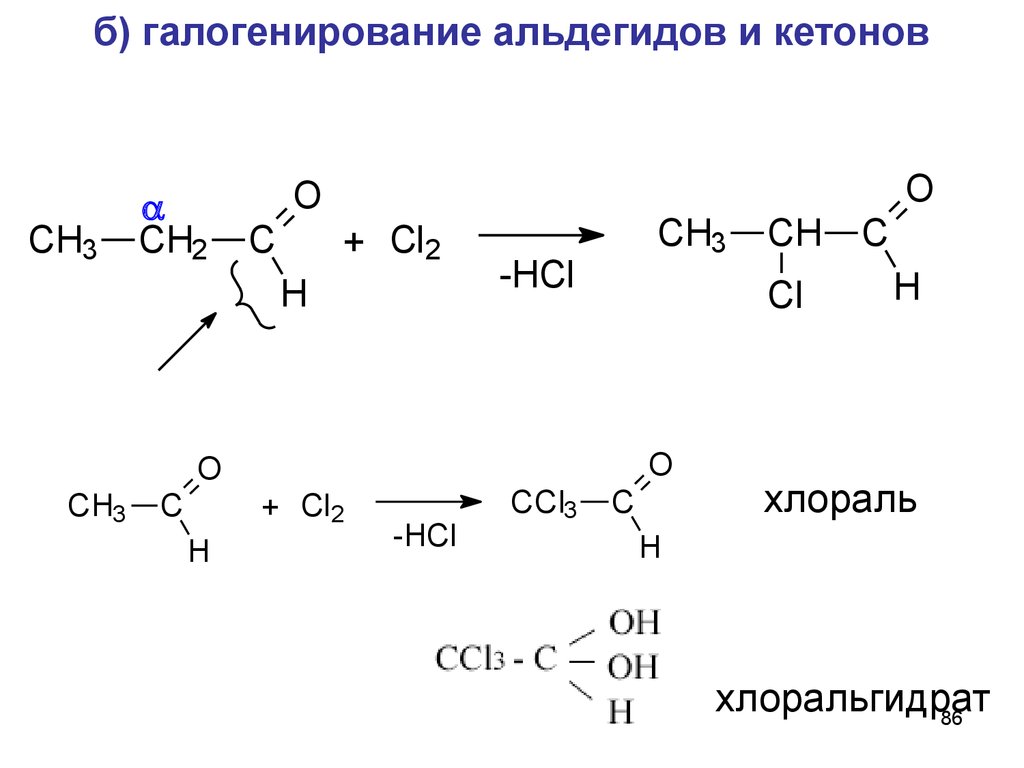
86.
б) галогенирование альдегидов и кетоновCH3
CH2
O
O
C
+ Cl2
H
C
+ Cl2
H
-HCl
-HCl
CCl3
CH
Cl
O
O
CH3
CH3
C
C
H
хлораль
H
хлоральгидрат
86
87. Получение альдегидов и кетонов
Окислением первичных спиртов (CuO)
получают альдегиды, а при окислении
вторичных спиртов – кетоны
Из дигалогенпроизводных
87
88. КАРБОНОВЫЕ КИСЛОТЫ
(карбоксильные производные)88
89.
-
Классификация:
алифатические КК (предельные и непредельные)
ароматические КК
гетероциклические КК
-монокарбоновые кислоты (одноосновные)
- дикарбоновые (двухосновные)
-поликарбоновые
C
O
OH
Содержат карбоксильную группу,
связанную с алкильной или арильной группой
89
90.
Предельные монокарбоновые кислоты CnH2n+1COOHНоменклатура
H C
O
ì åòàí î âàÿ
ì óðàâüèí àÿ êèñëî òà
HCOO-
ô î ðì èàò
CH3COO-
àöåòàò
OH
CH3COOH
ýòàí î âàÿ
óêñóñí àÿ êèñëî òà
CH3CH2COOH
ï ðî ï èî í î âàÿ êèñëî òà
CH3CH2COO-
CH3CH2CH2COOH
ì àñëÿí àÿ êèñëî òà
CH3CH2CH2COO-
ï ðî ï èî í àò
áóòèðàò
CH3(CH2)3COOH
âàëåðèàí î âàÿ
CH3(CH2)3COO-
âàëåðàò
CH3(CH2)4COOH
êàï ðî í î âàÿ
CH3(CH2)4COO-
êàï ðî àò
90
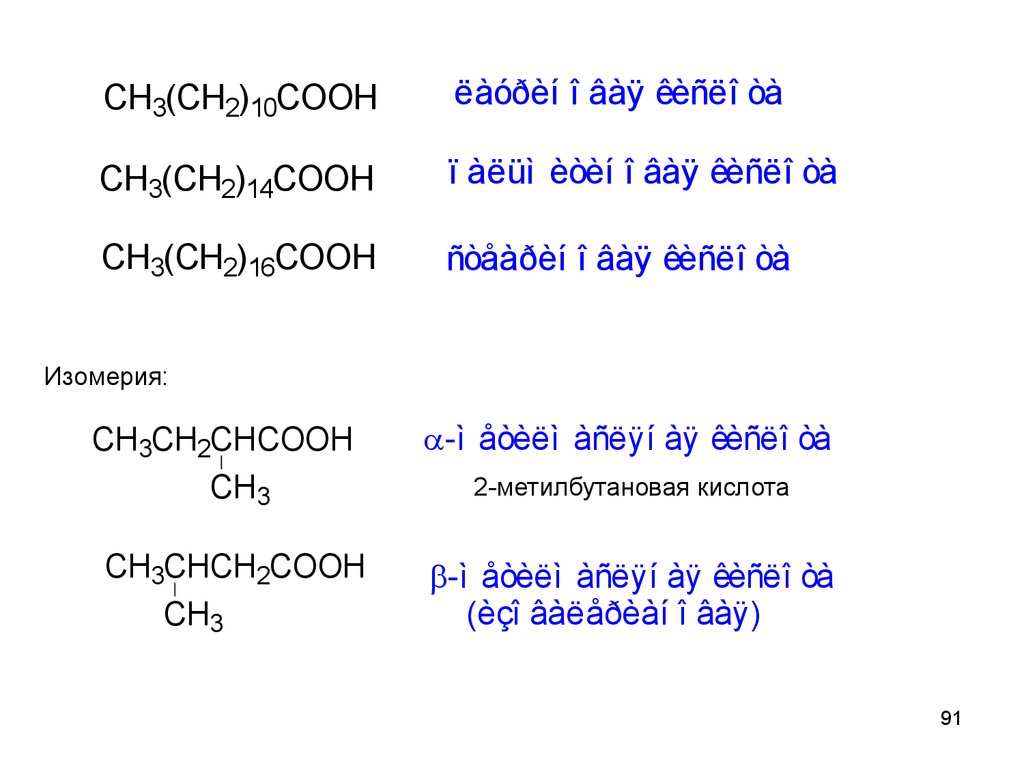
91.
CH3(CH2)10COOHëàóðèí î âàÿ êèñëî òà
CH3(CH2)14COOH
ï àëüì èòèí î âàÿ êèñëî òà
CH3(CH2)16COOH
ñòåàðèí î âàÿ êèñëî òà
Изомерия:
CH3CH2CHCOOH
CH3
CH3CHCH2COOH
CH3
-ì åòèëì àñëÿí àÿ êèñëî òà
2-метилбутановая кислота
-ì åòèëì àñëÿí àÿ êèñëî òà
(èçî âàëåðèàí î âàÿ)
91
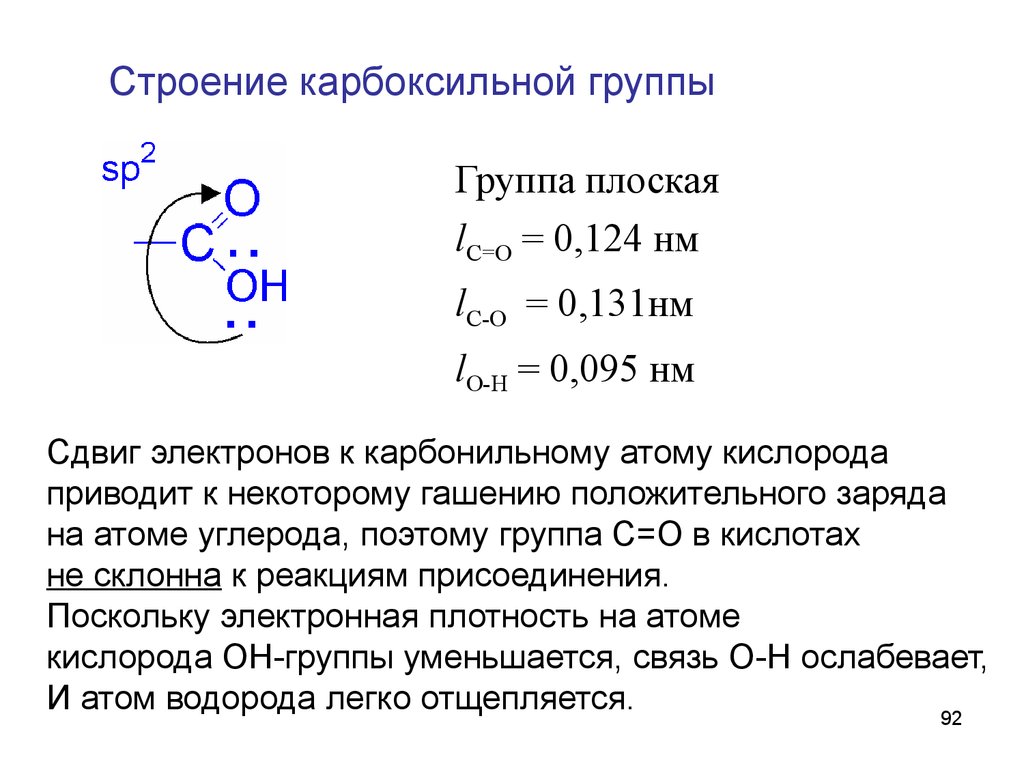
92.
Строение карбоксильной группыГруппа плоская
lC=O = 0,124 нм
lC-O = 0,131нм
lO-H = 0,095 нм
Сдвиг электронов к карбонильному атому кислорода
приводит к некоторому гашению положительного заряда
на атоме углерода, поэтому группа С=О в кислотах
не склонна к реакциям присоединения.
Поскольку электронная плотность на атоме
кислорода ОН-группы уменьшается, связь О-Н ослабевает,
И атом водорода легко отщепляется.
92
93.
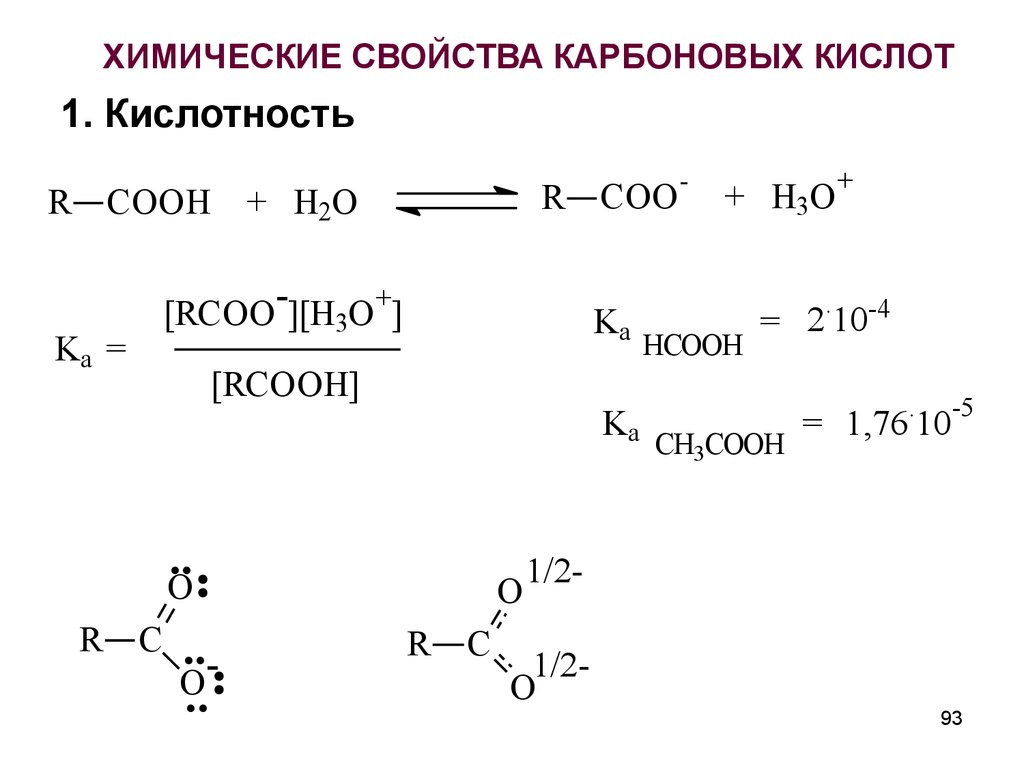
ХИМИЧЕСКИЕ СВОЙСТВА КАРБОНОВЫХ КИСЛОТ1. Кислотность
R COO
R COOH + H2O
Ka =
+
[RCOO ][H3O ]
Ka
[RCOOH]
Ka
..
O
R C
..O
..
O
R
C
-
+ H3O
+
.
HCOOH
= 2 10-4
.
CH3COOH
= 1,76 10
-5
1/2-
1/2O
93
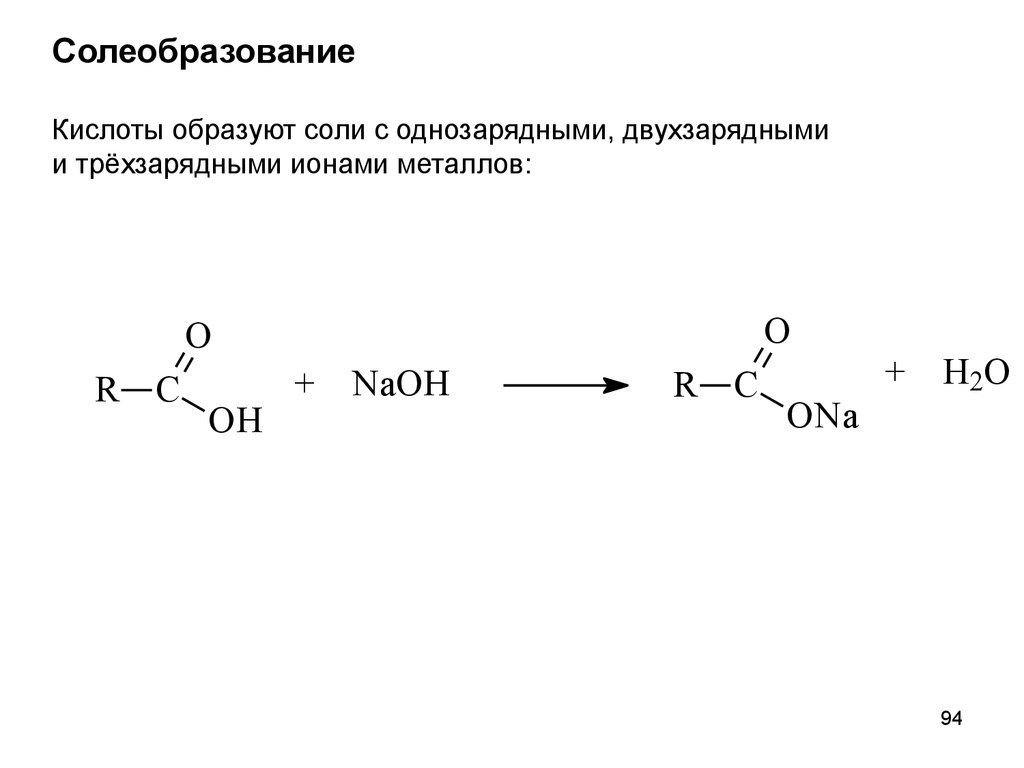
94.
СолеобразованиеКислоты образуют соли с однозарядными, двухзарядными
и трёхзарядными ионами металлов:
O
O
R C
OH
+
NaOH
R C
ONa
+
H2O
94
95.
2. Реакции нуклеофильного замещенияв карбоксильной группе -получение функциональных производных карбоновых
кислот (OH-группа замещена на группы NH2, OR,
OC(O)R, Cl).
Все они содержат ацильную группу
R C
O
ацильная группа
ФПКК можно превращать друг в друга, а гидролизом
снова превратить в кислоту.
95
96.
ФУНКЦИОНАЛЬНЫЕ ПРОИЗВОДНЫЕКАРБОНОВЫХ КИСЛОТ (ФПКК)
96
97.
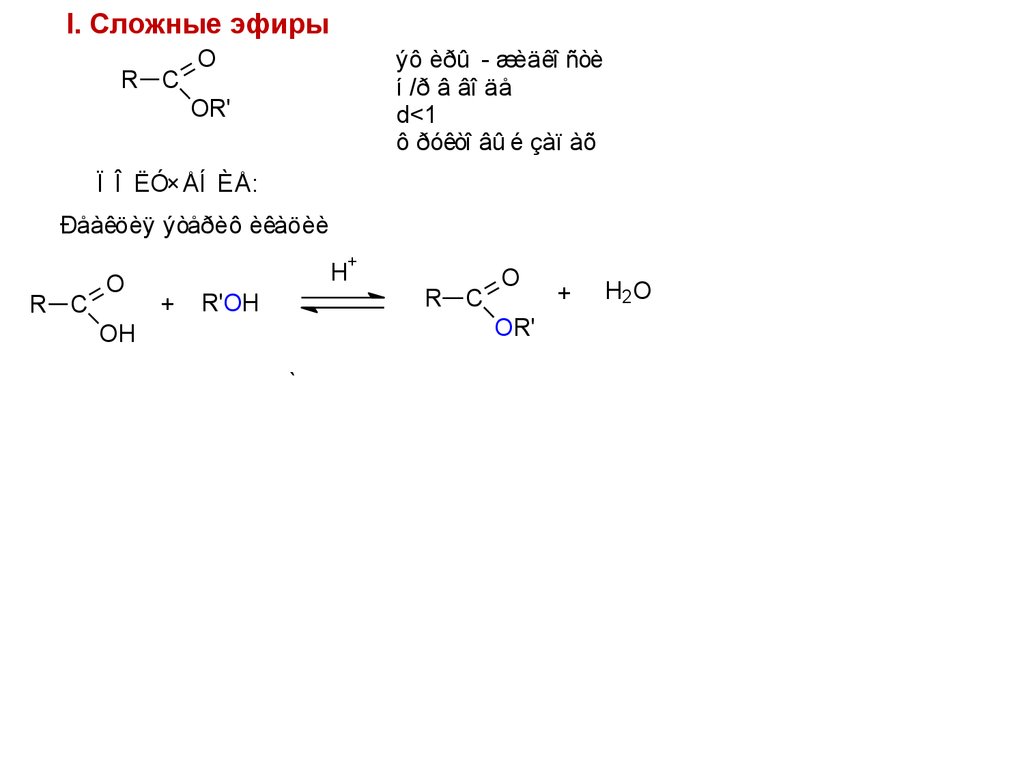
I. Сложные эфирыR C
O
ýô èðû - æèäêî ñòè
í /ð â âî äå
d<1
ô ðóêòî âû é çàï àõ
OR'
Ï Î ËÓ×ÅÍ ÈÅ:
1). Ðåàêöèÿ ýòåðèô èêàöèè
R C
O
H+
+
OH
Êàòàëèçàòî ðû :
H2SO4 (êî í ö.),
HCl (ñóõî é ãàç)
R'OH
R C
O
+
H2O
OR'
Ì èí åðàëüí û å êèñëî òû óñêî ðÿþ ò ï ðÿì óþ è î áðàòí óþ ðåàêöèè,
ï ðî òî í èðóÿ êèñëî ðî ä êàðáî í èëüí î é ãðóï ï û è òåì ñàì û ì
óâåëè÷èâàÿ ñêëî í í î ñòü óãëåðî äà êàðáî í èëüí î é ãðóï ï û
ê ï ðèñî åäèí åí èþ í óêëåî ô èëà.
Ï ðî öåññ ðàâí î âåñí û é.
Äëÿ ñì åù åí èÿ ðàâí î âåñèÿ: èçáû òî ê ñï èðòà; óäàëåí èå H2.O
Î ï û òû ñ êèñëî òî é, ì å÷åí î é ï î 18O, ï î êàçàëè,
÷òî â ñî ñòàâå H2O18 âû äåëÿåòñÿ OH-ãðóï ï à êèñëî òû .
Ï î ðåàêöèî í í î é ñï î ñî áí î ñòè:
ï åðâè÷í û é ñï èðò > âòî ðè÷í û é ñï èðò > òðåòè÷í û é ñï èðò
97
98.
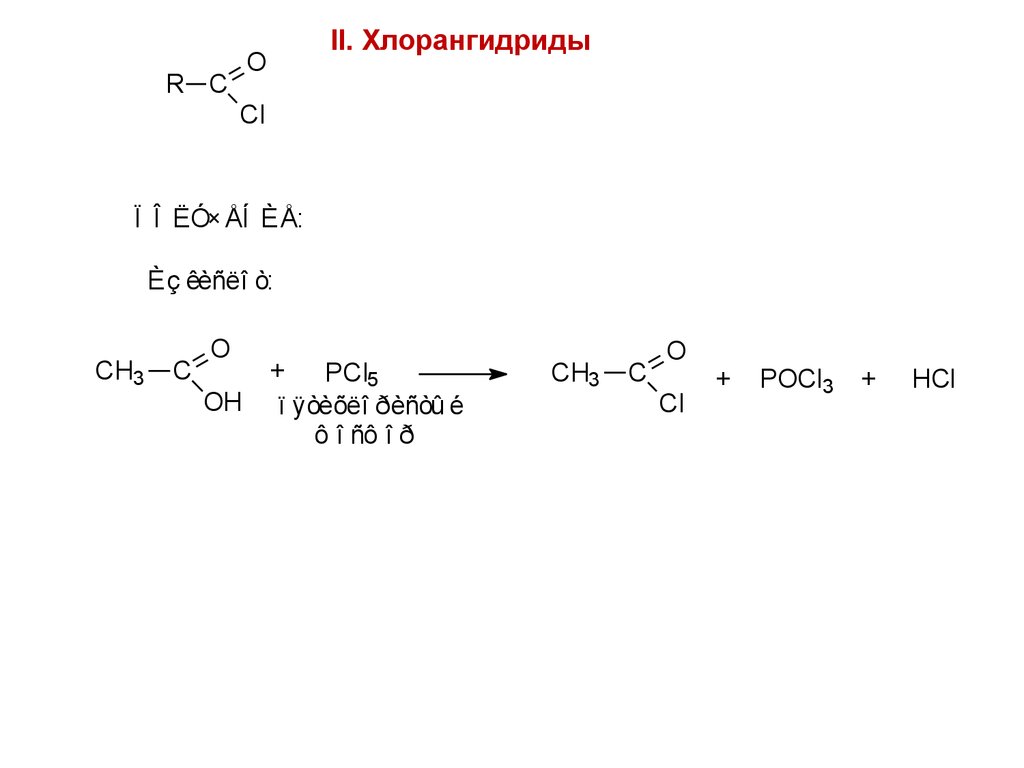
II. ХлорангидридыO
R C
Cl
Ï Î ËÓ×ÅÍ ÈÅ:
1) Èç êèñëî ò:
CH3
CH3
C
O
OH
C
O
+
PCl5
ï ÿòèõëî ðèñòû é
ô î ñô î ð
+
OH
COCl2
ô î ñãåí
CH3
C
Cl
C
O
Cl
+
POCl3
+
CO2
+
+
HCl
HCl
O
O
C
C
OH
CH3
O
+
SOCl2
òèî í èëõëî ðèä
Cl
+
SO2
+
HCl
98
99.
III. АнгидридыR C O C R
O
æèäêî ñòè ñ ðåçêèì çàï àõî ì ,
ï åðåãî í ÿþ òñÿ áåç ðàçëî æåí èÿ
O
Ï Î ËÓ×ÅÍ ÈÅ:
1)
CH3
O
C
+
CH3
C
C O
êåòåí
+
CH3
(CH3CO)2O + NaCl
ONa
Cl
2) CH2
O
C
O
(CH3CO)2O
OH
Êåòåí ï î ëó÷àþ ò âû ñî êî òåì ï åðàòóðí î é äåãèäðàòàöèåé
óêñóñí î é êèñëî òû èëè ï èðî ëèçî ì àöåòî í à
99
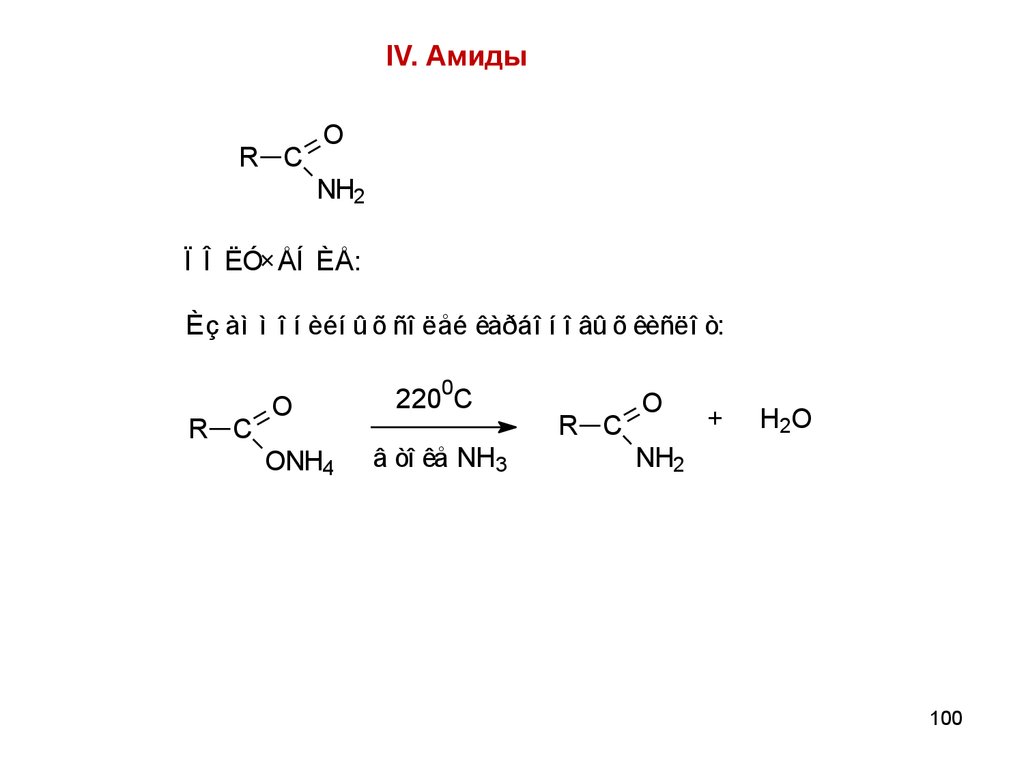
100.
IV. АмидыR C
O
NH2
Ï Î ËÓ×ÅÍ ÈÅ:
Èç àì ì î í èéí û õ ñî ëåé êàðáî í î âû õ êèñëî ò:
R C
O
ONH4
0
220 C
â òî êå NH3
R C
O
+
H 2O
NH2
100
101. Липиды
содержатся в животных и растительныхтканях
Большая группа соединений, содержащих
в своем составе сложно-эфирную
связь, нерастворимых в воде и
выполняющих в организме ряд важных
функций
101
102. Структурные компоненты липидов
• СПИРТЫ• ВЫСШИЕ ЖИРНЫЕ КАРБОНОВЫЕ
КИСЛОТЫ
• другие вещества
102
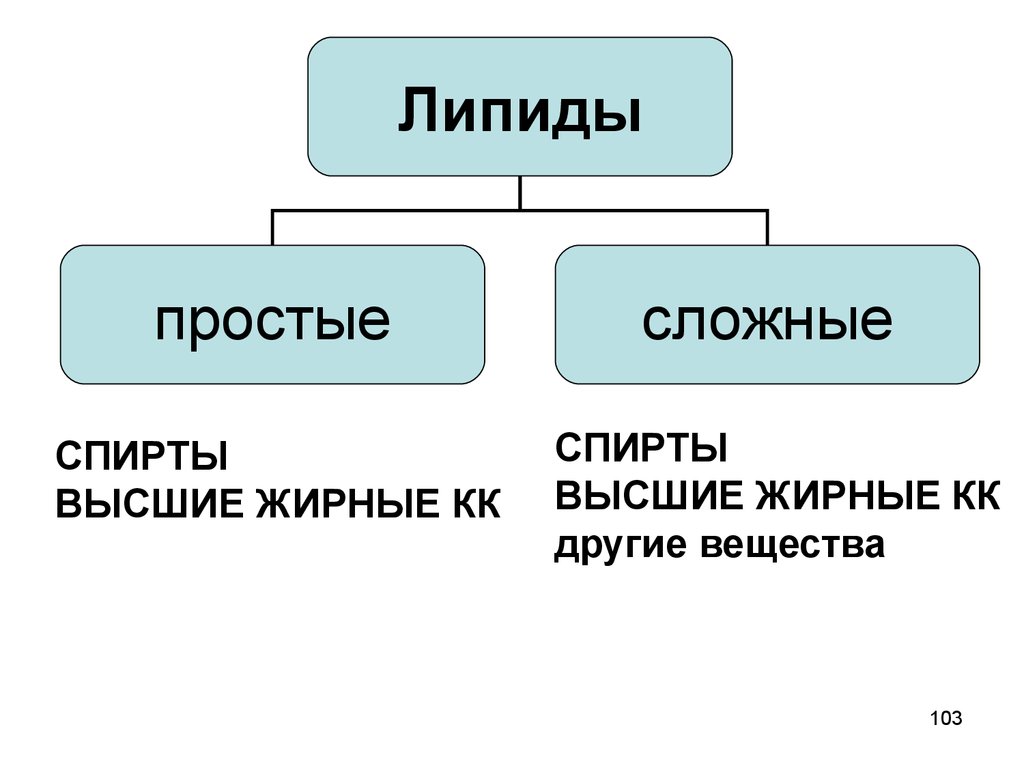
103.
Липидыпростые
сложные
СПИРТЫ
ВЫСШИЕ ЖИРНЫЕ КК
СПИРТЫ
ВЫСШИЕ ЖИРНЫЕ КК
другие вещества
103
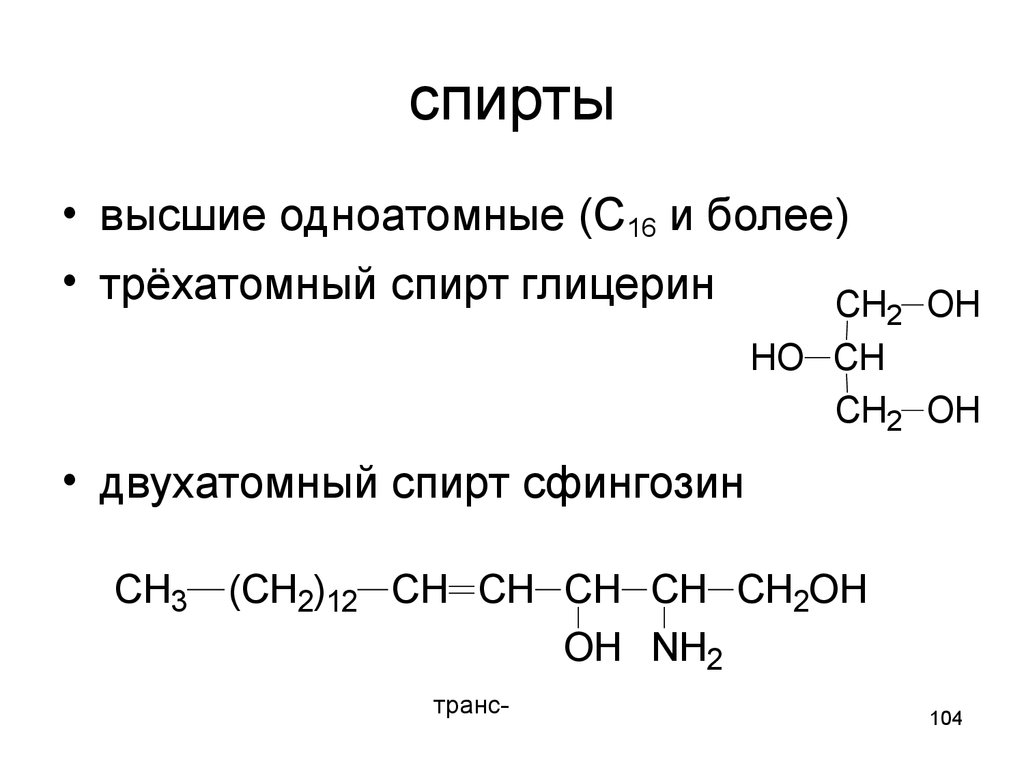
104. спирты
• высшие одноатомные (С16 и более)• трёхатомный спирт глицерин
CH2 OH
HO CH
CH2 OH
• двухатомный спирт сфингозин
CH3 (CH2)12 CH CH CH CH CH2OH
OH NH2
транс-
104
105. Простые липиды
воски
жиры и масла
церамиды
стериды
105
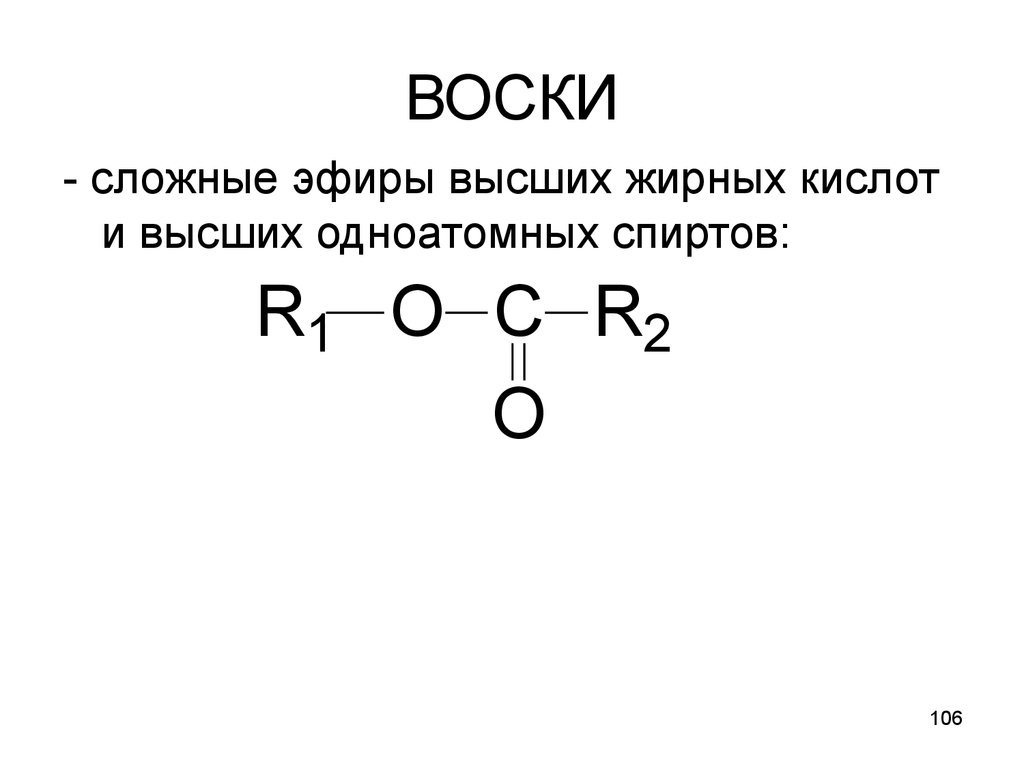
106. ВОСКИ
- сложные эфиры высших жирных кислоти высших одноатомных спиртов:
R1 O C R2
O
106
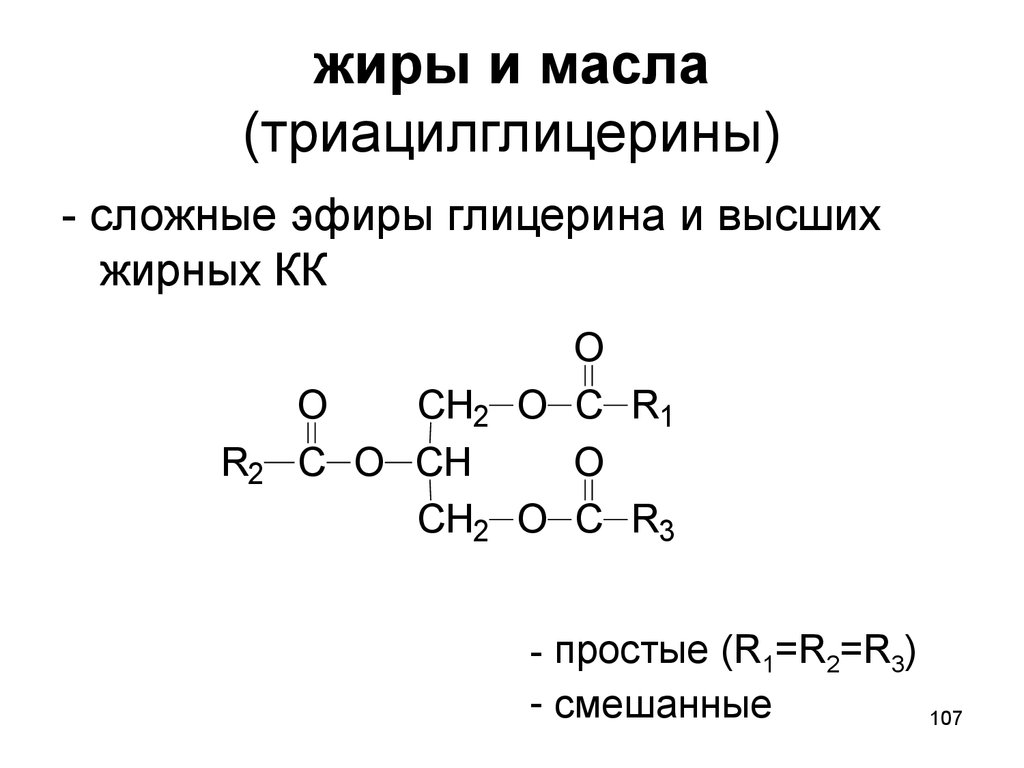
107. жиры и масла (триацилглицерины)
- сложные эфиры глицерина и высшихжирных КК
R2
O
CH2
C O CH
CH2
O
O C R1
O
O C R3
- простые (R1=R2=R3)
- смешанные
107
108. церамиды
- N-ацилированные производные спиртасфингозина
108
109. стериды
- сложные эфиры высокосмолекулярногоциклического спирта стерола и
высокомолекулярной КК
109
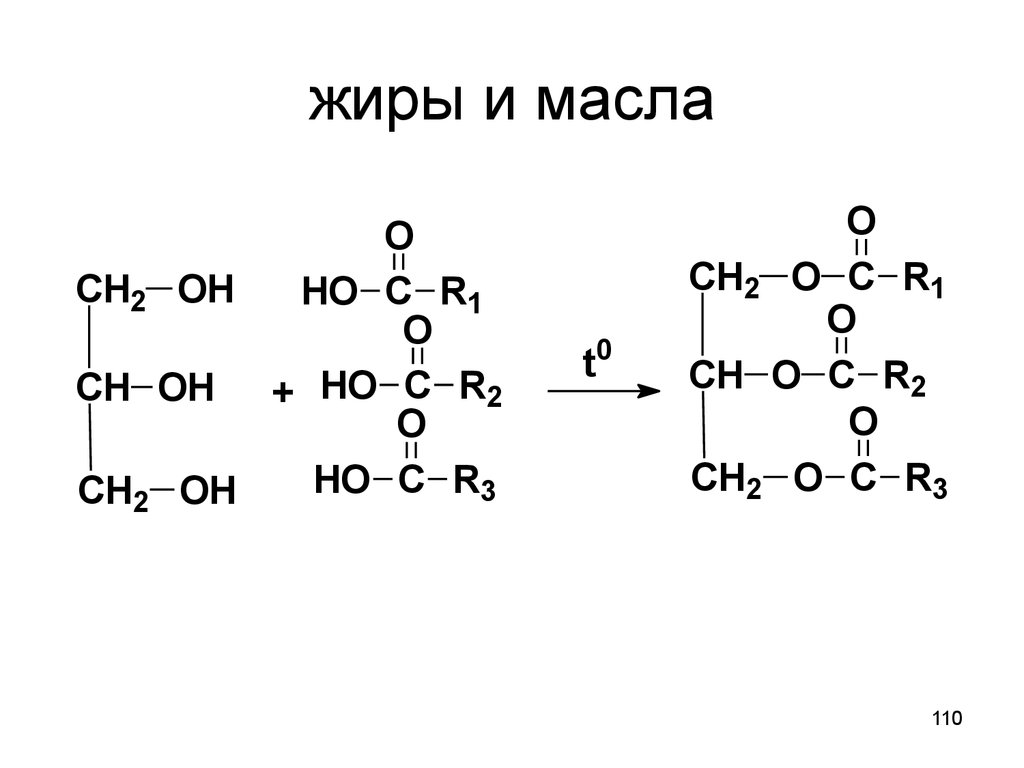
110. жиры и масла
OCH2 OH
HO C R1
O
CH OH + HO C R2
O
HO C R3
CH2 OH
t0
O
CH2 O C R1
O
CH O C R2
O
CH2 O C R3
110
111.
OCH2 O C C17H35
O
CH O C C17H35
O
CH2 O C C17H35
тристеарин
(тристеароилглицерин)
O
CH2 O C C17H33
O
CH O C C17H33
O
CH2 O C C17H33
триолеин
(триолеилглицерин)
111
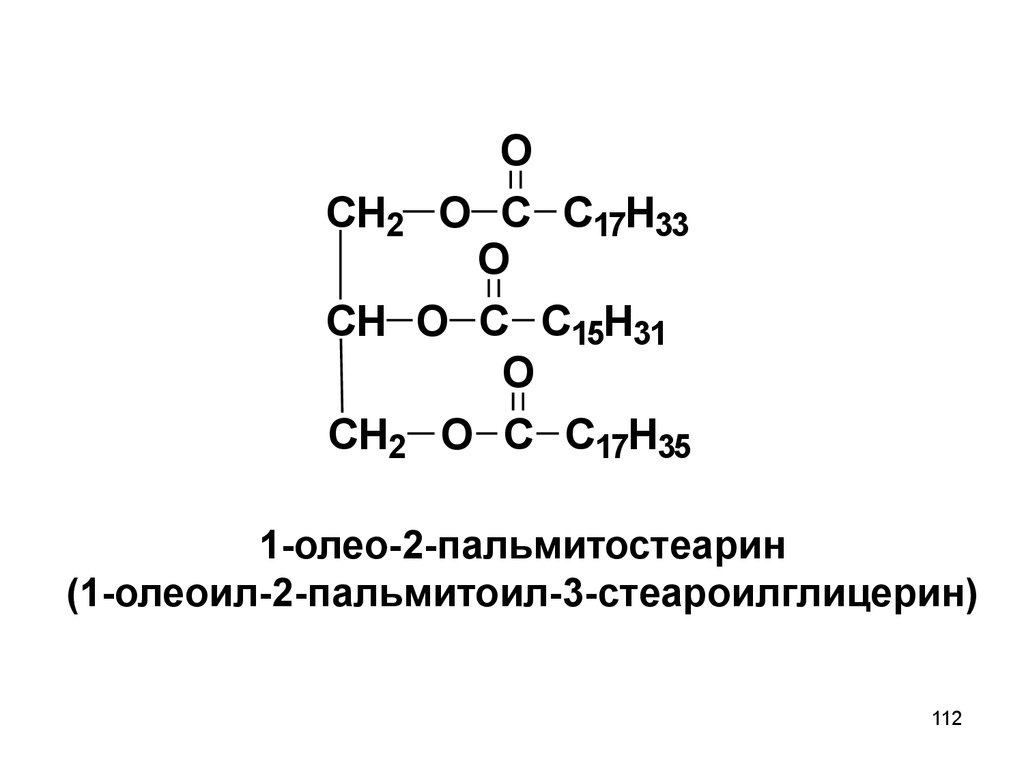
112.
OCH2 O C C17H33
O
CH O C C15H31
O
CH2 O C C17H35
1-олео-2-пальмитостеарин
(1-олеоил-2-пальмитоил-3-стеароилглицерин)
112
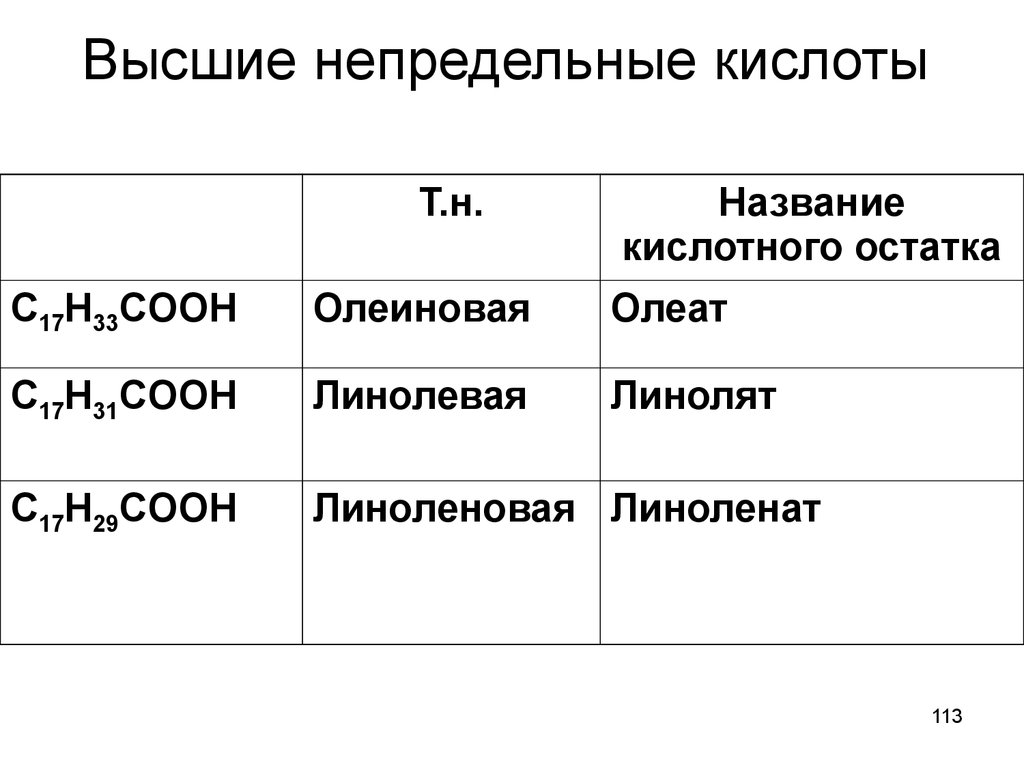
113. Высшие непредельные кислоты
Т.н.Название
кислотного остатка
C17H33COOH
Олеиновая
Олеат
C17H31COOH
Линолевая
Линолят
C17H29COOH
Линоленовая Линоленат
113
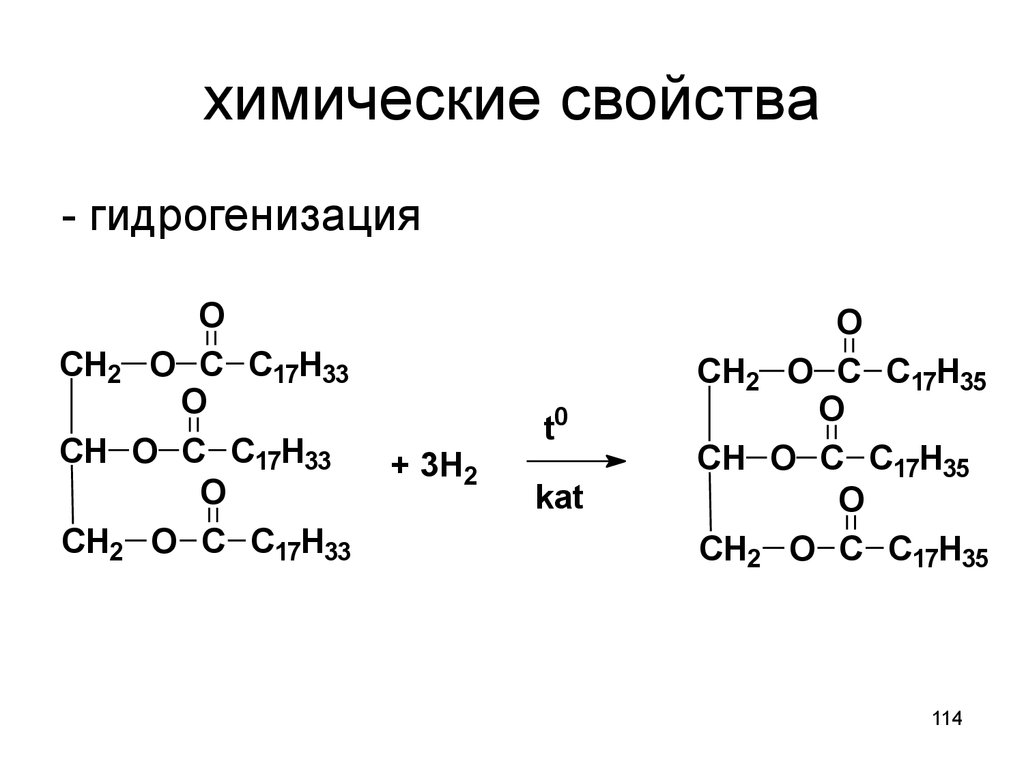
114. химические свойства
- гидрогенизацияO
CH2 O C C17H33
O
CH O C C17H33
O
CH2 O C C17H33
+ 3H2
t0
kat
O
CH2 O C C17H35
O
CH O C C17H35
O
CH2 O C C17H35
114
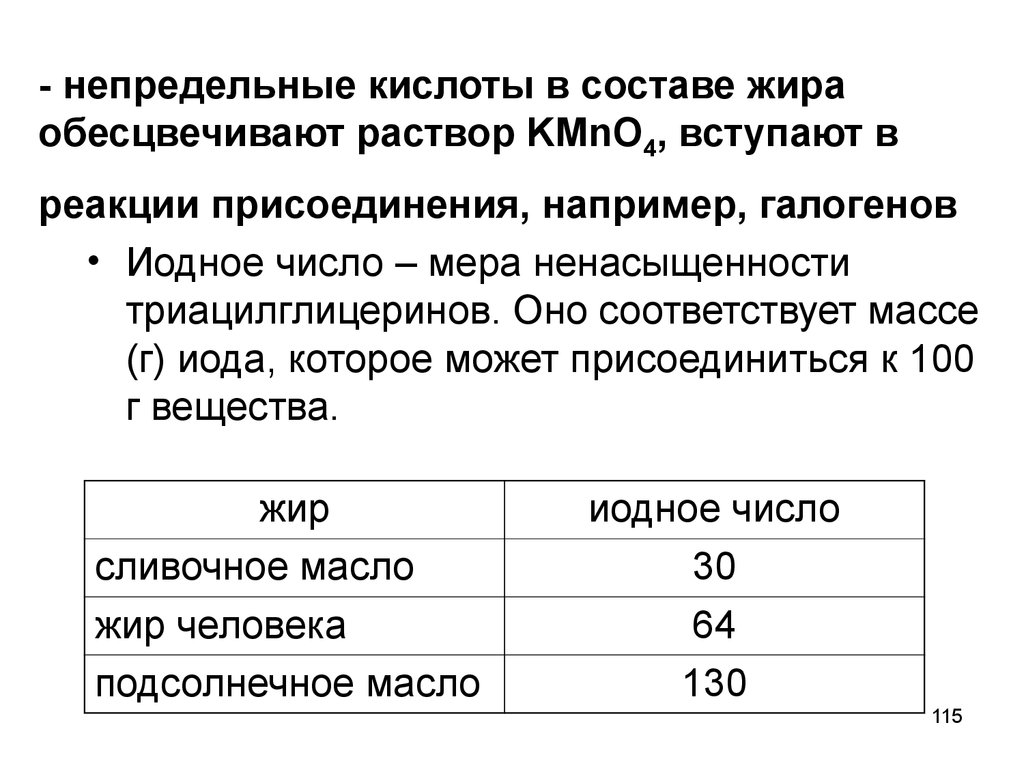
115. - непредельные кислоты в составе жира обесцвечивают раствор KMnO4, вступают в реакции присоединения, например, галогенов
• Иодное число – мера ненасыщенноститриацилглицеринов. Оно соответствует массе
(г) иода, которое может присоединиться к 100
г вещества.
жир
сливочное масло
жир человека
подсолнечное масло
иодное число
30
64
130
115
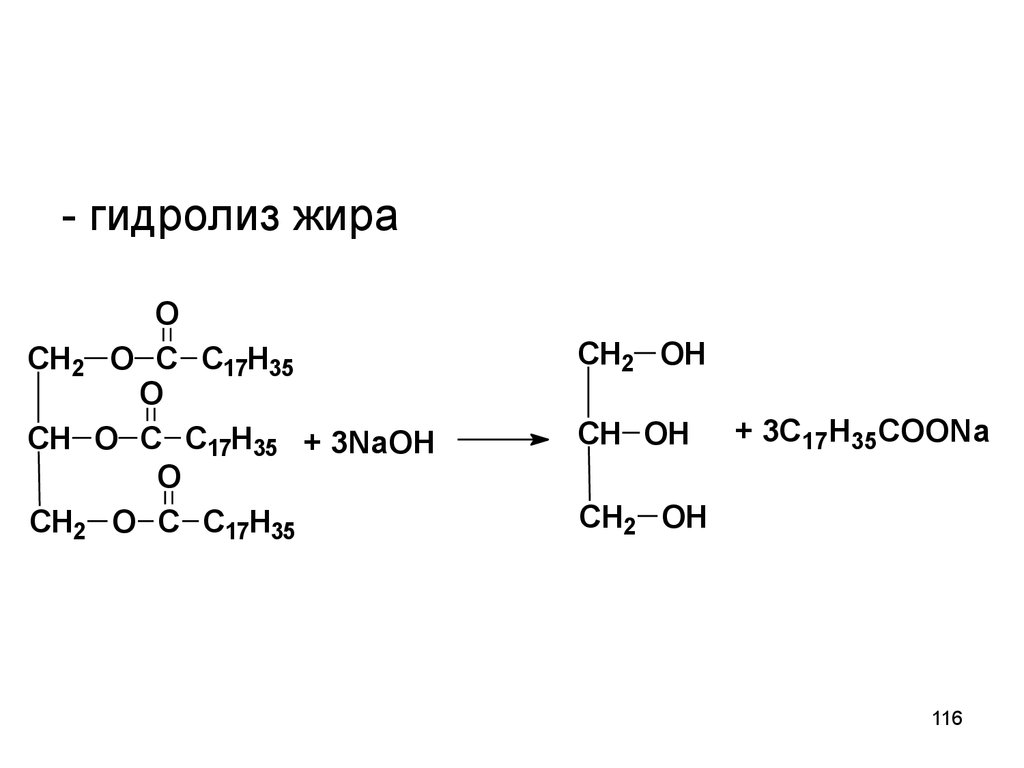
116.
- гидролиз жираO
CH2 O C C17H35
O
CH O C C17H35 + 3NaOH
O
CH2 O C C17H35
CH2 OH
CH OH
+ 3C17H35COONa
CH2 OH
116
117.
- акролеиновая пробаCH2 OH
CH OH
CH2 OH
0
t
H
O
C
CH
CH2
117
118. Биологическая роль жиров
Энергетическая
Структурная
Резервная
Механическая защита внутренних
органов от повреждений
• Термоизоляционная
• Источник эндогенной воды
• Растворяют жирорастворимые
витамины (A,D,E,K)
118
119. Сложные липиды
• Фосфолипиды• Сфинголипиды
• Гликолипиды
119
120. Фосфолипиды
- липиды, при гидролизе отщепляющиефосфорную кислоту
Глицерофосфолипиды - сложные
эфиры глицерина с высшими жирными
кислотами и фосфорной кислотой.
В состав фосфолипидов входят также
азотсодержащие соединения, такие как
холин, этаноламин или серин.
120
121.
• Глицерофосфолипиды – главныелипидные компоненты клеточных
мембран. Они сопутствуют жирам в
пище и служат источником
фосфорной кислоты, необходимой
для жизни человека.
121
122.
• Глицерофосфолипиды являютсяпроизводными фосфатидной кислоты. В
их состав входят глицерин, жирные
кислоты, фосфорная кислота и обычно
азотсодержащие соединения.
R2
O
CH2
C O CH
CH2
O
O C R1
O
O P OH
OH
фосфатидная кислота
122
123.
глицерофосфолипидR2
O
CH2
C O CH
CH2
O
O C R1
O
O P O R3
O
Как правило, в положении 1 – остаток насыщенной, а в
123
положении 2 – остаток ненасыщенной кислоты
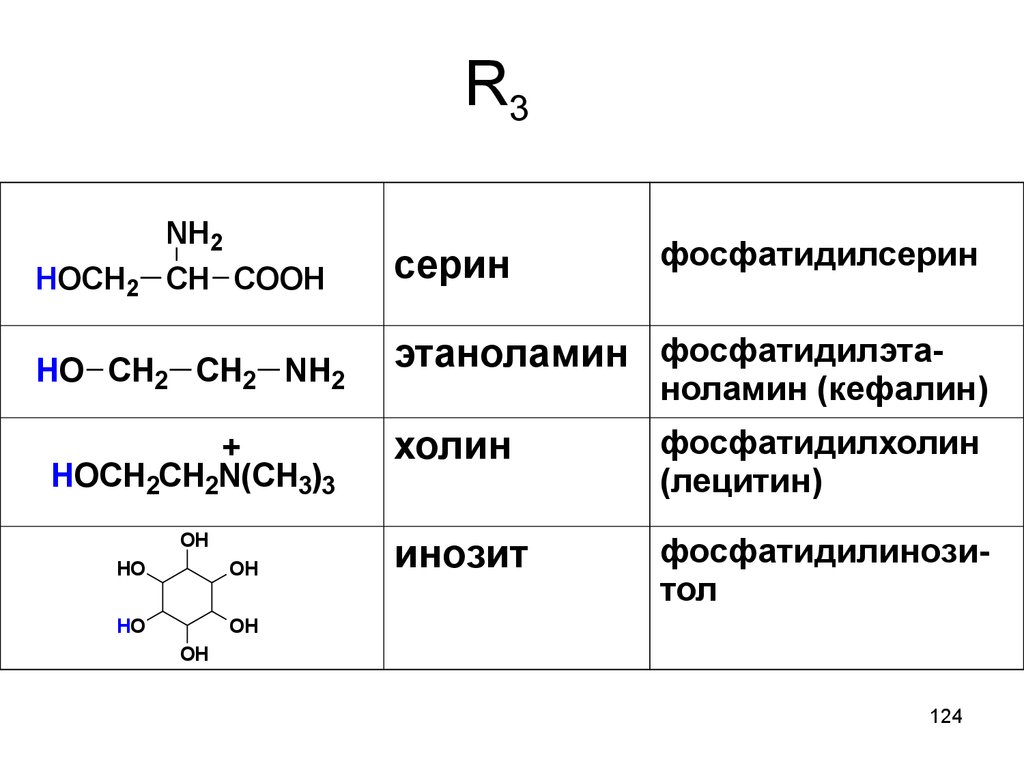
124. R3
HOCH2NH2
CH COOH
HO CH2 CH2 NH2
+
HOCH2CH2N(CH3)3
OH
HO
OH
HO
OH
серин
фосфатидилсерин
этаноламин фосфатидилэта-
ноламин (кефалин)
холин
фосфатидилхолин
(лецитин)
инозит
фосфатидилинозитол
OH
124
125.
OCH2 O C R1
O
+
+ HOCH2CH2N(CH3)3
CH O C R2
- H2O
O
CH2 O P O H
O-
O
CH2 O C R1
.
O
CH O C R2
O
+
CH2 O P OCH2CH2N(CH3)3
O-
лецитин
Из всех липидов глицерофосфолипиды
обладают полярными свойствами. При
помещении глицерофосфолипидов в воду в
истинный раствор переходит лишь небольшая
их часть, основная же масса липидов находится
125
в виде мицелл.
126. Биологическая роль фосфолипидов
• Структурная - входят в составклеточных мембран
• Повышают растворимость холестерина
и способствуют его выведению из
организма
• Препятствуют синтезу жира в печени
126























































 chemistry
chemistry