Similar presentations:
Алкены
1.
АЛКЕНЫСnH2n
Номенклатура.
Признаком двойной связи в названии вещества является окончание -ЕН
Для алкенов характерны следующие виды изомерии: Структурная, Геометрическая
(пространственная), Оптическая
Изомерия.
H3C
Пент-2-ен
Пент-1-ен
Структурные
изомеры C5H10
2-Метилбут-2-ен
2-Метилбут-1-ен
CH2
CH3
C
CH2
Бут-1-ен
CH3
CH3
C
H
CH3
H
C
H
цис-Бут-2-ен
CH3
Метилпропен
C
H3C
Оптически активный алкен
CH2
Названия одновалентных алкенильных групп (заместителей)
CH3
CH
C C
*
H3C CH
CH3
2,3,4-Триметилгекс-2-ен
Структурные изомеры С4Н8
H2C
CH3
C
H
CH3
транс-Бут-2-ен
Пространственные изомеры С4Н8
H2C CH
этенил (винил)
3 2
1
H2C CH CH2
проп-2-енил (аллил)
4CH3
3 HC
H3C
CH 2
1 CH
2 1
H2C C
1-метилбут-2-енил или
пент-3-ен-2-ил
3
CH3
1 2 CH3
1-метилэтенил (изо-пропенил)
HC C
1
3
2
CH3
H3C CH CH
2-метилпроп-1-ен-1-ил
проп-1-енил
1
2.
Геометрические (конфигурационные) изомерыцис
С
С
С
1
1
1
С
H3C
H
H3C
~ 260 кДж/моль H
H
H
1
2
Z-конфигурация
транс
С
С
2
2
2
H3C
E-конфигурация
H
CH3
CH3
~ 260 кДж/моль H3C
цис-Бут-2-ен
H
транс-Бут-2-ен
CH3
(1)
CH3
CH3 (2)
C
(2)
H
(1)
CH3
C
C
CH
CH3 (1)
(2)
H
CH
CH3 (1)
CH3
(2)
C
CH3
(E)-3,4-Диметилпент-2-ен
(Z)-3,4-Диметилпент-2-ен
Чтобы отнести изомер к Z- или Е- ряду, необходимо определить старшинство в
парах заместителей у каждого атома при двойной связи (зеленый цвет). Если
оба старших заместителя расположены по одну сторону плоскости, в которой
лежит двойная связь, то изомер относится к Z-ряду, в противном случае к Еряду (красный цвет).
2
3.
В Z,E-системе старшими считаются заместители с большим атомным номером.Если атомы, непосредственно связанные с ненасыщенными углеродами, одинаковы,
то переходят ко "второму слою", в случае необходимости - к "третьему слою" и т.д.
35
17
Br
1
Cl
+
H
7
N O
O
В формуле три заместителя разные. При определении стереохимического
обозначения все решается атомами "первого слоя".
Расставив их атомные номера, получим, что старшие заместители каждой
пары (бром в верхней части формулы и хлор в верхней) находятся
в цис-положении, отсюда следует стереохимические обозначение Z:
(Z)-1-бром-1-хлор-2-нитроэтен
1
(HHH)
1
H
1
H
1
H 6C
H H1
1
H
H C 1H 1
1 H 6C
(CHH)
6 H
6
(CHH)
(CHH)
C
6
1H
C H1
1
C
H
1
C
6
C
H
1
(HHH)
H1 H 1
Для определения стереохимического обозначения структуры
необходимо искать различие в "высших слоях".
По первому слою группы СН3, С2Н5, С3Н7 не отличаются.
Во втором слое у группы СН3 сумма атомных номеров равна трем
(три атома водорода), у групп С2Н5 и С3Н7 - по 8.
Значит, группа СН3 не рассматривается – она младше двух других.
Таким образом, старшие группы – это С2Н5 и С3Н7, они находятся в
цис-положении; стереохимическое обозначение Z.
Название соединения: (Z)-4-метилгепт-3-ен
3
4.
Способы получения алкеновДегидрирование и крекинг алканов
> 450 OC, Cr2O3/Fe2O3
Бут-2-ен
Бутан
+
+
H2
Бут-1-ен
Дегидрогалогенирование
CH3 CH CH2 CH3
Br
NaOH, C2H5OH , Т
-HBr
Дегидратация
CH3 CH CH2 CH2 CH3
OH
H
CH3 CH CH CH3 + CH3 CH2 CH CH2
Бут-2-ен (71 %)
Бут-1-ен (29 %)
+
CH3 CH CH CH2 CH3 + H2O
Ï åí ò-2-åí
(î ñí î âí î é ï ðî äóêò)
Преобладающим
продуктом
реакции
является
наиболее
устойчивый, т.е. наиболее алкилированный алкен (правило Зайцева)
4
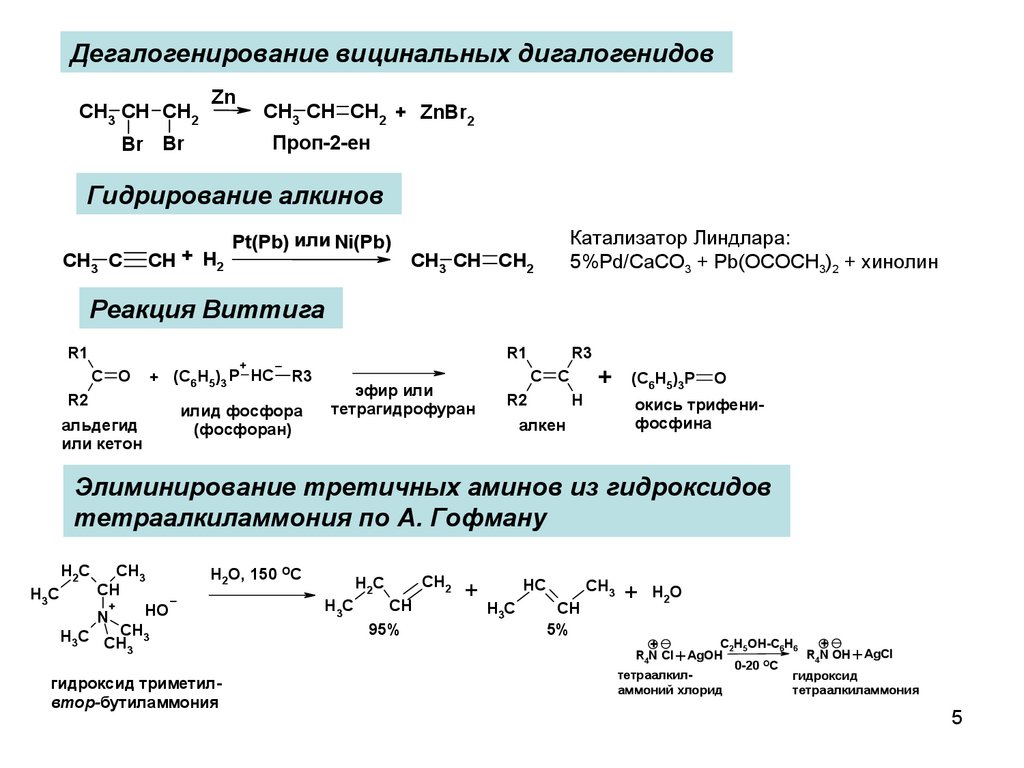
5.
Дегалогенирование вицинальных дигалогенидовCH3 CH CH2
Zn
CH3 CH CH2 + ZnBr2
Проп-2-ен
Br Br
Гидрирование алкинов
CH3 C
CH + H2
Pt(Pb) или Ni(Pb)
Катализатор Линдлара:
5%Pd/CaCO3 + Pb(OCOCH3)2 + хинолин
CH3 CH CH2
Реакция Виттига
R1
C O
+
+ (C6H5)3 P HC
R2
альдегид
или кетон
R1
R3
илид фосфора
(фосфоран)
эфир или
тетрагидрофуран
R3
C C
R2
H
+
(C6H5)3P
O
окись трифенифосфина
алкен
Элиминирование третичных аминов из гидроксидов
тетраалкиламмония по А. Гофману
CH3
CH
H3C
+
HO
N
CH
H3C CH 3
3
H2C
H2O, 150 ОС
гидроксид триметилвтор-бутиламмония
H2C
H3C
CH
95%
CH2
+
HC
H3C
CH
5%
CH3
+
H 2O
C2H5OH-C6H6
+
+
R4N OH + AgCl
R4N Cl + AgOH
0-20 OC
тетраалкилгидроксид
аммоний хлорид
тетраалкиламмония
5
6.
Строение молекулыНаправления и формы орбиталей
sp2-гибридизованного атома углерода
2p
2sp2
2sp2
2sp2
p
sp2
C
sp2
= 120o
sp2
6
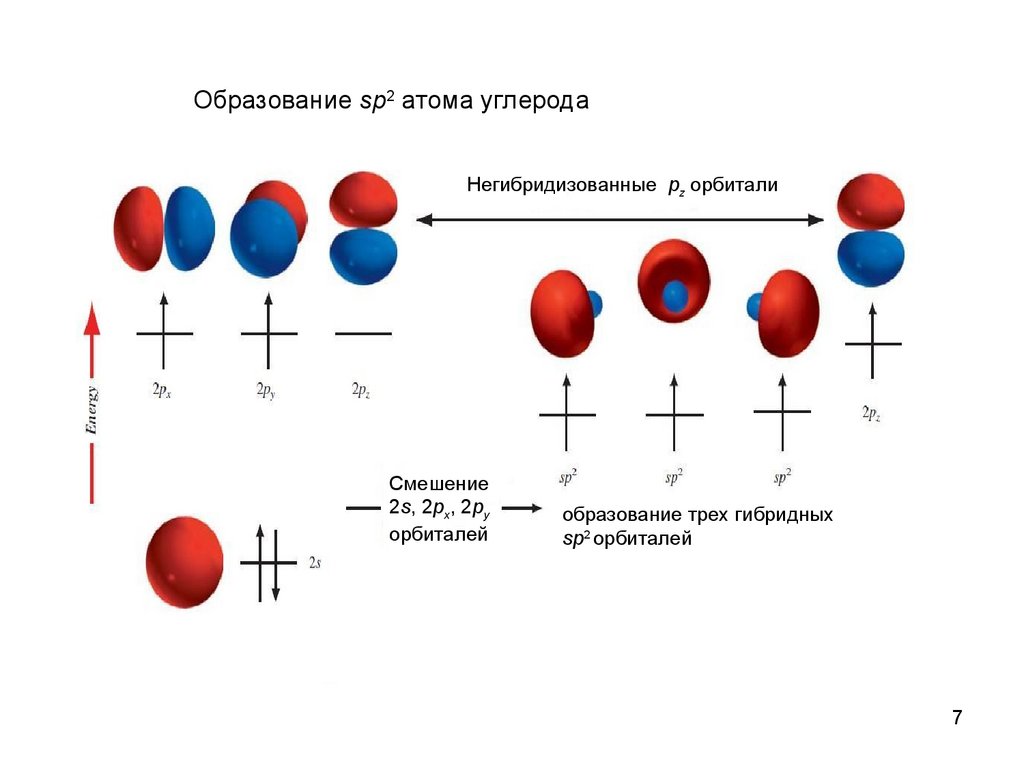
7.
Образование sp2 атома углеродаНегибридизованные pz орбитали
Смешение
2s, 2px, 2py
орбиталей
образование трех гибридных
sp2 орбиталей
7
8.
HH 1s
1s
2p
2sp2
2p
2sp2
C
2sp2
2sp2
C
2sp2
2sp
2
H
H 1s
1s
C-C
-связь
C-H
-связь
Перекрывание 1s орбиталей Н и
2sp2 орбиталей С образует
четыре -связи C-H.
Перекрывание двух 2sp2 орбиталей С
образует -связь C-С
H
H
C
C
H
H
C-C
-связь
H
H
C
H
C
H
Перекрывание двух 2p орбиталей С
образует -связь C-С
8
9.
НСМОВЗМО
9
10.
10,9 10-2 нмH
13,4 10-2 нм
C
C
H
H
H
117,5 О H
15,4 10-2 нм
C
C
H
H
121,2 О
11,0 10-2 нм
H
15,01.10-2 нм
109,5O
CH
H H3C
H
CH2
С-С -связь (347 кДж/моль)
С-С -связь (260 кДж/моль)
Энергия двойной связи
347+260 = 607 ≠ 694 (347 ∙2) кДж/моль
С-Н в этилене (435 кДж/моль)
С-Н в этане (405 кДж/моль)
Химические свойства
H3C
CH2
H2C
C C
X Y
CH3
H C CH2 C C
2
CH2
X Y
:
:
R Y
H3C
- HY
R
H3C
AdE
CH2
CH
C C
SR
CH2
H2C
R
C C
AdR
Y
10
11.
Гидрирование.C C
+ H2
кат., Т, Р
H H
C C
Åï
Åàêò í å êàòàëèçèðóåì î é ðåàêöèè
Åàêò êàòàëèçèðóåì î é ðåàêöèè
Òåï ëî òà
ãèäðèðî âàí èÿ
Õî ä ðåàêöèè
11
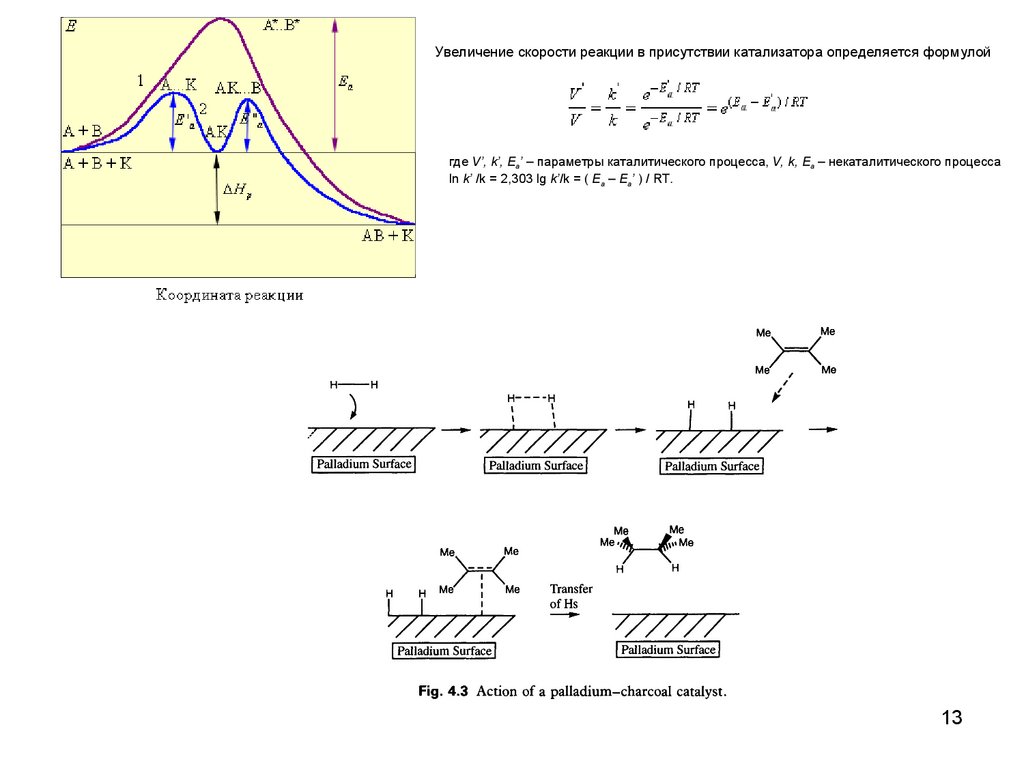
12.
1. На поверхности катализатораадсорбируется водород.
Водород переходит в активную
форму.
H
C*
H
C*
H
H
Ï î âåðõí î ñò ü
êàò àëèçàò î ðà
2. На поверхности катализатора 3. Атом водорода переносится
адсорбируется алкен и активи- с катализатора и присоедируется с разрывом двойной
няется к атому углерода.
связи.
H*
H*
Гидрирование этена
С*, H* - атомы углерода и водорода,
активированные на поверхности
катализатора
4. Второй атом водорода переносится с
поверхности катализатора и присоединяется к
углероду. Получившийся алкан десорбируется
с поверхности катализатора, освобождая место
для новых молекул алкена и водорода
12
13.
Увеличение скорости реакции в присутствии катализатора определяется формулойгде V’, k’, Ea’ – параметры каталитического процесса, V, k, Ea – некаталитического процесса
ln k’ /k = 2,303 lg k’/k = ( Ea – Ea’ ) / RT.
13
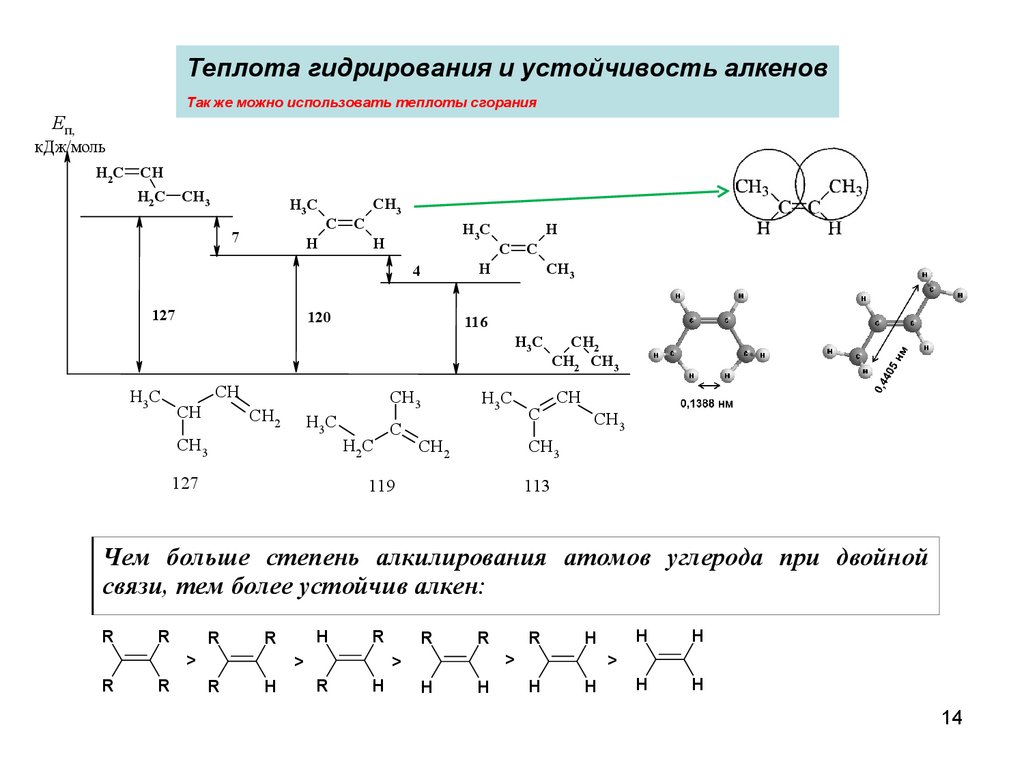
14.
Теплота гидрирования и устойчивость алкеновТак же можно использовать теплоты сгорания
Еп,
кДж/моль
H2C
CH
H 2C
CH3
H3C
7
C
H
C
CH3
H3C
H
C
H
4
127
H
C
120
CH3
116
H3C
H3C
CH
CH
CH2
H3C
CH3
127
CH3
H2C
C
H3C
CH2
C
CH2
CH2 CH3
CH
CH3
CH3
113
119
Чем больше степень алкилирования атомов углерода при двойной
связи, тем более устойчив алкен:
R
R
R
>
R
R
H
R
R
H
R
H
R
R
H
>
>
>
R
R
H
H
H
H
H
H
>
H
H
14
15.
.. .
C
C
C
Гиперконъюгация
Csp3
Csp2
Csp2 Csp3
CH3 CH CH CH3
Бут-2-ен
более устойчив
Свя зь Csp3
Csp3
Csp2
Csp3
Csp3
CH2 CH CH2 CH3
1-Бут-1-ен
менее устойчив
Csp2 более прочная , чем свя зь Csp3
Csp3
15
16.
Реакции электрофильного присоединения (AdE)Присоединение галогенов
H
H
CCl4 ; 25 OC H
Br
C C + Br2
C C H
H
H
H
Br
H
1,2-Äèáðî ì ýòàí
Электрофильное присоединение (AdE) –
это реакция, при протекании которой
в скорость лимитирующей стадии к
субстрату присоединяется электрофил.
v=k’ [алкен] [Br2] +k’’[алкен] [Br2]2 + k’’’[алкен] [Br2] [Br-]
Механизм реакции AdE
Первая стадия.
C
C
Br
Br
èëè
C
C
Br
Br
-êî ì ï ëåêñ
èëè
Br
Br
16
17.
ππ-электроны
С=С связи
17
18.
Вторая стадия.+
..
...Br...
......Br ..
C
sp3
C
....Br..
C
+
Âàêàí òí àÿ (í åçàí ÿòàÿ)
2p-î ðáèòàëü
-
sp3
C
Медленно
C
C
Br
+
.. ...Br. ..
.. ...Br. .. +
Br2
Br3
Несимметричный
ион бромония
18
19.
Третья стадия.Br3
sp3
C
Br
Br
C
C
+
C
Br2
Br
3
+
Циклический ион бромония
19
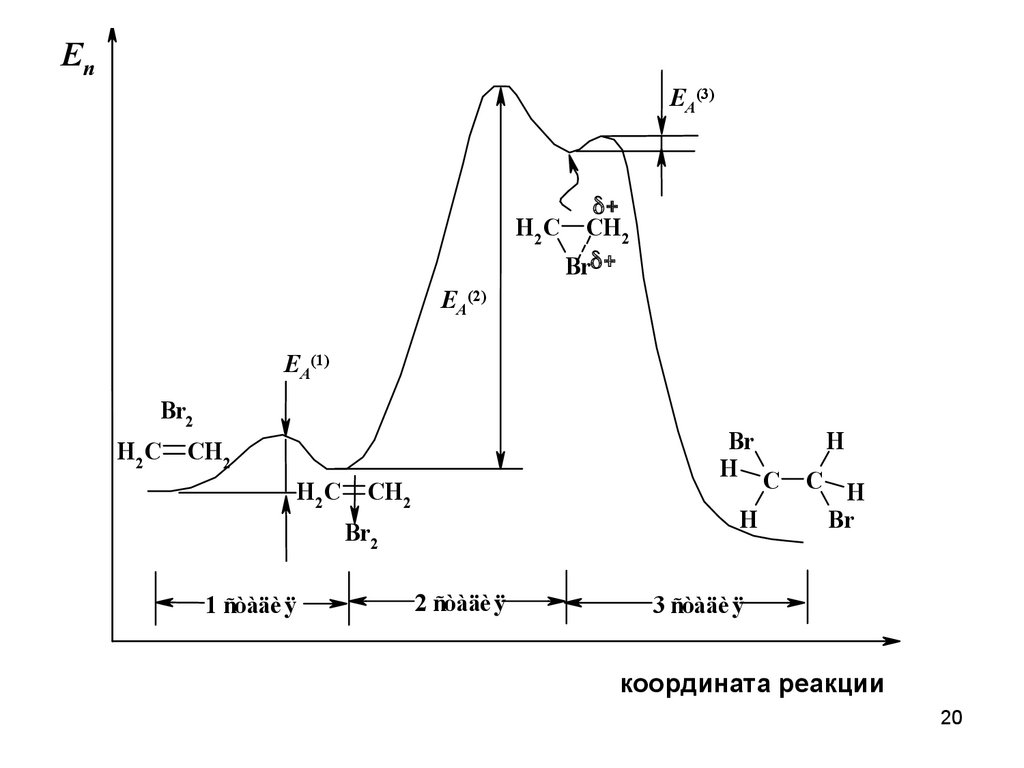
20.
ЕпEA(3)
H2C CH2
Br
EA(2)
EA(1)
Br2
H2C
Br
H C
CH2
H 2C
CH2
H
Br2
1 ñòàäè ÿ
2 ñòàäè ÿ
H
C H
Br
3 ñòàäè ÿ
координата реакции
20
21.
Сопряженное присоединениеH2C CH2
H2C CH2
Br2, NaCl
H2C CH2 + H2C CH2 ( но не H2C CH2 )
Br Br
Br Cl
Cl Cl
1,2-Дибром- 1-Бром-2этан
хлорэтан
Br2, H2O
H2C CH2
Br OH
2-Бромэтанол
+
Cl-
H2C CH2
H2C CH2
Br2, NaCl
H2C
Br Br
CH
Br
1,2-Дибромэтан
Br3-
+
H2C CH2 + H2C CH2
Br Br
Br Cl
1,2-Дибром- 1-Бром-2этан
хлорэтан
H2C CH2
Cl Cl
Не образуется
1,2-дихлорэтан
Основной
продукт
R1
Br , H O
HC CH2 2 2
R1
R1
HC CH2 + HC CH2
HO Br
Br Br
анти-Присоединение нуклеофила к циклическому иону бромония
Br3Br2, CCl4
Циклогексен
транс-присоединение
Br
+
Br
Атака циклического
иона бромония
циклогексена
(анти-присоединение)
H
H
Br
транс-1,2-Дибромциклогексан
Стереоспецифическим называется процесс, в котором орбразуется только один из
возможных стереоизомеров.
Стереоселективным называется процесс, в котором преимущественно
образуется один стереоизомер.
21
22.
Присоединение галогеноводородов (HCl, HBr, HI)C C
+
X
H C C
+ H X
HCl
эфир
Cl
+
Cl
(94%)
+
HBr
CH3COOH
+
(91%)
1-бром-1-метилциклогексан
+
1-метилциклогекс-1-ен
(6%)
Br
1-метилциклогекс-1-ен
Аналогично проходят реакции
присоединения дейтерогалогенов D-Cl,
D-Br, D-I
CH3COOD
DBr
(9%) Br
2-бром-1-метилциклогексан
+
D
Br
D
1-Бром-1-метил2-дейтероциклогексан (основной
продукт)
Br
22
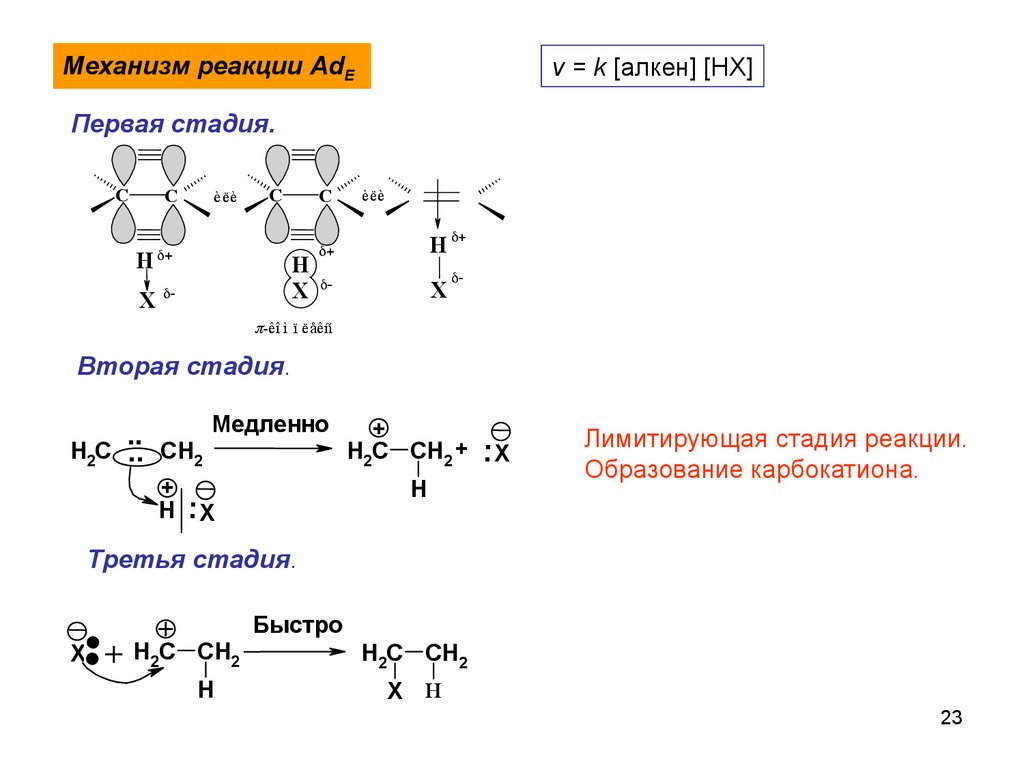
23.
Механизм реакции AdEv = k [алкен] [HX]
Первая стадия.
C
C
H
X
è ëè
C
C
H
X
èëè
H
X
-êî ì ï ëåêñ
Вторая стадия.
Медленно
+
..
H2C .. CH2
H2C CH2 + .. X
+ .
H .X
H
Лимитирующая стадия реакции.
Образование карбокатиона.
Третья стадия.
..+
X
Быстро
+
H2C CH2
H
H2C CH2
X H
23
24.
Порядок увеличения реакционной способности галогеноводородовпо отношению к алкенам совпадает с порядком увеличения их кислотности:
HF << HCI < HBr < HI.
Направление электрофильного присоединения
H3C
H3C
HC CH2+ HBr
CH
CH3
Br
H3C
(85 %)
2-Бромпропан
CH2Br
CH2
(15 %)
1-Бромпропан
1869 г. В. Марковников
Галогеноводороды, вода и другие протонные кислоты,
присоединяются к несимметричным алкенам таким образом,
что водород присоединяется к атому углерода, несущему
наибольшее число атомов водорода.
24
25.
(1)I.
H3C + CH3
CH
áû ñòðî
+
Âòî ðè÷í û é
H
H3C
êàðáî êàòèî í
HC CH2 ì åäëåí í î
(2)
+
CH2
CH2
H3C
Cl
CH
CH3
H3C
Cl
2-Õëî ðï ðî ï àí
Î ñí î âí î é ï ðî äóêò
ï ðè ñî åäèí åí èÿ
Cl
H3C
áû ñòðî
Ï åðâè ÷í û é êàðáî êàòèî í , ì åí åå óñòî é÷èâû é
CH3
(1)
Cl
H3C C CH3 áû ñòðî
+
II.
H3C
Òðåòè÷í û é
êàðáî êàòèî í
+
CH2 H
C
CH3
ì åäëåí í î
(2)
CH3
+ Cl
H3C HC CH2 áû ñòðî
Ï åðâè÷í û é êàðáî êàòèî í , ì åí åå óñòî é÷èâû é
(1)
III.
+
CH3 H
HC
H3 C
C
ì åäëåí í î
CH3
H3C
1-Õëî ðï ðî ï àí
CH3
H3C C CH3
Cl
2-Ì åòèë-2-õëî ðï ðî ï àí
Î ñí î âí î é ï ðî äóêò
ï ðèñî åäè í åí èÿ
CH3
H3C HC CH2Cl
2-Ì åòè ë-1-õëî ðï ðî ï àí
CH3
Cl
H2C C CH3 áû ñòðî
+
Òðåòè÷í û é
êàðáî êàòèî í
(2)
CH3
Cl
H3 C + HC
CH3 áû ñòðî
HC
Âòî ðè÷í û é êàðáî êàòèî í , ì åí åå óñòî é÷èâû é
CH Cl
CH2 2
Легкость образования карбокатионов
увеличивается в следующей
последовательности:
первичный < вторичный < третичный.
Устойчивость карбокатионов
увеличивается в следующей
последовательности:
первичный < вторичный < третичный.
CH3
H3C CH C CH
3
2
Cl
2-Ì åòèë-2-õëî ðáóòàí
Î ñí î âí î é ï ðî äóêò
ï ðèñî åäèí åí èÿ
CH3
H3C HC HC CH
3
Cl
2-Ì åòèë-3-õëî ðáóòàí
25
26.
Строение карбокатионавакантная pz-орбиталь
C
sp2-гибридизация
CH3+
C2H5+
+I-эффект алкильных групп, делокализация заряда.
H
H
H
R
R
<
C+ < R
R
C < R
C
C
R
H
H
H
Чем устойчивее карбокатион, тем легче он образуется.
26
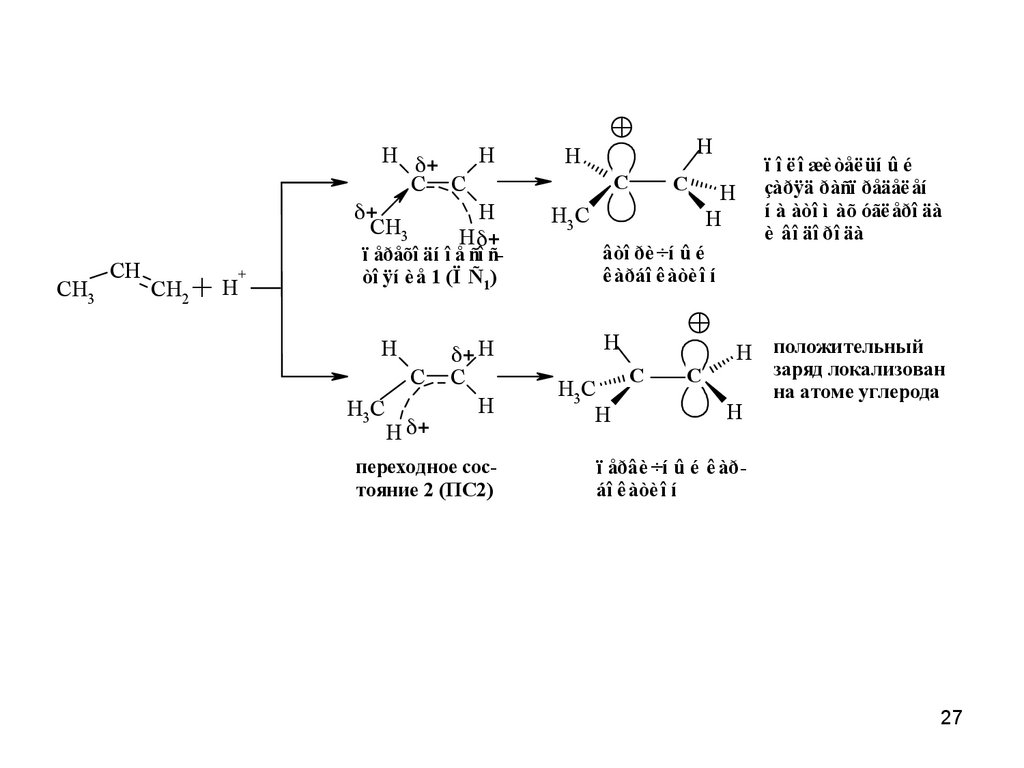
27.
HH
C C
H
CH3
H
CH3
CH
CH2
+H
+
ï åðåõî äí î å ñî ñòî ÿí è å 1 (Ï Ñ1)
H
C
H3 C
H
C
H
H
переходное состояние 2 (ПС2)
+
H
C
H
C
H
H
H3C
âòî ðè ÷í û é
ê àðáî ê àòè î í
+
H
H3C
H
C
ï î ë î æè òåë üí û é
çàðÿä ðàñï ðåäåë åí
í à àòî ì àõ óãë åðî äà
è âî äî ðî äà
H положительный
C
H
заряд локализован
на атоме углерода
ï åðâè ÷í û é ê àðáî ê àòè î í
27
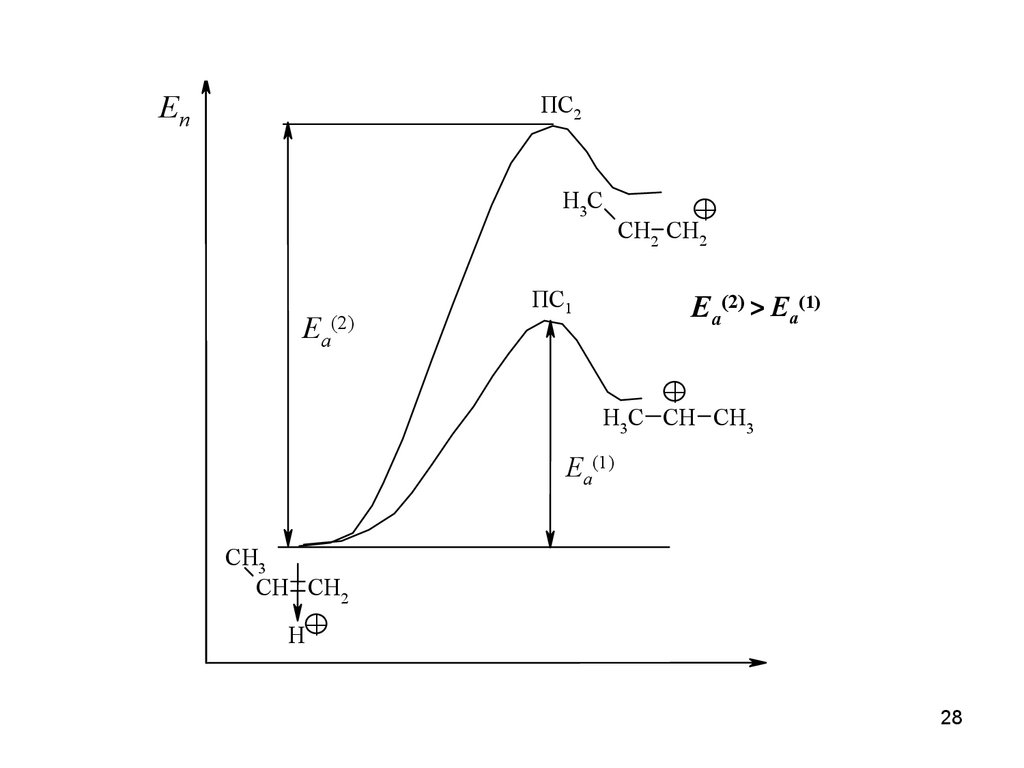
28.
ЕпПС2
H3C
Ea
(2)
+
CH2 CH2
ПС1
Ea(2) > Ea(1)
+
H3C CH CH3
Ea(1)
CH3
CH CH2
H
+
28
29.
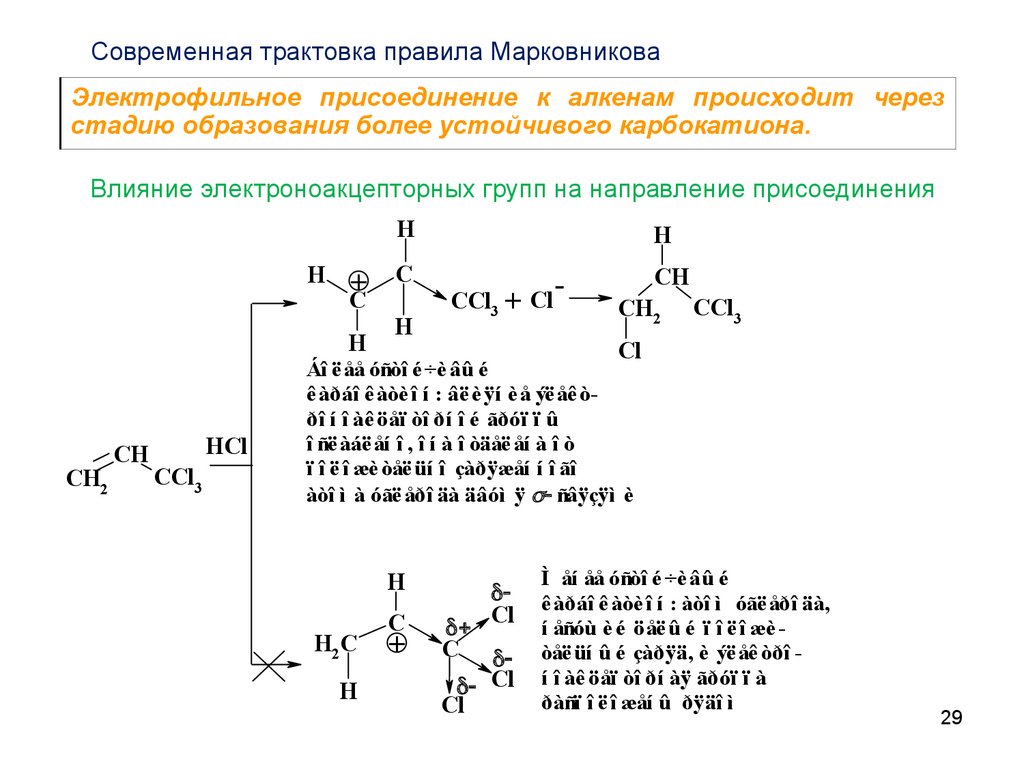
Современная трактовка правила МарковниковаЭлектрофильное присоединение к алкенам происходит через
стадию образования более устойчивого карбокатиона.
Влияние электроноакцепторных групп на направление присоединения
H
+
C
H
CH2
CH
HCl
CCl3
H
H
C
CH
H
CCl3 + Cl
CH2
CCl3
Cl
Áî ë åå óñòî é ÷è âû é
ê àðáî ê àòè î í : âë è ÿí è å ýë åê òðî í î àê öåï òî ðí î é ãðóï ï û
î ñë àáë åí î , î í à î òäåë åí à î ò
ï î ë î æè òåë üí î çàðÿæåí í î ãî
àòî ì à óãë åðî äà äâóì ÿ ñâÿçÿì è
H
H2C
H
C
+
Cl
C
Cl
Cl
Ì åí åå óñòî é ÷è âû é
ê àðáî ê àòè î í : àòî ì óãë åðî äà,
í åñóù è é öåë û é ï î ë î æè òåë üí û é çàðÿä, è ýë åê òðî í î àê öåï òî ðí àÿ ãðóï ï à
ðàñï î ë î æåí û ðÿäî ì
29
30.
Квантово-хиимические расчеты и правило Марковниковаφ=c1χ1+ c2χ2+…+ cμχμ+…+ cnχn
C2pz=0,4695
Cpz=- 0,6852
q = - 0,2260
Cpz=- 0,6209
C2pz=0,3855
C2pz=0,1639
Cpz=- 0,4048
NO2
q = - 0,1619
q =0,048
Cpz=- 0,5353
C2pz=0,2865
C2pz=0,3403
Cpz=0,5834
N(CH3)2
Cpz=0,3019
C2pz=0,0911
NO2
q = - 0,043
q = - 0,3168
N(CH3)2
q = - 0,0405
Cpz - коэффициенты а.о. атомов углерода в ВЗМО алкена
q - заряды на атомах углерода.
30
31.
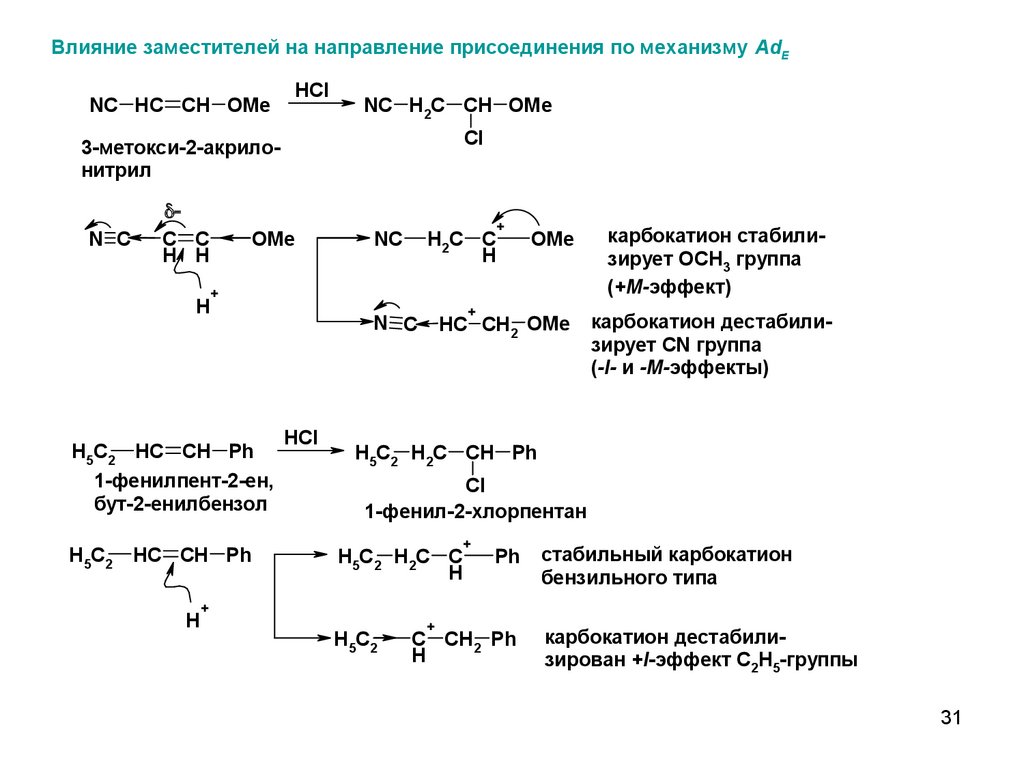
Влияние заместителей на направление присоединения по механизму AdENC HC CH OMe
HCl
NC H2C CH OMe
Cl
3-метокси-2-акрилонитрил
N C
C C
H H
H
OMe
HC CH Ph
H
H2C C
H
+
OMe
+
H5C2 HC CH Ph
1-фенилпент-2-ен,
бут-2-енилбензол
H5C2
NC
+
N C
HCl
HC CH2 OMe
карбокатион стабилизирует OCH3 группа
(+M-эффект)
карбокатион дестабилизирует CN группа
(-I- и -M-эффекты)
H5C2 H2C CH Ph
Cl
1-фенил-2-хлорпентан
H5C2 H2C C
H
+
Ph
стабильный карбокатион
бензильного типа
+
H5C2
+
C CH2 Ph
H
карбокатион дестабилизирован +I-эффект C2H5-группы
31
32.
Примеры сопряженного присоединения к алкенам AdECl2
NC HC CH OMe
H2O
3-метокси-2-акрилонитрил
N C HC CH
NC
-CH3OH
Cl OH
полуацеталь
+
OMe
NC HC CH OMe
Cl
Cl2
H5C2 HC CH Ph
1-фенилпент-2-ен,
бут-2-енилбензол
H5C2
HC CH Ph
Cl
карбокатион стабилизирует OCH3 группа
(+M-эффект)
+
NC HC CH OMe карбокатион дестабилизирует CN группа
Cl
(-I- и -M-эффекты)
Cl2
H2O
H5C2
HC CH Ph
Cl OH
1-фенил-2-хлор-1-пентанол
H5C2
+
HC CH Ph
Cl
Cl2
NC
HC CH OMe
O
HC CH
H5C2
+
HC CH Ph
Cl
стабильный карбокатион
бензильного типа
карбокатион стабилизирован
+I-эффектом C2H5-группы
32
33.
Реакционная способность и селективностьНаиболее реакционноспособным должен быть алкен,
дающий наиболее устойчивый карбокатион:
CH3
C
CH3
CH3
CH2 > HC
CH2
>
H2C
CH3
+
C CH3
CH3
CH2
CH3
+
> HC CH3
>
+
CH2 CH3
Устойчивость карбокатионов возрастает
Реакционная способность возрастает
Перегруппировка
H3C
C
H
CH3
CH3
CH3
CH2 + HCl
C
H
3-Метилбут-1-ен
H3C
C
H
H
C
CH3
Cl
2-Метил-3-хлорбутан
+ H3C
C
Cl
CH2
CH3
2-Метил-2-хлорбутан
33
34.
Механизм реакцииCH3
H3C
CH
CH3
CH
CH2 + HCl
H3C CH
3-Метилбут-1-ен
C
..
CH3
~H
+
CH
CH3
гидридный сдвиг
H3C
H
Вторичный
карбокатион
H3C
H3C
CH
+
CH
CH3 + Cl
Вторичный
карбокатион
..
H3C
H3C
+
CH
C
+
CH
..
CH3
H
Третичный карбокатион,
более устойчивый
CH3
CH3
+
Cl
H3C
CH
CH
CH3
Cl
2-Метил-3-хлорбутан
CH3
CH3
H3C
C
+
CH2
CH3
+
Cl
H3C
C
CH2
CH3
Cl
2-Метил-2-хлорбутан
34
35.
CH3CH3
CH3
H3C C CH CH2 + HCl
H3C C
CH3
H3C
CH
CH3 + H3C C CH
CH3
Cl CH3
Cl
Механизм реакции
CH3
H3C
+
H3C C CH
H3C C CH CH2 + HCl
CH3
3,3-Диметилбут-1-ен
CH3
+
H3C C CH CH3
..
CH3
CH3
H3C C CH CH3
+ ..
CH3
CH3
CH3
Cl
CH3
Вторичный карбокатион
H3C C
CH
CH3
H3C Cl
2,2-Диметил-3-хлорбутан
.
~ . CH3
перегруппировка
1,2-алкильный сдвиг
Cl
Третичный карбокатион
CH3
H3C C CH
CH3
Cl CH3
2,3-Диметил-2-хлорбутан
Перегруппировка происходит в том случае, если при 1,2-сдвиге
гидрид-иона или отрицательно заряженной CH3-группы может
образоваться более устойчивый карбокатион.
35
36.
Присоединение серной кислотыO
O
H3C HC CH CH3 + HO S OH
H3C CH2 CH O S OH
O
CH3
O
втор-Бутилгидросульфат
Механизм реакции AdE
O
+ HO
H3C HC CH CH3
O
S OH
H3C HC CH CH3
O
H
+
+O
S OH
O
-êî ì ï ëåêñ
H3C HC CH CH3
H
H3C
+
-êî ì ï ëåêñ
CH CH CH3
H
-êî ì ï ëåêñ
+
..
+
H3C CH CH CH3
+
H3C CH2 CH CH3
H3C CH2 CH CH3
O
H
O
O
O
O
H
S
H
H
S
O S O
O
H
O
O
O
OH
+
+
H
36
37.
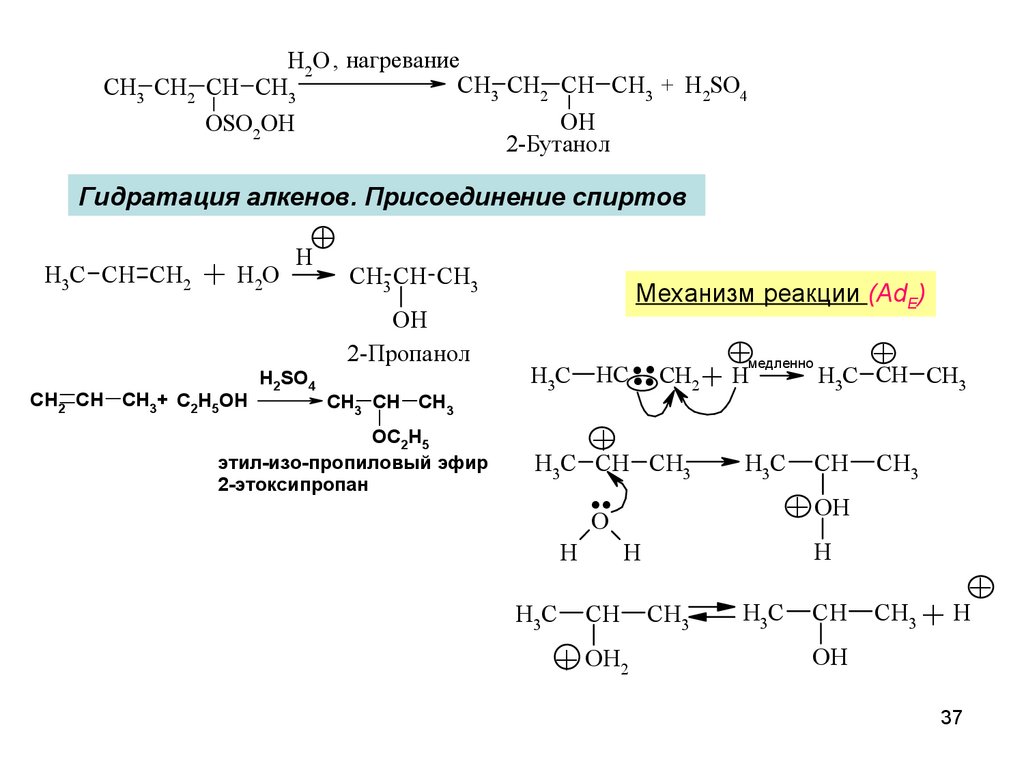
H2O , нагреваниеCH3 CH2 CH CH3 + H2SO4
CH3 CH2 CH CH3
OH
OSO2OH
2-Бутанол
Гидратация алкенов. Присоединение спиртов
H3C CH CH2
+ H2O
+
H
CH3 CH CH3
OH
2-Пропанол
CH2 CH CH3+ C2H5OH
H2SO4
CH3 CH CH3
OC2H5
этил-изо-пропиловый эфир
2-этоксипропан
Механизм реакции (AdE)
H3C
HC
..
CH2
+
..
H3C CH CH3
+
+
H
H3C CH CH3
H3C
CH
H3C
CH3
+ OH
O
H
+
медленно
H
H
CH
+ OH2
CH3
H3C
CH
CH3
+
+
H
OH
37
38.
Оксимеркурирование-демеркурирование (AdE)Региоселективное получение спиртов в соответствии с правилом
Марковникова. Сопряженное присоединение.
1) Hg(OAc)2; ТГФ-H2O; 20 OC
CH3
2) NaBH4; H2O
H3C C CH CH3
H3C C CH CH2
CH3
CH3
+
CH3
H3C C CH2 CH2 OH
H3C OH
3,3-диметилбутан-2-ол
(97%)
1) Hg(OAc)2; ТГФ-H2O; 20 OC
2) NaBH4; H2O
H3C CH2 CH CH2
H3C CH2 CH CH3
3
3
OH
1-гексен
гексан-2-ол
(99,5%)
CH3
3,3-диметилбутан-1-ол
+
H3C CH2 CH2 CH2 OH
3
гексан-1-ол
(0,5%)
Отсутствуют перегруппировки
ТГФ
O
38
39.
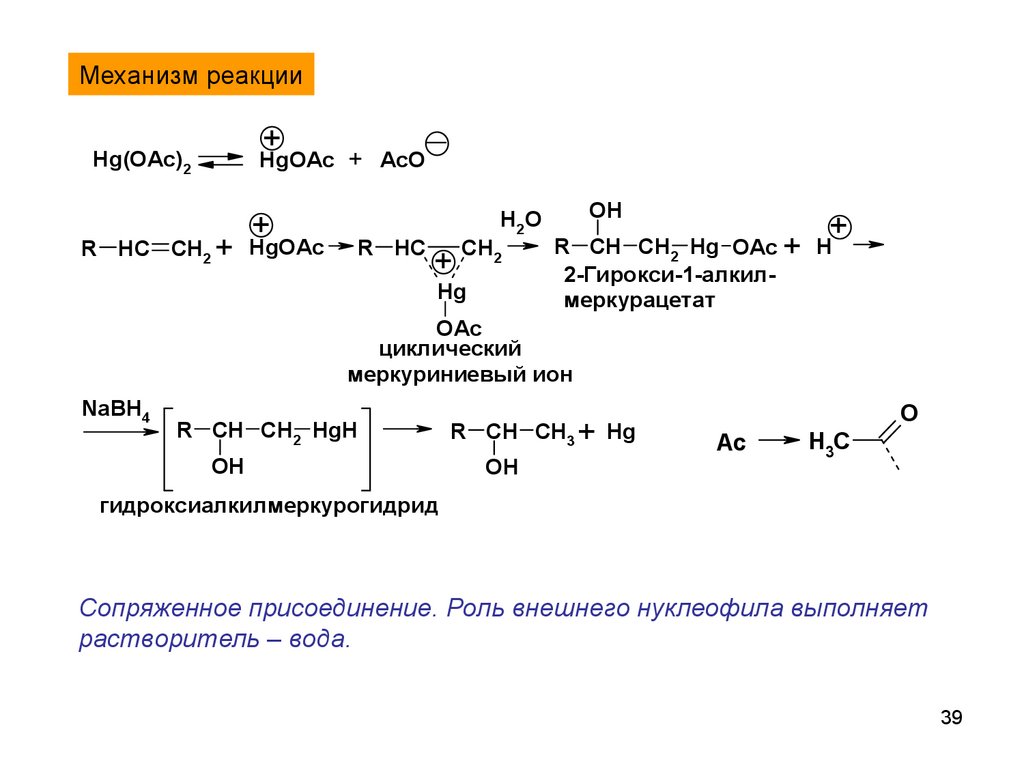
Механизм реакции+
HgOAc + AcO
Hg(OAc)2
+
R HC CH2 + HgOAc
R HC
H2O
+
CH2
Hg
OH
+
R CH CH2 Hg OAc + H
2-Гирокси-1-алкилмеркурацетат
OAc
циклический
меркуриниевый ион
NaBH4
R CH CH2 HgH
OH
R CH CH3 + Hg
OH
O
Ac
H3C
гидроксиалкилмеркурогидрид
Сопряженное присоединение. Роль внешнего нуклеофила выполняет
растворитель – вода.
39
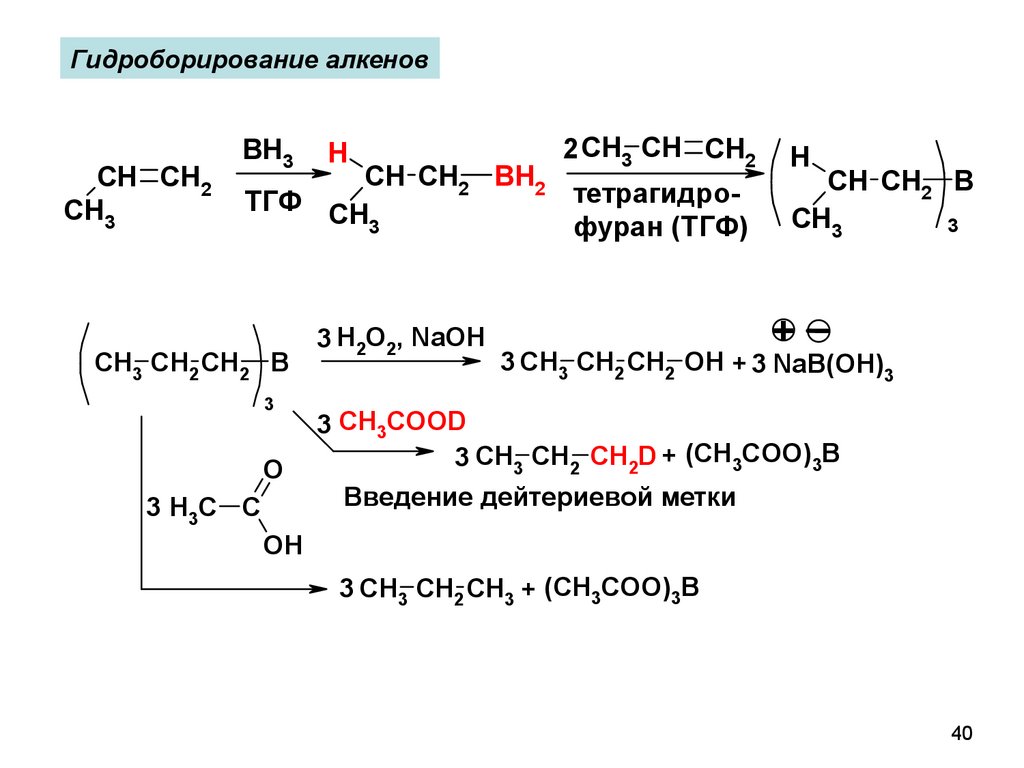
40.
Гидроборирование алкеновCH CH2
CH3
BH3
H
2 CH3 CH CH2
CH CH2 BH2
тетрагидроТГФ CH
3
фуран (ТГФ)
CH3 CH2 CH2 B
3
O
3 H3C C
3 H2O2, NaOH
H
CH CH2 B
CH3
3
+
3 CH3 CH2 CH2 OH + 3 NaB(OH)3
3 CH3COOD
3 CH3 CH2 CH2D + (CH3COO)3B
Введение дейтериевой метки
OH
3 CH3 CH2 CH3 + (CH3COO)3B
40
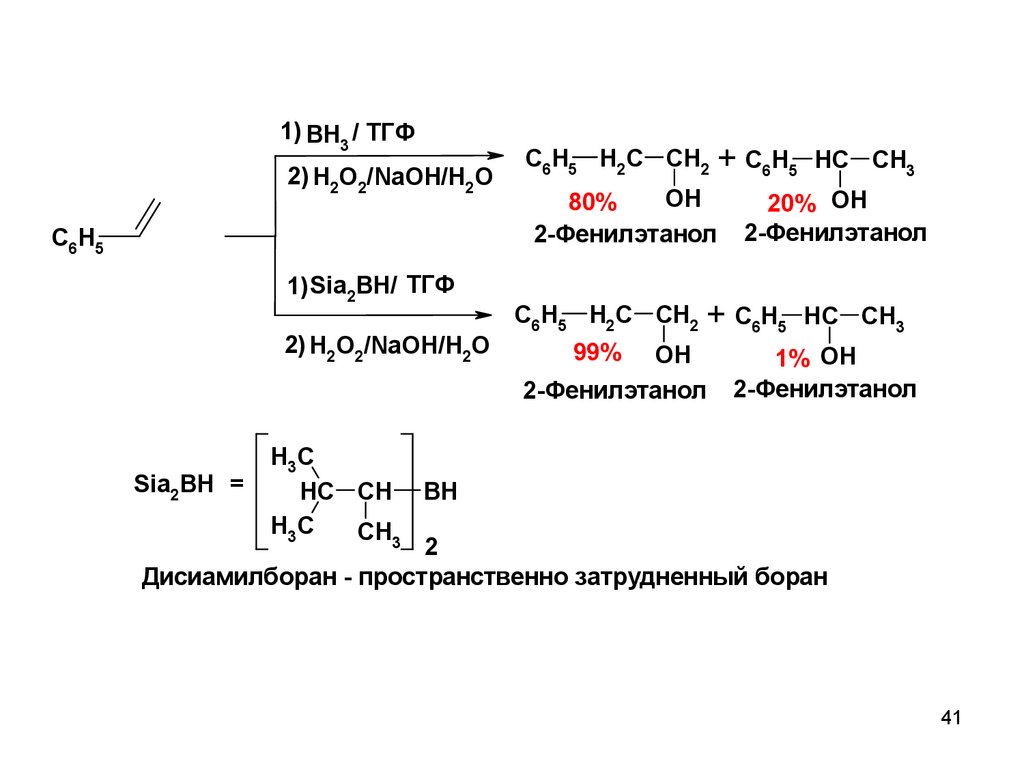
41.
1) BH3 / ТГФ2) H2O2/NaOH/H2O
C6H5
C6H5 H2C CH2 + C6H5 HC CH3
OH
80%
2-Фенилэтанол
20% OH
2-Фенилэтанол
1) Sia2BH/ ТГФ
C6H5 H2C CH2 + C6H5 HC CH3
2) H2O2/NaOH/H2O
99% OH
1% OH
2-Фенилэтанол
2-Фенилэтанол
H3C
Sia2BH =
HC CH BH
H3C
CH3
2
Дисиамилборан - пространственно затрудненный боран
41
42.
Механизм реакцииq-заряды на атомах
q = - 0,2260
q = - 0,1619
CH3
CH3
CH CH2
H BH2
Электроотрицательность
водорода 2,1 > бора 1,9
Стерический фактор
CH3
CH3
CH2
H
BH2
CH3
CH
CH2
H
BH2
CH2
H
ПС1-более
BH2 стабильно
CH
+
CH2
H2B
Rбора > Rводорода
+
CH
+
CH
ПС2
H
CH3
CH
CH2
H
BH2
42
43.
Алкилирование алкеновCH3
H3C CH + H2C C
CH3
H2SO4 или HF
CH3
CH3
CH3
CH3
CH3 C CH2CH CH3
CH3
2,2,4-Триметилпентан
Механизм реакции (AdE)
CH3
+
H + H2C C
CH3
CH3
+
H3C C +
CH3
CH3
H3C C +
(I) CH3
CH3
CH2 C
CH3
CH3
CH3
.
H3C C CH2C + + H . C CH3
CH3
CH3
CH3
CH3
CH3
CH3
H3C C CH2 C +
CH3
CH3
(II)
CH3
CH3
CH3
CH3C CH2 CH + + C CH3
CH3 CH3 CH3
2,2,4-Триметилпентан
43
44.
Радикальные реакции алкеновВ реакцию радикального присоединения
к алкенам могут вступать хлор и бром.
Йод в этой реакции мало актитивен.
Галогенирование алкенов
h , T
+
Br
Br2
Br
бут-1-ен
1,2-дибромбутан
Механизм реакции AdR
1.
.. . .. .
.. Br
.. .
. . . Br
УФ-облучение
..
2 ..Br
.. .
Br
2. Br .
+
H2C
вторичный радикал,
CH3
более устойчивый
CH2
Br
бут-1-ен
атом
брома
HC
H2C
CH
CH3
CH2
первичный радикал,
менее устойчивый
Br
3. Br
HC
H2C
CH3
CH2
вторичный
радикал
+
Br2
Br
1,2-дибромбутан
+
.
Br
атом
брома
44
45.
Присоединение бромистого водорода в присутствиипероксидов (AdR)
ROOR
CH CH2 + HBr
CH3
CH2
Br
Перекисный эффект Хараша, 1929 г.
CH2
1-Бромпропан
CH3
CH3
Механизм реакции
H3C C N N C CH3
CN
CN
азо-бис-изобутиронитрил (АИБН)
1. Инициирование:
O O
C6H5
C
T или h
C C6H5
2C6H5
O O
перекись бензоила
O
C6H5 C + H .. Br
.
O
.+
H2C
Br
.
..
CH2
CH CH3
+
CH
H
O
C6H5
Br
C
H3C C O OH
CH3
гидроперекись
трет-бутила
H2O2
перекись
водорода
.
C
.
+ Br
O H
. ..
. ...
Образование атома Br· энергетически более выгодно,
чем образование атома H
·
Br CH2 CH CH3
H = -13 кДж/моль
вторичный радикал,
более устойчивый
CH3
..
O
CH3
O
2. Рост цепи:
Br
CH3
CH2 CH CH3
H = 13 кДж/моль
Br
первичный радикал,
менее устойчивый
Br
CH
CH2 2 CH3
.
+ Br
H = -29 кДж/моль
1-Бромпропан
45
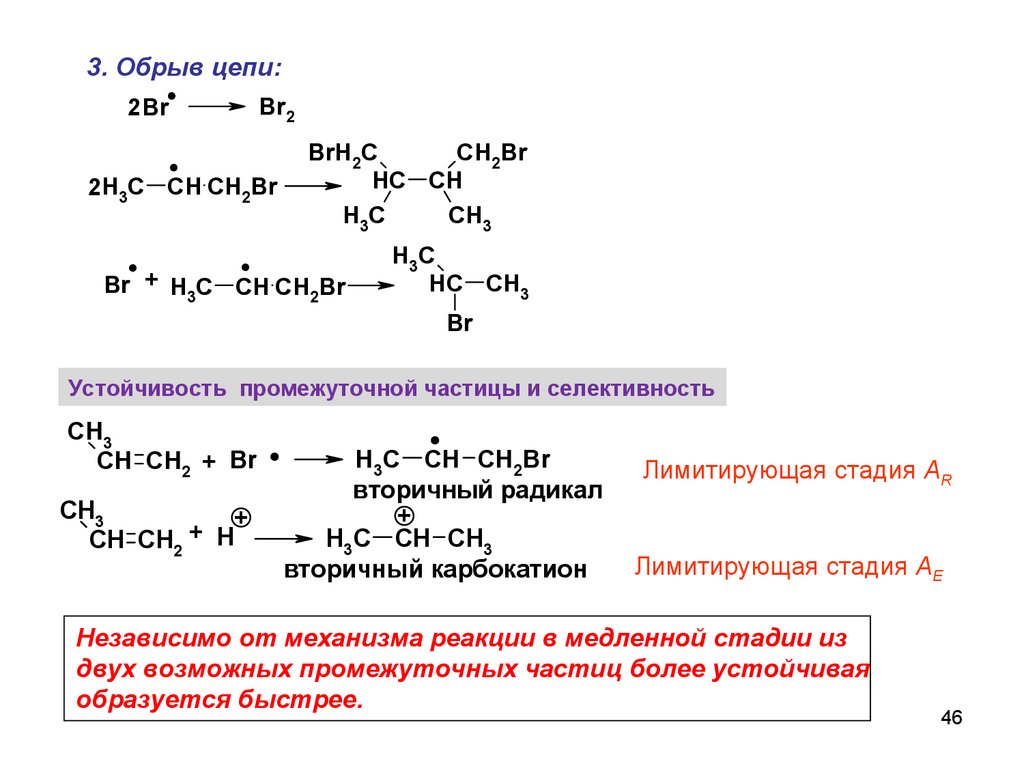
46.
3. Обрыв цепи:.
.
Br2
2 Br
CH2Br
BrH2C
HC CH
H3C
CH3
2H3C CH CH2Br
.
.
+
Br
H C CH CH Br
3
2
H3C
HC CH3
Br
Устойчивость промежуточной частицы и селективность
CH3
CH CH2 + Br
CH3
+
+
H
CH CH2
.
.
H3C CH CH2Br
вторичный радикал
+
H3C CH CH3
вторичный карбокатион
Лимитирующая стадия AR
Лимитирующая стадия AE
Независимо от механизма реакции в медленной стадии из
двух возможных промежуточных частиц более устойчивая
образуется быстрее.
46
47.
Реакция аллильного замещения. ГалогенированиеH2C
CH
CH2
CH3
>300 OC
+ Cl2
H3C
CH2
CH
Cl
2-хлорбутан
-HCl
бут-1-ен
Механизм реакции SR
300 OC
Cl2
2Cl
.
CH3
.
2
- HCl
CH CH2
Более устойчивый
аллильный радикал
Cl2
+ Cl2
CH2
CH2 CH
- HCl
.
CH
.
CH + Cl
Cl2
2 Cl
CH
CH3
CH2
2
CH2
+
+
Cl
3-Хлорбут-1-ен
CH
Cl
- HCl
CH2
CH
3-Хлорбут-1-ен
Br
tO
Cl
1-Хлорбут-2-ен
CH3
Cl2
Cl
2
Cl
N Br
~ 400 OC
Бут-1-ен
CH2 CH
O
+
Аллильная перегруппировка
Cl
Менее устойчивый
радикал
CH3 CH CH2 + Cl
.
CH
.
CH
CH2
CH3
CH2
CH2
Cl
1-хлорбутан
CH3 +
CH
H2C
CH
CH3
Cl
1-Хлорбут-2-ен
O
+
NH
CCl4
циклогексен
O
N-бромсукцинимид
(NBS)
2-бромциклогексен
O
сукцинимид
47
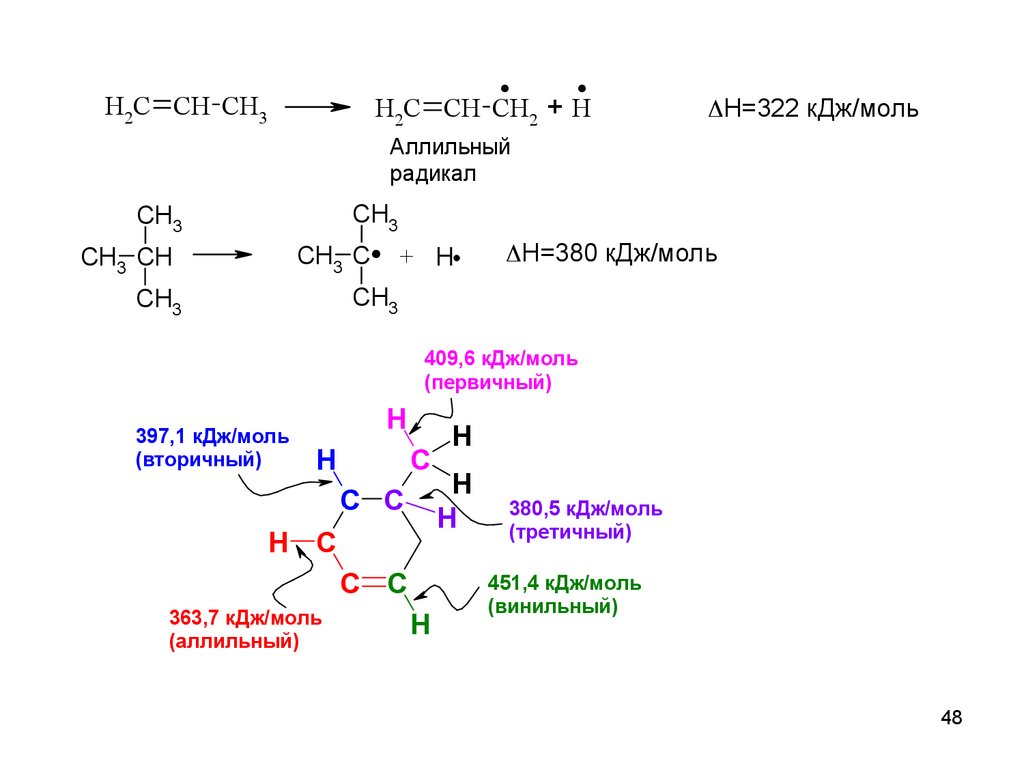
48.
. +.H2C CH CH3
H2C CH CH2
H
H=322 кДж/моль
Аллильный
радикал
.
CH3
CH3
CH3 C
CH3 CH
+ H
H=380 кДж/моль
CH3
CH3
409,6 кДж/моль
(первичный)
397,1 кДж/моль
(вторичный)
H
H
C
C C
H C
C C
363,7 кДж/моль
(аллильный)
H
H
H
H
380,5 кДж/моль
(третичный)
451,4 кДж/моль
(винильный)
48
49.
Ряд устойчивости свободных радикалов:метильный < первичный < вторичный <
аллильный.
.
C
C
третичный <
Делокализация неспаренного
электрона в аллильном радикале
C
электронная
0,703 д.е.
-0,406 д.е. плотность
0,703 д.е.
.
CH2
CH
CH2
0,138 нм 0,138 нм
1,455
1,455 порядок
связи
49
50.
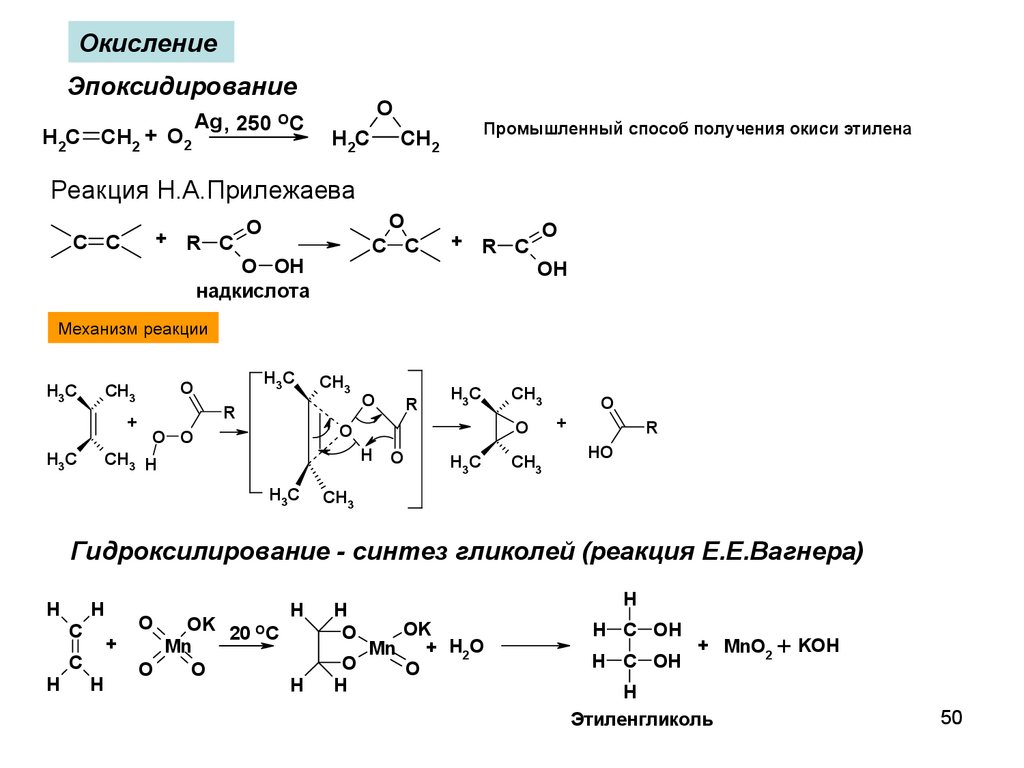
ОкислениеЭпоксидирование
H2C CH2 + O2
Ag , 250 OC
O
H2C
Промышленный способ получения окиси этилена
CH2
Реакция Н.А.Прилежаева
+ R C
C C
O
O
C C
O OH
надкислота
O
+ R C
OH
Механизм реакции
H3C
+
H3C
H3C
O
CH3
R
CH3
O
R
H3C
O
O
O O
H
CH3 H
H3C
CH3
O
H3C
CH3
O
+
R
HO
CH3
Гидроксилирование - синтез гликолей (реакция Е.Е.Вагнера)
H
H
C
+
C
H
O
H
OK 20 OC
Mn
O
O
H
H
H
O
OK
+ H2O
Mn
O
O
H
H
H C OH
H C OH
+ MnO2 + KOH
H
Этиленгликоль
50
51.
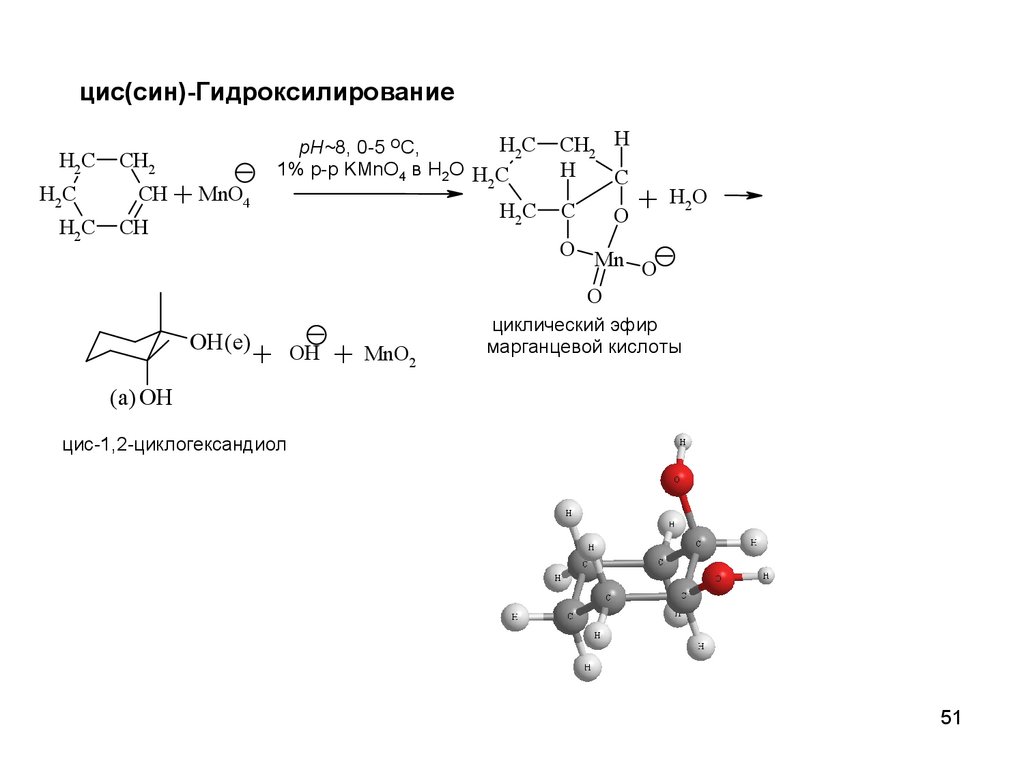
цис(син)-ГидроксилированиеH2C
H2C
H2C
CH2
CH
H2C
pH~8, 0-5 OC,
1% р-р KMnO4 в H2O H C
2
+ MnO4
H2C
CH
CH2 H
H
C
C
+
O
H2O
O Mn
O
O
OH (е)
+
OH
+
MnO2
циклический эфир
марганцевой кислоты
(а) OH
циc-1,2-циклогександиол
51
52.
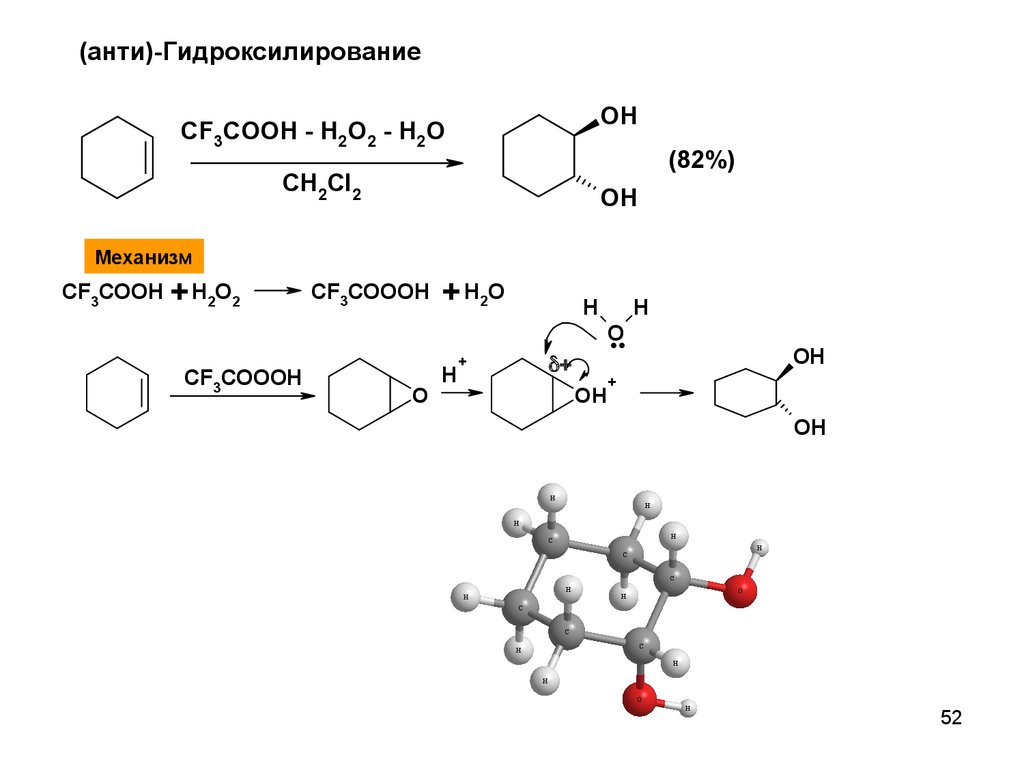
(анти)-ГидроксилированиеOH
CF3COOH - H2O2 - H2O
(82%)
CH2Cl2
OH
Механизм
CF3COOH + H2O2
CF3COOOH
CF3COOOH
O
+ H2O
H
+
H
OH
O
..
H
OH
+
OH
52
53.
Гидроксилирование алкенов реагентом Майласа, перекисью водорода,по реакции Вагнера, реакция Криге
OH
H2O2, OsO4 , 0 OC
H
син-гидроксилирование
OH
(реактив Майласа)
H
цис-1,2-Циклогександиол
H2O2, CH3COOH, H2SO4
OH
KMnO4, H2O, 20 OC, pH=7
H анти-гидроксилирование
(реакция Вагнера)
OH
1) OsO4, 25 OC
H
2) NaHSO3/H2O
транс-1,2-Циклогександиол
(реакция Криге)
53
54.
Окисление с разрывом углерод-углеродной связиCH3 HC CH CH3
CH3C CH CH3
CH3
KMnO4 , H +
нагревание
KMnO4, H
OH
OH
Уксусная кислота
+
H3C C O + O C CH3
нагревание
CH3
OH
Ацетон
Уксусная кислота
CH3 CH CH CH2
CH3
H3C C O + O C CH3
KMnO4, H
+
O
CH3 CH C + CO2 + H2O
нагревание
OH
CH3
изомасляная кислота
54
55.
ОзонолизМетод определения структуры алкена
O O
H3C C CH CH2 CH3 + O3
H3C C
CH3
CH3
Озонид
H2O, Zn
O O
H3C C
O
CH3
O
CH CH2 CH3
CH CH2 CH3
H3C C O + O CH CH2 CH3
CH3
Ацетон
Пропаналь
OH
H2O2, CH3COOH
H3C C O + O C
CH3
Ацетон
CH2 CH3
Пропионовая
кислота
55
56.
Механизм реакцииR2
R1
H
....O..
C C
+
..
O
H
R2
H C C H
O
O
O
H
.... ....
..
..
..
O
..
мольозонид
(1,2,3-триоксолан)
....O
R1
C
R1
+
..O . .
...O.
H
C
R1
R2
..O
..
C
C
....O O....
R2
озонид
биполярный альдегид
ион
Если в смеси присутствует два альдегида,
то образуется смешанный озонид
56
57.
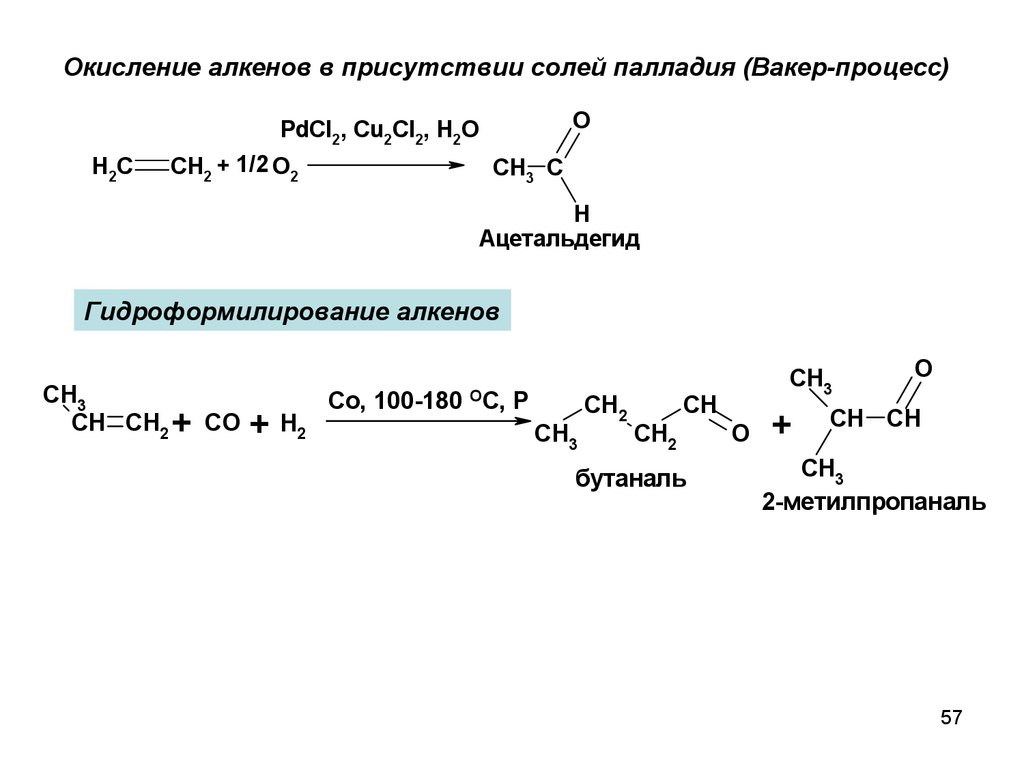
Окисление алкенов в присутствии солей палладия (Вакер-процесс)O
PdCl2, Cu2Cl2, H2O
H2C
CH2 + 1/2 O2
CH3 C
H
Ацетальдегид
Гидроформилирование алкенов
CH3
CH CH2 + CO
+
H2
Co, 100-180 OC, P
CH3
CH2
CH3
CH
CH2
бутаналь
O
+
O
CH CH
CH3
2-метилпропаналь
57
58.
Полимеризация алкеновПолимеризация – химический процесс присоединения молекул ненасыщенного
углеводорода одна к другой за счет разрыва π-связей и образования новых -связей.
n H2C CH2
мономер
CH2 CH2 n *
*
n - степень полимеризации
полимер
Полимер - это макромолекула, состоящая из очень большого числа повторяющихся звеньев.
Он образуется путем последовательного присоединения малых молекул, называемых мономерами.
Полимер, получаемый из одинаковых мономеров, называется гомополимером.
Полимер, получаемый из двух различных мономеров – сополимером или гетерополимером.
Степень полимеризации – число молекул мономера, соединяющихся друг с другом в молекуле полимера.
nA –A–A–A–A– или
An
гомополимер
mB + nA
–A–B–B–A–B–A–A–B–B–A–
сополимер (случайное расположение)
X––Y
Инициатор
полимеризации
+
nA
X––(An)––Y
концевые группы
58
59.
Катионная полимеризация[H+]
CH3
n H2C C
CH3
CH3
H3C C
CH3
CH2 C
CH2 C CH2
n-2
CH3
CH3
CH3
Инициаторы: AlCl3, BF
полиизобутилен
AdE
Механизм
H+ + (BF3)OH-
BF3 + H2O
H
+ +
H C C
C C
+
+
H C C
C C
+
H C C
C C
+
H H
H C C nC C +
..
H H
H C C n CH CH2 + H
+
59
60.
Анионная полимеризацияn H2C CH
NaNH2
H2N
CH2 CH
C
N
C
N
R
n
полиакрилонитрил
(орлон)
Механизм
+
Na
NH2 + H2C CH
C
N
H2N CH2 CH
C
N
H2N CH2 CH + H2C CH
CN
H2N CH2 CH CH2 CH
CN
CN
+
H2N CH2 CH CH2 CH CH2 CH + H
CN
CN n
CN
CN
H2N CH2 CH CH2 CH CH2 CH2
CN
CN n
CN
60
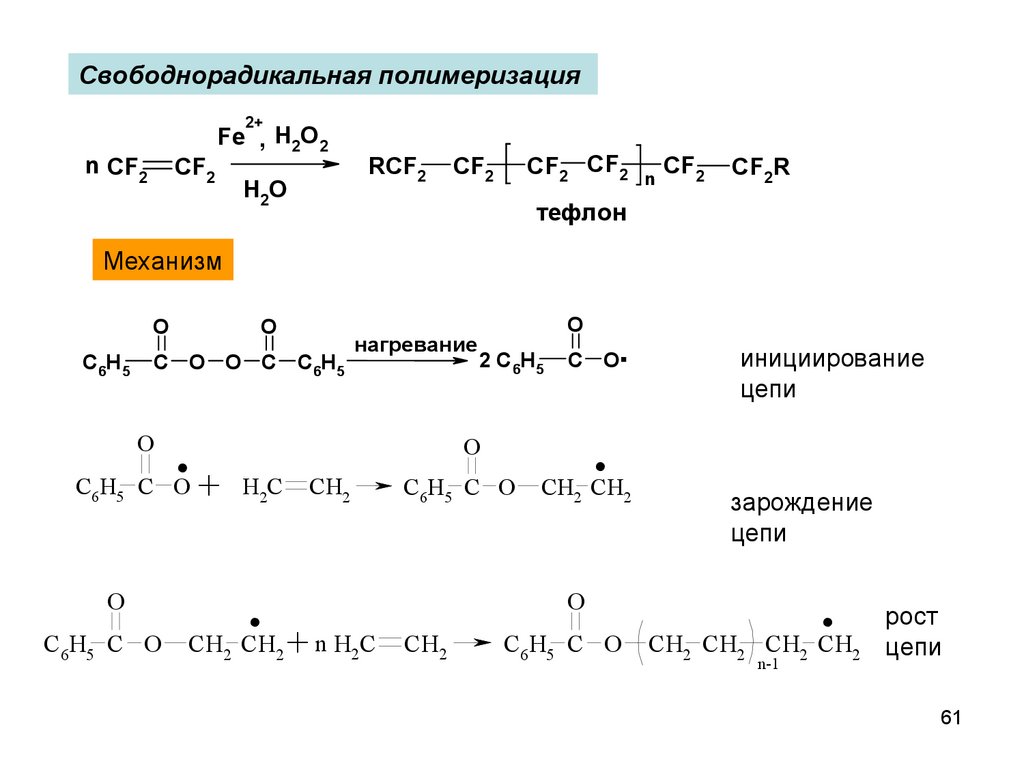
61.
Свободнорадикальная полимеризация2+
n CF2
CF2
Fe , H2O2
H2O
RCF2
CF2 CF2
CF2
n
CF2
CF2R
тефлон
Механизм
O
C6H5
O
C O O C C6H5
O
.+
C6H5 C O
O
C6H5 C O
нагревание
O
2 C6H5
C O.
.
O
H2C
.+
CH2 CH2
CH2
C6H5 C O
CH2 CH2
инициирование
цепи
зарождение
цепи
.
O
n H2C
CH2
C6H5 C O
CH2 CH2 CH2 CH2
n-1
рост
цепи
61
62.
обрыв цепи.
O
2 C6H5 C O CH2 CH2 CH2 CH2
n-1
O
O
C6H5 C O CH2 CH2 CH2 CH2 CH2 CH2 CH2 O C C6H5
n-1
n-1
рекомбинация
O
C6H5 C O
. +.
CH2 CH2 CH2 CH2 O C C6H5
CH2 CH2 CH2 CH2
n-1
O
n-1
O
O
C6H5 C O
+ H2C
CH2 CH2 CH2 CH3
n-1
CH CH2 CH2 O C C6H5
n-1
диспропорционирование
62
63.
Полимеризация несимметричных алкенов протекает по типу «голова кхвосту», через стадию образования более устойчивой промежуточной
частицы (радикала, катиона, аниона)
"хвост"
.+
R
.
R CH2 CH
HC CH2
C6H5
"голова"
H2C CH
C6H5
C6H5
C6H5
более устойчивый
радикал
R
.
R CH2 CH CH2 CH2
C6H5
.
CH CH2
C6H5
менее устойчивый
радикал
"хвост"
"хвост"
"голова"
CH3
+
H3C C
H3C
C CH2
H3C
+
+
H
CH3 "голова"
H2C C
CH3
CH3
более устойчивый
карбокатион
H3C
+
HC CH2
H3C
H3C
H3C
+
H3C C CH2 C
H3C
H3C
63
64.
Координационная полимеризацияКатализатор К.Циглера-Дж.Натта (1953 г): TiCl4+ Al(C2H5)3
TiCl4 + Al(C2H5)3
Cl
(C2H5)2Al
Cl
C2H5
Ti
CH2 CH
CH3
Cl Cl
(C2H5)2Al
(C2H5)2Al
Cl
Cl
Ti
Cl Cl
CH2 CH
CH3
Cl
Cl
Ti
C2H5
Cl Cl
(C2H5)2Al
+
Cl
Cl
Ti
Cl Cl
CH2 CH C2H5
CH3
+
CH3
n CH2 CH
C2H5
CH2 CH
CH3
CH3
CH2 CH
n
64
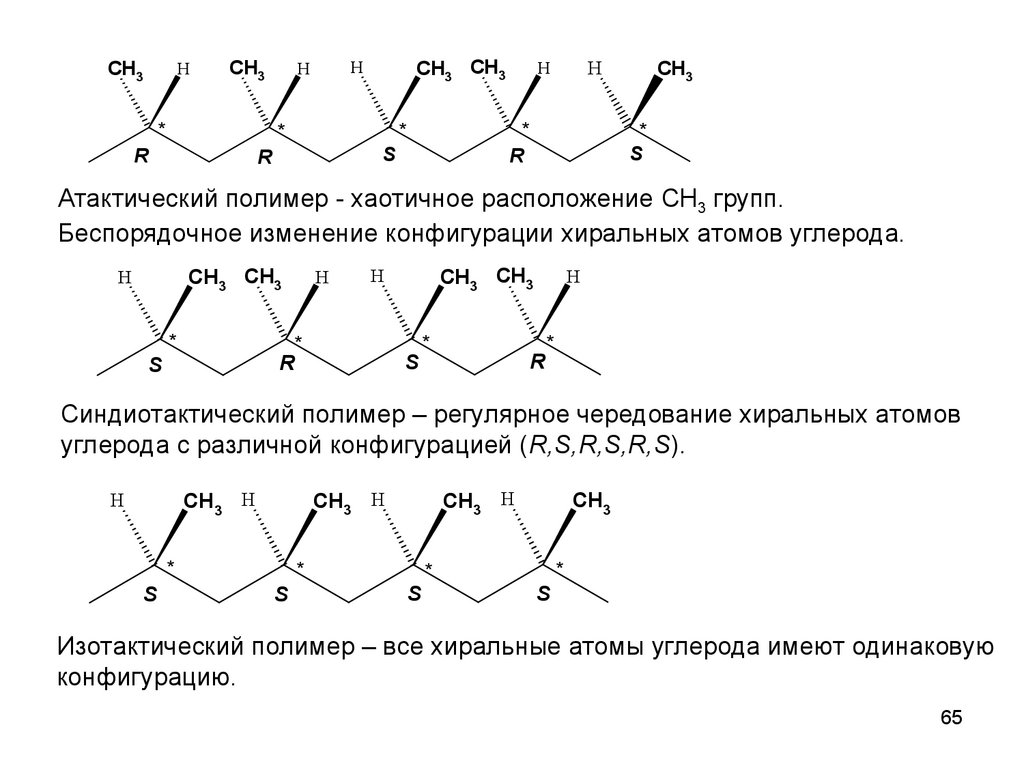
65.
CH3H
CH3
*
CH3 CH3
H
H
R
*
R
*
*
S
R
CH3
H
H
*
S
Атактический полимер - хаотичное расположение CH3 групп.
Беспорядочное изменение конфигурации хиральных атомов углерода.
CH3 CH3
H
*
R
S
H
CH3 CH3
H
*
S
*
H
R
*
Синдиотактический полимер – регулярное чередование хиральных атомов
углерода с различной конфигурацией (R,S,R,S,R,S).
CH3 H
H
*
S
CH3 H
CH3 H
*
S
S
*
CH3
*
S
Изотактический полимер – все хиральные атомы углерода имеют одинаковую
конфигурацию.
65
66.
Атактический полипропилен66
67.
Синдиотактический полипропилен67
68.
Изотактический полипропилен68
69.
Карбены и карбеноидыКарбены – частицы с двухкоординационным атомом углерода,
имеющим только шесть валентных электронов.
Способы генерирования карбенов
H2C C O
кетен
.
+
CH2 N N
h или t O
.
.
CH2 + CO2
карбен
h или t O
CH2 + N2
диазометан
- +
CHCl3 + трет- C4H9OK
трет-бутоксид калия
.
CCl2 + KCl + трет- C4H9OH
дихлоркарбен
69
70.
.CHСтроение
метилен
2
вакантная
p-орбиталь отвечает за электрофильный характер и
кислотные свойства
Сsp2
H
дважды заня тая
sp2-гибридная
орбиталь отвечает за основные свойства
C
H
синглетный
метилен
p-орбиталь
p-орбиталь
H
C
H
Сsp
C
Сsp3
H
H
триплетный
метилен
70
71.
Присоединение карбенов к алкенам (циклопропанирование)Присоединение синглетного карбена. Синхронный механизм.
Стереоспецифическая реакция. Реакция в жидкой фазе.
Синглетный карбен: два несвязывающих электрона со антипараллельными спинами
находятся на одной орбитали.
R1
R2
+
C C
H
H
цис-алкен
H
..CH
R2
C C
+
R1
H
транс-алкен
R1
2
..CH
2
R2
H
H
цис-1,2-диалкилциклопропан
H
R2
H
R1
транс-1,2-диалкилциклопропан
71
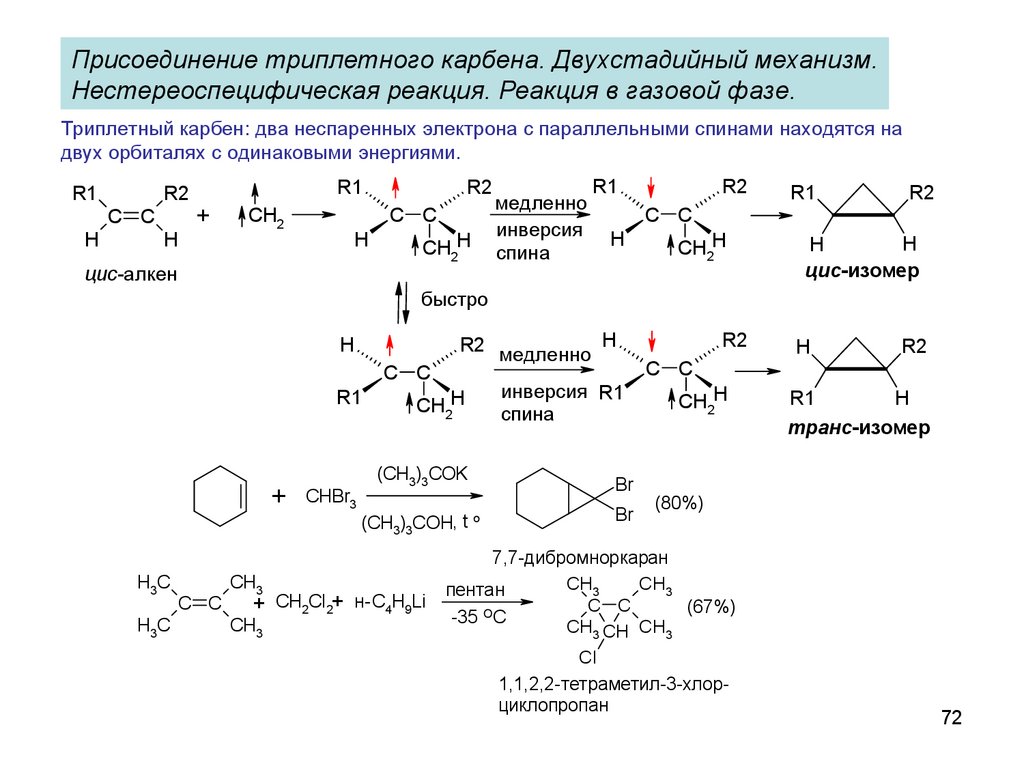
72.
Присоединение триплетного карбена. Двухстадийный механизм.Нестереоспецифическая реакция. Реакция в газовой фазе.
Триплетный карбен: два неспаренных электрона с параллельными спинами находятся на
двух орбиталях с одинаковыми энергиями.
R1
R2
C C
H
R1
+
H
R2
C C
CH2
H
цис-алкен
CH2H
медленно
инверсия
спина
R1
R2
R1
R2
C C
H
CH2H
H
H
цис-изомер
быстро
H
C C
R1
+
H3C
H3C
C C
CH3
CHBr3
CH2H
(CH3)3COK
(CH3)3COH, t o
+ CH2Cl2+ н- C4H9Li
CH3
R2 медленно H
инверсия R1
спина
Br
Br
R2
C C
CH2H
H
R2
H
R1
транс-изомер
(80%)
7,7-дибромноркаран
CH3
CH3
пентан
C C
(67%)
-35 OC
CH3 CH CH3
Cl
1,1,2,2-тетраметил-3-хлорциклопропан
72
73.
Присоединение карбеноидов к алкенам (циклопропанирование)Карбеноиды по химическому поведению подобны карбенам, но по строению отличаются от карбенов.
Реакция Г.Симмонса, Р. Смита (1958 г),
CH2I2
+
ICH2ZnI Карбеноид
Zn(Cu)
йодид
йодметилцинка
+
циклогексен
CH2I2
йодистый
метилен
Zn(Cu)
эфир, 40 ОС
норкаран
(бицикло[4.1.0]гептан)
O
+
бут-3-ен-2-он
CH2I2
(92%)
O
Zn(Cu)
эфир, 40
ОС
(50%)
1-циклопропилэтанон
73


















































 chemistry
chemistry








