Similar presentations:
Алкены (этиленовые углеводороды, олефины)
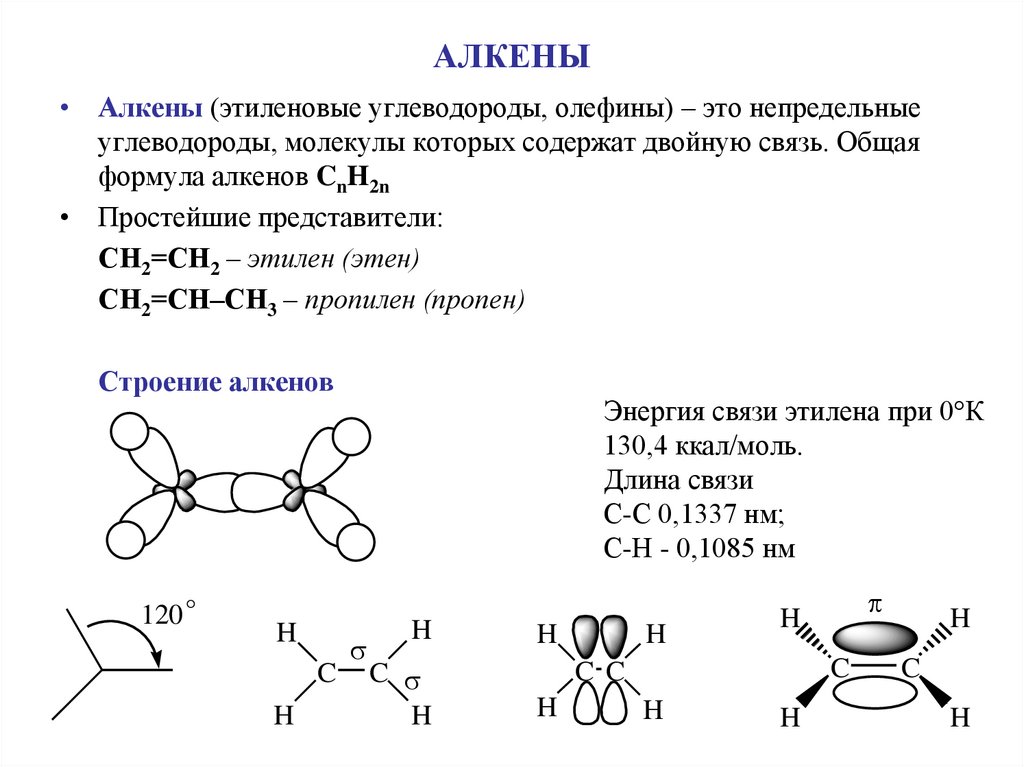
1. АЛКЕНЫ
• Алкены (этиленовые углеводороды, олефины) – это непредельныеуглеводороды, молекулы которых содержат двойную связь. Общая
формула алкенов CnH2n
• Простейшие представители:
СН2=СН2 – этилен (этен)
СН2=СН–СН3 – пропилен (пропен)
Строение алкенов
120 °
H
C
H
Энергия связи этилена при 0 К
130,4 ккал/моль.
Длина связи
С-С 0,1337 нм;
С-Н - 0,1085 нм
H
C
H
H
H
C
C C
H
H
H
H
H
C
H
2.
Номенклатура алкенов•Названия алкенов производят от названий соответствующих алканов
(с тем же числом атомов углерода) путем замены суффикса -ан на -ен:
этан этен; пропан пропен; бутан бутен и т.д.
•Главная цепь выбирается таким образом, чтобы она обязательно
включала в себя двойнуюсвязь (при этом она может быть не самой
длинной).
•Нумерацию углеродных атомов начинают с ближнего к двойной
связи конца цепи. Цифра, обозначающая положение двойной связи,
ставится обычно после суффикса -ен. Например:
6
5
4
3
2
1
CH3 CH CH2 C CH CH3
CH2 CH2 CH3
CH3
5-метил-3-пропилгексен-2
Для простейших алкенов применяются также исторически
сложившиеся названия: этилен (этен), пропилен (пропен), бутилен
(бутен-1), изобутилен (2-метилпропен)
3.
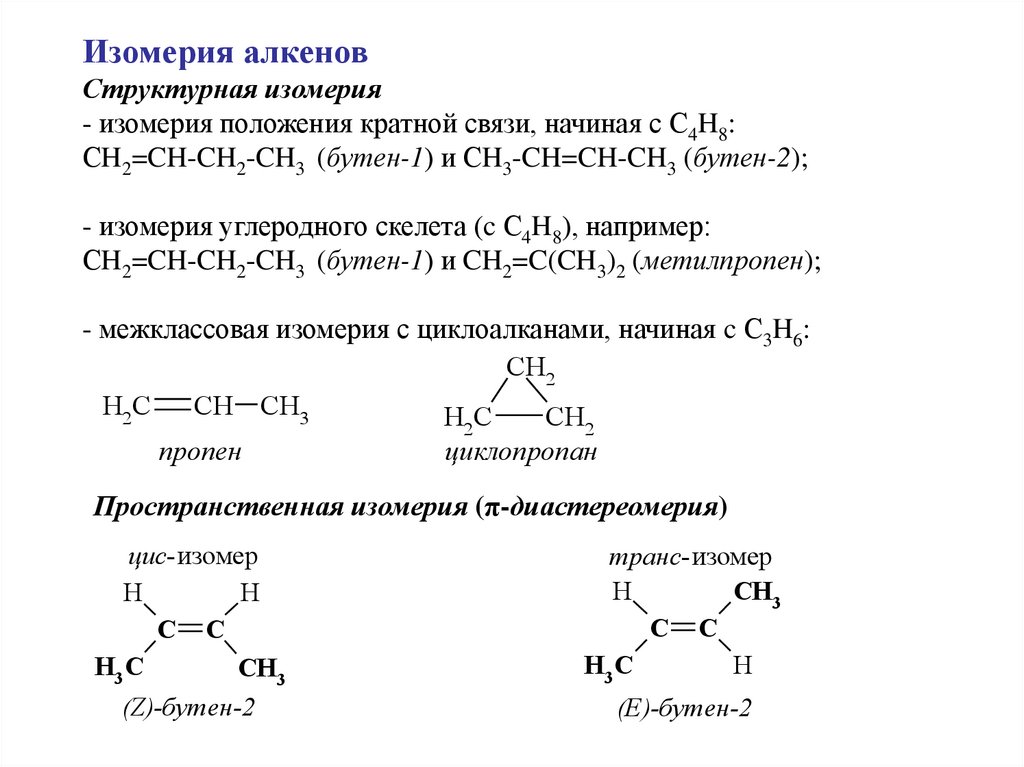
Изомерия алкеновСтруктурная изомерия
- изомерия положения кратной связи, начиная с С4H8:
СH2=CH-CH2-CH3 (бутен-1) и СH3-CH=CH-CH3 (бутен-2);
- изомерия углеродного скелета (c С4H8), например:
СH2=CH-CH2-CH3 (бутен-1) и CH2=C(CH3)2 (метилпропен);
- межклассовая изомерия с циклоалканами, начиная c С3H6:
CH2
H2 C
CH CH3
HC
CH
пропен
2
2
циклопропан
Пространственная изомерия (π-диастереомерия)
цис-изомер
H
H
C C
H3 C
CH3
(Z)-бутен-2
транс-изомер
H
CH3
C C
H
H3 C
(E)-бутен-2
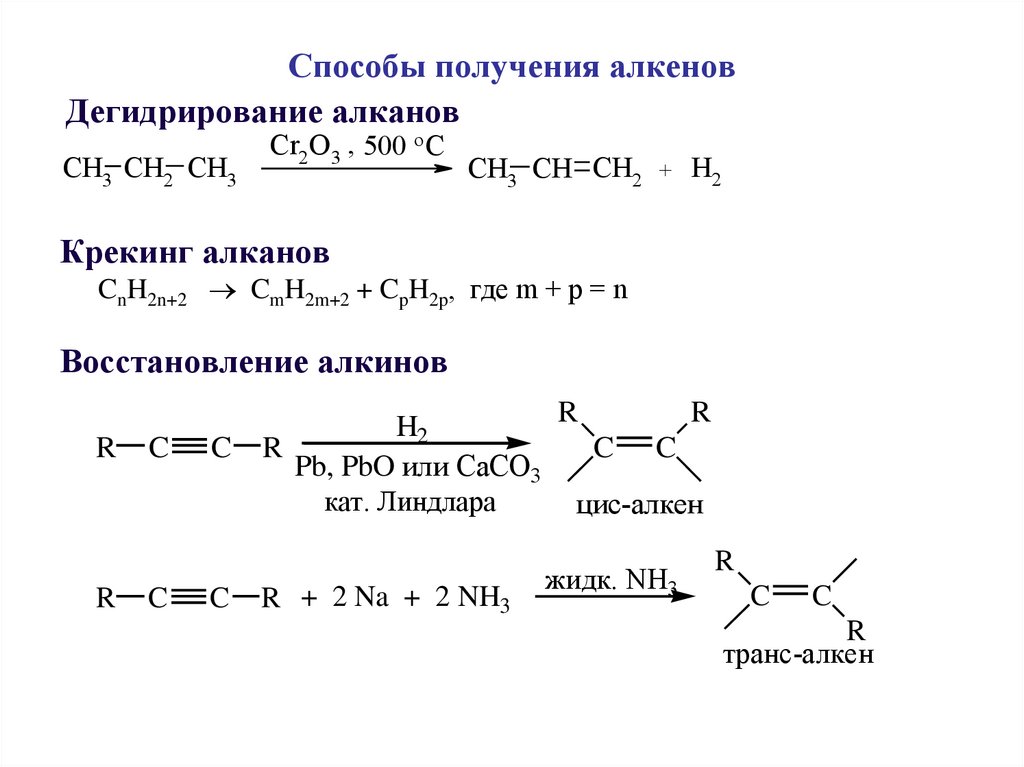
4. Способы получения алкенов
Дегидрирование алкановCH3 CH2 CH3
Cr2 O3 , 500 о С
CH3 CH CH2 + H2
Крекинг алканов
CnH2n+2 CmH2m+2 + CpH2p, где m + p = n
Восстановление алкинов
R
R
C
C
C
C
R
R
H2
R
C C
Pb, PbO или CaCO3
кат. Линдлара
цис-алкен
R + 2 Na + 2 NH3
жидк. NH3
R
C
C
R
транс-алкен
5.
Дегалогенирование дигалогеналкановH2C
CH2
Zn пыль
t, спирт
H2C
CH2 + ZnX2
X X
X = Cl, Br
CH3 CH CH CH3
Zn пыль
t, спирт
CH3 CH CH CH3 + ZnX2
Br Br
2,3-дибромбутан
2-бутен
Дегидрогалогенирование галогеналканов
при действии спиртового раствора щелочи
CH3 CH2 CH2 Cl
KOH
спирт
пропилхлорид
CH3 CH2 CH CH3
Cl
вторбутилхлорид
CH3 CH
CH2 + HCl
пропен
KOH
спирт
CH3 CH
CH CH3 + CH3 CH2 CH CH2
2-бутен (80%)
1-бутен (20%)
6.
Направление реакции дегидрогалогенирования определяетсяотносительными скоростями конкурирующих реакций.
Относительная скорость образования алкенов:
CH3CH2Br
CH3CHBrCH3
(CH3)3CBr
CH2 CH2
H3CHC CH2
(H3C)2C CH2
1,0
9,4
120,0
Реакционная способность алкилгалогенидов уменьшается в
порядке:
третичный > вторичный > первичный.
Ряд легкости образования алкенов:
R2C=CR2 > R2C=CHR > R2C=CH2 > RHC=CHR > RHC=CH2
7.
Механизм дегидрогалогенирования Е1CH3
CH3 C Br
CH3
H2O
- Br
CH3
CH3 C
+
-H
CH3
CH3 C CH2
CH3
Механизм дегидрогалогенирования Е2
CH3 CH2 CH2 Cl + NaOH
CH3
..
HO
.. :
H H
..
C
.. :
.. C : Cl
H
..
CH3 CH CH2 + H2O + :Cl
.. :
H
Откуда берется энергия для разрыва связи С-Н и С-Hal?
• За счет образования связи Н-ОН
• За счет образования -связи (60 ккал)
• За счет энергии сольватации ионов.
8.
Дегидратация спиртовпри нагревании с концентрированной серной кислотой
CH3 CH2 OH
этанол
CH3 CH2 CH2
H2SO4 (95%)
H2C CH2 + H2O
этен
H SO (75%)
OH 2 4
CH3 CH CH2 + H2O
пропанол-1
CH3 CH2 CH CH3
пропен
H2SO4 (60%)
CH3 CH
OH
бутанол-2
CH3
CH3 C OH
H2SO4 (20%)
CH3
трет-бутиловый
спирт
CH CH3 + CH3 CH2 CH CH2 + H2O
2-бутен (80%)
CH3 C
CH2 + H2O
CH3
изобутен
1-бутен (20%)
9.
Механизм дегидратации спирта Е1H3O+ + HSO4
более слабое
основание
H2O + H2SO4
более сильное
основание
C2H5OH + H2SO4
более сильное
основание
H
H C
C2H5OH2 + HSO4
более слабое
основание
H
H
C H + H+
H
OH
H
H
H C
H
H
C H
H C
H :O :H
H
H
H C
..
..
..
H
C H протонированный спирт
OH2
H
C H
CH2 CH2 + H+
10.
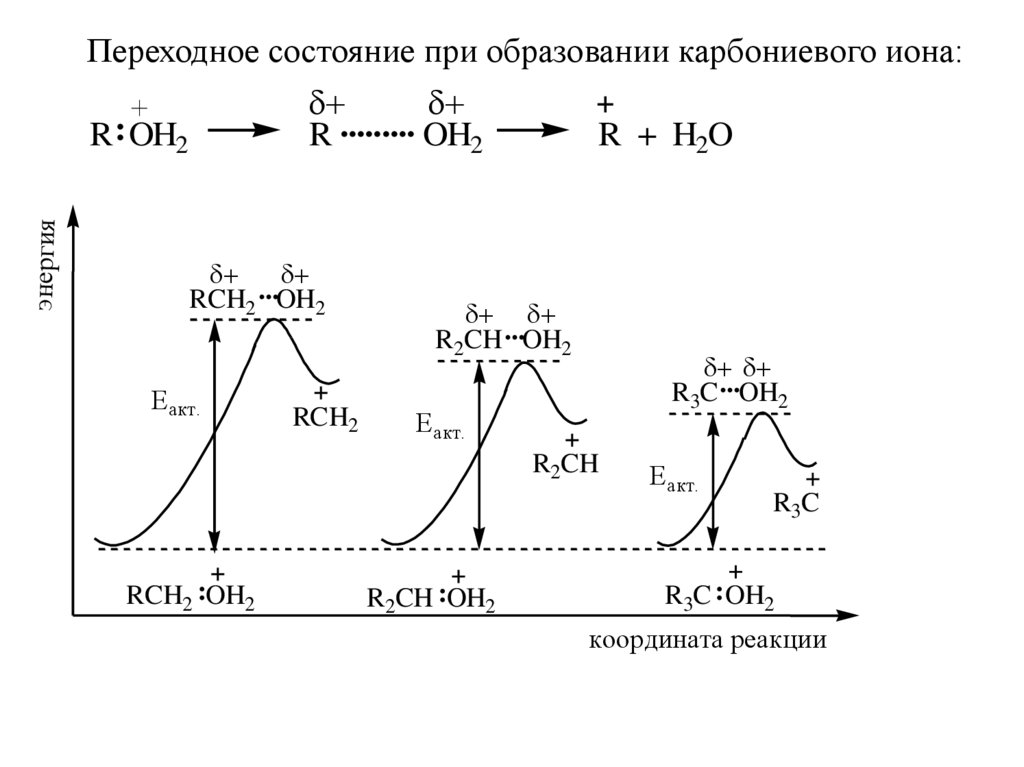
Образование карбониевого иона по механизму Е1 происходит в результатеотщепления воды от протонированного спирта. Это энергетически более
выгодно, чем отрыв гидроксид – аниона от спирта:
R+ + H2O легче
слабое основание,
хорошо уходящая группа
R+ + HO труднее
сильное основание,
трудно уходящая группа
ROH2
ROH
Устойчивость карбониевых катионов
H
H
H C
<
H
метильный
карбониевый ион
H3C C
H
<
H3C C
CH3
<
H3C C
H
CH3
CH3
этильный
изопропильный
третбутильный
карбониевый ион, карбониевый ион, карбониевый ион,
первичный
вторичный
третичный
11.
Переходное состояние при образовании карбониевого иона:R ......... OH2
энергия
R : OH2
...
RCH2 OH2
Еакт.
RCH2
R + H2O
R2CH ...OH2
R3C ...OH2
Еакт.
R2CH
RCH2 :OH2
R2CH :OH2
Еакт.
R3C
R3C : OH2
координата реакции
12.
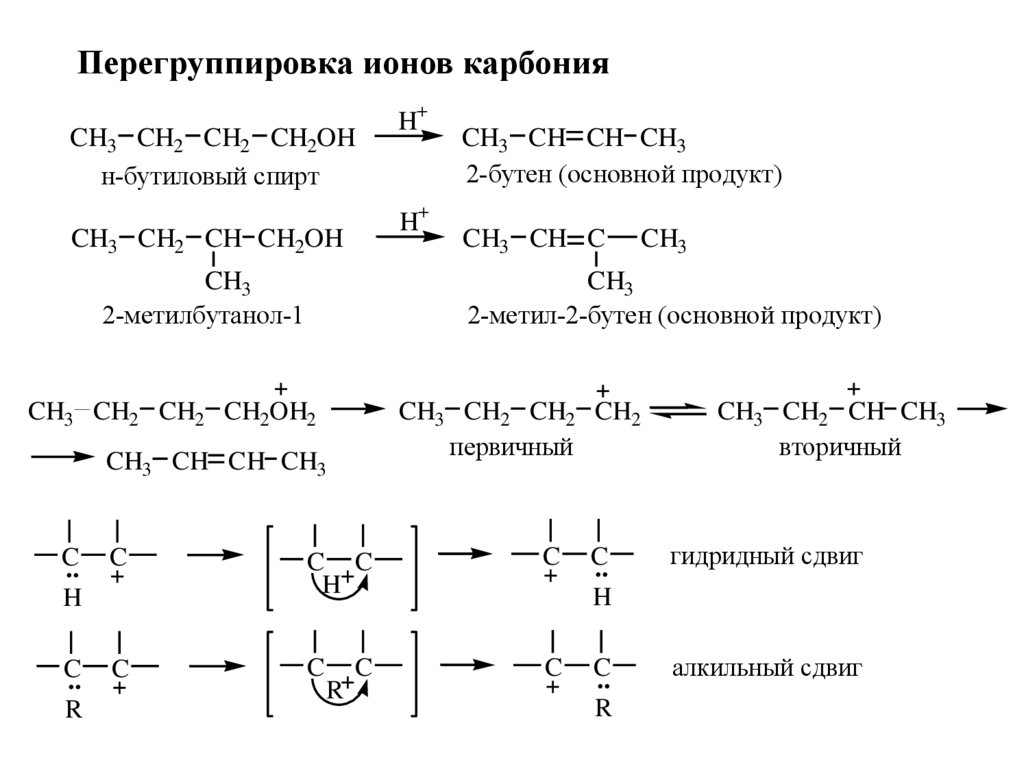
Перегруппировка ионов карбонияCH3 CH2 CH2 CH2OH
н-бутиловый спирт
H+
H+
CH3 CH2 CH CH2OH
CH3
2-метилбутанол-1
CH3 CH CH CH3
2-бутен (основной продукт)
CH3 CH C
CH3
CH3
2-метил-2-бутен (основной продукт)
CH3 CH2 CH2 CH2OH2
CH3 CH2 CH2 CH2
первичный
CH3 CH CH CH3
CH3 CH2 CH CH3
вторичный
C
..
H
C
C C
H
C
C..
H
гидридный сдвиг
C..
R
C
C
C
C
..
R
алкильный сдвиг
R
C
13.
Правило Зайцева:В реакции β-элиминирования группы НХ атом водорода
отщепляется преимущественно от наименее
гидрогенизированного атома углерода.
Современная формулировка: реакции β-элиминирования
идут с образованием более замещенных при двойной связи
алкенов (такие алкены обладают меньшей энергией и более
устойчивы)
14.
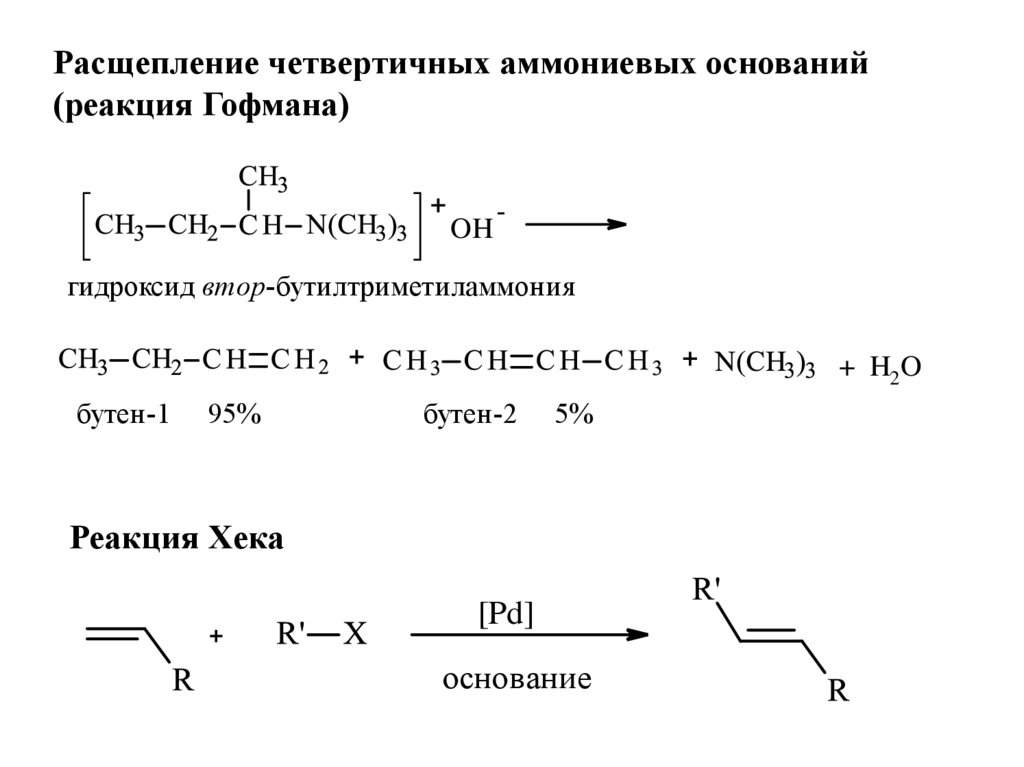
Расщепление четвертичных аммониевых оснований(реакция Гофмана)
OH
-
гидроксид втор-бутилтриметиламмония
+ H2 O
бутен-1
95%
бутен-2
5%
Реакция Хека
[Pd]
основание
15.
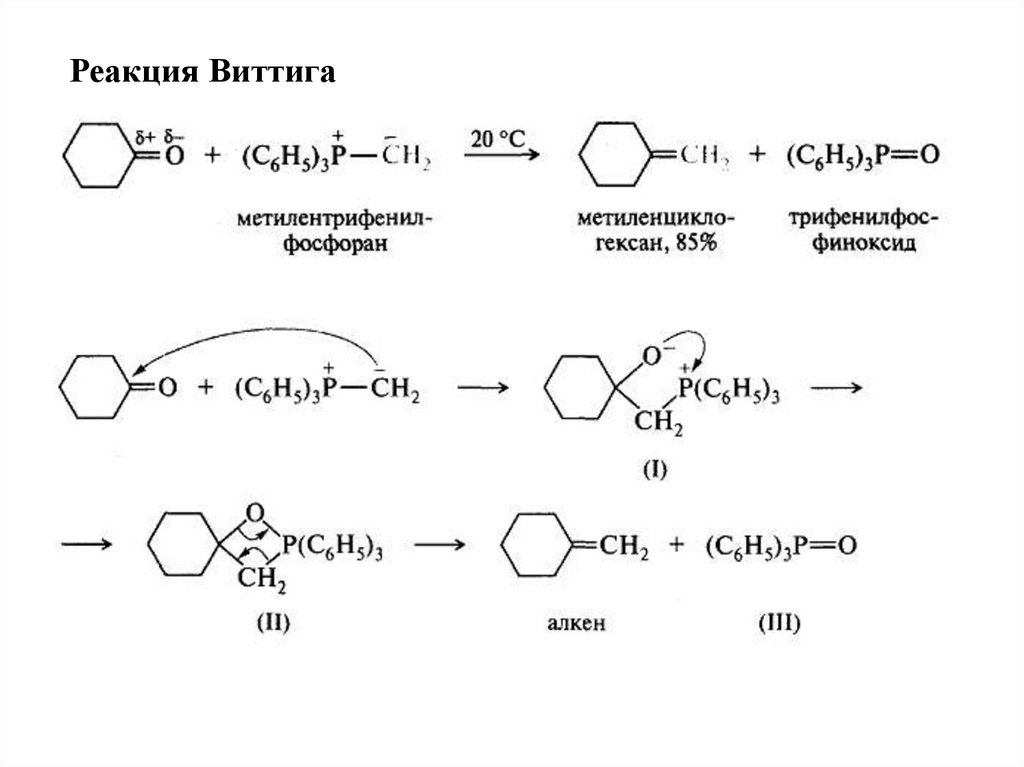
Реакция Виттига16.
17. Химические свойства алкенов
Реакции присоединенияРеагент
HCl
H2O (H+ )
H2SO4
C C
Br2
Продукт реакции
H
C C
Cl
Гидрогалогенирование
H
C C
OH
Гидратация
H
C C
OSO3H
Cульфатирование
(сульфоэтерификация)
Br
C C
кат.
H2 (Ni)
KMnO4 (H2O)
Тип реакции
(C
Br
C )n
Галогенирование
Полимеризация
H
C C
H
Гидрирование
(восстановление)
HO
C C
OH
Гидроксилирование
(окисление по Вагнеру)
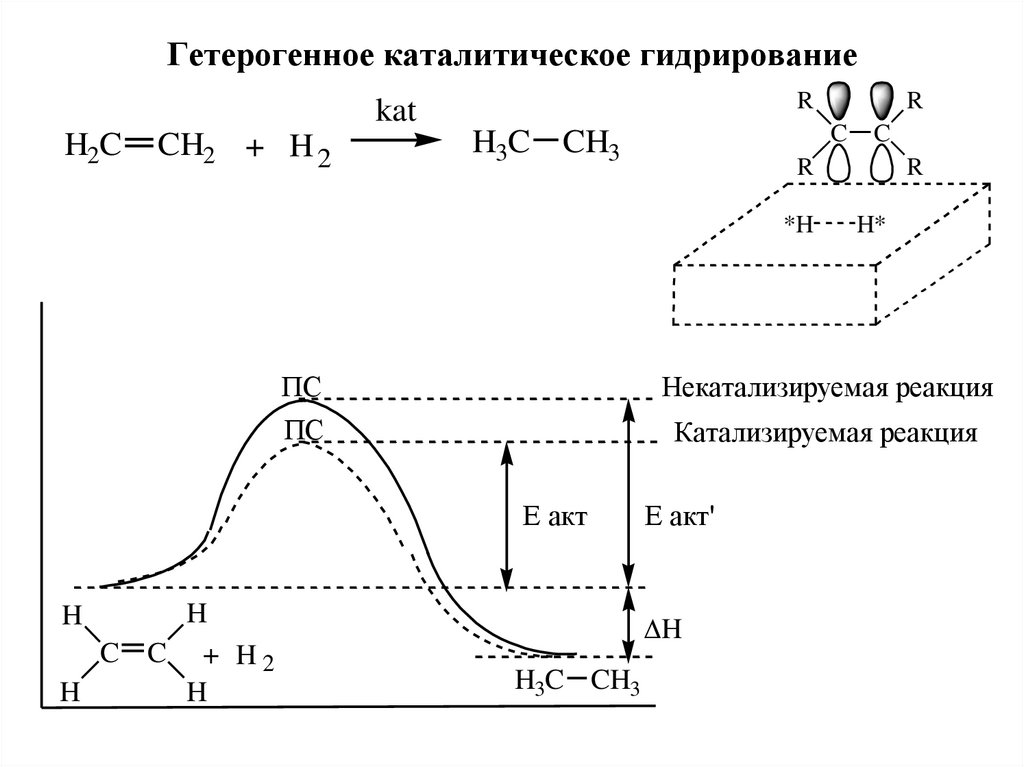
18. Гетерогенное каталитическое гидрирование
Rkat
H2C
CH2 + H 2
C
H3C CH3
R
H*
Некатализируемая реакция
Катализируемая реакция
Е акт
H
C C + H2
H
H
C
R
*H
ПС
ПС
R
H
Е акт'
H
H3C CH3
19.
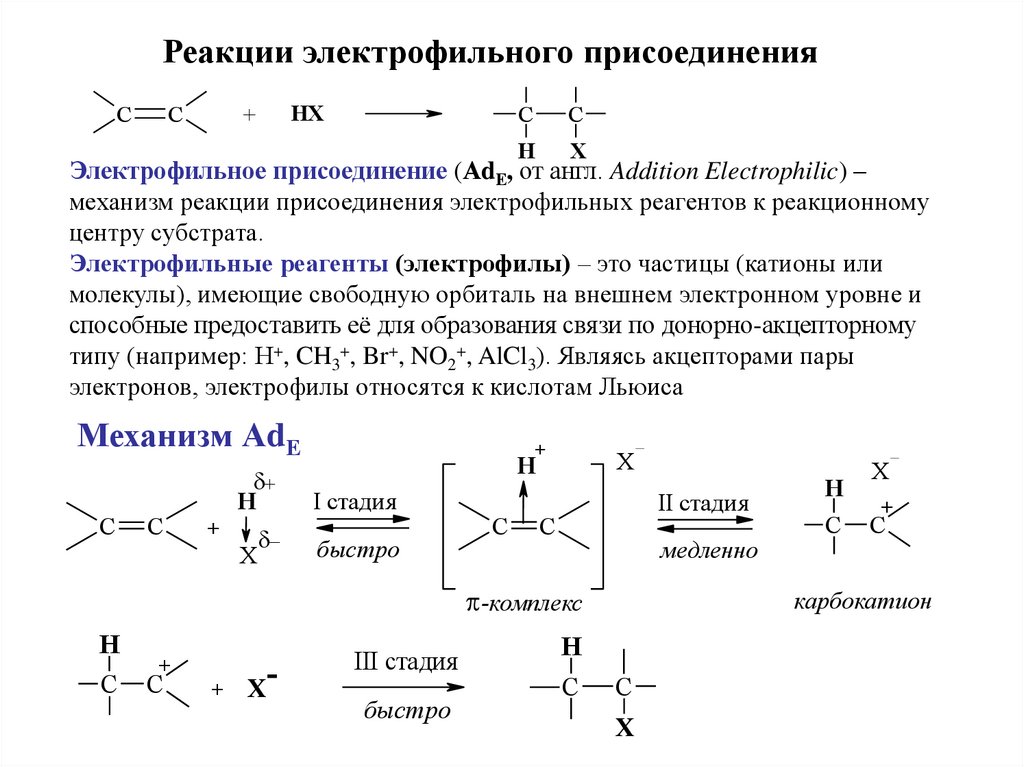
Реакции электрофильного присоединенияC
C
HX
+
C
C
H
X
Электрофильное присоединение (АdЕ, от англ. Addition Electrophilic) –
механизм реакции присоединения электрофильных реагентов к реакционному
центру субстрата.
Электрофильные реагенты (электрофилы) – это частицы (катионы или
молекулы), имеющие свободную орбиталь на внешнем электронном уровне и
способные предоставить её для образования связи по донорно-акцепторному
типу (например: H+, CH3+, Br+, NO2+, AlCl3). Являясь акцепторами пары
электронов, электрофилы относятся к кислотам Льюиса
Механизм АdЕ
C
C
+
H
I стадия
быстро
+
X
X
H
C
II стадия
C
медленно
-комплекс
H
C
+
C
+
X
III стадия
быстро
C
X
+
C
карбокатион
H
C
H
C
X
20.
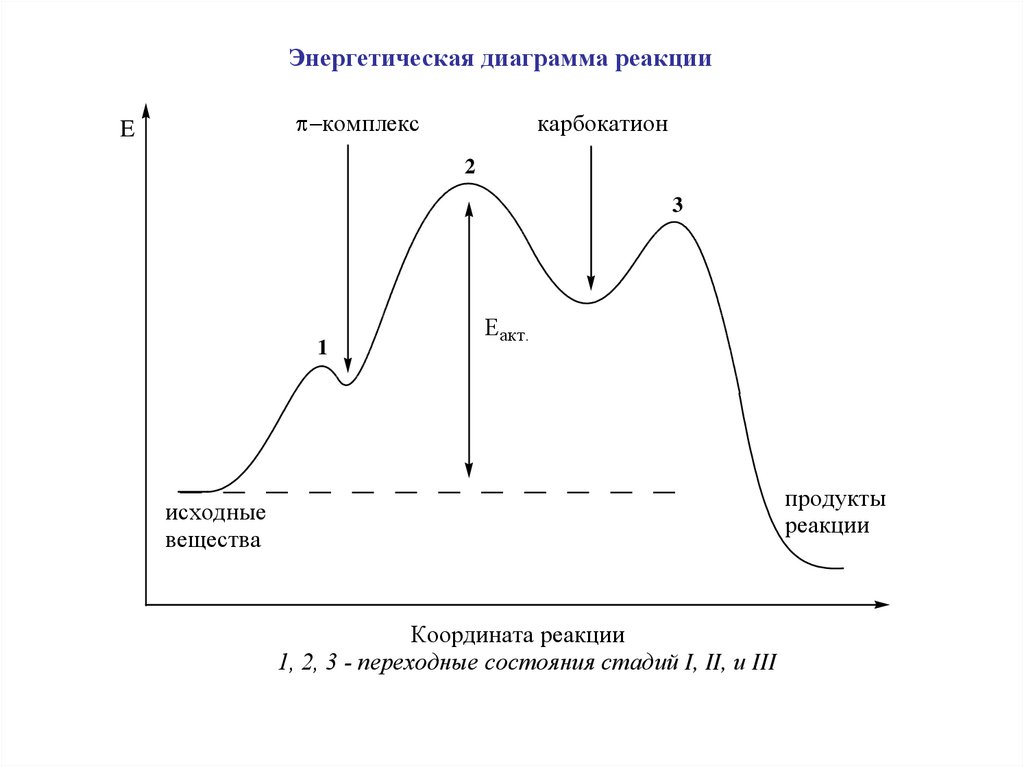
Энергетическая диаграмма реакциикомплекс
E
карбокатион
2
3
1
Еакт.
продукты
реакции
исходные
вещества
Координата реакции
1, 2, 3 - переходные состояния стадий I, II, и III
21.
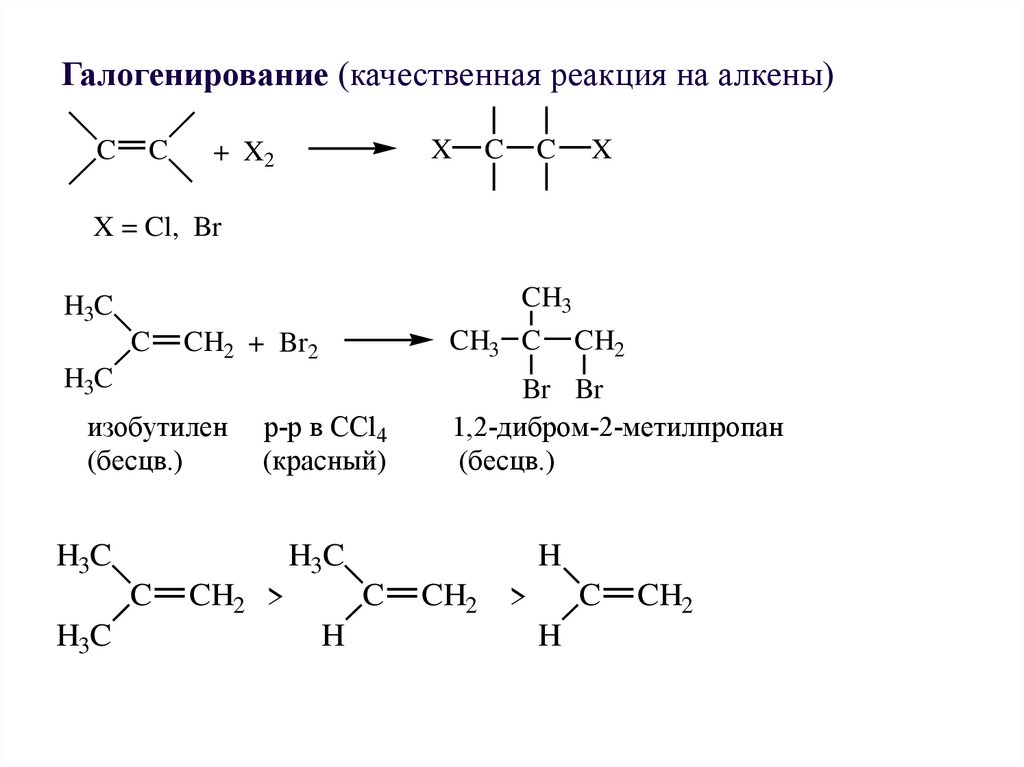
Галогенирование (качественная реакция на алкены)C
C
X
+ X2
C
C
X
X = Cl, Br
CH3
H3C
C
CH3 C
CH2 + Br2
H3C
изобутилен
(бесцв.)
р-р в CCl4
(красный)
H3C
H3C
Br Br
1,2-дибром-2-метилпропан
(бесцв.)
H3C
C
CH2 >
H
C
H
CH2
CH2
C
>
H
CH2
22.
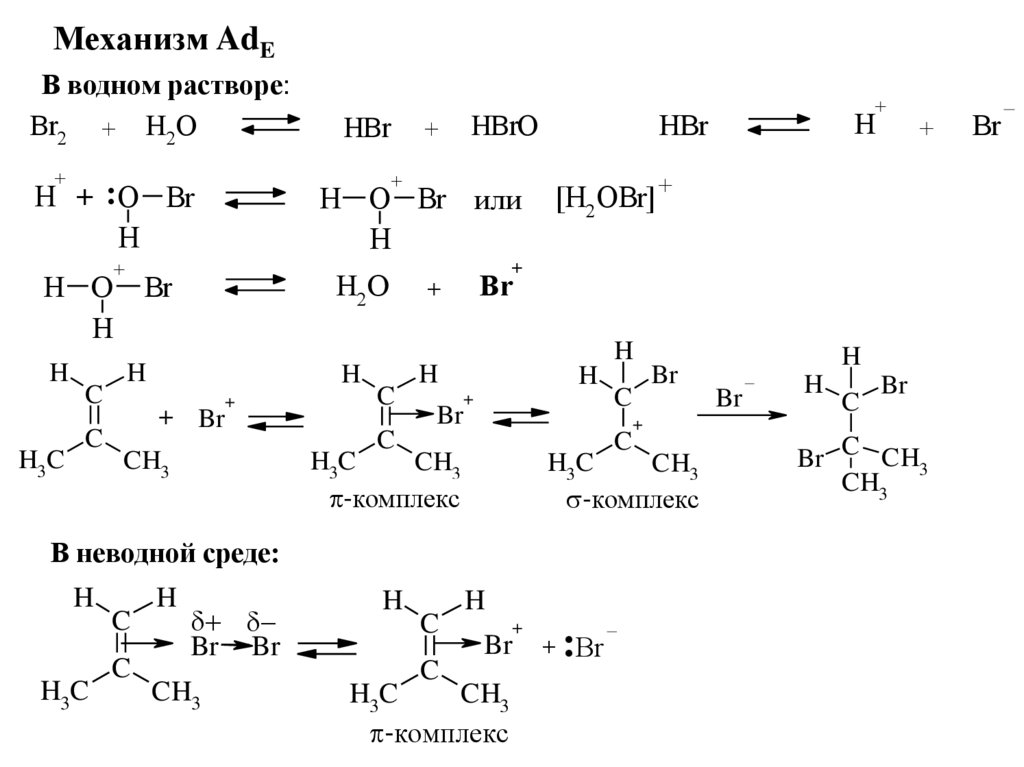
Механизм AdEВ водном растворе:
Br2 + H2 O
+
H O
H
H
H3C
C
C
H O Br или
H
H2 O
Br
H
H
+ Br
HBrO
+
+
H + :O Br
H
+
HBr
+
CH3
C
H3C
C
C
H
+
Br
+
H
H
H
+
Br
CH3
H
C
C
C
Br
H
Br
H
C
Br
+
C
C
H3C
CH3
-комплекс
H3C
CH3
-комплекс
Br Br
+
[H2OBr] +
В неводной среде:
H
+
H
HBr
H
Br
H3C
CH3
-комплекс
+
:
+ Br
Br C CH3
CH3
Br
23.
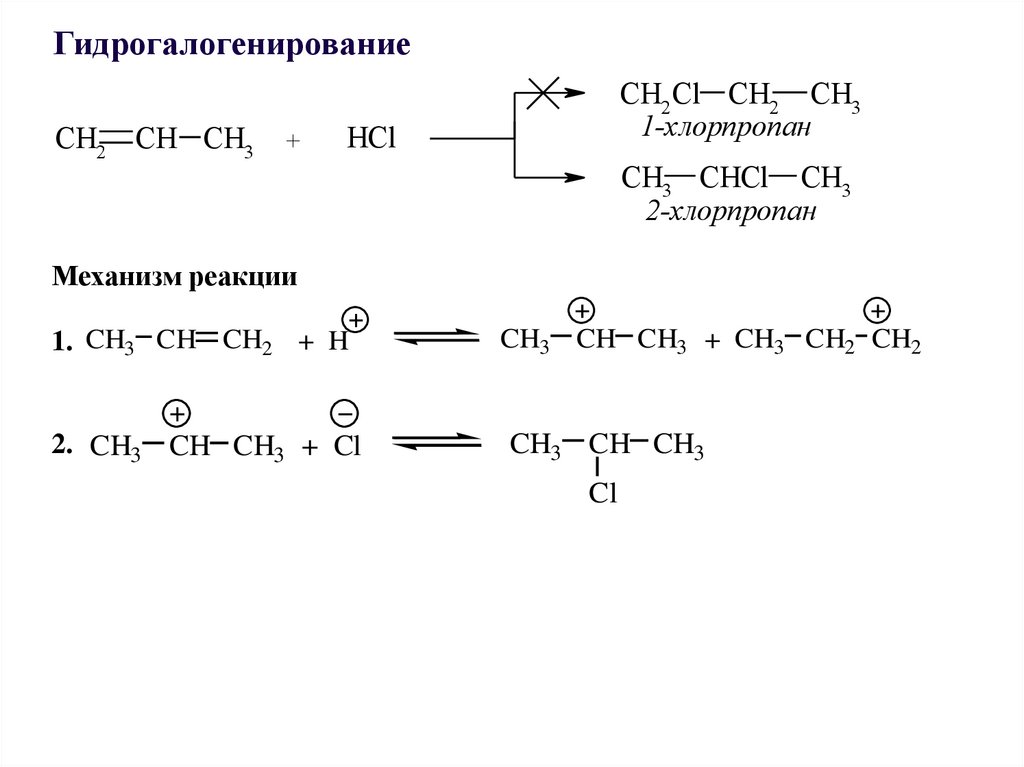
ГидрогалогенированиеCH2 CH CH3
+
CH2 Cl CH2 CH3
1-хлорпропан
HCl
CH3 CHCl CH3
2-хлорпропан
Механизм реакции
1. CH3 CH CH2 + H
2. CH3 CH CH3 + Cl
CH3 CH CH3 + CH3 CH2 CH2
CH3 CH CH3
Cl
24.
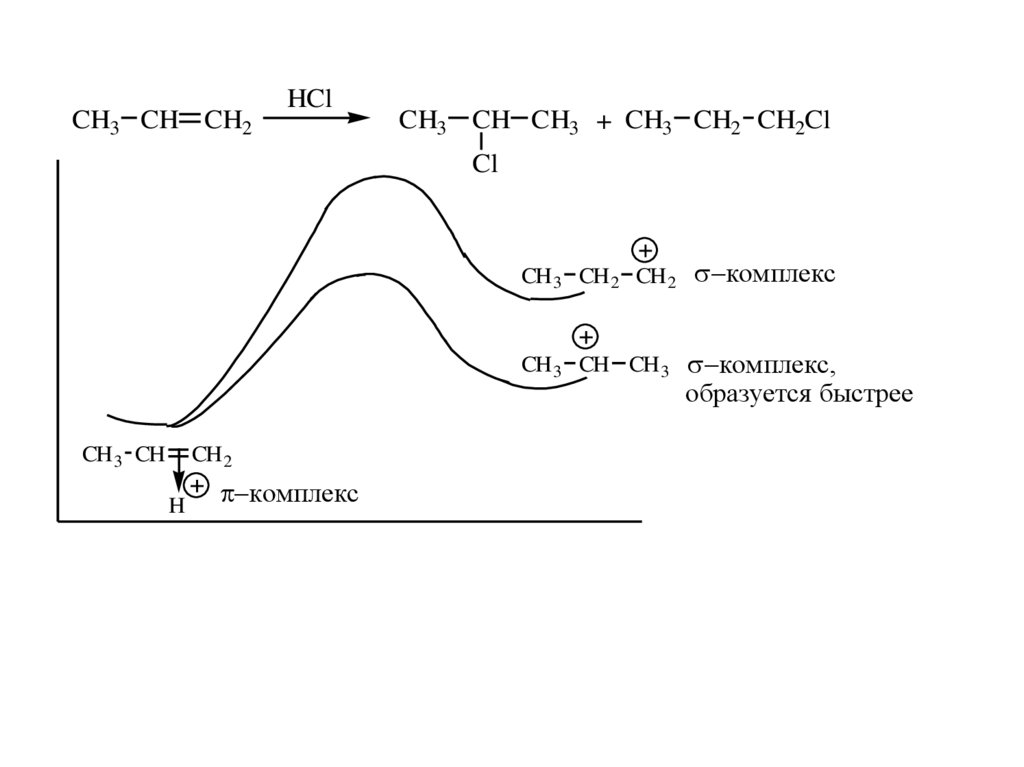
CH3 CH CH2HCl
CH3 CH CH3 + CH3 CH2 CH2Cl
Cl
CH 3 CH 2 CH 2
CH 3 CH CH 3
CH 3 CH
CH 2
H
комплекс
комплекс
комплекс,
образуется быстрее
25.
Реакция идет региоселективно по правилу Марковникова:• в реакциях присоединения полярных молекул НХ к несимметричным
алкенам водород присоединяется к более гидрогенизированному атому
углерода при двойной связи (т.е. к атому углерода, связанному с
наибольшим числом атомов водорода).
Правило Марковникова объясняется:
•распределением электронной плотности в статическом
(нереагирующем) состоянии молекулы (статический фактор)
H
H
C
CH
CH2 +
+
H Cl
+
CH3 C
H
H
CH3
•относительной устойчивостью интермедиатов – промежуточных
карбокатионов (динамический фактор)
+
CH2 CH CH3 + H Cl
CH2 CH CH3 (I) вторичный
карбокатион
H
- Cl
+
H2C CH CH3 (II) первичный
карбокатион
H
26.
Присоединение против правила МарковниковаЗаместитель при двойной связи оттягивает электронную плотность на себя,
т.е. проявляет электроноакцепторные свойства (–I и/или –М-эффекты)
F
F
C
F
CH
CH2 + H X
F3 C CH
H
CH2
X
27.
Гидратация+
H2C CH CH3 + H2O
H
H3C CH CH3
OH
CH3 CH CH2 +
CH3
H
..
CH CH3 + HOH
..
CH3 CH CH3
O:
H
H
HSO4
CH3 CH CH3
CH3 CH CH3
O:
H
H
CH3 CH CH3 + H2SO4
: OH
..
28.
Присоединение серной кислотыH2C CH CH3 + H2SO4
H3C CH CH3
OSO3 H
H2O
H3C CH CH3
OSO3 H
H3C CH CH3
OH
Присоединение хлорноватистой кислоты
CH3 CH CH2
+ HO Cl
CH3 CH CH2Cl
OH
CH3 CH CH2 + Cl2 + H2O
CH3 CH CH2Cl + HCl
OH
29.
Реакции радикального присоединенияГалогенирование алкенов на свету
Br2
hv
2 Br
CH3 CH CH2 + Br
CH3 CH CH2Br
более устойчивый радикал
CH3 CHBr CH2
менее устойчивый радикал
CH3 CH CH2Br + Br2
CH3 CHBr CH2Br + Br
Активность галогенов в реакции:
Cl2 > Br2 > I2
30.
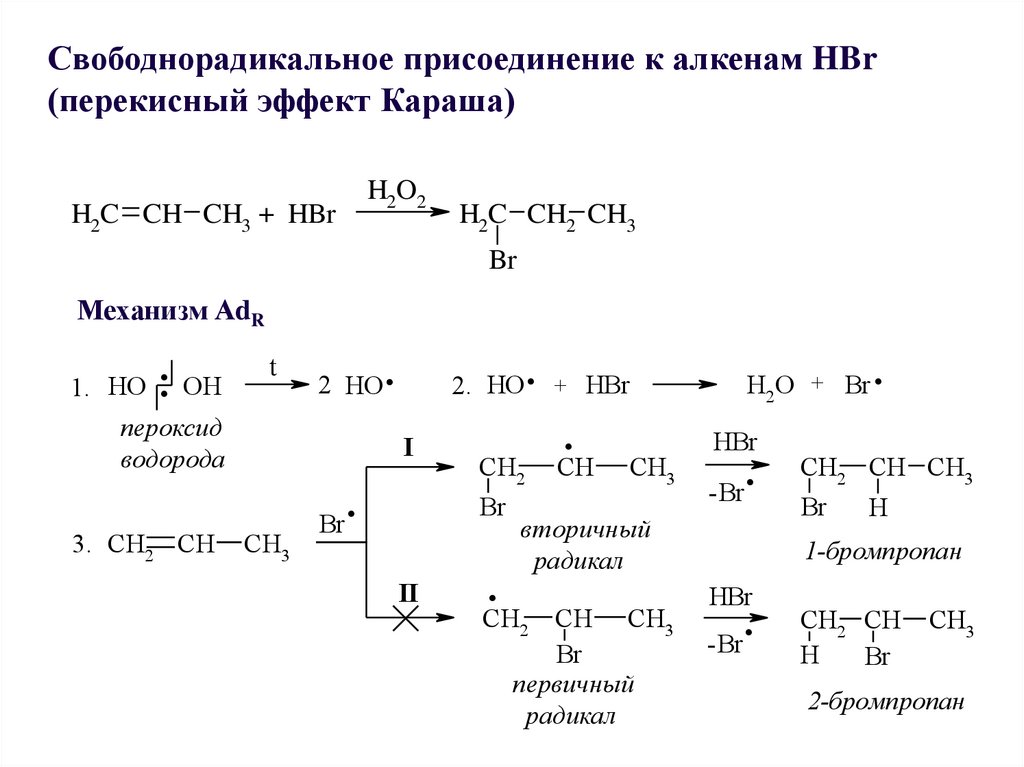
Свободнорадикальное присоединение к алкенам HBr(перекисный эффект Караша)
H2O2
H2C CH CH3 + HBr
H2C CH2 CH3
Br
Механизм АdR
.
1. HO . OH
пероксид
водорода
3. CH2 CH
t
2. HO . + HBr
2 HO .
I
CH3
Br
.
II
.
CH2 CH CH3
Br
вторичный
радикал
.
CH2
CH CH3
Br
первичный
радикал
H2 O + Br .
HBr
.
-Br
CH2 CH CH3
Br
H
1-бромпропан
HBr
.
-Br
CH2 CH
H
Br
CH3
2-бромпропан
31.
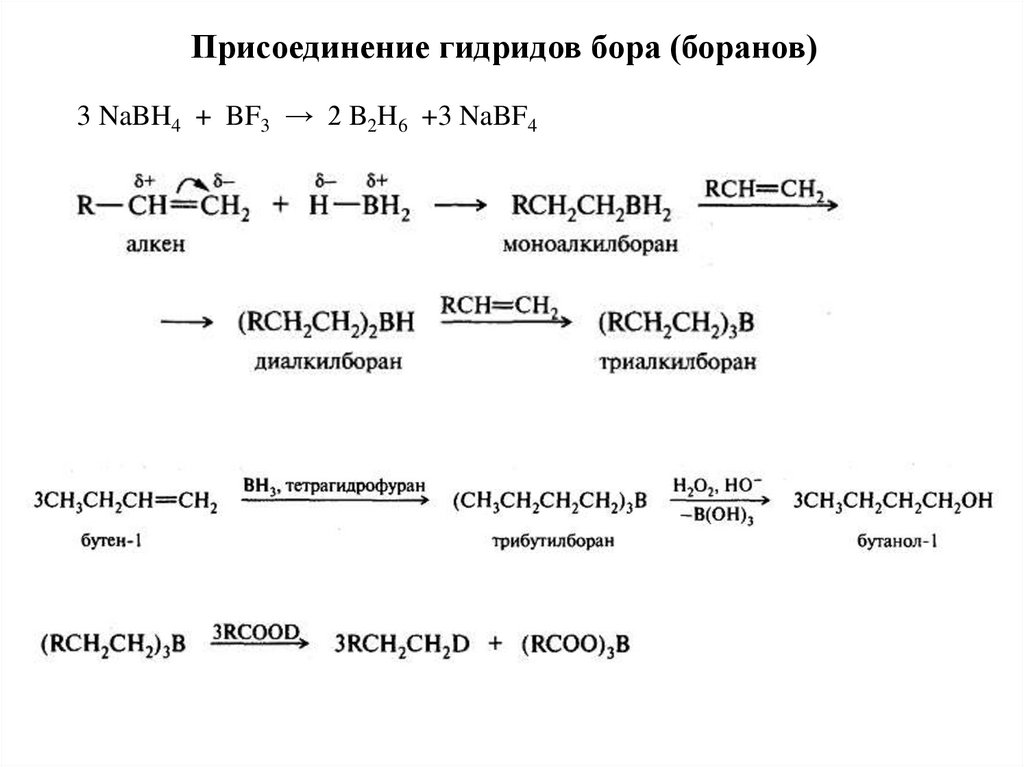
Присоединение гидридов бора (боранов)3 NaBH4 + BF3 → 2 B2H6 +3 NaBF4
32.
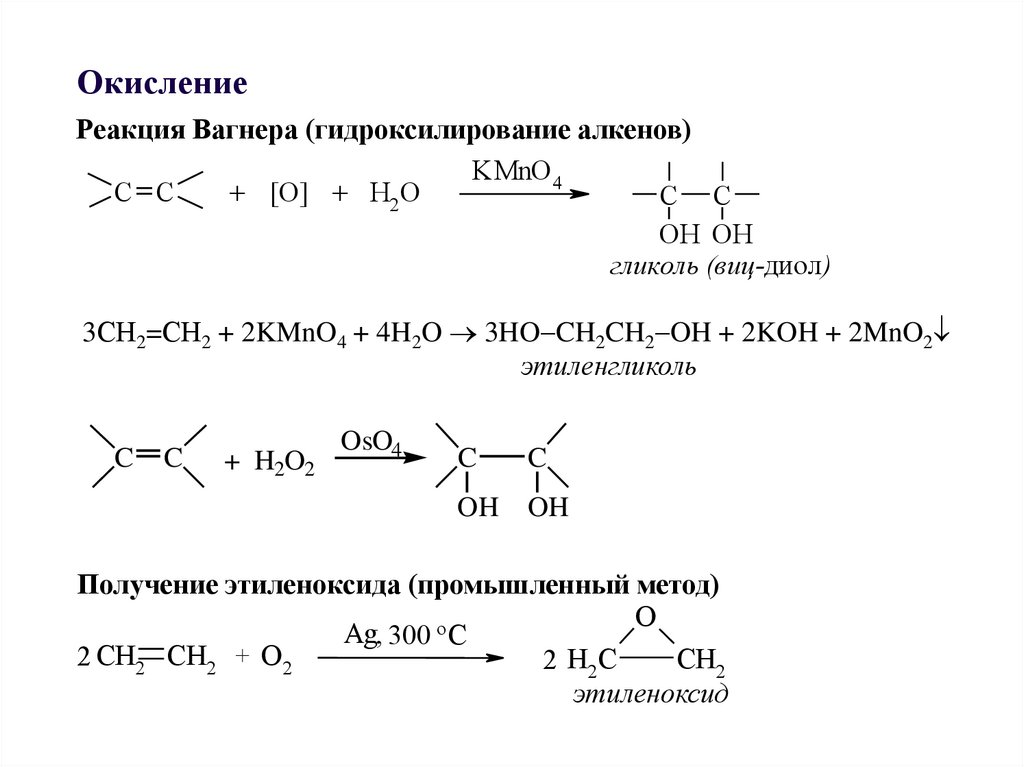
ОкислениеРеакция Вагнера (гидроксилирование алкенов)
KMnO4
C C
+ [O] + H2O
C C
OH OH
гликоль (виц-диол)
3СН2=СН2 + 2KMnO4 + 4H2O 3HO CH2CH2 OH + 2KOH + 2MnO2
этиленгликоль
C
C
+ H2O2
OsO4
C
C
OH
OH
Получение этиленоксида (промышленный метод)
O
Ag, 300 oC
2 CH2 CH2 + O2
CH2
2 H2 C
этиленоксид
33.
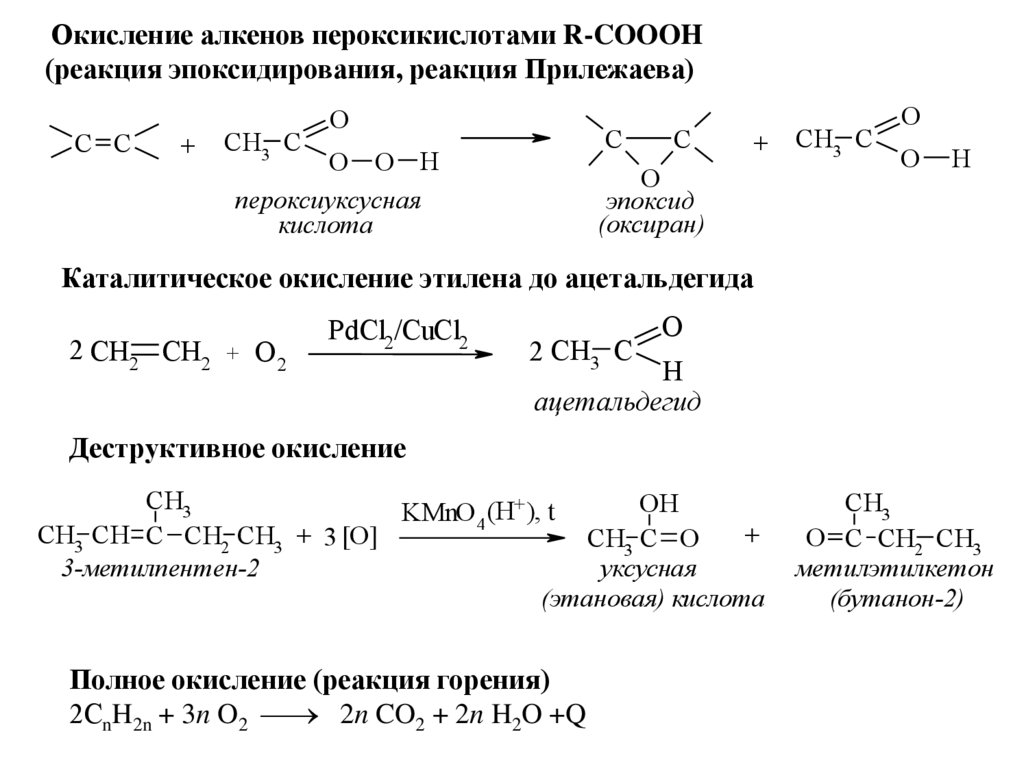
Окисление алкенов пероксикислотами R-COOOH(реакция эпоксидирования, реакция Прилежаева)
C C
+
CH3 C
O
C
O O H
пероксиуксусная
кислота
C
+
O
эпоксид
(оксиран)
CH3 C
O
O
H
Каталитическое окисление этилена до ацетальдегида
2 CH2 CH2 + O 2
PdCl2 /CuCl2
2 CH3 C
O
H
ацетальдегид
Деструктивное окисление
CH3
OH
KMnO4 (H+), t
CH3 CH C CH2 CH3 + 3 [O]
+
CH3 C O
3-метилпентен-2
уксусная
(этановая) кислота
Полное окисление (реакция горения)
2СnH2n + 3n O2 2n CO2 + 2n H2O +Q
CH3
O C CH2 CH3
метилэтилкетон
(бутанон-2)
34.
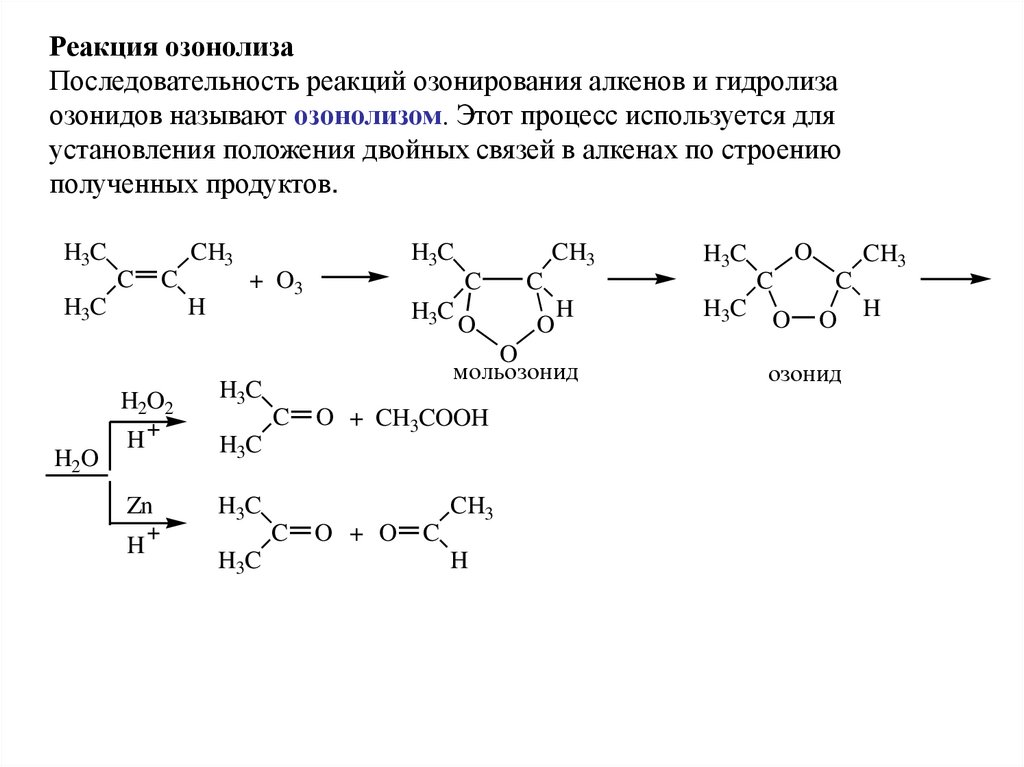
Реакция озонолизаПоследовательность реакций озонирования алкенов и гидролиза
озонидов называют озонолизом. Этот процесс используется для
установления положения двойных связей в алкенах по строению
полученных продуктов.
H3C
CH3
C
C
H3C
H2O
H
H3C
+ O3
H2O2
H
H3C
Zn
H3C
H
C
H3C
H3C
O
O
O + CH3COOH
CH3
C
O + O
C
H
O
H3C
C
C
H
O
мольозонид
C
H3C
CH3
H3C
O
CH3
C
O
озонид
H
35.
OH
C
H2O2
CH3
O
H
+ H3C C
O3
окислительная
OH обработка
O
O
Zn
+ H3C C
H
H
H3C
H3C
H3C
восстановительная
обработка
C CH CH2 CH3 + O3
C
H3C
CH CH2 CH3
O
O
O
Zn
H2O
H3C
O
C
O +
H3C
ацетон
C CH2 CH3
H
пропионовый
альдегид
O
H3C
C
H3C
O
CH CH2 CH3
O
36.
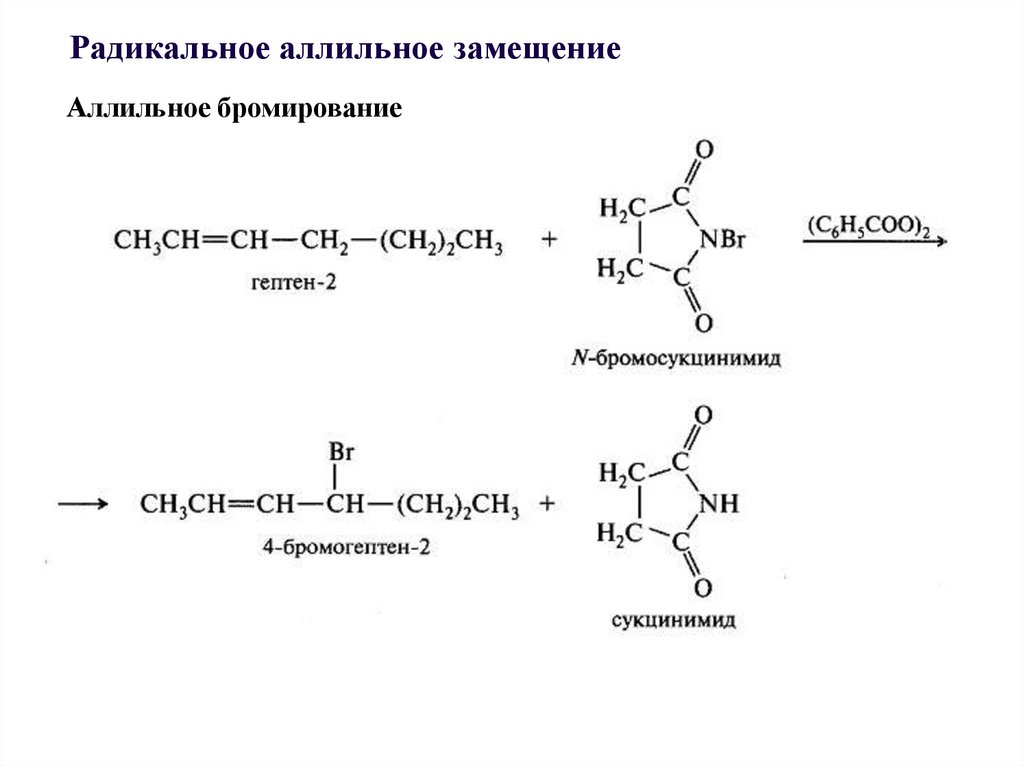
Радикальное аллильное замещениеАллильное бромирование
37.
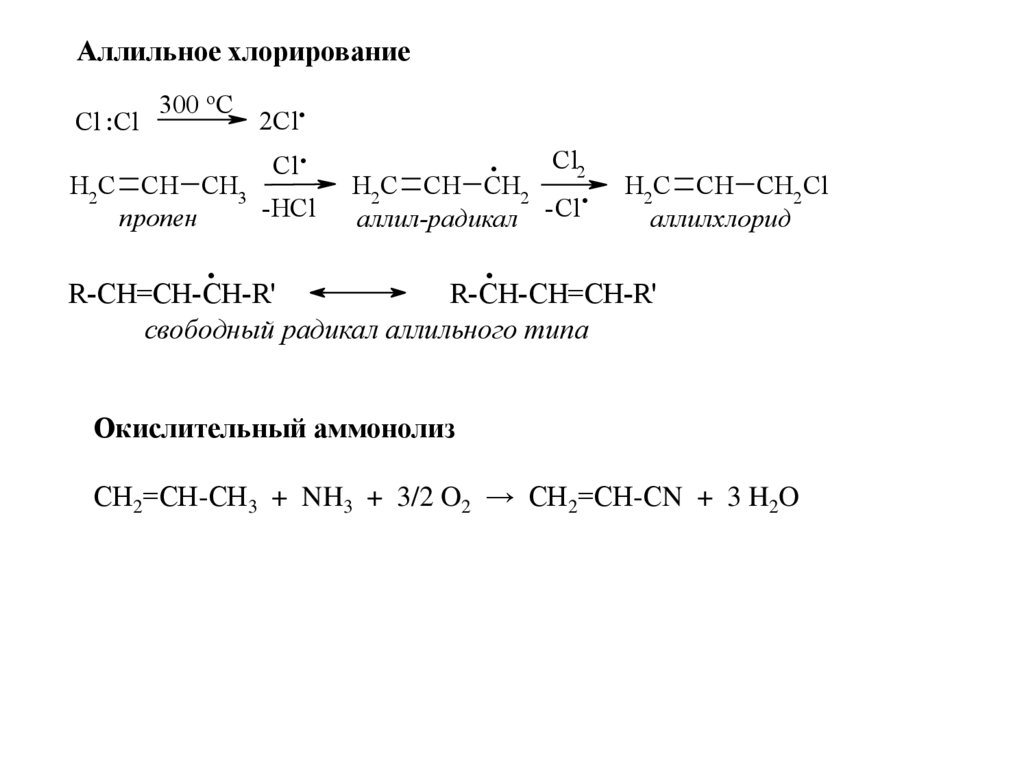
Аллильное хлорированиеCl :Cl
300 o C
2Cl.
Cl.
H2C CH CH3
-HCl
пропен
.
Cl2
H2C CH CH2
.
-Cl
аллил-радикал
.
H2C CH CH2Cl
аллилхлорид
.
R-CH-CH=CH-R'
R-CH=CH-CH-R'
свободный радикал аллильного типа
Окислительный аммонолиз
СН2=СН-СН3 + NH3 + 3/2 O2 → СН2=СН-СN + 3 H2O
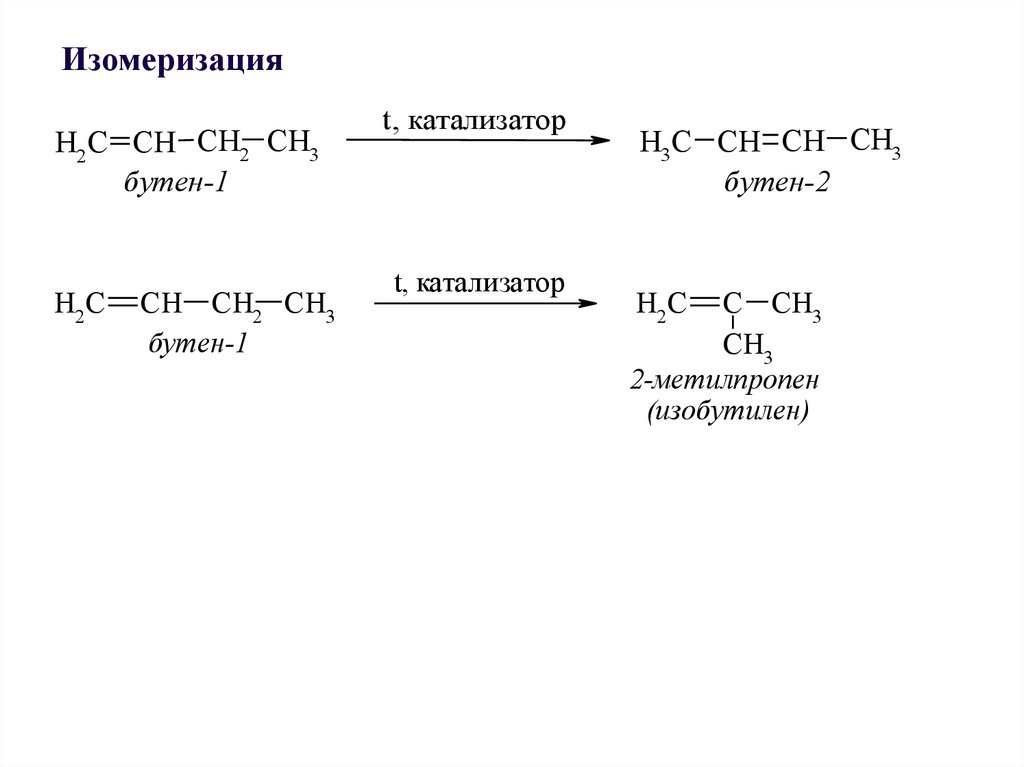
38.
ИзомеризацияH2C CH CH2 CH3
бутен-1
H2 C
CH CH2 CH3
бутен-1
t, катализатор
t, катализатор
H3C CH CH CH3
бутен-2
H2 C
C CH3
CH3
2-метилпропен
(изобутилен)















 chemistry
chemistry








