Similar presentations:
Непредельные углеводороды: алкены, олефины
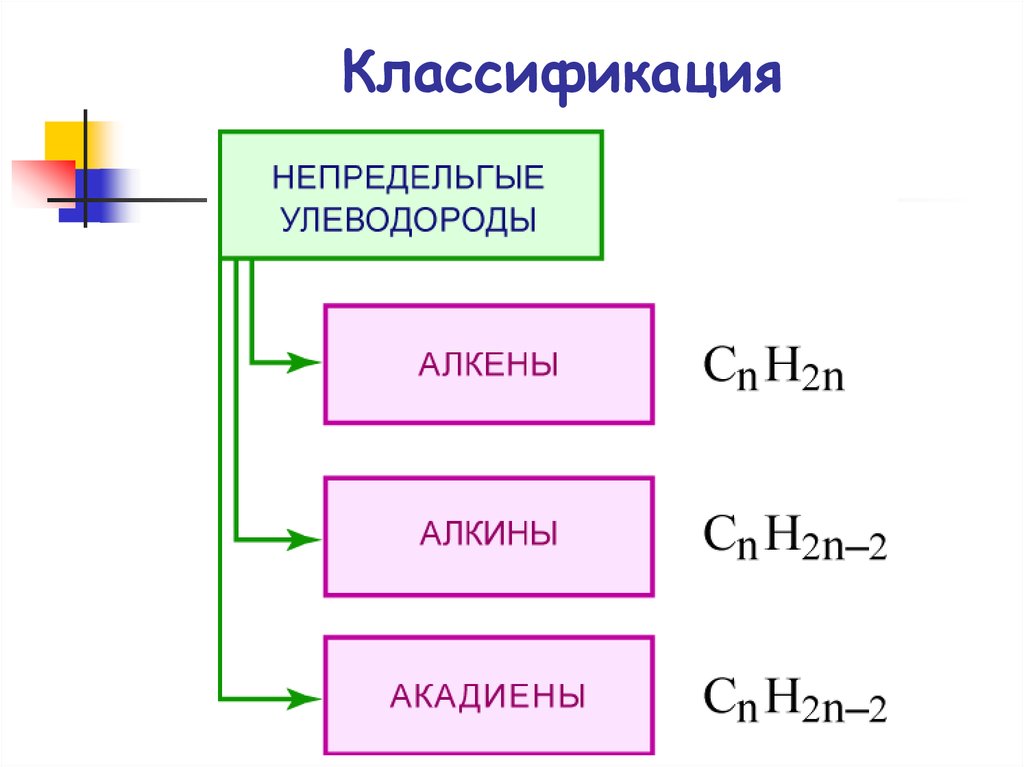
1. Непредельные углеводороды
Алкены, олефины2. Классификация
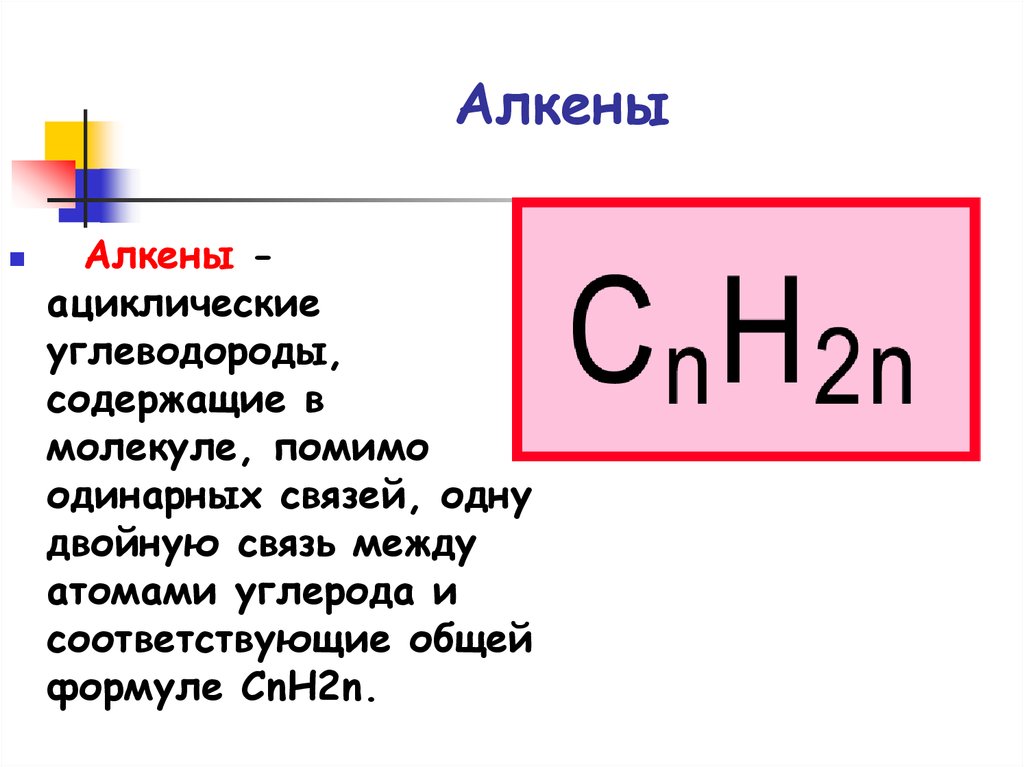
3. Алкены
Алкены ациклическиеуглеводороды,
содержащие в
молекуле, помимо
одинарных связей, одну
двойную связь между
атомами углерода и
соответствующие общей
формуле CnH2n.
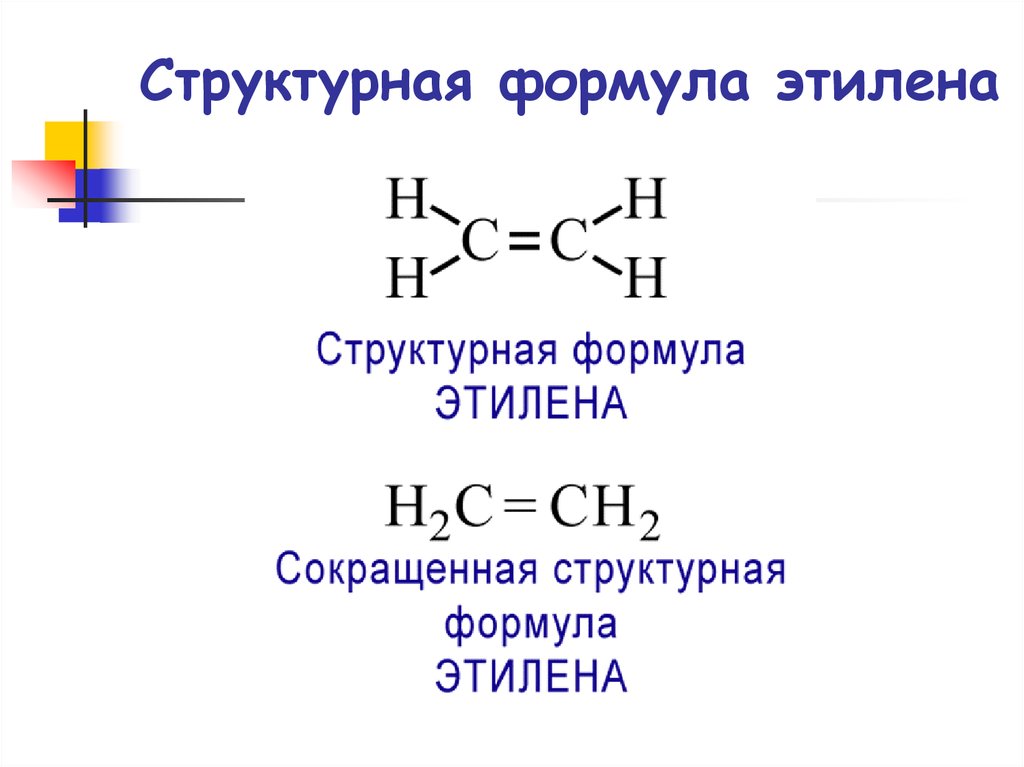
4. Структурная формула этилена
5. Изомерия и номенклатура
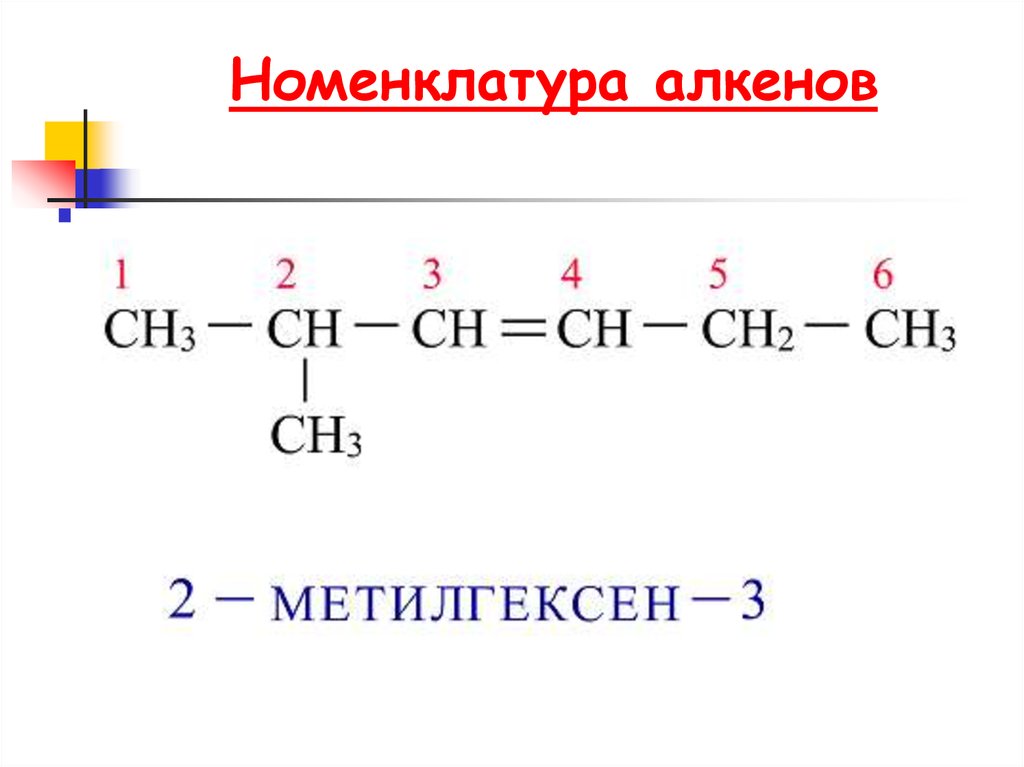
6. Номенклатура алкенов
7. Алкены. Номенклатура
1) в алкенах с неразветвленной цепьюнумерацию производят с того конца, ближе к
которому находится двойная связь. В названии
алкана, соответствующего этой родоначальной
структуре, суффикс -ан заменяется на –ен.
CH2 CH2
CH2 CH CH3
этилен
пропилен
CH3CH CHCH2CH2CH3
гексен-2
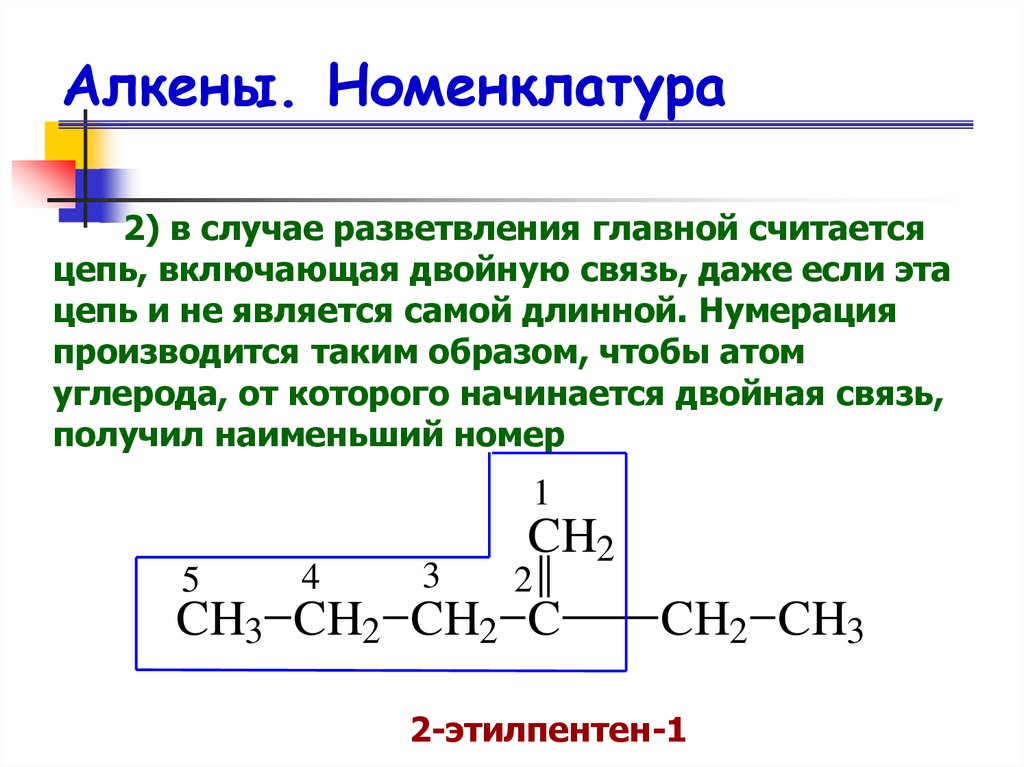
8. Алкены. Номенклатура
2) в случае разветвления главной считаетсяцепь, включающая двойную связь, даже если эта
цепь и не является самой длинной. Нумерация
производится таким образом, чтобы атом
углерода, от которого начинается двойная связь,
получил наименьший номер
1
5
4
3
CH2
2
CH3 CH2 CH2 C
CH2 CH3
2-этилпентен-1
9. Алкены. Номенклатура
3) Углеводородные заместители обозначаютсяпрефиксом. Положение их указывается цифрой,
соответствующей номеру того атома углерода, у
которого находится заместитель. Заместители
перечисляются в алфавитном порядке. В случае
нескольких одинаковых углеводородных
заместителей перед их названием ставится
умножительная приставка ди-, три- и т. д.
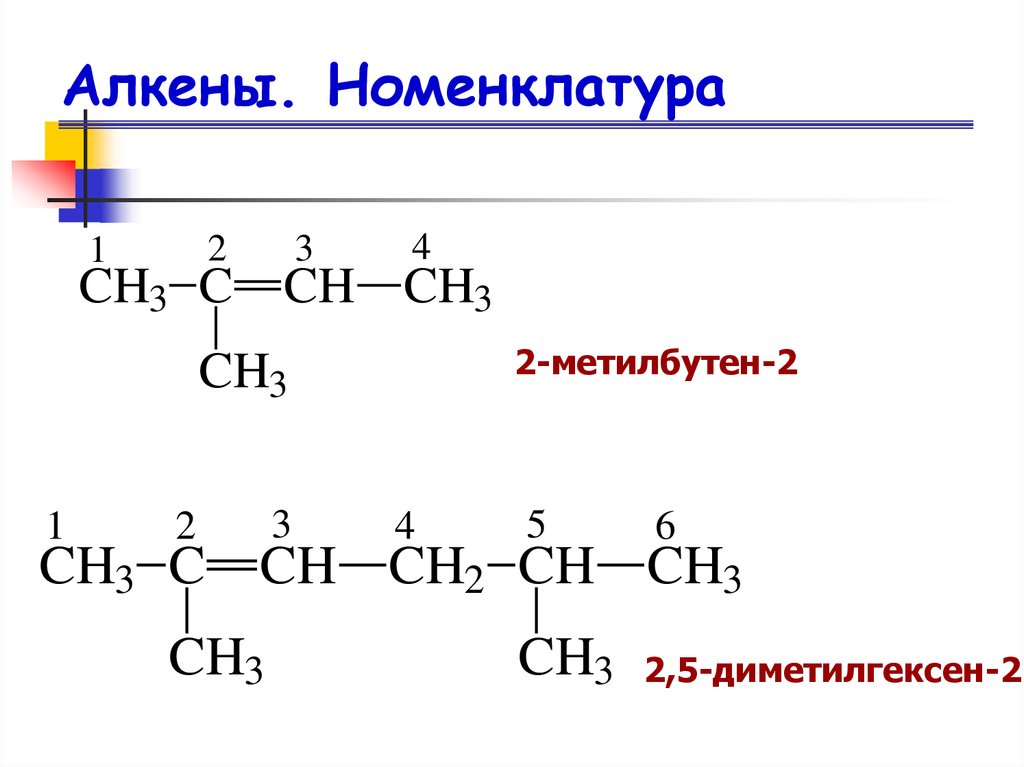
10. Алкены. Номенклатура
21
3
4
CH3 C CH CH3
2-метилбутен-2
CH3
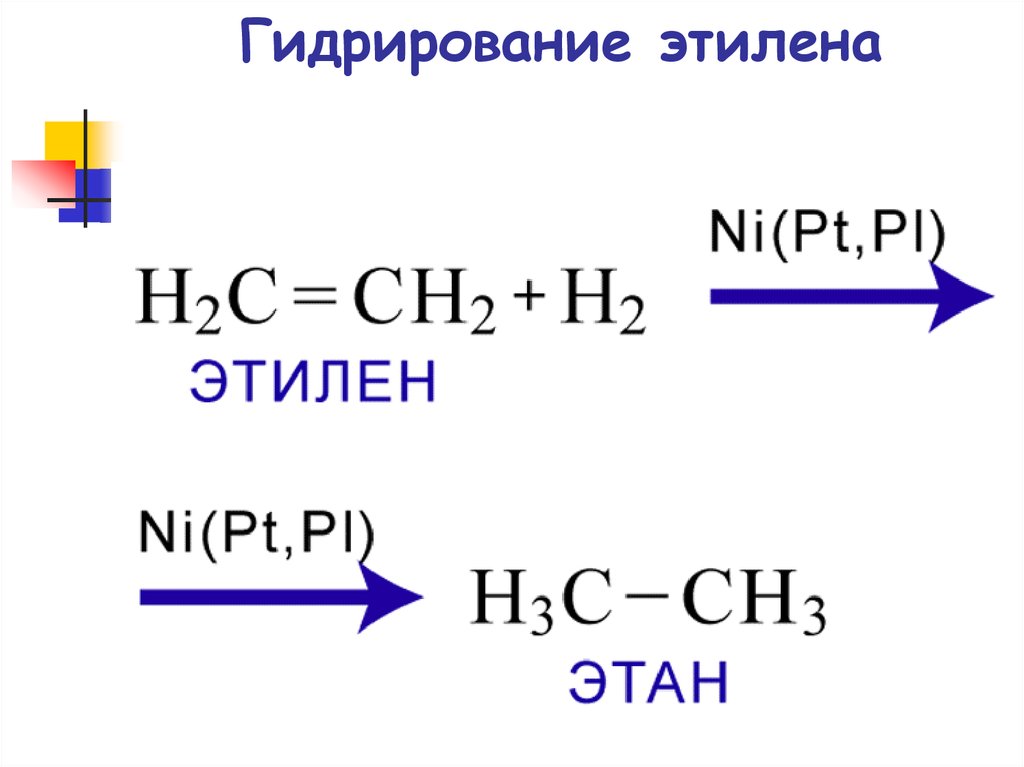
1
2
CH3 C
3
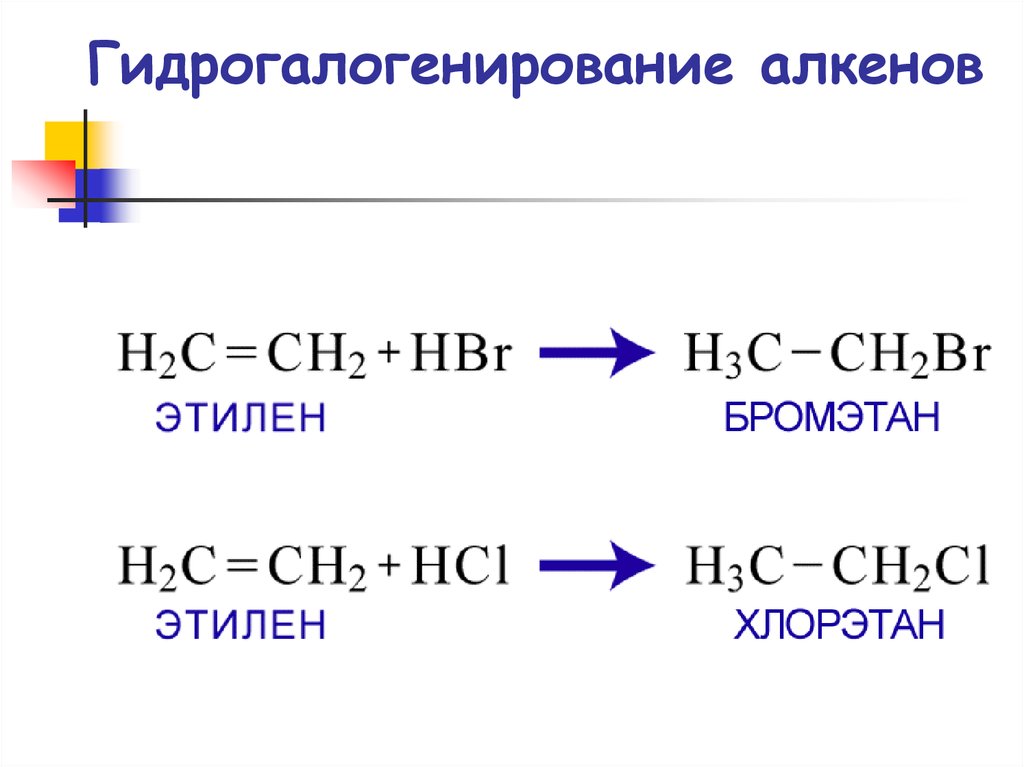
4
5
6
CH CH2 CH CH3
CH3
CH3
2,5-диметилгексен-2
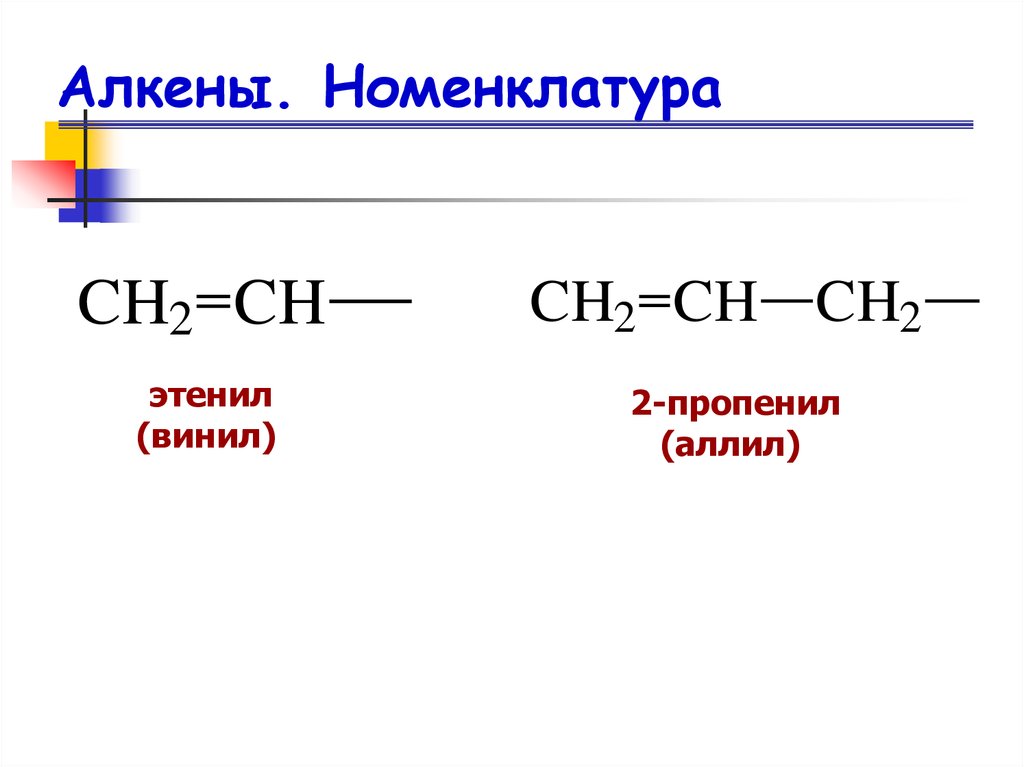
11. Алкены. Номенклатура
CH2 CHCH2 CH CH2
этенил
(винил)
2-пропенил
(аллил)
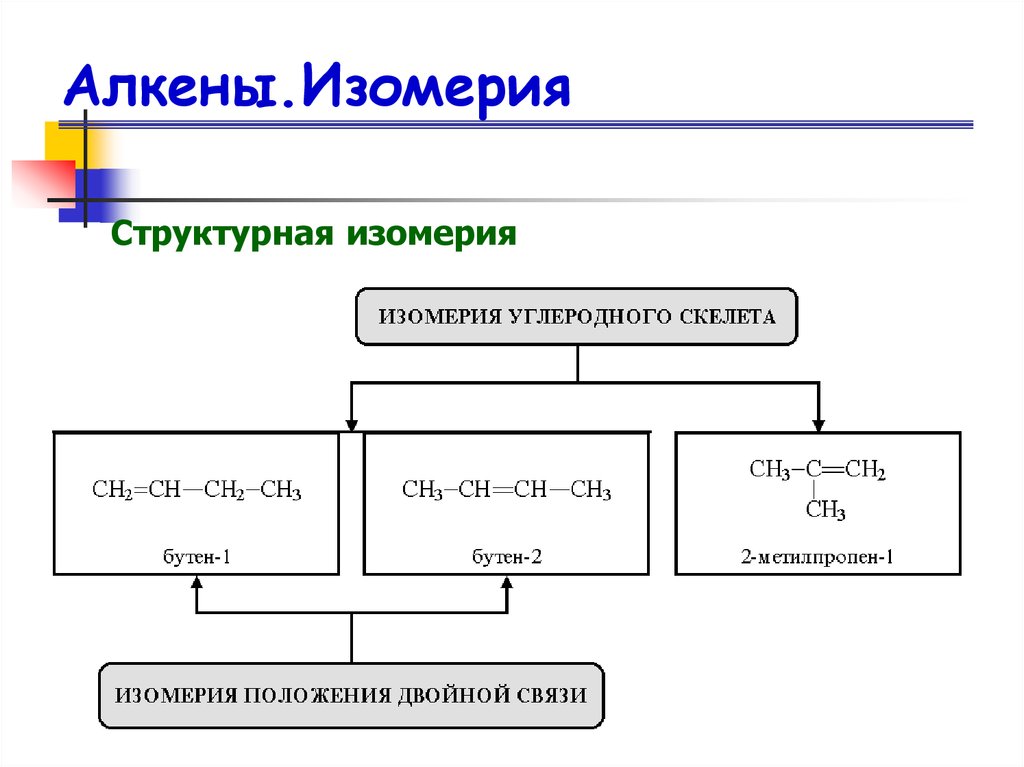
12. Изомерия алкенов
13. Алкены.Изомерия
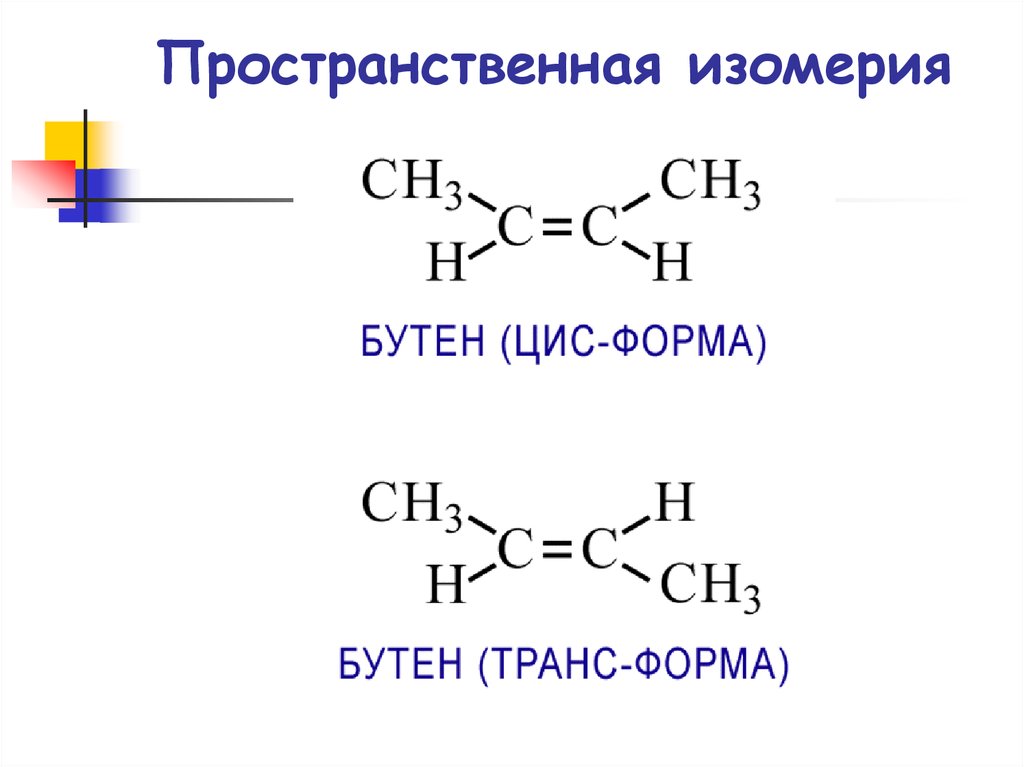
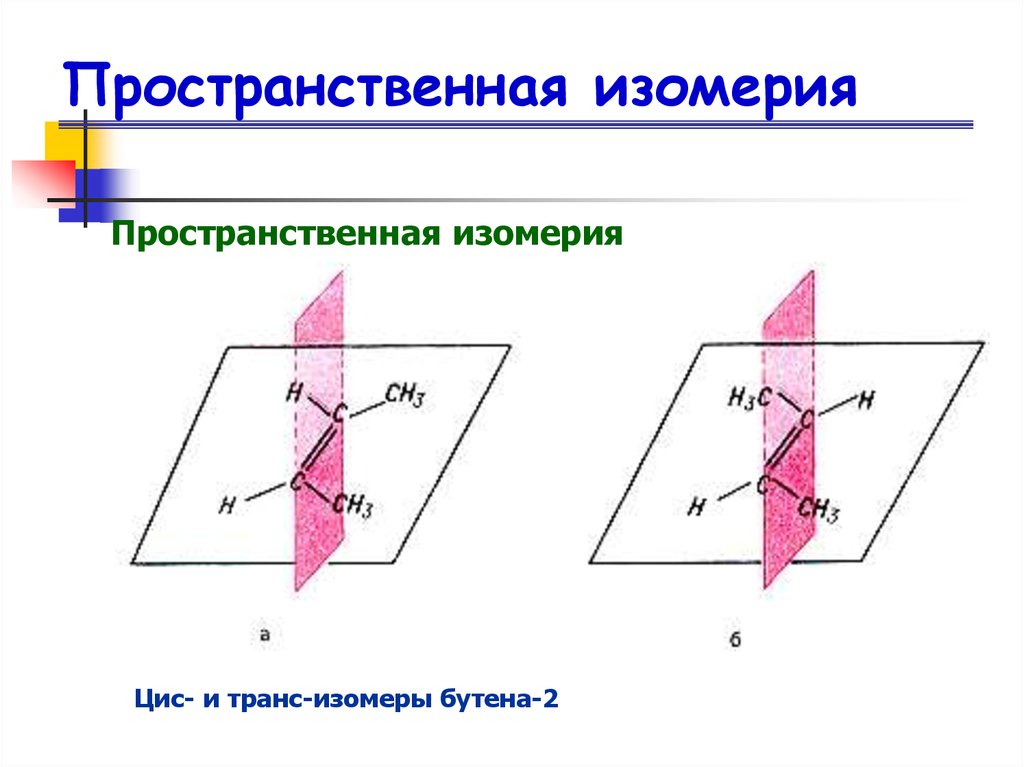
Структурная изомерия14. Пространственная изомерия
15. Пространственная изомерия
16. Пространственная изомерия
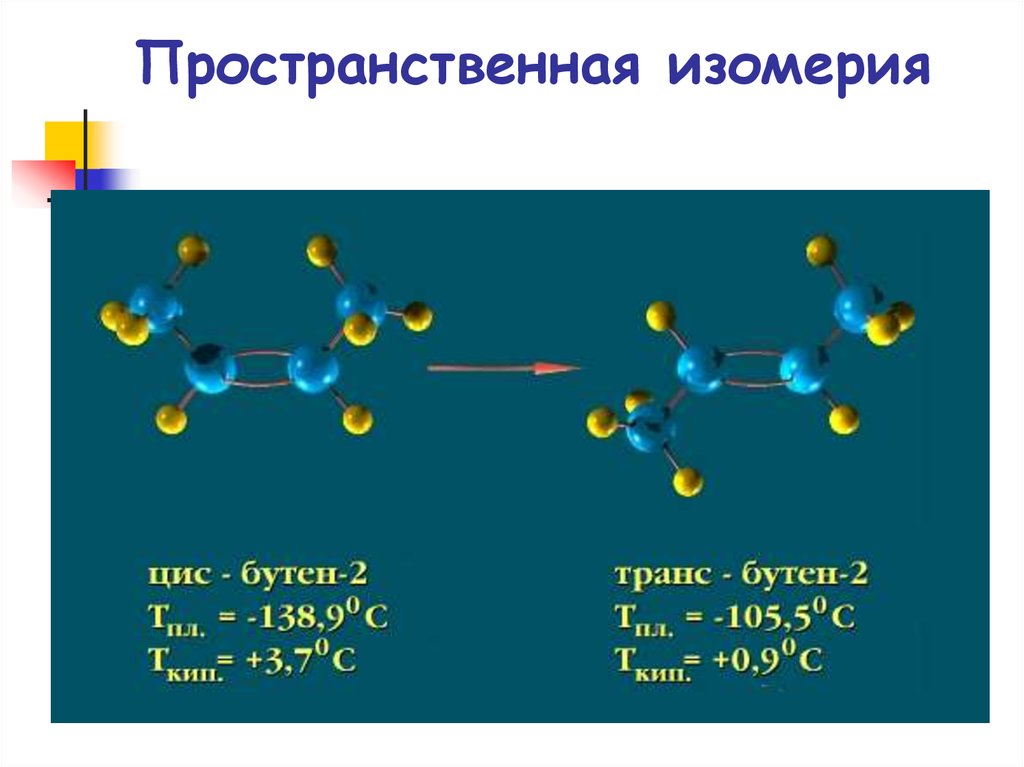
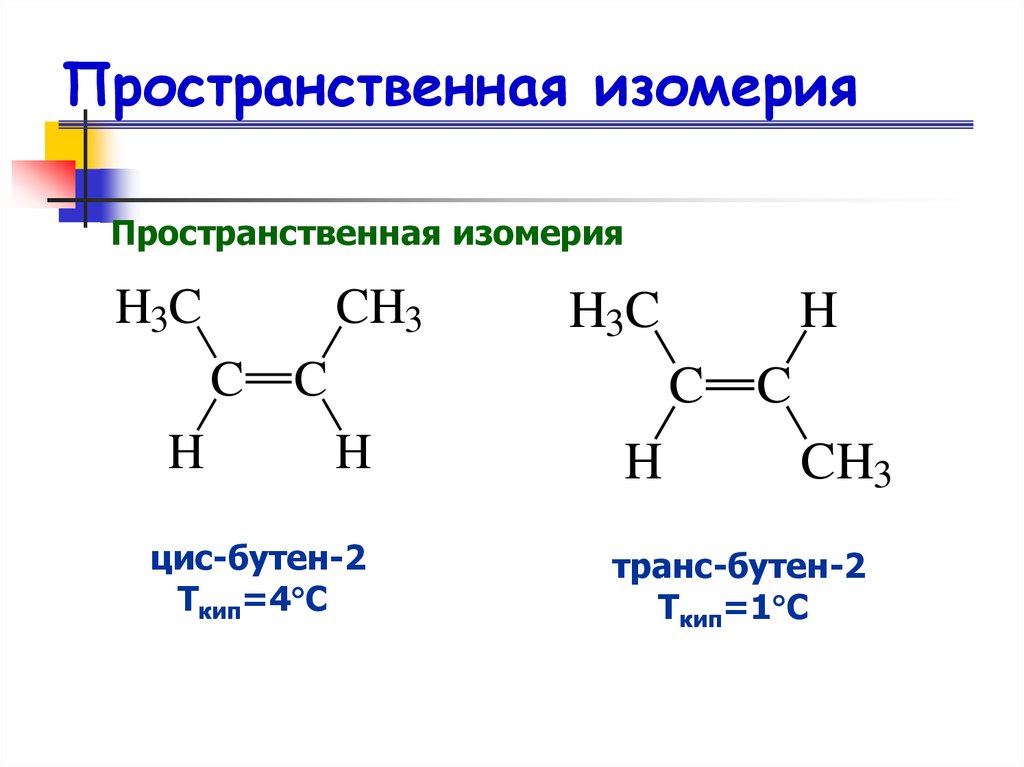
Пространственная изомерияЦис- и транс-изомеры бутена-2
17. Пространственная изомерия
Пространственная изомерияH3C
CH3
H3C
C C
H
H
C
H
цис-бутен-2
Ткип=4 С
H
C
CH3
транс-бутен-2
Ткип=1 С
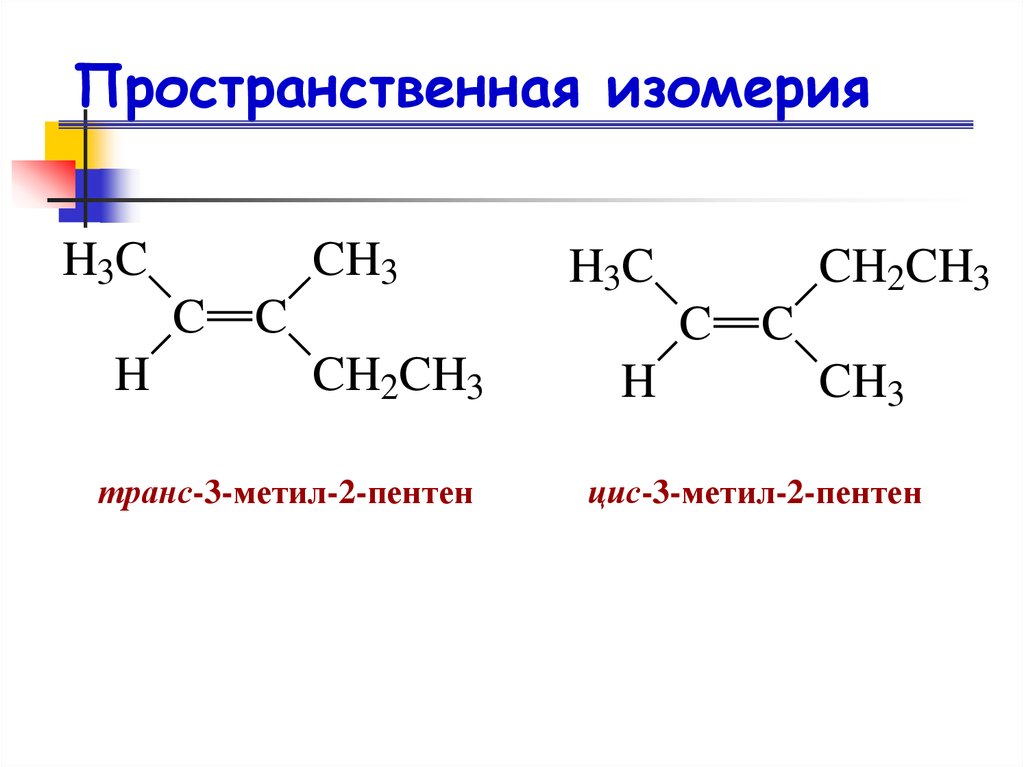
18. Пространственная изомерия
H3CCH3
C
H
H3C
C
CH2CH3
C
CH2CH3
транс-3-метил-2-пентен
H
C
CH3
цис-3-метил-2-пентен
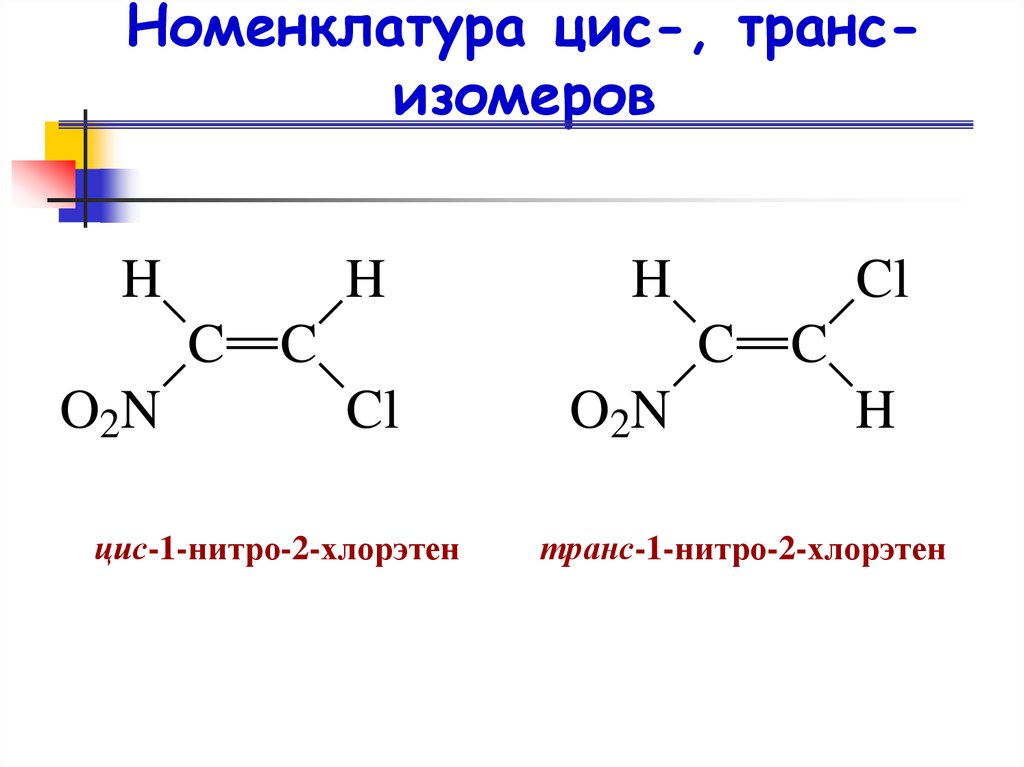
19. Номенклатура цис-, транс-изомеров
Номенклатура цис-, трансизомеровH
H
C
O 2N
H
C
Cl
C
Cl
цис-1-нитро-2-хлорэтен
O 2N
C
H
транс-1-нитро-2-хлорэтен
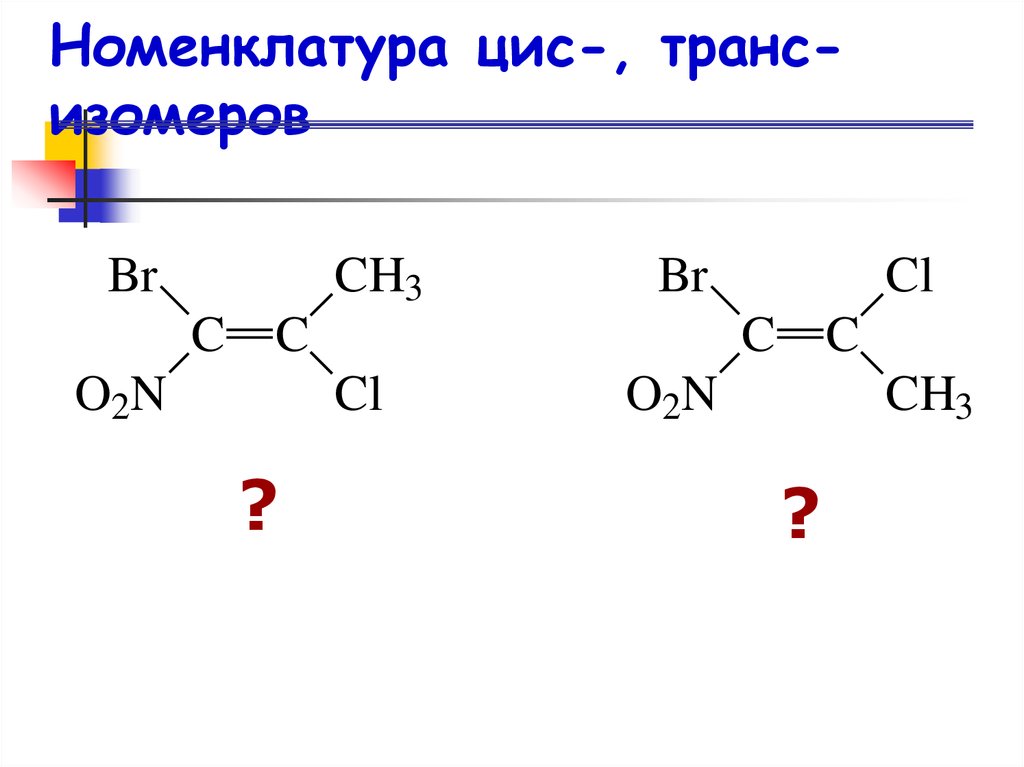
20. Номенклатура цис-, транс-изомеров
Номенклатура цис-, трансизомеровBr
CH3
C
Br
C
O 2N
C
Cl
?
Cl
C
O2N
CH3
?
21. Номенклатура цис-, транс-изомеров
Номенклатура цис-, трансизомеровСистема Кана–Ингольда–Прелога
?
Роберт Сидни Кан
Ингольд Кристофер
Прелог Владимир
(9.06.1899-15.09.1981) (28.10.1893–8.10.1970)
(23.07.1906–07.01.1998)
(Великобритания)
(Великобритания)
(Швейцария)
22. Номенклатура цис-, транс-изомеров
Номенклатура цис-, трансизомеров1. Используя систему Кана–Ингольда–Прелога,
определяют сначала относительное старшинство
заместителей, связанных с двойной связью, и
дают им номера по старшинству 1 или 2.
2. Если две наиболее старшие группы
расположены по одну сторону от плоскости связи, то конфигурация заместителей
обозначается символом Z, если же эти группы
находятся по разные стороны от плоскости связи, то конфигурация обозначается символом Е.
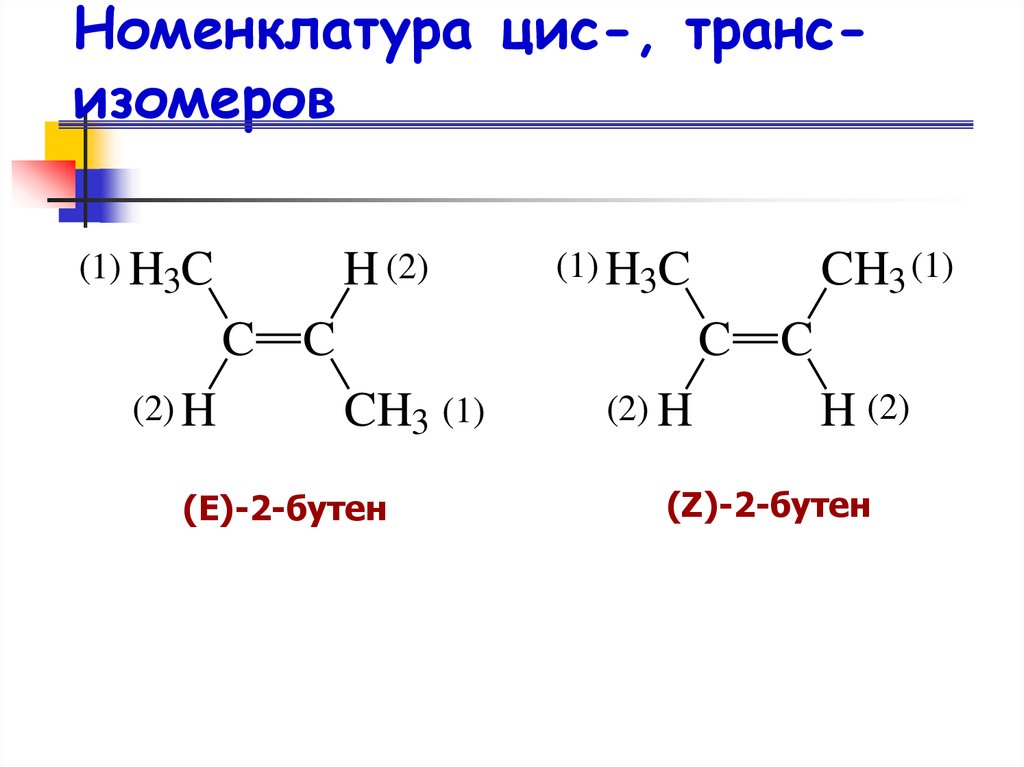
23. Номенклатура цис-, транс-изомеров
Номенклатура цис-, трансизомеров(1) H3C
H (2)
(1) H3C
C C
(2) H
CH3 (1)
C
CH3 (1)
(Е)-2-бутен
(2) H
C
H (2)
(Z)-2-бутен
24. Номенклатура цис-, транс-изомеров
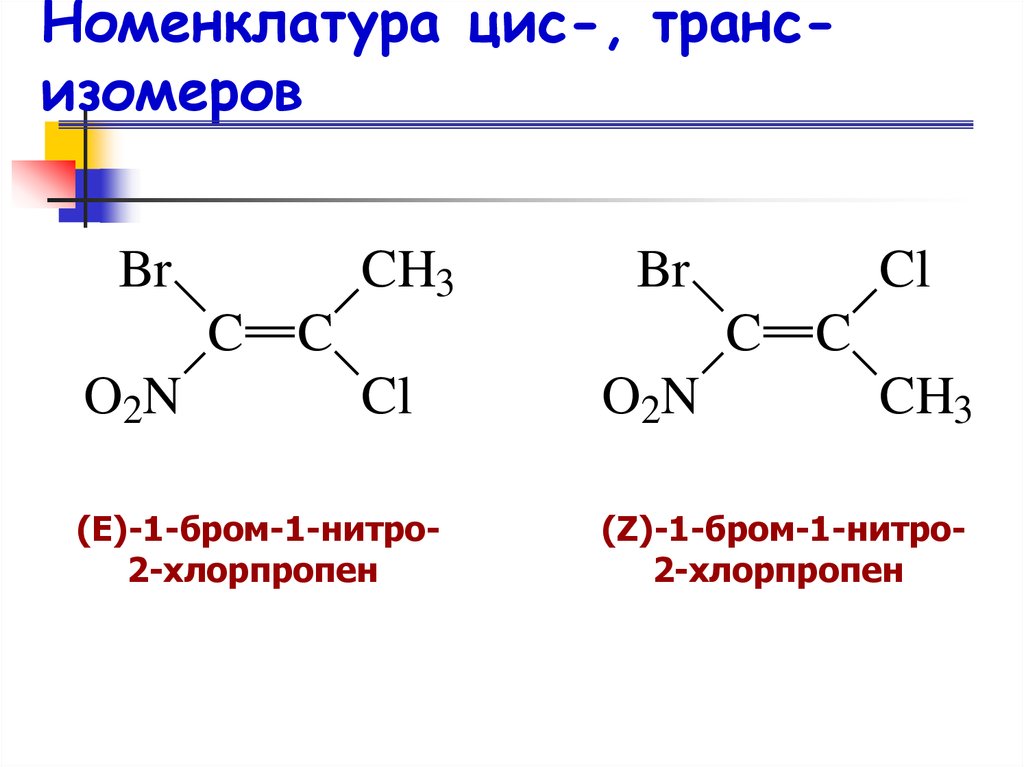
Номенклатура цис-, трансизомеровBr
CH3
C
O2N
Br
C
Cl
C
Cl
(Е)-1-бром-1-нитро2-хлорпропен
O 2N
C
CH3
(Z)-1-бром-1-нитро2-хлорпропен
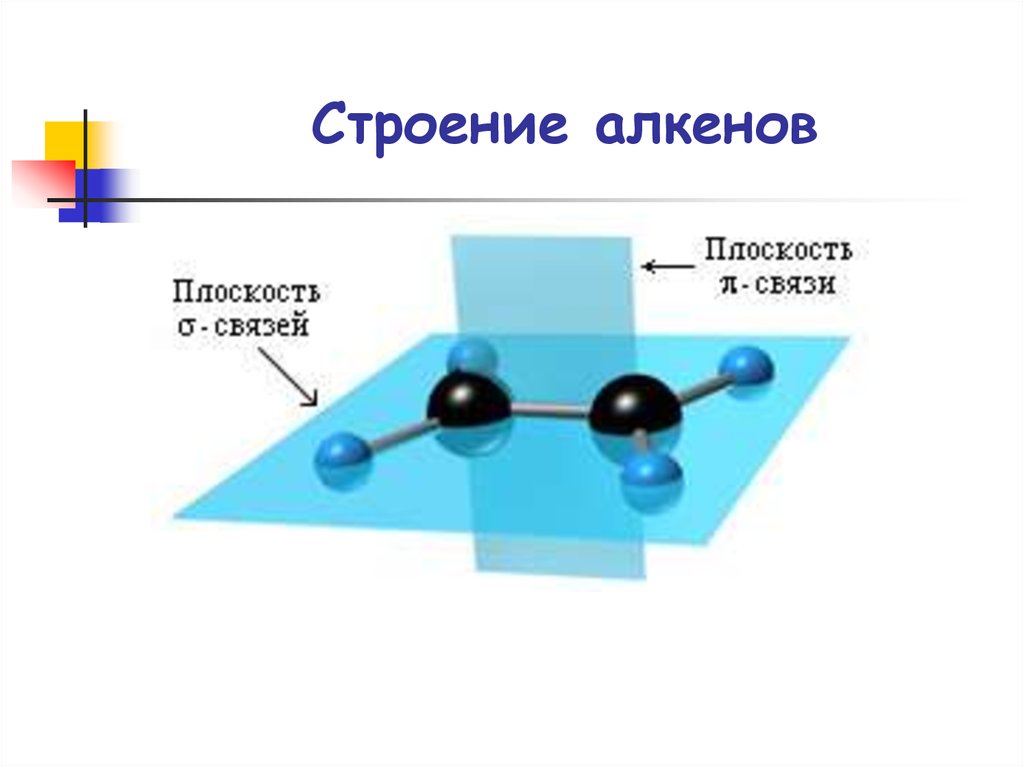
25. Строение алкенов
26. Модель молекулы этилена
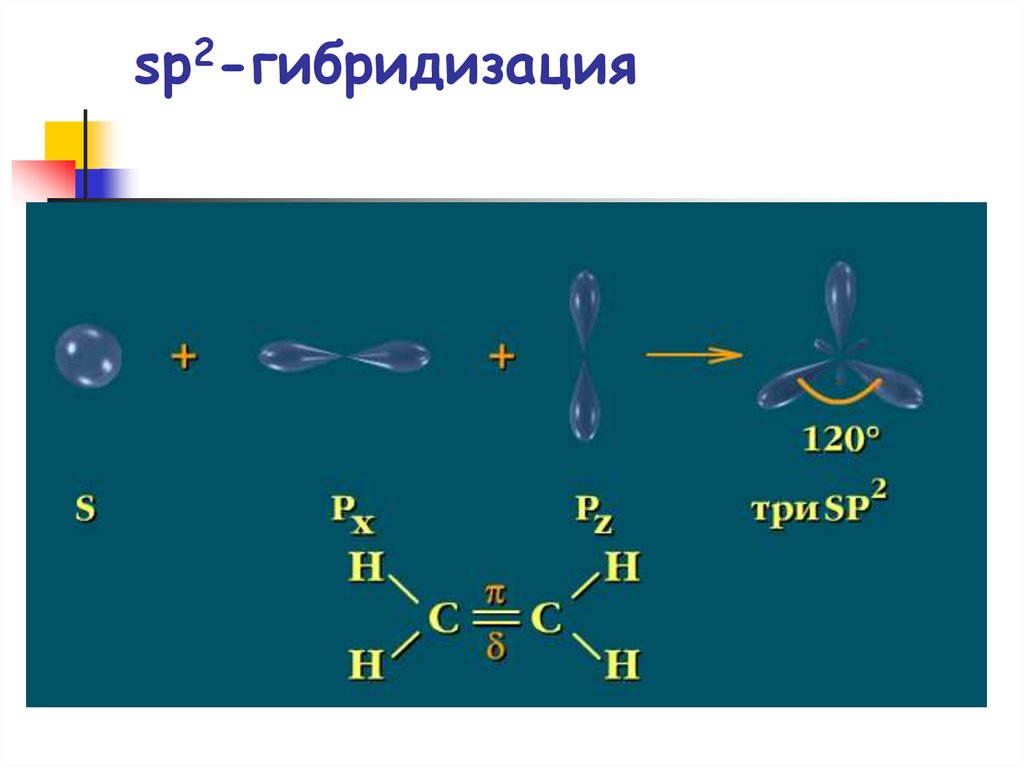
27. sp2-гибридизация
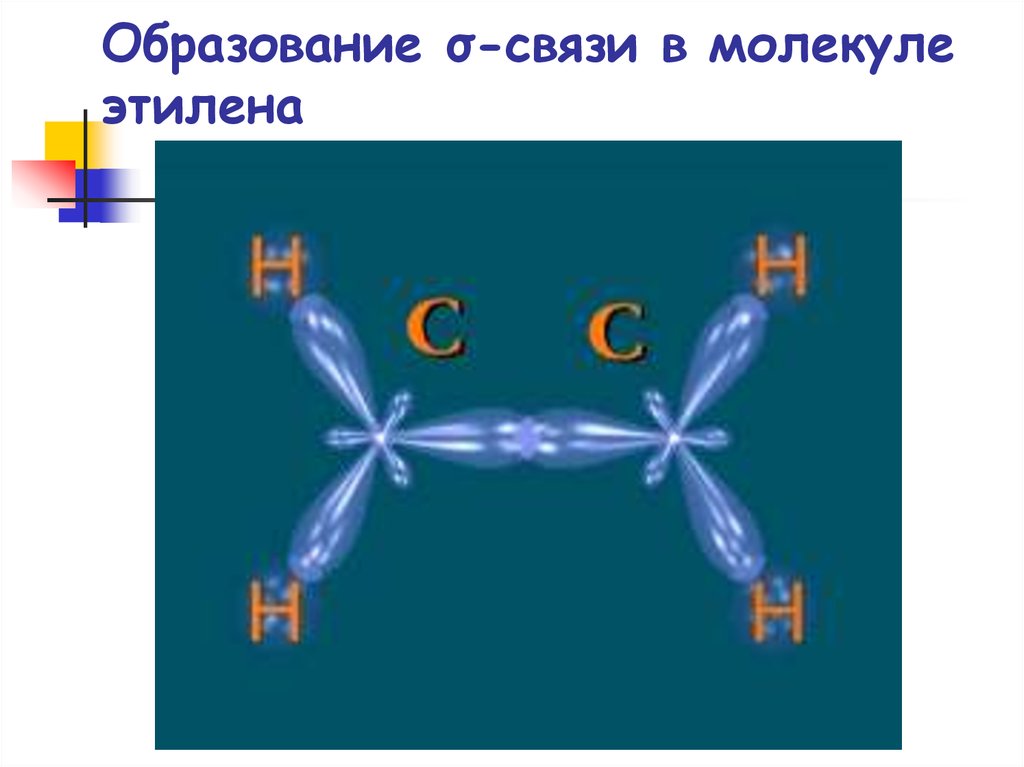
28. Образование σ-связи в молекуле этилена
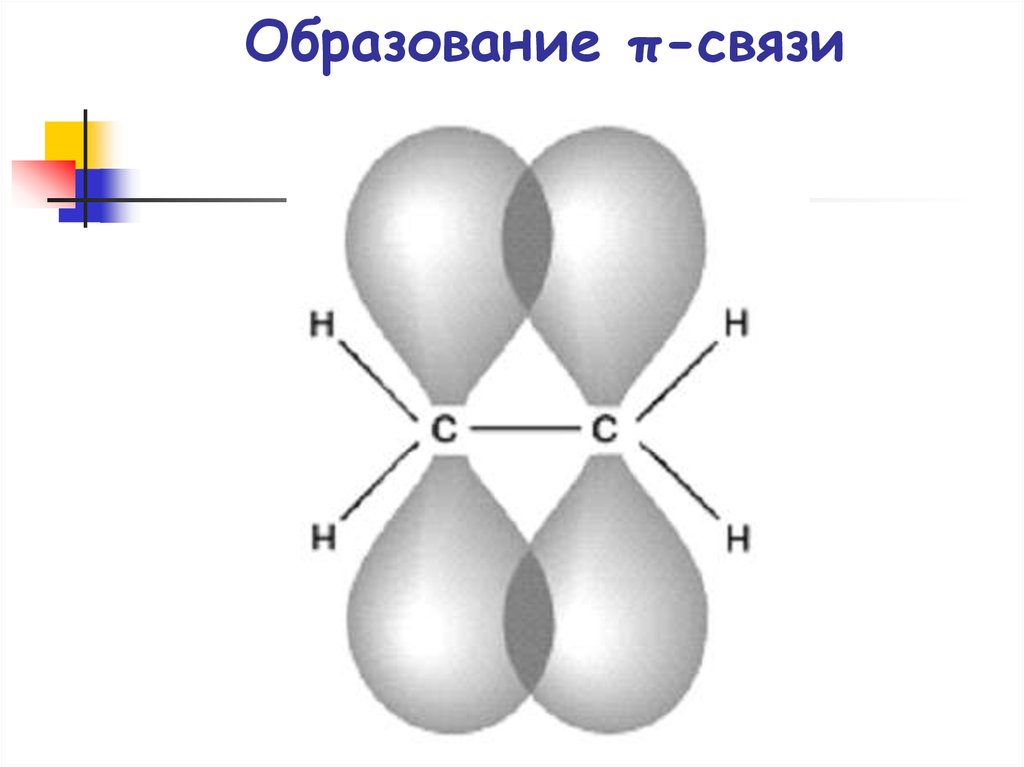
29. Образование π-связи
30. Строение алкенов
31.
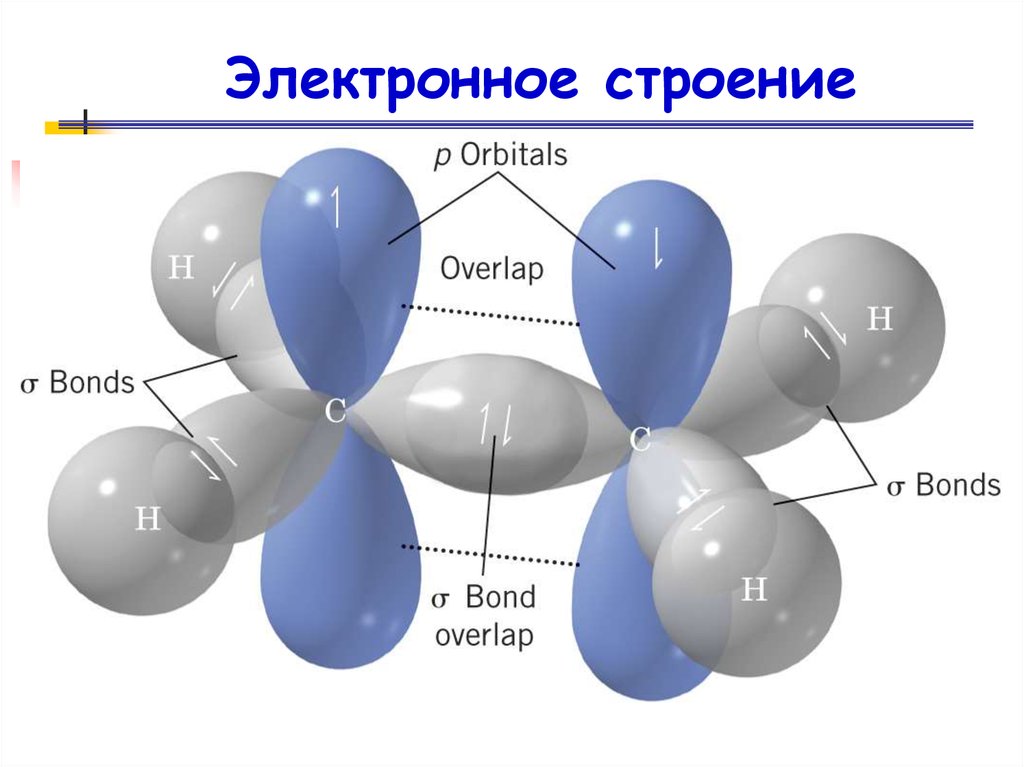
Электронное строение32.
33. Нахождение в природе
Этилен и его гомологи вочень небольшом
количестве встречаются в
природном газе, а также
нефти. Олефины,
образуются при крекинге
нефти, при сухой
перегонке дерева и
каменного угля.
34. Способы получения алкенов
35. Алкены
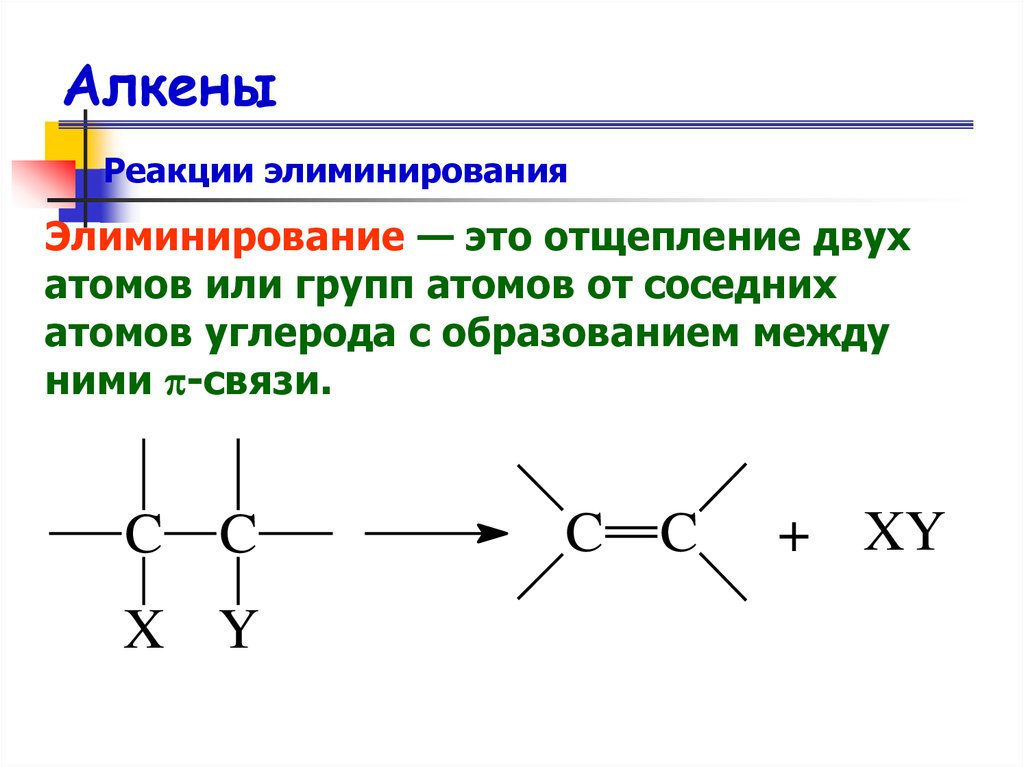
Реакции элиминированияЭлиминирование — это отщепление двух
атомов или групп атомов от соседних
атомов углерода с образованием между
ними -связи.
C C
X Y
C C
+ XY
36. Алкены
Реакции элиминированияЭЛИМИНИРОВАНИЕ
галогенводорода
HHal
воды
H2O
галогена
Hal2
водорода
H2
Дегидрогалогенирование
Дегидратация
Дегалогенирование
Дегидрирование
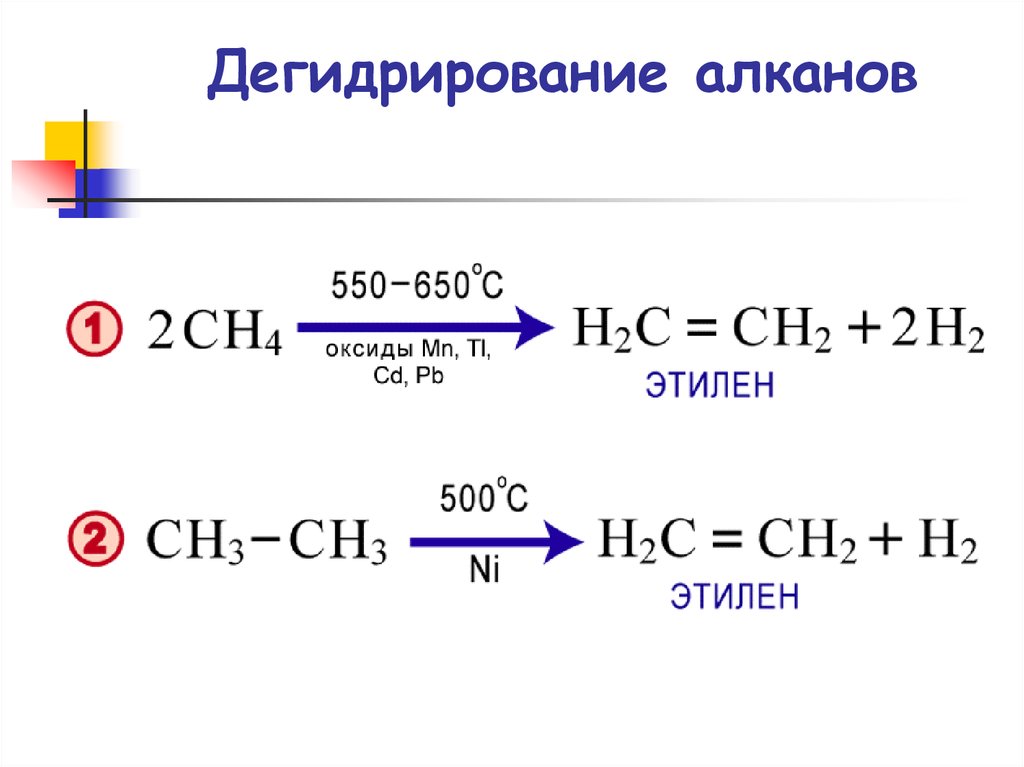
37. Дегидрирование алканов
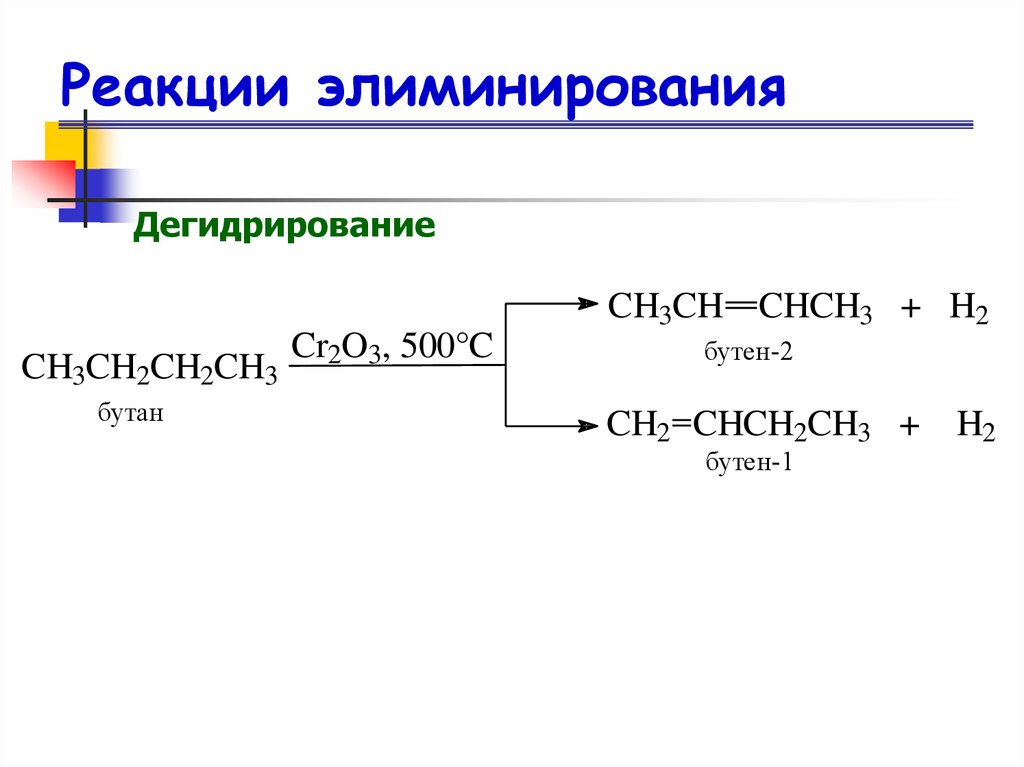
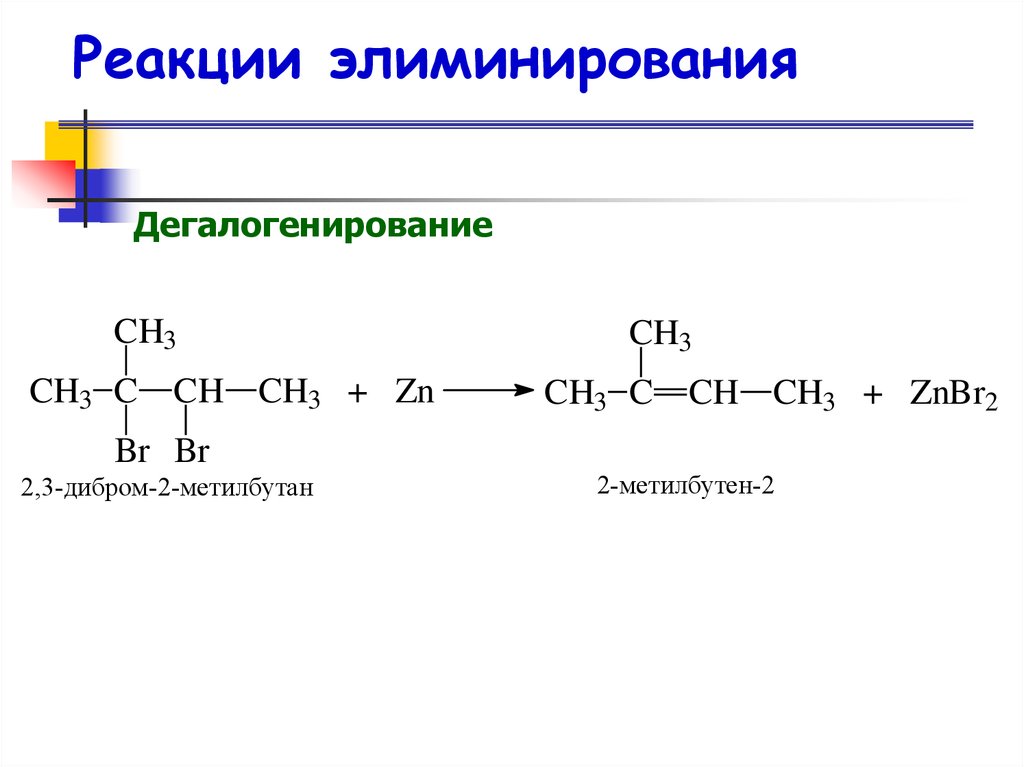
38. Реакции элиминирования
ДегидрированиеCH3CH CHCH3 + H2
CH3CH2CH2CH3
бутан
Cr2O3, 500°C
бутен-2
CH2 CHCH2CH3 +
бутен-1
H2
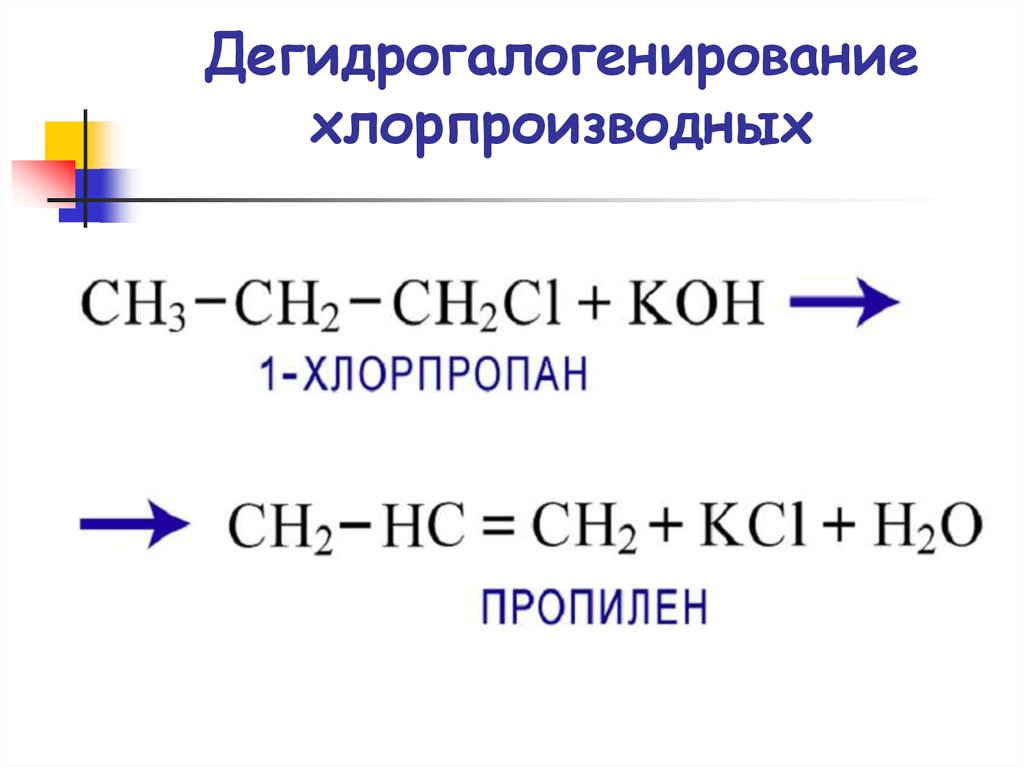
39. Дегидрогалогенирование хлорпроизводных
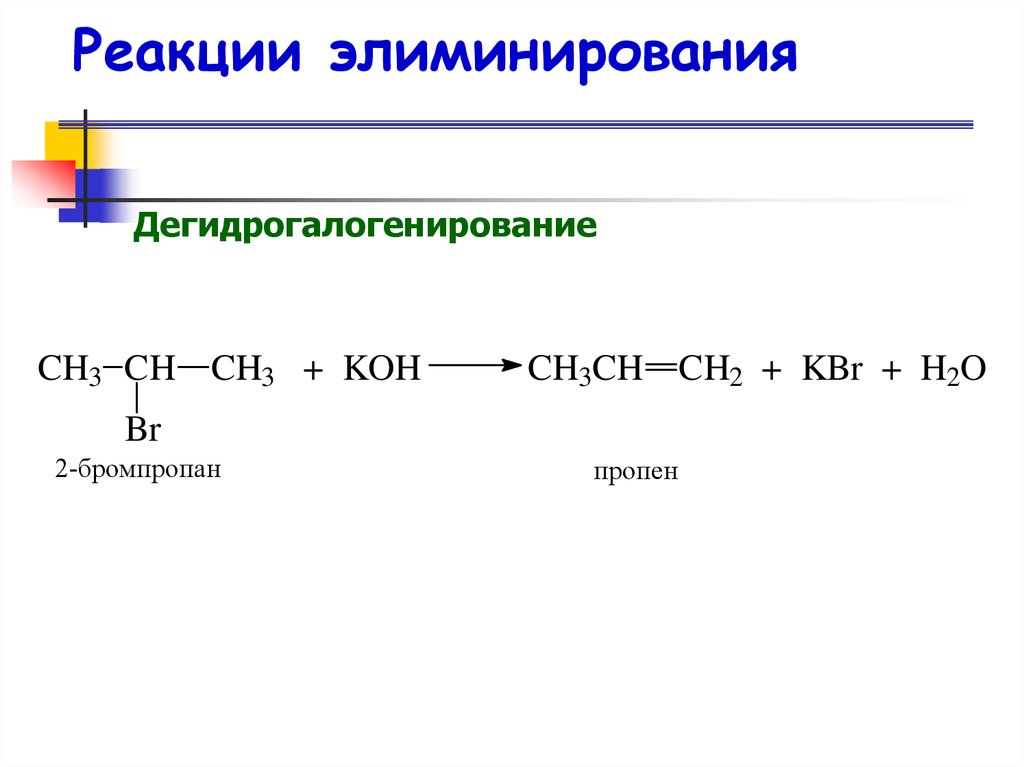
40. Реакции элиминирования
ДегидрогалогенированиеCH3 CH CH3 + KOH
CH3CH CH2 + KBr + H2O
Br
2-бромпропан
пропен
41. Реакции элиминирования
ДегидрогалогенированиеCH3 CH CH CH2CH3 + KOH
CH3 Br
3-бром-2-метилпентан
CH3 C
CH CH2CH3 + KBr + H2O
CH3
2-метилпентен-2
Правило Зайцева
В случае нессиметричных алкилгалогенидов
отщепление атома водорода происходит от
наименее гидрогенизированного атома углерода.
42.
ЗАЙЦЕВ Александр Михайлович (Россия)(2.VII.1841 - 1.IX.1910)
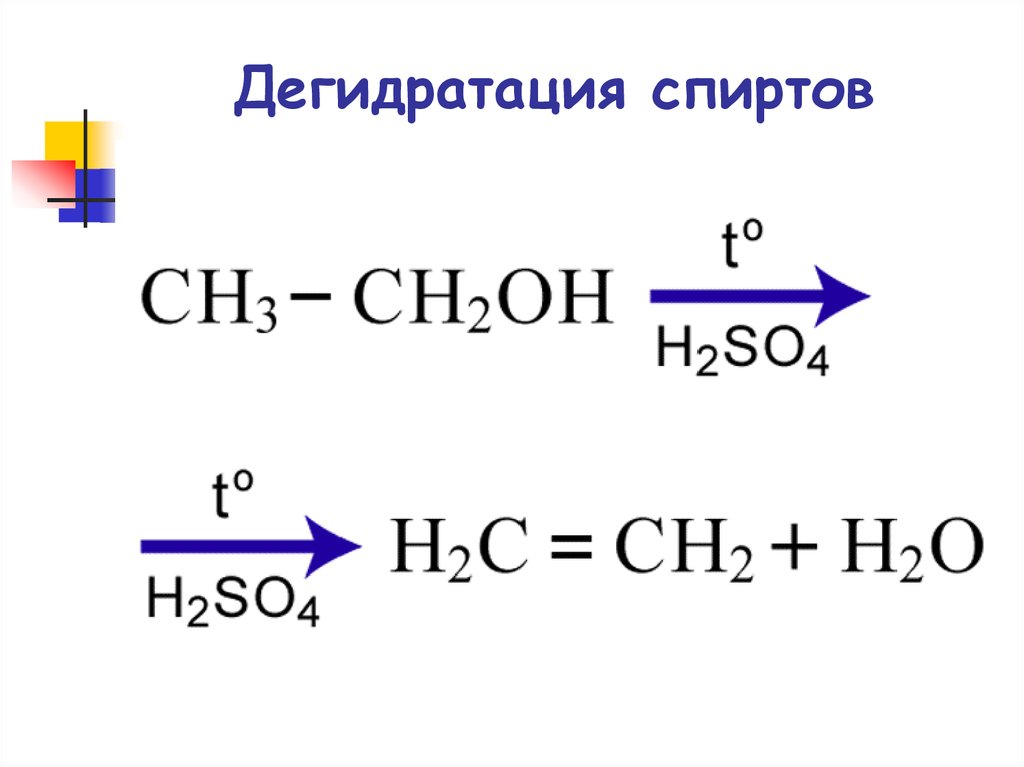
43. Дегидратация спиртов
44. Реакции элиминирования
ДегидратацияCH2 CH2
H
H2SO4, 170°C
CH2 CH2 + H2O
OH
этилен
этанол
CH3
CH CH2
H
H2SO4, 180°C
CH3
CH CH2 + H2O
OH
пропанол-1
пропен
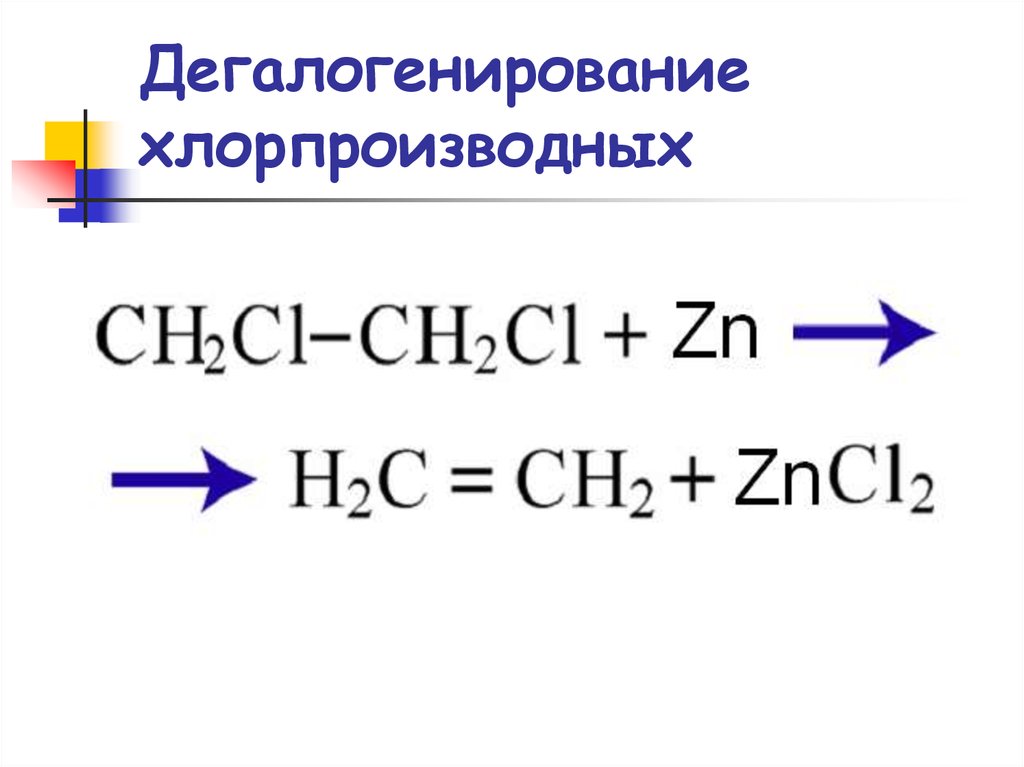
45. Дегалогенирование хлорпроизводных
46. Реакции элиминирования
ДегалогенированиеCH3
CH3 C
CH CH3 + Zn
CH3
CH3 C
CH CH3 + ZnBr2
Br Br
2,3-дибром-2-метилбутан
2-метилбутен-2
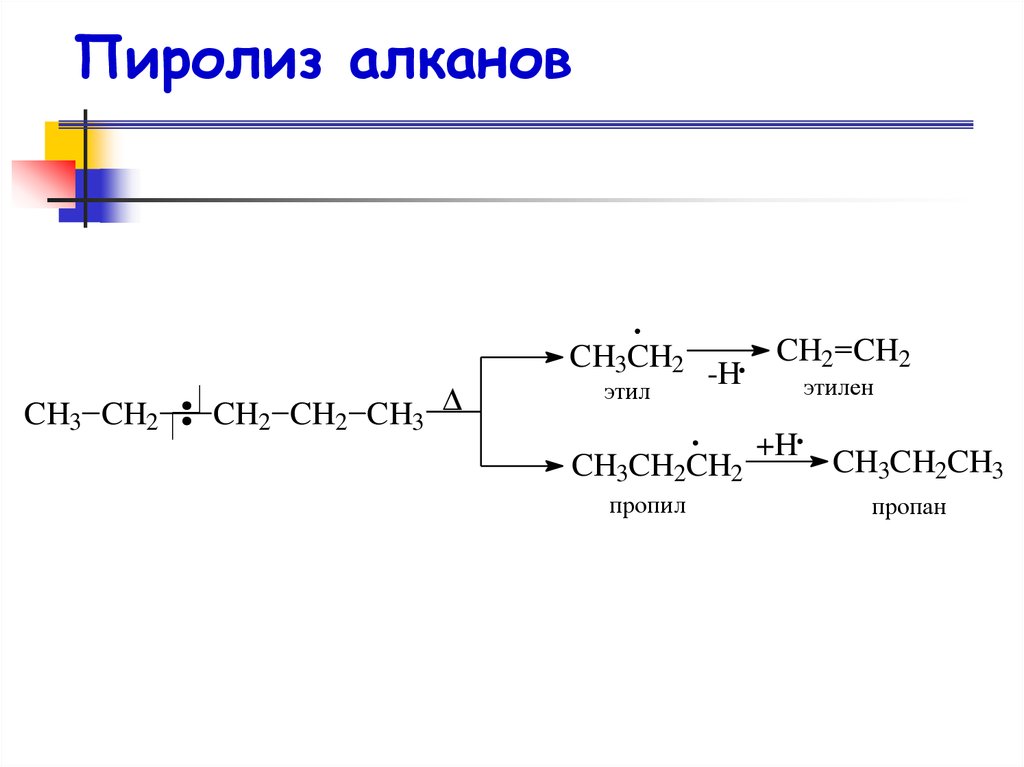
47. Пиролиз алканов
CH3CH2CH3 CH2
CH2 CH2 CH3
этил
-H
CH3CH2CH2
пропил
CH2 CH2
этилен
+H
CH3CH2CH3
пропан
48. Физические свойства алкенов
Алкены обладаютболее резким
запахом. По ρ
легче воды, плохо
растворяются в
воде. Некоторые
алкены обладают
физиологической,
биологической
активностью.
49.
50. Химические свойства
51. Общая характеристика реакционной способности алкенов
Алкены достаточнохимически активны. Причиной
этого является наличие в их
молекулах π-связи. Считается,
что π-связь является менее
прочной, чем σ-связь по
энергии, более поляризуемой
и пространственно доступной
для атаки различных
реагентов. Поэтому наиболее
характерными реакциями для
алкенов являются реакции
присоединения, протекающие
за счет разрыва π-связи и
образования двух новых σсвязей.
52. Химические свойства
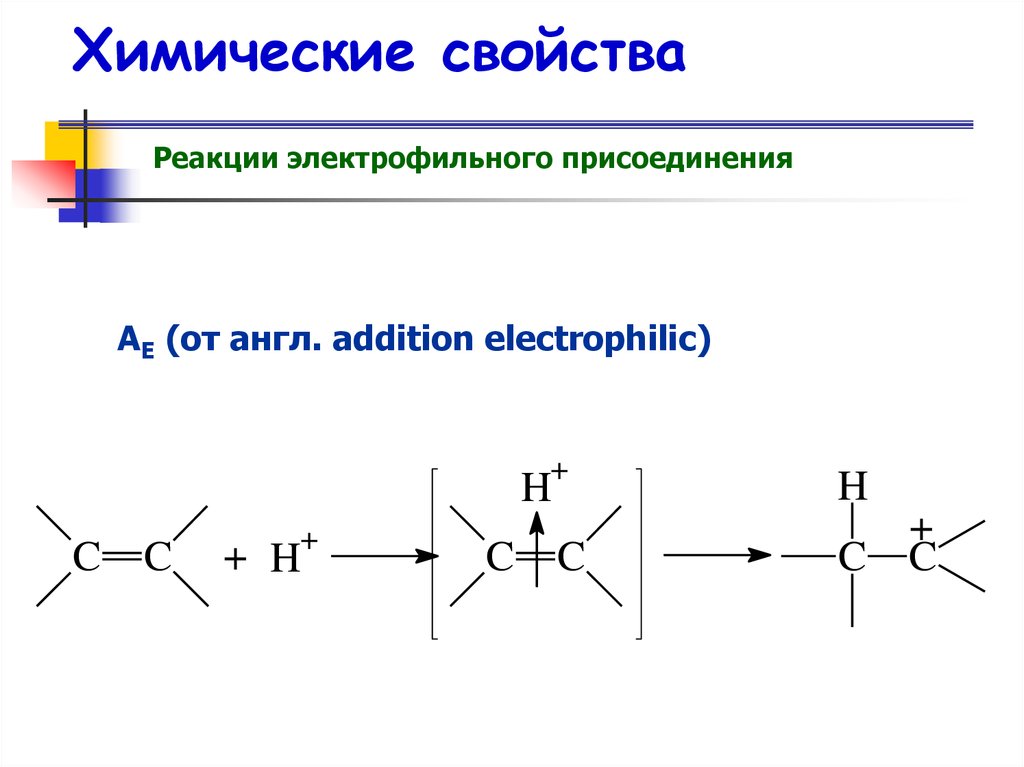
Реакции электрофильного присоединенияАE (от англ. addition electrophilic)
+
H
C
C
+
+ H
C
C
H
C
+
C
53. Химические свойства
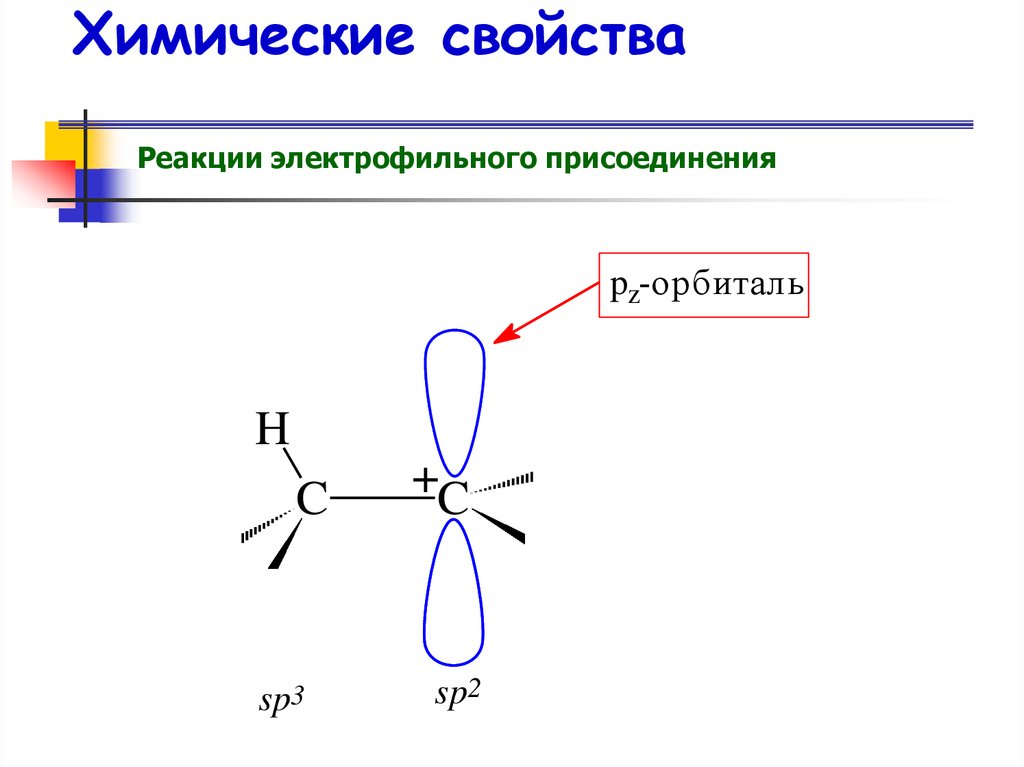
Реакции электрофильного присоединенияpz-орбиталь
H
C
sp3
+C
sp2
54.
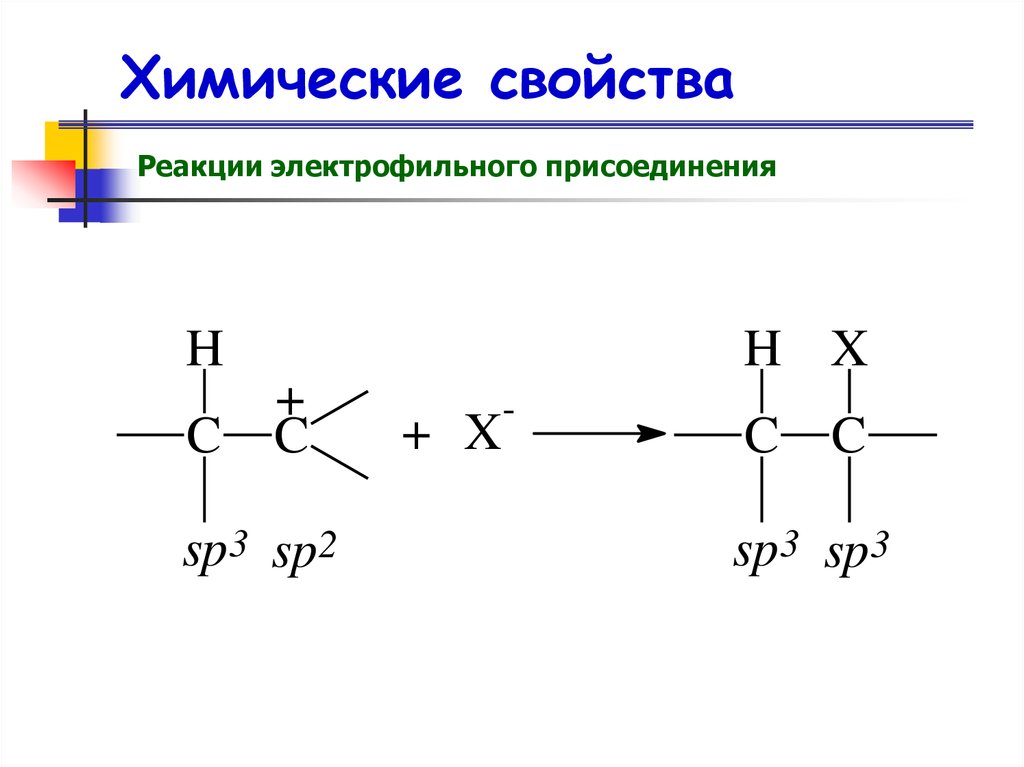
Химические свойстваРеакции электрофильного присоединения
H
C
H X
+
C
sp3 sp2
+ X
-
C
C
sp3 sp3
55.
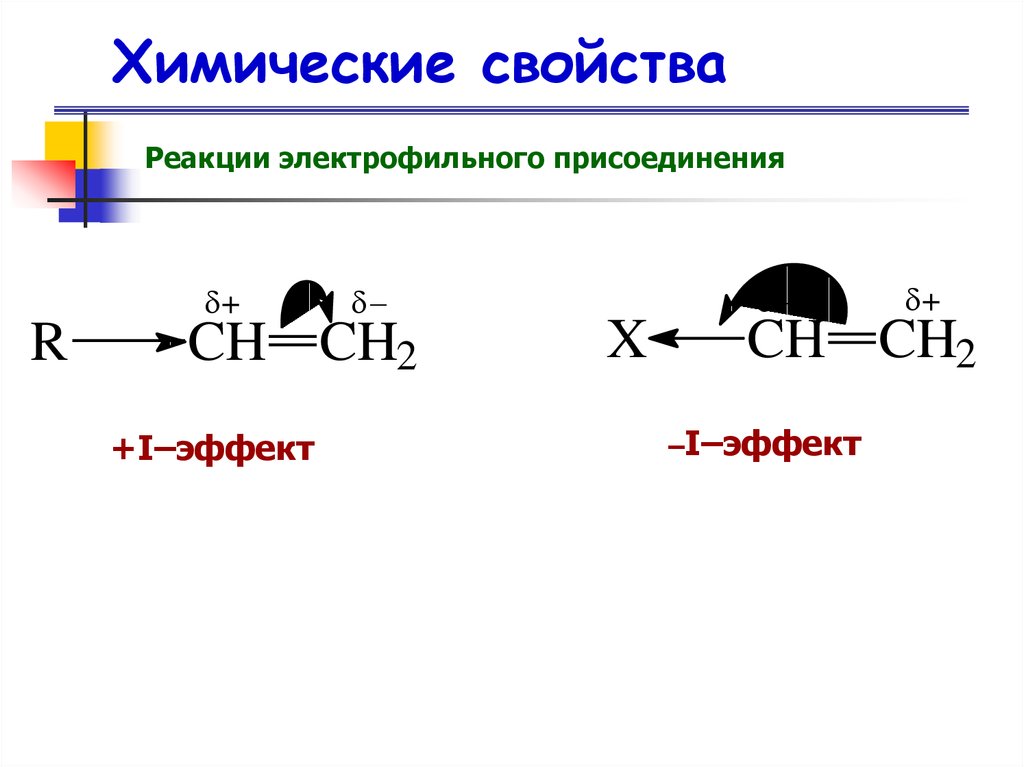
Химические свойстваРеакции электрофильного присоединения
+
R
CH CH2
+I–эффект
X
+
CH CH2
–I–эффект
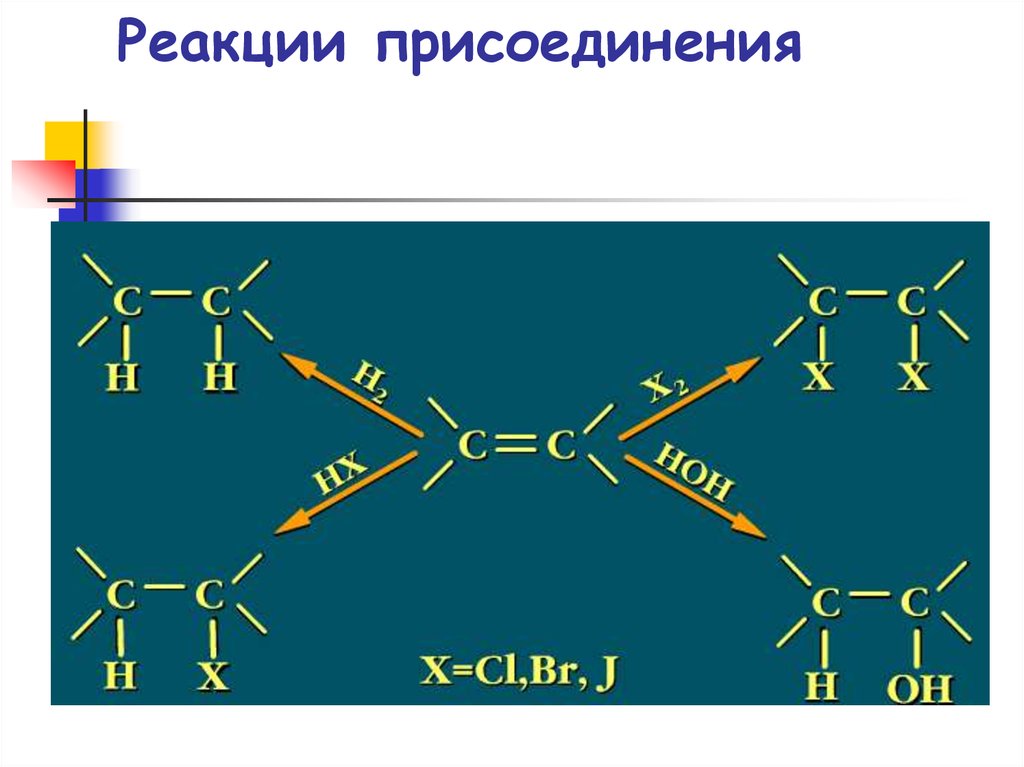
56. Реакции присоединения
57. Гидрирование этилена
58. Гидратация алкенов
59. Галогенирование алкенов
60.
Реакции электрофильногоприсоединения
Галогенирование
+
Br
Br
-
Br
C
C
+
Br
-комплекс
C
Br
+
C
Br
-комплекс
Br
C
C
C
+
Br
циклический
ион бромония
Br
C
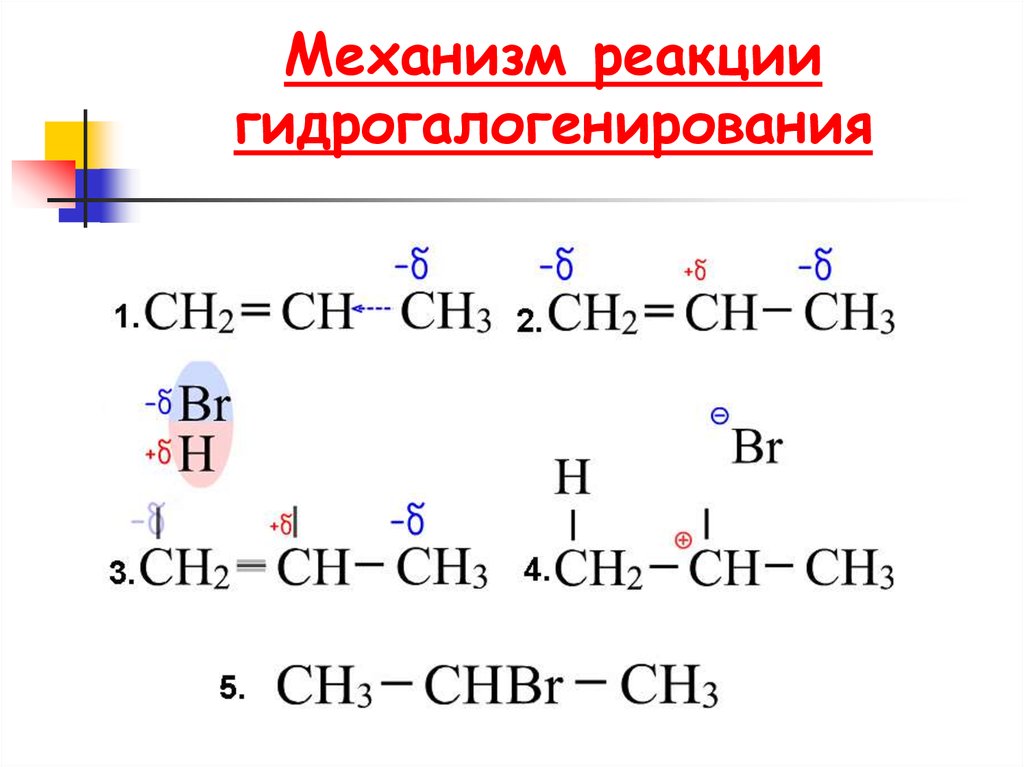
61. Гидрогалогенирование алкенов
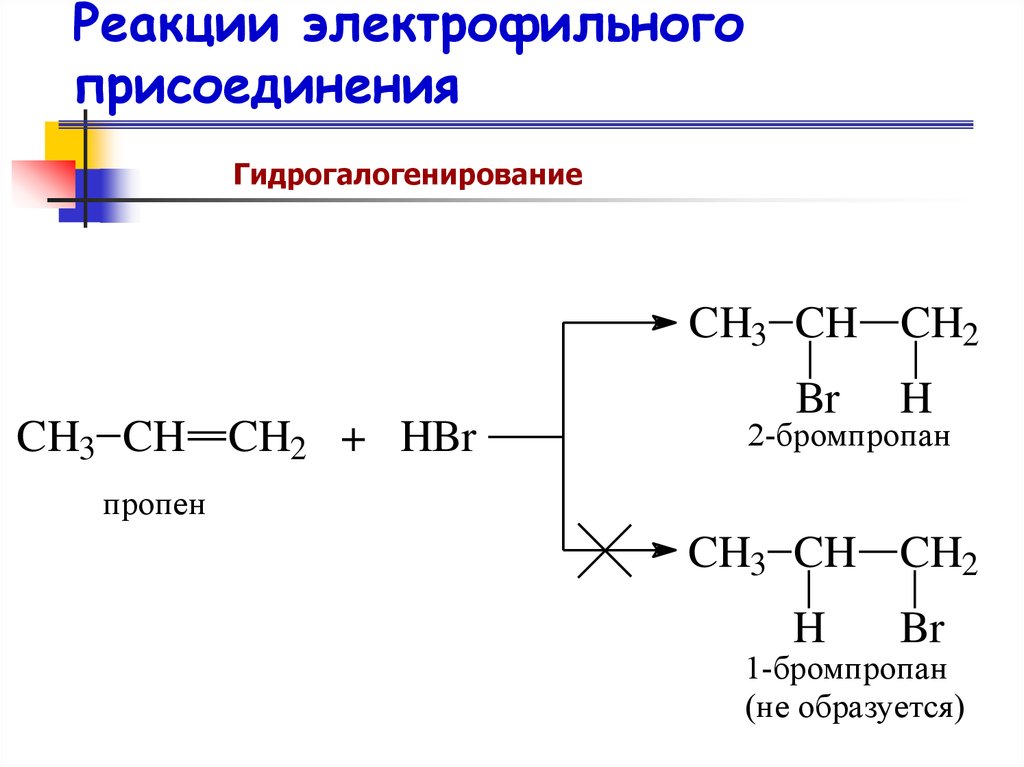
62. Реакции электрофильного присоединения
ГидрогалогенированиеCH3 CH CH2
CH3 CH CH2 + HBr
Br
H
2-бромпропан
пропен
CH3 CH CH2
H
Br
1-бромпропан
(не образуется)
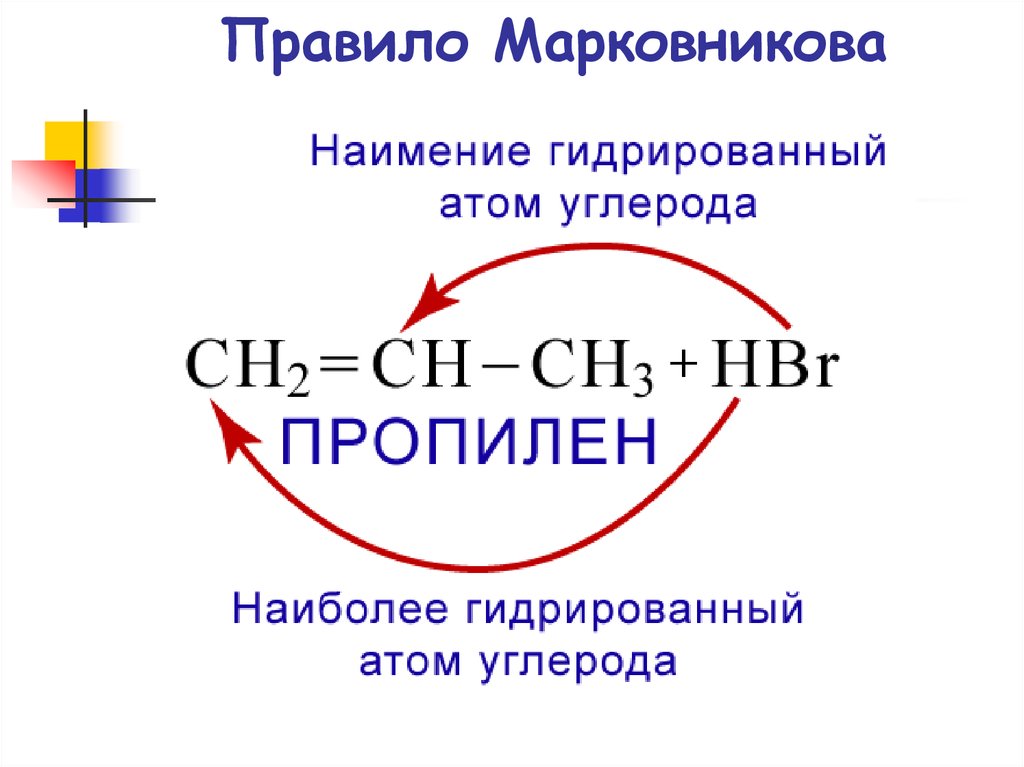
63. Правило Марковникова
64. Владимир Васильевич Марковников 1837 – 1904 гг.
Русский химик-органик.Исследования посвящены
теоретической органической химии,
органическому синтезу и
нефтехимии. Исследования спиртов,
карбоновых кислот послужили
основой его учения о взаимном
влиянии атомов как главном
содержании теории химического
строения. В 1869 г. сформулировал
правило о направлении реакций
замещения, отщепления,
присоединения по двойной связи и
изомеризации в зависимости от
химического строения (правило
Марковникова).
65.
66. Механизм реакции гидрогалогенирования
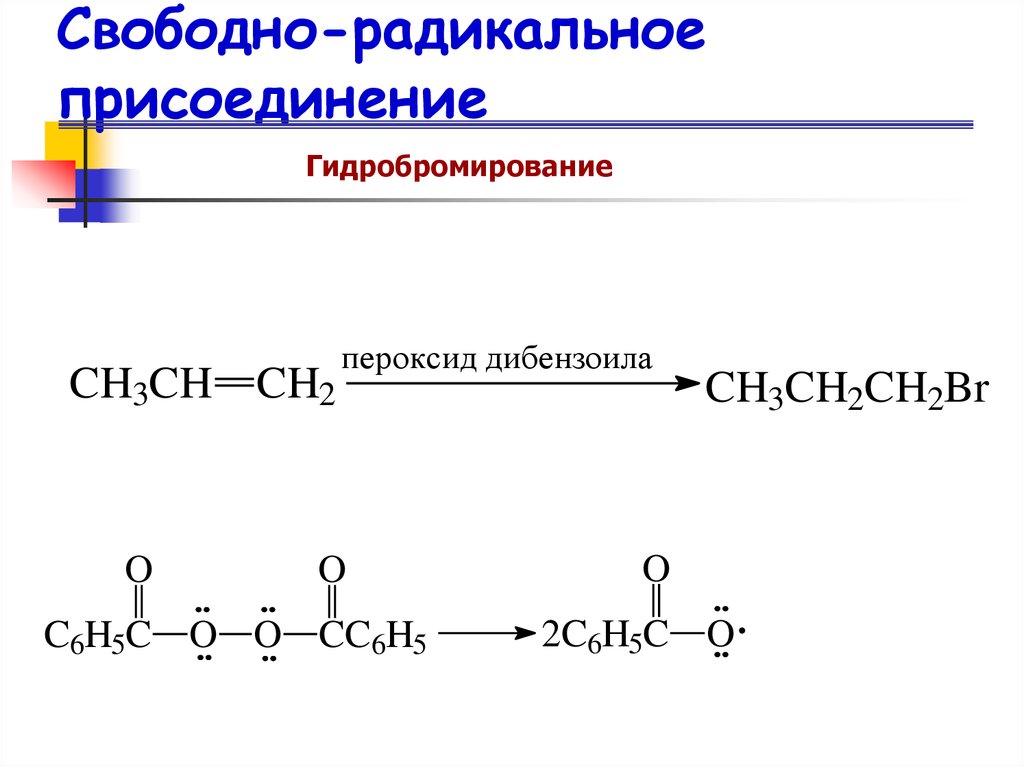
67. Свободно-радикальное присоединение
ГидробромированиеCH3CH CH2
O
пероксид дибензоила
O
C6H5C O O CC6H5
CH3CH2CH2Br
O
2C6H5C O
68.
Свободно-радикальноеприсоединение
Гидробромирование
Присоединение HBr против правила
Марковникова происходит следующим
образом: Br (а не Н ) реагирует в первую
очередь с -системой и быстрее всего
образуется наиболее стабильный радикал.
«Перекисный эффект» или эффект
Хараша.
69.
Свободно-радикальное замещениеАллильное замещение галогенами
CH2 CHCH3 + Cl2
300°C
CH2 CHCH2Cl + HCl
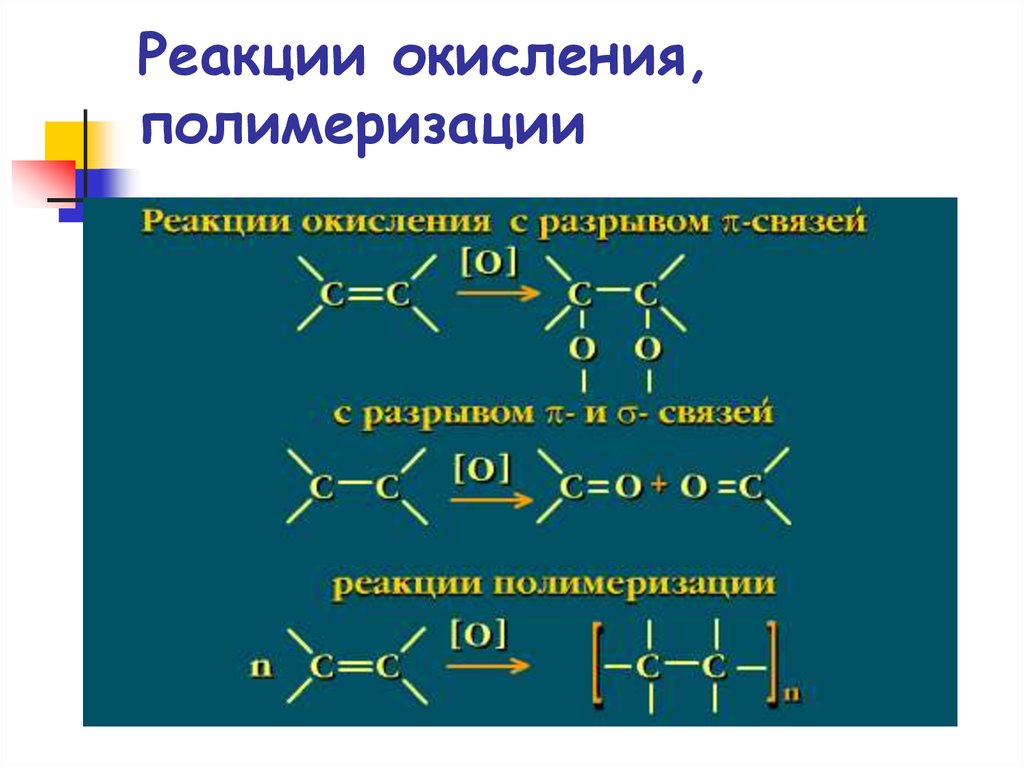
70. Реакции окисления, полимеризации
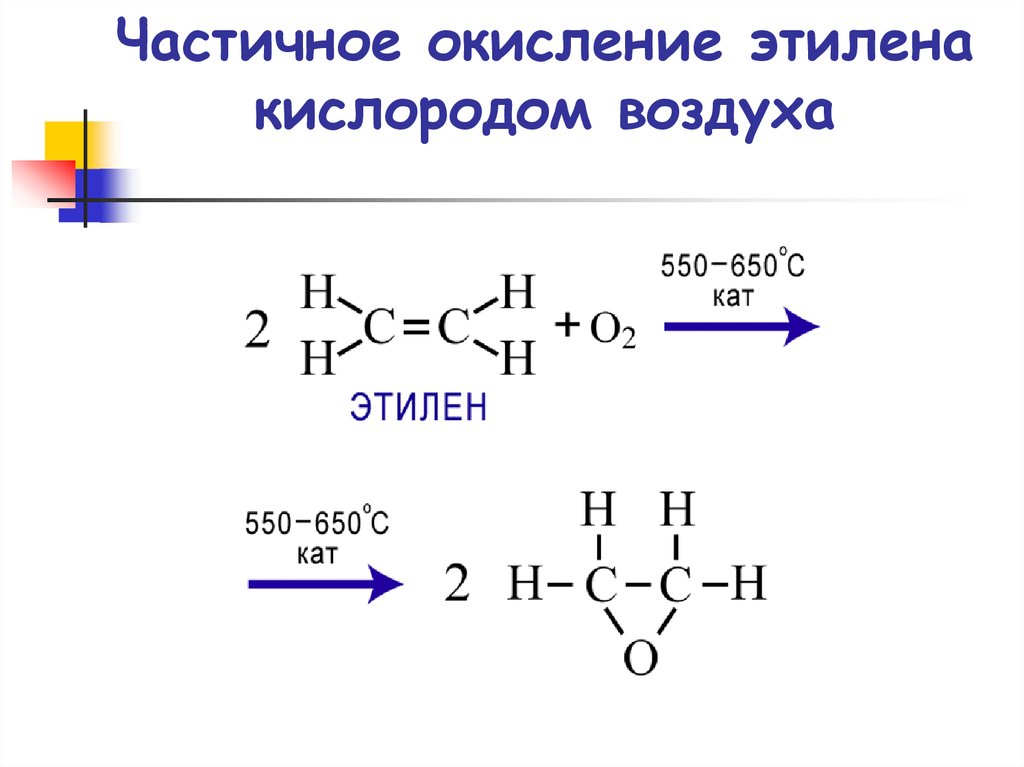
71. Частичное окисление этилена кислородом воздуха
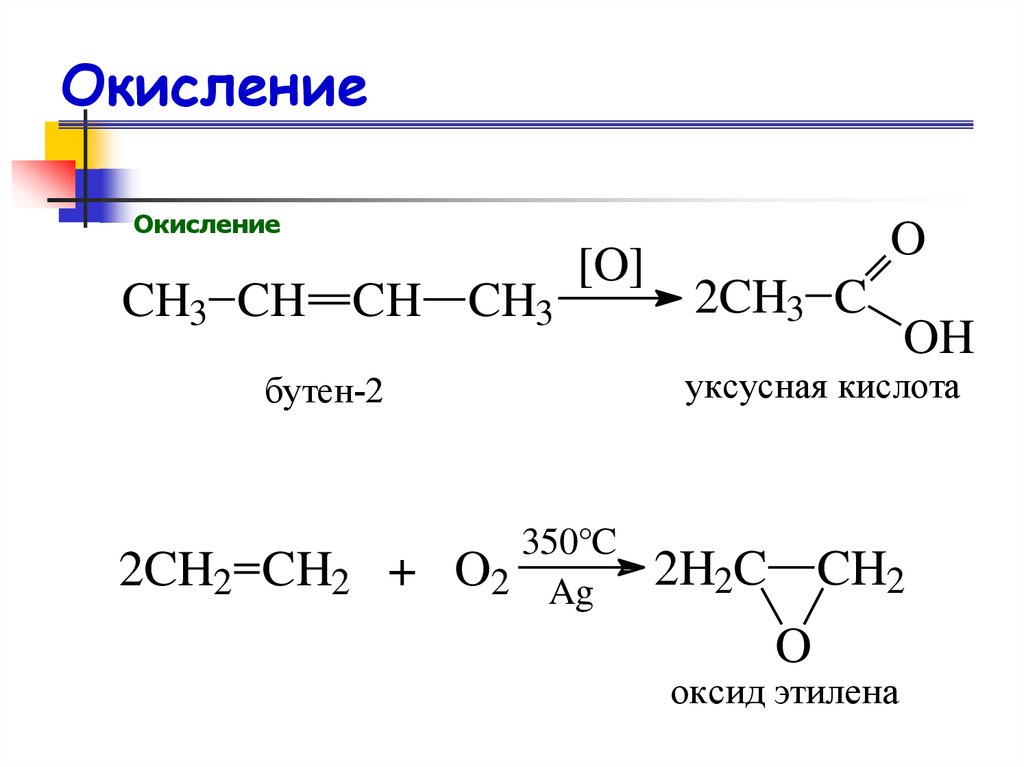
72. Окисление
ОкислениеCH3 CH CH CH3
[O]
2CH3 C
OH
уксусная кислота
бутен-2
2CH2 CH2 +
O
350°C
O2 Ag
2H2C CH2
O
оксид этилена
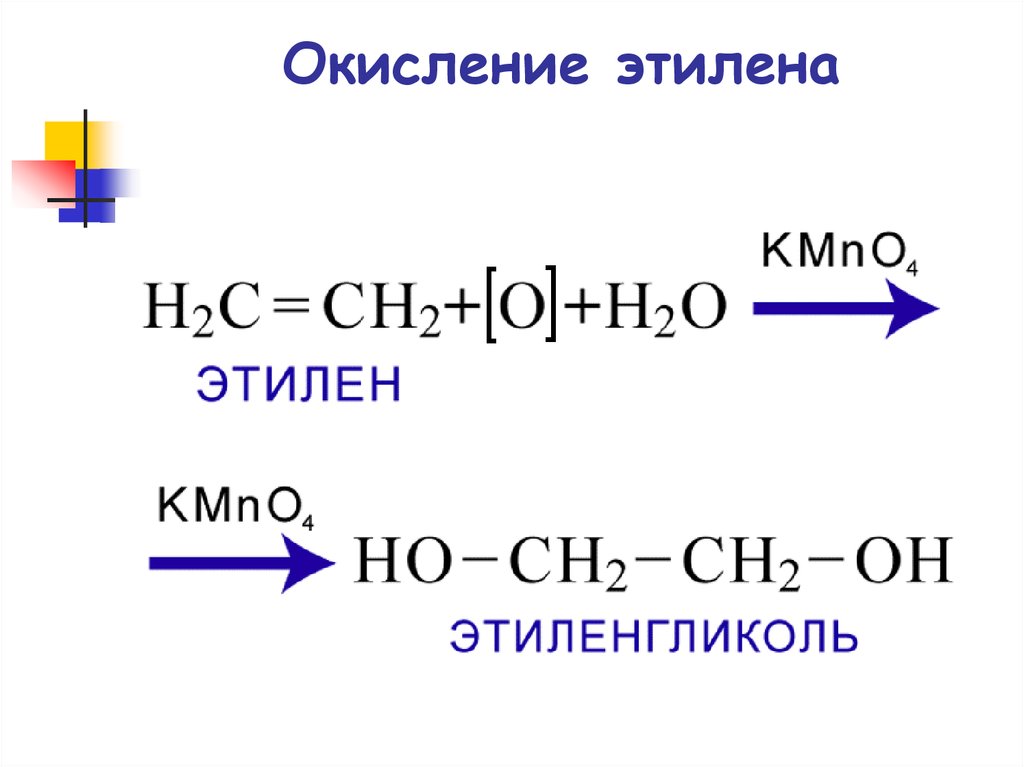
73. Окисление этилена
74. Окисление
ОкислениеОкисление по Вагнеру
3CH2 CH2 + 2KMnO4 + 4H2O
3CH2 CH2 + 2KOH + 2MnO2
OH OH
этилен
этиленгликоль
ВАГНЕР Егор Егорович (9.XII.1849 – 27.XI.1903)
75.
76. Окисление
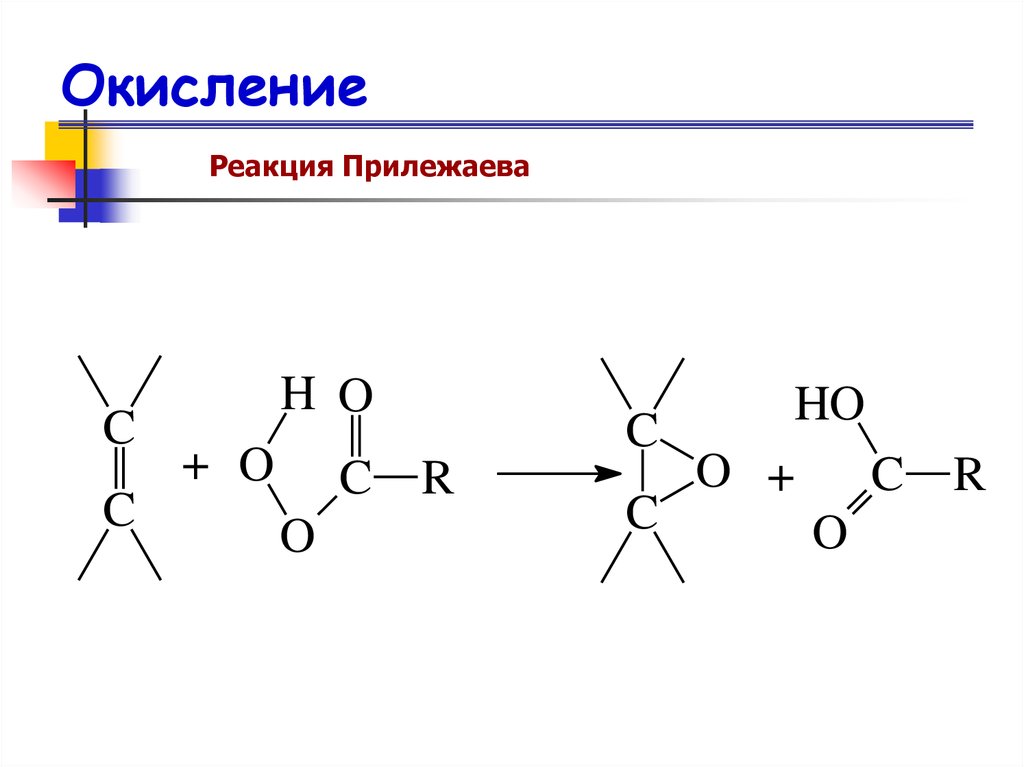
Реакция ПрилежаеваC
C
H O
+ O
C R
O
HO
C
O +
C
C
O
R
77. Окисление
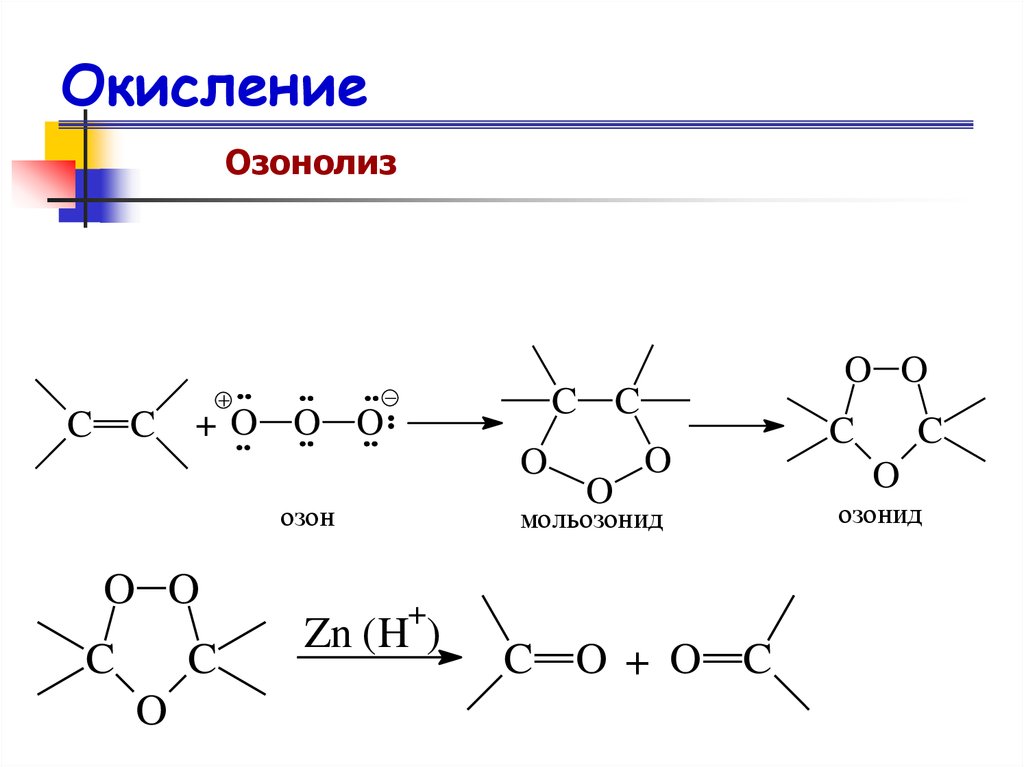
ОзонолизC C
C C
+O O O
O
озон
O O
C
C
O
O O
O
O
мольозонид
+
Zn (H )
C O + O C
C
C
O
озонид
78. Окисление
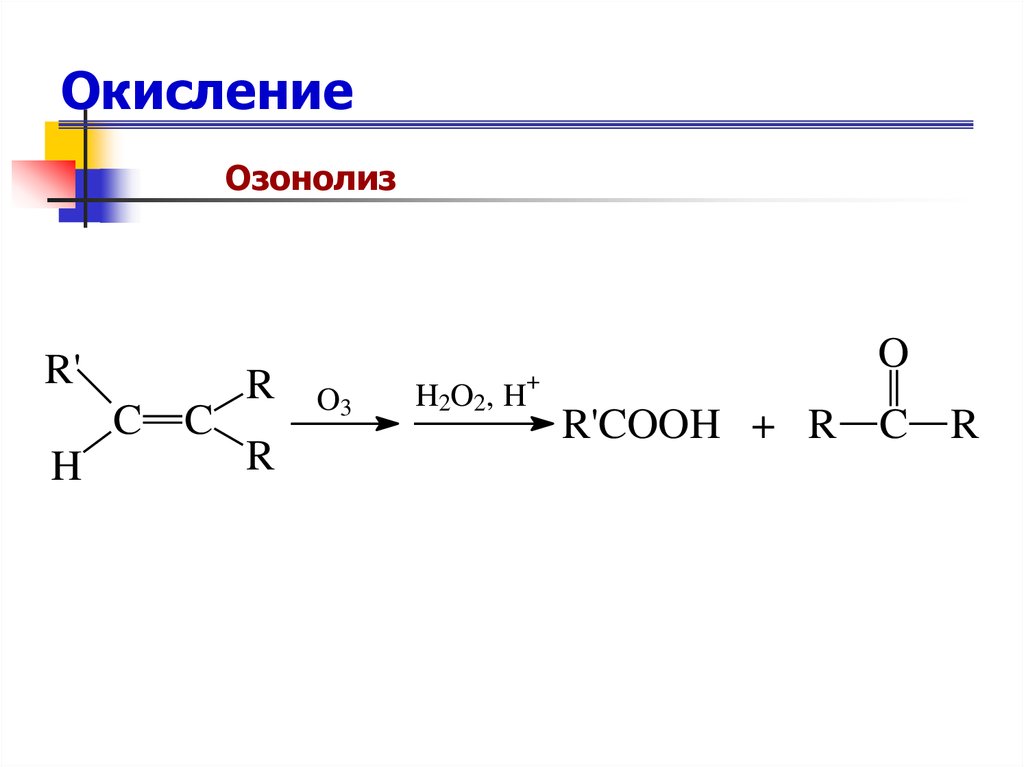
ОзонолизR'
C C
H
R
R
O3
H2O2, H
+
O
R'COOH + R C R
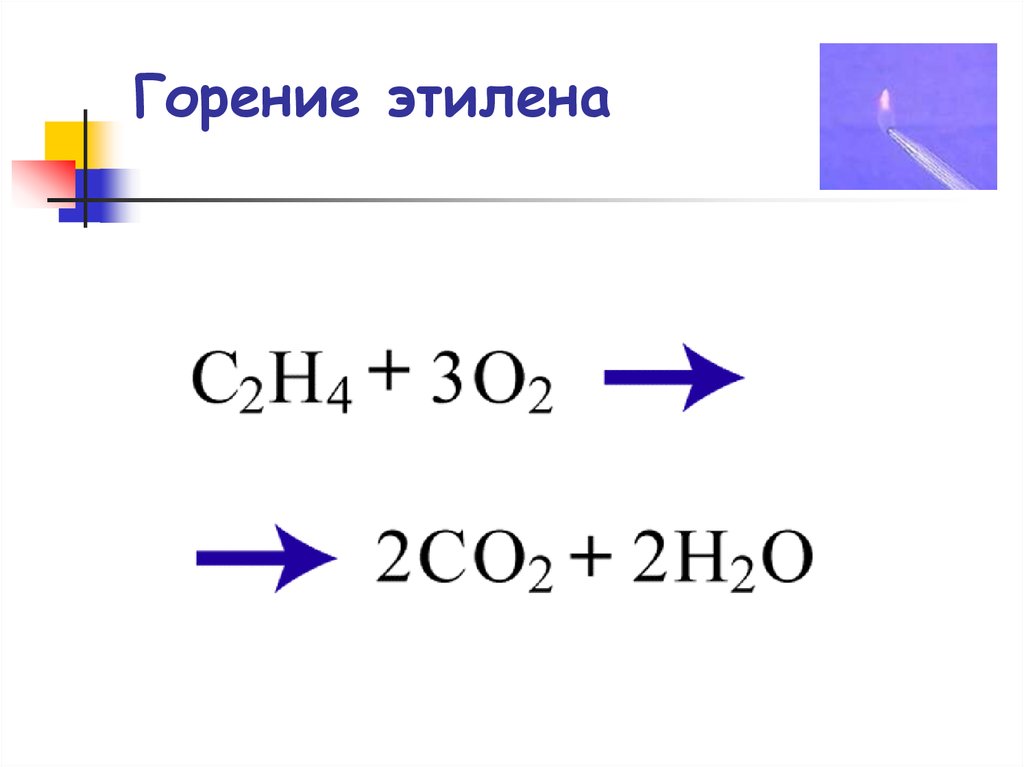
79. Горение этилена
80.
81.
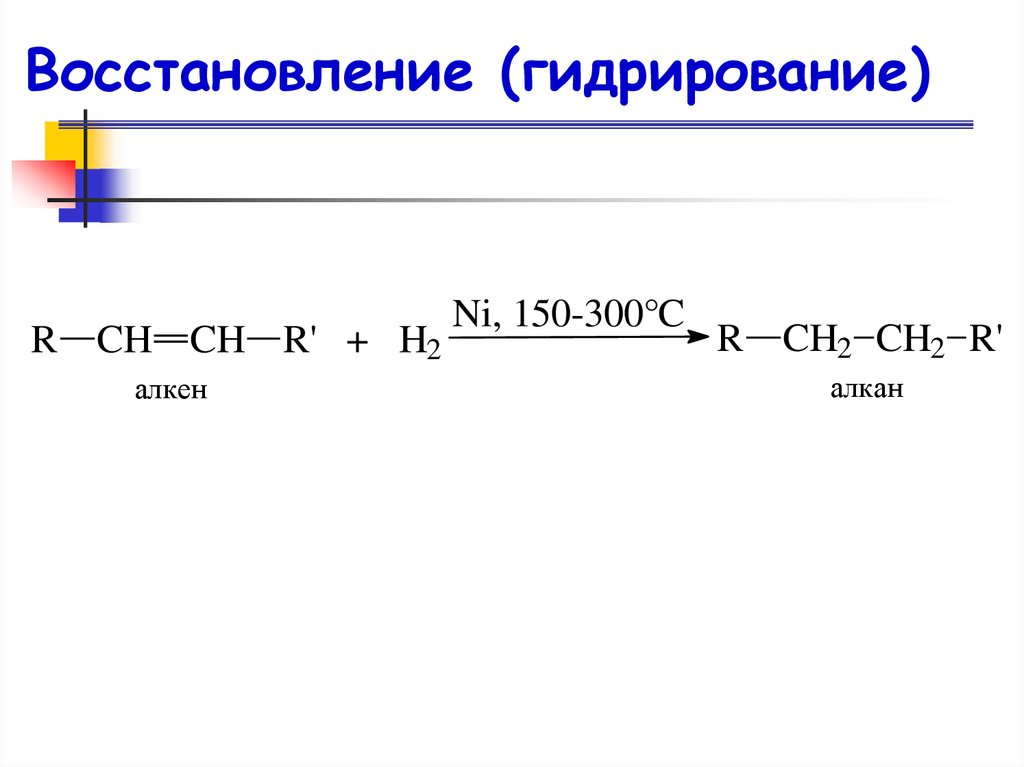
Восстановление (гидрирование)R CH CH R' + H2
алкен
Ni, 150-300°C
R CH2 CH2 R'
алкан
82.
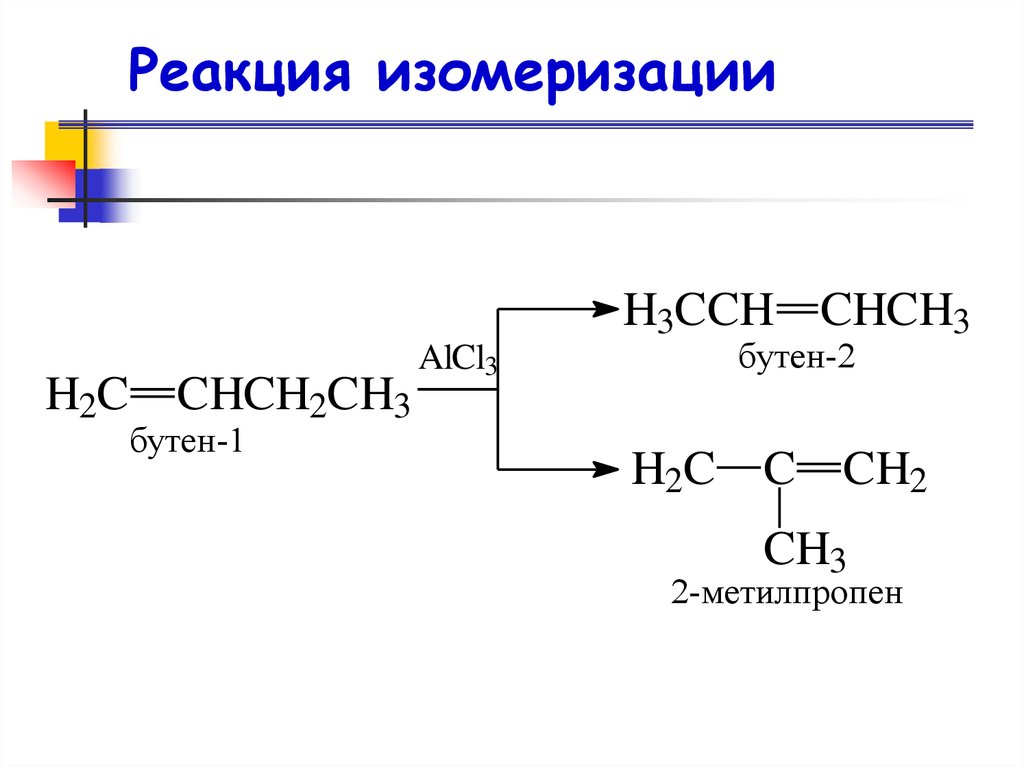
Реакция изомеризацииH3CCH CHCH3
H2C
CHCH2CH3
бутен-1
бутен-2
AlCl3
H2C
C CH2
CH3
2-метилпропен
83. Полимеризация этилена
84.
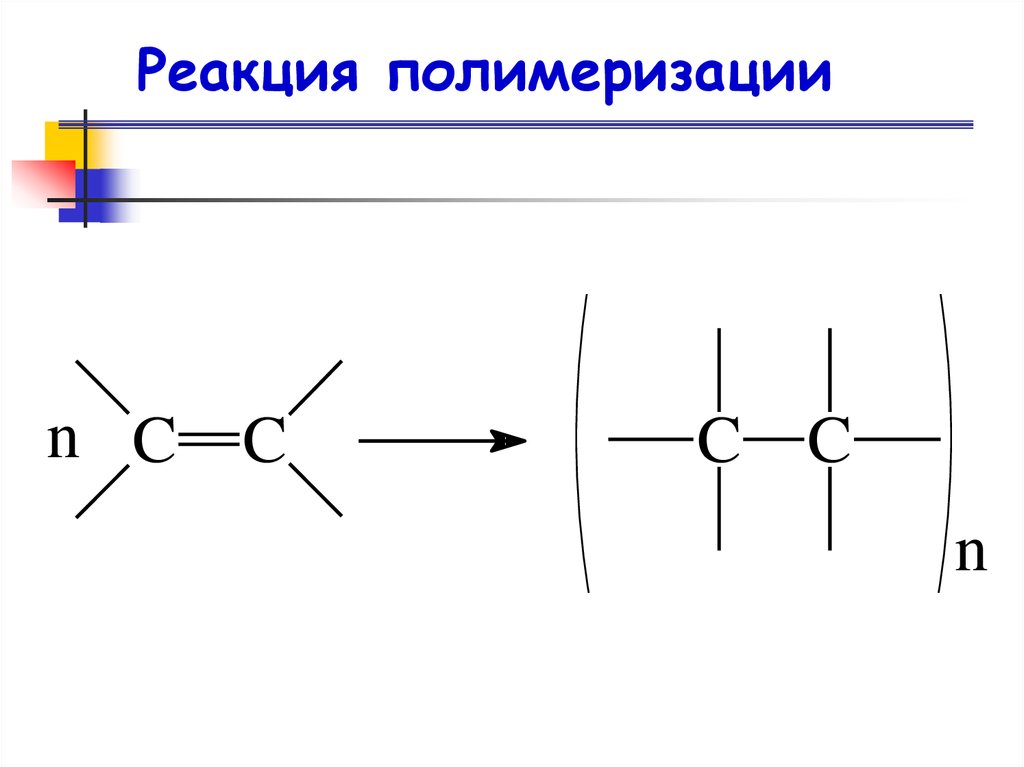
Реакция полимеризацииРеакция полимеризации — это
последовательное присоединение молекул
ненасыщенных соединений друг к другу с
образованием высокомолекулярного
продукта — полимера.
85.
Реакция полимеризацииn C C
C C
n
86.
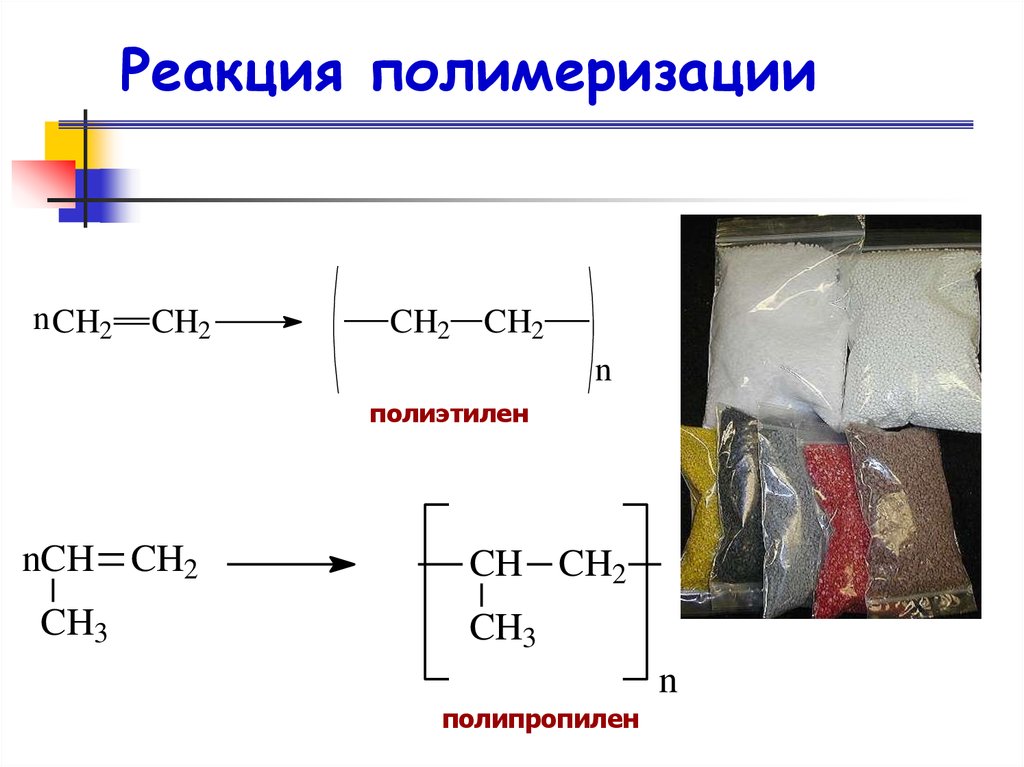
Реакция полимеризацииn CH2
CH2
CH2 CH2
n
полиэтилен
nCH CH2
CH3
CH CH2
CH3
n
полипропилен
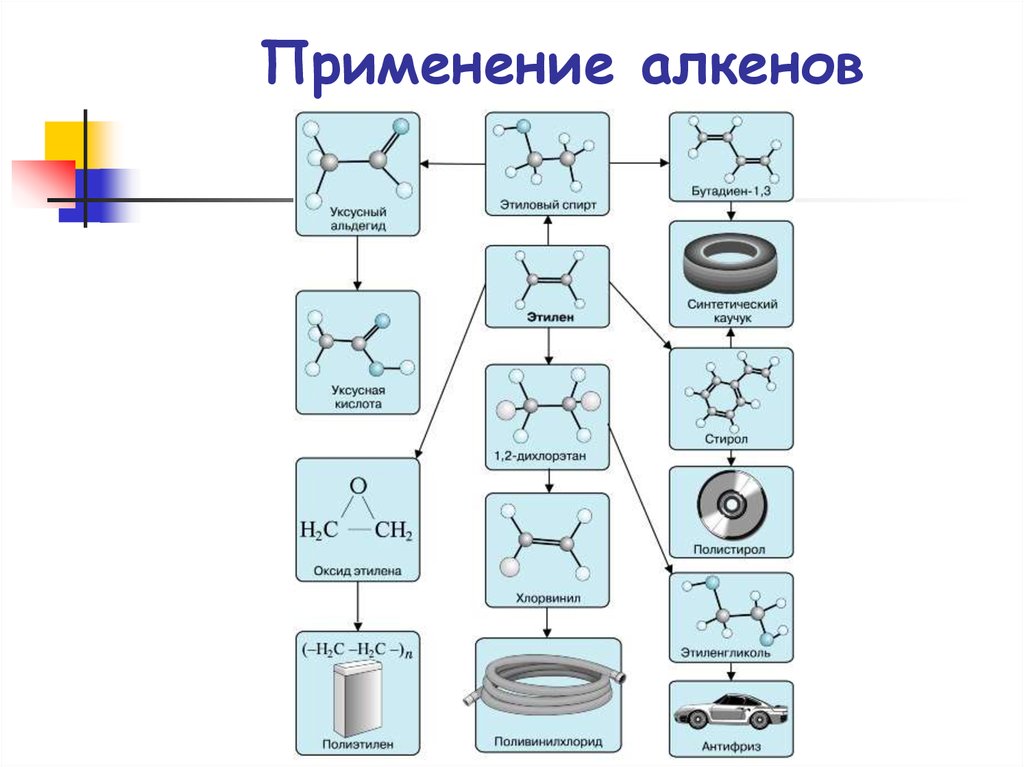
87. Применение алкенов
88. Задачи
ТестТест
Тест
Тест
Тест
1
2
3
4
5































 chemistry
chemistry








