Similar presentations:
Углеводороды. Алкены
1. Основы органической химии
E-mail: irkrav66@gmail.comОсновы
органической
химии
Семинар-8.
Углеводороды.Алкены
лектор:
проф. Рохин Александр
Валерьевич
2. Алкены
(этиленовые углеводороды,олефины) - непредельные
алифатические углеводороды,
молекулы которых содержат двойную
связь.
Общая формула ряда алкенов:
2
27.07.2017
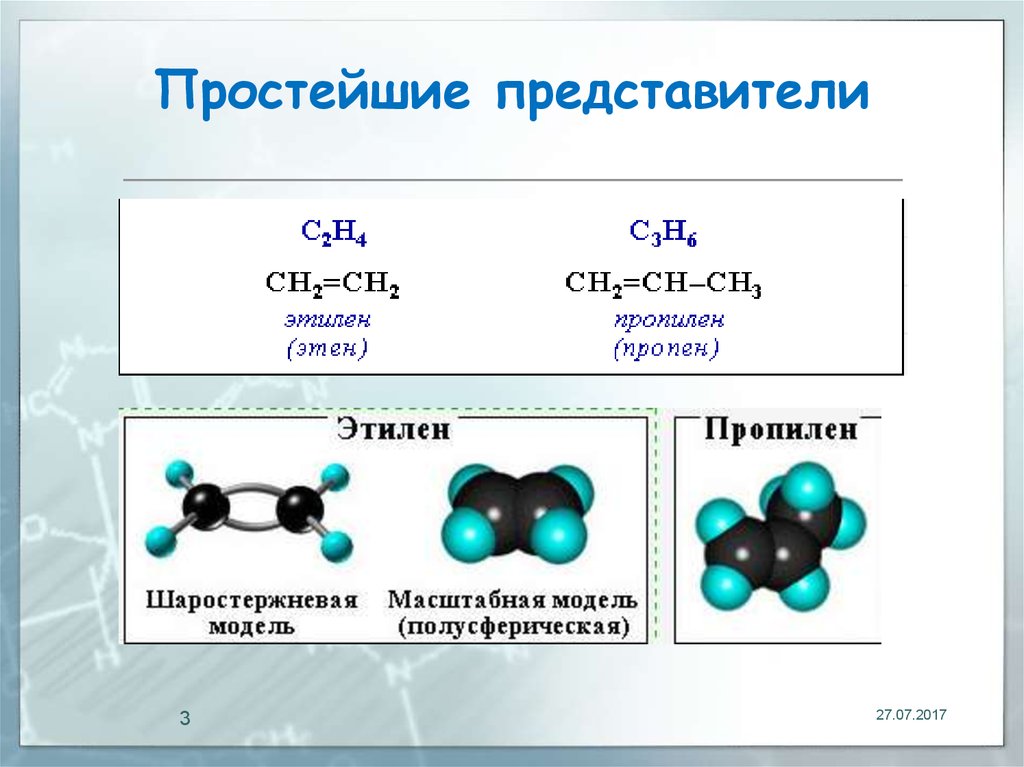
3. Простейшие представители
327.07.2017
4. Алкены
В отличие от предельныхуглеводородов, алкены содержат
двойную связь С=С, которая
осуществляется 4-мя общими
электронами:
В образовании такой связи
участвуют атомы углерода в sp2гибридизованном состоянии
4
27.07.2017
5. Строение С=С связи
Каждый из атомов имеет по три 2sp2гибридных орбитали, направленных друг кдругу под углом 120°, и одну
негибридизованную 2р-орбиталь,
расположенную под углом 90° к плоскости
гибридных АО:
5
27.07.2017
6. Строение С=С связи
Двойная связь является сочетанием σ- и πсвязей (хотя она изображается двумяодинаковыми черточками, всегда следует
учитывать их неравноценность).
σ-Связь возникает при осевом перекрывании
sp2-гибридных орбиталей,
π -связь – при боковом перекрывании рорбиталей соседних sp2-гибридизованных
атомов углерода.
6
27.07.2017
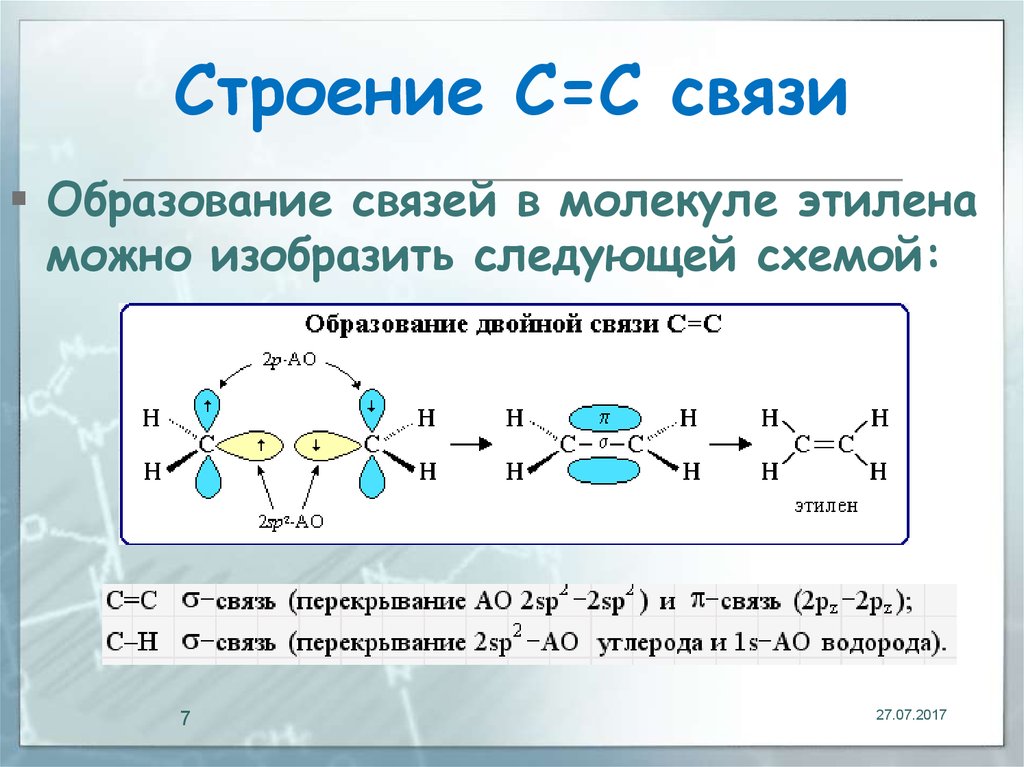
7. Строение С=С связи
Образование связей в молекуле этиленаможно изобразить следующей схемой:
7
27.07.2017
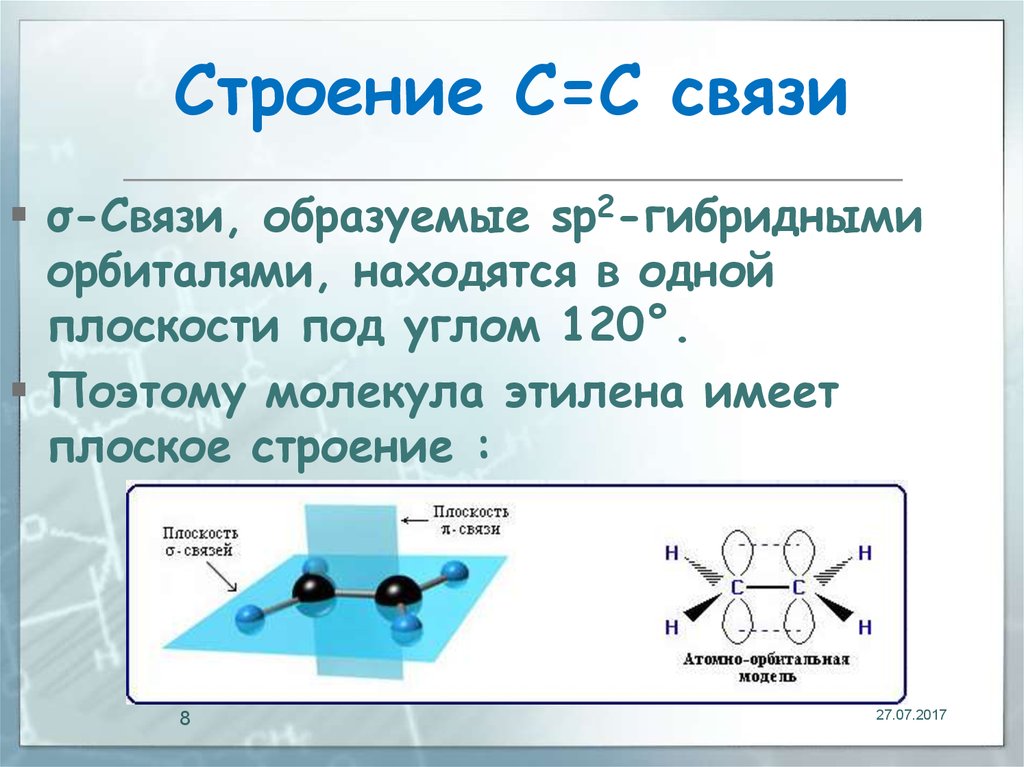
8. Строение С=С связи
σ-Связи, образуемые sp2-гибриднымиорбиталями, находятся в одной
плоскости под углом 120°.
Поэтому молекула этилена имеет
плоское строение :
8
27.07.2017
9. Номенклатура алкенов
названия алкенов производят отназваний соответствующих алканов
(путем замены суффикса –ан на –ен:
2 атома С → этан → этен;
3 атома С →пропан → пропен
Главная цепь выбирается таким образом,
чтобы она обязательно включала в себя
двойную связь.
9
27.07.2017
10. Номенклатура алкенов
названия алкенов производят отназваний соответствующих алканов
(путем замены суффикса –ан на –ен:
2 атома С → этан → этен;
3 атома С →пропан → пропен
Главная цепь выбирается таким образом,
чтобы она обязательно включала в себя
двойную связь.
10
27.07.2017
11. Номенклатура алкенов
Нумерацию углеродных атомовначинают с ближнего к двойной связи
конца цепи.
Цифра, обозначающая положение
двойной связи, ставится обычно после
суффикса –ен.
Например:
11
27.07.2017
12. Номенклатура алкенов
В номенклатуре различных классоворганических соединений наиболее
часто используются следующие
одновалентные радикалы алкенов:
12
27.07.2017
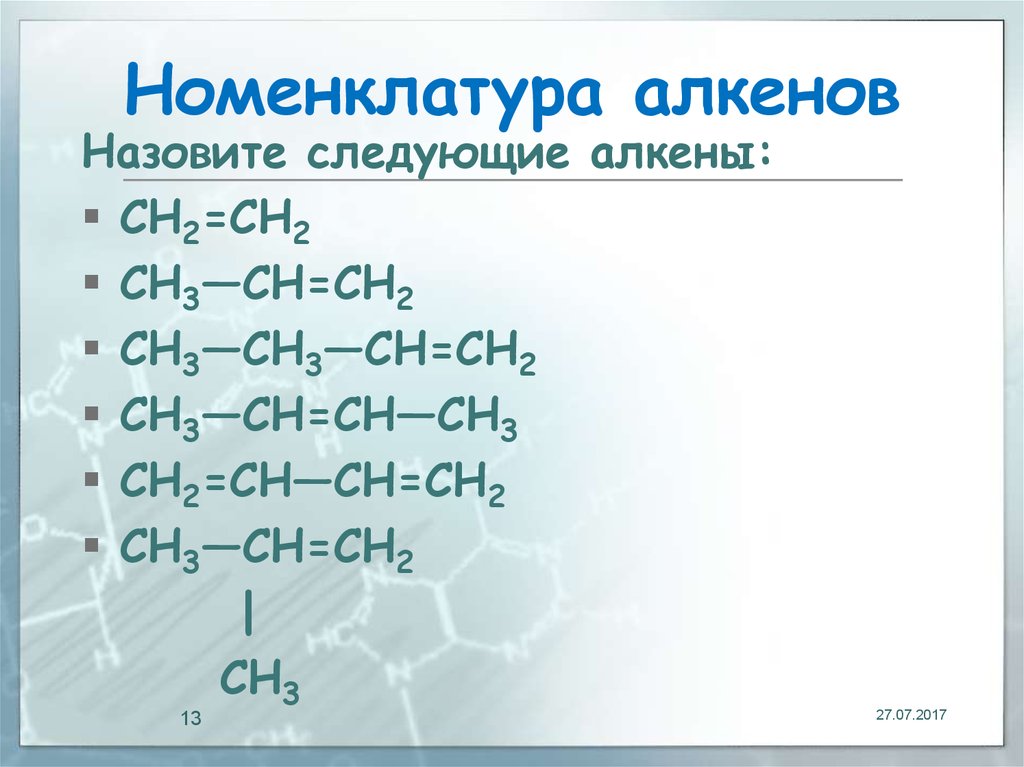
13. Номенклатура алкенов
Назовите следующие алкены:CH2=CH2
CH3—CH=CH2
CH3—CH3—CH=CH2
CH3—CH=CH—CH3
CH2=CH—CH=CH2
CH3—CH=CH2
|
CH3
13
27.07.2017
14. Структурная изомерия алкенов
1. Изомерия углеродного скелета(начиная с С4Н8):
14
27.07.2017
15. Структурная изомерия алкенов
2. Изомерия положения двойнойсвязи (начиная с С4Н8) :
15
27.07.2017
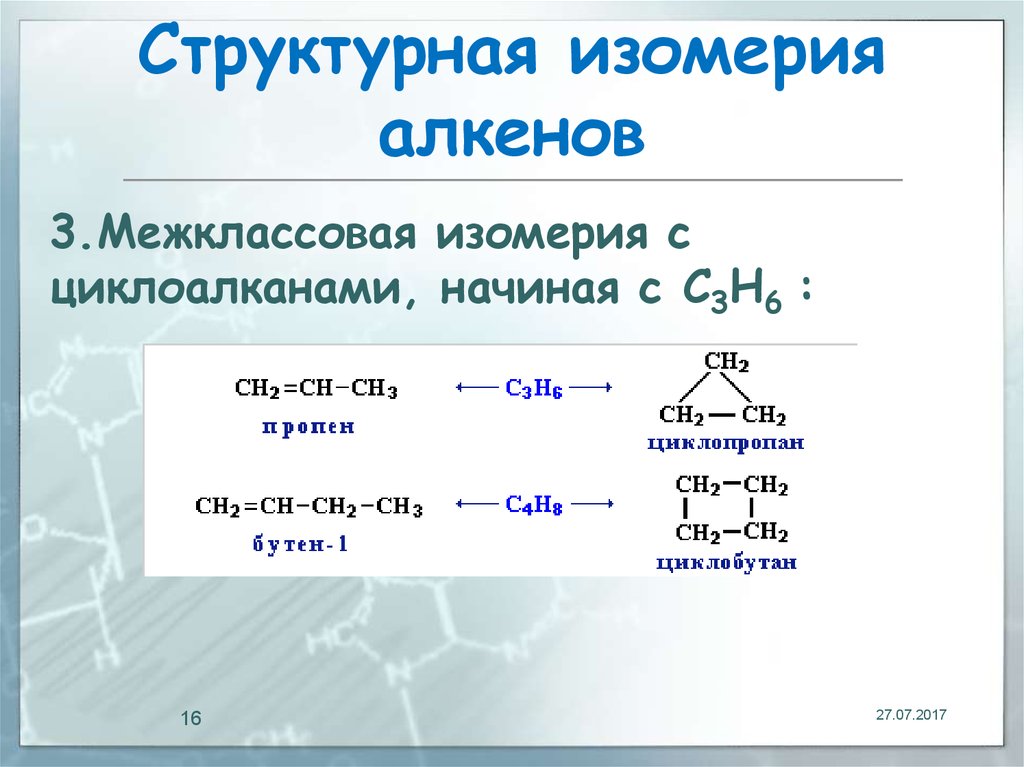
16. Структурная изомерия алкенов
3.Межклассовая изомерия сциклоалканами, начиная с С3Н6 :
16
27.07.2017
17. Пространственная изомерия алкенов
Вследствие жесткой закрепленностиатомов поворотная изомерия
относительно двойной связи не
проявляется.
Но становится возможной цис-трансизомерия:
17
27.07.2017
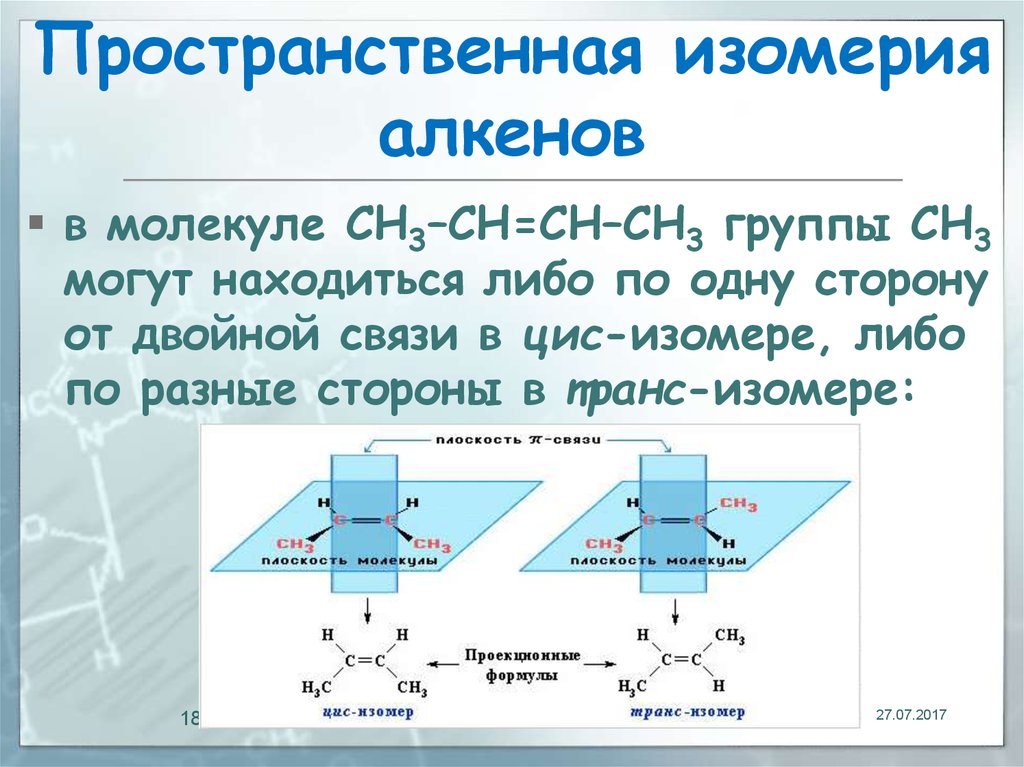
18. Пространственная изомерия алкенов
в молекуле СН3–СН=СН–СН3 группы СН3могут находиться либо по одну сторону
от двойной связи в цис-изомере, либо
по разные стороны в транс-изомере:
18
27.07.2017
19. Свойства алкенов
Физические свойства алкеновизменяются в гомологическом ряду:
от С2Н4 до С4Н8 – газы,
начиная с С5Н10 – жидкости,
с С18Н36 – твердые вещества.
Алкены практически нерастворимы в
воде, но хорошо растворяются в
органических растворителях
19
27.07.2017
20. Свойства алкенов
Химические свойства алкеновопределяются строением и свойствами
двойной связи С=С, которая значительно
активнее других связей в молекулах
этих соединений.
Алкены химически более активны, чем
алканы.
20
27.07.2017
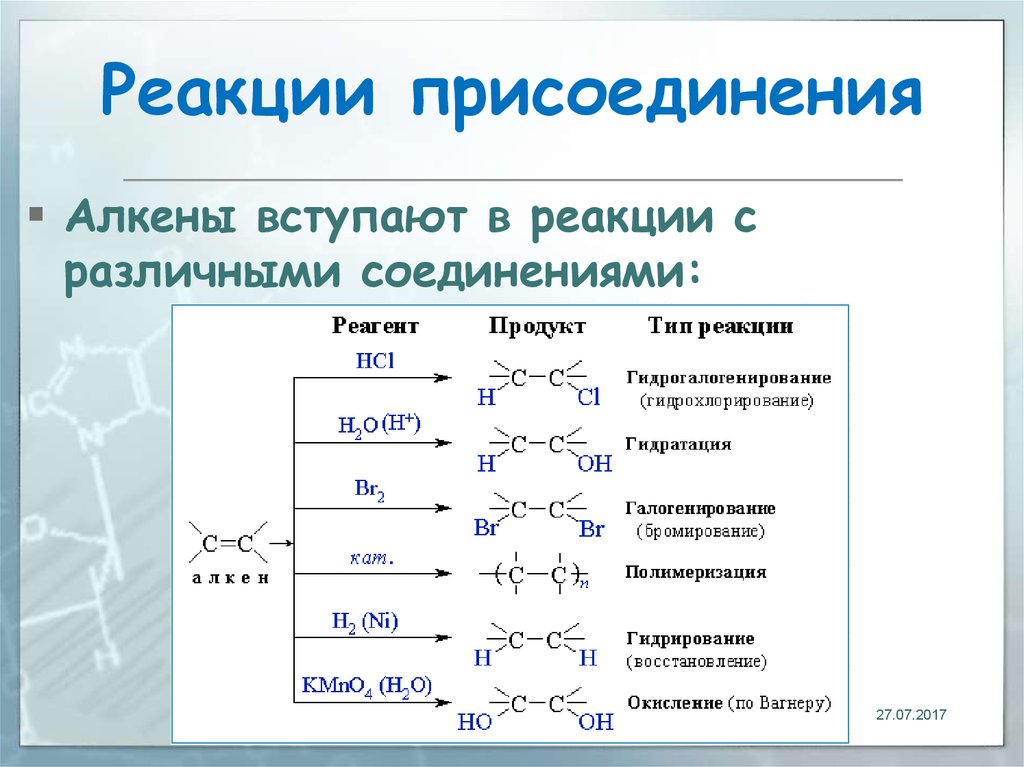
21. Реакции присоединения
Алкены вступают в реакции сразличными соединениями:
21
27.07.2017
22. Гидрирование (присоединение водорода)
Алкены взаимодействуют с водородомпри нагревании в присутствии
металлов Pt, Pd или Ni:
22
27.07.2017
23. Гидрирование (присоединение водорода)
Присоединение водорода к атомамуглерода в алкенах приводит к
понижению степени их окисления:
Поэтому гидрирование алкенов относят
к реакциям восстановления.
23
27.07.2017
24. Гидрирование (присоединение водорода)
Эта реакция используется впромышленности для получения
высокооктанового топлива:
24
27.07.2017
25. Галогенирование (присоединение галогенов)
Присоединение галогенов по двойнойсвязи С=С происходит легко в обычных
условиях (при комнатной температуре,
без катализатора):
Эти реакции протекают по механизму
электрофильного присоединения
25
27.07.2017
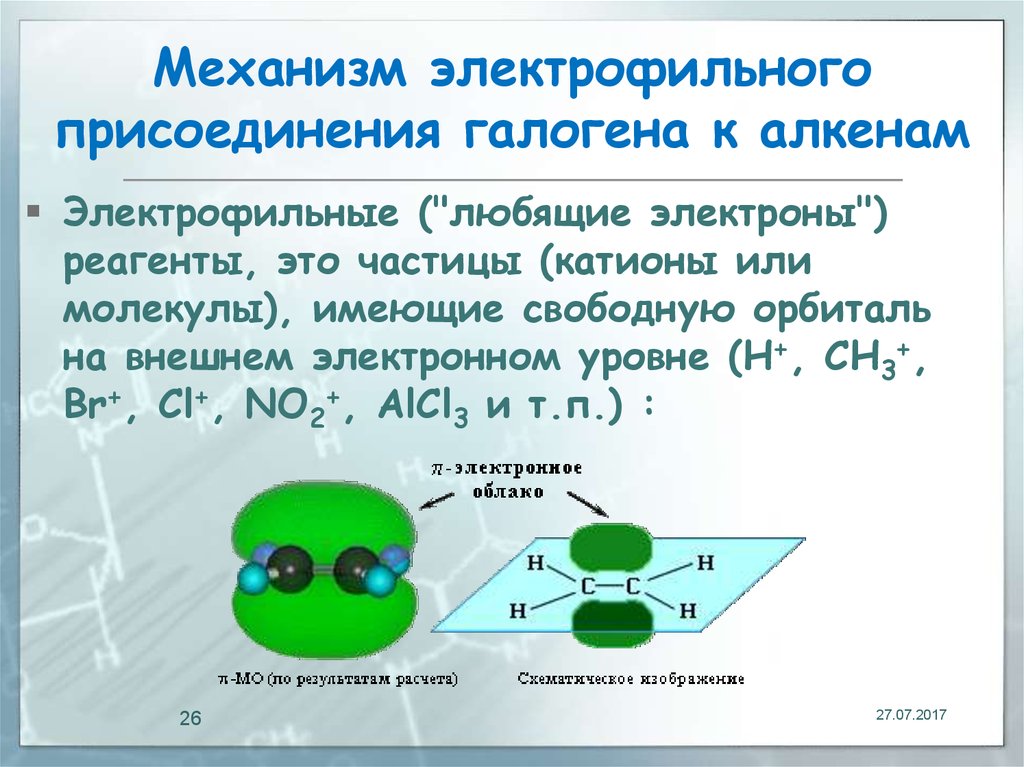
26. Механизм электрофильного присоединения галогена к алкенам
Электрофильные ("любящие электроны")реагенты, это частицы (катионы или
молекулы), имеющие свободную орбиталь
на внешнем электронном уровне (H+, CH3+,
Br+, Cl+, NO2+, AlCl3 и т.п.) :
26
27.07.2017
27. Механизм электрофильного присоединения галогена к алкенам
Механизм присоединения протекает в тристадии:
Ст адия 1: образование π-комплекса. pЭлектронное облако двойной связи С=С
взаимодействует с электрофилом, например,
с катионом брома (Br+):
27
27.07.2017
28. Механизм электрофильного присоединения галогена к алкенам
Ст адия 2 (лимитирующая): образованиекарбокатиона. Электрофил (Br+)
присоединяется к одному из атомов углерода
за счет электронной пары π-связи.
На втором углеродном атоме, лишенном
связывающих p-электронов, появляется
положительный заряд:
28
27.07.2017
29. Механизм электрофильного присоединения галогена к алкенам
Ст адия 3: взаимодействие карбокатиона санионом Br-, образовавшемся при
диссоциации HBr (или Вr2), которое
приводит к продукту реакции:
29
27.07.2017
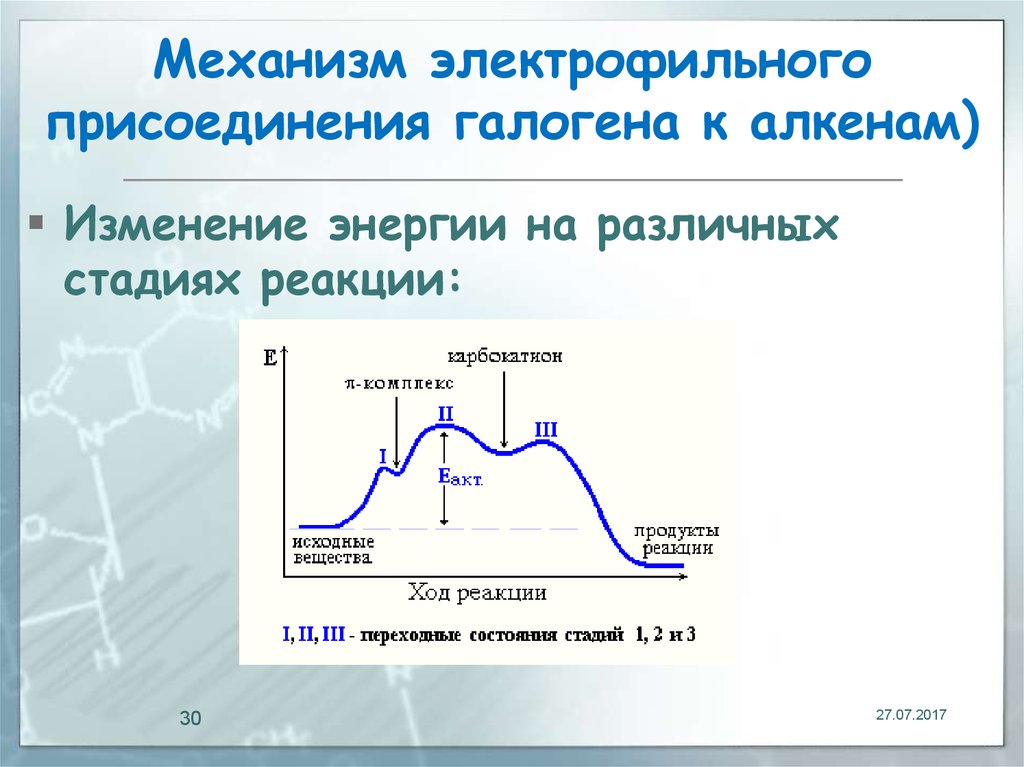
30. Механизм электрофильного присоединения галогена к алкенам)
Изменение энергии на различныхстадиях реакции:
30
27.07.2017
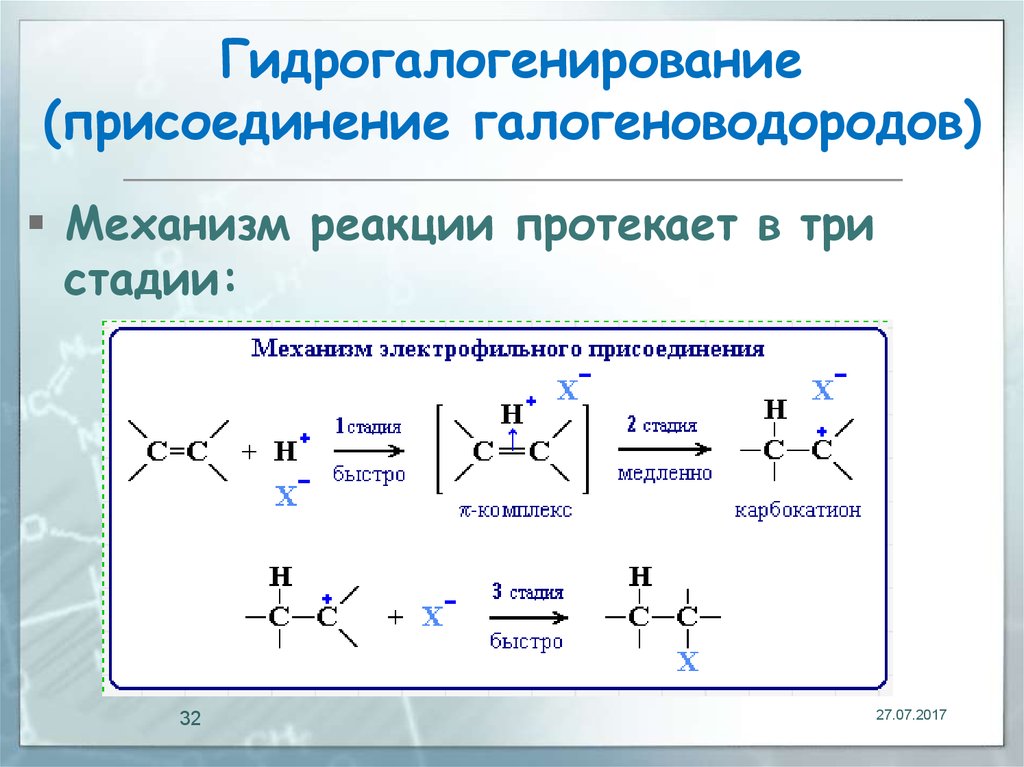
31. Гидрогалогенирование (присоединение галогеноводородов)
Реакция идет по механизмуэлектрофильного присоединения с
гетеролитическим разрывом связей.
Электрофилом является протон Н+ в
составе молекулы галогеноводорода
HX (X - галоген):
31
27.07.2017
32. Гидрогалогенирование (присоединение галогеноводородов)
Механизм реакции протекает в тристадии:
32
27.07.2017
33. Гидратация (присоединение воды)
Гидратация происходит в присутствииминеральных кислот по механизму
электрофильного присоединения:
33
27.07.2017
34. Гидратация (присоединение воды)
Реакция происходит в присутствииминеральных кислот (донора Н+) по
механизму электрофильного
присоединения:
34
27.07.2017
35. Полимеризация алкенов
1. Полимеризация – реакцияобразования высокомолекулярного
соединения (полимера) путем
последовательного присоединения
молекул низкомолекулярного вещества
(мономера) по схеме:
35
27.07.2017
36. Полимеризация алкенов
Число n называется степеньюполимеризации. Реакции
полимеризации алкенов идут в
результате присоединения по кратным
связям:
36
27.07.2017
37. Полимеризация алкенов
2. Димеризация алкенов – образованиедимера в результате реакции
присоединения.
В присутствии минеральной кислоты
(донора протона Н+) происходит
присоединение протона по двойной
связи:
37
27.07.2017
38. Получение алкенов
I. Крекинг алканов:например:
38
27.07.2017
39. Получение алкенов
II. Отщепление (элиминирование) двухатомов или групп атомов от соседних
атомов углерода с образованием между
ними π-связи двух типов:
дегидратация
дегидрогалогенирование
39
27.07.2017
40. Получение алкенов
II. Отщепление :дегидратация (при температуре
менее 150°C в присутствии
водоотнимающих реагентов )
40
27.07.2017
41. Получение алкенов
II. Отщепление :Дегидрогалогенирование
(Дегидрогалогенирование
моногалогеналканов при действии
спиртового раствора щелочи)
41
27.07.2017
42. Применение алкенов
Алкены применяются в качествеисходных продуктов в производстве
полимерных материалов (пластмасс,
каучуков, пленок) и других
органических веществ
42
27.07.2017
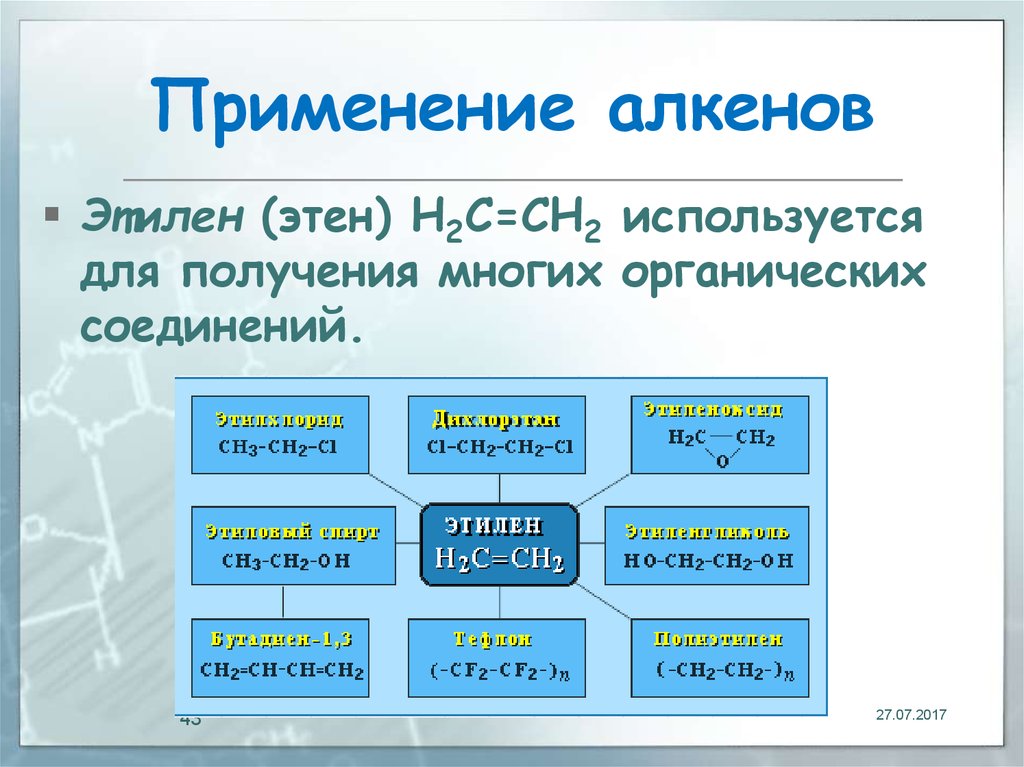
43. Применение алкенов
Этилен (этен) Н2С=СН2 используетсядля получения многих органических
соединений.
43
27.07.2017
44. Применение алкенов
Пропилен (пропен) Н2С=СН2–СН3 ибутилены (бутен-1 и бутен-2)
используются для получения спиртов и
полимеров.
Изобутилен (2-метилпропен)
Н2С=С(СН3)2 применяется в
производстве синтетического каучука.
44
27.07.2017
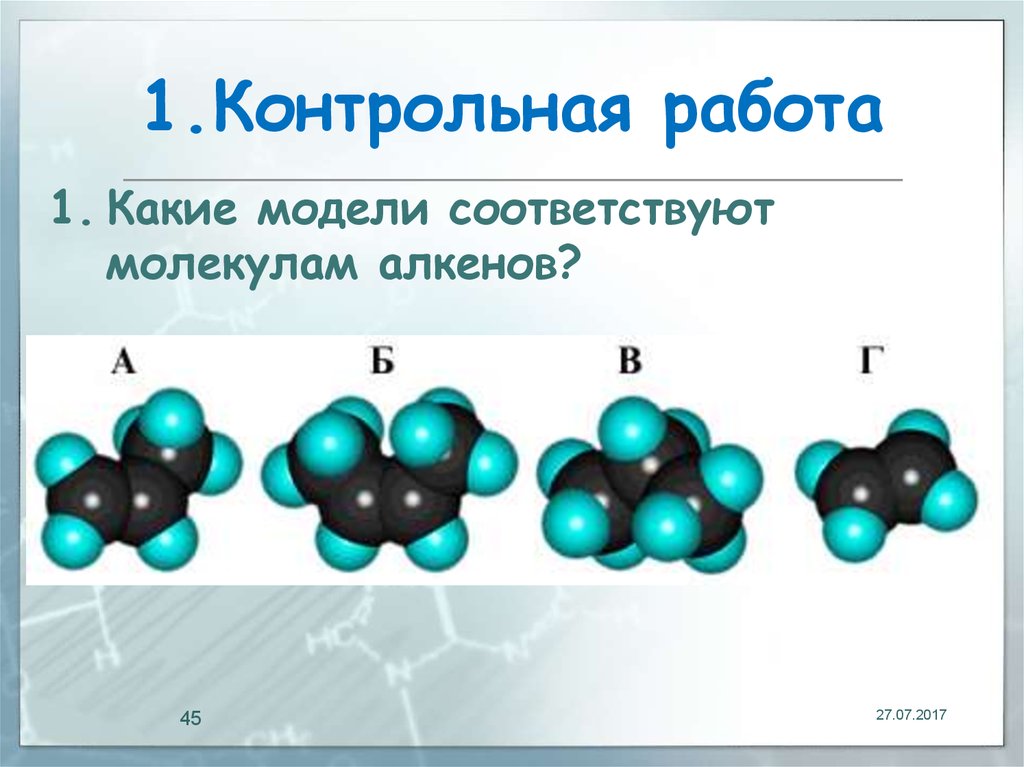
45. 1.Контрольная работа
1. Какие модели соответствуютмолекулам алкенов?
45
27.07.2017
46. 2. Контрольная работа
Дайте названия следующих алкенов,полученных из алканов:
- пропан
- декан
- октан
- этан
- пентан
- гексан
46
27.07.2017
47. 3.Контрольная работа
Назовите соединение:Ответ 1: 3-метил-4-этилпентен-2
Ответ 2: 3-метил-2-этилпентен-3
Ответ 3: 3,4-диметилгексен-2
Ответ 4: 2-этил-3-метилпентен-2
47
27.07.2017
48. 4. Контрольная работа
Сколько изомерных алкеновсоответствует формуле С4Н8 ?
Ответ
Ответ
Ответ
Ответ
48
1:
2:
3:
4:
изомеров нет
два
три
четыре
27.07.2017
49. 5. Контрольная работа
Двойная связь является сочетанием . . .Ответ
Ответ
Ответ
Ответ
связи
49
1:
2:
3:
4:
двух σ-связей
двух π-связей
одной σ-связи и одной π-связи
ионной связи и ковалентной
27.07.2017
50. 6. Контрольная работа
Какова гибридизация атомов углерода вмолекуле алкена:
Ответ
Ответ
Ответ
Ответ
sp2
1:
2:
3:
4:
50
1
1
1
1
и
и
и
и
4
4
4
4
–
–
–
–
sp2, 2 и 3 – sp3
sp3, 2 и 3 – sp2
sp3, 2 и 3 – sp
не гибридизованы, 2 и 3 –
27.07.2017
51. 7. Контрольная работа
Наиболее характерными реакциямиалкенов являются:
Ответ 1: реакции замещения
Ответ 2: реакции присоединения
Ответ 3: реакции разложения
51
27.07.2017







































 chemistry
chemistry








