Similar presentations:
Алкены. Этен (этилелен)
1.
АлкеныАлкенами называются
ненасыщенные углеводороды,
молекулы которых содержат
одну двойную связь.
СnН2n
олефины
1
2.
АлкеныH
H
C
H
C
H
Этен (этилелен)
2
3.
АлкеныНоменклатура
1) в алкенах с неразветвленной цепью нумерацию
производят с того конца, ближе к которому находится
двойная связь. В названии алкана, соответствующего
этой родоначальной структуре, суффикс -ан
заменяется на –ен.
CH2 CH2
CH2 CH CH3
Этен (этилен)
Пропен (пропилен)
CH3CH CHCH2CH2CH3
гексен-2
3
4.
АлкеныНоменклатура
2) в случае разветвления главной считается цепь,
включающая двойную связь, даже если эта цепь и не
является самой длинной. Нумерация производится
таким образом, чтобы атом углерода, от которого
начинается двойная связь, получил наименьший
номер
1
5
4
3
CH2
2
CH3 CH2 CH2 C
CH2 CH3
2-этилпентен-1
4
5.
АлкеныНоменклатура
3) Углеводородные заместители обозначаются
префиксом. Положение их указывается цифрой,
соответствующей номеру того атома углерода, у
которого находится заместитель.
Заместители перечисляются в алфавитном порядке.
В случае нескольких одинаковых углеводородных
заместителей перед их названием ставится
умножительная приставка ди-, три- и т. д.
5
6.
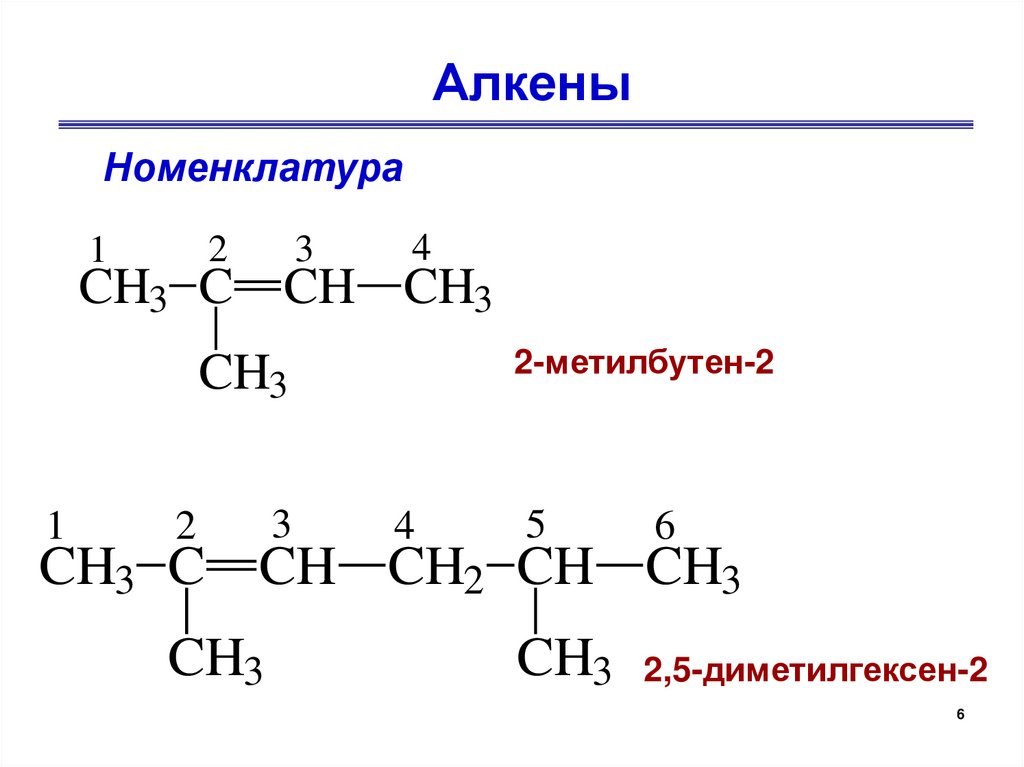
АлкеныНоменклатура
2
1
3
4
CH3 C CH CH3
2-метилбутен-2
CH3
1
2
3
4
5
6
CH3 C CH CH2 CH CH3
CH3
CH3 2,5-диметилгексен-2
6
7.
АлкеныИзомерия
Структурная изомерия
7
8.
АлкеныИзомерия
Пространственная изомерия
H3C
CH3
H3C
C C
H
H
C C
H
цис-бутен-2
Ткип=4 С
H
CH3
транс-бутен-2
Ткип=1 С
8
9.
АлкеныФизические
свойства
9
10.
АлкеныХимические свойства
10
11.
АлкеныХимические свойства
11
12.
АлкеныH
H
С
H
C
H
.
-Связь делает невозможным вращение вокруг связи углеродуглерод; с этим связано явление геометрической изомерии.
Таким образом, двойная углерод-углеродная связь построена
из более прочной -связи (347 кДж/моль ) и менее прочной связи (264 кДж/моль ). Двойная углерод-углеродная связь в
этилене короче, чем простая связь в этане.
12
13.
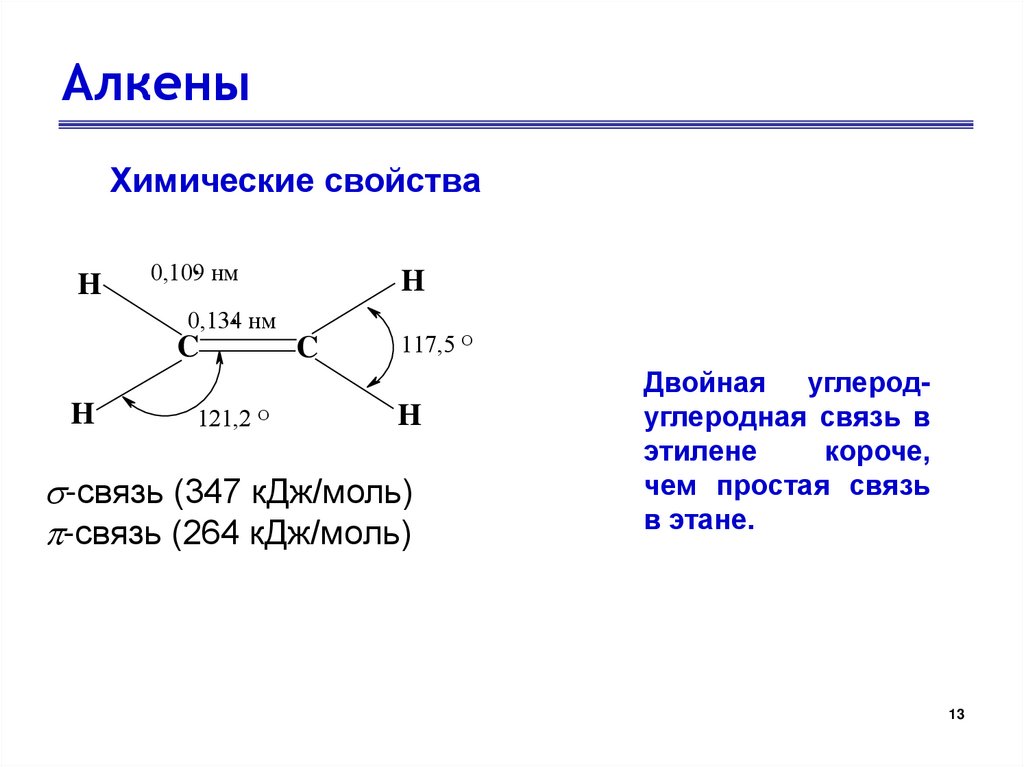
АлкеныХимические свойства
H
. нм
0,109
. нм
0,134
C
H
H
121,2 О
C
117,5 О
H
-связь (347 кДж/моль)
-связь (264 кДж/моль)
Двойная углеродуглеродная связь в
этилене
короче,
чем простая связь
в этане.
13
14.
АлкеныХимические свойства
0,150.нм
0,153.нм
CH3
CH3
CH
CH3
CH2
Расстояние С-Н в этилене равно 0,109 нм, что меньше, чем
расстояние С-Н в этане (0,110 нм). Гибридизация атомов
углерода в этих соединениях неодинакова. По сравнению с
sp3- орбиталью, sp2-орбиталь имеет меньшую долю pорбитали и большую долю s-орбитали. p-Орбиталь
находится на большем расстоянии от ядра, чем s- орбиталь.
По мере возрастания s-характера гибридной орбитали её
эффективный
размер
уменьшается
и
одновременно
уменьшается длина связи с другим атомом.
14
15.
АлкеныХимические свойства
Типичными реакциями двойной связи являются реакции, в
которых происходит разрыв -связи и образование вместо нее
двух более прочных -
C C
+
X
Y
X
Y
C C
15
16.
АлкеныХимические свойства
H
H
С
H
С
+
X
H
16
17.
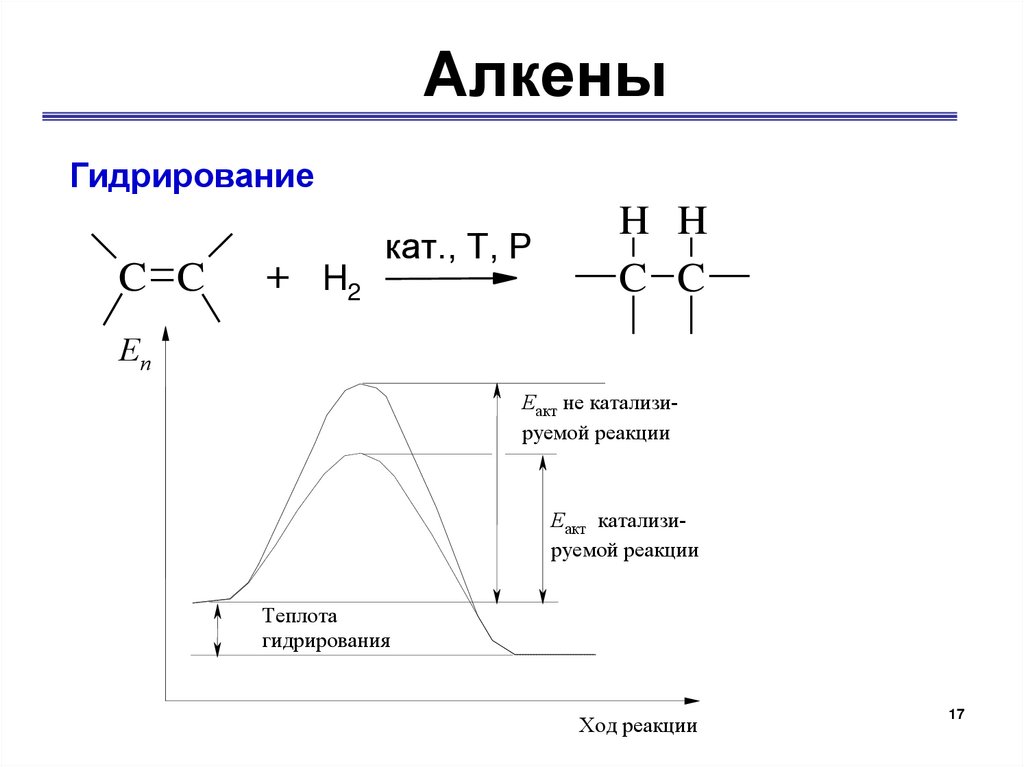
АлкеныГидрирование
C C
+ H2
кат., Т, Р
H H
C C
Еп
Еакт не катализируемой реакции
Еакт катализируемой реакции
Теплота
гидрирования
Ход реакции
17
18.
АлкеныТеплота гидрирования и устойчивость алкенов
Чем больше степень алкилирования атомов
углерода при двойной связи, тем более устойчив
алкен:
R
R
C C
R
R
R
R
C C
R
H
R
R
C C
H
H
RHC=CHR
RHC=CH CH =CH
2
2
2
18
19.
АлкеныПрисоединение галогеноводородов (HCl, HBr, HI)
C C
+
H X
X
C
C
H
CH3
CH3
эфир
C CH2 + HCl
Cl C CH3 (94%)
CH3
CH3
CH3 + HBr
1-метил-1-циклогексен
CH3COOH
CH3
(91%)
Br
1-бром-1-метилциклогексан
19
20.
АлкеныМеханизм реакции
Первая стадия.
C
C
или
C
H
X
C
H
X
или
H
H2 C
..
..
X
+
H
-комплекс
+
CH2
..
H2 C
CH2
..
+ X
H
X
Вторая стадия (медленная).
H2 C
..
..
+
CH2
+
H
..
X
H2 C
CH2
.
+.
X
H
20
21.
АлкеныМеханизм реакции AdE
Третья стадия (быстрая).
.. +
X
+
H2C
CH2
H2C
CH2
H
X
H
Порядок увеличения реакционной способности галогеноводородов
по отношению к алкенам совпадает с порядком увеличения их
кислотности:
HF << HCI < HBr < HI.
21
22.
АлкеныНаправление электрофильного присоединения
H3C
H3C
HC
CH2
CH
CH3
(85 %)
2-Бромпропан
Br
+ HBr
H3C
CH2
CH2Br
(15 %)
1-Бромпропан
1869 г. В. Марковников
Галогеноводороды, как и другие протонные кислоты,
присоединяются к несимметричным алкенам таким
образом, что водород присоединяется к атому
углерода, несущему наибольшее число атомов
водорода.
22
23.
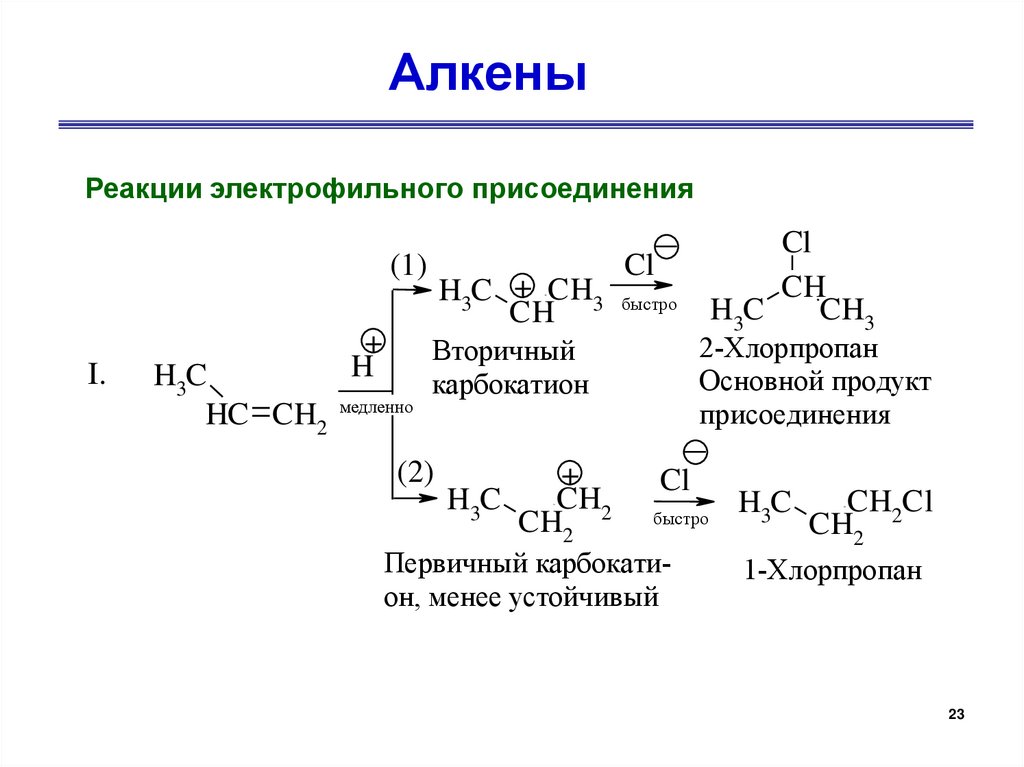
АлкеныРеакции электрофильного присоединения
(1)
I.
+
H
H3C
HC CH2 медленно
Cl
H3C + CH3 быстро
CH
2-Хлорпропан
Основной продукт
присоединения
Вторичный
карбокатион
(2)
+
CH2
H3C
CH2
Cl
CH
CH3
H3C
Cl
быстро
Первичный карбокатион, менее устойчивый
H3C
CH2Cl
CH2
1-Хлорпропан
23
24.
АлкеныРеакции электрофильного присоединения
(1)
CH3
H C C CH
3
II.
H3C
+
CH2 H
C
CH3
+
3
Cl
быстро
CH3
H3C C CH3
Cl
Третичный
карбокатион
2-Метил-2-хлорпропан
Основной продукт
присоединения
CH3
(2)
Cl
+
H C HC CH
CH3
H C HC CH Cl
медленно
3
2 быстро
Первичный карбокатион, менее устойчивый
3
2
2-Метил-1-хлорпропан
24
25.
АлкеныРеакции электрофильного присоединения
(1)
III.
+
CH3 H
HC
H3C
C
CH3
медленно
(2)
CH3
Cl
H3C
H2C C CH3 быстро
+
CH3
H3C CH C CH
3
2
Cl
Третичный
карбокатион
2-Метил-2-хлорбутан
Основной продукт
присоединения
CH3
Cl
H3C + HC
CH быстро
HC
CH3
H3C HC HC CH
3
Cl
3
Вторичный карбокатион, менее устойчивый
2-Метил-3-хлорбутан
25
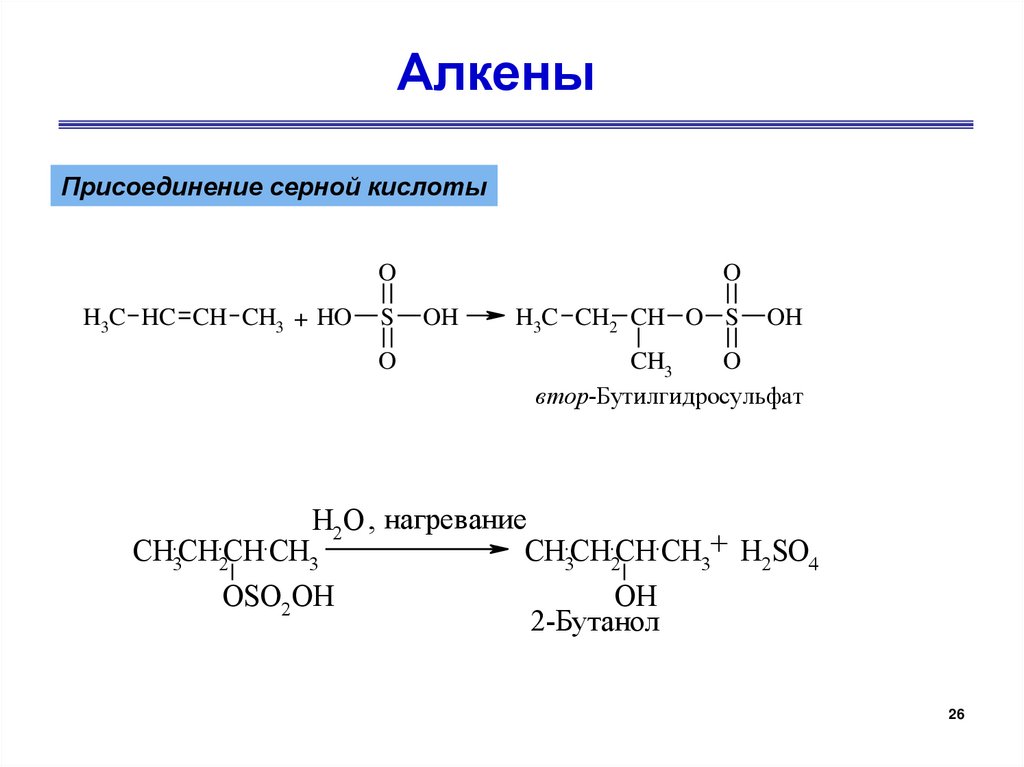
26.
АлкеныПрисоединение серной кислоты
O
H3C HC CH CH3 + HO
S
O
O
OH
H3C CH2 CH O S
OH
CH3
O
втор-Бутилгидросульфат
H2O , нагревание
CH3CH2CH CH3
CH3CH2CH CH3+ H2SO4
OSO2OH
OH
2-Бутанол
26
27.
АлкеныХимические свойства
Реакции электрофильного присоединения
Гидратация
CH3
CH
CH2
пропен
+
H 2O
H2SO4
CH3 CH
OH
CH2
H
пропанол-2
27
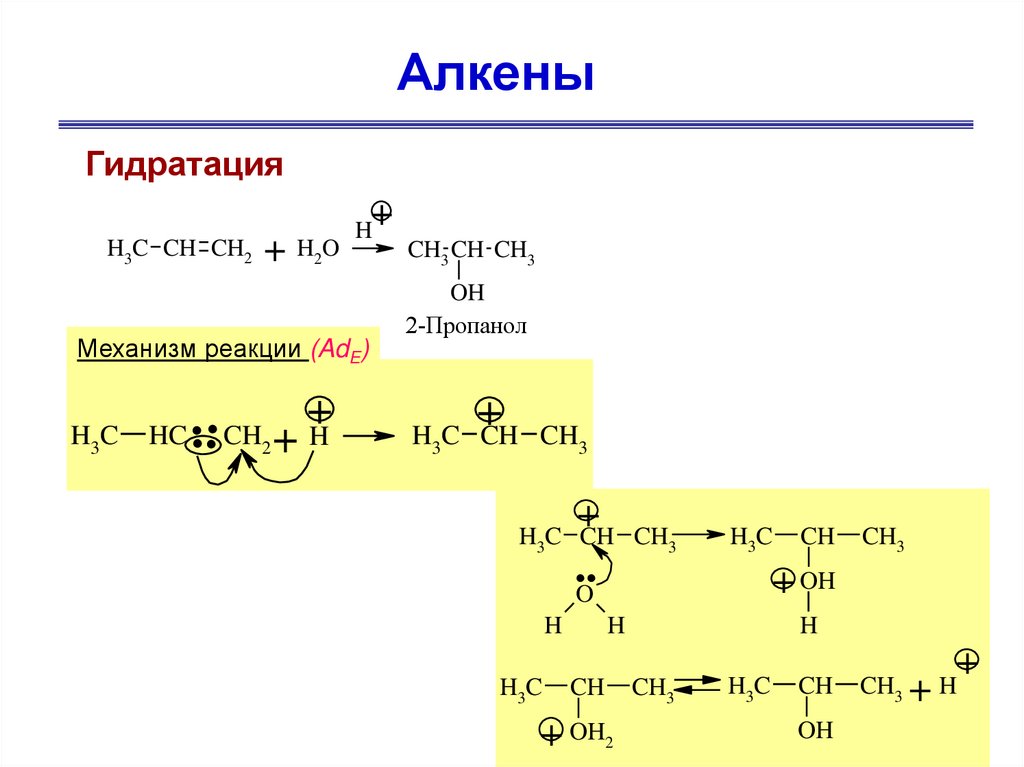
28.
АлкеныГидратация
+
H3C CH CH2
+ H2O
H
Механизм реакции (AdE)
H3C
HC
.. + +
CH2
H
CH3 CH CH3
OH
2-Пропанол
+
H C CH CH
3
3
+
H3C CH CH3
..
H3C
H3C
+
CH3
+ OH
O
H
CH
H
H
CH
OH2
CH3
H3C
CH
OH
CH3
+
+
H
28
29.
АлкеныСинтез простых эфиров
CH2 CH CH3+ C2H5OH
H2SO4
CH3 CH CH3
OC2H5
этилизопропиловый эфир
2-этоксипропан
29
30.
АлкеныПрисоединение галогенов
H
H
C C
H
H
+ Br2
CCl4 ; 25 OC
AdE
Br
H
H
C
C
H
Br
H
1,2-Дибромбутан
30
31.
АлкеныПрисоединение галогенов
Первая стадия.
C
C
Br
Br
или
C
C
Br
Br
или
Br
Br
-комплекс
31
32.
АлкеныСопряженное присоединение
H2C CH2
Br2, NaCl
H2C CH2 + H2C CH2 ( но не H2C CH2 )
Br Br
Br Cl
Cl Cl
1,2-Дибром- 1-Бром-2этан
хлорэтан
32
33.
АлкеныГидроборирование алкенов
CH CH2
CH3
BH3
2 CH3 CH CH2
H
CH CH2 BH2
тетрагидроТГФ CH
3
фуран (ТГФ)
H
CH CH2 B
CH3
3
_
CH3 CH2 CH2 B
3 H2O2, OH
3 CH3 CH2 CH2 OH + 3B(OH)3
3
B
H
Механизм реакции AdE
электроотрицательность
водорода 2,1
бора 1,9
33
34.
АлкеныАлкилирование алкенов
CH3
H3C
CH
+ H2C C
CH3 H2SO4
или HF
CH3
CH3 C CH2 CH CH3
CH3
CH3
CH3
CH3
2,2,4-Триметилпентан
+
H
CH3
+ H2C C
H3C
C
CH3
+
CH3
H3C
C
+ +
CH3
CH3
CH3
CH3
H3C
CH2 C
CH3
CH3
C
CH3
H3C C CH2 C +
CH3
CH3
.
+
CH2 C
CH3
+
CH3
(II)
(I)
CH3
CH3
CH3
CH3
CH3
H C CH3
CH3 C CH2 CH
+ + C CH3
CH3
CH3
CH3
CH3
CH3
2,2,4-Триметилпентаí
34
35.
АлкеныСвободно-радикальное присоединение AdR
Гидробромирование
CH3CH CH2
пероксид дибензоила
CH3CH2CH2Br
1. Инициирование
O
O
C6H5C O O CC6H5
O
2C6H5C O
35
36.
АлкеныСвободно-радикальное присоединение AdR
2. Рост цепи:
Br
.+
CH2
..
CH
. ..
. ...
H = -13 кДж/моль
Br CH2 CH CH3
вторичный радикал,
более устойчивый
CH3
H = 13 кДж/моль
CH2
H2C
Br
.
CH CH3
CH CH3
Br
первичный радикал,
менее устойчивый
+ ..
H
Br
Br
CH
CH2 2 CH3
+ Br
.
H = -29 кДж/моль
1-Бромпропан
36
37.
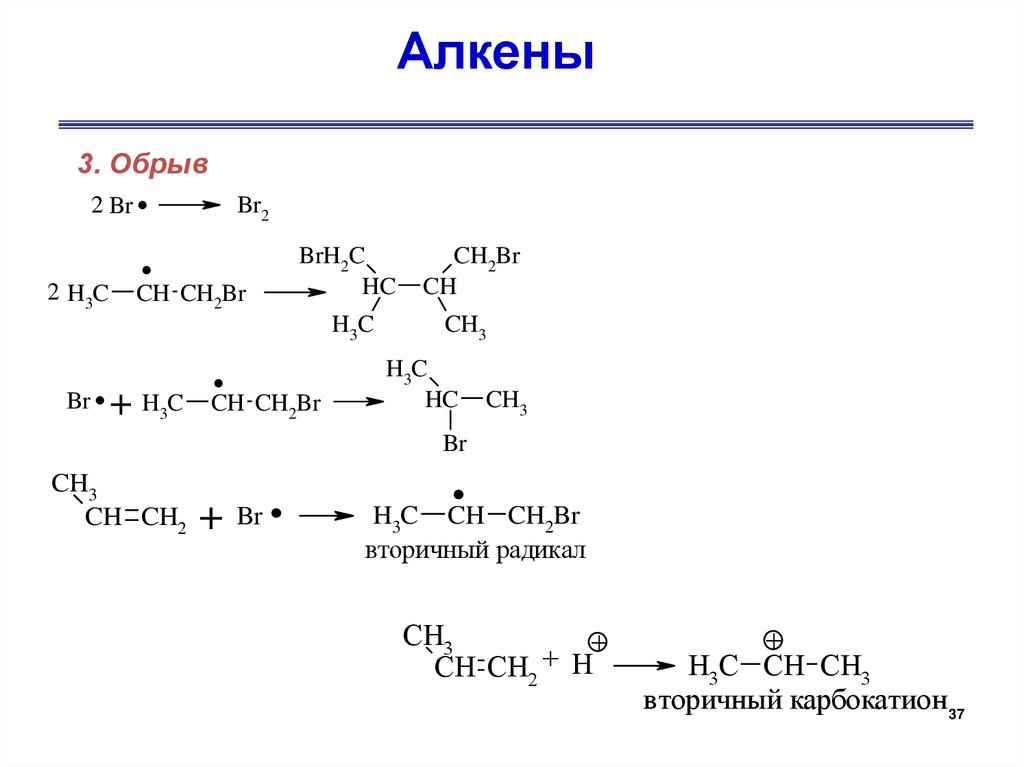
Алкены3. Обрыв
2 Br
2 H3C
Br
.+
.
.
Br2
CH CH2Br
H3C
.
BrH2C
HC
CH2Br
CH
H3C
CH3
CH CH2Br
H3C
HC
CH3
Br
CH3
CH CH2
+ .
Br
.
H3C CH CH2Br
вторичный радикал
CH3
+
+
CH CH2 H
+
H3C CH CH3
вторичный карбокатион 37
38.
АлкеныСвободно-радикальное присоединение
Аллильное замещение галогенами
CH2 CHCH3 + Cl2
300°C
CH2 CHCH2Cl + HCl
.
.
CH CH CH + Cl
3
2
CH3 CH CH2
Cl
.CH CH CH + HCl
2
2
Cl2
.
CH CH CH + Cl
2
2
Cl
38
39.
АлкеныХимические свойства
Реакция полимеризации
n CH2
CH2
CH2 CH2
n
полиэтилен
nCH CH2
CH CH2
CH3
CH3
n
полипропилен
39
40.
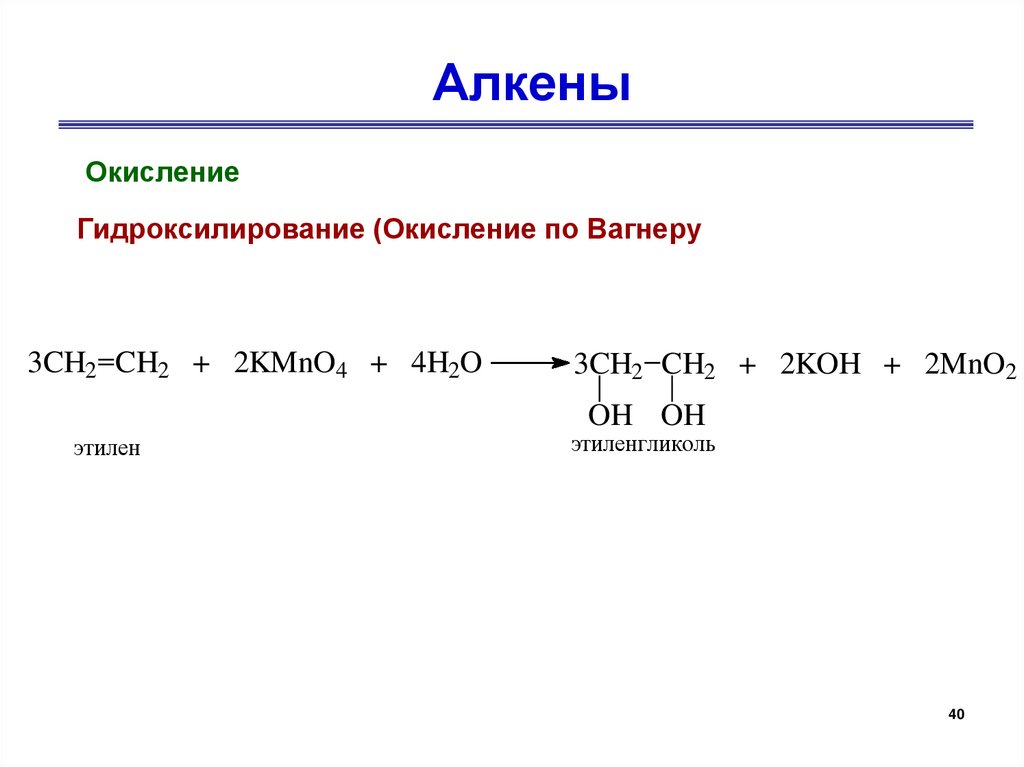
АлкеныОкисление
Гидроксилирование (Окисление по Вагнеру
3CH2 CH2 + 2KMnO4 + 4H2O
3CH2 CH2 + 2KOH + 2MnO2
OH OH
этилен
этиленгликоль
40
41.
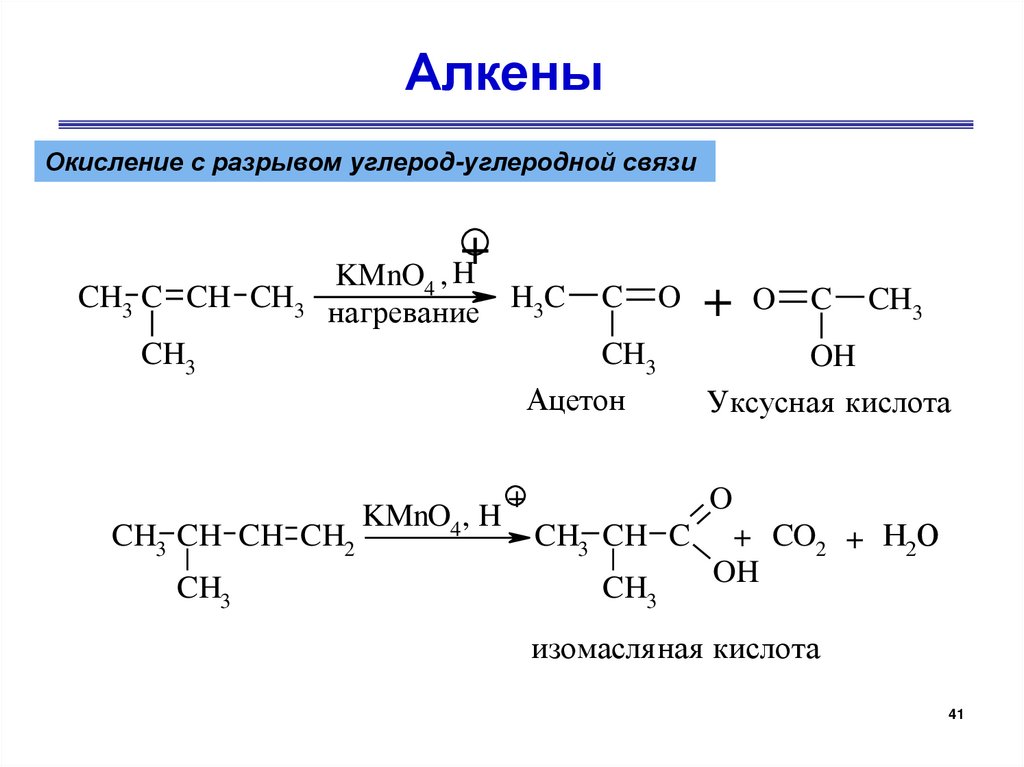
АлкеныОкисление с разрывом углерод-углеродной связи
+
CH3 C CH CH3
KMnO4 , H
нагревание H3C
CH3
CH3 CH CH CH2
CH3
C
O
CH3
Ацетон
KMnO4, H
+
+ O C CH3
OH
Уксусная кислота
O
CH3 CH C
CH3
+ CO2 + H2O
OH
изомасля ная кислота
41
42.
АлкеныОкисление
2CH2 CH2 +
350°C
O2 Ag
2H2C CH2
O
C C
+
R C
O
O OH
надкислота
Реакция
Н.А.Прилежаева
оксид этилена
O
O
+ R C
C C
OH
42
43.
АлкеныЭпоксидирование (Окисление)
Реакция Прилежаева
H3C
H
H
C C
O
+ R C
CH3
O OH
надкислота
H3C
H
H
O
+
C C
R C
CH3
OH
O
Окись транс-бутена-2
43
44.
АлкеныОкисление
Горение
C2H4 + 3O2 2CO2 + 2H2O
44
45.
АлкеныОзонолиз
O
H3C C
CH CH2 CH3
+ O3
H3C C
CH3
H3C C
O
H3C C O
+ O CH CH2 CH3
CH3
O
O
CH CH2 CH3
CH3
Озонид
H2O, Zn
O
O
CH CH2 CH3
Пропаналь
Ацетон
CH3
H2O2 , CH3COOH
H3C C O
CH3
Ацетон
OH
+O C
CH2 CH3
Пропионовая
кислота
45
46.
АлкеныСпособы получения
Элиминирование — это отщепление двух
атомов или групп атомов от соседних атомов
углерода с образованием между ними -связи.
C C
C C
+ XY
X Y
46
47.
АлкеныСпособы получения
ЭЛИМИНИРОВАНИЕ
галогенводорода
HHal
воды
H2O
галогена
Hal2
водорода
H2
Дегидрогалогенирование
Дегидратация
Дегалогенирование
Дегидрирование
47
48.
АлкеныРеакции элиминирования
Дегидрогалогенирование
CH3
CH
Br
CH3
+ KOH
C2H5OH
CH3 CH CH2 + KBr + H2O
48
49.
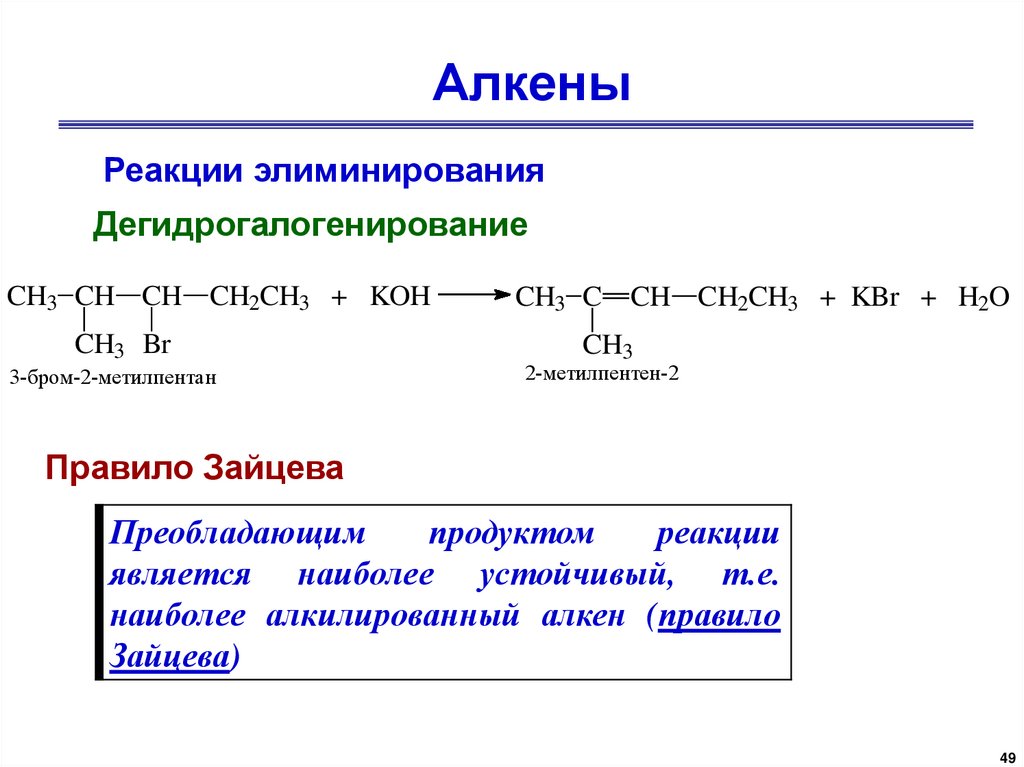
АлкеныРеакции элиминирования
Дегидрогалогенирование
CH3 CH CH CH2CH3 + KOH
CH3 Br
3-бром-2-метилпентан
CH3 C CH CH2CH3 + KBr + H2O
CH3
2-метилпентен-2
Правило Зайцева
Преобладающим
продуктом
реакции
является наиболее устойчивый, т.е.
наиболее алкилированный алкен (правило
Зайцева)
49
50.
АлкеныРеакции элиминирования
Дегидратация
CH2 CH2
H
H2SO4, 170°C
CH2 CH2 + H2O
OH
этилен
этанол
CH3
CH CH2
H
H2SO4, 180°C
CH3
CH CH2 + H2O
OH
пропанол-1
пропен
50
51.
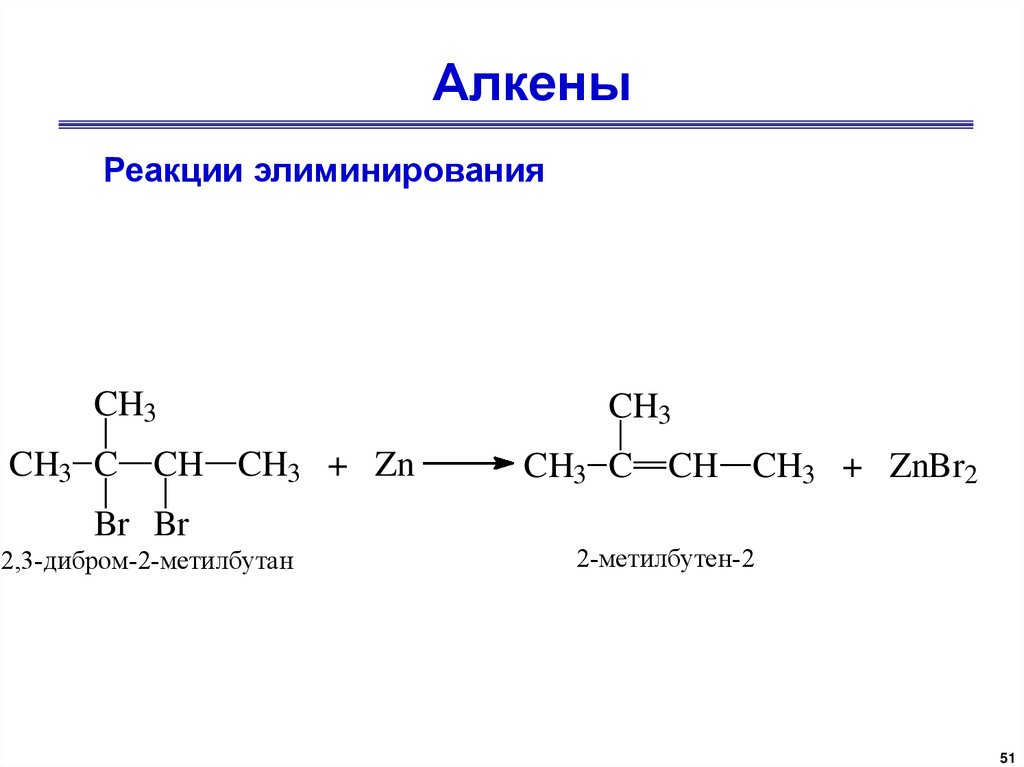
АлкеныРеакции элиминирования
CH3
CH3 C CH CH3 + Zn
Br Br
2,3-дибром-2-метилбутан
CH3
CH3 C CH CH3 + ZnBr2
2-метилбутен-2
51
52.
АлкеныРеакции элиминирования
Дегидрирование
CH3CH CHCH3 + H2
CH3CH2CH2CH3
бутан
Cr2O3, 500°C
бутен-2
CH2 CHCH2CH3 + H2
бутен-1
52
53.
АлкеныГидрирование алкинов
CH3 C
CH + H2
Pt(Pb) или Ni(Pb)
CH3 CH CH2
53
54.
АлкеныВосстановительное сочетание альдегидов и кетонов
R1 C O
R2
+ O
C R1
R2
LiAlH4, TiCl3 R1
ТГФ
R2
R1
C
C
R2
54
55.
АлкеныСпособы получения
Пиролиз алканов
CH3 CH2
CH2 CH2 CH3
CH3CH2
этил
-H
CH3CH2CH2
пропил
CH2 CH2
этилен
+H
CH3CH2CH3
пропан
55












































 chemistry
chemistry








