Similar presentations:
Алкены
1.
HF < HCl < HBr < HIРост силы кислоты
Скорость галогенирования
HO-H
HO-H
F
HO-H
H-OH
H-OH
H-OH
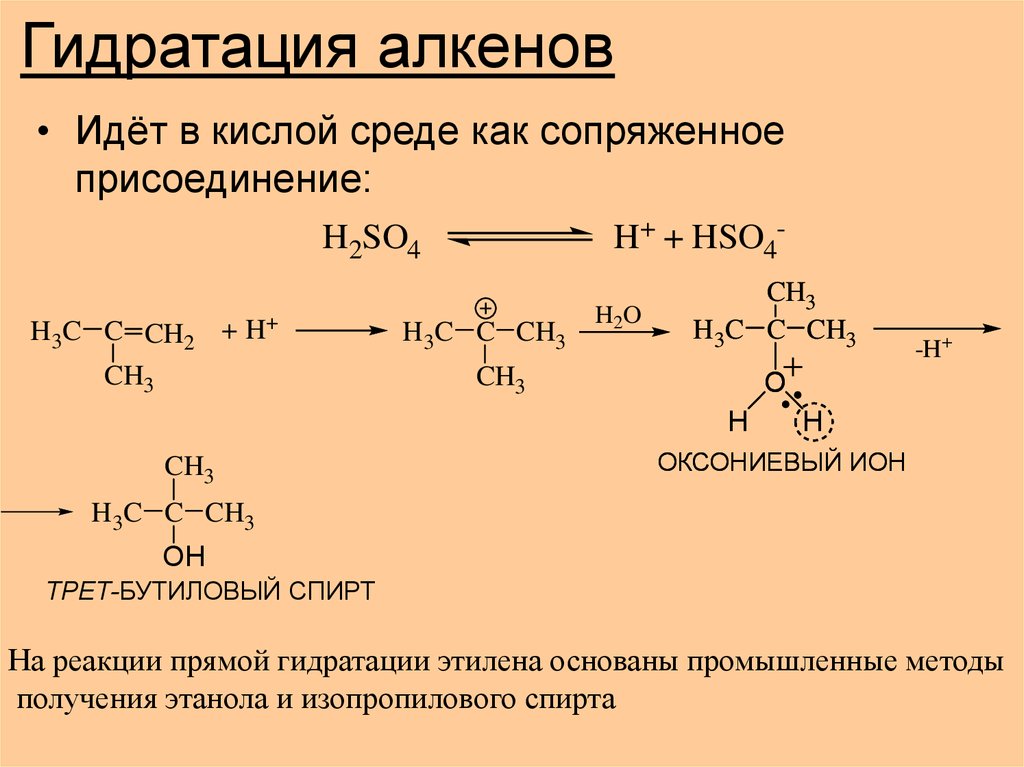
2. Гидратация алкенов
• Идёт в кислой среде как сопряженноеприсоединение:
H+ + HSO4-
H2SO4
H 3C C CH2 + H+
CH3
H 3C C CH3
H2O
CH3
H 3C C CH3
CH3
O
H
CH3
-H+
H
ОКСОНИЕВЫЙ ИОН
H 3C C CH3
OH
ТРЕТ-БУТИЛОВЫЙ СПИРТ
На реакции прямой гидратации этилена основаны промышленные методы
получения этанола и изопропилового спирта
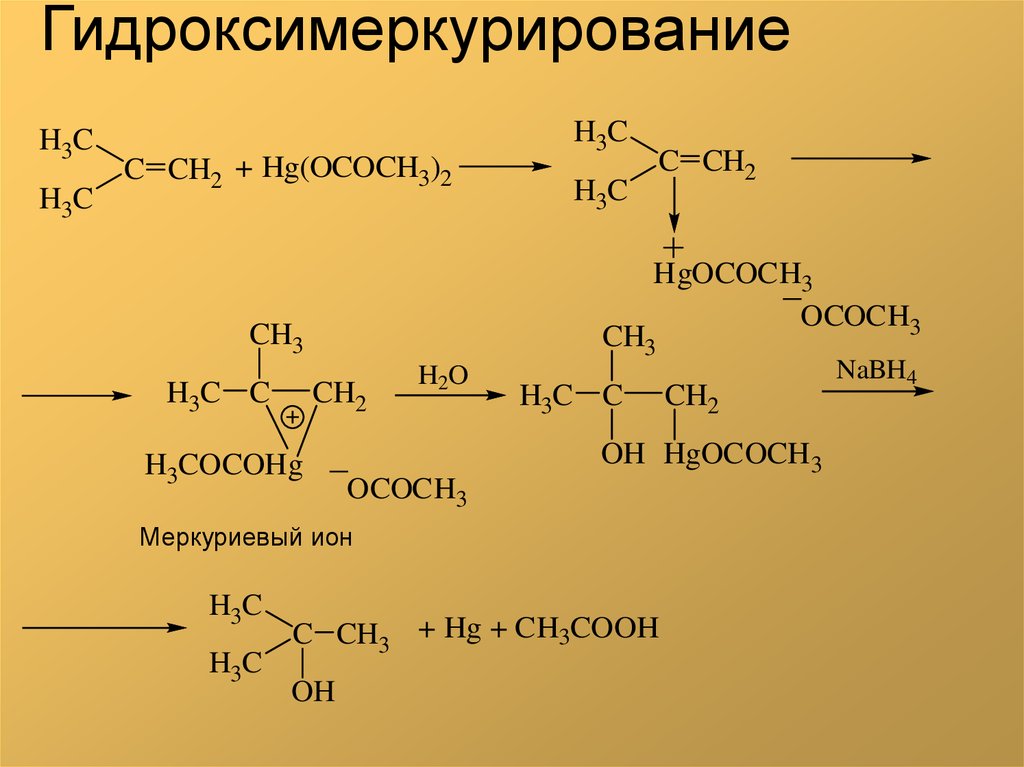
3. Гидроксимеркурирование
H3CH3C
H3C
C CH2 + Hg(OCOCH3)2
H3C
HgOCOCH3
OCOCH3
CH3
H3C C
C CH2
CH3
CH2
H3COCOHg
H2O
H3C C
OH HgOCOCH 3
OCOCH3
Меркуриевый ион
H3C
H3C
C CH3 + Hg + CH3COOH
OH
CH2
NaBH4
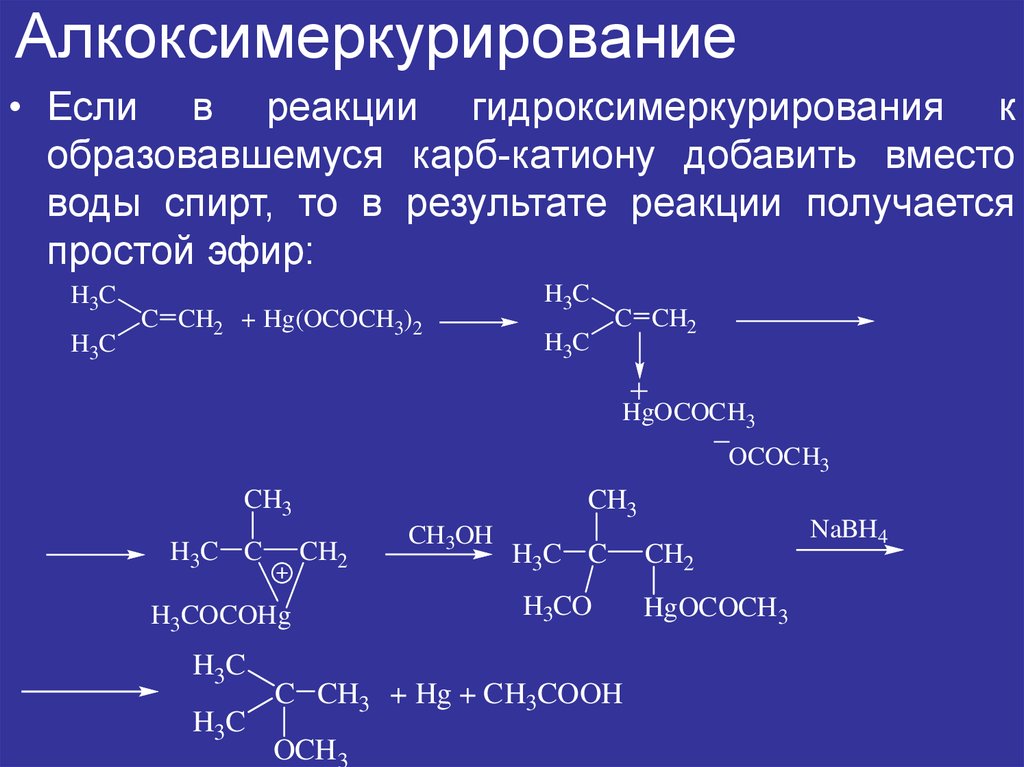
4. Алкоксимеркурирование
• Если в реакции гидроксимеркурирования кобразовавшемуся карб-катиону добавить вместо
воды спирт, то в результате реакции получается
простой эфир:
H3C
H3C
C CH2 + Hg(OCOCH3)2
H3C
H3C
C CH2
HgOCOCH3
OCOCH3
CH3
H3C C
CH3
CH2
H3COCOHg
H3C
H3C
CH3OH
H3C C
H3CO
C CH3 + Hg + CH3COOH
OCH 3
CH2
HgOCOCH 3
NaBH4
5. Присоединение хлорноватистой кислоты:
H3C C CH2H
+ HOCl
π, σ
Cl
H
H 3C C CH2
OH
Аналогично при действии Cl2 в H2O
H
Cl2
H3C C CH 2
H3C C CH2
H
H
H3C C CH2
Cl
H2O
Cl Cl
OH
H 3C C CH2 + H+
H
Cl
6. Гидроборирование (присоединение гидридов бора к алкенам)
Вкачестве гидроборирующего агента
H
H
H
используют диборан B2H6
B
B
H
H
H
Диборан в обычных условиях реагирует с алкенами
только в эфире или ТГФ (переходит в BH3). Гидроборирование
протекает в три стадии, но промежуточные моно- и диалкилбораны,
как правило, не могут быть выделены:
2 H2C
H2C
H2C
CH2 + B2H6
CH2 + C2H5BH2
CH2 + (C2H5)2BH
t
2C2H5BH2
t
(C2H5)2BH
t
(C 2H5)3B
7.
При гидроборировании несимметричных олефинов атом бора идетк концевому (терминальному) атому углерода.
Гидроборирование протекает как цис-присоединение. Полагают, что
Присоединение протекает через циклическое переходное состояние:
R C
H
+
CH 2
H
H
B
H
R C
H
CH 2
B
H
H
H
RC2H5BH2
8. Окисление алкенов
CC
C
C
CO2
C
C
O
C
O
OH OH
Эпоксиды
(эпокись, оксиран,
α-окись)
Диол (вицинальный
диол, гликоль, α-гликоль)
Направление реакции определяется
1. Строением алкена;
2. Природой реагента;
3. Значением рН;
4. Природой растворителя;
5. Температурой.
H
C
O
O
C
OH
Карбонильные соединения
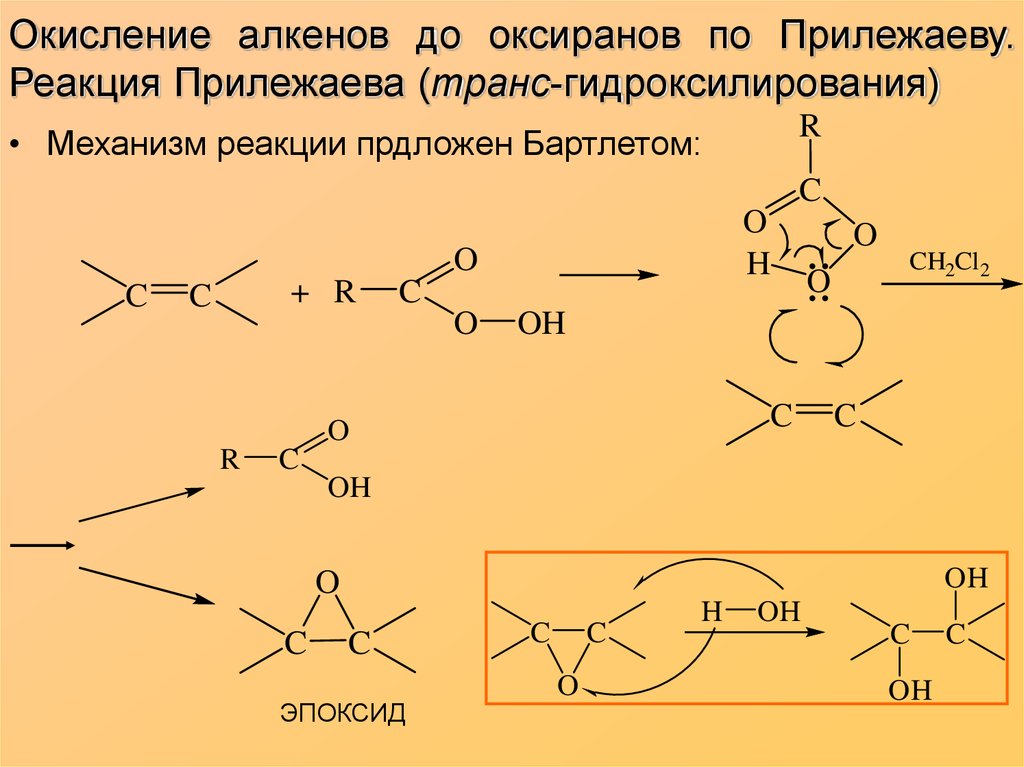
9. Окисление алкенов до оксиранов по Прилежаеву. Реакция Прилежаева (транс-гидроксилирования)
R• Механизм реакции прдложен Бартлетом:
C
O
H
O
C
+ R
C
C
O
O
CH2Cl2
OH
C
O
R
O
C
C
OH
OH
O
C
C
ЭПОКСИД
C
C
O
H
OH
C
OH
C
10.
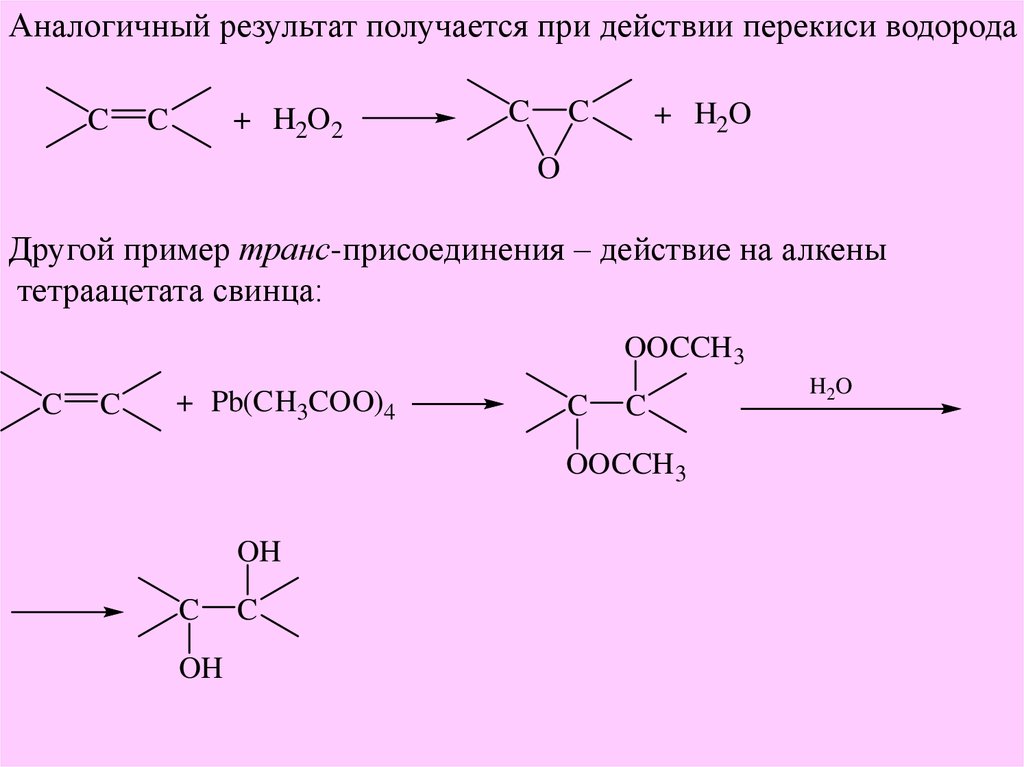
Аналогичный результат получается при действии перекиси водородаC
+ H2O2
C
C
C
+ H2O
O
Другой пример транс-присоединения – действие на алкены
тетраацетата свинца:
OOCCH 3
C
C
+ Pb(CH3COO)4
C
C
OOCCH 3
OH
C
OH
C
H 2O
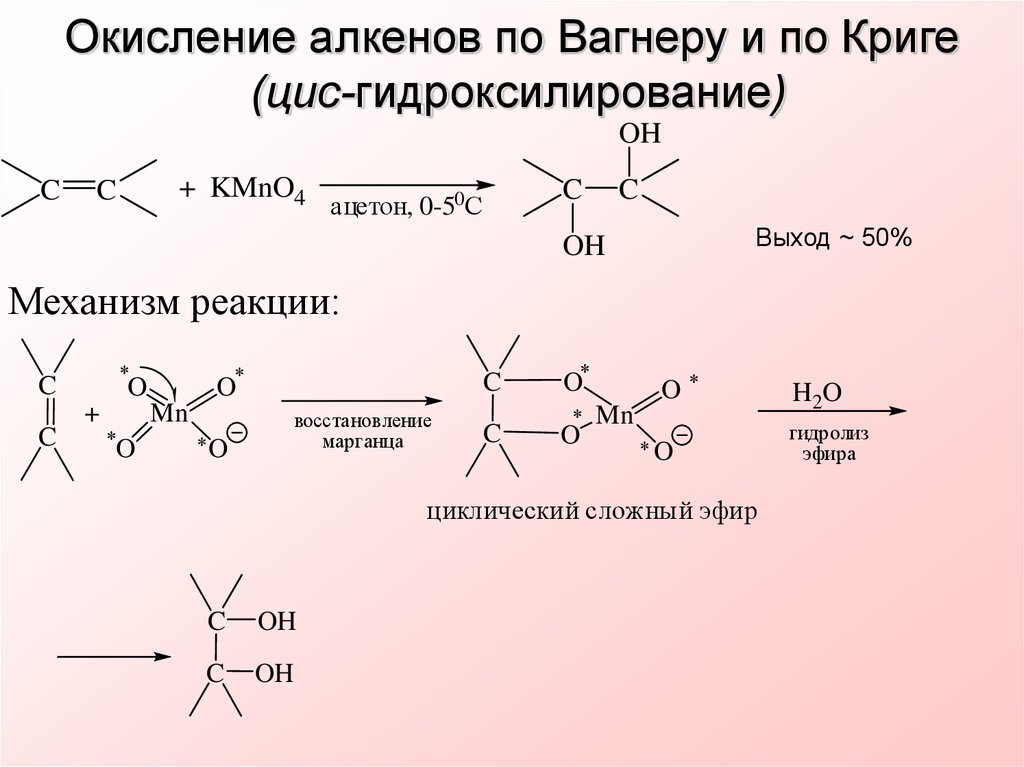
11. Окисление алкенов по Вагнеру и по Криге (цис-гидроксилирование)
OHC
+ KMnO4
C
C
ацетон, 0-50С
C
Выход ~ 50%
OH
Механизм реакции:
C
+
C
O
O
O
Mn
восстановление
марганца
O
C
O
C
O
O
Mn
O
циклический сложный эфир
C
OH
C
OH
H2O
гидролиз
эфира
12.
• В тех случаях когда необходимо провести цисгидроксилирование алкена с высоким выходом и«чисто» , используют OsO4 (окисление по Криге):
C
+
C
C
O
O
Os
O
бензол
или
эфир
O
C
O
Os
O
O
H2O
O
или
H2S
цвет от желтого до черного
C
C
OH
OH
+ OsVI
OsVI
+ H2O2
OsO4 + H2O
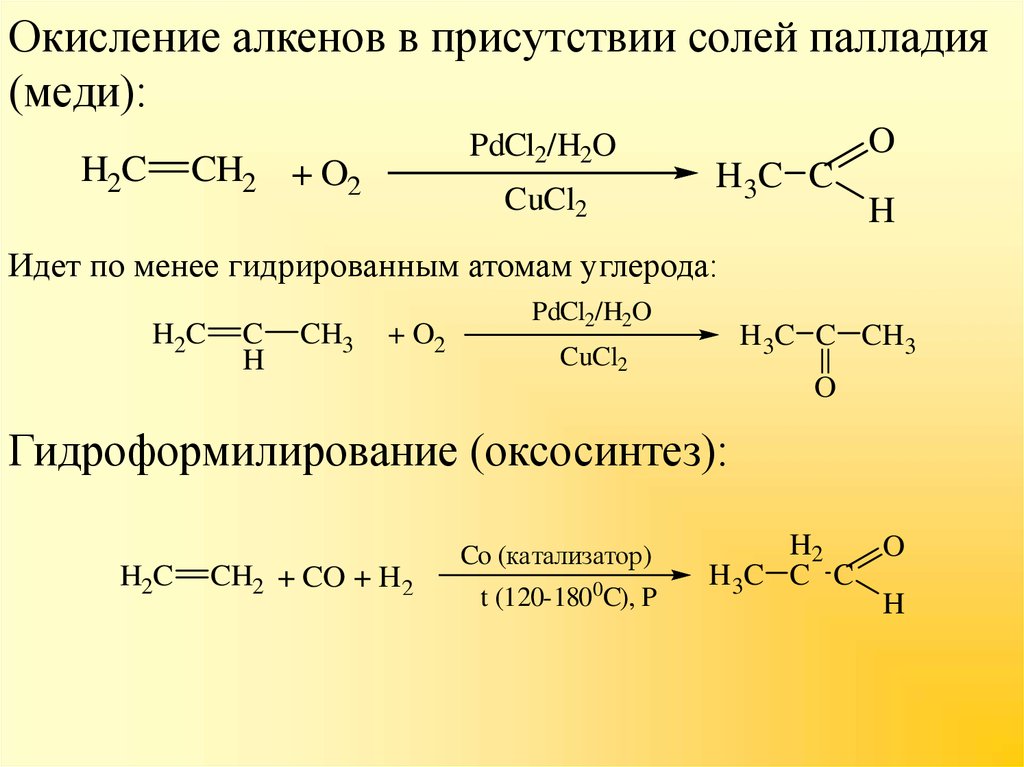
13. Окисление алкенов в присутствии солей палладия (меди):
H2CPdCl2/H2O
CH2 + O2
CuCl2
O
H 3C C
H
Идет по менее гидрированным атомам углерода:
H2C
C
H
CH3
+ O2
PdCl2/H2O
H3C C CH3
CuCl2
O
Гидроформилирование (оксосинтез):
H2C
CH2 + CO + H2
Co (катализатор)
t (120-1800C), P
H2
O
H 3C C C
H
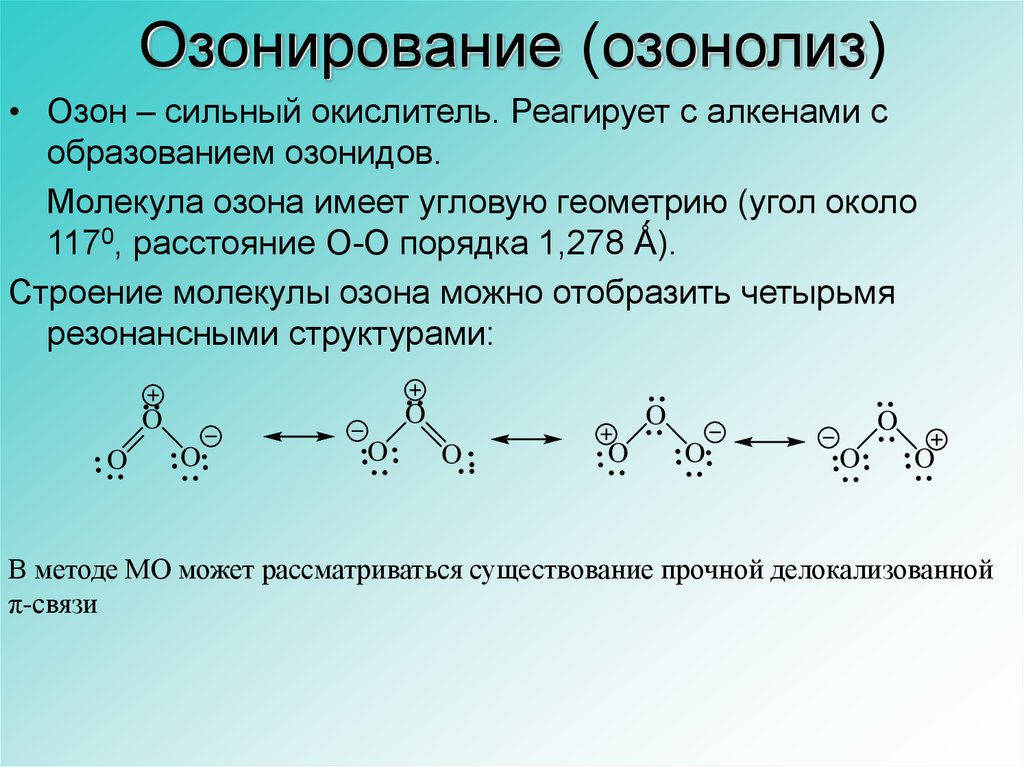
14. Озонирование (озонолиз)
• Озон – сильный окислитель. Реагирует с алкенами собразованием озонидов.
Молекула озона имеет угловую геометрию (угол около
1170, расстояние O-O порядка 1,278 Ǻ).
Строение молекулы озона можно отобразить четырьмя
резонансными структурами:
O
O
O
O
O
O
O
O
O
O
O
O
В методе МО может рассматриваться существование прочной делокализованной
π-связи
15.
Механизм реакции алкенов с озоном:O
O
C
O
CH2Cl2
-780C
O
C
O
O
C
O
Рекомбинация
B
Димеризация
C
O
O
A
A
O
+
C
C
C
O
Вторичный озонид
C
O
O
B
C
O
O
O
C
Биспероксид
16. Разложение озонидов:
H2OZn
O
R C
+ R C R
H
O
Кетонное расщепление
O
R
O
C
C
H
R
O
R
H2O2
O
R C
+ R C R
OH
O
Кислотное расщепление
17.
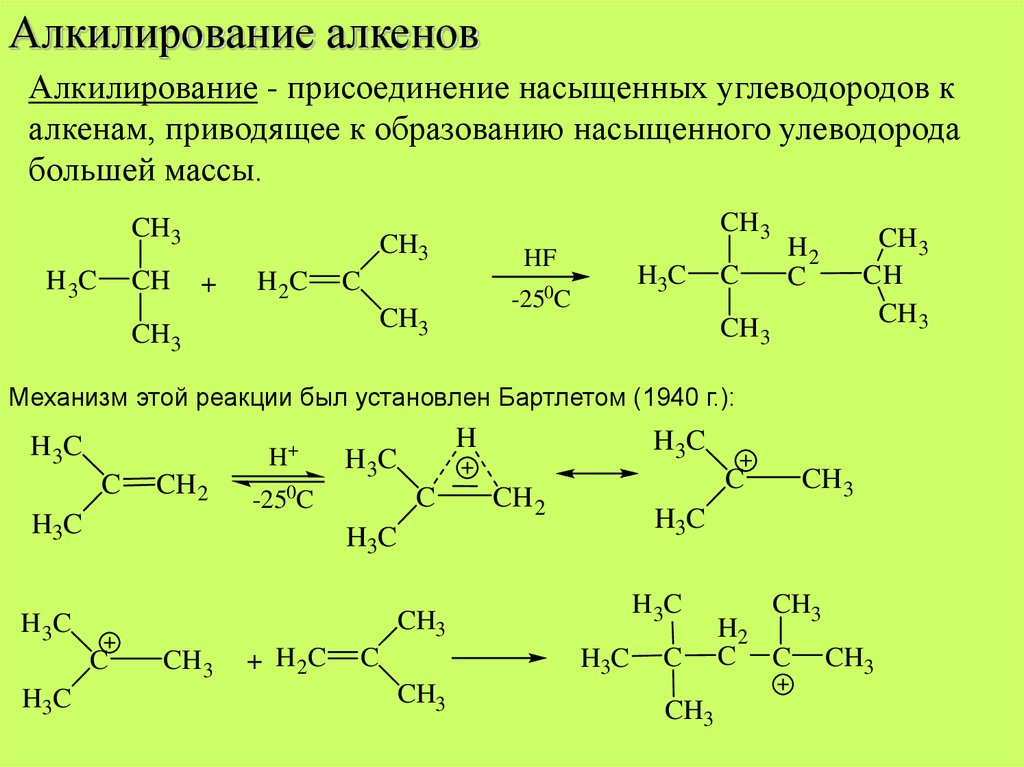
Алкилирование алкеновАлкилирование - присоединение насыщенных углеводородов к
алкенам, приводящее к образованию насыщенного улеводорода
большей массы.
CH3
H 3C
CH
CH 3
CH3
+
H 2C
HF
C
CH3
CH3
H3C
-250C
C
CH 3
CH
CH 3
H2
C
CH 3
Механизм этой реакции был установлен Бартлетом (1940 г.):
H 3C
H+
C
CH 2
H3C
H 3C
-250C
C
H 3C
C
CH 2
H 3C
CH3
C
CH 3
+ H 2C
C
H3C
CH3
CH 3
H3C
H3C
H 3C
H3C
H
C
CH3
CH3
H2
C C
CH3
18.
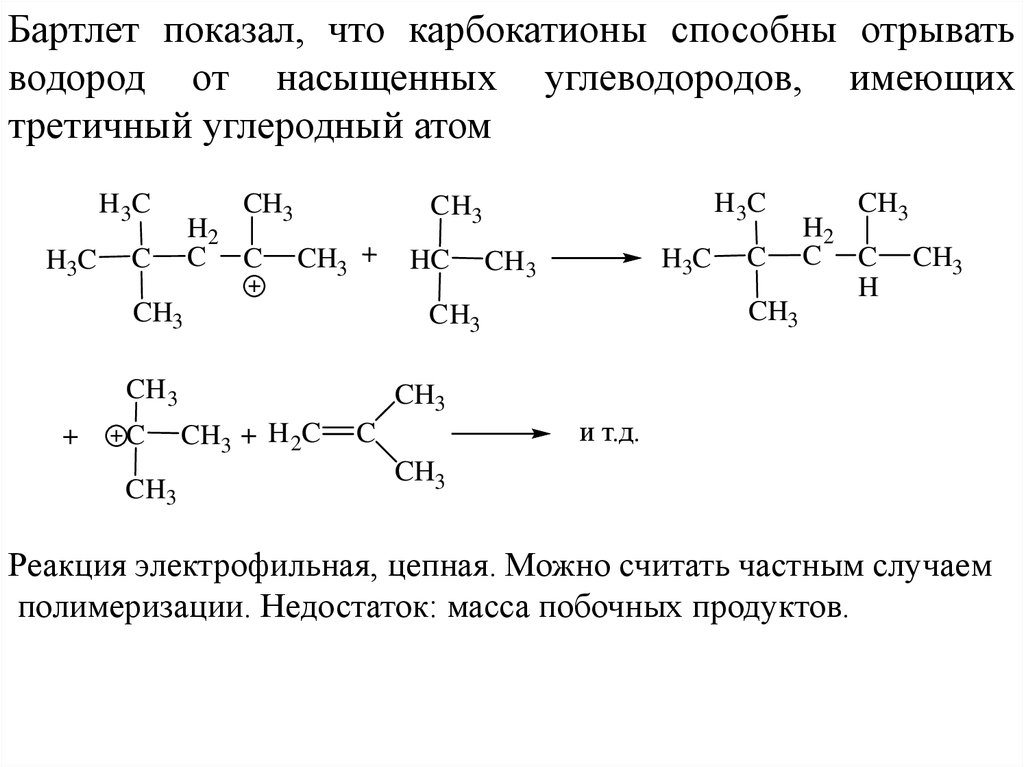
Бартлет показал, что карбокатионы способны отрыватьводород от насыщенных углеводородов, имеющих
третичный углеродный атом
H3C
CH3
H2
C C
C
CH3
CH3
C
CH3
HC
CH3
CH3 + H 2C
H3C
CH 3
C
C
CH3
CH3
CH 3
+
H 3C
CH3
+
H 3C
CH3
H2
C C
H
CH3
и т.д.
CH3
Реакция электрофильная, цепная. Можно считать частным случаем
полимеризации. Недостаток: масса побочных продуктов.
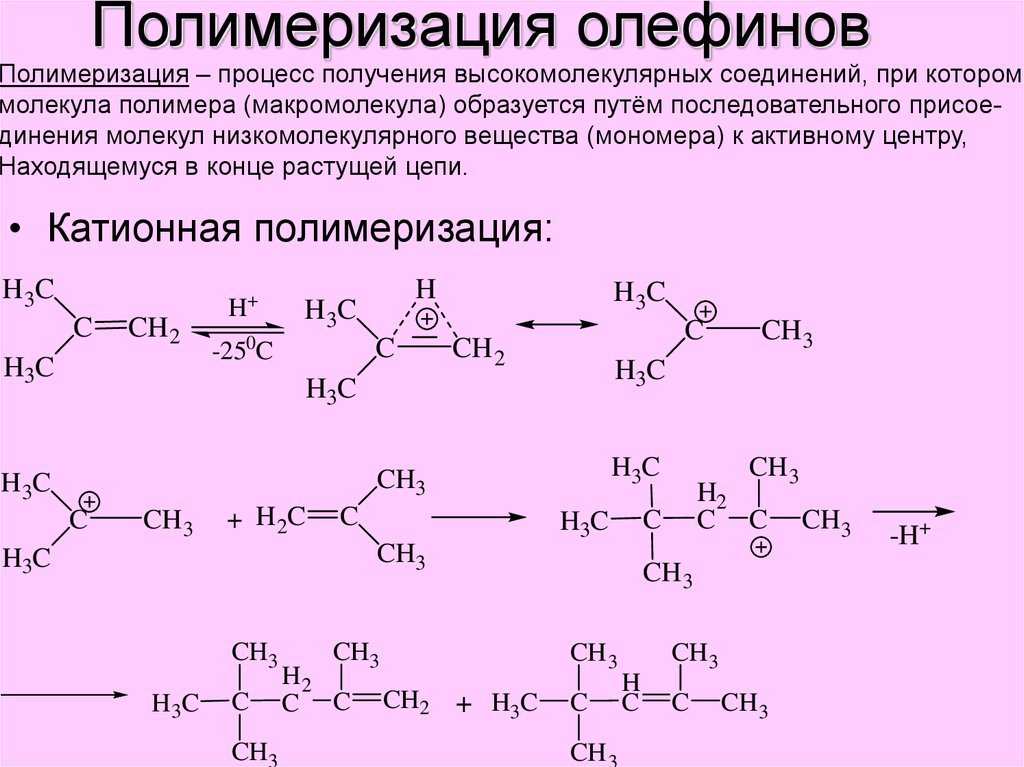
19. Полимеризация олефинов
Полимеризация – процесс получения высокомолекулярных соединений, при котороммолекула полимера (макромолекула) образуется путём последовательного присоединения молекул низкомолекулярного вещества (мономера) к активному центру,
Находящемуся в конце растущей цепи.
• Катионная полимеризация:
H 3C
C
CH 2
H3C
H+
H
H 3C
-250C
C
H 3C
C
CH 2
H3C
H3C
H3C
CH3
H 3C
C
CH 3
+ H 2C
C
CH3
H 3C
C
CH3
CH 3
CH2
H2
C C
CH 3
CH3
H2
C C
CH 3
C
H3C
CH3
H3C
CH 3
+ H3C
C
CH 3
CH 3
H
C
C
CH 3
CH 3
-H+
20.
Гетеролитически можно полимеризовать низшие олефины(этилен, пропилен) в ВМС с молекулярным весом 104-105.
Впервые в промышленных масштабах была осуществлена
полимеризация изобутилена в оппанол (немецкая торговая марка) и
вистанекс (торговая марка США).
Условия полимеризации: BF3, t = 1000C.
H 3C
H 3C
H 3C
C
CH 2 +
BF3
C
CH 2
C
H3C
H3C
H3C
BF3
H3C
CH 3
H3C
C
CH
BF3
H3C
CH 3
C CH2
F3B
C
CH3
CH
B
F3
CH 3
H2 H2
C C C
CH3
21.
ТеломеризацияТеломеры – полимеры сравнительно низкой молекулярной массы.
Часто жидкие.










 chemistry
chemistry