Similar presentations:
Карбонильные соединения (альдегиды и кетоны). Карбонильная группа
1. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ (АЛЬДЕГИДЫ И КЕТОНЫ)
OC
КАРБОНИЛЬНАЯ ГРУППА
2.
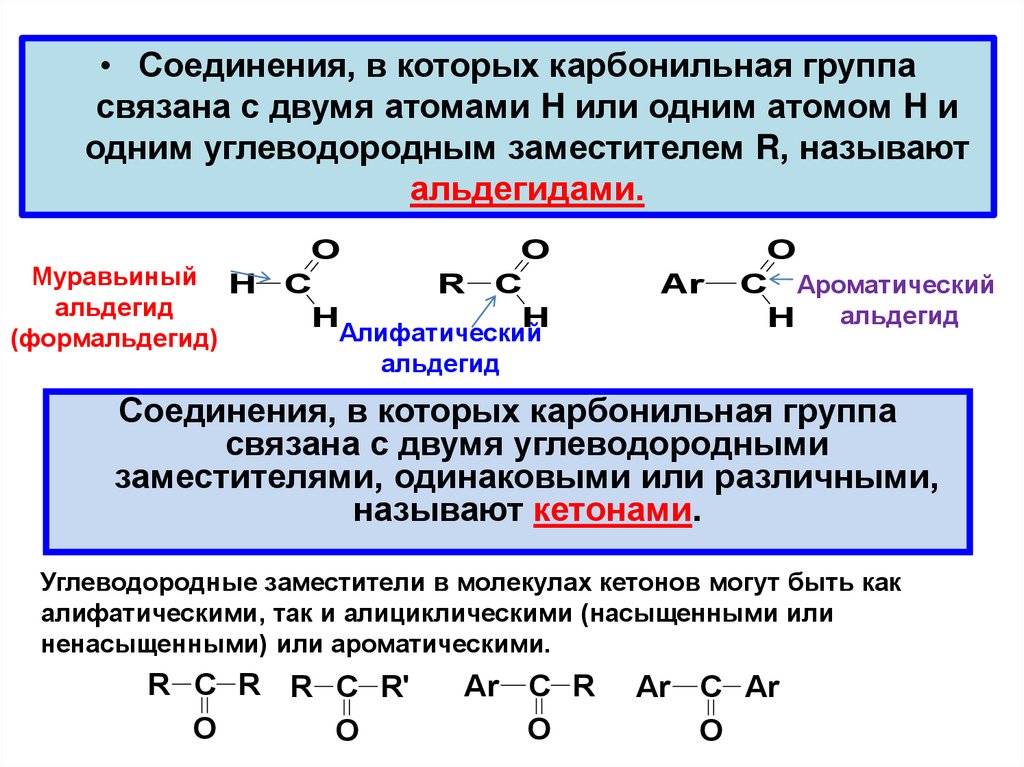
• Соединения, в которых карбонильная группасвязана с двумя атомами H или одним атомом H и
одним углеводородным заместителем R, называют
альдегидами.
Муравьиный H
альдегид
(формальдегид)
O
C
H
R
O
C
H
Алифатический
альдегид
Ar
O
C Ароматический
альдегид
H
Соединения, в которых карбонильная группа
связана с двумя углеводородными
заместителями, одинаковыми или различными,
называют кетонами.
Углеводородные заместители в молекулах кетонов могут быть как
алифатическими, так и алициклическими (насыщенными или
ненасыщенными) или ароматическими.
R C R R C R'
O
O
Ar C R
O
Ar C Ar
O
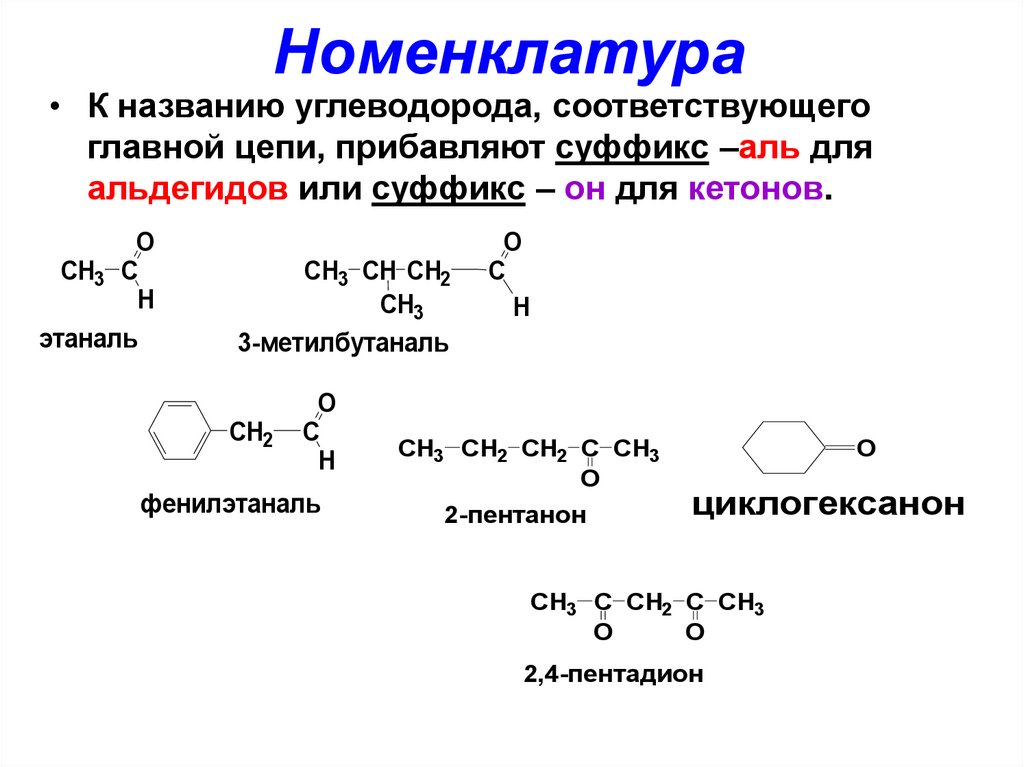
3. Номенклатура
• К названию углеводорода, соответствующегоглавной цепи, прибавляют суффикс –аль для
альдегидов или суффикс – он для кетонов.
O
CH3 C
H
этаналь
CH3 CH CH2
CH3
3-метилбутаналь
CH2
O
C
H
фенилэтаналь
O
C
H
CH3 СH2 CH2 C CH3
O
2-пентанон
O
циклогексанон
CH3 C CH2 C CH3
O
O
2,4-пентадион
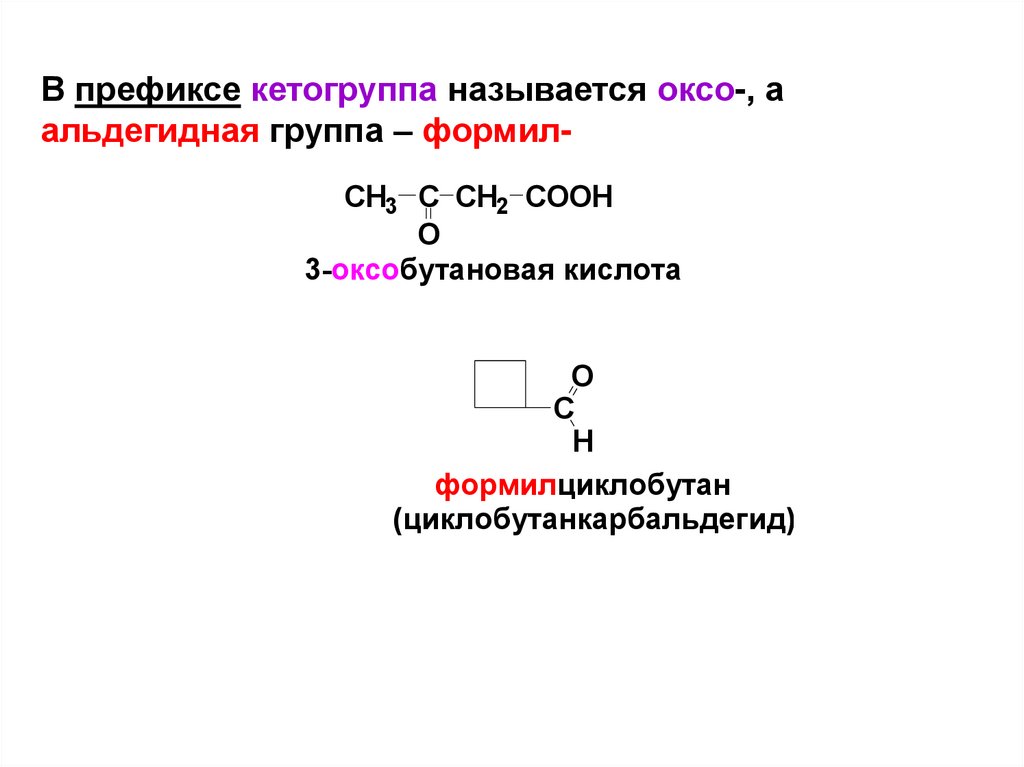
4.
В префиксе кетогруппа называется оксо-, аальдегидная группа – формилCH3 C CH2 COOH
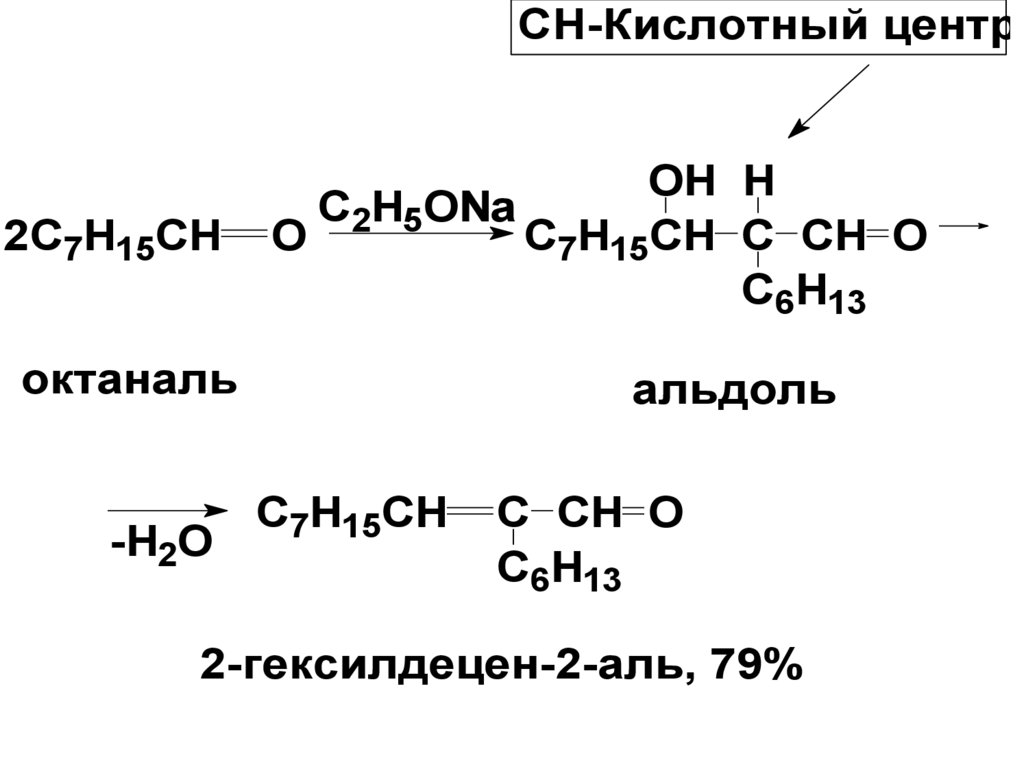
O
3-оксобутановая кислота
O
C
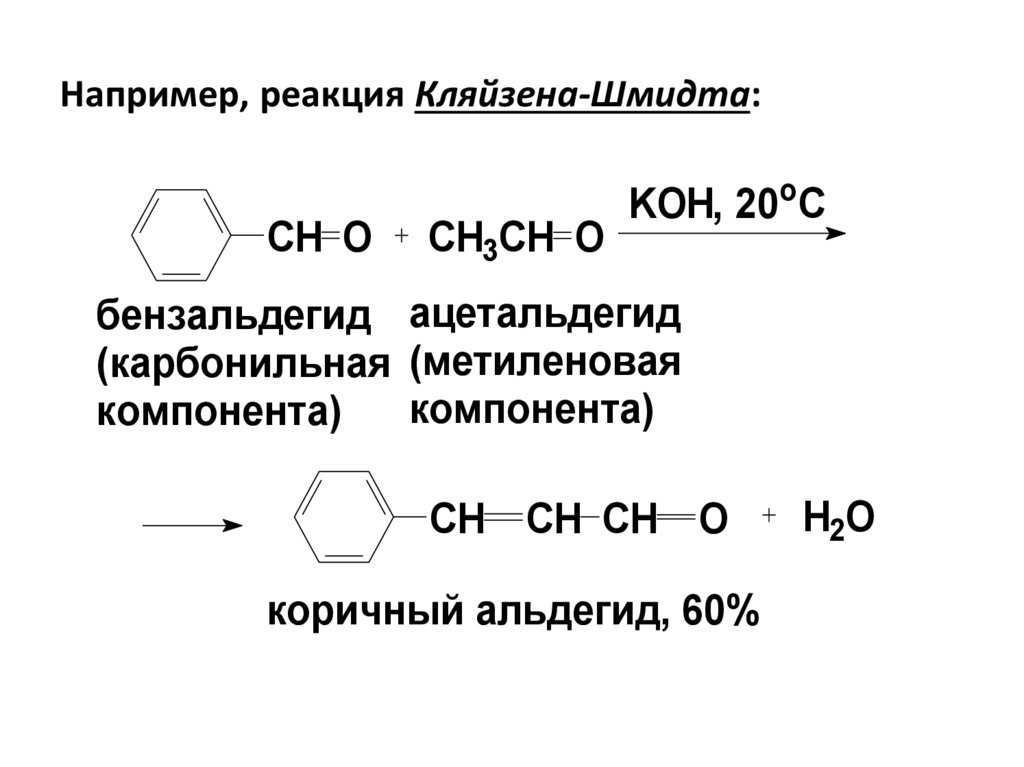
H
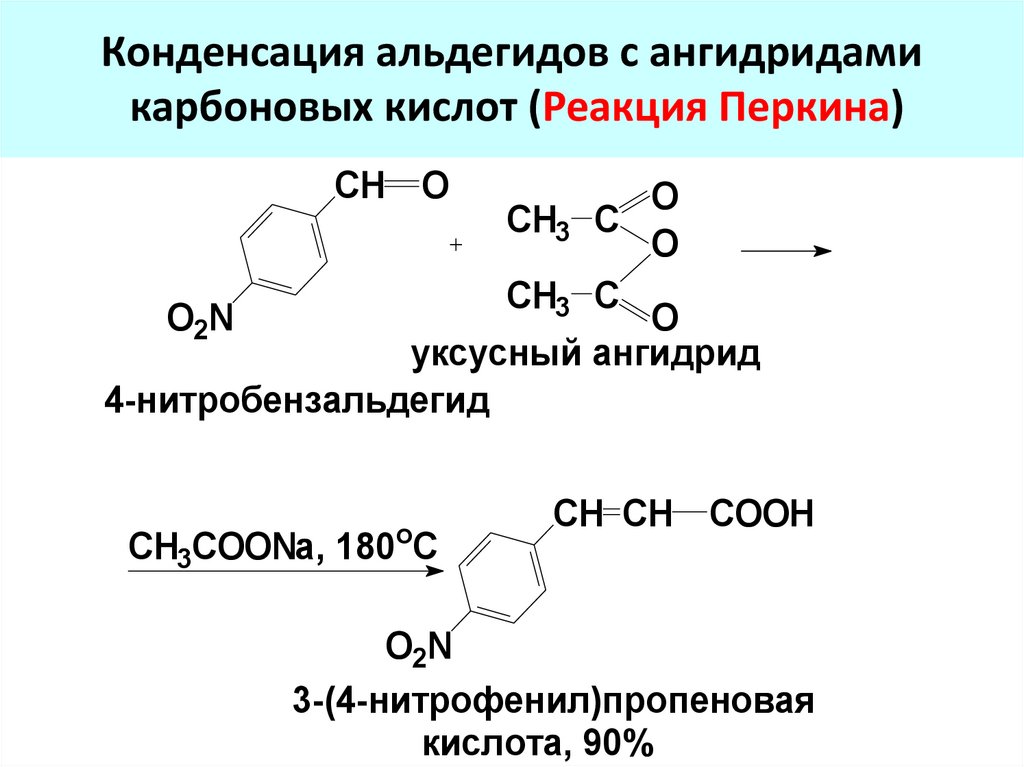
формилциклобутан
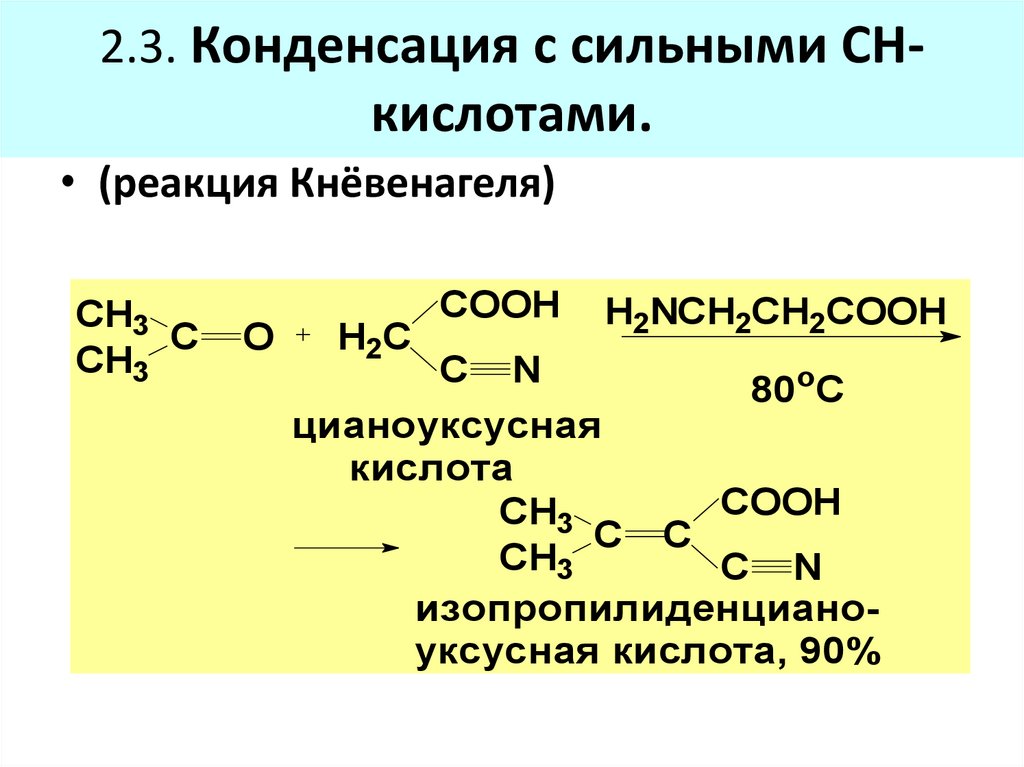
(циклобутанкарбальдегид)
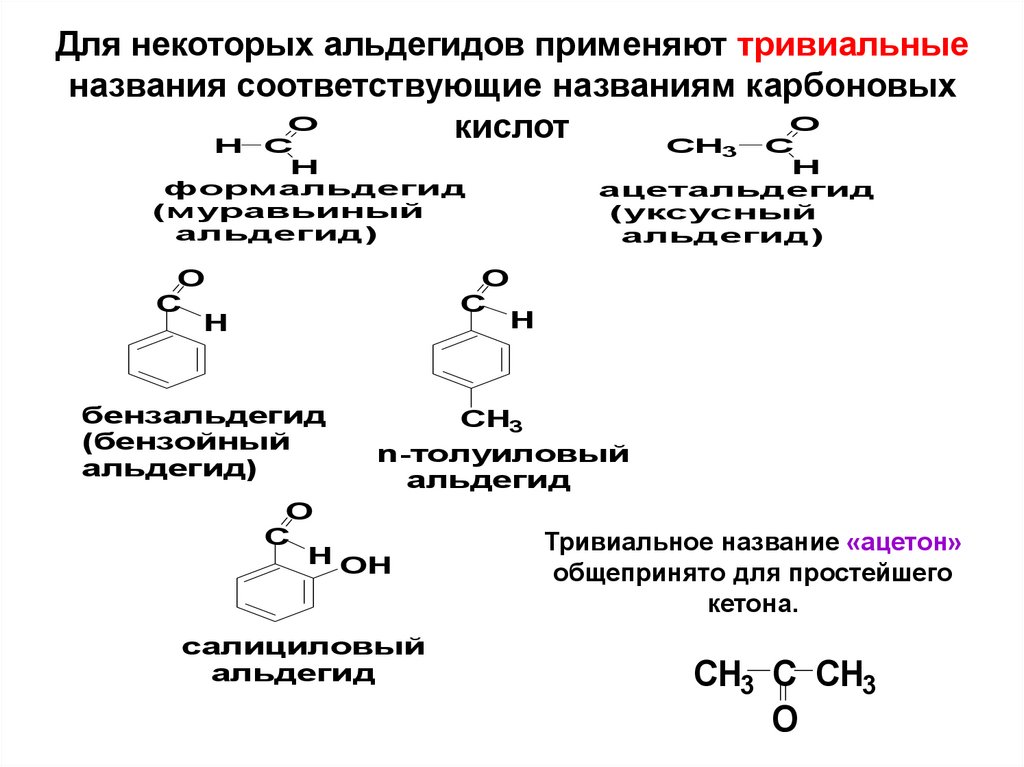
5. Для некоторых альдегидов применяют тривиальные названия соответствующие названиям карбоновых кислот
Для некоторых альдегидов применяют тривиальныеназвания соответствующие названиям карбоновых
O
O
кислот
H C
СH
C
H
формальдегид
(муравьиный
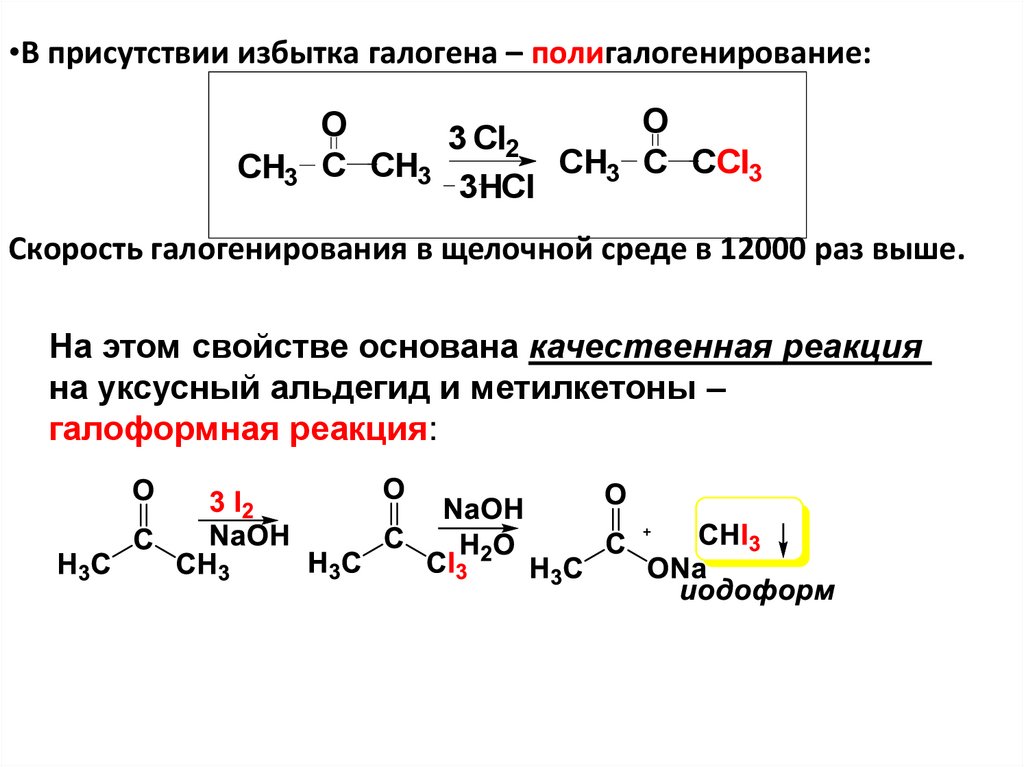
альдегид)
O
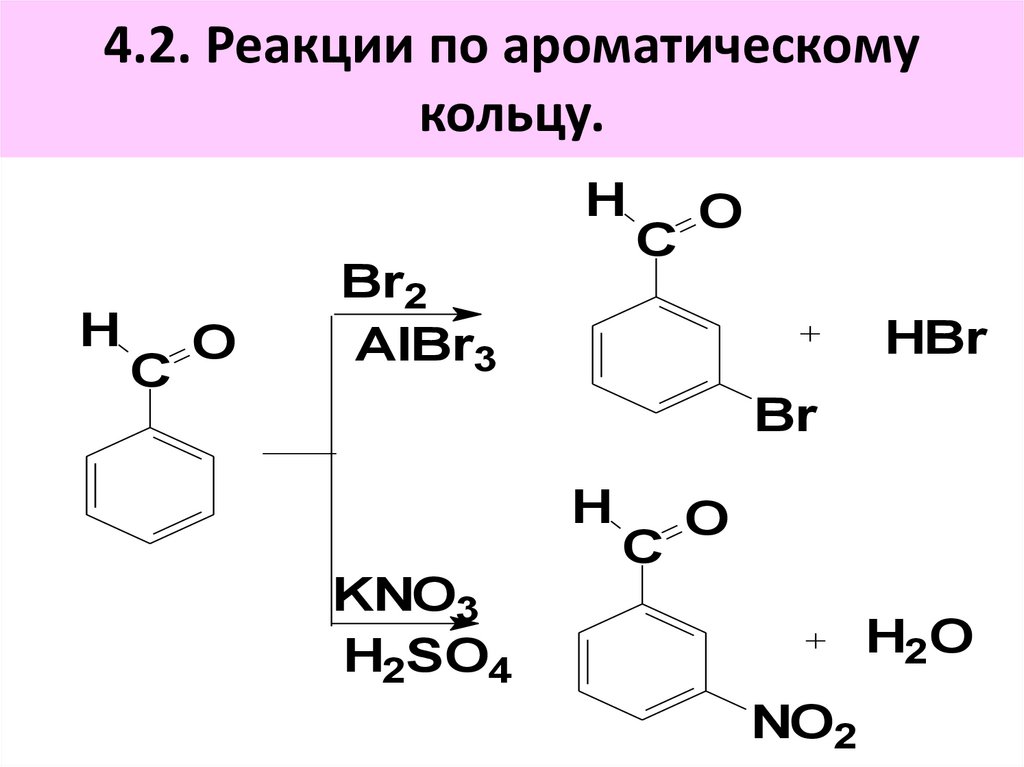
C
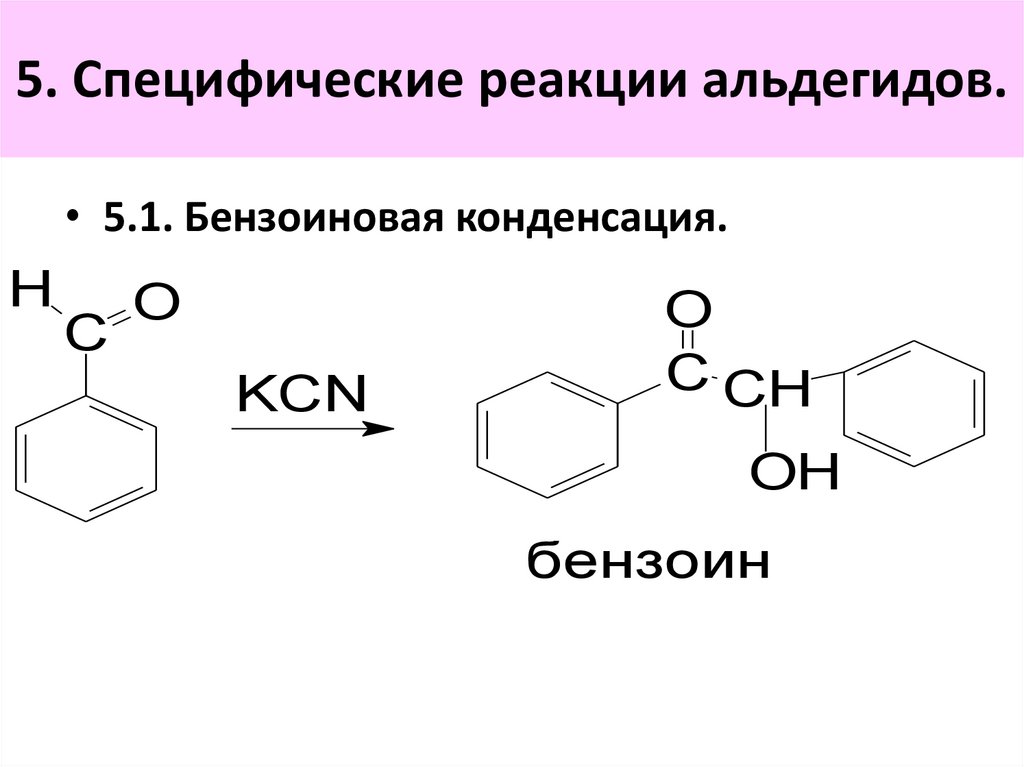
H
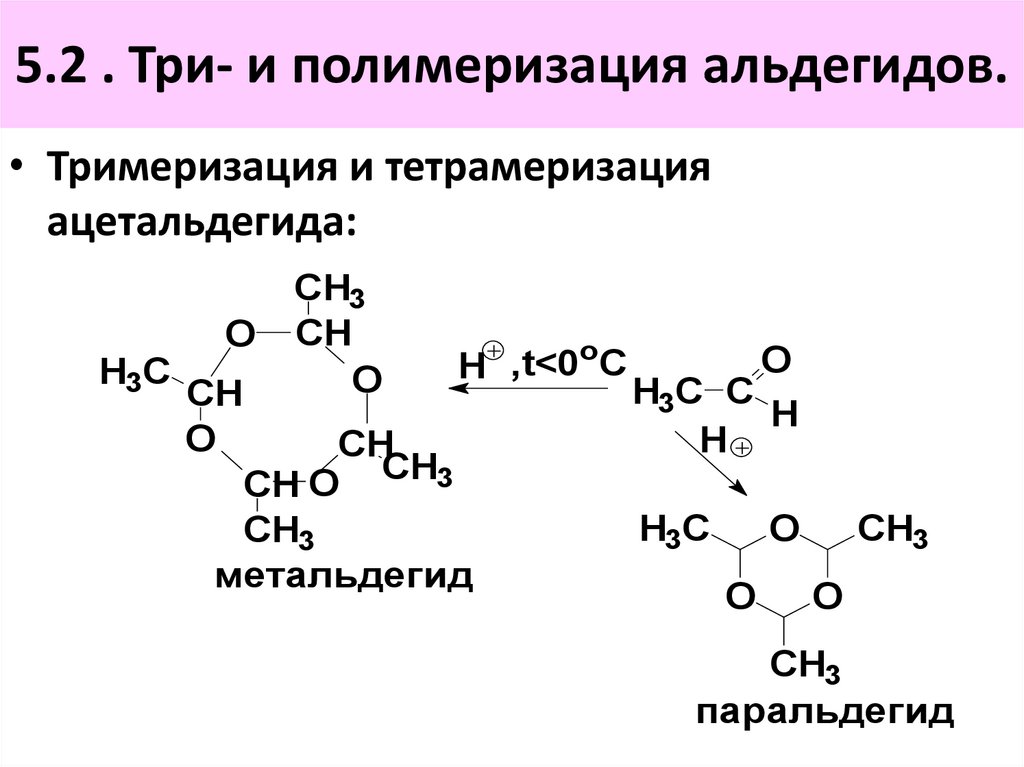
O
C
H
бензальдегид
(бензойный
альдегид)
СH3
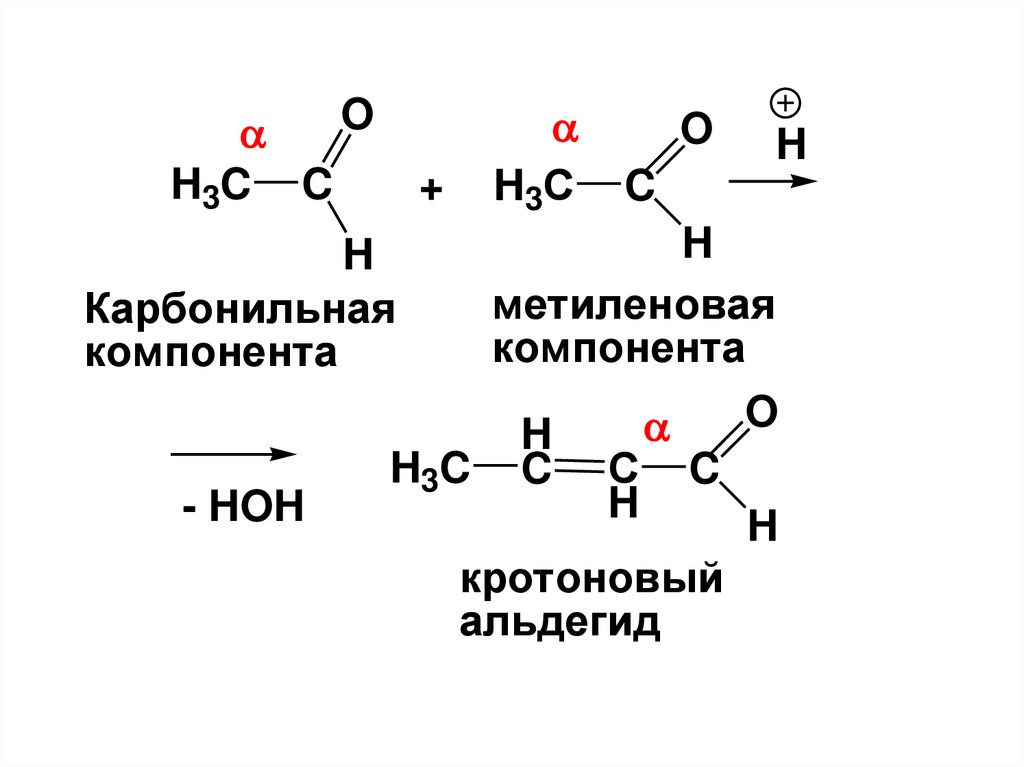
3
H
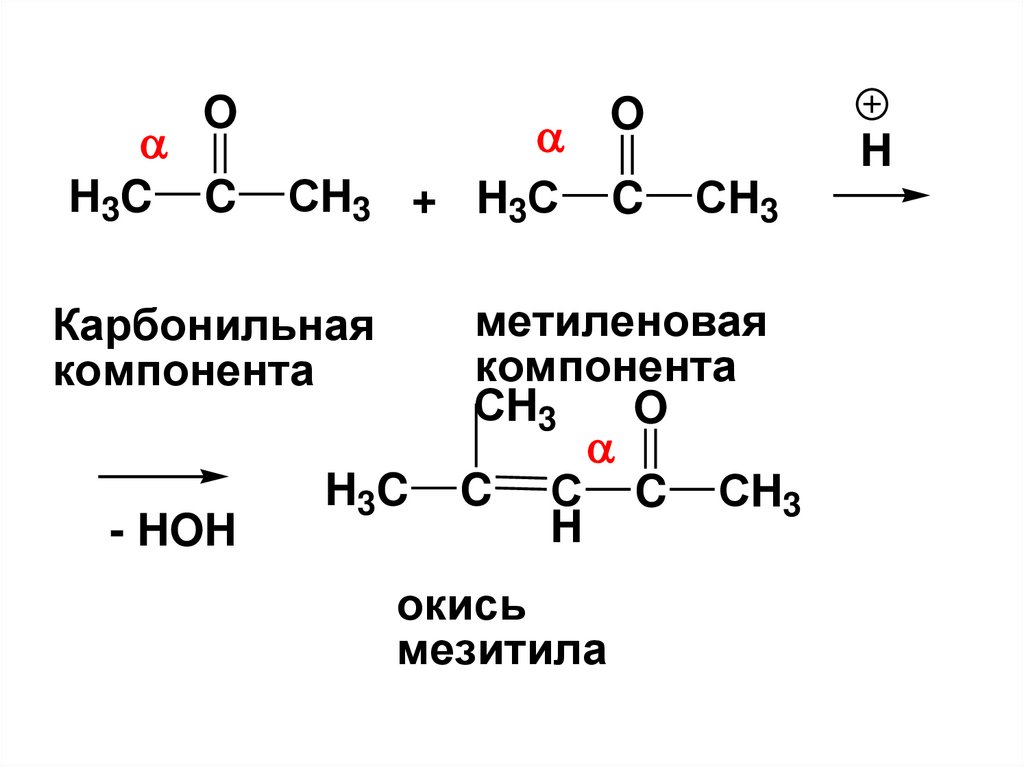
ацетальдегид
(уксусный
альдегид)
n-толуиловый
альдегид
O
C
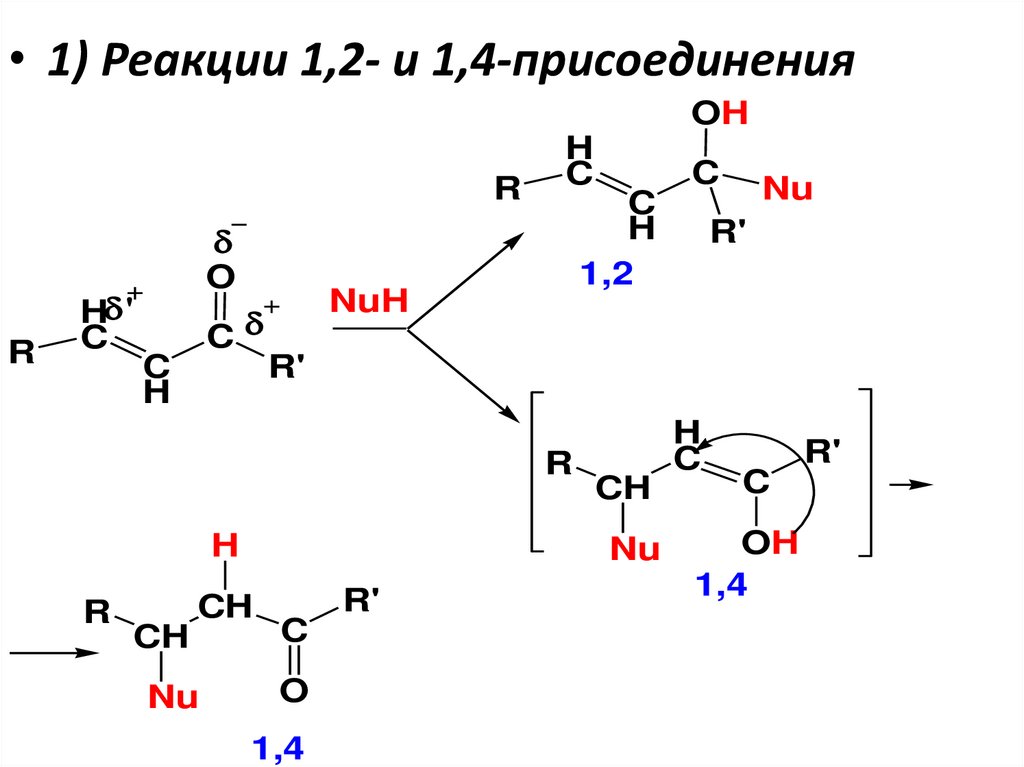
H OH
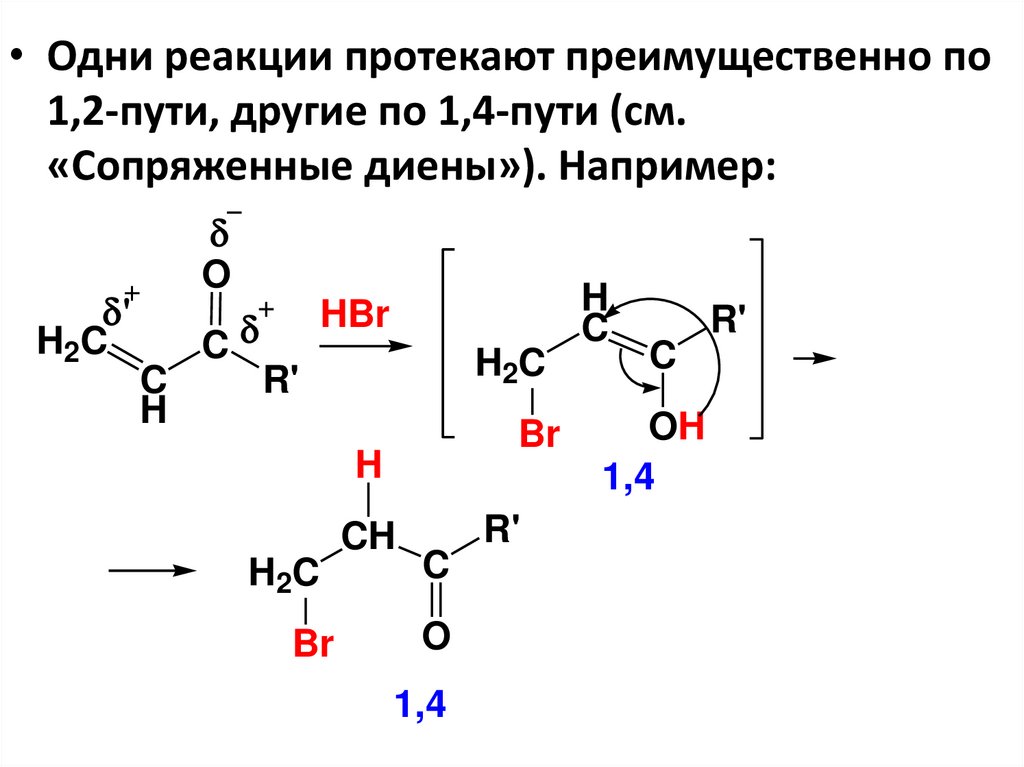
салициловый
альдегид
Тривиальное название «ацетон»
общепринято для простейшего
кетона.
СH3 C CH3
O
6.
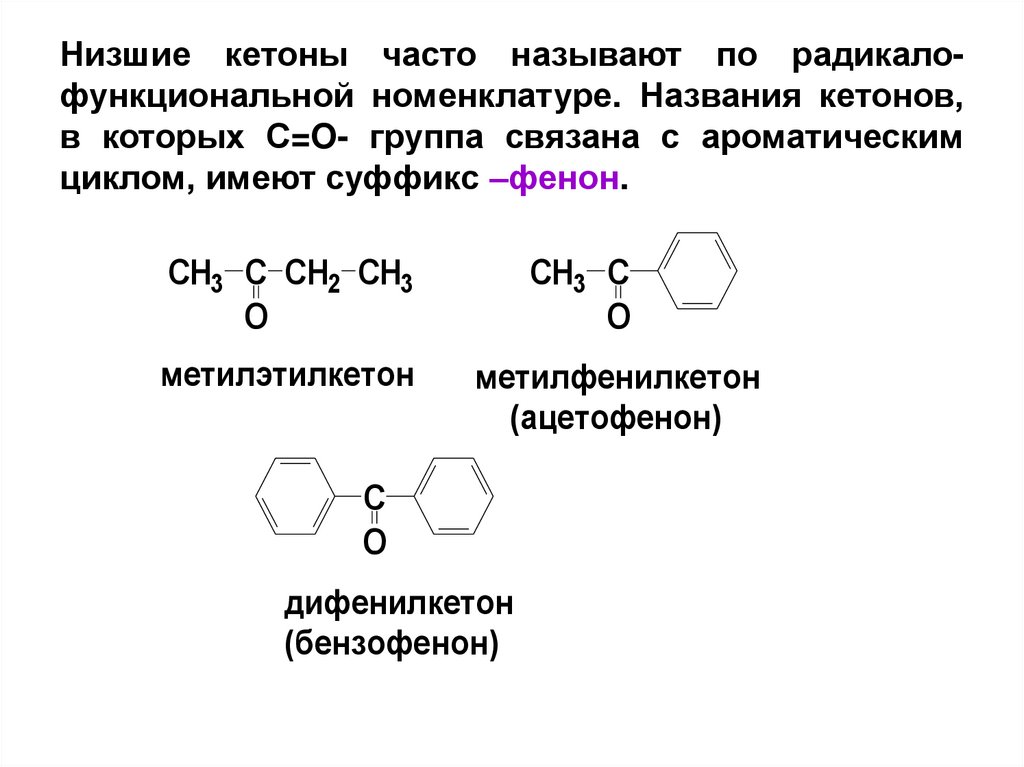
Низшие кетоны часто называют по радикалофункциональной номенклатуре. Названия кетонов,в которых С=O- группа связана с ароматическим
циклом, имеют суффикс –фенон.
CH3 C CH2 CH3
O
метилэтилкетон
CH3 C
O
метилфенилкетон
(ацетофенон)
C
O
дифенилкетон
(бензофенон)
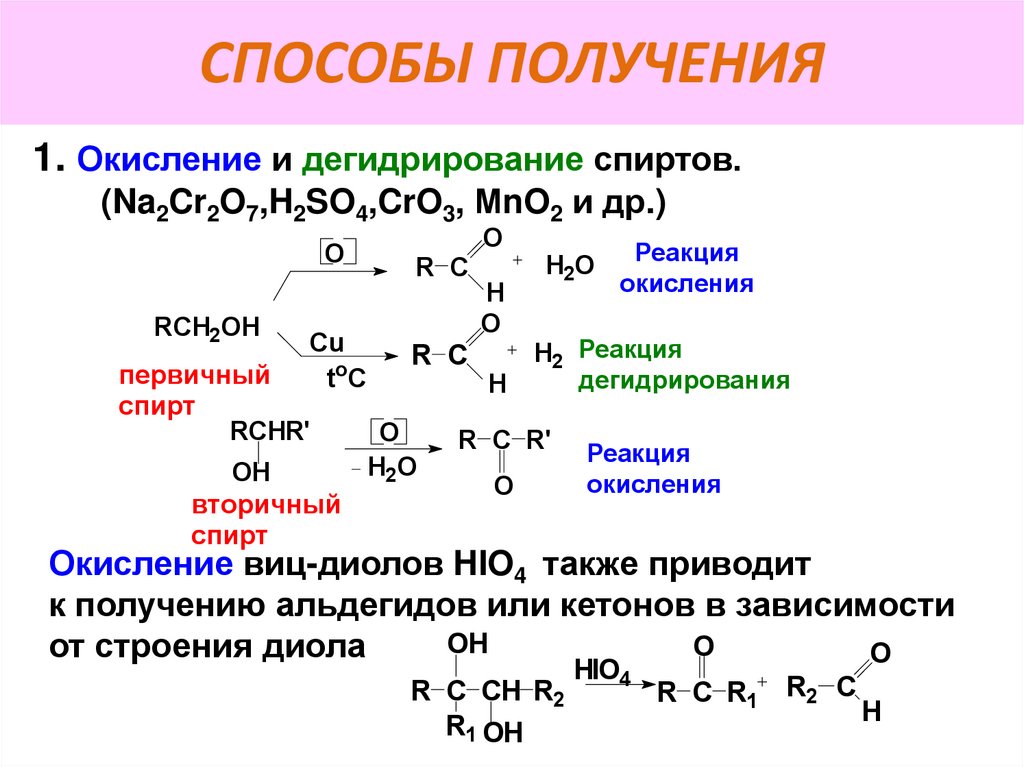
7. СПОСОБЫ ПОЛУЧЕНИЯ
1. Окисление и дегидрирование спиртов.(Na2Cr2O7,H2SO4,CrO3, МnO2 и др.)
O
RCH2OH
Cu
t oC
первичный
спирт
RCHR'
OH
вторичный
спирт
R С
R С
O
H2O
O
H
O
H2O
Реакция
окисления
H2 Реакция
дегидрирования
H
R C R'
O
Реакция
окисления
Окисление виц-диолов HIO4 также приводит
к получению альдегидов или кетонов в зависимости
OH
O
от строения диола
O
R C CH R2
R1 OH
HIO4
R C R1
R2 C
H
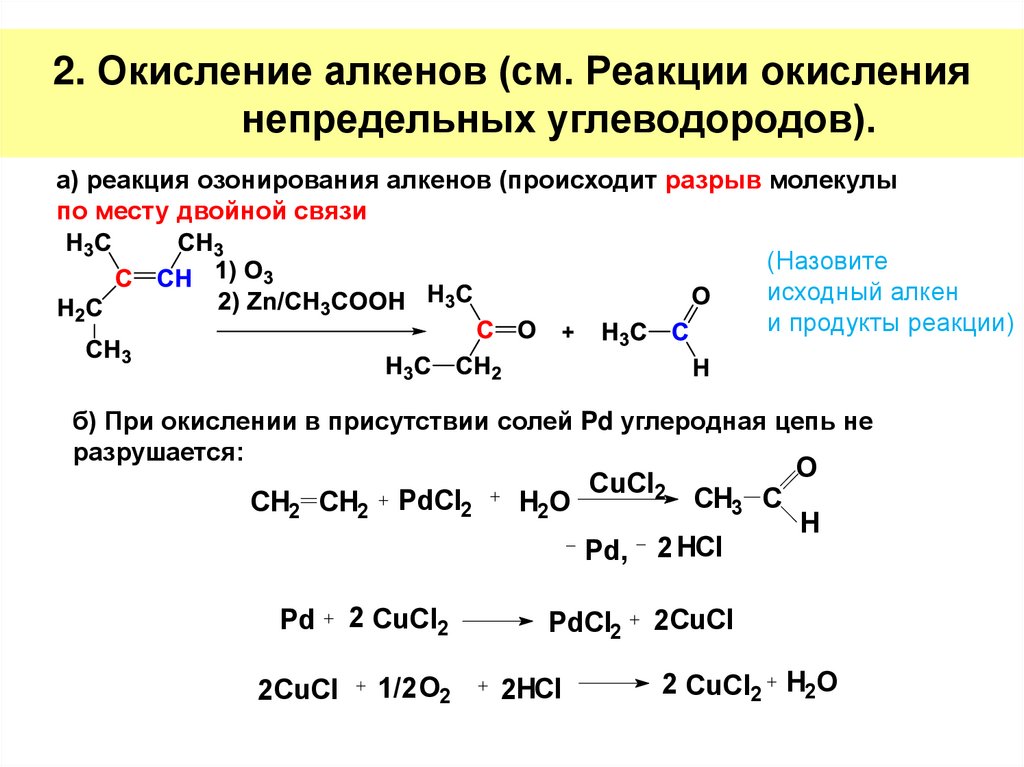
8. 2. Окисление алкенов (см. Реакции окисления непредельных углеводородов).
а) реакция озонирования алкенов (происходит разрыв молекулыпо месту двойной связи
(Назовите
исходный алкен
и продукты реакции)
б) При окислении в присутствии солей Pd углеродная цепь не
разрушается:
CH2 CH2
PdCl2
Pd
2 CuCl2
2 CuCl
1/2 O2
H2O
CuCl2
CH3 С
Pd,
2 HCl
PdCl2
2 CuCl
2HCl
O
H
2 CuCl2 H2O
9. 3. Восстановление производных карбоновых кислот:
• 3.1.По Розенмунду:R С
O
O
HCl
H2 Pd/BaSO R С
4
H
Cl
•3.2.По Стефану:
NH H2O/H
SnCl2/HCl
R С
R C N
NH3
SnCl4
H
R С
O
H
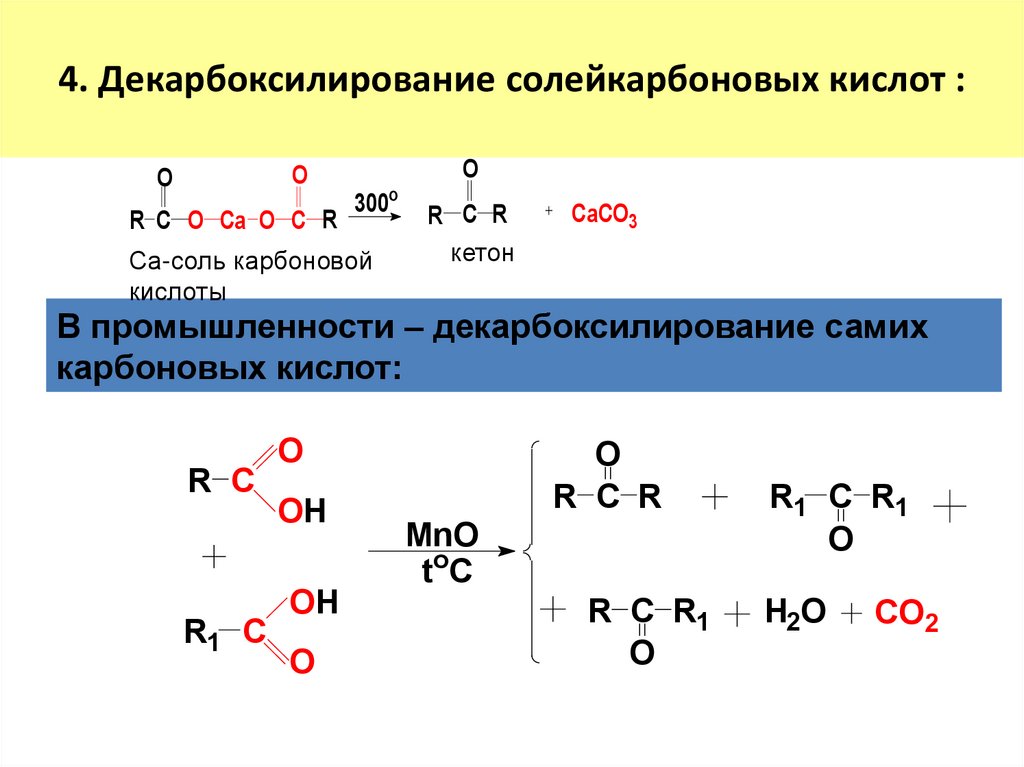
10. 4. Декарбоксилирование солейкарбоновых кислот :
OO
R C O Ca O C R
300o
Са-соль карбоновой
кислоты
O
R C R
кетон
CaCO3
В промышленности – декарбоксилирование самих
карбоновых кислот:
R C
R1 C
O
OH
OH
O
O
R C R
MnO
toC
R C R1
O
R1 C R1
O
H2O
CO2
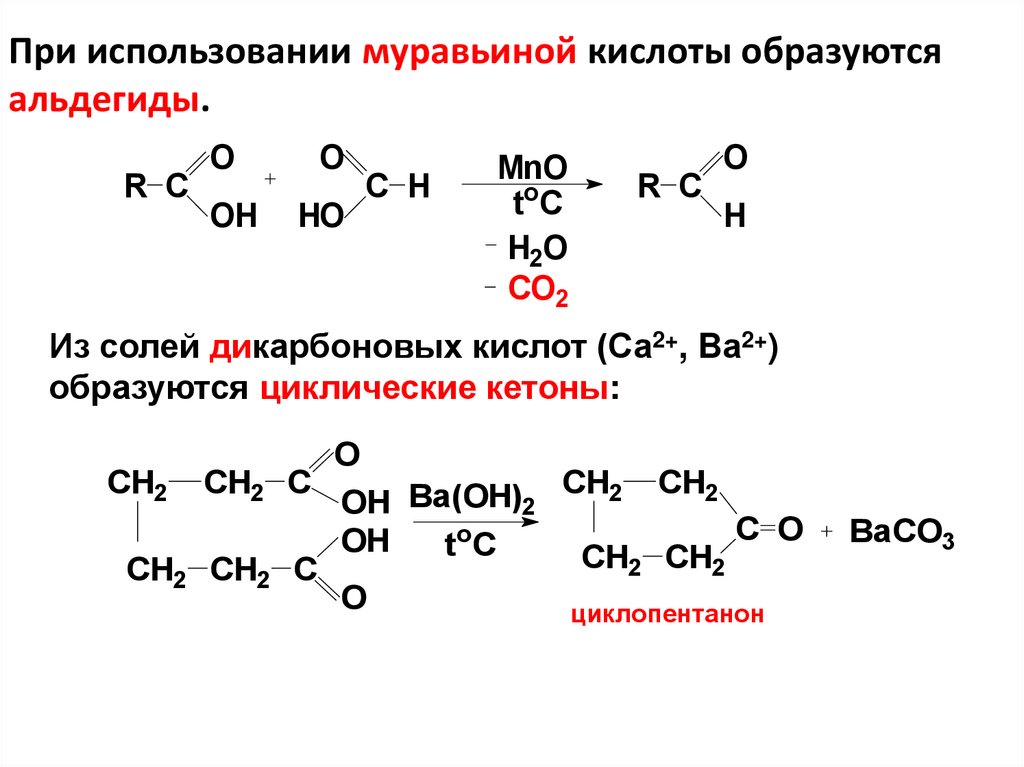
11. При использовании муравьиной кислоты образуются альдегиды.
R CO
O
OH
HO
C H
MnO
toC
H2O
CO2
R C
O
H
Из солей дикарбоновых кислот (Са2+, Bа2+)
образуются циклические кетоны:
CH2
CH2 C
CH2 CH2
O
CH2 CH2
Ba(OH)
OH
2
C O
OH
toC
CH2 CH2
C
O
циклопентанон
BaCO3
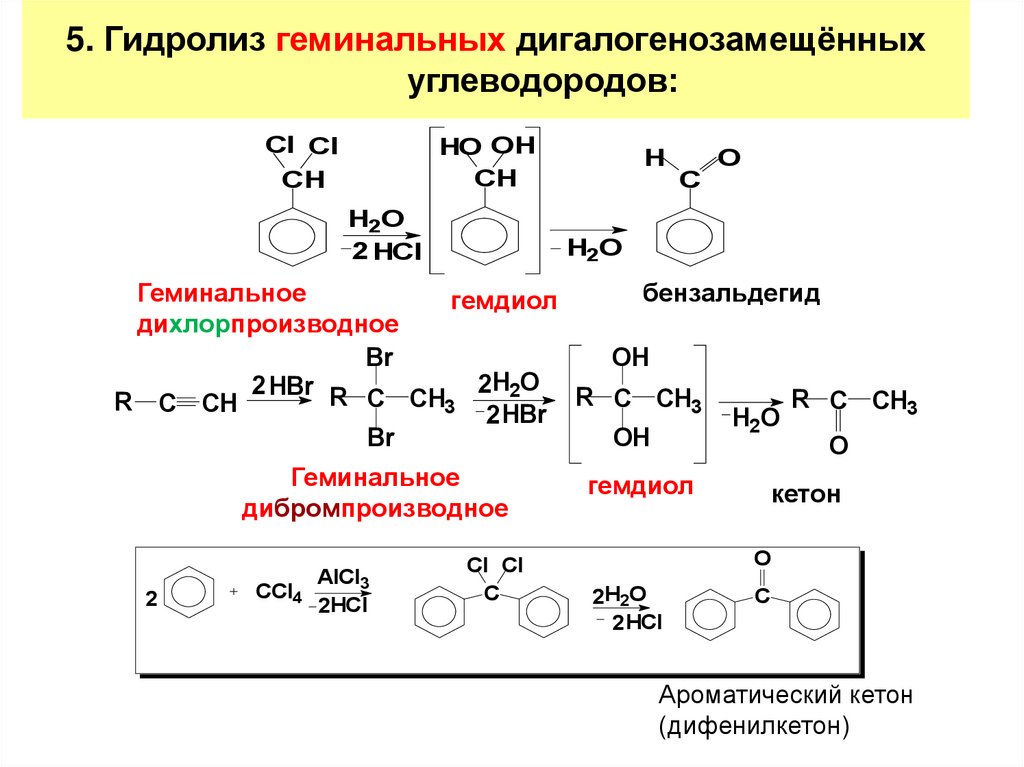
12. 5. Гидролиз геминальных дигалогенозамещённых углеводородов:
Cl ClCH
HO OH
CH
H2O
2 HCl
H
C
O
H2O
Геминальное
бензальдегид
гемдиол
дихлорпроизводное
Br
OH
2 HBr R C CH 2H2O R C CH
R C CH3
R C CH
3
3
2 HBr
H2O
Br
OH
O
Геминальное
дибромпроизводное
2
CCl4
AlCl3
2HCl
Cl Cl
C
гемдиол
кетон
O
2H2O
2 HCl
C
Ароматический кетон
(дифенилкетон)
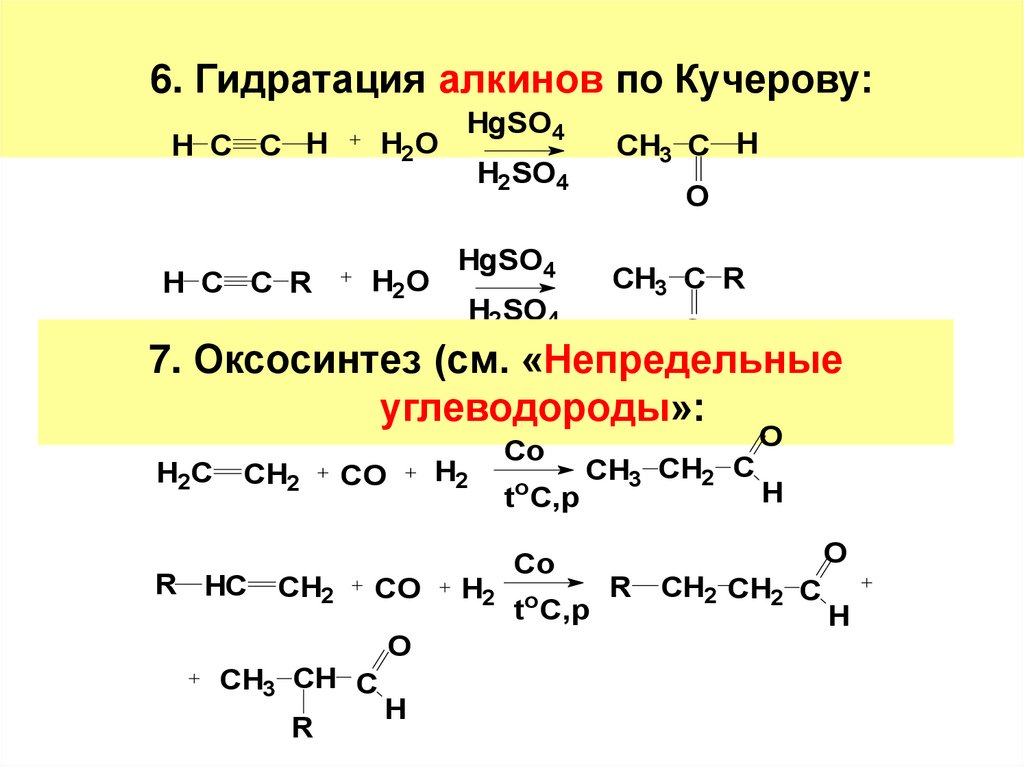
13. 6. Гидратация алкинов по Кучерову:
H C C HH C C R
H2O
H2O
HgSO4
CH3 C H
H2SO4
O
HgSO4
CH3 C R
H2SO4
O
7. Оксосинтез (см. «Непредельные
углеводороды»:
H2C
CH2
R HC
CH2
H2
CO
CO
O
CH3 CH C
R
H
H2
Co
toC,p
CH3 CH2 C
Co
o
t C,p
O
H
O
R CH2 CH2 C
H
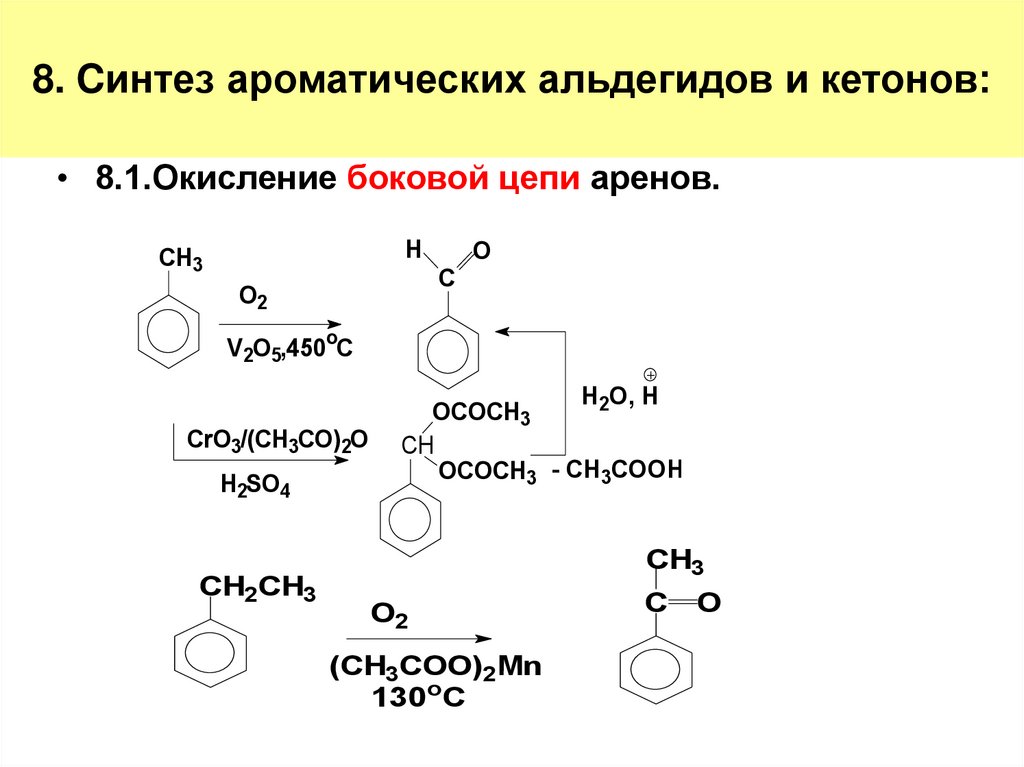
14. 8. Cинтез ароматических альдегидов и кетонов:
• 8.1.Окисление боковой цепи аренов.H
CH3
C
O2
O
V 2O5,450oC
CrO3/(CH3CO)2O
H2SO4
CH2CH3
H2O, H
OCOCH3
CH
OCOCH3 - CH3COOH
CH3
O2
(CH3COO)2Mn
130oC
C
O
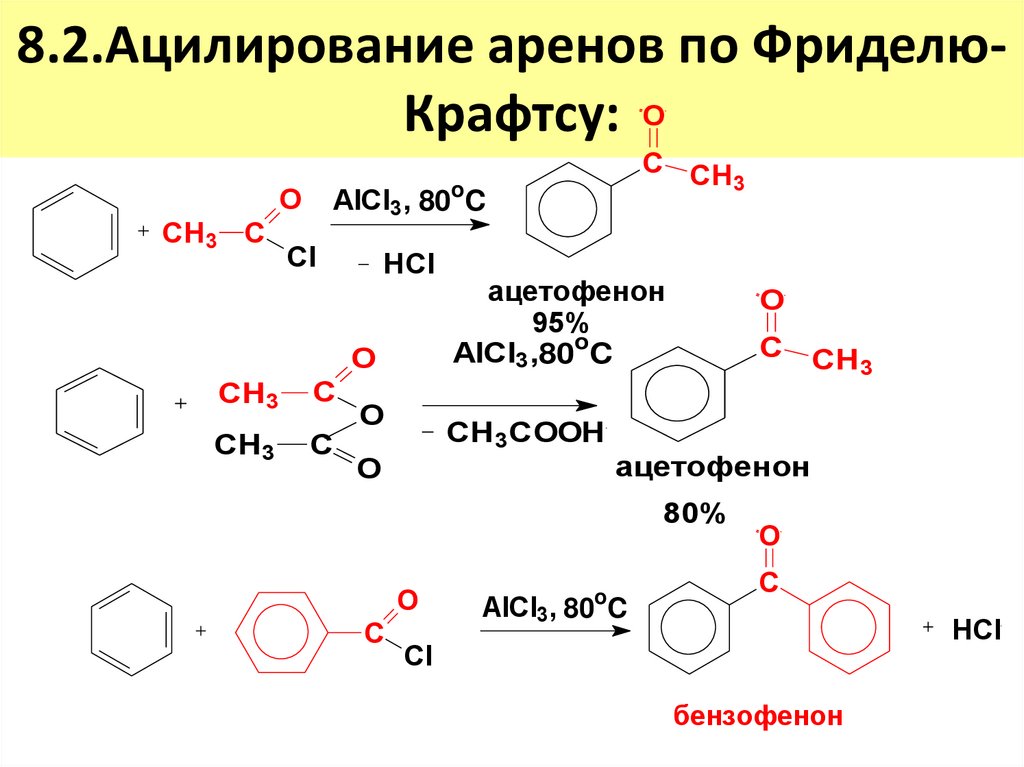
15. 8.2.Ацилирование аренов по Фриделю-Крафтсу:
8.2.Ацилирование аренов по ФриделюКрафтсу: OO
AlCl3, 80oC
Cl
HCl
CH3 C
O
CH3
C
CH3
C
O
C CH
3
ацетофенон
95%
AlCl3,80oC
CH 3COOH
O
O
C
ацетофенон
80%
O
C
o
CH3
AlCl3, 80 C
O
C
HCl
Cl
бензофенон
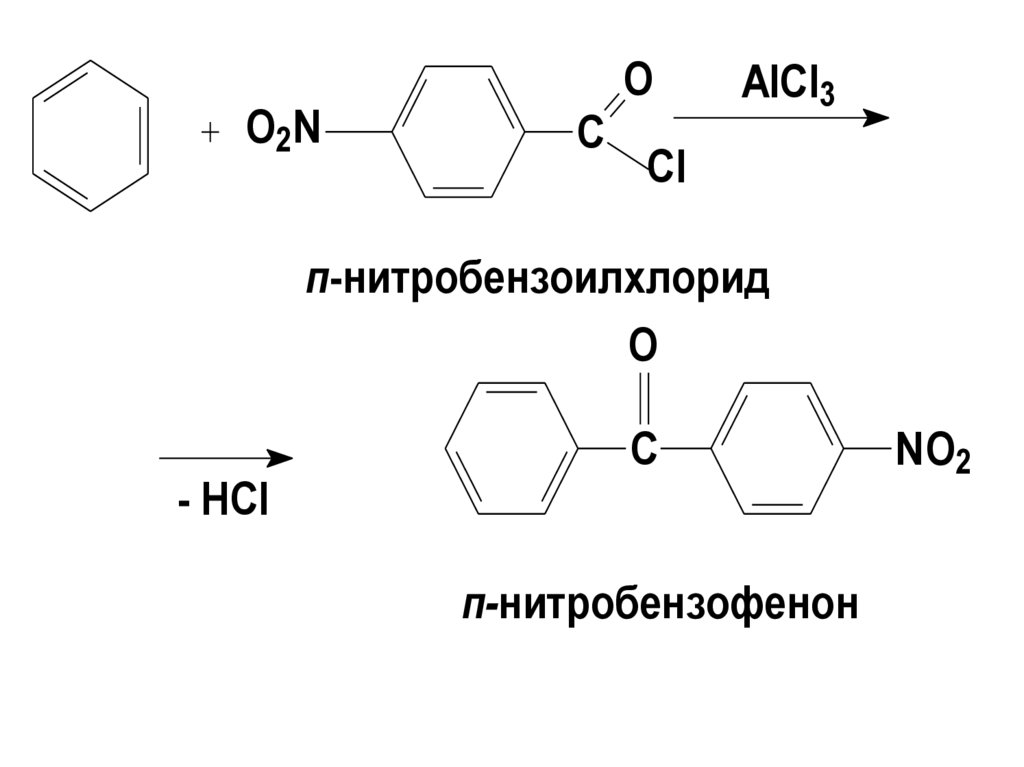
16.
Ацилированию подвергаются только активныеарены.
Реакцию можно провести также с
галогенобензолами, но при наличии сильных
акцепторных заместителей -
нельзя:
NO2
O
C
Cl
AlCl3
17.
O2NO
C
AlCl3
Cl
п-нитробензоилхлорид
O
- HCl
C
п-нитробензофенон
NO2
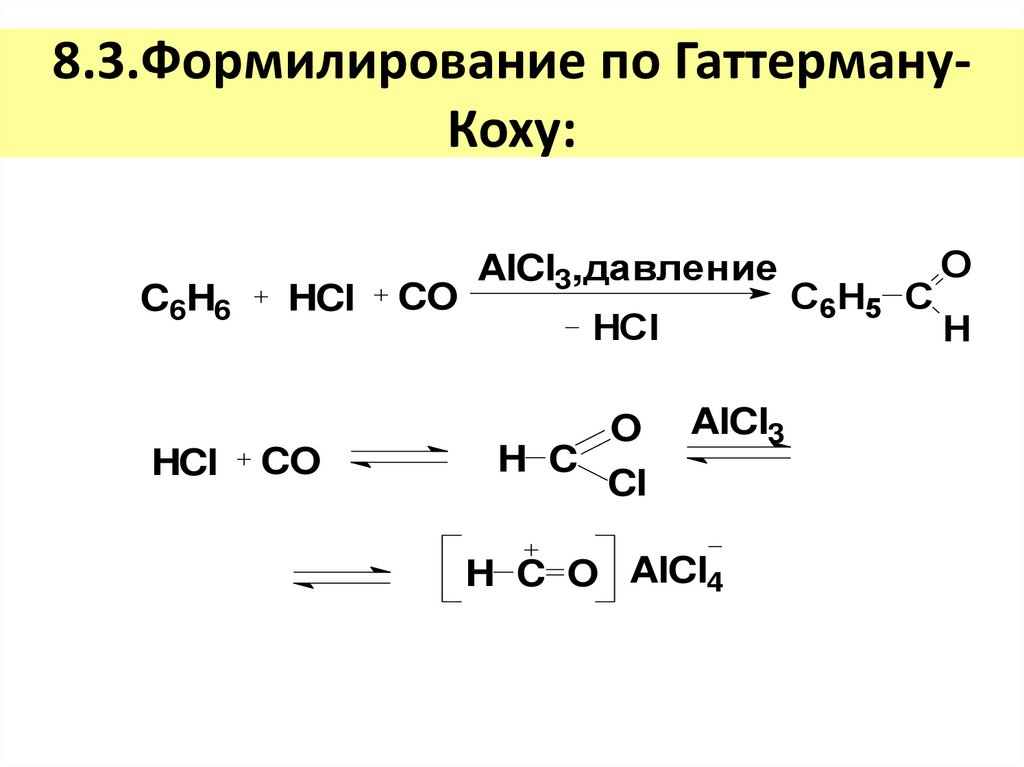
18. 8.3.Формилирование по Гаттерману-Коху:
8.3.Формилирование по ГаттермануКоху:C6H6
HCl
HCl
CO
CO
AlCl3,давление
HCl
O
H C
Cl
AlCl3
H C O AlCl4
С6H5 C
O
H
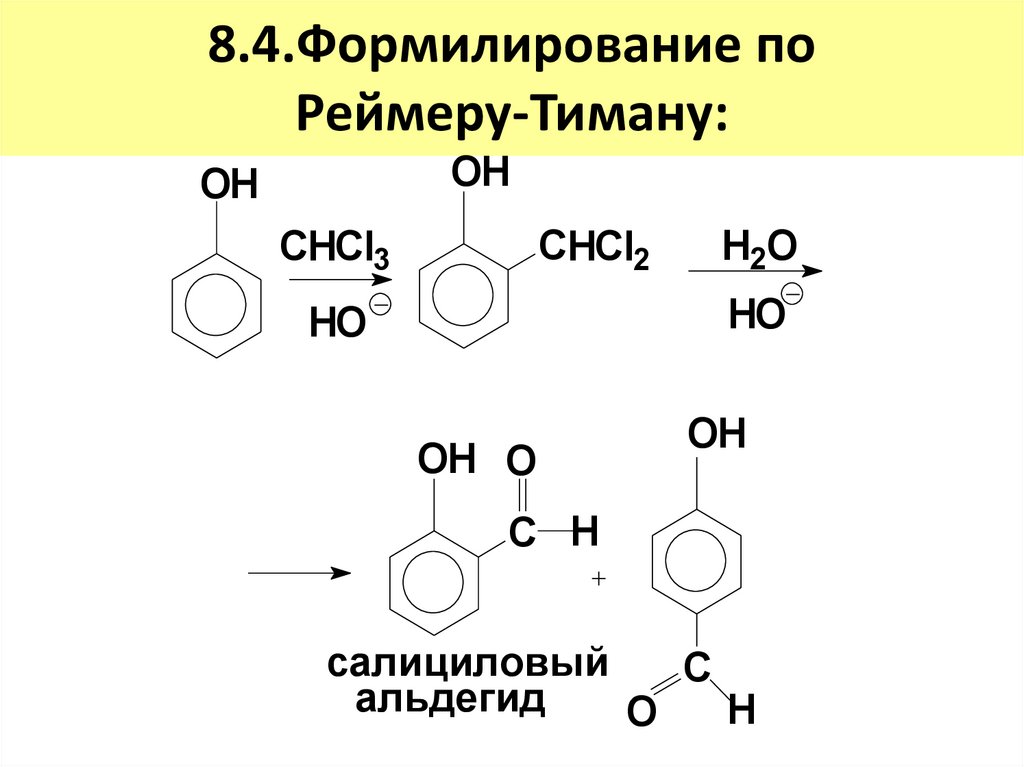
19. 8.4.Формилирование по Реймеру-Тиману:
OHOH
СHCl2
СHCl3
H2O
HO
HO
OH O
OH
С H
салициловый
C
альдегид
H
O
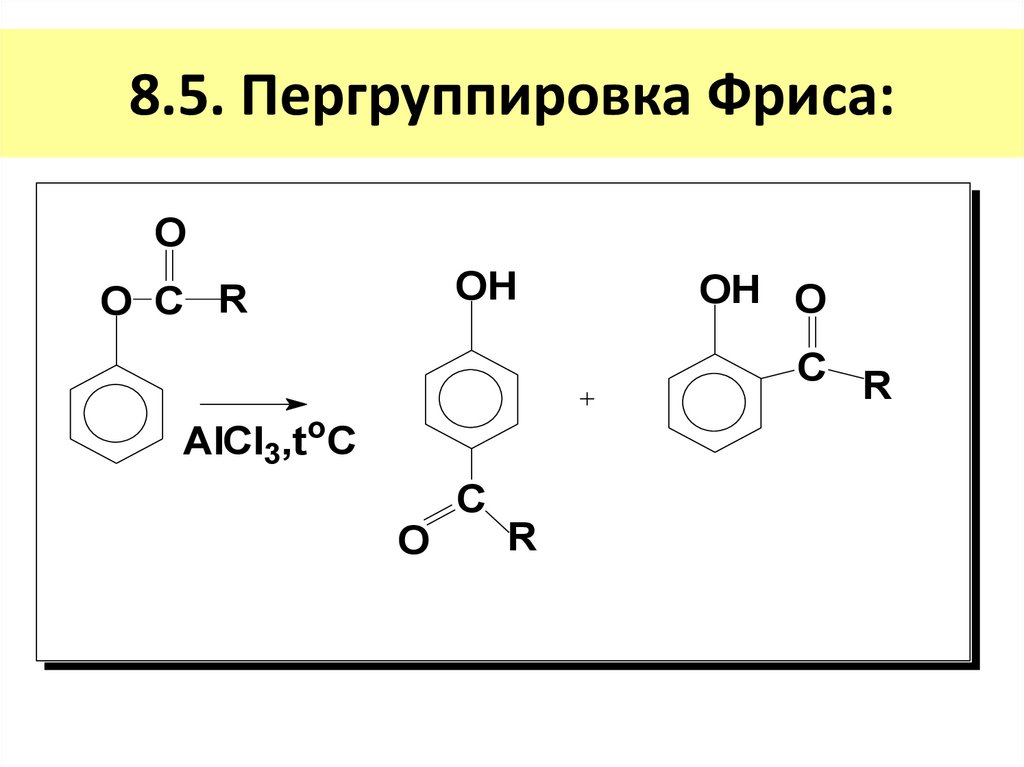
20. 8.5. Пергруппировка Фриса:
OOH
O C R
OH O
C R
AlCl3,toC
O
C
R
21. ФИЗИЧЕСКИЕ СВОЙСТВА
•Низшие алифатические альдегиды икетоны, кроме газообразного формальдегида, являются подвижными жидкостями.
•Первые представители (формальдегид,
ацетальдегид, ацетон) растроримы в воде за
счет образования с ней водородных связей. С
увеличением R раств-сть снижается,
ароматические плохо растворимы.
•Альдегиды и кетоны имеют более низкие
• Т. кип. , чем спирты и кислоты, так как не
образуют ассоциатов.
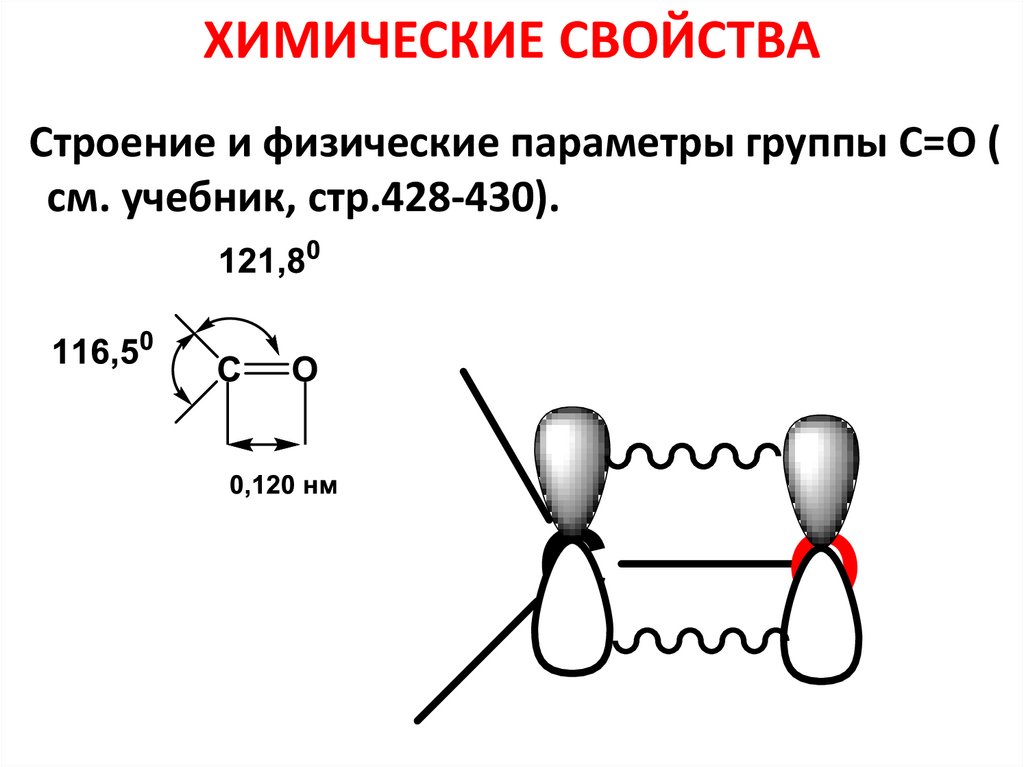
22. ХИМИЧЕСКИЕ СВОЙСТВА
Строение и физические параметры группы С=О (см. учебник, стр.428-430).
O
23. Отличие С=О связи от С=С связи
• Отличие С=О связи от С=С связи – еёвысокая полярность.
• Е связи С=О>Е связи С=С,
• длина связи меньше (0,121нм<0,134
нм).
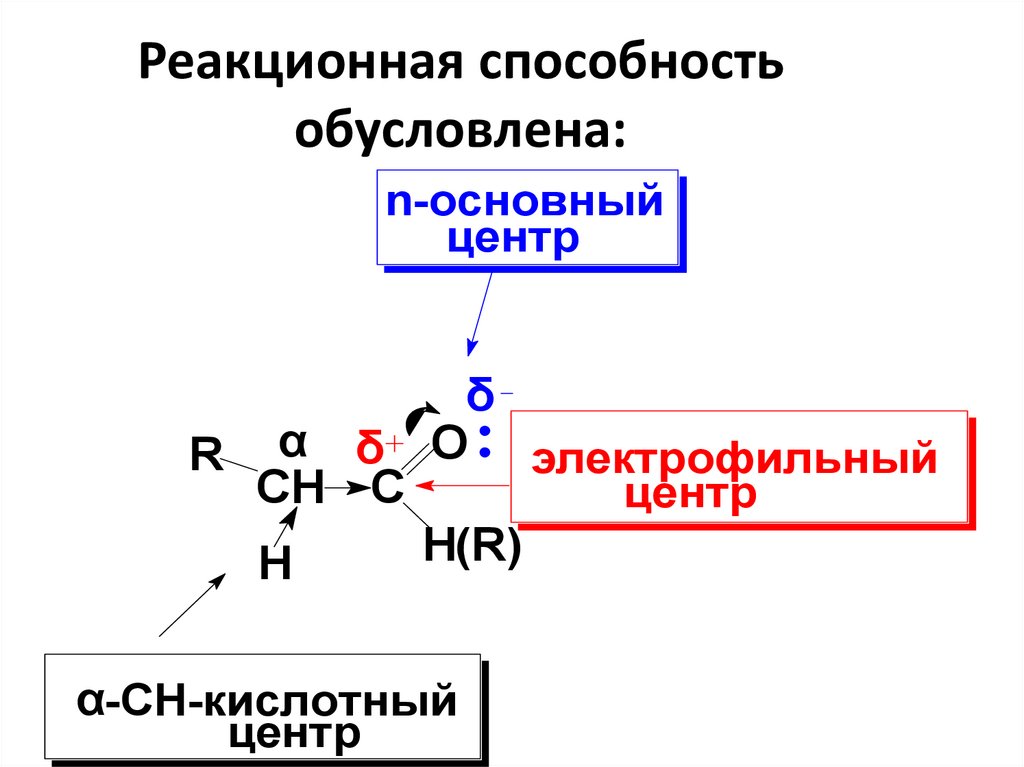
24. Реакционная способность обусловлена:
n-основныйцентр
δ
R α δ O электрофильный
CH C
центр
H(R)
H
α-СН-кислотный
центр
25.
26.
• Электрофильный центр участвует вреакциях нуклеофильного
присоединения (AN);
• Основный центр присоединяет протон и
кислоты Льюиса в условиях кислотного
катализа в реакциях присоединения, а
также процессах енолизации;
27.
• α- СН-кислотный центр – при егоучастии протекают многие реакции, в
частности реакции конденсации.
• Связь С-Н в альдегидной группе
разрывается при окислении.
• Ненасыщенные и ароматические
карбонильные соединения
реагируют по С=С и Ar-ядру.
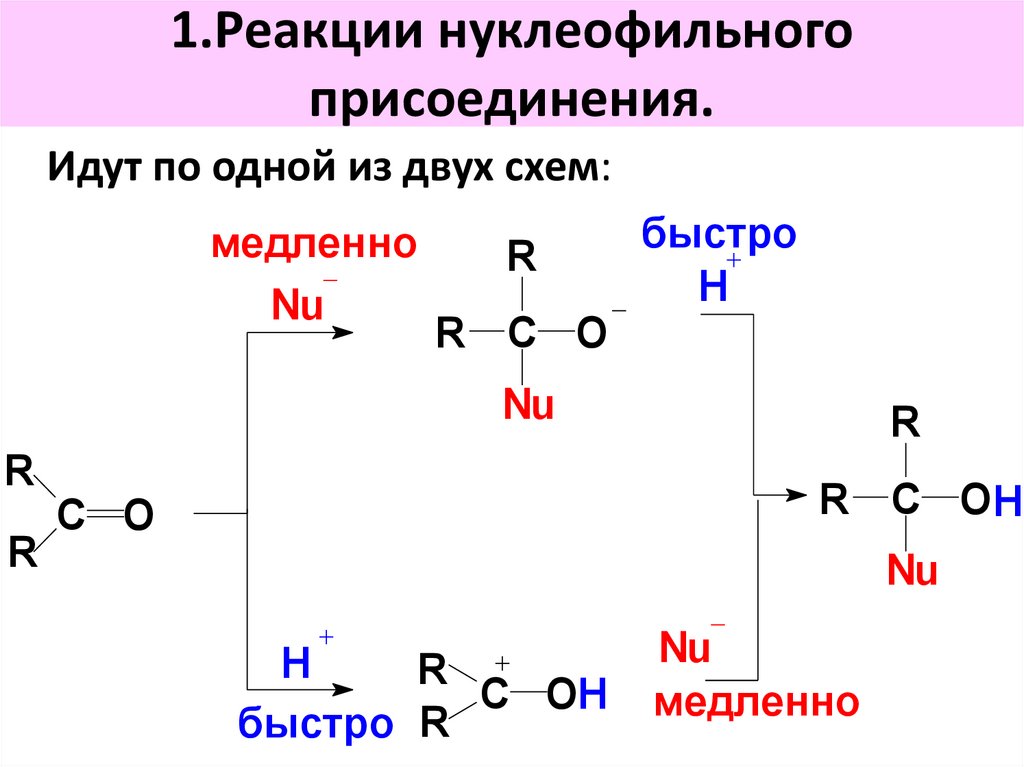
28. 1.Реакции нуклеофильного присоединения.
Идут по одной из двух схем:медленно
Nu
R
R C O
быстро
H
Nu
R
R
R
R C OH
С O
Nu
H
R
C OH
быстро R
Nu
медленно
29.
• Большинство реакций AN обратимы.• ЭА заместители в R повышают
реакционную способность
карбонильных соединений, ЭД
снижают её.
• Кетоны менее реакционноспособны,
чем альдегиды, так как присутствует
электронодонорное влияние двух R,
что снижает величину d+ заряда на
карбонильном С.
30.
δ OCH3 С
H
δ' O
С
H
δ > δ'
• Из-за -М эффекта карбонильной группы
ароматические альдегиды и кетоны
менее реакционноспособны, чем
алифатические.
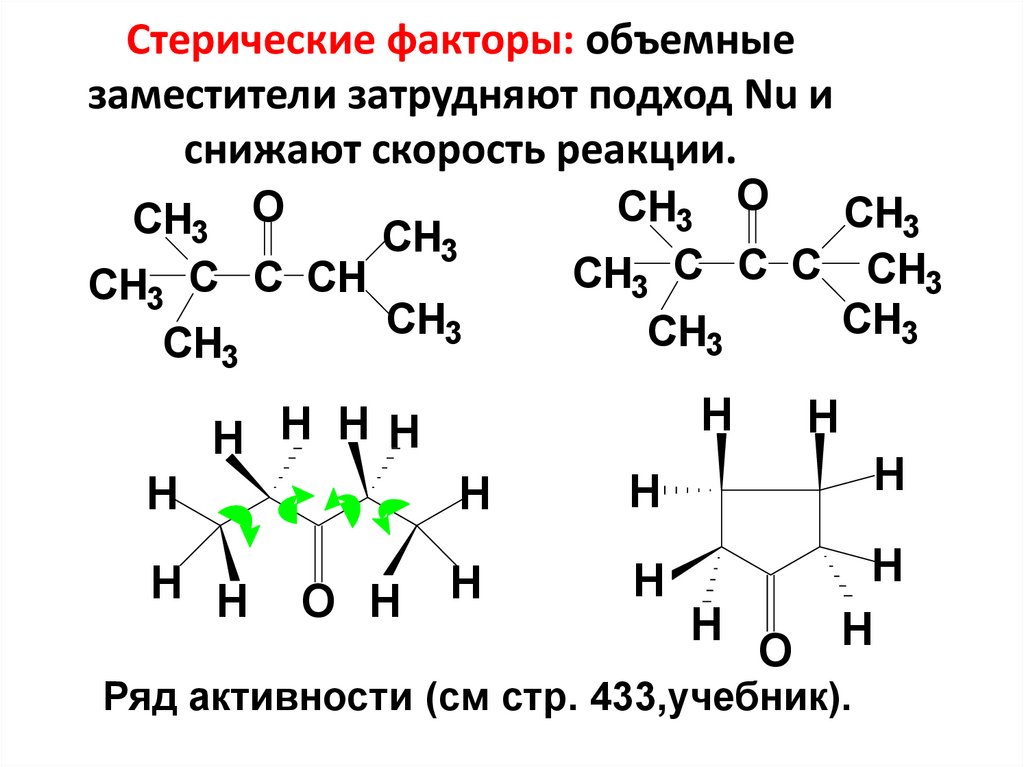
31. Стерические факторы: объемные заместители затрудняют подход Nu и снижают скорость реакции.
OCH3
CH3
CH3 C C CH
CH3
CH3
CH3 O
CH3
CH3 C C C CH3
CH3
CH
3
H
H H H H
H
H
H
H
H
H H
H
H
H
H
O H
H
O
Ряд активности (см стр. 433,учебник).
32. Природа нуклеофила определяет выбор условий реакции.
• Сильные нуклеофилы реагируют безKt, для слабых необходима активация
субстрата или реагента. Если
активируют реагент, то реакцию
осуществляют в условиях основного
Kt, если субстрат – в условиях
кислотного Kt .
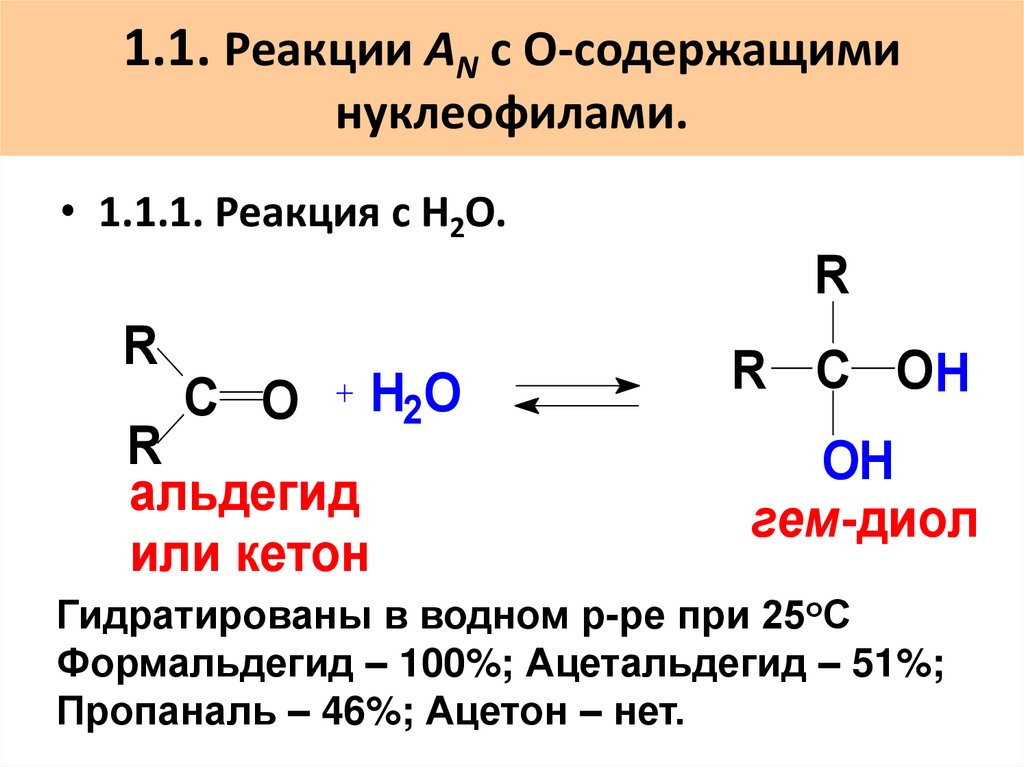
33. 1.1. Реакции AN с О-содержащими нуклеофилами.
• 1.1.1. Реакция с Н2О.R
R
С O
H2O
R
альдегид
или кетон
R C OH
OH
гем-диол
Гидратированы в водном р-ре при 25оС
Формальдегид – 100%; Ацетальдегид – 51%;
Пропаналь – 46%; Ацетон – нет.
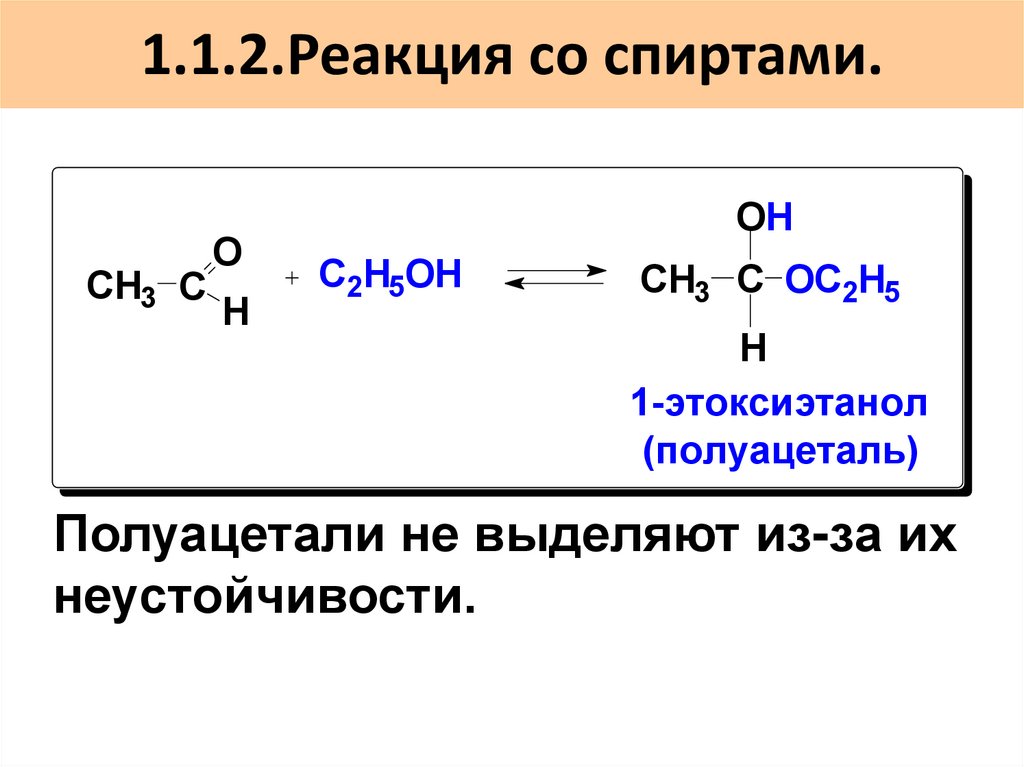
34. 1.1.2.Реакция со спиртами.
СH3 СO
H
OH
C2H5OH
CH3 C OC2H5
H
1-этоксиэтанол
(полуацеталь)
Полуацетали не выделяют из-за их
неустойчивости.
35. Исключение – циклические полуацетали из γ- и δ-гидроксиальдегидов
СO
HOH
H
C
OH
O
циклический
5-гидроксипентаналь
полуацеталь
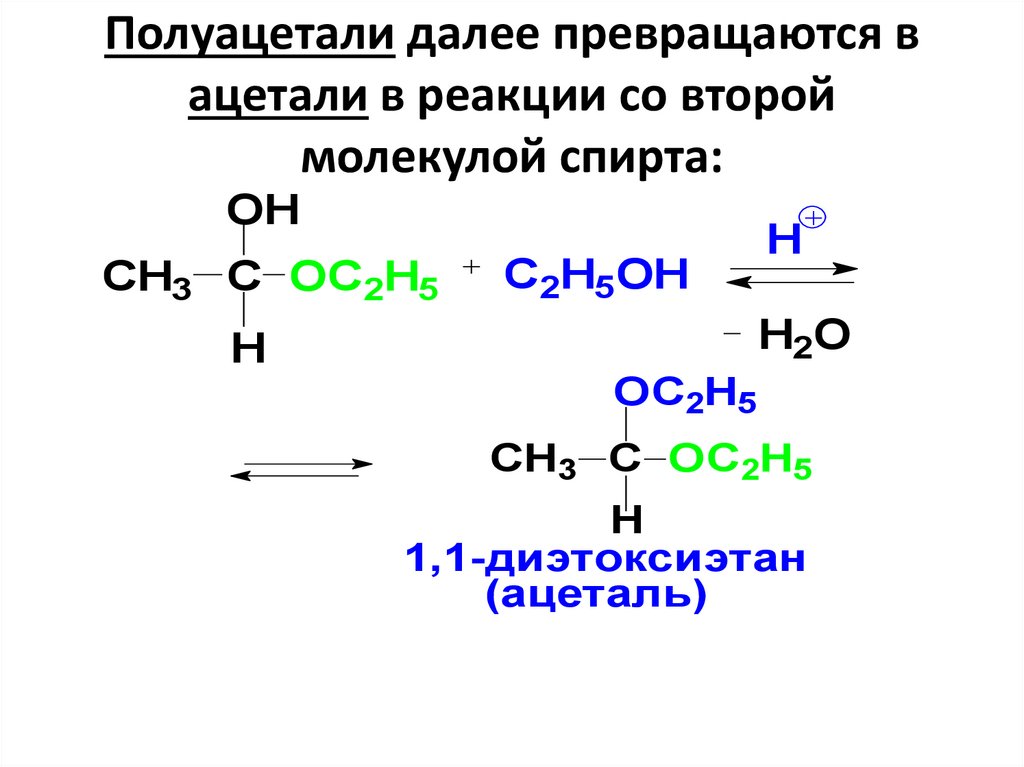
36. Полуацетали далее превращаются в ацетали в реакции со второй молекулой спирта:
OHCH3 C OC2H5
H
C2H5OH
H
H2O
OC2H5
CH3 C OC2H5
H
1,1-диэтоксиэтан
(ацеталь)
37.
• В кислой среде ацетали подвергаютсягидролизу, в щелочной – устойчивы.
Поэтому образование ацеталей –
метод защиты карбонильной группы.
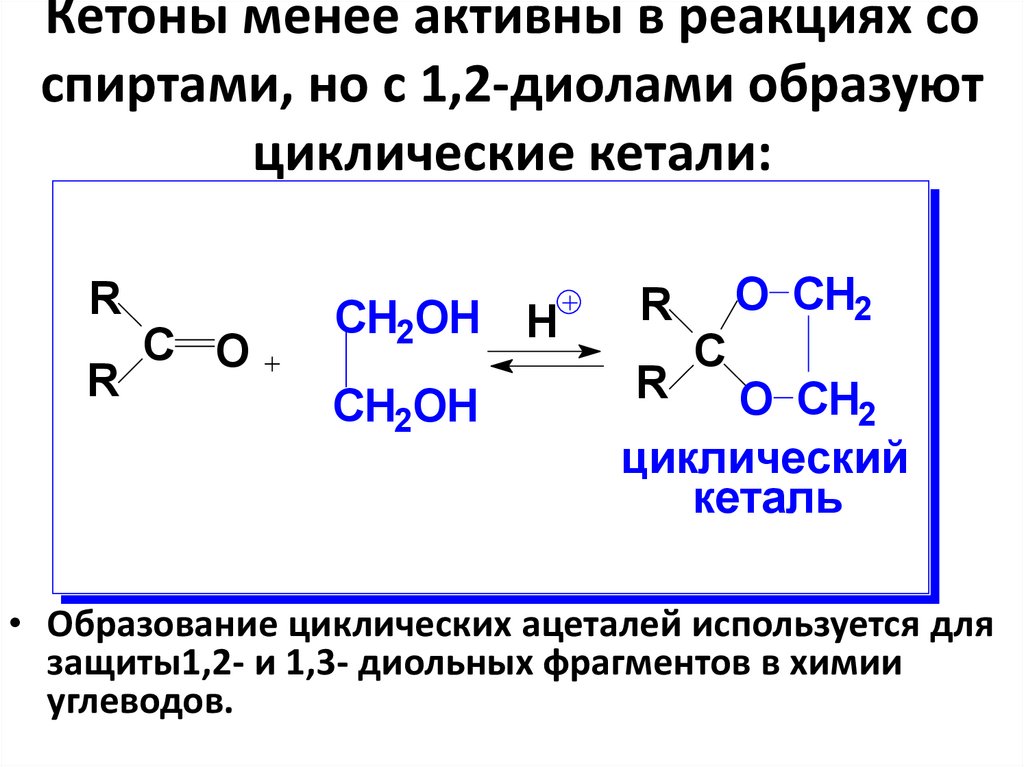
38. Кетоны менее активны в реакциях со спиртами, но с 1,2-диолами образуют циклические кетали:
RR
С O
СH2OH H
CH2OH
R
R
C
O CH2
O CH2
циклический
кеталь
• Образование циклических ацеталей используется для
защиты1,2- и 1,3- диольных фрагментов в химии
углеводов.
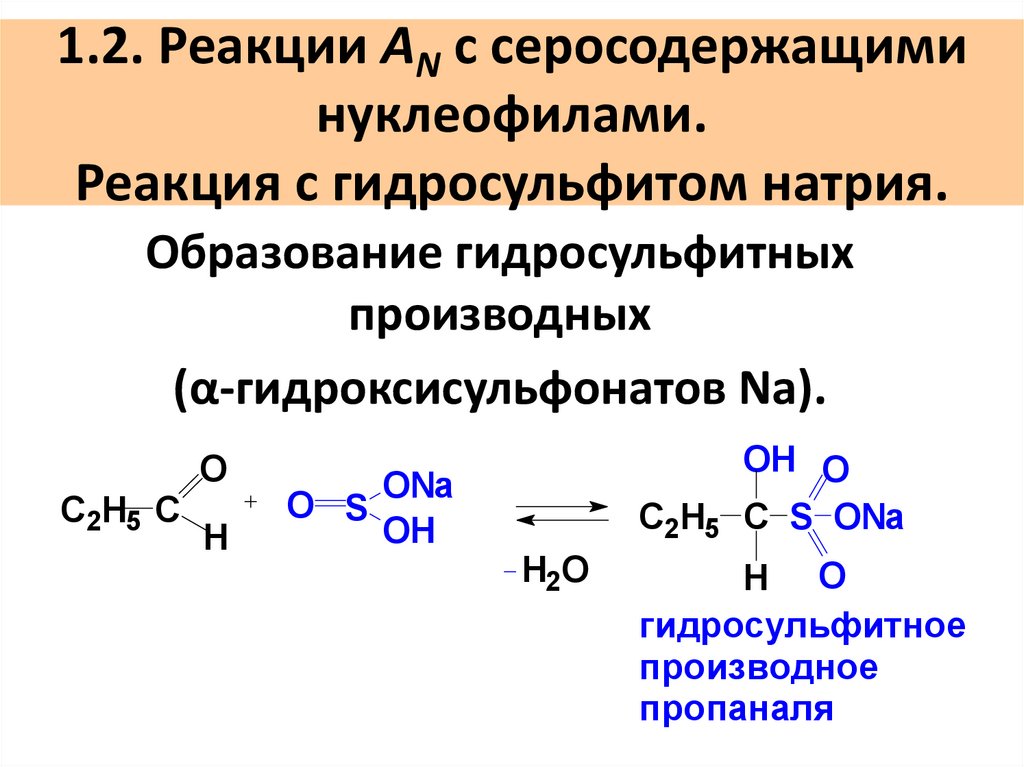
39. 1.2. Реакции AN с серосодержащими нуклеофилами. Реакция с гидросульфитом натрия.
Образование гидросульфитныхпроизводных
(α-гидроксисульфонатов Na).
С2H5 C
O
H
O S
ONa
OH
OH O
C2H5 C S ONa
H2O
H O
гидросульфитное
производное
пропаналя
40.
• Под действием кислот или содыбисульфитное производное
• разлагается с выделением исходного
карбонильного соединения.
• Реакция используется для выявления
альдегидов и метилкетонов,
• а также для очистки альдегидов.
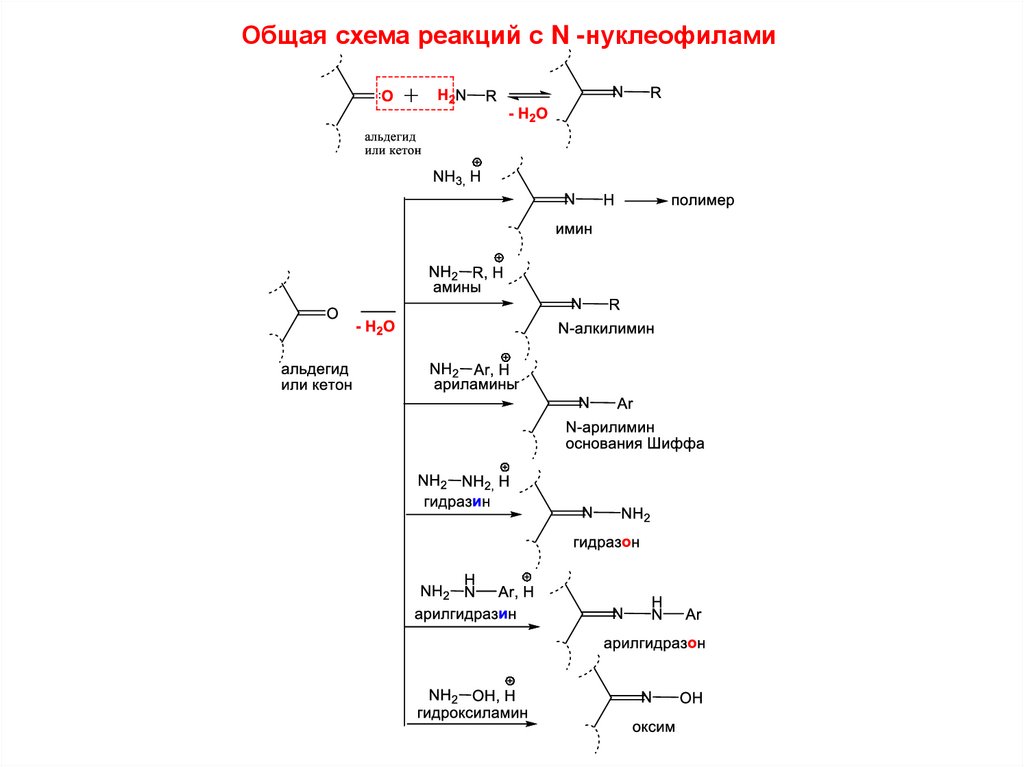
41. 1.3.Реакции AN с азотсодержащими нуклеофилами.
• Нуклеофилы:аммиак
NH3
амины R NH2
гидразин NH2NH2
арилгидразины NH2 NH Ar
гидроксиламин и др. NH2OH
42.
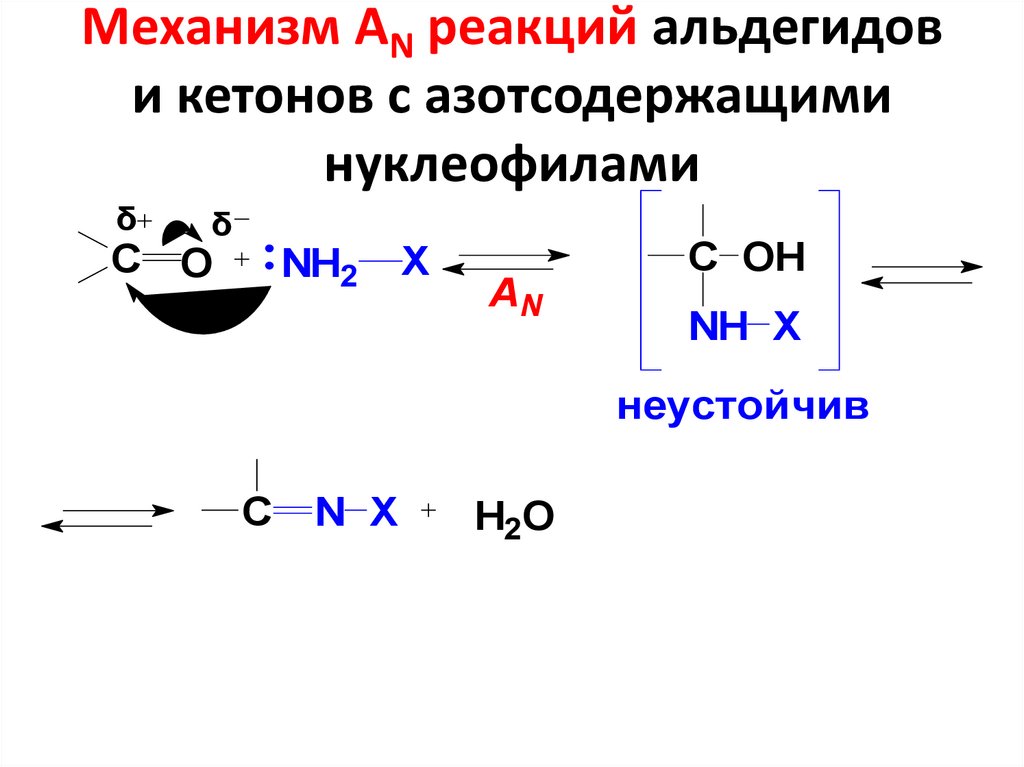
Общая схема реакций с N -нуклеофилами43. Механизм АN реакций альдегидов и кетонов с азотсодержащими нуклеофилами
δδ
С O
NH2
X
AN
С OH
NH X
неустойчив
C
N X
H2O
44.
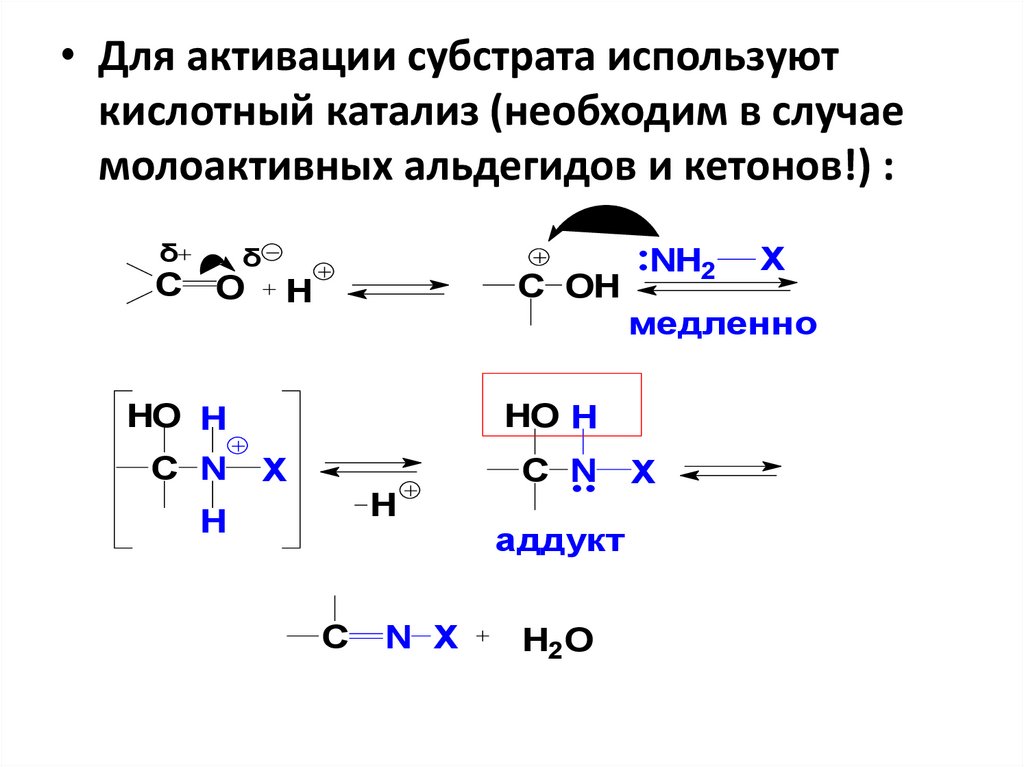
• Для активации субстрата используюткислотный катализ (необходим в случае
молоактивных альдегидов и кетонов!) :
δ
С
δ
O
С OH
H
X
медленно
HO H
С N
NH2
HO H
X
H
H
C
N X
С N X
аддукт
H2O
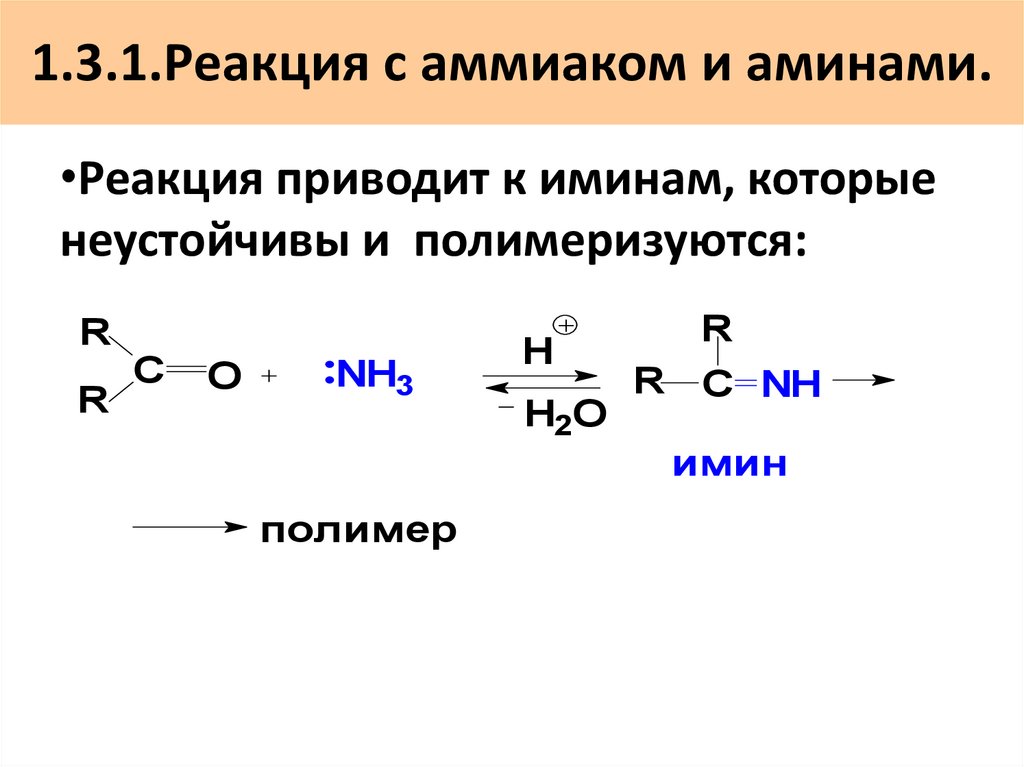
45. 1.3.1.Реакция с аммиаком и аминами.
•Реакция приводит к иминам, которыенеустойчивы и полимеризуются:
R
R
С
O
NH3
H
H2O
R
R C NH
имин
полимер
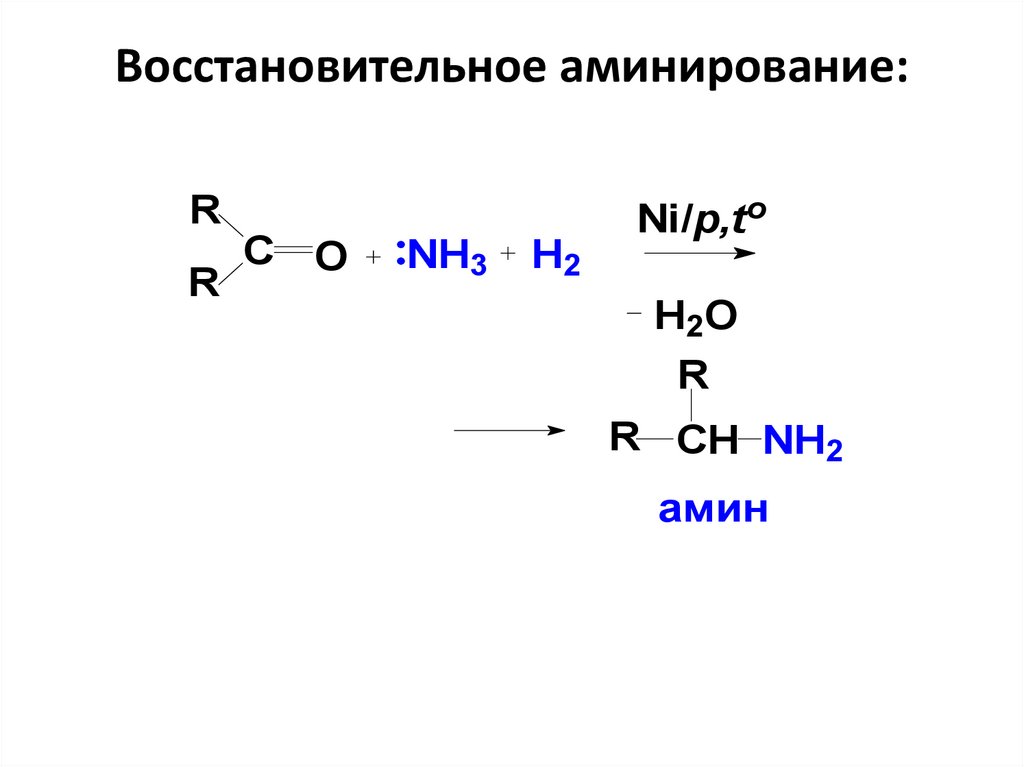
46. Восстановительное аминирование:
RR
С O
NH3
H2
Ni/p,to
H2O
R
R CH NH2
амин
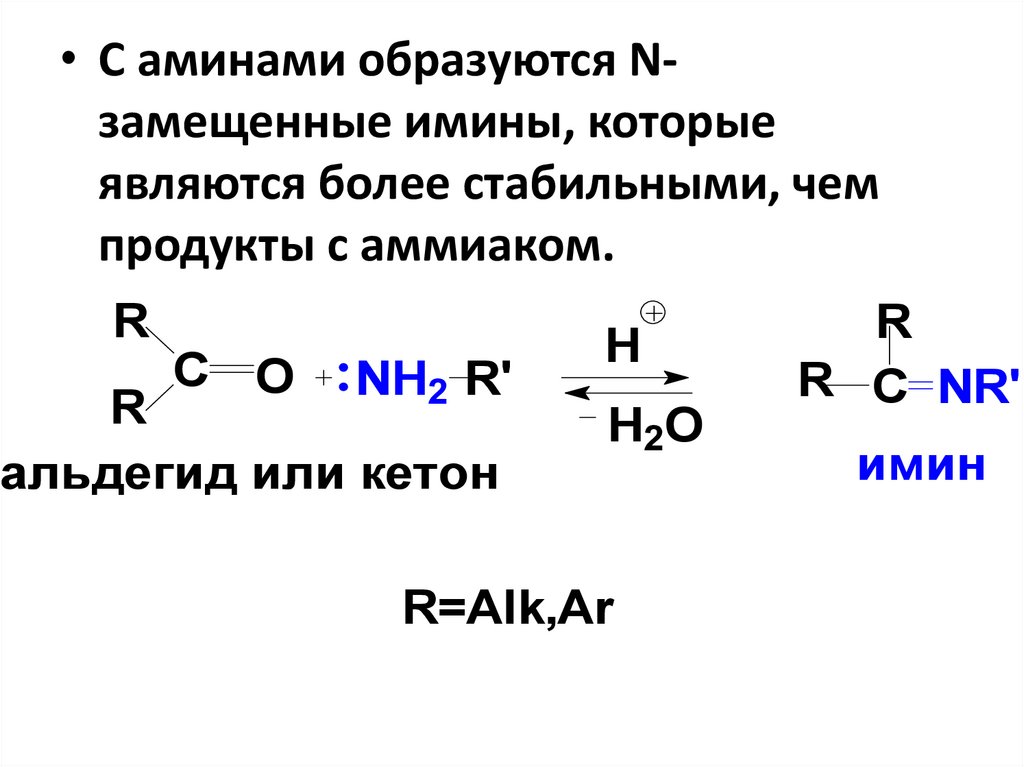
47.
• С аминами образуются Nзамещенные имины, которыеявляются более стабильными, чем
продукты с аммиаком.
R
С O
NH2 R'
R
альдегид или кетон
H
H2O
R=Alk,Ar
R
R C NR'
имин
48.
• Соединения, содержащие хотя бы одинAr-заместитель обладают большей
устойчивостью – их называют основания
Шиффа.
С
O
H
NH2
H2O
СH N
бензальанилин
49.
• Гидролиз замещенных иминов вкислой среде приводит к регенерации
исходных альдегида и амина.
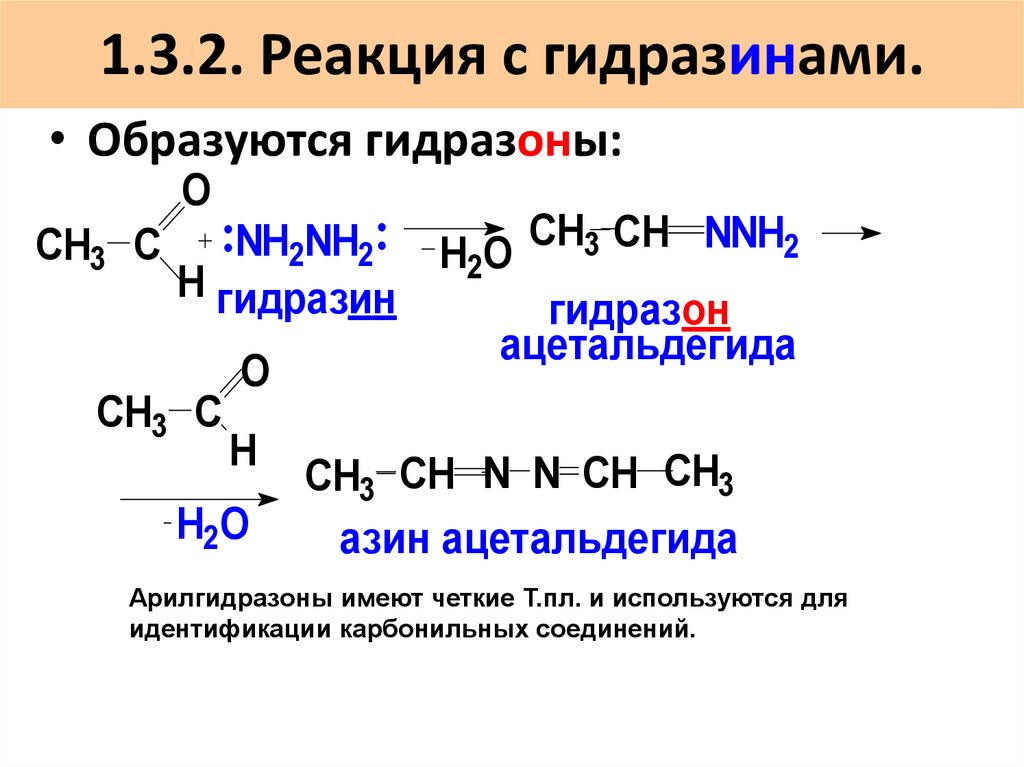
50. 1.3.2. Реакция с гидразинами.
• Образуются гидразоны:O
NH2NH2 H O СH3 CH NNH2
2
H гидразин
гидразон
ацетальдегида
O
CH3 С
H
СH3 CH N N CH CH3
H2O
азин ацетальдегида
CH3 С
Арилгидразоны имеют четкие Т.пл. и используются для
идентификации карбонильных соединений.
51.
NO2CH3
CH3
C
N
NH
NO2
2,4-динитрофенилгидразон
ацетона
Т.пл. 126 оС
СН
NHNHC6H5
фенилгидразон
бензальдегида
Т.пл. 158 оС
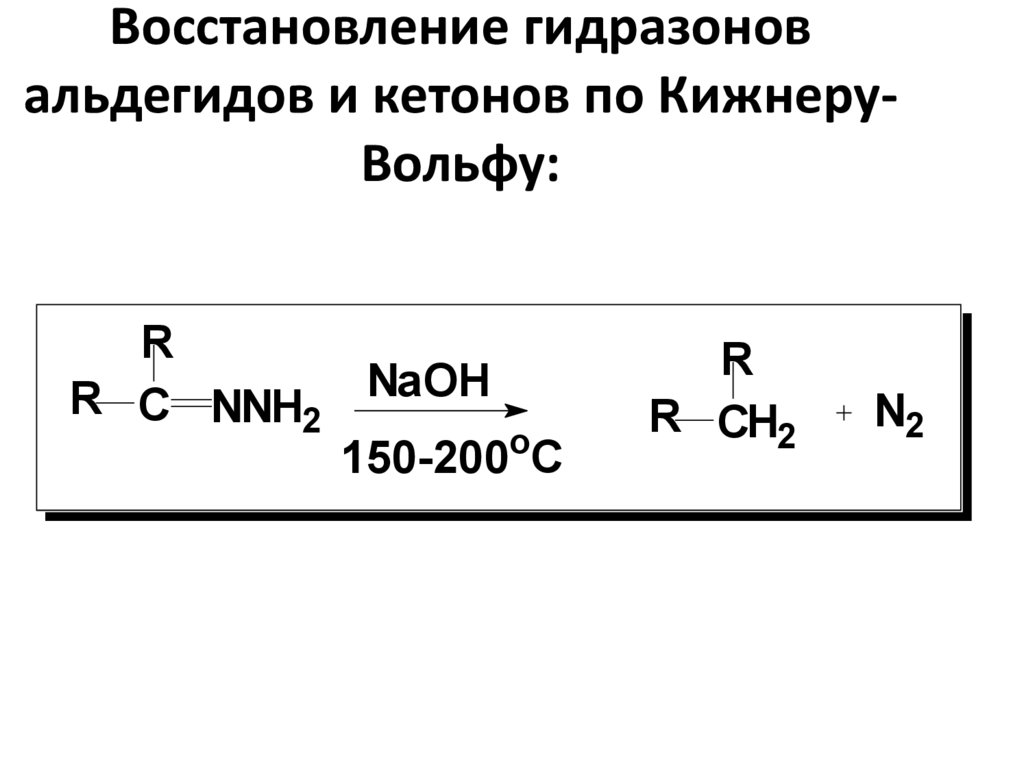
52. Восстановление гидразонов альдегидов и кетонов по Кижнеру-Вольфу:
Восстановление гидразоновальдегидов и кетонов по КижнеруВольфу:
R
R C NNH2 NaOH
o
150-200 C
R
R CH2
N2
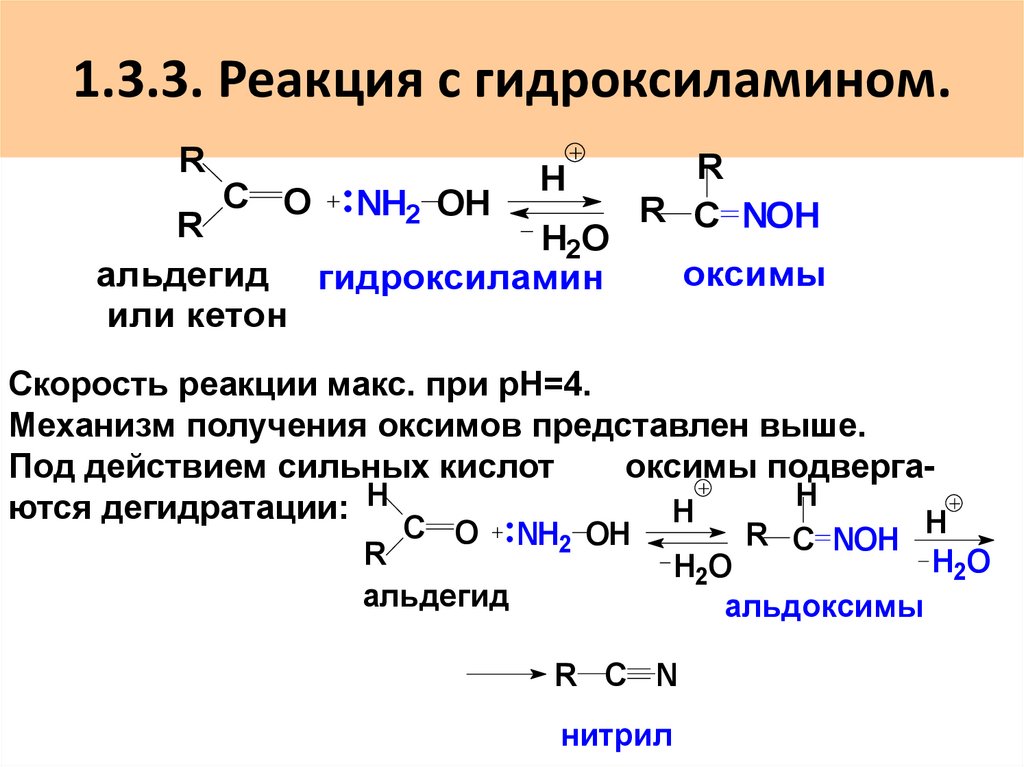
53. 1.3.3. Реакция с гидроксиламином.
RH
С O
NH2 OH
R
H2O
альдегид гидроксиламин
или кетон
R
R C NOH
оксимы
Скорость реакции макс. при рН=4.
Механизм получения оксимов представлен выше.
Под действием сильных кислот
оксимы подвергаH
ются дегидратации: H
H
H
С O
R
альдегид
NH2 OH
H2O
H2O
альдоксимы
R C N
нитрил
R C NOH
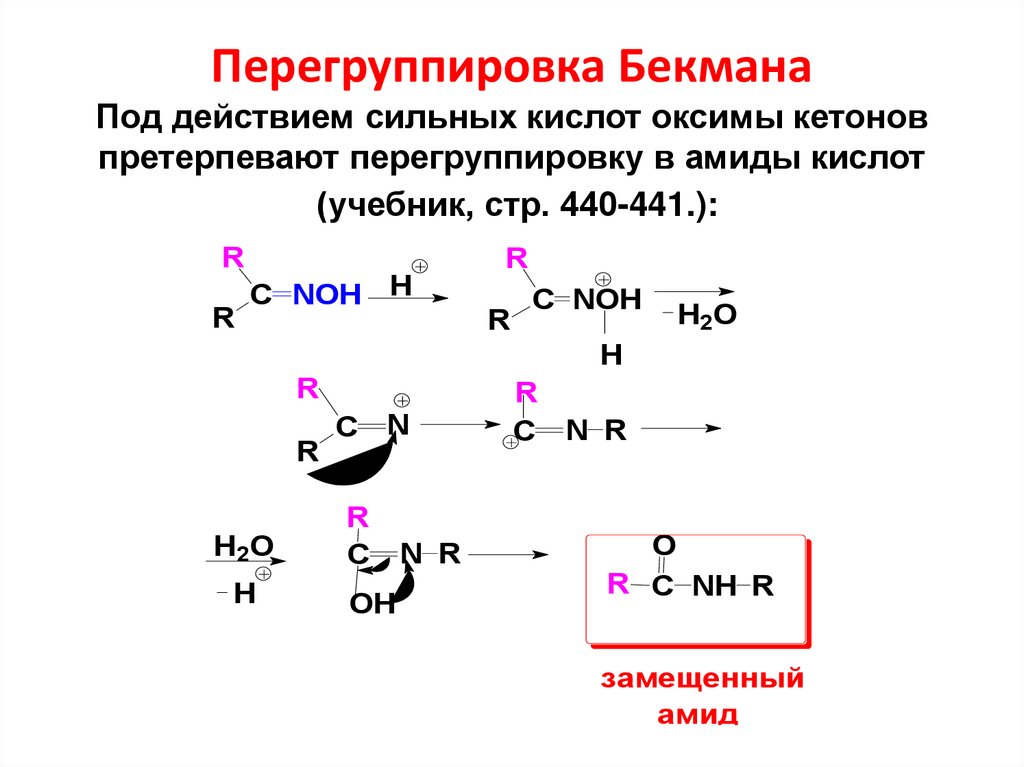
54. Перегруппировка Бекмана Под действием сильных кислот оксимы кетонов претерпевают перегруппировку в амиды кислот (учебник, стр.
440-441.):R
R
C NOH H
R
R
C NOH
H2O
H
R
C
N
H2O
R
C
N R
H
OH
R
R
C N R
O
R C NH R
замещенный
амид
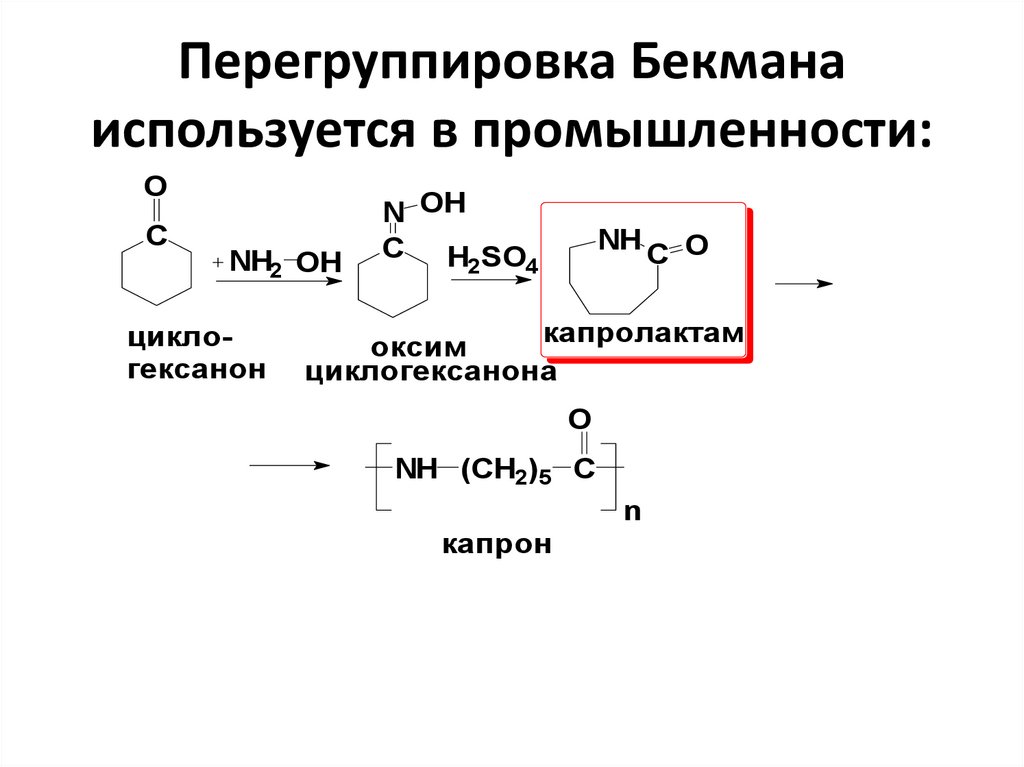
55. Перегруппировка Бекмана используется в промышленности:
OC
NН2 OH
циклогексанон
N OH
C H SO
2
NH
4
C O
капролактам
оксим
циклогексанона
O
NH (CH2)5 C
n
капрон
56. 1.4. Реакции AN с углерод-содержащими нуклеофилами.
1.4. Реакции AN с углеродсодержащими нуклеофилами.1.4.1. Реакция с HCN.
Приводит к образованию гидроксинитрилов
(ЦИАНГИДРИНОВ) и позволяет удлинить С-цепь
HO R OH
R
на один атом:
C
R'
С O
HC N
Реакция используется для получения
α-гидроксикарбоновых кислот:
R
H
OH
C
C N
H2O
p,to
NH3
C N
R'
оксинитрил
(циангидрин)
HO
R CH COOH
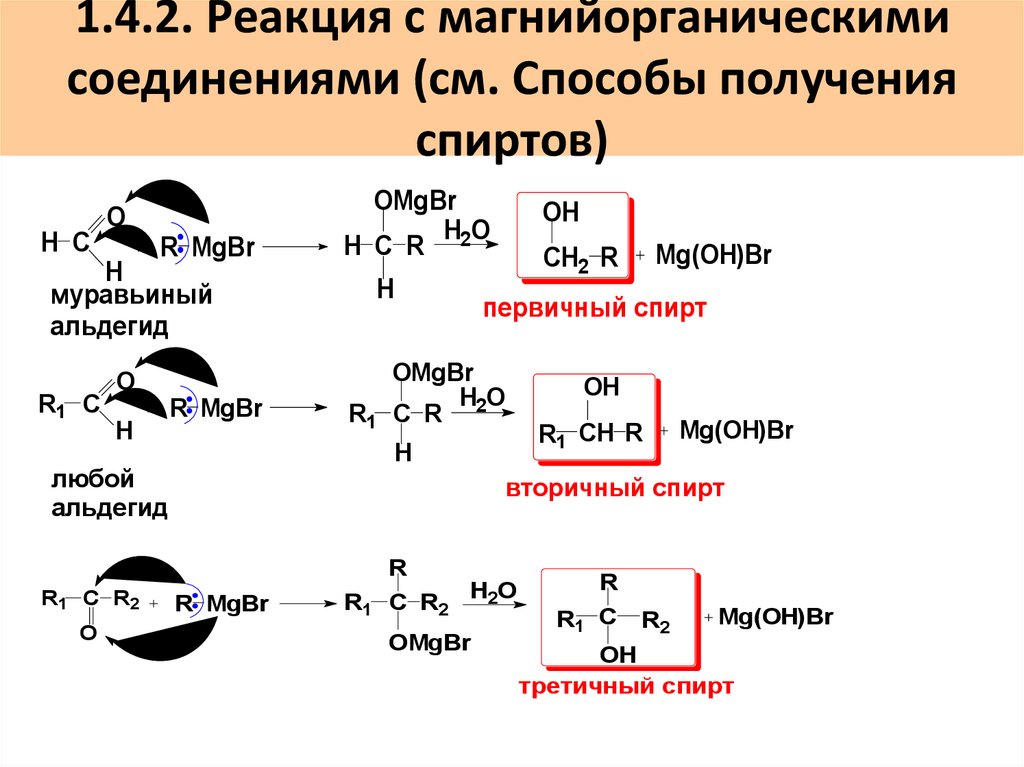
57. 1.4.2. Реакция с магнийорганическими соединениями (см. Способы получения спиртов)
H СO
R MgBr
H
муравьиный
альдегид
R1 С
O
H
R MgBr
OMgBr
HO
H C R 2
H
первичный спирт
OMgBr
HO
R1 C R 2
OH
R1 CH R
Mg(OH)Br
вторичный спирт
R
O
Mg(OH)Br
CH2 R
H
любой
альдегид
R1 C R2
OH
R MgBr
R1 C R2
H2O
OMgBr
R
R1 C
R2
Mg(OH)Br
OH
третичный спирт
58. 2. Реакции конденсации.
• К этим реакциям относят реакцииприсоединении или замещения атома
кислорода карбонильной группы с
образованием новой С-С связи.
• В реакциях 2 участника:
• 1) карбонильное соединение
(карбонильная компонента)
• 2) метиленовая компонента (С-Н
кислота), в качестве которой могут
выступать и сами карбонильные
соединения:
59.
Карбонильная компонента: альдегиды икетоны алифатического и ароматического
ряда.
Метиленовая компонента: обладающие С-Н
кислотностью альдегиды и кетоны
(обязательно алифатические), сложные
эфиры, ангидриды кислот,
нитросоединения и др., т.е. соединения
типа
60.
• Карбонильные соединения как С-Нкислоты (Учебник, стр. 442-444,).
• Где X и Y (или одна из них) – сильные ЭА
группы:
61.
Реакции конденсации альдегидов и кетоновнепосредственно связаны с кетоенольной
таутомерией - таутомерией, при которой
соединение существует в двух,
находящихся в равновесии,
формах: кетонной и енольной.
H
O
С С
кетонная
форма
С С
OH
енольная
форма
Процесс носит название
енолизации.
62.
• Равновесие смещено обычно в сторонутермодинамически более стабильной и
менее кислой карбонильной
формы(енол.ф. – 10-2–10-6 %).
• ЕНОЛИЗАЦИЯ УСКОРЯЕТСЯ ПОД
ДЕЙСТВИЕМ ОСНОВАНИЙ ИЛИ КИСЛОТ
63.
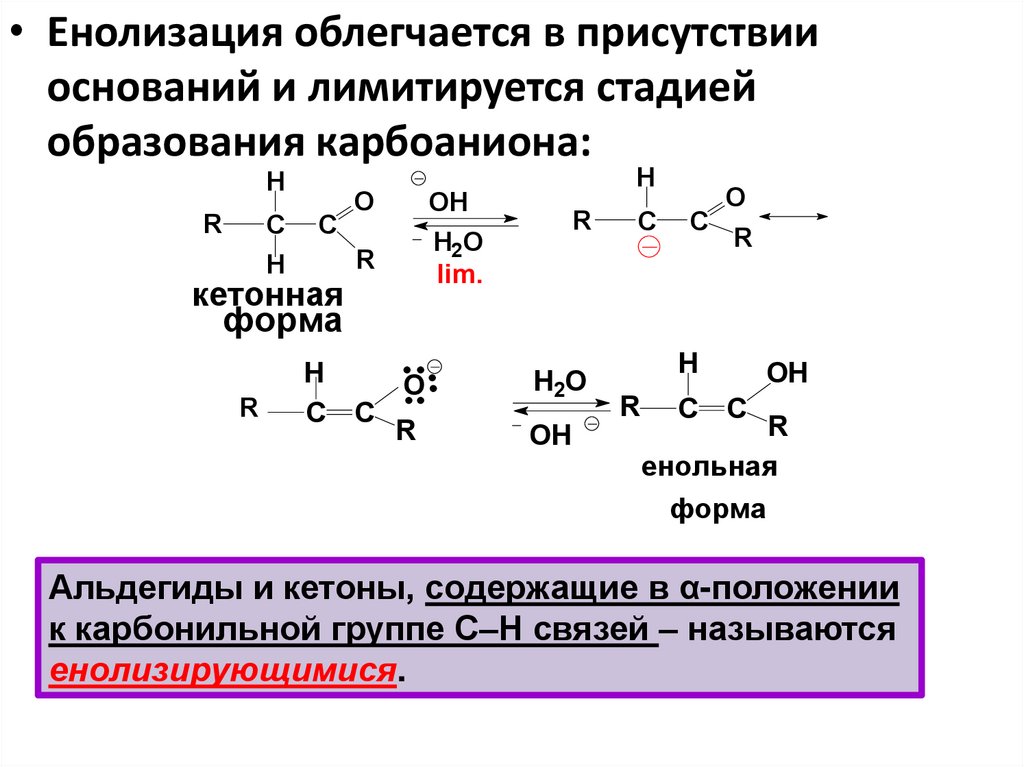
• Енолизация облегчается в присутствииоснований и лимитируется стадией
образования карбоаниона:
H
R
С
H
С
O
R
кетонная
H
OH
H2O
lim.
R
С
С
O
R
форма
R
H
O
С С
R
H2O
OH
H
R
OH
С С
R
енольная
форма
Альдегиды и кетоны, содержащие в α-положении
к карбонильной группе С–Н связей – называются
енолизирующимися.
64.
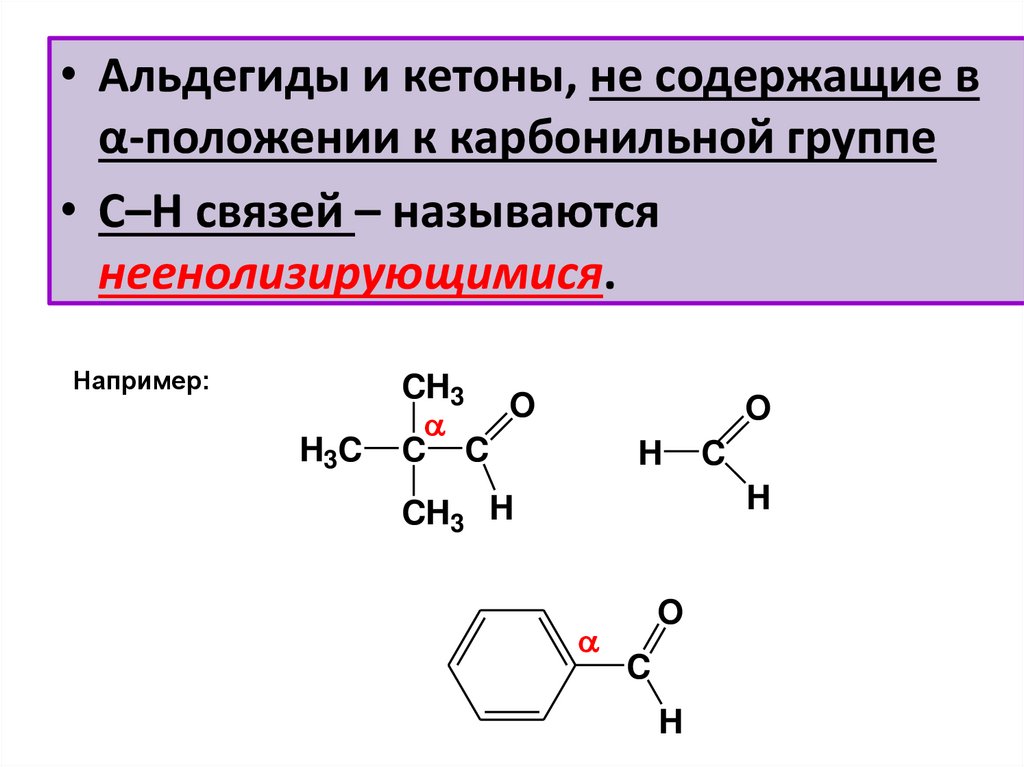
• Альдегиды и кетоны, не содержащие вα-положении к карбонильной группе
• С–Н связей – называются
неенолизирующимися.
Например:
H3 C
CH3
O
C C
O
H
C
H
CH3 H
O
C
H
65.
• Альдольная конденсация –обратимая реакция, продуктом
которой являются соединения,
называемые АЛЬДОЛИ.
• Обратный процесс называется
альдольным расщеплением
(ретроальдольной реакцией).
66. 2.1. Альдольная и кротоновая конденсации.
• Альдольная конденсация протекаетпри действии на енолизирующиеся
альдегиды или кетоны разбавленных
щелочей. При этом одна молекула
альдегида представляет собой
карбонильную компоненту, а другая –
метиленовую
2CH3CH2CH O
KOH, 10oC
CH3CH2CH CH CH O
OH CH3
3-гидрокси-2-метилпентаналь, 60%
67. МЕХАНИЗМ
CH3CHHO
C
O -H2O
H
[CH3CH
CH O
A
H
O
d
CH3CH2C
H
CHCH O
CH3
A
CH3CH CH O]
(I)
O
CH3CH2C CH CH O
H CH3
(II)
+H2O
OH
CH3CH2C CH CH O
H CH3
HO
68. Возможен и кислотный катализ енолизации:
HO
R С С
R
H
кетонная
форма
H
H2O
H
R С С
H
OH
H2O
R
H3O
lim.
H
OH
R С С
R
енольная
форма
69.
Если альдольная конденсациясопровождается отщеплением воды (это
часто происходит при повышенной
температуре), то такая реакция
называется кротоновой конденсацией.
Протеканию реакции дегидратации
способствует наличие в альдоле α-СНкислотного центра и π,π-сопряжения в
образующемся α,β-ненасыщенном
альдегиде или кетоне:
70.
CH-Кислотный центр2C7H15CH
OH H
C2H5ONa
O
C7H15CH C CH O
C6H13
октаналь
-H2O
альдоль
C7H15CH
C CH O
C6H13
2-гексилдецен-2-аль, 79%
71.
72.
• Реакции альдольной или кротоновойконденсации часто проводятся в
смешанном варианте, когда карбонильная
и метиленовая компоненты – разные
соединения.
• Карбонильная компонента должна иметь
высокую реакционную способность в
реакциях нуклеофильного
присоединения.
• Метиленовая компонента должна
обладать достаточно высокой СНкислотностью.
73. Например, реакция Кляйзена-Шмидта:
СH OCH3CH O
KOH, 20oC
бензальдегид ацетальдегид
(карбонильная (метиленовая
компонента)
компонента)
CH CH CH O
коричный альдегид, 60%
H2O
74. Конденсация альдегидов с ангидридами карбоновых кислот (Реакция Перкина)
CH OO
CH3 C
O
CH3 C
O2N
О
уксусный ангидрид
4-нитробензальдегид
o
CH3COONa, 180 C
CH CH COOH
O2N
3-(4-нитрофенил)пропеновая
кислота, 90%
75. 2.3. Конденсация с сильными СН-кислотами.
2.3. Конденсация с сильными СН-кислотами.
• (реакция Кнёвенагеля)
CH3
C
CH3
O
H2C
COOH
H2NCH2CH2COOH
C N
80oC
цианоуксусная
кислота
COOH
CH3
C C
CH3
C N
изопропилиденцианоуксусная кислота, 90%
76.
В общем виде качестве метиленовой компоненты в реакцииКнёвенагеля
могут участвовать вещества общей
формулы Х–CH2–У ,
где X и(или) Y– сильные
электроноакцепторные группы.
Примеры метиленовых компонент в реакции Кнёвенагеля:
Название
pK a CH
Формула
HOOС CH2 COOH
Малоновая кислота
Малоновый эфир
кислоты
C2H5OOC CH2 COOC2H5
Ацетоуксусный эфир
CH3 CO CH2 COOC2H5
Цианоуксусная кислота
N C CH2 COOH
Цианоуксусный эфир
N C CH2 COOC2H5
Нитрометан
Малононитрил
CH3 NO2
N C CH2 C
N
13
11
9
10,6
11-12
77. 2.4. Реакция Виттига.
3. Реакции окисления и восстановления(уч. 2013, с. 643-644)
В общем виде реакции восстановления ведут
к получению спиртов,
а реакции окисления - к получению
карбоновых кислот или СО2 .
• 3.1.Диспропорционирование (самоокислениесамовосстановление) - Реакция Канниццаро.
• В реакцию вступают неенолизирующиеся (не имеющие
С-Н связей в α-положении) альдегиды
C6H5CH
60%KOH,20oC
O
бензальдегид
C6H5CH2OH
бензиловый
спирт
C6H5COOK
бензоат
калия
78. 3. Реакции окисления и восстановления (уч. 2013, с. 643-644)
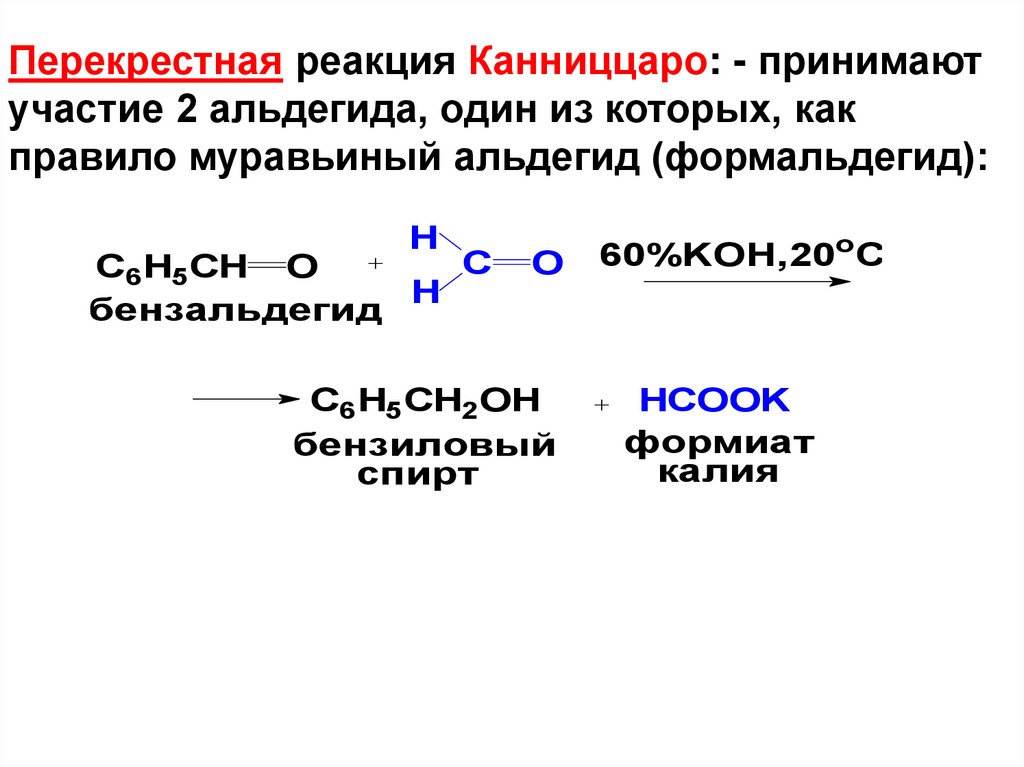
Перекрестная реакция Канниццаро: - принимаютучастие 2 альдегида, один из которых, как
правило муравьиный альдегид (формальдегид):
H
C
C6H5CH O
H
бензальдегид
O
C6H5CH2OH
бензиловый
спирт
60%KOH,20oC
HCOOK
формиат
калия
79.
3.2. Реакция Тищенко:• Этому превращению подвергаются
альдегиды, имеющие С-Н кислотный атом
углерода.
2 CH3CH O
ацетальдегид
(C2H5O)3Al
(недостаток)
CH3 C
O
O C2H5
этилацетат
80. 3.2. Реакция Тищенко:
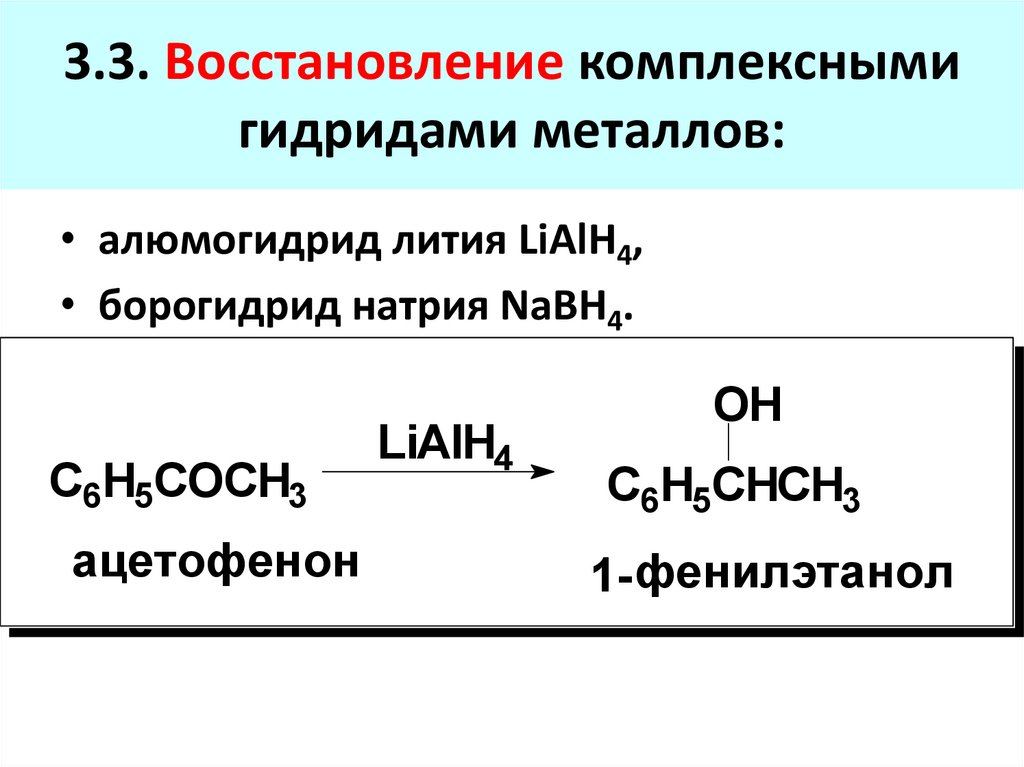
3.3. Восстановление комплекснымигидридами металлов:
• алюмогидрид лития LiAlH4,
• борогидрид натрия NaBH4.
С6H5COCH3
ацетофенон
LiAlH4
OH
C6H5CHCH3
1- фенилэтанол
81. 3.3. Восстановление комплексными гидридами металлов:
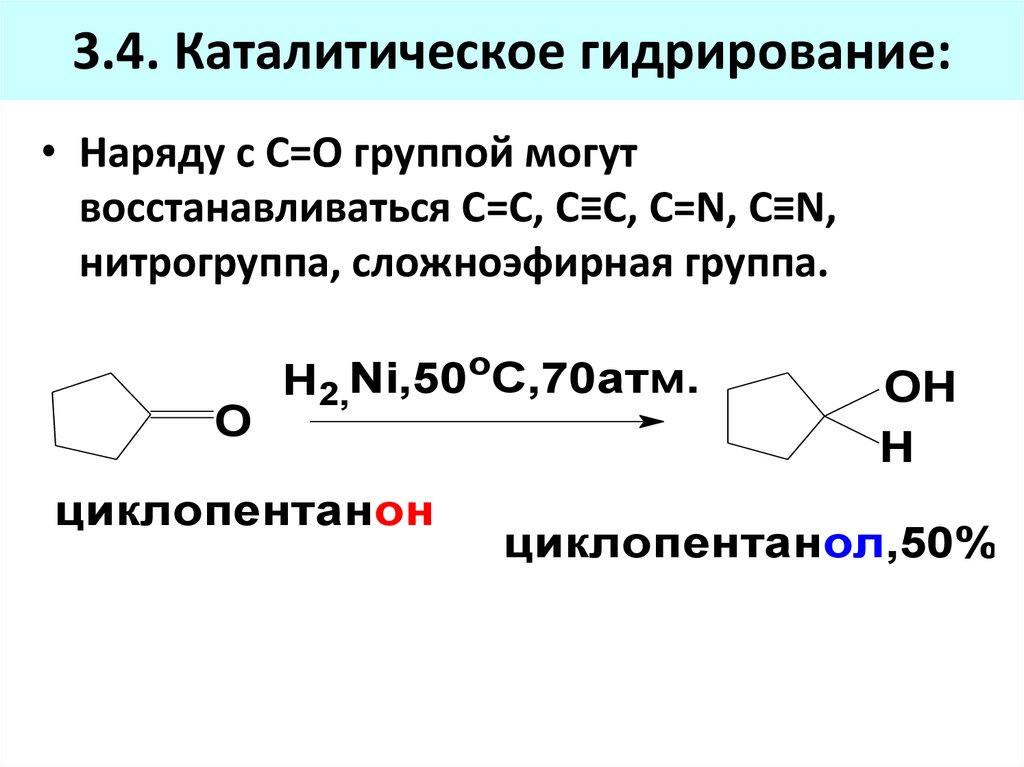
3.4. Каталитическое гидрирование:• Наряду с С=О группой могут
восстанавливаться С=С, C≡C, C=N, C≡N,
нитрогруппа, сложноэфирная группа.
O
H2,Ni,50oC,70атм.
циклопентанон
ОН
Н
циклопентанол,50%
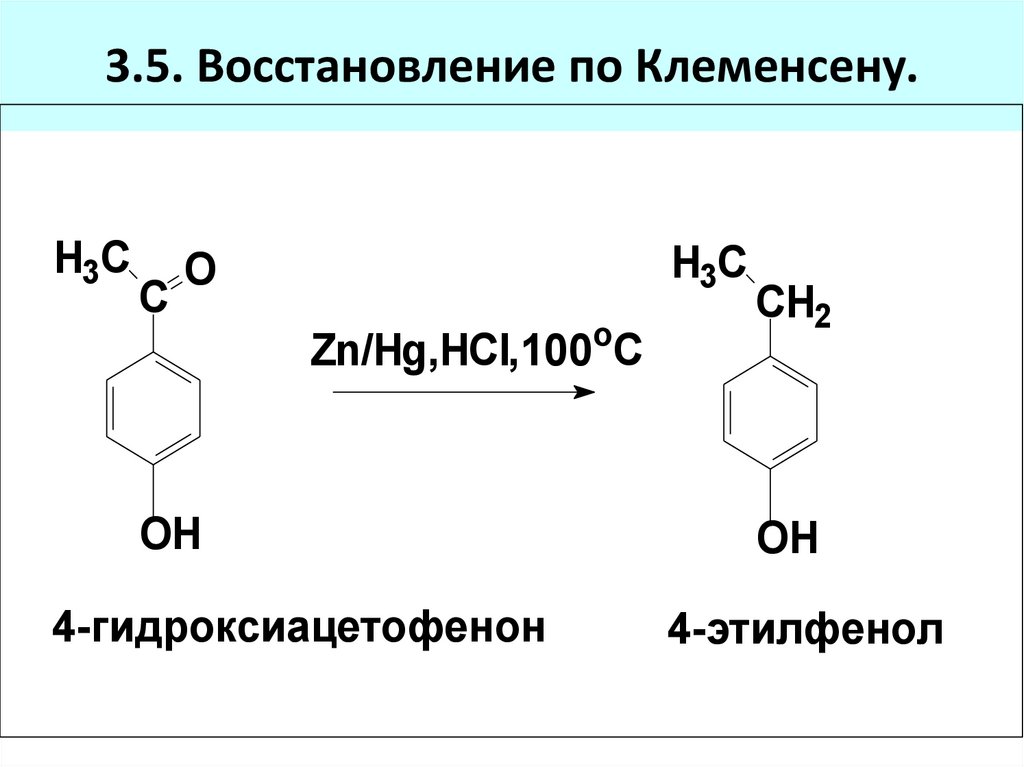
82. 3.4. Каталитическое гидрирование:
3.5. Восстановление по Клеменсену.H3C
C
H3C
O
o
Zn/Hg,HCl,100 C
OH
4-гидроксиацетофенон
CH2
OH
4-этилфенол
83. 3.5. Восстановление по Клеменсену.
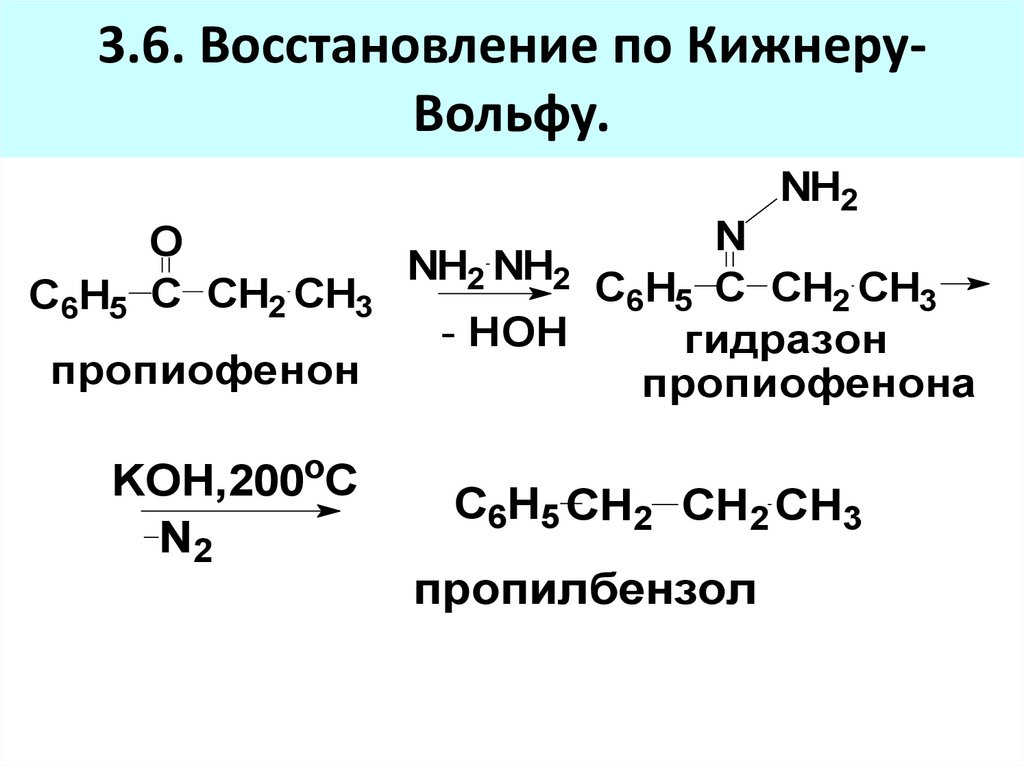
3.6. Восстановление по КижнеруВольфу.NH2
N
O
NH2 NH2
С6H5 C CH2 CH3
С6H5 C CH2 CH3
- HOH
гидразон
пропиофенон
пропиофенона
KOH,200oC
N2
С6H5 CH2 CH2 CH3
пропилбензол
84. 3.6. Восстановление по Кижнеру-Вольфу.
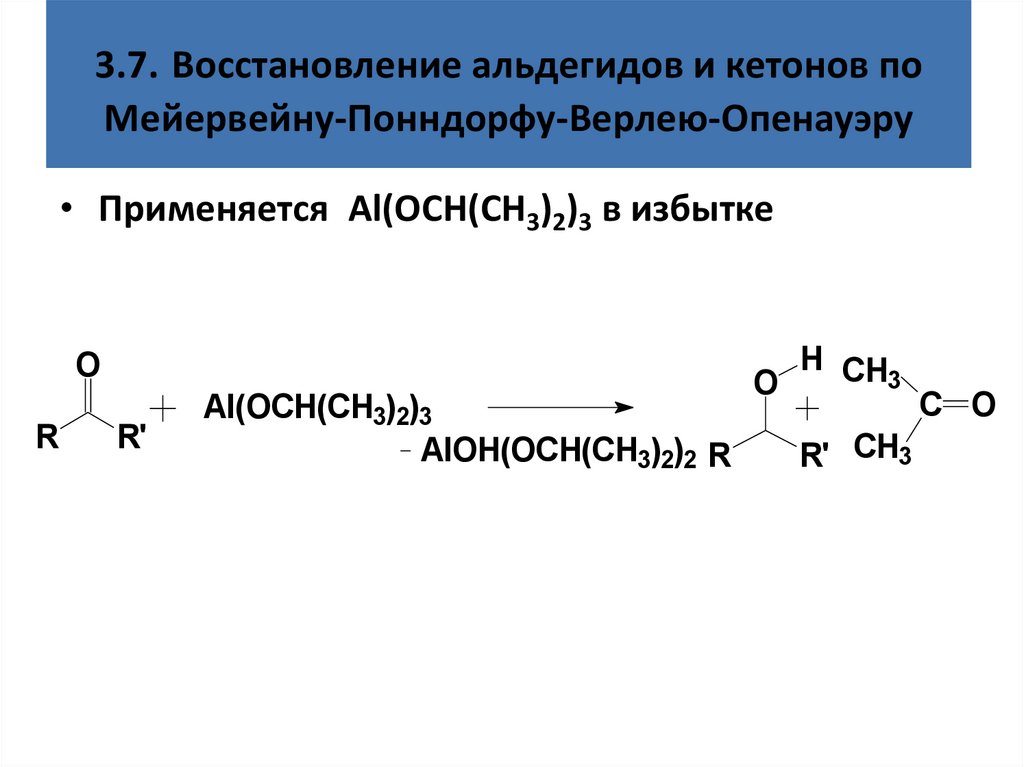
3.7. Восстановление альдегидов и кетонов поМейервейну-Понндорфу-Верлею-Опенауэру
• Применяется Al(OCH(CH3)2)3 в избытке
O
R
R'
Al(OCH(CH3)2)3
AlOH(OCH(CH3)2)2 R
O
H CH
3
R' CH3
C O
85. 3.7. Восстановление альдегидов и кетонов по Мейервейну-Понндорфу-Верлею-Опенауэру
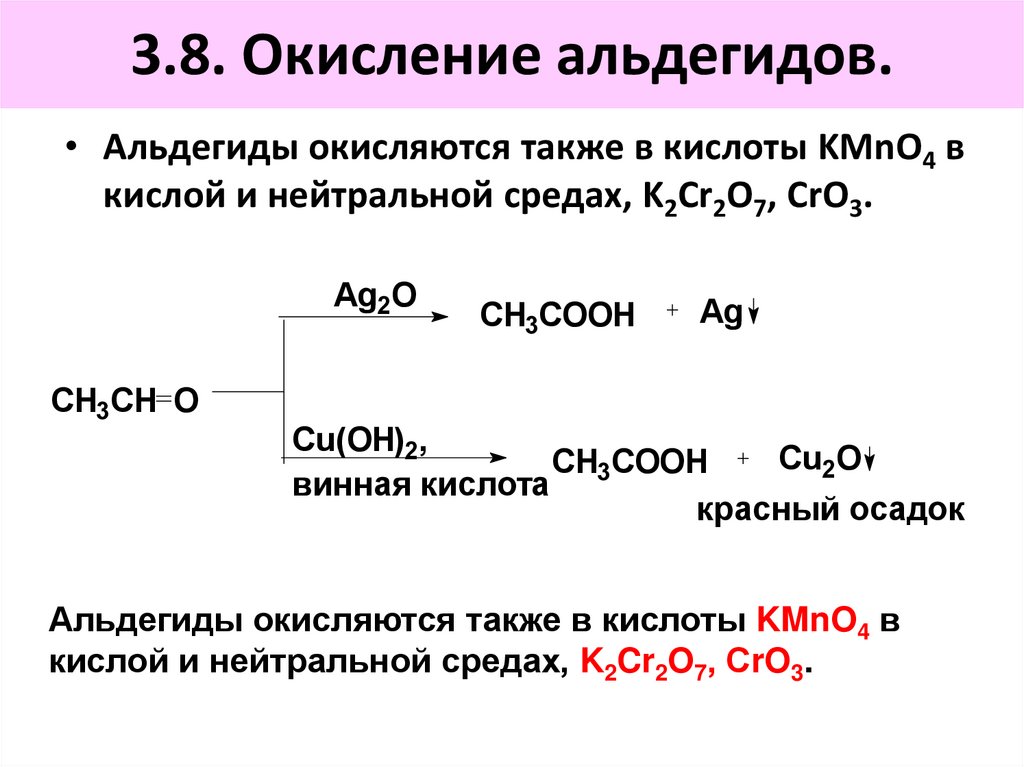
3.8. Окисление альдегидов.• Альдегиды окисляются также в кислоты KMnO4 в
кислой и нейтральной средах, K2Cr2O7, СrO3.
Ag2O
CH3CH O
CH3COOH
Ag
Cu(OH)2,
Cu2O
CH3COOH
винная кислота
красный осадок
Альдегиды окисляются также в кислоты KMnO4 в
кислой и нейтральной средах, K2Cr2O7, СrO3.
86. 3.8. Окисление альдегидов.
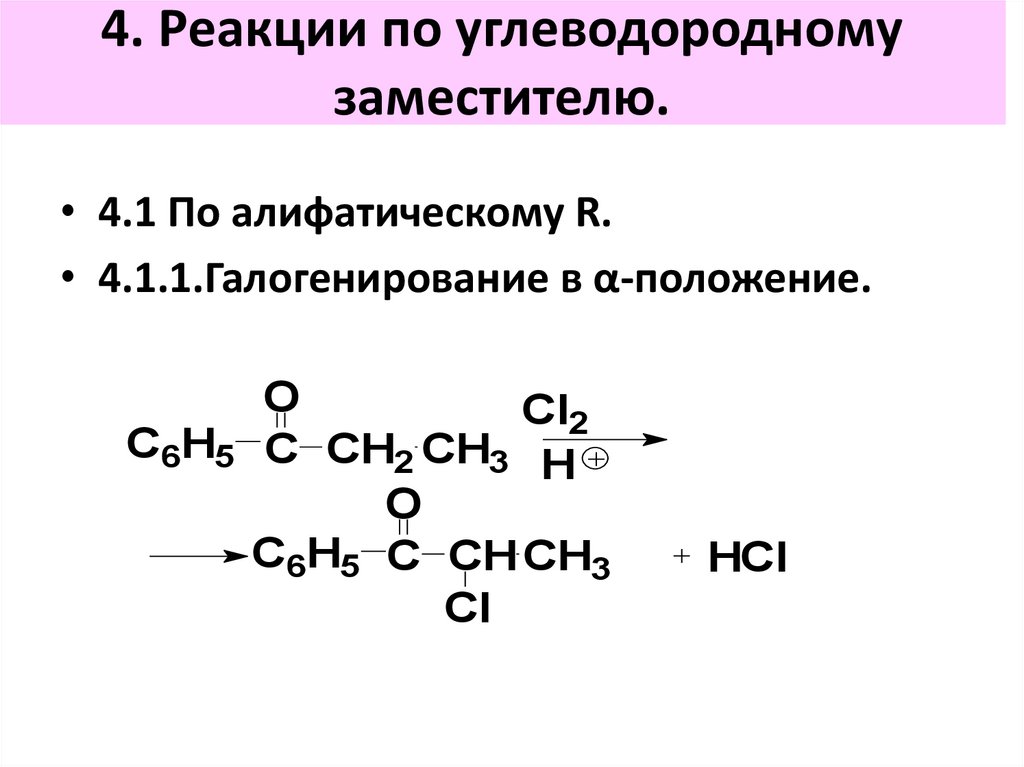
4. Реакции по углеводородномузаместителю.
• 4.1 По алифатическому R.
• 4.1.1.Галогенирование в α-положение.
O
Сl2
С6H5 C CH2 CH3
H
O
С6H5 C CH CH3
Cl
HCl
87. 4. Реакции по углеводородному заместителю.
•В присутствии избытка галогена – полигалогенирование:O
O
3 Сl2
СH3 C CСl3
СH3 C CH3
3HCl
Скорость галогенирования в щелочной среде в 12000 раз выше.
На этом свойстве основана качественная реакция
на уксусный альдегид и метилкетоны –
галоформная реакция:
88.
• 4.1.2. Карбонильная группа оказываетсильное влияние на кратные связи, если
они оказываются в α,β-положениях.
(Учебник, стр. 456-457).
89.
4.2. Реакции по ароматическомукольцу.
H
H
C
O
Br2
AlBr3
C
O
HBr
Br
H
KNO3
H2SO4
C
O
H2O
NO2
90. 4.2. Реакции по ароматическому кольцу.
5. Специфические реакции альдегидов.• 5.1. Бензоиновая конденсация.
H
C
O
KCN
O
C CH
OH
бензоин
91. 5. Специфические реакции альдегидов.
5.2 . Три- и полимеризация альдегидов.• Тримеризация и тетрамеризация
ацетальдегида:
H3C
O
CH3
CH
O
o
H ,t<0 C
CH
O
CH
CH3
CH O
CH3
метальдегид
O
H3C C
H
H
H3C
O
O
CH3
O
CH3
паральдегид
92. Механизм бензоиновой конденсации:
Тримеризация и полимеризацияформальдегида:
3 H C
O
H
H
O
O O
триоксиметилен
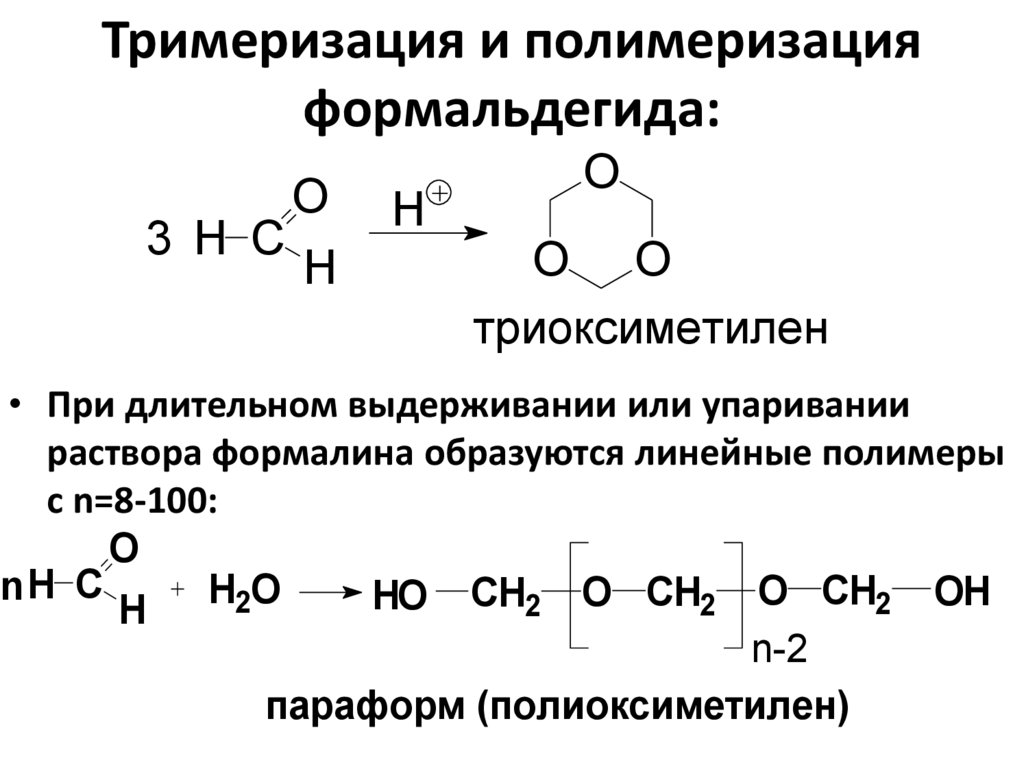
• При длительном выдерживании или упаривании
раствора формалина образуются линейные полимеры
с n=8-100:
O
nH C
H2O
HO СH2 O CH2 O CH2 OH
H
n-2
параформ (полиоксиметилен)
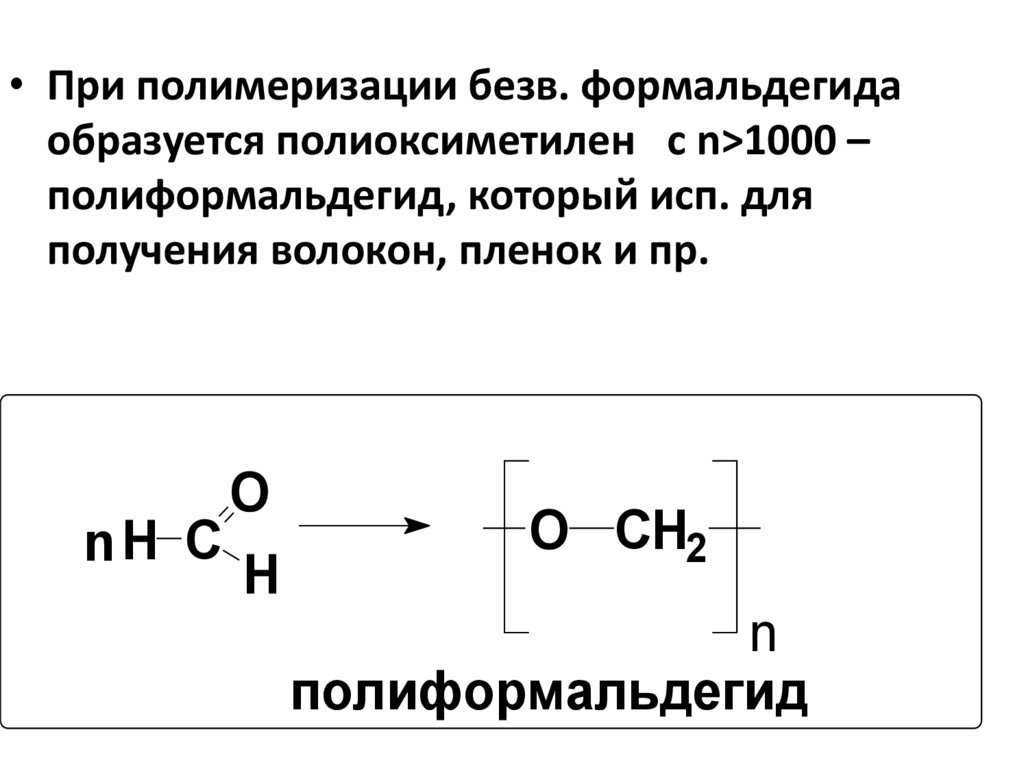
93. 5.2 . Три- и полимеризация альдегидов.
• При полимеризации безв. формальдегидаобразуется полиоксиметилен с n>1000 –
полиформальдегид, который исп. для
получения волокон, пленок и пр.
nH C
O
H
O CH2
n
полиформальдегид
94. Тримеризация и полимеризация формальдегида:
Важнейшие представители•ФОРМАЛЬДЕГИД – бесц. газ с резким
запахом. 35-37 %-ные водные р-ры,
содержащие 5-10 % метанола – формалин.
Самый активный неенолизирующийся
альдегид. В водных р-рах присоединяет
воду, олигомеризуется и полимеризуется.
Из водных р-ров упариванием в вакууме
выделяют смесь олигомеров и полимеров
– параформ – очень широко примен.
95.
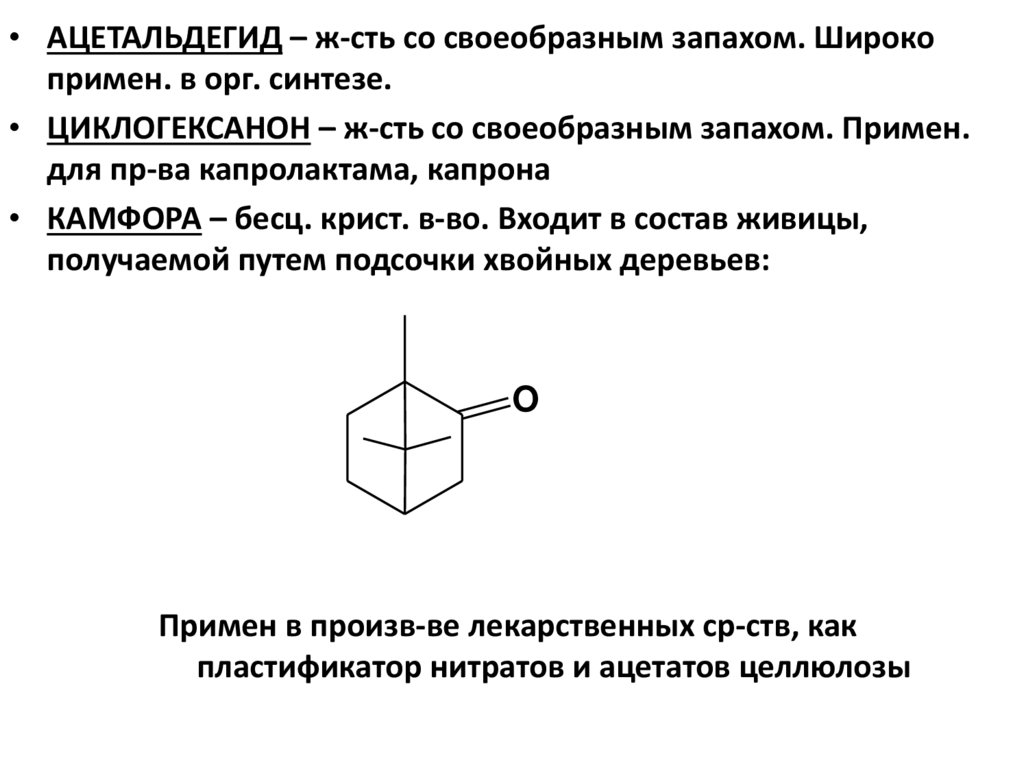
• АЦЕТАЛЬДЕГИД – ж-сть со своеобразным запахом. Широкопримен. в орг. синтезе.
• ЦИКЛОГЕКСАНОН – ж-сть со своеобразным запахом. Примен.
для пр-ва капролактама, капрона
• КАМФОРА – бесц. крист. в-во. Входит в состав живицы,
получаемой путем подсочки хвойных деревьев:
O
Примен в произв-ве лекарственных ср-ств, как
пластификатор нитратов и ацетатов целлюлозы
96.
• АЦЕТОФЕНОН – имеет запахчеремухи.
• БЕНЗОФЕНОН – исп-ся в органич.
синтезе и в кач-ве
фотосенсибилизатора.
• БЕНЗАЛЬДЕГИД – бесц. ж-сть с
запахом горького миндаля.
97.
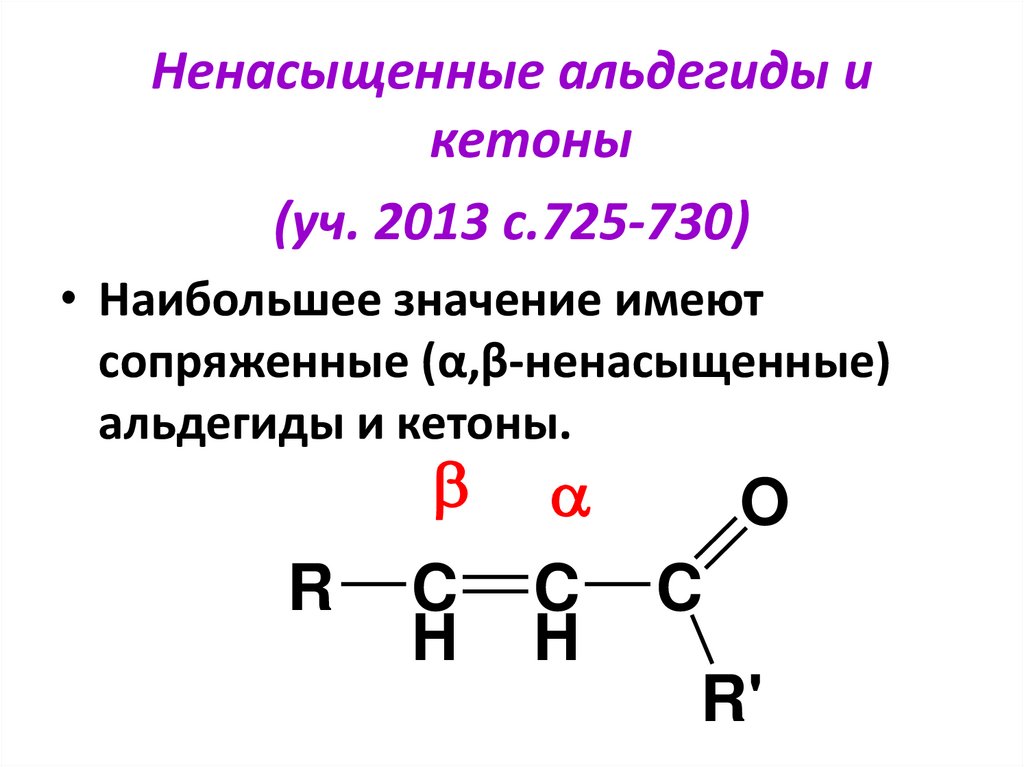
Ненасыщенные альдегиды икетоны
(уч. 2013 с.725-730)
• Наибольшее значение имеют
сопряженные (α,β-ненасыщенные)
альдегиды и кетоны.
R
C
H
O
C C
H
R'
98.
Способы получения• а) Кротоновая конденсация (КляйзенаШмидта):
O
C
+
H3С
O
C
H
H
метиленовая
компонента
Карбонильная
компонента
H
C
- HOH
NaOH/HOH
С
H
коричный
альдегид
O
C
H
99.
H3 C CO
+
O
H
C
H
метиленовая
компонента
O
H
H3 C C С C
H
H
кротоновый
альдегид
H
Карбонильная
компонента
- HOH
H3 С
100.
OH3C C
+ H3С
СH3
Карбонильная
компонента
- HOH
H3C
O
C
СH3
метиленовая
компонента
СH3
O
C С C СH3
H
окись
мезитила
H
101.
• б) Дегидратация альдолейOH
H3C
C
O
H2
C C
H
СH3
CH3
Диацетоновый
спирт
CH3
- HOH
H3 C
C
С
H
окись
мезитила
O
C
СH3
102.
в) Окисление α,β-ненасыщенных спиртов:В качестве окислителей используют специальные
реагенты – пиридиний перхлорат, CrO3 при низкой
температуре.
Пропилен можно окислить кислородом при
повышенной температуре в присутствии
каталитзаторов до акролеина (пропЕНаля):
O2/CuO
300-400 0C
пропилен
H
O
пропеналь
(акролеин)
103.
Строение и физические свойства• α,β-Ненасыщенные альдегиды и
кетоны представляют собой бесцв. жти и кристаллич. в-ва, обладающие
резким запахом.
Сочетание в каждой молекуле двух
двойных связей (С=С и С=О)
обуславливает появление новых св-в у
данных в-в.
104.
Следовательно в молекуле имеетсядва электрофильных центра –
1) атом С карбонильной группы и
2) β-углеродный атом.
105.
В УФ спектрах данных соединений наблюдается– 220-260 нм (ε ~ 10000, π-π* переход)
– 310-330 нм (ε ~ 100, n-π* переход)
В ИК-спектрах С=O
для ненасыщенных альдегидов 1680-1705 см-1,
для ненасыщенных кетонов 1665-1685 см-1.
Двойная сопряженная связь С=С – 1600-1620 см-1.
106.
Химические свойства• Хар-ны реакции:
• - с участием С=С и С=О связей
•- реакции по соседнему с С=С связью атому
углерода (благодаря сопряжению С=О и
С=С связей влияние карбонильной группы
передается на данный атом, который
проявляет св-ва аналогичные αуглеродному атому насыщенных
карбонильных соединений – явление
винилогии)
107.
• 1) Реакции 1,2- и 1,4-присоединенияOH
R
R
Hd'
C
d
O
Cd
C
H
H
C
C
H
1,2
NuH
H
CH
Nu
R'
R'
R
R
C
R'
CH
C
Nu
O
1,4
H
C
R'
CH
C
Nu
OH
1,4
108.
• Одни реакции протекают преимущественно по1,2-пути, другие по 1,4-пути (см.
«Сопряженные диены»). Например:
d'
H2C
d
O
HBr
Cd
C
H
H2C
R'
Br
H
CH
R'
H2C
C
Br
O
1,4
H
C
R'
C
OH
1,4
109.
• Вывод - присоединениегалогенводородных кислот
протекает как 1,4-присоедиенние
(по результату реакция идет
против правила Марковникова)
110.
• Восстановление:111.
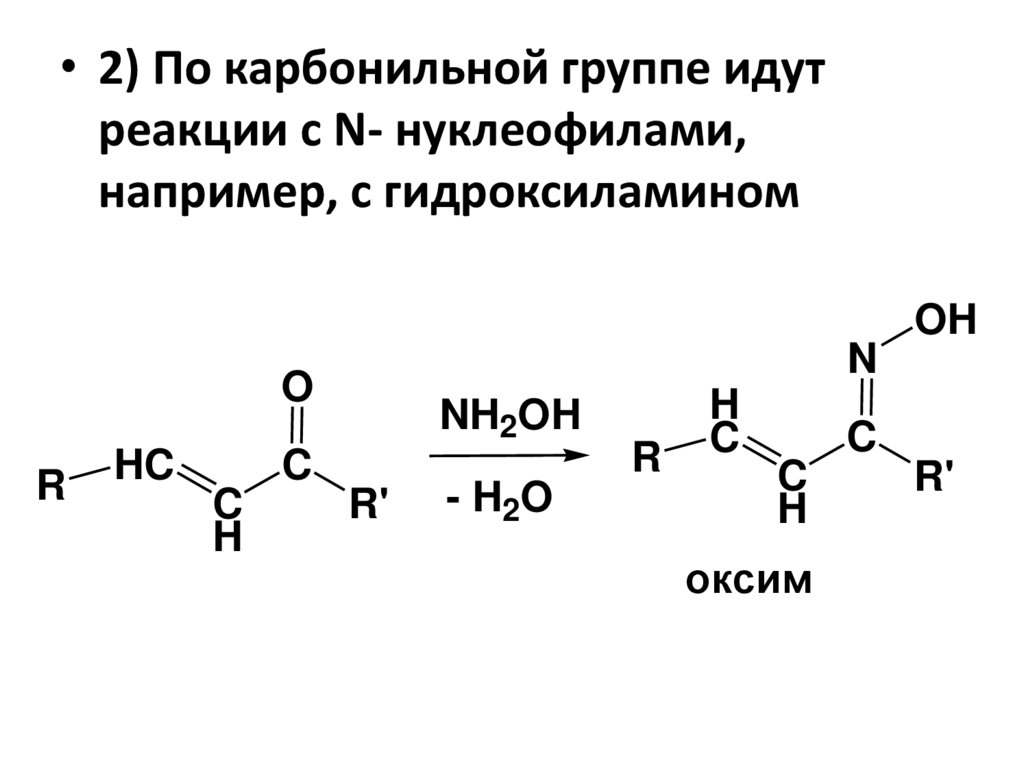
• 2) По карбонильной группе идутреакции с N- нуклеофилами,
например, с гидроксиламином
OH
N
O
R
HC
C
H
C
NH2OH
R'
- H2O
R
H
C
C
H
оксим
C
R'
112.
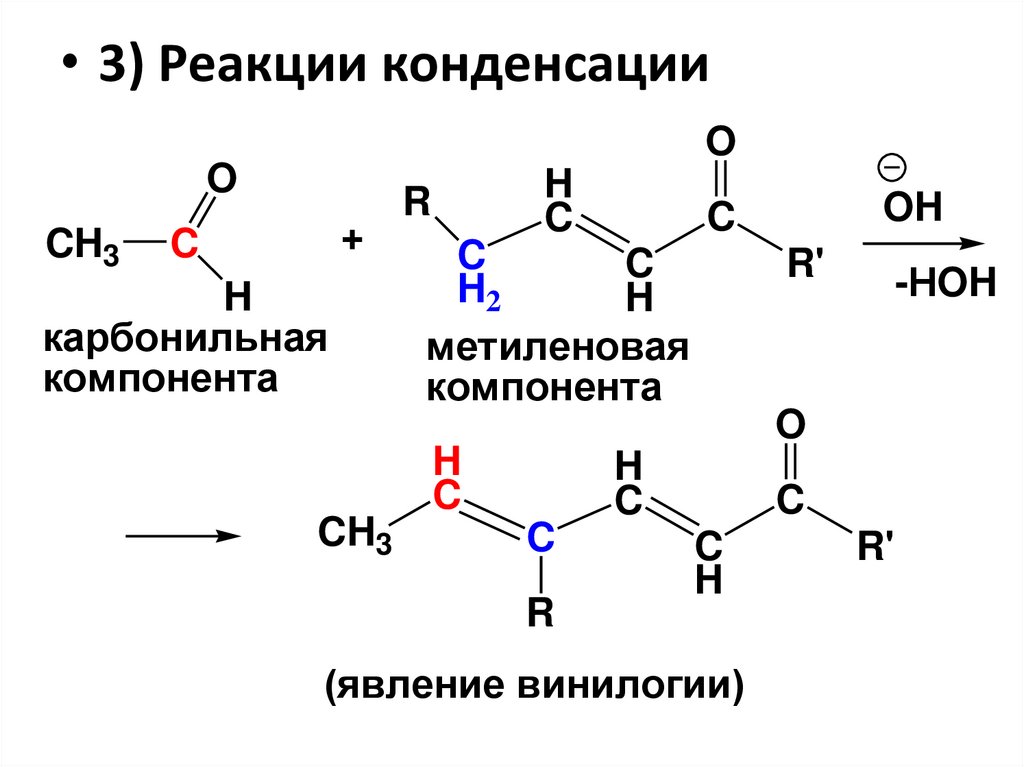
• 3) Реакции конденсацииO
O
CH3
+
C
H
карбонильная
компонента
CH3
H
C
R
OH
C
C
C
H2
H
метиленовая
компонента
R'
-HOH
O
H
C
H
C
C
R
C
C
H
(явление винилогии)
R'
113.
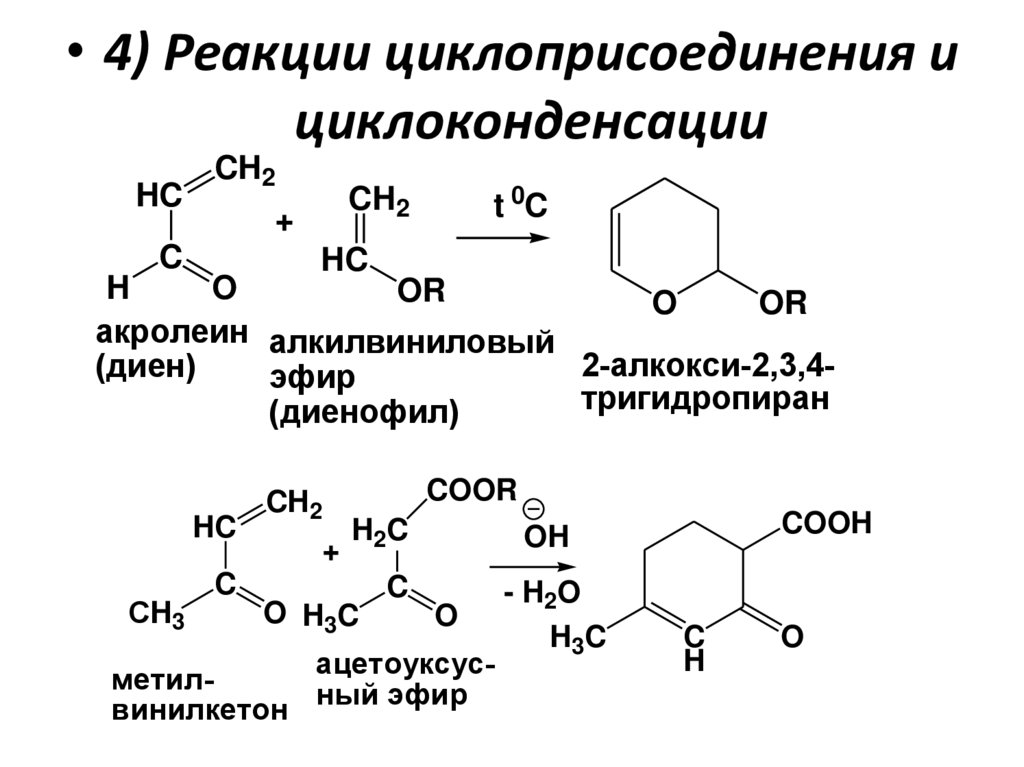
• 4) Реакции циклоприсоединения ициклоконденсации
HC
CH2
+
C
t 0C
CH2
HC
H
O
OR
O
OR
акролеин алкилвиниловый
2-алкокси-2,3,4(диен)
эфир
тригидропиран
(диенофил)
HC
СH3
CH2
+
COOR
H2C
OH
C
- H2O
H3C
C
O H3C
O
ацетоуксусметилный эфир
винилкетон
COOH
C
H
O
114.
Важнейшие представителиАкролеин (пропеналь) – бесцв. ж-сть с
острым запахом, лакриматор. В промышти получают окислением пропилена над
CuO при 300-4000С. Он легко
полимеризуется и поэтому его
стабилизируют гидрохиноном. Это
важнейший продукт органического
синтеза. Выступает как диен и как
диенофил в реакциях
циклоприсоединения.
115.
Окись мезитила – (4-метилпент-3-ен-2-он) – ж-сть сострым запахом. Получают из ацетона реакцией
альдольной конденсации и дегидратации:
O
O
OH
OH
O
+
O
H
- H2O
Кротоновый альдегид –
бут-2-еналь – ж-сть с острым запахом, исп-ся для
получения масляного альдегида, бутанола,
масляной кислоты, малеинового ангидрида.
116.
Метилвинилкетон - ж-сть с острым запахом,получают присоединением воды к
винилацетилену в присутствии солей ртути (II) и
конденсацией формальдегида c ацетоном.
Присоединение HCN к нему идет не по
карбонильной группе, а по С=С связи. Он легко
полимеризуется в стекловидную пластмассу.
Форон – 2,6-диметилгепт-2,5-диен-4-он. Получают
конденсацией окиси мезитила с ацетоном.
Растворитель нитратов целлюлозы, других
полимеров.
Сорбиновый альдегид – гекс-2,4-диеналь – получают
полимеризацией ацетальдегида, применяют для
получения сорбиновой кислоты – консерванта.
117.
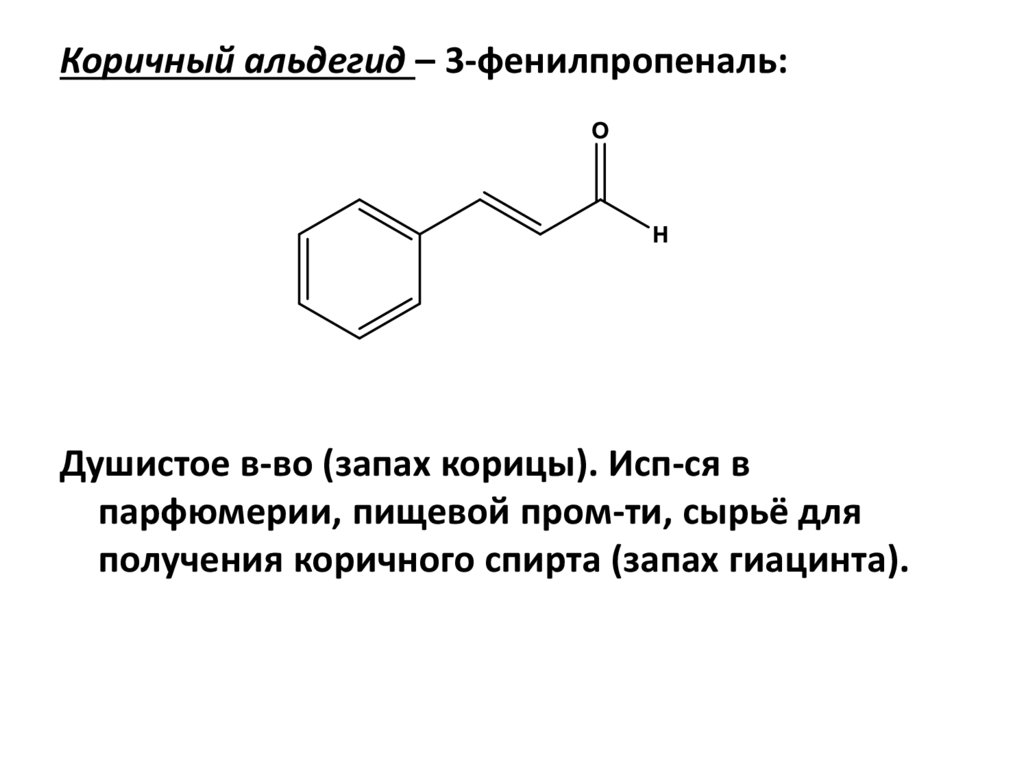
Коричный альдегид – 3-фенилпропеналь:Душистое в-во (запах корицы). Исп-ся в
парфюмерии, пищевой пром-ти, сырьё для
получения коричного спирта (запах гиацинта).

















































 chemistry
chemistry








