Similar presentations:
Свойства и биологическая роль карбонильных соединений
1. Лекция № 3 Свойства и биологическая роль карбонильных соединений
Реакции альдольнойконденсации
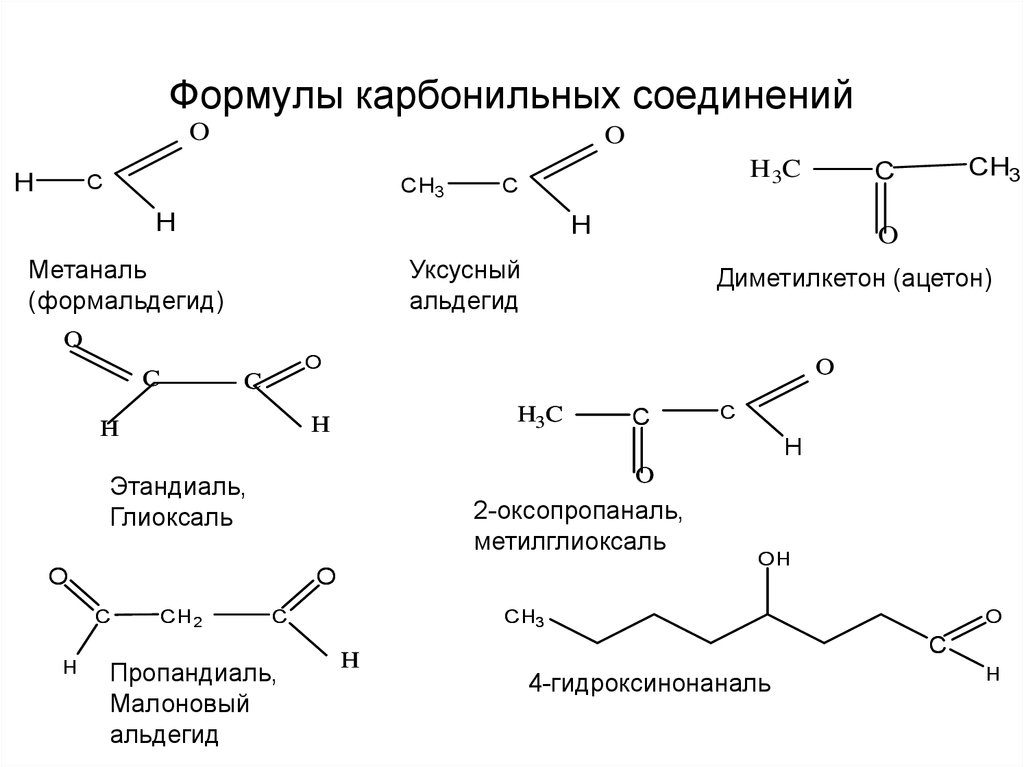
2. Формулы карбонильных соединений
OH
O
C
CH3
H3C
C
H
H
Метаналь
(формальдегид)
CH3
C
O
Уксусный
альдегид
Диметилкетон (ацетон)
O
O
C
O
C
H3C
H
H
O
2-оксопропаналь,
метилглиоксаль
O
H
C
H
Этандиаль,
Глиоксаль
O
C
C
CH 2
C
Пропандиаль,
Малоновый
альдегид
OH
CH3
O
C
H
4-гидроксинонаналь
H
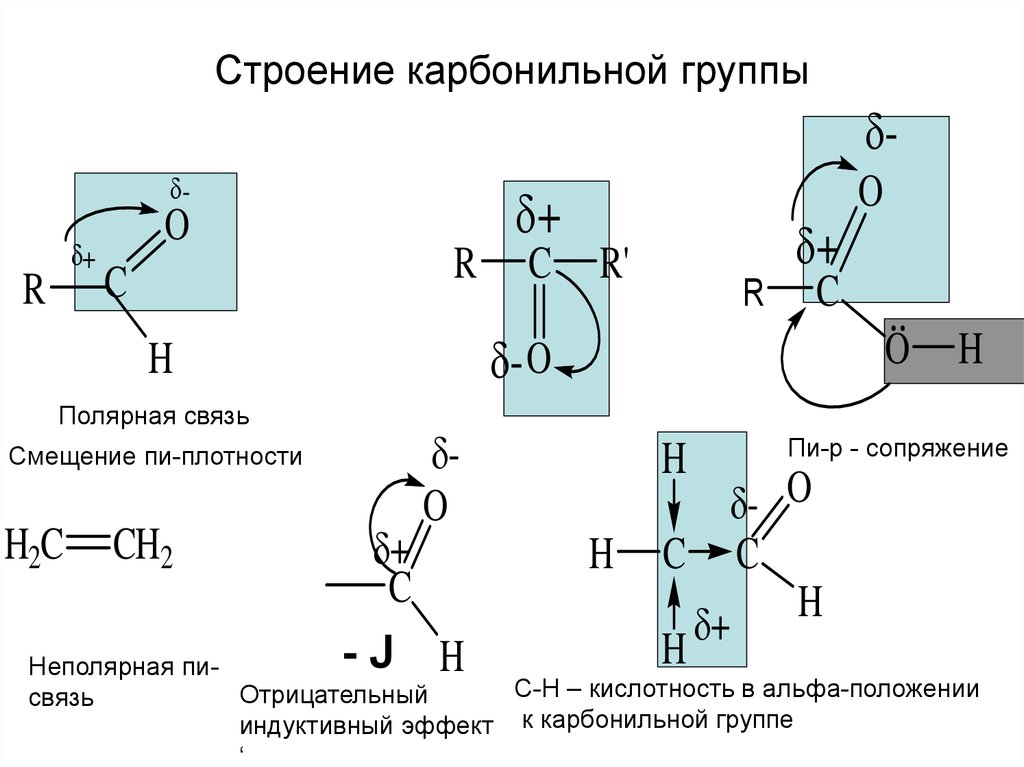
3. Строение карбонильной группы
+R
O
C
+
R
Смещение пи-плотности
H2C
CH2
+
R'
R
C
- O
H
Полярная связь
C
O
O
+
C
-J H
O
H
H
H
Пи-р - сопряжение
- O
C C
H
+
H
Неполярная пиС-Н – кислотность в альфа-положении
Отрицательный
связь
индуктивный эффект к карбонильной группе
‘
4. Прогнозирование реакционной способности карбонильных соединений
• 1. Склонность к реакциямнуклеофильного присоединения АN
• Нуклеофильные реагенты –соединения,
имеющие неподеленные пары электронов или
анионы
··
··
··
··
• Н-О-Н, NH3, NH2-OH, R-OH, H+ CN-
• 2. Реакции конденсации, обусловленные
С-Н- кислотностью в альфа-положении к
карбонильной группе
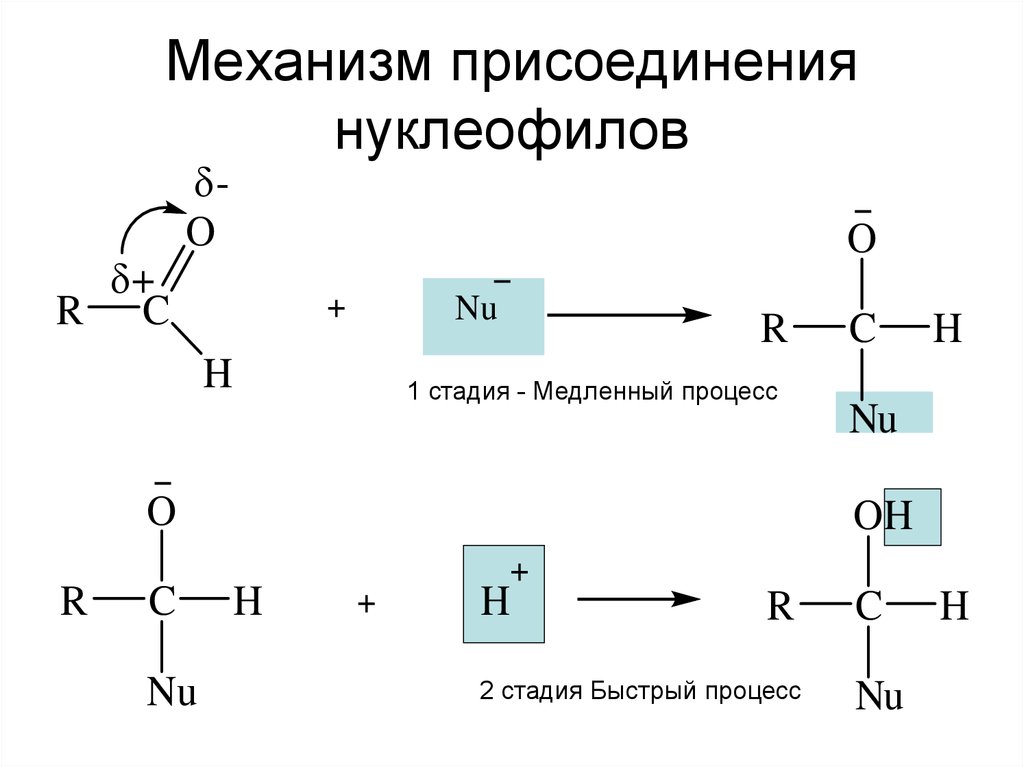
5. Механизм присоединения нуклеофилов
+R C
O
O
Nu
H
R
1 стадия - Медленный процесс
O
R
C
Nu
C
H
Nu
OH
H
H
R
2 стадия Быстрый процесс
C
Nu
H
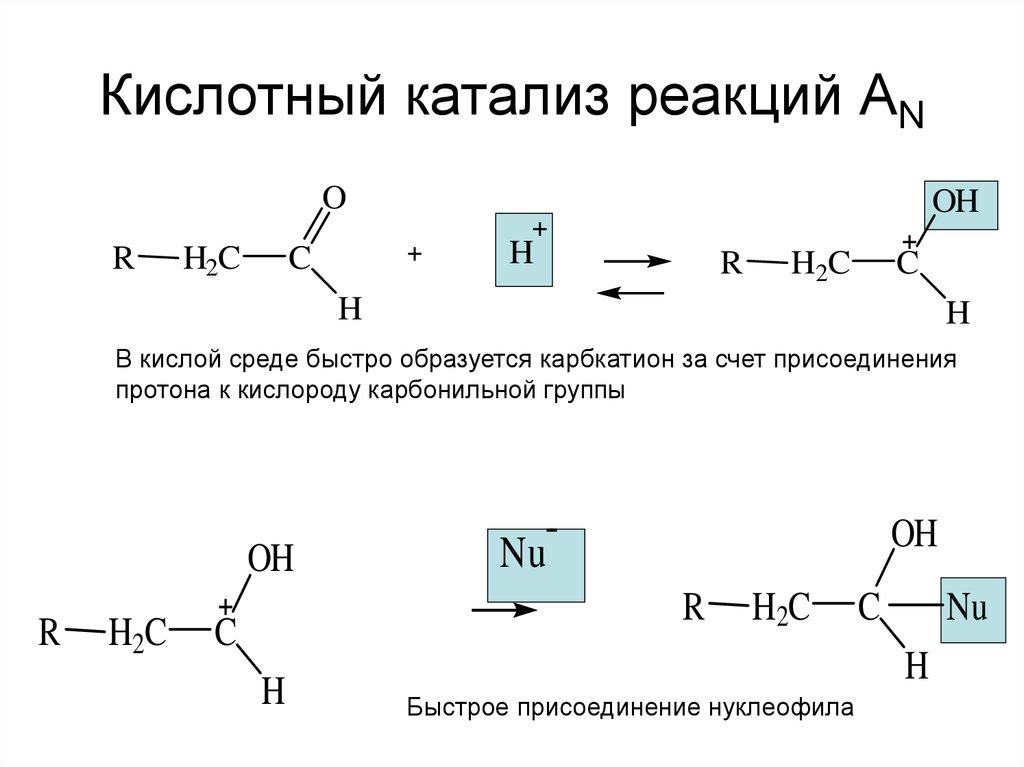
6. Кислотный катализ реакций AN
OR
H2C
OH
H
C
R
H2C
C
H
H
В кислой среде быстро образуется карбкатион за счет присоединения
протона к кислороду карбонильной группы
OH
R
H2C
-
OH
Nu
R
C
H
H2C
C
Nu
H
Быстрое присоединение нуклеофила
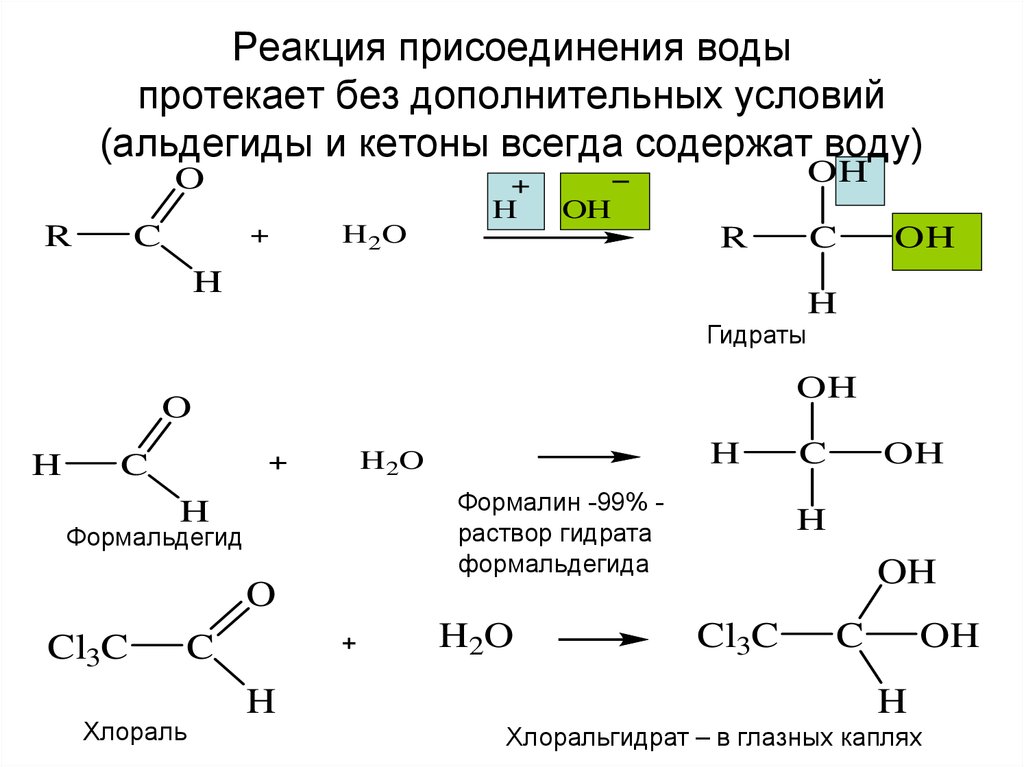
7. Реакция присоединения воды протекает без дополнительных условий (альдегиды и кетоны всегда содержат воду)
OHO
H
R
C
OH
H 2O
R
C
H
Гидраты
H
OH
O
H
H
H 2O
C
Формалин -99% раствор гидрата
формальдегида
H
Формальдегид
C
OH
H
OH
O
Cl3C
H2O
C
Хлораль
OH
H
Cl3C
C
OH
H
Хлоральгидрат – в глазных каплях
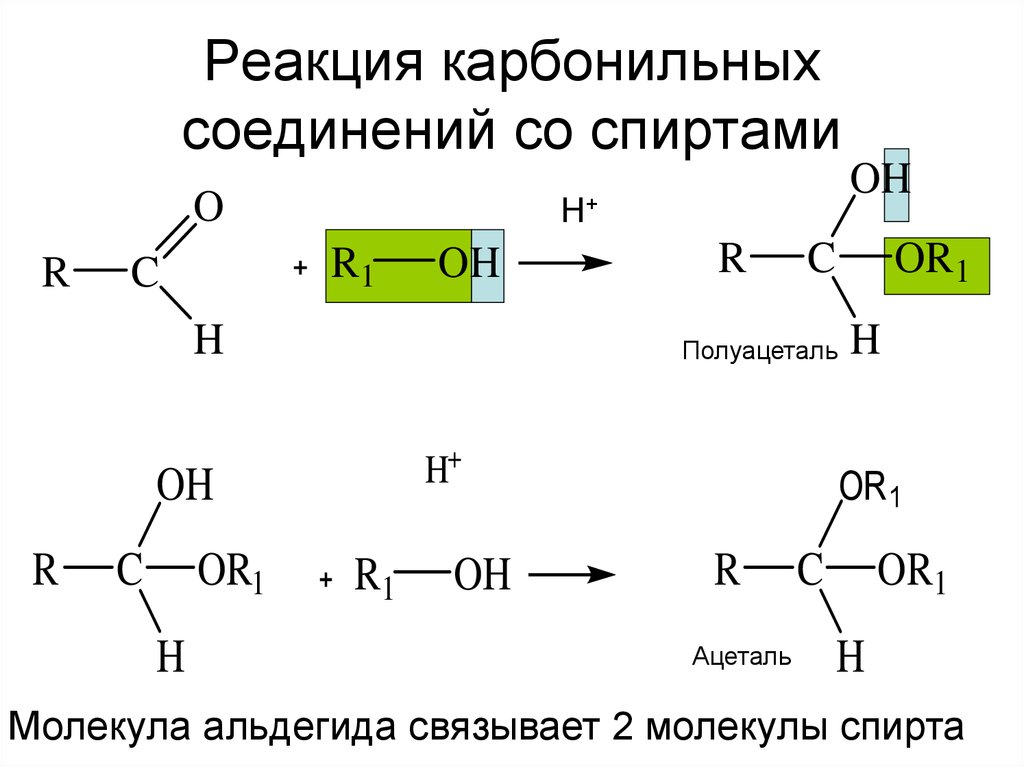
8. Реакция карбонильных соединений со спиртами
OR
R1
C
OH
H
C
OR1
H
R
C
OR1
Полуацеталь
H+
OH
R
OH
Н+
R1
OH
H
OR1
R
Ацеталь
C
OR1
H
Молекула альдегида связывает 2 молекулы спирта
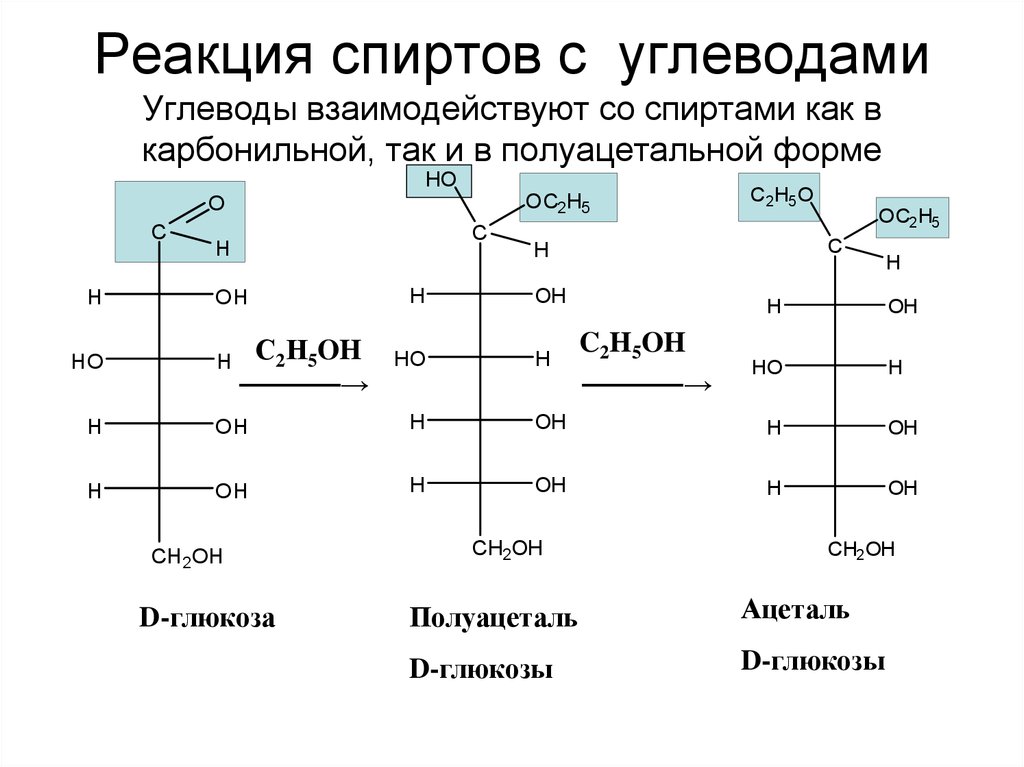
9. Реакция спиртов с углеводами Углеводы взаимодействуют со спиртами как в карбонильной, так и в полуацетальной форме
HOOC2 H5
O
C
H
HO
C
H
OH
H
С2Н5OH
─────→
H
HO
C 2 H5 O
C
H
OH
H
OC2 H5
H
C2H5OH
─────→
H
OH
HO
H
H
OH
H
OH
H
OH
H
OH
H
OH
H
OH
CH 2 OH
D-глюкоза
CH2 OH
CH2 OH
Полуацеталь
Ацеталь
D-глюкозы
D-глюкозы
10.
H2C
H2C
H2C
O
C
H
H
OH
C
H2
O
OH
5-гидрокси пентаналь
Полуацеталь
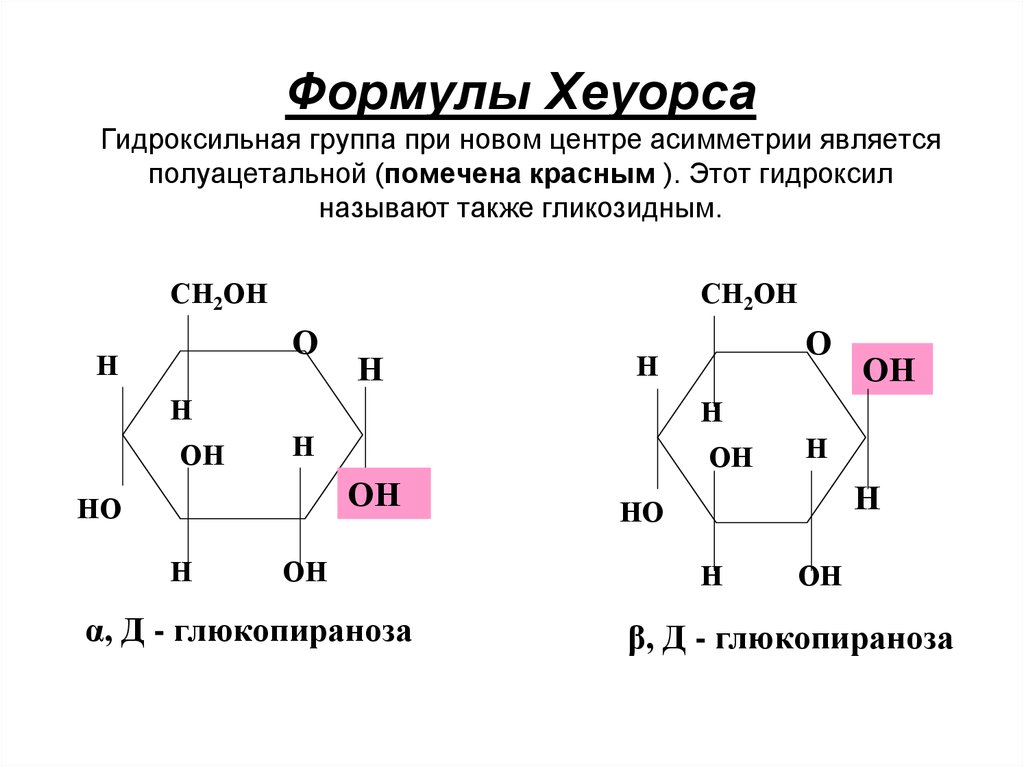
11. Формулы Хеуорса Гидроксильная группа при новом центре асимметрии является полуацетальной (помечена красным ). Этот гидроксил
называют также гликозидным.СН2ОН
СН2ОН
О
Н
Н
Н
Н
ОН
ОН
Н
Н
ОН
ОН
НО
Н
О
ОН
α, Д - глюкопираноза
Н
Н
НО
Н
ОН
β, Д - глюкопираноза
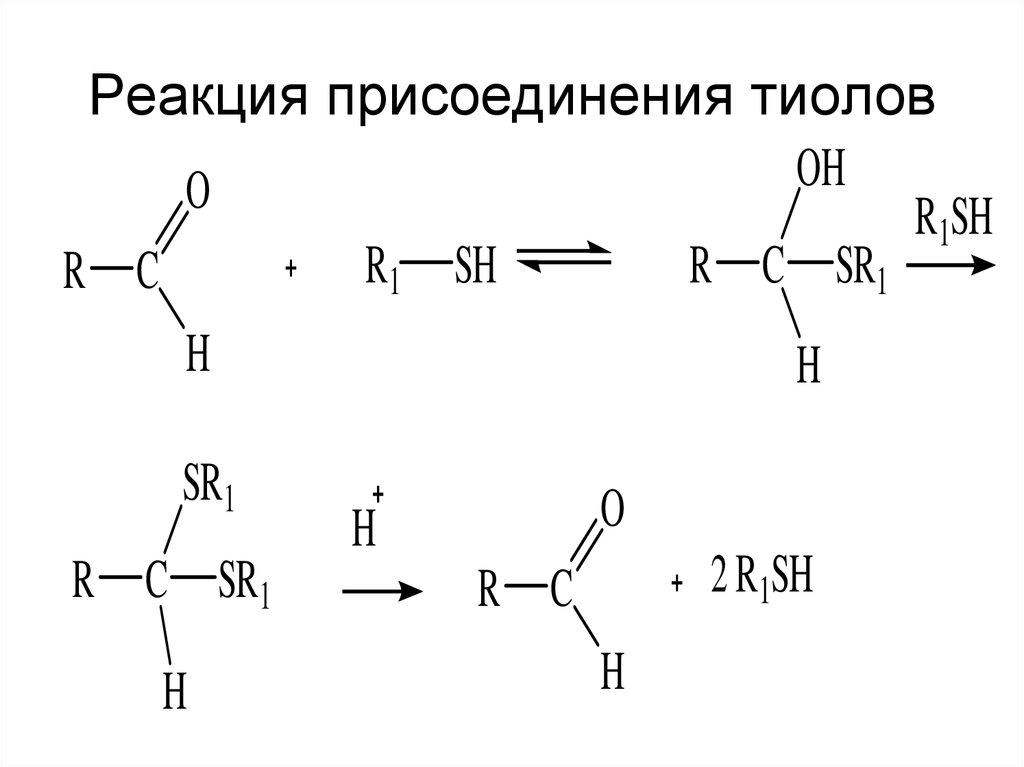
12. Реакция присоединения тиолов
OHO
R1SH
R1 SH
R C SR1
R C
H
H
SR1
R C SR1
H
O
H
2 R1SH
R C
H
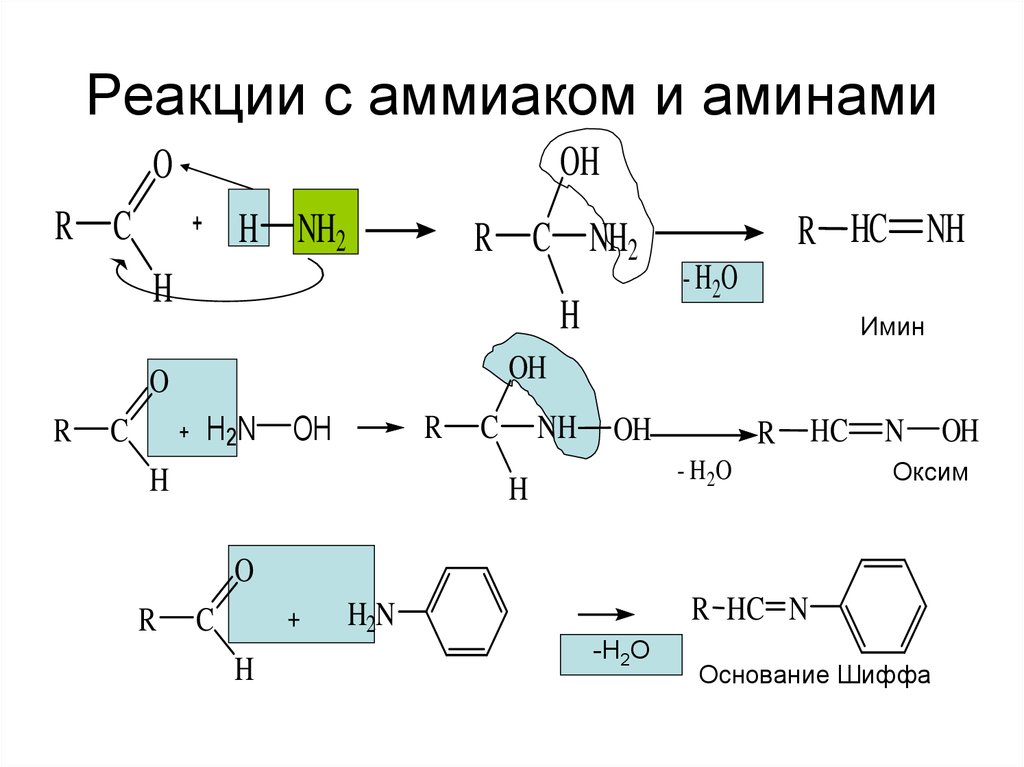
13. Реакции с аммиаком и аминами
OHO
R C
H NH2
R C NH2
H
H
H2N
C
- H2O
Имин
OH
O
R
R HC NH
R
OH
H
C
NH
OH
R
- H2O
H
HC
N
Оксим
O
R
H2N
C
H
R HC N
-Н2О
OH
Основание Шиффа
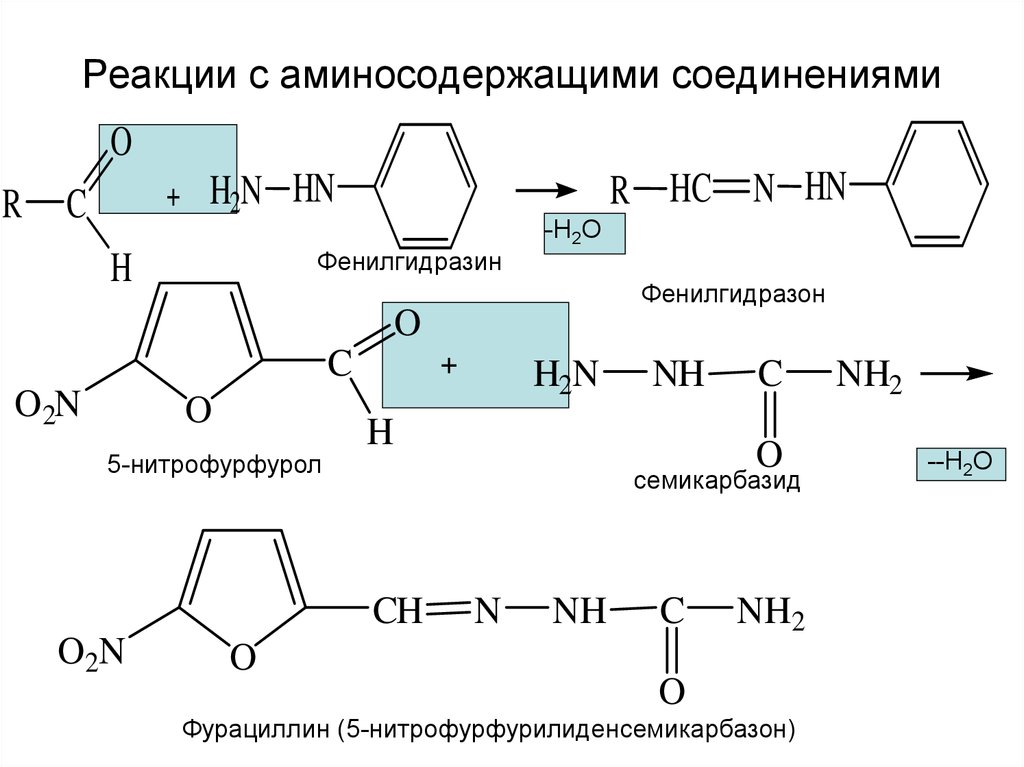
14. Реакции с аминосодержащими соединениями
OR
R HC N HN
H2N HN
C
Фенилгидразин
H
-Н2О
Фенилгидразон
O
C
O2N
O
H2N
H
семикарбазид
CH
O
C
O
5-нитрофурфурол
O2N
NH
N
NH
C
NH2
O
Фурациллин (5-нитрофурфурилиденсемикарбазон)
NH2
--Н2О
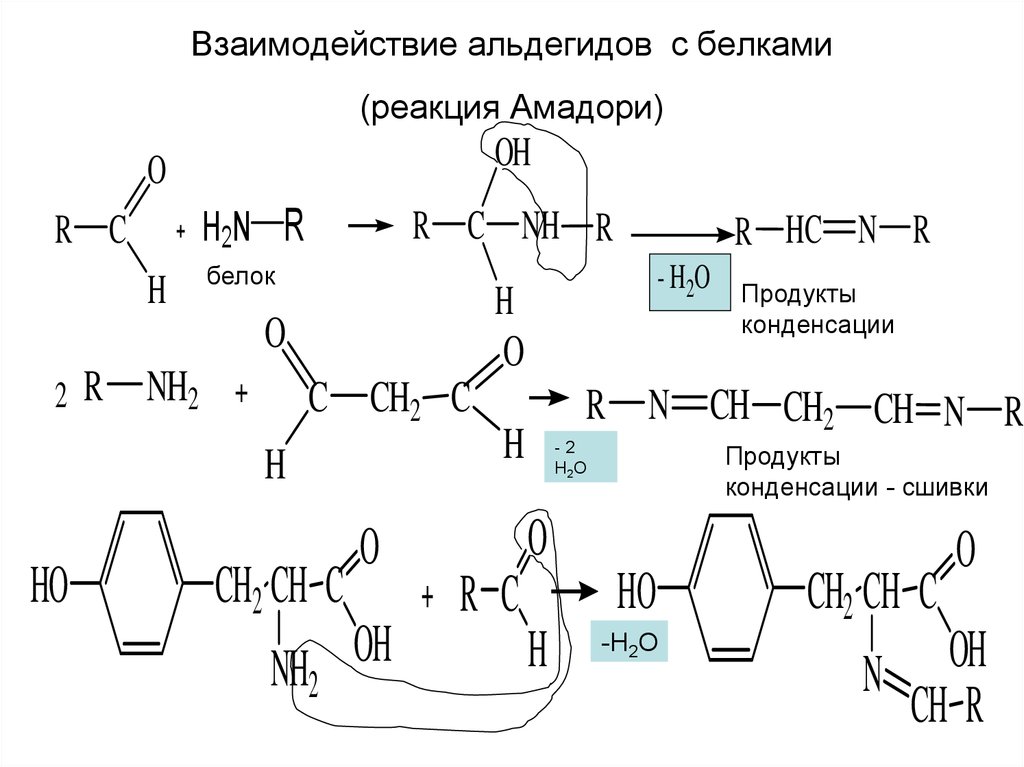
15. Взаимодействие альдегидов с белками (реакция Амадори)
OHO
H2N R
R C
H
R C NH R
белок
NH2
O
C CH2 C
H
HO
- H2O
H
O
2 R
R HC N R
CH2 CH C
O
OH
NH2
Продукты
конденсации
R N CH CH2 CH N R
H
-2
Н2О
Продукты
конденсации - сшивки
O
HO
R C
H
-Н2О
CH2 CH C
O
OH
N
CH R
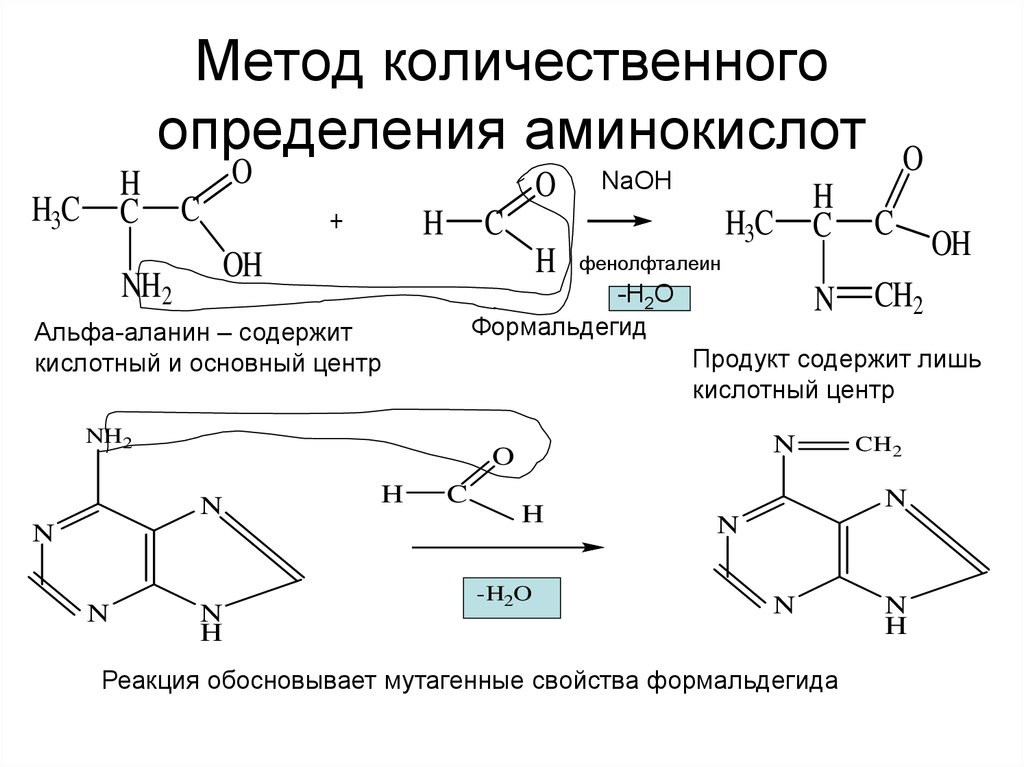
16. Метод количественного определения аминокислот
HC
H3C
O
O
C
H
C
N
N
H
C
N
CH2
N
O
H
H
C
OH
Продукт содержит лишь
кислотный центр
NH 2
N
O
фенолфталеин
-Н2О
Формальдегид
Альфа-аланин – содержит
кислотный и основный центр
N
H3C
H
OH
NH2
NaOH
C
H
-H2O
CH2
N
N
N
Реакция обосновывает мутагенные свойства формальдегида
N
H
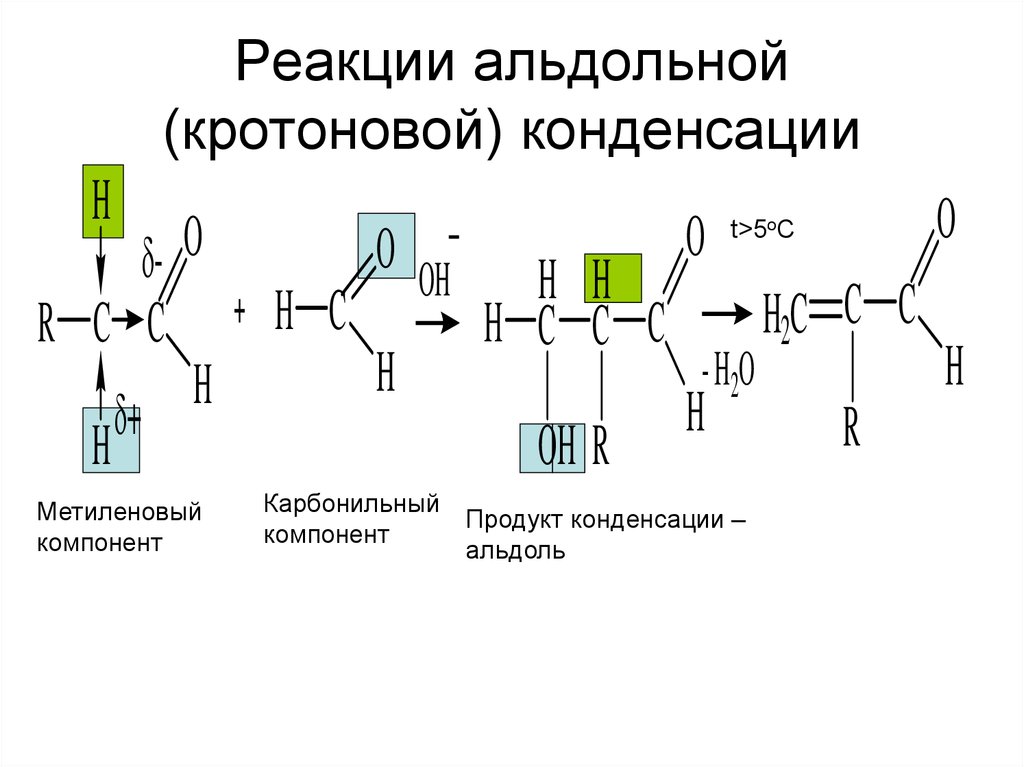
17. Реакции альдольной (кротоновой) конденсации
H- O
R C C
H
+
H
Метиленовый
компонент
H C
O OH
H
H H
H C C C
OH R
Карбонильный
компонент
O
O
t>5оС
- H2O
H
Продукт конденсации –
альдоль
H2C C C
R
H
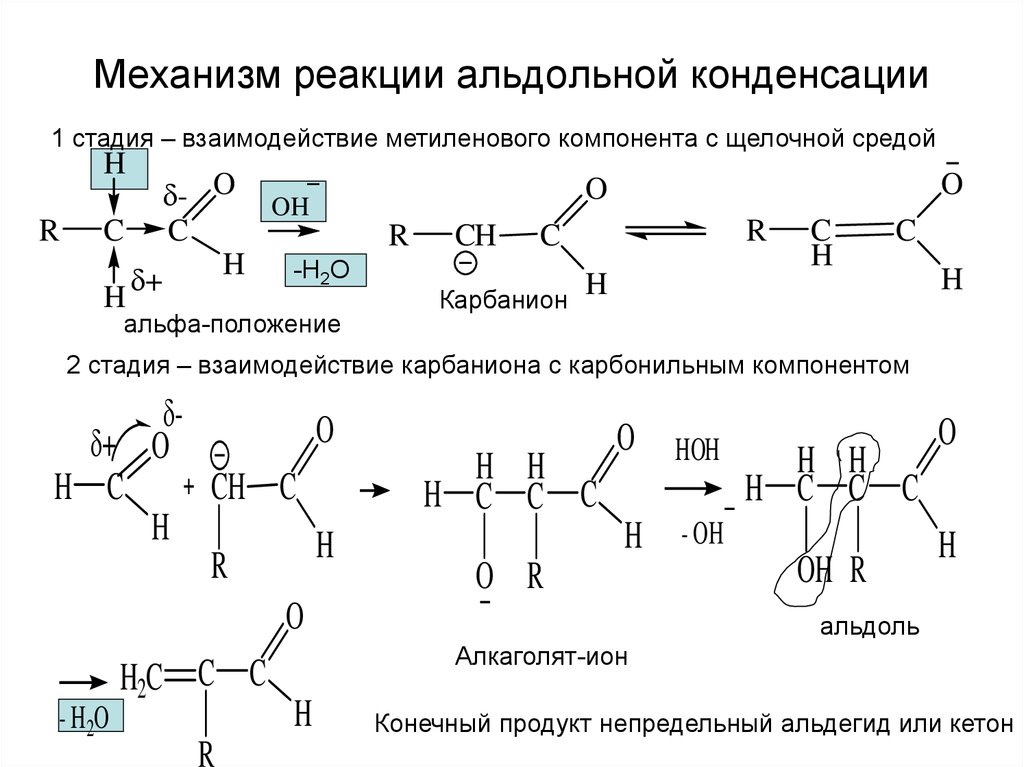
18. Механизм реакции альдольной конденсации
1 стадия – взаимодействие метиленового компонента с щелочной средойH
R
- O OH
C C
H
-Н2О
+
H
альфа-положение
O
O
R
CH
R
C
H
Карбанион
C
H
C
H
2 стадия – взаимодействие карбаниона с карбонильным компонентом
O
+ O
H C
CH C
H
H
R
O
H2C C C
H
- H2O
R
H H
H C C C
O
HOH
H
- OH
O R
H H
H C C C
OH R
O
H
альдоль
Алкаголят-ион
Конечный продукт непредельный альдегид или кетон
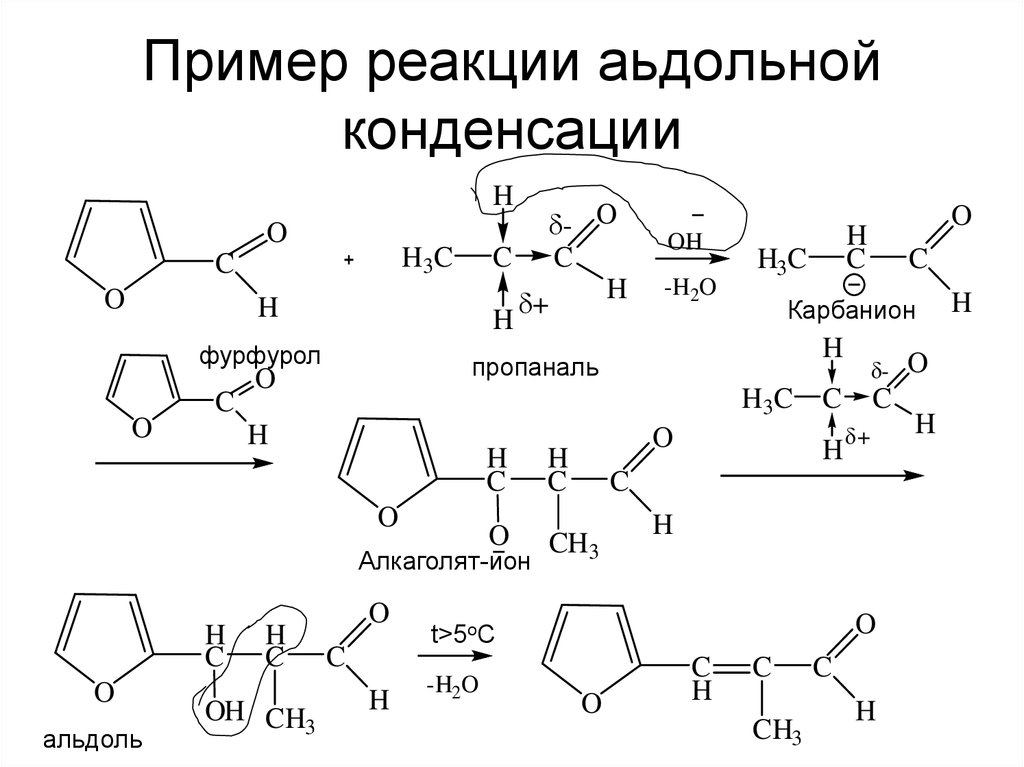
19. Пример реакции аьдольной конденсации
HO
H 3C
C
O
C
H
H
фурфурол
O
C
+
H
C
O
Алкаголят-ион
O
альдоль
OH CH3
-H2O
H3C
O
C
H
H
H
-
C
+
C
CH3
H
O
t>5oC
-H2O
C
Карбанион
O
H
C
O
H
C
H3C C
O
H
C
OH
пропаналь
O
H
H
C
- O
C
H
O
C
H
C
CH3
C
H
O
H
H
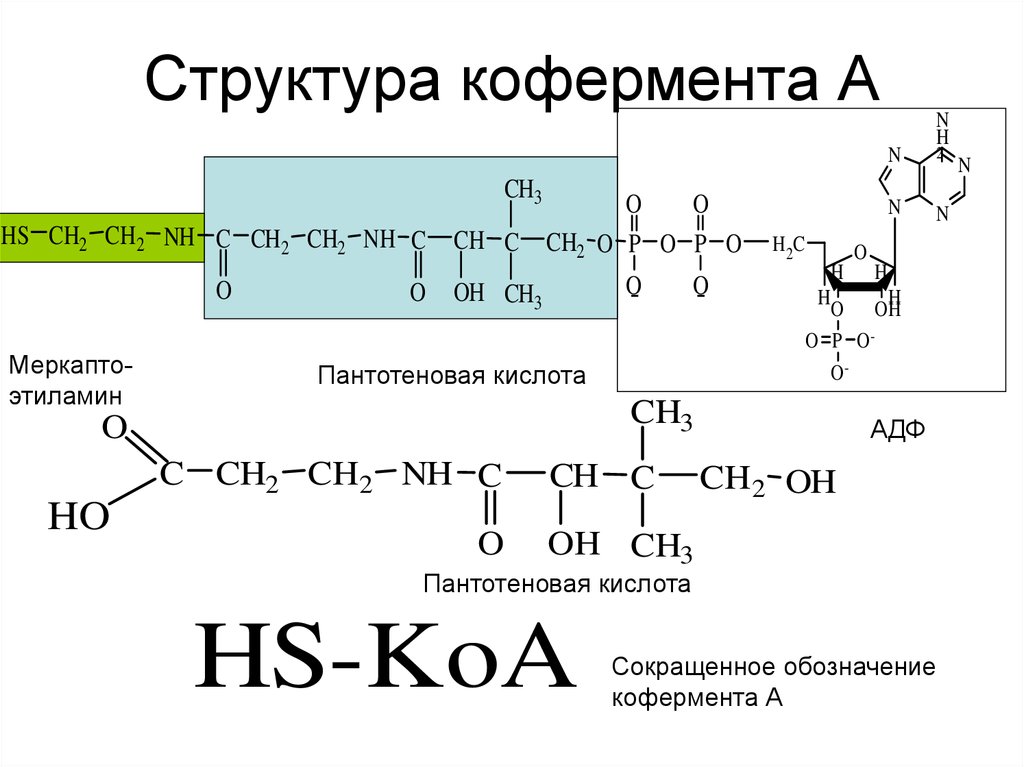
20. Структура кофермента А
NCH3
HS CH2 CH2 NH C CH2 CH2 NH C
O
Меркаптоэтиламин
O
CH C
O
CH2 O P O P O
O
OH CH3
O
Пантотеновая кислота
N
H 2C
C CH2 CH2 NH C
O
CH C
2
N
O
H
H
H
H
O OH
O P OO-
CH3
O
HO
O
N
H
АДФ
CH2 OH
OH CH3
Пантотеновая кислота
HS-KoA
Сокращенное обозначение
кофермента А
N
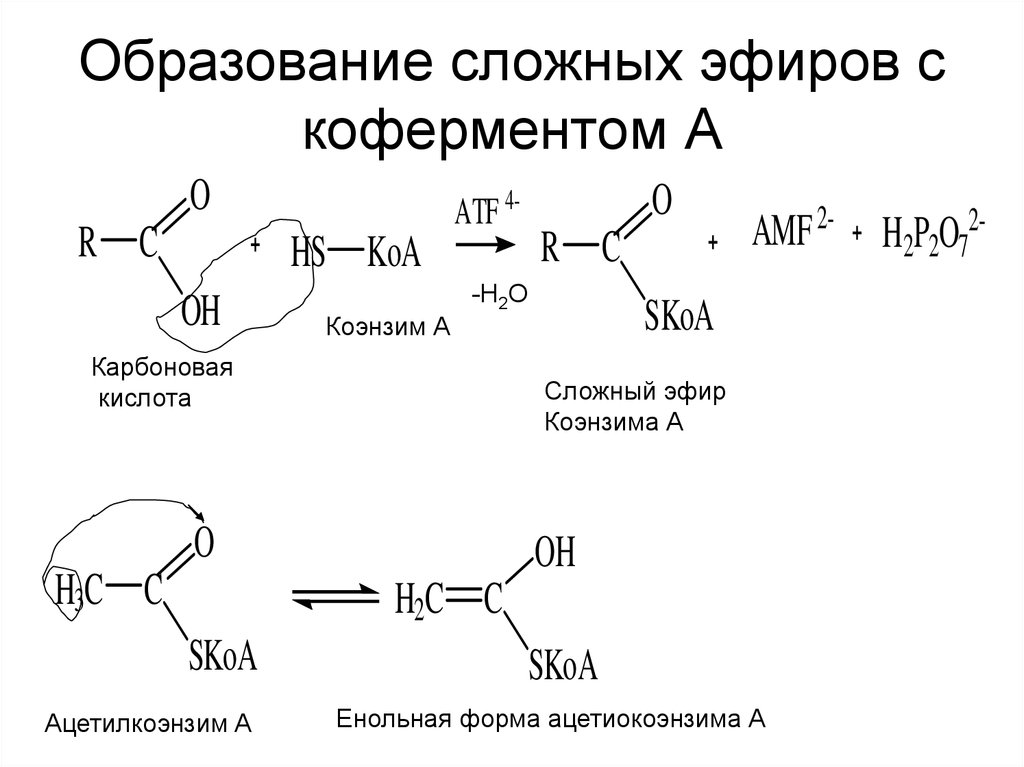
21. Образование сложных эфиров с коферментом А
OR C
ATF 4-
HS KoA
OH
Коэнзим А
R C
-Н2О
Карбоновая
кислота
AMF 2-
SKoA
Сложный эфир
Коэнзима А
O
H3C C
O
OH
H2C C
SKoA
Ацетилкоэнзим А
SKoA
Енольная форма ацетиокоэнзима А
H2P2O72-
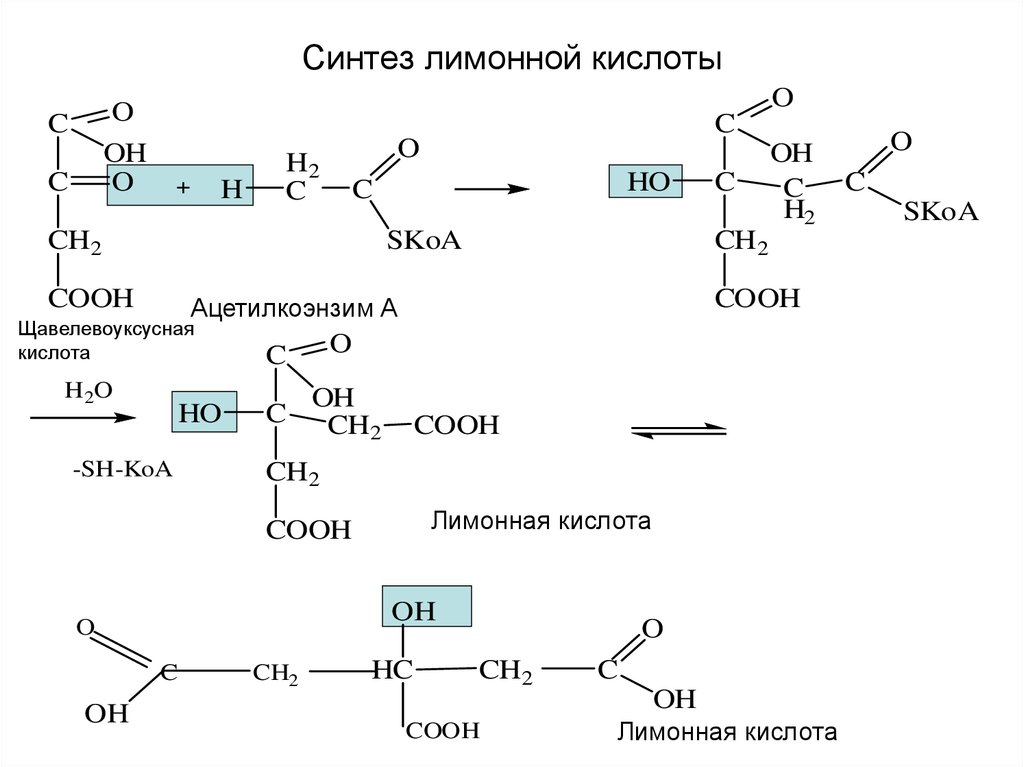
22. Синтез лимонной кислоты
OO
OH
O
C
C
H
O
H2
C
HO
C
CH2
SKoA
COOH
H 2O
HO
-SH-KoA
C
O
C
OH
CH2
COOH
COOH
CH2
Лимонная кислота
COOH
OH
O
C
C
OH
C
H2
CH2
Ацетилкоэнзим А
Щавелевоуксусная
кислота
OH
C
CH2
HC
O
CH2
C
OH
COOH
Лимонная кислота
O
C
SKoA
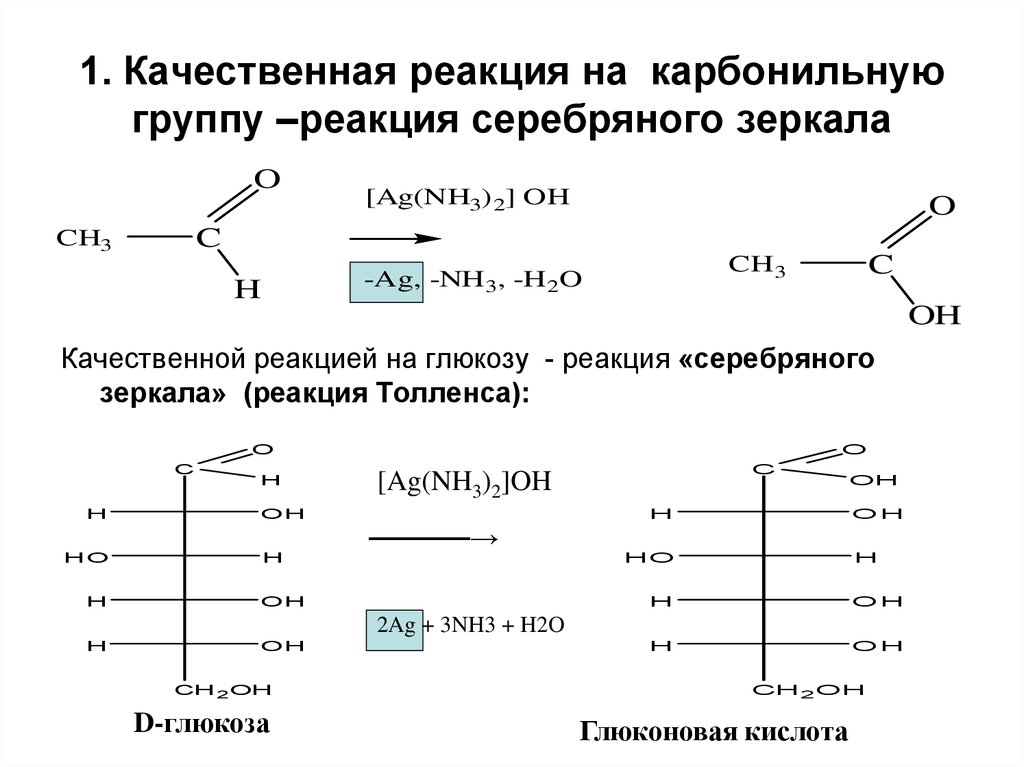
23. 1. Качественная реакция на карбонильную группу –реакция серебряного зеркала
O[Ag(NH3) 2] OH
O
C
CH3
H
C
CH 3
-Ag, -NH 3, -H 2O
OH
Качественной реакцией на глюкозу - реакция «серебряного
зеркала» (реакция Толленса):
O
C
H
HO
H
O
OH
H
H
OH
H
OH
C
[Ag(NH3)2]OH
H
─────→
OH
OH
HO
H
H
OH
H
OH
2Ag + 3NH3 + H2O
CH 2 OH
D-глюкоза
CH 2 OH
Глюконовая кислота
24. Карбонильный стресс
Под карбонильным стрессом понимаютпротекание нежелательных для
организма процессов на фоне повышенного уровня карбонильных соединений,
образующихся при нарушениях
углеводного, липидного обмена, при
алкоголизме.
25.
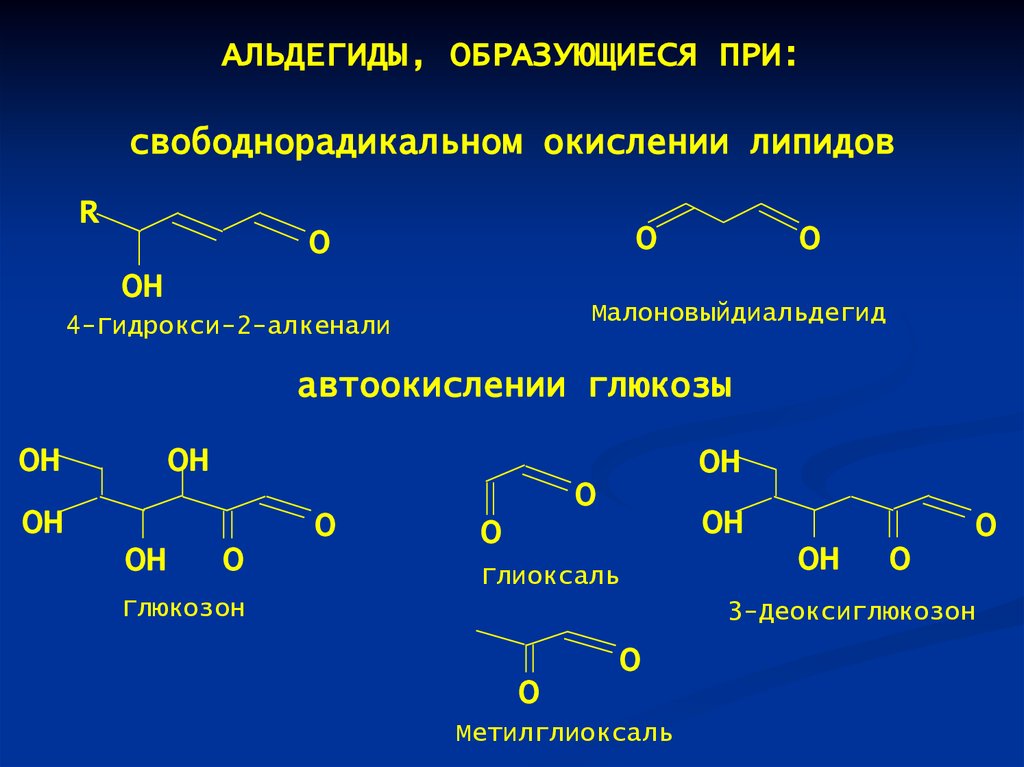
АЛЬДЕГИДЫ, ОБРАЗУЮЩИЕСЯ ПРИ:свободнорадикальном окислении липидов
R
O
O
OH
O
Малоновыйдиальдегид
4-Гидрокси-2-алкенали
автоокислении глюкозы
OH
OH
OH
O
OH
O
OH
O
OH
O
Глиоксаль
Глюкозон
OH
O
O
3-Деоксиглюкозон
O
O
Метилглиоксаль
26.
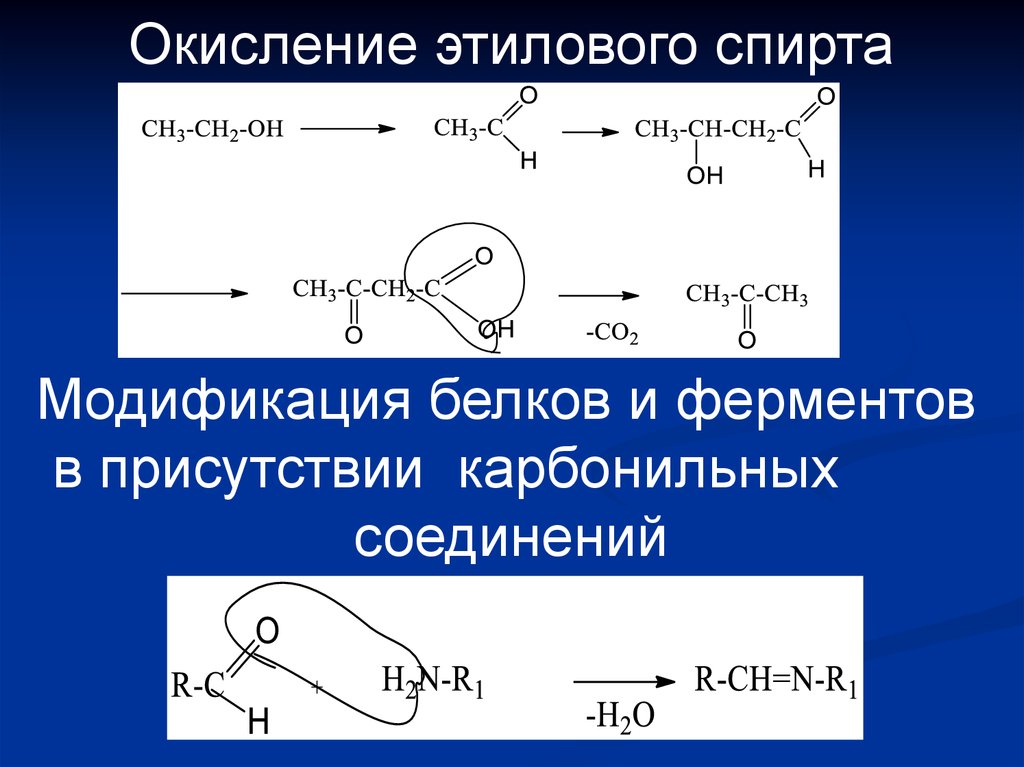
Окисление этилового спиртаМодификация белков и ферментов
в присутствии карбонильных
соединений
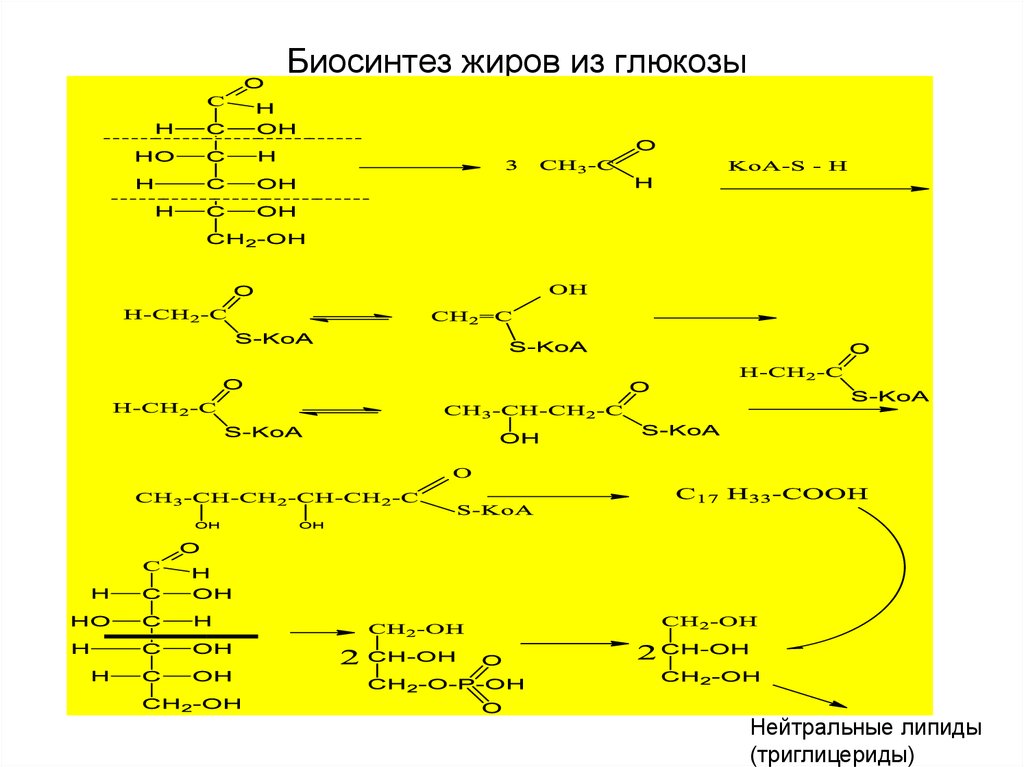
27. Биосинтез жиров из глюкозы
Нейтральные липиды(триглицериды)





 chemistry
chemistry








