Similar presentations:
Биологически важные реакции карбонильных соединений. Масс-спектрометрия
1. Лекция 3-I Биологически важные реакции карбонильных соединений. Масс-спектрометрия.
Кафедра общей и медицинской химииЛекция 3-I
Биологически важные реакции
карбонильных соединений.
Масс-спектрометрия.
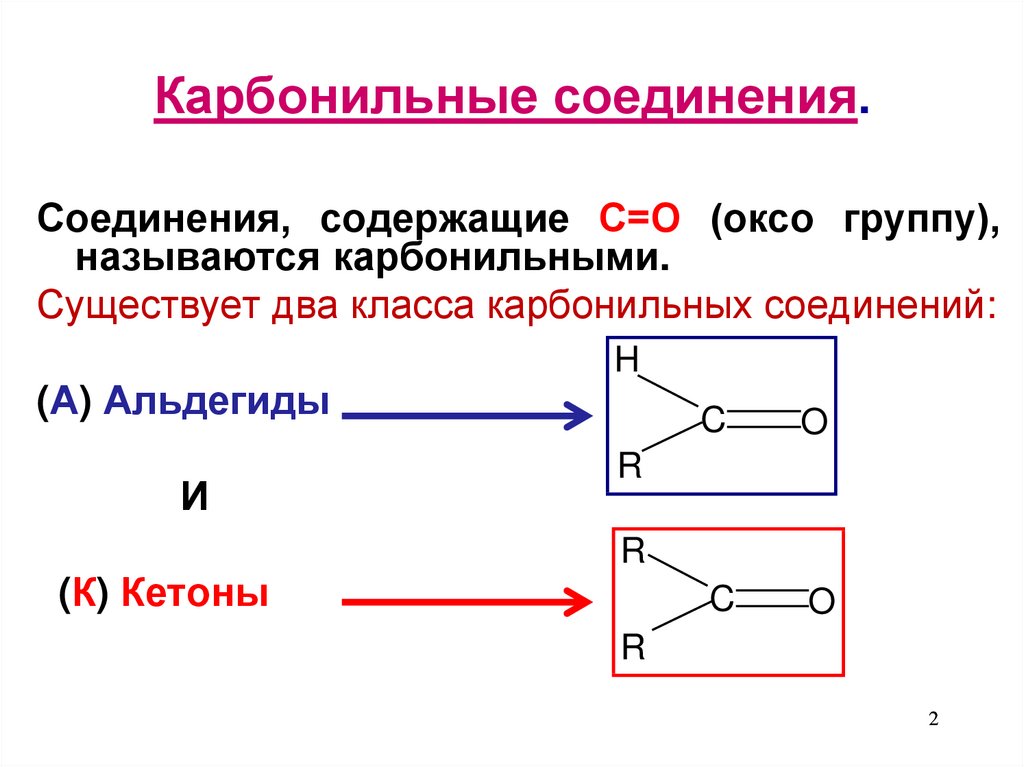
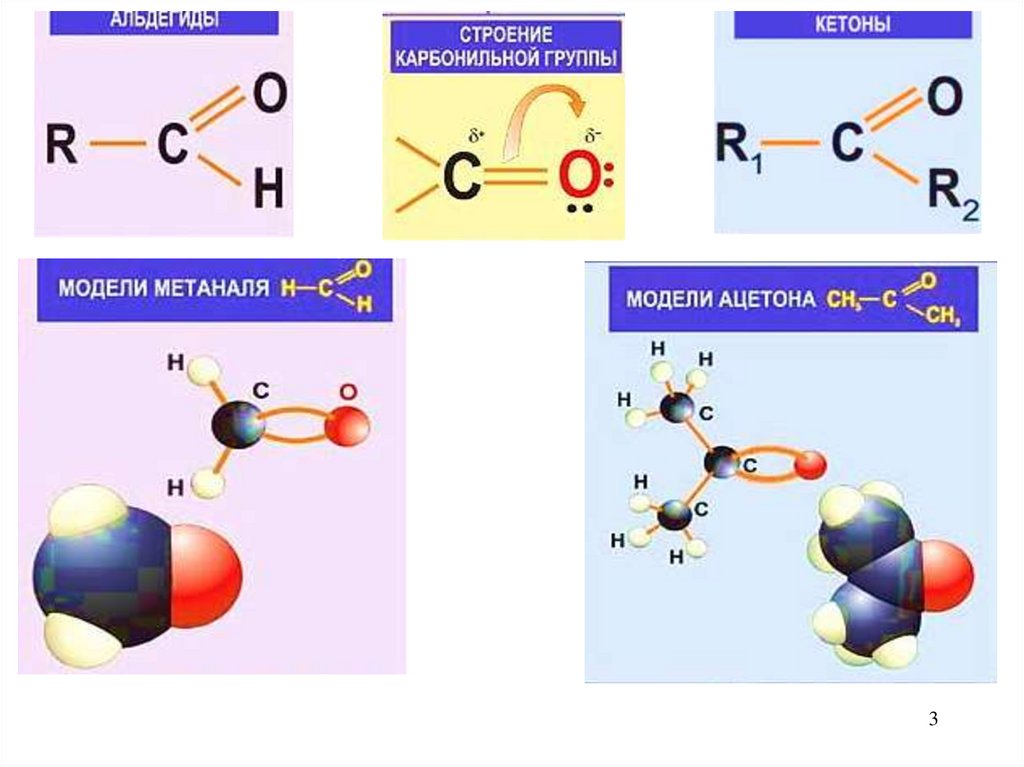
2. Карбонильные соединения.
Соединения, содержащие С=О (оксо группу),называются карбонильными.
Существует два класса карбонильных соединений:
(А) Альдегиды
И
(К) Кетоны
H
C
O
C
O
R
R
R
2
3.
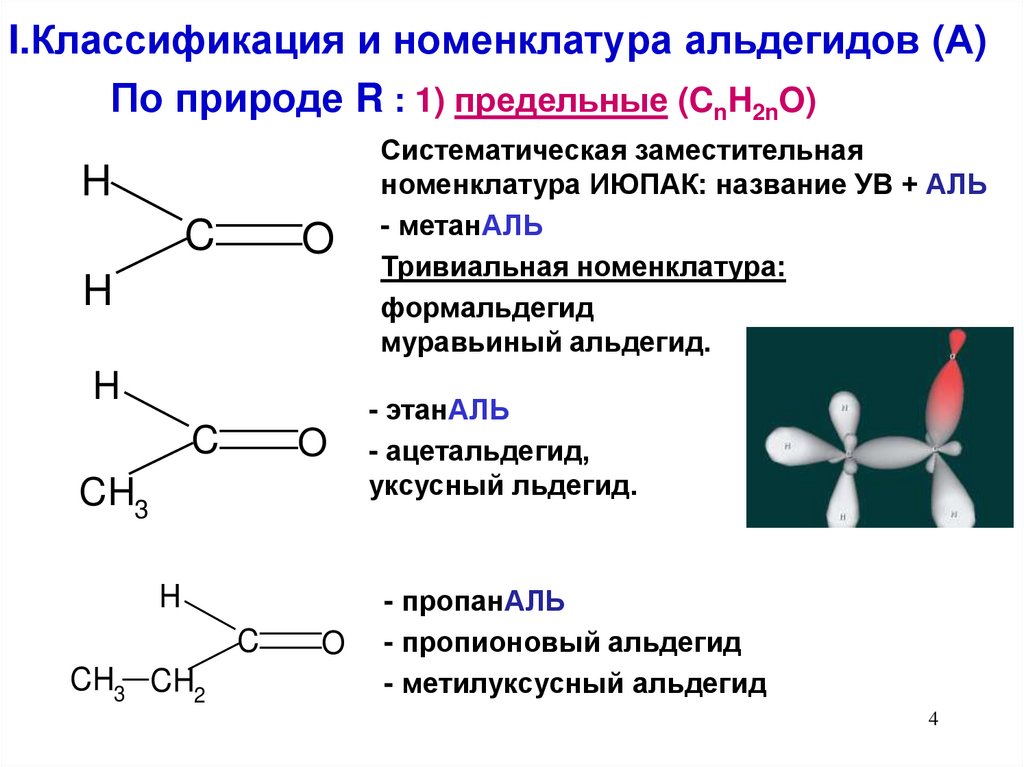
34. I.Классификация и номенклатура альдегидов (А)
По природе R : 1) предельные (CnH2nO)H
C
O
H
H
C
O
CH3
H
C
CH3 CH2
O
Систематическая заместительная
номенклатура ИЮПАК: название УВ + АЛЬ
- метанАЛЬ
Тривиальная номенклатура:латура
формальдегид
муравьиный альдегид.
- этанАЛЬ
- ацетальдегид,
уксусный льдегид.
- пропанАЛЬ
- пропионовый альдегид
- метилуксусный альдегид
4
5.
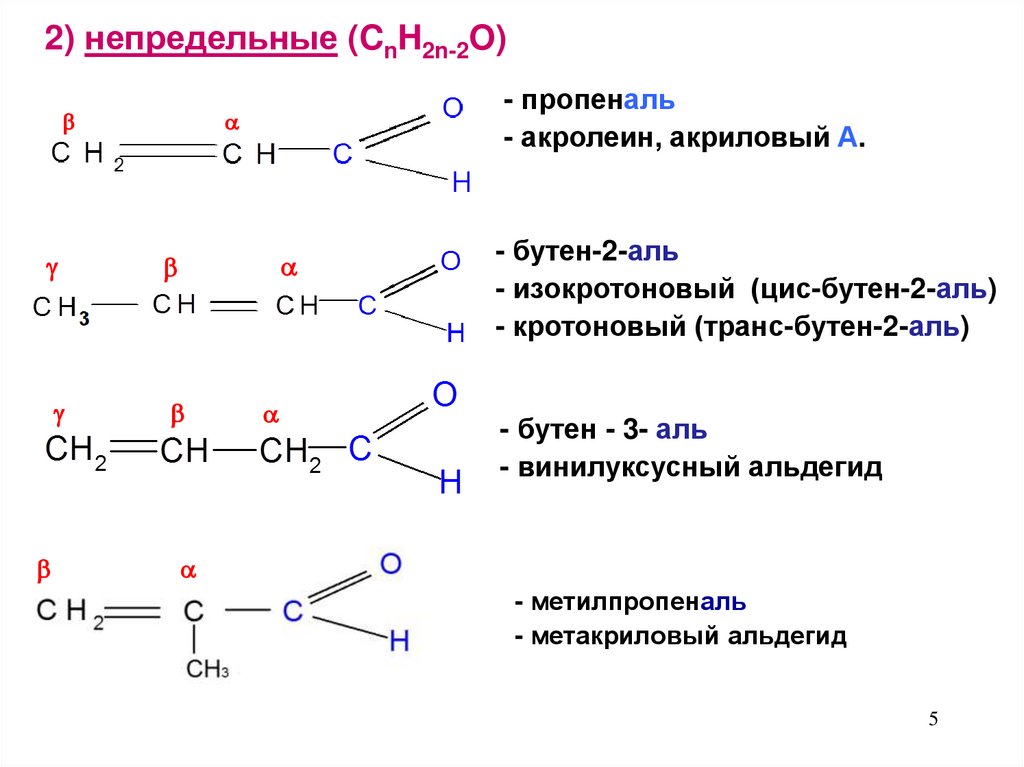
2) непредельные (CnH2n-2O)- пропеналь
- акролеин, акриловый А.
- бутен-2-аль
- изокротоновый (цис-бутен-2-аль)
- кротоновый (транс-бутен-2-аль)
- бутен - 3- аль
- винилуксусный альдегид
- метилпропеналь
- метакриловый альдегид
5
6.
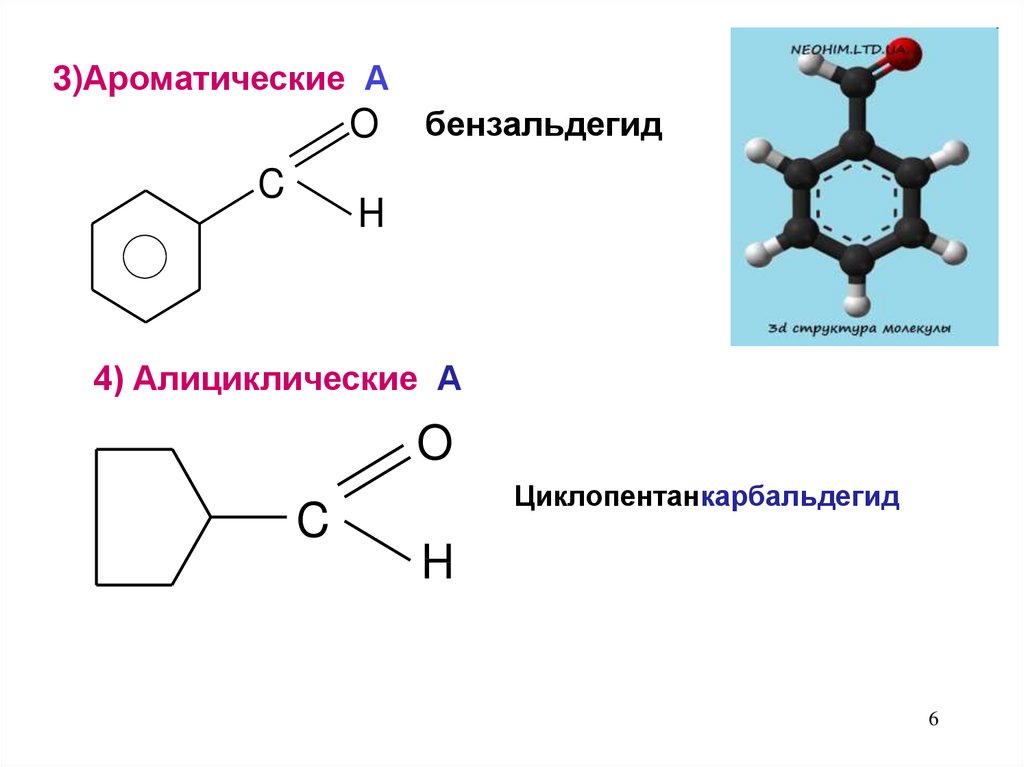
3)Ароматические АO
C
бензальдегид
H
4) Алициклические А
O
C
Циклопентанкарбальдегид
H
6
7.
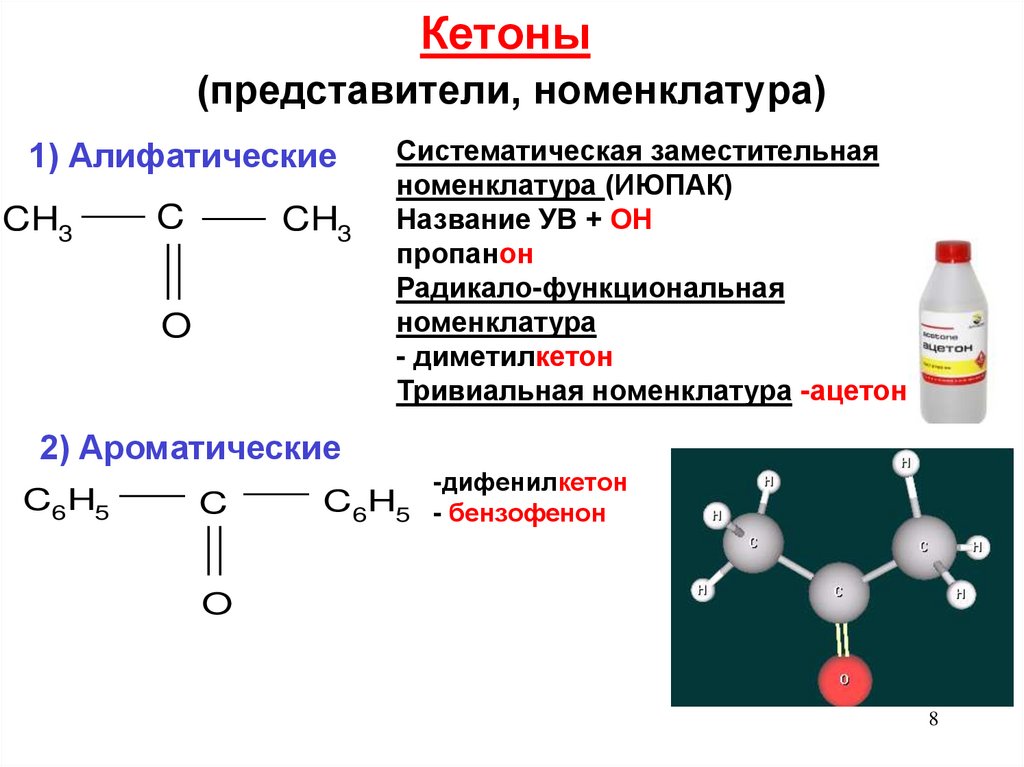
78. Кетоны (представители, номенклатура)
1) АлифатическиеCH3
C
CH3
O
Систематическая заместительная
номенклатура (ИЮПАК)
Название УВ + ОН
пропанон
Радикало-функциональная
номенклатура
- диметилкетон
Тривиальная номенклатура -ацетон
2) Ароматические
C6H5
C
-дифенилкетон
C6H5 - бензофенон
O
8
9.
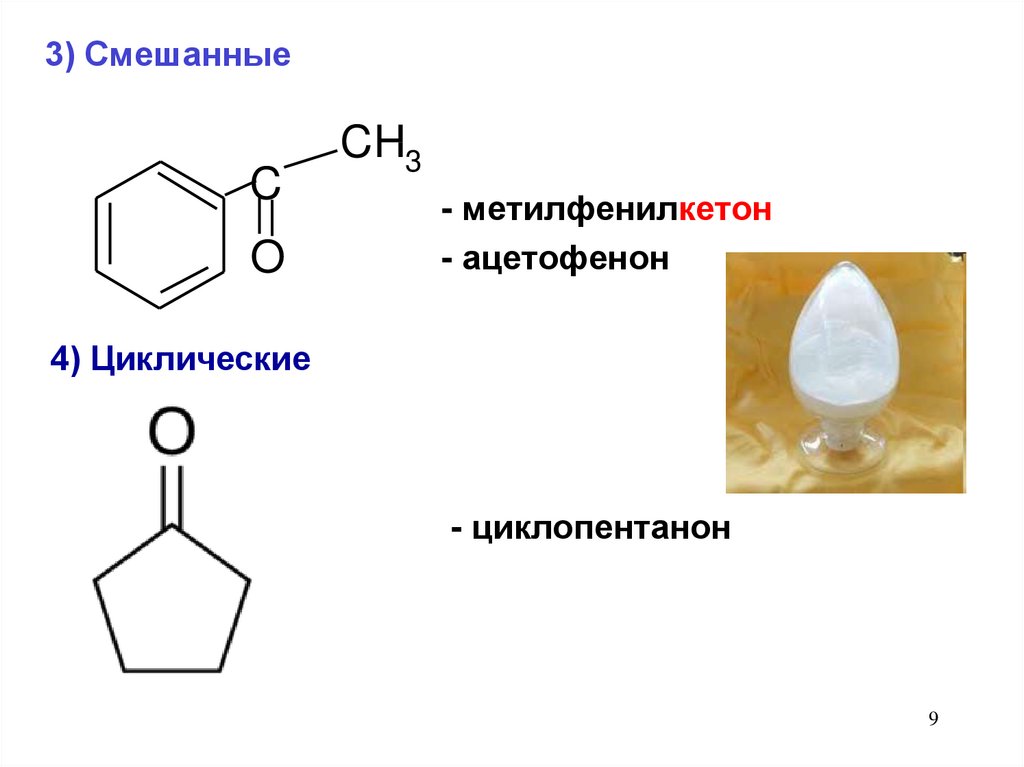
3) СмешанныеC
O
CH3
- метилфенилкетон
- ацетофенон
4) Циклические
- циклопентанон
9
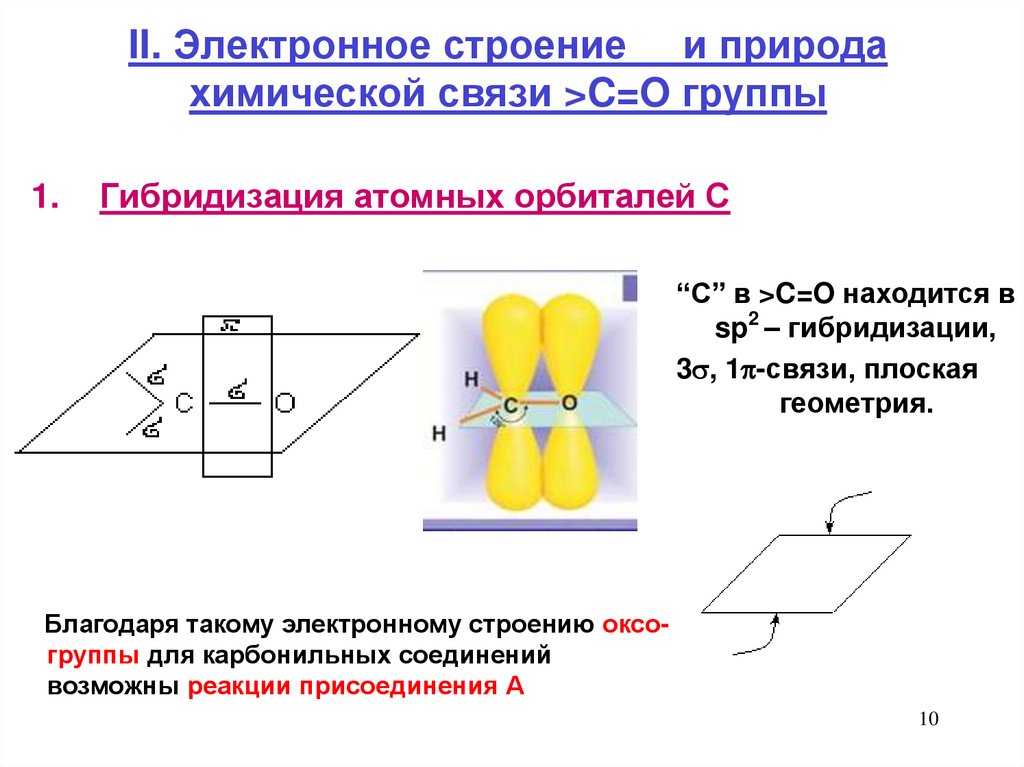
10. II. Электронное строение и природа химической связи >C=O группы
II. Электронное строение и природахимической связи >C=O группы
1.
Гибридизация атомных орбиталей С
“С” в >C=O находится в
sp2 – гибридизации,
3 , 1 -связи, плоская
геометрия.
Благодаря такому электронному строению оксогруппы для карбонильных соединений
возможны реакции присоединения А
10
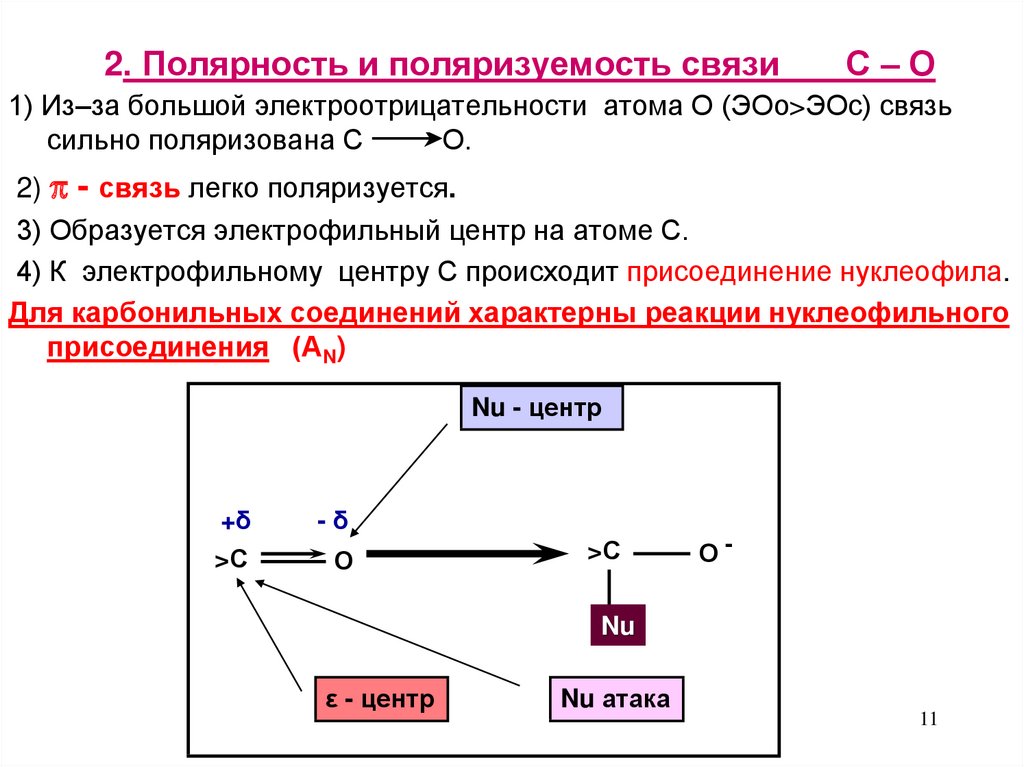
11. 2. Полярность и поляризуемость связи С – О
2. Полярность и поляризуемость связиС–О
1) Из–за большой электроотрицательности атома О (ЭОо>ЭОс) связь
сильно поляризована С
О.
2) - связь легко поляризуется.
3) Образуется электрофильный центр на атоме С.
4) К электрофильному центру С происходит присоединение нуклеофила.
Для карбонильных соединений характерны реакции нуклеофильного
присоединения (АN)
Nu - центр
+δ
>С
-δ
О
>С
О-
Nu
ε - центр
Nu атака
11
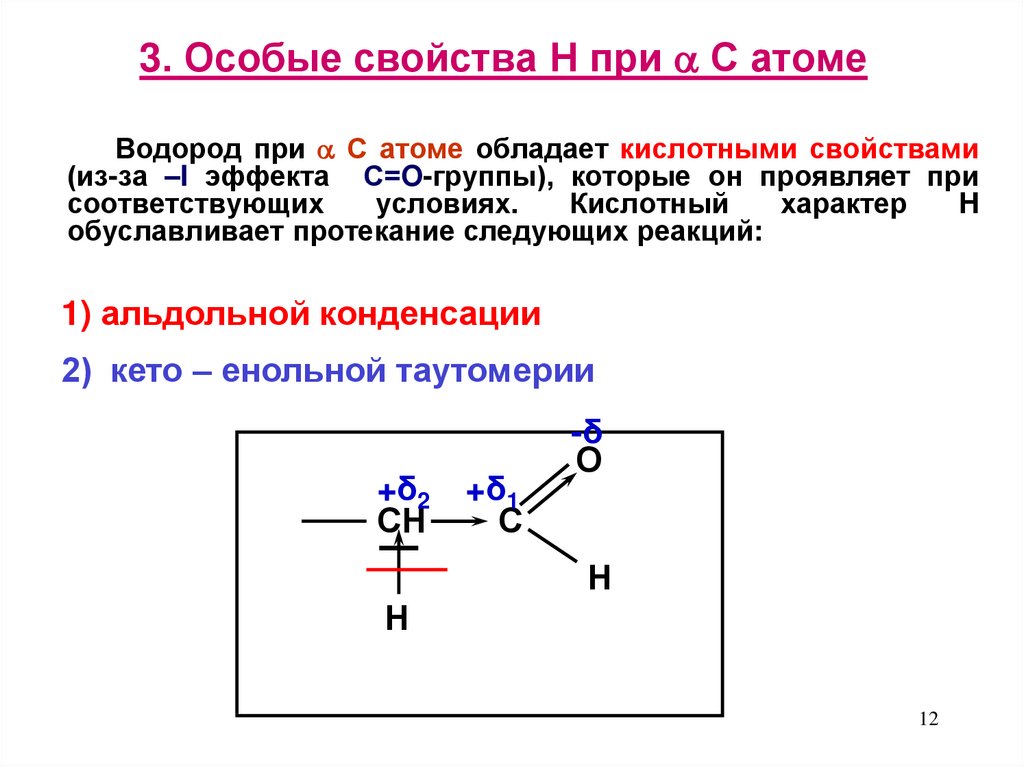
12. 3. Особые свойства Н при С атоме
3. Особые свойства Н при С атомеВодород при С атоме обладает кислотными свойствами
(из-за –I эффекта С=O-группы), которые он проявляет при
соответствующих
условиях.
Кислотный
характер
H
обуславливает протекание следующих реакций:
1) альдольной конденсации
2) кето – енольной таутомерии
+δ2
СН
+δ1
С
-δ
О
Н
Н
12
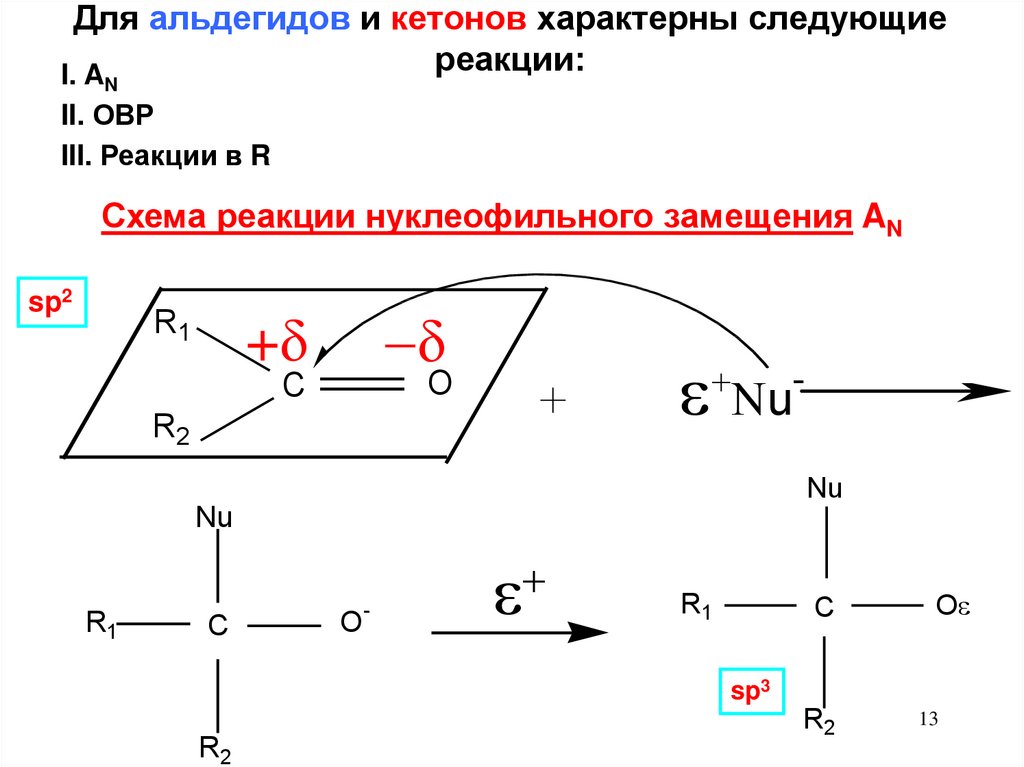
13. Для альдегидов и кетонов характерны следующие реакции:
I. AN
II. ОВР
III. Реакции в R
Схема реакции нуклеофильного замещения AN
sp2
R1
+
u
O
C
R2
Nu
Nu
R1
C
O
-
R1
C
sp3
R2
-
R2
O
13
14.
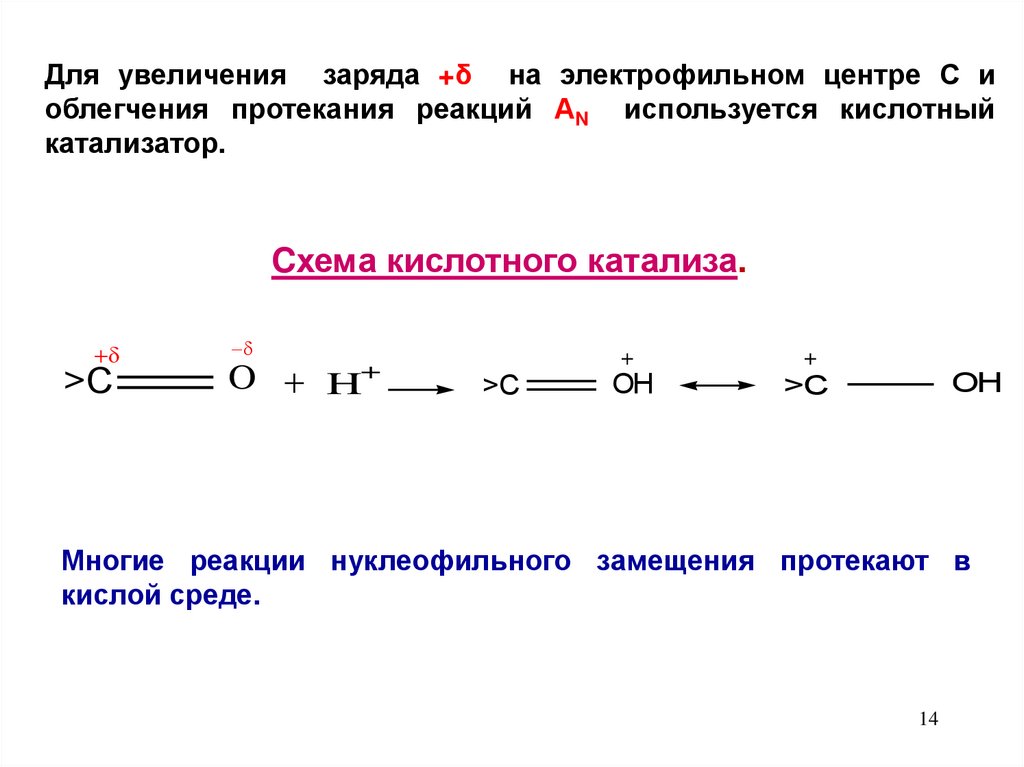
Для увеличения заряда +δ на электрофильном центре С иоблегчения протекания реакций АN используется кислотный
катализатор.
Cхема кислотного катализа.
>C
O
+
H
>C
+
OH
+
OH
>C
Многие реакции нуклеофильного замещения протекают в
кислой среде.
14
15.
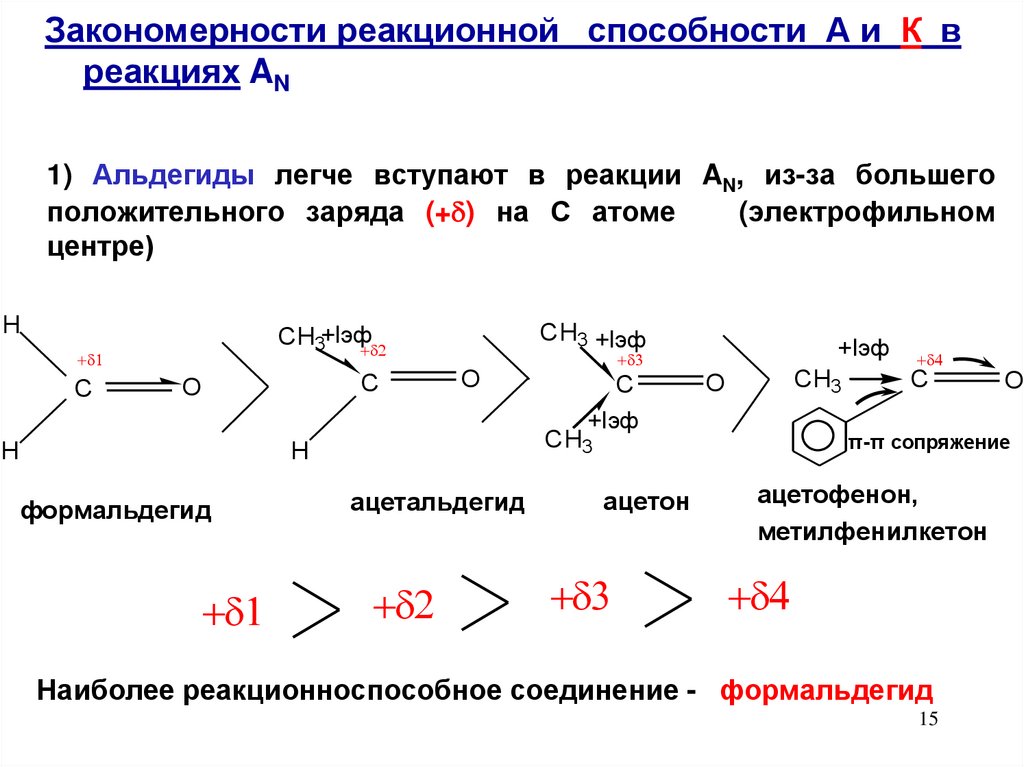
Закономерности реакционной способности А и К вреакциях AN
1) Альдегиды легче вступают в реакции AN, из-за большего
положительного заряда (+ ) на С атоме
(электрофильном
центре)
H
C
CH3 +Iэф
CH3+Iэф
C
O
H
O
C
+Iэф
+Iэф
CH3
O
CH3
H
формальдегид
ацетальдегид
ацетон
C
O
π-π сопряжение
ацетофенон,
метилфенилкетон
Наиболее реакционноспособное соединение - формальдегид
15
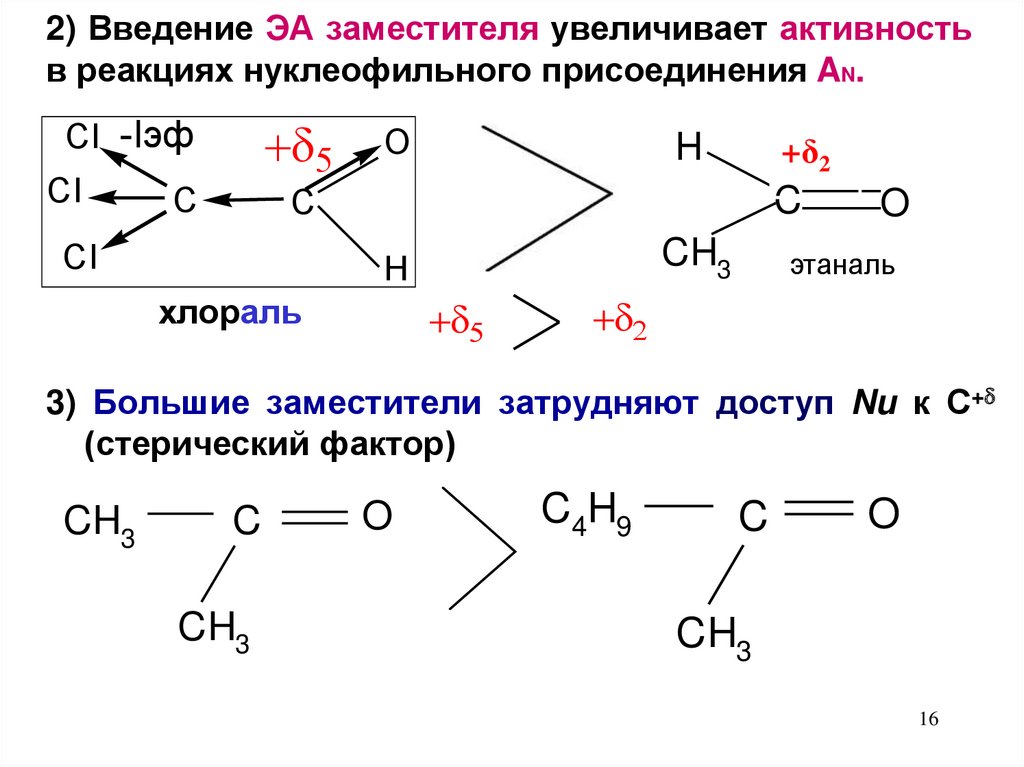
16.
2) Введение ЭА заместителя увеличивает активностьв реакциях нуклеофильного присоединения AN.
CI -Iэф
CI
С
O
H
+δ2
C
CI
C
CH3
H
хлораль
O
этаналь
3) Большие заместители затрудняют доступ Nu к С+
(стерический фактор)
CH3
C
CH3
O
C4H9
C
O
CH3
16
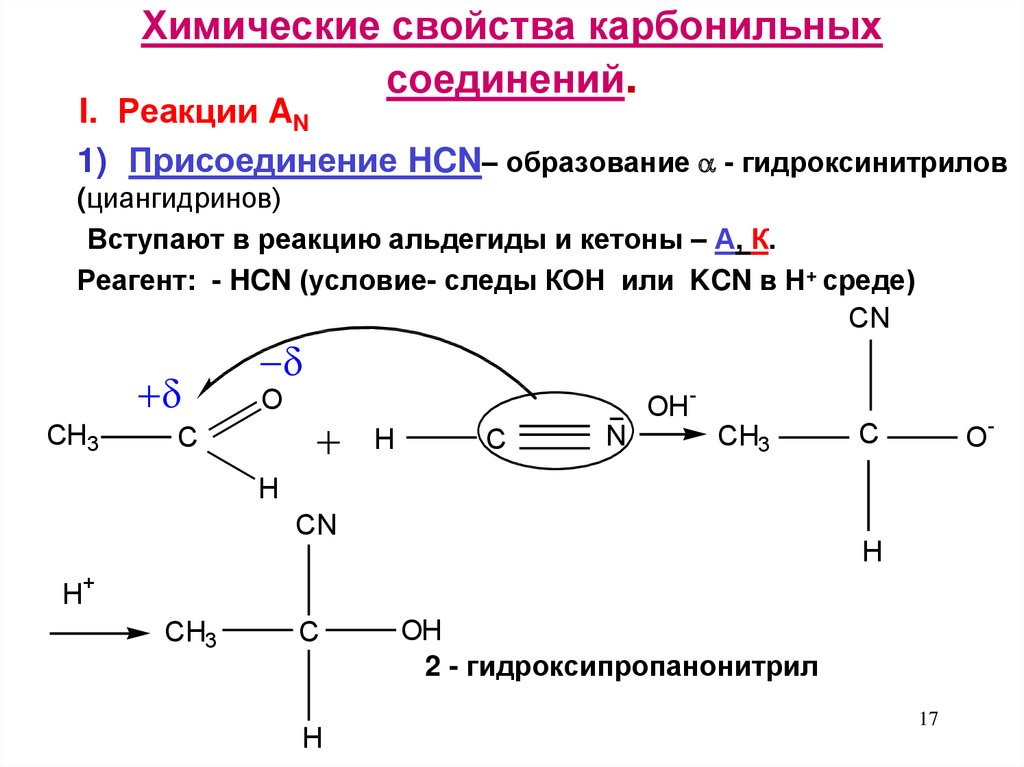
17. Химические свойства карбонильных соединений.
I. Реакции AN1) Присоединение HCN– образование - гидроксинитрилов
(циангидринов)
Вступают в реакцию альдегиды и кетоны – А, К.
Реагент: - HCN (условие- следы КОН или KCN в Н+ среде)
CN
СH3
O
C
H
C
N
OH
-
CH3
C
O
H
CN
H
+
H
CH3
C
H
OH
2 - гидроксипропанонитрил
17
-
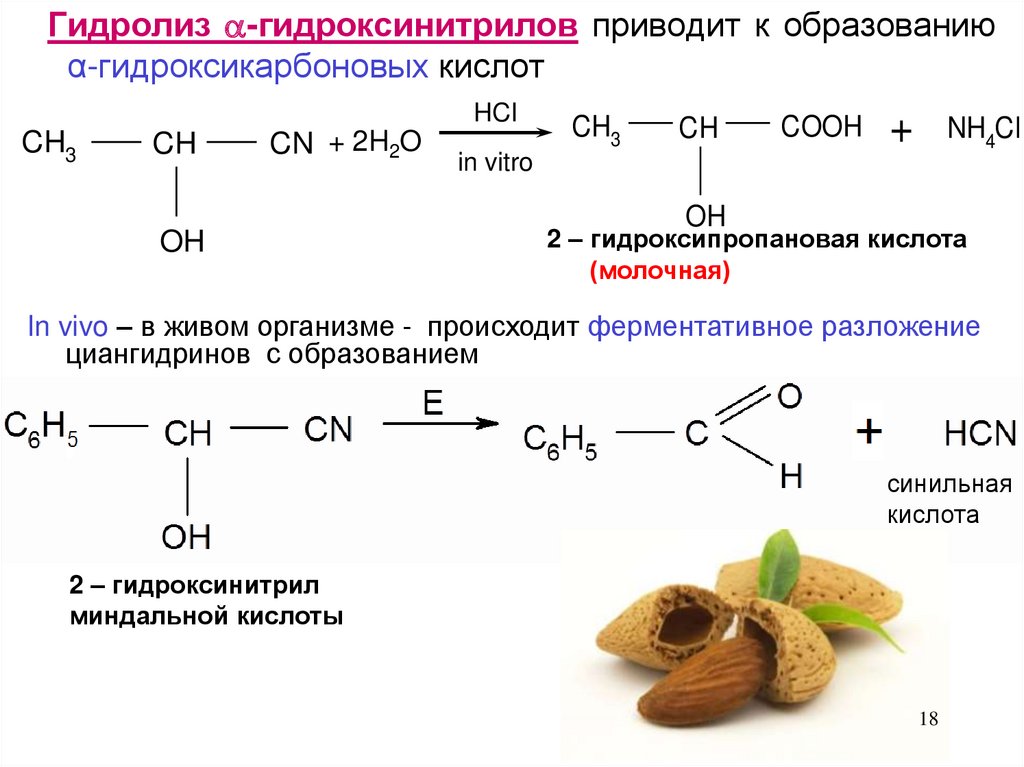
18.
Гидролиз -гидроксинитрилов приводит к образованиюα-гидроксикарбоновых кислот
HCI
CH3
CH
CN + 2H2O
OH
CH3
CH
COOH
+
NH4Cl
in vitro
OH
2 – гидроксипропановая кислота
(молочная)
In vivo – в живом организме - происходит ферментативное разложение
циангидринов с образованием
синильная
кислота
2 – гидроксинитрил
миндальной кислоты
18
19.
!Значение реакции присоединения HCN1) Используется при синтезе аминов и карбоновых кислот
(образуются соединения с большей длиной углеродной цепи)
RCN
RCN
H
RCH2NH2
восстановление
н2о
гидролиз
RCOOH
2) Применяется для получения - гидрокси- и
- аминокислот.
19
20.
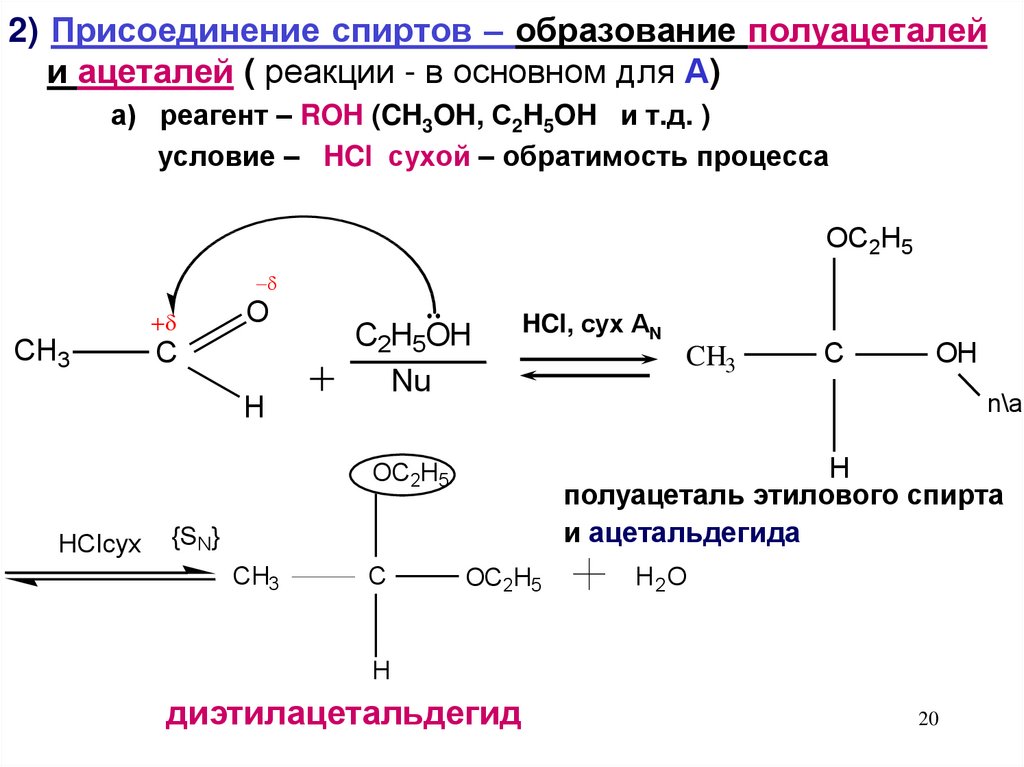
2) Присоединение спиртов – образование полуацеталейи ацеталей ( реакции - в основном для А)
а) реагент – ROH (CH3OH, С2H5OH и т.д. )
условие – HCl сухой – обратимость процесса
OC2H5
СH3
O
C
H
C2H5OH
Nu
HCl, сух АN
{SN}
CH3
C
C
OH
n\a
H
полуацеталь этилового спирта
и ацетальдегида
OC2H5
HCIсух
CH3
OC2H5
H 2O
H
диэтилацетальдегид
20
21.
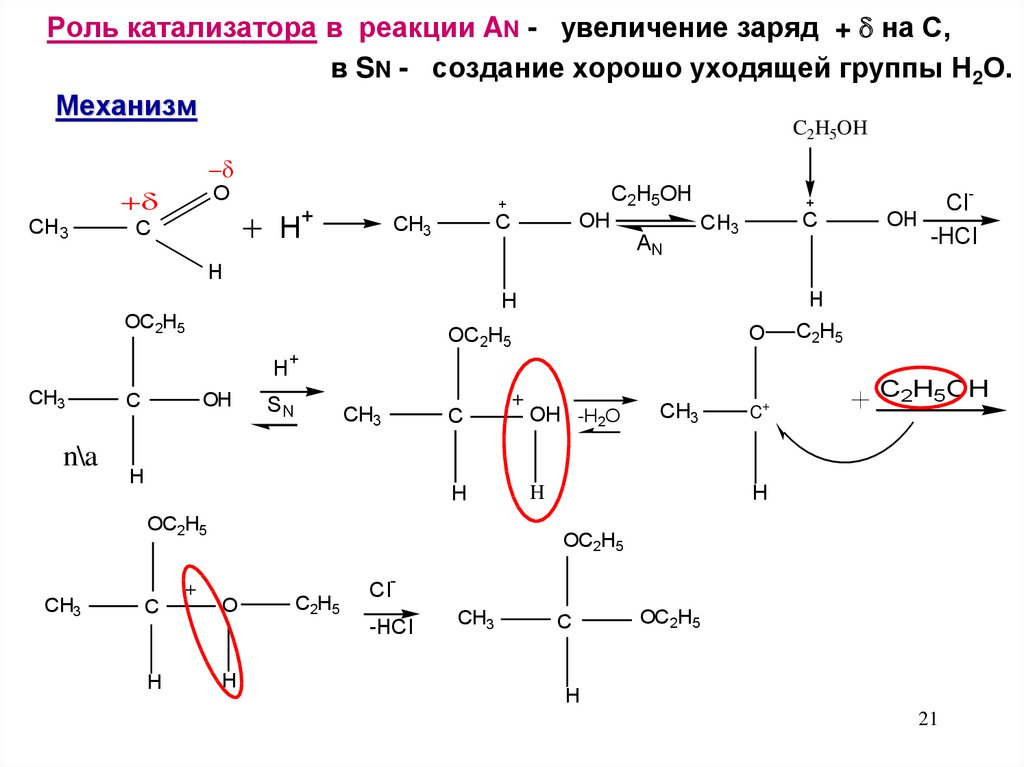
Роль катализатора в реакции AN - увеличение заряд + на С,в SN - создание хорошо уходящей группы Н2О.
Механизм
C2H5OH
СH3
O
C
H+
C2H5OH
+
OH
C
CH3
AN
+
C
CH3
-
CI
OH
-HCI
H
H
OC2H5
H
CH3
n\a
OH
C
+
SN
CH3
H
C
H
OC2H5
CH3
C
H
+
O
OC 2H5
+
OH -H2O
CH3
+
H
C2H5
C2H5OH
C
H
H
OC2H5
O
H
C2H5
CI-HCI
CH3
C
OC2H5
H
21
22.
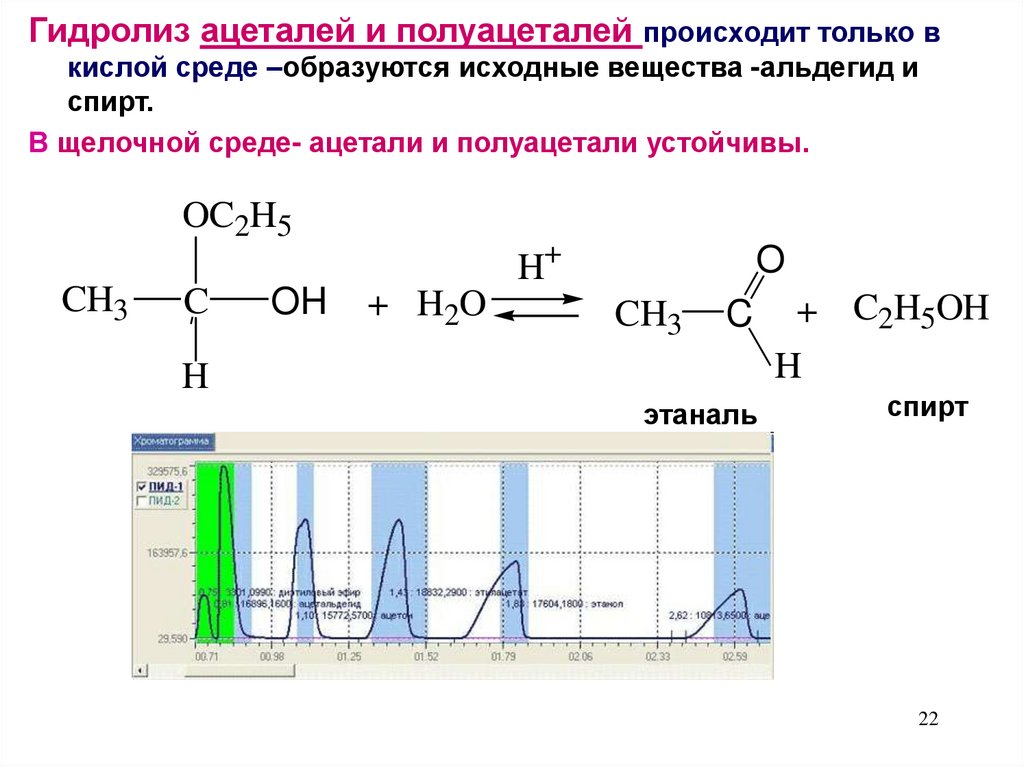
Гидролиз ацеталей и полуацеталей происходит только вкислой среде –образуются исходные вещества -альдегид и
спирт.
В щелочной среде- ацетали и полуацетали устойчивы.
OC2H5
CH3
C
OH
H+
+ H2O
O
CH3
C
H
этаналь
+ C2H5OH
H
спирт
22
23.
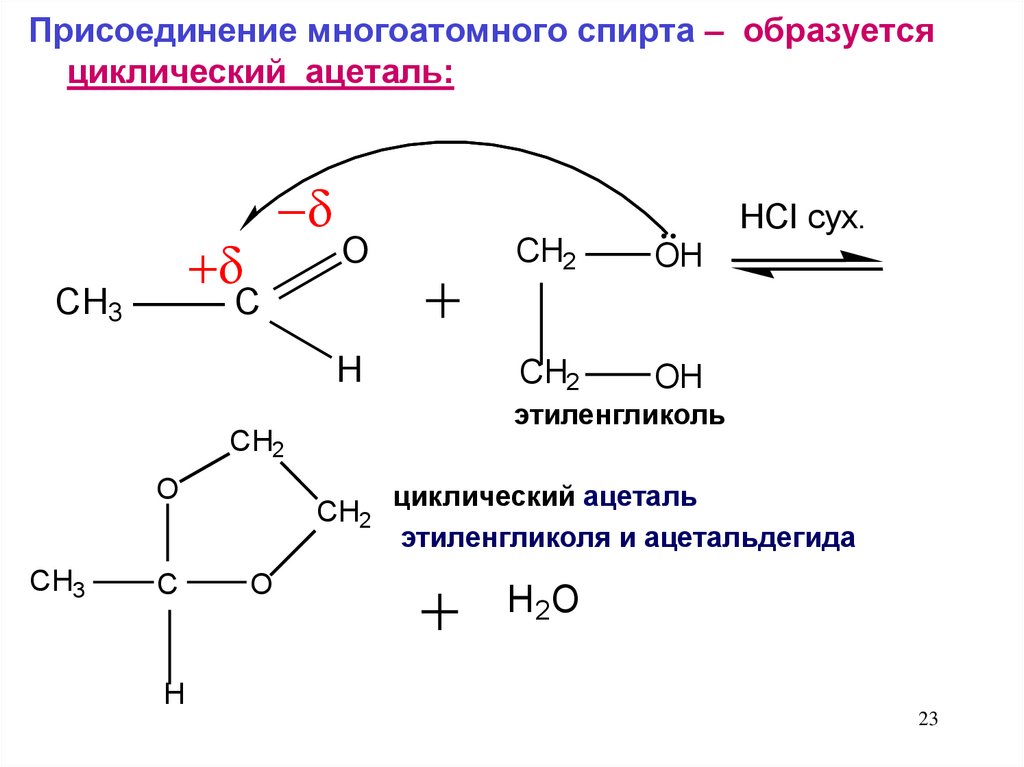
Присоединение многоатомного спирта – образуетсяциклический ацеталь:
CH3
O
CH2
OH
H
CH2
OH
C
этиленгликоль
CH2
O
CH3
HCI сух.
C
CH2
O
циклический ацеталь
этиленгликоля и ацетальдегида
H 2O
H
23
24.
внутримолекулярное взаимодействие альдегиднойи гидроксогруппы приводит к образованию циклических
полуацеталей.
Общая схема образования полуцеталей
H
п/а
C
O
OH
OH
H
C
O
24
25.
H1
C
O
H
C
OH
n\a
H+
(CH2)3
(CH2)3
5
CH2OH +
CH2
5 – гидроксипентаналь
Пятичленный цикл
- фуранозный
O
шестичленный цикл
- пиранозный
25
26. Значение реакции ацетализации
Реакциялежит
в
основе
получения
природных
полисахаридов (полиацеталей) – целлюлозы, крахмала и т.д.
(гетерополисахаридов – хондроитинсульфатов).
1).
26
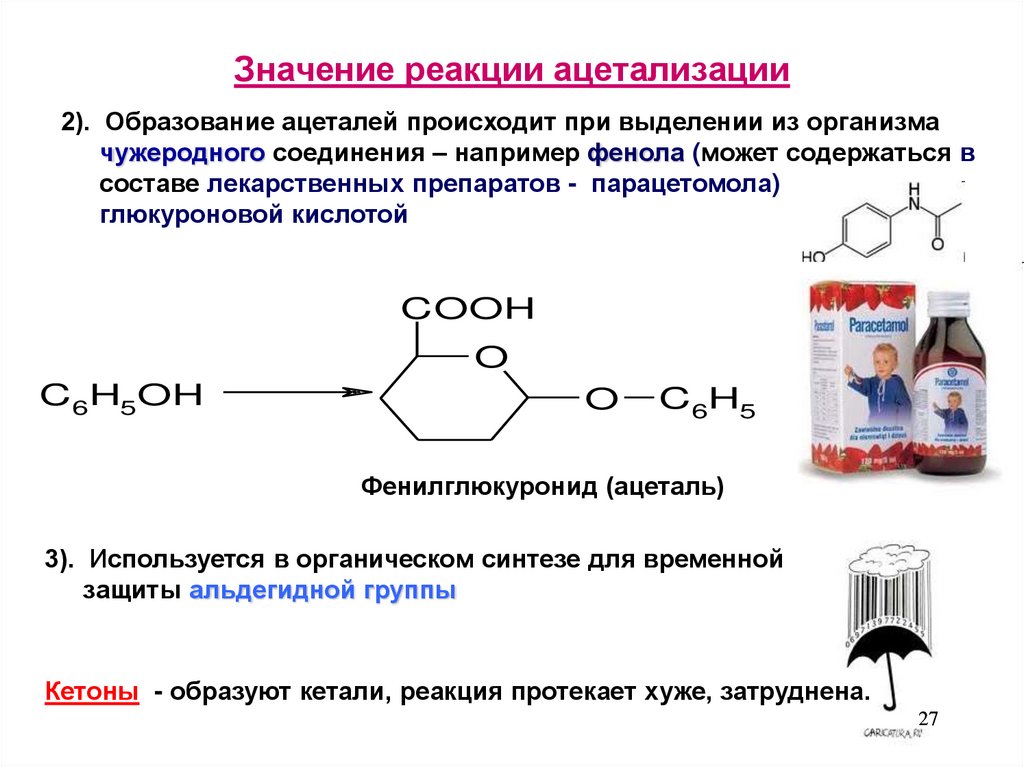
27. Значение реакции ацетализации
2). Образование ацеталей происходит при выделении из организмачужеродного соединения – например фенола (может содержаться в
составе лекарственных препаратов - парацетомола)
глюкуроновой кислотой
COOH
O
C6H5OH
O
C6H5
Фенилглюкуронид (ацеталь)
3). Используется в органическом синтезе для временной
защиты альдегидной группы
Кетоны - образуют кетали, реакция протекает хуже, затруднена.
27
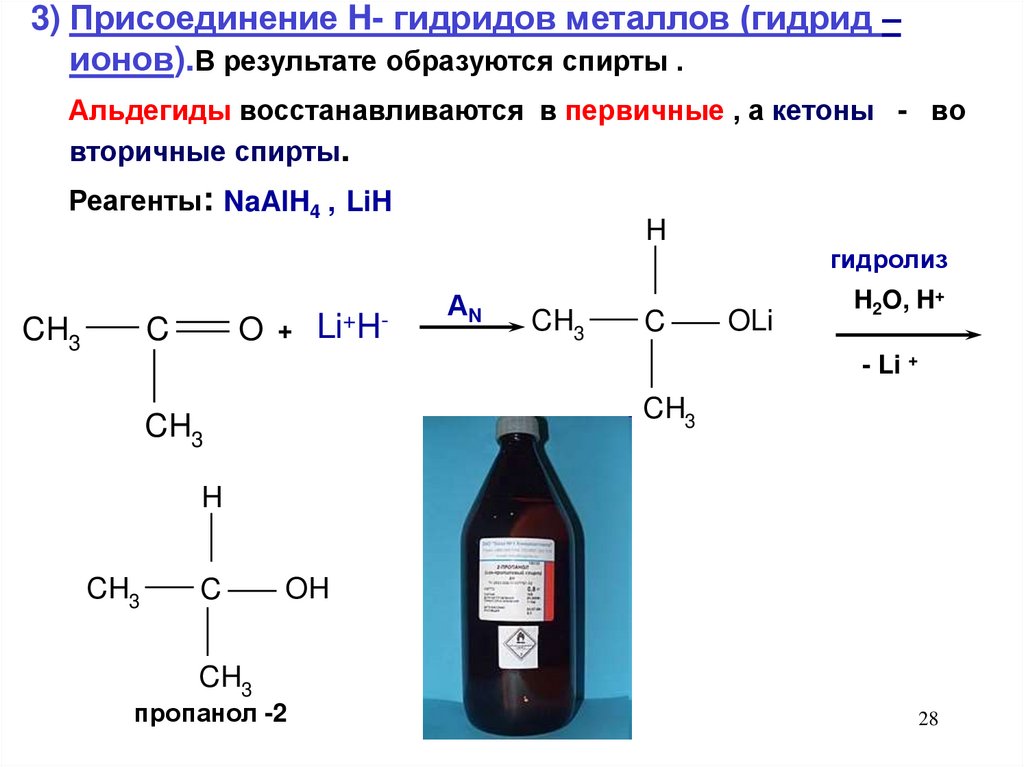
28.
3) Присоединение H- гидридов металлов (гидрид –ионов).В результате образуются спирты .
Альдегиды восстанавливаются в первичные , а кетоны - во
вторичные спирты.
Реагенты: NaAlH4 , LiH
CH3
C
O
+
Li+H-
H
АN
CH3
C
гидролиз
OLi
H2O, H+
- Li +
CH3
CH3
H
CH3
C
OH
CH3
пропанол -2
28
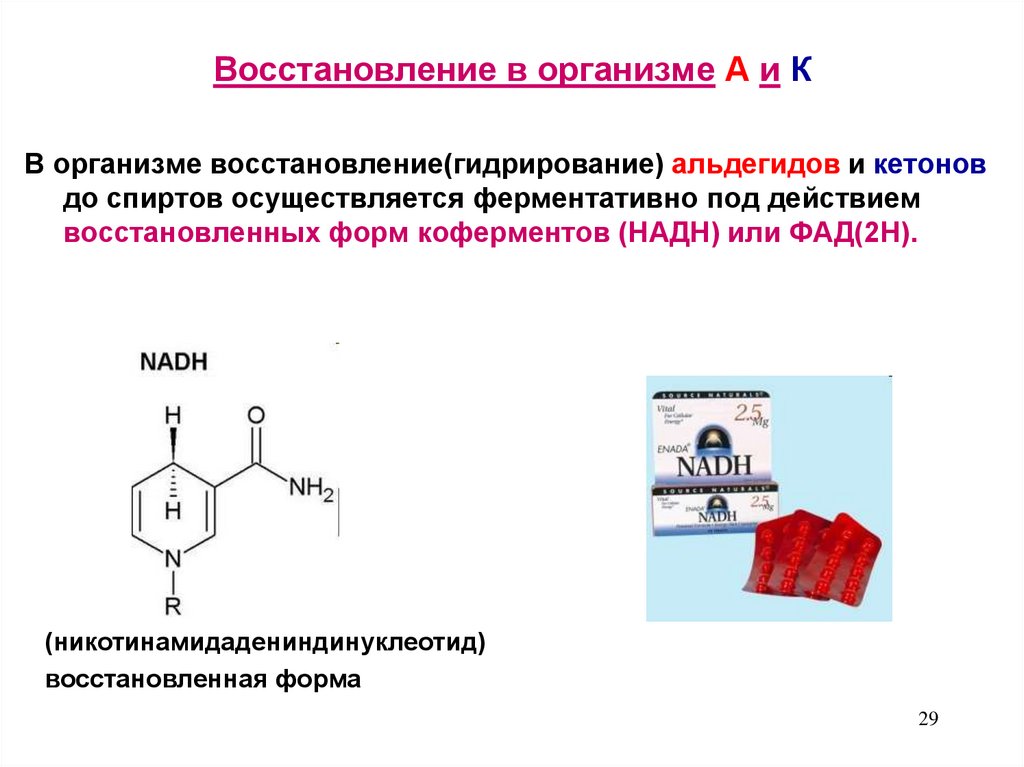
29. Восстановление в организме А и К
В организме восстановление(гидрирование) альдегидов и кетоновдо спиртов осуществляется ферментативно под действием
восстановленных форм коферментов (НАДН) или ФАД(2Н).
(никотинамидадениндинуклеотид)
восстановленная форма
29
30.
4) Взаимодействие с аминами и их производными(NH2X) - образуются имины - (основания Шиффа).
В реакцию вступают и альдегиды и кетоны, процесс
протекает в два этапа:
-нуклеофильное присоединение NH2X - первичных аминов
или аммиака NH3
-отщепление Н2О
классифицируется как реакция AN –E (присоединения-
отщепления)
CH3
C
O + C2H5NH2
AN –E
CH3
- H2O
CH3
Рассматриваются 2 механизма этой реакции :
1) с Н+ катализатором;
2)через образование биполярного иона
C
N
C2H5
этилимин ацетона
CH3
30
31.
Механизм через образование биполярного иона.СH3
O
C
..
+ C2H5 - NH2
O
H
C
+N
H
C2H5
AN
CH3
H
H
OH
биполярный ион
H
E
CH3
C
N
C2H5
- H2O
H
карбиноламин
CH3
C
C2H5
N
H
этилимин ацетальдегида
31
32.
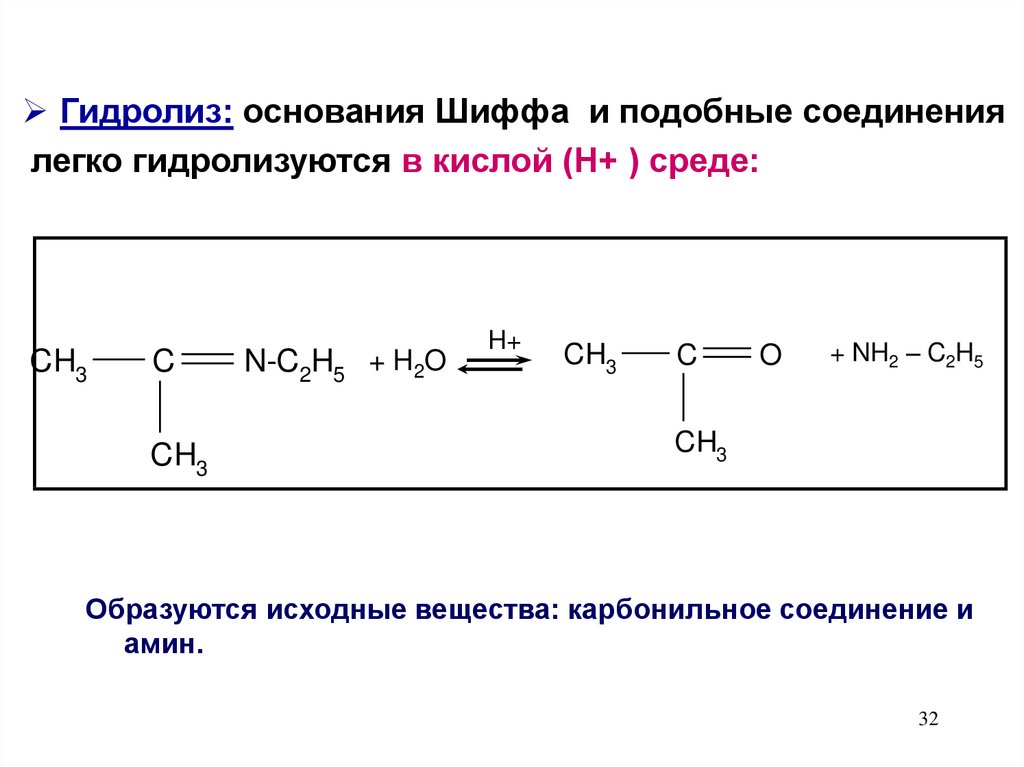
Гидролиз: основания Шиффа и подобные соединениялегко гидролизуются в кислой (Н+ ) среде:
CH3
C
CH3
N-C2H5 + H2O
H+
CH3
C
O
+ NH2 – C2H5
CH3
Образуются исходные вещества: карбонильное соединение и
амин.
32
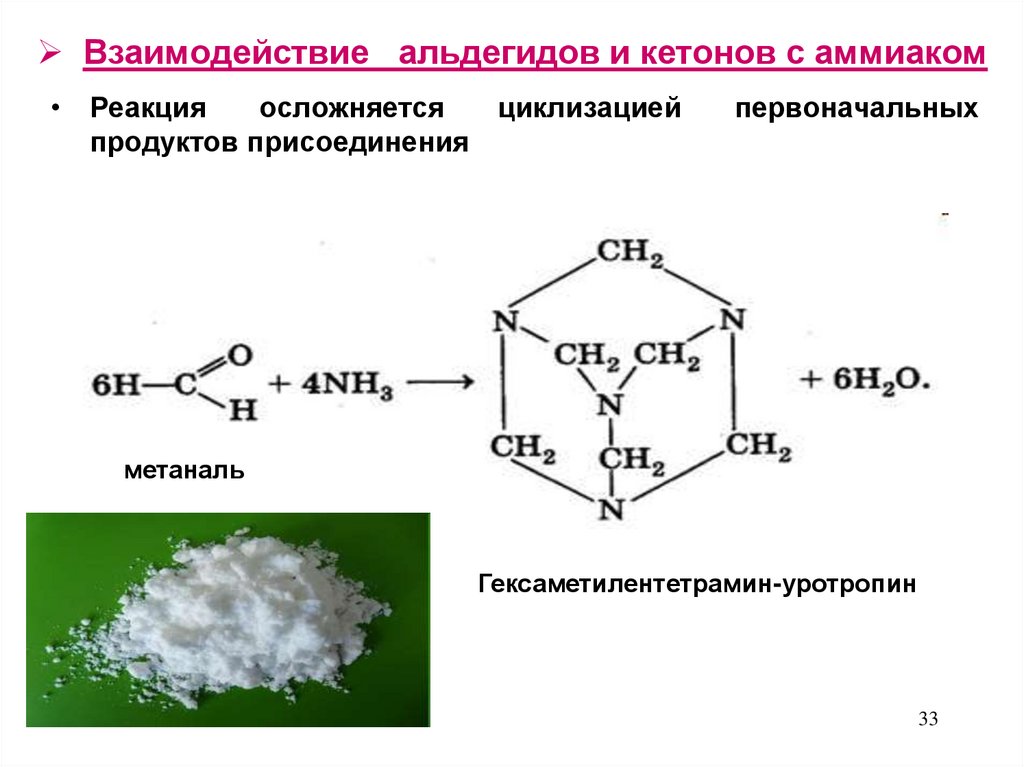
33. Взаимодействие альдегидов и кетонов с аммиаком
• Реакцияосложняется
циклизацией
продуктов присоединения
первоначальных
метаналь
Гексаметилентетрамин-уротропин
33
34. Уротропин - лекарственный препарат, дезинфецирующее средство, использующееся при воспалении мочевых путей (А.М.Бутлеров 1859г).
Уротропинлекарственный
препарат,
дезинфецирующее
средство, использующееся при воспалении мочевых путей
(А.М.Бутлеров 1859г).
• Из уротропина в кислой среде (гидролиз)
образуются формальдегид и аммиак.которые
обладают антимикробными свойствами.
• Особенно сильное антимикробное
действие уротропин оказывает
в кислой среде мочевыводящих
путей почек.
34
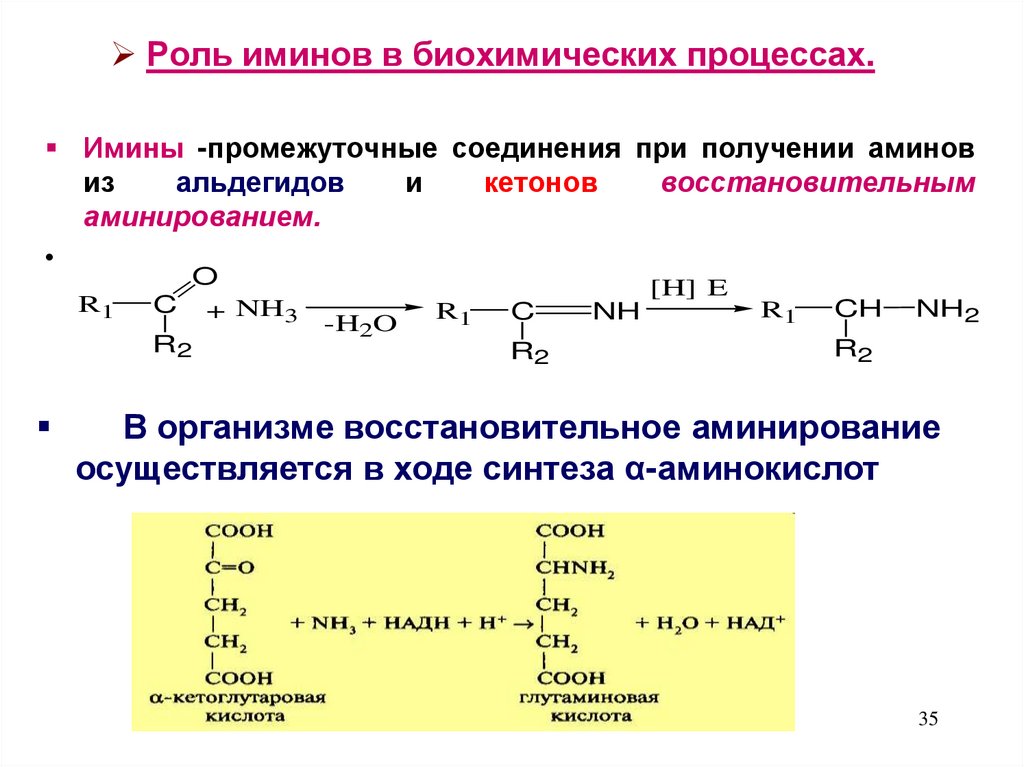
35. Роль иминов в биохимических процессах.
Имины -промежуточные соединения при получении аминовиз
альдегидов
и
кетонов
восстановительным
аминированием.
R1
O
C + NH3
R2
[H] E
-H2O
R1
C
R2
NH
R1
CH
NH2
R2
В организме восстановительное аминирование
осуществляется в ходе синтеза α-аминокислот
35
36.
Процесс образования - аминокислот из - оксокислотназывается переаминированием или трансаминированием.
Он протекает через стадию стадию получения иминов.
В процессе трансаминирования участвует кофермент
пиридоксальфосфат.
2 метил – 3 гидрокси, 5 гидрокси –
пиридин – 4 карбальдегидфосфат
Пиридоксальфосфат
выполняет функцию
переносчика аминогруппы т.е.
временно хранит
NH2-группу, являясь «камерой
хранения»)
36
37.
Химические превращения α-аминокислот в организмес участием пиридоксальфосфата.
H
R
H
C
H
O
C
N
C
O3POCH2
O3POCH2
+
N
CH3
NH 2CHCOOH
R
H
пиридоксальфосфат
H
O
OH
+
COOH
+
N
CH3
H
α-аминокислота
альдимин
37
38. Аналитические реакции иминов
• Используя производные NH3 и аминов, можно выделить А и Киз реакционной смеси и идентифицировать
их по
температурам плавления.
• Оксимы - продукты реакции А и К с гидроксиламином
NH2OH, механизм реакции AN - E
38
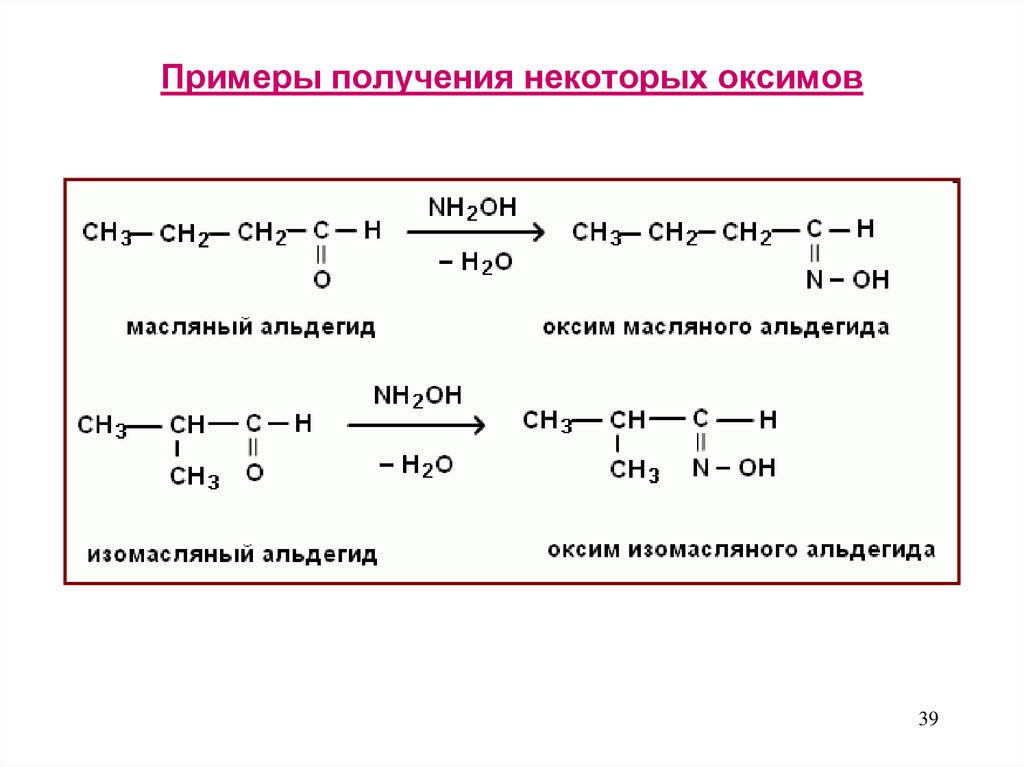
39. Примеры получения некоторых оксимов
3940.
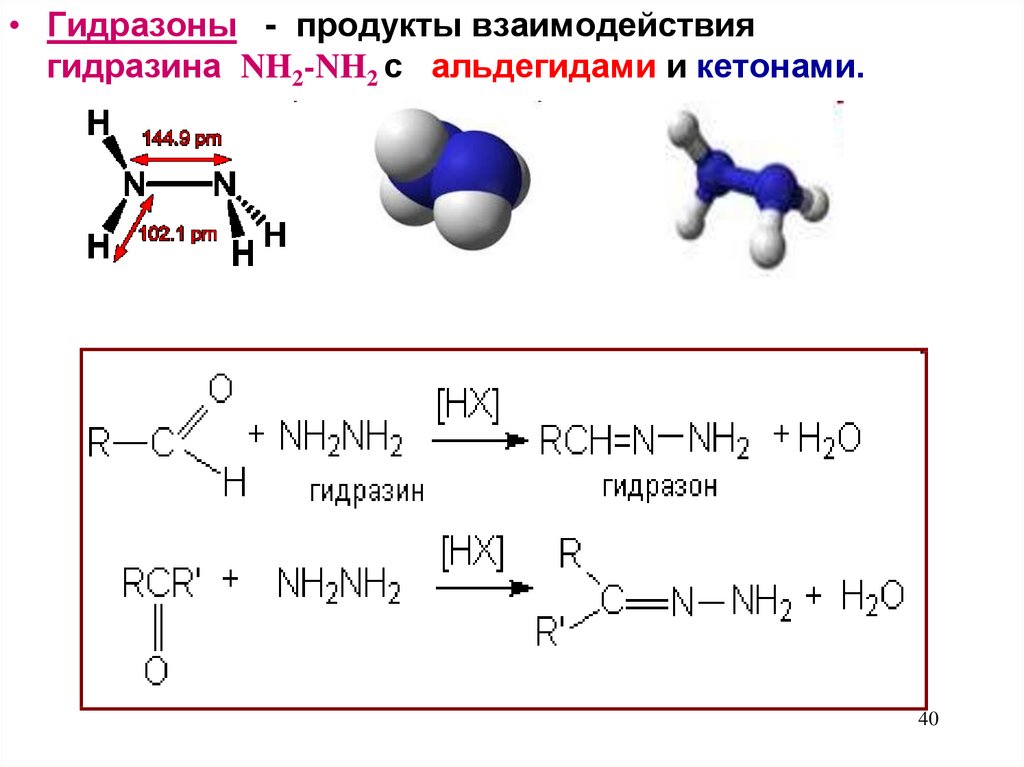
• Гидразоны - продукты взаимодействиягидразина NH2-NH2 с альдегидами и кетонами.
40
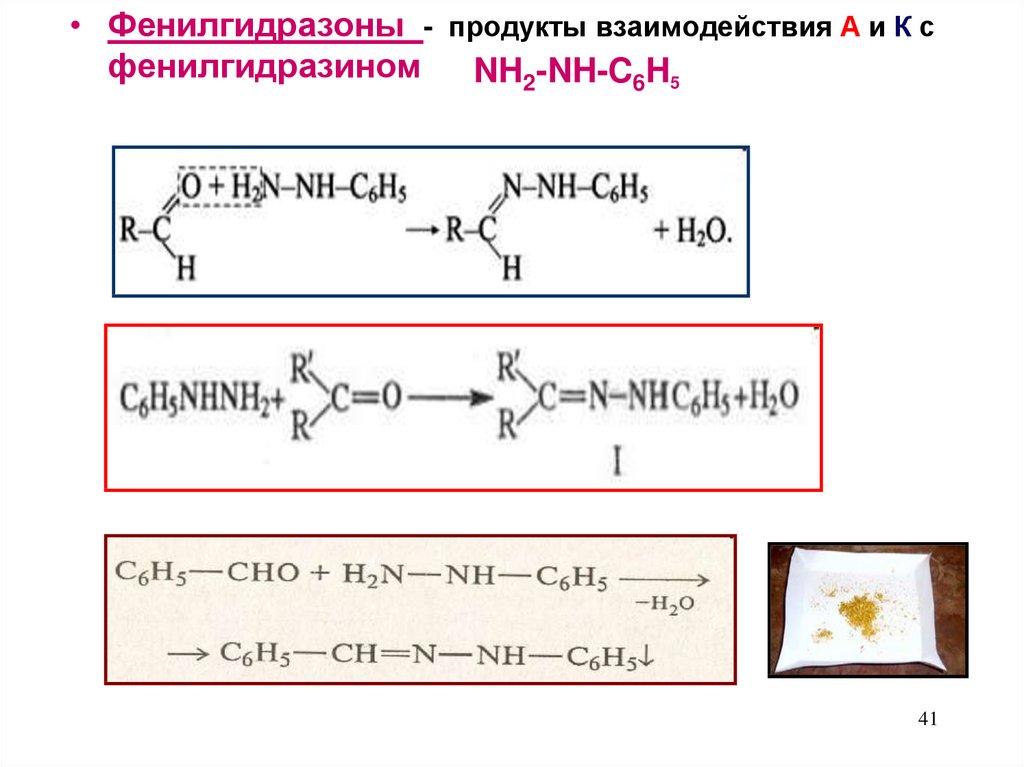
41.
• Фенилгидразоны - продукты взаимодействия А и К сфенилгидразином
NH2-NH-C6H5
41
42.
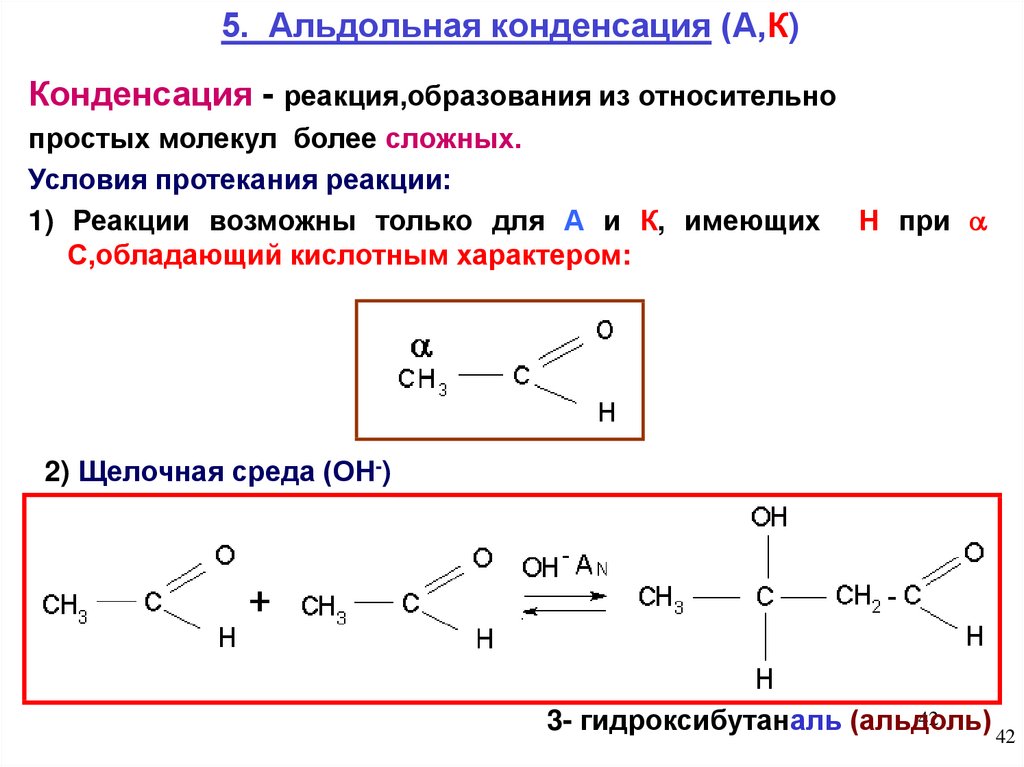
5. Альдольная конденсация (А,К)Конденсация - реакция,образования из относительно
простых молекул более сложных.
Условия протекания реакции:
1) Реакции возможны только для А и К, имеющих
С,обладающий кислотным характером:
Н при
2) Щелочная среда (ОН-)
42
3- гидроксибутаналь (альдоль)
42
43.
Механизм реакции альдольной конденсации ANа) Образование нуклеофильной частицы (Nu) из 1-ой молекулы
O
альдегида
CH3
C
H
CH2
C
O
O
OH
H
-
-H2O
CH2
C
карбанион - Nu
H
H
43
44.
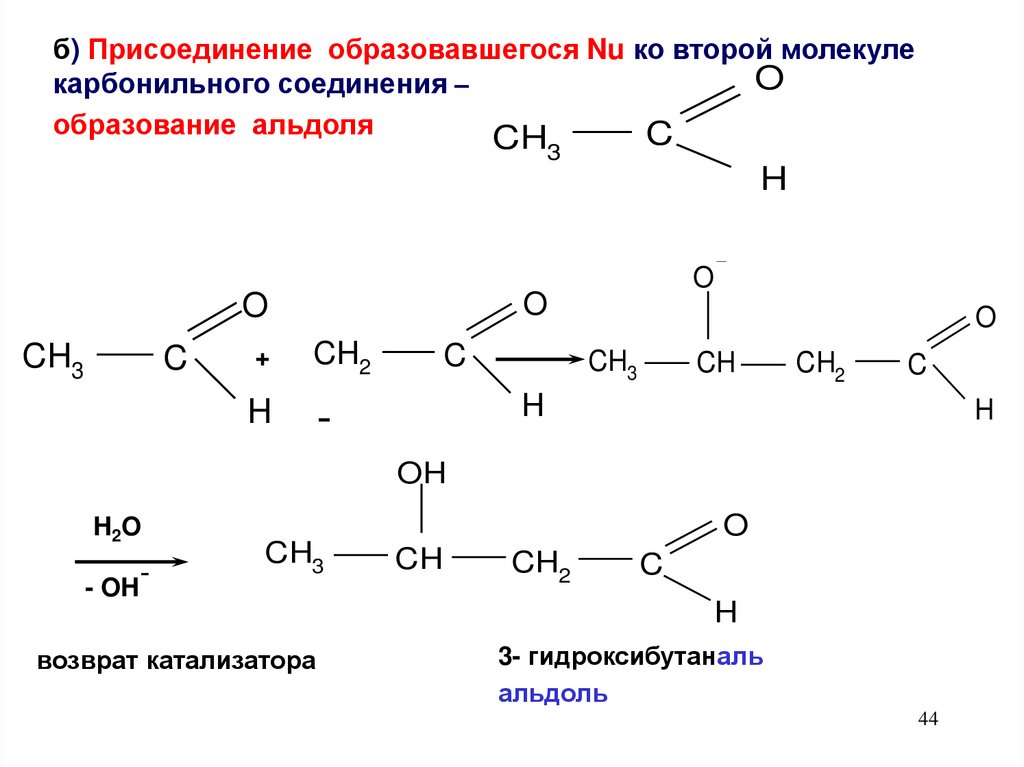
б) Присоединение образовавшегося Nu ко второй молекулеO
карбонильного соединения –
образование альдоля
C
CH
3
H
O
O
CH3
C
O
+
CH2
H
-
C
O
CH3
CH
CH2
C
H
H
OH
H2O
- OH
O
CH3
возврат катализатора
CH
CH2
C
H
3- гидроксибутаналь
альдоль
44
45.
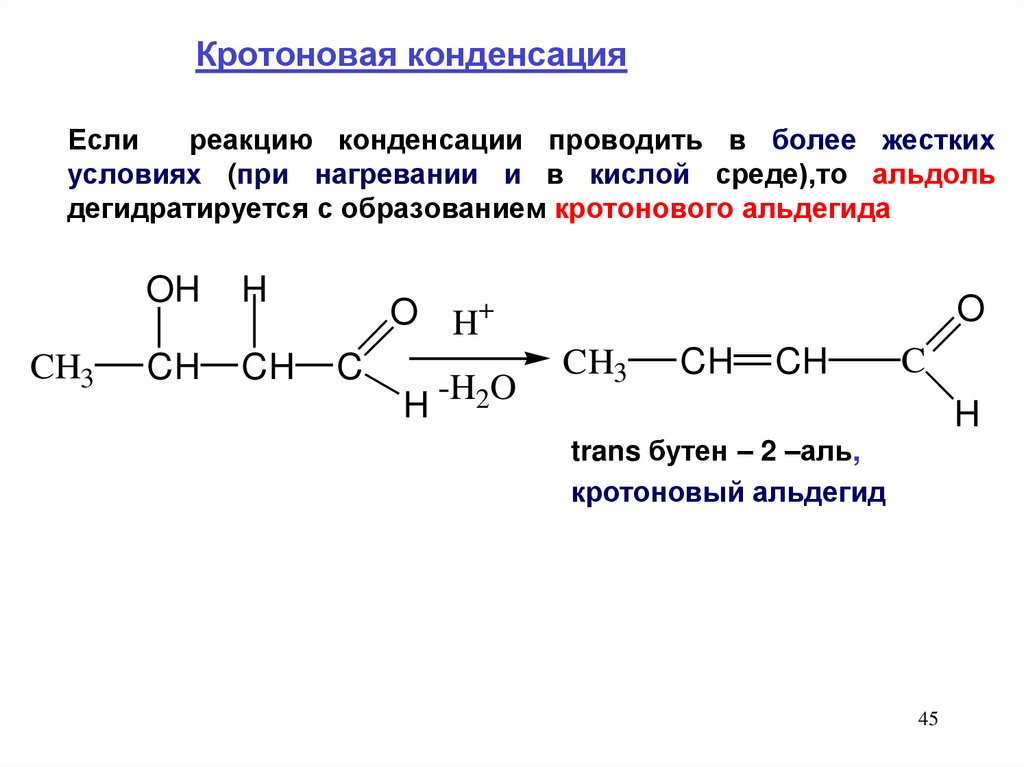
Кротоновая конденсацияЕсли
реакцию конденсации проводить в более жестких
условиях (при нагревании и в кислой среде),то альдоль
дегидратируется с образованием кротонового альдегида
CH3
OH
H
CH
CH
O
O H+
C
H
-H2O
CH3
CH
CH
C
H
trans бутен – 2 –аль,
кротоновый альдегид
45
46.
Значение реакции альдольной конденсации(присоединения).
Реакции альдольного присоединения обратимы . В организме
происходят два процесса: альдольная конденсация и
альдольное расщепление.
1) В углеводном обмене, например, образуется нейраминовая
кислота (С9) из С3 и С6. ( в свободном состоянии содержится в
спинномозговой жидкости).
Ее производные - сиаловые кислоты:
компоненты специфических веществ крови и тканей входят в
состав ганглиозидов мозга, участвующих в проведении
нервных импульсов
46
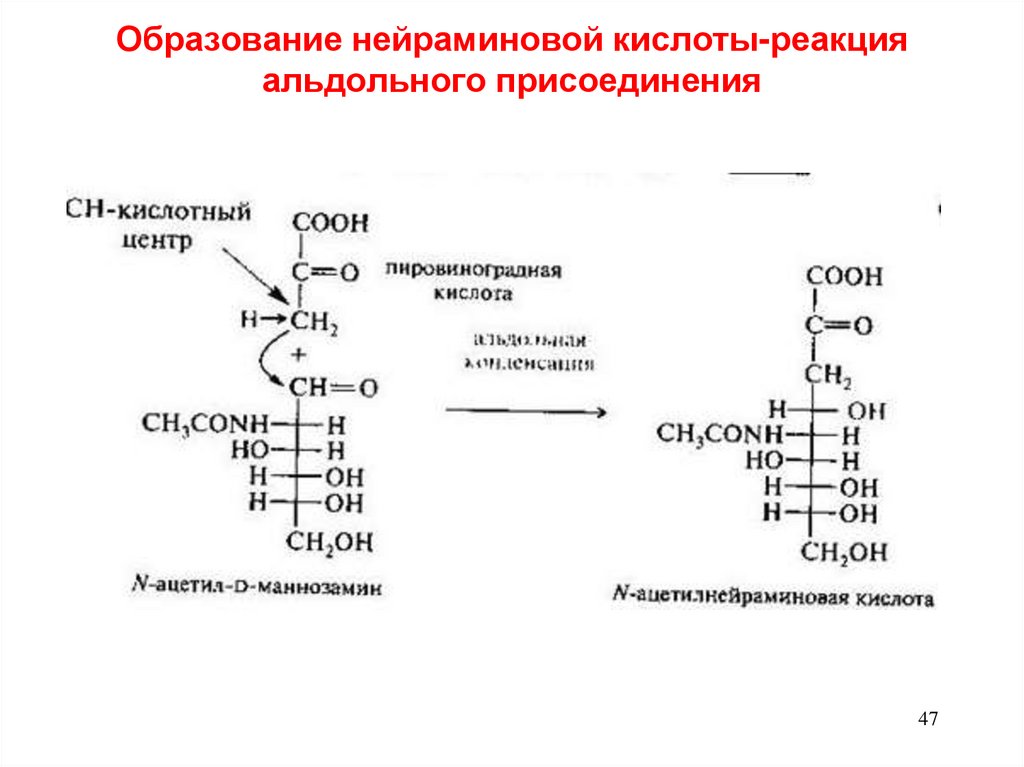
47. Образование нейраминовой кислоты-реакция альдольного присоединения
4748.
Значение реакции альдольной конденсации(присоединения).
2) Образование новых связей С – С с участием тиоэфиров
карбоновых кислот.
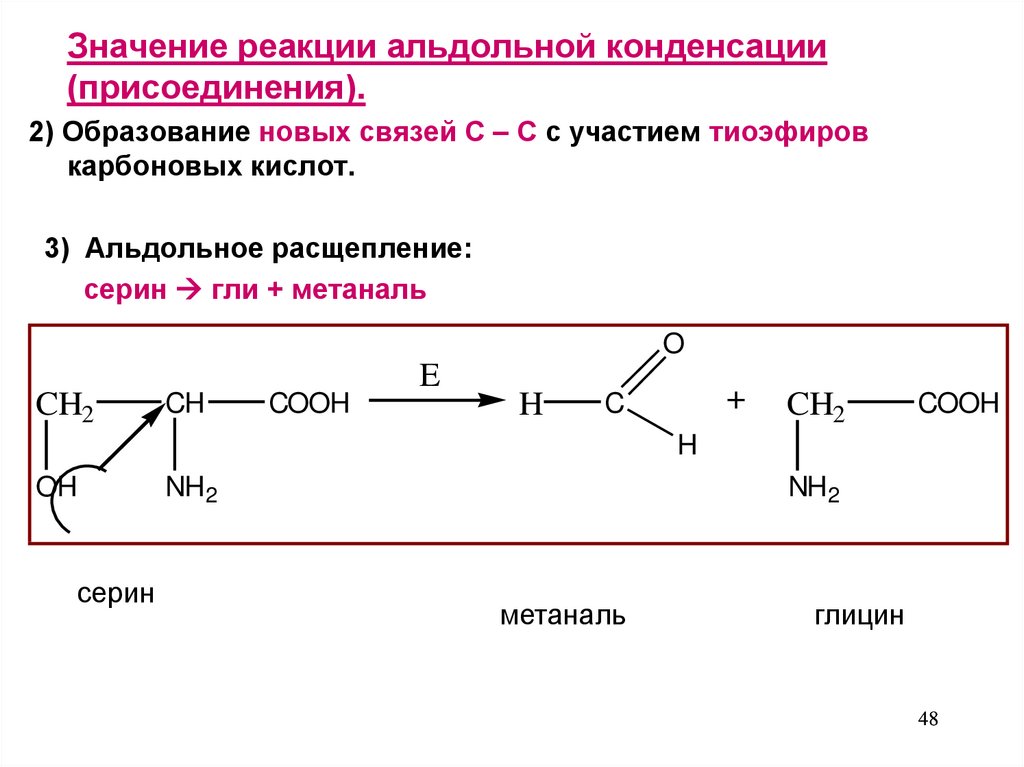
3) Альдольное расщепление:
серин гли + метаналь
O
CH2
CH
COOH
E
H
+
C
CH2
COOH
H
OH
серин
NH2
NH2
метаналь
глицин
48
49.
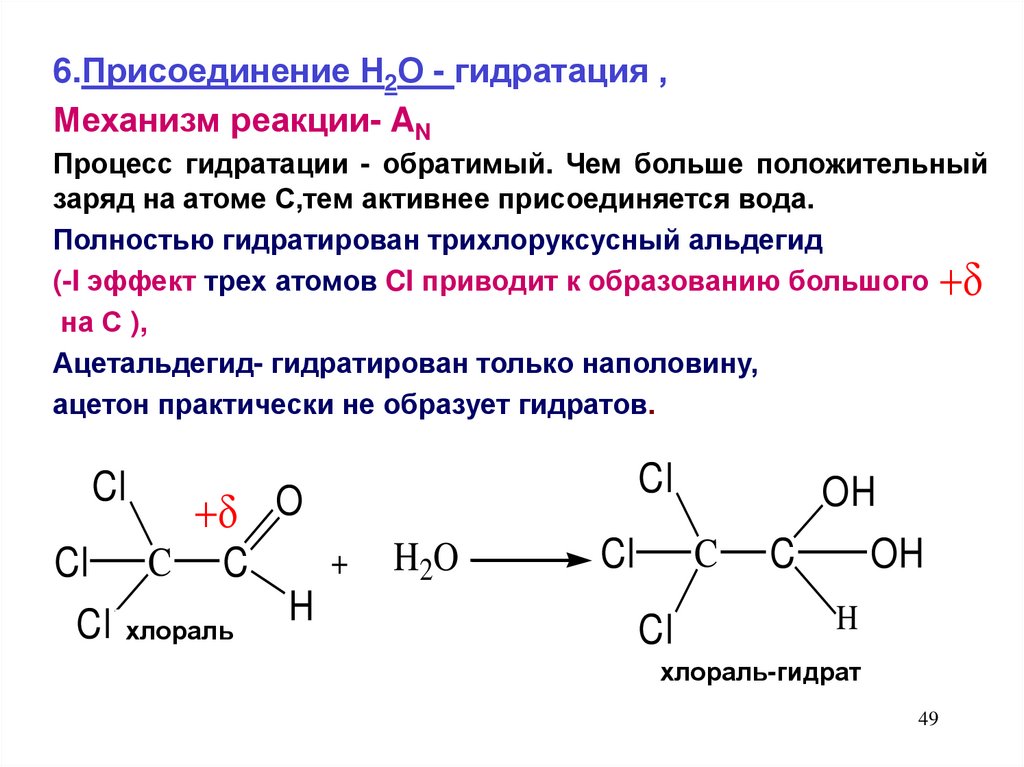
6.Присоединение Н2О - гидратация ,Механизм реакции- AN
Процесс гидратации - обратимый. Чем больше положительный
заряд на атоме С,тем активнее присоединяется вода.
Полностью гидратирован трихлоруксусный альдегид
(-I эффект трех атомов CI приводит к образованию большого
на С ),
Ацетальдегид- гидратирован только наполовину,
ацетон практически не образует гидратов.
Cl
Cl
O
+
Cl C C
H
Cl хлораль
H 2O
Cl
OH
C
Cl
C
OH
H
хлораль-гидрат
49
50.
Хлоральгидрат применяется в медицине как успокаивающее иснотворное средство. В основе его фармакологического
эффекта лежит наркотическое действие на организм
альдегидной группы.
50
51.
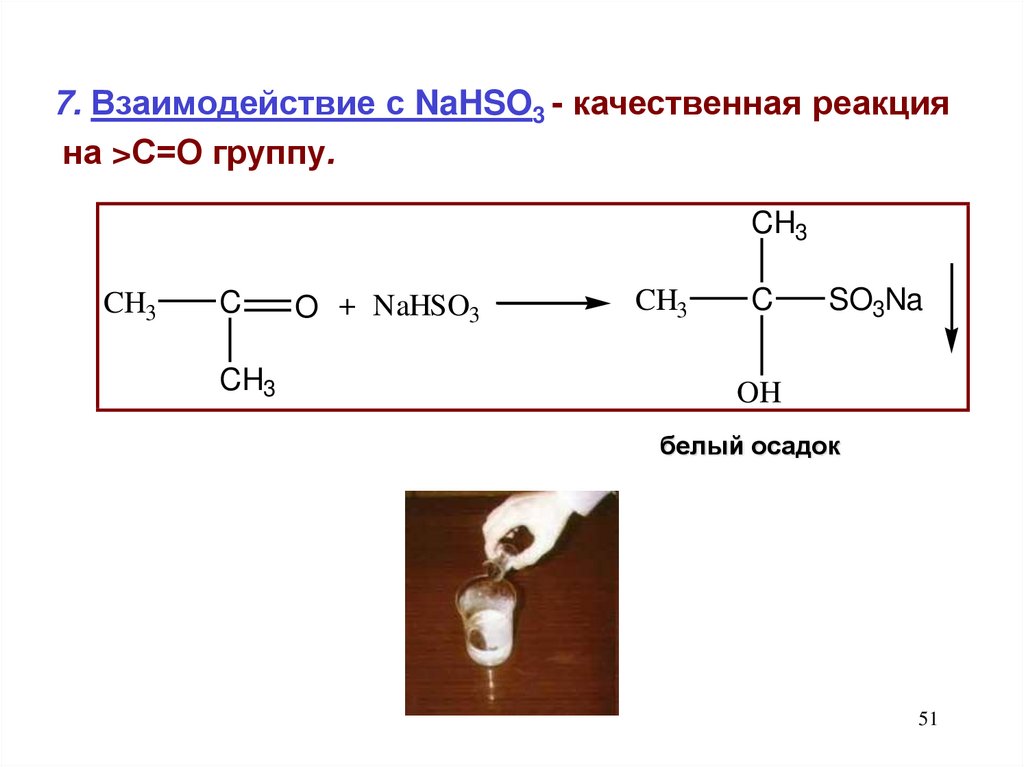
7. Взаимодействие с NaHSO3 - качественная реакцияна >С=О группу.
CH3
CH3
C
CH3
O + NaHSO3
CH3
C
SO3Na
OH
белый осадок
51
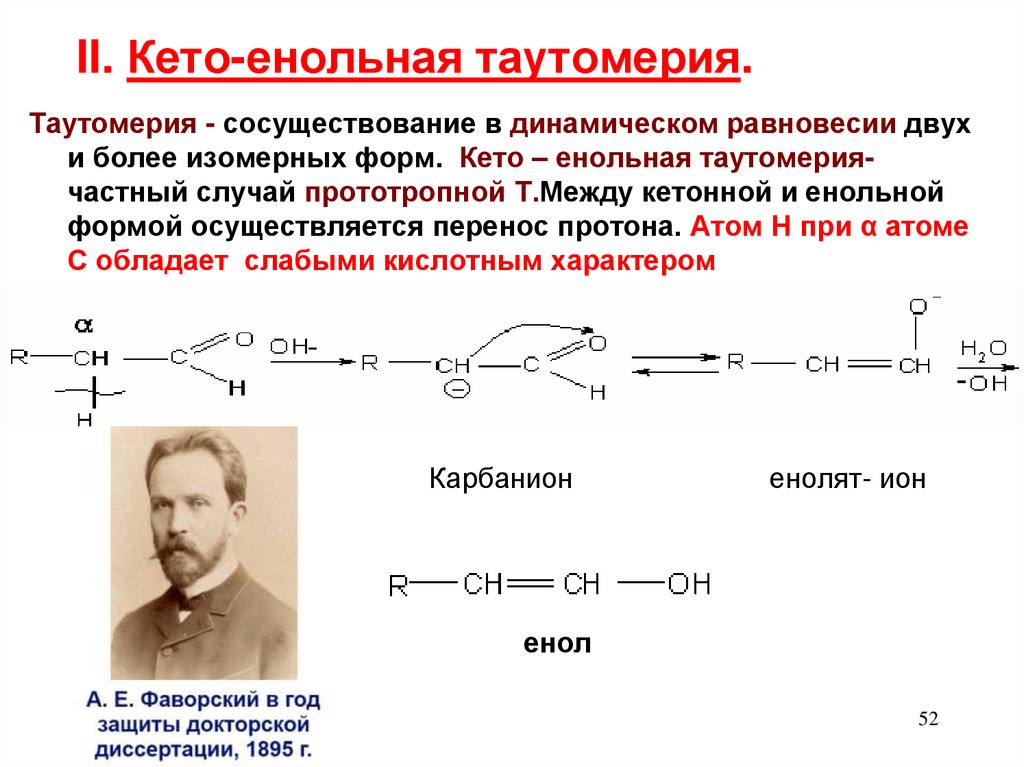
52. II. Кето-енольная таутомерия.
Таутомерия - сосуществование в динамическом равновесии двухи более изомерных форм. Кето – енольная таутомериячастный случай прототропной Т.Между кетонной и енольной
формой осуществляется перенос протона. Атом Н при α атоме
С обладает слабыми кислотным характером
Карбанион
енолят- ион
енол
52
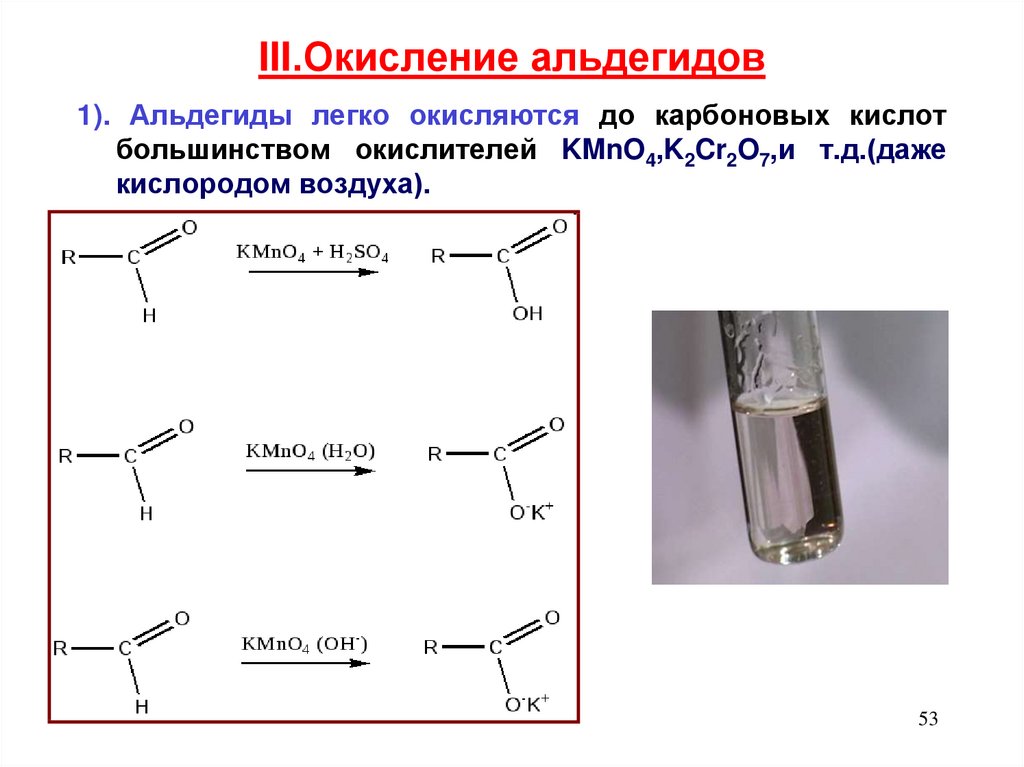
53. III.Окисление альдегидов
1). Альдегиды легко окисляются до карбоновых кислотбольшинством окислителей KMnO4,K2Cr2O7,и т.д.(даже
кислородом воздуха).
53
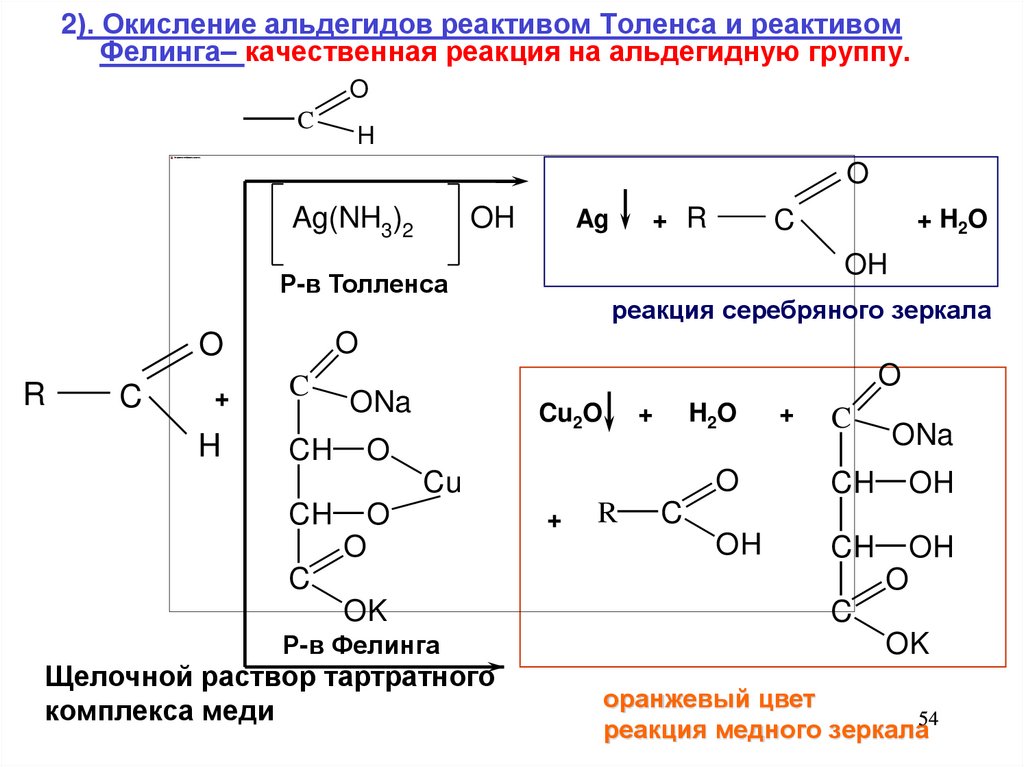
54.
2). Окисление альдегидов реактивом Толенса и реактивомФелинга– качественная реакция на альдегидную группу.
O
C
H
O
Ag(NH3)2
OH
+
H
+ H 2O
реакция серебряного зеркала
O
O
C
C
OH
Р-в Толленса
R
+ R
Ag
C
O
ONa
CH
Cu2O
+
H2O
+
C
O
Cu
CH
O
O
+
R
ONa
O
CH
OH
OH
CH
OH
C
C
O
OK
Р-в Фелинга
Щелочной раствор тартратного
комплекса меди
C
OK
оранжевый цвет
реакция медного зеркала54
55.
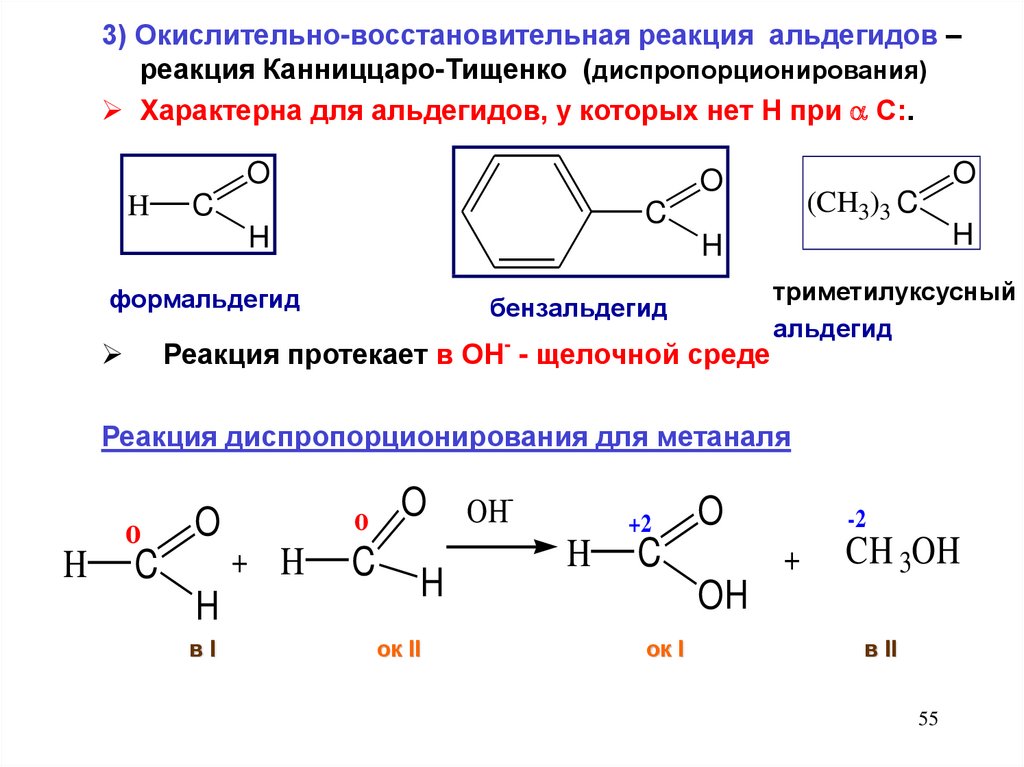
3) Окислительно-восстановительная реакция альдегидов –реакция Канниццаро-Тищенко (диспропорционирования)
Характерна для альдегидов, у которых нет Н при С:.
O
H
C
(CH3)3 C
C
H
H
формальдегид
бензальдегид
Реакция протекает в ОН- - щелочной среде
O
O
H
триметилуксусный
альдегид
Реакция диспропорционирования для метаналя
H
o
O
+ H
C
H
вI
O
OH
o
C
H
ок II
+2
H
O
C
-2
+
CH 3OH
OH
ок I
в II
55
56.
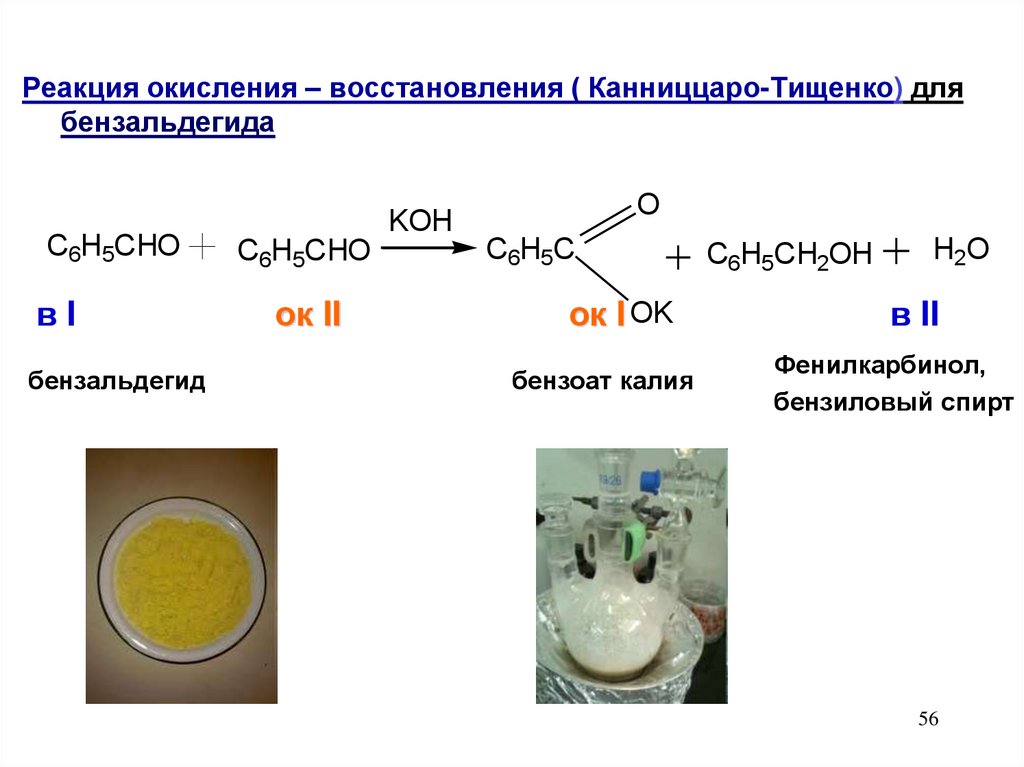
Реакция окисления – восстановления ( Канниццаро-Тищенко) длябензальдегида
C6H5CHO
вI
бензальдегид
C6H5CHO
ок II
KOH
O
C6H5C
ок I OK
бензоат калия
C6H5CH2OH
H2O
в II
Фенилкарбинол,
бензиловый спирт
56
57.
V Реакции карбонильных соединений в радикале .1.Для предельных альдегидов и кетонов характерны реакции радикального замещения SR : Cl2, Br2, h или Р красный.
Замещение происходит всегда в -С атоме.
O
CH3
CH2
C
+ Br2
Pkp
O
CH3
CH
- HBr
H
C
H
Br
2-бромпропаналь
галогензамещенные
альдегиды и кетоны оказывают
сильное
раздражающее
действие
на
слизистые
оболочки носа и глаз, то есть
являются лакриматорами (от
лат. Lacrima - слеза)
57
58.
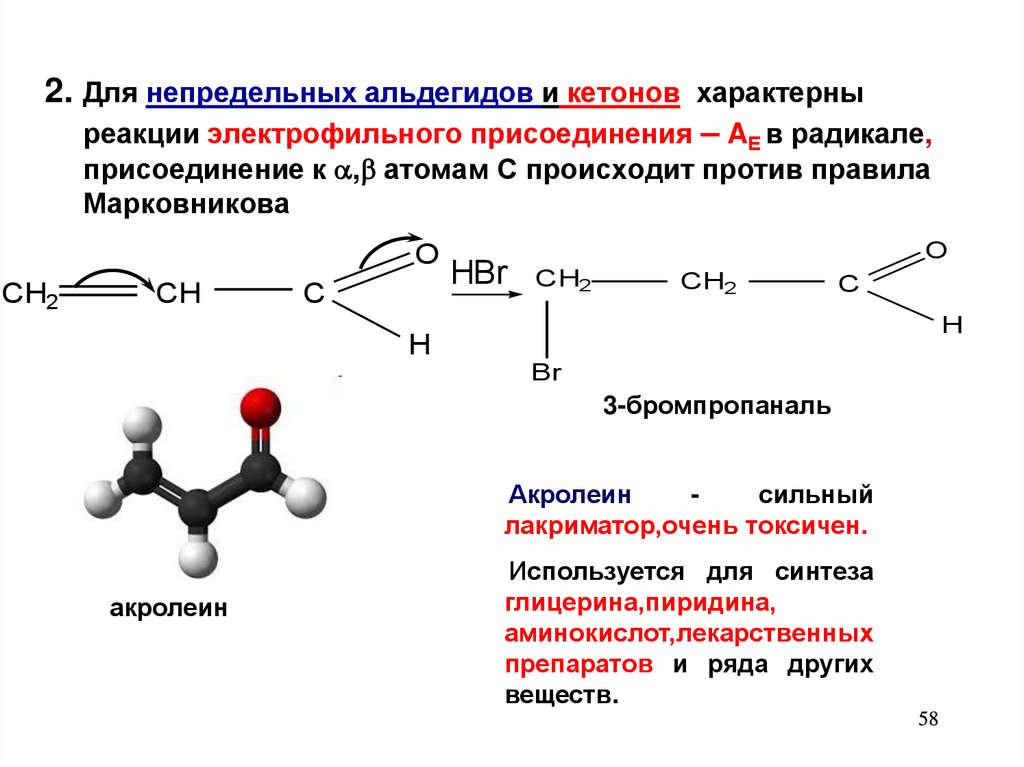
2. Для непредельных альдегидов и кетонов характерныреакции электрофильного присоединения – AЕ в радикале,
присоединение к , атомам С происходит против правила
Марковникова
O
CH2
CH
C
H
HBr
O
CH2
CH2
C
H
Br
3-бромпропаналь
Акролеин
сильный
лакриматор,очень токсичен.
акролеин
Используется для синтеза
глицерина,пиридина,
аминокислот,лекарственных
препаратов и ряда других
веществ.
58
59.
3) Для ароматических альдегидов и кетонов характерныреакции электрофильного замещения - SЕ ( катализатор AlCl3
AIBr3) – замещение происходит в мета – положении в
бензольном кольце.
O
C
O
C
H
H
Br2
AIBr3
HBr
3-бромбензальдегид
Br
Бензальдегид применяется для
синтеза душистых веществ,
в парфюмернокосметических
композициях,как
растворитель и т.д.
59
60.
Галоформная реакция – качественная реакцияна фрагмент
CH3
C
O
Используется для определения ацетона и ацетоновых тел
в клиническом анализе при сахарном диабете.
O
CH3
C
R + 3 I2 + 4 NaOH
CHI3 + R
иодоформ
O
C
+ 3 NaI + 3 H2O
ONa
60
61.
Механизм галоформной реакцииOH
C
CH3
R
3 I2
4 NaOH
- 3 NaI
I
+δ
C
+δ
C
ONa
I
O
CHI3
I
R
Желтый цвет
O
R
C
O-
61
Na+
62.
Биологическое значение.62
63. Карбонильные соединения – активные участники метаболизма
1. Кетокислотыучаствуют в метаболизме углеводов(ПВК)
и в процессах окисления липидов.
Малоновый альдегид - пропандиаль - важнейший
продукт перекисного окисления липидов, его
определение в биосредах практикуется в
биохимическом анализе.
O
O
C
H
CH2
C
H
63
64.
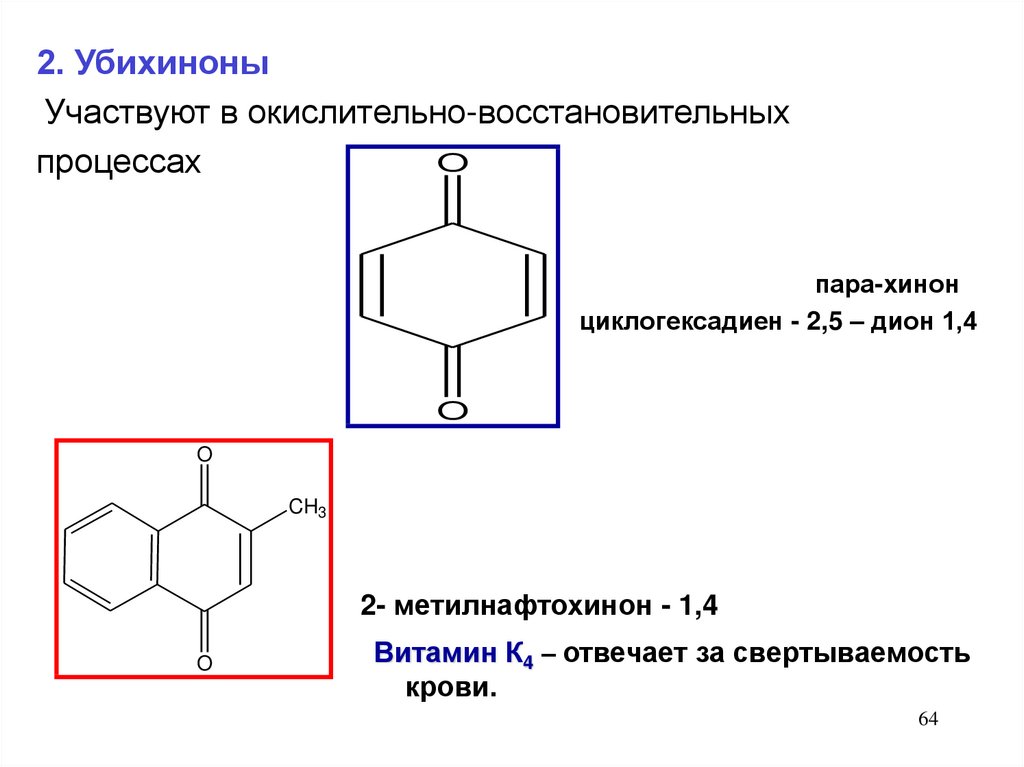
2. УбихиноныУчаствуют в окислительно-восстановительных
O
процессах
пара-хинон
циклогексадиен - 2,5 – дион 1,4
O
O
CH3
2- метилнафтохинон - 1,4
O
Витамин К4 – отвечает за свертываемость
крови.
64
65.
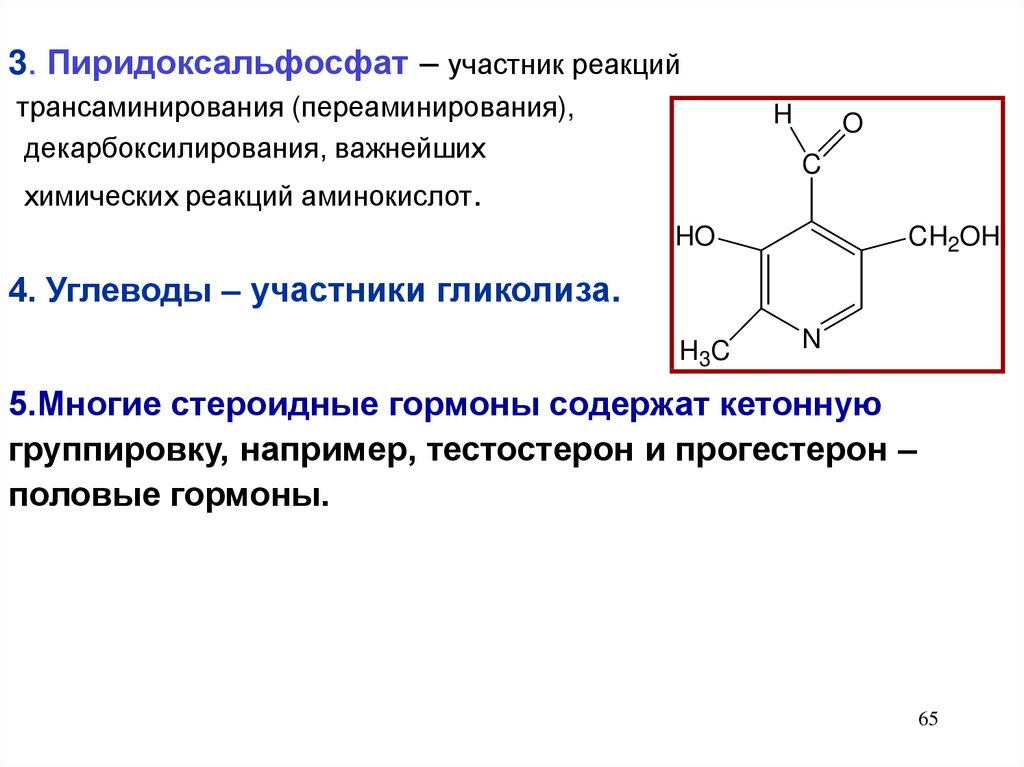
3. Пиридоксальфосфат – участник реакцийтрансаминирования (переаминирования),
декарбоксилирования, важнейших
H
O
C
химических реакций аминокислот.
HO
CH2OH
4. Углеводы – участники гликолиза.
H3C
N
5.Многие стероидные гормоны содержат кетонную
группировку, например, тестостерон и прогестерон –
половые гормоны.
65
66. Карбонильные соединения как лекарственные средства (некоторые примеры)
1.Производные бутиферонаC6H5
CO
CH2
CH2
CH2
NR2
обладают успокаивающим
действием (нейролептики).
66
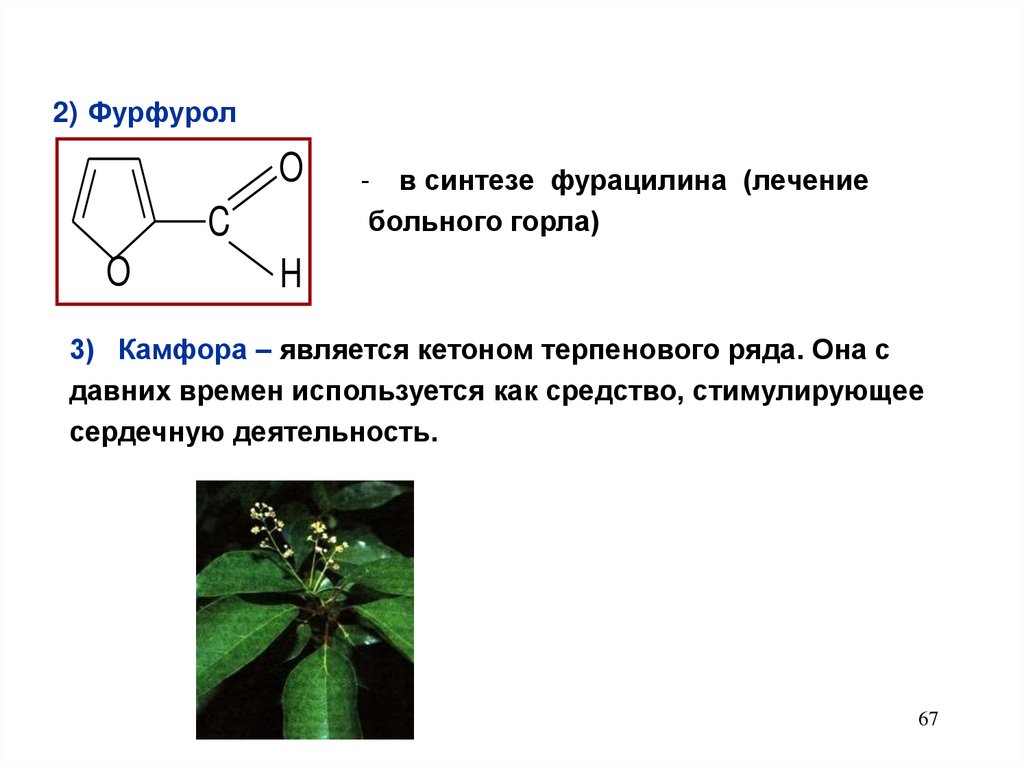
67.
2) ФурфуролO
C
O
- в синтезе фурацилина (лечение
больного горла)
H
3) Камфора – является кетоном терпенового ряда. Она с
давних времен используется как средство, стимулирующее
сердечную деятельность.
67
68. Масс-спектрометрия
• Метод масс - спектрометрии основан на регистрации ионов,возникающих при ионизации нейтральных молекул
Масс-спектрометрия позволяет
определять:
1.Молекулярную массу вещества.
2. Молекулярную формулу
вещества.
3. Строение вещества.
Масс-спектрометрия включает
совокупность трёх
отдельных процессов:
1. Ионизация молекулы.
2. Разделение ионов по массам.
3. Детектирование ионов.
68
69. Масс-спектрометрия
Ионизация нейтральных молекул.Существует несколько способов ионизации молекул:
электронный
удар
(ЭУ),
химическая
ионизация,
фотоионизация ,
электроспрей,матричная
лазерная
десорбционная
ионизация.
Распространённым
способом
ионизации
является
электронный удар.
Ионизация происходит при бомбардировке электронами с
высокой энергией паров вещества при давлении 10-5 – 10-8 мм
рт. ст. При соударении молекула вещества теряет электрон и
образует возбуждённый катион –радикал, называемый
молекулярным ионом.
69
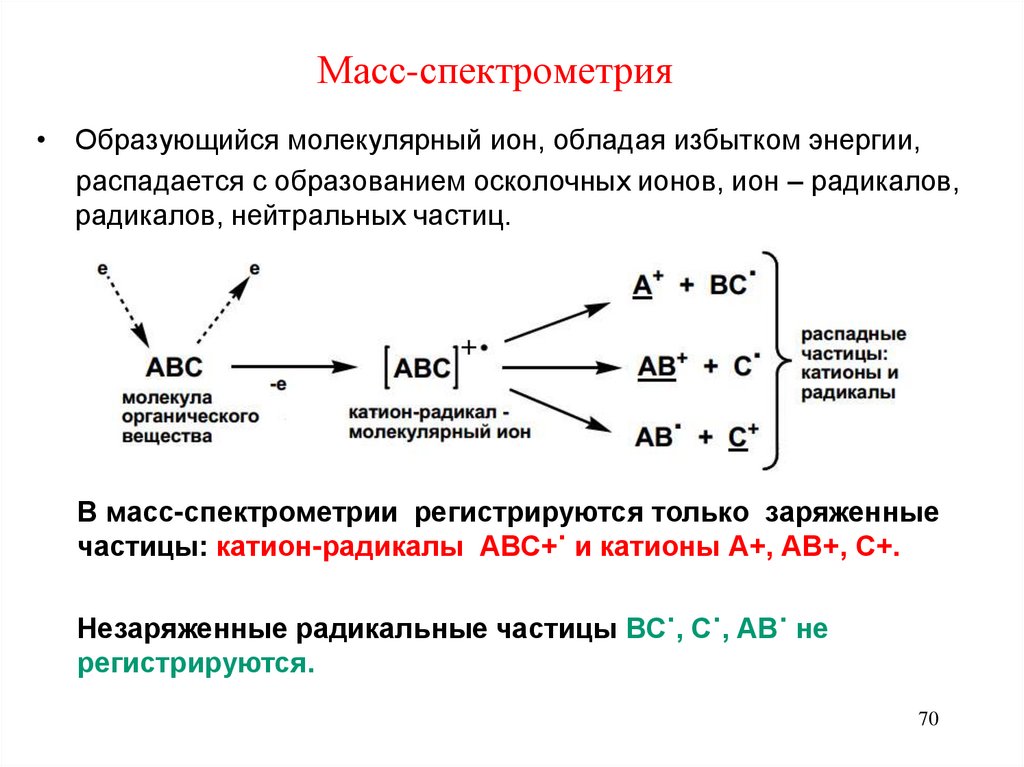
70. Масс-спектрометрия
• Образующийся молекулярный ион, обладая избытком энергии,распадается с образованием осколочных ионов, ион – радикалов,
радикалов, нейтральных частиц.
В масс-спектрометрии регистрируются только заряженные
частицы: катион-радикалы АВС+˙ и катионы А+, АВ+, С+.
Незаряженные радикальные частицы ВС˙, С˙, АВ˙ не
регистрируются.
70
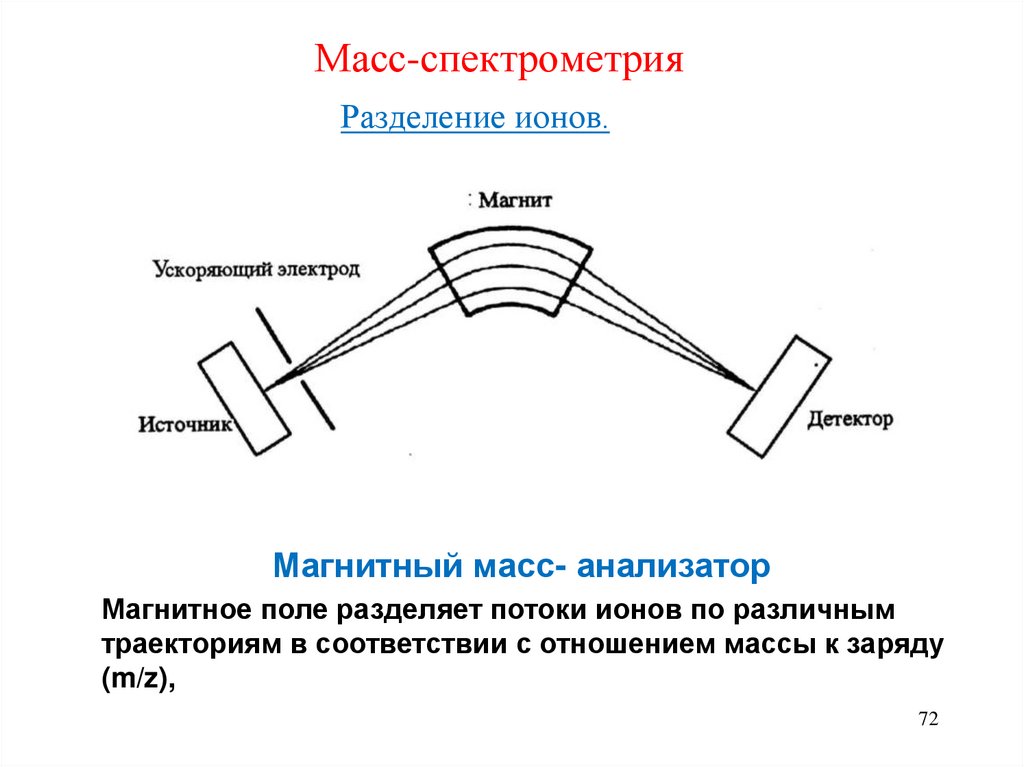
71. Масс-спектрометрия
Разделение ионов.• Разделение ионов основано на различии в траекториях их
движения в магнитном и (или ) электростатическом полях.
• Положительно заряженные ионы разделяются в зависимости от
отношения массы к заряду (m/z), детектируются и
регистрируются.
Для разделения ионов в соответствии с отношение ми
m/z используют устройство, называемое массанализатором.
Существует более 10 типов динамических анализаторов.
Основные типы масс- анализаторов:
Магнитные
Квадрупольные
Времяпролётные
«Ионная ловушка»
71
72. Масс-спектрометрия
Разделение ионов.Магнитный масс- анализатор
Магнитное поле разделяет потоки ионов по различным
траекториям в соответствии с отношением массы к заряду
(m/z),
72
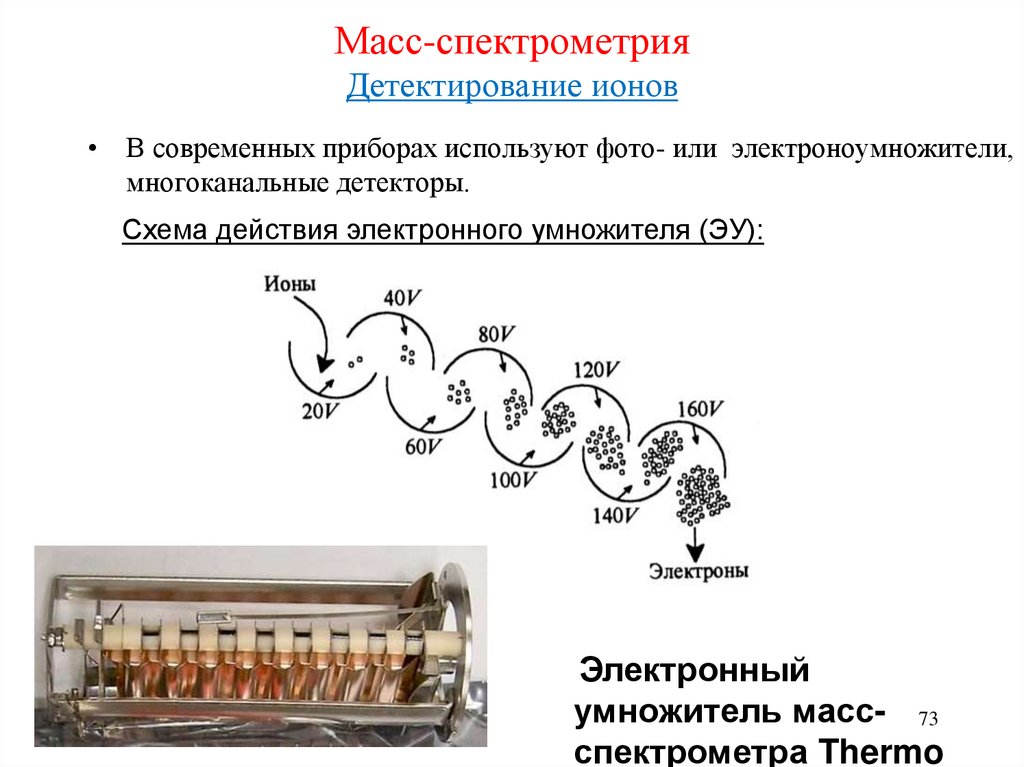
73. Масс-спектрометрия Детектирование ионов
• В современных приборах используют фото- или электроноумножители,многоканальные детекторы.
Схема действия электронного умножителя (ЭУ):
Электронный
умножитель масс- 73
спектрометра Thermo
74. Масс-спектрометрия
• Масс- спектры представляют в виде в виде таблицы илиграфика.
При графическом изображении на оси абсцисс приводят
значения m/z,совпадающие с массой иона , так как в основном
они однозарядны.
На оси ординат- относительную
интенсивность. (Интенсивность максимального пика принимают
за 100%).
• Полные масс-спектры могут использоваться как «отпечатки
пальцев» соединений. Масс- спектр любого соединения
индивидуален и с его помощью можно идентифицировать
вещество, если известен его масс-спектр.
74
75.
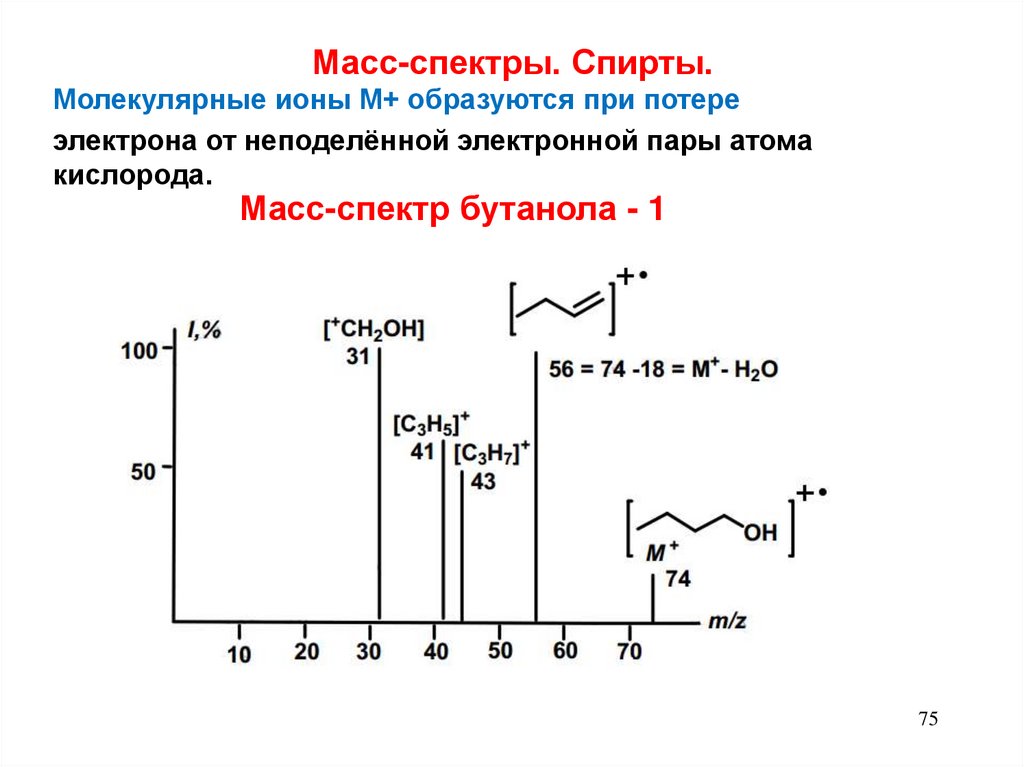
Масс-спектры. Спирты.Молекулярные ионы М+ образуются при потере
электрона от неподелённой электронной пары атома
кислорода.
Масс-спектр бутанола - 1
75
76.
Масс-спектры. Кетоны.Альдегиды.Масс-спектр кетонов
ионы R1-C O + и R2-C O+.
R1
C
O
содержит
R2
Масс-спектр
метилбутаналя
Каждый пик
соответствует
определенному
молекулярному
катиону,
образующемуся
при ионизации.
76
77.
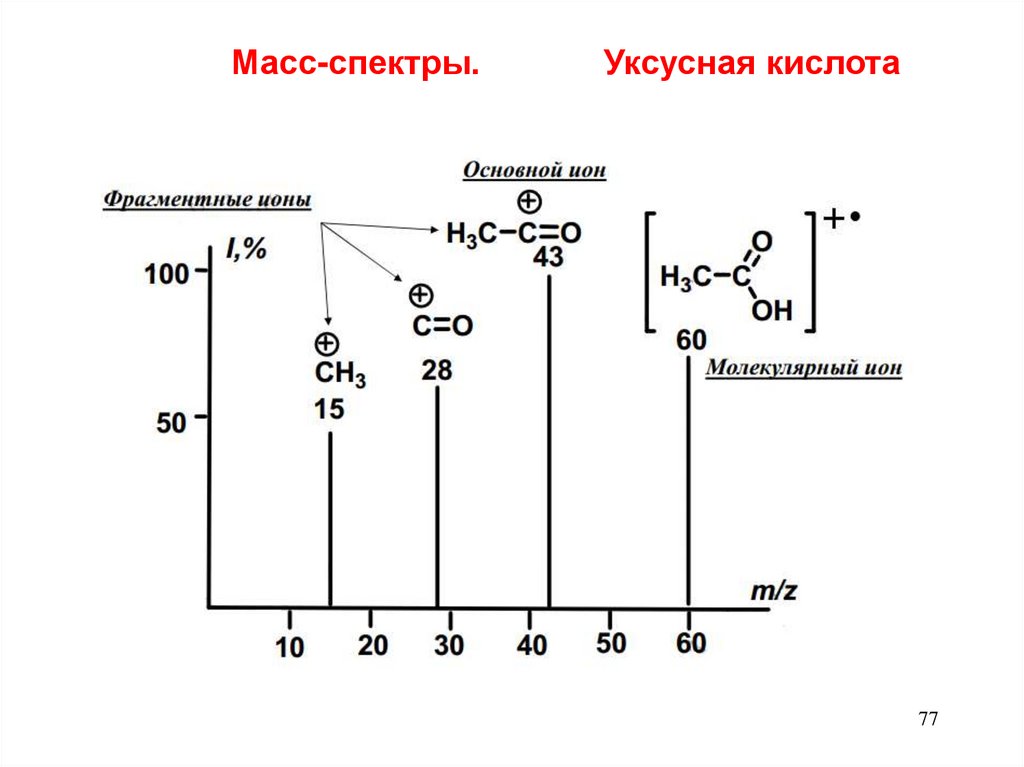
Масс-спектры.Уксусная кислота
77
78.
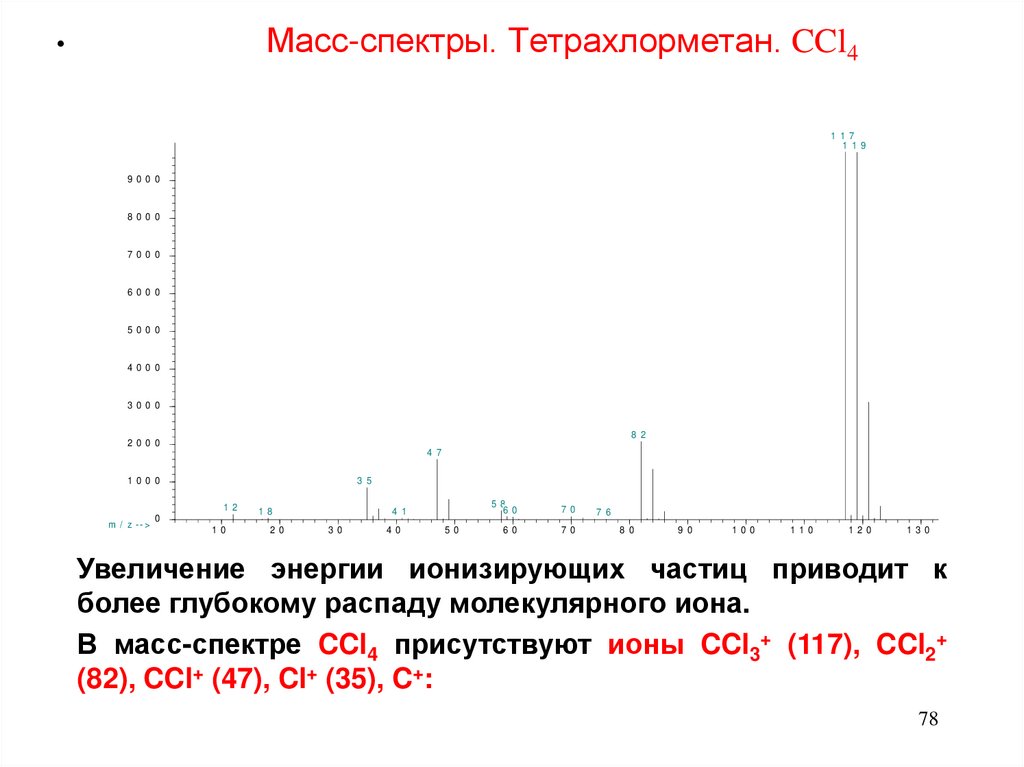
Масс-спектры. Тетрахлорметан. CCl4# 2 4 3 8 4 1 : C a r b o n T e t r a c h lo r id e $ $ M e t h a n e , t e t r a c h lo r o - $ $ B e ( * )
A b u n d a n c e
1 1 7
1 1 9
9 0 0 0
8 0 0 0
7 0 0 0
6 0 0 0
5 0 0 0
4 0 0 0
3 0 0 0
8 2
2 0 0 0
4 7
3 5
1 0 0 0
1 2
m / z -->
0
1 0
1 8
2 0
4 1
3 0
4 0
5 0
5 8
6 0
7 0
6 0
7 0
7 6
8 0
9 0
1 0 0
1 1 0
1 2 0
1 3 0
Увеличение энергии ионизирующих частиц приводит к
более глубокому распаду молекулярного иона.
В масс-спектре CCl4 присутствуют ионы CCl3+ (117), CCl2+
(82), CCl+ (47), Cl+ (35), C+:
78
79.
Области применения масс-спектрометрии1. Установление строения соединений.
2.Определение молекулярной массы и молекулярной формулы
органи-ческих соединений.
3.Химический анализ вещества
4.Элементный анализ неорганических веществ (одновременно
определяются до 70 элементов).
5. Кинетические исследования:
• Определение механизмов химических процессов (в том числе по
изотопным меткам).
• Определение констант скоростей химических процессов.
• Определение порядка и молекулярности реакции.
6.Термодинамические исследования:
• Определение потенциалов ионизации молекул и появления ионов.
• Определение парциального давления паров вещества.
Определение теплоты сублимации.
Определение константы равновесия химической реакции и
теплоты химической реакции.
• Ион-молекулярные равновесия.
79
80. Применение масс-спектрометрии в медицине
• 1.Разработка новых лекарственных средств для спасениячеловека от ранее неизлечимых болезней .
• 2. Контроль производства лекарств,
• 3.Генная инженерия и биохимия, протеомика.
• 4.Контроль над незаконным распространением наркотических и
психотропных средств,
• 5.Криминалистический и клинический анализ токсичных
препаратов, анализ взрывчатых веществ.
81. ХРОМАТО-МАСС-СПЕКТРОМЕТРИЯ
• В настоящее время для идентификации и структурногоисследования
лекарственных
веществ
и
их
метаболитов
применяют
массспектрометры,представляющие
собой
комбинацию
хроматографа и масс-спектрометра
81
82. ХРОМАТО-МАСС-СПЕКТРОМЕТРИЯ
ХРОМАТО-МАСС-СПЕКТРОМЕТРИЯ - метод анализа смесейорганических веществ (главным образом) и определения
следовых количеств веществ в объеме жидкости.
Метод основан на комбинации двух самостоятельных
методов - хроматографии и масс-спектрометрии. С
помощью первого осуществляют разделение смеси на
компоненты, с помощью второго идентификацию и определение строения
вещества, количественный анализ.
Газовый хромато-масс-спектрометр – GCMSQP 2010 Ultra
82
83. ХРОМАТО-МАСС-СПЕКТРОМЕТРИЯ
Хромато-масс-спектрометр(другими словами - хромас),
представляет собой
комбинацию газового
хроматографа и массспектрометра
Область применения хромаса –
химический и структурный
анализ веществ и соединений
• в органической химии,
• медицине,
•судебно-медицинской
экспертизе, криминалистике,
токсикологии,
83
84. Применение масс-спектрометрии
• В настоящее время для идентификации и структурногоисследования
лекарственных
веществ
и
их
метаболитов
применяют
масс-спектрометры,
представляющие собой комбинацию хроматографа и
масс-спектрометра
84
85. ХРОМАТО-МАСС-СПЕКТРОМЕТРИЯ
Область применения хромаса –•при производстве и контроле качества
различных видов пищевой,
парфюмерной, фармацевтической,
промышленной и
сельскохозяйственной продукции,
•при наркотическом и экологическом
контроле,
•также в учебных, научноисследовательских учреждениях и
центрах санэпиднадзора Министерства
Здравоохранения РФ.
85
86.
СПАСИБОЗА ВНИМАНИЕ!
86































 chemistry
chemistry








