Similar presentations:
Нуклеофилы и электрофилы. Лекция 2
1. Нуклеофилы и электрофилы
Нуклеофилы (Nu) – ионы, имеющие отрицательныйзаряд, или нейтральные молекулы,
имеющие неподеленную пару электронов
Электрофилы (Е) – ионы, имеющие положительный
заряд, или нейтральные молекулы,
способные реагировать с нуклеофилами
2. Лекция
Алифатические углеводороды3. Лекция № 2
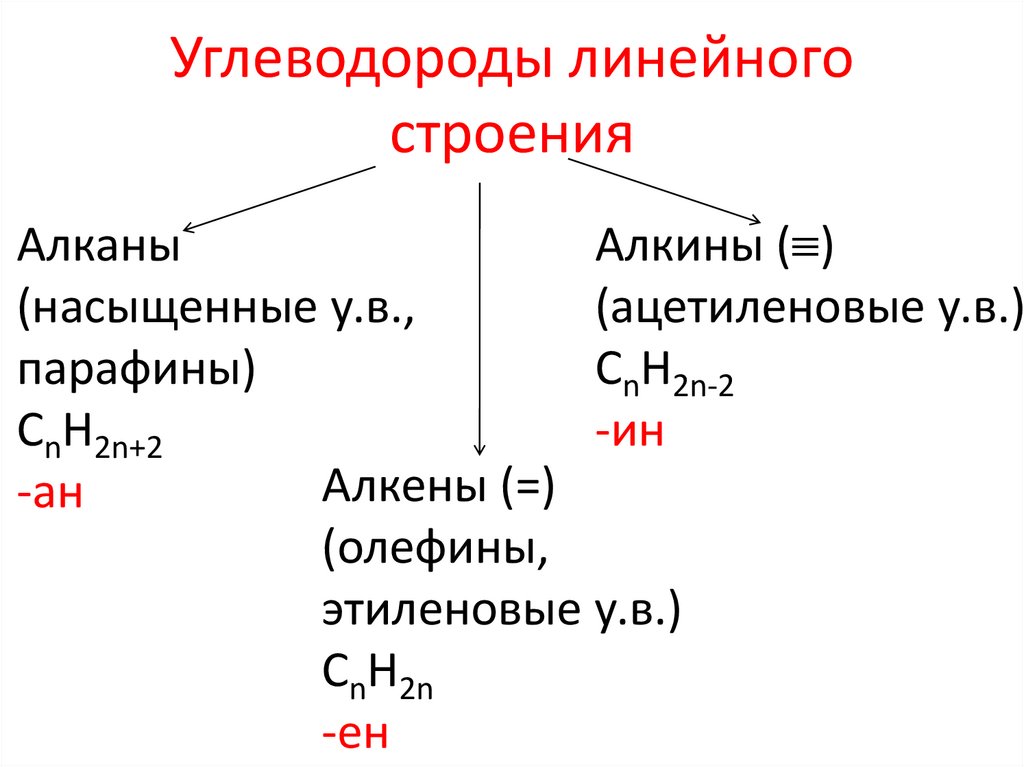
Углеводороды линейногостроения
Алканы
Алкины ( )
(насыщенные у.в.,
(ацетиленовые у.в.)
парафины)
СnH2n-2
СnH2n+2
-ин
Алкены (=)
-ан
(олефины,
этиленовые у.в.)
СnH2n
-ен
4. Углеводороды линейного строения
Гомологический ряд– ряд органических соединений, в
котором каждый следующий член
отличается от предыдущего на
гомологическую разность – группу СН2
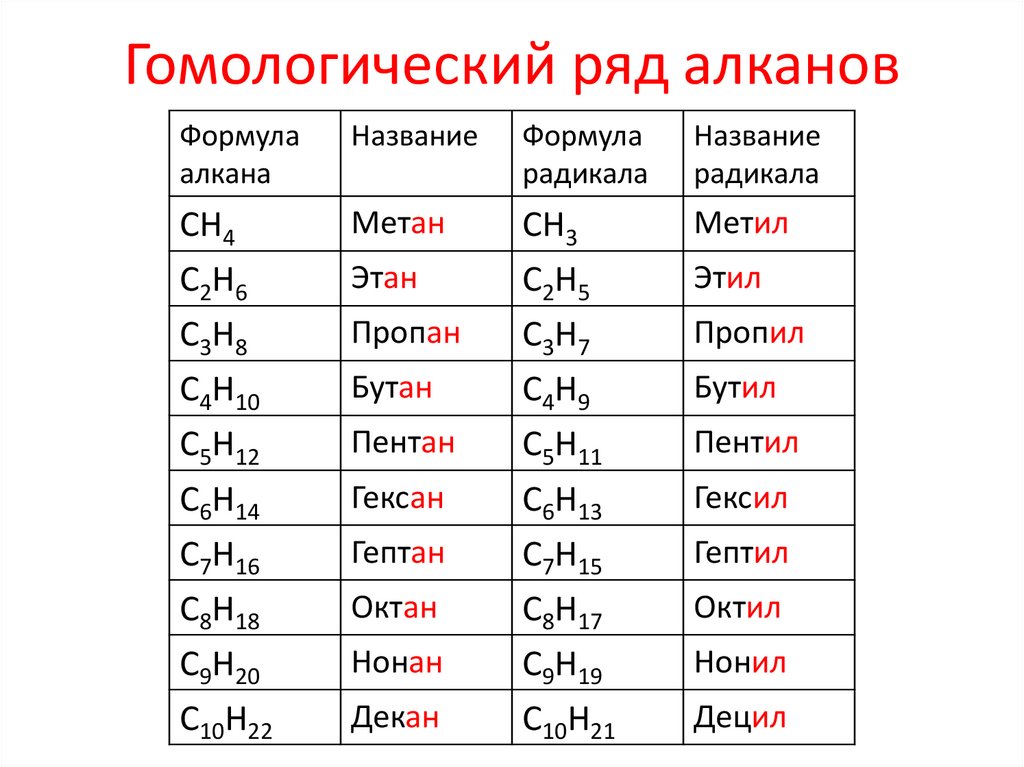
5. АЛКАНЫ (предельные или насыщенные у.в., парафины)
Гомологический ряд алкановФормула
алкана
Название
Формула
радикала
Название
радикала
СН4
С2Н6
С3Н8
С4Н10
С5Н12
С6Н14
С7Н16
С8Н18
С9Н20
С10Н22
Метан
СН3
С2Н5
С3Н7
С4Н9
С5Н11
С6Н13
С7Н15
С8Н17
С9Н19
С10Н21
Метил
Этан
Пропан
Бутан
Пентан
Гексан
Гептан
Октан
Нонан
Декан
Этил
Пропил
Бутил
Пентил
Гексил
Гептил
Октил
Нонил
Децил
6. Гомологический ряд
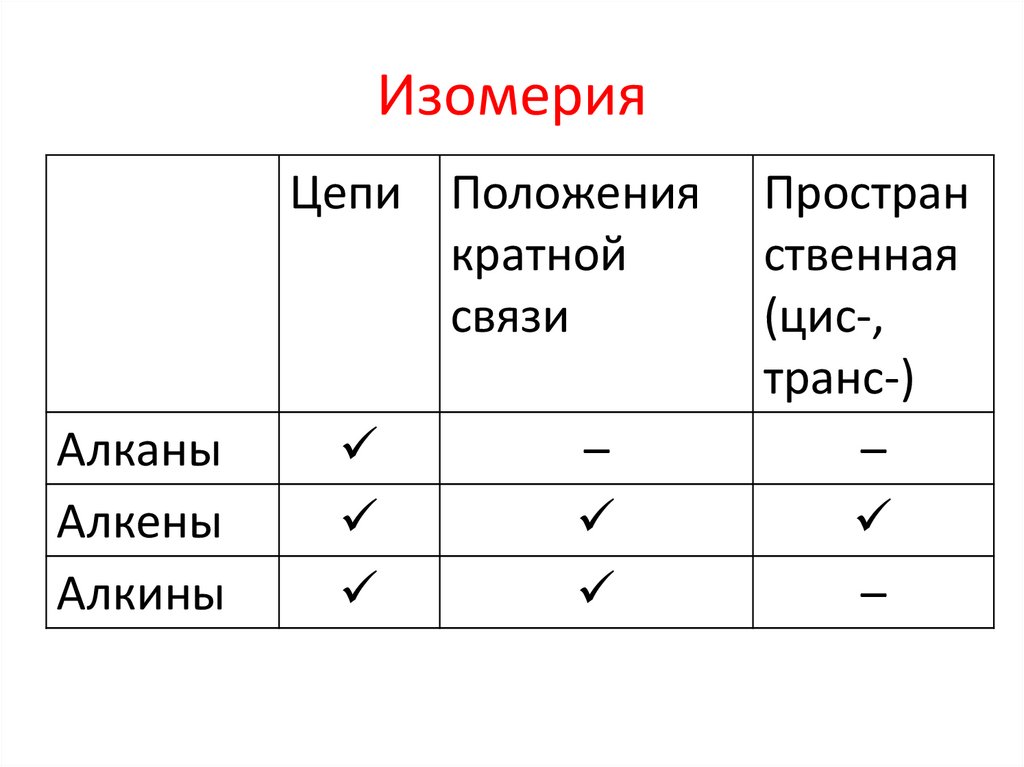
ИзомерияЦепи Положения
кратной
связи
Алканы
Алкены
Алкины
–
Простран
ственная
(цис-,
транс-)
–
–
7. Гомологический ряд алканов
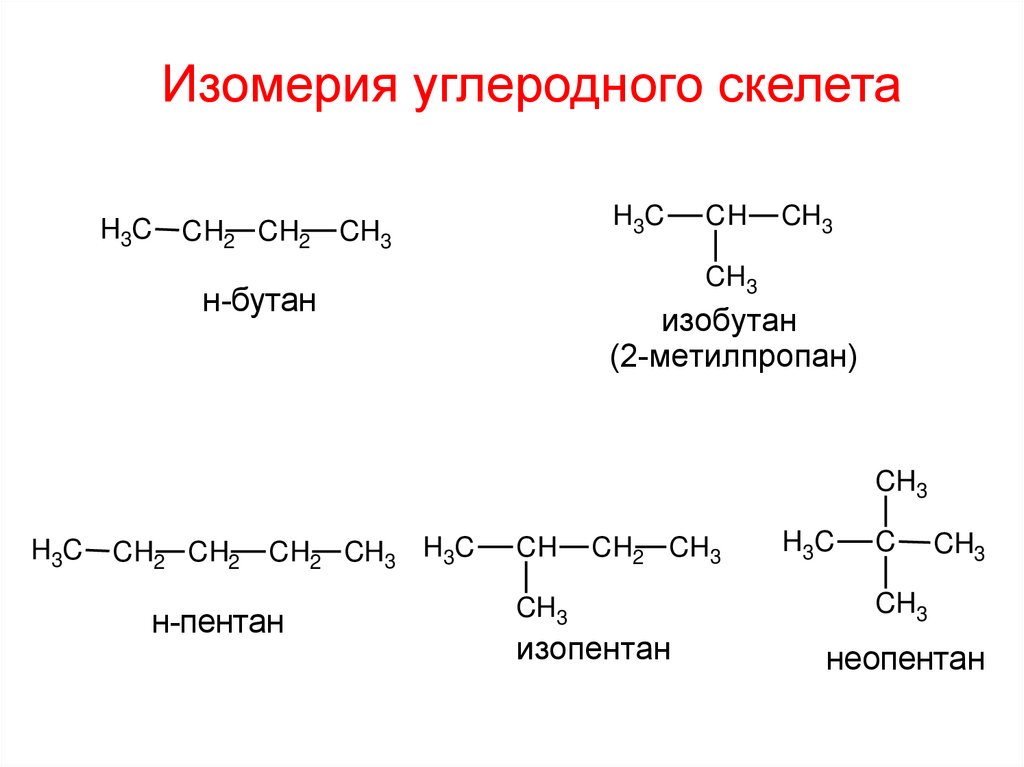
Изомерия углеродного скелетаH3C
CH2 CH2
H3C
CH3
CH
CH3
CH3
н-бутан
изобутан
(2-метилпропан)
CH3
H3C
CH2 CH2
CH2 CH3 H3C
н-пентан
CH
CH2 CH3
CH3
изопентан
H3C
C
CH3
CH3
неопентан
8. Изомерия
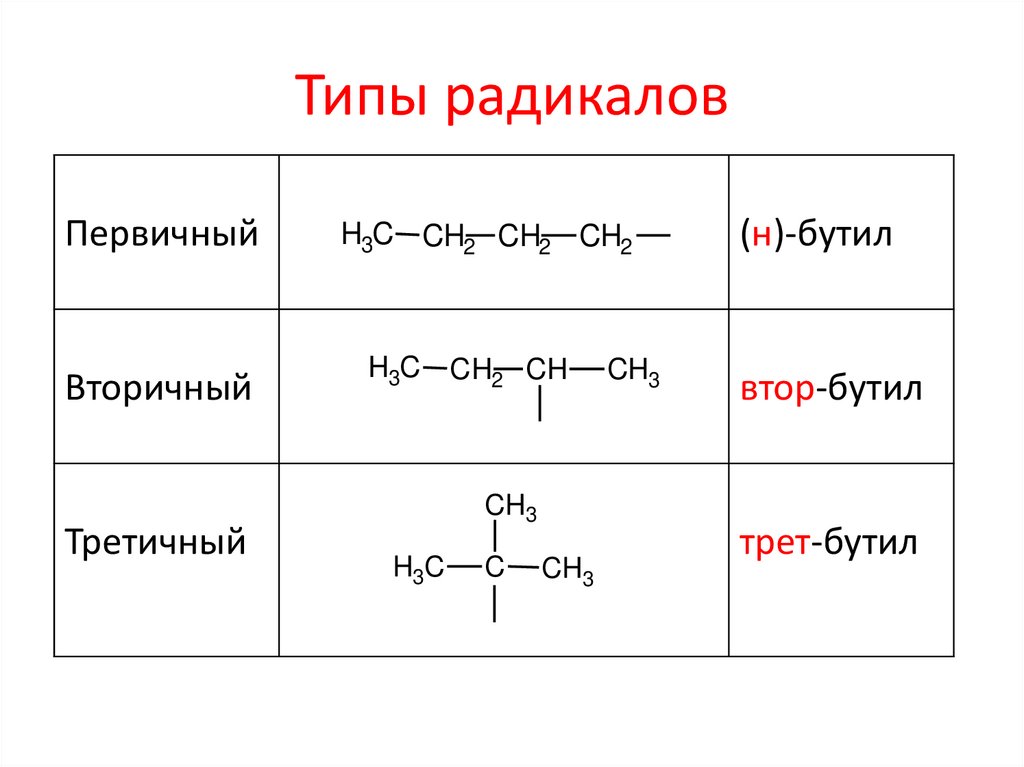
Типы радикаловПервичный
Вторичный
Третичный
H3C CH2 CH2 CH2
H3C CH2 CH
CH3
H3C
C
CH3
CH3
(н)-бутил
втор-бутил
трет-бутил
9.
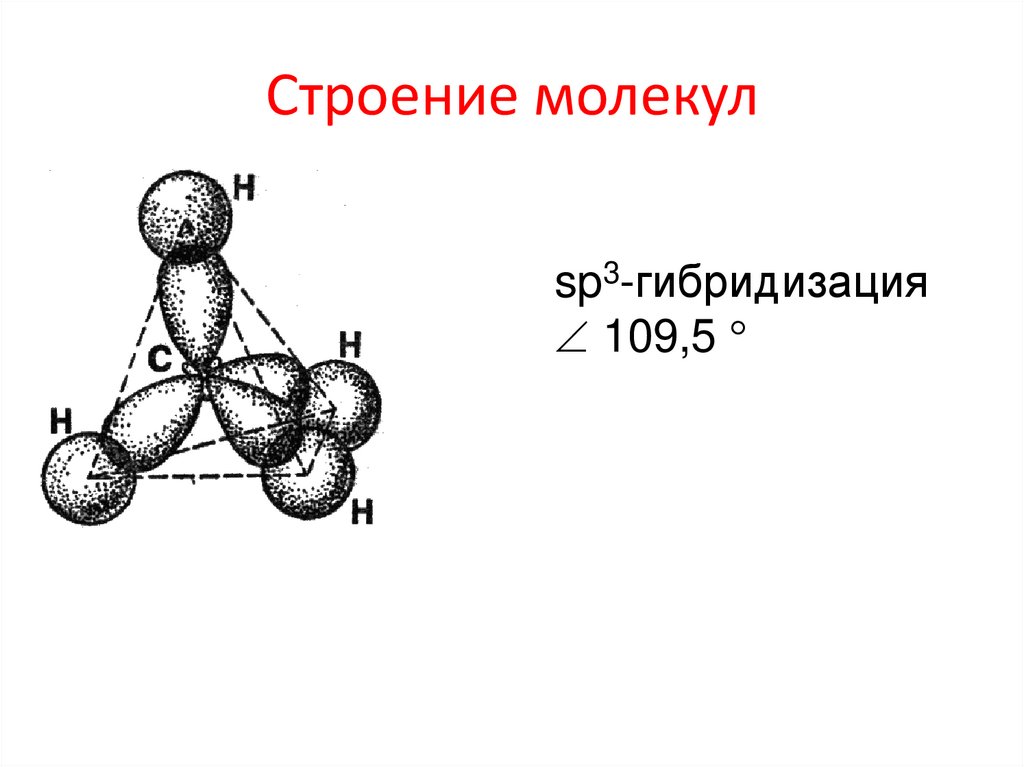
Строение молекулsp3-гибридизация
109,5
10. Типы радикалов
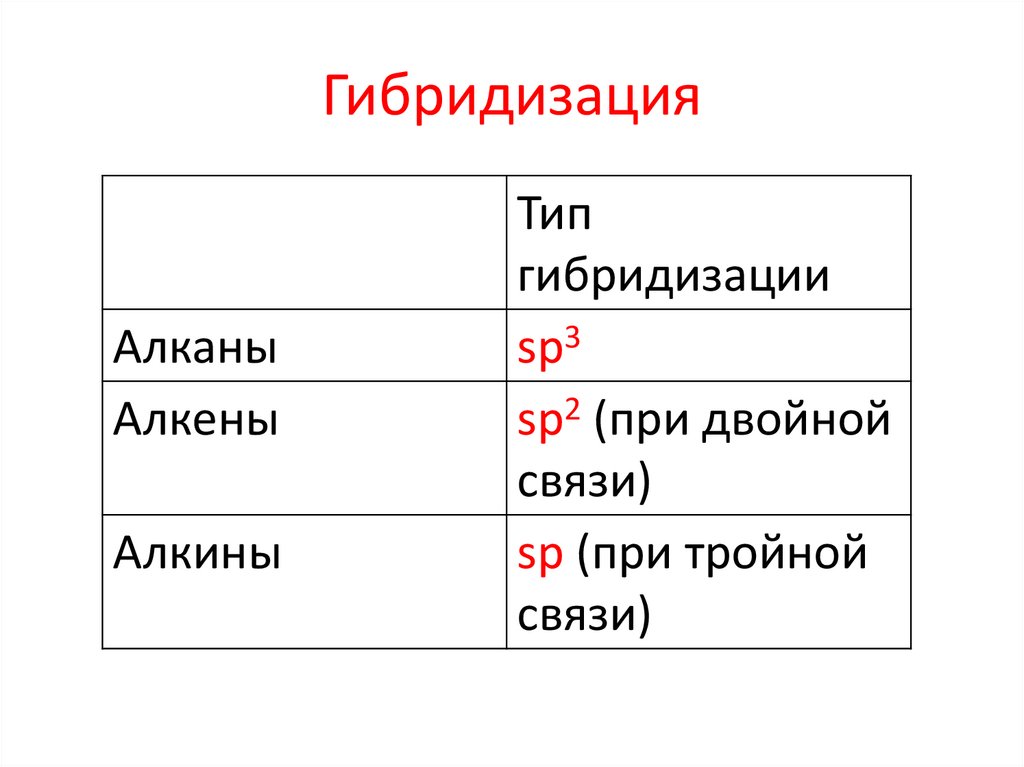
ГибридизацияАлканы
Алкены
Алкины
Тип
гибридизации
sp3
sp2 (при двойной
связи)
sp (при тройной
связи)
11. Строение молекул
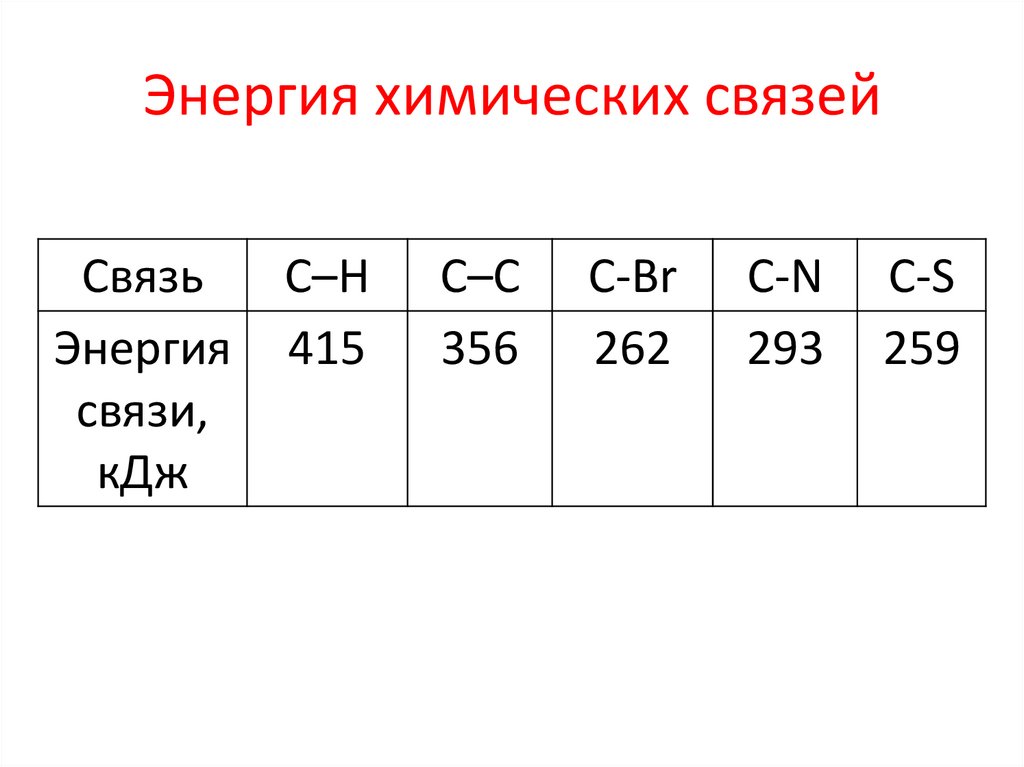
Энергия химических связейСвязь
Энергия
связи,
кДж
С–Н
415
С–С
356
С-Br
262
С-N
293
C-S
259
12. Гибридизация
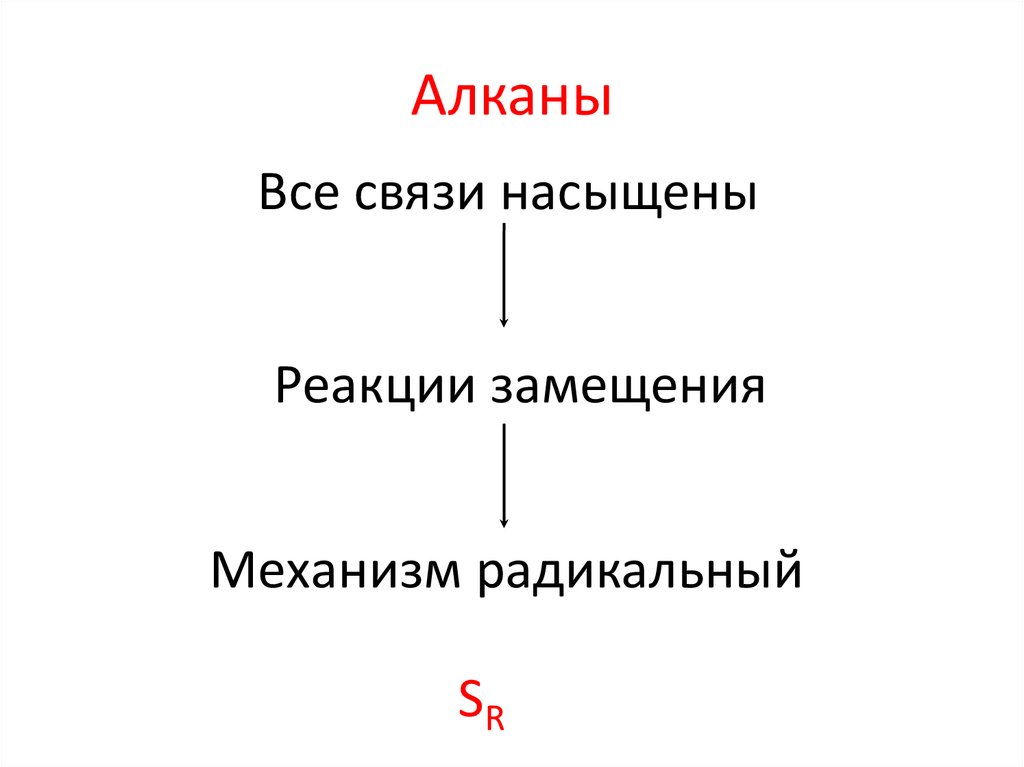
АлканыВсе связи насыщены
Реакции замещения
Механизм радикальный
SR
13. Конформации
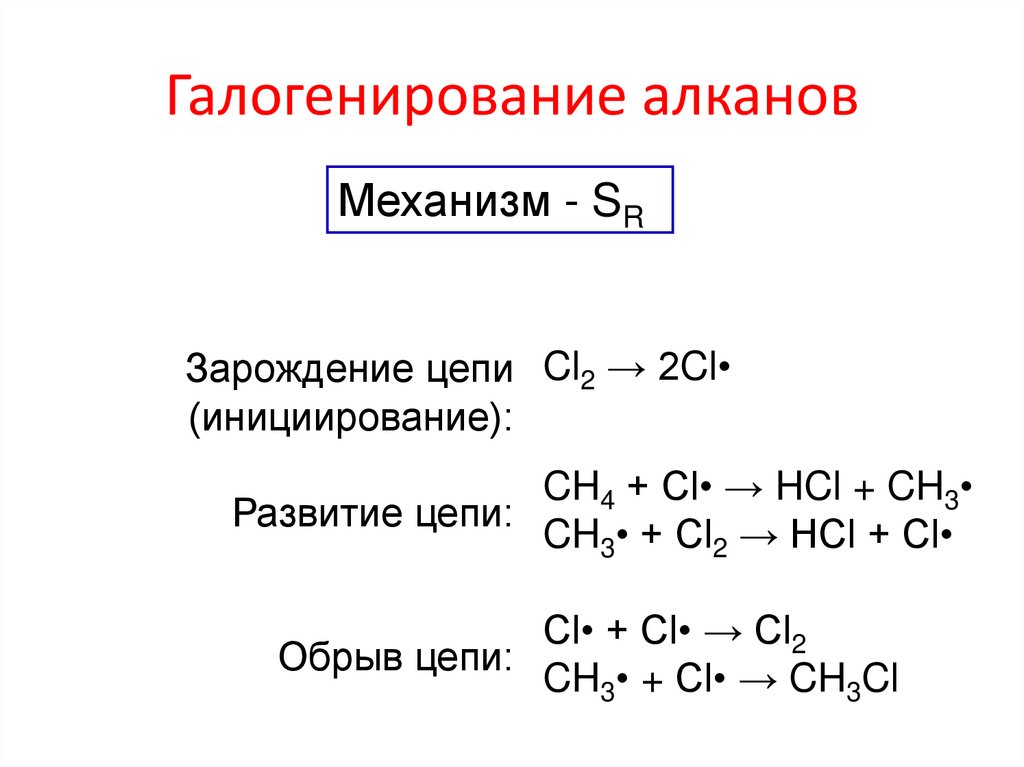
Галогенирование алкановМеханизм - SR
Зарождение цепи Cl2 → 2Cl
(инициирование):
CH4 + Сl• → HCl + CH3
Развитие цепи:
CH3• + Cl2 → HCl + Cl
Cl• + Cl• → Cl2
Обрыв цепи:
CH3• + Cl• → CH3Cl
14. Конформации
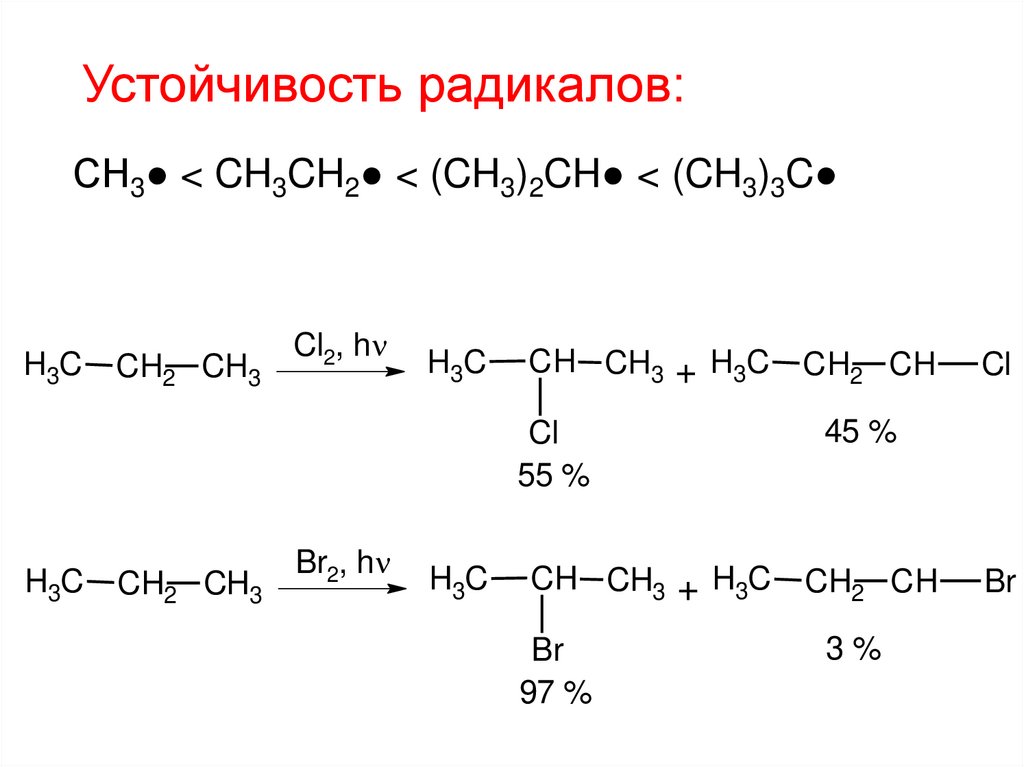
Устойчивость радикалов:СН3● < CH3CH2● < (CH3)2CH● < (CH3)3C
H3C
CH2 CH3
Cl2, h
H3C
CH CH3 + H3C
Cl
55 %
H3C
CH2 CH3
Br2, h
H3C
CH CH3 + H3C
Br
97 %
CH2 CH
Cl
45 %
CH2 CH
3%
Br
15. Энергия химических связей
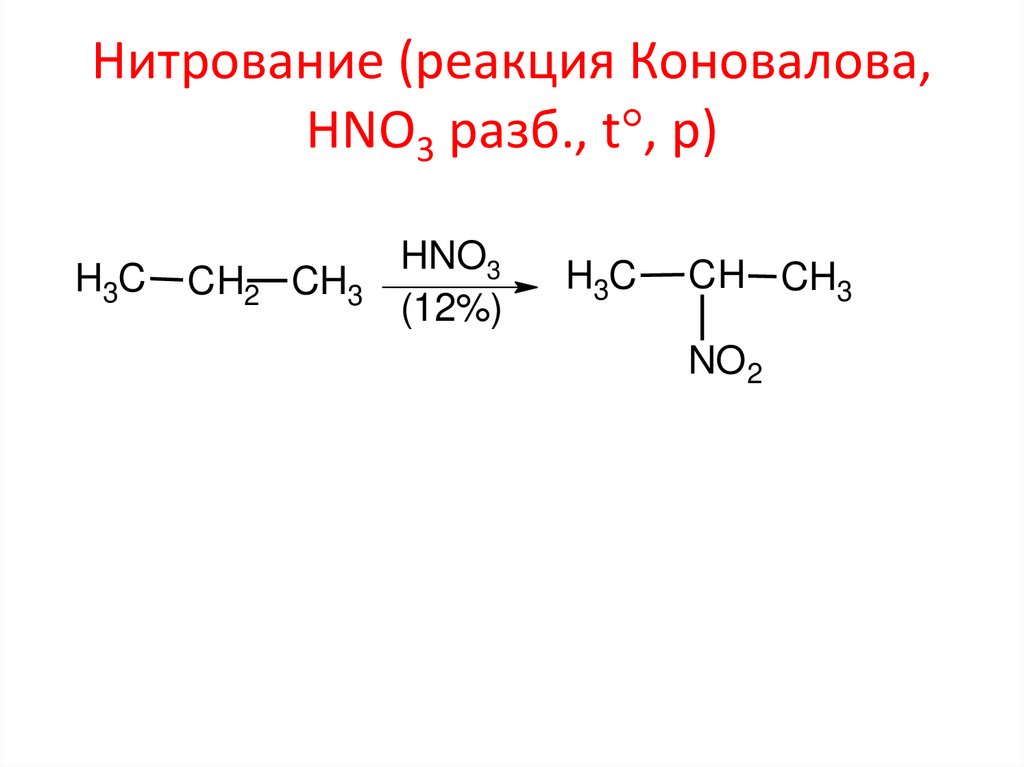
Нитрование (реакция Коновалова,HNO3 разб., t , p)
H3C
CH2 CH3
HNO3
(12%)
H3C
CH CH3
NO2
16. Алканы
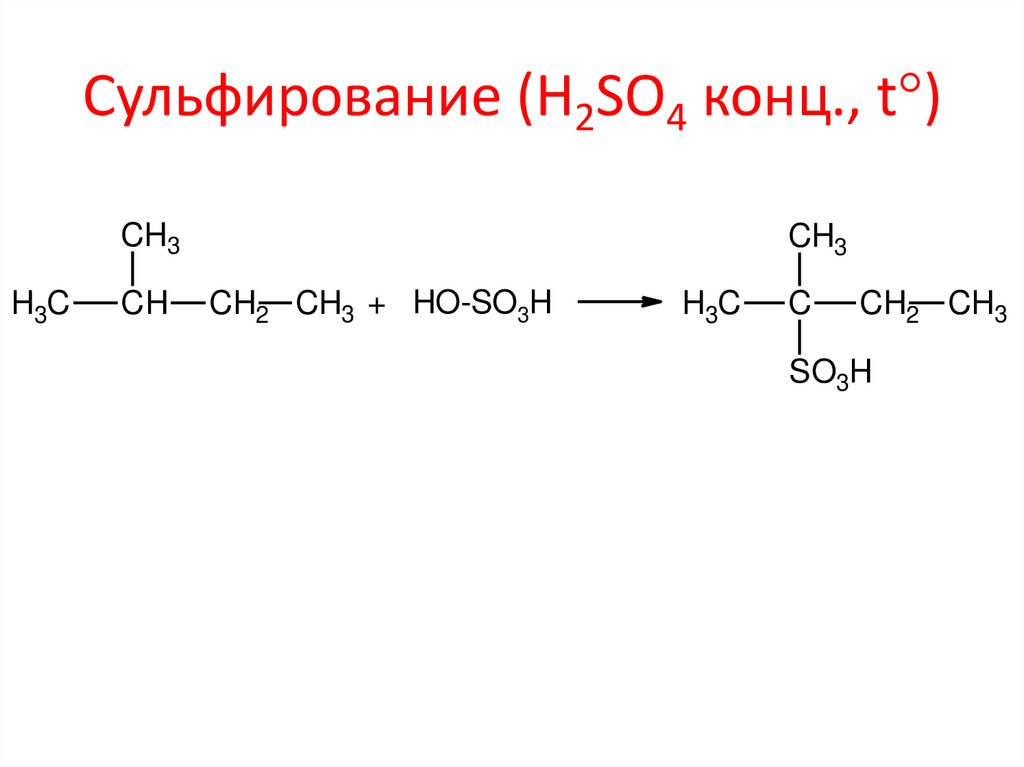
Сульфирование (H2SO4 конц., t )CH3
H3C
CH
CH3
CH2 CH3 + HO-SO3H
H3C
C
CH2 CH3
SO3H
17. Галогенирование алканов
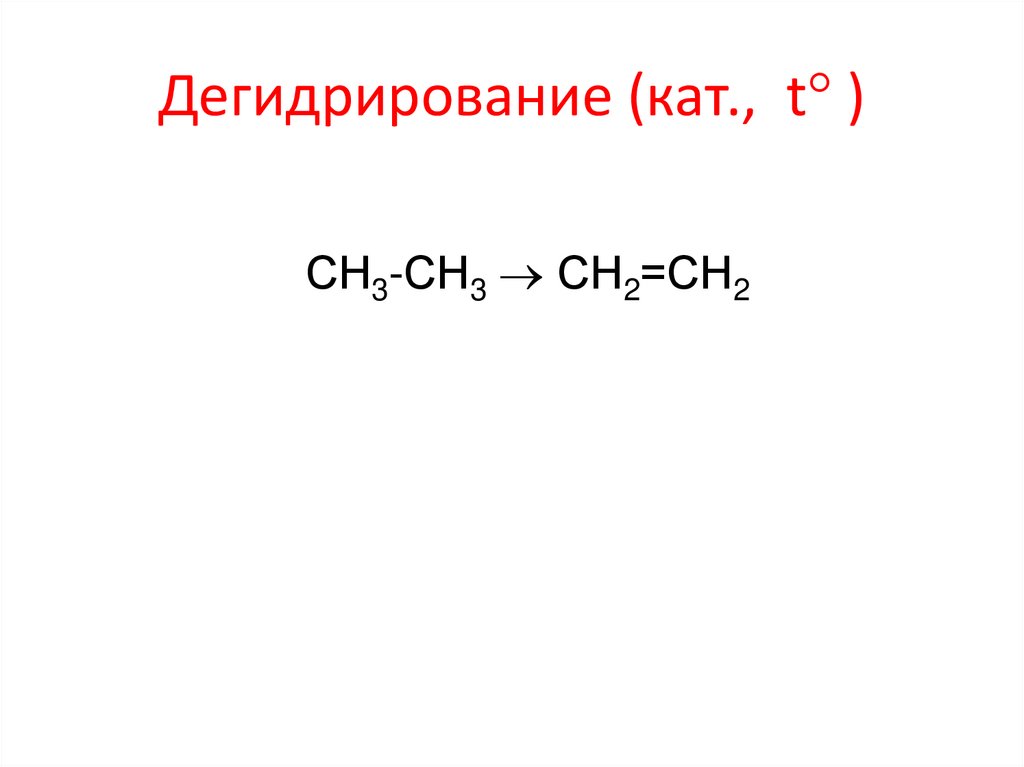
Дегидрирование (кат., t )СН3-СН3 СН2=СН2
18.
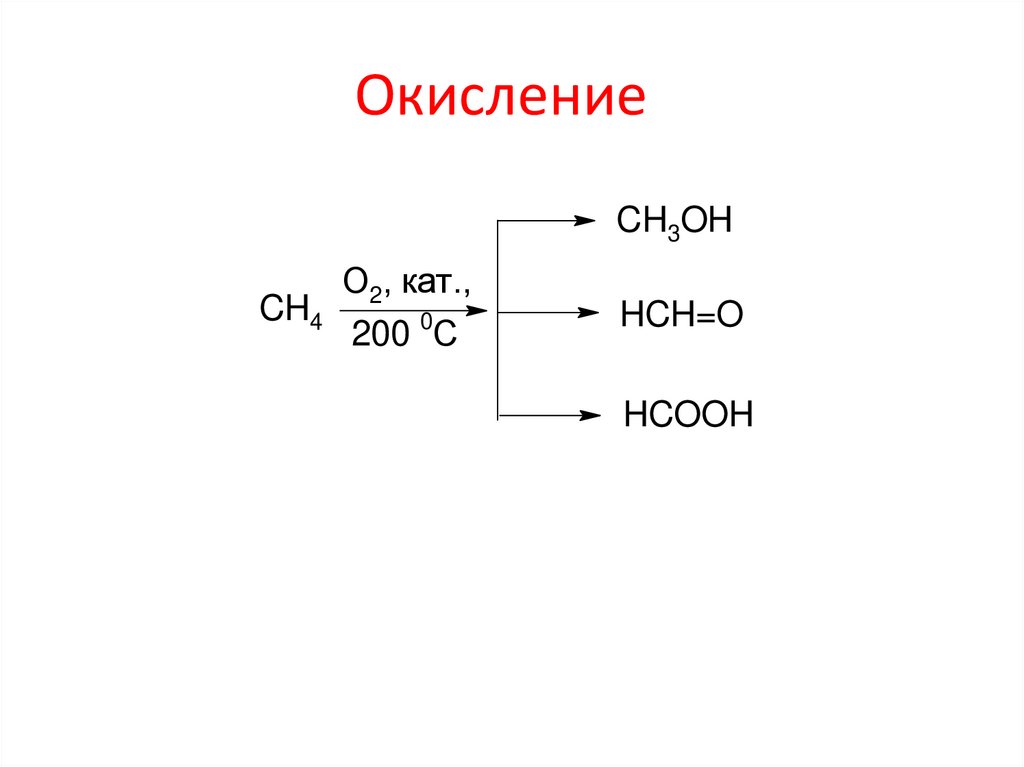
ОкислениеCH3OH
О2, кат.,
CH4
200 0С
HCH=O
HCOOH
19. Сульфохлорирование (SO2 + Cl2, t)
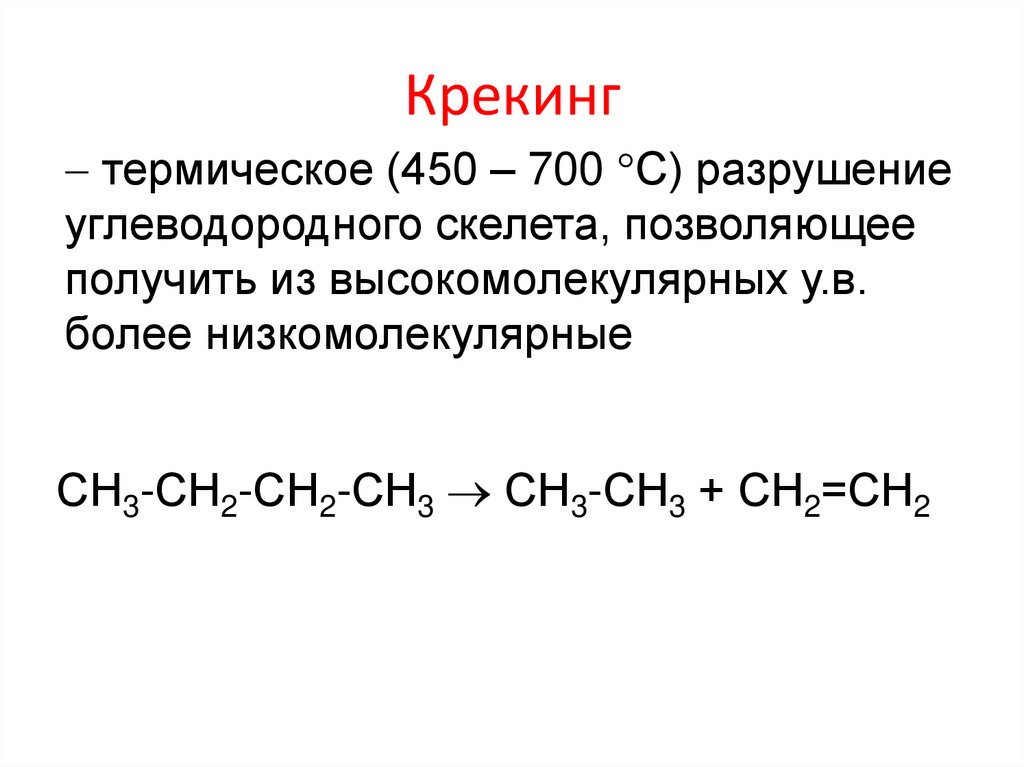
Крекингтермическое (450 – 700 С) разрушение
углеводородного скелета, позволяющее
получить из высокомолекулярных у.в.
более низкомолекулярные
СН3-СН2-СН2-СН3 СН3-СН3 + СН2=СН2
20. Нитрование (реакция Коновалова, HNO3 разб., t, p)
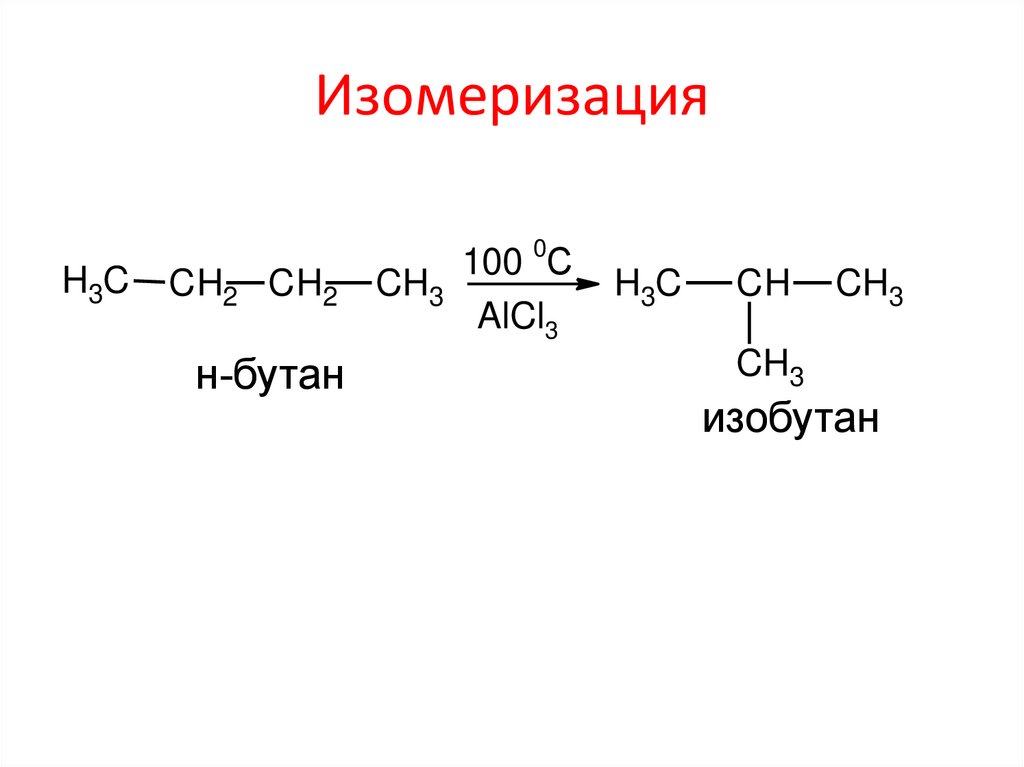
ИзомеризацияH3C
CH2 CH2
н-бутан
100 0С
CH3
AlCl3
H3C
CH
CH3
CH3
изобутан
21. Сульфирование (H2SO4 конц., t)
Получение алкановI. В промышленности
1) Из природного сырья (нефть, газ)
2) Газификация каменного угля (1869 г. – Бертло)
nC + (n+1)H2 CnH2n+2
3) Процесс Фишера-Тропша (300 С, Fe):
nСО + (2n+1)Н2 CnH2n+2 + nН2О
4) Каталитическое гидрирование алкенов (Ni, t )
CnH2n + H2 CnH2n+2
22. Дегидрирование (кат., t )
Получение алкановII. В лаборатории
1) Гидролиз карбида алюминия
Al4C3 + H2O CH4 + Al(OH)3
2) Сплавление ацетата натрия со щелочью
CH3COONa + NaOH CH4 + Na2CO3
3) Реакция Вюрца
2R-Br + 2Na R-R + 2NaBr





 chemistry
chemistry








