Similar presentations:
Органическая химия. Лекция 1
1. ОРГАНИЧЕСКАЯ ХИМИЯ Лекция 1
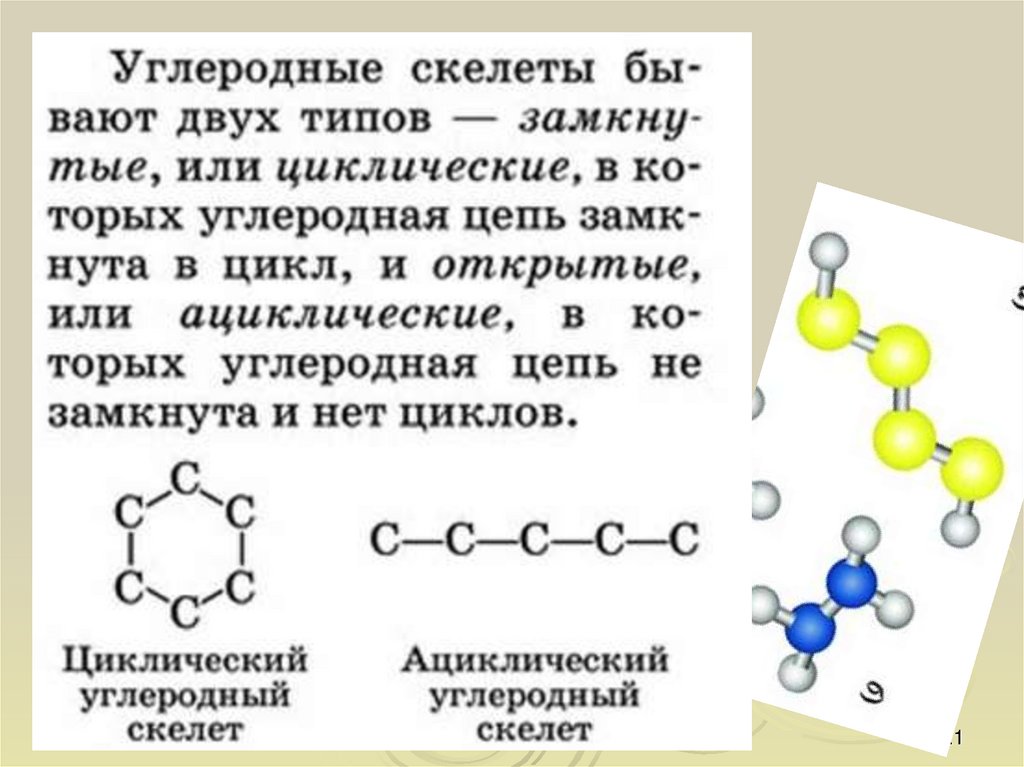
12. Предмет и значение органической химии, представление о многообразии органических соединений
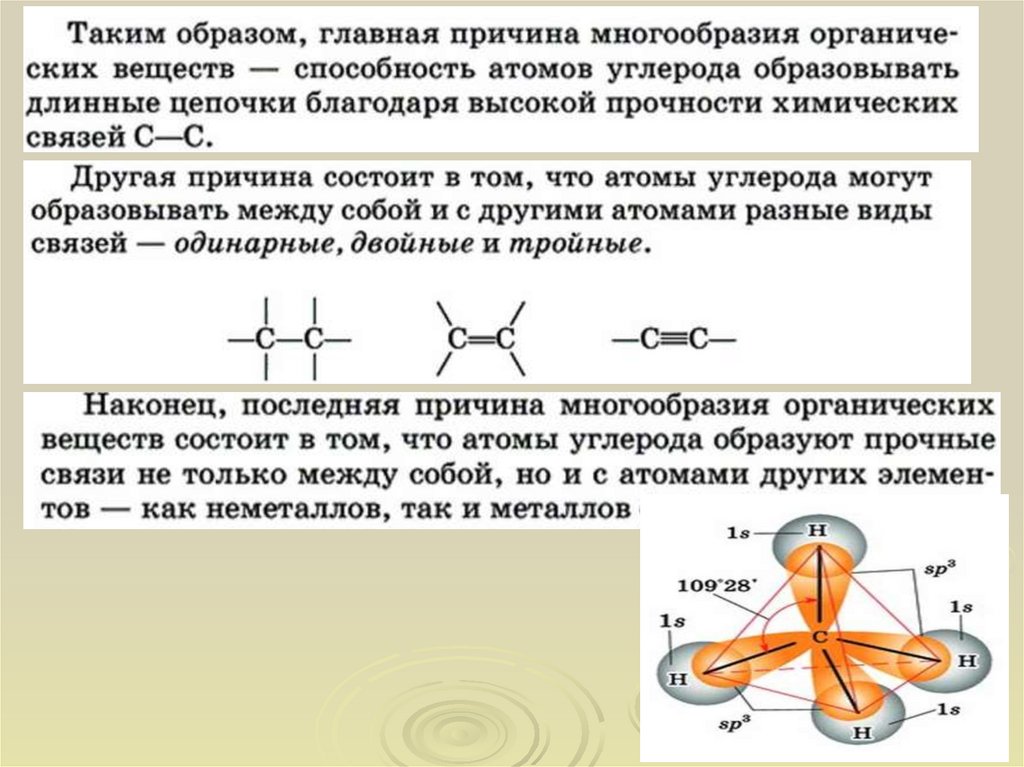
Органическая химия – это химия углерода и егосоединений с другими элементами.
В молекулах органических веществ могут
присутствовать также атомы: водорода Н, кислорода
О, азота N, серы S, фосфора P, галогенов, металлов и
других элементов.
Количество известных органических соединений в
настоящее время - около 70 миллионов.
2
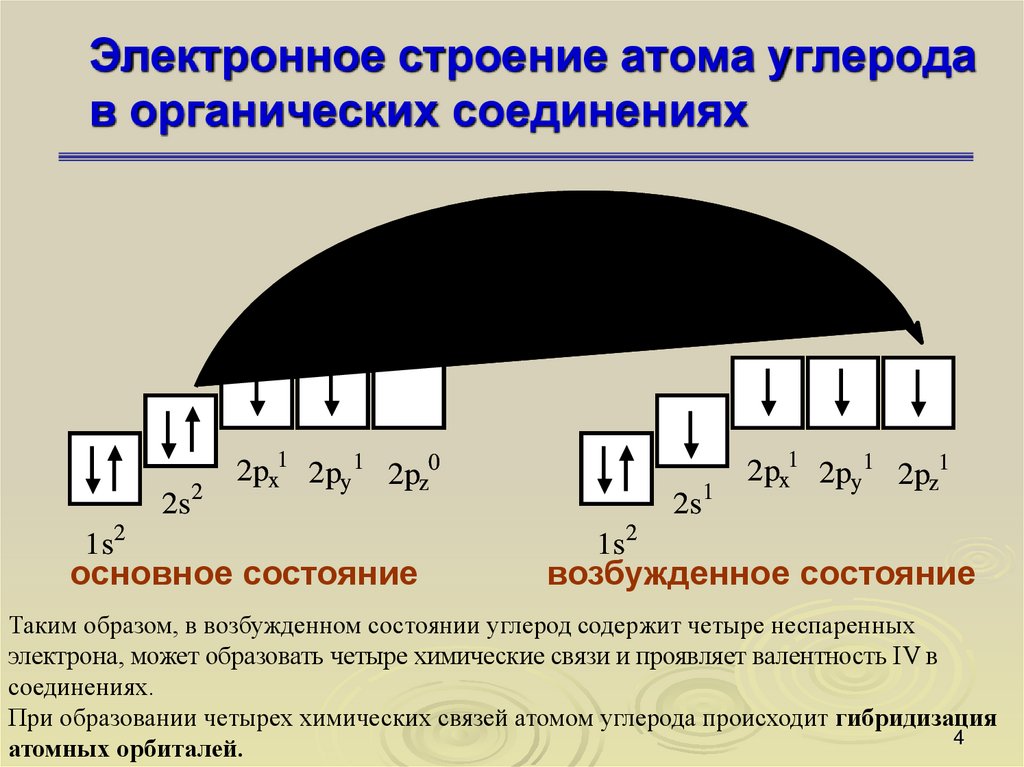
3. Электронное строение атома углерода в органических соединениях
34. Электронное строение атома углерода в органических соединениях
2s21s2
2px1 2py 1 2pz0
основное состояние
2s1
2px1 2py 1 2pz1
1s2
возбужденное состояние
Таким образом, в возбужденном состоянии углерод содержит четыре неспаренных
электрона, может образовать четыре химические связи и проявляет валентность IV в
соединениях.
При образовании четырех химических связей атомом углерода происходит гибридизация
4
атомных орбиталей.
5. Гибридизация
Гибридизация атомных орбиталей — это выравниваниеэлектронной плотности атомных орбиталей разного типа с
образованием новых, молекулярных орбиталей, форма и энергия
которых одинаковы.
В гибридизацию вступают атомные орбитали с небольшой
разницей в энергии (как правило, орбитали одного
энергетического уровня). В зависимости от числа и типа
орбиталей, участвующих в гибридизации, для атома углерода
возможны sp3, sp2 и sp-гибридизация.
5
6. Гибридизация атомных орбиталей
2p2sp3
Увeличeниe 2sp2
энeргии
2sp
2s
1s
C
C*
sp3
sp2
sp
Из четырех негибридных атомных орбиталей (одной s и трех p) в
результате гибридизации «образуется» ЧЕТЫРЕ гибридные орбитали.
Такой тип гибридизации называется sp3
6
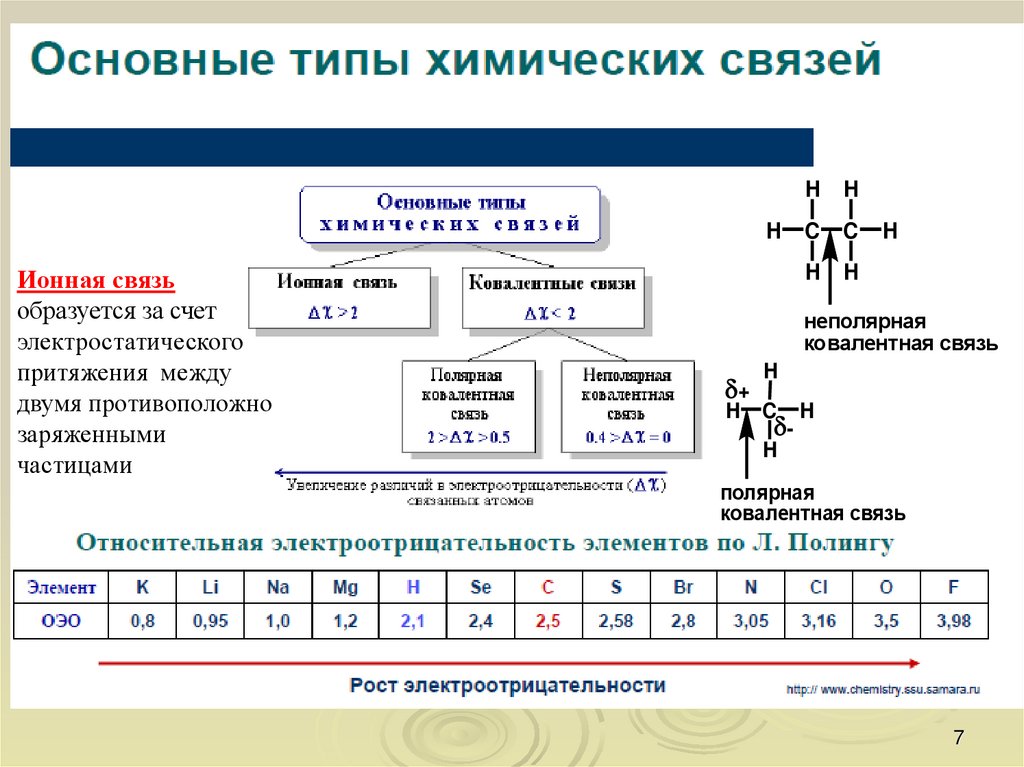
7.
+H
Ионная связь
образуется за счет
электростатического
притяжения между
двумя противоположно
заряженными
частицами
H
C
-
H
H
H
полярная
ковалентная связь
H
H
C
C
H
H
H
неполярная
ковалентная связь
H
+
H C
-
H
H
H
C
H
H
полярная
ковалентная связь
не
ко
7
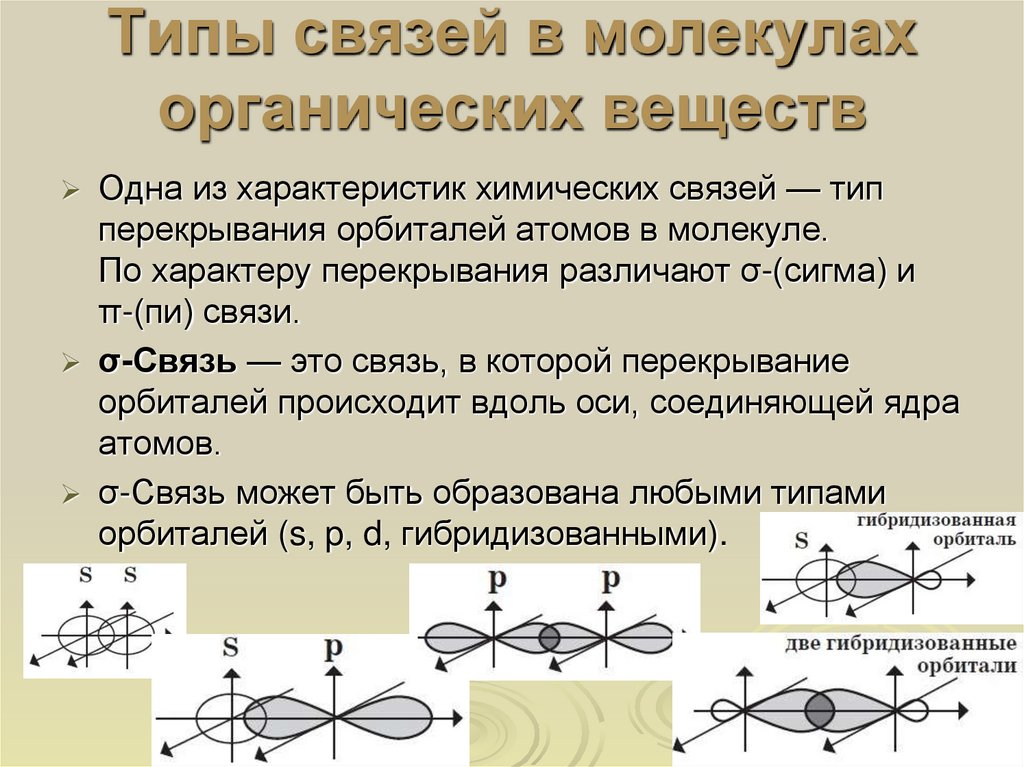
8. Типы связей в молекулах органических веществ
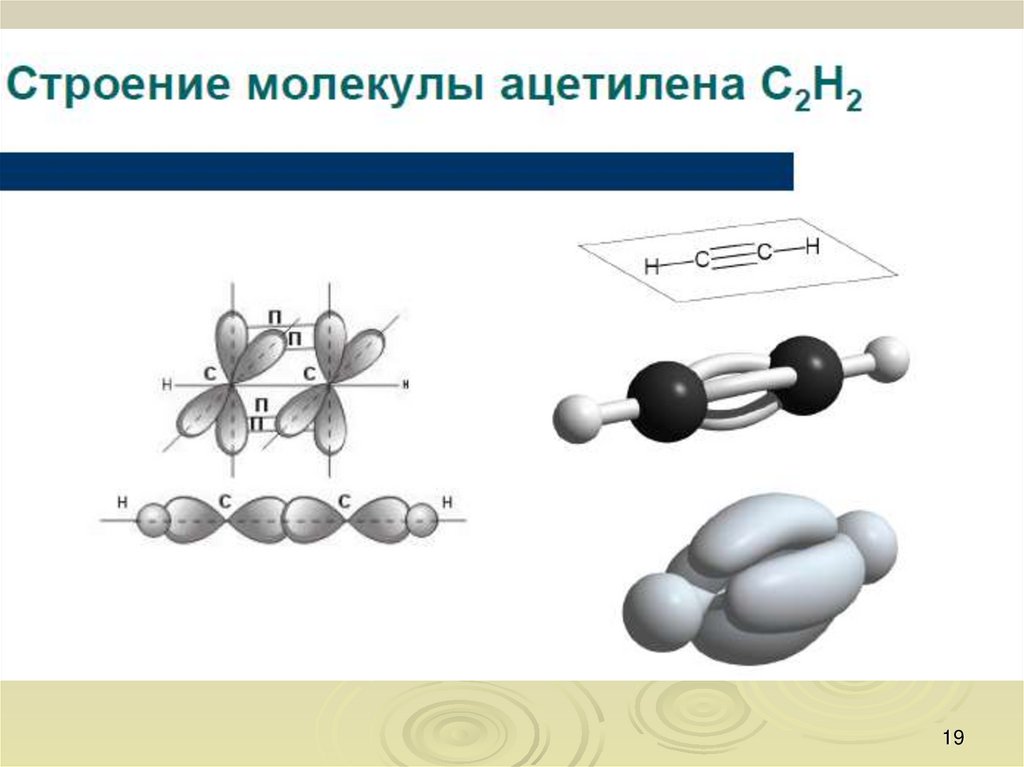
Одна из характеристик химических связей — типперекрывания орбиталей атомов в молекуле.
По характеру перекрывания различают σ-(сигма) и
π-(пи) связи.
σ-Связь — это связь, в которой перекрывание
орбиталей происходит вдоль оси, соединяющей ядра
атомов.
σ-Связь может быть образована любыми типами
орбиталей (s, p, d, гибридизованными).
8
9.
910.
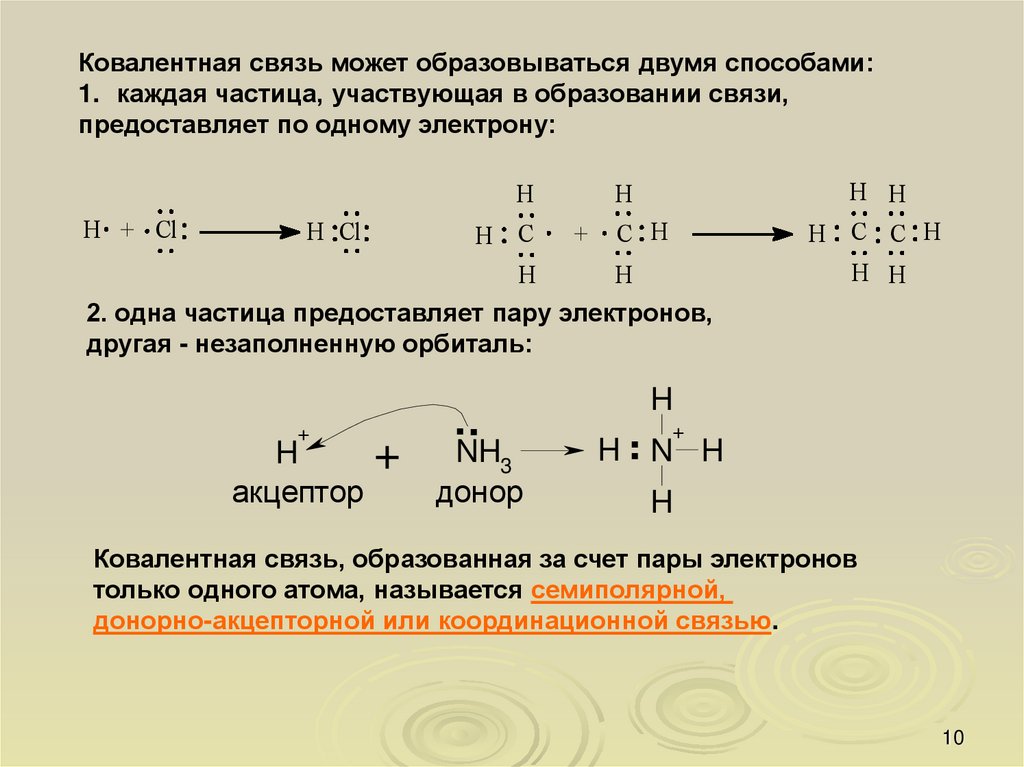
Ковалентная связь может образовываться двумя способами:1. каждая частица, участвующая в образовании связи,
предоставляет по одному электрону:
H
H + Cl
H Cl
H C
H H
H C C H
H
+
C H
H
H
2. одна частица предоставляет пару электронов,
другая - незаполненную орбиталь:
+
H
+
акцептор
H
..NH
H.N H
донор
H
3
H H
+
Ковалентная связь, образованная за счет пары электронов
только одного атома, называется семиполярной,
донорно-акцепторной или координационной связью.
10
11.
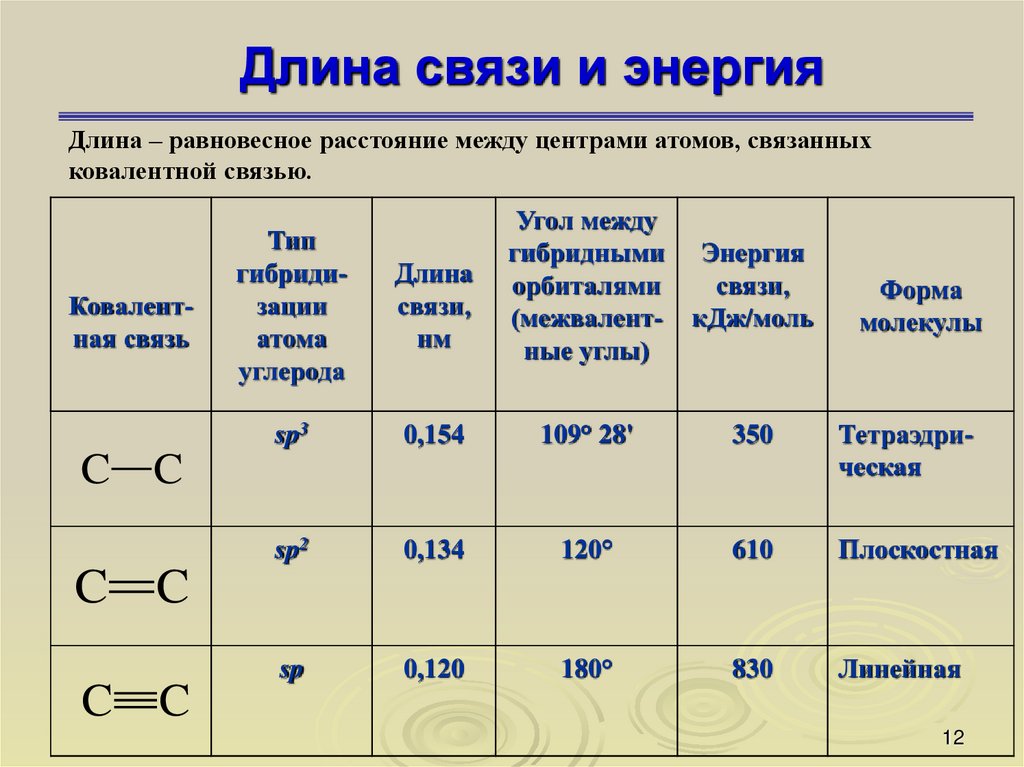
1112. Длина связи и энергия
Длина – равновесное расстояние между центрами атомов, связанныхковалентной связью.
Ковалентная связь
C
C
C
Угол между
гибридными Энергия
орбиталями
связи,
(межвалент- кДж/моль
ные углы)
Тип
гибридизации
атома
углерода
Длина
связи,
нм
sp3
0,154
109° 28'
350
Тетраэдрическая
sp2
0,134
120°
610
Плоскостная
sp
0,120
180°
830
Линейная
C
Форма
молекулы
C
C
12
13.
Полярность связи – смещение электронной плотности ковалентнойсвязи к более электроотрицательному атому.
F > O > Сl > N > Вг > С > Н
13
14.
Энергия связи – средняя энергия, которая необходима длягомолитического разрыва связи (энергия диссоциации).
Гомолитический разрыв связи – разрыв связи, приводящий к
образованию двух частиц, каждая из которых имеет один неспаренный
электрон.
A + B Радикал – частица, имеющая неспаренный электрон.
A :B
Гетеролитический разрыв связи – разрыв связи, приводящий к
образованию двух ионов.
A :B
A
+
B
14
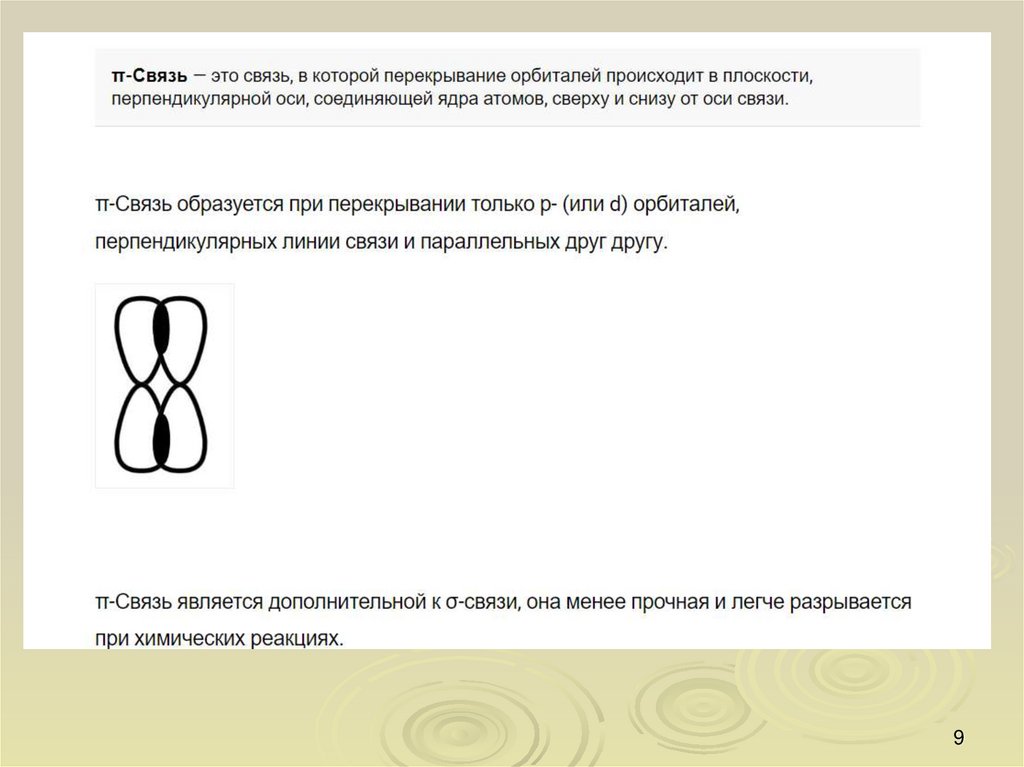
15. Поляризуемость
Ковалентная связь обладаетполяризуемостью — способностью
изменять свою полярность, например,
под влиянием внешнего воздействия.
-связи поляризуются гораздо легче,
чем -связи
15













 chemistry
chemistry








