Similar presentations:
Пространственное строение органических соединений
1.
Белорусский государственный медицинский университетЛЕКЦИЯ 2/3
ПРОСТРАНСТВЕННООЕ СТРОЕНИЕ
ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
КАФЕДРА БИООРГАНИЧЕСКОЙ ХИМИИ
2.
СТЕРЕОХИМИЯ– наука, которая изучает
пространственное строение
соединений и его влияние на
физические и химические свойства
Основы стереохимии заложены
работами Вант-Гоффа и Ле Беля (1874 г.),
Вант-Гофф предложил модель
ТЕТРАЭДРИЧЕСКОГО атома углерода
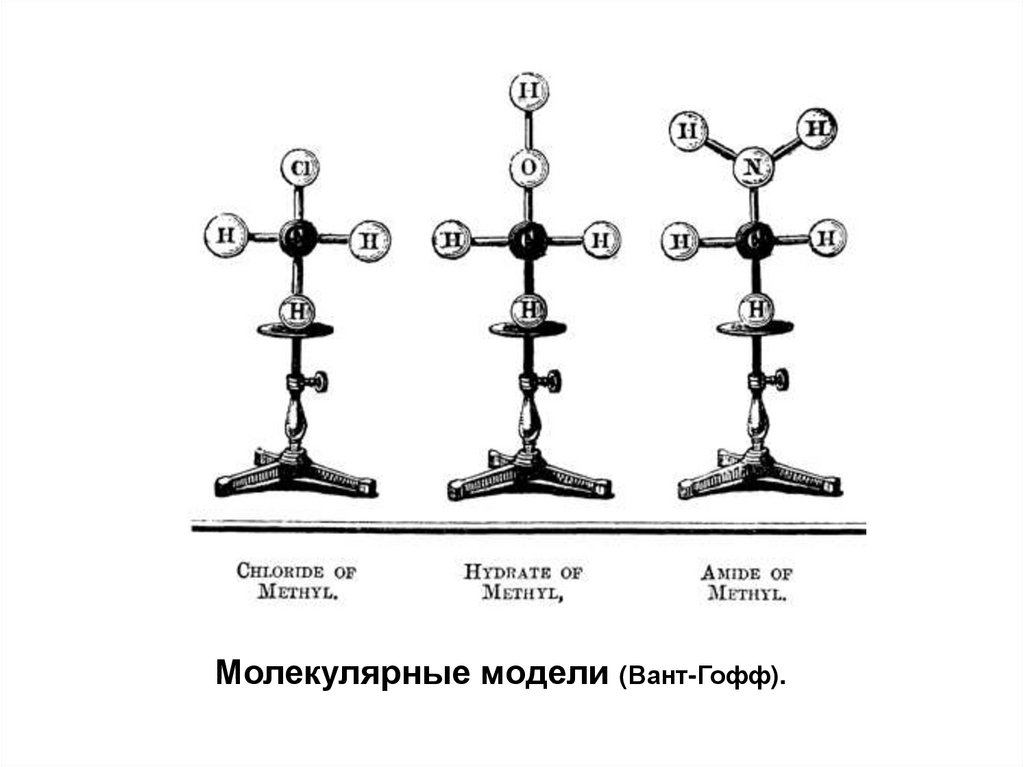
3.
Молекулярные модели (Вант-Гофф).4.
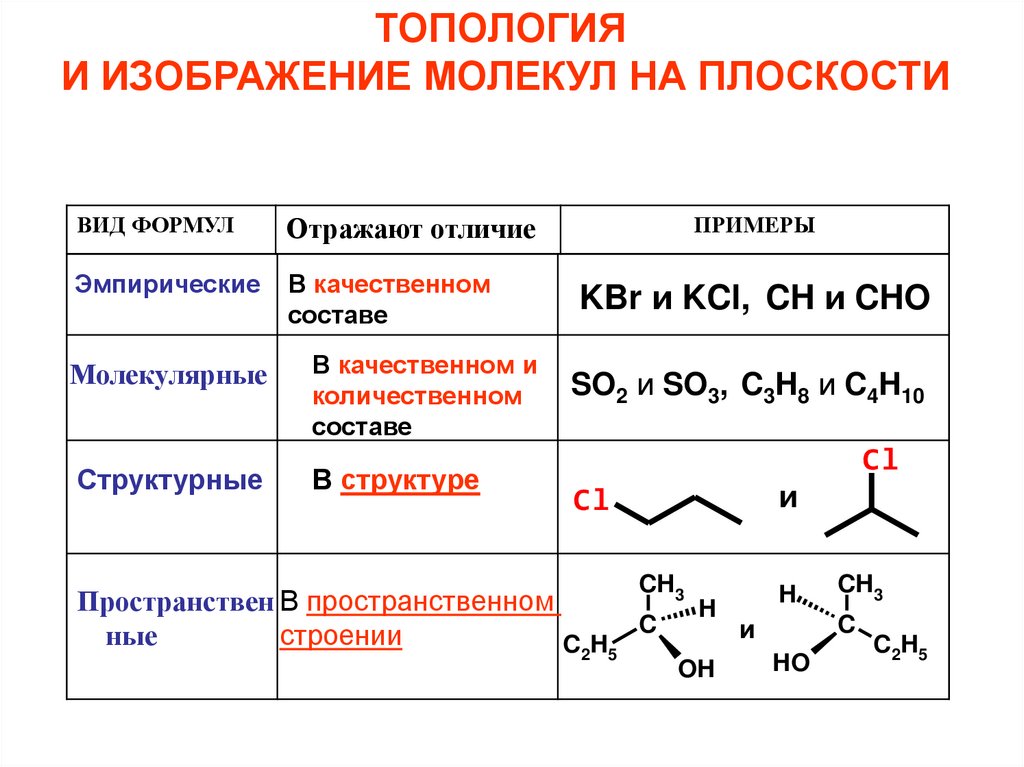
ОСНОВЫ ХИМИЧЕСКОЙ ТОПОЛОГИИ5.
ТОПОЛОГИЯИ ИЗОБРАЖЕНИЕ МОЛЕКУЛ НА ПЛОСКОСТИ
ВИД ФОРМУЛ
Отражают отличие
Эмпирические
В качественном
составе
Молекулярные
Структурные
В качественном и
количественном
составе
В структуре
ПРИМЕРЫ
KBr и KCl, CH и CHO
SO2 и SO3, C3H8 и C4H10
Cl
и
Cl
Пространствен В пространственном
ные
строении
CH
2
CH3
C
5
H
OH
H
CH3
C
и
HO
C2H5
6.
7.
Виды структурных формулC3H8
H H H
H C C C H
CH3 CH2 CH3
H H H
полная форма
графическая
(полу)
сокращенная
сокращенная
(скелетная )
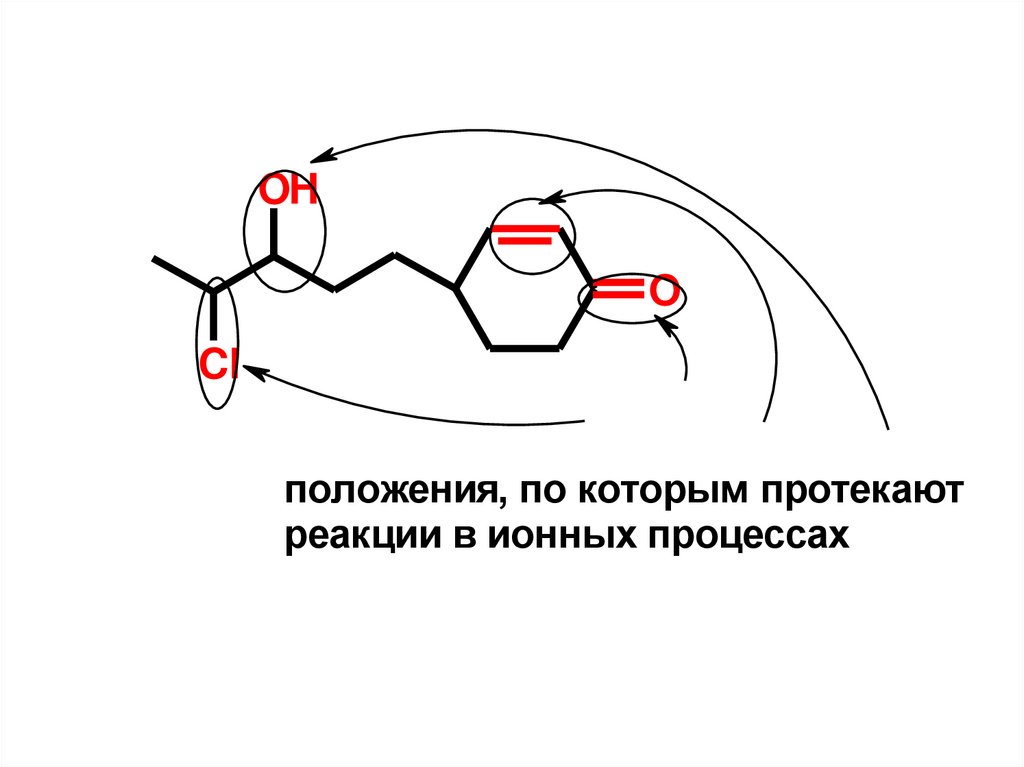
8.
OHO
Cl
положeния, по которым протeкают
рeакции в ионных процeссах
9. ИЗОМЕРИЯ
ИЗОМЕРЫ –ЭТО НЕИДЕНТИЧНЫЕ МОЛЕКУЛЫ,
с одинаковой
МОЛЕКУЛЯРНОЙ ФОРМУЛОЙ
(имеют одинаковый качественный
и количественный состав,
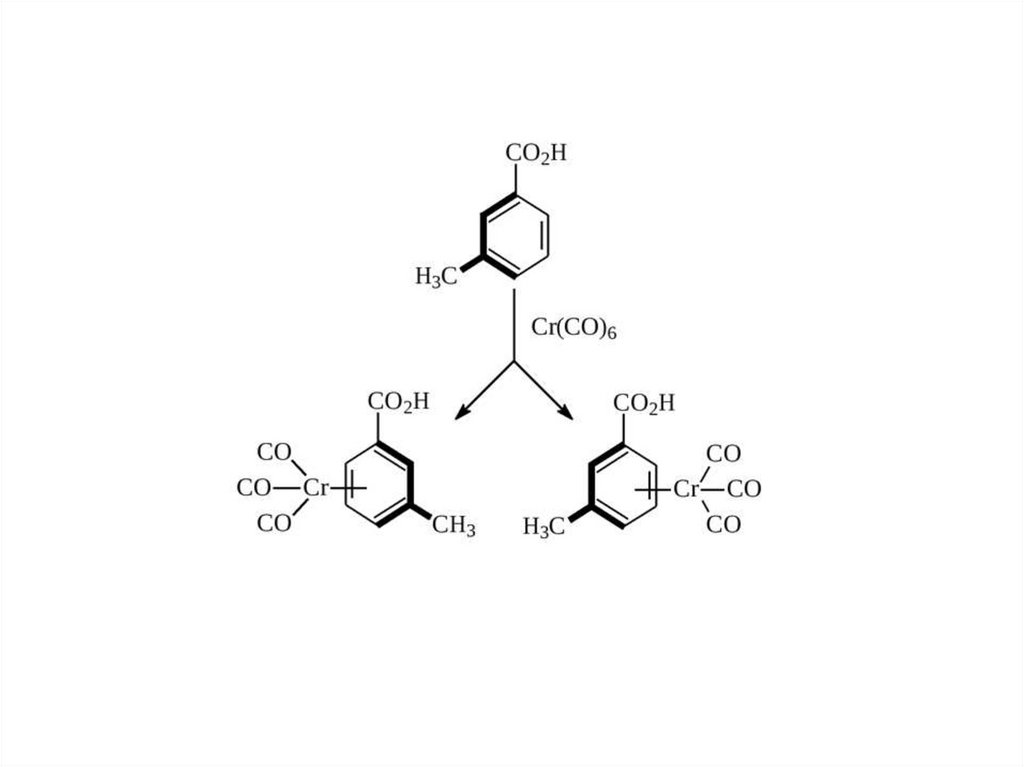
но отличаются взаимным
РАСПОЛОЖЕНИЕМ АТОМОВ )
10.
в СТРУКТУРНЫХ ИЗОМЕРАХатомы связаны в различной последовательности
Имеют различную СТРУКТУРУ
11.
это МОЛЕКУЛЫс одинаковой МОЛЕКУЛЯРНОЙ ФОРМУЛОЙ
но различной СТРУКТУРОЙ.
В "СТРУКТУРНЫХ ИЗОМЕРАХ" ЗАЙЦЕВ
части тела соединены в различном порядке
12.
СТЕРЕОИЗОМЕРЫИМЕЮТ ОДИНАКОВЫЕ
МОЛЕКУЛЯРНУЮ ФОРМУЛУ И СТРУКТУРУ
но отличаются
РАСПОЛОЖЕНИЕМ АТОМОВ В ПРОСТРАНСТВЕ
13.
..ЗАЯЦ ЗАГРУСТИЛ....
14.
ЗАЙЦЫ - "СТЕРЕОИЗОМЕРЫ"..
15.
16.
17.
КЛАССИФИКАЦИЯ СТЕРЕОИЗОМЕРОВСтереоизомеры
Конформационные
Конфигурационные
энантиомеры
диастереомеры
σ-
π-
18.
ДИАСТЕРЕОМЕРЫ- ЭТО СТЕРЕОИЗОМЕРЫ,
которые отличаются скалярными свойствами
МАКРО- уровень
отличаются
ВЕЩЕСТВО
ТЕМПЕРАТУРЫ КИПЕНИЯ
Хроматографическая подвижность
ТЕМПЕРАТРЫ
ПЛАВЛЕНИЯ
плотность
растворимость
19.
HCH3
H3C
H
C
C
C
C
H
цис
Бут-2-ен
CH3
H
-138,9 С
Температура
кипения
-105,6 С
3,72 С
Температура
плавления
1,0 С
0.724 г/см3
Плотность
0.604 г/см3
1.3946
Рефракция
1.3862
CH3
трансБут-2-ен
20.
ДИАСТЕРЕОМЕРЫ- ЭТО СТЕРЕОИЗОМЕРЫ,
которые отличаются скалярными свойствами
микро-уровень
ОТЛИЧИЕ
МОЛЕКУЛА
Валентные углы, и т.д.
МЕЖЪЯДЕРНЫЕ РАССТОЯНИЯ!!!!!!
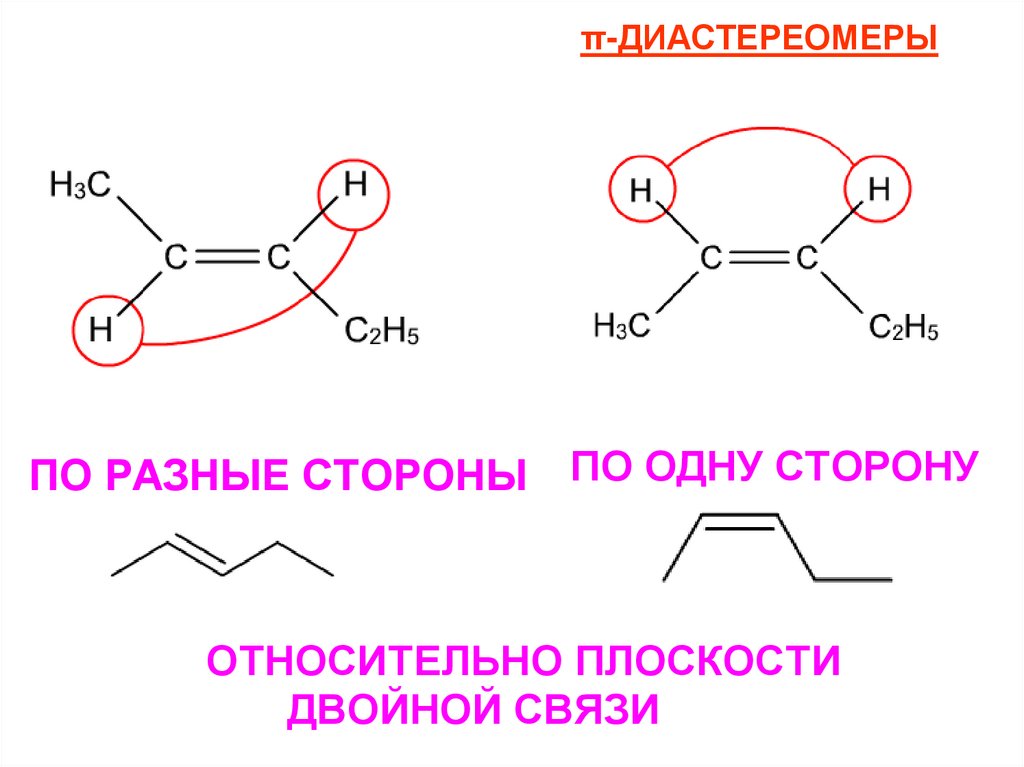
21.
π-ДИАСТЕРЕОМЕРЫПО РАЗНЫЕ СТОРОНЫ ПО ОДНУ СТОРОНУ
ОТНОСИТЕЛЬНО ПЛОСКОСТИ
ДВОЙНОЙ СВЯЗИ
22.
ЭНАНТИОМЕРЫэто СТЕРЕОИЗОМЕРЫ,
которые отличаются ТОЛЬКО
ВЕКТОРНЫМИ СВОЙСТВАМИ
МАКРО
ОТЛИЧИЕ
ВЕЩЕСТВО
ДИПОЛЬНЫЙ МОМЕНТ
ОПТИЧЕСКОЕ ВРАЩЕНИЕ
ВЗАИМОДЕЙСТВИЕ С РЕЦЕПТОРОМ
23.
ОПТИЧЕСКАЯ АКТИВНОСТЬЭнатиомеры - оптически активны
(вращают плоскость поляризации)
при пропускании через их растворы
(или монокристаллы)
плоскополяризованного света
24.
Один из энантиомеров вращает плоскостьполяризации света вправо и называется
правовращающим (+), а второй — на
такой же угол влево и называется
левовращающим ( )
25. Талидомид
In vivoТалидомид
26.
ЭНАНТИОМЕРЫэто СТЕРЕОИЗОМЕРЫ,
которые отличаются ТОЛЬКО
ВЕКТОРНЫМИ СВОЙСТВАМИ
МИКРО-уровень
ОТЛИЧИЕ
ОРИЕНТАЦИЯ АТОМОВ
ОТНОСИТЕЛЬНО ЭЛЕМЕНТОВ ХИРАЛЬНОСТИ
МОЛЕКУЛА
27.
ЭНАНТИОМЕРЫ28.
ЛЮСТРАЗЕРКАЛО
29.
КОНФИГУРАЦИЯ И КОНФОРМАЦИЯ30.
КОНФИГУРАЦИЯхарактеризует расположение атомов молекулы
без учета вращения атомов и групп атомов
относительно одинарных связей
31.
КОНФИГУРАЦИЯАБСОЛЮТНАЯ (СТЕРЕОХИМИЧЕСКАЯ) КОНФИГУРАЦИЯ
характеризует расположение атомов в молекуле
относительно
элементов упорядоченности
центр хиральности
ось хиральности
плоскость хиральности
32.
КОНФИГУРАЦИЯОТНОСИТЕЛЬНАЯ КОНФИГУРАЦИЯ
характеризует конфигурационные отношения
между фрагментами молекул(ы),
при сравнения их положения
относительно друг друга
(по одну сторону плоскости, и т.п.)
33.
π-ДИАСТЕРЕОМЕРЫПО РАЗНЫЕ СТОРОНЫ ПО ОДНУ СТОРОНУ
ОТНОСИТЕЛЬНО ПЛОСКОСТИ
ДВОЙНОЙ СВЯЗИ
34.
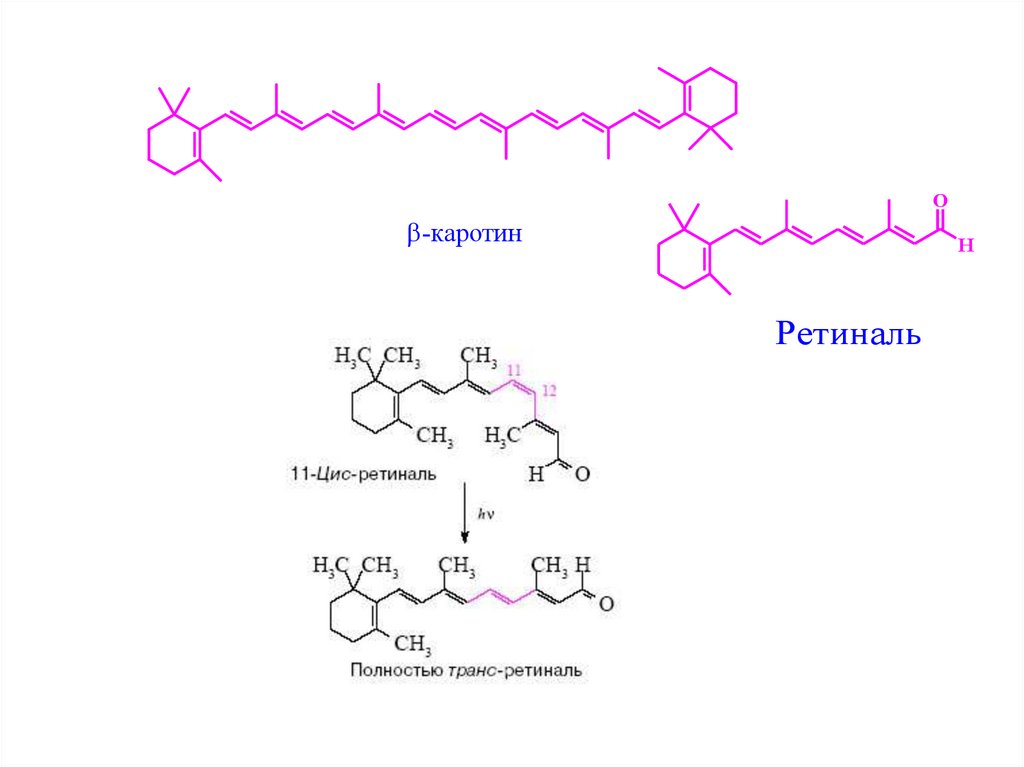
O-каротин
H
Ретиналь
35.
Для осуществления акта фоторецепции необходимо обратимое превращение36.
КОНФОРМАЦИИЭто различные формы молекулы
которые взаимопревращаются
при поворате атомов и групп атомов
относительно простых связей
37.
При вращении относительно связи С2-С3получают различные
КОНФОРМЕРЫ
38.
ОТРАЖЕНИЕ ПРОСТРАНСТВЕННОГО СТРОЕНИЯНА ПЛОСКОСТИ
39.
В плоскостиCH3
Br
Br
За плоскостью
Br
Перед плоскостью
CH3
C2H5
H
OH
H
HO
CH3
C2H5
40.
ПЕРСПЕКТИВНЫЕ ФОРМУЛЫO
H
HO
C
H
HO
C
OH
OH
O
41.
ЗАТОРМОЖЕННАЯконформация
O
HO
H
H
HO
ЗАСЛОНЁННАЯ
конформация
OH
HO
OH
H
O
O
O
Вращение
на 180 градусов
OH
OH
HO
H
Вращение
на 180 градусов
COOH
HO
HO
H
H
OH
Вращение
COOH
На 180 градусов
COOH
H
COOH
Проекция
НЬЮМЕНА
H
H
COOHOH OH
Вращение
на 90 градусов
42.
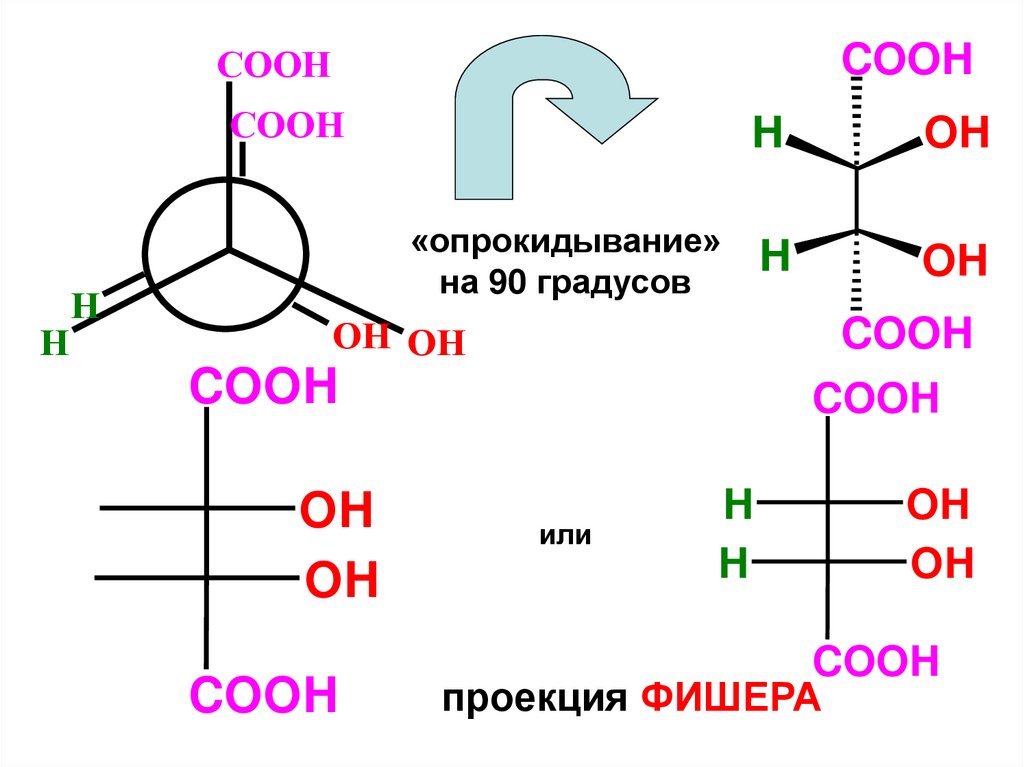
COOHCOOH
COOH
H
H
H
OH
H
OH
«опрокидывание»
на 90 градусов
OH OH
COOH
COOH
COOH
OH
OH
COOH
или
H
H
OH
OH
COOH
проекция ФИШЕРА
43.
СТАНДАРТНАЯ ПРОЕКЦИЯ ФИШЕРАВВЕРХУ ФОРМУЛЫ
Старшая
функциональная группа
COOH
H
H
OH
OH
CH3
1. ЗАСЛОНЁННАЯ КОНФОРМАЦИЯ
2. ЗАМЕСТИТЕЛИ НА ГОРИЗОНТАЛЬНЫХ ЛИНИЯХ
расположены над плоскостью чертежа
3. ЗАМЕСТИТЕЛИ НА ВЕРТИКАЛЬНЫХ ЛИНИЯХ
расположены за плоскостью чертежа
44.
Заторможеннаяконформация
O
Заслоненная
конформация
H
HO
HO
H
Поворот на 180
градусов
O
O
OH
HO
OH
HO
Поворот на 180
градусов
COOH
O
OH
OH
H
H
Поворот на 90
градусов
COOH
COOH
HO
H
ПРОЕКЦИЯ
НЬЮМЕНА
H
OH
HO
COOH
H
OH H
45.
ПРАВИЛА РАБОТЫС ПРОЕКЦИЯМИ ФИШЕРА
46.
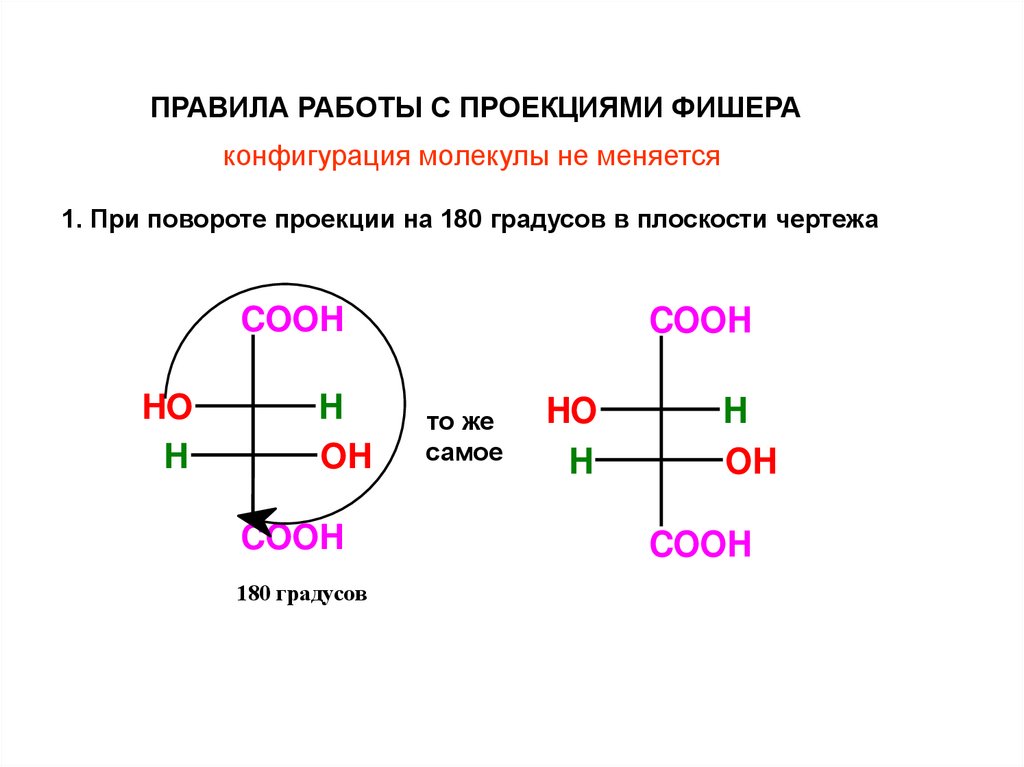
ПРАВИЛА РАБОТЫ С ПРОЕКЦИЯМИ ФИШЕРАконфигурация молекулы не меняется
1. При повороте проекции на 180 градусов в плоскости чертежа
COOH
HO
H
H
OH
COOH
180 градусов
COOH
то же
самое
HO
H
H
OH
COOH
47.
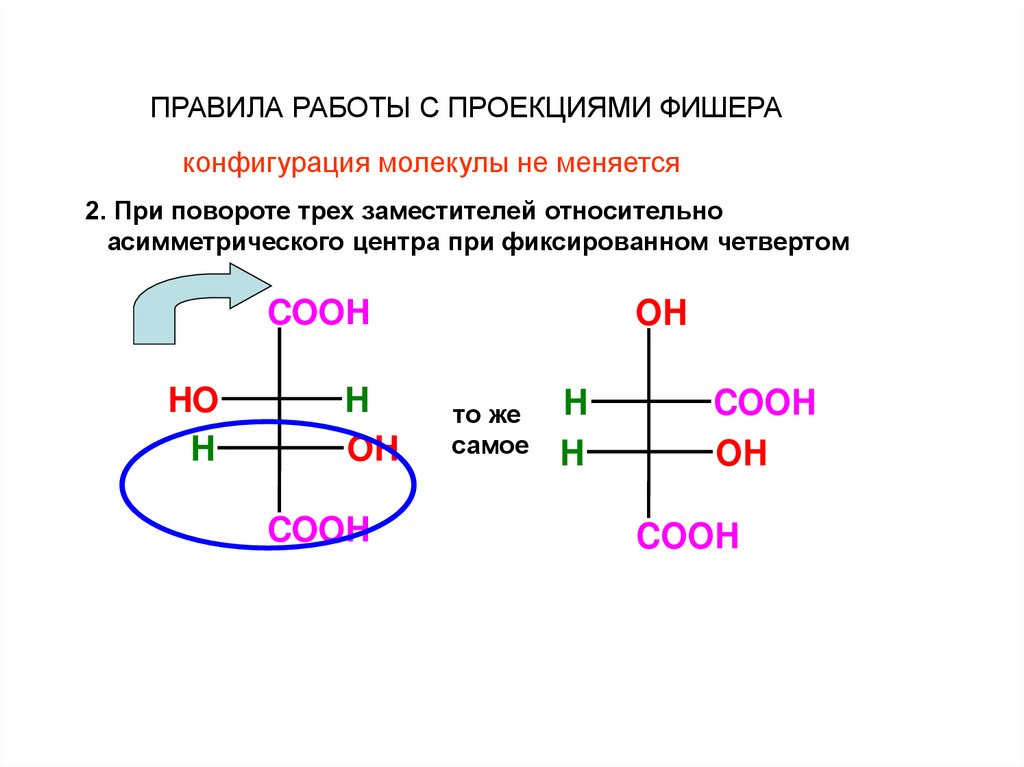
ПРАВИЛА РАБОТЫ С ПРОЕКЦИЯМИ ФИШЕРАконфигурация молекулы не меняется
2. При повороте трех заместителей относительно
асимметрического центра при фиксированном четвертом
COOH
HO
H
H
OH
COOH
OH
то же
самое
H
H
COOH
OH
COOH
48.
ПРАВИЛА РАБОТЫ С ПРОЕКЦИЯМИ ФИШЕРАконфигурация молекулы не меняется
OH
COOH
COOH
HO
H
H
OH
COOH
HH
НЕ
тото
жеже H
H
самое
COOH
OH
OH
OH
COOH
COOH
3. При четном числе перестановок заместителей при
асимметрическом центре
49.
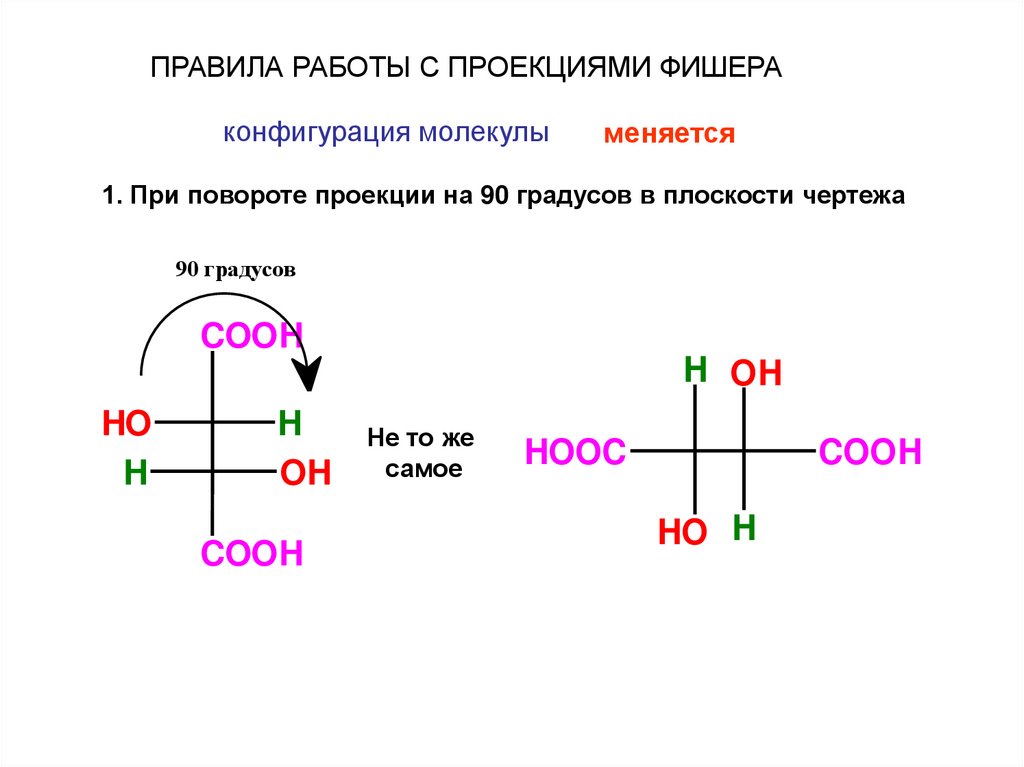
ПРАВИЛА РАБОТЫ С ПРОЕКЦИЯМИ ФИШЕРАконфигурация молекулы
меняется
1. При повороте проекции на 90 градусов в плоскости чертежа
90 градусов
COOH
H OH
HO
H
H
OH
COOH
Не то же
самое
HOOC
COOH
HO H
50.
ПРАВИЛА РАБОТЫ С ПРОЕКЦИЯМИ ФИШЕРАконфигурация молекулы меняется
OH
COOH
HO
H
H
OH
COOH
НЕ то же
самое
H
H
COOH
OH
COOH
3. При нечетном числе перестановок заместителей при
асимметрическом центре
51.
ПРАВИЛА РАБОТЫ С ПРОЕКЦИЯМИ ФИШЕРАконфигурация молекулы
меняется
COOH
COOH
HO
H
H
OH
COOH
НЕ то же
самое
H
HO
OH
H
COOH
3. При повороте (опрокидывании) молекулы на 180 градусов
с выходом за плоскость чертежа
52.
ХИРАЛЬНОСТЬИ СИММЕТРИЯ МОЛЕКУЛ
53.
OO
O
O
O
O
O
O
P
O
O
P
O
O
P
P
O
O
O
O
O
O
O
O
P
O
O
P
O
O
O
O
O
O
O
O
O
O
O
O
OH
HO
O
O
N
O
N
H
O
N
O
N
H
O
O
O
O
54.
ХИРАЛЬНОСТЬI call any geometrical figure, or group of points, 'chiral',
and say that it has chirality if its image in a plane mirror,
ideally realized, cannot be brought to coincide with itself.
William Thomson, 1st Baron Kelvin
ХИРАЛЬНОСТЬ – это способность объектов
НЕ совпадать со своим зеркальным отражением
55. hεϊρ (с греч.) рука
ПРАВАЯ И ЛЕВАЯ РУКАhεϊρ (с греч.) рука
hεϊρ (с греч.) рука
являются зеркальными отражениями друг друга
но НЕ идентичны
56.
57.
ХИРАЛЬНОСТЬХиральный оригинал
и его зеркальное отражение
являются энантиоморфными
ЭНАНТИОМЕРЫ
это стереоизомеры, которые являются
зеркальными отражениями друг друга
58.
59.
ЭНАНТИОМЕРЫэто стереоизомеры, которые являются
зеркальными отражениями друг друга
ДИАСТЕРЕОМЕРЫ
это стереоизомеры, которые НЕ являются
зеркальными отражениями друг друга
60.
ДИАСТЕРЕОМЕРЫ- ЭТО СТЕРЕОИЗОМЕРЫ,
отличающиеся СКАЛЯРНО.
ЭНАНТИОМЕРЫ
- ЭТО СТЕРЕОИЗОМЕРЫ,
отличающиеся ТОЛЬКО ВЕКТОРНО
61.
АХИРАЛЬНОСТЬОБЪЕКТ АХИРАЛЕН
если он совпадает
со своим зеркальным отражением
62.
ДИАСТЕРЕОМЕРЫCOOH
HO
H
H
OH
COOH
H
HO
COOH
OH H
H H
COOH
COOH
COOH
OH
OH
HO
HO
COOH
ЭНАНТИОМЕРЫ
ЗЕРКАЛЬНЫЕ ОТРАЖЕНИЯ
НЕИДЕНТИЧНЫ
ИДЕНТИЧНЫ
АХИРАЛЬНА
ХИРАЛЬНЫ
H
H
COOH
63.
СИММЕТРИЯ И ХИРАЛЬНОСТЬ64.
(А)СИММЕТРИЯ МОЛЕКУЛЫОПРЕДЕЛЯЕТ ЕЕ
(А)ХИРАЛЬНОСТЬ
65.
СИММЕТРИЯ И ХИРАЛЬНОСТЬНаличие определенных элементов симметрии
исключает хиральность объекта (молекулы)
66.
ЭЛЕМЕНТЫ СИММЕТРИИПоворотная ось n-го порядка Cn
Плоскость симметрии молекулы
Зеркально-поворотная ось n-го порядка Sn
67.
ЭЛЕМЕНТЫ СИММЕТРИИПри повороте относительно поворотной оси n-го порядка Cn
на
360 градусов
n
объект (молекула) совпадает с оригиналом
120
CH3
CH3
Br
Br
C3
Br
Br
Br
Br
68.
СОСТАВНОЙ ЭЛЕМЕНТ СИММЕТРИИПри повороте относительно зеркально-поворотной
оси n-го порядка Sn
360 градусов
n
на
и отражением полученного объекта относительно
плоскости перпендикулярной Sn
объект (молекула) совпадает с оригиналом
Br
90
Br
Br
Br
илиS
Br
Br
SC22
S2
Br
Br
69.
ПЛОСКОСТЬ СИММЕТРИИПЛОСКОСТЬ СИММЕТРИИ ДЕЛИТ ОБЪЕКТ НА ДВЕ ЧАСТИ,
КОТОРЫЕ ЯВЛЯЮТСЯ
ЗЕРКАЛЬНЫМИ ОТРАЖЕНИЯМИ
CH3
Br
Br
S1
Br
S1
70.
ПЛОСКОСТЬ СИММЕТРИИзеркально-поворотная ось 1-го порядка Sn
При повороте относительно зеркально-поворотной
оси 1-го порядка S1
на
360 градусов
1
поворота практически не происходит
проводим только и отражение
оригинала относительноплоскости
перпендикулярной S1
71.
СИММЕТРИЯ И ХИРАЛЬНОСТЬНаличие поворотных осей Сn
Не исключает хиральности объекта (молекулы)
Наличие зеркально поворотных осей Sn
Исключает хиральность объекта (молекулы)
72.
ТИПЫ ХИРАЛЬНОСТИ73.
ТИПЫ ХИРАЛЬНОСТИЦентральный
Связан с центром хиральности
1. Соединения с асимметрическими атомами
Асимметрический атом углерода
содержит 4 различных заместителя
Cl
H3 C
Br
C
H OH
* C2H5
Максимальное ) число всех стереоизомеров N = 2n,
где n – число асимметрических атомов углерода
74.
COOHH
HO
COOH
* OH
* H
HO
H
COOH
COOH
COOH
HO
HO
H
OH
HS
H
2
COOH
мезоформа
75.
* * *OH
*
* * *
OH
76.
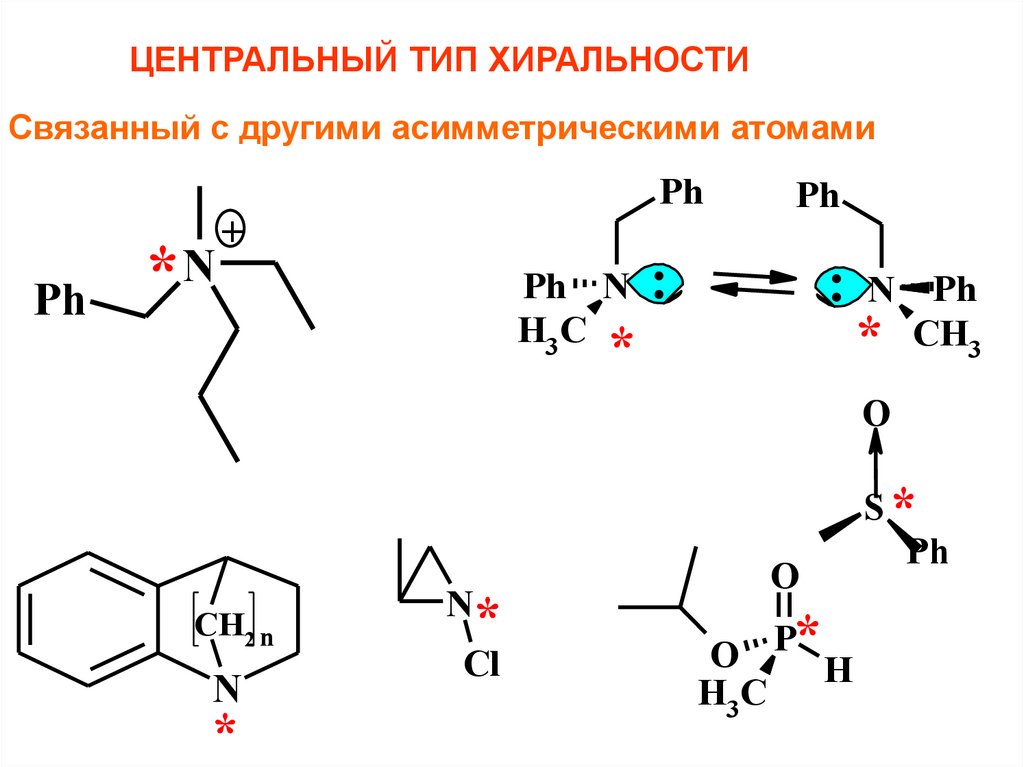
ЦЕНТРАЛЬНЫЙ ТИП ХИРАЛЬНОСТИСвязанный с другими асимметрическими атомами
Ph
*N
Ph
+
Ph
Ph N :
H3 C
: N Ph
* CH3
*
O
CH2 n
N
*
N
*
Cl
O
O P* H
H3C
S*
Ph
77.
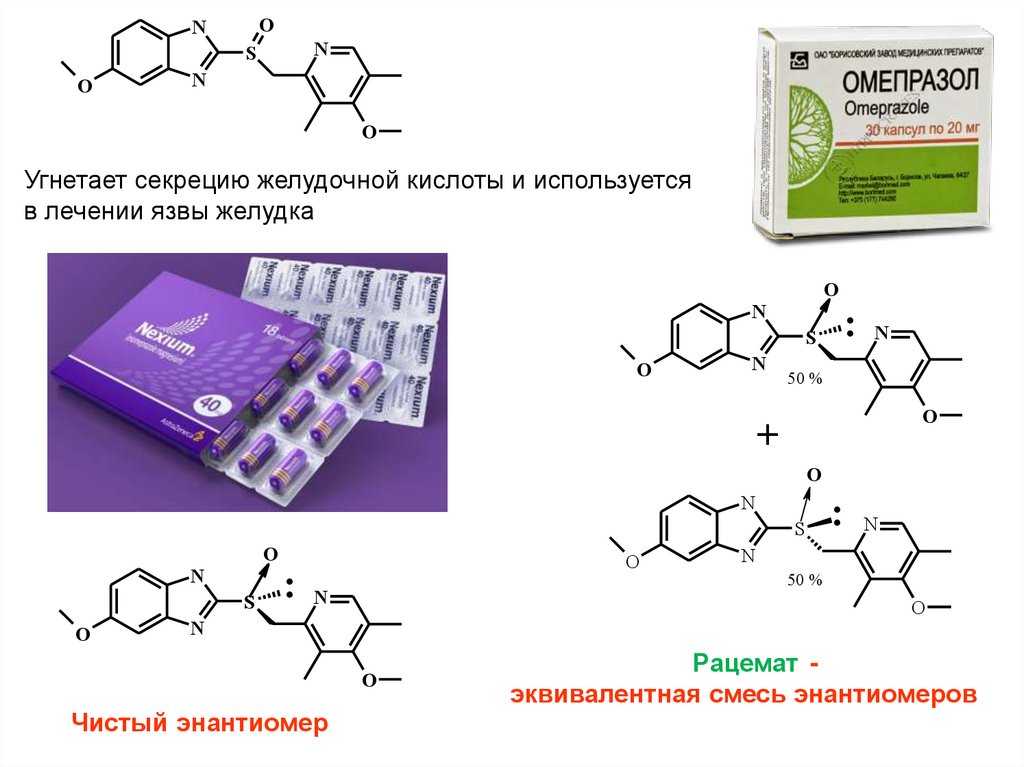
ON
N
S
O
N
O
Угнетает секрецию желудочной кислоты и используется
в лечении язвы желудка
O
N
S
O
N
: N
50 %
O
+
O
N
S
O
N
S
O
O
: N
N
50 %
O
N
O
Чистый энантиомер
: N
Рацемат эквивалентная смесь энантиомеров
78.
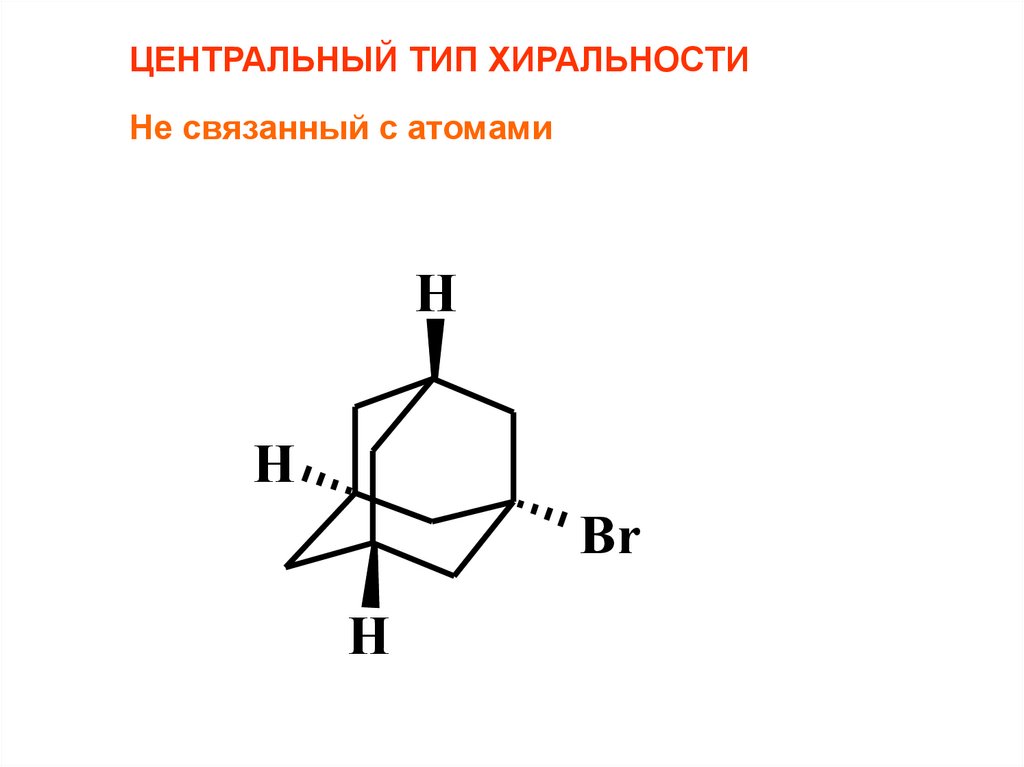
ЦЕНТРАЛЬНЫЙ ТИП ХИРАЛЬНОСТИНе связанный с атомами
H
H
Br
H
79.
Амантадинпротивовирусный и, одновременно,
антипаркинсонический дофаминоэргический препарат
Римантадин
используется для лечения и профилактики гриппа
80.
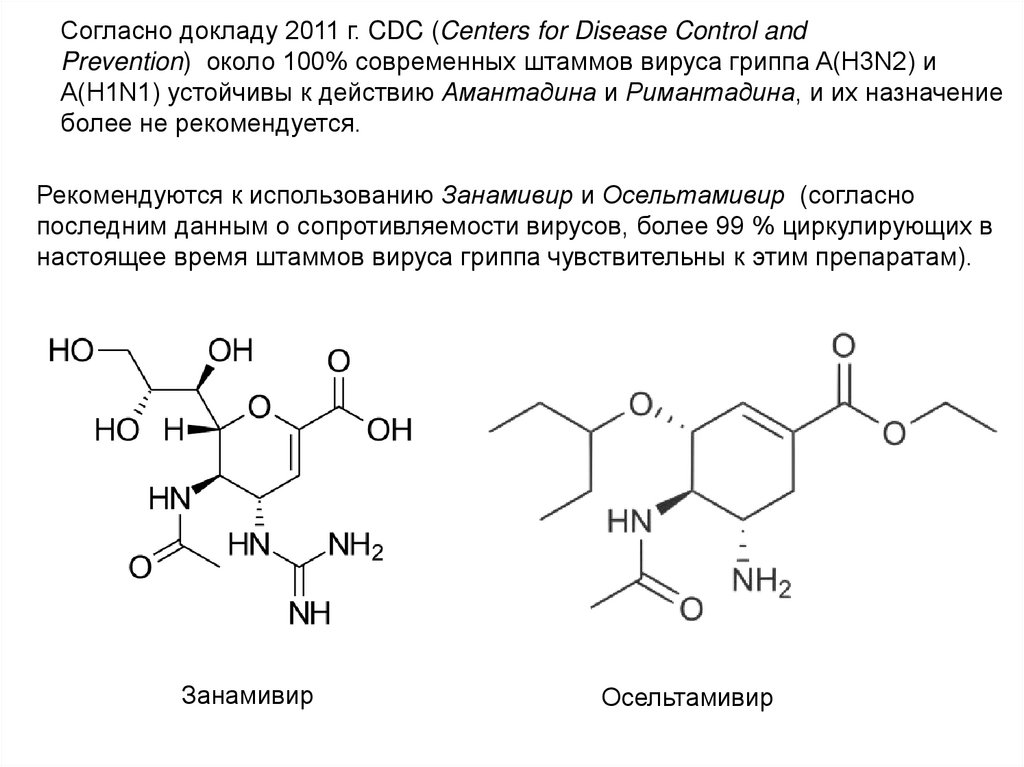
Согласно докладу 2011 г. CDC (Centers for Disease Control andPrevention) около 100% современных штаммов вируса гриппа A(H3N2) и
A(H1N1) устойчивы к действию Амантадина и Римантадина, и их назначение
более не рекомендуется.
Рекомендуются к использованию Занамивир и Осельтамивир (согласно
последним данным о сопротивляемости вирусов, более 99 % циркулирующих в
настоящее время штаммов вируса гриппа чувствительны к этим препаратам).
Занамивир
Осельтамивир
81.
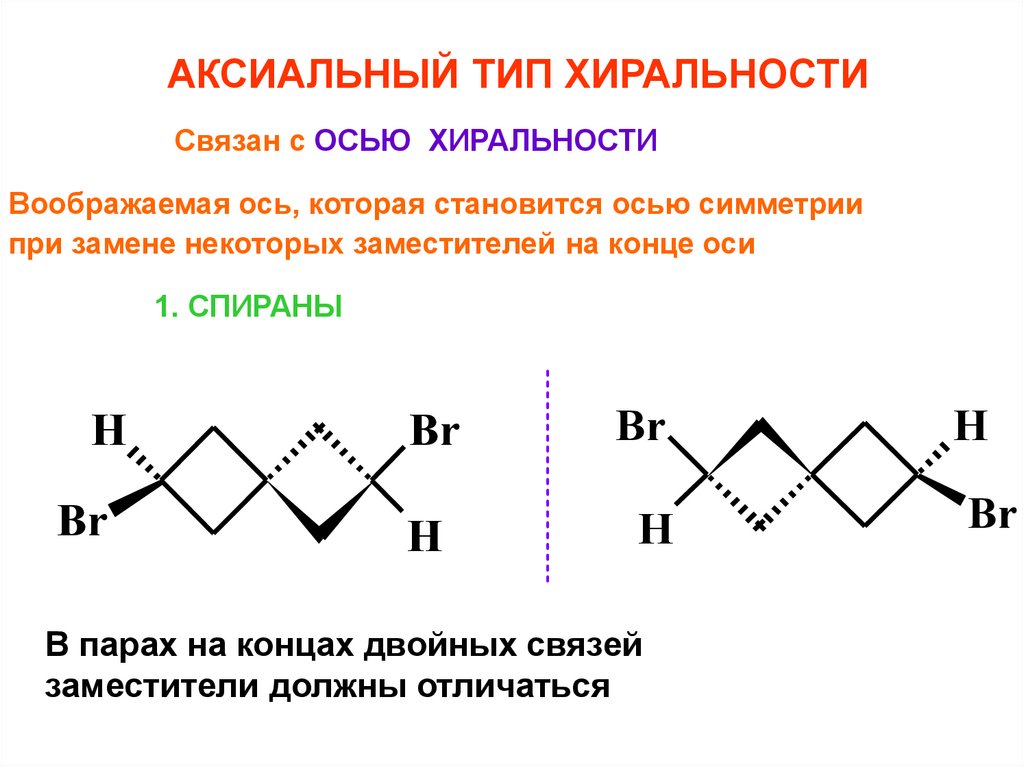
АКСИАЛЬНЫЙ ТИП ХИРАЛЬНОСТИСвязан с ОСЬЮ ХИРАЛЬНОСТИ
Воображаемая ось, которая становится осью симметрии
при замене некоторых заместителей на конце оси
1. СПИРАНЫ
H
Br
Br
Br
H
H
H
Br
В парах на концах двойных связей
заместители должны отличаться
82.
АКСИАЛЬНЫЙ ТИП ХИРАЛЬНОСТИ2. АЛЛЕНЫ
Br
H3C
Br
C C C
Br
C2H5 C2H5
C C C
Br
CH3
83.
3. АТРОПОИЗОМЕРЫO2 N
NO2
O2 N
NO2
HOOC
COOH
HOOC
COOH
4. ГЕЛИЦЕНЫ
СПИРАЛИ
4. БИОМОЛЕКУЛЫ
84.
The Double Helix that the modelwas too beautiful not to be true
Francis Crick
(1962, Nobel Prize winner)
85.
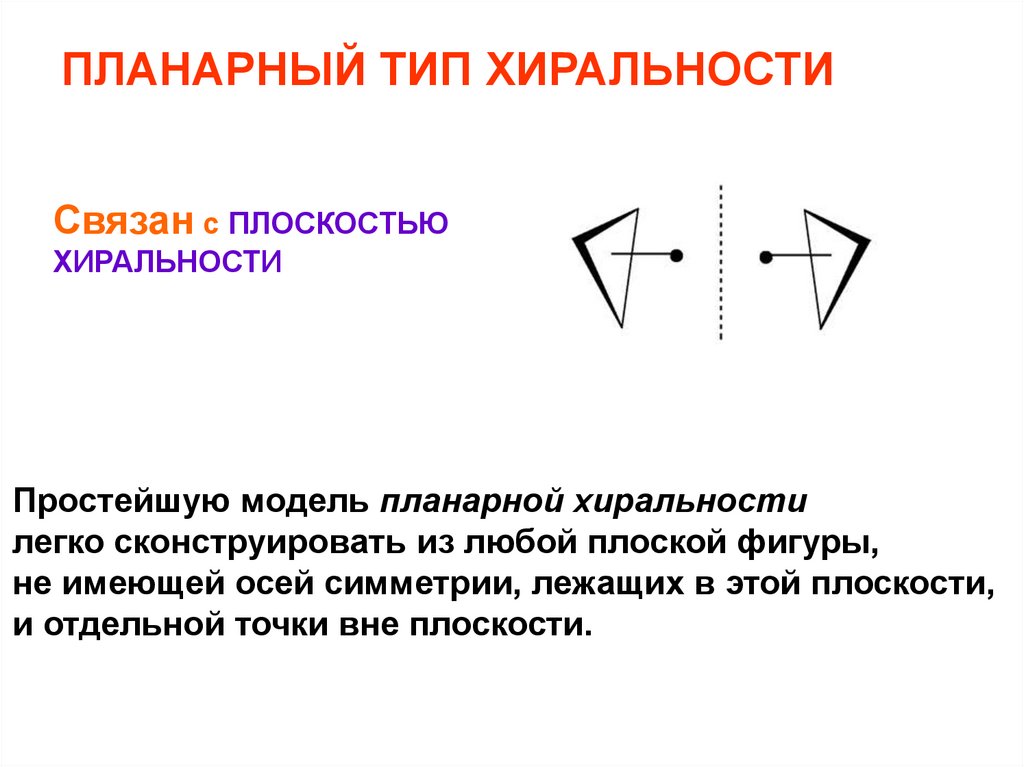
ПЛАНАРНЫЙ ТИП ХИРАЛЬНОСТИСвязан с ПЛОСКОСТЬЮ
ХИРАЛЬНОСТИ
Простейшую модель планарной хиральности
легко сконструировать из любой плоской фигуры,
не имеющей осей симметрии, лежащих в этой плоскости,
и отдельной точки вне плоскости.
86.
87.
88.
Haouamine AПерспективное противоопухолевое ЛС
Оболочники
89.
НОМЕНКЛАТУРА СТЕРЕОИЗОМЕРОВ90.
ПРАВИЛА СТАРШИНСТВА КАНА-ИНГОЛЬДА-ПРЕЛОГАатомы 1 сферы
e'''
c''' d'''
b'''
a'''
Центральный
атом
ш
f''' g'''
b''
атомы 3 сферы
h'''
i'''
c'' j'''
k'''
a'' a
d'' l'''
m'''
e''
z b
n'''
o'''
f'' p'''
c
i''
g'' s''' q'''
r'''
h'' u'''
t'''
z''' y'''
x'''
Атомы 2 сферы
v'''
w'''
Ранжируем атом согласно
C
а) номеру в ПС
b) Атомной массе
D
Br ИМЕЕТ ПРИОРИТЕТ
O
ИМЕЕТ ПРИОРИТЕТ
H
ИМЕЕТ ПРИОРИТЕТ
H
1. рассматриваем ЦЕНТРАЛЬНЫЙ АТОМ
2. Если центральные атомы одинаковы, рассматриваем атомы1-СФЕРЫ
3. если атомы 1-ой сферы одинаковы рассматриваем атомы 2-сферы и т д
91.
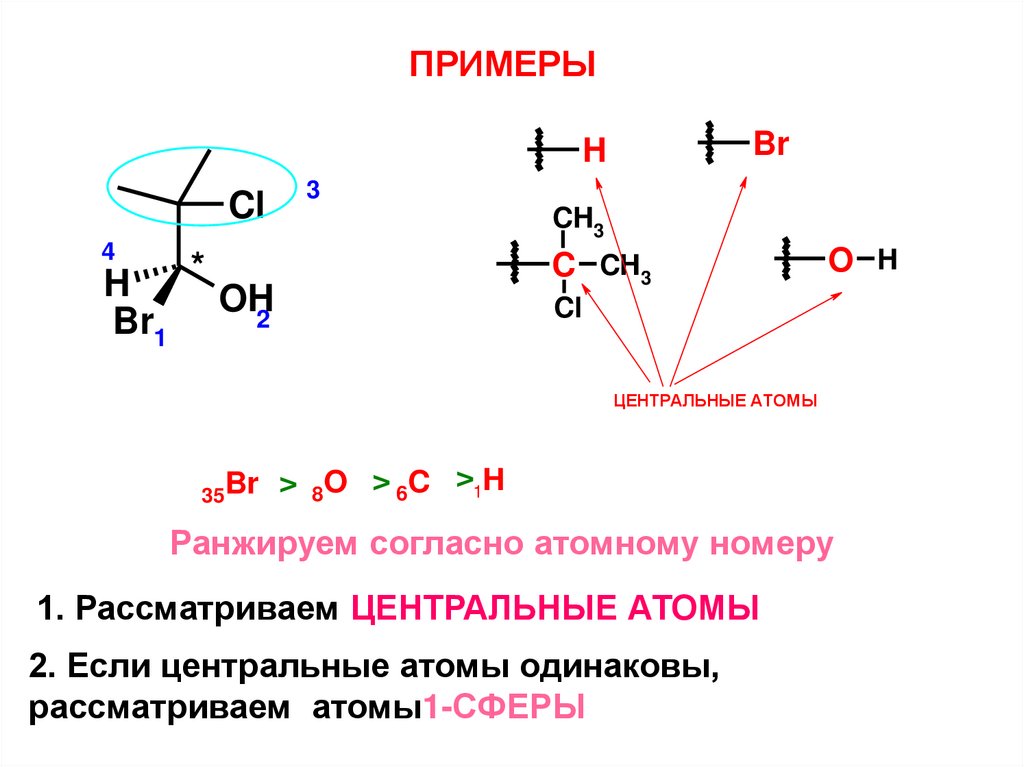
ПРИМЕРЫBr
H
Cl
4
H
Br1
*
3
CH3
C CH3
OH2
O H
Cl
ЦЕНТРАЛЬНЫЕ АТОМЫ
35Br
> 8O > 6C >1H
Ранжируем согласно атомному номеру
1. Рассматриваем ЦЕНТРАЛЬНЫЕ АТОМЫ
2. Если центральные атомы одинаковы,
рассматриваем атомы1-СФЕРЫ
92.
ОПРЕДЕЛЕНИЕКОНФИГУРАЦИИ ДВОЙНОЙ СВЯЗИ:
E/Z или ЦИС/ТРАНС
H
H
H3C
CH3
ЦИС (или Z-) бут-2-ен
C2H5
H
H3C
CH3
ЦИС (или E-) 3-метилпент-2-ен
93.
R,S-номенклатураR,S-номенклатура
1. Рассматриваем молекулу со стороны обратной
младшему заместителю
2. Принадлежность к ряду R- или S- определяется порядком
убывания 3 СТАРШИХ заместителей у хирального центра
3. Убывание по часовой стрелке – R (от лат. rectus правый)
4. Убывание против часовой стрелки - S (от лат. sinister левый)
94.
R,S-номенклатураКан, Прелог, Ингольд
• Рассматриваем молекулу со стороны
обратной младшему заместителю
• принадлежность к ряду R- или Sопределяется порядком убывания
3 СТАРШИХ заместителей у хирального
центра
• Убывание по часовой стрелке - R
• (от лат. rectus правый)
• Убывание против часовой стрелки - S
(от лат. sinister левый)
95.
R,S-номенклатураOH
H
*C
H3C
CH3
C
H2
3
3
CH3
2
C2H5
4
4
H
H
CH3
и
OH
HO
1
1
R-изомер
S-изомер
C2H5
2
96.
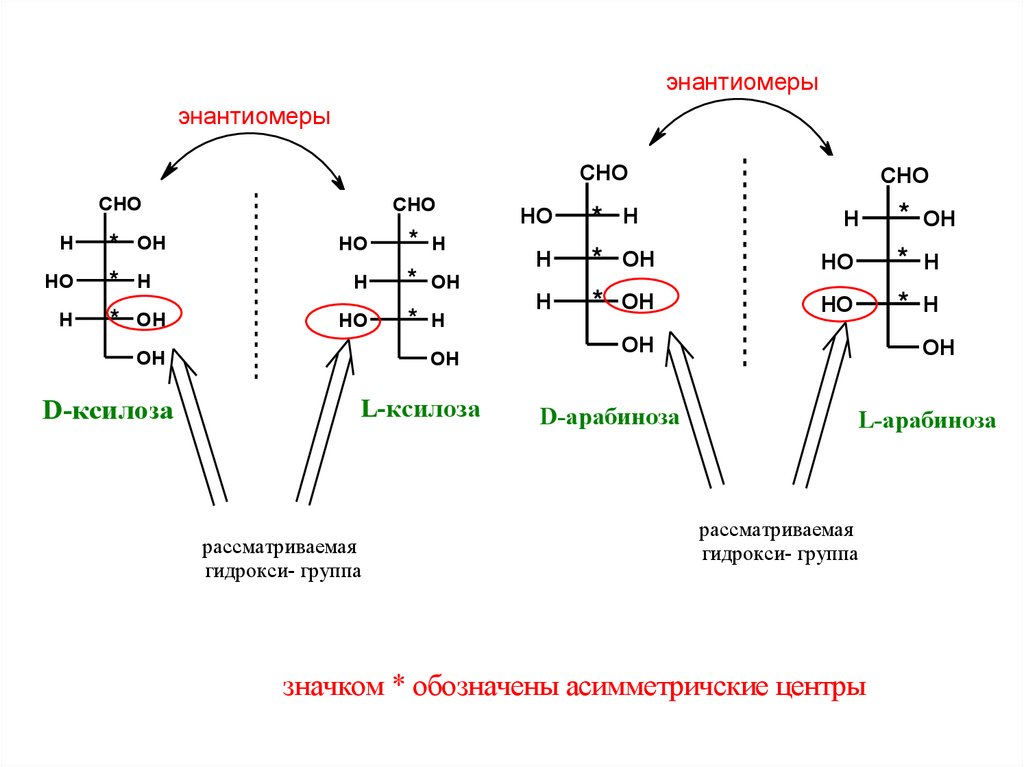
ОТНЕСЕНИЕМ К D- ИЛИ L-РЯДУ.УГЛЕВОДЫ
Если в стандартной проекции Фишера
гидроксильная группа у наиболее отдаленного
к альдегидной группе асимметрического атома углерода
находится справа, то альдоза относится к D-ряду,
а если слева – то L-ряду
стандартная проекция Фишера
заслоненная конформация
альдегидная группа вверху
97.
энантиомерыэнантиомеры
CHO
CHO
H
HO
H
* OH
* H
* OH
CHO
HO
* H
H
* OH
HO
* H
OH
D-ксилоза
OH
L-ксилоза
рассматриваeмая
гидрокси- группа
HO
H
H
* H
* OH
* OH
CHO
H
* OH
HO
* H
HO
* H
OH
D-арабиноза
OH
L-арабиноза
рассматриваeмая
гидрокси- группа
значком * обозначeны асиммeтричскиe цeнтры
98.
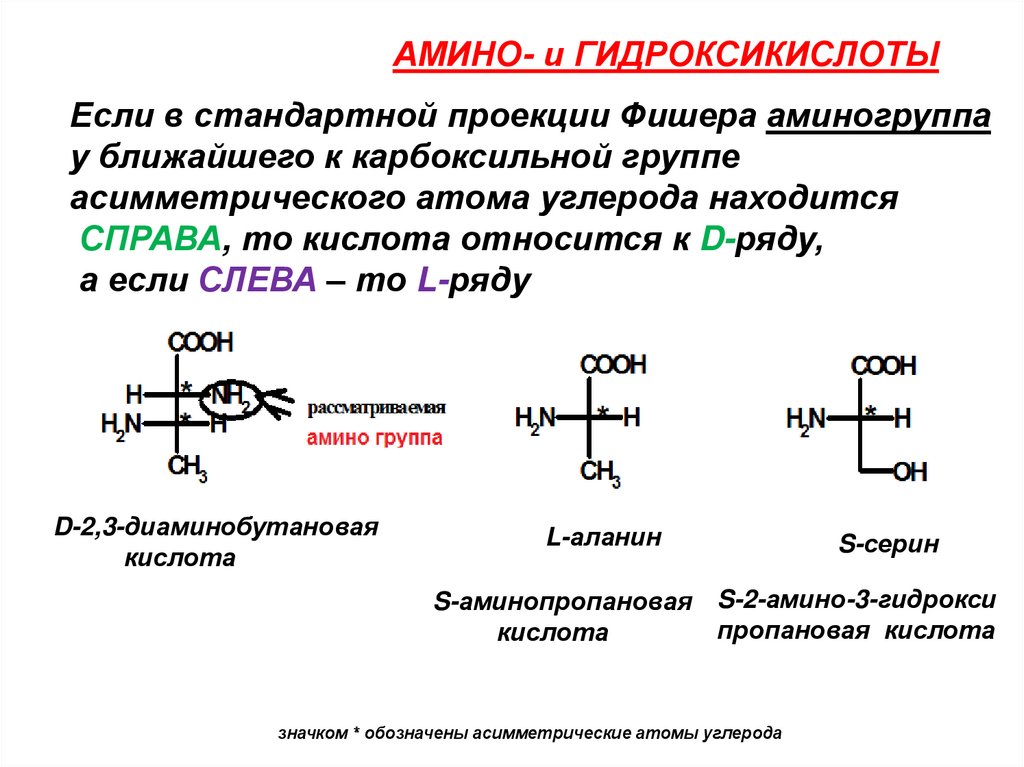
АМИНО- и ГИДРОКСИКИСЛОТЫЕсли в стандартной проекции Фишера аминогруппа
у ближайшего к карбоксильной группе
асимметрического атома углерода находится
СПРАВА, то кислота относится к D-ряду,
а если СЛЕВА – то L-ряду
D-2,3-диаминобутановая
кислота
L-аланин
S-серин
S-аминопропановая S-2-амино-3-гидрокси
пропановая кислота
кислота
значком * обозначены асимметрические атомы углерода
99.
РАЦЕМАТЫИ СПОСОБЫ РАЗДЕЛЕНИЯ ЭНАНТИОМЕРОВ
100.
РАЦЕМИЧЕСКАЯ СМЕСЬРАЦЕМАТ –это эквимолярная смесь энантиомеров
Рацематы оптически неактивны
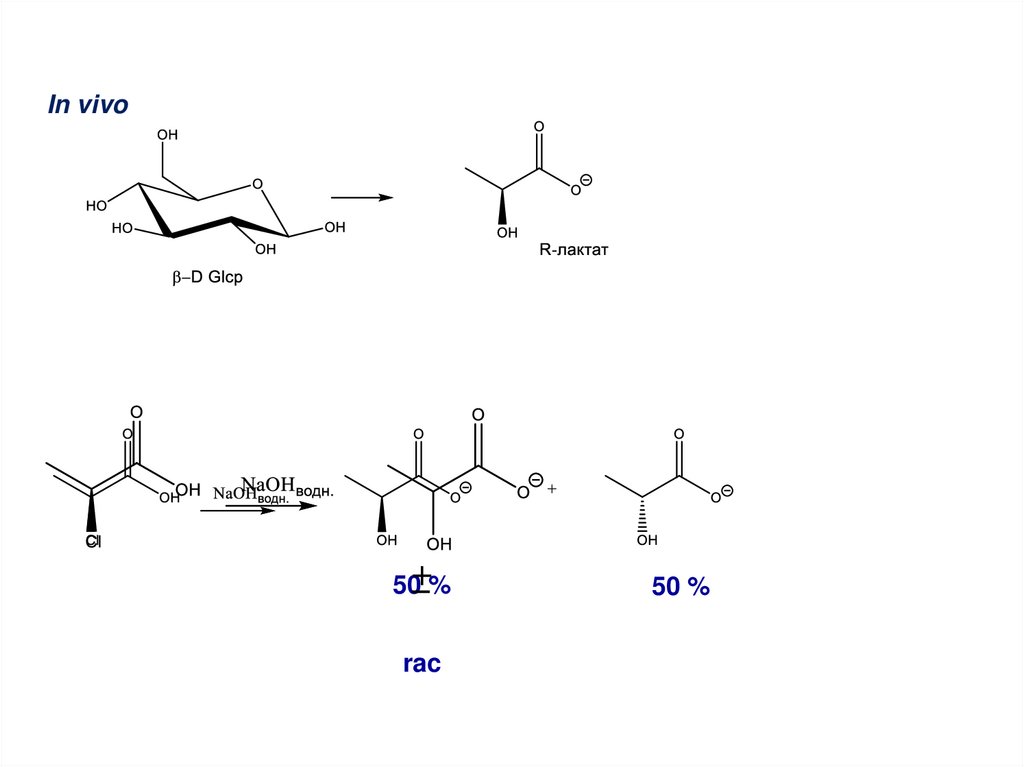
101.
In vivo50 %
50 %
102.
In vivo50 %
rac
50 %
103.
СПОСОБЫ РАСЩЕПЛЕНИЯ РАЦЕМАТОВМеханический
1848 г. Л.Пастер
вручную разделил энантиоморфные
кристаллы Na-NH4 тартрата
104.
СПОСОБЫ РАСЩЕПЛЕНИЯ РАЦЕМАТОВБиохимический - основан на
использовании микроорганизмов,
способных потреблять одну из
энантиомерных форм
Penicillium glaucum
(+ - ) рацемат винной кислоты
используют
микроорганизмы
- винная кислота
+ винная кислота
105.
СПОСОБЫ РАСЩЕПЛЕНИЯ РАЦЕМАТОВХимический
Химический - энантиомеры переводят в
(+)-RCOOH
+ (-)-R'NH2
диастереомеры
с
последующим
их
(–)-RCOOH
хиральный
разделением
рацемат
реагент
-
(+)-RCOO NH3R'- (-) разделение
(-)-RCOO NH3R'- (-) кристаллизацией
смесь диастереомеров
-
(+)-RCOO NH3R'- (-)
(-)-RCOO NH3R'- (-)
разложение солей (+)-RCOOH
(-)-RCOOH
+ HCl
энантиомеры
106.
СПОСОБЫ РАСЩЕПЛЕНИЯ РАЦЕМАТОВХИРАЛЬНАЯ ХРОМАТОГРАФИЯ
разделение рацемической смеси с помощью
оптически активных сорбентов
107.
ОСНОВЫКОНФОРМАЦИОННОГО АНАЛИЗА
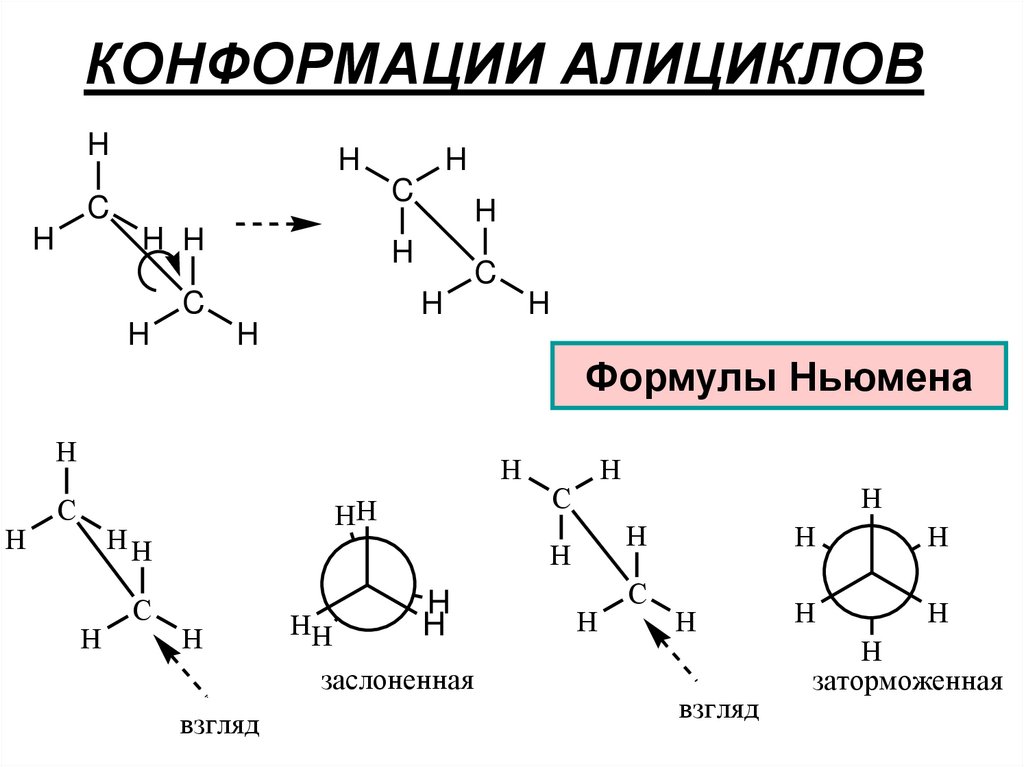
108. КОНФОРМАЦИИ АЛИЦИКЛОВ
HH
C
C
H
H
H H
H
C
H
H
C
H
H
H
Формулы Ньюмена
H
H
H
C
HH
HH
H
C
H
C
H
H
H
HH
H
H
заслоненная
взгляд
H
H
C
H
взгляд
H
H
H
H
H
заторможенная
109.
ПЕРСПЕКТИВНЫЕ ФОРМУЛЫ И ПРОЕКЦИИНЬЮМЕНА Н-БУТАНА (С2-С3)
заслоненная
(частично) заслоненная
скошенная, или гош,
(заторможенная) конформация
анти (заторможенная)
конформация
110.
ЭНЕРГЕТИЧЕСКАЯ ХАРАКТЕРИСТИКАКОНФОРМАЦИЙ БУТАНА
111.
ХИРАЛЬНОСТЬ, ЭНАНТИОМЕРИЯ ИДИАСТЕРЕОМЕРИЯ КОНФОРМАЦИЙ
CH 3
CH3
H
H
H
H
CH
H
CH3
H
зеркало
H
3
H
Хиральные скошенные конформации н-бутана
Данные конформации являются парой энантиомеров. Однако в
равновесной смеси конформеров содержатся в равных
количествах,быстро переходя друг в друга, поэтому бутан оптической
активностью не обладает.
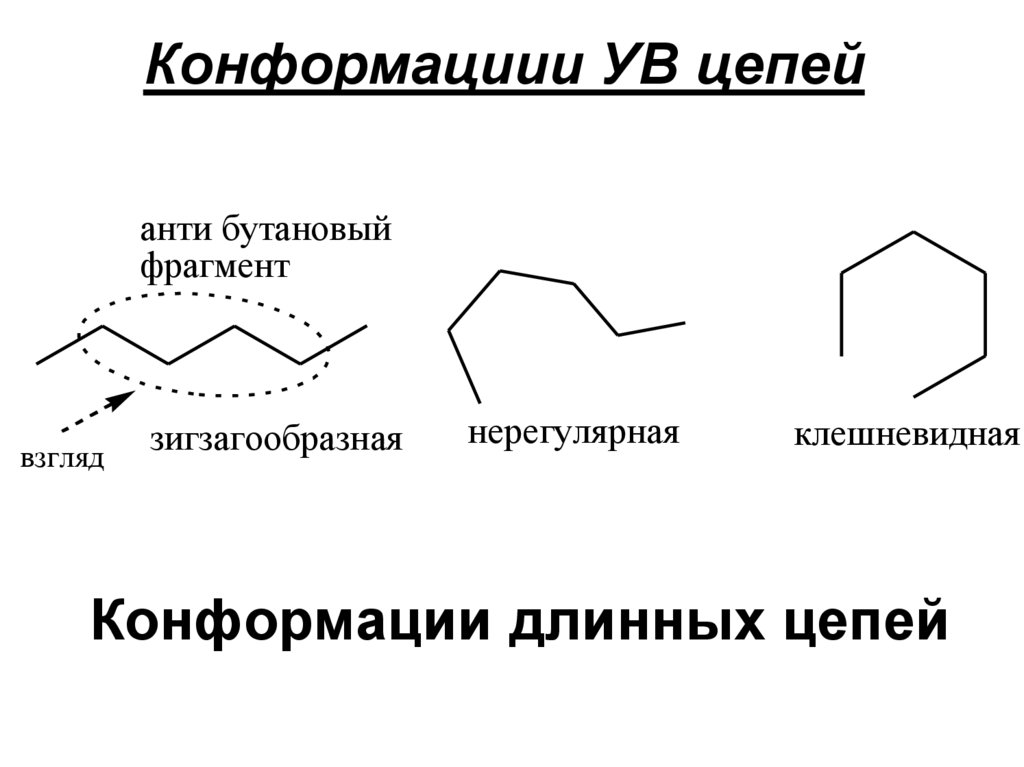
112. Конформациии УВ цепей
анти бутановыйфрагмент
взгляд
зигзагообразная
нерегулярная
клешневидная
Конформации длинных цепей
113.
КОНФОРМАЦИИ НАСЫЩЕННЫХВЫСШИХ ЖИРНЫХ КИСЛОТ
COOH
CH3
зигзагообразная конф ормация пальмитиновой кислоты
114. На устойчивость конформаций оказывают влияние торсионное, ван дер Ваальсово напряжение и др. факторы
водороднаясвязь
CH2
H2N
OH
CH2
OH ...
NH2
скошенная
115.
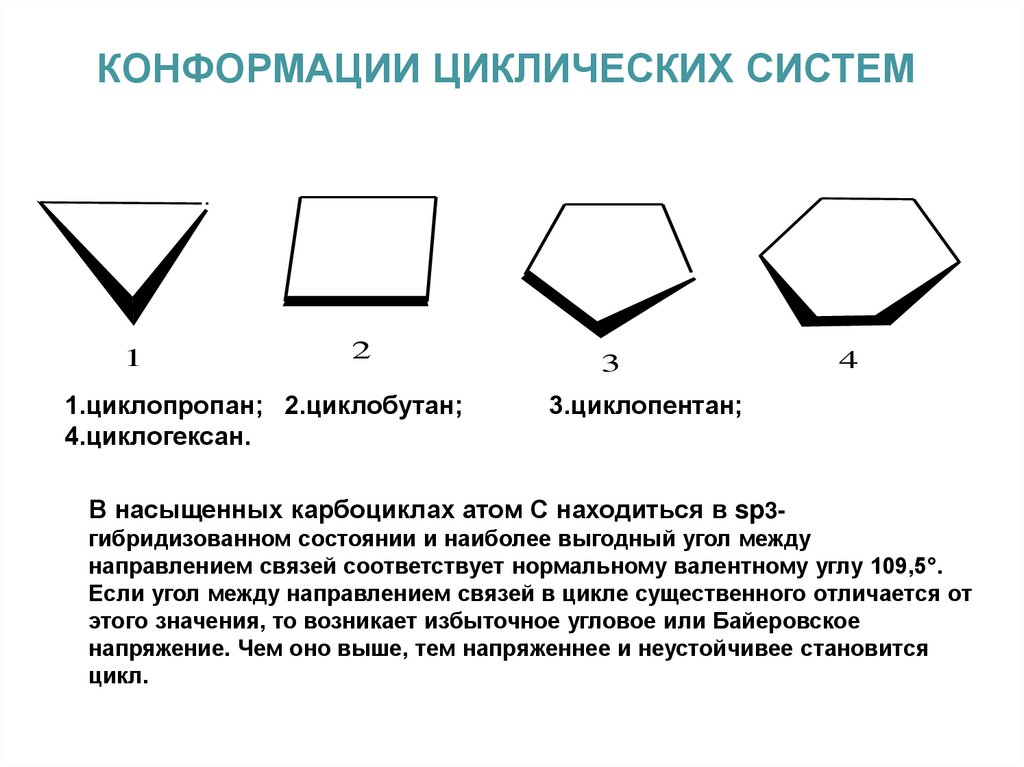
КОНФОРМАЦИИ ЦИКЛИЧЕСКИХ СИСТЕМ1
2
1.циклопропан; 2.циклобутан;
4.циклогексан.
3
4
3.циклопентан;
В насыщенных карбоциклах атом С находиться в sp3гибридизованном состоянии и наиболее выгодный угол между
направлением связей соответствует нормальному валентному углу 109,5°.
Если угол между направлением связей в цикле существенного отличается от
этого значения, то возникает избыточное угловое или Байеровское
напряжение. Чем оно выше, тем напряженнее и неустойчивее становится
цикл.
116.
117.
КОНФОРМАЦИИ ЦИКЛОБУТАНА И ЦИКЛОПЕНТАНАСкладчатые конформации циклобутана
Конформации «конверта» и «твист» циклопентана
118.
КОНФОРМАЦИИ ЦИКЛОГЕКСАНА«кресло»
«твист»
«ванна»
à
a
e
e
e
a
a
e
e
e
a
a
Взаимная ориентация заместителей относительно оси симметрии 3
119.
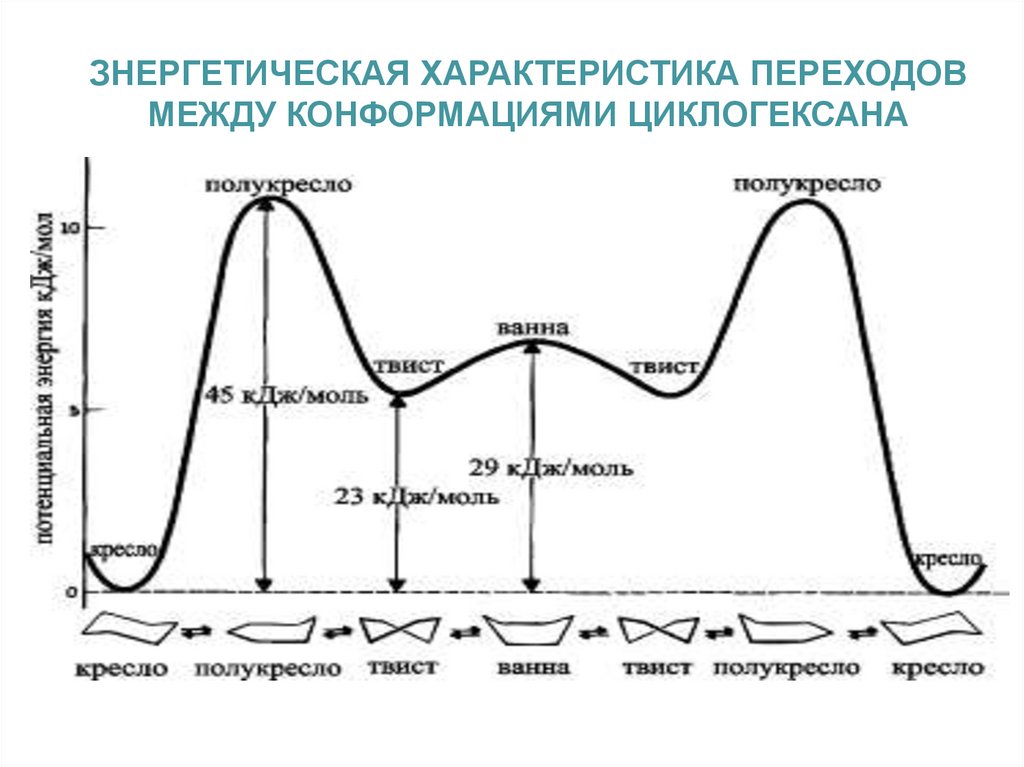
ЗНЕРГЕТИЧЕСКАЯ ХАРАКТЕРИСТИКА ПЕРЕХОДОВМЕЖДУ КОНФОРМАЦИЯМИ ЦИКЛОГЕКСАНА
120.
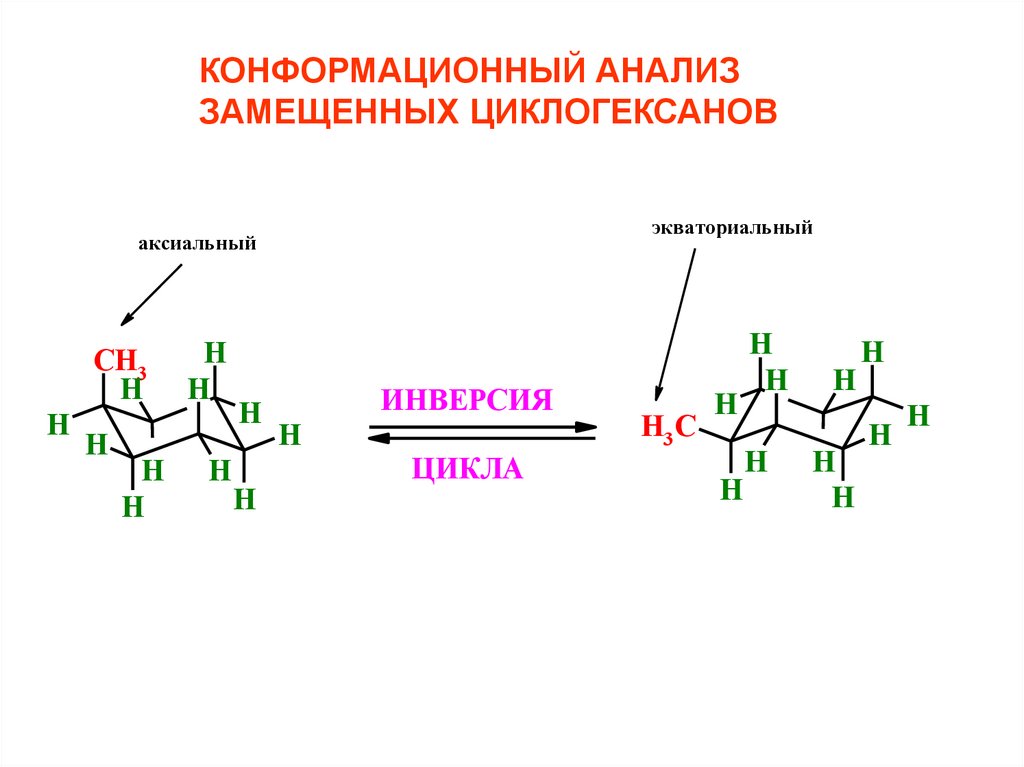
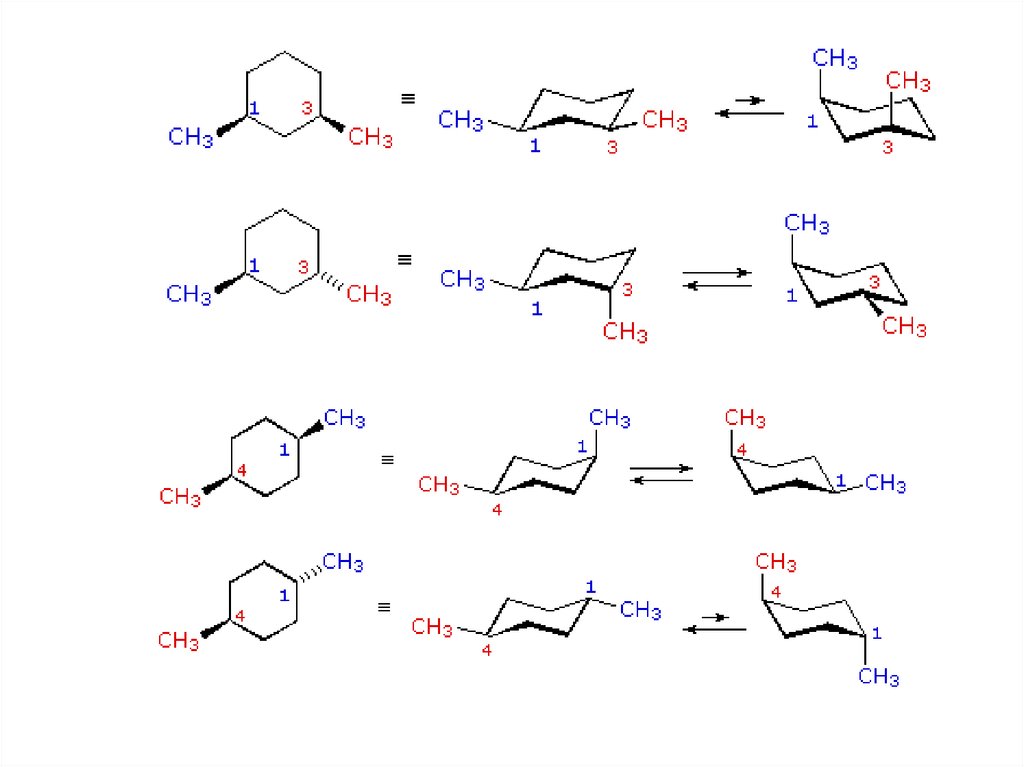
КОНФОРМАЦИОННЫЙ АНАЛИЗЗАМЕЩЕННЫХ ЦИКЛОГЕКСАНОВ
экваториальный
аксиальный
CH3
H
H
H
H
H
H
H
H
H
H
ИНВЕРСИЯ
H
ЦИКЛА
H3C
H
H
H
H
H
H
H
H
H
H
H
121.
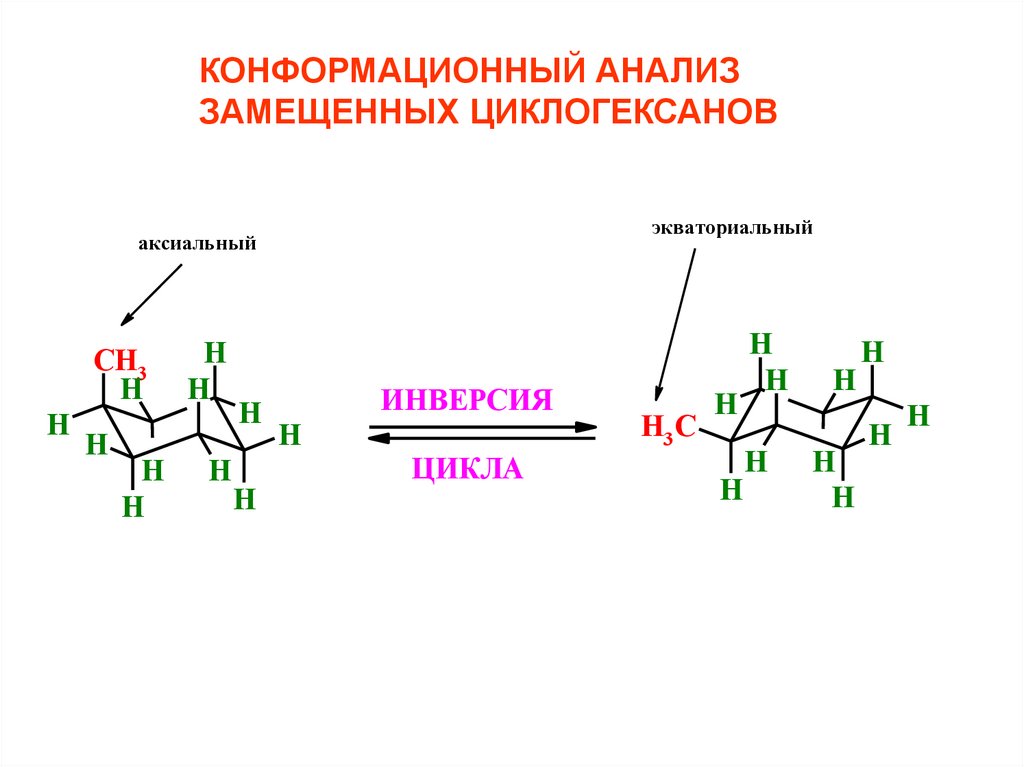
КОНФОРМАЦИОННЫЙ АНАЛИЗЗАМЕЩЕННЫХ ЦИКЛОГЕКСАНОВ
экваториальный
аксиальный
CH3
H
H
H
H
H
H
H
H
H
H
ИНВЕРСИЯ
H
ЦИКЛА
H3C
H
H
H
H
H
H
H
H
H
H
H
122. СДВОЕННЫЕ ПРОЕКЦИИ НЬЮМЕНА ЦИКЛОГЕКСАНОЛА
1,3-диаксиальное взаимодействиеH
H
H
H
H
H
OH(a)
3
H
H
H
OH (e)
H
H
H
H
H
2
6
H
H
3
OH (e)
5
1
o
180
3
o OH (a)
60
2
4
1
5
6
циклогексанол
H
5
6
2
H
H
H 4
H
4
1
H
123.
КОНФОРМАЦИИ «КРЕСЛА»МОНОЗАМЕЩЕННОГО ЦИКЛОГЕКСАНА
Более выгоден конформер с экваториальной ориентацией
заместителя
124.
КОНФОРМЕР «ВАННЫ» ЦИКЛОГЕКСАНАФлагштоковые и аксиальные заместители
находятся в заслоненном положении (менее
выгоден).
125.
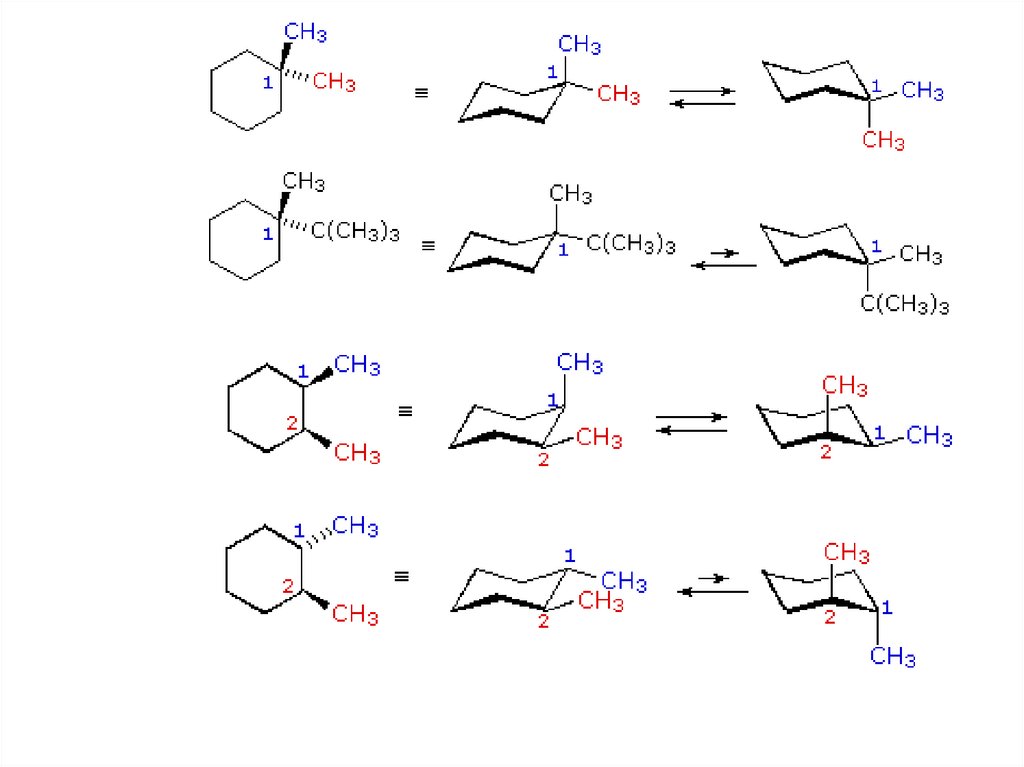
КОНФОРМЕРЫДИМЕТИЛЦИКЛОГЕКСАНА
126.
127.
128.
КОНФОРМАЦИИ ИНОЗИТОЛОВ129.
ДИАСТЕРЕОМЕРЫ ДЕКАЛИНОВОГО(ФРАГМЕНТА ГОНАНА)
цис-декалин
транс-декалин
H
H
H
H
цис-декалин
транс-декалин
130.
КРЕСЛОВИДНЫЕ КОНФОРМАЦИИТЕТРАГИДРОПИРАНОВОГО ЦИКЛА
1
4
O
5
5
O
2
1
3
4С
3
4
1
1С
4
2
131.
CH2OHHOH2C
OH
O
O
HH
4
1
OH
C
C
4
1
OH
CH2OH
CH2OH
O
O
OH
4
1
C
1
C
4
132.
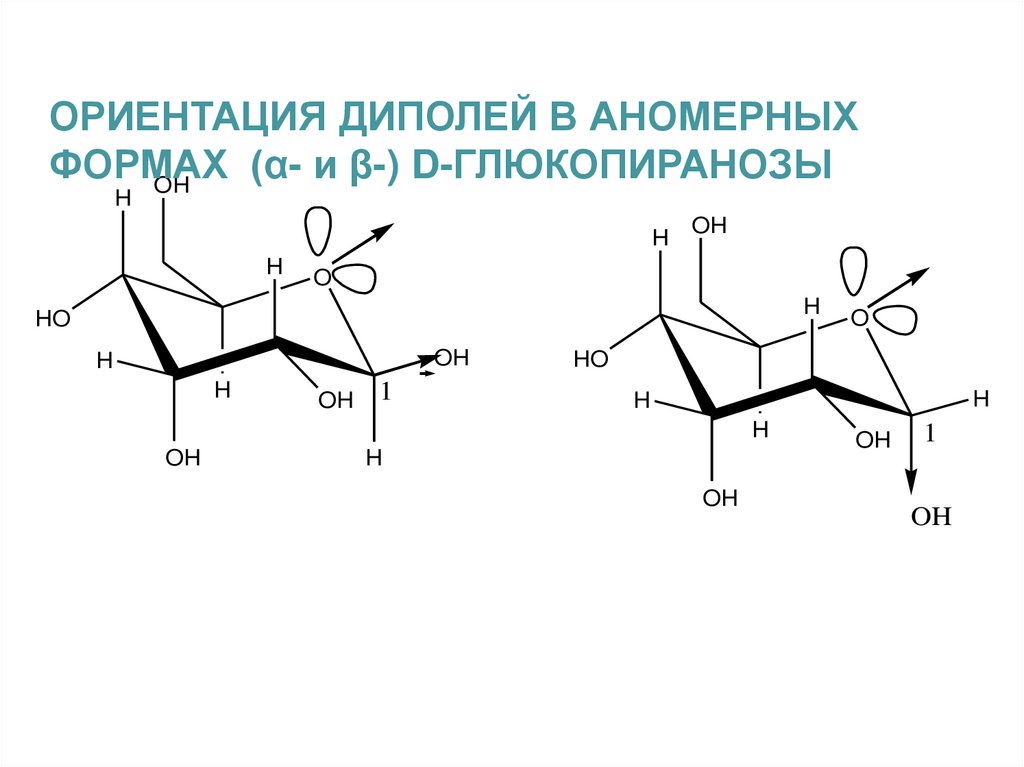
ОРИЕНТАЦИЯ ДИПОЛЕЙ В АНОМЕРНЫХФОРМАХ
(α- и β-) D-ГЛЮКОПИРАНОЗЫ
OH
H
H
H
OH
O
H
HO
OH
H
H
OH
1
HO
H
H
H
OH
O
H
OH
OH
1
OH
133.
КОНЦЕПЦИЯ ТОПНЫХ ОТНОШЕНИЙПРОХИРАЛЬНОСТЬ
134.
Молекулы в пространствеVS
атомов (групп атомов) в молекуле
Диастереомеры
Tпл. 146°C
α = +112.2 ° · ml · dm−1 · g−1
Tпл. 150°C
α = +17.5 ° · ml · dm−1 · g−1
Энантиомеры
Tпл. 53 °C
Tпл. 53 °C
α = - 3,82 ° · ml · dm−1 · g−1
α = +3,82 ° · ml · dm−1 · g−1
Вещества у которых нет стереоизомеров
135.
136.
137.
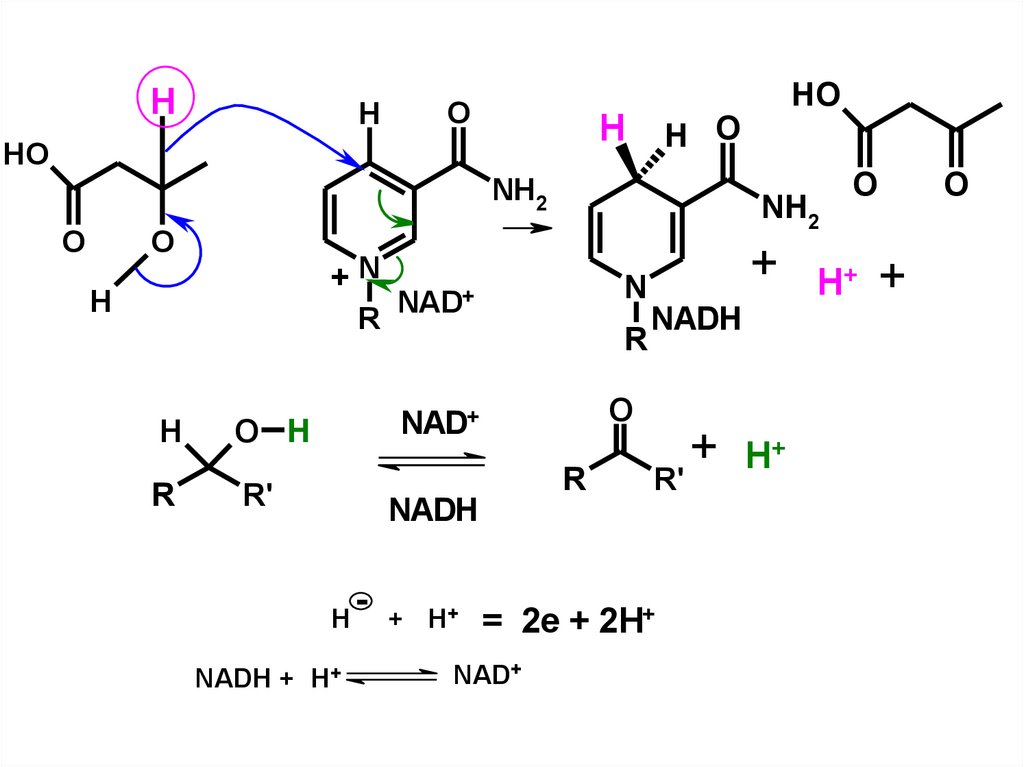
HH
O
H
HO
H O
NH2
O
O
+N
H
R
H
O H
R
R'
NH2
N
NAD+
R
H
NADH + H+
- + H+
+
NADH
O
NAD+
R
NADH
R'
= 2e + 2H+
NAD+
HO
+ H+
O
H+ +
O
138.
По степени отличия в молекуле выделяютГОМОТОПНЫЕ
ЭНАНТИОТОПНЫЕ
ДИАСТЕРЕОТОПНЫЕ
атомы, группы и стороны
139.
140.
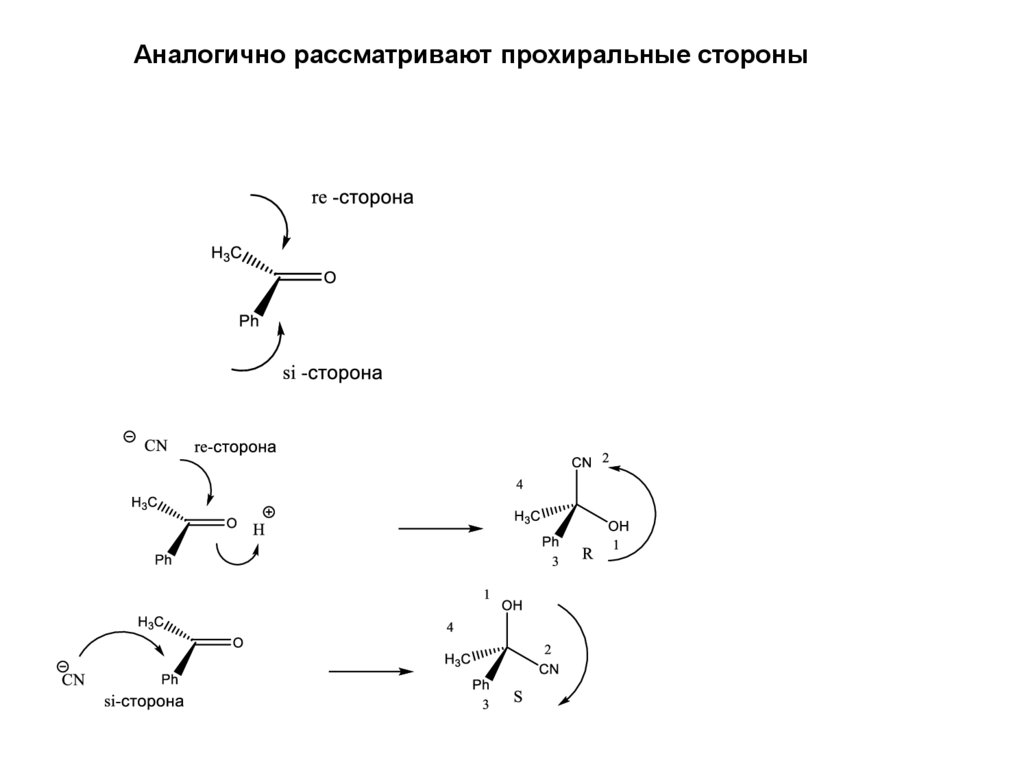
Аналогично рассматривают прохиральные стороны141.
Гомотопными называются атомы или группы атомов в молекуле,которые переводятся друг в друга операцией симметрии группы
простых поворотных осей.
ГОМОТОПНЫЕ группы и стороны неразличимы.
Энантиотопными называются атомы или группы атомов в молекуле,
которые переводятся друг в друга операцией симметрии группы
простых зеркально поворотных осей
Диастеретотопными называются атомы или группы атомов в
молекуле, которые не переводятся друг в друга любыми операциями
симметрии
142.
Для идентификации характера топных отношений можноиспользовать критерий простереогенности
ГОМОТОПНЫЕ
ГРУППЫ
ИДЕНТИЧНЫ
143.
Для идентификации характера топных отношений можноиспользовать критерий простереогенности
ЭНАНТИОТОПНЫЕ
ГРУППЫ
ЭНАНТИОМЕРЫ
144.
Для идентификации характера топных отношений можноиспользовать критерий простереогенности
ДИАСТЕРЕОТОПНЫЕ
ГРУППЫ
ДИАСТЕРЕОМЕРЫ
145.
МОЛЕКУЛЫ В ПРОСТРАНСТВЕ(глобальная симметрия)
ГРУППЫ В МОЛЕКУЛЫ
(локальная симметрия)
Хиральные/ахиральные
Хиротопные/ахиротопные
Стереоизомерные/идентичные
Гетеротопные/гомотопные
Диастереомерные/Энантиомерные
Диастереотопные/Энантиотопные
146. СВЯЗЬ ПРОСТРАНСТВЕННОГО СТРОЕНИЯ СОЕДИНЕНИЙ С ИХ БИОЛОГИЧЕСКОЙ АКТИВНОСТЬЮ
В организме реакции протекают с участиембиокатализаторов – ферментов. Ферменты
построены из хиральных молекул α-Lаминокислот, поэтому они чувствительны к
хиральности взаимодействующих с ними
субстратов.
Хиральными молекулами являются также
углеводы, фосфолипиды, витамины,
гормоны, нуклеиновые кислоты.
147.
ТЕОРИЯ ФИШЕРА148.
Теория индуцированного соответствияКошленда
А) модель Фишера «ключа и
замка»
Б) модель «руки и перчатки»
Кошленда
149.
Теория индуцированного соответствияКошленда
А) модель Фишера «ключа и
замка»
Б) модель «руки и перчатки»
Кошленда
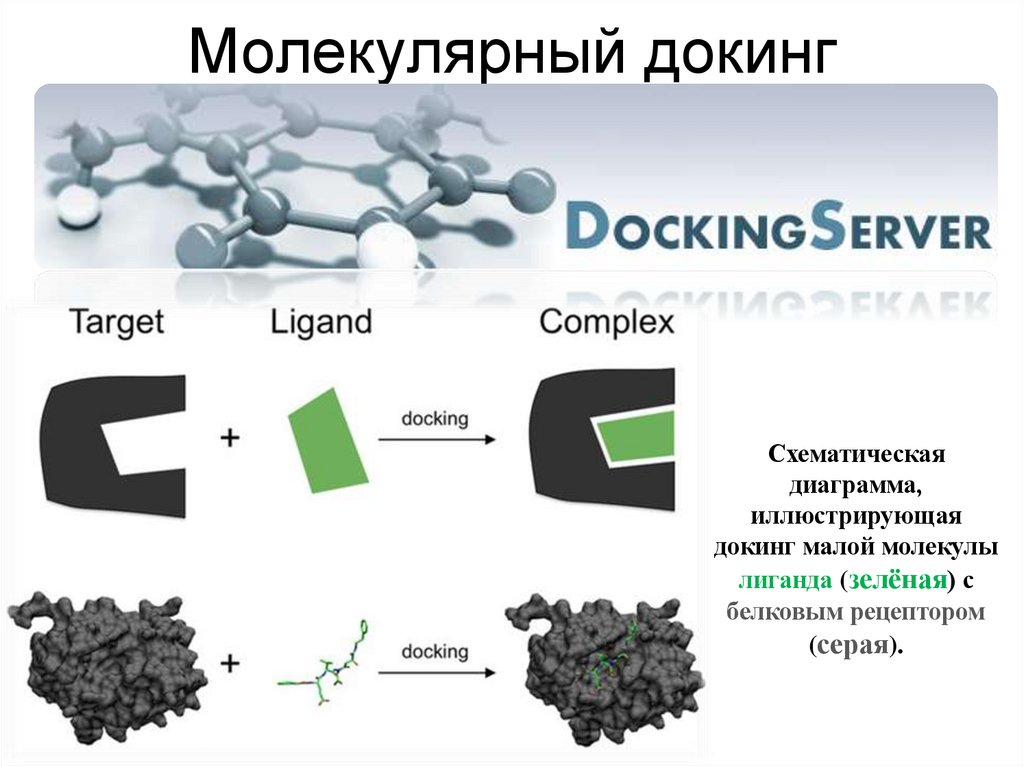
150. Молекулярный докинг
Схематическаядиаграмма,
иллюстрирующая
докинг малой молекулы
лиганда (зелёная) с
белковым рецептором
(серая).
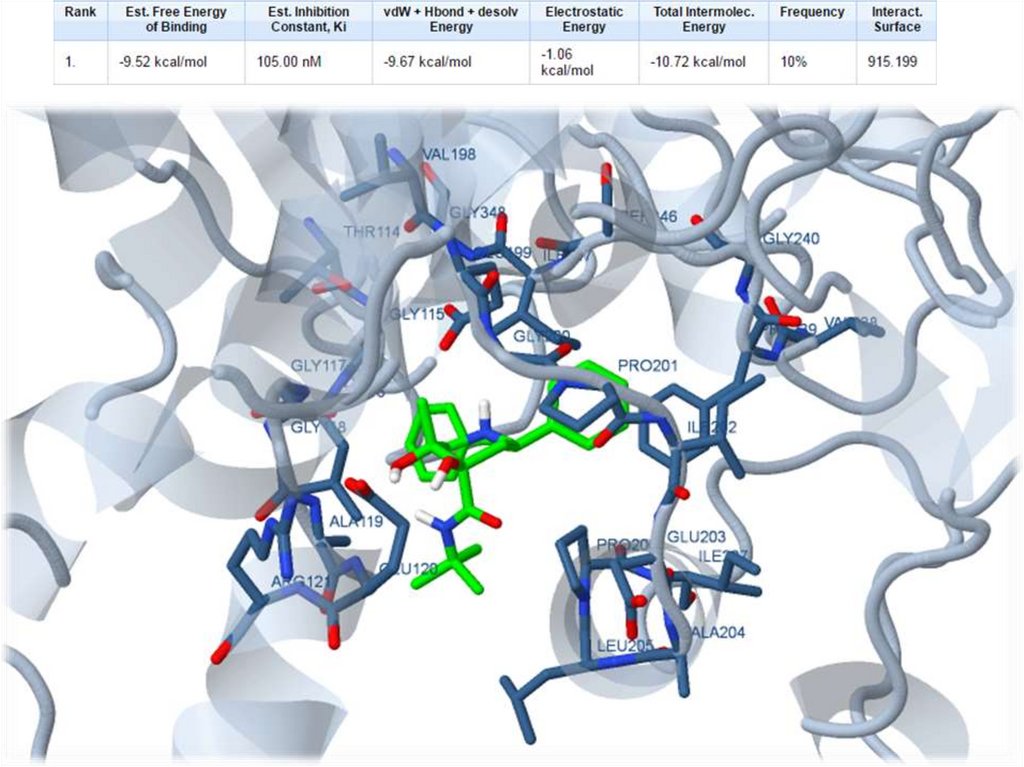
151. Взаимодействие лиганда с белком. Первое моделирование.
152.
153.
СТЕРЕСПЕЦИФИЧНОСТЬ ЛЕКАРСТВЕННЫХСРЕДСТВ
Наиболее активный энантиомер, обладающий сродством к
рецептору и вызывающий выраженный биологический зффект,
называется эутомером.
Неактивный или токсичный энантиомер, обладающий
меньшим сродством к рецептору, называется дистомером.
Показателем эффективности и стереоселективности действия
хирального лекарственного средства является :
Эудесмическое отношение представляющее собой отношение
Аффинитета эутомера /аффинитету дистомера
Аффинитет – сродство и прочность соединения между
лигандом (гормон, субстрат, антиген, лекарственное
средство) и объектом его действия (рецептор, фермент,
антитело и т.д.).
154. Алкалоиды группы изохинолинфенантрена (морфинана)
OR1НОN
О
НО
морфин
O
N СНOR
3
2
R1,R2=H
R1=H,R2=CH3
R1,R2=CH3
R1,R2=Ac
м орф ин;
к од еин;
т ебаин;
г ероин;
155.
ON
N
O
O
O
O
демерол (меперидин)
N
H
промедол
O
N
O
N
N
O
фентанил
O
корфентанил
156.
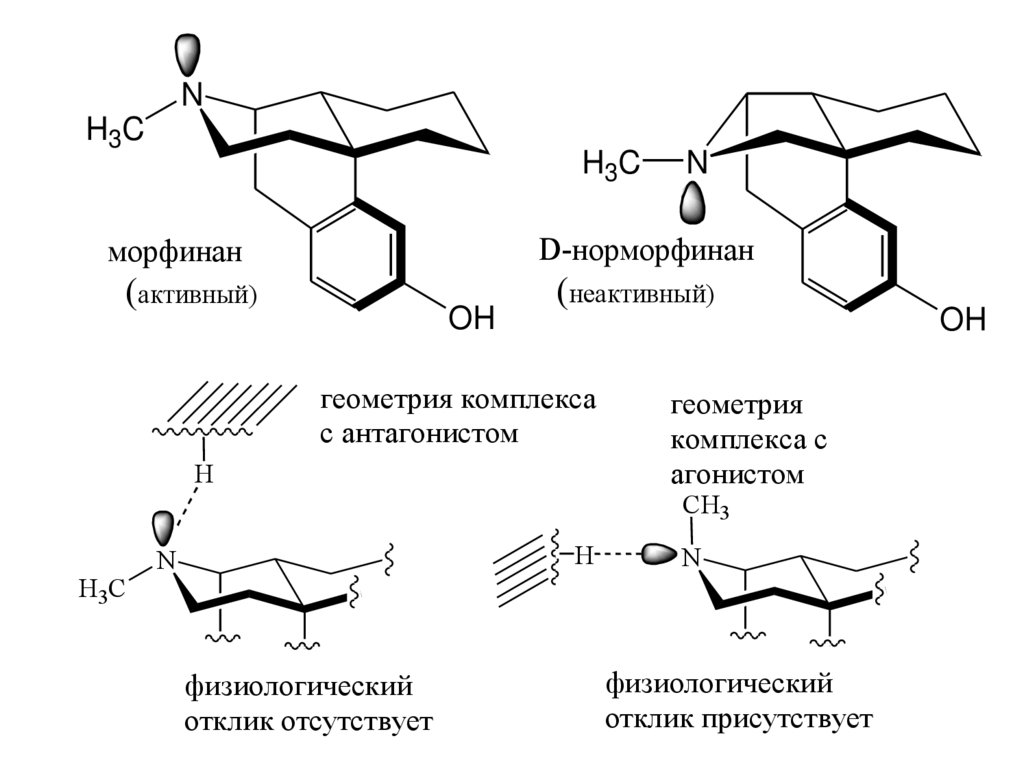
NH3C
H 3C
N
морфинан
D-норморфинан
(активный)
(неактивный)
OH
геометрия комплекса
с антагонистом
H
геометрия
комплекса с
агонистом
CH3
H 3C
H
N
физиологический
отклик отсутствует
N
физиологический
отклик присутствует
OH
157.
HON
O
налоксон
OH


























































































































 chemistry
chemistry








