Similar presentations:
Пространственное строение органических соединений. Основные закономерности протекания органических реакций
1.
Лекции по химииПространственное строение
органических соединений. Основные
закономерности протекания
органических реакций.
2.
Пространственное строение органическихсоединений. Основные закономерности
протекания органических реакций
Строение органических соединений
1.1. Структурная изомерия
2. Пространственное строение
2.1. Конформации и конформационные изомеры
2.2. Конфигурация и конфигурационные изомеры
2.3. Энантиомеры
2.4. Стереохимическая номенклатура
2.5. Диастереомеры
1.
3.
Основные закономерности протекания органических реакций
3.1. Типы реагентов и реакций
3.1.1. Понятие о механизме реакции
3.1.2. Факторы, определяющие реакционную способность
органического соединения
3.
О С Н О В Н Ы Е П ОЛ О Ж Е Н И Я Т Е О Р И ИХИМИЧЕСКОГО СТРОЕНИЯ
В органических молекулах атомы соединяются между собой в
определённом порядке согласно их валентности, что
определяет химическое строение молекул
Химические и физические свойства органических соединений
зависят как от природы и числа входящих в их состав атомов,
так и от химического строения молекул
Химическое строение — природа и последовательность
связывания атомов в молекуле отображается при помощи
структурных формул
4.
Структурная формула — изображение при помощихимических символов последовательности связей между
атомами в молекуле.
- отражают двумерное строение молекулы.
Для каждой эмпирической формулы можно вывести определённое число
теоретически возможных структур (изомеров)
Каждое органическое соединение имеет одну формулу, которая даёт
представление о свойствах этого соединения
В молекулах существует взаимное влияние атомов как связанных, так и
непосредственно не связанных друг с другом
5.
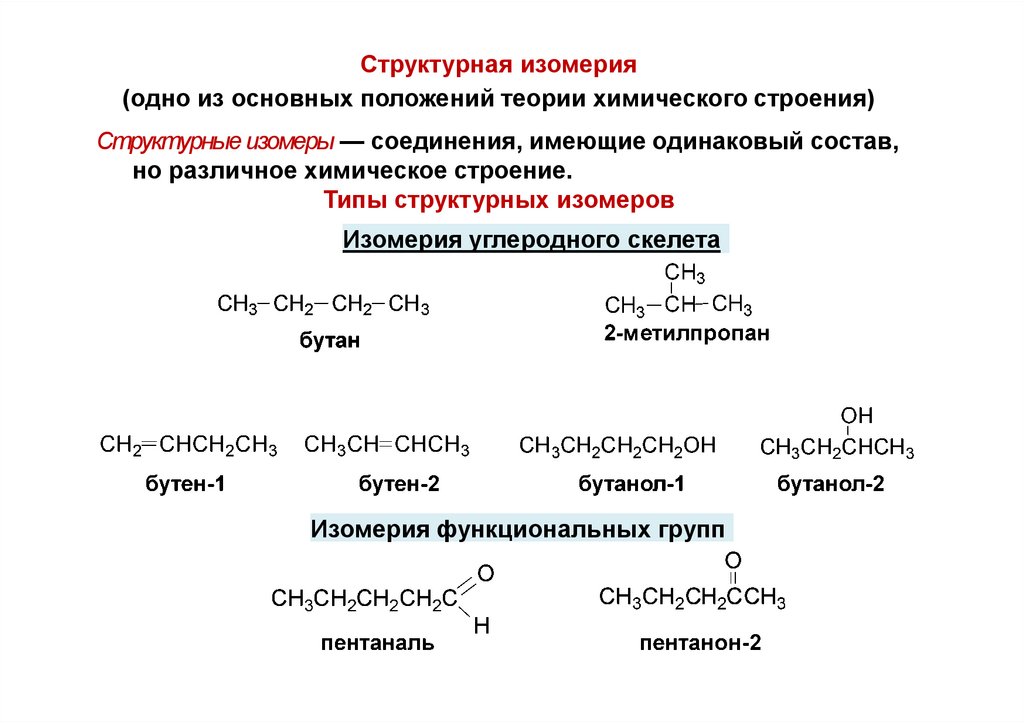
Структурная изомерия(одно из основных положений теории химического строения)
Структурные изомеры — соединения, имеющие одинаковый состав,
но различное химическое строение.
Типы структурных изомеров
Изомерия углеродного скелета
Изомерия функциональных групп
6.
Пространственное строение—
взаимное расположение атомов и атомных групп в
трехмерном пространстве.
(более полная характеристика соединений по сравнению с химическим
строением)
—
изображается при помощи стереохимических формул
— химическая связь лежит в плоскости чертежа
химическая связь уходит за плоскость назад
химическая связь выходит из плоскости вперед
7.
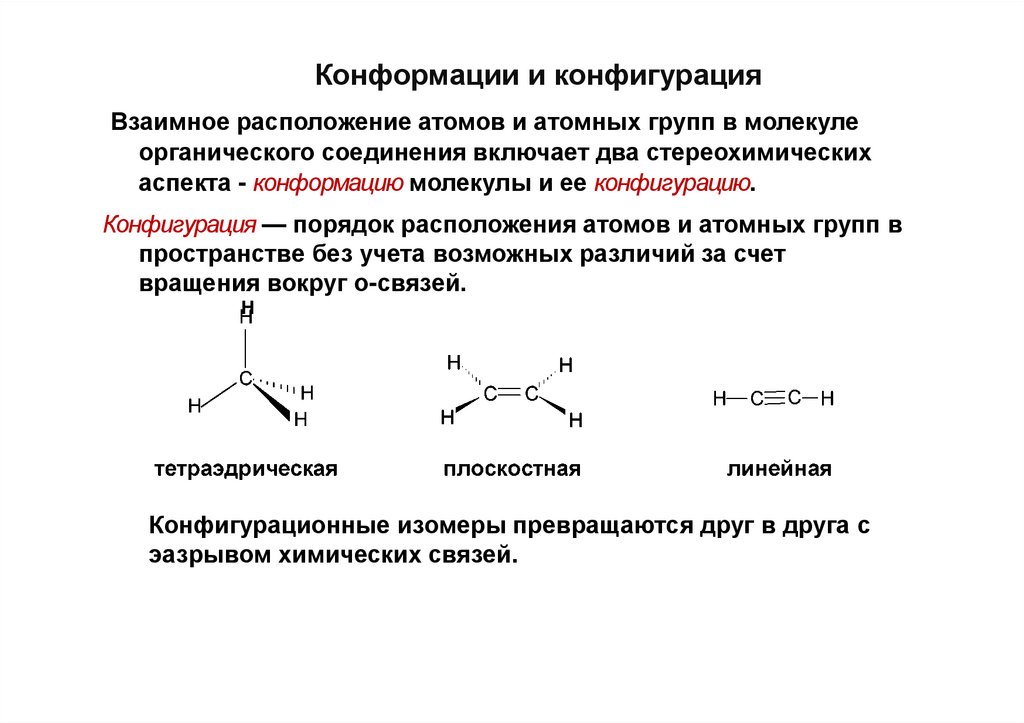
Конформации и конфигурацияВзаимное расположение атомов и атомных групп в молекуле
органического соединения включает два стереохимических
аспекта - конформацию молекулы и ее конфигурацию.
Конфигурация — порядок расположения атомов и атомных групп в
пространстве без учета возможных различий за счет
вращения вокруг о-связей.
H
Конфигурационные изомеры превращаются друг в друга с
эазрывом химических связей.
8.
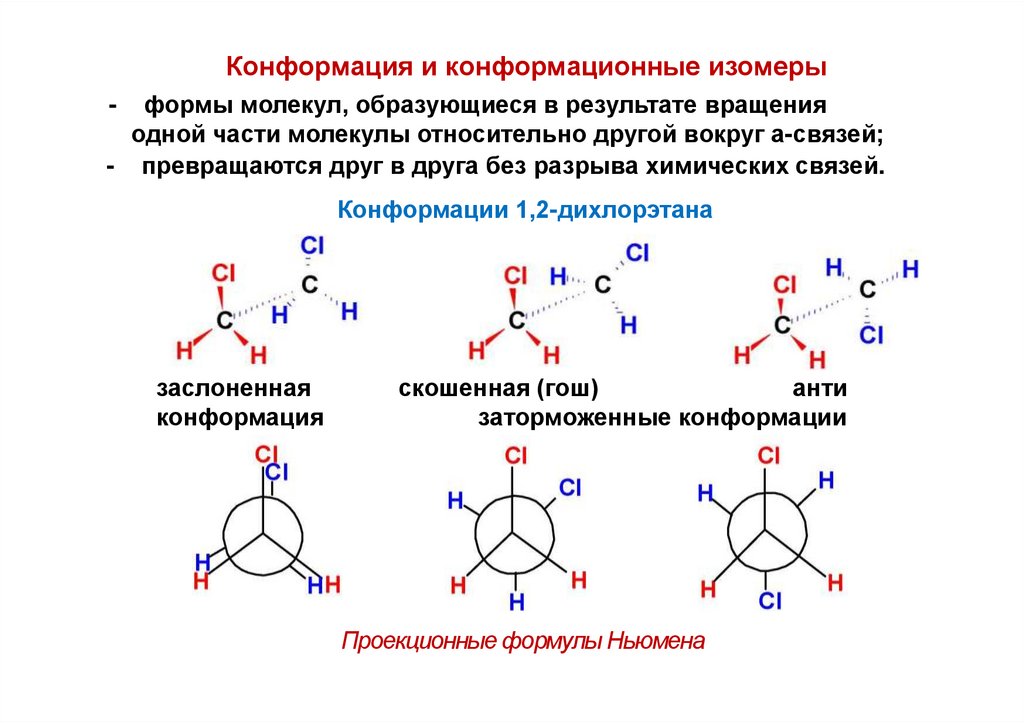
Конформация и конформационные изомерыформы молекул, образующиеся в результате вращения
одной части молекулы относительно другой вокруг а-связей;
- превращаются друг в друга без разрыва химических связей.
-
Конформации 1,2-дихлорэтана
заслоненная
конформация
скошенная (гош)
анти
заторможенные конформации
Проекционные формулы Ньюмена
9.
Конфигурация и конфигурационные изомерыКонфигурационные изомеры — соединения с одинаковой
последовательностью связей атомов в молекуле, но
различной конфигурацией без учета возможных различий за
счет вращения вокруг а-связей.
Конфигурационные изомеры могут существовать в виде различных
конформаций.
Конфигурационные изомеры могут быть энантиомерами и
диастереомерами.
10.
Хиральность— свойство предмета быть неидентичным своему зеркальному
отображению (от греч. cheir — рука).
(левая и правая рука, перчатки, пара
ботинок, левая и правая винтовые
лестницы и другие предметы)
• Молекулы, как геометрические тела, могут
быть хиральными и ахиральными.
Как следствие хиральности, некоторые молекулы существуют в виде
пары пространственных изомеров — энантиомеров, представляющих
собой несовместимые в пространстве зеркальные изображения
(зеркальные изомеры).
Простейший случай хиральности — наличие в молекуле центра
хиральности (хирального центра), которым может служить атом углерода,
связанный с четырьмя различными атомами или группами
— асимметрический атом углерода (*С)
11.
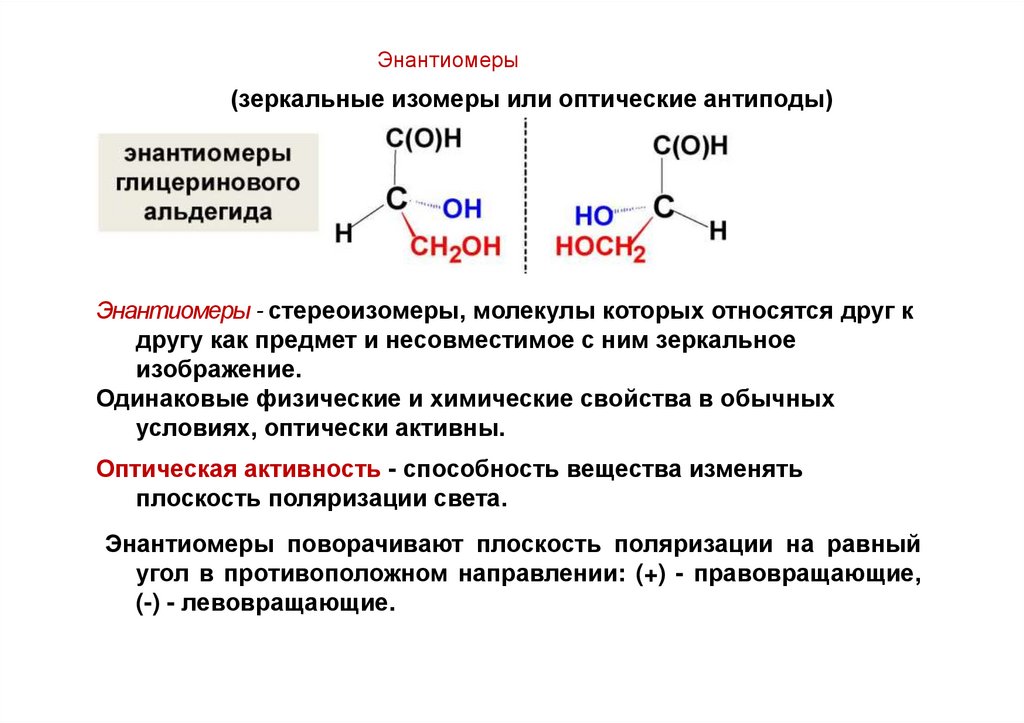
Энантиомеры(зеркальные изомеры или оптические антиподы)
Энантиомеры - стереоизомеры, молекулы которых относятся друг к
другу как предмет и несовместимое с ним зеркальное
изображение.
Одинаковые физические и химические свойства в обычных
условиях, оптически активны.
Оптическая активность - способность вещества изменять
плоскость поляризации света.
Энантиомеры поворачивают плоскость поляризации на равный
угол в противоположном направлении: (+) - правовращающие,
(-) - левовращающие.
12.
Конфигурационный стандарт — глицериновый альдегидУглеродная цепь расположена сверху вниз (наверху старшая группа)
Горизонтальные связи выходят вперед из плоскости чертежа, вертикальные —
назад за плоскость чертежа
Перестановка двух заместителей изменяет
конфигурацию молекулы на противоположную
Следствие — четное число перестановок не изменяет конфигурацию.
Поворот формулы Фишера на 90° изменяет конфигурацию на
противоположную; поворот на 180° ее не изменяет
13.
РацематыРацемат — оптически неактивная смесь равных количеств энантиомеров.
Разделение рацематов
Механический способ — разделение путем отбора кристаллов по их
форме (Л. Пастер, 1848).
При кристаллизации рацемата индивидуальные энантиомеры
в этом случае кристаллизуются самостоятельно.
Биохимический способ — разделение с использованием
микроорганизмов, способных потреблять один из энантиомеров.
Расщепление рацемической виноградной кислоты на
энантиомеры с помощью плесневого грибка Penicillium glaucum,
использующего для своей жизнедеятельности лишь (+)-винную
кислоту. способ — перевод обоих энантиомеров в
Химический
диастереомеры с последующим их разделением.
Диастереомеры получают взаимодействием рацемата с
хиральным реагентом.
14.
Стереохимическая номенклатураDL-Система обозначения конфигурации (М.А. Розанов, 1906)
Определение D- или L-конфигурации:
1.
Записать формулу Фишера в «стандартном» виде, т.е. так чтобы
углеродная цепь располагалась вертикально, а старший заместитель
располагался наверху.
2. Если функциональная группа у асимметрического атома углерода
окажется при этом слева - это L-энантиомер,
если справа - это D-энантиомер.
3. Если формула Фишера записана не в стандартном виде, необходимо
путем перестановок заместителей преобразовать ее к стандартному виду
и учесть число перестановок. Например, если при четном числе
перестановок был получен D-энантиомер, значит и исходный
стереоизомер имел D-конфигурацию.
15.
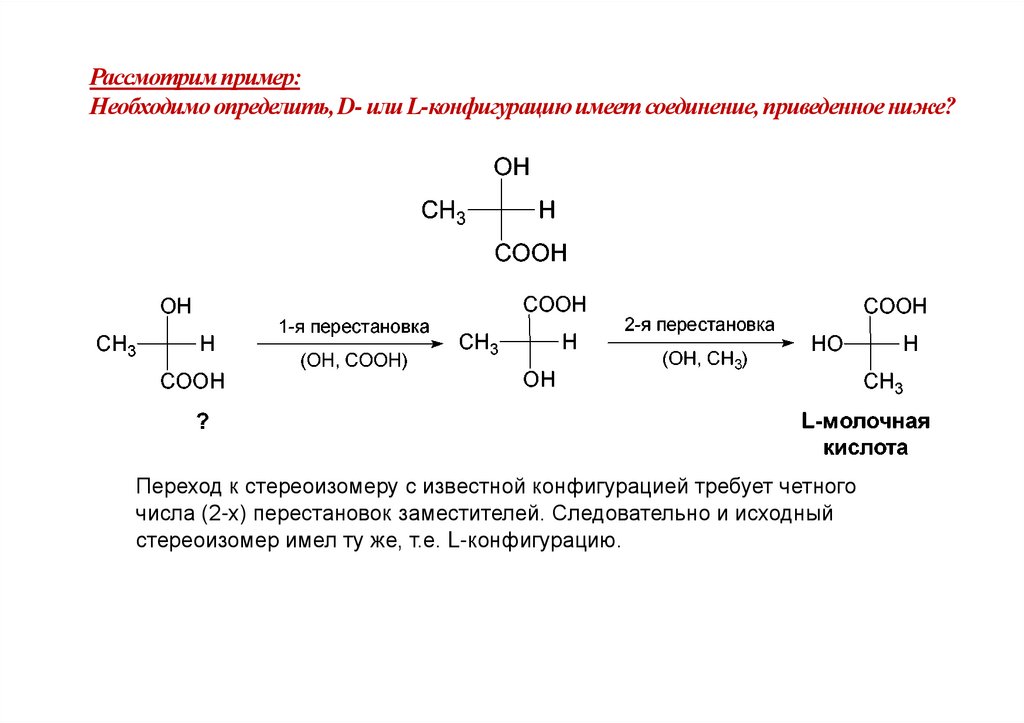
Рассмотрим пример:Необходимо определить, D- или L-конфигурацию имеет соединение, приведенное ниже?
Переход к стереоизомеру с известной конфигурацией требует четного
числа (2-х) перестановок заместителей. Следовательно и исходный
стереоизомер имел ту же, т.е. L-конфигурацию.
16.
RS-Система обозначения конфигурации (Р. Кан,К. Ингольд и В. Прелог, 1956)
(от лат. rectus - правый, sinister - левый)
Основные правила:
а) чем больше атомный номер элемента, непосредственно связанного с
центром хиральности, тем старше заместитель. Если первое окружение не
позволяет выбрать порядок старшинства двух или более заместителей, то
рассматривают второе окружение, затем третье и т. д. Атомные номера
элементов, связанных двойной и тройной связью, удваивают или утраивают;
б) молекулу энантиомера располагают так, чтобы самый младший
заместитель был обращен назад (формулу Фишера перестраивают так, чтобы
он оказался снизу или сверху). Если порядок старшинства остальных трех
заместителей убывает по часовой стрелке, то данный изомер имеет Rконфигурацию, если против часовой стрелки, то S-конфигурацию.
17.
ДиастереомерыДиастереомеры —конфигурационные изомеры (стереоизомеры), не
являющиеся энантиомерами.
Диастереомеры обладают различными физическими и
химическими свойствами.
18.
σ -Диастереомеры — диастереомеры, в которых заместителисвязаны с хиральным центром σ
-связями.
π -Диастереомеры — диастереомеры, содержащие π -связи.
σ –Диастереомеры
— Соединения, имеющие более одного центра хиральности, могут
существовать в виде диастереомеров;
— Число стереоизомеров N = 2n, где n равно числу асимметрических
атомов (хиральных центров).
19.
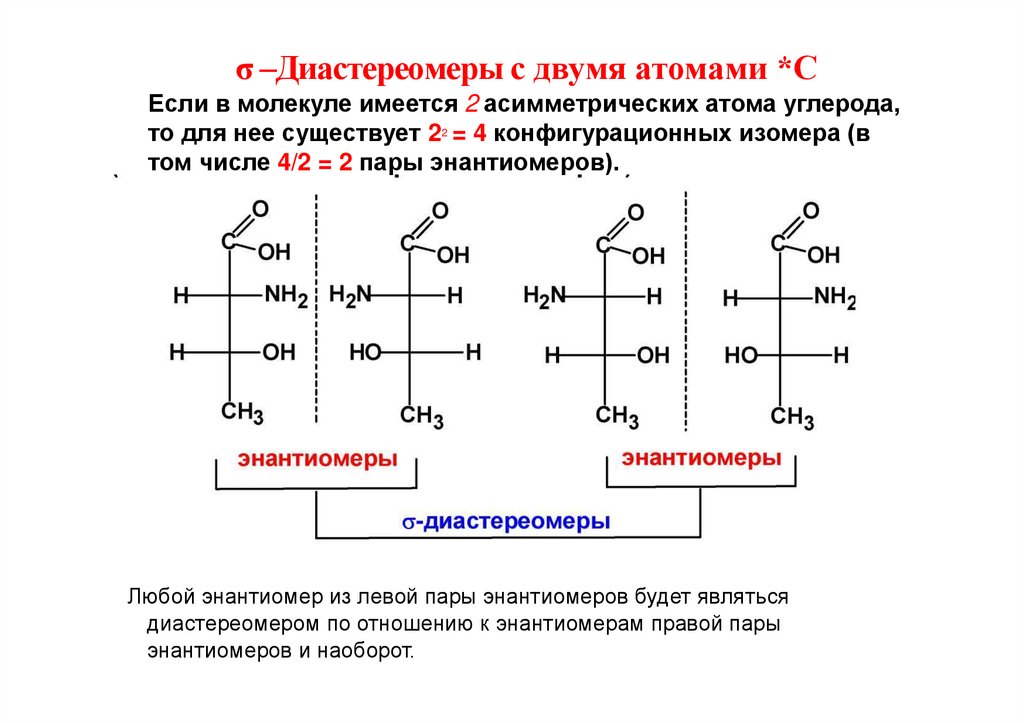
σ –Диастереомеры с двумя атомами *СЕсли в молекуле имеется 2 асимметрических атома углерода,
то для нее существует 22 = 4 конфигурационных изомера (в
том числе 4/2 = 2 пары энантиомеров).
Любой энантиомер из левой пары энантиомеров будет являться
диастереомером по отношению к энантиомерам правой пары
энантиомеров и наоборот.
20.
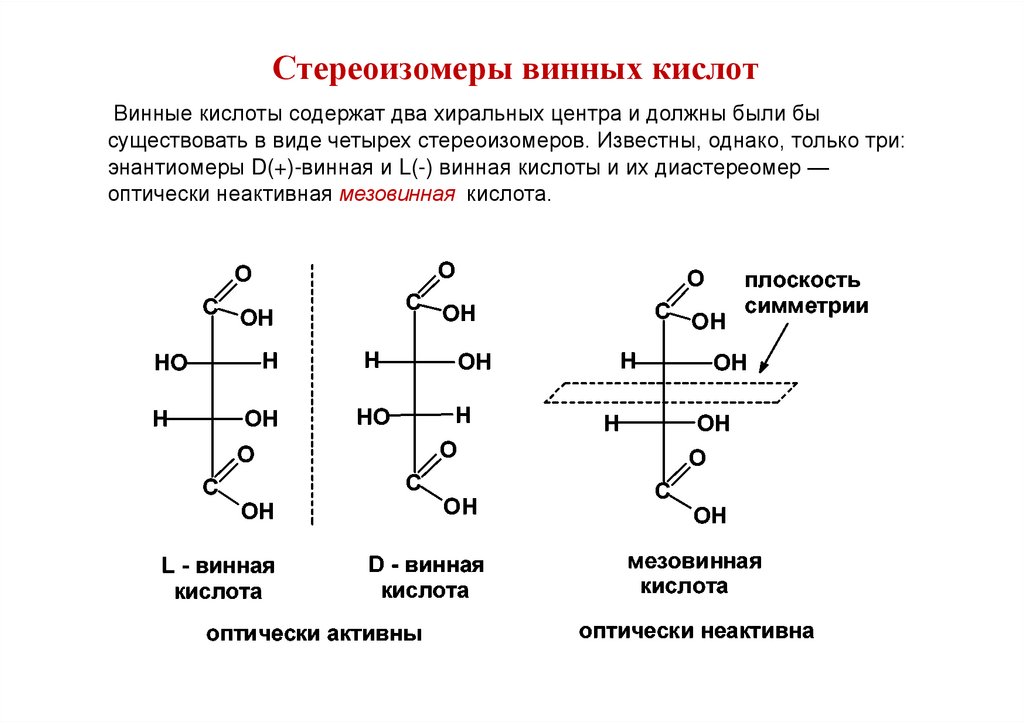
Стереоизомеры винных кислотВинные кислоты содержат два хиральных центра и должны были бы
существовать в виде четырех стереоизомеров. Известны, однако, только три:
энантиомеры D(+)-винная и L(-) винная кислоты и их диастереомер —
оптически неактивная мезовинная кислота.
21.
π -ДиастереомерыВозникают при неидентичности заместителей, связанных с атомами
углерода двойной связи; отличаются различным расположением
заместителей относительно плоскости симметрии п π -связи.
π -Диастереомеры бутена-
π -Диастереомеры октадецен-9-овой кислоты
олеиновая кислота (цисоктадецен-9-овая кислота)
жидкая, т. пл. 13-16 °С
элаидиновая кислота (трансоктадецен-9-овая кислота) твердая,
т. пл. 44-47 °С
22.
Z,E-Система обозначения конфигурацииπ-диастереомеров
(К. Ингольд и В. Прелог, 1951)
(от нем. zusammen - вместе, entgegen - напротив)
Основные правила:
а) чем больше атомный номер элемента, непосредственно
связанного с двойной связью, тем старше заместитель. Если
первое окружение не позволяет выбрать порядок старшинства
двух или более заместителей, то рассматривают второе
окружение, затем третье и т. д.
б) Z-конфигурация для диастереомеров соответствует цисрасположению старших заместителей в каждой паре, E —
транс-расположению.
23.
ИзомерияС учетом пространственного строения понятие изомерии
расширяется и включает в себя не только структурную изомерию,
но также и пространственную изомерию.
Изомеры — соединения с одинаковым составом, отличающиеся
последовательностью связывания атомов и (или)
расположением их в пространстве.
Таким образом, приведенное общее определение изомерии
включает как химическое строение, так и пространственное
расположение атомов.
Пространственные изомеры (стереоизомеры) — соединенения с
одинаковым химическим строением, т.е. одной и той же
последовательностью соединения атомов, но различным
расположением этих атомов относительно друг друга в
пространстве.
24.
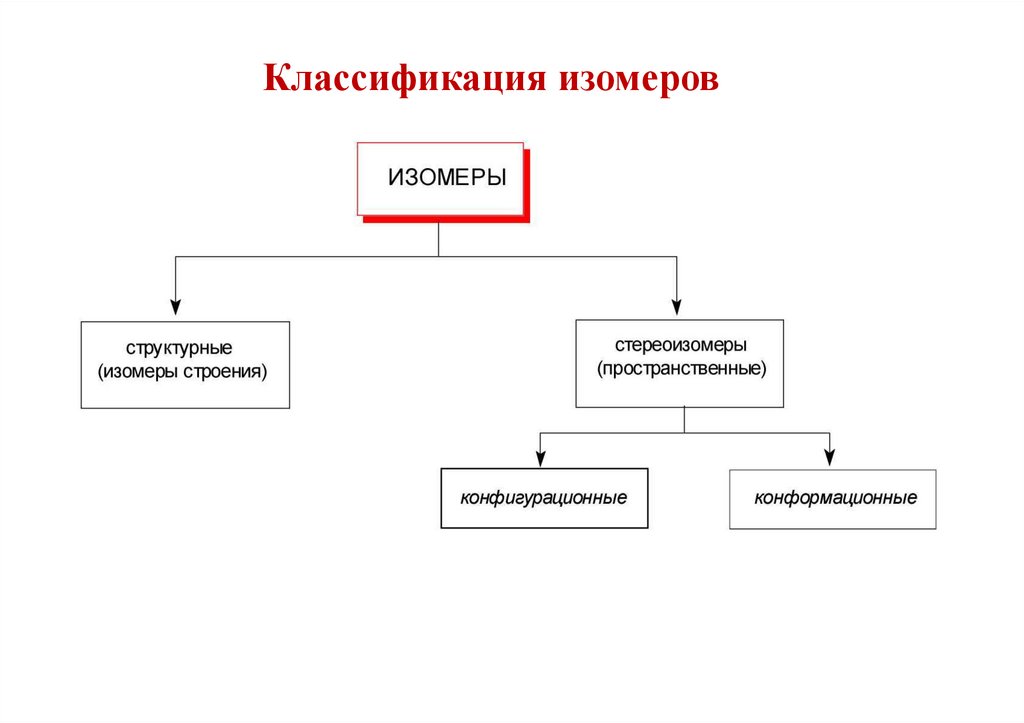
Классификация изомеров25.
Основные закономерности протеканияорганических реакций
Реакционная способность — способность вещества вступать в ту
или иную химическую реакцию и реагировать с большей
или меньшей легкостью
— характеристика химической активности соединения.
Реакционный центр — атом или группа атомов в молекуле,
непосредственно участвующие в химической реакции
Субстрат — вещество, реакционная способность которого
по отношению к реагенту рассматривается в данной
химической реакции
Реагент — действующее на субстрат вещество
(реакционная частница)
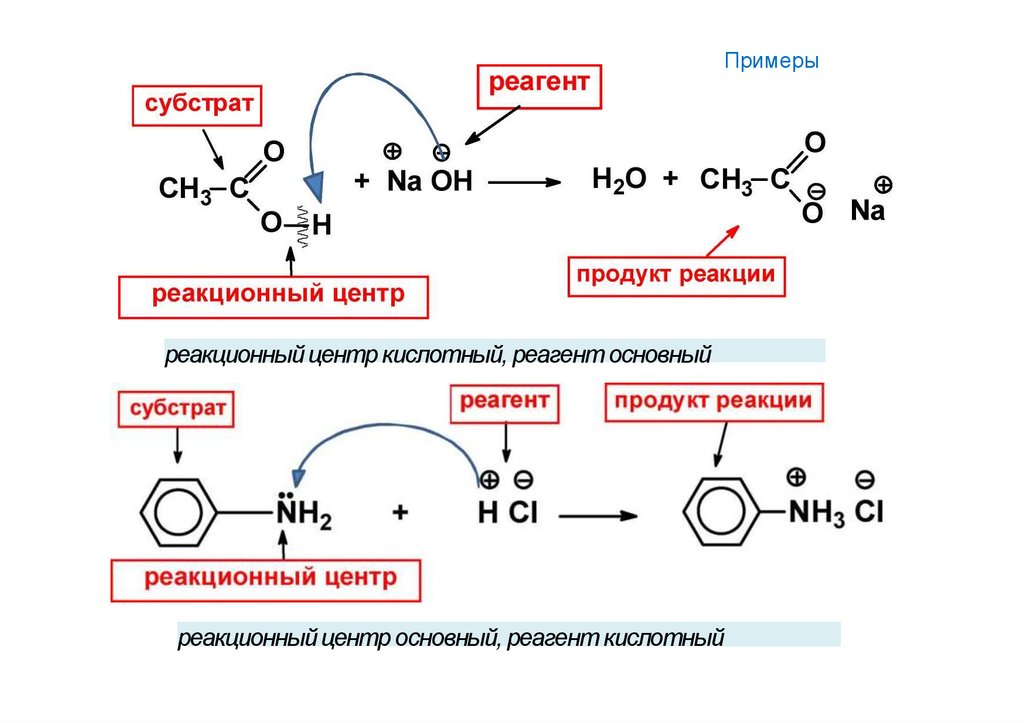
26.
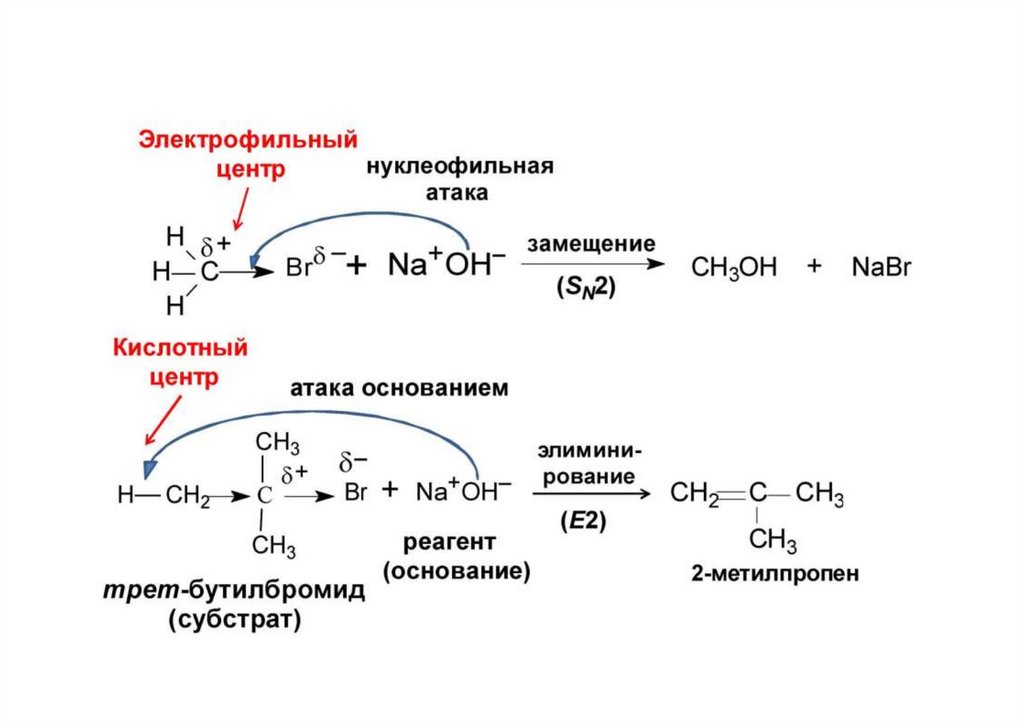
Примерыреакционный центр кислотный, реагент основный
реакционный центр основный, реагент кислотный
27.
Типы реагентови характер изменения связей в реакционном
Кислотные и основные реагенты
центре субстрата
Кислотные реагенты (кислоты) — доноры протона по отношению к
реакционному партнеру.
СВОЙСТВА:
частично или нацело ионизированы в водных растворах, являются
нейтральными молекулами (HCl, CH3COOH)
или положительно заряженными частицами
(NH4+/,H3O+)
Основные реагенты (основания) — акцепторы протона по отношению
к реакционному партнеру.
СВОЙСТВА:
способны оторвать протон от кислотного центра, являются отрицательно
заряженнымичастицами — HO-, CH3O-или нейтральными молекулами —
:NH3, H2O:.
Символ В- или В.
28.
Нуклеофильные и электрофильные реагентыНуклеофильные реагенты (нуклеофилы) — частицы, образующие новую
ковалентную связь за счет своей электронной пары.
СВОЙСТВА:
— обладают повышенной электронной плотностью, взаимодействуют с
любым атомом (кроме водорода), несущим частичный или полный
положительный заряд;
— нуклеофил заряжен отрицательно (Nu-, Cl-, HO-, CH3O-, R3C- карбоанион)
или имеет неподеленную пару электронов (Nu, NH3, H2O)
или п -связь CH2=CH2, C6H6 Символ Nu- или Nu.
Электрофильные реагенты (электрофилы) - частицы, образующие новую
ковалентную связь за счет пары электронов партнера;
СВОЙСТВА:
— имеют недостаток электронов;
— взаимодействуют с реакционным центром партнера с повышенной
электронной плотностью;
— имеют атом, несущий частичный или полный положительный
заряд или обладают вакантной орбиталью. .
H+, Cl+, AlCl3, SO3, R3C+ (карбокатион), RC(0)+
Символ E+ или E.
29.
Радикальные реагенты, окислители и восстановителиРадикальные реагенты (радикалы) — свободные атомы или частицы
с неспаренным электроном (парамагнитные частицы)
(Cl •. Br •, HOO •, R •, •O—O• (бирадикал)).
Символ R.
Окислители — нейтральные молекулы или ионы, принимающие
электроны или атомы водорода от органического субстрата. (O2, Fe3+,
органические окислители).
Символ [O] (или Ox) .
Восстановители — нейтральные молекулы или ионы, отдающие
электроны или атомы водорода органическому субстрату
(H2, Fe2+, H-, органические восстановители).
Символ [H] (или Red).
30.
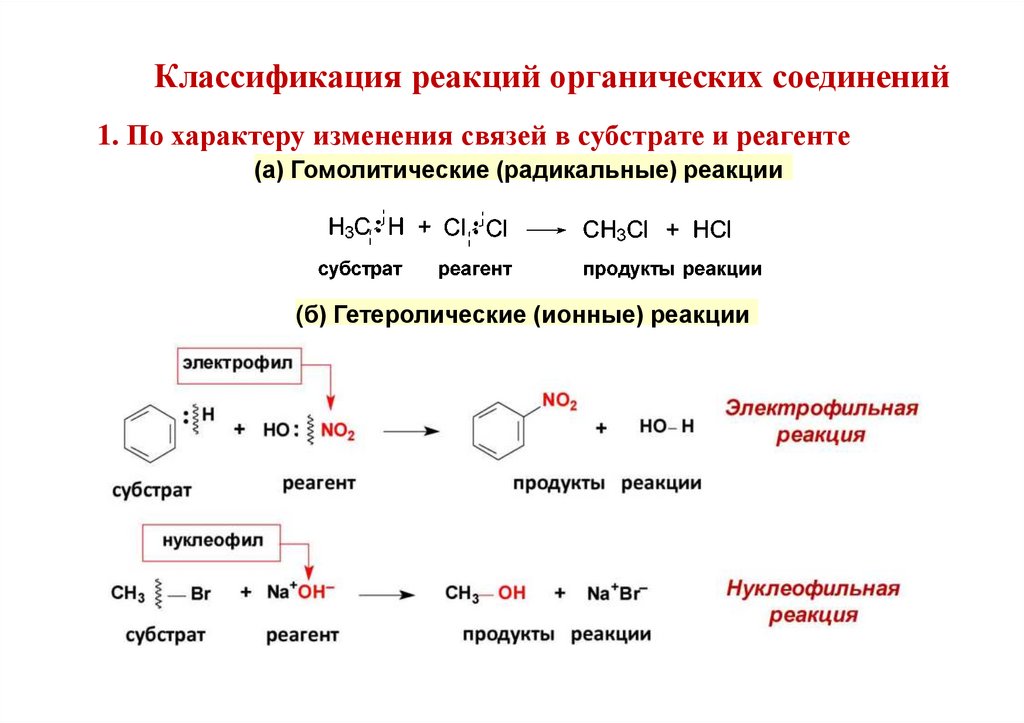
Способы разрыва ковалентной связи1. Гомолитический (свободнорадикальный)
образующиеся активные промежуточные частицы —
свободные радикалы.
2. Гетеролитический (ионный)
образующиеся активные органические промежуточные частицы
—
карбокатионы (положительный заряд на атоме С) или
—
карбоанионы (отрицательный заряд на атоме углерода).
31.
Классификация реакций органических соединений1. По характеру изменения связей в субстрате и реагенте
(а) Гомолитические (радикальные) реакции
(б) Гетеролические (ионные) реакции
32.
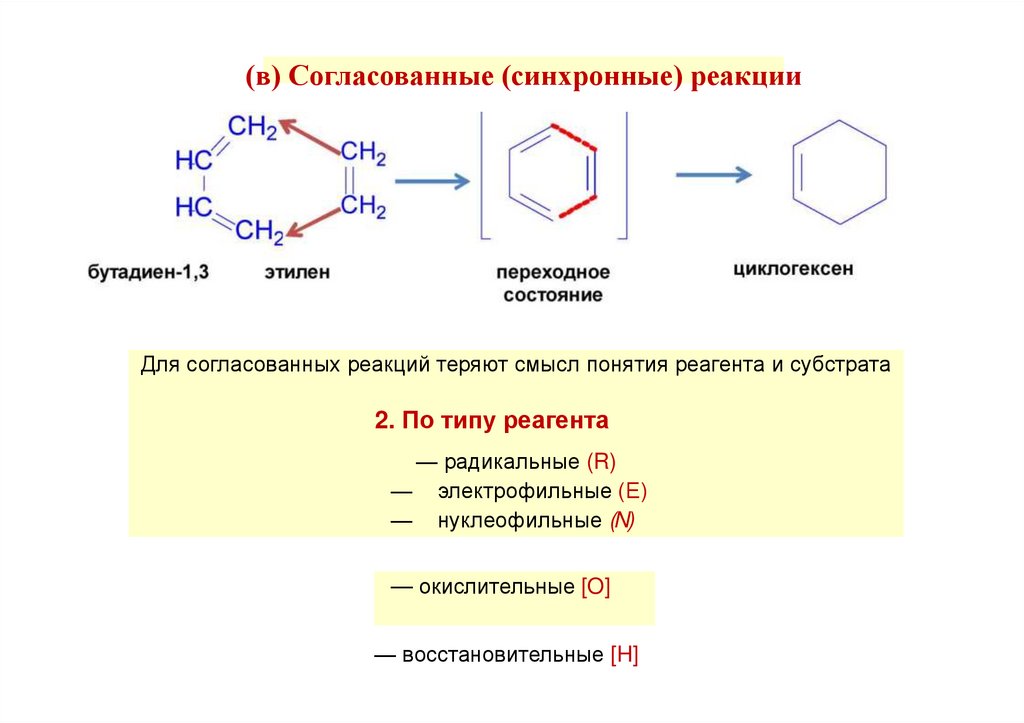
(в) Согласованные (синхронные) реакцииДля согласованных реакций теряют смысл понятия реагента и субстрата
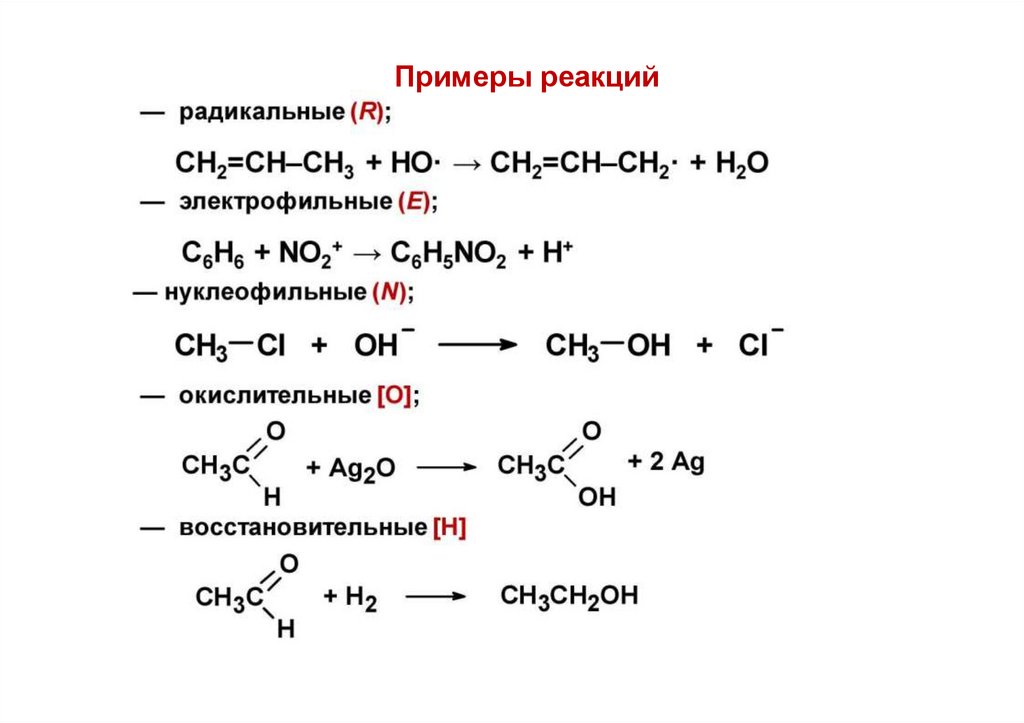
2. По типу реагента
— радикальные (R)
— электрофильные (Е)
— нуклеофильные (N)
— окислительные [O]
— восстановительные [H]
33.
Примеры реакций34.
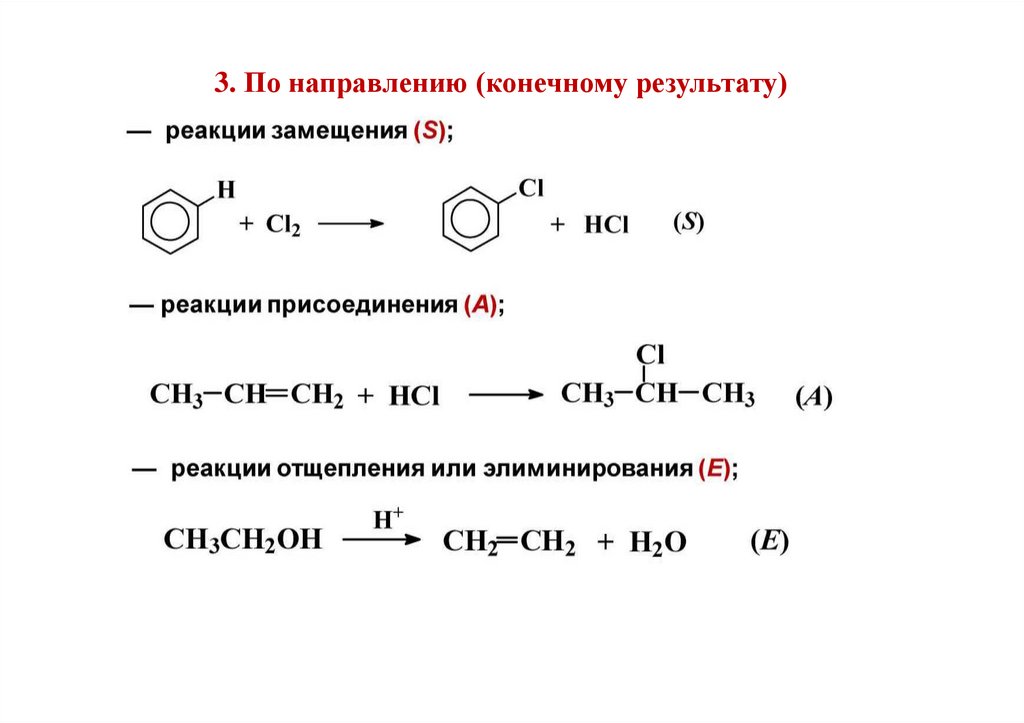
3. По направлению (конечному результату)35.
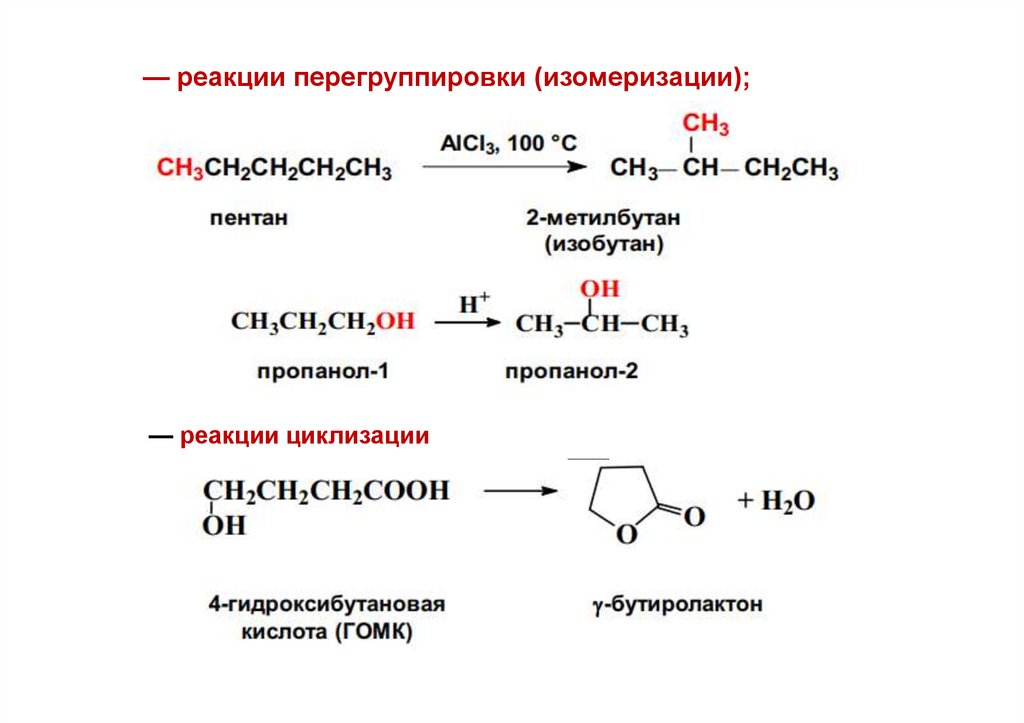
— реакции перегруппировки (изомеризации);CH3
AlCl3, 100 °C
CH3CH2CH2CH2CH3
3
CH3- CH- CH2CH3
2-метилбутан
(изобутан)
пентан
OH
H + CH -CH-CH
3
CH3CH2CH2OH
пропанол-1
3
пропанол-2
— реакции циклизации
CH2CH2CH2COOH
OH
4-гидроксибутановая
кислота (ГОМК)
+ H2O
Y-бутиролактон
36.
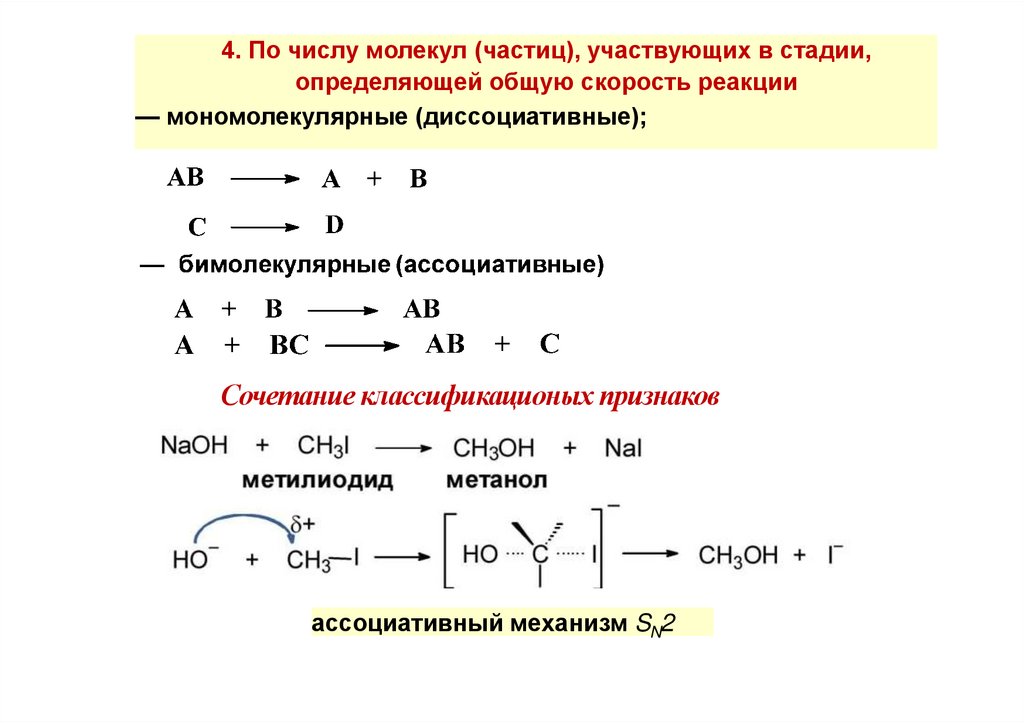
4. По числу молекул (частиц), участвующих в стадии,определяющей общую скорость реакции
— мономолекулярные (диссоциативные);
Сочетание классификационых признаков
ассоциативный механизм SN2
37.
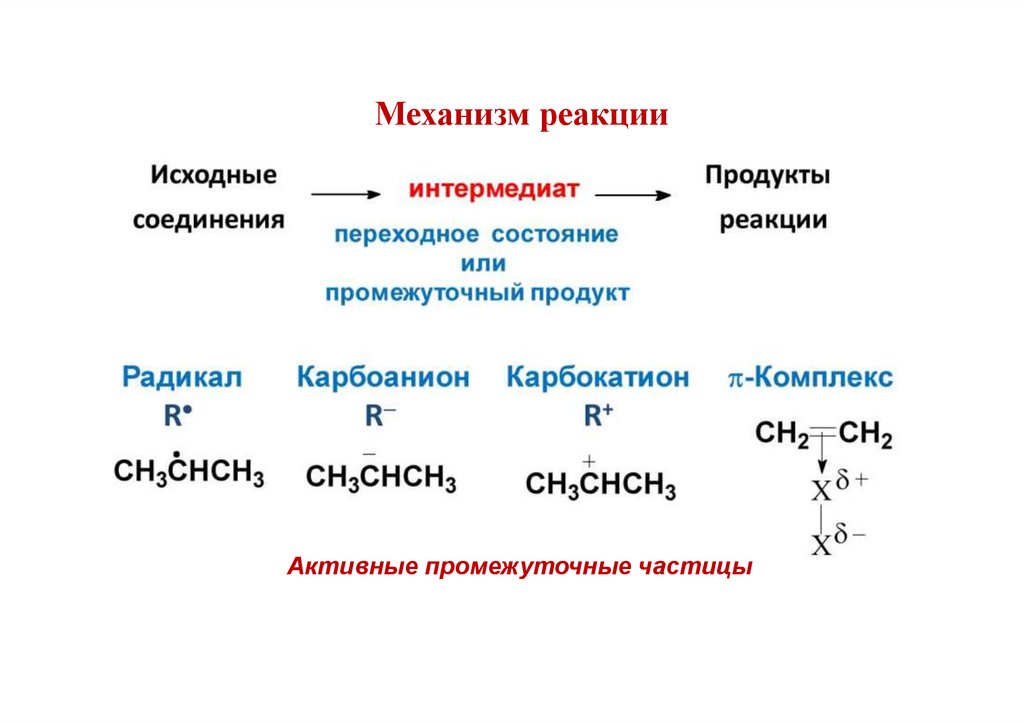
Понятие о механизме реакцииМеханизм реакции:
— детальное описание процесса, в результате которого исходные вещества
превращаются в конечные продукты;
— детальное описание всех стадий реакции
Включает:
элементарные стадии реакции;
способ разрыва и образования связей на каждой стадии.
Согласуется с:
стереохимией процесса - пространственным строением исходных продуктов,
переходных состояний, промежуточно образующихся частиц и продуктов
реакции;
кинетическими закономерностями процесса;
термодинамикой процесса.
38.
Механизм реакцииАктивные промежуточные частицы
39.
Факторы, определяющие реакционную способностьорганического соединения
(статические и динамические)
Статические факторы
(молекула в нереагирующем состоянии)
электронный
пространственный
Электронный фактор —
распределение электронной плотности в молекуле
(электроотрицательность атомов, входящих в молекулу,
электронные эффекты заместителей, наличие сопряженных и
ароматических фрагментов).
Пространственный фактор —
пространственная доступность реакционного центра молекулы.
40.
Динамические факторыВключают оценку энергии промежуточных
частиц или переходного состояния.
*Чем больше возможностей для делокализации
(рассредоточения) электронной плотности в
промежуточной частице (свободном радикале, катионе,
анионе, π -комплексе), или в переходном состоянии, тем
более они устойчивы (стабильны), тем ниже их энергия и
тем легче идет реакция.
41.
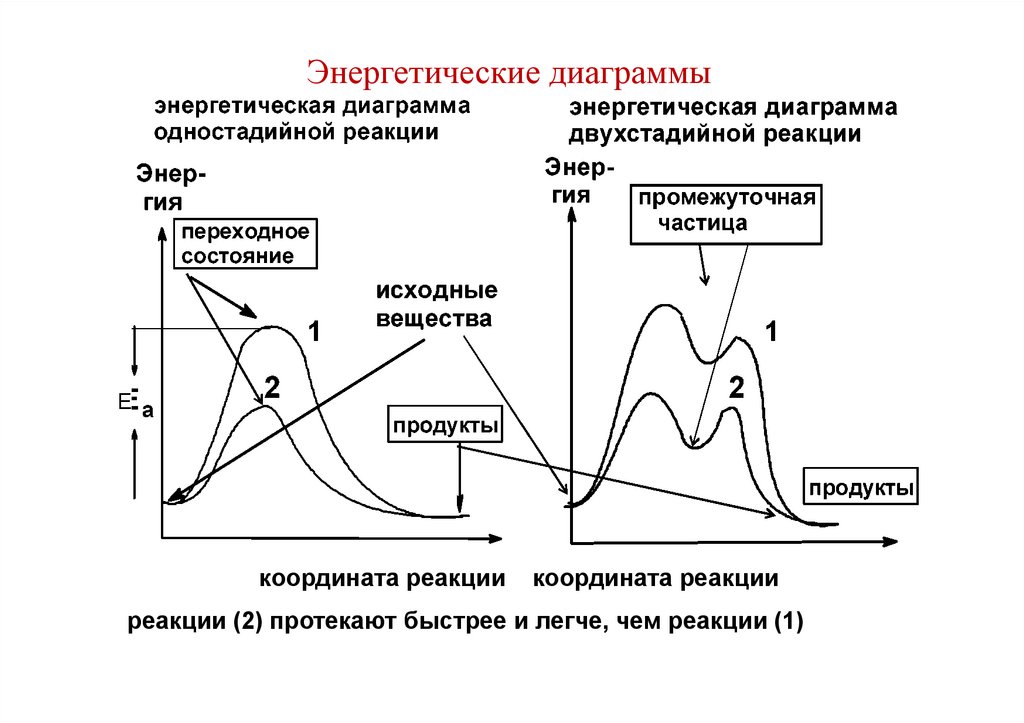
Энергетические диаграммыЕ
координата реакции
координата реакции
реакции (2) протекают быстрее и легче, чем реакции (1)
























 chemistry
chemistry








