Similar presentations:
Введение в биоорганическую химию. Пространственное и электронное строение органических соединений
1.
Кафедра химииТема лекции:
Введение в биоорганическую химию.
Пространственное и электронное строение
органических соединений
1
1
2.
Предмет и задачи биоорганической химииБиоорганическая химия изучает строение и свойства
веществ, участвующих в процессах жизнедеятельности,
в непосредственной связи с познанием их биологических функций.
«Органическая химия – химия
соединений углерода с другими
элементами»
Август Кекуле
«Органическая химия – химия
углеводородов и их функциональных
производных»
Карл Шорлеммер
2
3.
Уникальность углерода1. Способность к катенированию – образованию
исключительно прочных связей с самим собой
Тип связи
Энергия связи,
кДж/моль
Тип связи
Энергия связи,
кДж/моль
С-С
356
N-N
250
В-В
264
Si-Si
226
2. Многообразие структур на основе углерода:
- неограниченная длина цепочек,
- способность к разветвлениям,
- образование циклов,
- образование кратных связей.
3. Возможность одновременного образования связей
как с более, так и с менее электроотрицательными
атомами (водородом, кислородом, азотом и др.).
3
4.
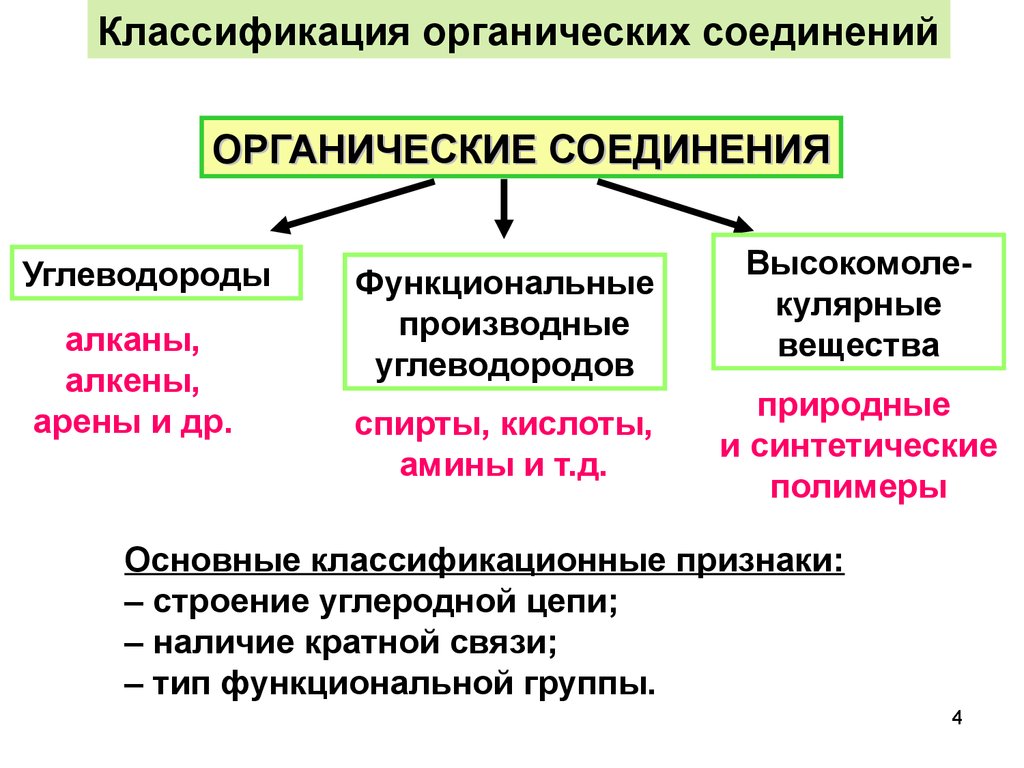
Классификация органических соединенийОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
Углеводороды
алканы,
алкены,
арены и др.
Функциональные
производные
углеводородов
спирты, кислоты,
амины и т.д.
Высокомолекулярные
вещества
природные
и синтетические
полимеры
Основные классификационные признаки:
– строение углеродной цепи;
– наличие кратной связи;
– тип функциональной группы.
4
5.
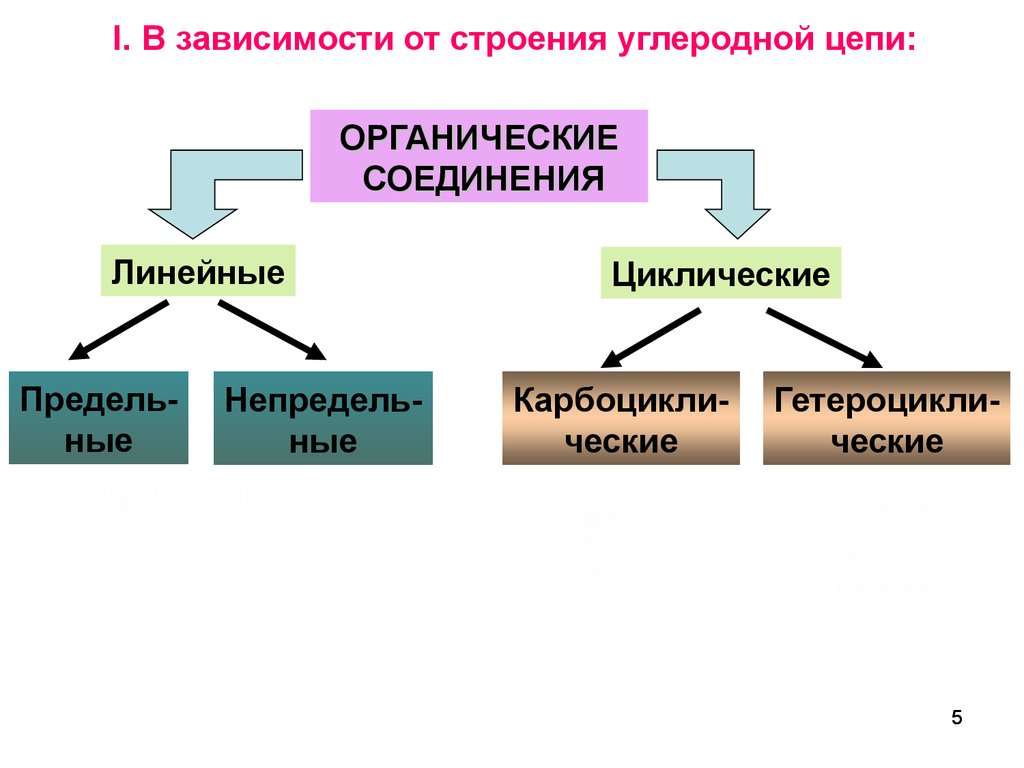
I. В зависимости от строения углеродной цепи:ОРГАНИЧЕСКИЕ
СОЕДИНЕНИЯ
Линейные
Предельные
Непредельные
Циклические
Карбоциклические
Гетероциклические
5
6.
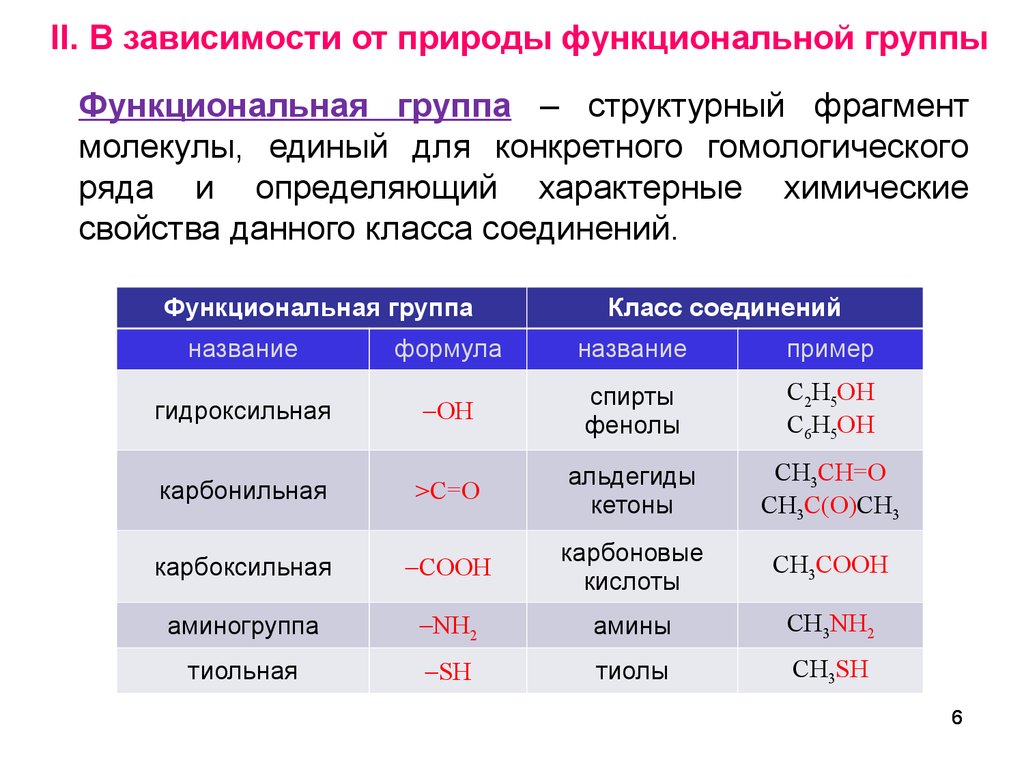
II. В зависимости от природы функциональной группыФункциональная группа – структурный фрагмент
молекулы, единый для конкретного гомологического
ряда и определяющий характерные химические
свойства данного класса соединений.
Функциональная группа
Класс соединений
название
формула
название
пример
гидроксильная
OH
спирты
фенолы
C2H5OH
C6H5OH
карбонильная
>C=O
альдегиды
кетоны
CH3CH=O
CH3C(O)CH3
карбоксильная
COOH
карбоновые
кислоты
CH3COOH
аминогруппа
NH2
амины
CH3NH2
тиольная
SH
тиолы
CH3SH
6
7.
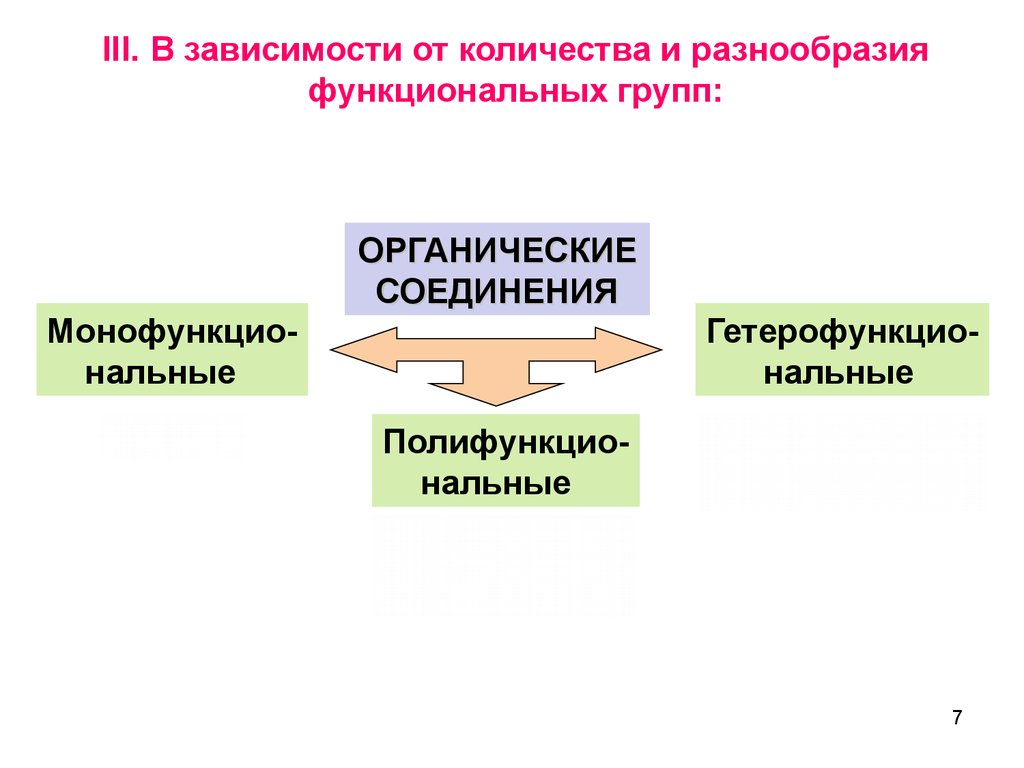
III. В зависимости от количества и разнообразияфункциональных групп:
Монофункциональные
ОРГАНИЧЕСКИЕ
СОЕДИНЕНИЯ
Гетерофункциональные
Полифункциональные
7
8.
Пространственное строение органическихсоединений. Виды изомерии
В молекулах атомы соединены друг с другом
в определенной последовательности в
соответствии с их валентностью. Порядок
связей атомов называется ХИМИЧЕСКИМ
СТРОЕНИЕМ.
А.М. Бутлеров
Явление существования индивидуальных химических
соединений, одинаковых по молярной массе и составу,
но различающихся по строению и расположению атомов
в пространстве, а вследствие этого – и по свойствам,
называется ИЗОМЕРИЕЙ, а соединения – изомерами.
8
9.
СтруктурнаяПространственная
ИЗОМЕРИЯ УГЛЕРОДНОГО СКЕЛЕТА
ИЗОМЕРИЯ ПОЛОЖЕНИЯ
МЕЖКЛАССОВАЯ ИЗОМЕРИЯ
ТАУТОМЕРИЯ
9
10.
СтруктурнаяПространственная
Конформационная
Оптическая
Конфигурационная
Геометрическая
10
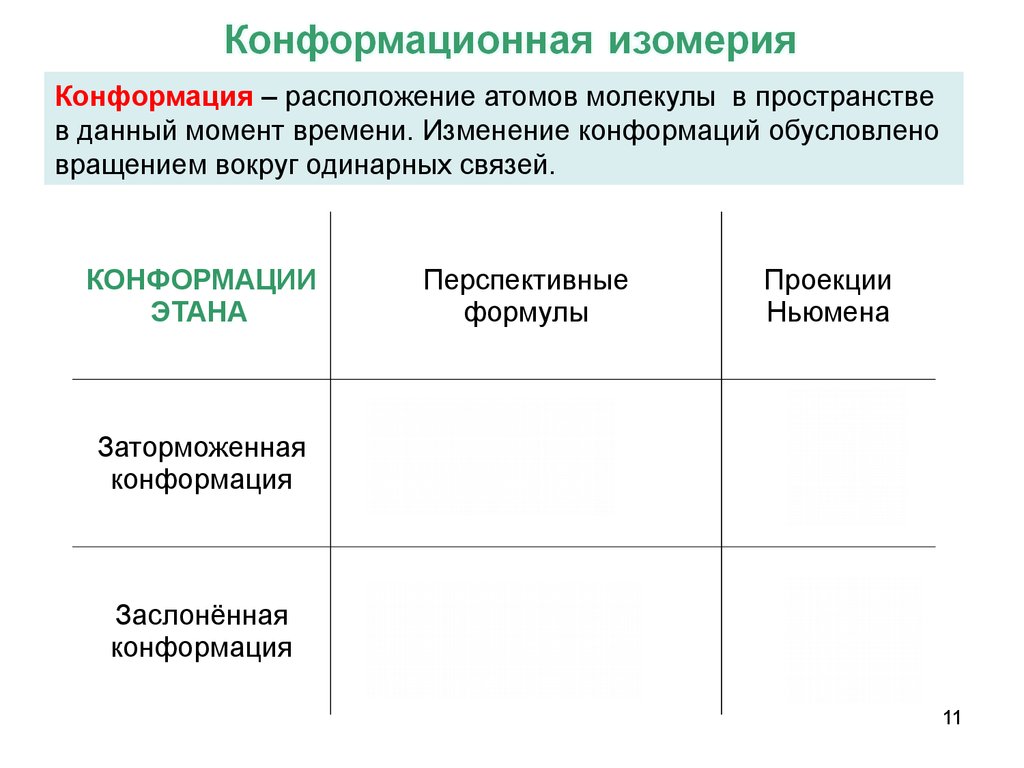
11.
Конформация – расположение атомов молекулы в пространствев данный момент времени. Изменение конформаций обусловлено
вращением вокруг одинарных связей.
КОНФОРМАЦИИ
ЭТАНА
Перспективные
формулы
Проекции
Ньюмена
Заторможенная
конформация
Заслонённая
конформация
11
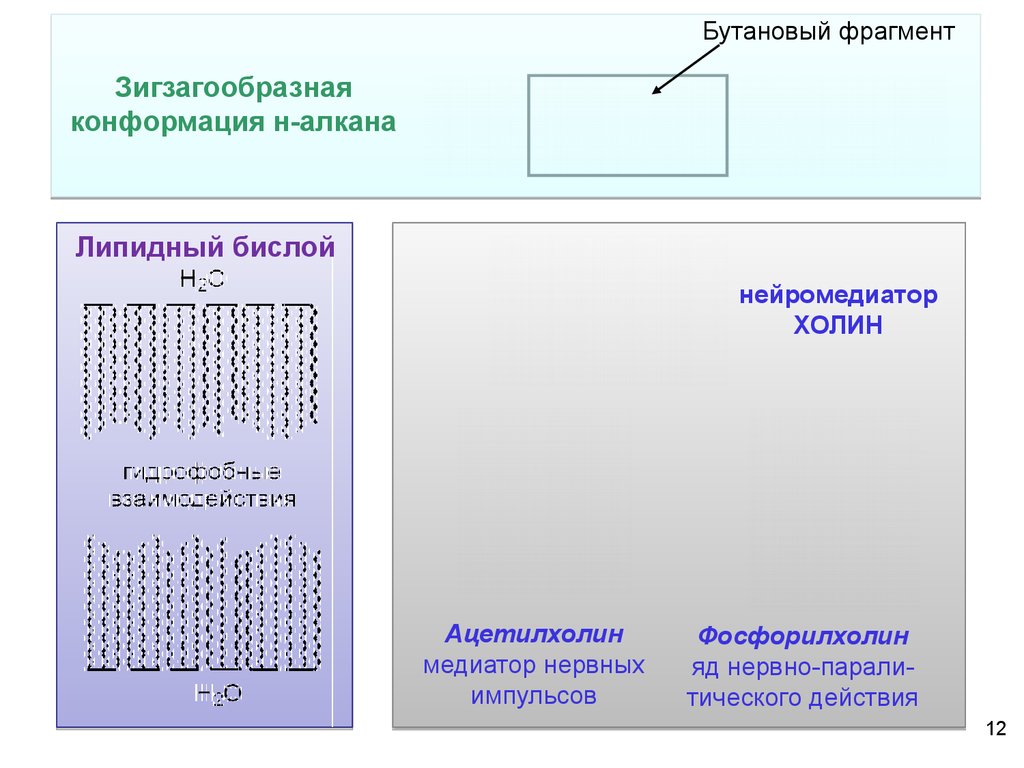
12.
Бутановый фрагментЗигзагообразная
конформация н-алкана
Липидный бислой
нейромедиатор
ХОЛИН
Ацетилхолин
медиатор нервных
импульсов
Фосфорилхолин
яд нервно-паралитического действия
12
13.
Конфигурация – пространственное расположение заместителей относительно стерических центров, к которымотносятся: двойная связь, цикл или элементы хиральности.
Конфигурационная изомерия
Геометрическая
изомерия
Цис-, транс-изомеры
Оптическая
изомерия
D,L-изомеры
13
14.
ГЕОМЕТРИЧЕСКАЯ ИЗОМЕРИЯПричина – отсутствие свободного вращения вокруг -связей
Геометрические изомеры отличаются расположением заместителей у
атомов углерода относительно плоскости двойной связи
Витамин А (ретиналь)
участвует в зрительном восприятии
за счет цис-,транс-изомеризации
14
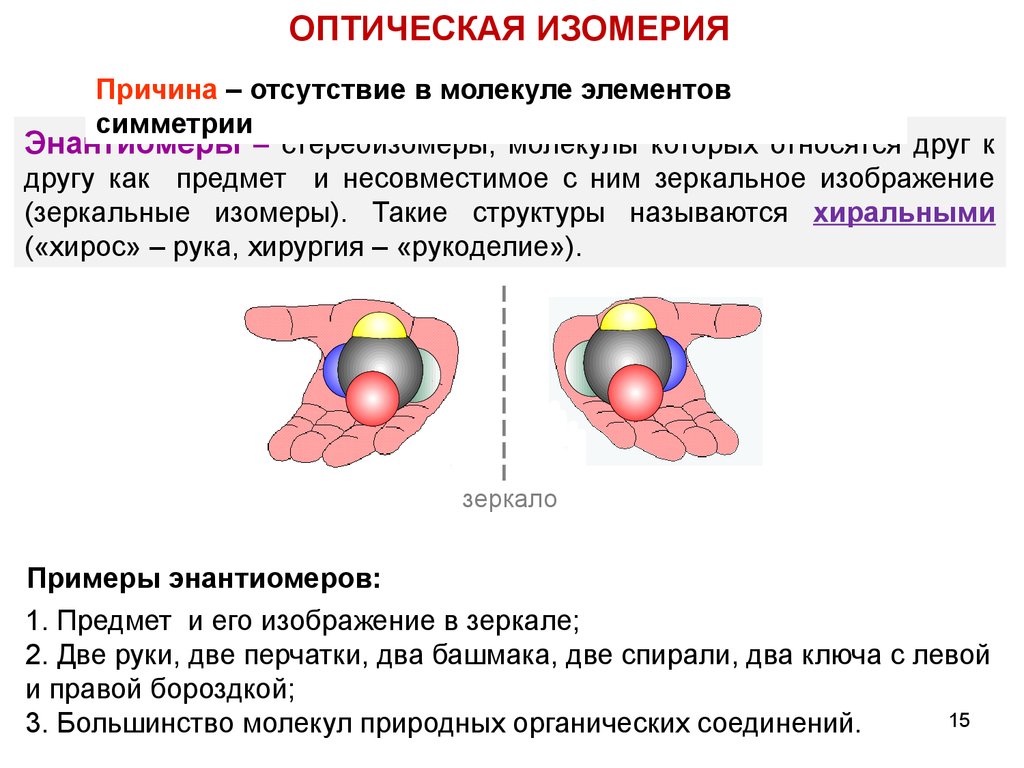
15.
ОПТИЧЕСКАЯ ИЗОМЕРИЯПричина – отсутствие в молекуле элементов
симметрии
Энантиомеры – стереоизомеры, молекулы которых относятся друг к
другу как предмет и несовместимое с ним зеркальное изображение
(зеркальные изомеры). Такие структуры называются хиральными
(«хирос» – рука, хирургия – «рукоделие»).
зеркало
Примеры энантиомеров:
1. Предмет и его изображение в зеркале;
2. Две руки, две перчатки, два башмака, две спирали, два ключа с левой
и правой бороздкой;
15
3. Большинство молекул природных органических соединений.
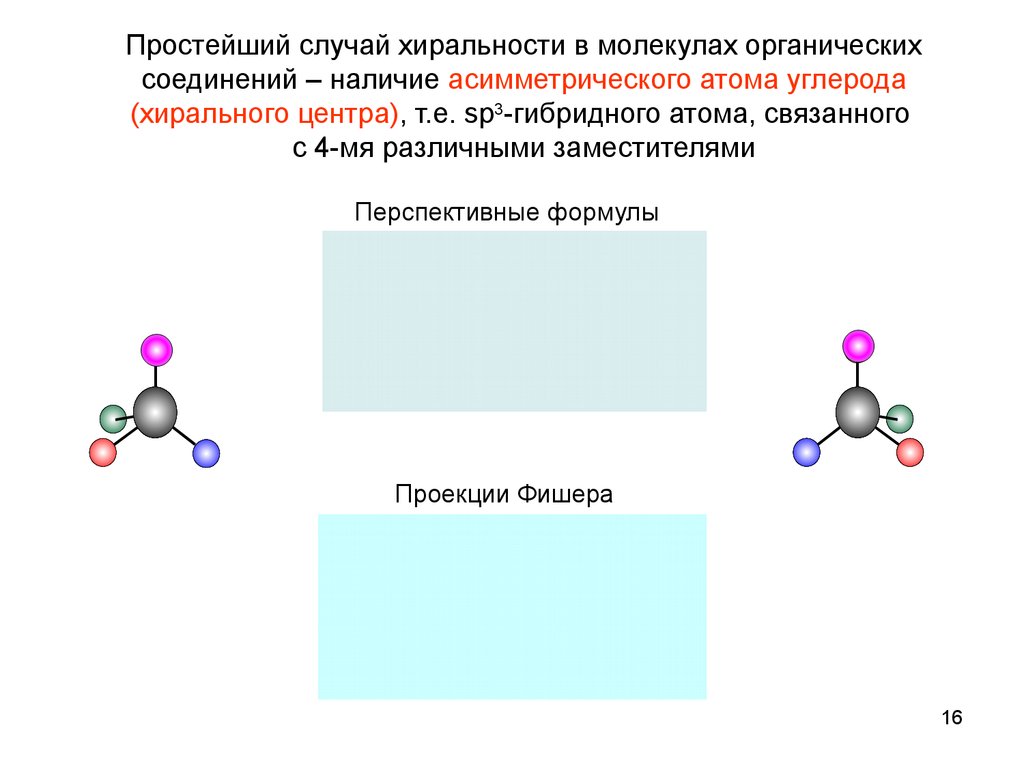
16.
Простейший случай хиральности в молекулах органическихсоединений – наличие асимметрического атома углерода
(хирального центра), т.е. sp3-гибридного атома, связанного
с 4-мя различными заместителями
Перспективные формулы
Проекции Фишера
16
17.
Свойства энантиомеров1) Химические
Энантиомеры идентичны в большинстве свойств, исключая те, что
проявляются под влиянием асимметрических воздействий
2) Физические
Поляризованный свет асимметричен, поэтому все физические свойства
одинаковы, кроме одного – способности вращать в разные стороны, но
на одинаковый угол плоскость поляризованного света.
Это свойство – оптическая активность.
Измеряется с помощью приборов – поляриметров
Энантиомеры – оптические изомеры
Левовращающий изомер – (–)
Правовращающий изомер – (+)
Эквимолярная смесь двух энантиомеров –
рацемат – оптически не активна!!!
17
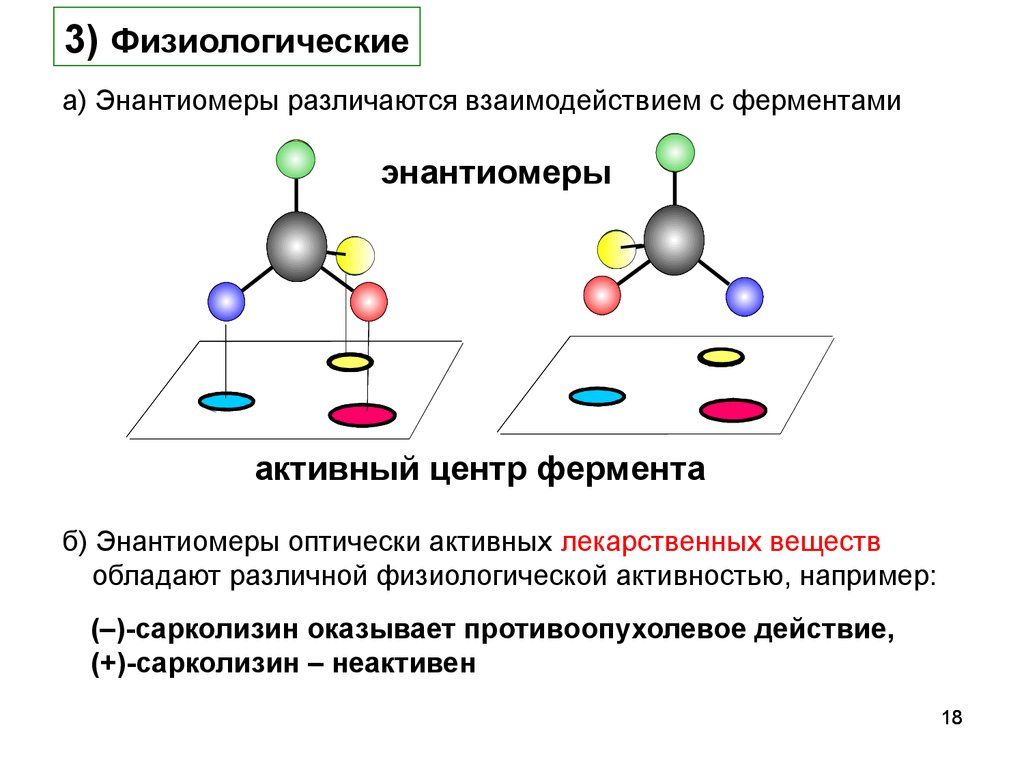
18.
3) Физиологическиеа) Энантиомеры различаются взаимодействием с ферментами
энантиомеры
активный центр фермента
б) Энантиомеры оптически активных лекарственных веществ
обладают различной физиологической активностью, например:
(–)-сарколизин оказывает противоопухолевое действие,
(+)-сарколизин – неактивен
18
19.
D,L-номенклатура энантиомеровВвел М.А. Розанов в 1906 году для углеводов.
Простейший пример глицериновый альдегид
Правила:
углеродная цепь – по вертикали,
старший заместитель – вверху,
атом водорода и функциональная группа – по горизонтали:
по их расположению относят изомеры.
Нет прямой зависимости
между знаком вращения
и D,L-номенклатурой!!!
D(+)-Глицериновый альдегид
L(–)-Глицериновый альдегид
19
20.
Диастереомеры – такие оптические изомеры, которые неявляются
энантиомерами
(у
них
конфигурация
одного
асимметрического центра совпадает, а другого (других) – не
совпадает.
Формула для расчета
количества оптических
изомеров: N = 2n,
где n – число
асимметрических атомов
углерода
У диастереомеров все физические и химические свойства
различны (на этом основан химический способ разделения
рацемических смесей на антиподы)
20
21.
Электронное строение органических соединенийС 1s22s22p2
C*…2s12p3
21
22.
Гибридизованные орбиталиобразуют -связи,
негибридные -связи
Поляризация связей
Определяется разницей в электроотрицательности атомов
F > O > Cl > N > Csp > Csp2 > Csp3 > H
Алканы неполярны из-за близкой электроотрицательности
атомов Csp3 и H. В молекулах других соединений
происходит перераспределение электронной плотности,
которое влияет на протекание реакций.
22
23.
Индуктивный эффект (I-эффект) – влияние заместителя наэлектронную плотность молекулы путем смещения электронов
-связей, вызванное разницей в электроотрицательности атомов,
образующих связи.
-I
+I
Знак эффекта определяется зарядом, который приобретает
заместитель.
Влияние заместителя быстро затухает и вызывает поляризацию
всего двух-трех -связей.
Индуктивный эффект проявляется во всех соединениях, в
которых разные по электроотрицательности атомы связаны
ковалентными -связями.
23
24.
Открытая сопряженная системаЗамкнутая сопряженная система
БУТАДИЕН-1,3
БЕНЗОЛ
24
25.
Мезомерный эффект или эффект сопряжения (М-эффект) – влияниезаместителя на электронную плотность молекулы, передаваемое по
сопряжённой системе путем смещения -электронов кратных связей или
неподелённых электронных пар гетероатомов; при этом влияние
заместителя передается без затухания по всей сопряжённой системе.
-M
+M
25
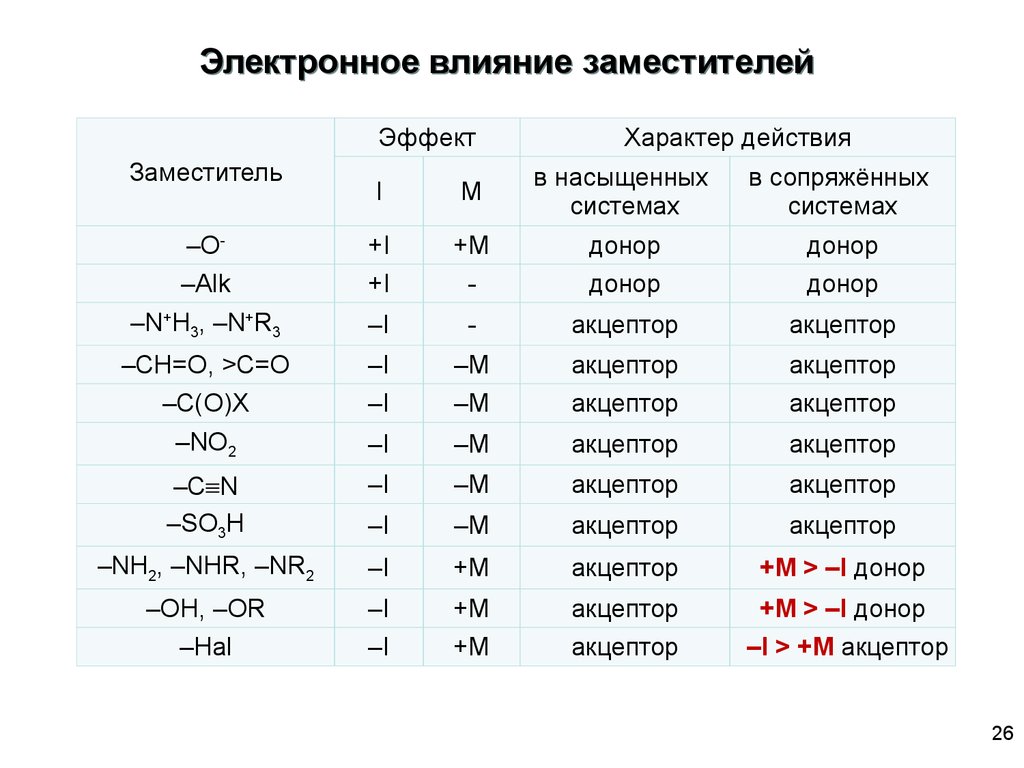
26.
Электронное влияние заместителейЭффект
Заместитель
Характер действия
I
M
в насыщенных
системах
в сопряжённых
системах
–O-
+I
+M
донор
донор
–Alk
+I
-
донор
донор
–N+H3, –N+R3
–I
-
акцептор
акцептор
–CН=O, >C=O
–C(O)X
–I
–I
–M
–M
акцептор
акцептор
акцептор
акцептор
–NO2
–I
–M
акцептор
акцептор
–C N
–SO3H
–I
–M
акцептор
акцептор
–I
–M
акцептор
акцептор
–NH2, –NHR, –NR2
–I
+M
акцептор
+М > –I донор
–OH, –OR
–I
+M
акцептор
+М > –I донор
–Hal
–I
+M
акцептор
–I > +М акцептор
26
















 chemistry
chemistry








