Similar presentations:
Углеводы. Стереохимия углеводов в проекциях Фишера
1.
Начала стереохимии.2.
УглеводыПервые из известных науке углеводов описывались брутто-формулой Cx(H2O)y –
вещества, состоящие, формально, из угля и воды. Термин ,,углеводы” был введен
профессором Тартуcского университета К. Шмидтом в 1844 г.
Источник углеводов – процесс фотосинтеза.
С точки зрения сегодняшних знаний о строении, углеводы (сахара) – это
многоатомные альдегидо- или кетоспирты и их производные.
«Родоночальник» – глицериновый альдегид.
H
O
OH
СН2OH
H
3.
Классификация моносахаридов (моноз)• С учетом
– природы карбонильной группы
• альдозы - содержащие альдегидную группу
• кетозы - содержащие кето-группу
– длины углеродной цепи (от 3 до 10 атомов)
триозы (глицериновый альдегид)
тетрозы
пентозы (альдопентозы, кетопентозы)
гексозы (альдогексозы, кетогексозы)
гептозы
октозы
нонозы
декозы
n=1-8
n=1-7
4.
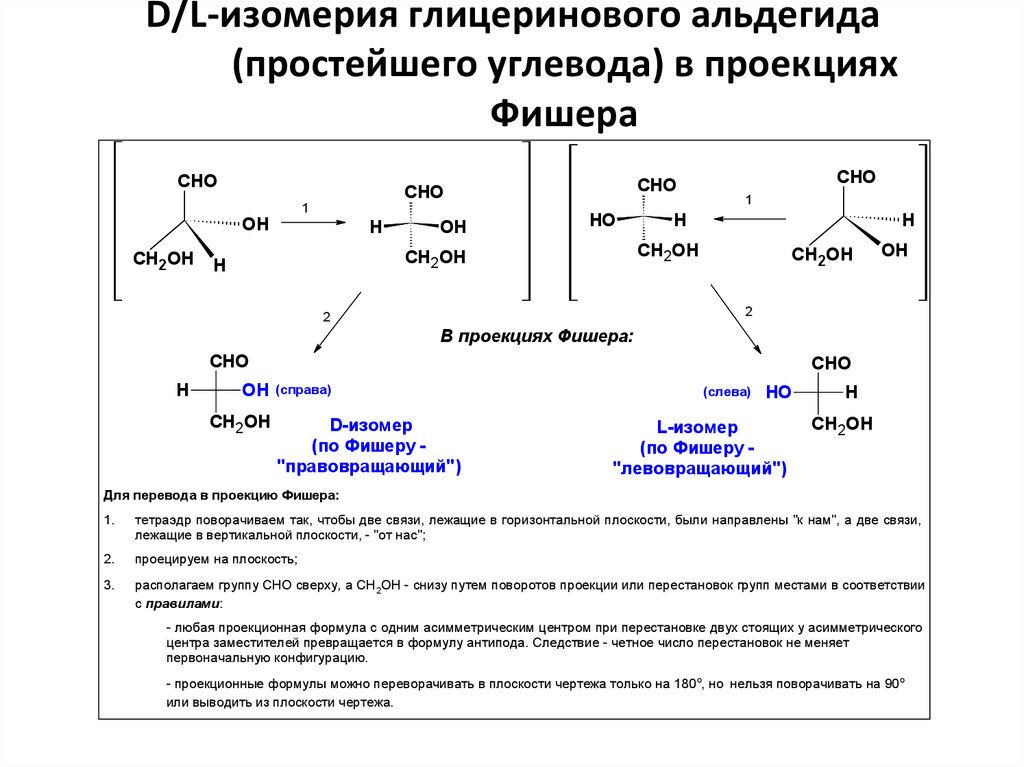
D/L-изомерия глицеринового альдегида(простейшего углевода) в проекциях
Фишера
CHO
1
OH
СН2OH
CHO
CHO
H
OH
HO
1
H
H
CH2OH
CH2OH
H
CHO
СН2OH
OH
2
2
В проекциях Фишера:
CHO
H
OH
CH2OH
CHO
(справа)
D-изомер
(по Фишеру "правовращающий")
(слева)
HO
L-изомер
(по Фишеру "левовращающий")
H
CH2OH
Для перевода в проекцию Фишера:
1.
тетраэдр поворачиваем так, чтобы две связи, лежащие в горизонтальной плоскости, были направлены "к нам", а две связи,
лежащие в вертикальной плоскости, - "от нас";
2.
проецируем на плоскость;
3.
располагаем группу CHO сверху, а СН2OH - снизу путем поворотов проекции или перестановок групп местами в соответствии
с правилами:
- любая проекционная формула с одним асимметрическим центром при перестановке двух стоящих у асимметрического
центра заместителей превращается в формулу антипода. Следствие - четное число перестановок не меняет
первоначальную конфигурацию.
- проекционные формулы можно переворачивать в плоскости чертежа только на 180 о, но нельзя поворачивать на 90о
или выводить из плоскости чертежа.
5.
Проекционные формулы ФишераЦепь молекулы с несколькими асимметрическими атомами располагают в пространстве
вертикально в виде равномерно выпуклой ломаной линии, обращенной выпуклостью к
наблюдателю. У альдоз сверху располагают альдегидную группу, а у кетоз – соседнюю с
карбонилом первичную спиртовую.
8
6.
Стереохимия углеводов в проекциях ФишераD-изомерный ряд
CHO
CHO
эта часть
определяет
принадлежность
изомерному
ряду
CHO
H
HO или Н
OH
H
CH2OH
OH или Н
HO или Н
OH или Н
HO или Н
OH или Н
OH
H
CH2OH
D-глицериновый
альдегид
OH
взаимное
расположение
ОН групп
определяет
название сахара
(см. след. слайд)
CH2OH
D-тетрозы
D-пентозы
L-изомерный ряд
CHO
CHO
HO
CHO
HO или Н
H
HO
CH2OH
L-глицериновый
альдегид
OH или Н
H
CH2OH
L-тетрозы
HO или Н
OH или Н
HO или Н
OH или Н
HO
H
CH2OH
L-пентозы
7.
Генетическое родство D-ряда альдоз c D-глицериновым альдегидомD(+)-аллоза
D(+)-альтроза
D(+)-глюкоза
D(+)-манноза
D(-)-гулоза
D(-)-идоза
D(+)-галактоза
D(+)-таллоза
8.
Энантиомеры Диастереомеры Эпимеры10/17/2021
9.
Эпимеры и диастереомерыальдопентозы
1
1
кетопентозы
5
D-рибоза
D-ксилоза
D-рибУЛоза
эпимеры
D-ксилУЛоза
эпимеры
кетогексозы
альдогексозы
1
1
6
D-манноза
D-глюкоза
D-галактоза
D-фруктоза
эпимеры
эпимеры
диастереомеры
Стереоизомеры -соединения, не являющиеся зеркальными отражениями друг друга. Если два стереоизомера имеют
противоположные конфигурации всех соответствующих стереоцентров, то они являются энантиомерами. Однако, если
конфигурация различается лишь у некоторых (а не у всех) стереоцентров, то такие стереизомеры являются
диастереомерами. Если стереомеры отличаются конфигурацией лишь одного стереоцентра, то они называются эпимерами.
10.
Некоторые пары стереоизомеров будут иметь противоположные конфигурациивсех соответствующих стереоцентров и являться, таким образом, энантиомерами.
Все остальные парные комбинации стереоизомеров будут различаться лишь
некоторыми конфигурациями, не являясь зеркальными отражениями друг друга.
Такие пары являются диастереомерами
10/17/2021
11.
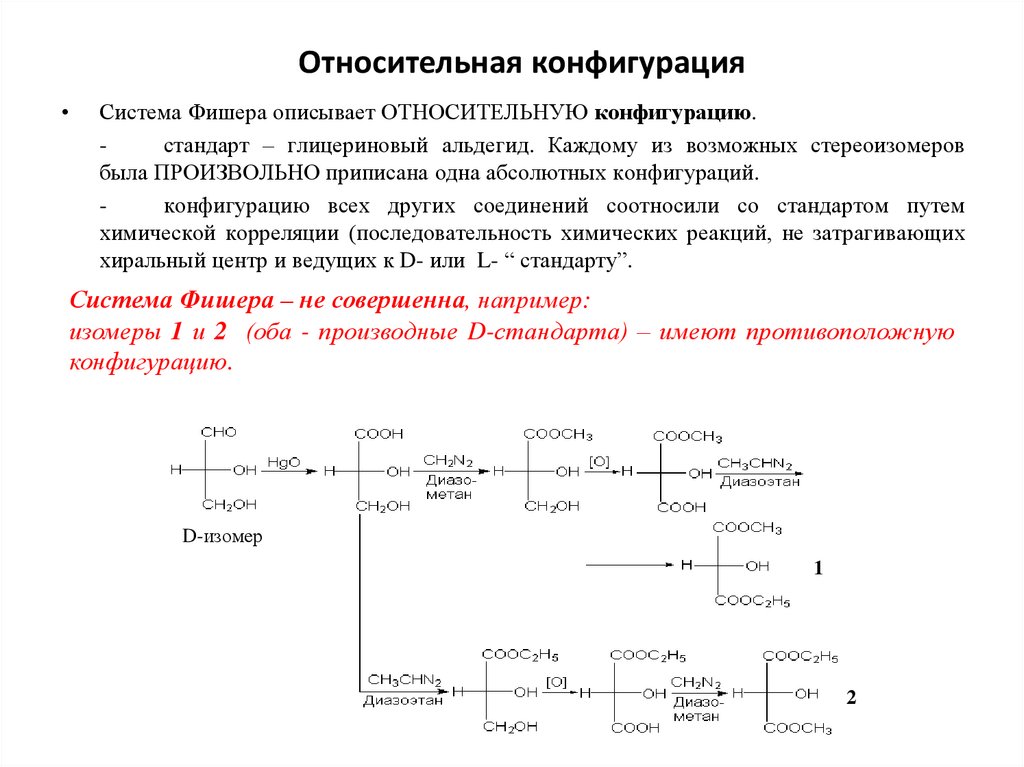
Относительная конфигурацияСистема Фишера описывает ОТНОСИТЕЛЬНУЮ конфигурацию.
стандарт – глицериновый альдегид. Каждому из возможных стереоизомеров
была ПРОИЗВОЛЬНО приписана одна абсолютных конфигураций.
конфигурацию всех других соединений соотносили со стандартом путем
химической корреляции (последовательность химических реакций, не затрагивающих
хиральный центр и ведущих к D- или L- “ стандарту”.
Система Фишера – не совершенна, например:
изомеры 1 и 2 (оба - производные D-стандарта) – имеют противоположную
конфигурацию.
D-изомер
1
2
12.
Абсолютные и относительные конфигурацииОтносительная конфигурация определяется химическими методами
D - ряд
CHO
H
COOH
COOH
OH
H
H
OH
CH2OH
CH2NH2
CH2OH
(+)-D-глицериновый
альдегид
OH
(-)-D-глицериновая
кислота
(+)-D-изосерин
COOH
H
OH
CH3
(-)-D-молочная
кислота
Абсолютная конфигурация определяется РСА (или теоретическим расчетом величины
оптического вращения) и описывается по системе К-И-П (R/S)
CHO
CHO
OH
СН2OH
H
R-изомер
HO
H
СН2OH
S-изомер
Если абсолютная конфигурация не известна, то в названии вещества указывают знак
оптического вращения
13.
Стереохимия (R/S и D/L-изомерия).Правила Кана-Ингольда-Прелога.
Cahn–Ingold–Prelog priority rules, CIP system or CIP conventions.
Полезная ссылка для понимания и обучения.
http://www.chem.msu.su/rus/teaching/butin/p4.html
14.
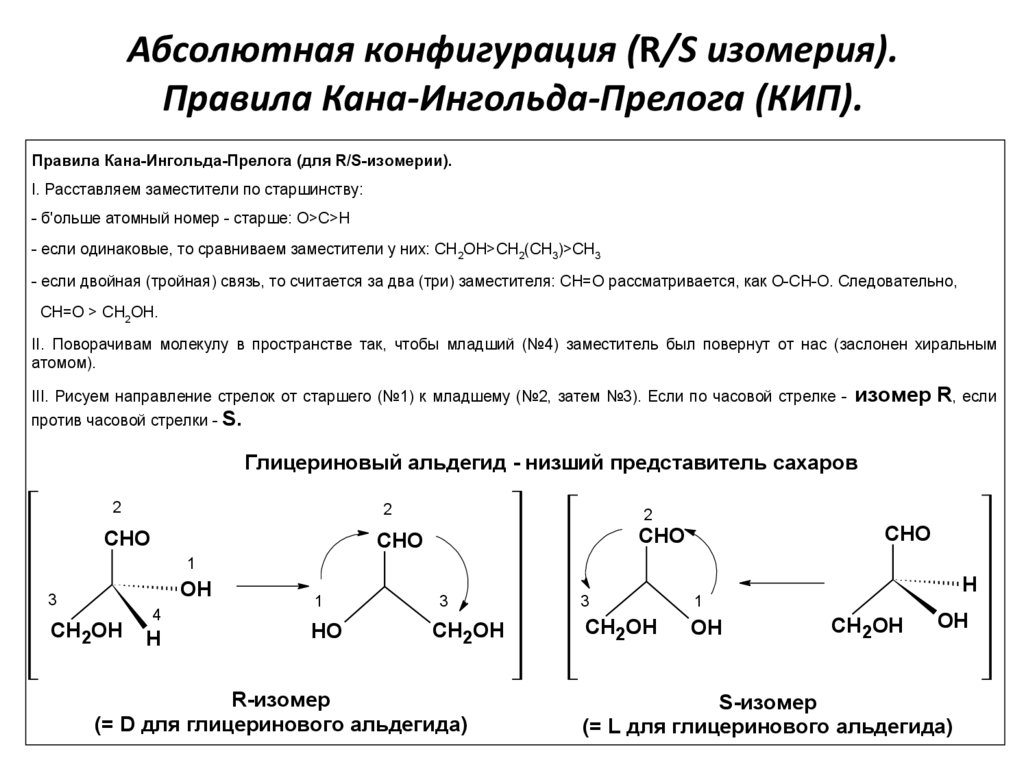
Абсолютная конфигурация (R/S изомерия).Правила Кана-Ингольда-Прелога (КИП).
Правила Кана-Ингольда-Прелога (для R/S-изомерии).
I. Расставляем заместители по старшинству:
- б'ольше атомный номер - старше: О>C>H
- если одинаковые, то сравниваем заместители у них: CH 2OH>СН2(СН3)>CH3
- если двойная (тройная) связь, то считается за два (три) заместителя: СН=О рассматривается, как О-СН-О. Следовательно,
СН=О > CH2OH.
II. Поворачивам молекулу в пространстве так, чтобы младший (№4) заместитель был повернут от нас (заслонен хиральным
атомом).
III. Рисуем направление стрелок от старшего (№1) к младшему (№2, затем №3). Если по часовой стрелке против часовой стрелки -
изомер R, если
S.
Глицериновый альдегид - низший представитель сахаров
2
2
CHO
2
CHO
CHO
CHO
1
OH
3
СН2OH
4
H
1
HO
3
СН2OH
R-изомер
(= D для глицеринового альдегида)
3
1
СН2OH
OH
H
СН2OH
OH
S-изомер
(= L для глицеринового альдегида)17
15.
D/L, R/S изомерия и оптическое вращениеВажно понимать:
1)Нет строгой корреляции между D/L и R/S изомерами
Для глицеринового
альдегида:
L-изомер = S
D-изомер = R
2)
Для цистеина:
D-изомер = S
L-изомер = R
Нет корреляции между D/L, R/S изомерами и знаком оптического вращения
COOH
H3C
H
COOH
H2N
D
L-изомер
COOMe
H3C
H
NH2
D
H
CH3
NH2
COOH
H3C
S-изомер
COOMe
H2N
NH2
COOMe
H
CH3
L-изомер
(-)-L-аланин
(-)-S-аланин
H3C
NH2
S-изомер
(+)-метиловый эфир L-аланина
(+)-метиловый эфир S-аланина
16.
Внутримолекулярная циклизацияR
H
OH
H+
O
+
R'
OH
R
полуацетальный
гидроксил
* O R'
H
полуацеталь
O
H
C
H
OH
(CH2OH)n
OH
H
C
H
H
гликозидный
гидроксил
(CH2OH)n
O
циклический
полуацеталь
*
H
новый
хиральный центр
(аномерный)
17.
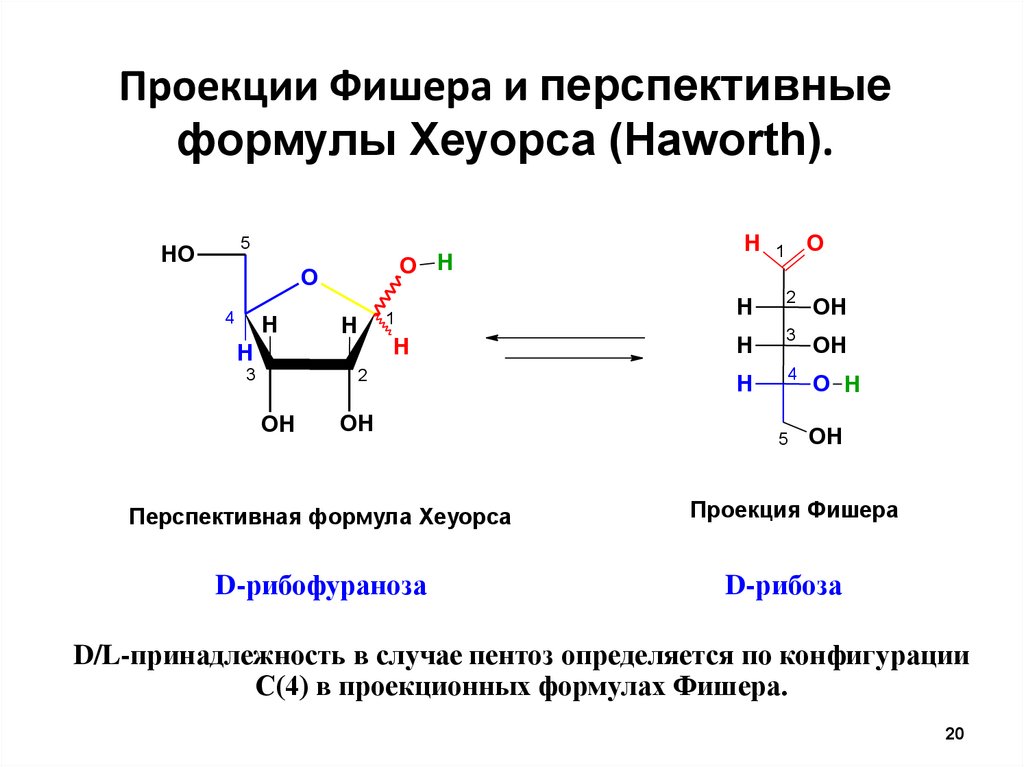
Проекции Фишера и перспективныеформулы Хеуорса (Haworth).
5
HO
O H
O
4
H
H
1
H
H
3
2
OH
OH
Перспективная формула Хеуорса
D-рибофураноза
H
O
1
H
2
OH
H
3
OH
H
4
O H
5
OH
Проекция Фишера
D-рибоза
D/L-принадлежность в случае пентоз определяется по конфигурации
С(4) в проекционных формулах Фишера.
20
18.
Перевод проекций Фишера в перспективныеформулы Хеуорса (Haworth) на примере D-глюкозы.
две перестановки заместителей в
положении 5
2
H
3
HO
4
H
H
5
1
O
OH
HO
1
OH
CH2OH
2
H
3
HO
H
OH
H
таутомерное
равновесие
4
H
HO
OH
H
2a
OH
5
H
3
HO
4
H
5
HO
H
2
H
H
CH2OH
1
2б
OH
H
OH
CH2OH
H
HO
H
HOH2C
Формула Хеуорса
1
H
2
3
4
5
6
OH
H
OH
H
O
1
O
H
O
Фишеровская проекция
3
H
4
OH
5
H
OH H
HO
3
H
2
OH
Для перевода проекции Фишера в формулу Хеуорса:
1.
Нарисовать связь между атомами 5-О и 1-С
2.
Согласно правилу, что четное число перестановок в проекции Фишера не меняет конфигурации, сделать две (!) перестановки у
атома 5-C так, чтобы в итоге кольцевая 5-C-O связь стала продолжением вертикальной линии снизу. Например, перестановки:
а) между СН2ОН и линией кольцевой 5-C - O связи; б) между СН2ОН и Н.
3.
O
При переводе в формулу Хеуорса:
- атом 1-С расположить справа в кольце;
- кислород в кольце должен быть в правом верхнем углу пиранозного цикла и направлен "от нас". С-С связи в кольце
выделяются жирными линиями - для обозначения пространственной перспективы.
- группы, расположенные справа от вертикальной линии в проекции Фишера, нужно помещать снизу от плоскости кольца, а
расположенные слева - сверху.
1
OH
H
19.
Перевод проекций Фишера в перспективныеформулы Хеуорса (Haworth) на примере D-рибозы.
две перестановки заместителей в
положении 4
2
H
3
H
4
H
5
1
O
HO
1
OH
2
H
3
H
OH
OH
H
таутомерное
равновесие
CH2OH
Открытая форма
(цепочка) -
OH
HO
2a
OH
4
H
5
CH2OH
H
H
H
1
H
2
3
4
OH
OH
CH2OH
5
HO
2б
H
H
HOH2C
Формула Хеуорса
1
HO
H
2
3
4
OH
OH
H
5
3
O H
O
4
O
1
O
H
O
Фишеровская проекция
1
H
H
H
H
3
2
5
OH
OH
Кольцо
доминирующая форма
в незамещенных по
1-О (1-ОН) пентозах
Для перевода проекции Фишера в формулу Хеуорса:
1.
Нарисовать связь между атомами 4-О и 1-С
2.
Согласно правилу, что четное число перестановок в проекции Фишера не меняет конфигурации, сделать две (!) перестановки у
атома 4-C так, чтобы в итоге кольцевая 4-C-O связь стала продолжением вертикальной линии снизу. Например, перестановки:
а) между СН2ОН и линией кольцевой 4-C - O связи; б) между СН2ОН и Н.
3.
При переводе в формулу Хеуорса:
- атом 1-С расположить справа в кольце;
- кислород в кольце должен быть направлен "от нас". С-С связи в кольце выделяются жирными линиями - для
пространственной перспективы.
обозначения
- группы, расположенные справа от вертикальной линии в проекции Фишера, нужно помещать снизу от плоскости кольца, а
расположенные слева - сверху.
22
20.
Сравнение конфигураций D- и L-рибоз в формулахХеуорса.
L-рибоза
HO
4
5
OH
H
H
H
CH2OH
HO
HO
2
3
4
5
H
1
H
O
HO
3
1
H
O
HO
2
O
2
HO
H
HO
H
HOH2C
H
3
4
HO
H
HO
H
H
2
3
4
H
OH
H
4
O
OH
H
2
CH2OH
HO
5
5
5
CH2OH
1
H
OH
O
1
H
1
H
HO
O H
3
H
H
поворот вокруг оси
5
5
O
O
HO
H
OH
HO
1
H
4
H
H
2
4
H
H
3
OH
L-рибофураноза
H
H
3
OH
OH
1
OH
2
OH
D-рибофураноза
оптические антиподы
23
21.
Изомерия аномерного центра на примере D-рибозы.1
2
H
3
H
4
H
1
O
HO
H
OH
5
3
H
OH
OH
2
таутомерное
равновесие
5
HO
H
OH
4
H
OH
4
H
3
CH2OH
1
H
H
H
5
CH2OH
OH
O
O
H
OH
2
OH
Кольцо
Цепочечная форма
-D-рибофураноза
D-рибоза
появление нового
хирального цeнтра 1
изомерия по 1
(аномерному) положению:
смесь двух
изомеров
(аномеров)
О-гликозидная связь
HO
5
OH
HO
5
O
1
3
OH
-аномер: 1-ОH - в ту же
O
4
2
1
4
-D-рибофураноза
сторону, что и 5
-аномер: 1-OH - в
3
OH
В рибофуранозе можно
(формально!) определять в
перспективных формулах:
OH
2
OH
противоположную 5
OH
-D-рибофураноза
24
22.
R/S изомерия. Правила Кана-Ингольда-Прелога. Еще раз…Рассматриваем молекулу (часть молекулы с хиральным центром и его заместителями) в
пространстве.
Расставляем нумерацию у атомов, соединенных с хиральным центром по правилам старшинства:
- б'ольше атомный номер - старше: S > O > N > C > H
- если одинаковые, то сравниваем заместители у них: CH2OH>СН2(СН3)>CH3 ;СН2SH>COOH
- если опять одинаковые, то последовательно идем по цепочке дальше, пока не появятся различия
- если появляется раздвоение в цепочке, то идти по той, в которой появится «старший» атом
- если двойная (тройная) связь, то считается за два (три) заместителя: СН=О рассматривается, как
О-СН-О, следовательно: СООН > СН=О > CH2OH.
Поворачивам молекулу в пространстве так, чтобы младший заместитель был повернут от нас
(заслонен хиральным атомом).
Рисуем направление стрелок от старшего (№1) к младшему (№2, затем №3). Если вправо (по
часовой стрелке) - изомер R, если влево (против часовой стрелки) - S
23.
R/S изомерия.H
5
4
HO
OH
O
4
1
3
2
H
OH
OH
OH
H
1.изображаем
конфигурацию С(4)
в пространстве
1
4
2.определяем
старшинство
заместителей
C(4)
3
3."разворачиваем"
тетраэдр так, чтобы
младший смотрел "от
нас" = был заслонен
хиральным центром
3 C(5)
O(4)
C(5)
3
на
C(5)
5. рисуем стрелки от
старшего к младшему
2
С(3)
H
4. проецируем
плоскость
C(4)
1
O(4)
2
C(4)
С(3)
1
O(4)
2 С(3)
С(2)
H
OH
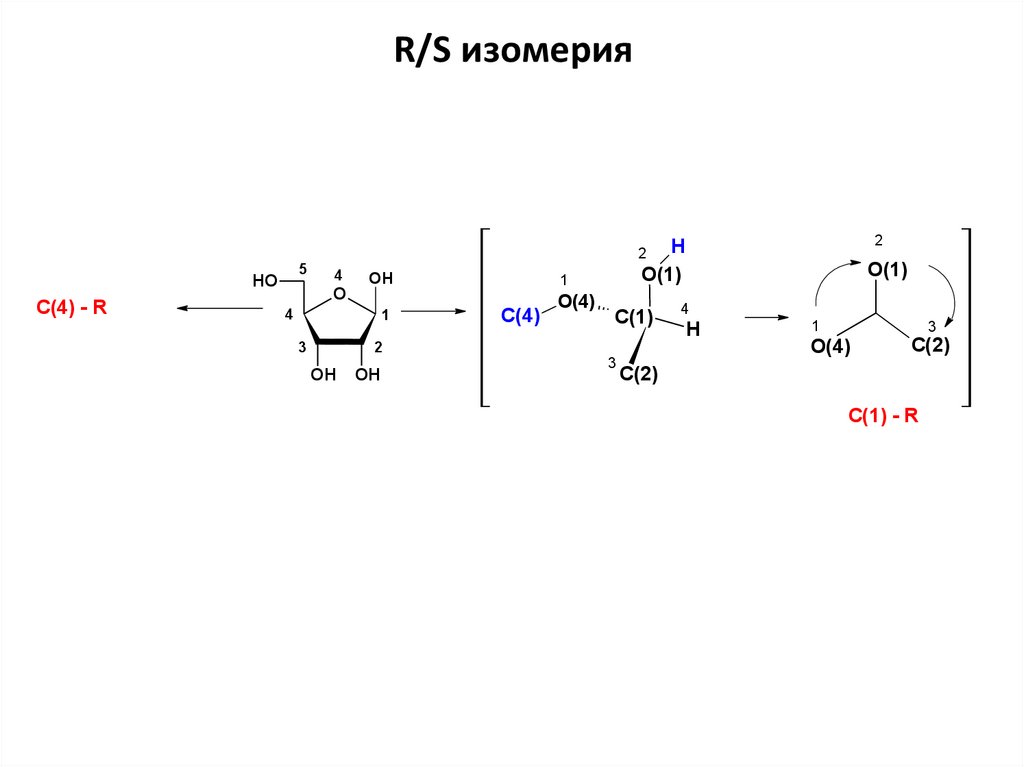
по часовой = R
C(4) - R
24.
R/S изомерия2
H
O(1)
2
5
HO
C(4) - R
4
O
OH
4
1
1
С(4)
O(4)
С(1)
2
3
OH
OH
3
O(1)
4
H
1
3
O(4)
C(2)
С(2)
C(1) - R
25.
R/S изомерия1
4
O(2)
H
H
2
3
(4)C
C(1) H
С(2)
С(3)
O(1)
O(4)
1
O(3)
2
3
C(3)
C(1)
O(2)
C(2) - R
5
HO
C(4) - R
4
O
OH
4
1
2
3
OH
OH
C(1) - R
26.
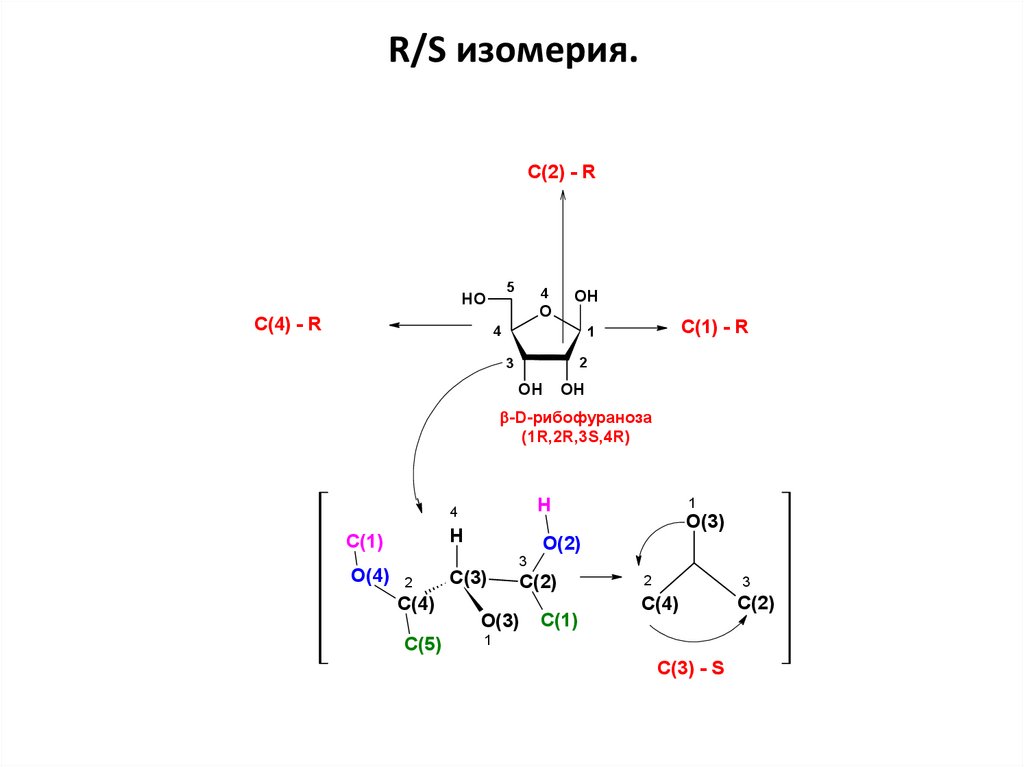
R/S изомерия.C(2) - R
5
HO
C(4) - R
4
O
OH
4
C(1) - R
1
2
3
OH
OH
-D-рибофураноза
(1R,2R,3S,4R)
H
4
H
C(1)
O(4)
2
C(4)
C(5)
1
O(3)
O(2)
С(3)
3
O(3)
C(2)
C(1)
2
3
C(4)
1
C(3) - S
C(2)
27.
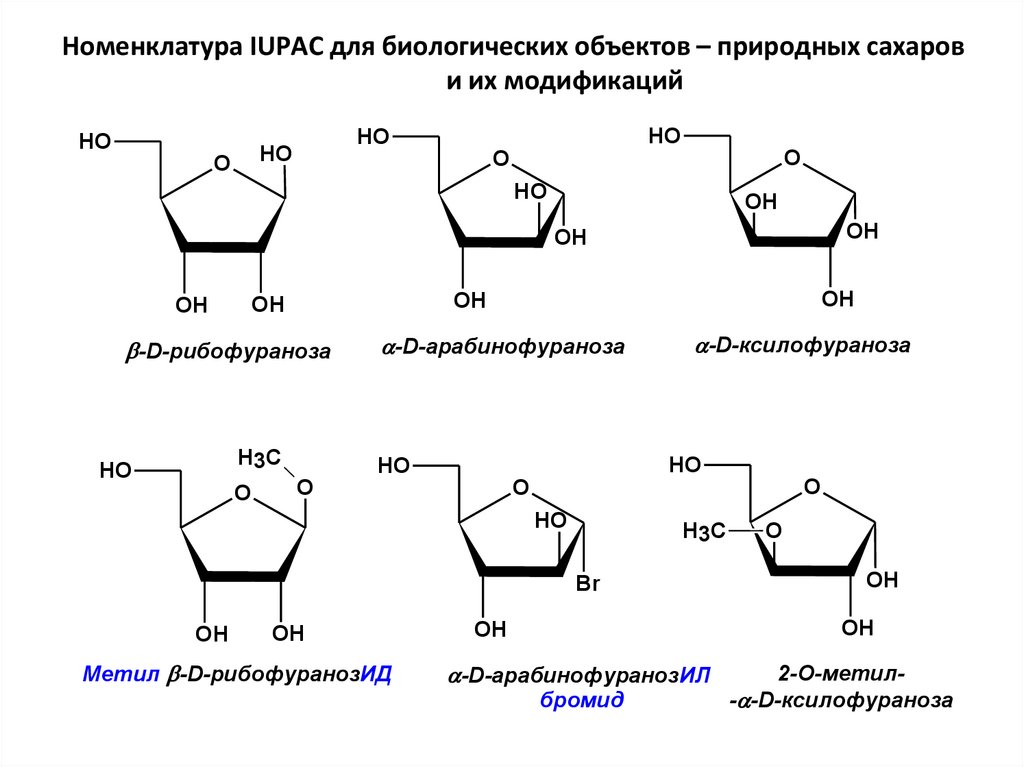
Номенклатура IUPAC для биологических объектов – природных сахарови их модификаций
HO
O
HO
HO
HO
O
O
HO
OH
OH
OH
OH
-D-рибофураноза
H3C
O
O
HO
OH
OH
OH
-D-арабинофураноза
-D-ксилофураноза
HO
HO
O
O
HO
H3C
Br
OH
OH
Метил -D-рибофуранозИД
O
OH
OH
OH
-D-арабинофуранозИЛ
бромид
2-О-метил- -D-ксилофураноза
28.
Номенклатура IUPAC для биологических объектов – природных сахарови их модификаций
5
HO
HO
HO
O
4
-D-рибофураноза
O
4
5
O
4
3
F
2-фтор-2-дезокси- -D-рибофураноза
("рибо" - обозначает, что F направлен в
ту же сторону, что и 2-OH в рибозе)
-D-ксилофураноза
HO
HO
5
O
1
F
2
3
OH
OH
-D-арабинофураноза
HO
1
2
3
OH
5
HO
1
OH
2
3
OH
OH
4
1
HO
2
3
HO
4
HO
O
HO
O
1
5
HO
5
2
OH
2-фтор-2-дезокси- -D-арабинофураноза
("арабино" - обозначает, что F направлен в
ту же сторону, что и 2-OH в арабинозе)
4
HO
OH H3C
1
2
3
F
2-фтор-2-метил-2-дезокси- -D-ксилофураноза
("ксило" - обозначает, что F, как
старший по сравнению с метилом,
направлен в ту же сторону, что и
2-OH в ксилозе)
Если есть какая-то неоднозначность в присвоении названия сахару, то указывают
конфигурацию R или S для хиральных центров.
29.
Номенклатура IUPAC(для органических соединений)
• Глюкоза:
(3R,4S,5S,6R)-tetrahydro-6-(hydroxymethyl)-2Hpyran-2,3,4,5-tetraol
• Галактоза
(3R,4S,5R,6R)-tetrahydro-6-(hydroxymethyl)2H-pyran-2,3,4,5-tetraol.






















 chemistry
chemistry








