Similar presentations:
Реакции окисления и восстановления органических соединений
1. Реакции окисления и восстановления органических соединений
2.
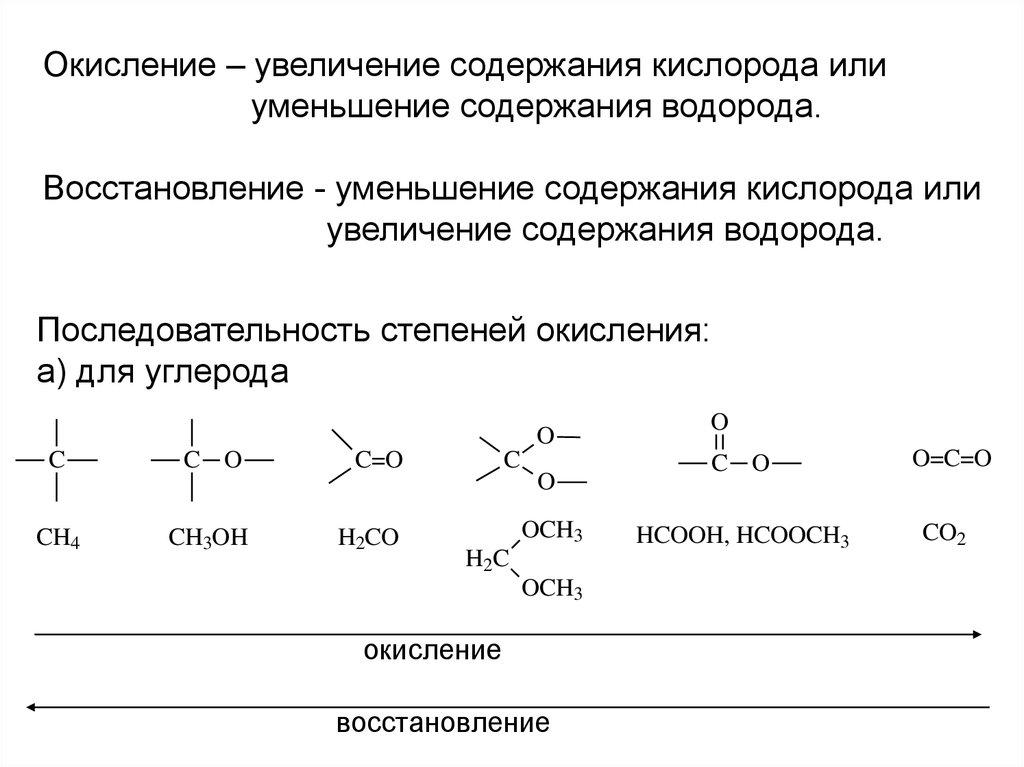
Окисление – увеличение содержания кислорода илиуменьшение содержания водорода.
Восстановление - уменьшение содержания кислорода или
увеличение содержания водорода.
Последовательность степеней окисления:
а) для углерода
O
C
C O
C=O
CH4
CH3OH
H2CO
C
O
OCH3
H2C
OCH3
окисление
восстановление
O
C O
HCOOH, HCOOCH3
O=C=O
CO2
3.
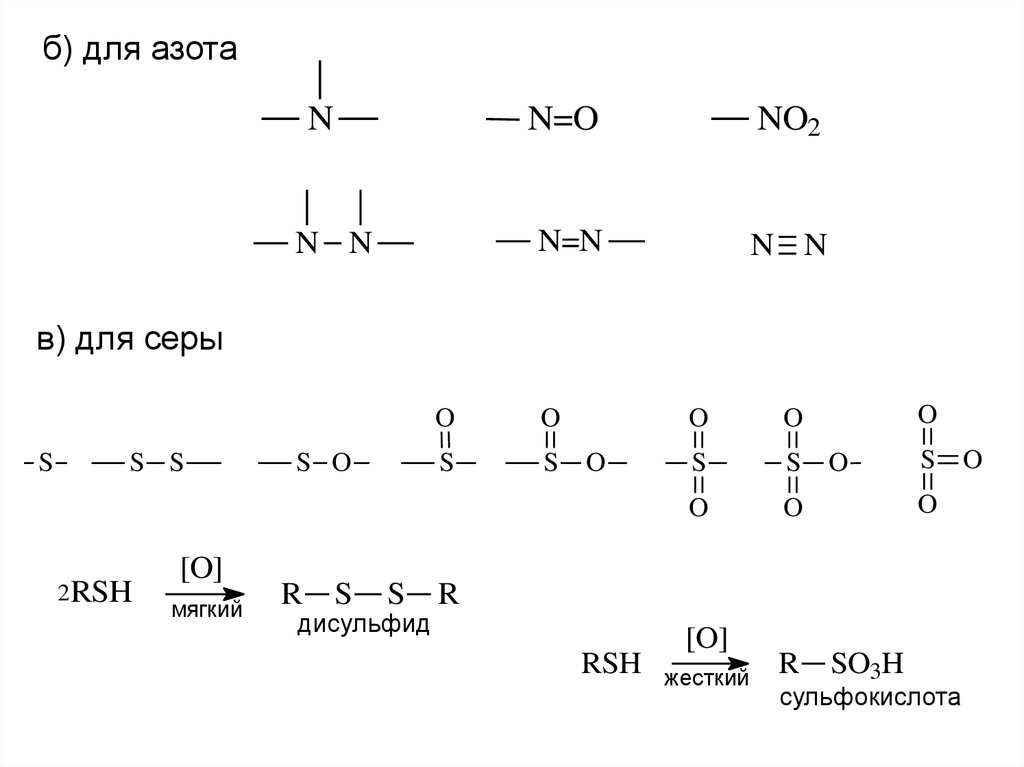
б) для азотаN
N N
N=O
NO2
N=N
N N
в) для серы
S
S S
2RSH
[O]
мягкий
S O
R
S
S
дисульфид
O
O
S
S
O
O
O
S
S
O
O
O
O
S
O
R
RSH
[O]
жесткий
R
SO3H
сульфокислота
O
4.
ОкислителиВосстановители
O2, O3, MnО2, KMnO4, CrO3,
K2Cr2O7, HClO4, HIO4, H2O2,
H2O2 + FeCl3, HNO3, H2SO4,
C6H5NO2, Hal2,
орг. гидроперекиси
H2(kat), Me, Na/NH3, Fe/HCl,
Sn/HCl, H2S, NaHS, (NH4)2S,
HI, LiH, LiAlH4, NaBH4,
гидрохинон, аскорбиновая
кислота
5.
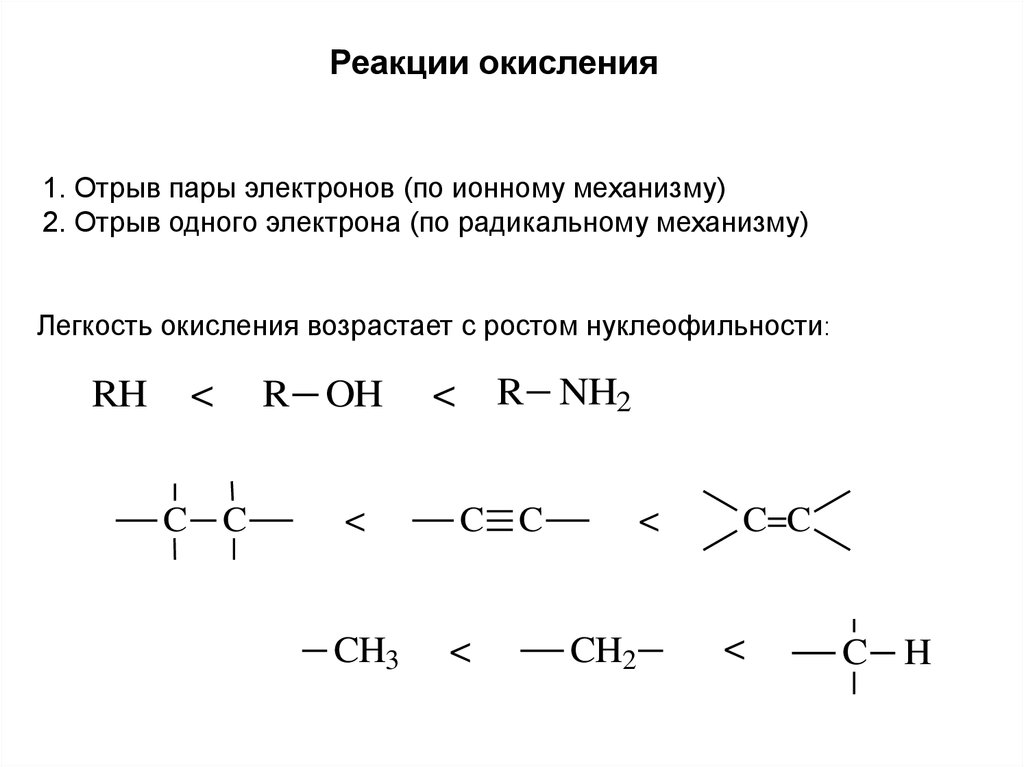
Реакции окисления1. Отрыв пары электронов (по ионному механизму)
2. Отрыв одного электрона (по радикальному механизму)
Легкость окисления возрастает с ростом нуклеофильности:
RH
<
C C
R OH
<
CH3
R NH2
<
C C
<
<
CH2
C=C
<
C H
6.
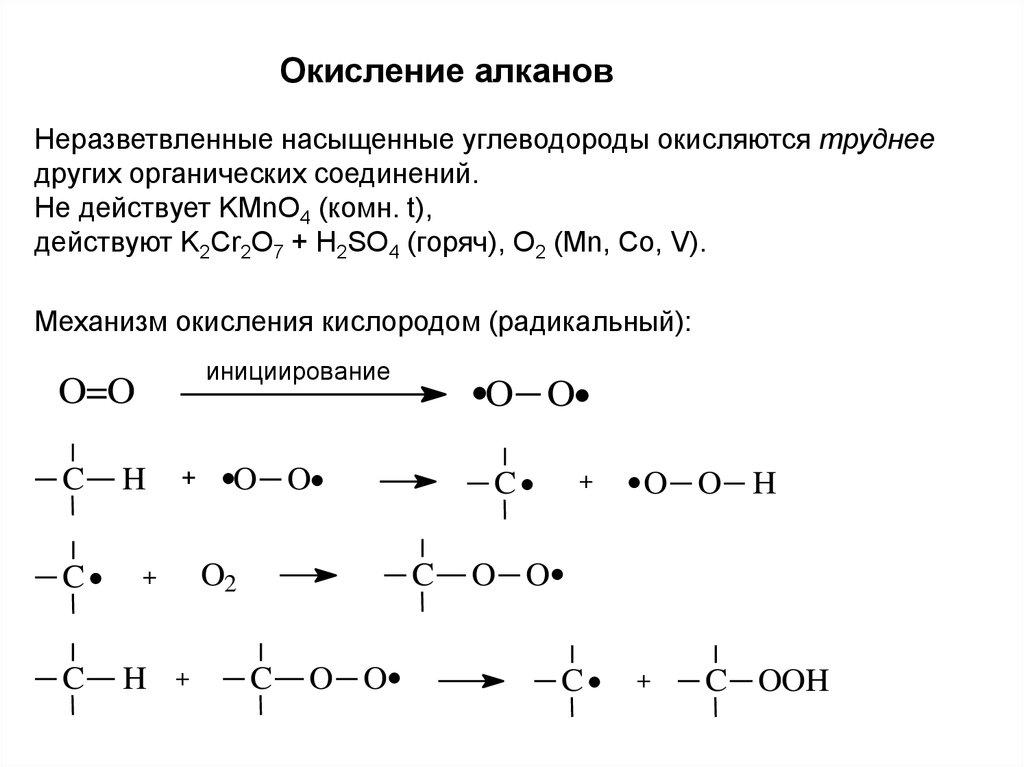
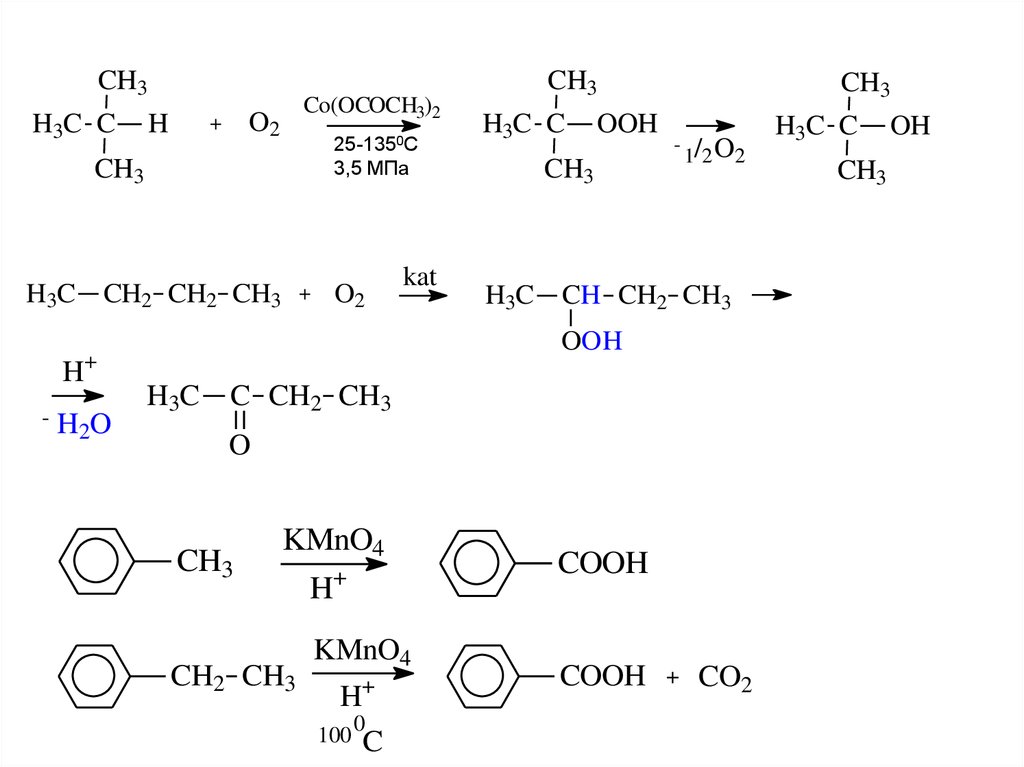
Окисление алкановНеразветвленные насыщенные углеводороды окисляются труднее
других органических соединений.
Не действует KMnO4 (комн. t),
действуют K2Cr2O7 + H2SO4 (горяч), O2 (Mn, Co, V).
Механизм окисления кислородом (радикальный):
инициирование
O=O
C
C
C
H
+
H
O O
O2
+
+
O O
C
C
C
O O
+
O O H
O O
C
+
C OOH
7.
CH3H3C C
H
Co(OCOCH3)2
O2
+
25-1350С
3,5 МПа
CH3
H3C
CH2 CH2 CH3
O2
+
kat
-
H2O
H3C C
OOH
CH3
-
CH3
H3C
1/2 O2
CH CH2 CH3
OOH
+
H
CH3
H3C
C CH2 CH3
O
CH3
KMnO4
CH2 CH3
+
H
KMnO4
+
H
100
0
C
COOH
COOH
+
CO2
H3C C
CH3
OH
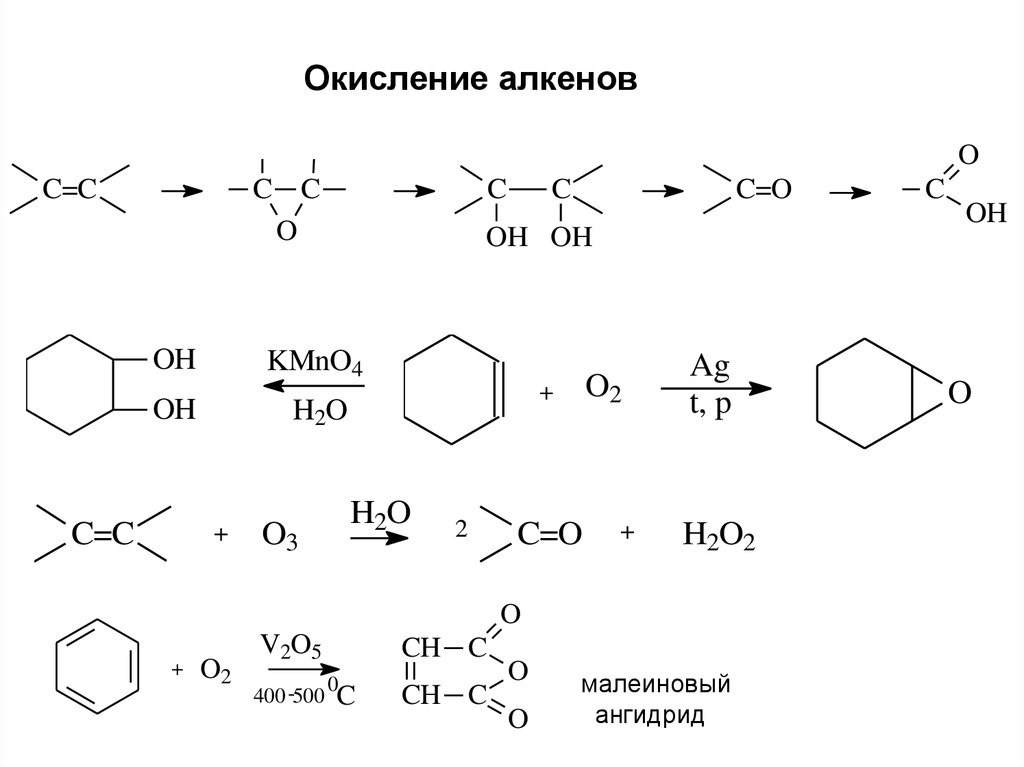
8.
Окисление алкеновO
C=C
C C
O
C
KMnO4
OH
H2O
+
O3
C=O
OH OH
OH
C=C
C
O2
+
H2O
2
C=O
+
Ag
t, p
H2O2
O
+
O2
V2O5
CH C
0
400 -500 C
CH C
O
O
малеиновый
ангидрид
C
OH
O
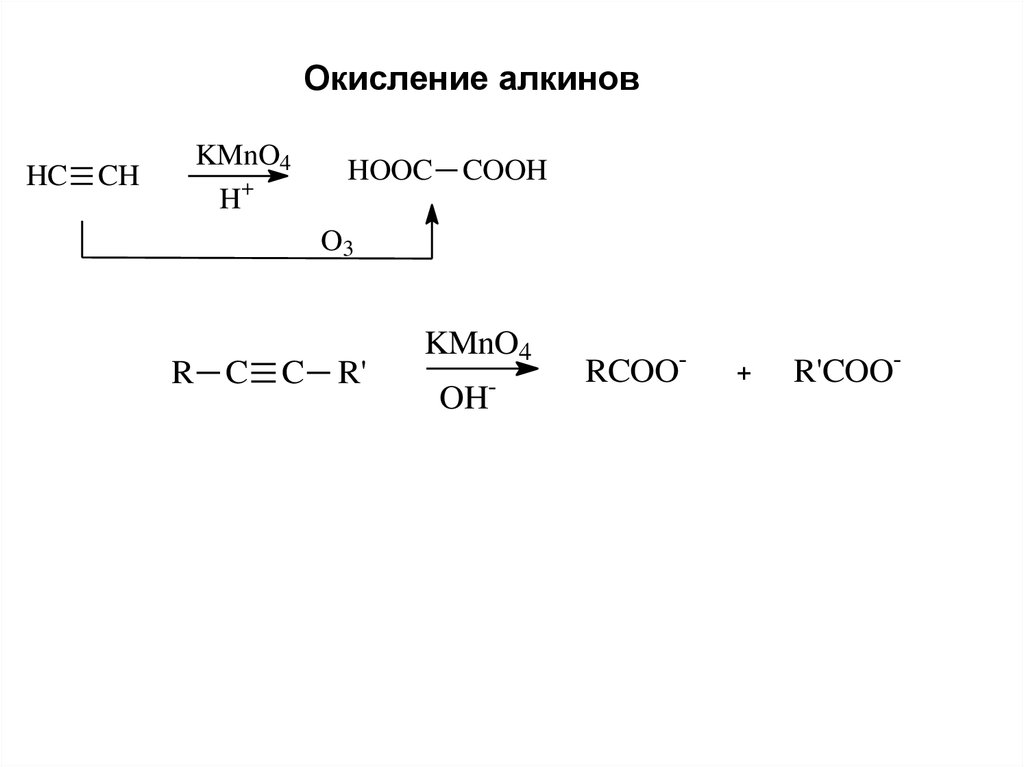
9.
Окисление алкиновHC
CH
KMnO4
H+
HOOC
COOH
O3
R C C
R'
KMnO4
OH-
RCOO-
+
R'COO-
10.
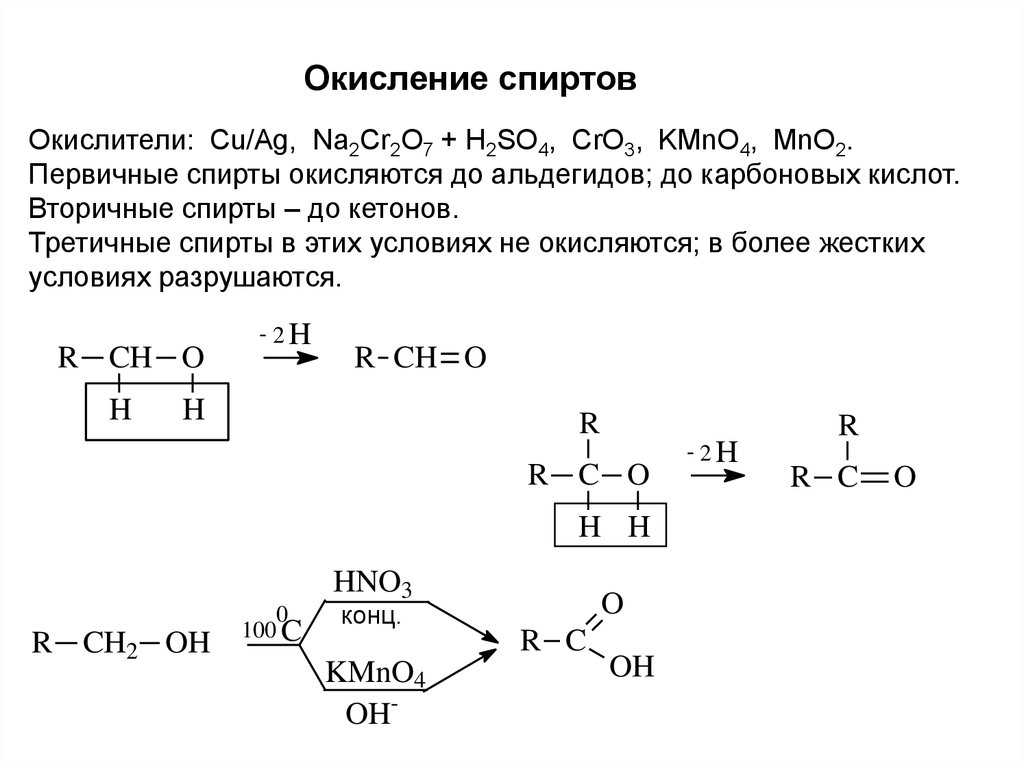
Окисление спиртовОкислители: Cu/Ag, Na2Cr2O7 + H2SO4, CrO3, KMnO4, MnO2.
Первичные спирты окисляются до альдегидов; до карбоновых кислот.
Вторичные спирты – до кетонов.
Третичные спирты в этих условиях не окисляются; в более жестких
условиях разрушаются.
R CH O
H
- 2H
R CH O
H
R
R C O
H H
HNO3
R CH2 OH
0
100 C
O
конц.
R C
KMnO4
OH-
OH
- 2H
R
R C
O
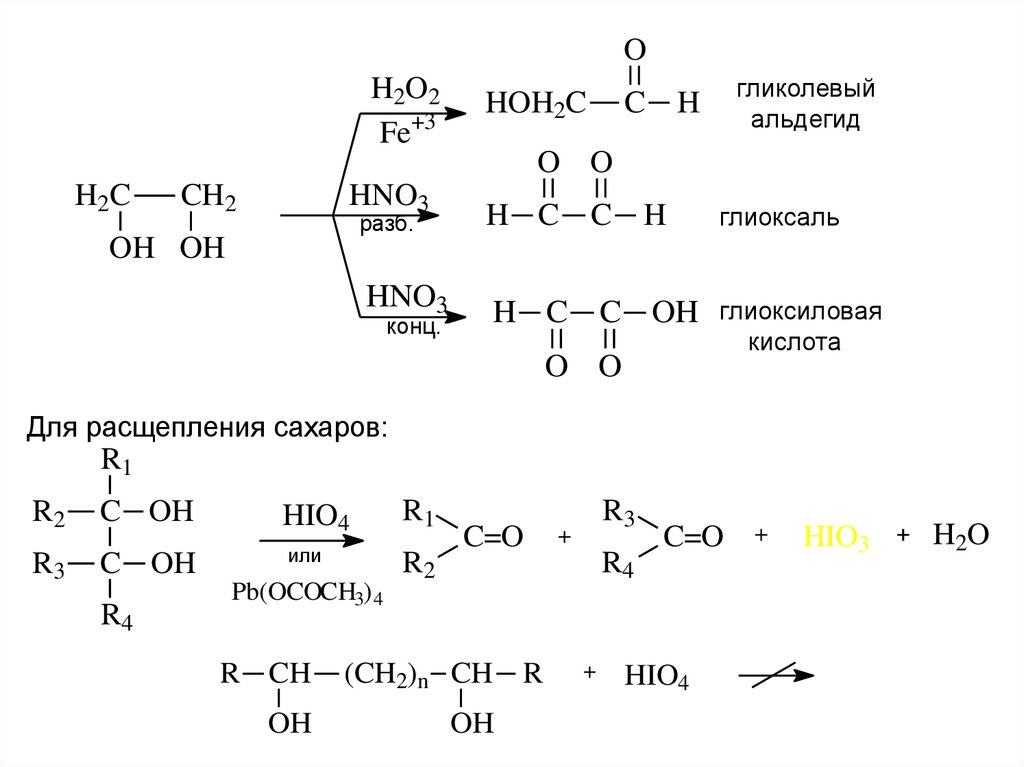
11.
OH2O2
Fe+3
HOH2C
гликолевый
альдегид
C H
O O
H2C
CH2
HNO3
разб.
H C C H
глиоксаль
OH OH
HNO3
конц.
H C C OH глиоксиловая
кислота
O O
Для расщепления сахаров:
R1
R2
R3
C OH
HIO4
R1
C OH
или
R2
R4
Pb(OCOCH3) 4
R CH
OH
C=O
(CH2)n CH R
OH
R3
+
R4
+
C=O
HIO4
+
HIO3
+
H2O
12.
HOOH
[O]
Cr2O7-2
O
O
13.
Окисление простых эфировОкисляются на свету кислородом воздуха до гидропероксидов:
CH3CH2OCH2CH3
O O
CH3CHOCH2CH3
OOH
Проверка: KI (водн.), в случае наличия пероксидов обрабатывают
FeSO4*7H2O.
14.
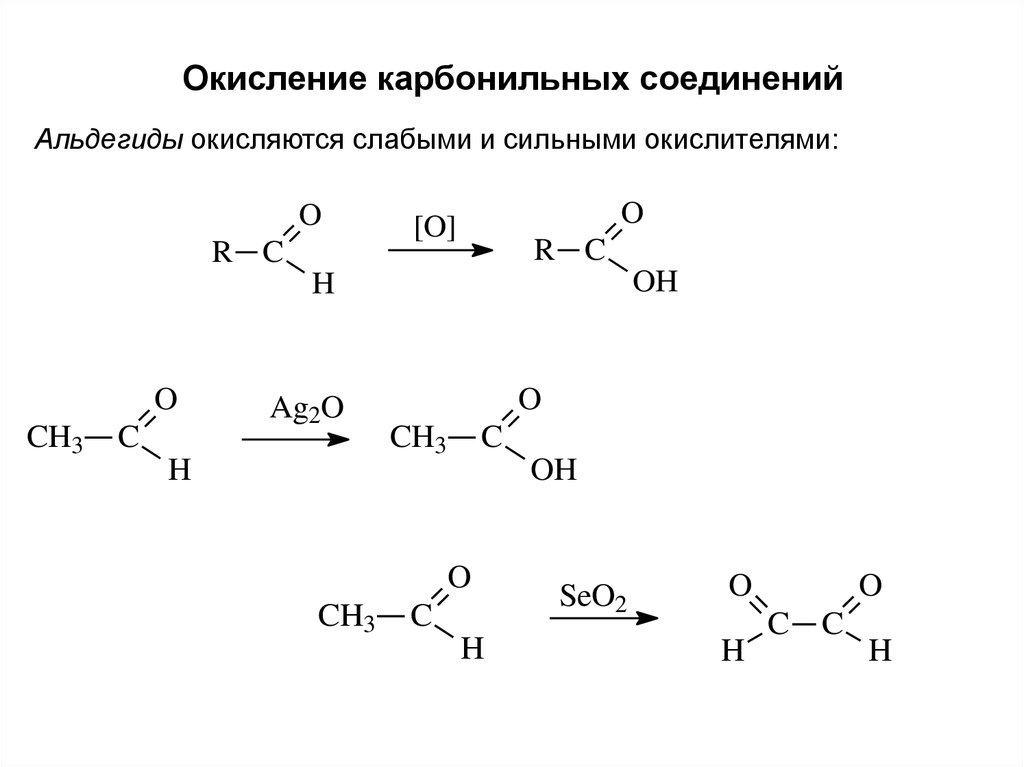
Окисление карбонильных соединенийАльдегиды окисляются слабыми и сильными окислителями:
O
R C
O
[O]
R C
OH
H
O
CH3
C
Ag2O
H
O
CH3
C
OH
O
CH3
C
H
SeO2
O
H
O
C C
H
15.
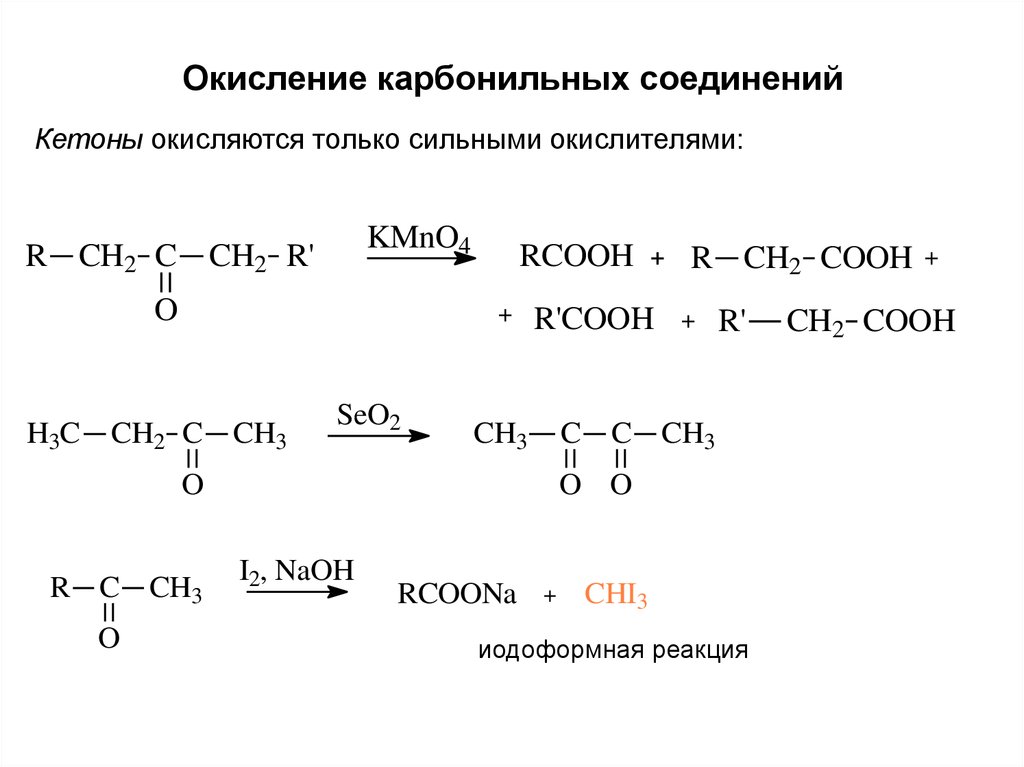
Окисление карбонильных соединенийКетоны окисляются только сильными окислителями:
KMnO4
R CH2 C CH2 R'
O
H3C
RCOOH
+
CH2 C CH3
SeO2
R'COOH
CH3
O
R CH2 COOH
+
R'
C C CH3
O
R C CH3
+
O O
I2, NaOH
RCOONa
+
CHI3
иодоформная реакция
+
CH2 COOH
16.
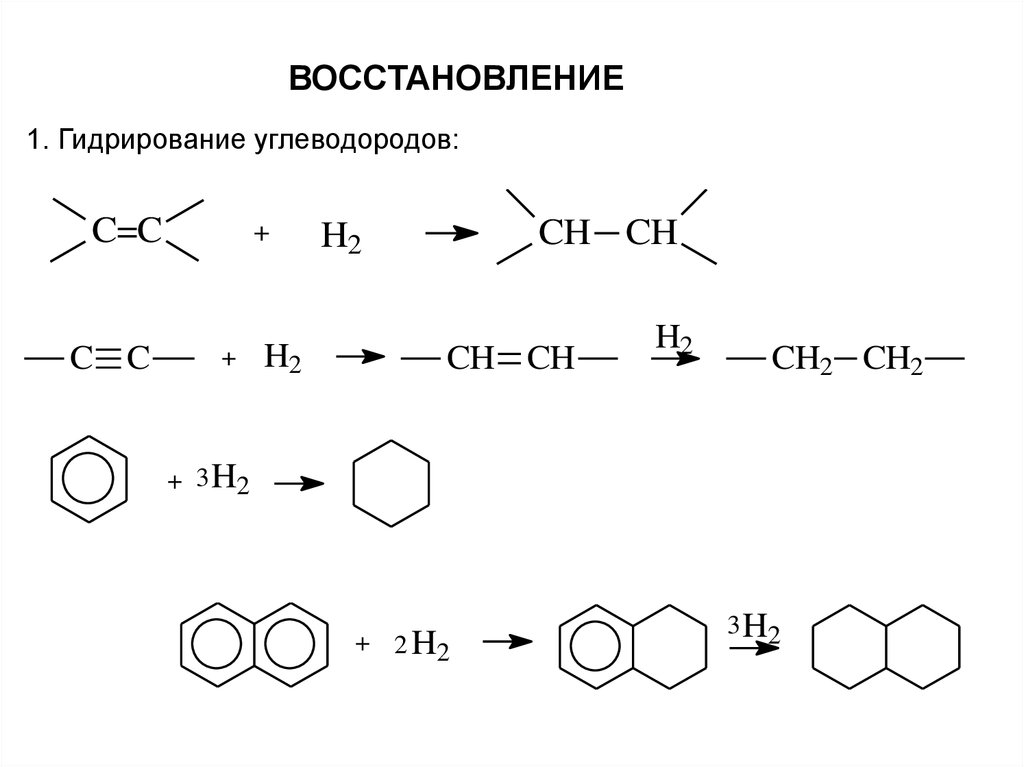
ВОССТАНОВЛЕНИЕ1. Гидрирование углеводородов:
C=C
C C
+
+
H2
CH CH
H2
CH CH
H2
CH2 CH2
+ 3 H2
+ 2 H2
3 H2
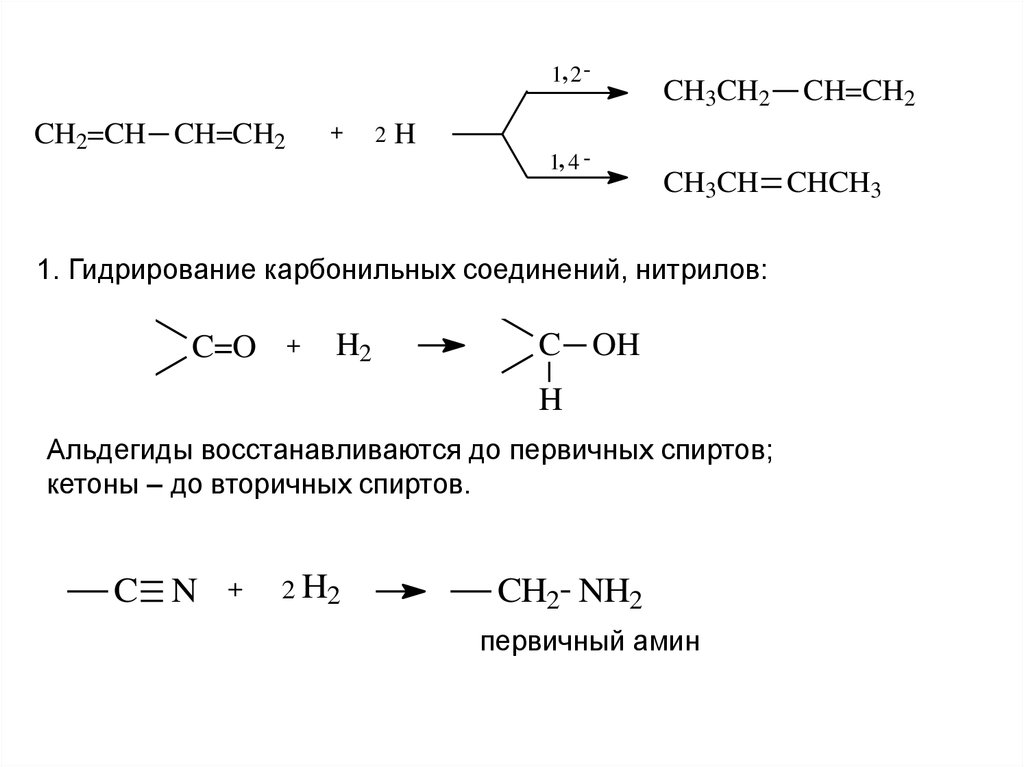
17.
1, 2 -CH2=CH CH=CH2
+
2
H
1, 4 -
CH3CH2
CH3CH CHCH3
1. Гидрирование карбонильных соединений, нитрилов:
C=O
+
H2
C OH
H
Альдегиды восстанавливаются до первичных спиртов;
кетоны – до вторичных спиртов.
C N
+
2 H2
CH=CH2
CH2 NH2
первичный амин
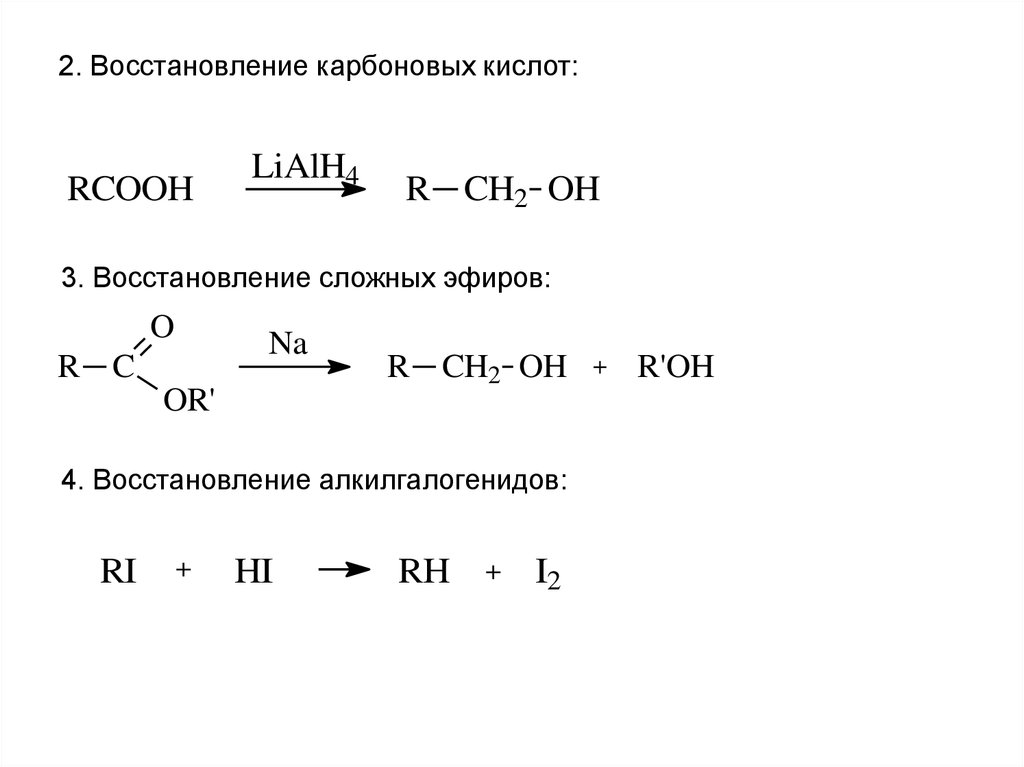
18.
2. Восстановление карбоновых кислот:RCOOH
LiAlH4
R CH2 OH
3. Восстановление сложных эфиров:
O
Na
R C
OR'
R CH2 OH
4. Восстановление алкилгалогенидов:
RI
+
HI
RH
+
I2
+
R'OH
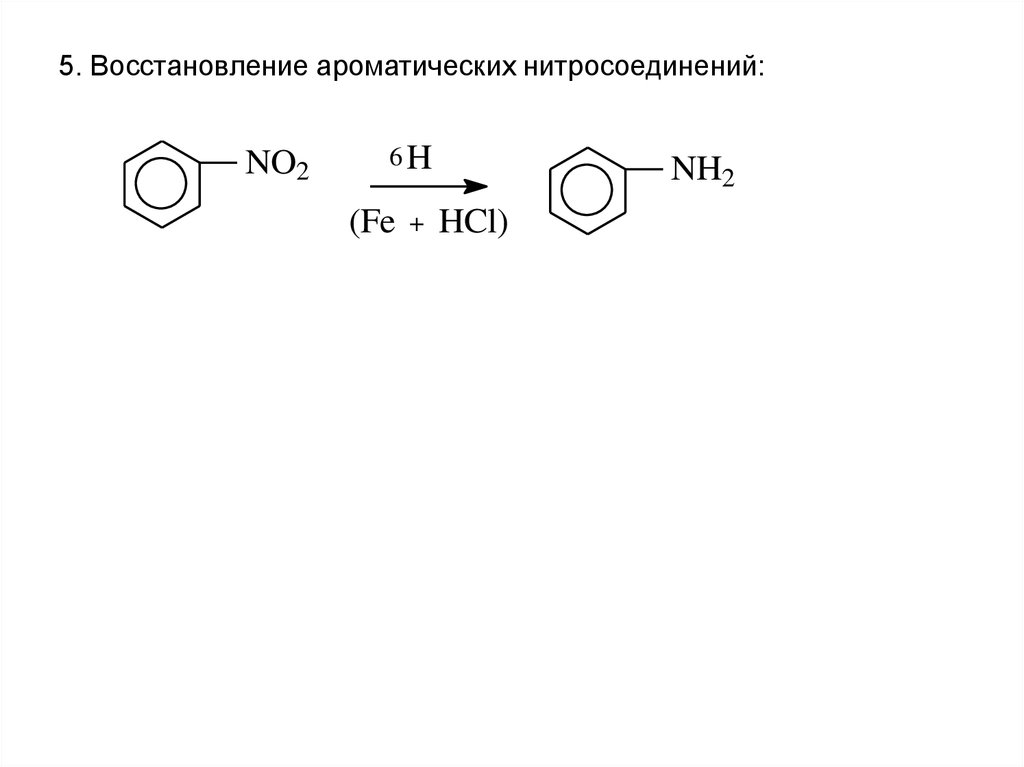
19.
5. Восстановление ароматических нитросоединений:NO2
6H
(Fe
+
NH2
HCl)
20.
Биологически важныеокислительно-восстановительные реакции
1. Окислительно-восстановительная система хинон-гидрохинон:
O
OH
[H]
[O]
O
хинон
окислитель
OH
OH
гидрохинон
восстановитель
OH
[O]
[H]
O
O
21.
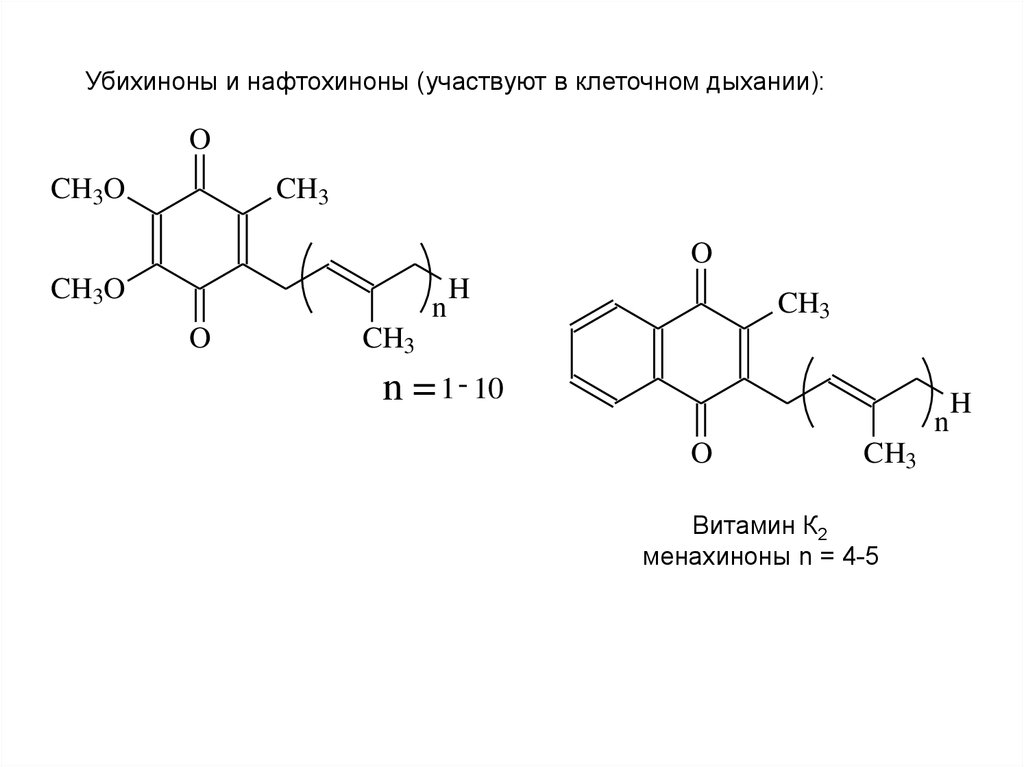
Убихиноны и нафтохиноны (участвуют в клеточном дыхании):O
CH3O
CH3
O
CH3O
n
O
H
CH3
CH3
n = 1 - 10
n
O
CH3
Витамин К2
менахиноны n = 4-5
H
22.
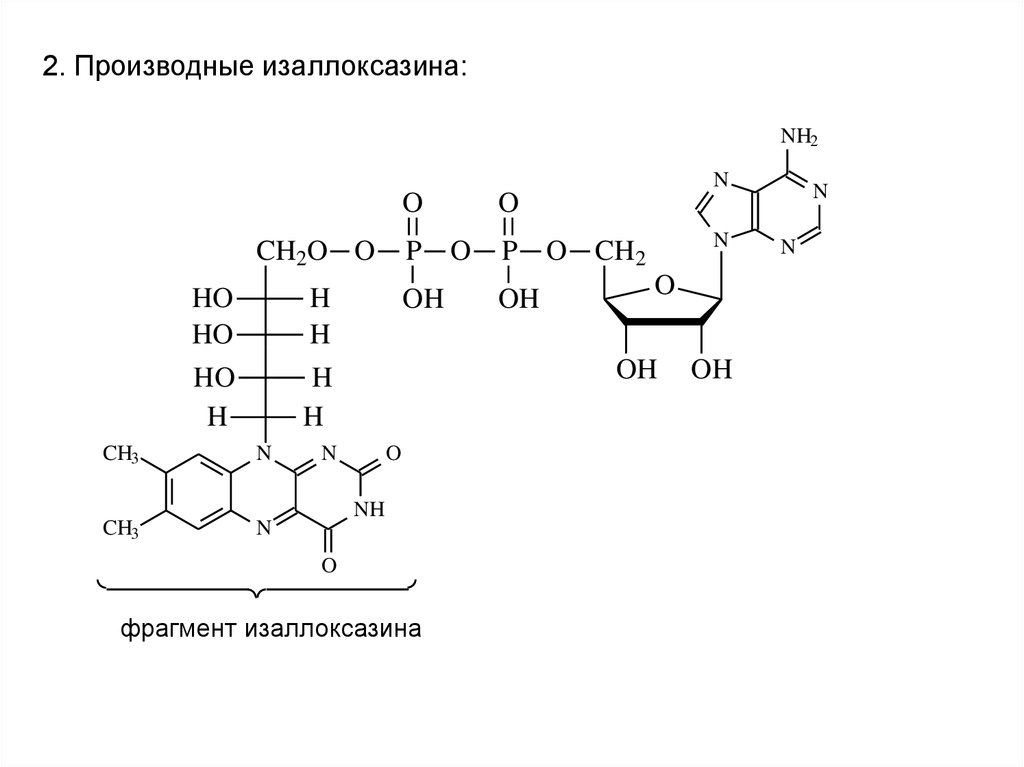
2. Производные изаллоксазина:NH2
N
CH2O O
CH3
CH3
HO
HO
H
H
HO
H
H
H
N
O
O
P O
P O CH2
OH
OH
O
OH
N
O
NH
N
N
O
фрагмент изаллоксазина
OH
N
N
23.
RCH3
CH3
N
N
O
[H]
NH
N
CH3
O
H
N
N
O
NH
N
H
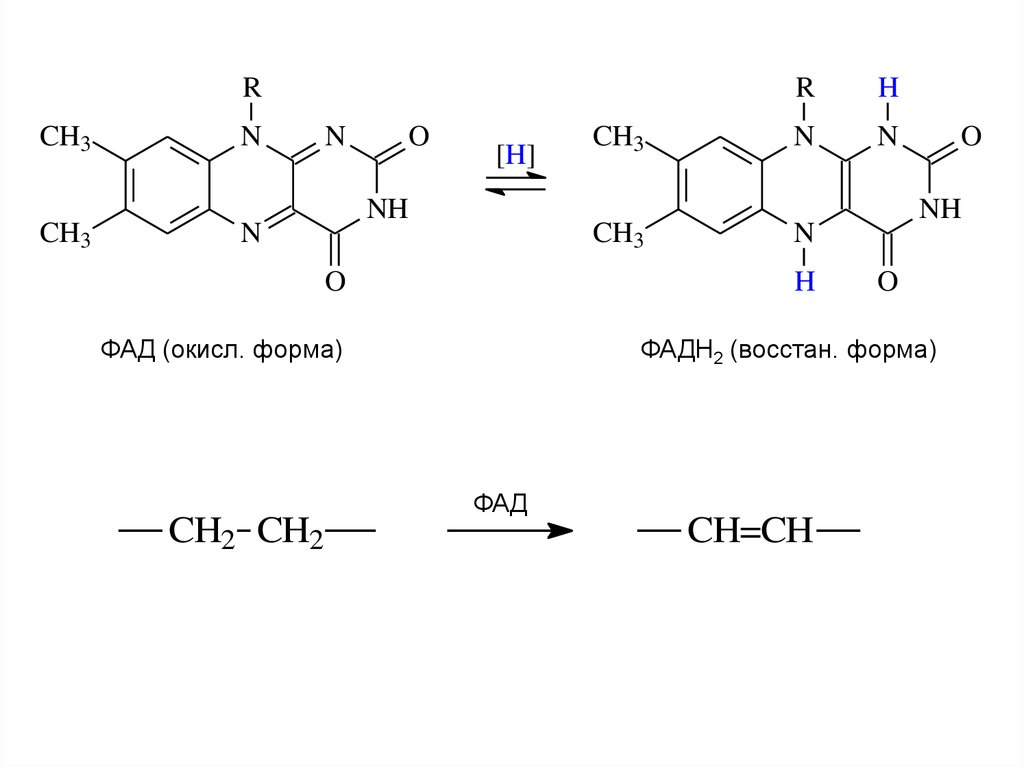
ФАД (окисл. форма)
CH2 CH2
CH3
R
O
ФАДН2 (восстан. форма)
ФАД
CH=CH
24.
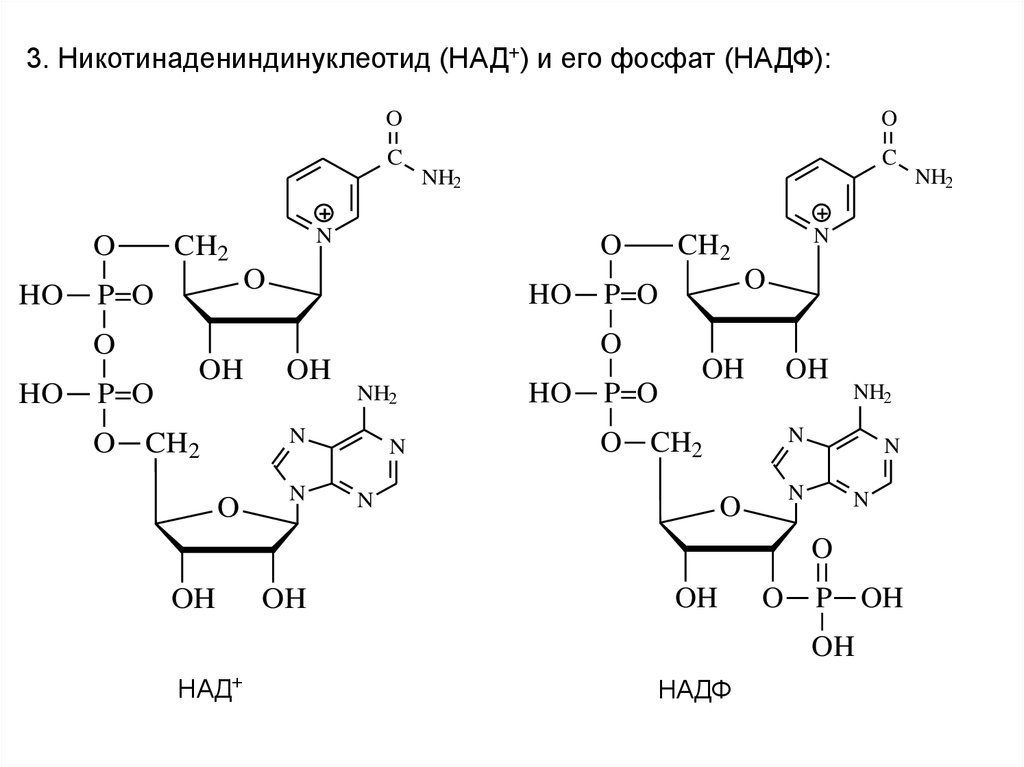
3. Никотинадениндинуклеотид (НАД+) и его фосфат (НАДФ):O
O
C
O
HO
O
HO
P=O
O
N
CH2
O
O
P=O
OH
HO
OH
NH2
O
N
N
HO
N
CH2
O
P=O
O
N
CH2
C
NH2
P=O
OH
OH
N
O CH2
N
NH2
N
N
O
N
O
OH
OH
OH
O
P OH
OH
НАД+
НАДФ
NH2
25.
OC
H
H
O
C
NH2
[2 H]
N
N
R
R
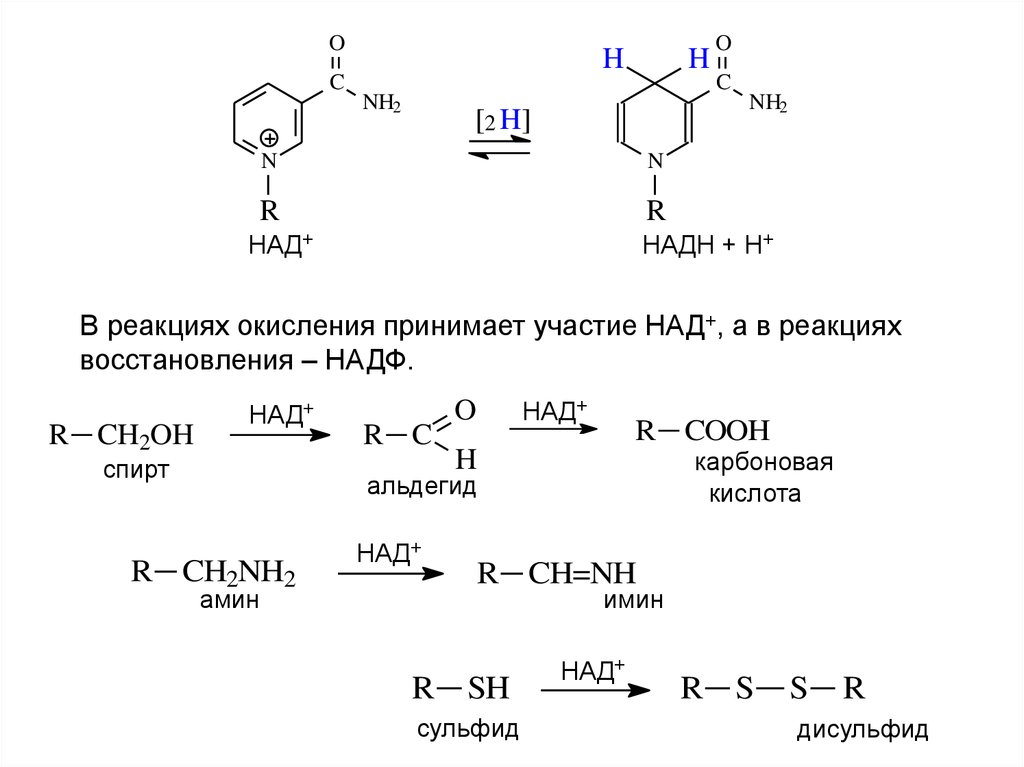
НАД+
NH2
НАДН + Н+
В реакциях окисления принимает участие НАД+, а в реакциях
восстановления – НАДФ.
R CH2OH
НАД+
cпирт
R C
НАД+
O
R COOH
карбоновая
кислота
H
альдегид
R CH2NH2
амин
НАД+
R CH=NH
имин
R SH
сульфид
НАД+
R S
S
R
дисульфид
26.
Пероксидное окисление липидов11
10
9
CH2 CH CH
X
- HX
9
10
11
CH CH CH
10
CH CH CH
мезомерный радикал
O2
11
10
9
11
CH CH CH
10
CH CH CH
O O
O O
+ RH
-R
11
10
9
+ RH
-R
9
11
CH CH CH
10
9
CH CH CH
O OH
O OH
продукты распада






 chemistry
chemistry








