Similar presentations:
Реакции окисления и восстановления биоорганических соединений. (Лекция 5)
1. ЛЕКЦИЯ № 5
РЕАКЦИИ ОКИСЛЕНИЯ ИВОССТАНОВЛЕНИЯ
БИООРГАНИЧЕСКИХ
СОЕДИНЕНИЙ
2. Кислород в атмосфере Земли появился около 600 млн. лет назад, что потребовало перестройки механизмов функционирования живых
существ.Наряду с анаэробными организмами появились аэробные,
метаболизм которых протекает с участием кислорода.
Потребление О2 человеком в покое составляет
250 мл/мин (360 литров в сутки),
при физической работе может возрастать в десятки
раз
Н-субстрат-Н + ½ О2
Н2О + дегидрированный
(окисленный)
субстрат
Окисление органических субстратов – процесс аналогичный горению
2Н
О
- 2е
2Н+
+ 2е
О2-
Н2О
∆G0 = - 100 кДж/моль
протонов - экзергонический
процесс
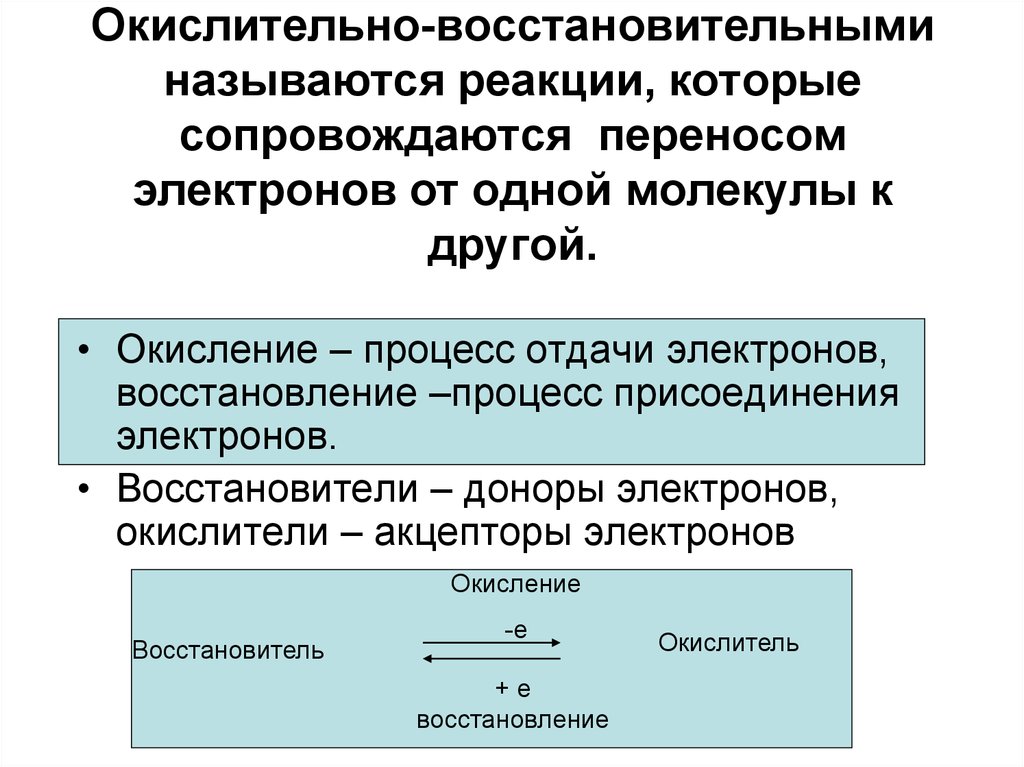
3. Окислительно-восстановительными называются реакции, которые сопровождаются переносом электронов от одной молекулы к другой.
• Окисление – процесс отдачи электронов,восстановление –процесс присоединения
электронов.
• Восстановители – доноры электронов,
окислители – акцепторы электронов
Окисление
Восстановитель
-е
+е
восстановление
Окислитель
4. Значение реакций окисления-восстановления в организме
Значение реакций окислениявосстановления в организме• 1. Окисление питательных веществ
• (процессы катаболизма), при которых
выделяется энергия, запасаемая в виде АТФ
и используемая в процессах анаболизма
(биосинтеза).
• 2. Основа клеточного дыхания
(окислительное фосфорилирование)
• 3. Процессы свободнорадикального
окисления липидов биологических мембран,
белков, нуклеиновых кислот
• 4. Процессы детоксикации ксенобиотиков
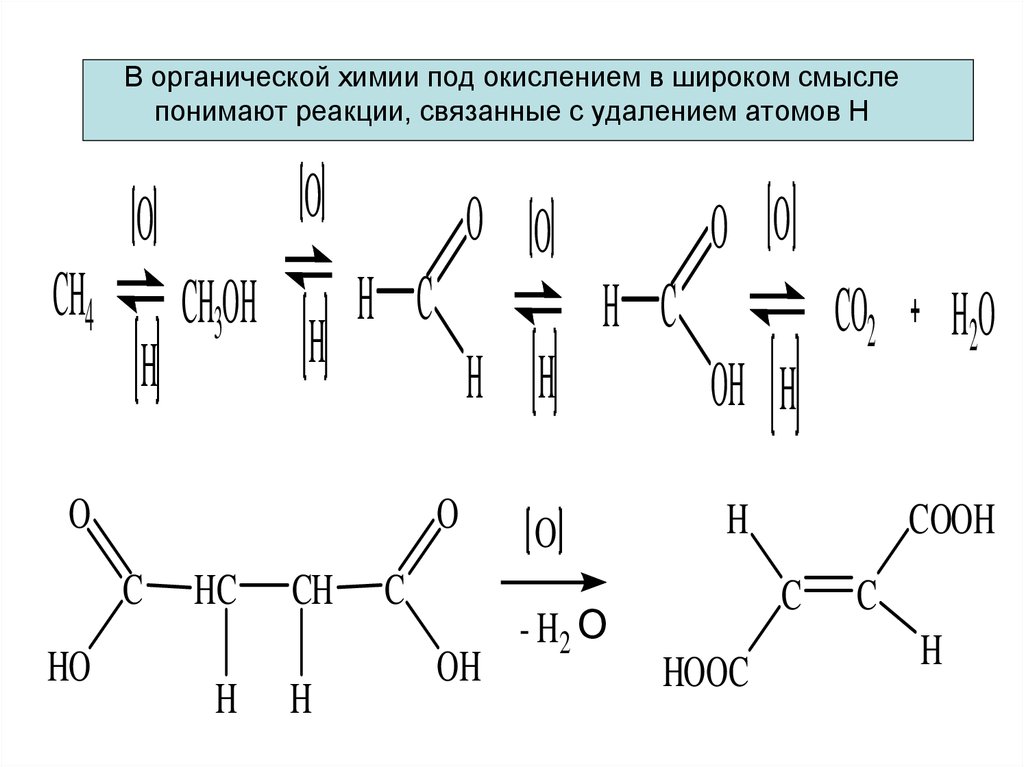
5. В органической химии под окислением в широком смысле понимают реакции, связанные с удалением атомов Н
OO
CH4
H
CH3OH
H
O O
H C
HO
H C
H H
O
O
C
HC
H
CH
H
O O
C
OH
O
- H2 О
CO2
H2O
OH H
H
COOH
C
HOOC
C
H
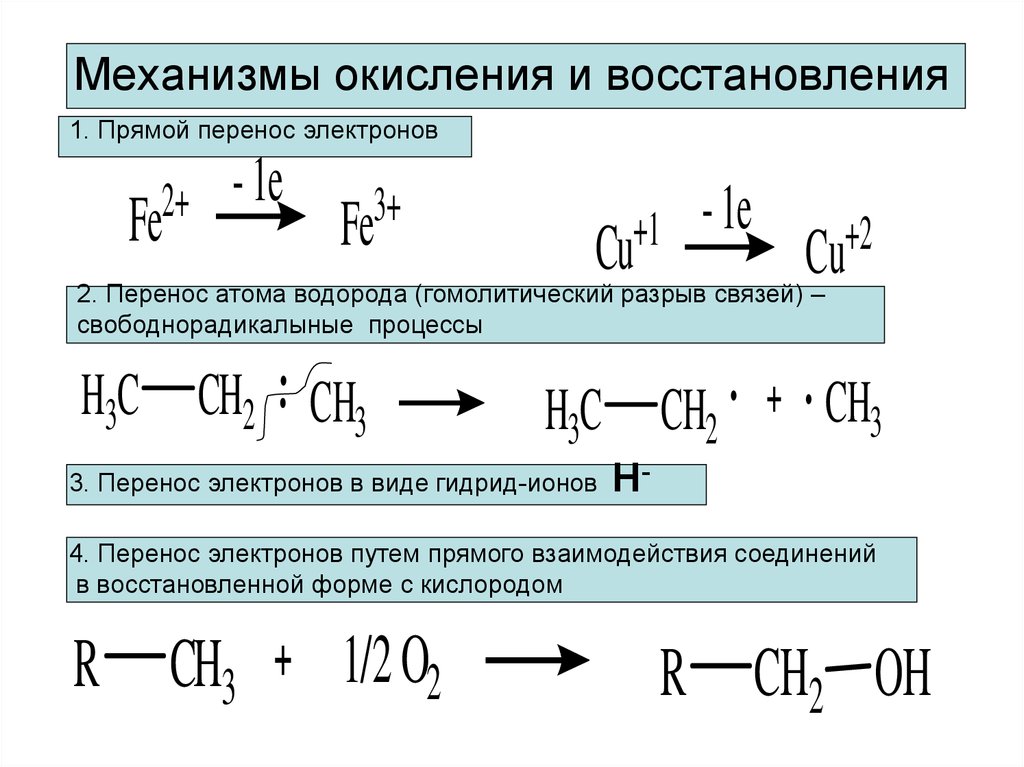
6. Механизмы окисления и восстановления
1. Прямой перенос электронов2+
Fe
- 1e
3+
Fe
+1
Cu
- 1e
+2
Cu
2. Перенос атома водорода (гомолитический разрыв связей) –
свободнорадикалыные процессы
H3C CH2 CH3
H3C CH2
3. Перенос электронов в виде гидрид-ионов
CH3
Н-
4. Перенос электронов путем прямого взаимодействия соединений
в восстановленной форме с кислородом
R
CH3
1/2 O2
R CH2 OH
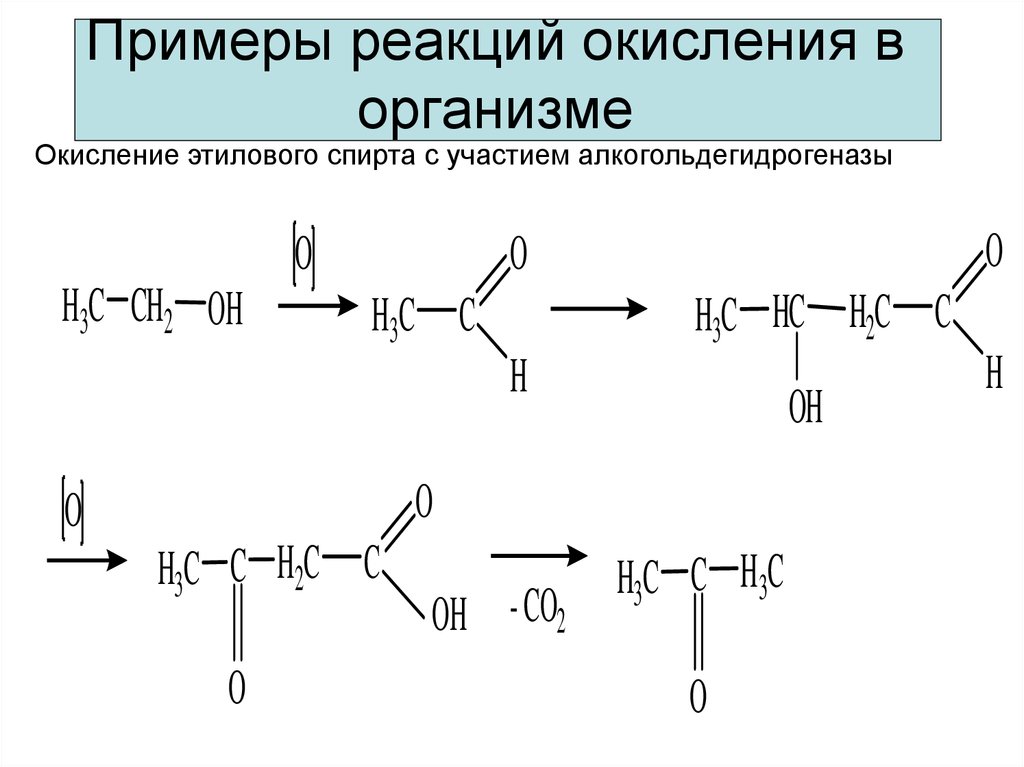
7. Примеры реакций окисления в организме
Окисление этилового спирта с участием алкогольдегидрогеназыO
H3C CH2 OH
O
O
H3C HC H2C C
H3C C
H
OH
O
O
H3C C H2C C
O
OH - CO2
H3C C H3C
O
H
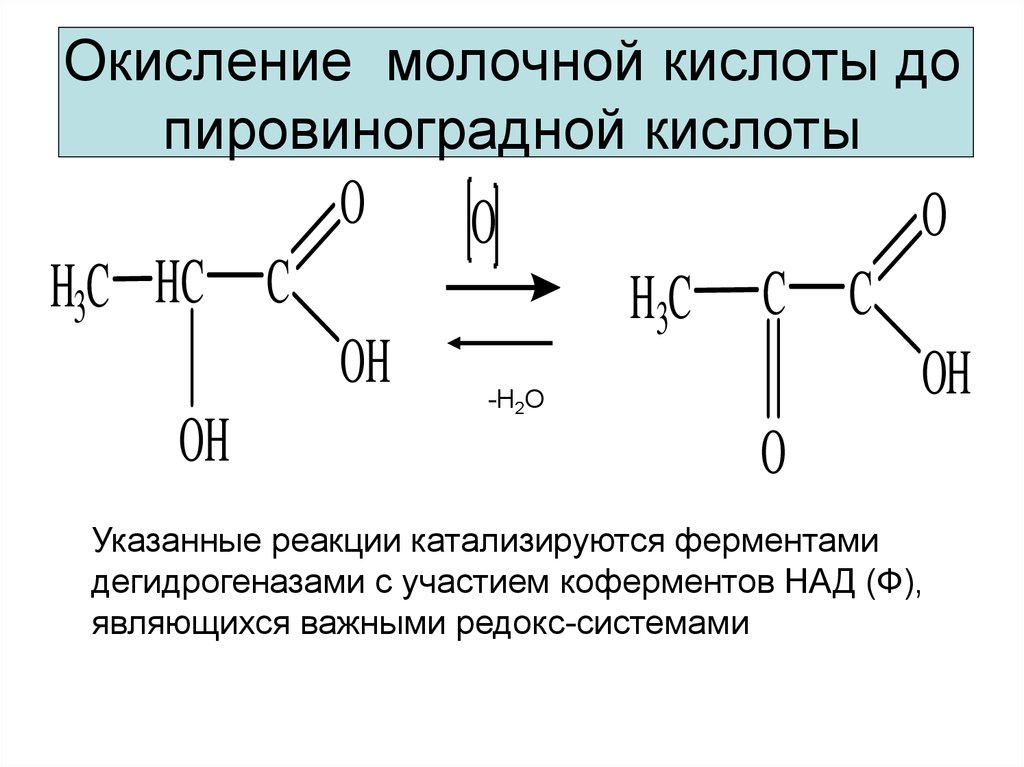
8. Окисление молочной кислоты до пировиноградной кислоты
OH3C HC C
OH
OH
O
O
H3C
C C
OH
-H2O
O
Указанные реакции катализируются ферментами
дегидрогеназами с участием коферментов НАД (Ф),
являющихся важными редокс-системами
9. Редокс – системы Взаимопревращения органических кислот
OO
O
C
HC
CH
O
2H
2e
C
C
O
O
2e
O
C
2H
O
H
C
C
OH
Оксалоацетат
(соль щавелевоуксусной кислоты)
O
CH3
2e
C
O
O
C
CH2
O
OH
C
C
O
O
CH2
CH2
Сукцинат (соль янтарной кислоты)
Фумарат
C
H 2C
O
O
C
O
Малат (соль яблочной кислоты)
O
2H
O
C
H
C
CH3
O
O
Пируват
(соль пировиноградной кислоты)
OH
Лактат (соль молочной кислоты
10.
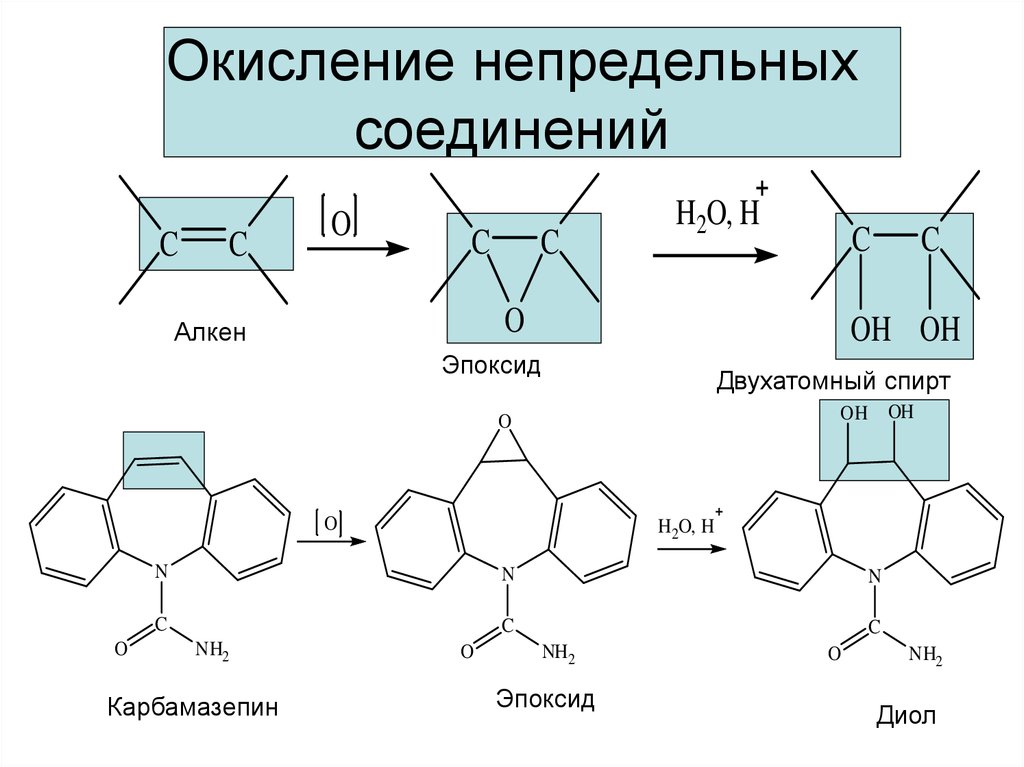
11. Окисление непредельных соединений
CC
O
C
C
H2O, H
O
Алкен
C
OH OH
Эпоксид
Двухатомный спирт
OH
OH
O
O
O
C
H 2O, H
N
N
N
C
C
C
NH2
Карбамазепин
O
NH 2
Эпоксид
O
NH2
Диол
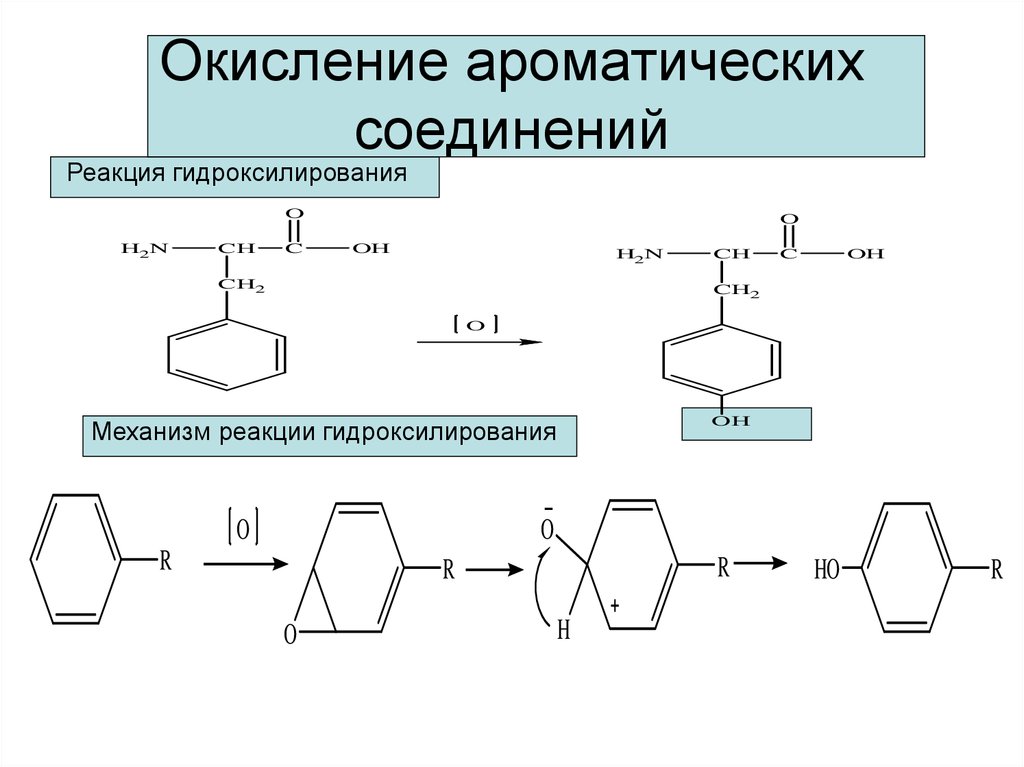
12. Окисление ароматических соединений
Реакция гидроксилированияO
H2N
CH
C
O
OH
H2N
CH2
CH
C
OH
CH2
O
OH
Механизм реакции гидроксилирования
O
O
R
R
R
O
H
HO
R
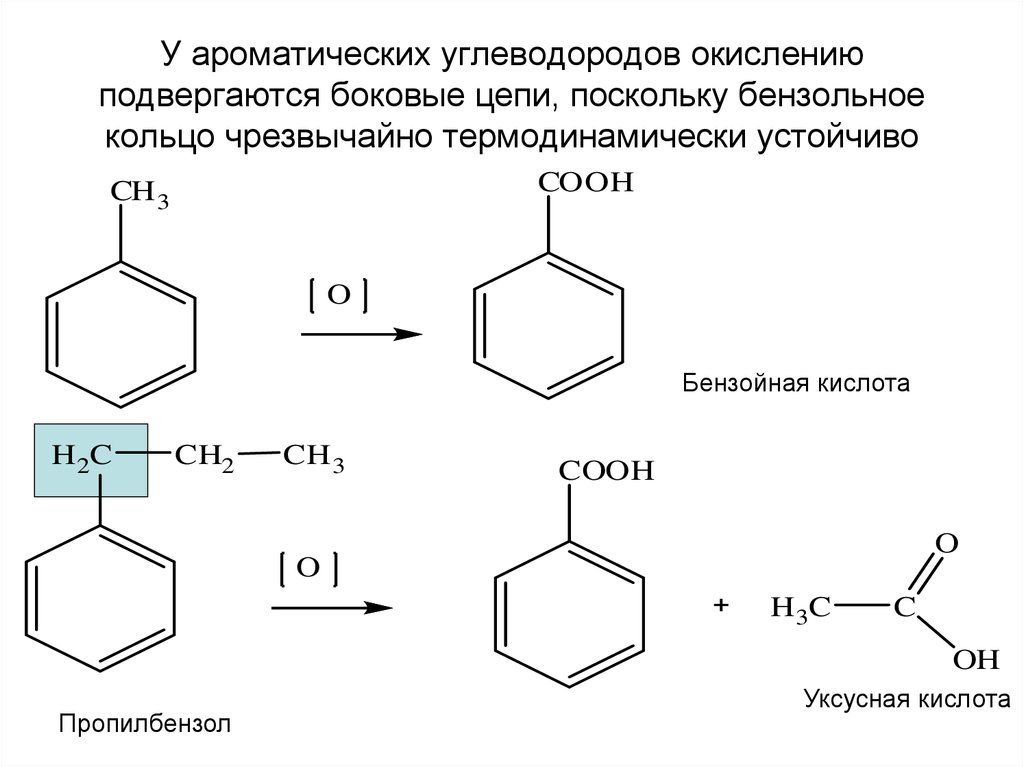
13. У ароматических углеводородов окислению подвергаются боковые цепи, поскольку бензольное кольцо чрезвычайно термодинамически
устойчивоCOOH
CH 3
O
Бензойная кислота
H 2C
CH2
CH 3
COOH
O
O
H 3C
C
OH
Пропилбензол
Уксусная кислота
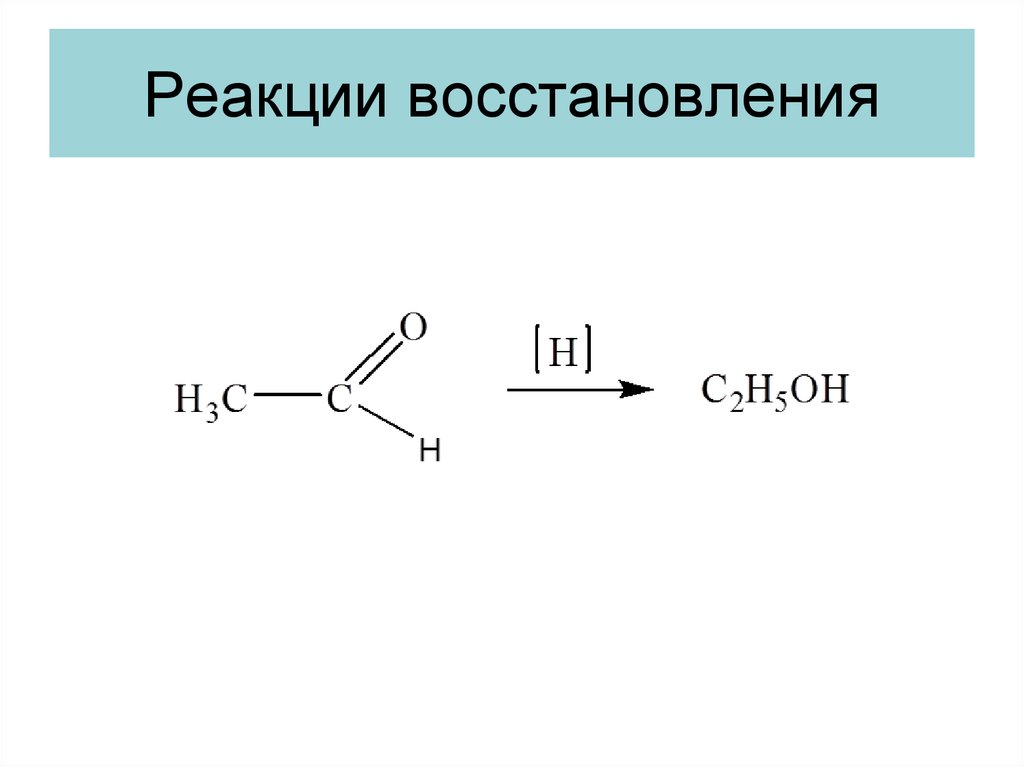
14. Реакции восстановления
15.
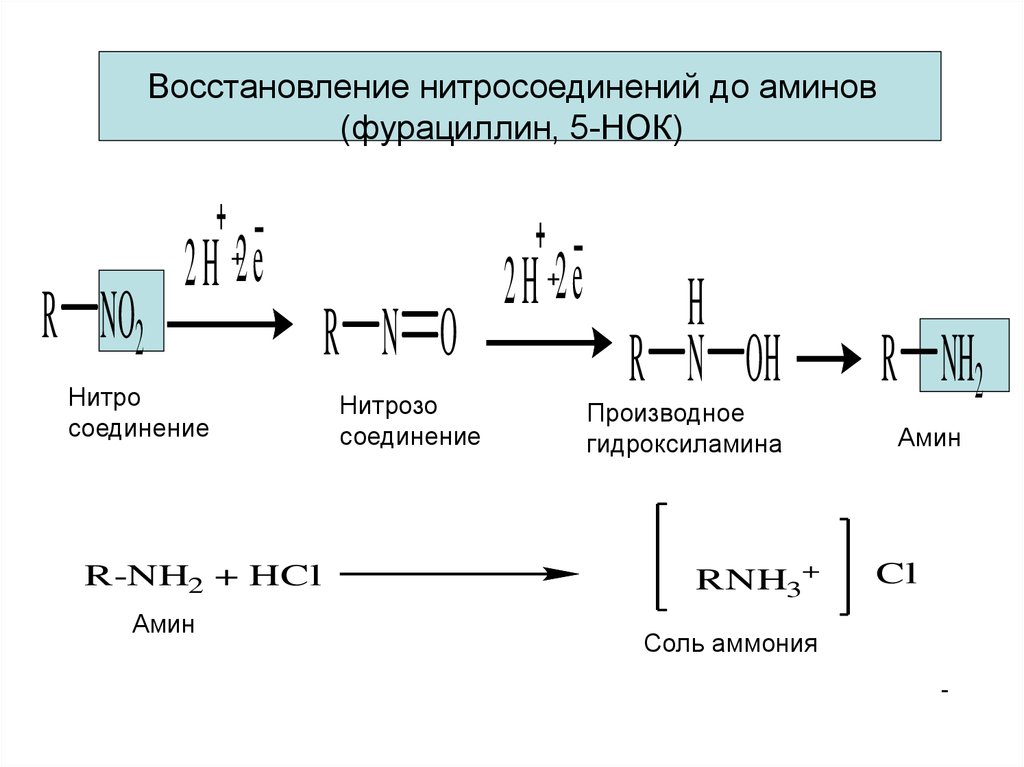
Восстановление нитросоединений до аминов(фурациллин, 5-НОК)
2H 2e
+
R NO2
Нитро
соединение
R-NH2 + HCl
Амин
2H 2e
+
R N O
Нитрозо
соединение
H
R N OH
Производное
гидроксиламина
RNH3+
R NH2
Амин
Cl
Соль аммония
-
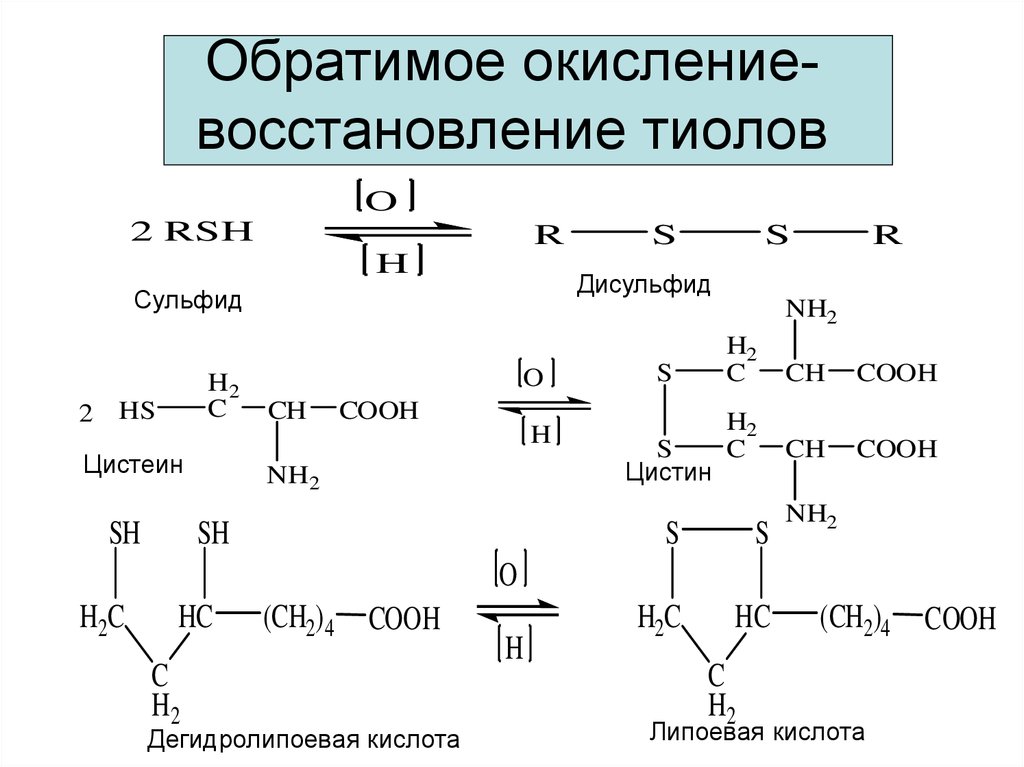
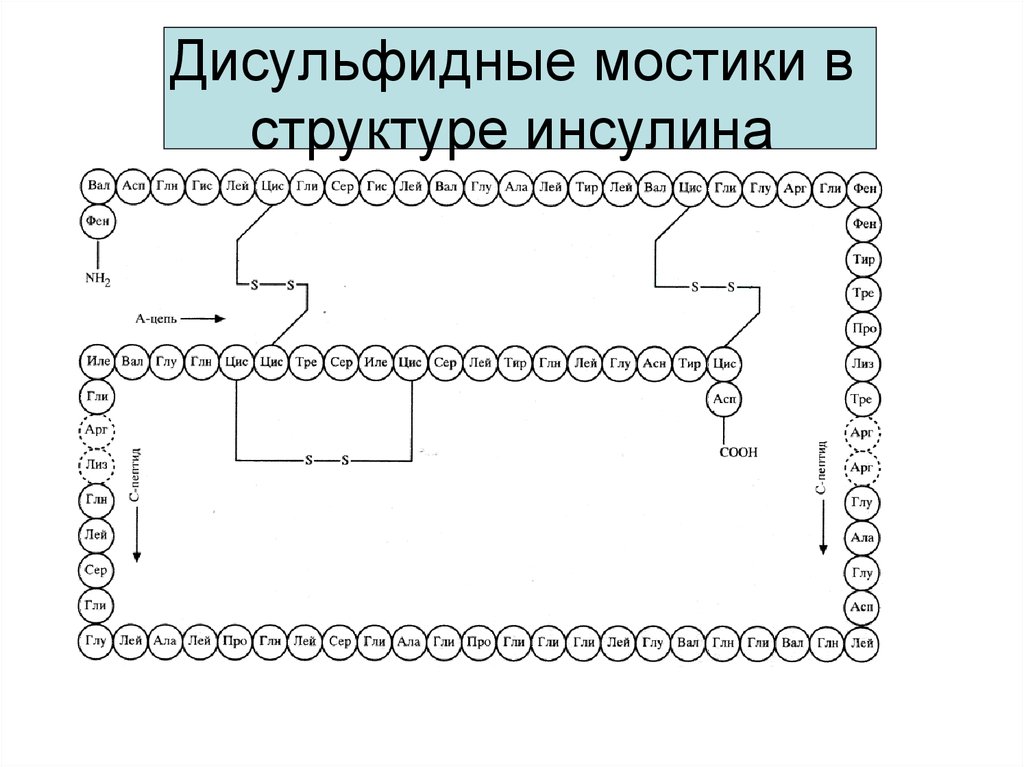
16. Обратимое окисление-восстановление тиолов
Обратимое окислениевосстановление тиоловO
2 RSH
R
H
2 HS
SH
R
NH2
O
CH
S
COOH
H
Цистеин
S
Дисульфид
Сульфид
H2
C
S
NH2
SH
S
Цистин
H2
C
CH
COOH
H2
C
CH
COOH
S
S
H2C
HC
NH2
O
H2C
HC
C
H2
(CH2)4
COOH
Дегидролипоевая кислота
H
C
H2
(CH2)4
Липоевая кислота
COOH














 biology
biology chemistry
chemistry








