Similar presentations:
Восстановление и окисление
1. ВОССТАНОВЛЕНИЕ И ОКИСЛЕНИЕ
- неразрывно связанные процессы. Если одно из двухвеществ восстанавливается, то другое окисляется.
• Восстановлением называют процесс, в результате
которого атом или группа атомов приобретают
электроны. Наоборот, окисление заключается в
потере электронов. Точнее, речь идет об изменении
плотности электронного облака, которое
окружает рассматриваемую группировку атомов
субстрата. При восстановлении оно увеличивается,
а при окислении уменьшается.
• Отнесение реакций к процессам окисления или— к
процессам восстановления определяется тем, какое
вещество является в данном случае субстратом.
KI + Cl
Cl
KCl + I
Cl
I– + Cl0
0
Cl
Количественно
рассматриваемые
характеризуется степенью окисления.
– +
Cl + I Cl
процессы
1
2. Степень окисления
— это тот заряд атома, который возникает приусловии, что электронные пары его связей полностью
смещены к более электроотрицательным атомам,
образующим эти связи, а электроны между
одинаковыми атомами поделены пополам.
• При окислении субстрата степень окисления атомов
увеличивается, при восстановлении - уменьшается
• Например, при окислении толуола, степень окисления
атома углерода метильной группы увеличивается от (–3)
до (+3). При восстановлении кислоты - наоборот
уменьшается. При этом изменяется и состав молекулы:
Ph CH3
–3
Ph CH2OH
Ph CH=O
Ph COOH
–1
+1
+3
• Легкость окисления субстрата возрастает вместе с
ростом его электронной плотности и нуклеофильности (N,
S, двойные и тройные связи).
• Окислители: простые вещества, оксиды элементов,
пероксиды, кислородсодержащие кислоты и др..
•Восстановители – металлы, их соли, комплексы,
амальгамы, водород, соединения серы и др. .
2
3. МЕТОДЫ ВОССТАНОВЛЕНИЯ И ОКИСЛЕНИЯ
Многочисленные методы восстановления и окисленияможно разделить на четыре группы:
• химические,
• каталитические,
• электролитические
• биохимические (микробиологические, витамин С).
Выбор восстановителя или окислителя определяется
• целевым продуктом (синтез анестезина),
• видом сырья (толуол, бензальдегид – окисление до кислоты),
• экономическими факторами (HNO3 и KMnO4),
• технологичностью процесса (р.Канниццаро - мепротан),
• вопросами техники безопасности (электролитические
методы) и др. критериями.
Следует отметить, что наиболее дешевым и доступным
окислителем является кислород воздуха, который в
настоящее
время
широко
используется
в
каталитических процессах окисления.
3
4. ХИМИЧЕСКИЕ МЕТОДЫ ВОССТАНОВЛЕНИЯ
1.Востановление металлами и их солями• Щелочными металлами (натрием).
• Оловом и хлоридом олова(II) в кислотах.
• Железом в кислотах.
• Цинком в кислотах, щелочи и амальгамой цинка.
2.Восстановление гидридами металлов.
3.Восстановление соединениями серы.
4.Восстановление алкоголятами алюминия.
5.Восстановление органическими реагентами.
6. КАТАЛИТИЧЕСКОЕ ВОССТАНОВЛЕНИЕ ВОДОРОДОМ.
7. ЭЛЕКТРОЛИТИЧЕСКОЕ ВОССТАНОВЛЕНИЕ.
4
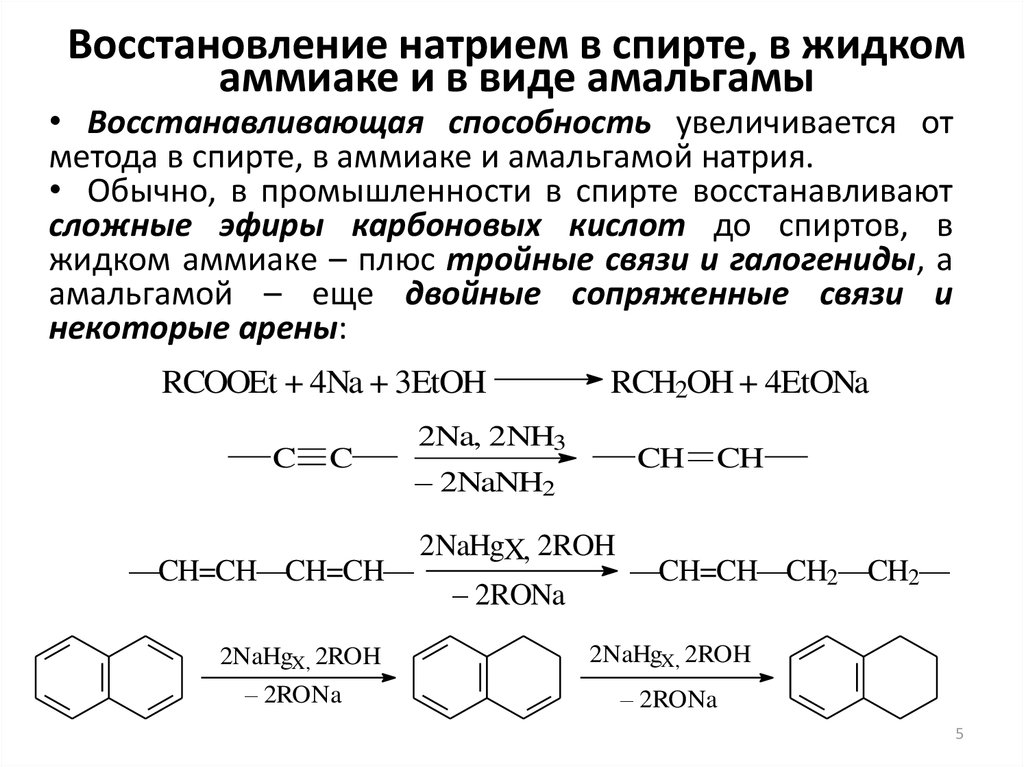
5. Восстановление натрием в спирте, в жидком аммиаке и в виде амальгамы
• Восстанавливающая способность увеличивается отметода в спирте, в аммиаке и амальгамой натрия.
• Обычно, в промышленности в спирте восстанавливают
сложные эфиры карбоновых кислот до спиртов, в
жидком аммиаке – плюс тройные связи и галогениды, а
амальгамой – еще двойные сопряженные связи и
некоторые арены:
RCOOEt + 4Na + 3EtOH
C
C
2Na, 2NH3
– 2NaNH2
RCH2OH + 4EtONa
CH
CH
2NaHgX, 2ROH
—CH=CH—CH=CH—
—CH=CH—CH2—CH2—
– 2RONa
2NaHgX, 2ROH
2NaHgX, 2ROH
– 2RONa
– 2RONa
5
6. Механизм восстановления натрием
C OOR'
2 Na
+
– 2 Na
C O
OR'
ROH
– RO
–
CH
O
– R'O
–
CH=O
OR'
• во всех случаях одинаков: атомы натрия отдают
электроны, источником протонов является спирт, аммиак
и вода (приведен упрощенный вариант).
• Потери обусловлены непосредственной реакцией
натрия со спиртом, аммиаком, водой (в случае
амальгамы). Выделяющийся водород неактивен, а
образующиеся алкоголяты вызывают образование
побочных продуктов. Поэтому в методе Буво-Блана
используются вторичные спирты (метилциклогексанол),
которые более слабые кислоты, чем первичные.
• По этой же причине нельзя восстановить вещества,
образующие с натрием соли: карбоновые кислоты,
O
алкилацетилен и др.
C O; R C C
6
7. Технология восстановления щелочными металлами
• Методики восстановления простые, но опасные(например, к кипящему раствору сложного эфира в спирте
загружают
натрий,
после
завершения
реакции
реакционную массу выливают в воду; в аммиаке
растворяют K, Na, Li), поэтому их применяют, когда нет
возможности применить другие методы.
• Отвод тепла (через обратный теплообменник) при
реакции в спирте является сложной технической
проблемой, т.к. тепловой эффект реакции очень высок (до
520
кДж/моль),
поэтому
используют
более
высококипящие спирты, чем этанол.
• Для ведения процесса в аммиаке необходима
специальная аппаратура, т.к. температура кипения
аммиака очень низкая (–33,5 °С). Зато калий, натрий и
литий хорошо растворяются в аммиаке.
7
8. Технология восстановления амальгамой натрия
• Амальгаму натрия получают растворением натрия вртути, что вызывает дополнительные трудности (отвод
тепла, защита от окисления). Это не только раствор, ртуть
со щелочными металлами образует меркуриды МеHgx
• Амальгама, содержащая меньше 1,25 % натрия, при
комнатной температуре жидкая, при больших
концентрациях натрия - твердая и ее можно измельчать
механически.
• Субстрат растворяют, эмульгируют или суспендируют в
спирте или воде, амальгама натрия реагирует с водой
медленно. Для растворения субстрата можно применять
органические растворители, смешивающиеся с водой и
спиртом. К смеси при энергичном перемешивании
постепенно
добавляют
избыток
амальгамы,
реакционную массу можно нагревать. После полного
разложения амальгамы, выделившую ртуть отделяют
декантацией и промывают водой или спиртом.
• При повышении рН скорость реакции замедляется.
8
9. Восстановление оловом, хлоридом олова (II) и железом в кислой среде, цинком в кислой и щелочной средах и амальгамой цинка
• простыеи
давно
известные
способы
восстановления нитро-, нитрозо-, гидроксиамино-,
азо- и диазо- групп. Они широко применяются как в
лабораторной практике, так и в промышленности
(кроме олова).
• Механизм восстановления нитрогрупп металлами
аналогичен механизму восстановления карбонильных
соединений, но восстанавливающая активность
перечисленных металлов ниже щелочных и в
передаче электронов участвует атом водорода.
9
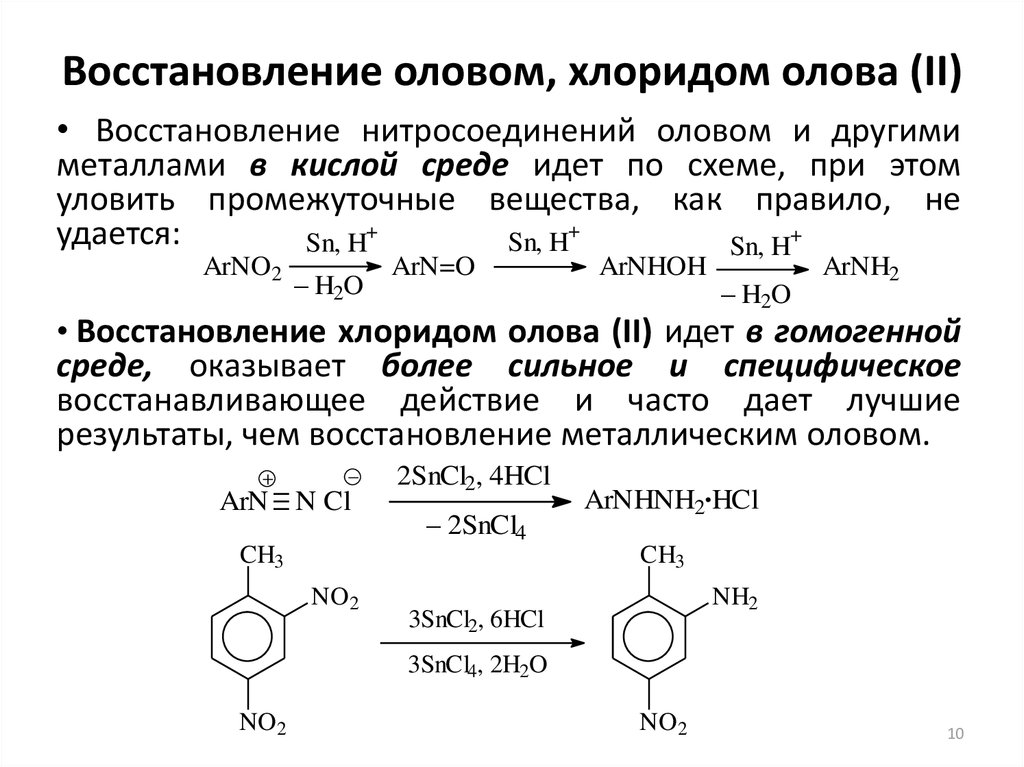
10. Восстановление оловом, хлоридом олова (II)
• Восстановление нитросоединений оловом и другимиметаллами в кислой среде идет по схеме, при этом
уловить промежуточные вещества, как правило, не
+
+
+
удается:
Sn, H
Sn, H
Sn, H
ArNO2
– H2O
ArN=O
ArNHOH
– H2O
ArNH2
• Восстановление хлоридом олова (II) идет в гомогенной
среде, оказывает более сильное и специфическое
восстанавливающее действие и часто дает лучшие
результаты, чем восстановление металлическим оловом.
ArN N Cl
2SnCl2, 4HCl
– 2SnCl4
CH3
ArNHNH2.HCl
CH3
NO2
NH2
3SnCl2, 6HCl
3SnCl4, 2H2O
NO2
NO2
10
11. Восстановление железом
• Железные опилки в среде кислот помимоазотсодержащих соединений восстанавливают и
+
Fe/ H
альдегиды:
–CH=O
–CH2OH
• Железо в присутствии электролитов (слабокислая
среда) один из распространенных промышленных
методов восстановления нитросоединений . При этом
одновременно протекает четыре реакции:
Fe + 2H2O
Fe(OH)2 + 2H
ArNO2 + 6Fe(OH)2 + 4H2O
ArNO2 + 6H
Fe + 8 Fe(OH)3
6Fe(OH)3 + ArNH2
ArNH2 + 2H2O
3Fe3O4 + 12H2O
• Скорость восстановления лимитируется первой стадией
(влажная коррозия железа). Поэтому реакцию ведут в
среде электролита в слабокислой среде. При повышении
величины рН среды скорость реакции уменьшается. При
рН > 12 процесс прекращается.
11
12. Технология восстановления железом в электролитах
• Электролиты (хлорид аммония, железа (II), и др.)можно получать в самом реакторе при протравливании
чугунной стружки соляной кислотой.
• Лучше использовать стружку серого чугуна,
активность которого объясняется возникновением
гальванической пары на границе раздела железо–
графит. Это приводит к распаду его на мелкие частицы и
к ускорению реакции.
• Подготовка восстановителя: измельчение, просев,
удаления пыли, обезжиривание и протравливание.
• Процесс восстановления ведут при температуре
кипения реакционной массы. Обогрев чаще всего
производят острым паром.
• К кипящей суспензии чугунной стружки в растворе
электролита загружают нитропродукт. Амин отгоняются с
водяным паром, отделяют или экстрагируют из
реакционной массы органическими растворителями.
12
13. Достоинства и недостатки восстановления железом в электролитах
• Метод - простотой, технологичный, дешевый, высокийвыход. Недостаток метода - фильтрация,
транспортировка тяжелого и содержащего абразивные
частицы осадка.
• В производстве восстановление проводят в стальных
или чугунных аппаратах (редукторах), футерованных
диабазовой плиткой на кислотоупорной замазке и
снабженных мешалкой (лопастной или сошниковой) и
барботером для подачи острого пара.
• Этот метод используют при производстве анестезина,
новокаина и ряда других препаратов:
O2N
COOEt(CH2CH2NEt2)
Fe, H2O,
NH4Cl
H2N
COOEt(CH2CH2NEt2)
анестезин (новокаин – основание)
13
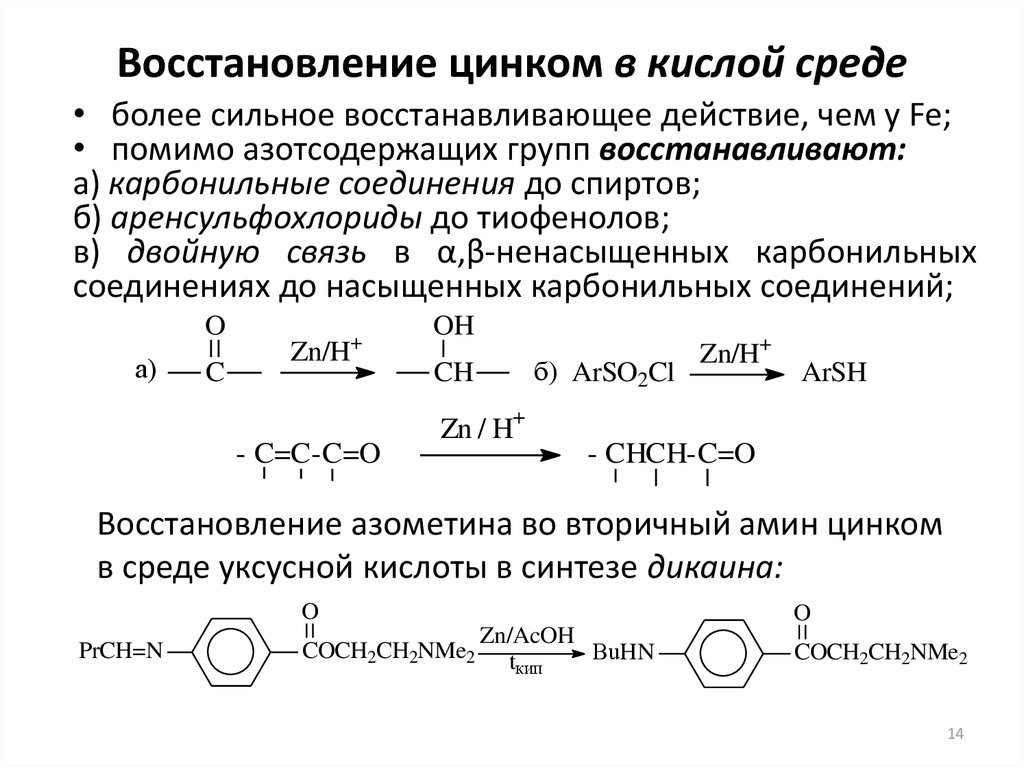
14. Восстановление цинком в кислой среде
• более сильное восстанавливающее действие, чем у Fe;• помимо азотсодержащих групп восстанавливают:
а) карбонильные соединения до спиртов;
б) аренсульфохлориды до тиофенолов;
в) двойную связь в α,β-ненасыщенных карбонильных
соединениях до насыщенных карбонильных соединений;
O
а)
C
+
Zn/H
- C=C-C=O
OH
б) ArSO2Cl
CH
Zn / H+
Zn/H+
ArSH
- CHCH-C=O
Восстановление азометина во вторичный амин цинком
в среде уксусной кислоты в синтезе дикаина:
O
PrCH=N
COCH2CH2NMe2
O
Zn/AcOH
BuHN
tкип
COCH2CH2NMe2
14
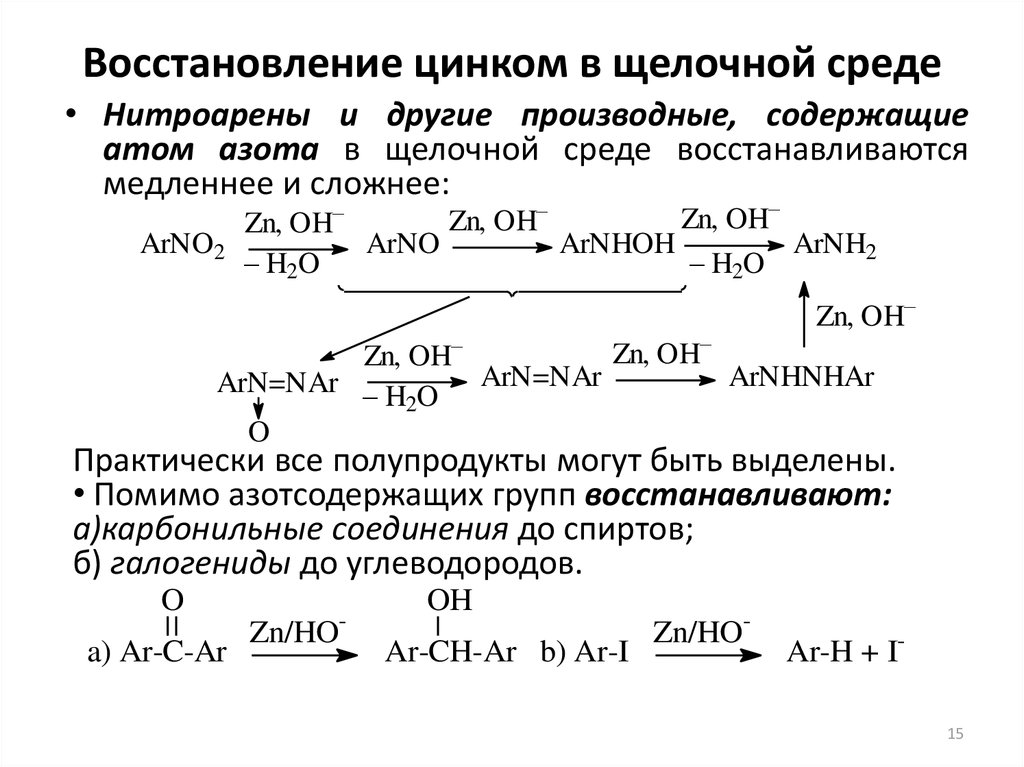
15. Восстановление цинком в щелочной среде
• Нитроарены и другие производные, содержащиеатом азота в щелочной среде восстанавливаются
медленнее и сложнее:
ArNO2
Zn, OH–
Zn, OH–
Zn, OH–
ArNO
ArNHOH
ArNH2
– H2O
– H2O
Zn, OH–
Zn, OH–
Zn, OH–
ArNHNHAr
ArN=NAr – H O ArN=NAr
2
O
Практически все полупродукты могут быть выделены.
• Помимо азотсодержащих групп восстанавливают:
а)карбонильные соединения до спиртов;
б) галогениды до углеводородов.
O
a) Ar-C-Ar
-
Zn/HO
OH
Ar-CH-Ar b) Ar-I
Zn/HO-
Ar-H + I15
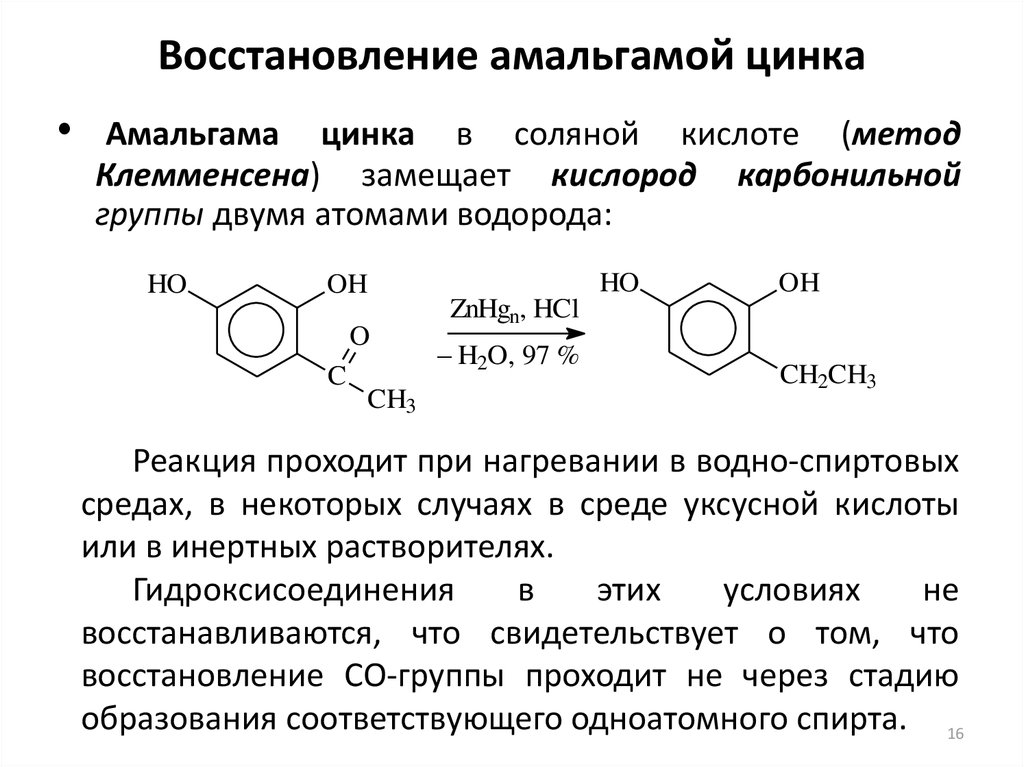
16. Восстановление амальгамой цинка
Амальгама цинка в соляной кислоте (метод
Клемменсена) замещает кислород карбонильной
группы двумя атомами водорода:
HO
OH
O
C
CH3
HO
OH
ZnHgn, HCl
– H2O, 97 %
CH2CH3
Реакция проходит при нагревании в водно-спиртовых
средах, в некоторых случаях в среде уксусной кислоты
или в инертных растворителях.
Гидроксисоединения
в
этих
условиях
не
восстанавливаются, что свидетельствует о том, что
восстановление СО-группы проходит не через стадию
образования соответствующего одноатомного спирта. 16
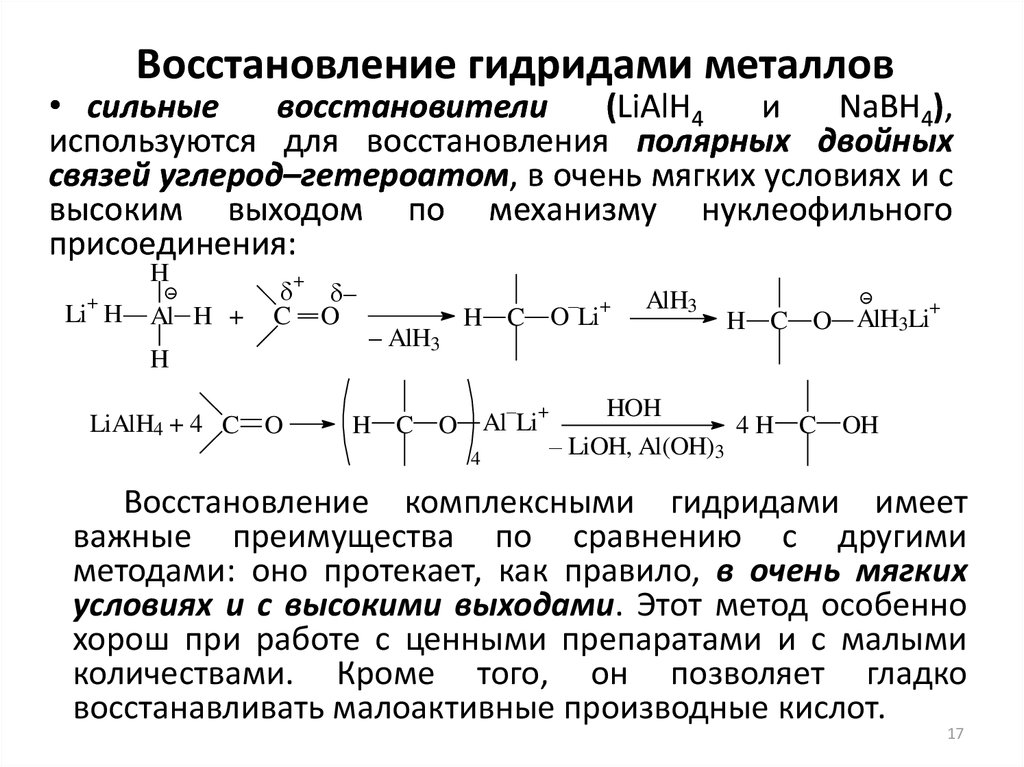
17. Восстановление гидридами металлов
• сильныевосстановители
(LiAlH4
и
NaBH4),
используются для восстановления полярных двойных
связей углерод–гетероатом, в очень мягких условиях и с
высоким выходом по механизму нуклеофильного
присоединения:
H
+
Li H
Al H +
C
H
LiAlH4 + 4 C O
+
–
O
–
– AlH3
+
H C O Li
–
H C O Al Li
4
+
AlH3
+
H C O AlH3Li
HOH
4 H C OH
– LiOH, Al(OH)3
Восстановление комплексными гидридами имеет
важные преимущества по сравнению с другими
методами: оно протекает, как правило, в очень мягких
условиях и с высокими выходами. Этот метод особенно
хорош при работе с ценными препаратами и с малыми
количествами. Кроме того, он позволяет гладко
восстанавливать малоактивные производные кислот.
17
18. Алюмогидрид лития восстанавливает :
–CH=O > –CO– > –COOR > –COCl > –CO–O–CO– > –COOH > –CN > –CONH2 > –NO2LiAlH4
–CH2NH2
–CH2OH
ROH
LiAlH4
RHlg
– HHlg , H2O
–NH2
RH
• не восстанавливает двойные связи углерод–углерод.
• Восстановление алюмогидридом лития
- протекает в безводной среде, как правило, в эфире
(диэтиловом, дибутиловом, тетрагидрофуране и др.). Это
позволяет проводить восстановление при разных
температурах.
- требует особых мер предосторожности. Важно
избегать контакта алюмогидрида лития с водой, так как
это вызывает бурное разложение восстановителя с
выделением воспламеняющегося в присутствии воздуха
водорода.
18
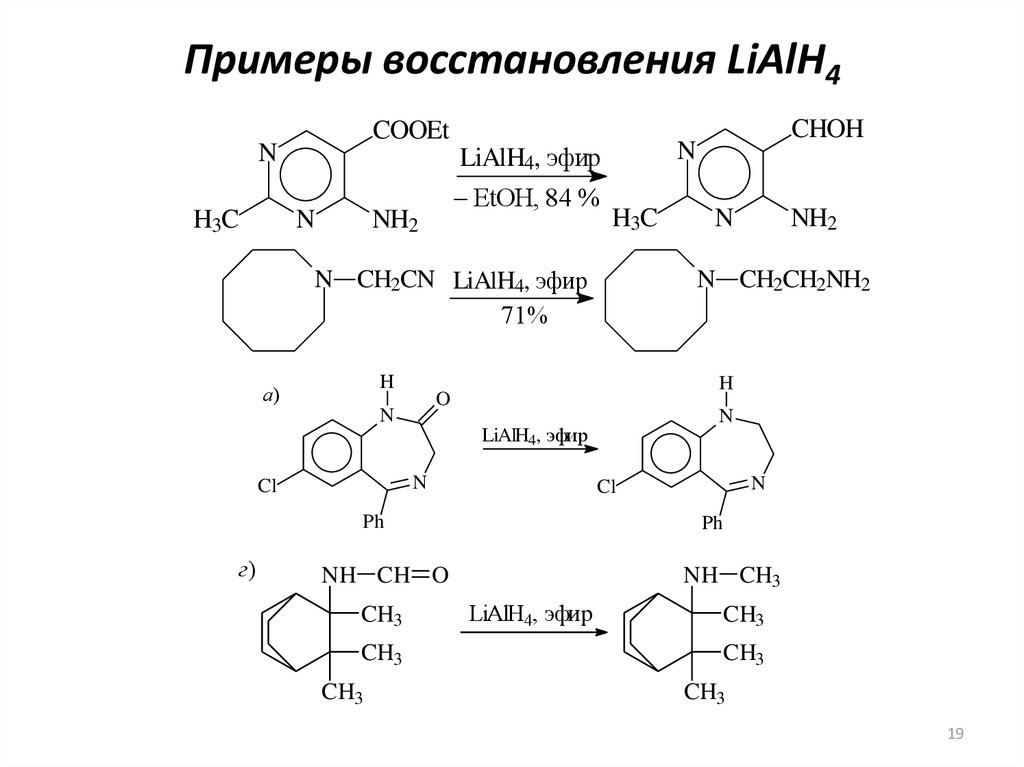
19. Примеры восстановления LiAlH4
COOEtN
H3C
N
NH2
N
LiAlH4, эфир
– EtOH, 84 %
H3C
N CH2CN LiAlH4, эфир
71%
H
а)
CH3
CH3
N
Cl
Ph
NH CH O
CH3
N
LiAlH4, эфир
Ph
г)
NH2
H
N
Cl
N
N CH2CH2NH2
O
N
CHOH
NH CH3
LiAlH4, эфир
CH3
CH3
CH3
19
20. Восстановление боргидридом натрия
• Боргидрид натрия применяется для избирательноговосстановления
хлорангидридов
кислот,
карбонильных соединений и оснований Шиффа в
таких полярных растворителях, как вода, метанол,
пиридин, ацетонитрил.
–COCl
–CH2OH
NaBH4
–CO–
>C=N–
>CHOH
>CH–NH–
EtOOC(CH2)4–C–CH2CH2Cl
O
NaBH4
спирт
EtOOC(CH2)4–CH–CH2CH2Cl
OH
20
21. Восстановление соединениями серы
• применяются редко, т.к. имеются более удобныевосстановители, и утилизация сточных вод, содержащих
вредные соединения, вызывает серьезные трудности;
• однако простая технология, стоимость и легкость
выделения продукта используются в некоторых
технологиях для восстановления азотистых соединений.
4RNO2 + 6NaHS + H2O
RNO2 + Na2S2 + H2O
O2N
CH3
4RNH2 + 3Na2S2O3
RNH2 + Na2S2O3
S, NaOH
– Na2S2O3, H2O
H2N
CH=O
Оборудование должно быть герметичным (но из
простой стали, среда не агрессивная), предусмотрены
все мероприятия по ТБ и экологической безопасности.
Маточники обрабатывают кислородом воздуха для
окисления соединений серы до Na2S2O3.
21
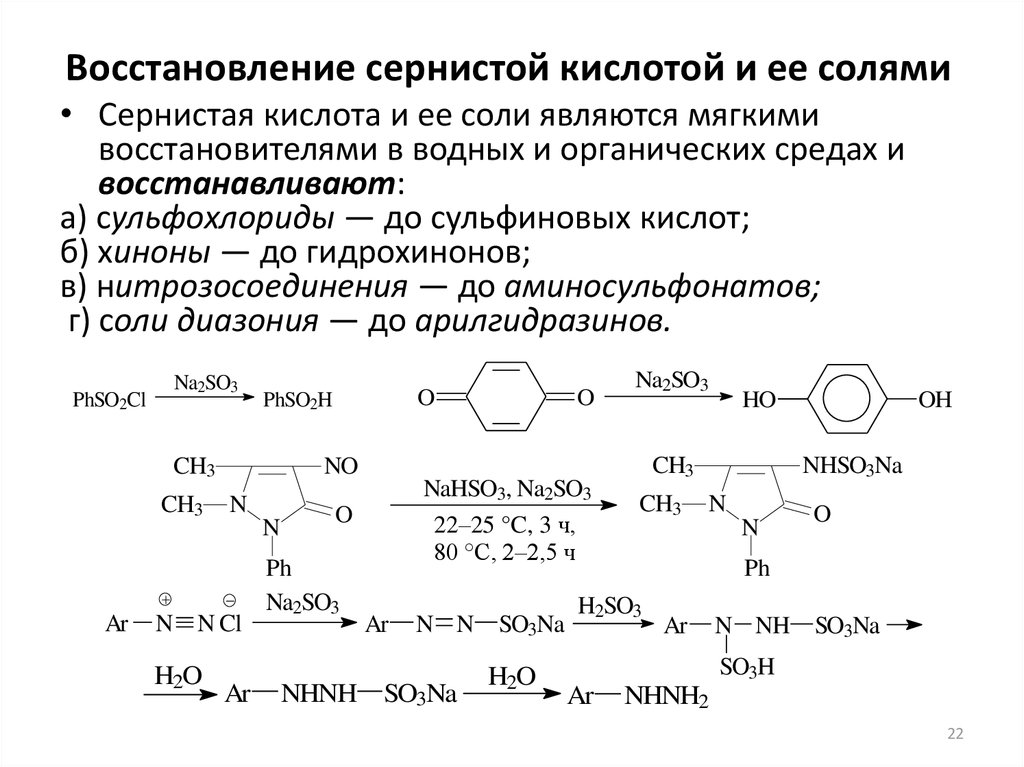
22. Восстановление сернистой кислотой и ее солями
• Сернистая кислота и ее соли являются мягкимивосстановителями в водных и органических средах и
восстанавливают:
а) сульфохлориды — до сульфиновых кислот;
б) хиноны — до гидрохинонов;
в) нитрозосоединения — до аминосульфонатов;
г) соли диазония — до арилгидразинов.
PhSO2Cl
Na2SO3
CH3
CH3
Ar
O
Na2SO3
NaHSO3, Na2SO3
N
N
Ar
O
Ph
Na2SO3
NHNH
22–25 °C, 3 ч,
80 °С, 2–2,5 ч
Ar
N N
SO3Na
SO3Na
H2O
HO
CH3
NO
N N Cl
H2O
O
PhSO2H
CH3
OH
NHSO3Na
N
N
O
Ph
H2SO3
Ar
N NH
SO3Na
SO3H
Ar
NHNH2
22
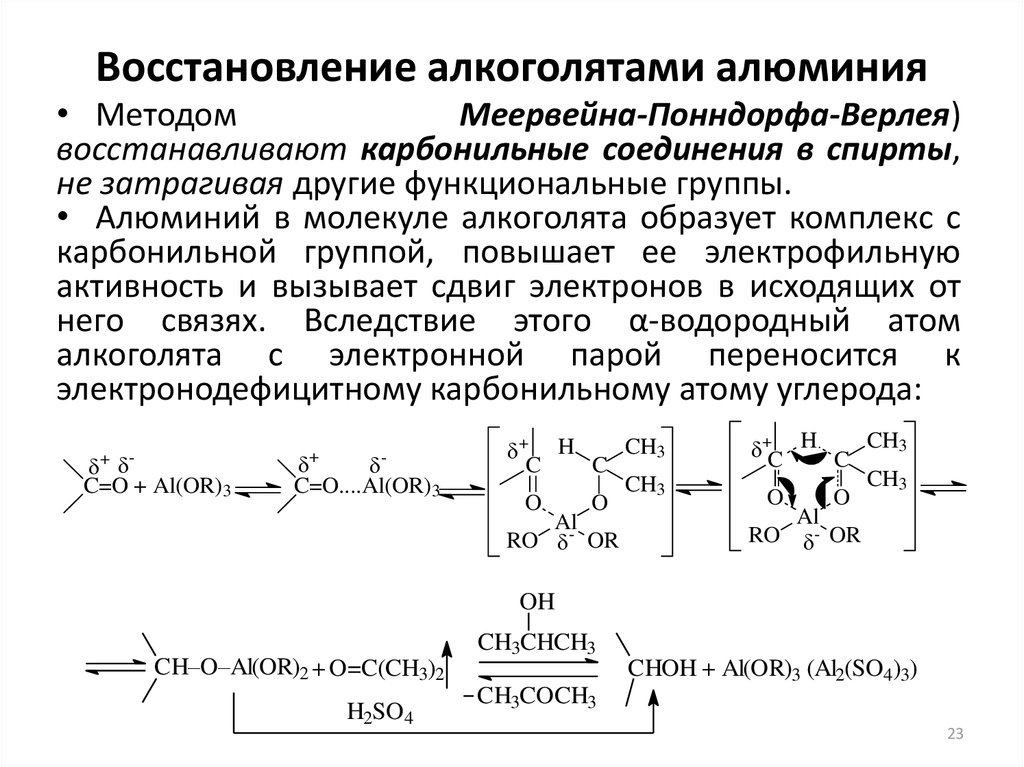
23. Восстановление алкоголятами алюминия
• МетодомМеервейна-Понндорфа-Верлея)
восстанавливают карбонильные соединения в спирты,
не затрагивая другие функциональные группы.
• Алюминий в молекуле алкоголята образует комплекс с
карбонильной группой, повышает ее электрофильную
активность и вызывает сдвиг электронов в исходящих от
него связях. Вследствие этого α-водородный атом
алкоголята с электронной парой переносится к
электронодефицитному карбонильному атому углерода:
C=O + Al(OR)3
+
-
C=O....Al(OR)3
+
-
CH3
+ H
C
C
CH3
O
O
AlRO OR
+C H C CH3
CH3
O
O
Al
RO - OR
OH
CH3CHCH3
CH–O–Al(OR)2 + O=C(CH3)2
H2SO4
CHOH + Al(OR)3 (Al2(SO4)3)
CH3COCH3
23
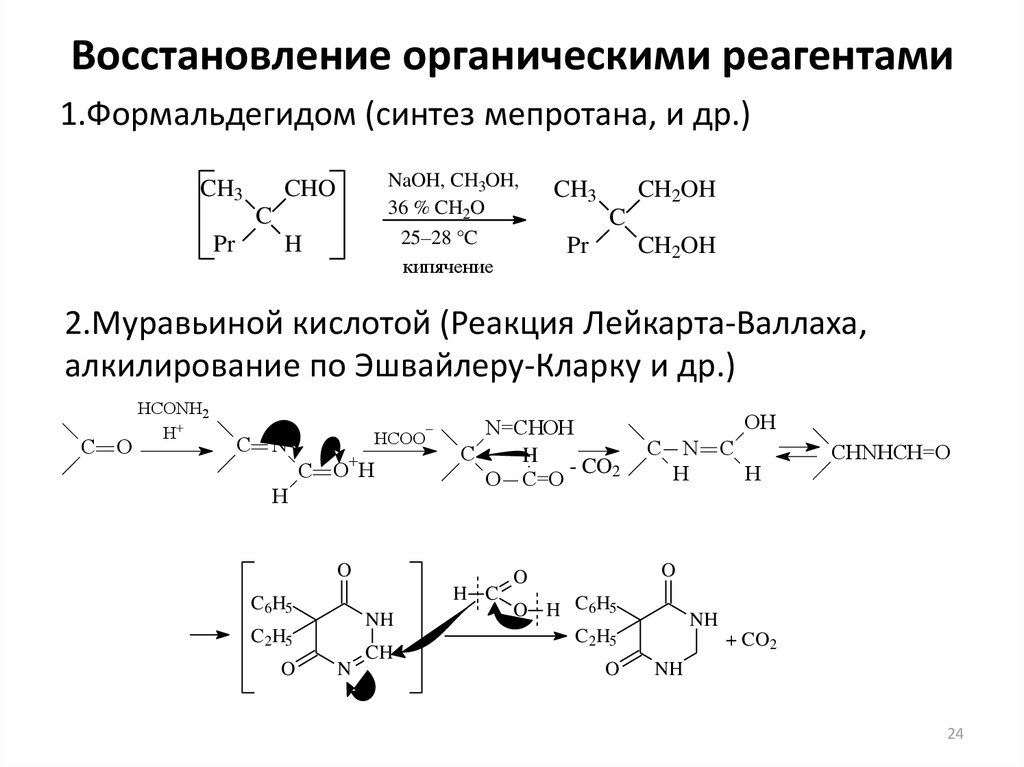
24. Восстановление органическими реагентами
1.Формальдегидом (синтез мепротана, и др.)CH3
NaOH, CH3OH,
36 % CH2O
CHO
C
Pr
25–28 °C
кипячение
H
CH3
CH2OH
C
Pr
CH2OH
2.Муравьиной кислотой (Реакция Лейкарта-Валлаха,
алкилирование по Эшвайлеру-Кларку и др.)
C O
HCONH2
H+
C N
–
HCOO
C O+H
H
N=CHOH
C
H
- CO2
O C=O
O
H C
C6H5
NH
C2H5
O
N
CH
OH
C N C
H
H
CHNHCH=O
O
O
O H C6H5
C2H5
O
NH
+ CO2
NH
24
25. Каталитическое восстановление водородом
КАТАЛИТИЧЕСКОЕ ВОССТАНОВЛЕНИЕ ВОДОРОДОМ• Достоинства: универсальность, высокая скорость
процесса, высокий выход продукта, чистота получаемых
продуктов и простота их выделения.
• Недостатки: дефицитность применяемого
электролитического водорода и катализаторов, большая
пожаро- и взрывоопасность процесса и необходимость во
многих случаях использования автоклавов.
• Скорость восстановления водородом на поверхности
катализатора (контактно-каталитического восстановления)
зависит от структуры субстрата, пространственных
факторов, от его сорбционной активности. Легкость
гидрирования отдельных групп, как правило, уменьшается
в следующей последовательности:
C = C > NO2 > C = O > –CN >
и
> –OH > –COOH
N
25
26. Катализаторы
• В химико-фармацевтической промышленности широкоприменяют скелетный катализатор никель Ренея
при нагревании в автоклавах, реже платиновые и
палладиевые катализаторы, которые, обладая всеми
достоинствами никелевых, но значительно активнее
их.
• Водородом в присутствии Pt и Pd восстанавливают
почти все органические соединения, способные к
восстановлению, причем часто при атмосферном
давлении. Однако платиновые и палладиевые
катализаторы дорогие и, из-за большой активности,
обычные
катализаторы
обладают
малой
селективностью.
• Для изменения активности катализаторов и увеличения
их селективности используют различные добавки
(промоторы и ингибиторы)
26
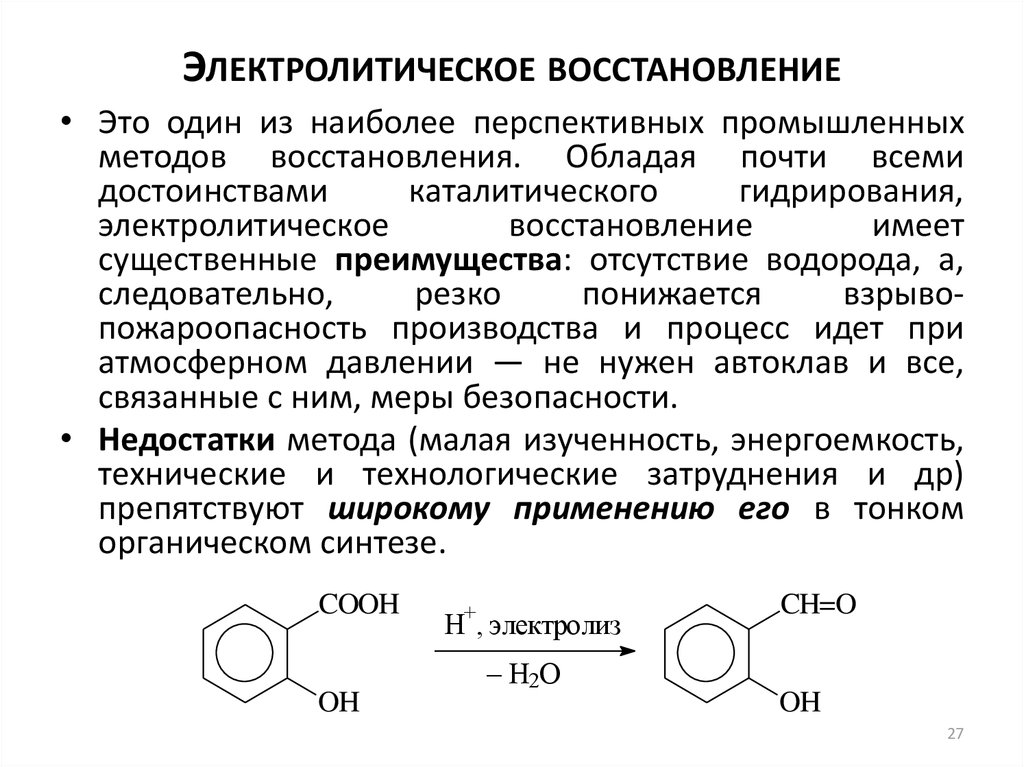
27. Электролитическое восстановление
ЭЛЕКТРОЛИТИЧЕСКОЕ ВОССТАНОВЛЕНИЕ• Это один из наиболее перспективных промышленных
методов восстановления. Обладая почти всеми
достоинствами
каталитического
гидрирования,
электролитическое
восстановление
имеет
существенные преимущества: отсутствие водорода, а,
следовательно,
резко
понижается
взрывопожароопасность производства и процесс идет при
атмосферном давлении — не нужен автоклав и все,
связанные с ним, меры безопасности.
• Недостатки метода (малая изученность, энергоемкость,
технические и технологические затруднения и др)
препятствуют широкому применению его в тонком
органическом синтезе.
COOH
OH
+
H , электролиз
– H2O
CH=O
OH
27
















 chemistry
chemistry








