Similar presentations:
Галогенопохідні ароматичних вуглеводнів
1. Галогенопохідні ароматичних вуглеводнів
ГАЛОГЕНОПОХІДНІ АРОМАТИЧНИХВУГЛЕВОДНІВ
• Ароматичні галогенопохідні поділяються на дві великі
групи: 1 – з галогеном у бензеновому ядрі і 2 – з галогеном
у бічному ланцюзі.
• Назви галогенопохідних будують за правилами як
замісникової, так і радикало-функціональної
номенклатури IUPAC. Використовують також тривіальні
назви.
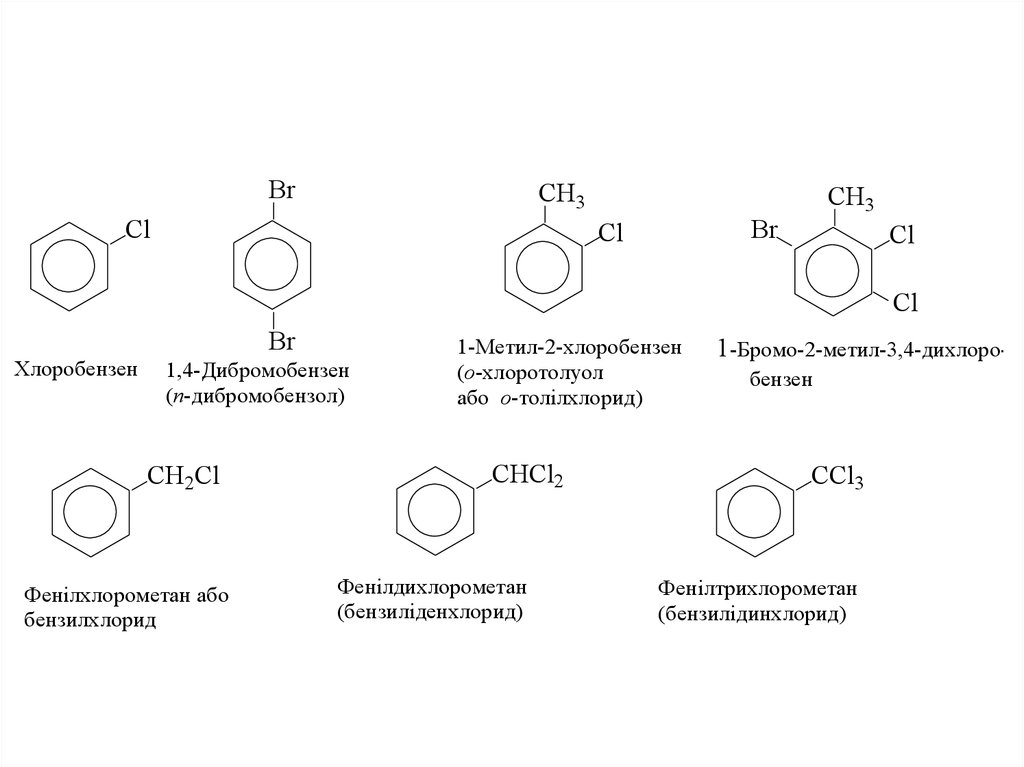
2.
BrCH3
Cl
CH3
Br
Cl
Cl
Cl
Br
Хлоробензен
1,4-Дибромобензен
(п-дибромобензол)
CH2Cl
Фенілхлорометан або
бензилхлорид
1-Метил-2-хлоробензен
(о-хлоротолуол
або о-толілхлорид)
CHCl2
Фенілдихлорометан
(бензиліденхлорид)
1-Бромо-2-метил-3,4-дихлоробензен
CCl3
Фенілтрихлорометан
(бензилідинхлорид)
3. Методи одержання
МЕТОДИ ОДЕРЖАННЯІснують три основних способи одержання
галогенопохідних ароматич-них вуглеводнів:
1 - заміщення атома водню на атом галогену в
бензеновому кільці;
2 - заміщення атома водню на атом галогену в бічному
ланцюзі;
3 - реакція хлорометилювання;
1. Заміщення атома водню на атом галогену в
бензеновому кільці
Реакція протікає за механізмом SE. Реакційна здатність
галогенів при цьому спадає в ряді F > CI > Br >I .
Бензен реагує з хлором у присутності каталізаторів
Фріделя-Крафтса (кислот Льюїса) AlCI3, FeCI3, FeBr3, SbCI3,
BF3 тощо.
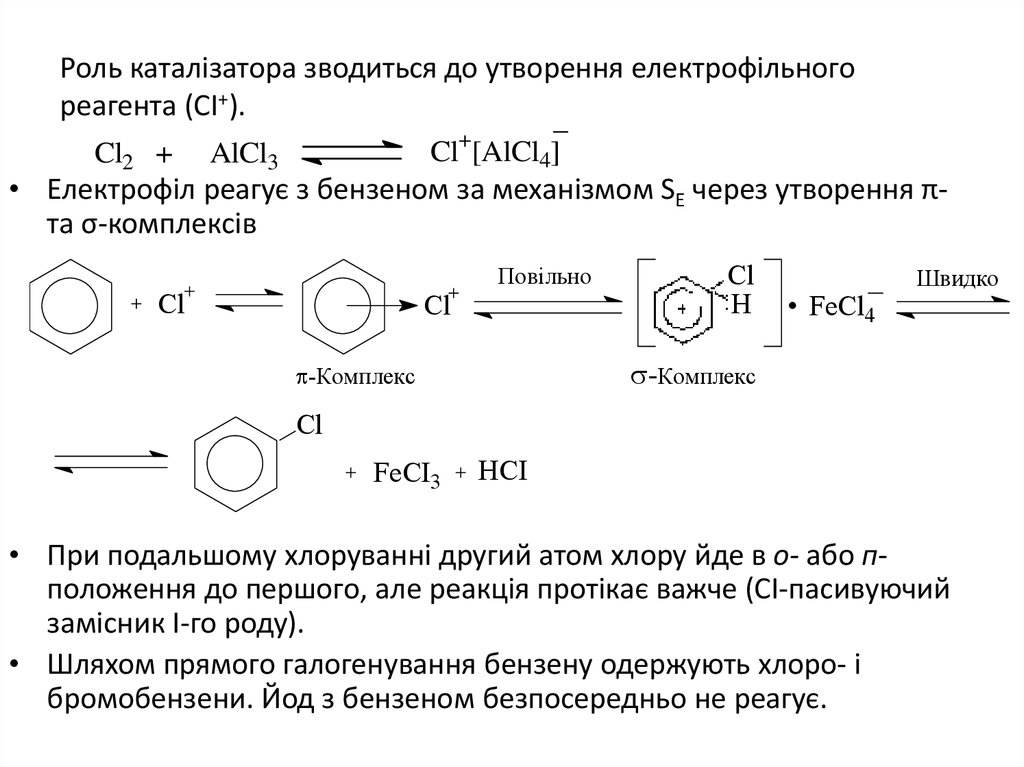
4. Роль каталізатора зводиться до утворення електрофільного реагента (СІ+).
_Cl2 +
+
Cl [AlCl4]
AlCl3
• Електрофіл реагує з бензеном за механізмом SE через утворення πта σ-комплексів
Повільно
Cl
Cl
Cl
H
FeCl4
Швидко
-Комплекс
-Комплекс
Cl
FeCI3
HCI
• При подальшому хлоруванні другий атом хлору йде в о- або пположення до першого, але реакція протікає важче (СІ-пасивуючий
замісник І-го роду).
• Шляхом прямого галогенування бензену одержують хлоро- і
бромобензени. Йод з бензеном безпосередньо не реагує.
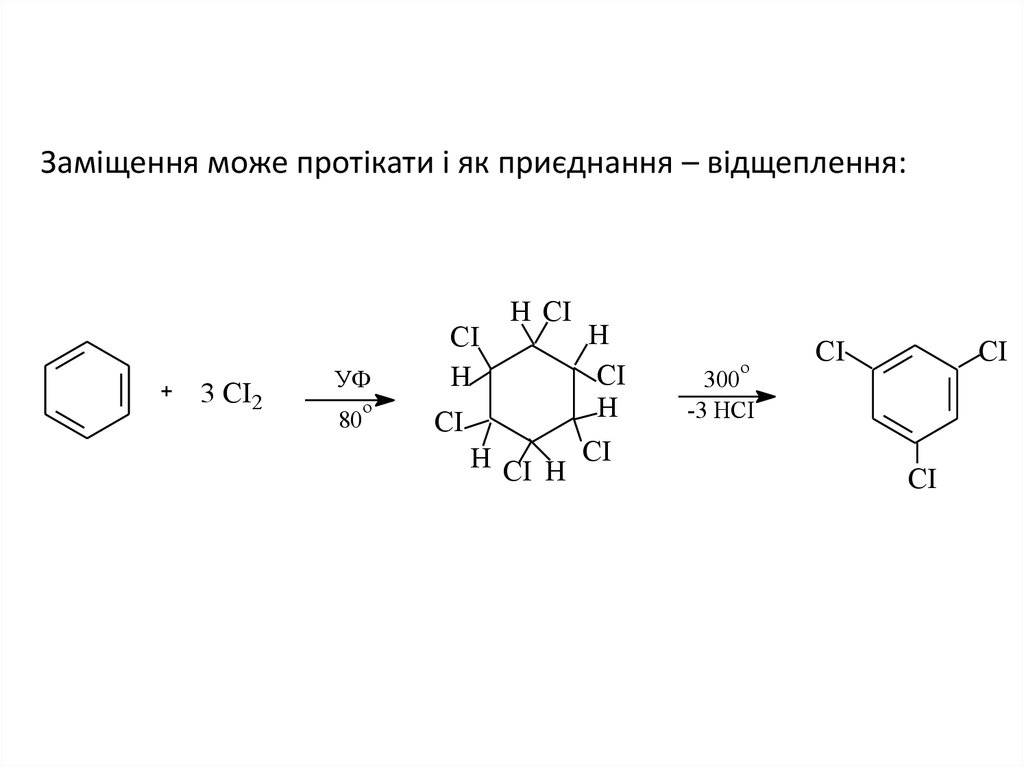
5. Заміщення може протікати і як приєднання – відщеплення:
Заміщення може протікати і як приєднання – відщеплення:3 СІ2
УФ
о
80
СІ
Н
СІ
Н СІ
Н
СІ
Н
Н СІ Н СІ
о
300
-3 НСІ
СІ
СІ
СІ
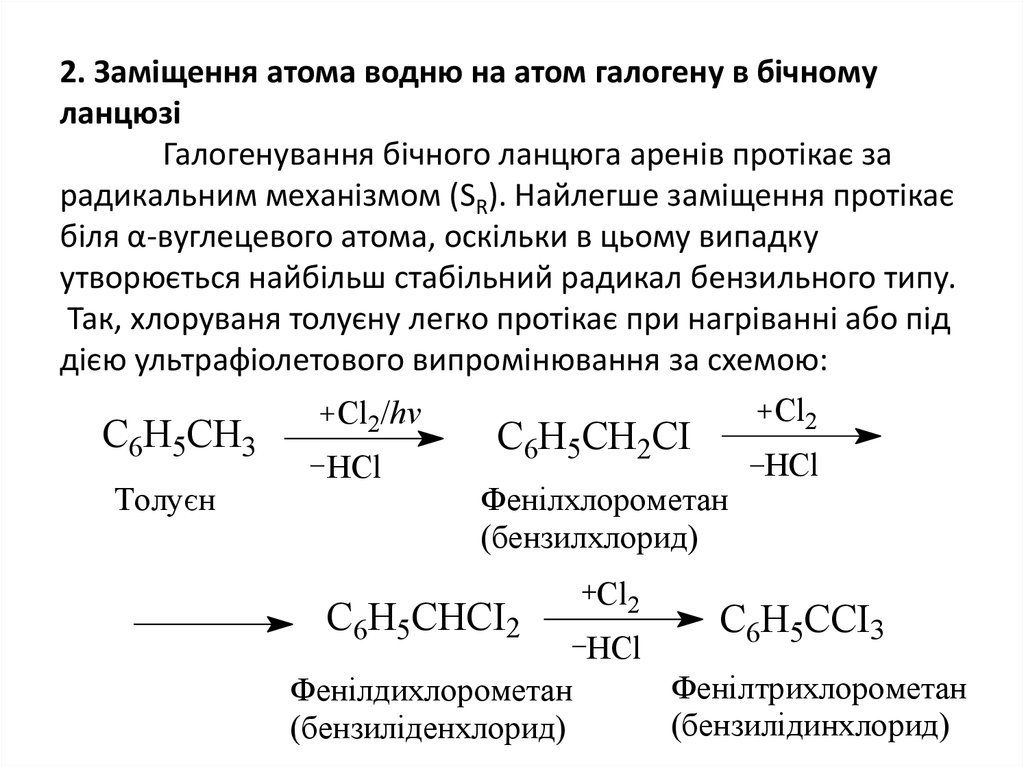
6. 2. Заміщення атома водню на атом галогену в бічному ланцюзі Галогенування бічного ланцюга аренів протікає за радикальним
механізмом (SR). Найлегше заміщення протікаєбіля α-вуглецевого атома, оскільки в цьому випадку
утворюється найбільш стабільний радикал бензильного типу.
Так, хлоруваня толуєну легко протікає при нагріванні або під
дією ультрафіолетового випромінювання за схемою:
Cl2
Cl2/hv
C6H5CH3
Толуєн
HCl
C6H5CH2CI
Фенілхлорометан
(бензилхлорид)
C6H5CHCI2
Фенілдихлорометан
(бензиліденхлорид)
Cl2
HCl
HCl
C6H5CCI3
Фенілтрихлорометан
(бензилідинхлорид)
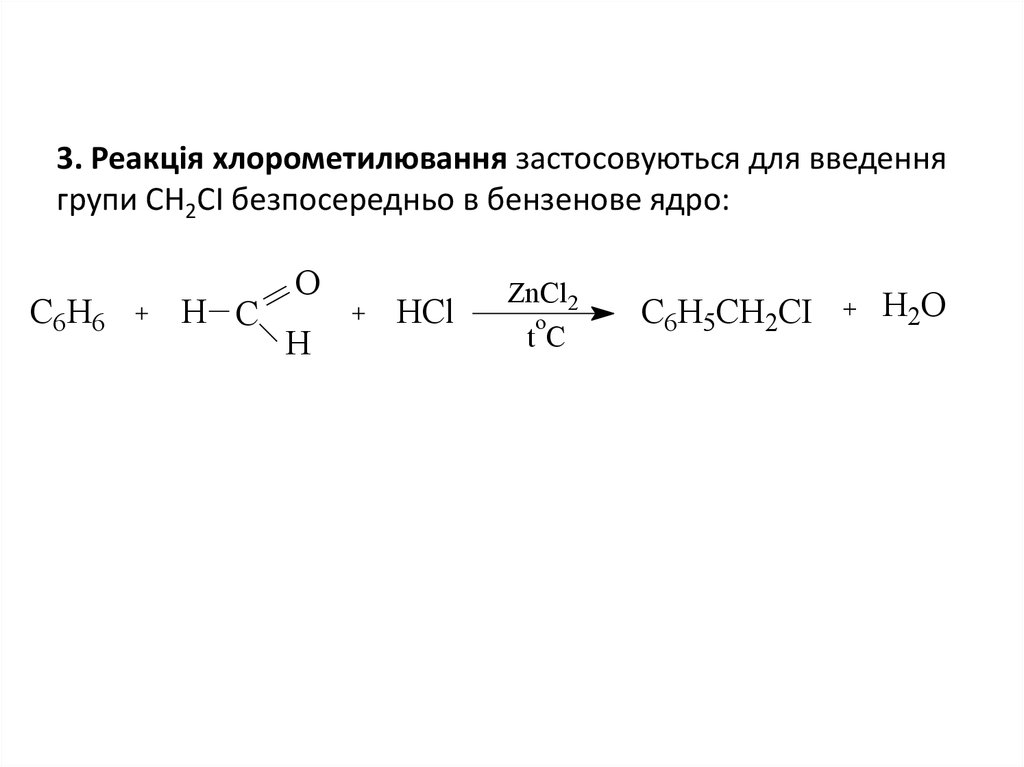
7. 3. Реакція хлорометилювання застосовуються для введення групи СН2СІ безпосередньо в бензенове ядро:
C6H6Н C
О
H
HCl
ZnCl2
o
tC
C6H5CH2CI
H2O
8. хімічні властивості
• Величини дипольних моментів у них менші, ніж у подібнихгалогеналканів. Це свідчить про меншу полярність зв’язку
С-НаІ за рахунок спряження неподіленої пари електронів
атому галогену з π-електронною системою бензенового
кільця (р-π спряження). Спряження призводить також до
зменшення довжини зв’язку C-Hal в порівнянні з
алкілгалогенідами.
З цих причин атом галогену в бензеновому ядрі
малоактивний і дуже важко вступає в реакції заміщення,
при взаємодії з нуклеофільними реагентами.
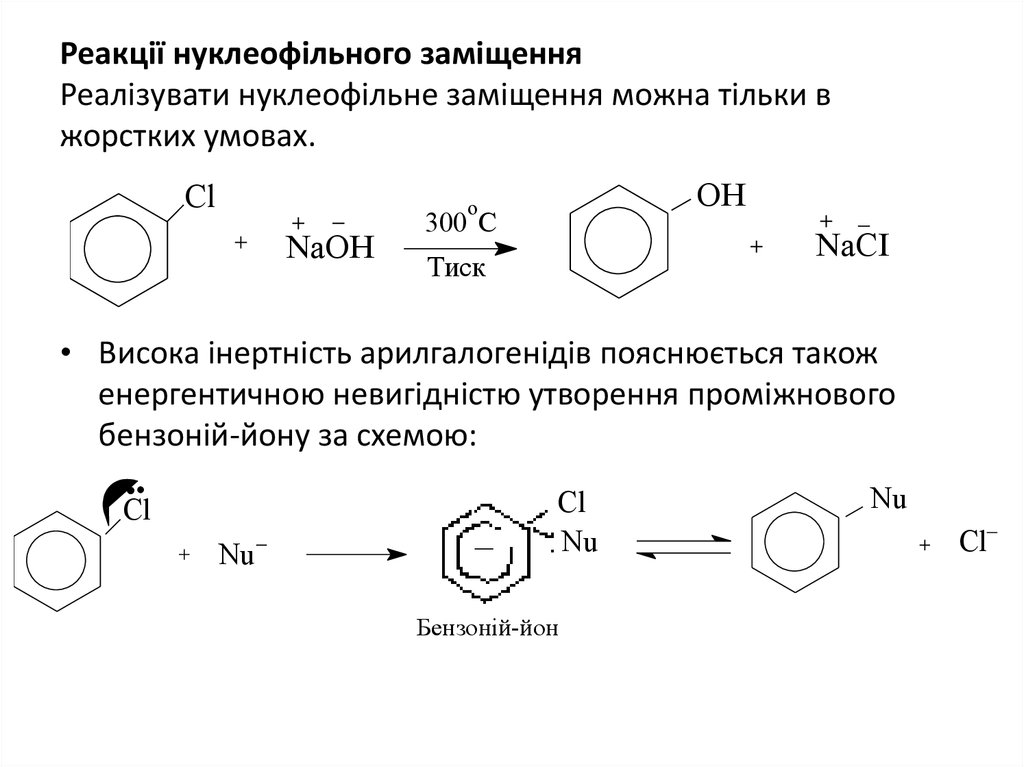
9. Реакції нуклеофільного заміщення Реалізувати нуклеофільне заміщення можна тільки в жорстких умовах.
ClOH
o
NaOH
300 C
NaCI
Тиск
• Висока інертність арилгалогенідів пояснюється також
енергентичною невигідністю утворення проміжнового
бензоній-йону за схемою:
Cl
Nu
Cl
Nu
Бензоній-йон
Nu
Cl
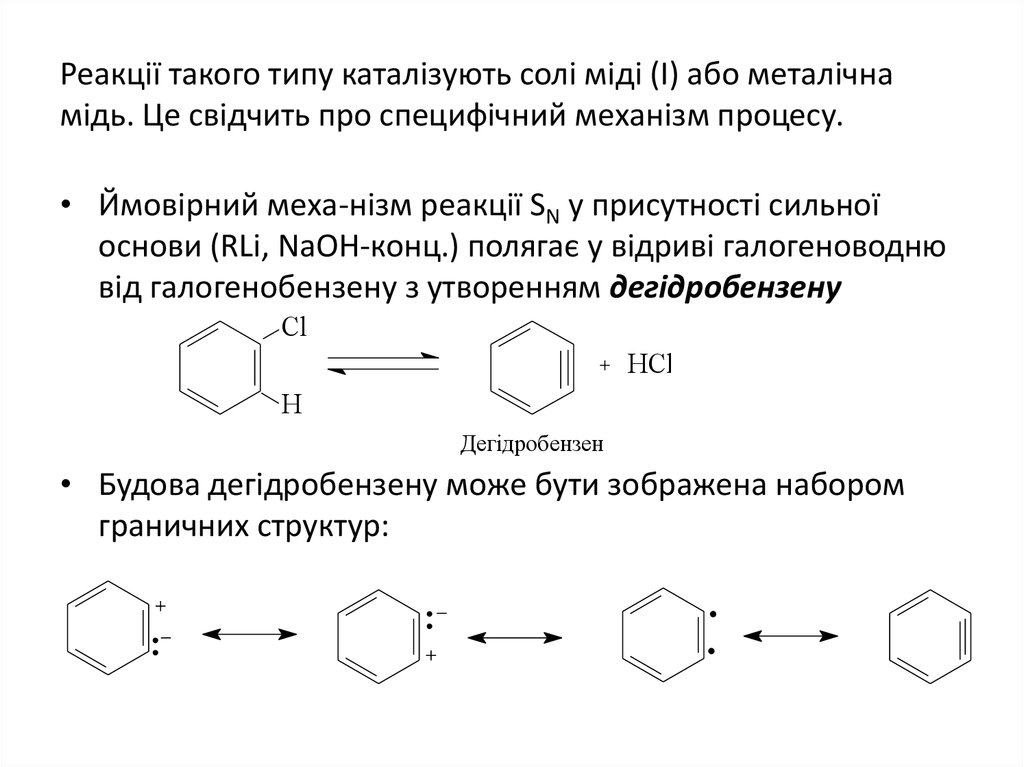
10. Реакції такого типу каталізують солі міді (І) або металічна мідь. Це свідчить про специфічний механізм процесу.
• Ймовірний меха-нізм реакції SN у присутності сильноїоснови (RLi, NaOH-конц.) полягає у відриві галогеноводню
від галогенобензену з утворенням дегідробензену
Cl
HCl
H
Дегідробензен
• Будова дегідробензену може бути зображена набором
граничних структур:
11.
абоO
O
H
H
OH
H
H
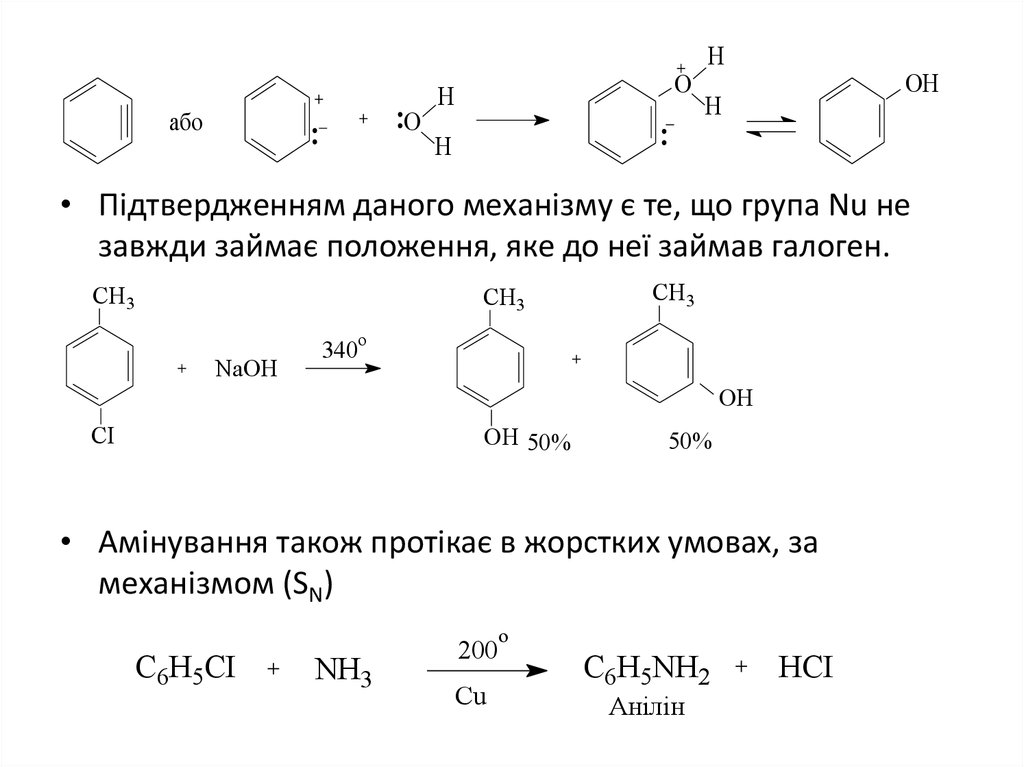
• Підтвердженням даного механізму є те, що група Nu не
завжди займає положення, яке до неї займав галоген.
CH3
CH3
CH3
o
NaOH
340
OH
CI
OH 50%
50%
• Амінування також протікає в жорстких умовах, за
механізмом (SN)
o
C6H5CI
NH3
200
Cu
C6H5NH2
Анілін
HCI
12.
• Реакція нуклеофільного заміщення протікає значно легше увипадку наявності в ароматичному ядрі в о- або пположеннях відносно галогену електроноакценопторних
груп (замісників ІІ-роду).
NO2
NaOH
NO2
OH
Легко
о-Нітрофенол
NO2
CI
OCH3
CH OH
о-Метоксинітробензен
3
NO2
NH2
NH3
о-Нітроанілін
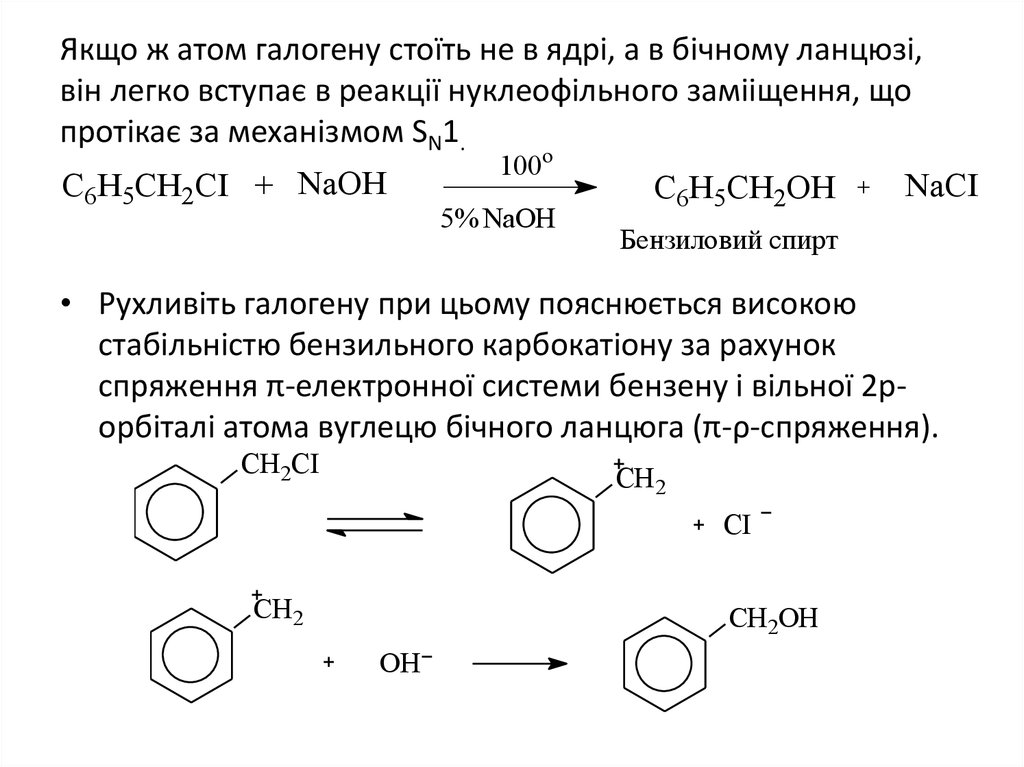
13. Якщо ж атом галогену стоїть не в ядрі, а в бічному ланцюзі, він легко вступає в реакції нуклеофільного замііщення, що протікає
за механізмом SN1.C6H5CH2CI + NaOH
100o
5% NaOH
C6H5CH2OH
NaCI
Бензиловий спирт
• Рухливіть галогену при цьому пояснюється високою
стабільністю бензильного карбокатіону за рахунок
спряження π-електронної системи бензену і вільної 2рорбіталі атома вуглецю бічного ланцюга (π-ρ-спряження).
CH2CI
CH2
CI
CH2
CH2ОН
OH
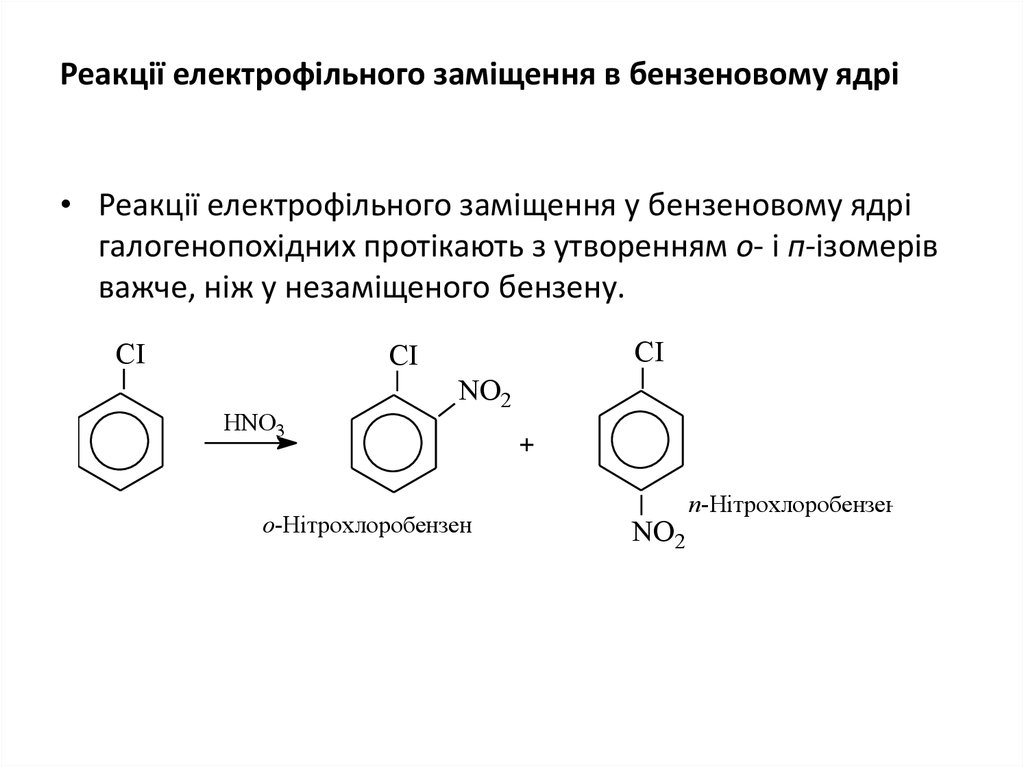
14. Реакції електрофільного заміщення в бензеновому ядрі
• Реакції електрофільного заміщення у бензеновому ядрігалогенопохідних протікають з утворенням о- і п-ізомерів
важче, ніж у незаміщеного бензену.
CI
CI
CI
НNO3
NO2
о-Нітрохлоробензен
+
NO2
п-Нітрохлоробензен




 chemistry
chemistry








