Similar presentations:
Ароматичні аміни
1. АРОМАТИЧНІ АМІНИ
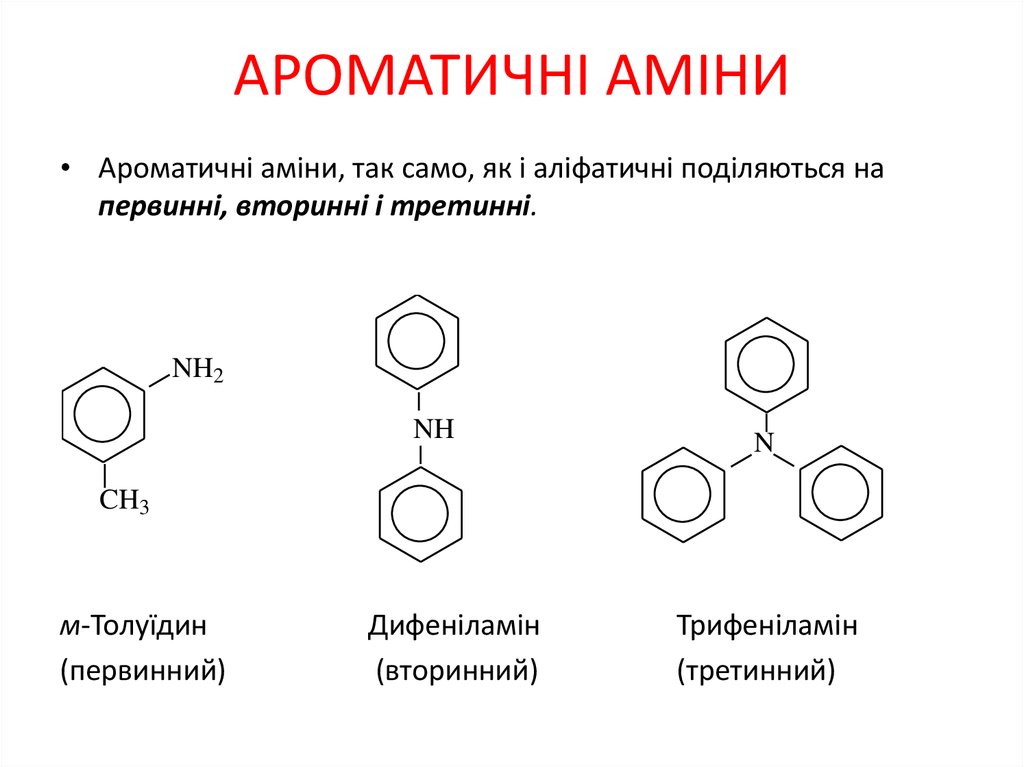
• Ароматичні аміни, так само, як і аліфатичні поділяються напервинні, вторинні і третинні.
NH2
NH
N
CH3
м-Толуїдин
(первинний)
Дифеніламін
(вторинний)
Трифеніламін
(третинний)
2. СПОСОБИ ОДЕРЖАННЯ
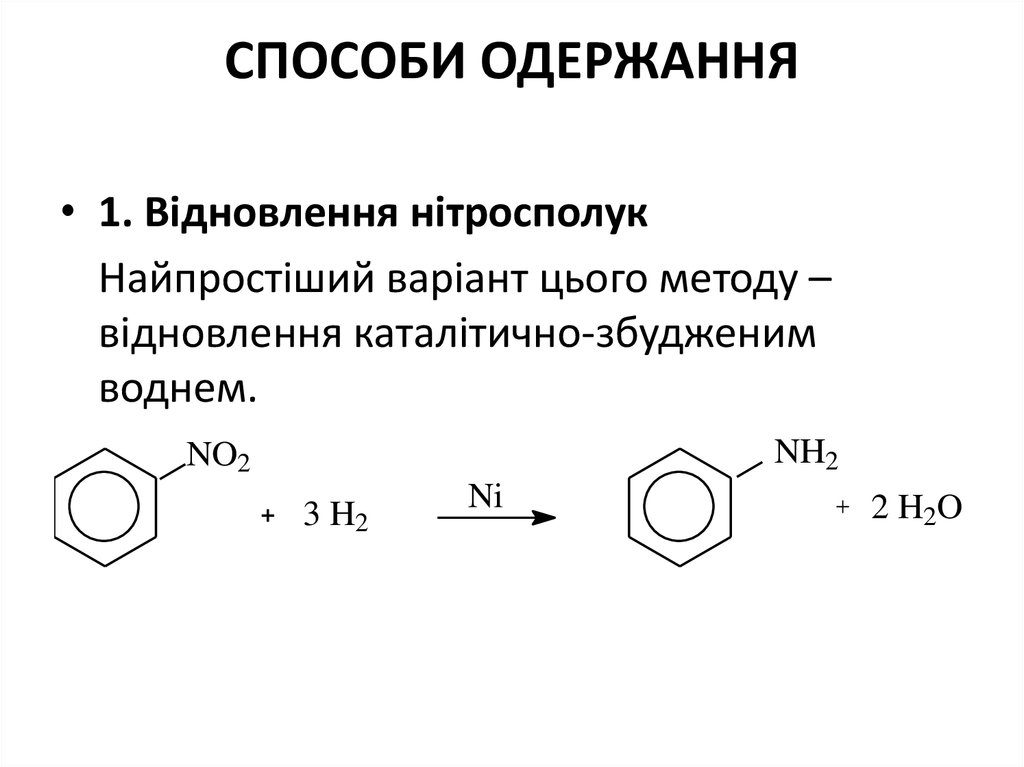
• 1. Відновлення нітросполукНайпростіший варіант цього методу –
відновлення каталітично-збудженим
воднем.
NH2
NO2
3 H2
Ni
2 H2O
3.
Існує велика кількість інших відновлювальнихсистем: Fe+HCI; Sn+НCI; H2S; Na2S.
У промислових умовах часто застосовують чавунні
ошурки в розведеній хлоридній кислоті. Так,
одержання аніліну з нітробензену можна
представити схемою:
o
4 C6H5 NO2 9 Fe 4 H2O
95 C
FeCI2
4 C6H5 NH2
3 Fe3O4;
4. 2. З галогенопохідних 2.1. Отримання первинних амінів
oC6H5CI + 2 NH3
P, 250
Cu
C6H5NH2 NH4CI
Реакція арилювання аміаку протікає в
жорстких умовах внаслідок низької
реакційної здатності атома галогену, що
зв'язаний з бензеновим ядром. В
аліфатичному ряді ця реакція протікає
значно легше.
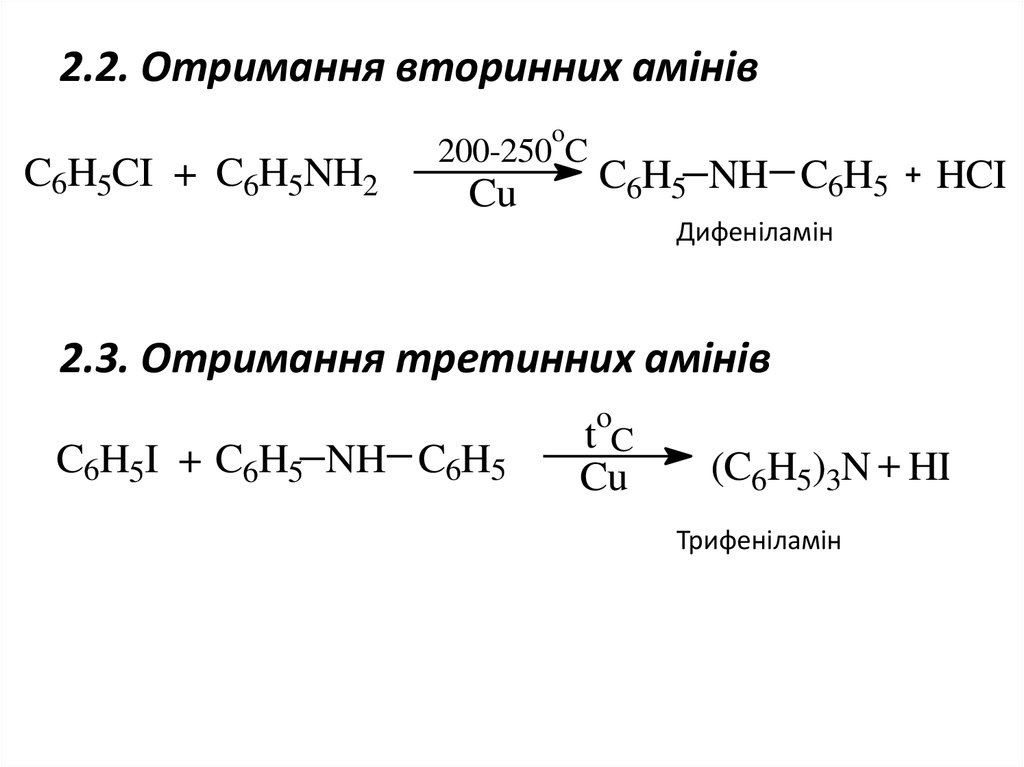
5. 2.2. Отримання вторинних амінів
oC6H5CI + C6H5NH2
200-250 C
Cu
C6H5 NH C6H5
HCI
Дифеніламін
2.3. Отримання третинних амінів
o
C6H5I + C6H5 NH C6H5
tC
Cu
(C6H5)3N + HI
Трифеніламін
6. ХІМІЧНІ ВЛАСТИВОСТІ
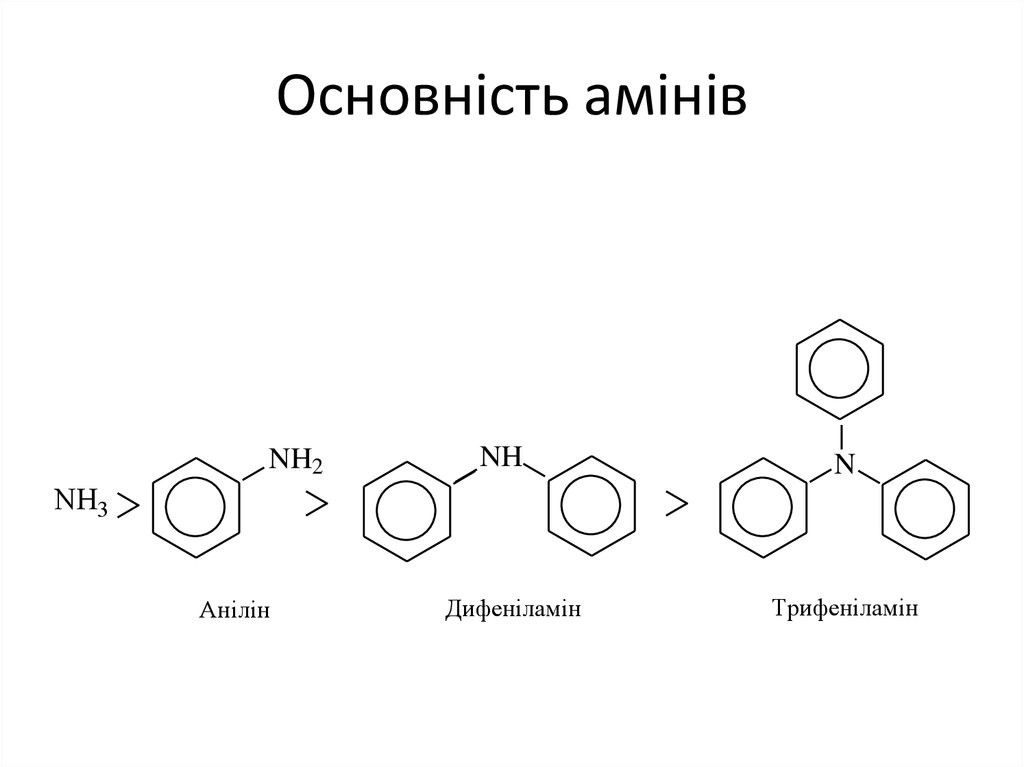
• 1. Основність ариламінів.Ариламіни є слабшими основами порівняно з
аліфатичними. Це пов'язано зі спряженням
неподіленої електронної пари атома азоту з πелектронами бензенового ядра (р-π-спряження).
Завдяки цьому знижується здатність атома азоту
реагувати з протоном Н+ (кислотою). Введення
другого бензенового кільця ще більше знижує
основність, третинні ариламіни основних
властивостей не проявляють.
7. Основність амінів
NH2NH
N
NH3
Анілін
Дифеніламін
Трифеніламін
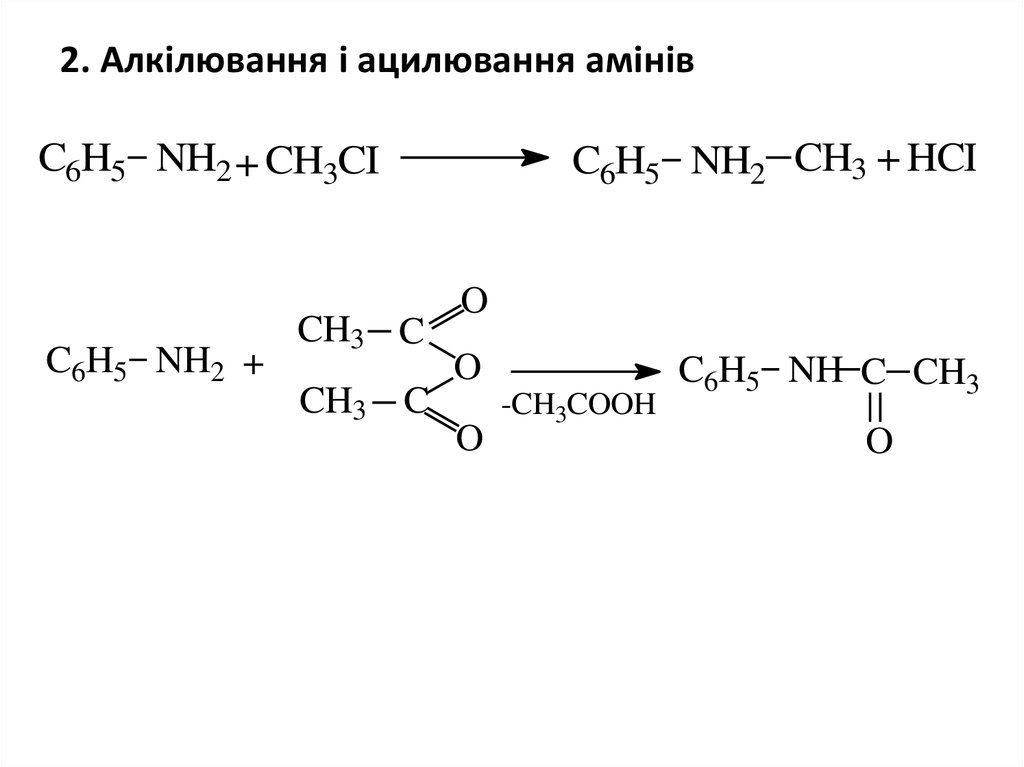
8. 2. Алкілювання і ацилювання амінів
C6H5 NH2 + CH3CIC6H5 NH2 +
CH3 C
CH3 C
C6H5 NH2 CH3 + HCI
O
O
O
-CH3COOH
C6H5 NH C CH3
O
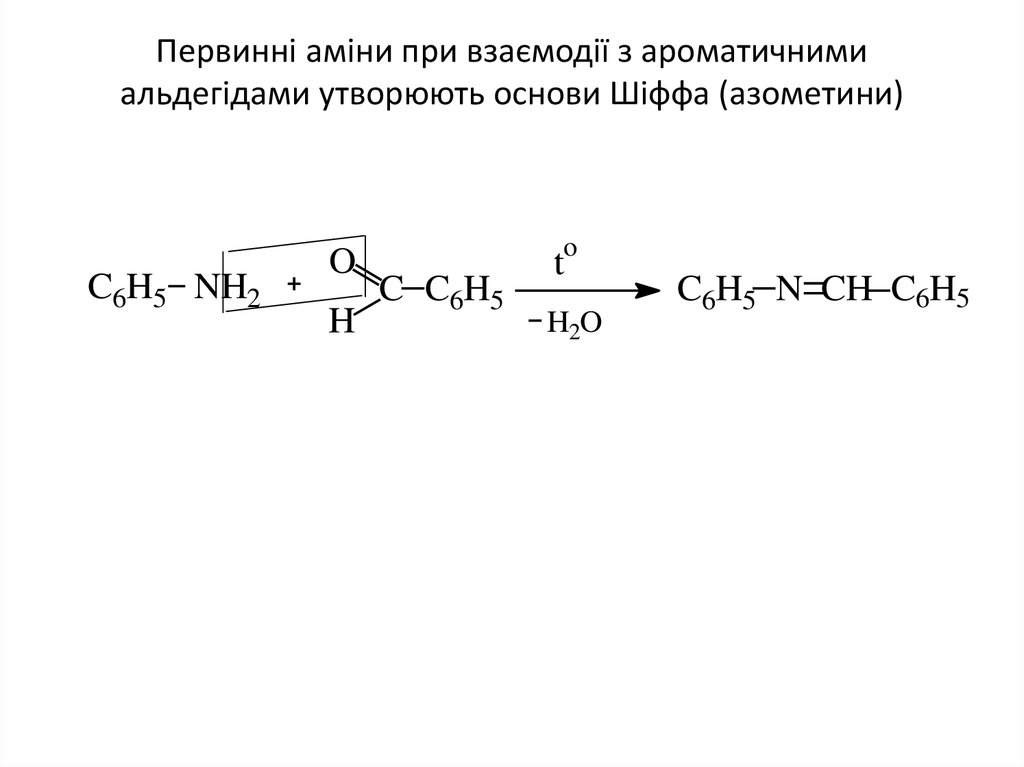
9. Первинні аміни при взаємодії з ароматичними альдегідами утворюють основи Шіффа (азометини)
Первинні аміни при взаємодії з ароматичнимиальдегідами утворюють основи Шіффа (азометини)
C6H5 NH2
O
H
o
C C6H5
t
H2O
C6H5 N CH C6H5
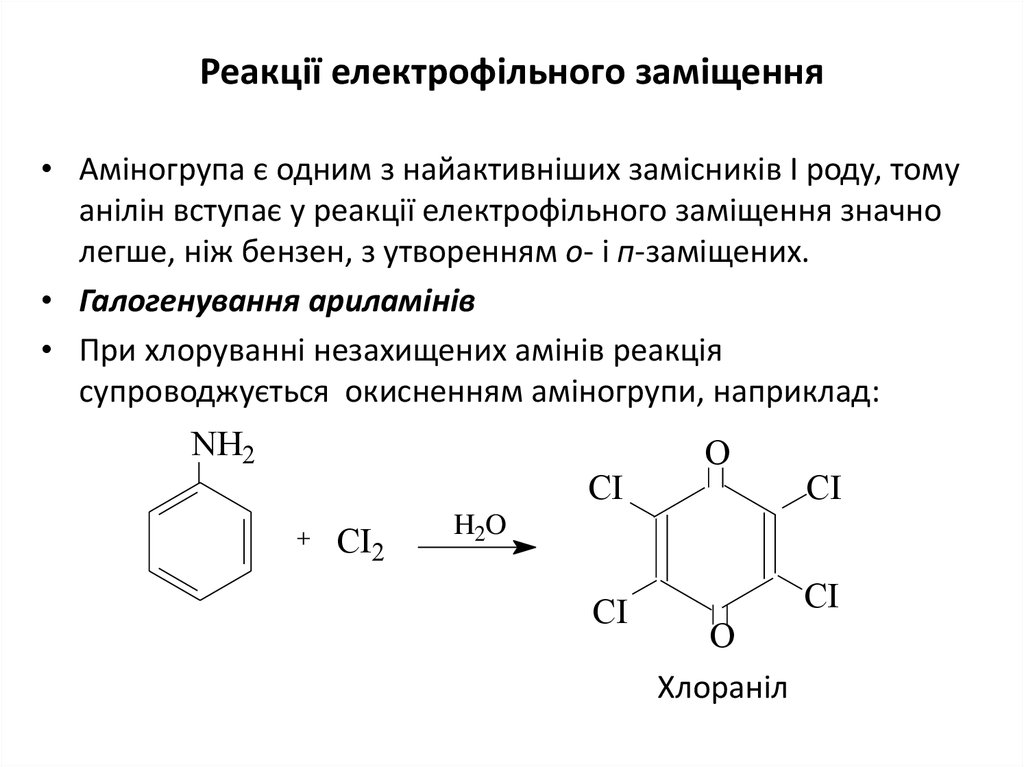
10. Реакції електрофільного заміщення
• Аміногрупа є одним з найактивніших замісників І роду, томуанілін вступає у реакції електрофільного заміщення значно
легше, ніж бензен, з утворенням о- і п-заміщених.
• Галогенування ариламінів
• При хлоруванні незахищених амінів реакція
супроводжується окисненням аміногрупи, наприклад:
NH2
CI
CI2
O
CI
H2O
CI
CI
O
Хлораніл
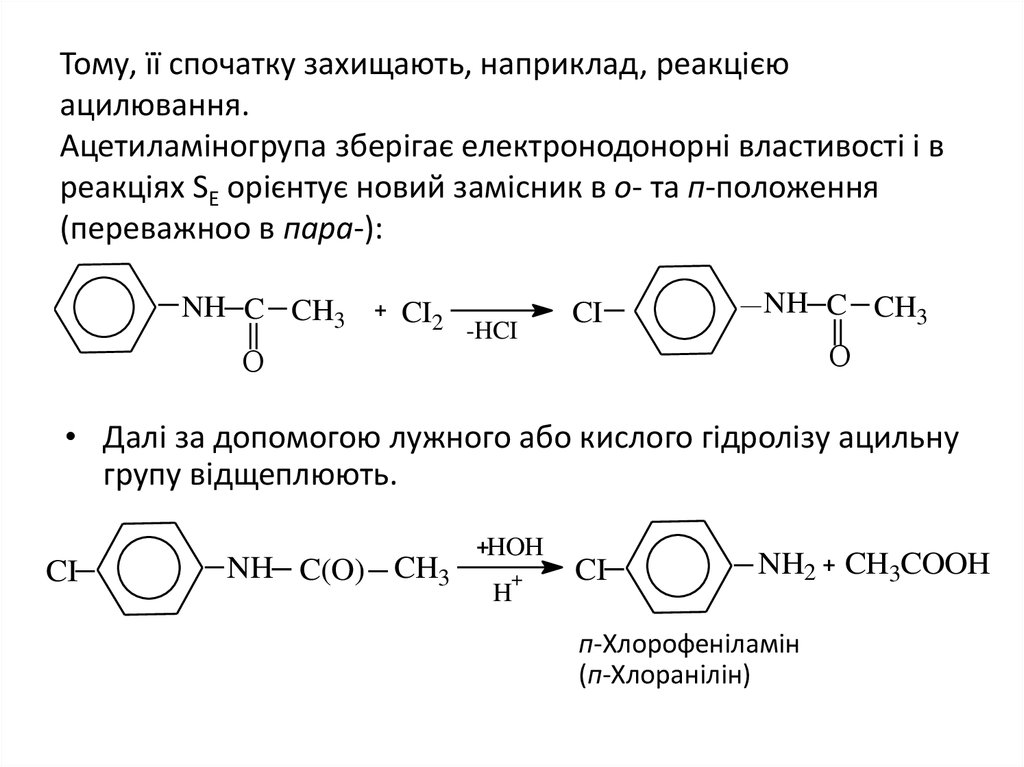
11. Тому, її спочатку захищають, наприклад, реакцією ацилювання. Ацетиламіногрупа зберігає електронодонорні властивості і в реакціях SE орієнт
Тому, її спочатку захищають, наприклад, реакцієюацилювання.
Ацетиламіногрупа зберігає електронодонорні властивості і в
реакціях SE орієнтує новий замісник в о- та п-положення
(переважноо в пара-):
NH C CH3
CI2
-HCI
CI
NH C CH3
O
O
• Далі за допомогою лужного або кислого гідролізу ацильну
групу відщеплюють.
CI
NH C(O) CH3
HOH
+
H
CI
NH2 CH3COOH
п-Хлорофеніламін
(п-Хлоранілін)
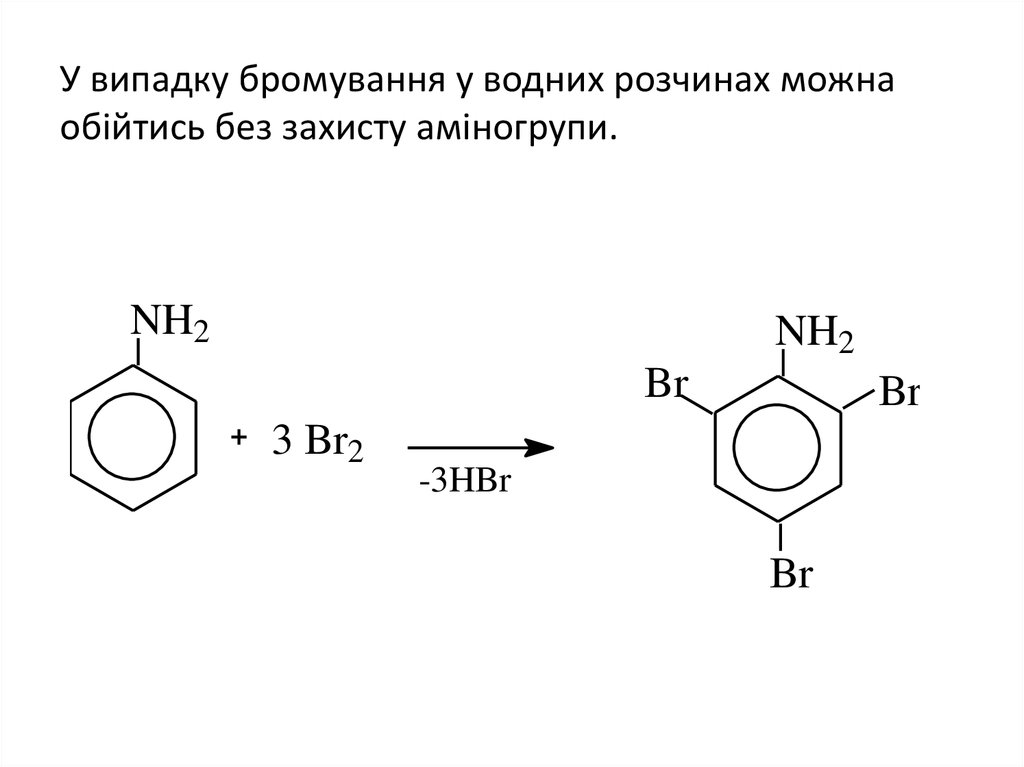
12. У випадку бромування у водних розчинах можна обійтись без захисту аміногрупи.
NH2NH2
Br
3 Br2
Br
-3HBr
Br
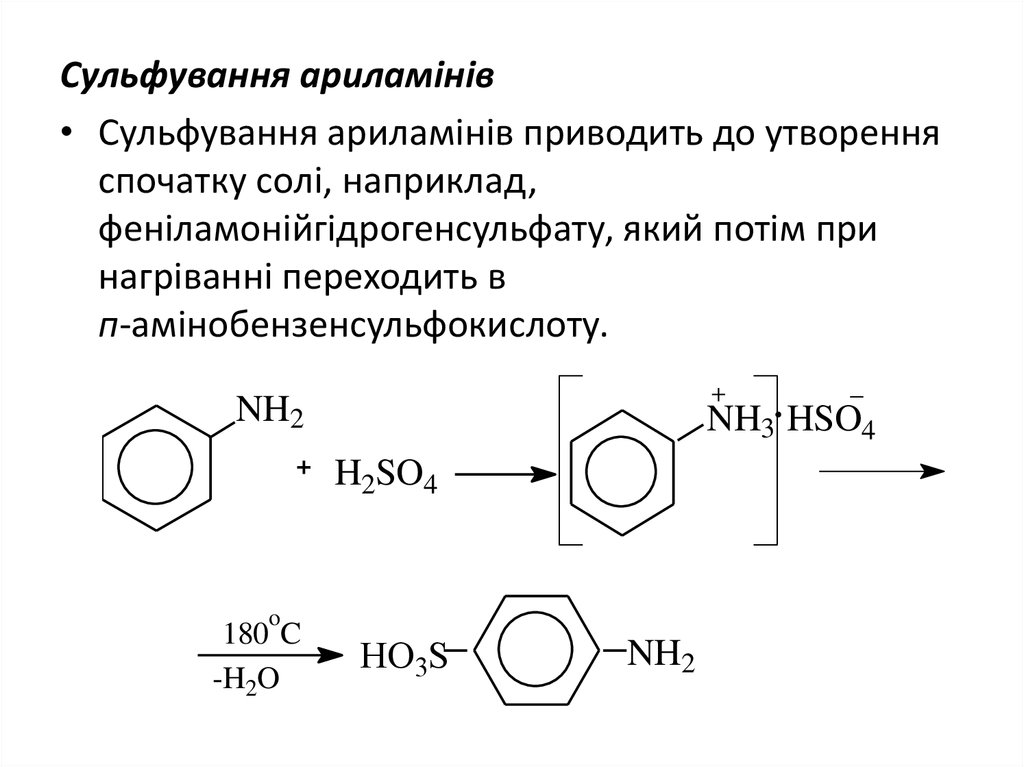
13. Сульфування ариламінів
• Сульфування ариламінів приводить до утворенняспочатку солі, наприклад,
феніламонійгідрогенсульфату, який потім при
нагріванні переходить в
п-амінобензенсульфокислоту.
NH2
NH3 HSO4
H2SO4
o
180 C
-H2O
HO3S
NH2
14. АРОМАТИЧНІ ДІАЗО- ТА АЗОСПОЛУКИ, АЗОБАРВНИКИ
• Ароматичні азосполуки - це речовинизагальної формули Ar—N=N—Ar у
молекулах яких азогрупа —N=N— зв'язана з
двома арильними залишками.
• В ароматичних діазосполуках (Ar—N=N—X)
азогрупа, зв'язана одночасно з арильним
залишком і неорганічним фрагментом (Х).
15. Діазосполуки
Найстабільнішими ароматичними діазосполуками є солідіазонію
([ArN≡N]+X─),
де (Х=Hal, SO3H, CN), але і вони доволі нестабільні
речовини, які вибухають при нагріванні.
Назви солей діазонію складаються з назви ароматичного
залишка (1), до якого додається закінчення "діазоній"- (2)
із зазначенням назви аніону – (3).
N N CI
1
2
Фенілдіазонійхлорид
3
N N Br
CH3
1
2
3
п-Толілдіазонійбромід
16. Способи оДЕРЖання (реакції діазотування)
СПОСОБИ ОДЕРЖАННЯ (РЕАКЦІЇ ДІАЗОТУВАННЯ)• Солі діазонію утворюються при дії HNO2 на первинні
ариламіни
o
C6H5 NH2 HNO2 HCI
0-5 C
C6H5N2CI 2H2O
• Оскільки нітритна кислота не стійка, її одержують
безпосередньо у процесі діазотування за реакцією:
NaNO2 HCI
NaCI + HNO2
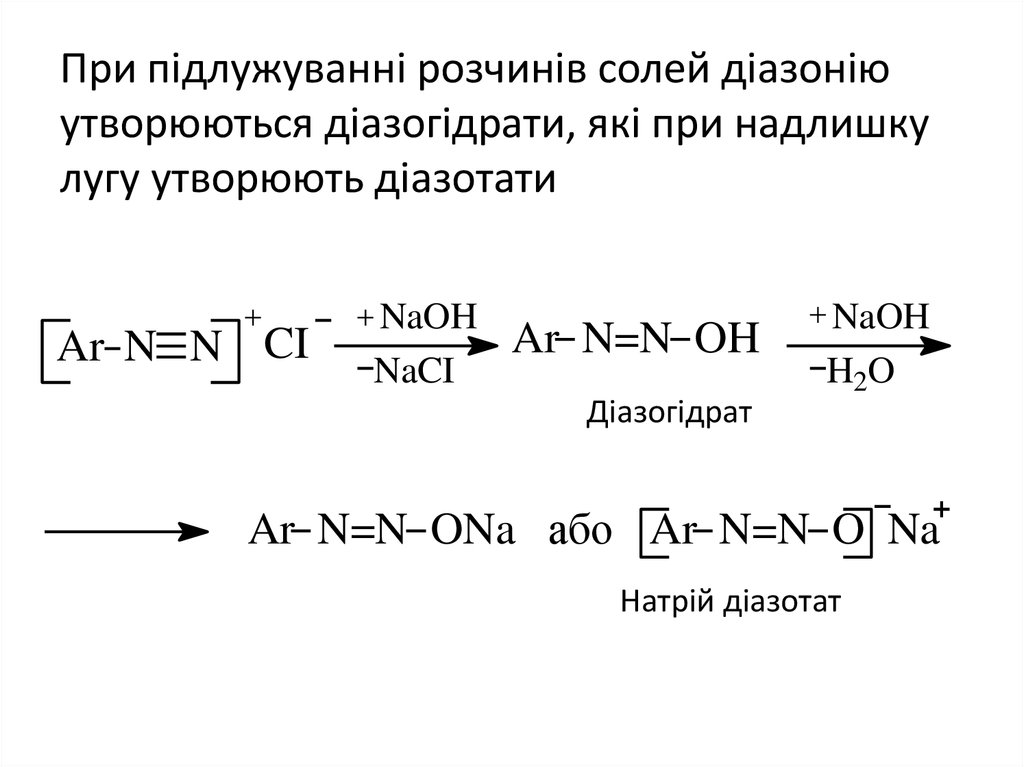
17. При підлужуванні розчинів солей діазонію утворюються діазогідрати, які при надлишку лугу утворюють діазотати
При підлужуванні розчинів солей діазоніюутворюються діазогідрати, які при надлишку
лугу утворюють діазотати
Ar N N CI
NaOH
NaCI
Ar N=N OH
Діазогідрат
NaOH
H2O
Ar N=N ONa або Ar N=N O Na
Натрій діазотат
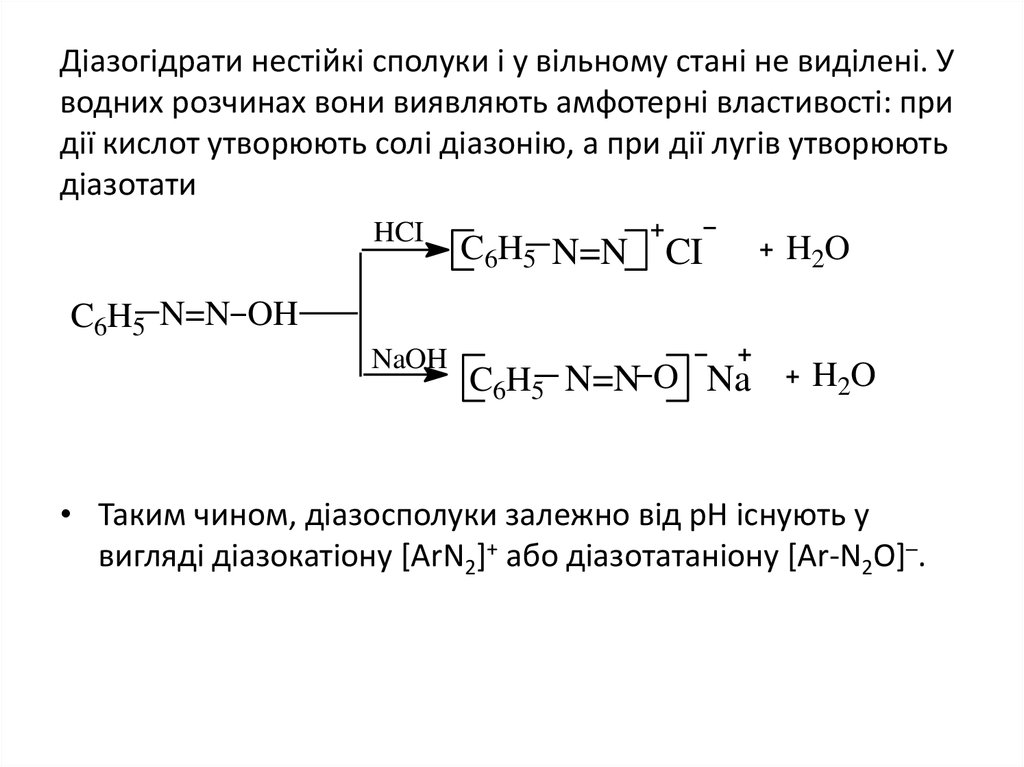
18. Діазогідрати нестійкі сполуки і у вільному стані не виділені. У водних розчинах вони виявляють амфотерні властивості: при дії кислот утвор
Діазогідрати нестійкі сполуки і у вільному стані не виділені. Уводних розчинах вони виявляють амфотерні властивості: при
дії кислот утворюють солі діазонію, а при дії лугів утворюють
діазотати
HCI
C6H5 N=N
CI
H2O
C6H5 N=N OH
NaOH
C6H5 N=N O Na
H2O
• Таким чином, діазосполуки залежно від рН існують у
вигляді діазокатіону [ArN2]+ або діазотатаніону [Ar-N2O]─.
19. ХІМІЧНІ ВЛАСТИВОСТІ
ХІМІЧНІ ВЛАСТИВОСТІ• Діазоарени характеризуються реакціями двох типів:
• 1 - реакції з заміщенням діазонієвої групи та виділенням
азоту;
• 2 - реакції зі збереженням атомів азоту без виділення N2.
Всі ці реакції відбуваються при взаємодії з
нуклеофільними реагентами.
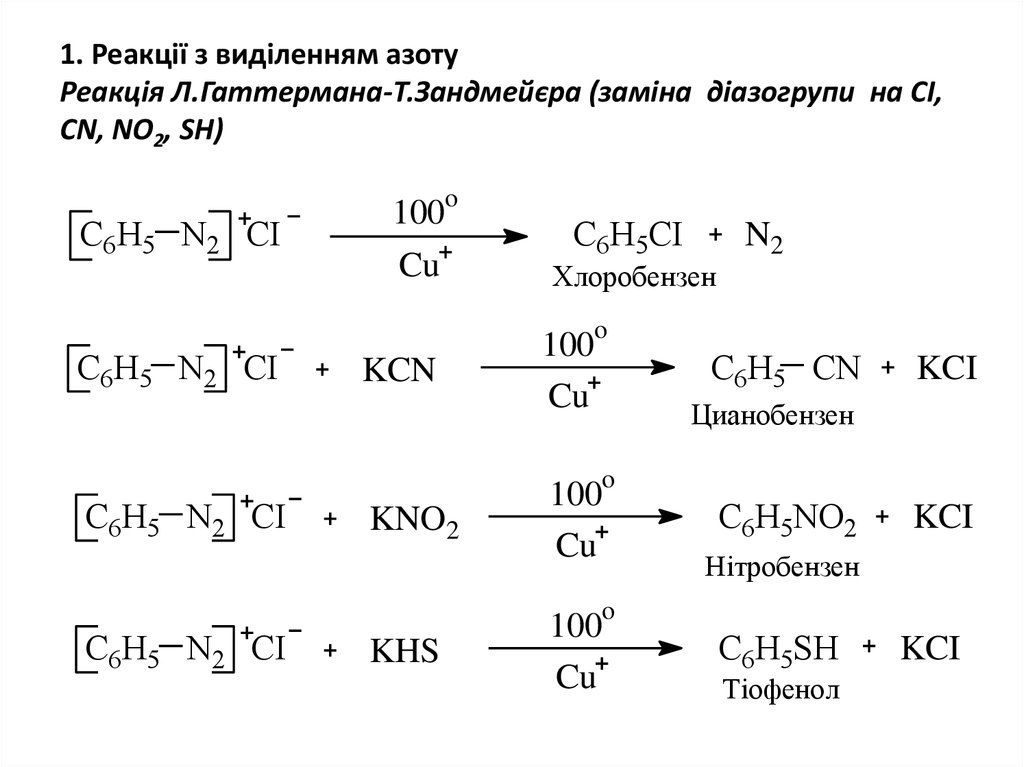
20. 1. Реакції з виділенням азоту Реакція Л.Гаттермана-Т.Зандмейєра (заміна діазогрупи на CI, CN, NO2, SН)
oC6H5 N2 CI
100
Cu
C6H5CI
Хлоробензен
N2
o
C6H5 N2 CI
KCN
100
Cu
C6H5 CN
KCI
Цианобензен
o
C6H5 N2 CI
KNO2
100
Cu
C6H5NO2
KCI
Нітробензен
o
C6H5 N2 CI
KHS
100
Cu
C6H5SH
Тіофенол
KCI
21. Розкладання солей діазонію при нагріванні
oC6H5N2CI + H2O
100 C
+
H
C6H5 OH + N2 + HCI
Фенол
Реакція відновлення (заміщення діазогрупи на водень)
C6H5N2CI + H3PO2 + H2O
C6H6 + N2 + HCI + H3PO3
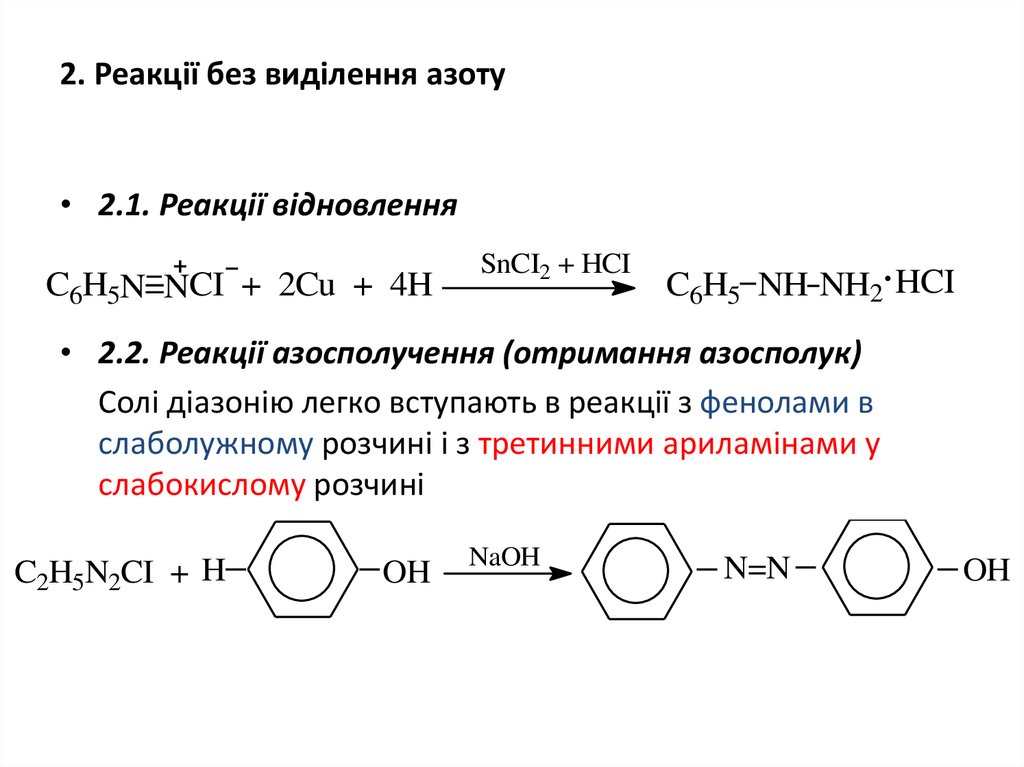
22. 2. Реакції без виділення азоту
• 2.1. Реакції відновленняC6H5N=NCI + 2Cu + 4H
SnCI2 + HCI
C6H5 NH NH2 HCI
• 2.2. Реакції азосполучення (отримання азосполук)
Солі діазонію легко вступають в реакції з фенолами в
слаболужному розчині і з третинними ариламінами у
слабокислому розчині
C2H5N2CI + H
OH
NaOH
N=N
OH
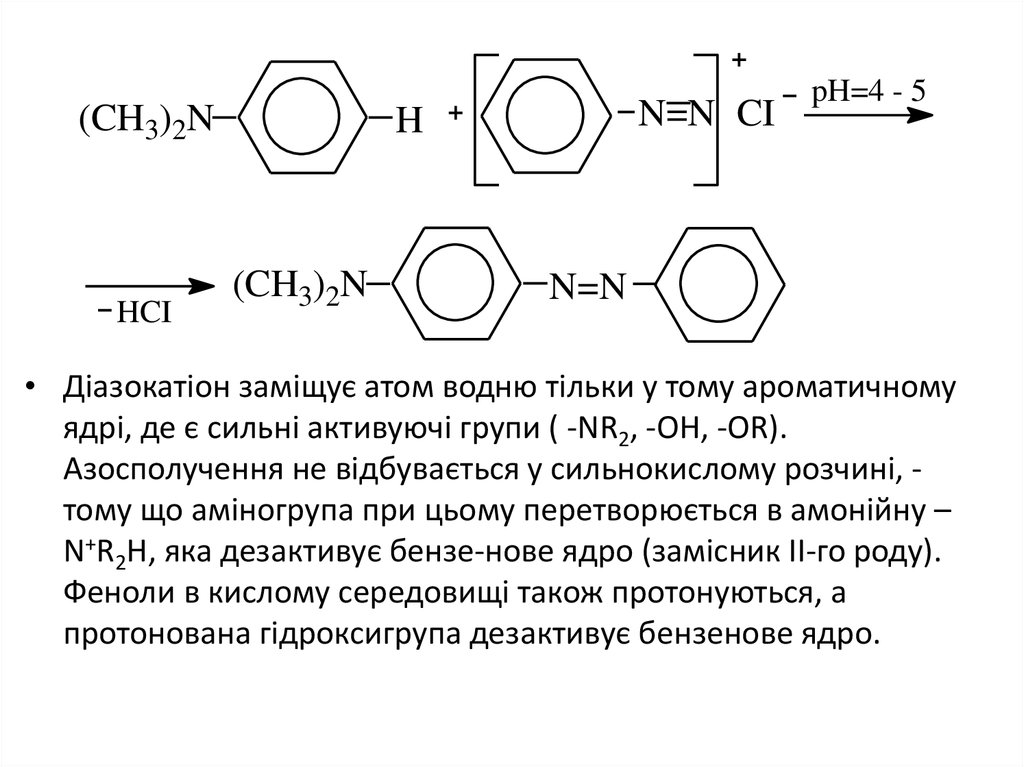
23.
(CH3)2NHCI
N=N CI
H
(CH3)2N
pH=4 - 5
N=N
• Діазокатіон заміщує атом водню тільки у тому ароматичному
ядрі, де є сильні активуючі групи ( -NR2, -OH, -OR).
Азосполучення не відбувається у сильнокислому розчині, тому що аміногрупа при цьому перетворюється в амонійну –
N+R2H, яка дезактивує бензе-нове ядро (замісник ІІ-го роду).
Феноли в кислому середовищі також протонуються, а
протонована гідроксигрупа дезактивує бензенове ядро.
24.
C6H5OHH
C6H5O H
H
• Реакція азосполучення відбувається у п-положенні, а якщо
воно зайняте, то в о-положенні, до NR2 або НОгрупи.
• Переважна більшість ароматичних азосполук забарвлена.
Багато з них використовуються як органічні барвники.
• Азобарвники - найбільш поширений клас синтетичних
барвників. Їх синтез складається з двох стадій:
• 1) діазотування
• 2) азосполучення.
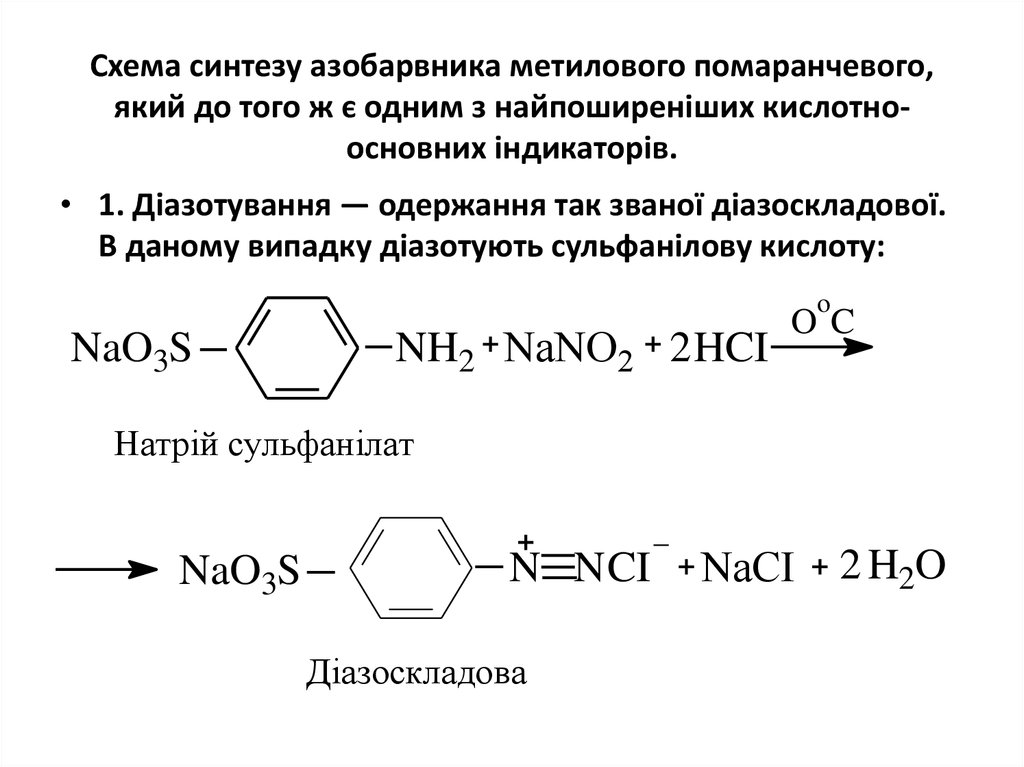
25. Схема синтезу азобарвника метилового помаранчевого, який до того ж є одним з найпоширеніших кислотно-основних індикаторів.
Схема синтезу азобарвника метилового помаранчевого,який до того ж є одним з найпоширеніших кислотноосновних індикаторів.
• 1. Діазотування ― одержання так званої діазоскладової.
В даному випадку діазотують сульфанілову кислоту:
o
NaO3S
NH2 NaNO2 2 HCI
OC
Натрій сульфанілат
NaO3S
N N CI
Діазоскладова
NaCI
2 H2O
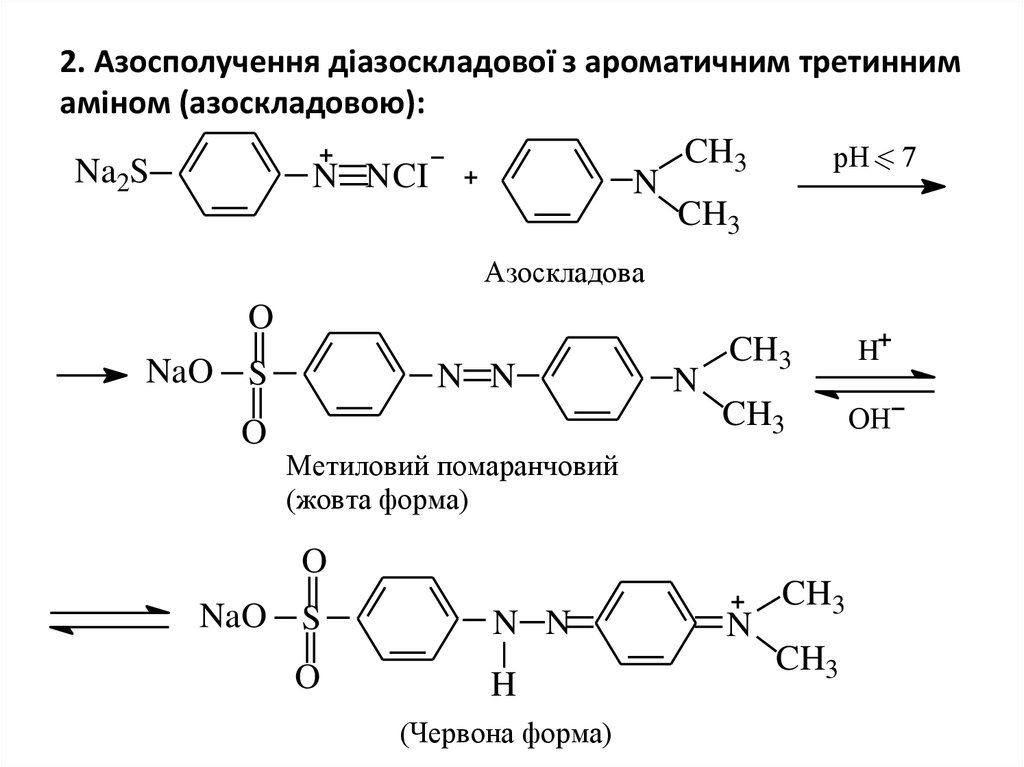
26. 2. Азосполучення діазоскладової з ароматичним третинним аміном (азоскладовою):
CH3рН < 7
Na2S
N N CI
N
CH3
Азоскладова
O
NaO S
O
N N
N
CH3
H
CH3
OH
Метиловий помаранчовий
(жовта форма)
O
NaO S
O
N N
H
(Червона форма)
N
CH3
CH3
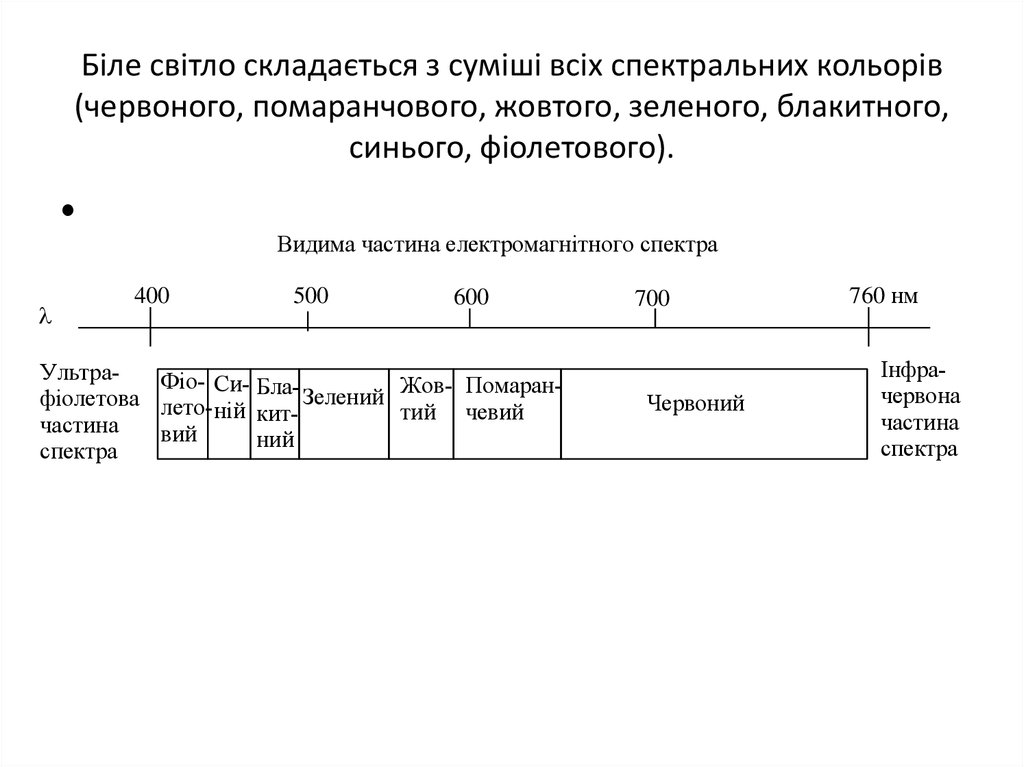
27. Біле світло складається з суміші всіх спектральних кольорів (червоного, помаранчового, жовтого, зеленого, блакитного, синього, фіолетового
Біле світло складається з суміші всіх спектральних кольорів(червоного, помаранчового, жовтого, зеленого, блакитного,
синього, фіолетового).
Видима частина електромагнітного спектра
400
500
600
УльтраФіо- Си- БлаЖов- ПомаранЗелений
фіолетова летоній киттий чевий
частина
вий
ний
спектра
700
Червоний
760 нм
Інфрачервона
частина
спектра
28.
• Якщо на поверхню тіла падає потік білого світла,то можна спостерігати такі явища:
• Світло проходить крізь тіло. Таке тіло буде
прозорим для білого світла.
• Світло поглинається тілом. Тіло буде чорним.
• Світло відбивається від поверхні тіла або
розсіюється нею. Таке тіло буде дзеркальним або
білим.
• Тіло вибірково поглинає деякі промені з видимої
частини спектра, а решта променів проходить
крізь нього, або відбивається його поверхнею.
Таке тіло буде забарвленим.
29.
• Отже, причиною забарвлення є вибірковепоглинання тілом частини світлових
променів із загального потоку у видимівй
частині електромагнітного спектра.
30. Як же пов’язана довжина світлової хвилі, що поглинається речовиною з її хімічною будовою?
• Більшість органічних речовин поглинає кванти, щовідповідають ультрафіолетовій частині спектра.
При цьому енергія поглинутого кванта
витрачається на збудження електронів молекули.
• При наявності в молекулі довгої спряженої
системи зв’язків енергія її збудження може
знижуватись до величини, що відповідає енергії
фотонів у видимій частині спектру і речовина
набуває забарвлення.
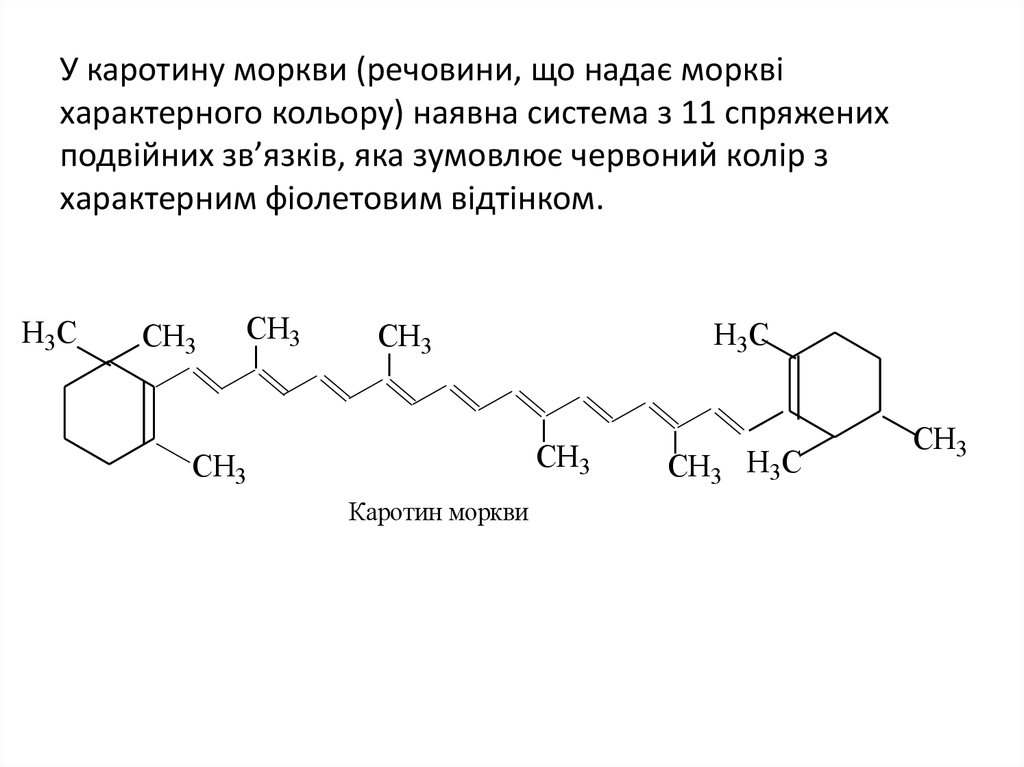
31. У каротину моркви (речовини, що надає моркві характерного кольору) наявна система з 11 спряжених подвійних зв’язків, яка зумовлює червоний
У каротину моркви (речовини, що надає морквіхарактерного кольору) наявна система з 11 спряжених
подвійних зв’язків, яка зумовлює червоний колір з
характерним фіолетовим відтінком.
H3C
CH3
CH3
H3C
CH3
CH3
CH3
Каротин моркви
CH3 H3C
CH3
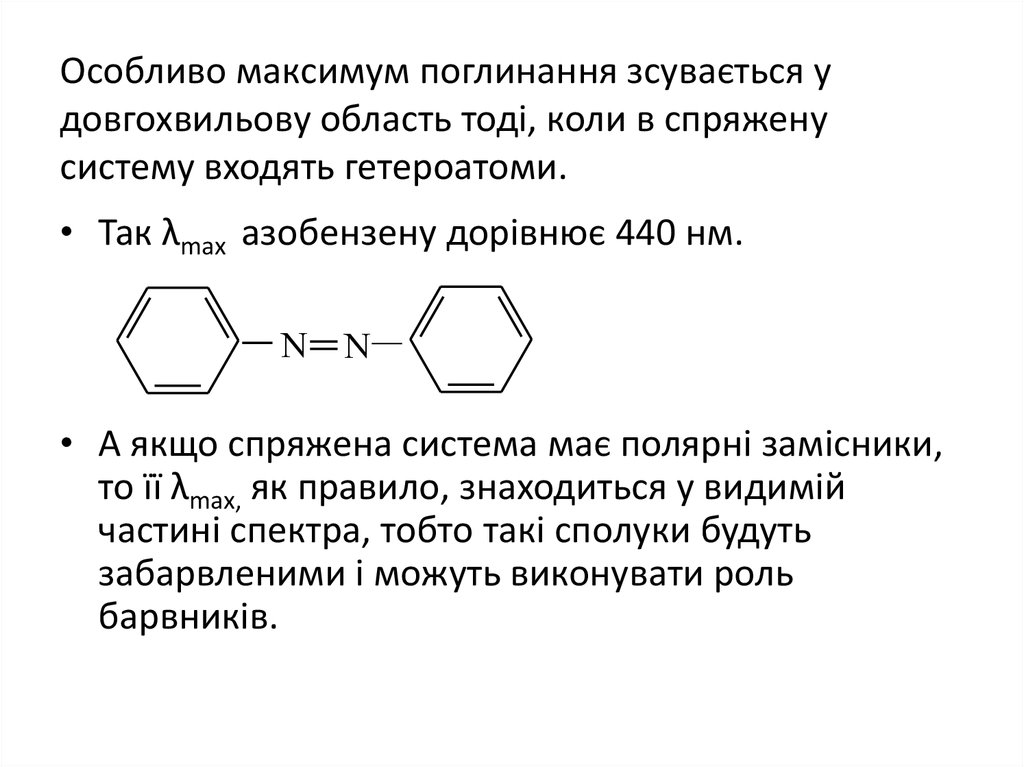
32. Особливо максимум поглинання зсувається у довгохвильову область тоді, коли в спряжену систему входять гетероатоми.
• Так λmах азобензену дорівнює 440 нм.N
N
• А якщо спряжена система має полярні замісники,
то її λmах, як правило, знаходиться у видимій
частині спектра, тобто такі сполуки будуть
забарвленими і можуть виконувати роль
барвників.
33.
• Система спряжених зв’язків, яка, восновному, зумовлює появу забарвлення,
називається хромоформною системою, а
полярні групи по її кінцях, що підсилюють
здатність поглинати світло і сприяють
зв’язуванню барвника з поверхнею, на яку
його нанесли – називаються ауксохромами.
Отже барвник має в складі молекули
хромофорну систему і принаймні два
ауксохроми.













 chemistry
chemistry








