Similar presentations:
Амінокислоти. Класифікація та номенклатура
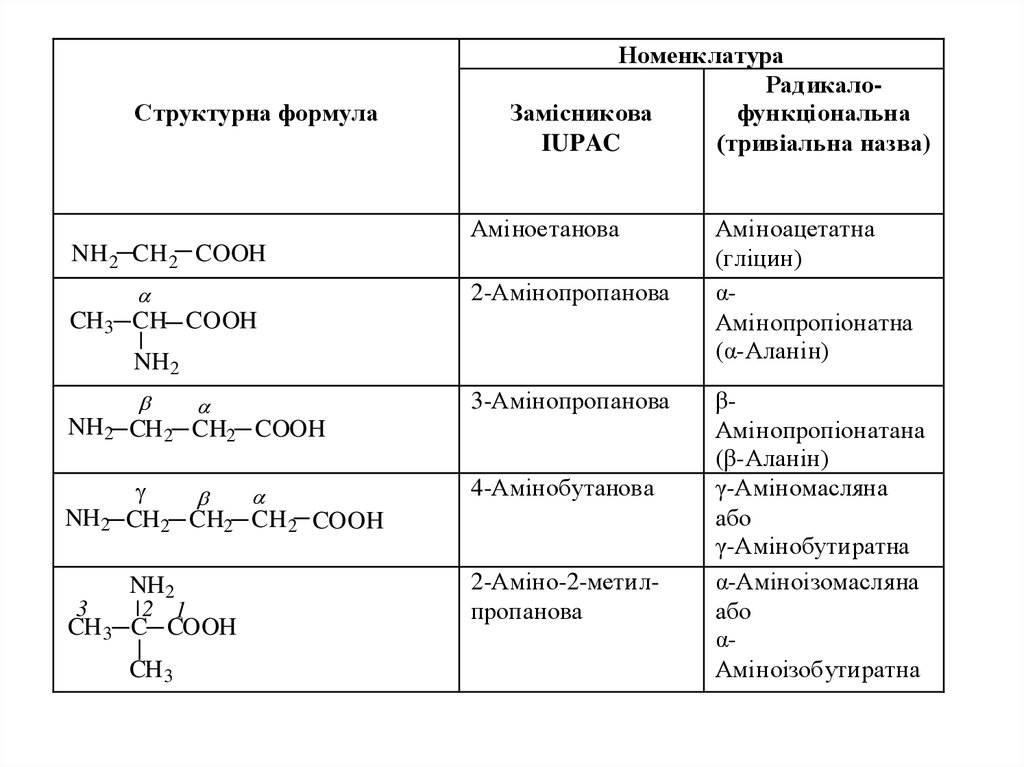
1. АМІНОКИСЛОТИ
Сполуки, які містять одночасно аміногрупу NH2 та карбоксильну COOH,називаються амінокислотами (амінокарбоновими кислотами).
КЛАСИФІКАЦІЯ ТА НОМЕНКЛАТУРА
За взаємним розташуванням аміно- та карбоксильної груп
амінокислоти поділяють на α, β, γ тощо, за аналогією до
галогенозаміщених, гідрокси- та оксокислот.
За систематичною номенклатурою назви амінокислот утворюються з
назв карбонових незаміщених кислот додаванням префіксу "аміно-",
положення аміногрупи вказується локантом .
За радикало-функціональною номенклатурою назви утворюють за
аналогією з назвами гідроксикислот.
Широко застосовують тривіальні назви.
2.
Структурна формулаНоменклатура
РадикалоЗамісникова
функціональна
IUPAC
(тривіальна назва)
Аміноетанова
NH 2 CH 2 COOH
2-Амінопропанова
CH 3 CH COOH
NH 2
3-Амінопропанова
NH 2 CH 2 CH2 COOH
NH 2
3
CH 2 CH2 CH 2 COOH
4-Амінобутанова
NH 2
2-Аміно-2-метилпропанова
2 1
CH 3 C COOH
CH 3
Аміноацетатна
(гліцин)
αАмінопропіонатна
(α-Аланін)
βАмінопропіонатана
(β-Аланін)
γ-Аміномасляна
або
γ-Амінобутиратна
α-Аміноізомасляна
або
αАміноізобутиратна
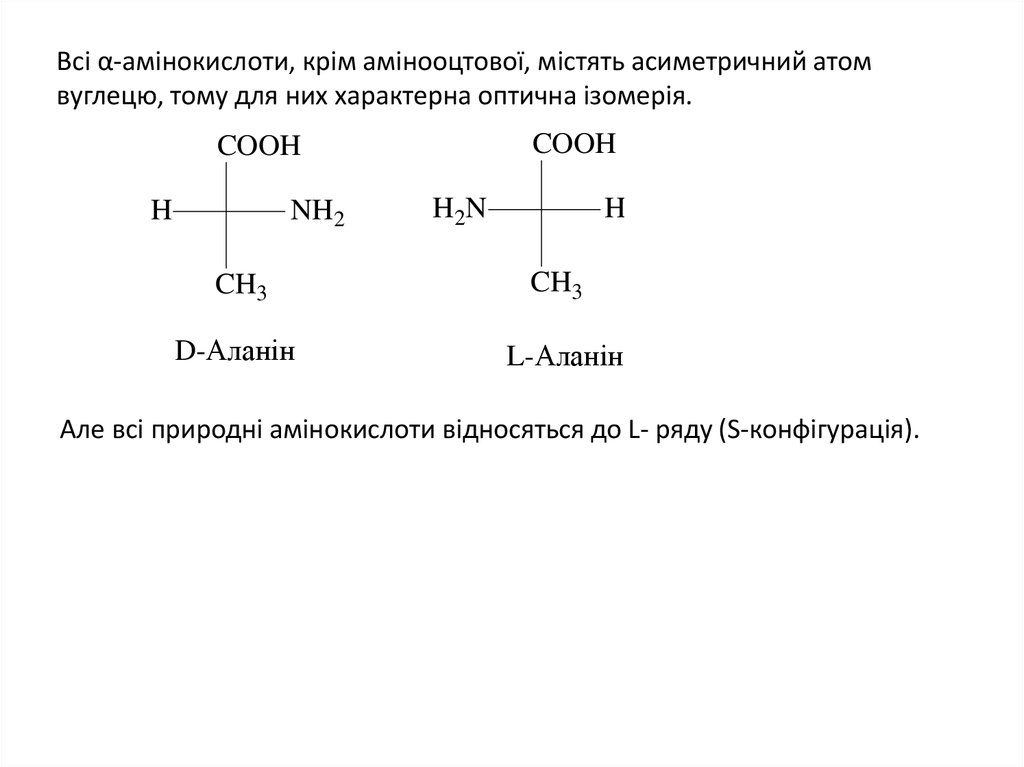
3. Всі α-амінокислоти, крім амінооцтової, містять асиметричний атом вуглецю, тому для них характерна оптична ізомерія.
COOHCOOH
H
NH2
H2N
H
CH3
CH3
D-Аланін
L-Аланін
Але всі природні амінокислоти відносяться до L- ряду (S-конфігурація).
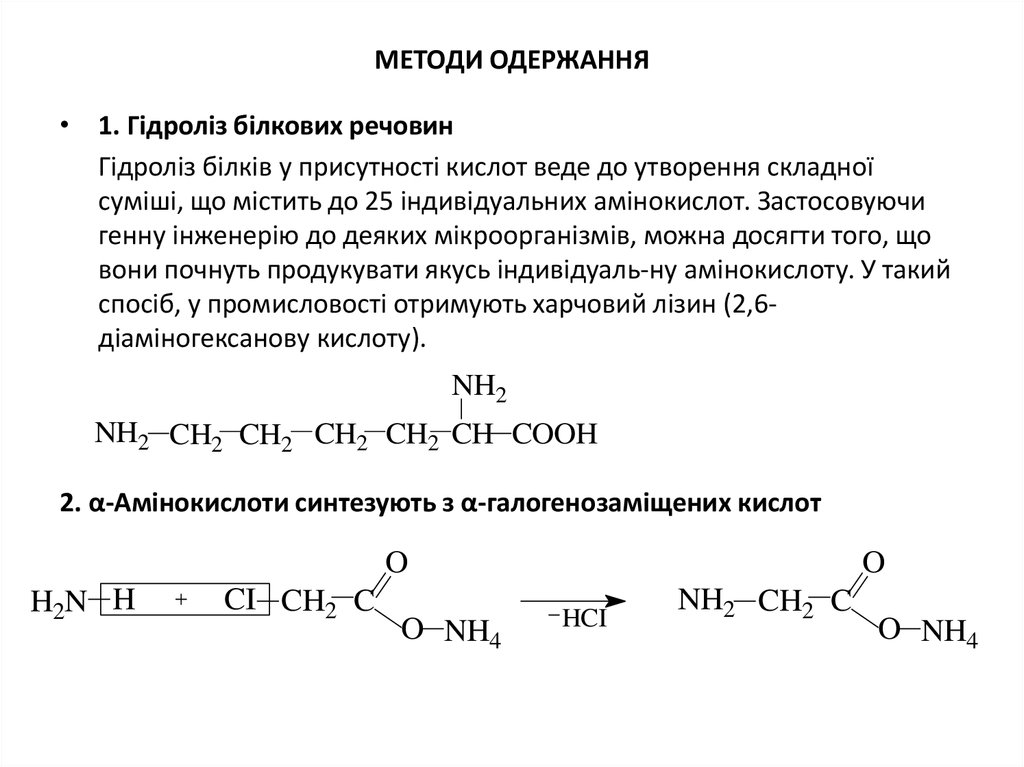
4. МЕТОДИ ОДЕРЖАННЯ
МЕТОДИ ОДЕРЖАННЯ• 1. Гідроліз білкових речовин
Гідроліз білків у присутності кислот веде до утворення складної
суміші, що містить до 25 індивідуальних амінокислот. Застосовуючи
генну інженерію до деяких мікроорганізмів, можна досягти того, що
вони почнуть продукувати якусь індивідуаль-ну амінокислоту. У такий
спосіб, у промисловості отримують харчовий лізин (2,6діаміногексанову кислоту).
NH2
NH2 CH2 CH2 CH2 CH2 CH COOH
2. α-Амінокислоти синтезують з α-галогенозаміщених кислот
O
H2N H
CI CH2 C
O NH4
O
HCI
NH2 CH2 C
O NH4
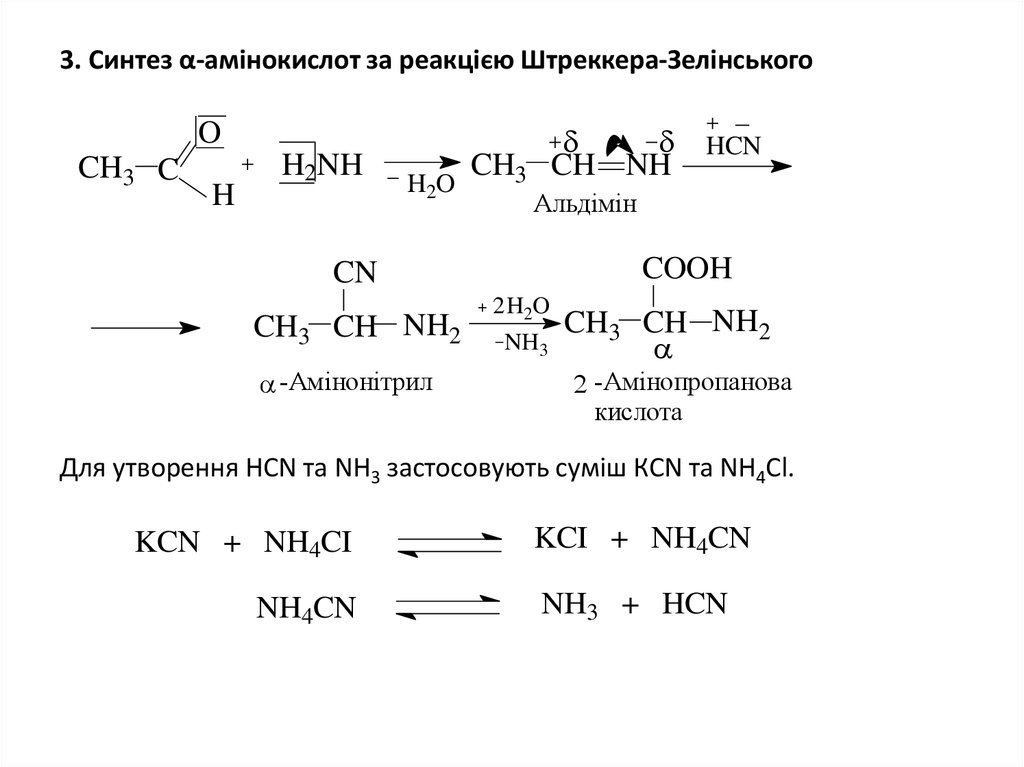
5. 3. Синтез α-амінокислот за реакцією Штреккера-Зелінського
3. Синтез α-амінокислот за реакцією Штреккера-ЗелінськогоO
CH3 C
H
H2NH
H2O
HCN
CH3 CH NH
Альдімін
COOH
CN
CH3 CH NH2
-Амінонітрил
2 H2O
NH3
CH3 CH NH2
-Амінопропанова
кислота
Для утворення HCN та NH3 застосовують суміш КCN та NH4Cl.
KCN + NH4CI
NH4CN
KCI + NH4CN
NH3 + HCN
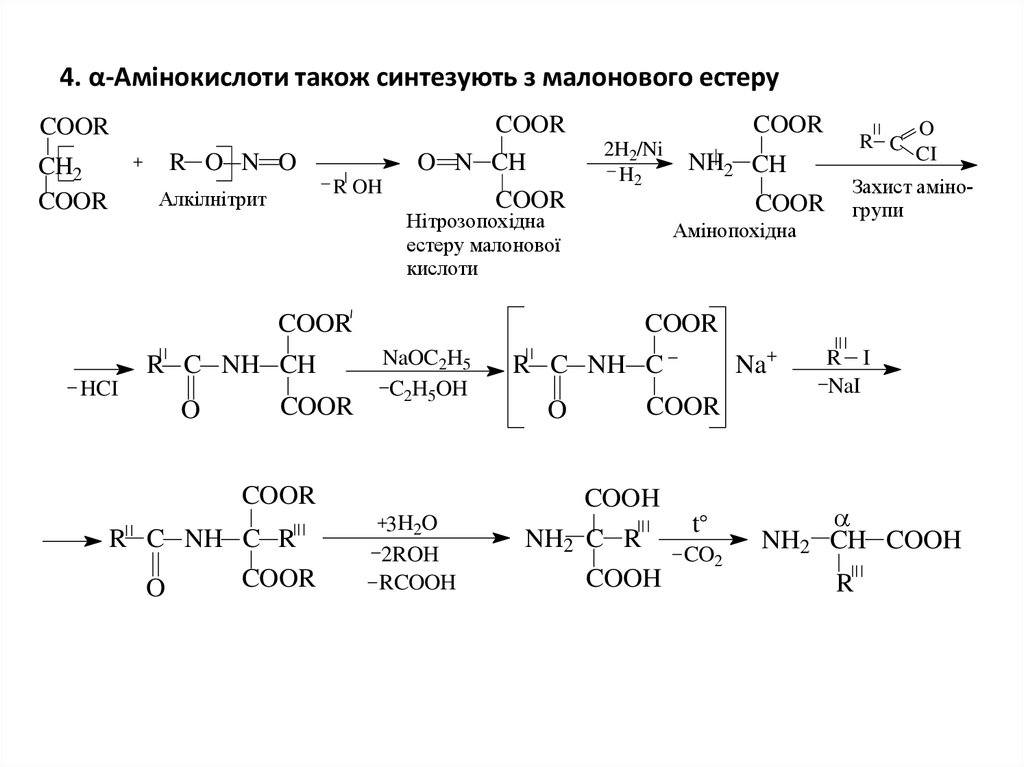
6. 4. α-Амінокислоти також синтезують з малонового естеру
COORCOOR
R O N O
CH2
COOR
2H2/Ni
H2
O N CH
R OH
Алкілнітрит
COOR
COOR
COOR
Нітрозопохідна
естеру малонової
кислоти
Амінопохідна
COOR
R C NH CH
HCI
O
COOR
O
COOR
Захист аміногрупи
COOR
NaOC2H5
C2H5OH
COOR
R C NH C R
NH2 CH
O
R C
CI
R C NH C
Na
COOR
O
COOH
3H2O
2ROH
RCOOH
NH2 C R
COOH
t
CO2
NH2
R I
NaI
CH COOH
R
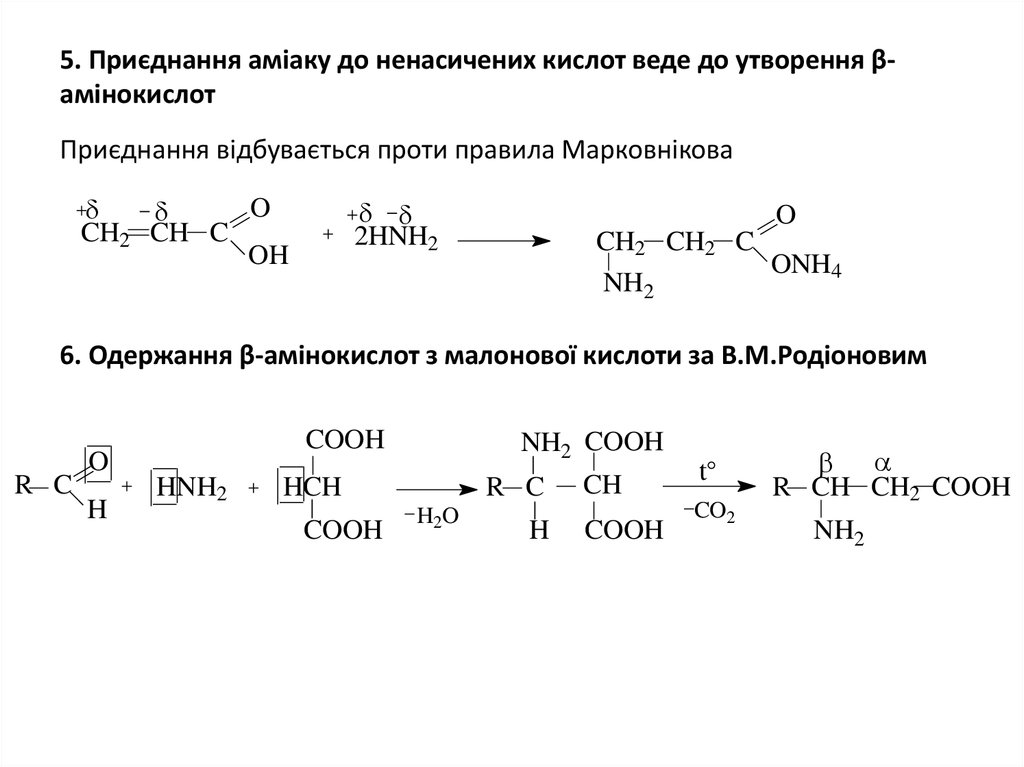
7. 5. Приєднання аміаку до ненасичених кислот веде до утворення β-амінокислот
5. Приєднання аміаку до ненасичених кислот веде до утворення βамінокислотПриєднання відбувається проти правила Марковнікова
O
CH2 CH C
OH
2HNH2
O
CH2 CH2 C
NH2
ONH4
6. Одержання β-амінокислот з малонової кислоти за В.М.Родіоновим
R C
COOH
O
H
HNH2
NH2 COOH
HCH
COOH
R C
H2O
H
CH
COOH
t
CO2
R CH CH2 COOH
NH2
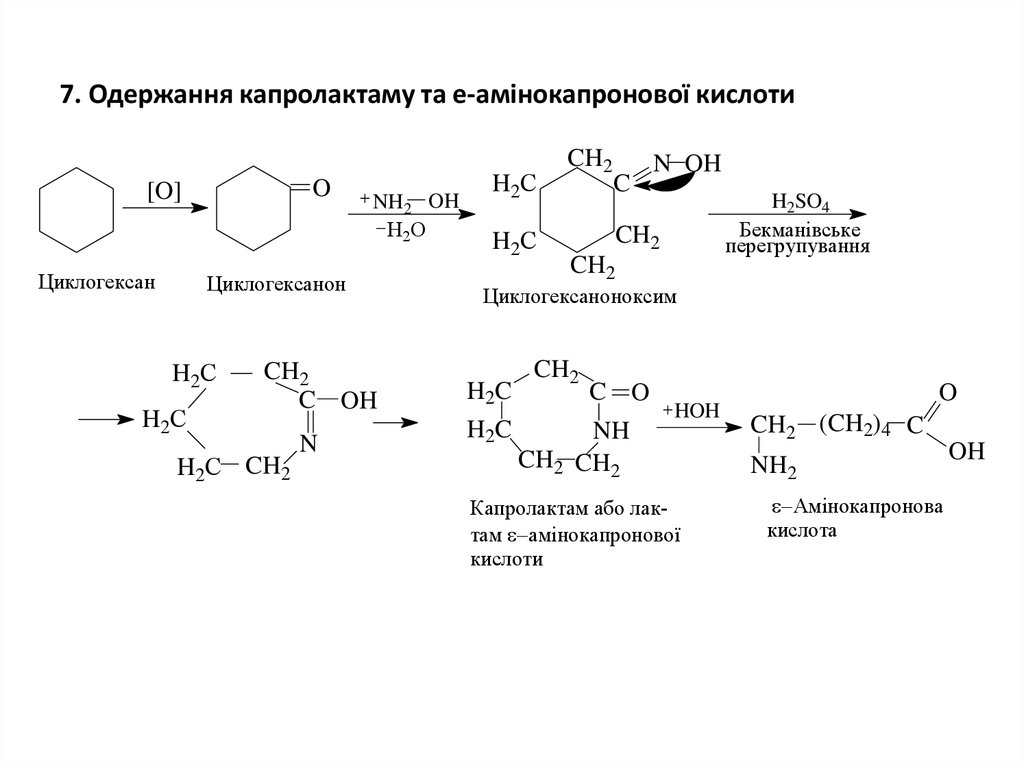
8. 7. Одержання капролактаму та e-амінокапронової кислоти
O[O]
Циклогексан
NH2 OH
Н2О
Циклогексанон
H 2С
H 2С
CH2
C OH
H2С CH2
N
H 2С
H 2С
CH2
C
N OH
H2SO4
Бекманівське
перегрупування
CH2
CH2
Циклогексаноноксим
H 2C
H 2C
CH2
C O
NH
CH2 CH2
HOH
Капролактам або лактам амінокапронової
кислоти
O
CH2 (CH2)4 C
NH2
Амінокапронова
кислота
OH
9. ФІЗИЧНІ ТА ХІМІЧНІ ВЛАСТИВОСТІ
• Амінокислоти є безбарвними кристалічними речовинами,що розчиняються у воді, важче - в органічних розчинниках.
• Амінокислоти містять одночасно основну (NH2) і кислотну
(COOH) групи, тобто виявляють амфотерний характер.
Крім того вони здатні утворювати внутрішні солі біполярні або цвіттер-йони.
O
O
H2N CH2 C
H2N CH2 C
OH
O
H
O
H3N CH2 C
Цвіттер-йон
O
10. У водних розчинах, залежно від рН середовища, існує рівновага між цвіттер-йоном, аніоном і катіоном.
OH2O
NH2 CH2 C
Аніон
O
O
OH (pH>7)
NH3 CH2 C
Цвіттер-йон
O
H (рН < 7)
NH3 CH2 C
O
Катіон
OH
• Значення рН розчину, при якому концентрація цвітерйонів максимальна, називається ізоелектрочною точкою
даної амінокислоти.
• Амінокислоти володіють всіма властивостями, що
притаманні аміносполукам та карбоновим кислотам.
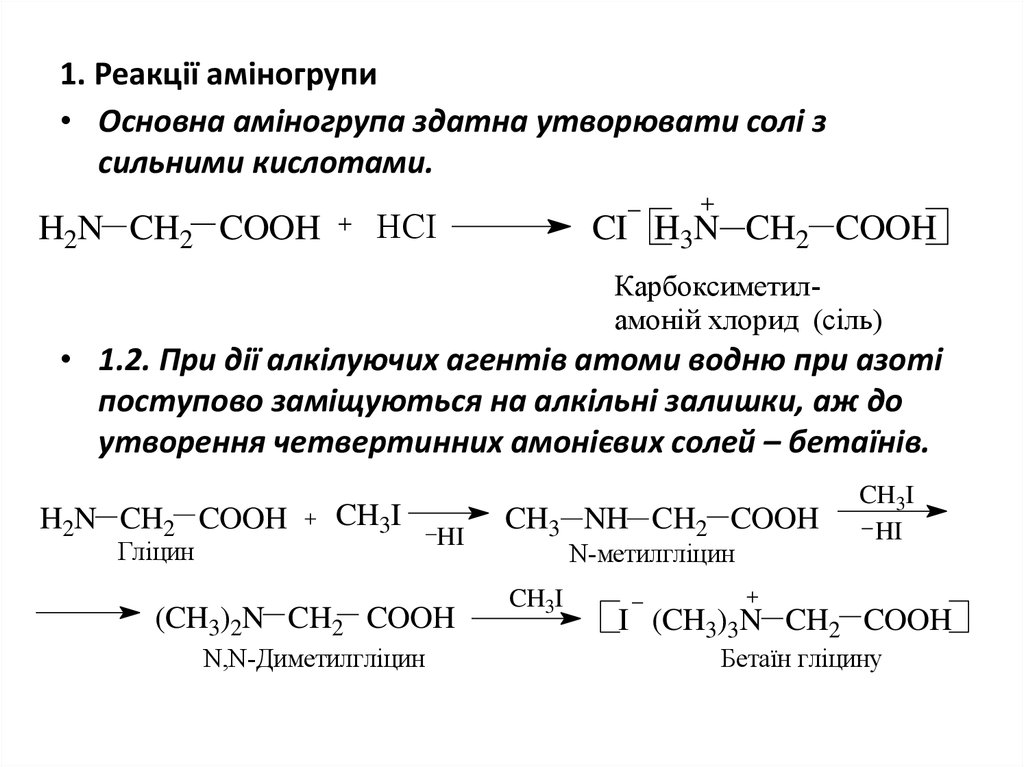
11. 1. Реакції аміногрупи
• Основна аміногрупа здатна утворювати солі зсильними кислотами.
H2N CH2 COOH
HCI
CI H3N CH2 COOH
Карбоксиметиламоній хлорид (сіль)
• 1.2. При дії алкілуючих агентів атоми водню при азоті
поступово заміщуються на алкільні залишки, аж до
утворення четвертинних амонієвих солей – бетаїнів.
H2N CH2 COOH
Гліцин
CH3I
HI
(CH3)2N CH2 COOH
N,N-Диметилгліцин
CH3 NH CH2 COOH
N-метилгліцин
CH3I
CH3I
HI
I (CH3)3N CH2 COOH
Бетаїн гліцину
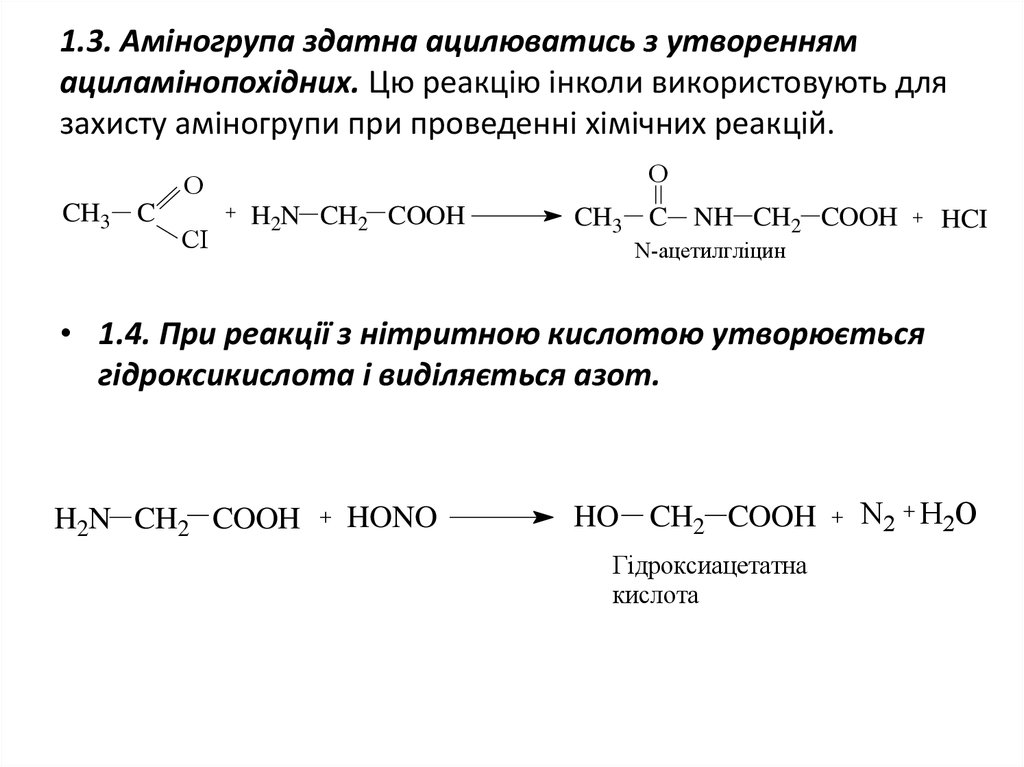
12. 1.3. Аміногрупа здатна ацилюватись з утворенням ациламінопохідних. Цю реакцію інколи використовують для захисту аміногрупи при
проведенні хімічних реакцій.O
O
CH3 C
CI
H2N CH2 COOH
CH3 C NH CH2 COOH
HCI
N-ацетилгліцин
• 1.4. При реакції з нітритною кислотою утворюється
гідроксикислота і виділяється азот.
H2N CH2 COOH
HONO
HO CH2 COOH
Гідроксиацетатна
кислота
N2 H2O
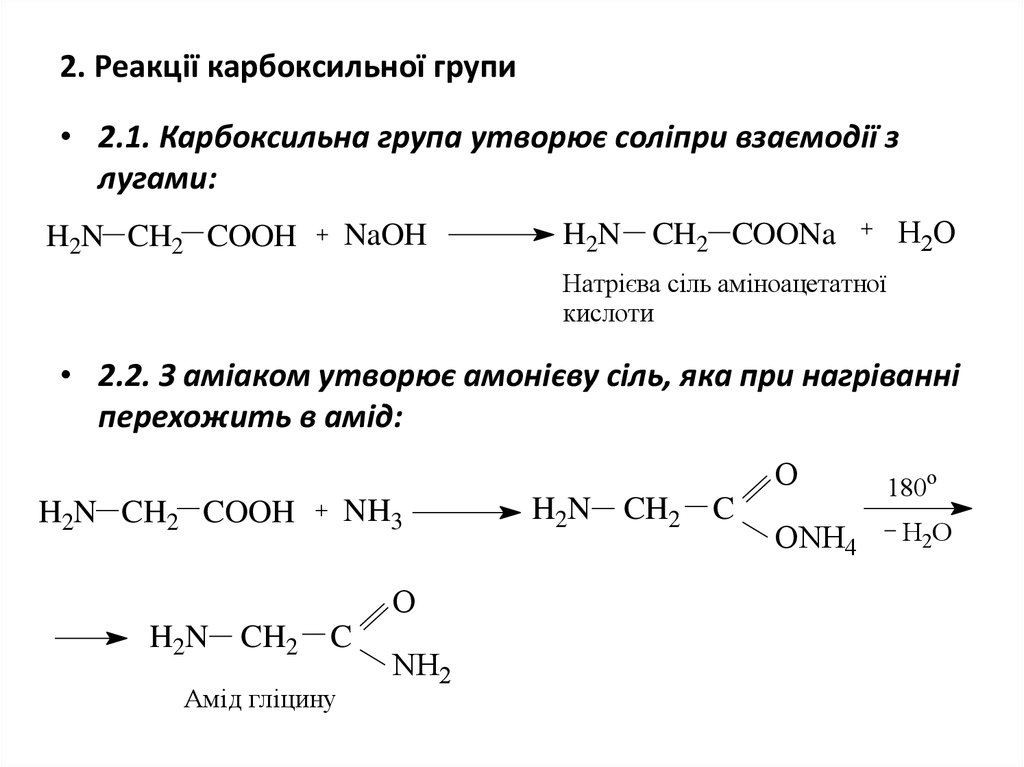
13. 2. Реакції карбоксильної групи
• 2.1. Карбоксильна група утворює соліпри взаємодії злугами:
H2N CH2 COOH
NaOH
H2O
H2N CH2 COONa
Натрієва сіль аміноацетатної
кислоти
• 2.2. З аміаком утворює амонієву сіль, яка при нагріванні
перехожить в амід:
O
H2N CH2 COOH
NH3
O
H2N CH2 C
Амід гліцину
NH2
H2N CH2 C
ONH4
180о
H2O
14. 2.3. При взаємодії зі спиртами в кислому середовищі утворюються естери:
H2N CH2 COOHC2H5OH
H
H2N CH2
O
C O C2H5
H2O
Етиловий естер
гліцину
• Взаємний вплив аміно- і карбоксильної групи одна на одну
обумовлює ряд їх специфічних властивостей.
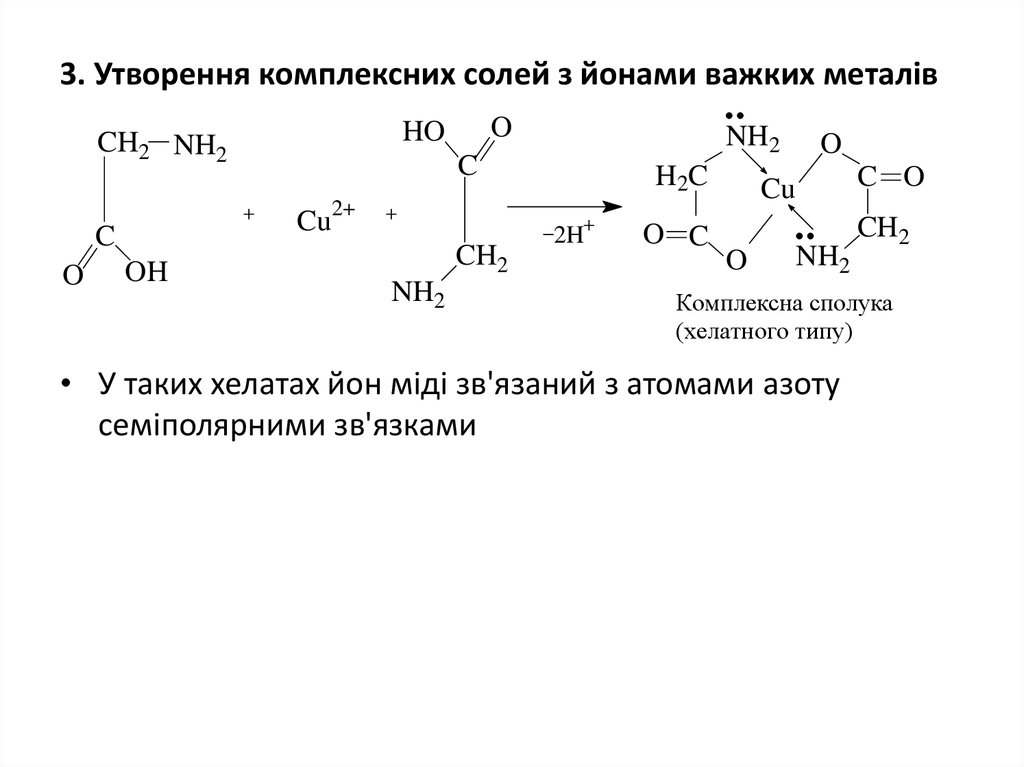
15. 3. Утворення комплексних солей з йонами важких металів
OHO
CH2 NH2
NH2
C
H2C
C
O
OH
CH2
NH2
2H
O C
C O
Cu
2+
Cu
O
O
NH2
CH2
Комплексна сполука
(хелатного типу)
• У таких хелатах йон міді зв'язаний з атомами азоту
семіполярними зв'язками
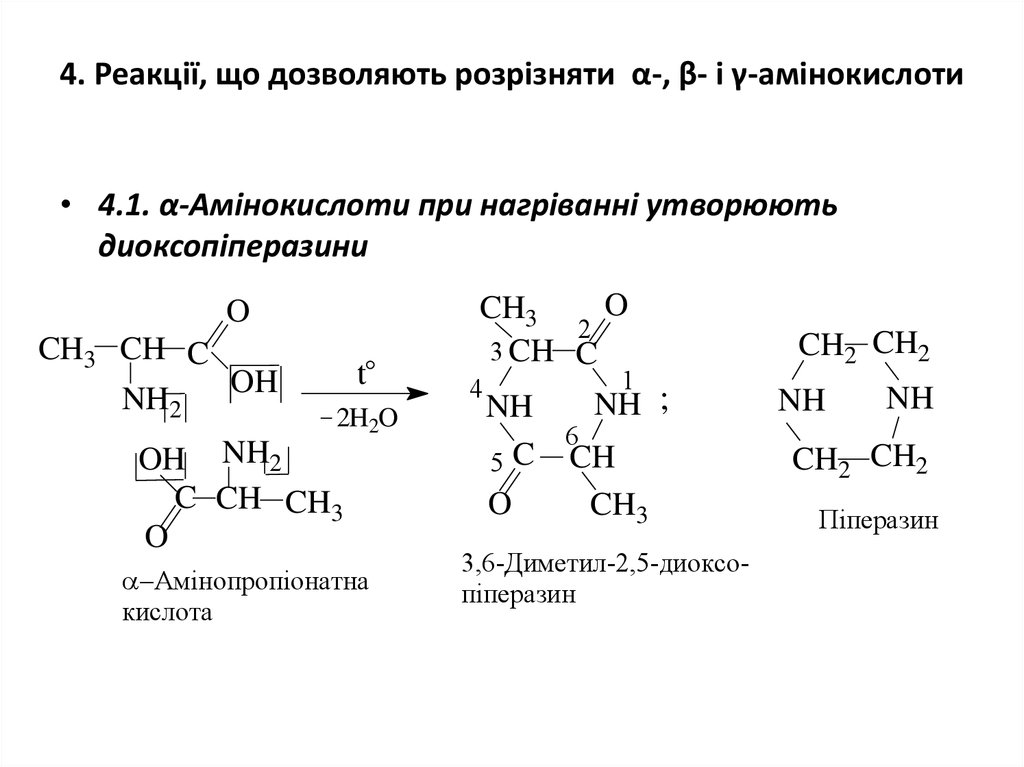
16. 4. Реакції, що дозволяють розрізняти α-, β- і γ-амінокислоти
• 4.1. α-Амінокислоти при нагріванні утворюютьдиоксопіперазини
O
CH3 CH C
OH
NH2
t
2H2O
OH NH2
C CH CH3
O
Амінопропіонатна
кислота
O
CH3
2
3 CH C
4
1
NH ;
NH
6
C
CH
5
O
CH3
3,6-Диметил-2,5-диоксопіперазин
CH2 CH2
NH
NH
CH2 CH2
Піперазин
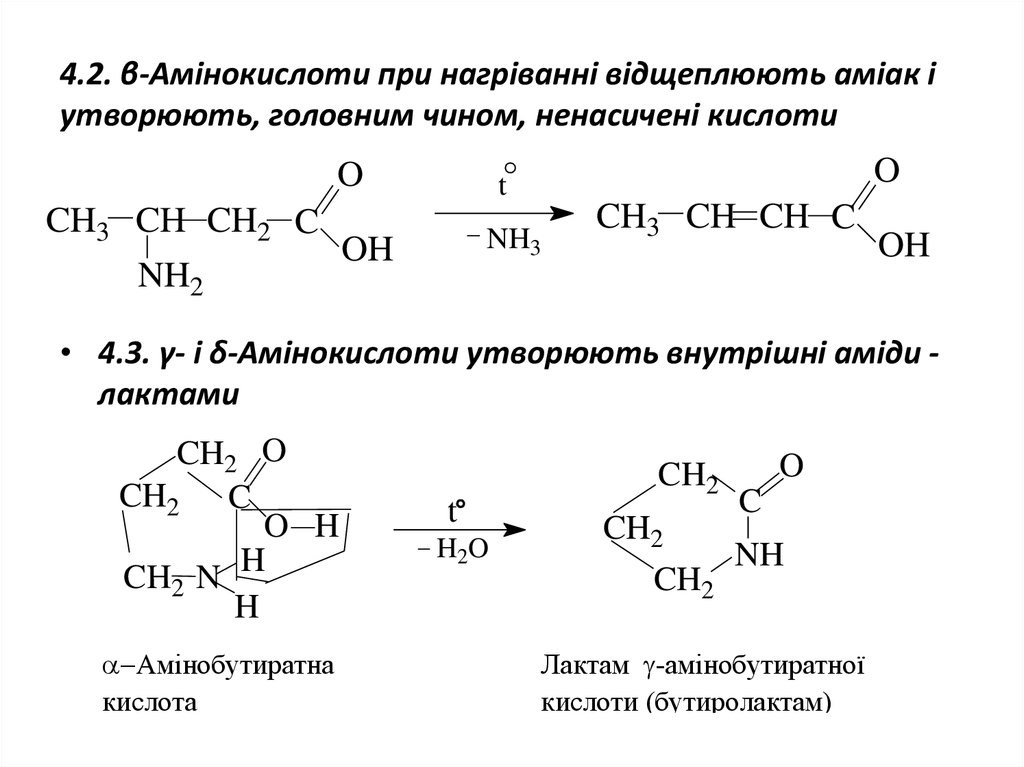
17. 4.2. β-Амінокислоти при нагріванні відщеплюють аміак і утворюють, головним чином, ненасичені кислоти
OCH3 CH CH2 C
NH2
O
t
NH3
OH
CH3 CH CH C
OH
• 4.3. γ- і δ-Амінокислоти утворюють внутрішні аміди лактами
CH2 O
CH2 C
O H
H
CH2 N
H
Амінобутиратна
кислота
t
H2O
CH2
CH2
CH2
O
C
NH
Лактам -амінобутиратної
кислоти (бутиролактам)
18.
OCH2 C
CH2
CH2 CH2
O H
N H
H
Аміновалер'янова
кислота
O
t
H2O
CH2 C
CH2
NH
CH2 CH2
Лактам -амівалер'янової
кислоти (валеролактам)
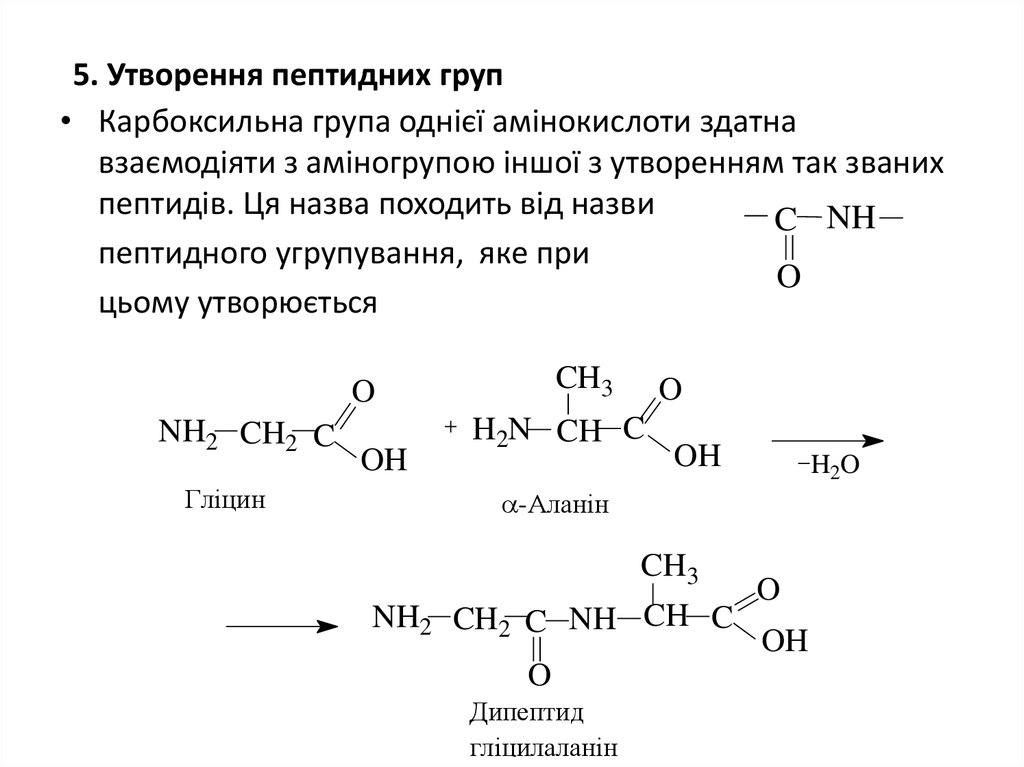
19. 5. Утворення пептидних груп
• Карбоксильна група однієї амінокислоти здатнавзаємодіяти з аміногрупою іншої з утворенням так званих
пептидів. Ця назва походить від назви
C NH
пептидного угрупування, яке при
O
цьому утворюється
CH3
O
NH2 CH2 C
Гліцин
OH
O
H2N CH C
OH
H2O
-Аланін
CH3
NH2 CH2 C NH CH C
O
Дипептид
гліцилаланін
O
OH
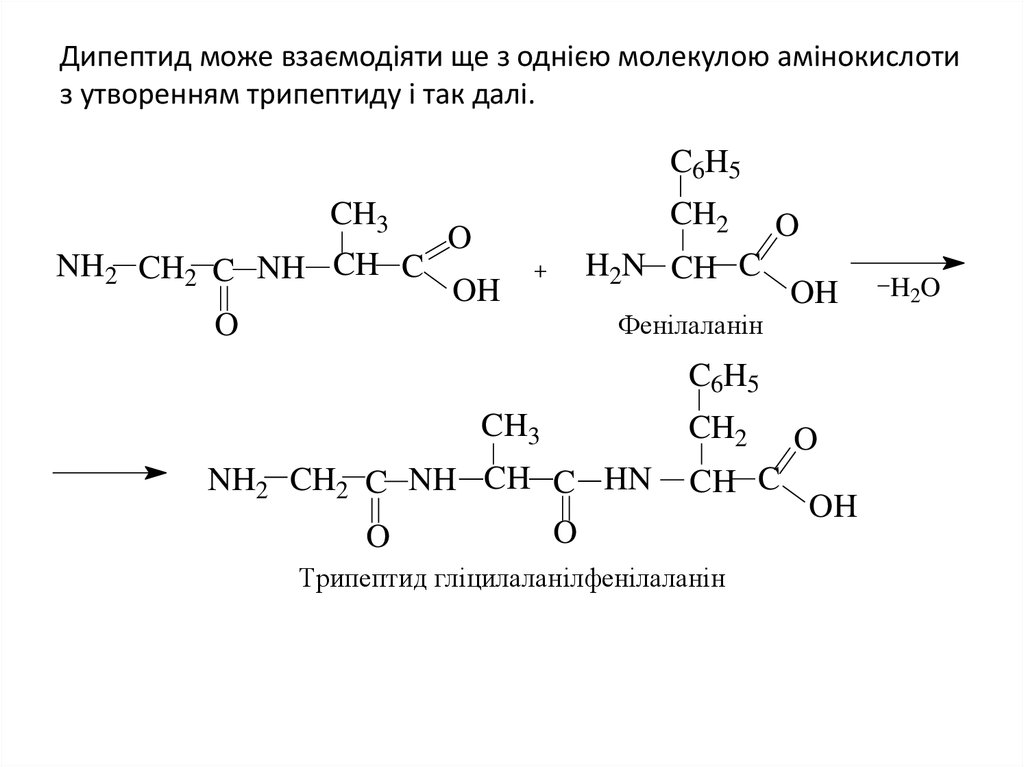
20. Дипептид може взаємодіяти ще з однією молекулою амінокислоти з утворенням трипептиду і так далі.
C6H5CH3
NH2 CH2 C NH CH C
CH2
O
O
H2N CH C
OH
Фенілаланін
O
OH
C6H5
CH3
CH2
NH2 CH2 C NH CH C HN
O
CH C
O
Трипептид гліцилаланілфенілаланін
O
OH
H2O
21. Окремі представники
• α-Амінокислоти є головним компонентом будови білків, усклад яких входить до 25 індивідуальних амінокислот.
Амінокислоти та білки синтезуються живими організмами. Людський організм здатний синтезувати всі
необхідні йому амінокислоти, крім восьми. Це т.з.
незамінимі амінокислоти і людина повинна їх вживати
разом з їжею.
22.
№п\п
Амінокислоти
Формули амінокислот
Добова
потреба
людини, г
NH2 CH2 CH 2 CH 2 CH2 CH COOH
4
Лізин
1.
NH 2
Треонін
2.
CH3 CH CH COOH
OH NH 2
3
CH3 S CH2 CH 2 CH COOH
3
Метіонін
3.
NH2
Валін
4.
CH3 CH CH COOH
4
CH3 NH 2
Лейцин
CH3 CH CH 2 CH COOH
5.
CH3
5
NH 2
Ізолейцин
6.
CH3 CH2 CH CH COOH
4
CH3 NH 2
Фенілаланін
C6H5 CH2 CH COOH
7.
3
NH 2
Триптофан
CH2 CH COOH
8.
NH2
N
H
1
23. Практичне значення має лактам ε-амінокапронової кислоти - капролактам, що застосовується для виробництва поліаміду капрону
Практичне значення має лактам ε-амінокапронової кислоти капролактам, що застосовується для виробництва поліамідукапрону реакцією ступінчатої полімеризації:
H2C
n
CH2
CH2
NH (CH2)5 C n
Капрон O
H2C
C O
H2C NH
• Капрон також можна отримати реакцією поліконденсації
ε-амінокапронової кислоти, аналогічно до процесу
отримання найлону
n NH2
(CH2)5 C OH
O
- n H2O
NH (CH2)5 C n
Капрон O
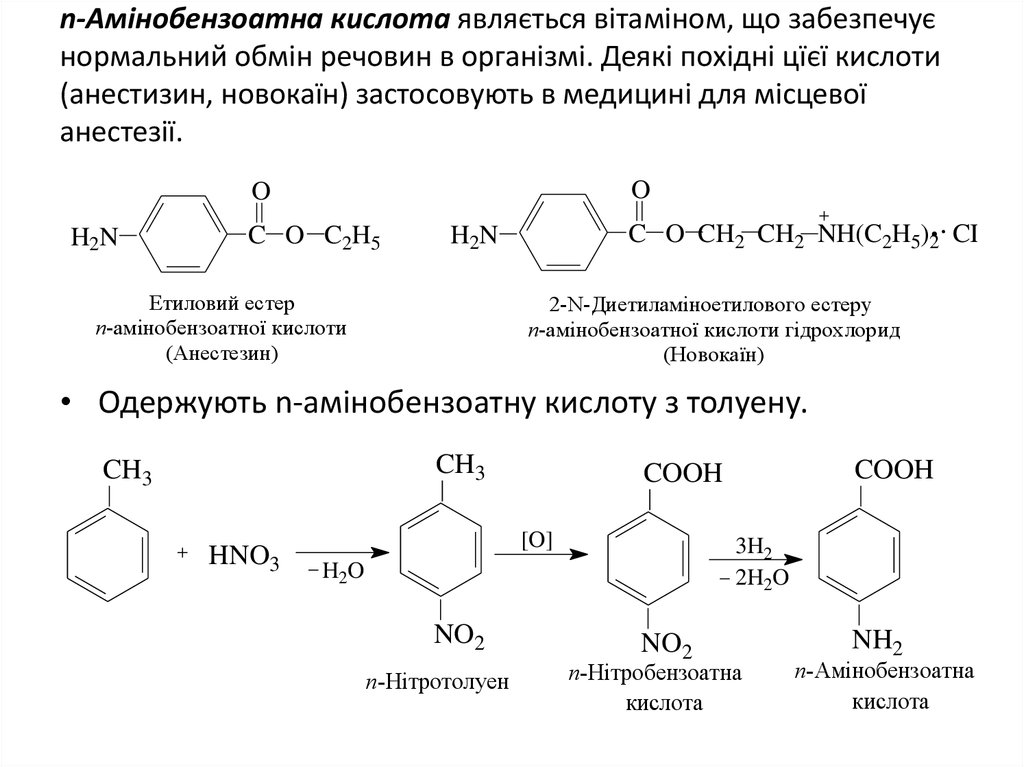
24. n-Амінобензоатна кислота являється вітаміном, що забезпечує нормальний обмін речовин в організмі. Деякі похідні цїєї кислоти
(анестизин, новокаїн) застосовують в медицині для місцевоїанестезії.
O
O
H2N
C O C2H5
C O CH2 CH2 NH(C2H5)2 CI
H2N
Етиловий естер
n-амінобензоатної кислоти
(Анестезин)
2-N-Диетиламіноетилового естеру
n-амінобензоатної кислоти гідрохлорид
(Новокаїн)
• Одержують n-амінобензоатну кислоту з толуену.
CH3
CH3
HNO3
[O]
3H2
2H2O
H2O
NO2
n-Нітротолуен
COOH
COOH
NO2
n-Нітробензоатна
кислота
NH2
n-Амінобензоатна
кислота
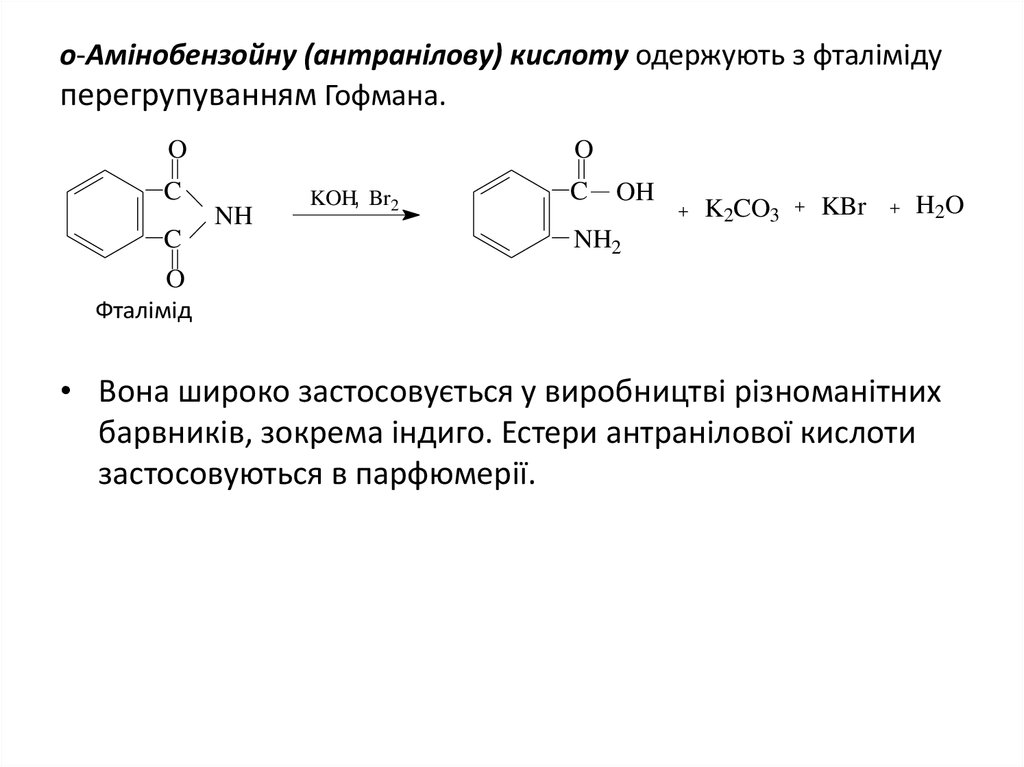
25. o-Амінобензойну (антранілову) кислоту одержують з фталіміду перегрупуванням Гофмана.
OO
C
C
NH
KOH, Br2
C
OH
K2CO3
KBr
H2O
NH2
O
Фталімід
• Вона широко застосовується у виробництві різноманітних
барвників, зокрема індиго. Естери антранілової кислоти
застосовуються в парфюмерії.
26. Комплексони.
• Комплексонами називають групу α-амінокислот, що містятьдекілька фрагментів оцтової кислоти, зв’язаних з азотом.
Важливою особливістю комплексонів є їх здатність утворювати
стійкі розчинні комплекси з йонами багатьох металів: кальцію,
магнію, заліза тощо. Одним з найбільш ефективних комплексів
є етилендіамінтетраоцтова кислота,
HOOC CH2
HOOC CH2
N CH2 CH2 N
CH2
COOH
CH2 COOH
динатрієва сіль якої називається «Трилон Б».
«Трилон Б» широко використовується в технологічних процесах
для «маскування» йонів металів в розчинах, а також в
аналітичній хімії.
27. ПОЛІПЕПТИДИ ТА БІЛКИ
• Білки - складні високомолекулярні сполуки біологічногопоходження, що побудовані з залишків α-амінокислот,
з'єднаних між собою пептидними групами
• NHC(О) . За хімічною будовою – це поліпептиди.
• Навіть найпростіші білки містять не менше 100
амінокислотних фрагментів. Речовини, що містять менше
100 ланок амінокислот, називаються поліпептидами.
Поліпептиди, у свою чергу, бувають дипептиди,
побудовані із залишків двох амінокислот, трипептиди, які
складаються із залишків трьох амінокислот тощо. Таким
чином ускладнення структури при переході від
амінокислот до білків можна подати схемою:
• амінокислота → дипептид → поліпептид → білок.
28. КЛАСИФІКАЦІЯ БІЛКІВ
• Білки діляться на протеїни (прості) і протеїди (складні).Протеїни складаються тільки з залишків амінокислот.
Протеїди містять у своїй структурі крім амінокислотних
залишків – фрагменти вуглеводів, нуклеїнових кислот,
фосфатної кислоти, барвників тощо.
• Протеїни поділяються залежно від розчинності на:
• 1. Альбуміни
4. Протаміни
• 2. Глобуліни
5. Гістони
• 3. Проламіни
6. Склеропротеїни
29. Протеїди класифікують залежно від природи небілкових складових. Відомі такі класи:
1. Нуклеопротеїди - містять фрагменти нуклеїнових кислот
2. Фосфорпротеїди - містять фрагменти фосфатних кислот
3. Глікопротеїди - містять фрагменти вуглеводів
4. Хромопротеїди - містять фрагменти барвників
У білковій макромолекулі можна виділити чотири рівні її
організації.
• Унікальна послідовність амінокислотних залишків у
поліпептидному ланцюзі називається первинною
структурою білка. Її унікальність пролягає в тому, що
вона є специфічною для кожного білка.
30.
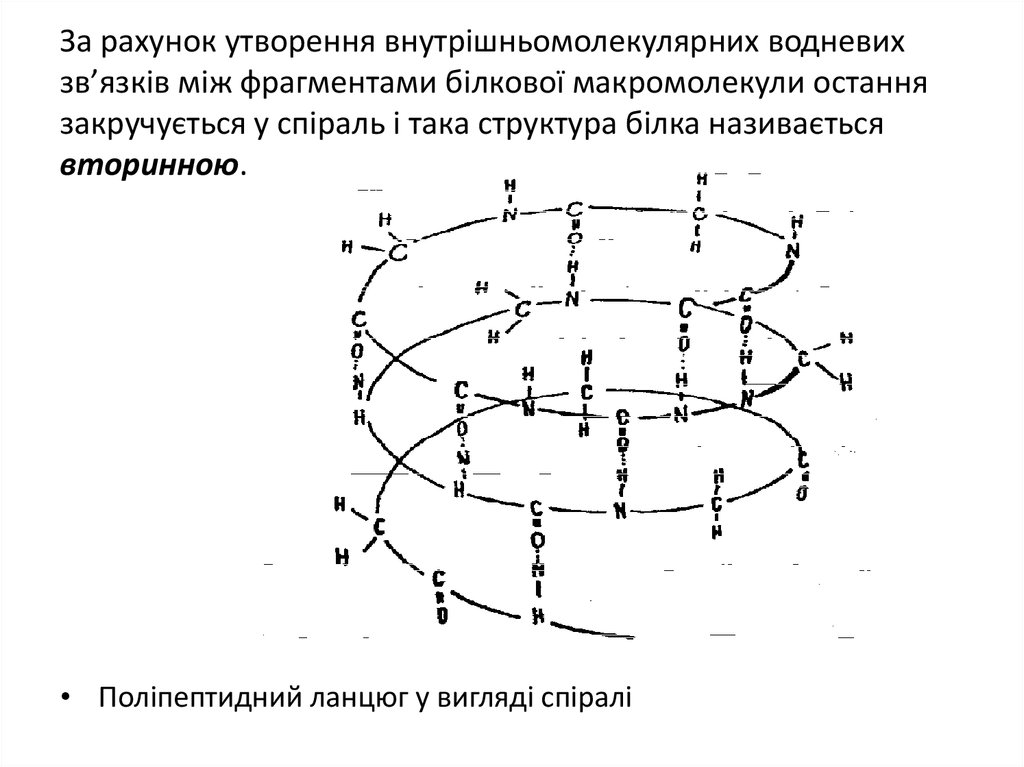
31. За рахунок утворення внутрішньомолекулярних водневих зв’язків між фрагментами білкової макромолекули остання закручується у
спіраль і така структура білка називаєтьсявторинною.
• Поліпептидний ланцюг у вигляді спіралі
32.
• Такі спіралі можуть згортатись в клубок (глобулу), аборозтягуватись в ниткоподібні структури - фібрили. Це третинна структура білка.
а) Третинна
б) Четвертинна структури
білка
33.
34. Глобулярну третинну структуру має гемоглобін крові, більшість ферментів. Фібрилярна третинна структура характерна для таких
білків,як каротин вовни, волосся, м’язевих білків тощо. Деякі білки
можуть здійснювати переходи між глобулою та
фіброструктурою. Так, застигання холодцю є спричинено
переходом білкових макромолекул желатини з глобулярного
у фібрилярний стан.
35.
• Інколи для виконання тої чи іншої біологічної функціїнеобхідне об’єднання двох або навіть трьох білкових
макромолекул. В результаті утворення таких надмолекулярних угруповань формується четвертинна
структурна білка. Прикладом білка з четвертинною
структурою може служити гемоглобін крові, що
складається з двох макромолекул, а також желатин, що
складається з трьох фібрилярних макромолекул.
• При нагріванні білка або під дією деяких речовин
(формальдегіду, фенолу, кислот, лугів) відбувається
руйнуваня вторинної, третинної та четвертинної структури
білка. Такий процес називається денатурацією білка. При
цьому хімічний склад білка не змінюється, але він
незворотньо втрачає свої біологічні функції.
36. СИНТЕЗ ПОЛІПЕПТИДІВ
• Синтез поліпептидів і балків з амінокислот є складнимзавданням, але має величезне теоретичне і практичне
значення. Головні етапи такого синтезу складаються з: 1 захисту аміно- або карбоксигрупи амінокислоти; 2 –
активація незахищеної групи; 3 - утворення пептидного
зв'язку; 4 - вибіркового відщеплення захищаючої групи.
Даний метод є багатостадійним, трудомістким, і потребує
використання чистих енантіомерів α-амінокислот L-ряду
(S-конфігурації). Проте, вже синтезовані аналоги білків
(гормон інсулін, фермент рибонуклеаза), що містять у
поліпептидному ланцюзі понад 100 амінокислотних
залишків з точно заданою їх послідовністю.
37. Захист аміно- або карбоксильних груп.
Для захисту NH2-групи застосовують:Карбобензоксигрупу, C6H5 CH2 O C
O
яка вводиться за допомогою карбобензоксихлориду
C6H5 CH2 O C
O
CI
• Трифенілметильну групу (С6Н5)3С—, яка вводиться за
допомогою трифенілхлорометану (С6Н5)3С—СІ.
• Трифторацетильну групу CF3C(O), яка вводиться за
допомогою трифтороцтового ангідриду CF3C(O)OC(O)CF3
38. Якщо виникає потреба захисту —СООН-групи, то її переводять у трет-бутиловий естер
R CO
O C(CH3)3
• Наведемо модельну схему синтезу дипептиду гліцилаланіну з α-гліцину та α-аланіну.
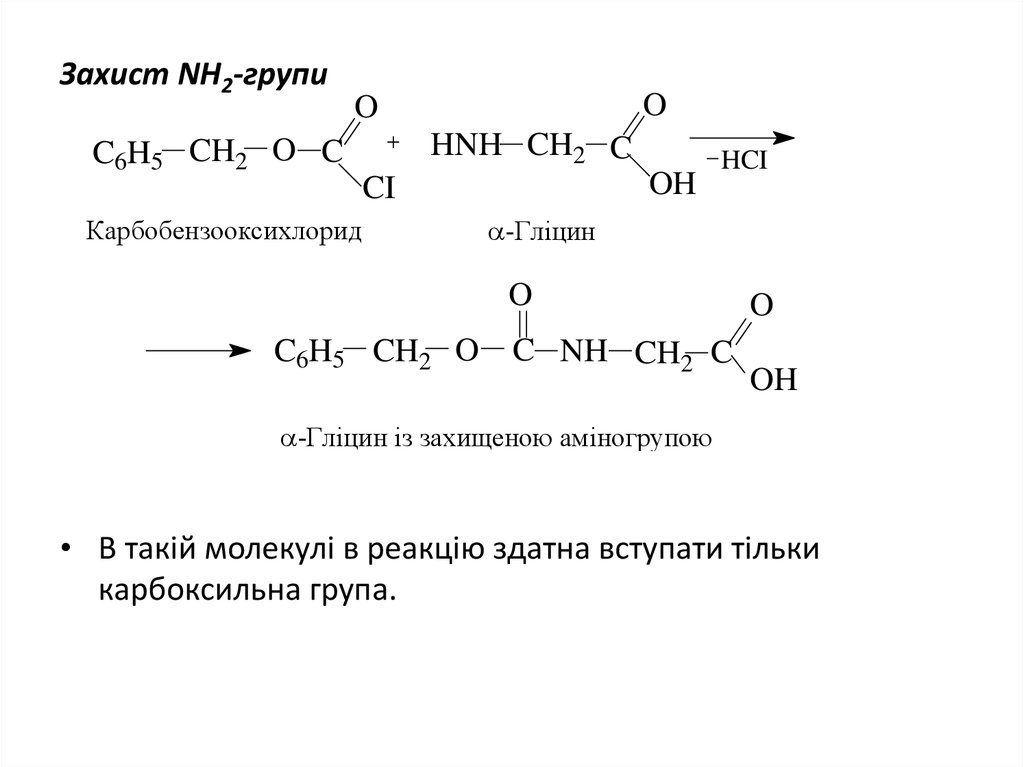
39. Захист NH2-групи
OO
HNH CH2 C
C6H5 CH2 O C
OH
CI
Карбобензооксихлорид
HCI
-Гліцин
O
C6H5 CH2 O
C NH CH2 C
O
OH
-Гліцин із захищеною аміногрупою
• В такій молекулі в реакцію здатна вступати тільки
карбоксильна група.
40. Для одержання гліцилаланіну треба сполучити цей захищений гліцин з аланіном, у якого захищена вже не аміно-, а карбоксильна
група.• В цьому випадку карбоксильна група гліцину має
можливість провзаємодіяти лише з незахищеною
аміногрупою аланіну.
• Утворення дипептиду. Для протікання реакції за мяких
умов карбоксильну группу гліцину додатково активують.
Для цього часто використовують
дициклогексилкарбодіімід (ДЦГКДІ) або трифтороцтовий
ангідрид, який утворює з карбоксильною групою
змішаний ангідрид.
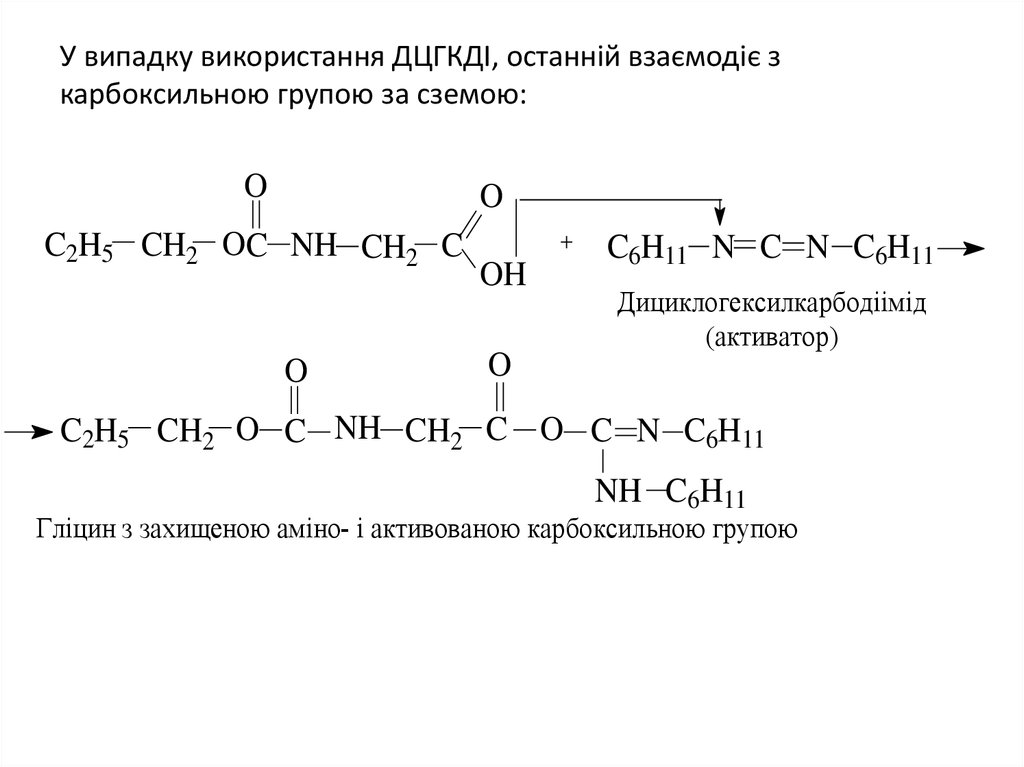
41. У випадку використання ДЦГКДІ, останній взаємодіє з карбоксильною групою за сземою:
OO
C2H5 CH2 OC NH CH2 C
O
OH
C6H11 N C N C6H11
Дициклогексилкарбодіімід
(активатор)
O
C2H5 CH2 O C NH CH2 C O C N C6H11
NH C6H11
Гліцин з захищеною аміно- і активованою карбоксильною групою
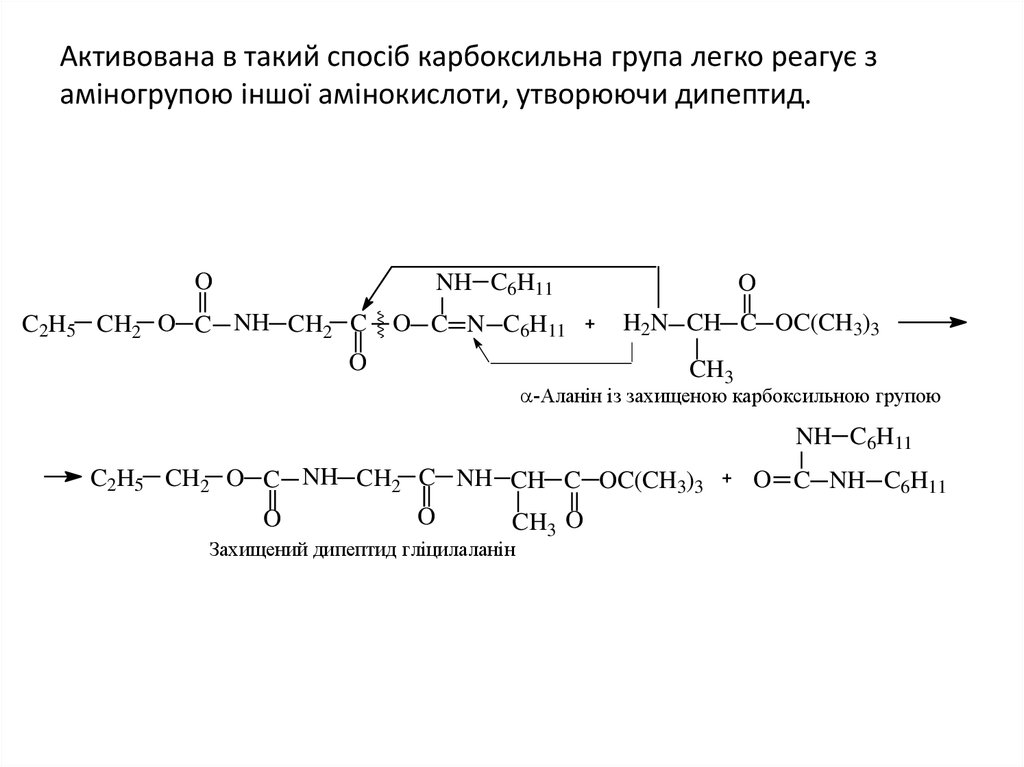
42. Активована в такий спосіб карбоксильна група легко реагує з аміногрупою іншої амінокислоти, утворюючи дипептид.
ONH C6H11
C2H5 CH2 O C NH CH2 C
O C N C6H11
O
O
H2N CH C OC(CH3)3
CH3
-Аланін із захищеною карбоксильною групою
NH C6H11
C2H5 CH2 O C NH CH2 C NH CH C OC(CH3)3
O
O
CH3 O
Захищений дипептид гліцилаланін
O C NH C6H11
43. Відщеплення захищаючих груп
• Захист аміногрупи знімається шляхом гідрування нанікелевому каталізаторі або відновленням гідразином
H2NNH2, а захист карбоксильної групи – гідролізом.
C6H5 CH2 O C NH CH2 C NH CH C OC(CH3)3
O
O
CH3 O
NH2 CH2 C NH CH C
O
CH3
O
OC(CH3)3
H2O
(CH3)3СOH
H2/Pd
C6H5 CH3
CO2
NH2 CH2 C NH CH C
O
CH3
O
OH
Гліцилаланін
Вказану послідовність реакцій можна повторювати далі до
утворення трипептиду, тетрапептиду тощо.
44. Якісні реакції на білок
ЯКІСНІ РЕАКЦІЇ НА БІЛОК• 1. Біуретова реакція - біурет з солями Си(ІІ) у лужному
середовищі утворює синьо-фіолетове забарвлення.
O
O
H2N C NH C NH2
Біурет
• Всі білки містять у своїй структурі пептидні угрупування, які
є фрагментами біурету і, подібно до нього, також
утворюють синьо-фіолетовий хелатний комплекс з йонами
Cu2+.
45.
• 2. Ксантопротеїнова реакція - при взаємодії з нітратноюкислотою (конц.) білки забарвлюються в жовтий колір.
• 3. Реакція Мілона - при взаємодії білків з розчином HgNO3
в нітратній кислоті з’являється червоне забарвлення
• 4. Дія солей свинцю. При нагріванні білків з лугом у
присутності солей Pb (ІІ) випадає чорний осад PbS.
























 chemistry
chemistry








