Similar presentations:
Амінокислоти
1. Амінокислоти
2.
Амінокислоти – гетерофункціональнісполуки, молекули яких містять одночасно
аміногрупу і карбоксильну.
Загальна формула амінокислот:
C
R
O
OH n
NH2 n1
3. Різноманітні пептиди і білки складаються із залишків α-амінокислот. Частіше за все термін "амінокислота" застосовують для
Різноманітні пептиди і білки складаються іззалишків α-амінокислот. Частіше за все термін
"амінокислота" застосовують для позначення
карбонових кислот, аміногрупа яких знаходиться
в α- положенні, тобто для α-амінокислот.
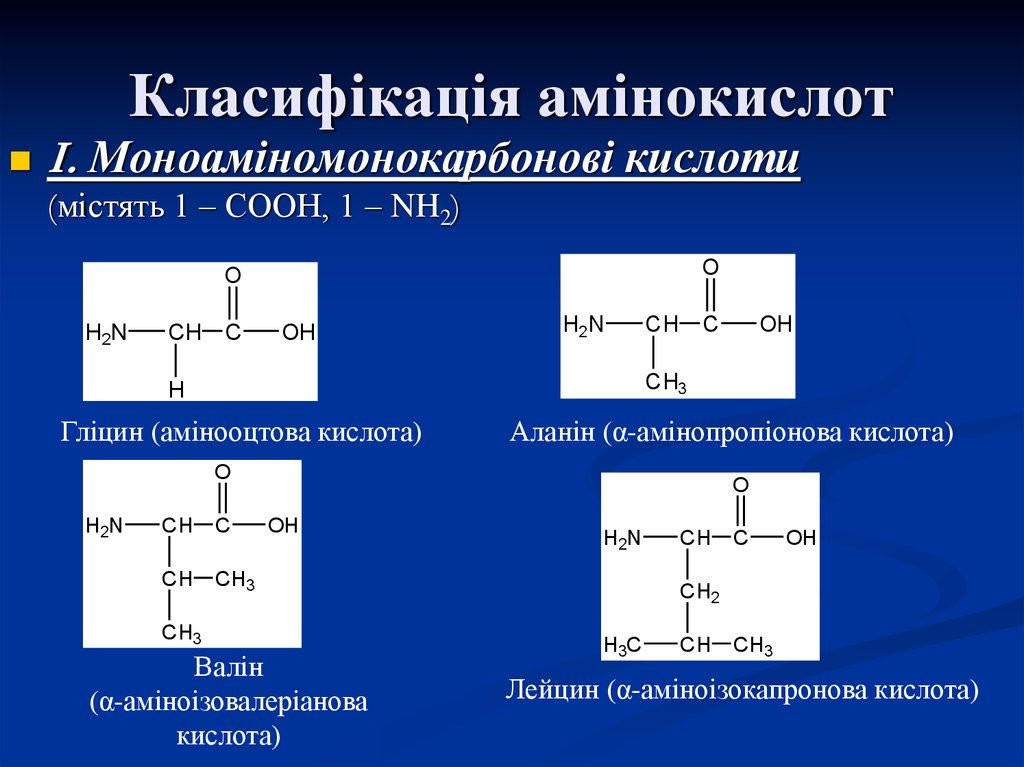
4. Класифікація амінокислот
I. Моноаміномонокарбонові кислоти(містять 1 – СООН, 1 – NH2)
O
O
H2N
CH
C
OH
H2N
CH
C
CH3
H
Гліцин (амінооцтова кислота)
Аланін (α-амінопропіонова кислота)
O
H2N
OH
CH
C
CH
CH3
O
OH
CH3
Валін
(α-аміноізовалеріанова
кислота)
H2N
CH
C
OH
CH2
H3C
CH
CH3
Лейцин (α-аміноізокапронова кислота)
5.
OO
H2N
H2N
CH
C
CH
C
OH
OH
CH OH
H2C
OH
CH3
Серин
(α-аміно-β-гідроксипропіонова кислота)
Треонін
(α-аміно-β-гідроксимасляна кислота)
O
H2N
CH
C
CH
CH3
OH
CH2
CH3
Ізолейцин (α-аміно-β-метилвалеріанова кислота)
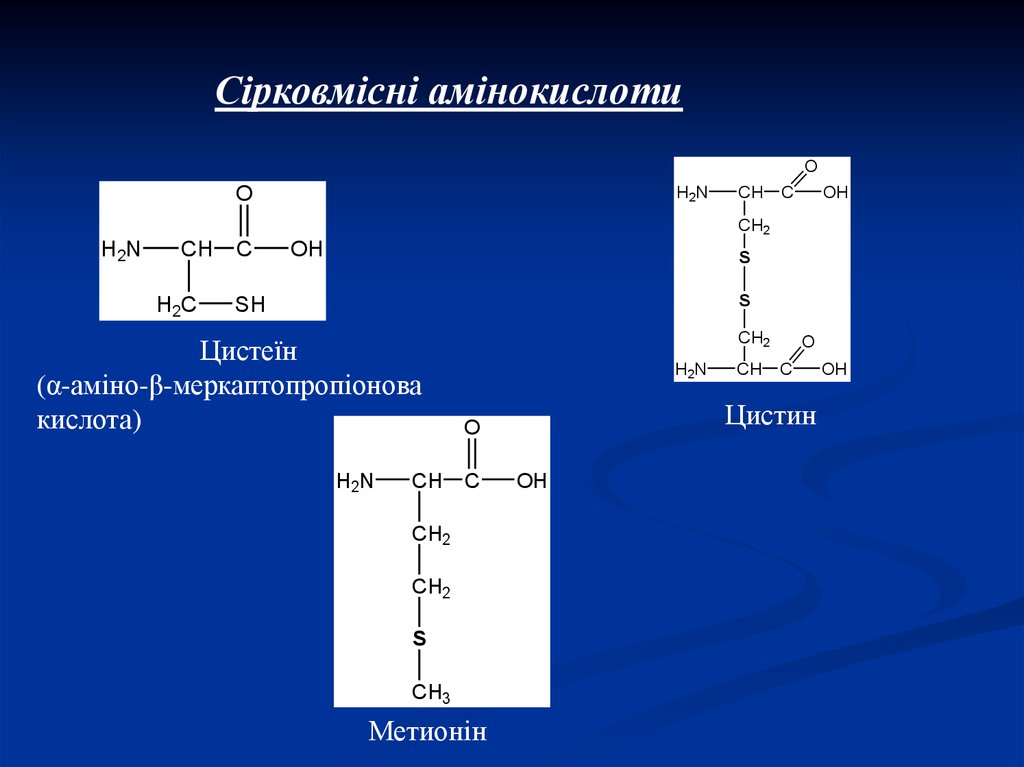
6.
Сірковмісні амінокислотиO
O
H2N
CH
C
OH
CH2
H2N
CH
H2C
C
OH
S
S
SH
Цистеїн
(α-аміно-β-меркаптопропіонова
кислота)
H2N
CH
CH2
H2N
CH2
CH2
S
CH3
Метионін
C
Цистин
O
C
CH
O
OH
OH
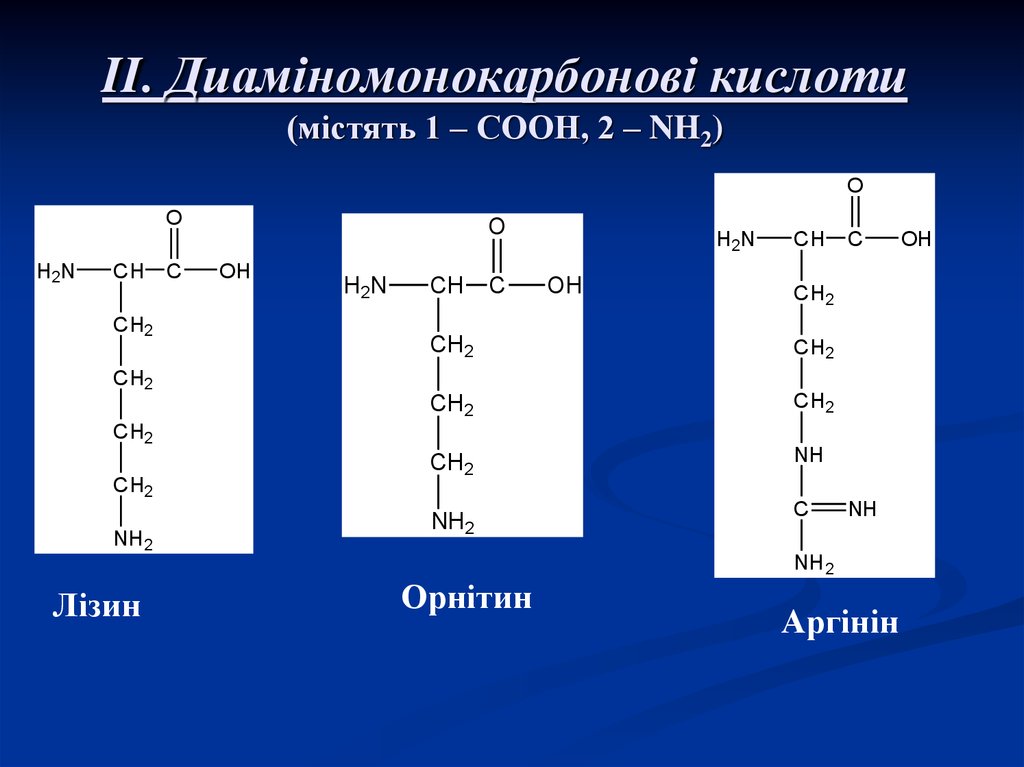
7. II. Диаміномонокарбонові кислоти (містять 1 – СООН, 2 – NH2)
OO
H2N
CH
CH2
C
O
OH
H2N
CH
C
H2N
OH
CH
CH2
CH2
CH2
CH2
CH2
CH2
NH
CH2
C
CH2
CH2
NH 2
NH2
C
NH
NH 2
Лізин
Орнітин
Аргінін
OH
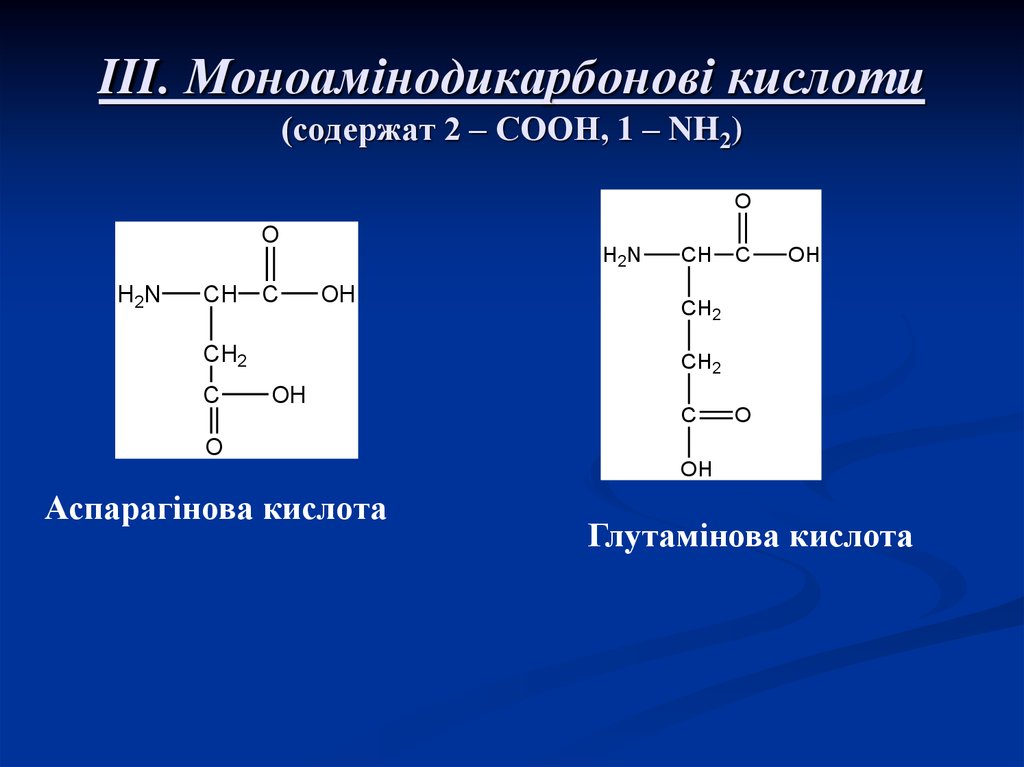
8. III. Моноамінодикарбонові кислоти (содержат 2 – СООН, 1 – NH2)
OO
H2N
CH
C
H2 N
OH
CH2
C
CH
C
OH
CH2
CH2
OH
C
O
O
OH
Аспарагінова кислота
Глутамінова кислота
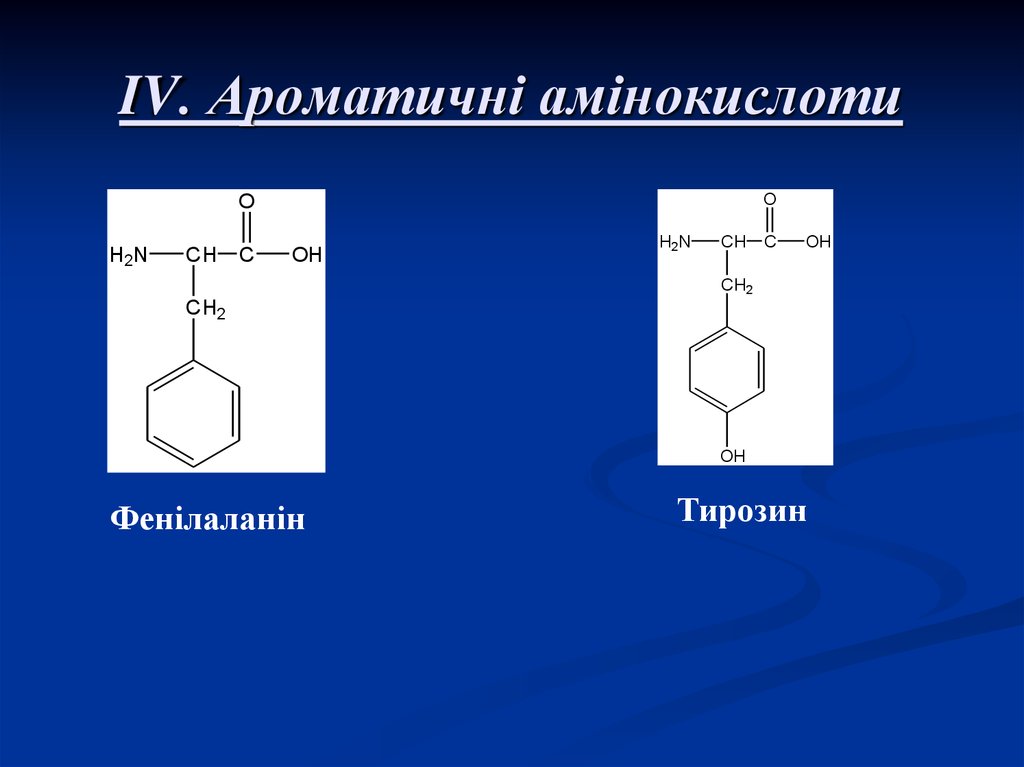
9. IV. Ароматичні амінокислоти
OO
H2N
CH
C
OH
H2N
CH
C
OH
CH2
CH2
OH
Фенілаланін
Тирозин
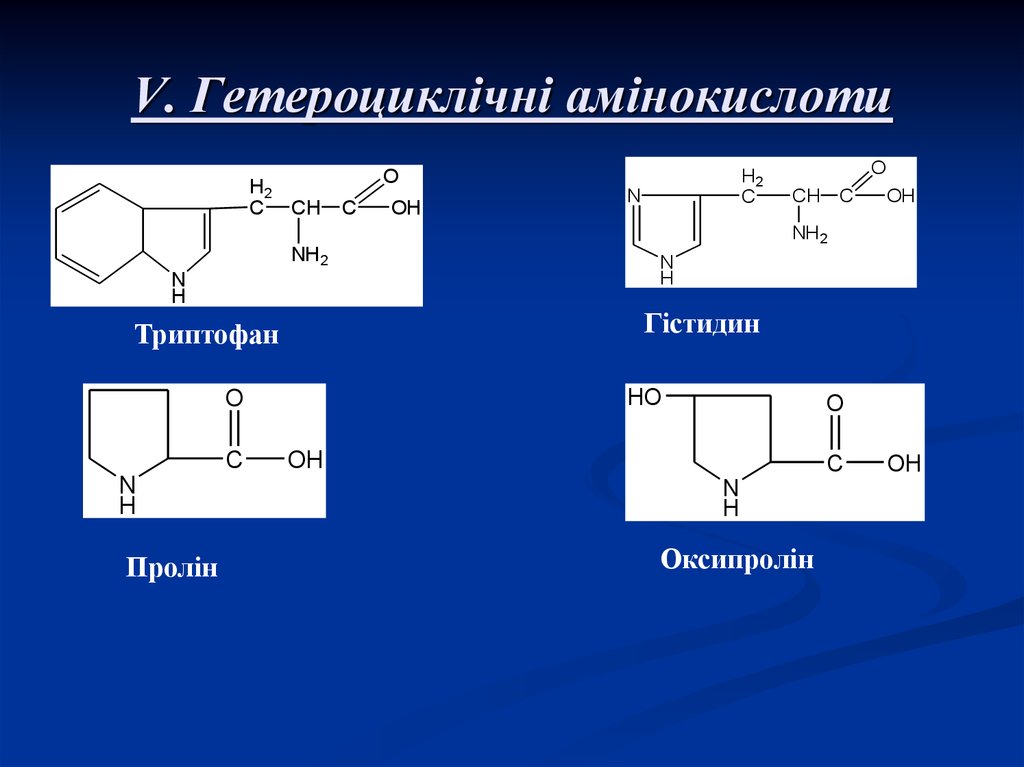
10. V. Гетероциклічні амінокислоти
H2C CH
O
C
OH
H2
C
N
O
CH
C
OH
NH2
NH2
N
H
Гістидин
Триптофан
HO
O
C
N
H
Пролін
N
H
O
OH
C
N
H
Оксипролін
OH
11. Амінокислоти
НезамінніЗамінні
Гліцин
Аланін
Серин
Цистеїн
Аспарагінова кислота
Глутамінова кислота
Тирозин
Пролін
Аспарагін
Глутамін
Треонін
Метионін
Валін
Лейцин
Ізолейцин
Лізин
Аргінін
Фенілаланін
Гістидин
Триптофан
12. Ізомерія
Разом з ізомерією, що обумовлена будовою вуглецевогоскелету та положенням функціональних груп, для
α-амінокислот характерна оптична (дзеркальна) ізомерія. Всі
α-амінокислоти, крім гліцину, оптично активні. Наприклад,
аланін має один асиметричний атом Карбону, а значить, існує
у вигляді оптично активних енантіомерів:
C
OH
C
O
H
C
NH2
H3C
Д-аланін
OH
O
H2N
C
H
H3C
L-аланін
Всі природні - амінокислоти відносяться до L– ряду.
13. Фізичні властивості
Амінокислоти представляють собою кристалічніречовини з високими (вище 250 С) температурами
плавлення, які мало відрізняються в індивідуальних
амінокислот і тому не є характерними. Амінокислоти
добре розчинні в воді і нерозчинні в органічних
розчинниках, чим вони схожі на неорганічні сполуки.
Більшість амінокислот мають солодкий смак.
Амінокислоти, за винятком гліцину, оптично активні.
В
організмі
всі
α-амінокислоти
L-ряду.
Д-амінокислоти отримують синтетичним шляхом,
вони зустрічаються в небілкових компонентах грибів,
синтезуються
мікроорганізмами.
В
організмі
знезаражуються і виводяться з нього. На ці
амінокислоті не діють ферменти.
14.
15.
16. Хімічні властивості
1. Дисоціація амінокислот:а) Моноаміномонокарбонові кислоти
O
H2N
CH2 C
O
+ HOH
OH
HOH3N
CH2 C
O
OH
+
H3N
CH2 C
+ H+ + OH-
O
гліцин
Білки, в складі яких переважає такий тип кислот, називаються
нейтральними, рН розчинів яких ≈7
17.
б) Диаміномонокарбонові кислотиO
O
H2N
CH
C
NH3OH
OH
C
OH
+
H3N
CH
C
CH2
CH2
CH2
CH2
CH2
CH2
CH2
CH2
CH2
CH2
CH2
+ 2HOH
CH2
NH2
O
+
Білки, в складі
яких переважає
такий тип кислот,
називаються
лужними,
середовище
лужне, рН>7.
-
Білки, в складі
яких
переважно
знаходяться
дикарбонові
кислоти,
називаються
кислими,
середовище кисле,
рН<7.
-
-
+ 2OH
+H
+
NH3
NH3OH
лізин
CH
O
в) Моноамінодикарбонові кислоти
O
H2N
CH C
CH2
C
O
OH
HOH3N
+ HOH
O
OH
Аспарагінова кислота
CH C
CH2
C
OH
O
OH
+
H3N
CH C
2H+ + OH-
CH2
O
C
O
O
-
O
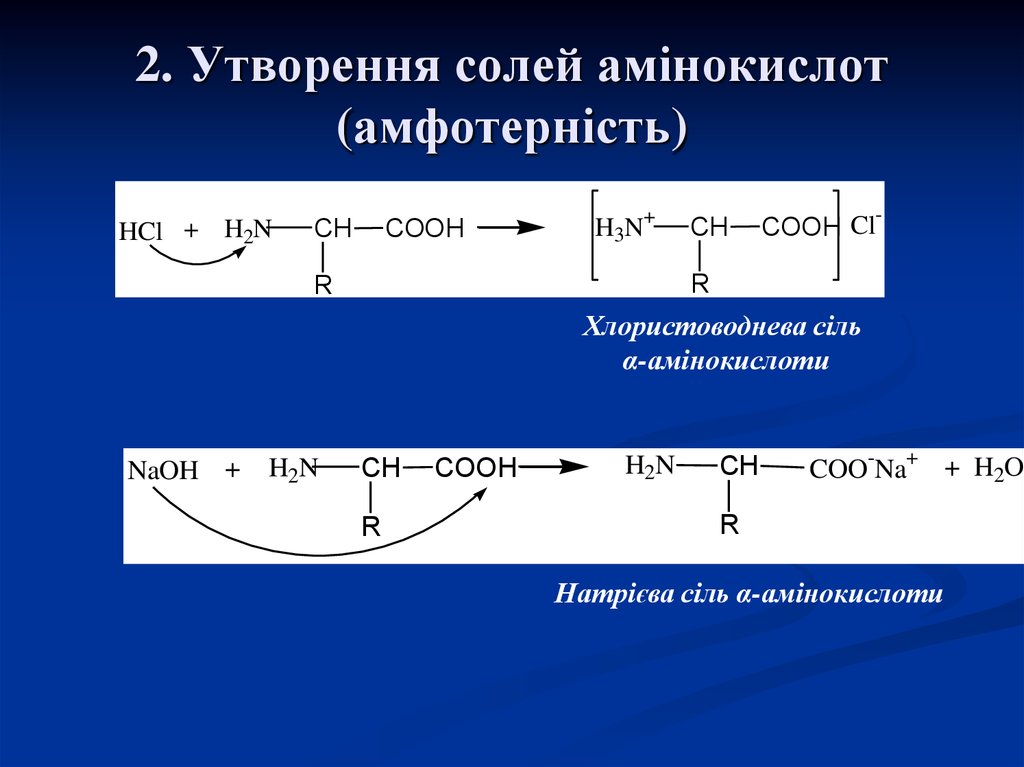
18. 2. Утворення солей амінокислот (амфотерність)
HCl + H2NCH
COOH
H3N+
CH
COOH Cl
R
R
Хлористоводнева сіль
α-амінокислоти
NaOH +
H2N
CH
R
COOH
H2N
CH
COO-Na+ + H2O
R
Натрієва сіль α-амінокислоти
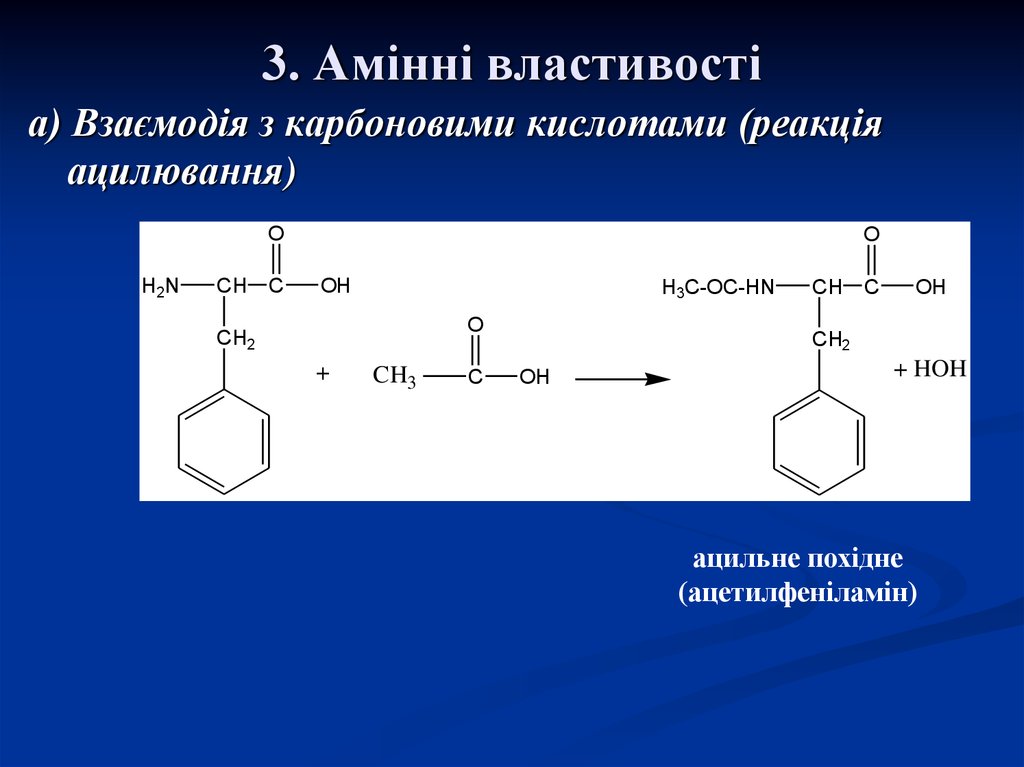
19. 3. Амінні властивості
а) Взаємодія з карбоновими кислотами (реакціяацилювання)
O
H2N
CH
C
O
OH
H3C-OC-HN
O
CH2
+
CH3
C
CH
C
OH
CH2
OH
+ HOH
ацильне похідне
(ацетилфеніламін)
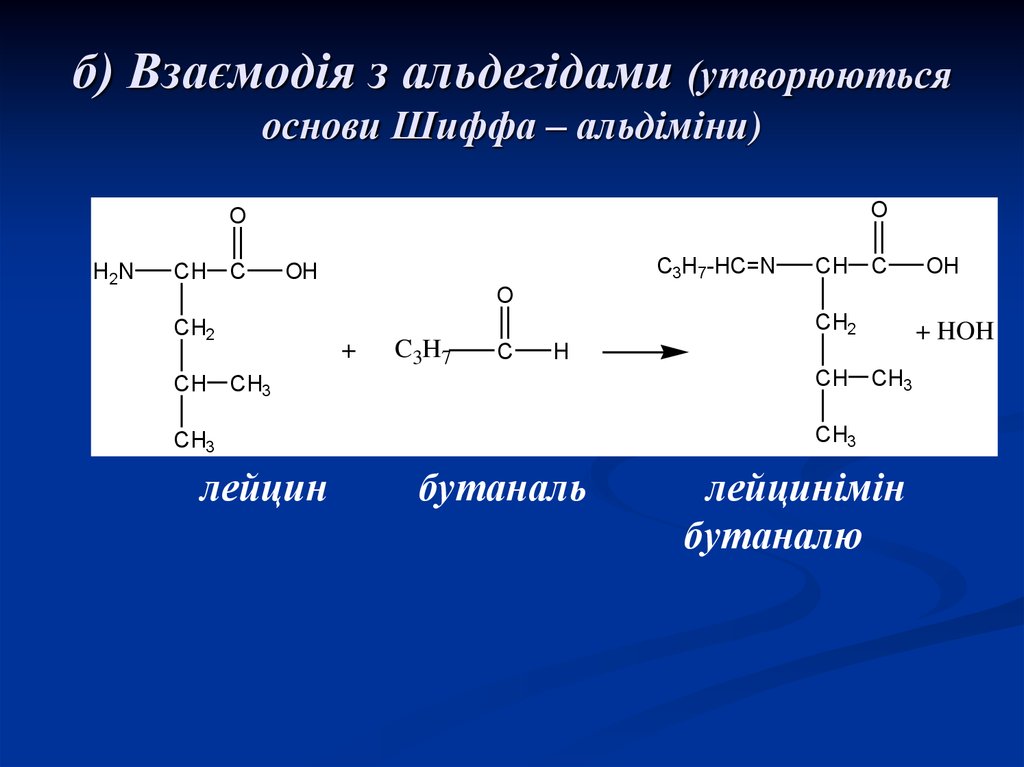
20. б) Взаємодія з альдегідами (утворюються основи Шиффа – альдіміни)
OO
H2N
CH
C
C3H7-HC=N
OH
CH
C
OH
O
CH2
CH2
CH
+
C3H7
C
H
CH
CH3
CH3
CH3
CH3
лейцин
+ HOH
бутаналь
лейцинімін
бутаналю
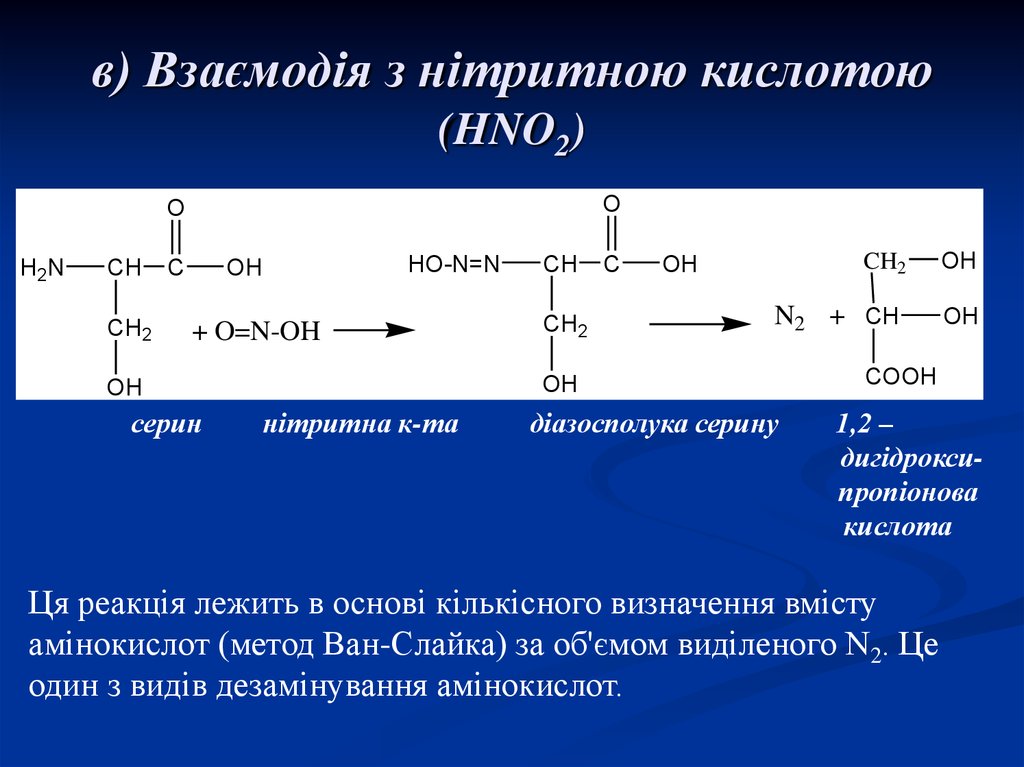
21. в) Взаємодія з нітритною кислотою (HNO2)
OO
H2N
CH
CH2
C
OH
HO-N=N
+ O=N-OH
CH2
C
CH2
OH
N2 + CH
OH
OH
OH
OH
серин
CH
нітритна к-та
діазосполука серину
COOH
1,2 –
дигідроксипропіонова
кислота
Ця реакція лежить в основі кількісного визначення вмісту
амінокислот (метод Ван-Слайка) за об'ємом виділеного N2. Це
один з видів дезамінування амінокислот.
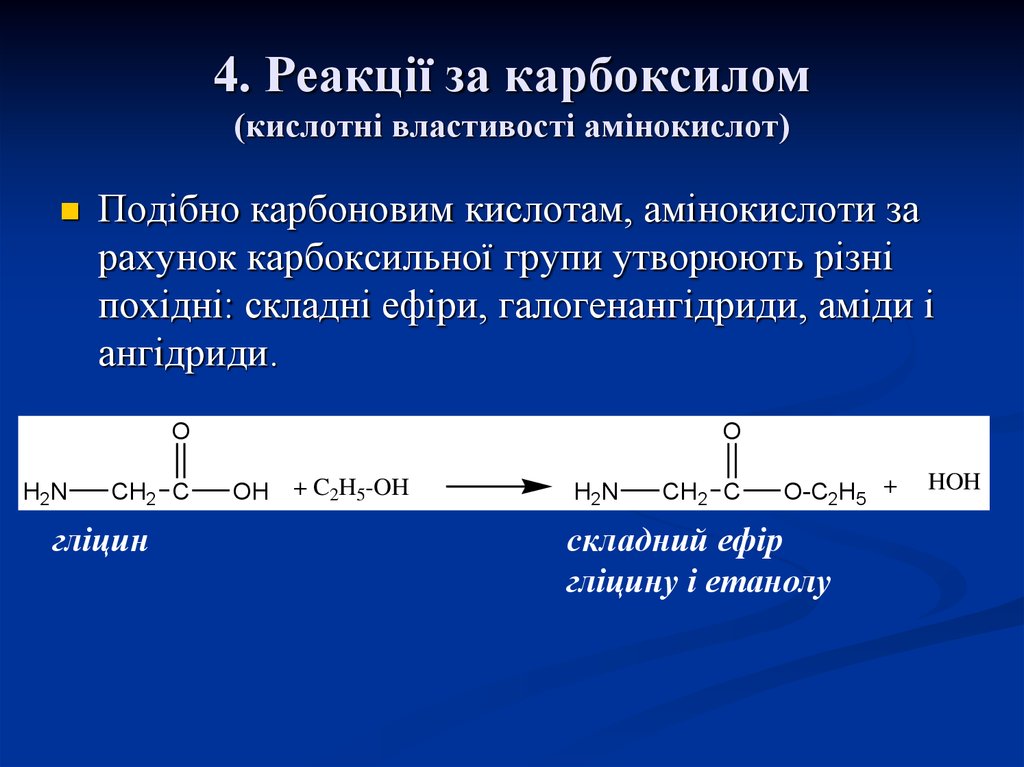
22. 4. Реакції за карбоксилом (кислотні властивості амінокислот)
Подібно карбоновим кислотам, амінокислоти зарахунок карбоксильної групи утворюють різні
похідні: складні ефіри, галогенангідриди, аміди і
ангідриди.
O
H2N
CH2 C
гліцин
O
OH
+ C2H5-OH
H2N
CH2 C
O-C2H5 +
складний ефір
гліцину і етанолу
HOH
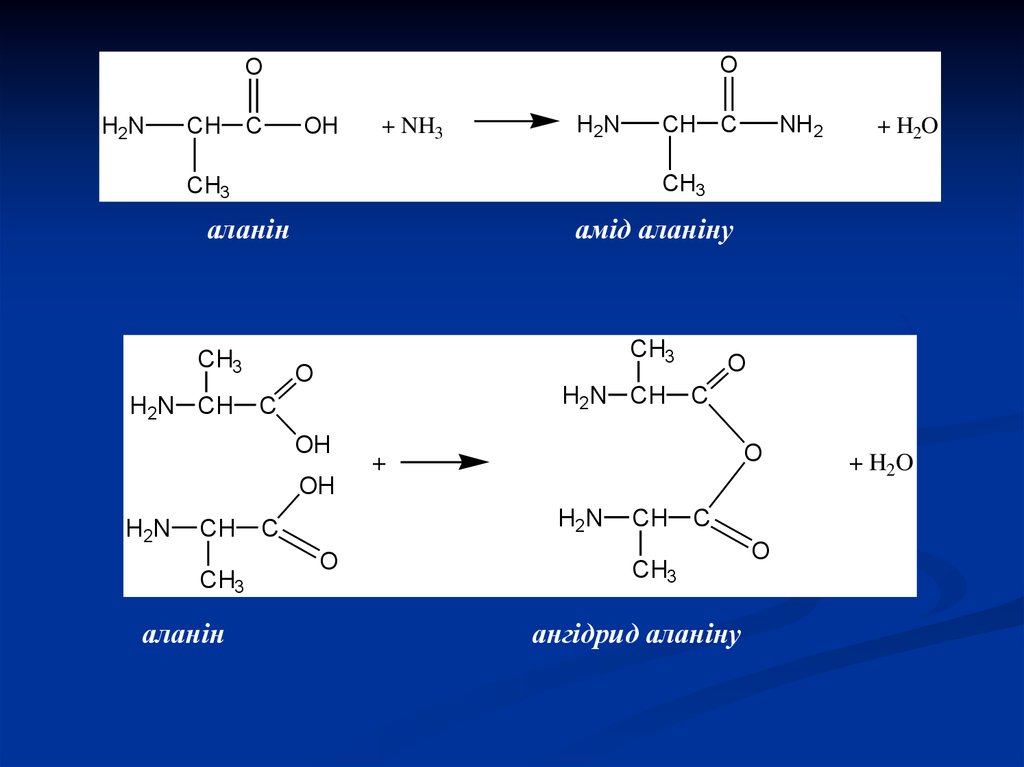
23.
OO
H2N
CH
C
OH
+ NH3
H2N
C
NH2
аланін
CH3
амід аланіну
CH3
O
H2N CH
C
OH
O
C
O
+
OH
H2N
CH
CH3
аланін
+ H2O
CH3
CH3
H2N CH
CH
H2N
C
O
CH
C
CH3
ангідрид аланіну
O
+ H2O
24.
OO
H2N
серин
CH
C
OH + PCl5
H2N
CH
CH2
CH2
OH
OH
C
хлорангідрид
серину
Cl
+ HCl + POCl3
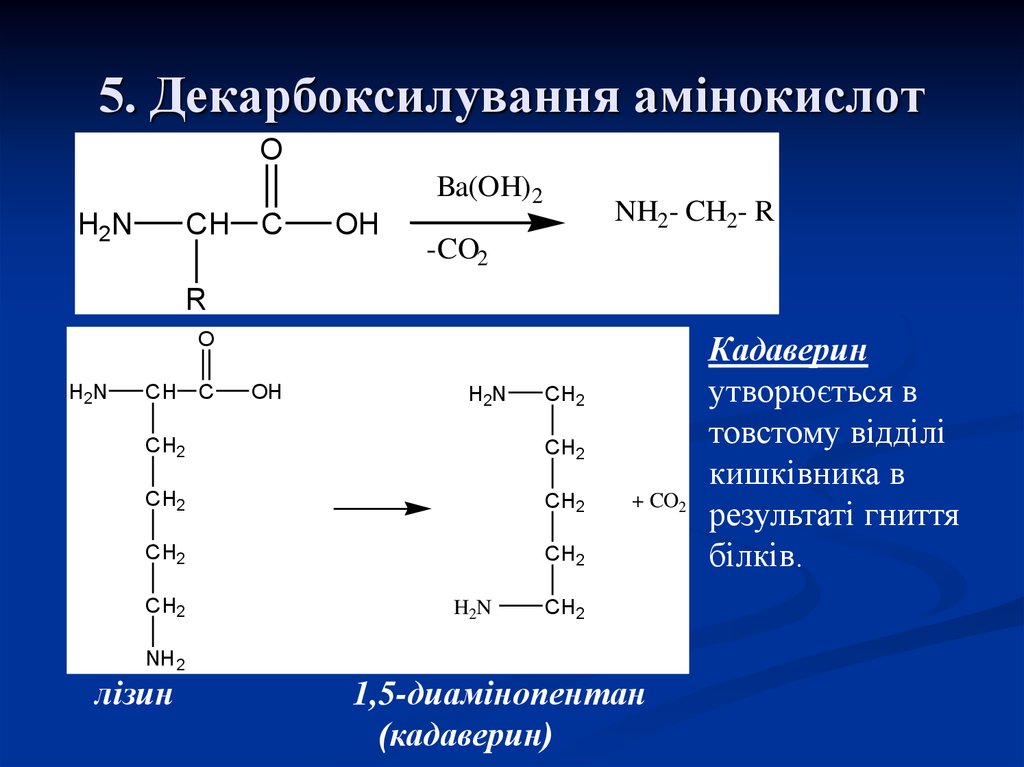
25. 5. Декарбоксилування амінокислот
OBa(OH) 2
H2N
CH
C
OH
NH2- CH2- R
-CO2
R
O
H2N
CH
C
OH
H2N
CH2
CH2
CH2
CH2
CH2
CH2
CH2
CH2
H2N
+ CO2
CH2
NH 2
лізин
1,5-диамінопентан
(кадаверин)
Кадаверин
утворюється в
товстому відділі
кишківника в
результаті гниття
білків.
26.
гістидингістамін
Гістамін у великих кількостях утворюється в місцях
запалень, призводить до розширення кровоносних судин, сприяє
припухлості та почервонінню. Протизапальні препарати
направлені на його зв'язування. Утворюється при багатьох
алергічних реакціях.
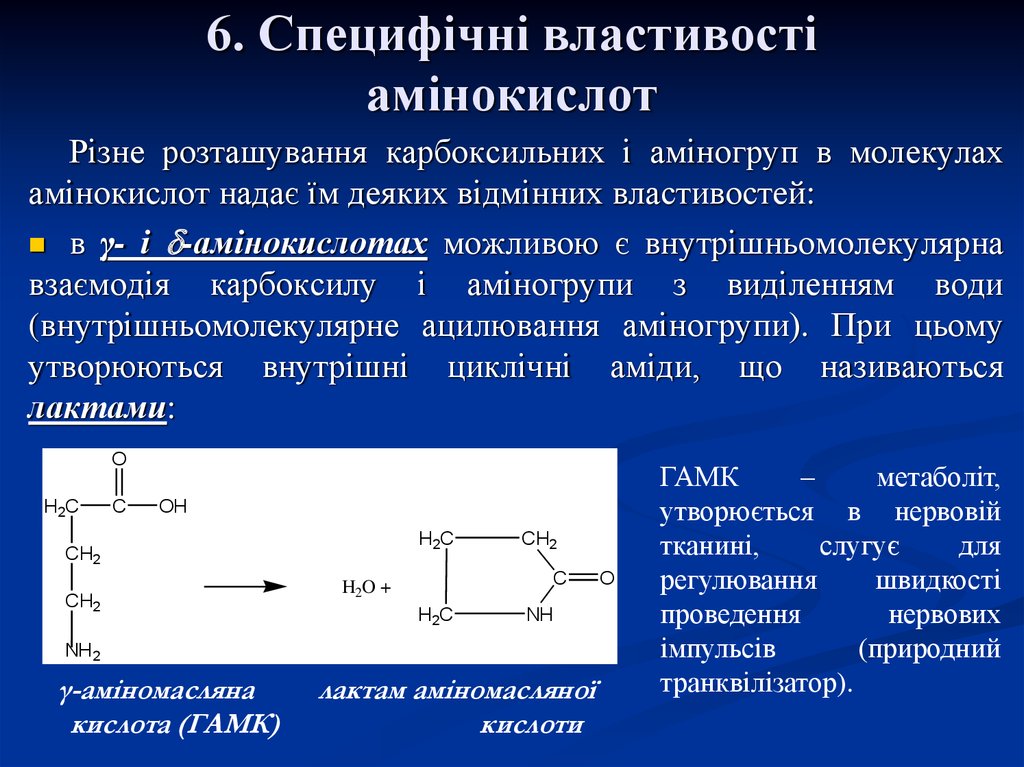
27. 6. Специфічні властивості амінокислот
Різне розташування карбоксильних і аміногруп в молекулахамінокислот надає їм деяких відмінних властивостей:
в γ- і -амінокислотах можливою є внутрішньомолекулярна
взаємодія карбоксилу і аміногрупи з виділенням води
(внутрішньомолекулярне ацилювання аміногрупи). При цьому
утворюються внутрішні циклічні аміди, що називаються
лактами:
O
H2C
C
OH
H2C
CH2
CH2
CH2
C
H2O +
H2C
NH
NH2
γ-аміномасляна
кислота (ГАМК)
лактам аміномасляної
кислоти
O
ГАМК
–
метаболіт,
утворюється в нервовій
тканині,
слугує
для
регулювання
швидкості
проведення
нервових
імпульсів
(природний
транквілізатор).
28.
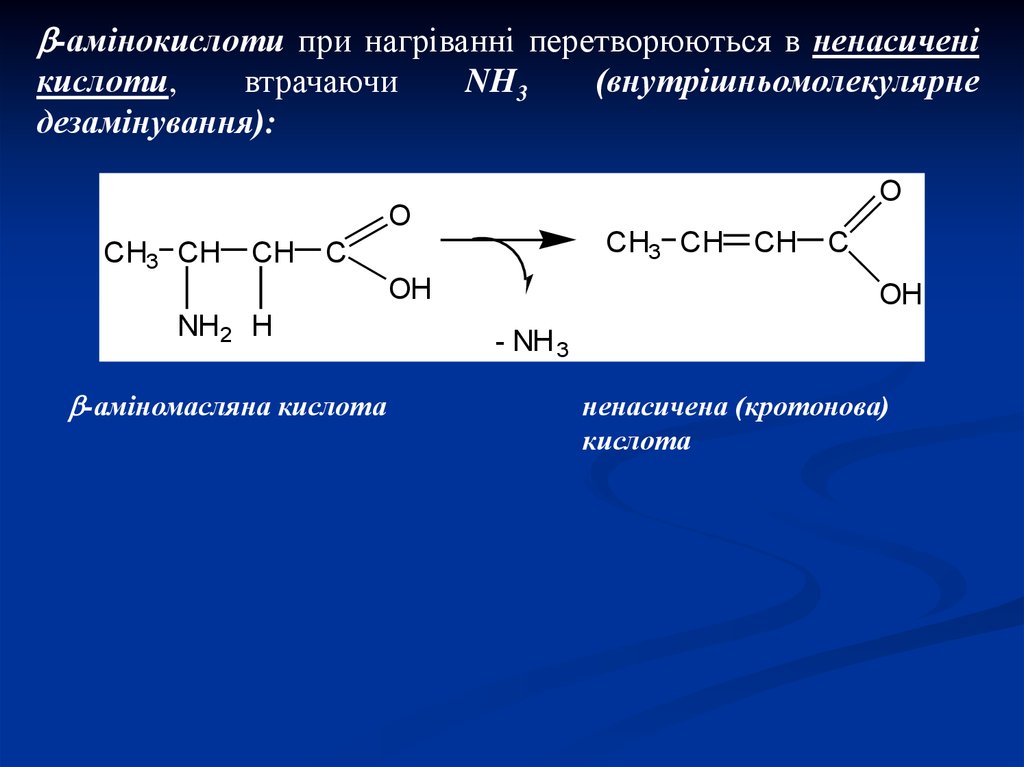
-амінокислоти при нагріванні перетворюються в ненасиченікислоти,
втрачаючи
дезамінування):
NH3
O
O
CH3 CH
CH
CH3 CH
C
OH
NH2 H
-аміномасляна кислота
(внутрішньомолекулярне
CH
C
OH
- NH 3
ненасичена (кротонова)
кислота
29.
-амінокислоти при нагріванні утворюють циклічні сполукитипу диамінів, що називаються дикетопіперазинами.
Відбувається взаємодія -СООН і -NH2 двох молекул
-амінокислот, виділяючи дві молекули води:
O
OH
C
CH
H3C
аланін
C
CH3
CH
+ 2 H2O
C
HO
H
N
O
CH
+
NH2
CH3
H2N
CH
O
H3C
C
N
H
O
ядро дикетопіперазину
(диметилдикетопіперазин
аланіну)
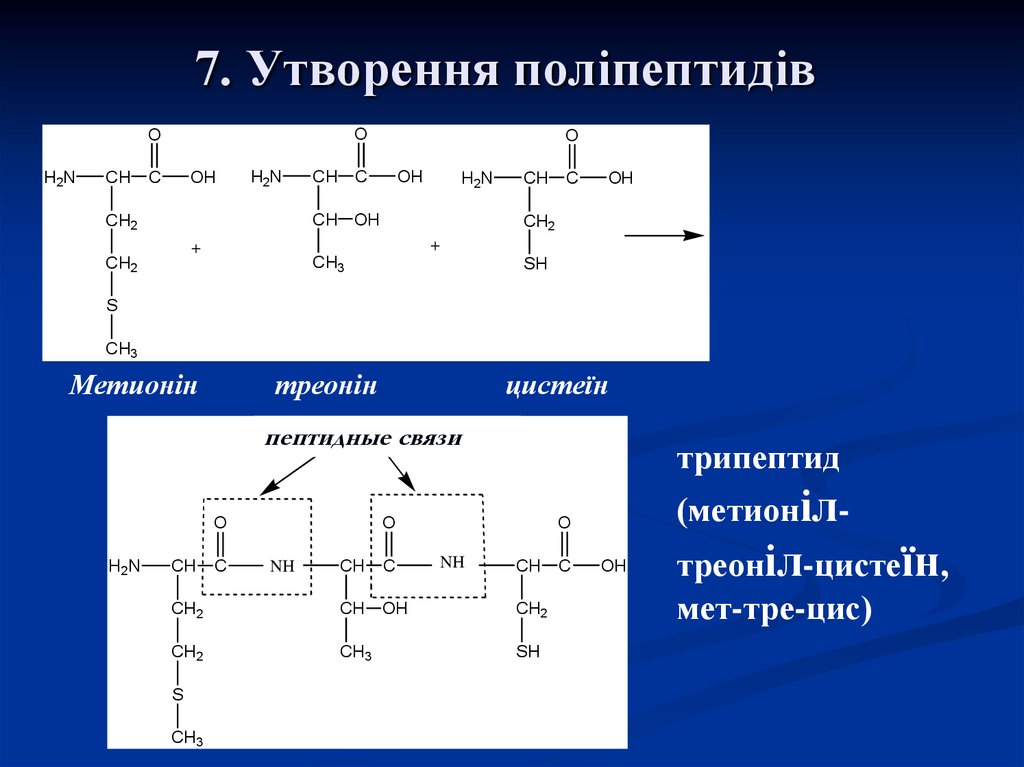
30. 7. Утворення поліпептидів
OO
H2N
CH
C
OH
H2N
CH
O
C
OH
H2N
CH OH
CH2
CH
C
OH
CH2
+
+
CH3
CH2
SH
S
CH3
Метионін
треонін
цистеїн
пептидные связи
O
O
H2N
CH
C
CH2
CH
OH
CH2
CH3
CH
S
CH3
C
трипептид
NH
(метионіл-
O
NH
CH
CH2
SH
C
OH
треоніл-цистеїн,
мет-тре-цис)
31. Біологічна роль амінокислот
1. Амінокислоти називають «цеглинками життя», тобтобілки складаються із залишків амінокислот.
2. Амінокислоти обумовлюють ріст і розвиток тварин,
рівень їх продуктивності.
3. Синтезуються штучно, використовуються, як кормові і
харчові добавки до раціонів людини і тварин.
4. Приймають участь у передаванні нервових імпульсів
(гліцин, глутамінова кислота).
5. Утворюють аміни (гістамін, ГАМК), що виконують
регуляторну функцію.
6. Кількісні зміни та порушення обміну амінокислот
викликають захворювання.
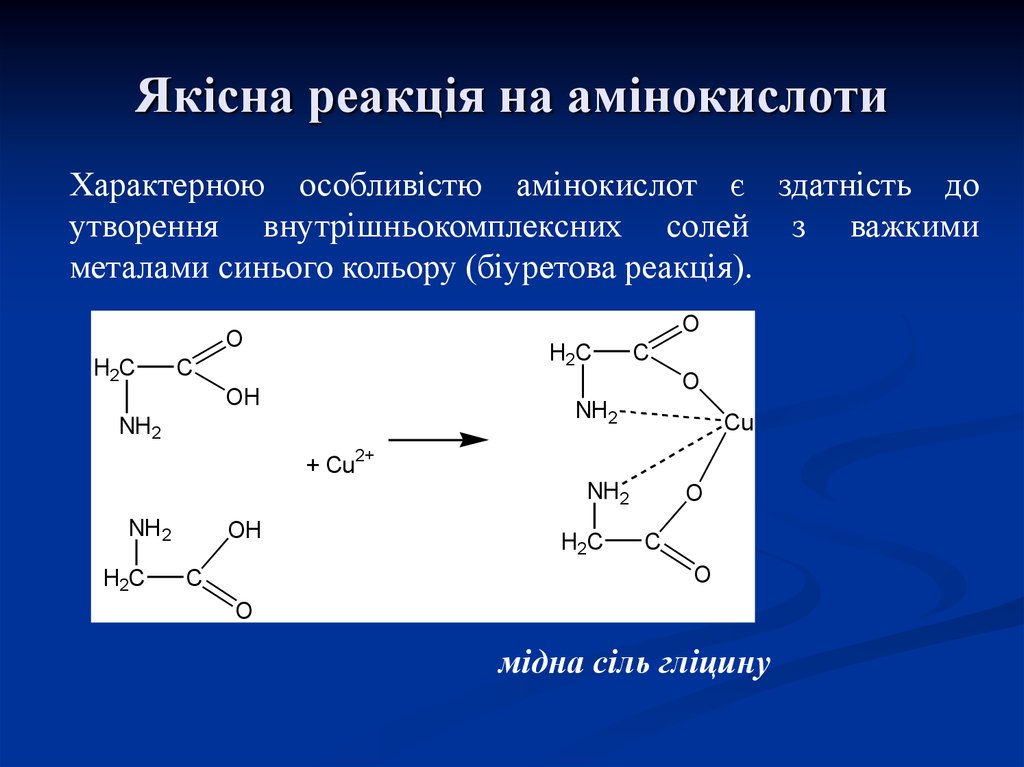
32. Якісна реакція на амінокислоти
Характерною особливістю амінокислот є здатність доутворення внутрішньокомплексних солей з важкими
металами синього кольору (біуретова реакція).
O
O
H2C
H2C
C
C
O
OH
NH2
NH2
Cu
+ Cu2+
NH2
NH2
H2C
OH
H2C
O
C
O
C
O
мідна сіль гліцину
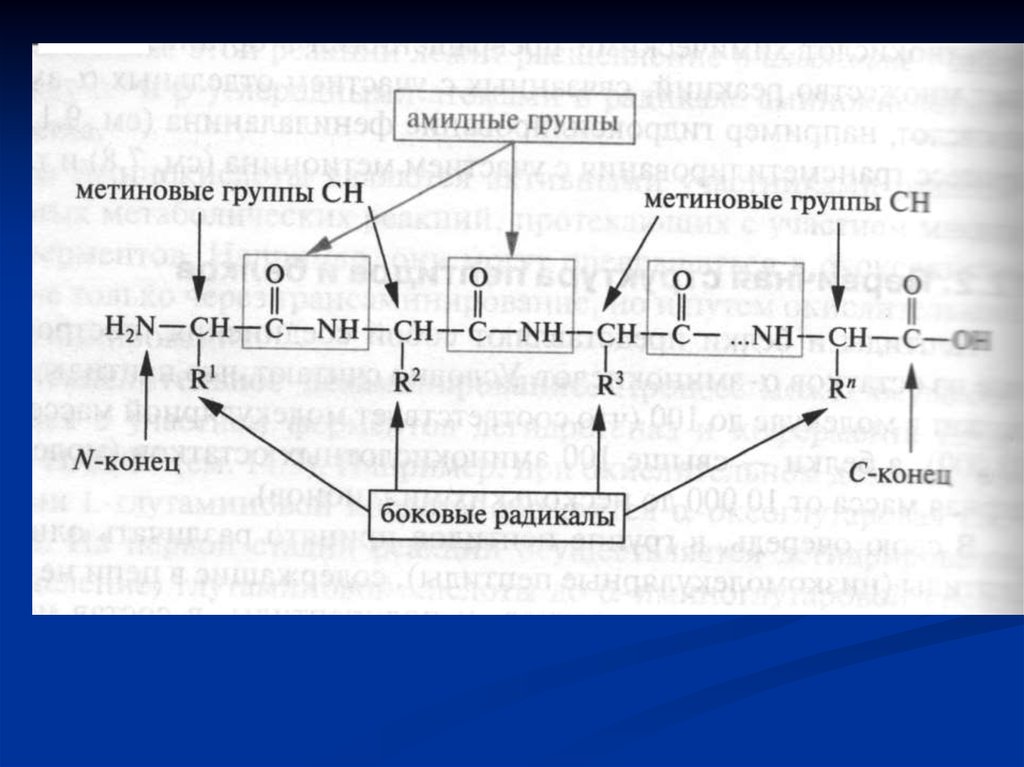
33. Пептиди і білки
Пептиди і білки представляють собоювисокомолекулярні органічні сполуки, які
побудовані із залишків α- амінокислот,
з'єднаних між собою пептидними зв'язками.
34.
35. Пептиди
Пептид складається з двох або більшої кількостіамінокислотних залишків, сполучених пептидними
зв'язками (дипептид, трипептид ….). До 10 залишків –
олігопептид, 10 і більше, то це поліпептид.
Значення: 1. Деякі гормони (вазопресин, окситоцин, інсулін).
2. Антибіотики (валіноміцин, граміцидин А).
3. Протипухлинні препарати.
4. Фізіологічно активні речовини (брадикінін –
розслабляє гладку мускулатуру. Глутатіон – модулятор
ферментативної активності, утворює дисульфідні зв'язки).
Як і амінокислоти, білки мають амфотерні властивості.
36. Білки
Білки – біологічні полімерні молекули,мономерами яких є амінокислоти,
сполучені пептидними зв'язками.
Індивідуальність білкових молекул визначається
порядком чергування амінокислот і їх кількістю.
Білки мають м.м. від 5 тис. Д і більше.
37. Функції білків
Каталітична – ферментиПластична – структурні білки
Регуляторна – гормони, ферменти
Скорочувальна – білки м'язів і цитоскелету
Захисна – імуноглобуліни
Енергетична – використані білки
Рецепторна – деякі білки мембран
Транспортна – білки крові, білки мембран
Гістосумісність – деякі білки мембран
В організмі тварин білків - 18-21%,
у рослин – 0,01-15%



















 chemistry
chemistry








