Similar presentations:
Ферменти
1. ФЕРМЕНТИ
Це специфічні білки, що виконують ворганізмі
функцію
біологічних
каталізаторів (Fermentum – закваска; enzyme
– в дріжджах).
Розділ біохімії, що вивчає ферменти та
ферментативні
процеси,
називається
ензимологією.
2. Відмінність біологічних каталізаторів (ферментів) від мінеральних
Надзвичайно висока ефективність дії (в дужемалих кількостях підсилюють швидкості
біохімічних реакцій в сотні тисяч разів).
Висока специфічність дії (як по відношенню до
типу хімічної реакції, так і по відношенню до
субстрату).
Проявляють свою дію в «м'яких» умовах
(температура 36-42оС, нормальний тиск, рН=7,0)
Активність ферментів регулюється різними
системами.
3. Будова ферментів
1) прості білки (однокомпонентні)2) складні білки (двокомпонентні):
простий білок + простетична група
(апофермент)
(кофермент)
4. Молекулярна маса
РИБОНУКЛЕАЗА ……………....………………..……………………..13700ТРИПСИН ………………………………………………………………23800
ГЕКСОКІНАЗА ……………………...………………….……………..45000
АЛЬДОЛАЗА ………………………………………………...………..142000
УРЕАЗА ………………………………………………………………..480000
ПІРУВАТДЕГІДРОГЕНАЗА ………..……….………………...……4500000
5. Коферменти
1. Водорозчинні вітаміни – у виглядіфосфорних ефірів (ТДФ та ФП) або в складі
нуклеотидів (ФМН, ФАД, НАД, НАДФ,
НS-КоА)
2. Нуклеозид три- і дифосфати (АТФ, ТТФ,
УТФ, ГТФ).
3. Метали (Zn2+, Cu2+, Fe2+, Mo2+).
4. Пептидні коферменти (глутатіон).
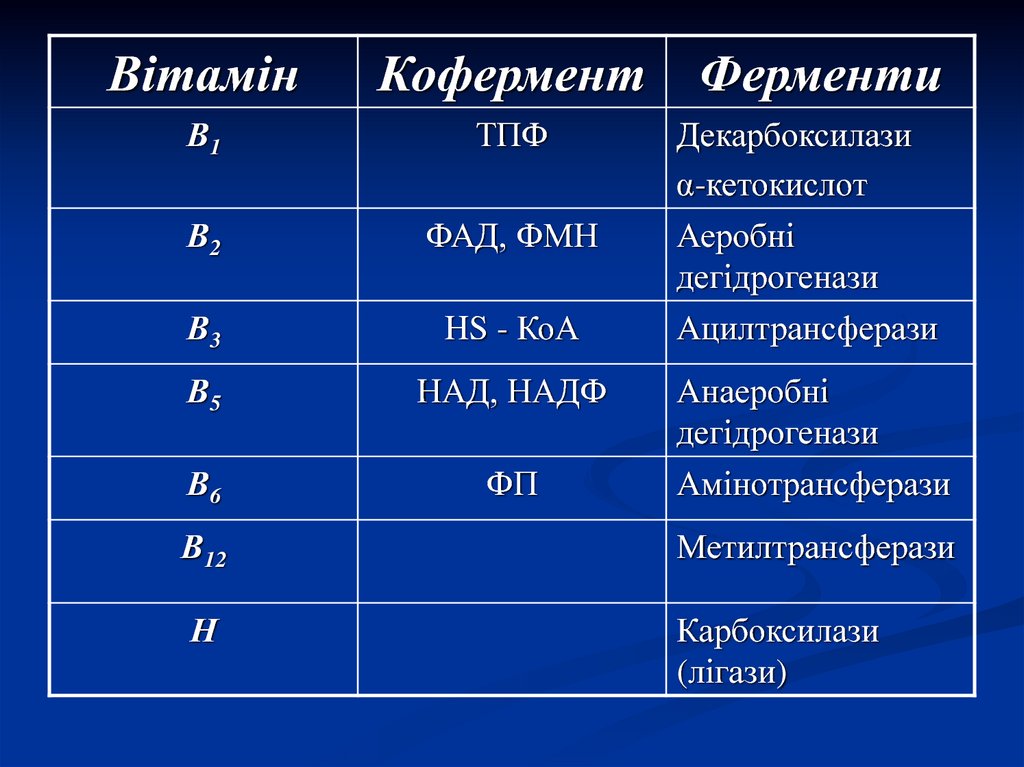
6.
ВітамінКофермент
В1
ТПФ
В2
ФАД, ФМН
В3
HS - КоА
В5
НАД, НАДФ
В6
ФП
Ферменти
Декарбоксилази
α-кетокислот
Аеробні
дегідрогенази
Ацилтрансферази
Анаеробні
дегідрогенази
Амінотрансферази
В12
Метилтрансферази
Н
Карбоксилази
(лігази)
7. Центри ферментів
це особливі ділянки ферментів, якіформуються на рівні третинної і
четвертинної
структури
та
забезпечують каталітичну функцію
ферментів
8.
В структурі ферментів розрізняють наступні центри:1. Активний центр, в ньому виділяють 2
ділянки, які теж іноді називають центрами:
а). Субстратний центр – це ділянка
ферменту, за рахунок якого утворюється зв'язок
між субстратом та ферментом і відбувається
утворення
нестійкого
фермент-субстратного
комплексу;
б). Каталітичний центр – це ділянка
ферменту, яка відповідає за безпосереднє
проведення
реакції
(часто
співпадає
з
коферментом).
9.
2. Регуляторний (алостеричний) центр –це ділянка ферменту, приєднання до якого
різних
речовин
(модифікаторів)
призводить до змін просторової структури
активного центру, в результаті чого
фермент змінює свою активність.
Модифікатори, що збільшують активність
ферментів, називаються активаторами, а
ті, що зменшують – інгібіторами.
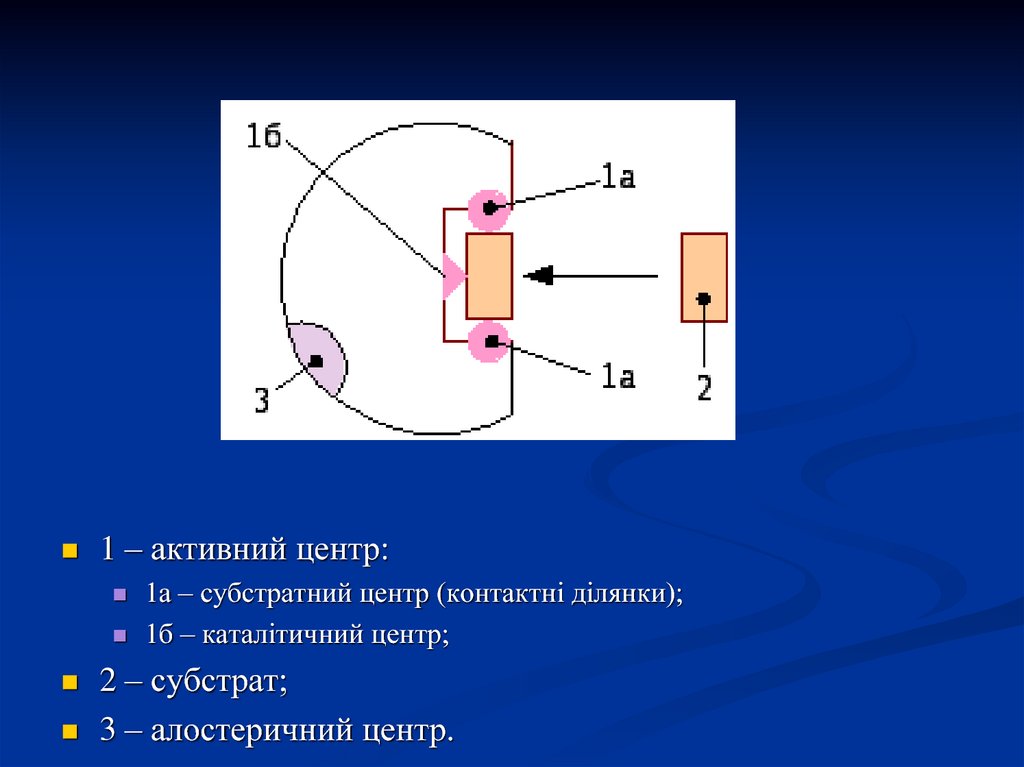
10.
1 – активний центр:1а – субстратний центр (контактні ділянки);
1б – каталітичний центр;
2 – субстрат;
3 – алостеричний центр.
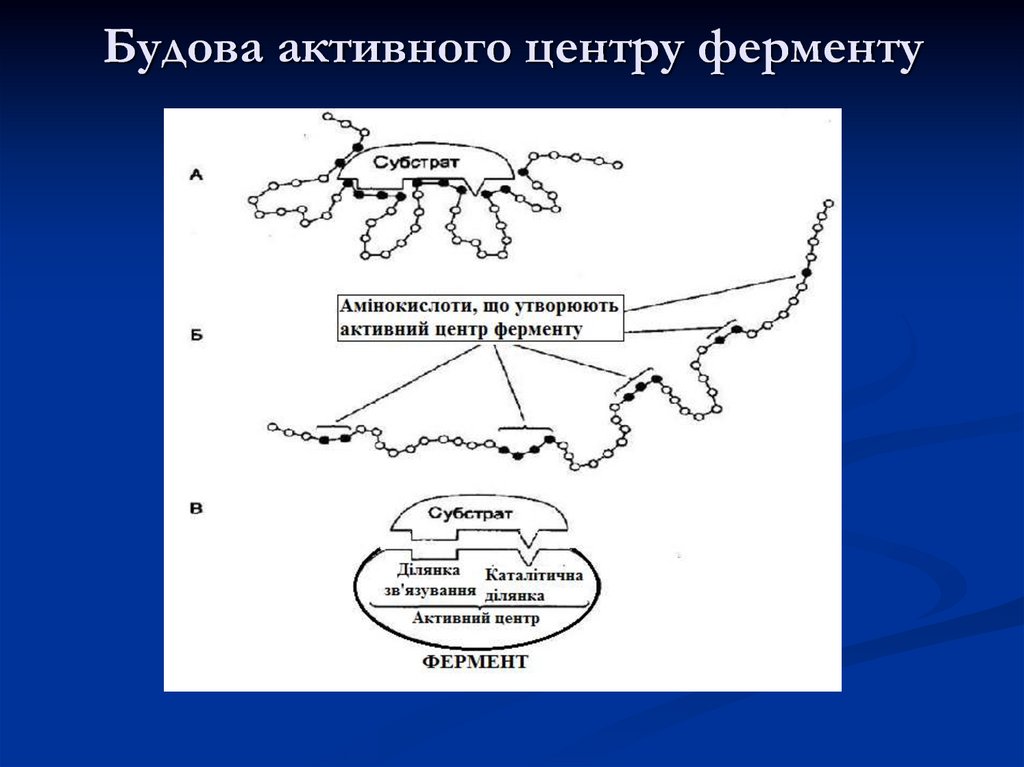
11. Будова активного центру ферменту
12. Амінокислоти, що найчастіше входять до структури центрів
Серин – ОНТреонін – ОН
Тирозин – ОН
Цистеїн – SH
Лізин – NH2
Аргінін – HN – C – NH2
||
NH
Гістидин - імідазол
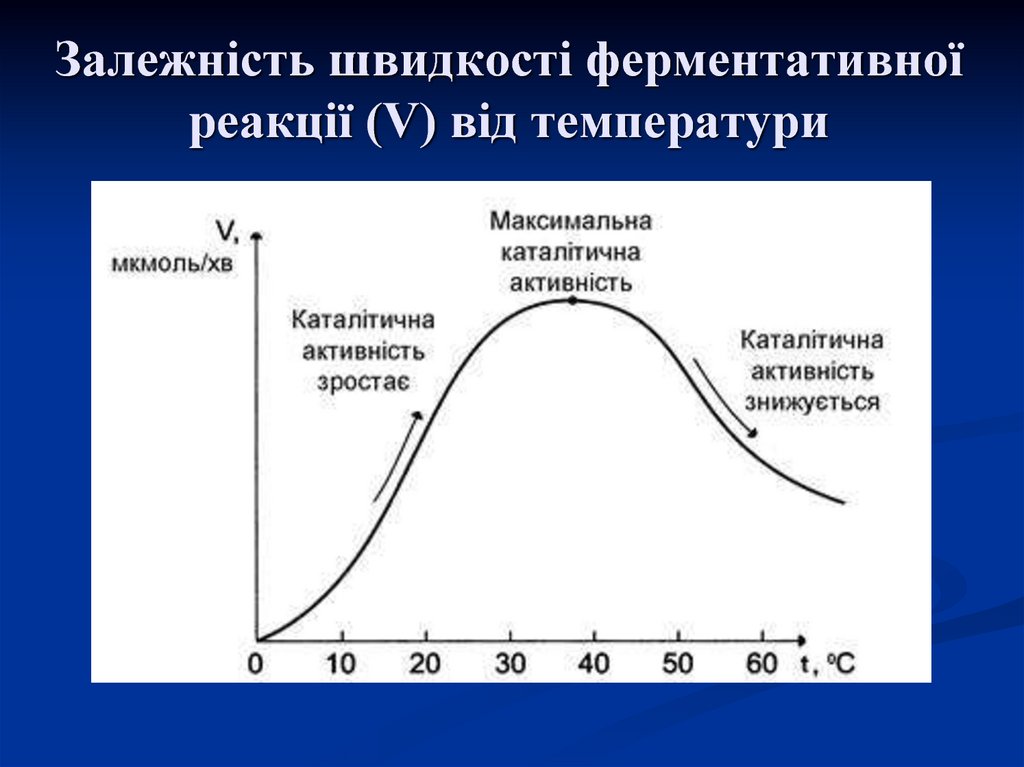
13. Загальні властивості ферментів
1. Термолабільність – це зміна активностіферментів при різних температурах: оптимальну
активність вони проявляють при температурі тіла
тварин.
При підвищенні температури їх активність
збільшується, але на певний час, бо з подальшим
підвищенням
температури
(80-100оС)
вони
припиняють свою дію необоротно (відбувається
денатурація білкової частини).
При зниженні температури активність ферментів
зменшується, а при 0оС і нижче (заморожування) їх
активність рівна нулю, але ця дія обернена.
14. Залежність швидкості ферментативної реакції (V) від температури
15.
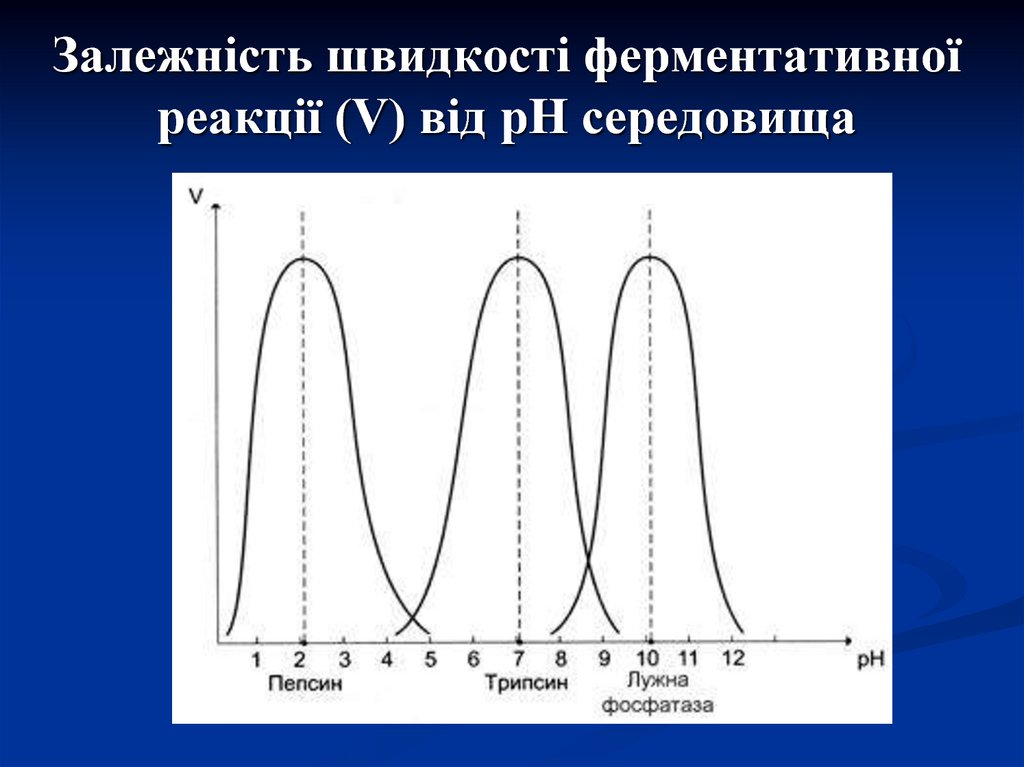
2. Чутливість до рН середовищаБільшість ферментів організму мають
оптимум рН, наближений до нейтрального,
хоча для кожного ферменту для прояву
максимальної його активності існує певне
значення рН, так як при даних значеннях
формується оптимальна конформація білкафермента з максимальною активністю його
центрів.
16. Залежність швидкості ферментативної реакції (V) від рН середовища
17.
3. Специфічність дії– це вибірковість дії
ферментів як по відношенню до субстрату реакції, так і по
відношенню до типу хімічної реакції.
Розрізняють наступні рівні специфічності:
Абсолютна (індивідуальна) – коли фермент діє
тільки на один конкретний субстрат (наприклад, уреаза,
яка каталізує гідроліз сечовини).
Відносна (групова) – фермент діє на групу речовин,
Оптична (стереоспецифічність) – коли фермент
близьких за хімічною будовою (наприклад, пепсин діє на
різні білки).
діє не просто на одну речовину, а тільки на певний його
оптичний ізомер (наприклад, ферменти амінокислот
організму специфічні тільки по відношенню до
L-ізомерів).
18.
4. Зберігають активність в ізольованомувигляді,
тому
багато
ферментів
використовують як лікарські препарати.
5. Чутливість до наявності в середовищі
модифікаторів
(активаторів
та
інгібіторів).
За рахунок їх дії регулюється активність
ферменту, кооперативність, взаємозв'язок і
запрограмованість їх дії.
19. Механізм дії ферментів. Енергетичні зміни ПРИ ХІМІЧНИХ РЕАКЦІЯХ.
Будь-які хімічні реакції перебігаютьзгідно
двох
основних
законів
термодинаміки: закону збереження енергії
та закону ентропії. Відповідно до цих
законів, загальна енергія хімічної системи
та її оточення залишається постійною, при
цьому хімічна система прагне до
зменшення впорядкованості (збільшення
ентропії).
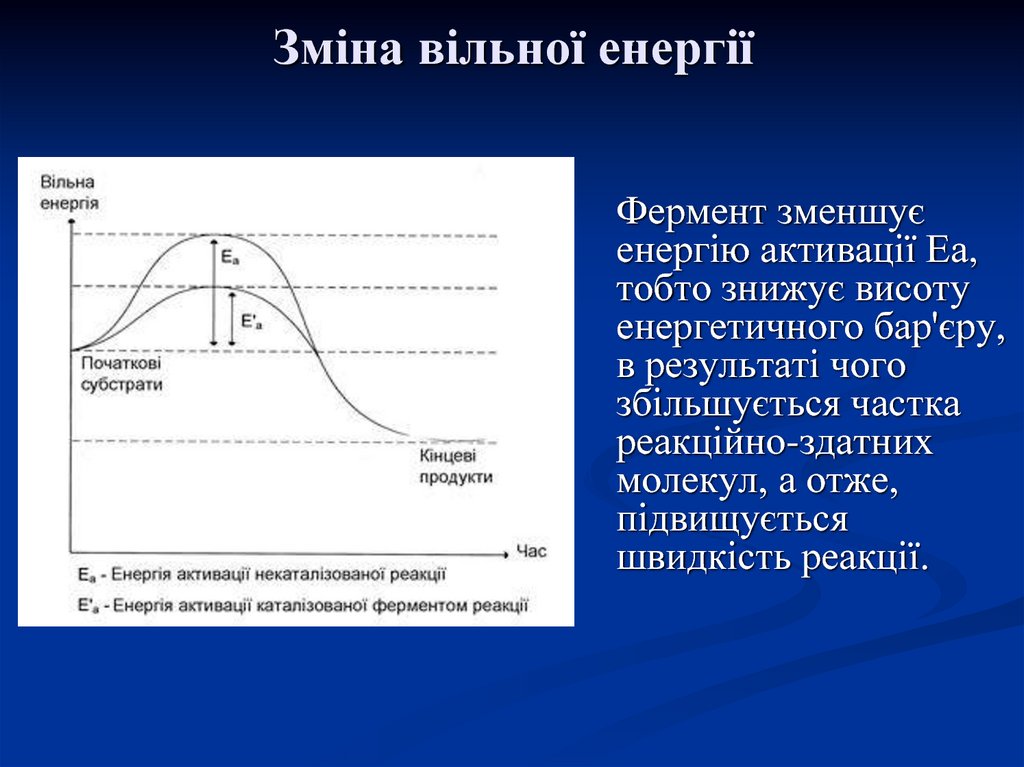
20. Зміна вільної енергії
Фермент зменшуєенергію активації Еа,
тобто знижує висоту
енергетичного бар'єру,
в результаті чого
збільшується частка
реакційно-здатних
молекул, а отже,
підвищується
швидкість реакції.
21. Зниження енергетичного бар'єру відбувається за рахунок:
1. Підвищення ймовірності зіткнення субстратів.2. Чіткої орієнтації взаємодій молекул в активному
центрі.
3. Максимального зближення субстратів.
4. Дії на певні атоми субстрату атомами активного
центру.
5. Зміщення електронів і протонів, що підвищує
реакційноздатність атомів.
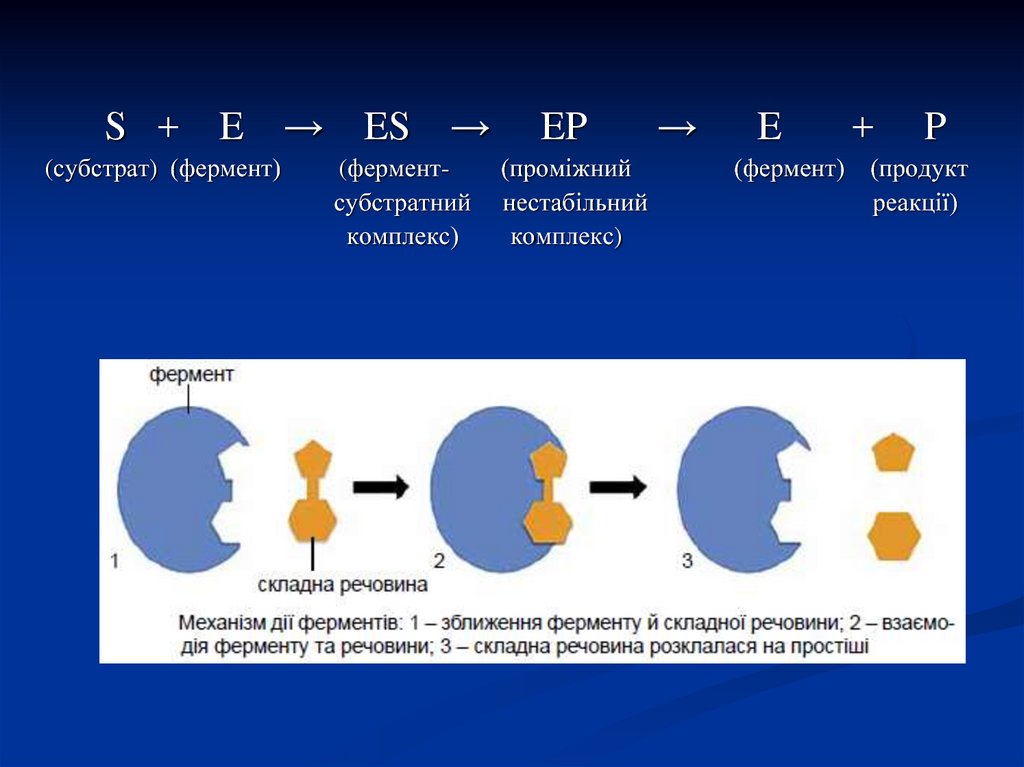
22. Механізм ферментативного каталізу (теорія нестійких фермент-субстратних комплексів)
Вмеханізмі
ферментативного
каталізу
вирішальне значення має утворення нестійких
проміжних сполук – фермент-субстратних
комплексів – ES, що перетворюються в
нестабільний перехідний комплекс – ЕР, який
майже миттєво розпадається на вільний фермент і
продукт реакції.
23.
S +E
(cубстрат) (фермент)
→
ES
→
(ферментсубстратний
комплекс)
EP
(проміжний
нестабільний
комплекс)
→
E
+
P
(фермент) (продукт
реакції)
24. Ефект деформації
Активний центр ферменту такожсприяє дестабілізації міжатомних
зв'язків в молекулі субстрату, що
полегшує перебіг хімічної реакції та
утворення продуктів. Ця властивість
активного
центру
називається
ефектом деформації субстрату.
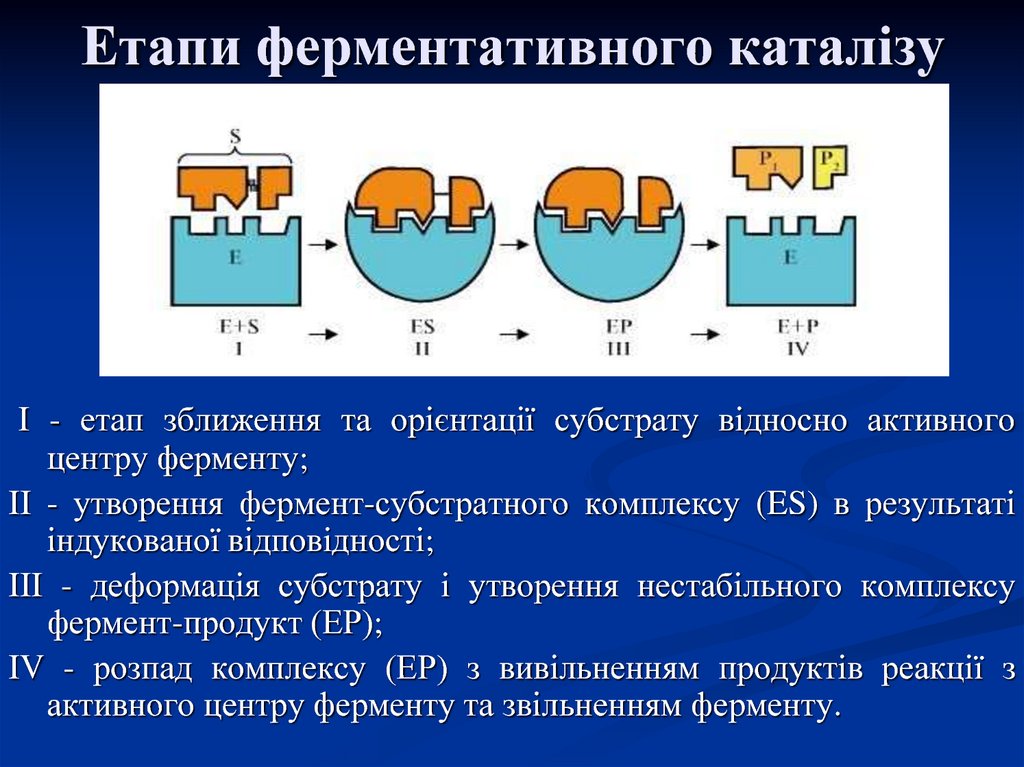
25. Етапи ферментативного каталізу
I - етап зближення та орієнтації субстрату відносно активногоцентру ферменту;
II - утворення фермент-субстратного комплексу (ES) в результаті
індукованої відповідності;
III - деформація субстрату і утворення нестабільного комплексу
фермент-продукт (ЕР);
IV - розпад комплексу (ЕР) з вивільненням продуктів реакції з
активного центру ферменту та звільненням ферменту.
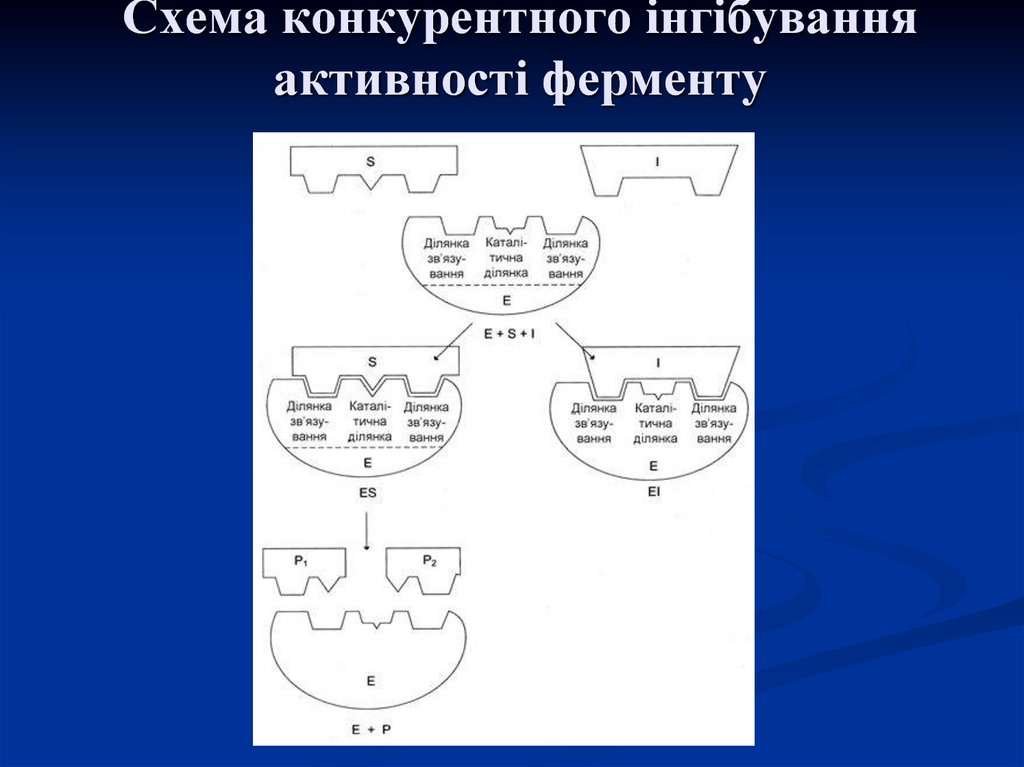
26. Конкурентна і неконкурентна дія інгібіторів
Конкурентна дія інгібітора буває втому випадку, коли його хімічна
будова подібна до будови субстрату і
тому він здатний приєднатися до
субстратного центру, конкуруючи з
субстратом, що пригнічує активність
ферменту.
27. Схема конкурентного інгібування активності ферменту
28.
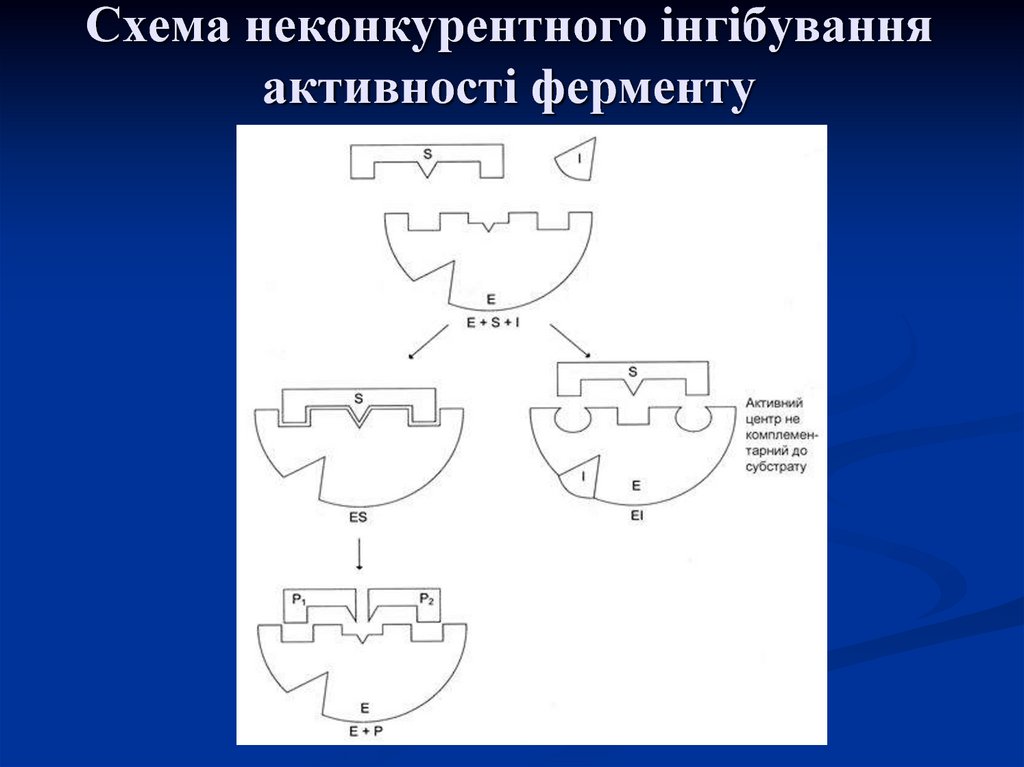
Занеконкурентного
інгібування
інгібітор
приєднується
до
алостеричного центру, в результаті
чого
змінюється
конформація
активного центру та його здатність
з'єднуватися
з
субстратом.
Ферментативна реакція при цьому
пригнічується.
29. Схема неконкурентного інгібування активності ферменту
30.
Ферментніансамблі
або
мультиферменти – комплекс
ферментів,
які
каталізують
послідовні
реакції
при
перетворенні однієї речовини.
31. ІЗОФЕРМЕНТИ
Цемножинні молекулярні форми,
що мають єдину субстратну
специфічність (фактично це один і
той
самий
фермент),
але
відрізняються за фізико-хімічними
та імунологічними властивостями.
32. Множинні ізоформи ЛДГ
А – будова різних ізоформ ЛДГ (субодиниці типу Н і типу М);Б – електрофореграма множинних форм ЛДГ;
В – вміст ізоформ ЛДГ в плазмі крові в нормі та при патології
(електрофореграми – ліворуч та фотометричне сканування –
праворуч).
33.
Активність ферментів визначають опосередковано:1.
2.
за кількістю продукту, що утворився (Р),
за кількістю спожитого субстрату (S).
Міжнародна одиниця активності ферменту Е –
це така кількість ферменту, яка каталізує
перетворення 1 мікромоля субстрату (S) на
продукт реакції (Р) за 1 хв. у стандартних
(оптимальних) умовах з розрахунку на 1 г
тканини.
34.
Для оцінки кількості молекул ферменту середінших білків досліджуваної тканини визначають
питому активність (пит. ак.) ферменту,
яка чисельно рівна кількості одиниць активності
ферменту в зразку тканини, розділену на масу (мг)
білка в цій тканині:
35.
Каталітична ефективністьКількість молекул субстрату, які
перетворюються в продукт однією
молекулою ферменту за 1 с, називають
числом обертів ферменту, або
молярною активністю.
36. Номенклатура ферментів
Тривіальна (пепсин, трипсин, хімотрипсин);Назва
субстрату (латинська або інша)
+ закінчення –аза: амілаза (amilum –
крохмаль);
Тип
реакції + закінчення –аза:
гідролази, оксидоредуктази, дегідрогенази.
37.
Наукова назва: за допомогою цифр:- перша цифра – це номер класу;
- друга цифра – це номер підкласу;
- третя цифра – це номер підпідкласу;
- четверта цифра – це номер ферменту за
каталогом.
Аланінамінотрансфераза (АлАТ – 2.6.1.2.)
38. КЛАСИФІКАЦІЯ ФЕРМЕНТІВ
Всі ферменти за механізмом дії розділені на6 основних класів:
1.Оксидоредуктази
2.Трансферази
3.Гідролази
4. Ліази
5. Ізомерази
6. Лігази
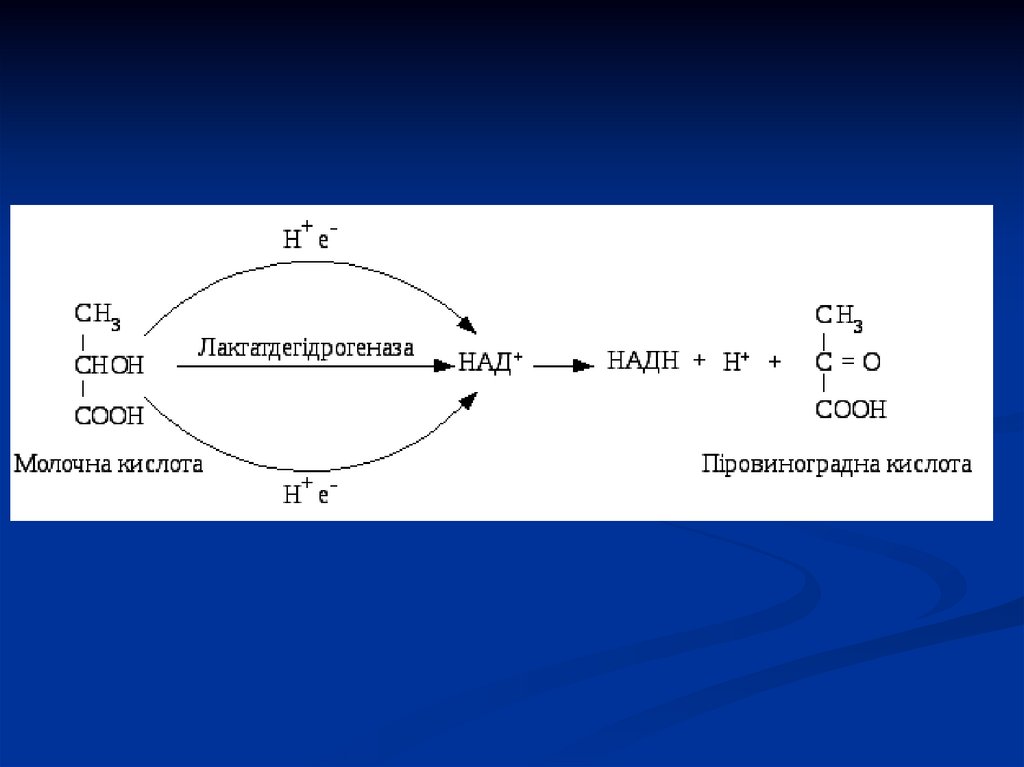
39. Оксидоредуктази
Ферменти цього класу каталізуютьокисно-відновні реакції, які лежать в
основі забезпечення тканин
необхідною енергією.
Оксидоредуктази ділять на основні
чотири підкласи:
40.
Дегідрогенази:а) піридинзалежні (анаеробні),
б) флавінзалежні (аеробні).
Цитохроми:
а) сімейство а (а1, а2, a3,…);
б) сімейство в (в1, в2, в3,…);
в) сімейство с (с1, с2, с3,…).
Допоміжні
оксидоредуктази.
Додаткові оксидоредуктази.
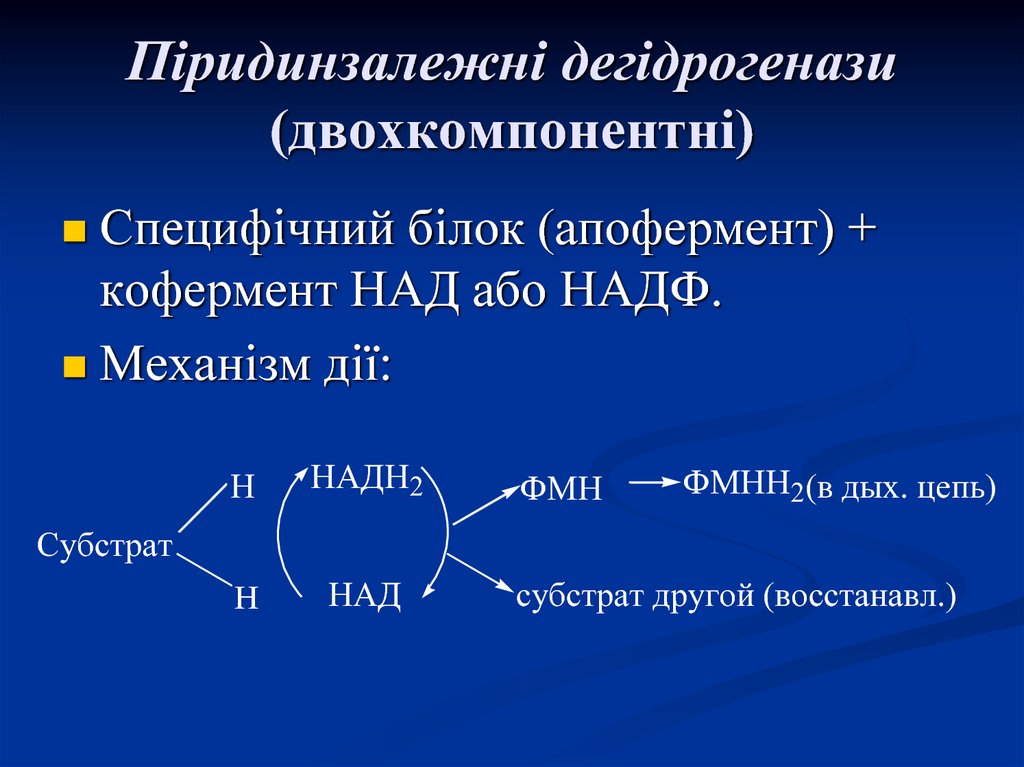
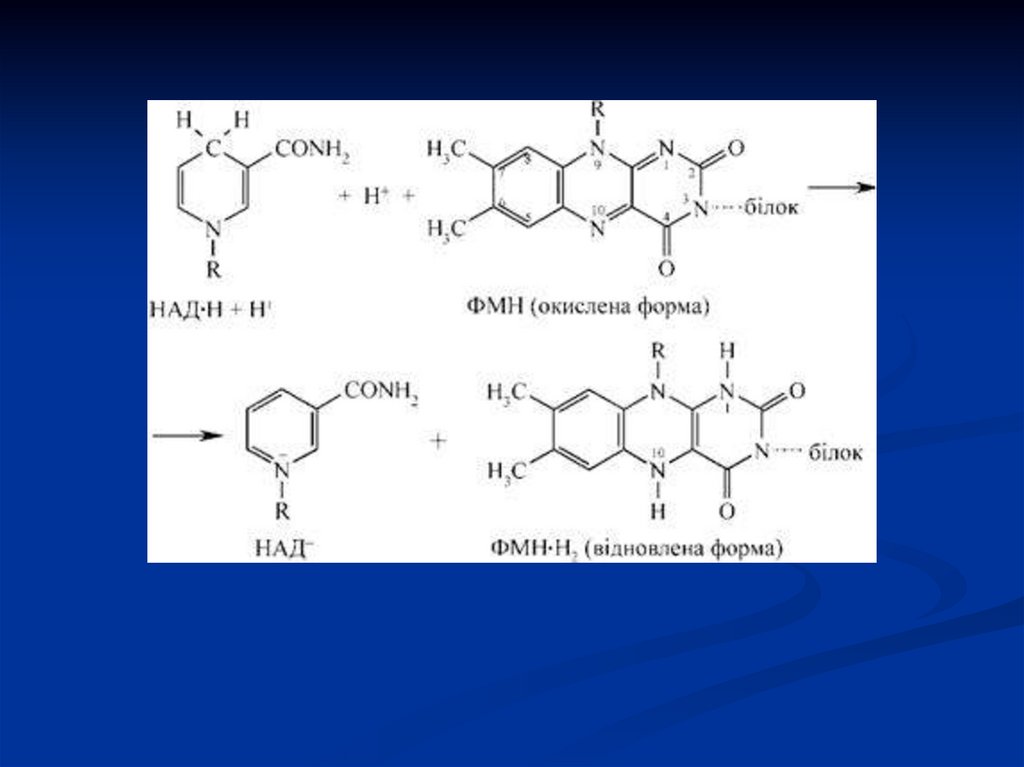
41. Піридинзалежні дегідрогенази (двохкомпонентні)
Специфічний білок (апофермент) +кофермент НАД або НАДФ.
Механізм дії:
Н
НАДН2
H
НАД
ФМН
ФМНН2(в дых. цепь)
Субстрат
субстрат другой (восстанавл.)
42.
НСубстрат
O
C NH2
+
H
H
Субстрат
N+5 R
+
O
C NH
2
+ H+
N+3 R
(НАД-окисл.)
(НАДН Н+-відновл.)
N+5 + 2e
N+3
43.
44. Флавінзалежні дегідрогенази (двохкомпонентні)
Специфічний білок (апофермент) +кофермент ФМН або ФАД.
Механізм дії:
Н НАДН2
ФМНН2
цитохроми
Субстрат
H
НАД
ФМН
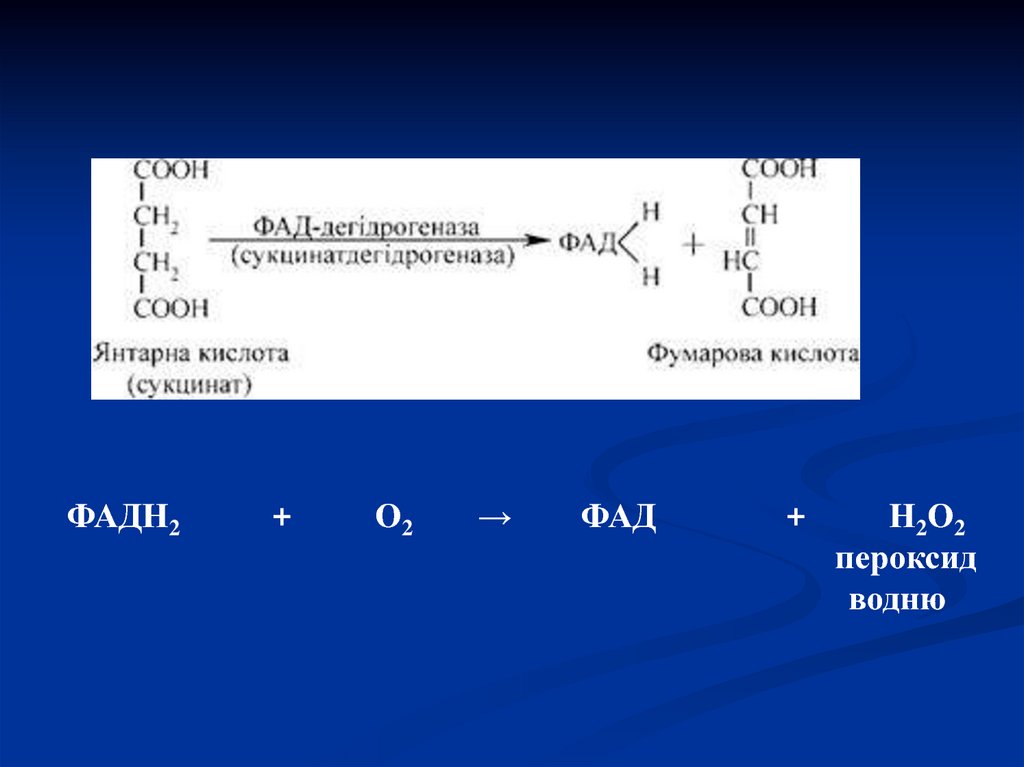
45.
ФАДН2+
О2
→
ФАД
+
Н2 О 2
пероксид
водню
46.
47. Цитохроми
За хімічною природою відносяться до хромопротеїнів(гемовмісних).
Їх
простетичною
групою
(коферментом) є гем, атом заліза якого здатний легко
приєднувати (відновлюватися) і також легко віддавати
(окиснюватися) електрони. В природі існує чотири
сімейства цитохромів в, с, а, які відрізняються між
собою величиною електричного потенціалу, що
збільшується в напрямку в – с – а – а3. В такому
порядку електрони в ланцюзі цитохромів послідовно
передаються від в до а3. Тому, цитохроми ще
називають проміжними переносниками електронів
(між дегідрогеназами і Оксигеном).
48. Додаткові оксидоредуктази – гідроксилази і оксигенази
Гідроксилази:OH
OH
OH
дофаміно-
+ O2
+
+ НАДФН Н
CH2
Дофамін
CH2
NH2
гідроксилаза
(Cu 2+)
OH
+ H2O
+ НАДФ
CH
OH
CH2
NH2
Норадреналін
49.
Оксигенази:HO
+ O2
HOOC
оксигеназа
OH
CH2 COOH
Гомогентизинова
кислота
CH
CH
C
CH2
C
CH2
O
O
Малеїлацетооцтова кислота
COOH
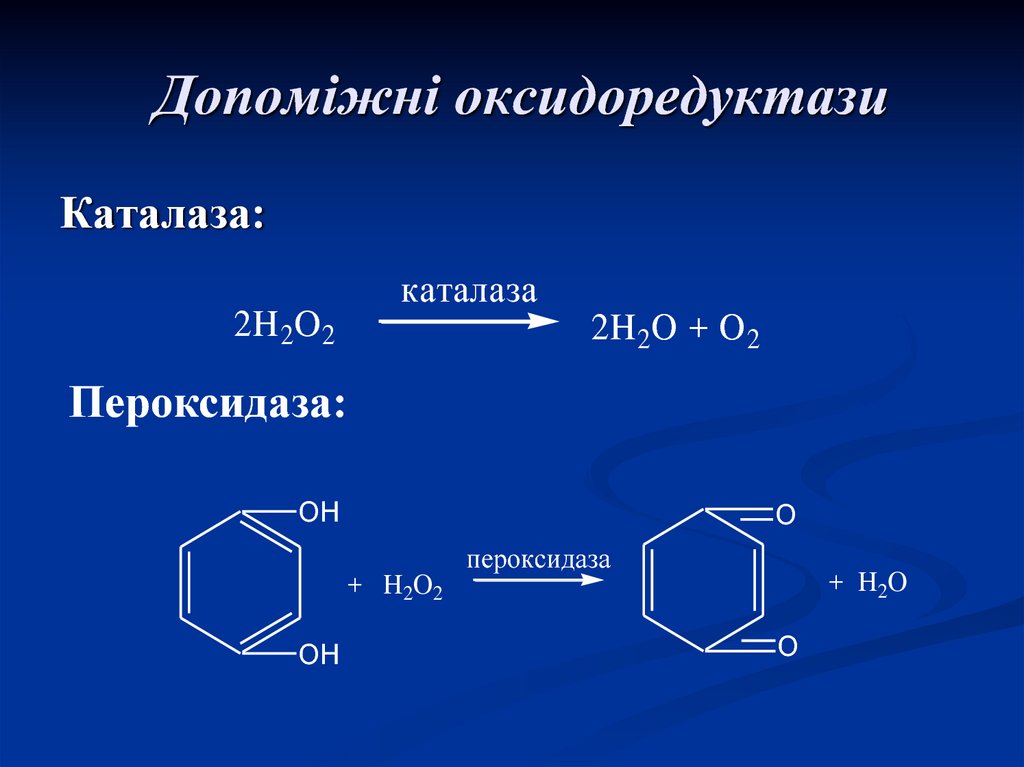
50. Допоміжні оксидоредуктази
Каталаза:каталаза
2H 2O 2
2H 2O + O 2
Пероксидаза:
OH
O
пероксидаза
+ H 2O
+ H2O2
OH
O
51. Трансферази
Амінотрансферази (апофермент + ФП),Ацилтрансферази (апофермент + НS-КоА),
Метилтрансферази (апофермент + В12),
Формілтрансферази (апофермент + Вс),
Фосфотрансферази (апофермент + АТФ).
52. Амінотрансферази (двохкомпонентні)
Склад: специфічний білок + фосфопіридоксаль(ФП), тобто фосфорильований вітамін В6.
COOH
COOH
CH2
CH2
CH3
Амінотрансфераза
CH2
C
O
CH2
CH
+
CH
NH2
NH2
+
C
O
COOH
COOH
ПВК
CH3
COOH
Глутамінова
кислота
Аланін
COOH
α -Кетоглутарат
53. Ацилтрансферази (двохкомпонентні)
Склад: специфічний білок (апофермент) +НS-коензимА (містить вітамін В3)
O
R
C
OH
O
+ HS-KoA + АТФ
R
C
S
KoA
+ АМФ + H4Р2О7
54. Метилтрансферази (двохкомпонентні)
Склад: специфічний білок (апофермент) +вітамін В12 та Вс
NH2
NH2
C
CH2 S
NH
NH
CH2
+
HOOC
COOH
Гуанідин-оцтова
кислота
CH2
CH NH2
Метионін
C
CH3
(-CH3)
CH2 SH
NH
N
Метилтрансфераза
CH3 +
CH2
COOH
Креатин
CH2
HOOC CH NH2
Гомоцистеїн
55. Фосфотрансферази (двохкомпонентні)
Склад: специфічний білок (апофермент) + АТФOH
CH2
OH
CH
OH
CH2
OH
Гліцерин
+ АТФ
Фосфотрансфераза
CH2
O
CH
OH
CH2
OH
P
O
OH
Гліцеринмонофосфат
+ АДФ
56. Гідролази (однокомпонентні)
Каталізують розрив хімічних зв'язків вмолекулах складних речовин шляхом
приєднання води. Найбільш часто гідролази
зустрічаються в травних соках, а в клітинах
вони сконцентровані в лізосомах.
57. Підкласи
пептидази,глікозидази,
естерази,
тіолази,
амідази та ін.
58. Пептидази
Прискорюють гідроліз пептидних зв'язків вмолекулах білків і поліпептидів:
R1
O
R2
O
R3
+ HOH
H2N
CH
C
NH
CH
Трипептид
R3
C
NH
R1
O
CH
C
CH
COOH
R2
+
H2N
CH
COOH
Амінокислота
H2N
NH
Дипептид
CH
COOH
Пептидаза
59. Ендопептидази
Ендопептидази гідролізують пептиднізв'язки в середині поліпептидного ланцюга
та розщеплюють її на декілька більш
коротких ланцюгів. Прикладом таких
пептидаз можуть бути пепсин, трипсин,
хімотрипсин, які гідролізують молекули
білків до поліпептидів та олігопептидів
різної величини.
60. Екзопептидази
При дії цих ферментів від поліпептидноголанцюга
відщеплюються
окремі
амінокислоти,
тобто
екзопептидази
гідролізують кінцеві пептидні зв'язки зі
сторони
вільної
аміногрупи
–
амінопептидази, або зі сторони вільної
карбоксильної групи – карбоксипептидази.
61.
RH2N CH
+ НОН
O
R1
O
R2
C
C
NH CH
NH CH
O
H2N CH C OH
амінокислота
C
O
NH CH C
OH
С-кінц.
карбоксипептидаза
N-кінц.
амінопептидаза
R
+ НОН
O
R3
+
R1
O
NH2 CH
C
R2
O
NH CH
дипептид
C
R3
O
+
OH NH2 CH C OH
амінокислота
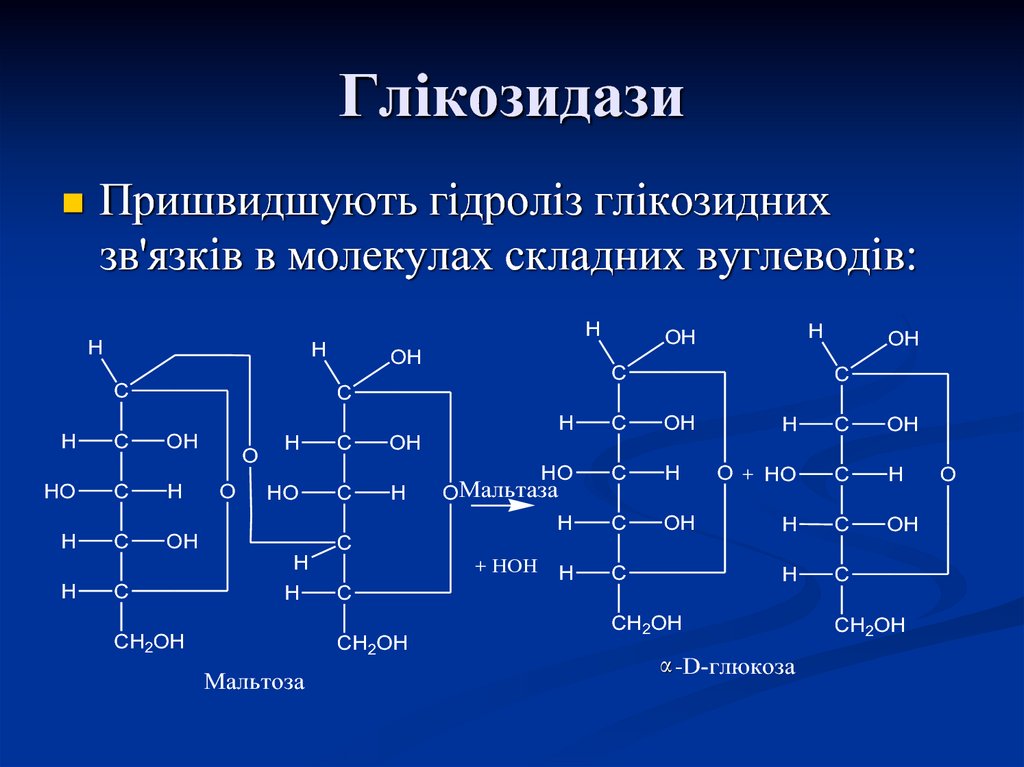
62. Глікозидази
Пришвидшують гідроліз глікозиднихзв'язків в молекулах складних вуглеводів:
H
H
H
C
OH
C
C
OH
HO
C
H
H
C
OH
O
O
H
C
OH
HO
C
H
C
H
C
OH
HO
OМальтаза
C
H
H
C
OH
H
C
C
H
H
CH2OH
+ HOH
C
CH2OH
Мальтоза
OH
C
C
H
H
H
OH
H
C
OH
O + HO
C
H
H
C
OH
H
C
CH2OH
α -D-глюкоза
CH2OH
O
63.
Крохмаль + НОНамілаза
Декстрини + НОН
амілаза
Глюкоза
Мальтоза + НОН
мальтаза
Сахароза + НОН
сахараза
(інвертаза)
глюкоза + фруктоза
Лактоза + НОН
лактаза
глюкоза + галактоза
Клітковина (целюлоза) + НОН
целобіаза
глюкоза
целюлаза
целобіоза + НОН
64. Естерази
Прискорюють гідроліз різних складних ефірів. Залежно відкислоти, що бере участь в утворенні складно-ефірного зв'язку,
естерази ділять на підкласи: карбоестерази (ліпази),
фосфоестерази (фосфатази), сульфоестерази та ін.
Карбоестерази:
CH2
CH
CH2
O
O
O
O
C
C17H35
O
C
C
Тристеарат
C17H35
O
C17H35
+ 3 H2O
Ліпаза
CH2
OH
CH
OH
CH2
OH
O
Гліцерин
+ 3 C17H35
C
OH
Стеаринова кислота
65. Фосфоестерази
OHH
OH
H
C
C
H
C
OH
HO
C
H
H
C
OH
H
C
O + HOH
CH2 O P
глюкозо-6-фосфат
OH
O
OH
фосфатаза
H
C
OH
HO
C
H
H
C
OH
H
C
O
CH2 OH
глюкоза
+ H3PO4
66. Ліази
Це ферменти, які можуть оберненоприєднувати або відщепляти атомні групи
по подвійним зв'язкам. По своїй будові
вони є складними білками, в яких роль
коферменту виконують вітаміни, наприклад
В1 або метали (Mg2+ , Mn2+).
67.
CH2C
O
PO3H2
CH2
O
O
O
PO3H2
H
C
HO
H
C
C
H
Альдолаза
OH
C
CH2
O
C
OH
CH2 O
PO3H2
Фруктозо-1,6-дифосфат
CH
OH
OH
Фосфодиоксиацетон
H
+
CH2 O
PO3H2
3-фосфогліцериновий альдегід
68.
CH3H
C
O
C
NH2
OH
аланін
декарбоксилаза
CH3
СО2 +
CH2
NH2
етил-амін
69. Ізомерази
Ферменти цього класу каталізують реакціїізомерних перебудов невеликих молекул, а
також реакції перенесення окремих груп в
межах даної молекули. Ізомерази є
складними ферментами.
70.
OCH2
C
O
PO3H2
C
Фосфотриозоізомераза
O
CH2
CH
OH
O
OH
CH2 O
PO3H2
3-фосфогліцериновий альдегід
Фосфодиоксиацетон
H
H
H
PO3H2
C
OH
C
H
C
OH
HO
C
H
H
C
OH
H
C
O
CH2OH
Глюкозо-1-фосфат
Фосфоглюкомутаза
H
C
OH
HO
C
H
H
C
OH
H
C
CH2O
O
PO3H2
Глюкозо-6-фосфат
71. Лігази (синтетази)
Каталізують синтез органічних речовин здвох більш простих молекул. При цьому
обов'язково використовується енергія АТФ
або інших нуклеозидтрифосфатів.
72.
COOHCH3
+ CO2 + ATФ
C
O
COOH
ПВК
Карбоксилаза
H3PO4 + АДФ +
CH2
C
O
COOH
ЩОК























































 chemistry
chemistry








