Similar presentations:
Метаболічні перетворення білків і амінокислот
1.
МЕТАБОЛІЧНІ ПЕРЕТВОРЕННЯБІЛКІВ І АМІНОКИСЛОТ
1.
Катаболізм основних харчових речовин
2.
Функції білків. Перетравлення харчових білків
3.
Метаболізм амінокислот
4
Розщеплення вуглецевих скелетів амінокислот
5.
Спадкові порушення катаболізму амінокислот
6.
Аміак – токсична для організму речовина, шляхи
його виведення
7.
Цикл сечовини
2.
КАТАБОЛІЗМ ОСНОВНИХ ХАРЧОВИХ РЕЧОВИНЖИРИ
ВУГЛЕВОДИ
БІЛКИ
1
Жирні
кислоти
Гліцерин
Глюкоза
Амінокислоти
Піруват
2
Ацетил-КоА
НS- КоА
Цитратний
цикл
1- розщеплення в травному тракті;
2 – специфічні шляхи катаболізму;
СО2,
3 – цитратний цикл і дихальний ланцюг
Н 2О
3
3. ОСНОВНІ ФУНКЦІЇ БІЛКІВ
1.2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
13.
14.
Основні структурні компоненти органів і тканин, а також усіх клітинних органел.
Енергетична функція (катаболітичні процеси).
Поживна, запасаюча функція.
Виявляють каталітичну (ферментативну) активність – проте у 1982 р.- відкриття
РНКзимів.
Беруть участь у регуляції метаболізму -клітинний рівень: білки - репрессори та
активатори транскрипції; організменний - білкова природа гормонів.
Виконують захисну функцію – антитіла.
Беруть участь у процесах скорочення м'язів і руху (актино-міозинові комплекси)
Беруть участь у процесах трансформації енергії - білки сітківки ока
трансформують світлову енергію в електричну.
Транспортна функція: а)гемоглобін здійснює транспорт О2, СО2;б)трансферрин транспорт заліза; в) пермеази - мембранні білки, які переносять полярні
сполуки через мембрану як за, так і проти градієнту концентрації.
Буферна функція.
Клітинна сигналізація - приклад, епідермальний фактор росту, що є промотором
клітинного поділу.
Беруть участь у процесах міжклітинної взаємодії та розпізнавання клітинних
поверхонь - молекули адгезії, інтегрини.
Рецепторні білки - інсулінові рецептори і інші.
Білки, що виконують спеціальні функції - високоваріабельні протеїни, наприклад,
антифризові білки, які попереджають від замерзання кров арктичних і антарктичних
риб, клейові білки, що сприяють надійному прикріпленню мідій та інших морських
організмів до скель.
4. ОСНОВНІ ФУНКЦІЇ БІЛКІВ
5.
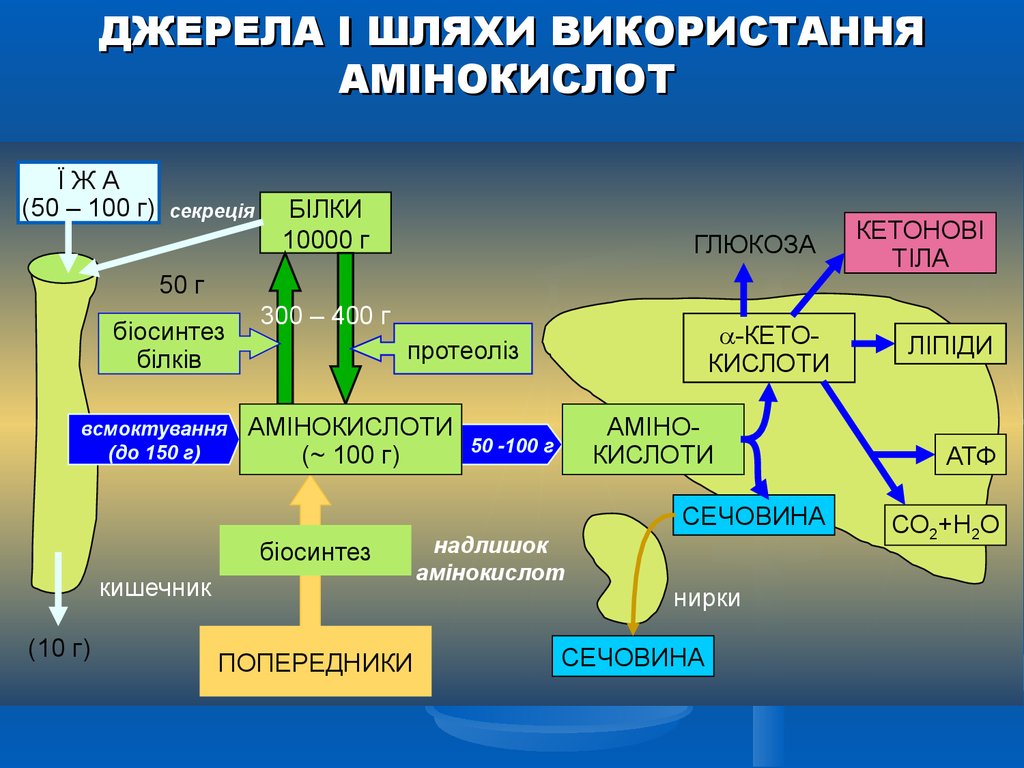
ДЖЕРЕЛА І ШЛЯХИ ВИКОРИСТАННЯАМІНОКИСЛОТ
ЇЖА
(50 – 100 г)
секреція
БІЛКИ
10000 г
ГЛЮКОЗА
50 г
біосинтез
білків
всмоктування
(до 150 г)
300 – 400 г
-КЕТОКИСЛОТИ
протеоліз
АМІНОКИСЛОТИ
(~ 100 г)
АМІНОКИСЛОТИ
50 -100 г
СЕЧОВИНА
біосинтез
кишечник
(10 г)
ПОПЕРЕДНИКИ
надлишок
амінокислот
нирки
СЕЧОВИНА
КЕТОНОВІ
ТІЛА
ЛІПІДИ
АТФ
СО2+Н2О
6.
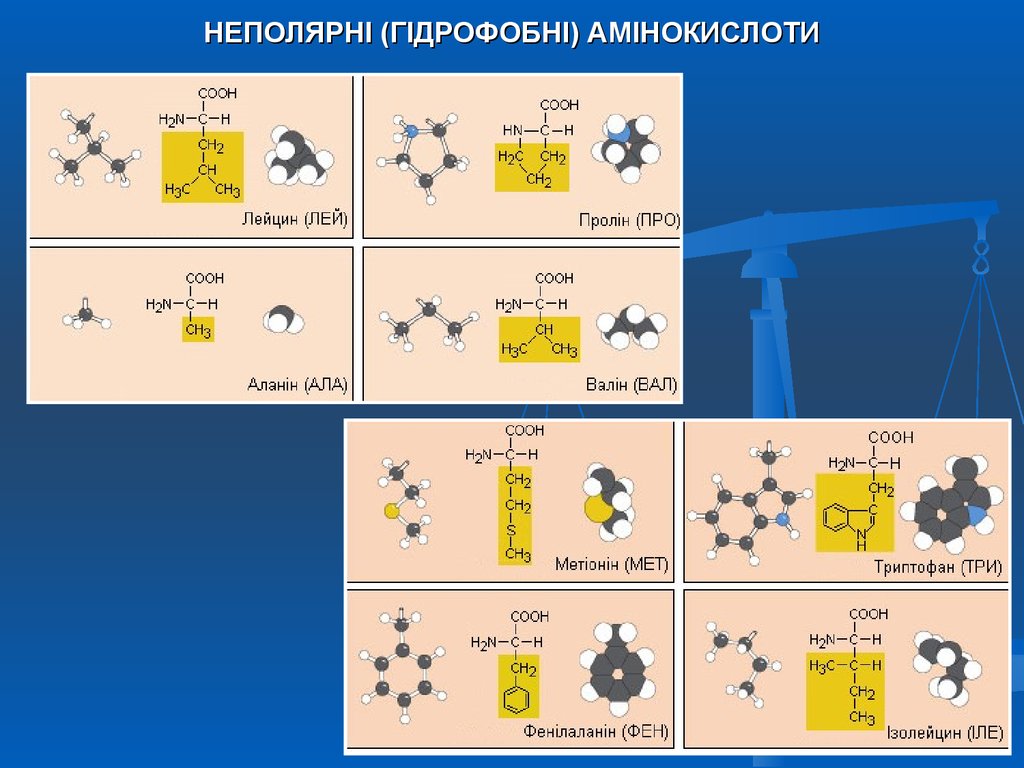
НЕПОЛЯРНІ (ГІДРОФОБНІ) АМІНОКИСЛОТИ7.
ПОЛЯРНІ (ГІДРОФІЛЬНІ) АМІНОКИСЛОТИПолярні (гідрофільні) амінокислоти бувають: незаряджені, негативно заряджені,
позитивно заряджені
8.
НЕОБХІДНІ АМІНОКИСЛОТИНезамінні
Умовно замінні
Частково замінні
Замінні
Валін
Ізолейцин
Лейцин
Лізин
Метіонін
Треонін
Триптофан
Фенілаланін
Тирозин
Цистеїн
Аргінін
Гістидин
Аланін
Аспарагін
Аспартат
Гліцин
Глутамат
Глутамін
Пролін
Серин
9.
МЕХАНІЗМ ДІЇ ПРОТЕЇНАЗ (Гідролази - КФ3.4.1- 3.4.4 )ЕКЗО- ТА ЕНДОПЕПТИДАЗИ
10.
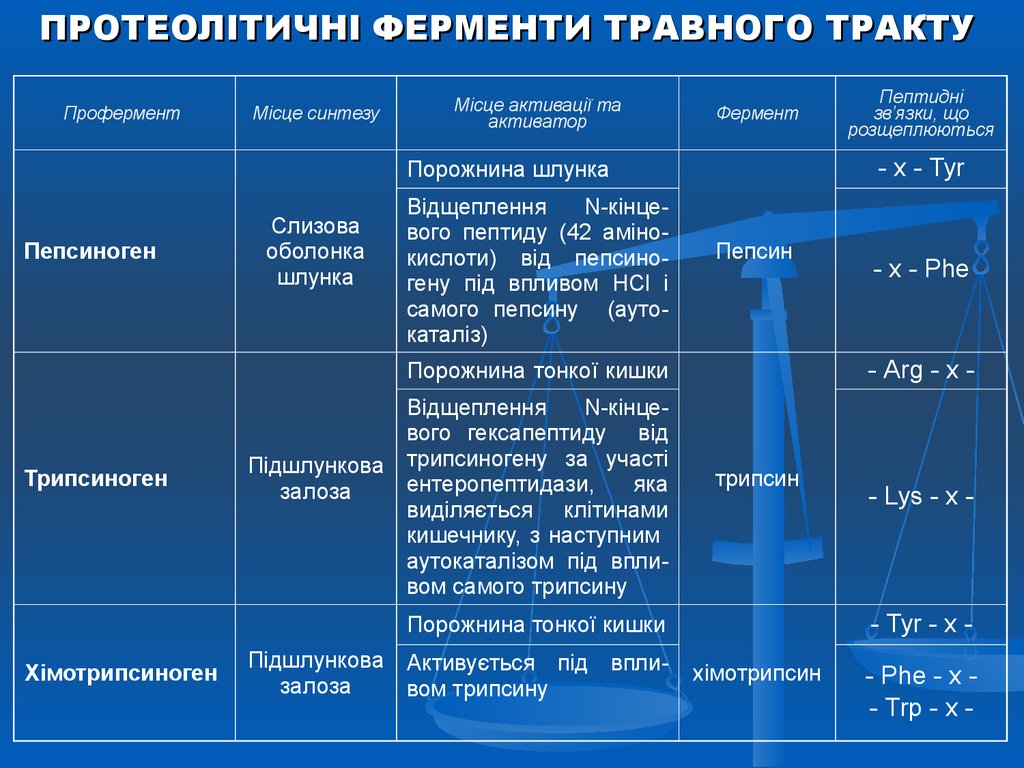
ПРОТЕОЛІТИЧНІ ФЕРМЕНТИ ТРАВНОГО ТРАКТУПрофермент
Місце синтезу
Місце активації та
активатор
Фермент
- х - Туr
Порожнина шлунка
Пепсиноген
Слизова
оболонка
шлунка
Відщеплення
N-кінцевого пептиду (42 амінокислоти) від пепсиногену під впливом НСl і
самого пепсину (аутокаталіз)
Пепсин
Трипсиноген
трипсин
Підшлункова Активується під вплизалоза
вом трипсину
- Lys - x -
- Tyr - x -
Порожнина тонкої кишки
Хімотрипсиноген
- х - Рhе
- Arg - x -
Порожнина тонкої кишки
Відщеплення
N-кінцевого гексапептиду від
Підшлункова трипсиногену за участі
ентеропептидази,
яка
залоза
виділяється клітинами
кишечнику, з наступним
аутокаталізом під впливом самого трипсину
Пептидні
зв’язки, що
розщеплюються
хімотрипсин
- Phe - x - Trp - x -
11.
периферійна кровамінокислоти
гормони
сечовина
кетосполуки
білки плазми
глюкоза
глюкоза
жирні кислоти
кетосполуки
сечовина
Н2О
ацетил-КоА
енергія
білки плазми
структурні
білки
гормони
ферменти
азот
білки
СО2
вуглецевий
скелет
біосинтез
їжа
ВКП
амінокислот
кров
ворітної
вени
білки
їжі
травлення
фекальний
азот
МЕТАБОЛІЗМ
АМІНОКИСЛОТ
ВИЩИХ ТВАРИН
Перебіг більшості реакцій перетворення амінокислот відбувається в
печінці. Тут синтезуються білки печінки, а також більшість білків плазми крові й проходить їх розпад. У
печінці синтезуються певні азотовмісні сполуки: пуринові й піримідинові основи, нікотинамід, сечова
кислота, креатин, сечовина. Деякі з
цих перетворень виявляються необоротними, і сполуки, що утворюються, транспортуються з печінки і
виводяться з організму із сечею.
Крім того, у печінці синтезуються
певні замінні амінокислоти.
Після дезамінування вуглецевий
скелет амінокислот або окиснюється в аеробних умовах і служить
джерелом енергії, або використовується в біосинтезі, включаючись у
цикл трикарбонових кислот.
ВКП – внутрішньоклітинний пул
12. П’ЯТЬ НАЙВАЖЛИВІШИХ МЕТАБОЛІЧНИХ ПЕРЕТВОРЕНЬ АМІНОКИСЛОТ, а також…
1. ДЕКАРБОКСИЛЮВАННЯ2. ОКИСНЕ ДЕЗАМІНУВАННЯ (крім того – відновне,
гідролітичне, внутрішньомолекулярне)
3. ТРАНСАМІНУВАННЯ ( ПЕРЕАМІНУВАННЯ )
4. МОДИФІКАЦІЯ БІЧНОГО ЛАНЦЮГА
5. ПОЛІМЕРИЗАЦІЯ
НЕПРЯМЕ ДЕЗАМІНУВАННЯ (трансдезамінування)
13.
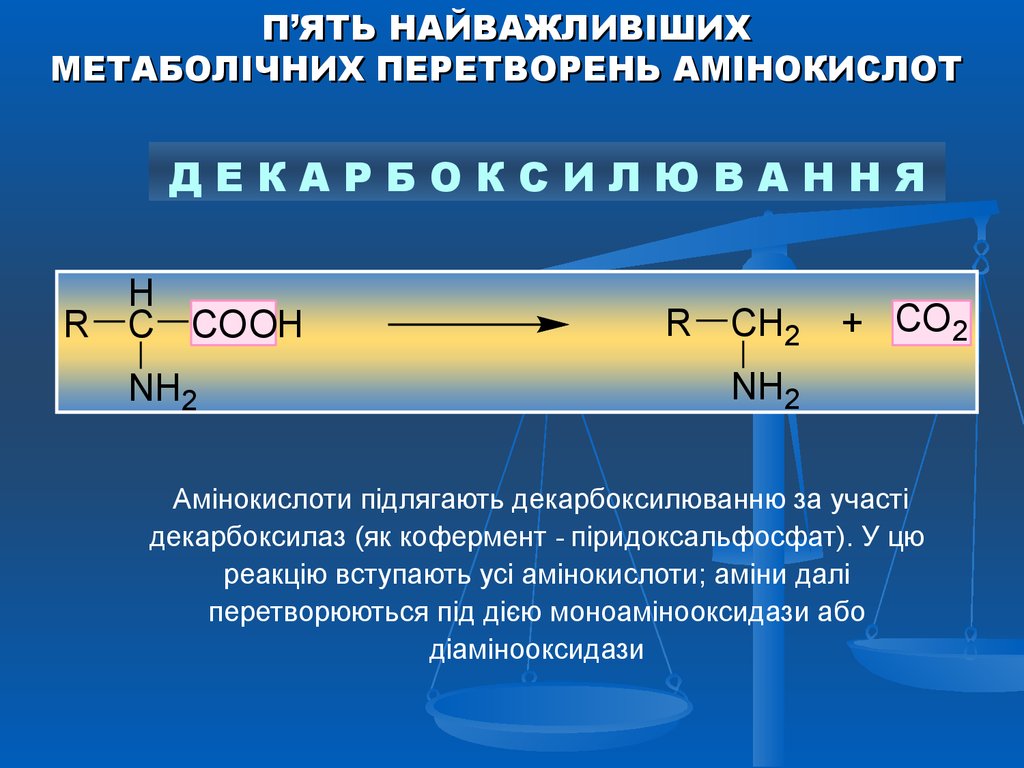
П’ЯТЬ НАЙВАЖЛИВІШИХМЕТАБОЛІЧНИХ ПЕРЕТВОРЕНЬ АМІНОКИСЛОТ
ДЕКАРБОКСИЛЮВАННЯ
H
R C COOH
NH2
R CH2
+ СО2
NH2
Амінокислоти підлягають декарбоксилюванню за участі
декарбоксилаз (як кофермент - піридоксальфосфат). У цю
реакцію вступають усі амінокислоти; аміни далі
перетворюються під дією моноамінооксидази або
діамінооксидази
14.
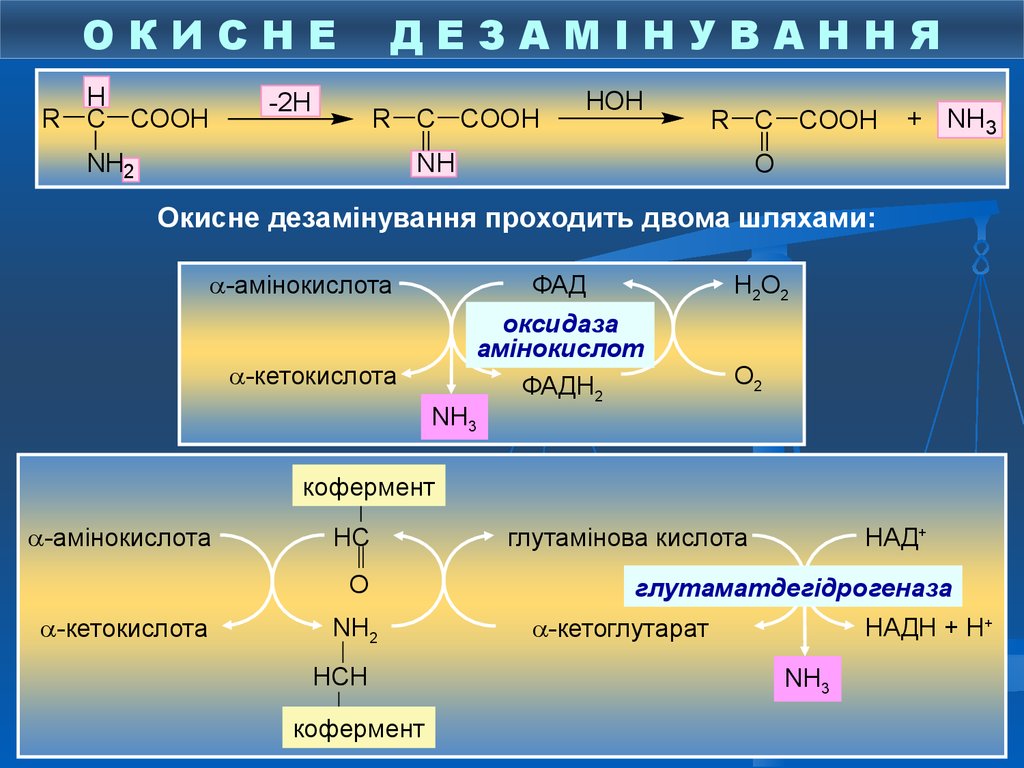
ОКИСНЕH
R C COOH
ДЕЗАМІНУВАННЯ
-2H
R C COOH
NH2
HOH
R C COOH
NH
+ NH3
O
Окисне дезамінування проходить двома шляхами:
-амінокислота
ФАД
-кетокислота
Н2О2
оксидаза
амінокислот
ФАДН2
О2
NH3
кофермент
-амінокислота
НС
О
-кетокислота
NН2
НСН
кофермент
глутамінова кислота
НАД+
глутаматдегідрогеназа
-кетоглутарат
НАДН + Н+
NH3
15.
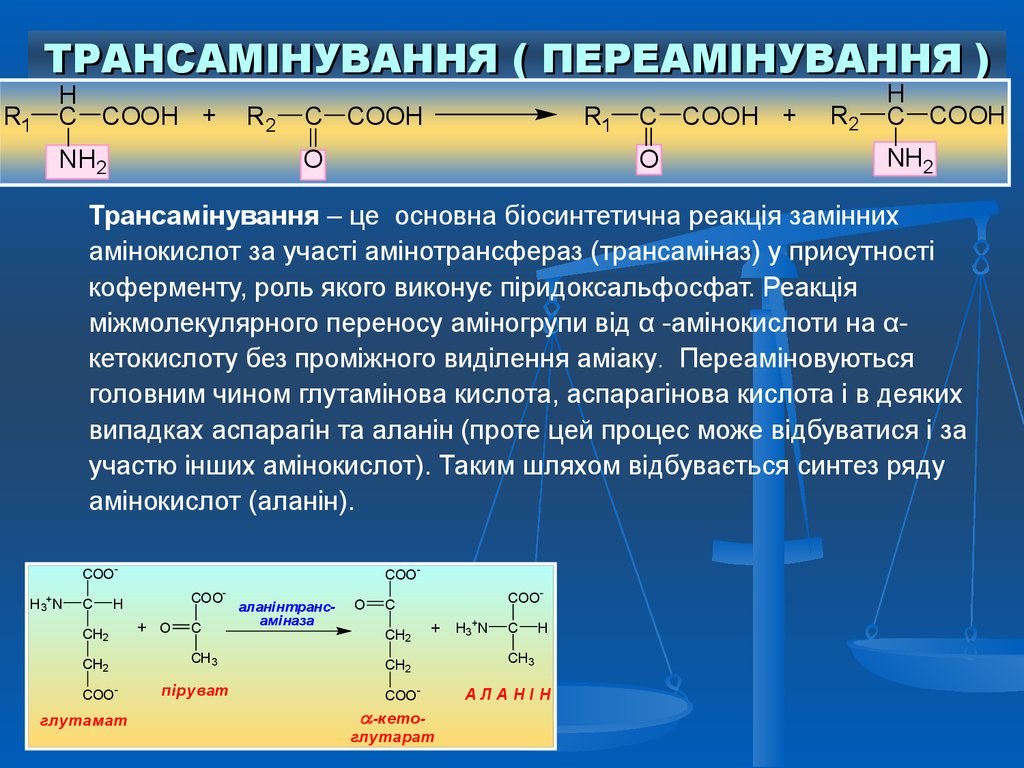
ТРАНСАМІНУВАННЯ ( ПЕРЕАМІНУВАННЯ )R1
H
C COOH +
NH2
R2
C COOH
R1
O
C COOH +
O
R2
H
C COOH
NH2
Трансамінування – це основна біосинтетична реакція замінних
амінокислот за участі амінотрансфераз (трансаміназ) у присутності
коферменту, роль якого виконує піридоксальфосфат. Реакція
міжмолекулярного переносу аміногрупи від α -амінокислоти на αкетокислоту без проміжного виділення аміаку. Переаміновуються
головним чином глутамінова кислота, аспарагінова кислота і в деяких
випадках аспарагін та аланін (проте цей процес може відбуватися і за
участю інших амінокислот). Таким шляхом відбувається синтез ряду
амінокислот (аланін).
COOH3+ N
C
COOCOO-
H
CH2
CH2
COO-
глутамат
+ O
C
CH3
піруват
аланінтрансаміназа
O
COO-
C
CH2
+ H3+N
CH2
COO-
-кетоглутарат
C
H
CH3
АЛАНІН
16.
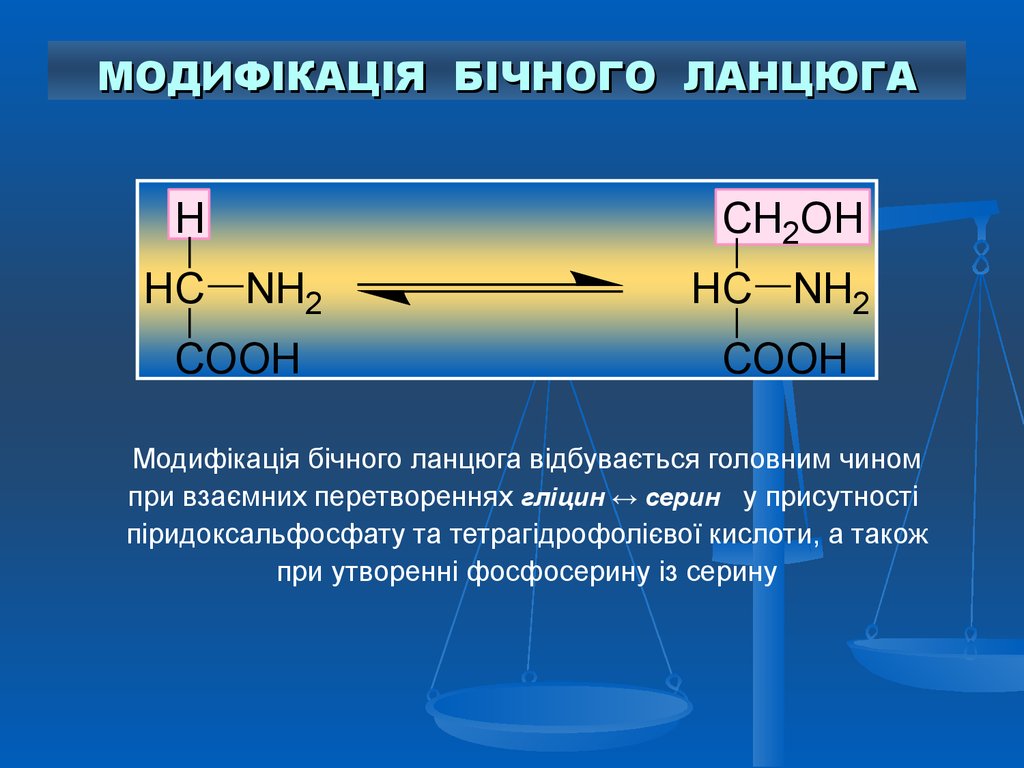
МОДИФІКАЦІЯ БІЧНОГО ЛАНЦЮГАH
CH2OH
HC NH2
HC NH2
COOH
COOH
Модифікація бічного ланцюга відбувається головним чином
при взаємних перетвореннях гліцин ↔ серин у присутності
піридоксальфосфату та тетрагідрофолієвої кислоти, а також
при утворенні фосфосерину із серину
17.
ПОЛІМЕРИЗАЦІЯR1
H
C COOH +
NH2
R2
H
C COOH
NH2
H2O
R1
H
C
NH2
O
H
C N
H
C COOH
R2
Пептидні ланцюги (три-, тетра-, пента-, оліго- та поліпептиди)
виникають за рахунок полімеризації амінокислот
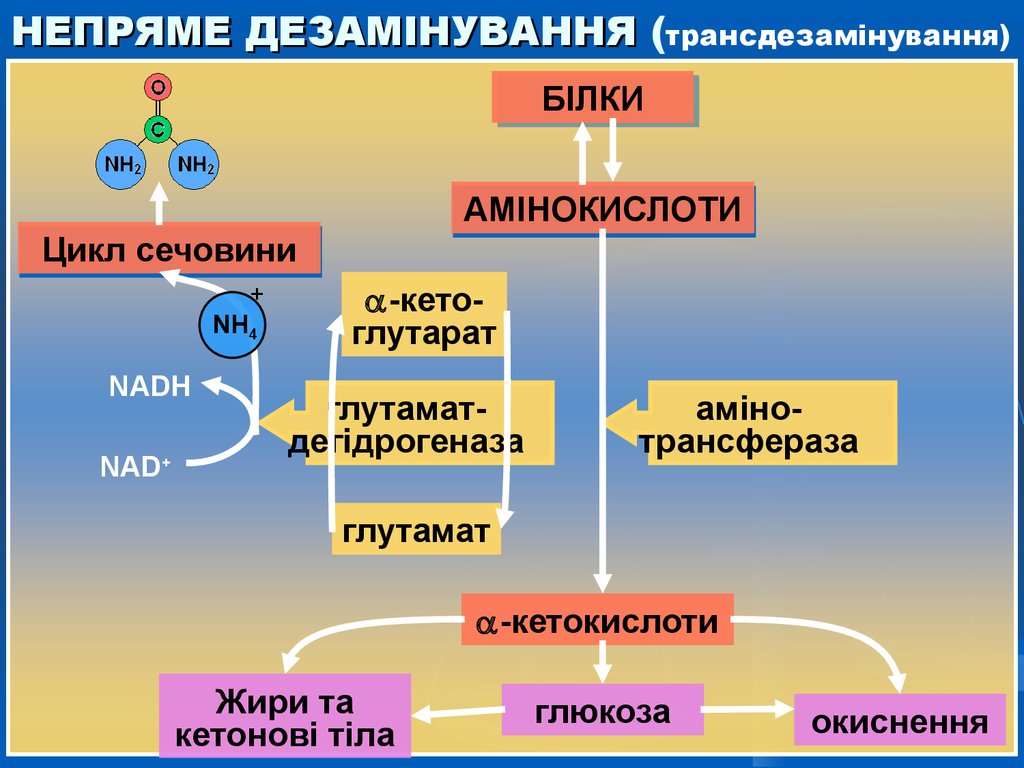
18. НЕПРЯМЕ ДЕЗАМІНУВАННЯ (трансдезамінування)
Більшість амінокислот не здатні дезамінуватись в однустадію, подібно глутамату. Аміногрупи таких амінокислот у
результаті трансамінування переносяться на -кетоглутарат
з утворенням глутамінової кислоти, яка потім зазнає прямого
окисного дезамінування. Такий механізм дезамінування
амінокислот у 2 стадії отримав назву трансдезамінування,
або непрямого дезамінування.
За сукупності 2-х реакцій – трансамінування і окисного
дезамінування аміногрупа амінокислоти перетворюється на
аміак. Глутамінова кислота в цьому процесі виконує
колекторну функцію - її аміногрупа “збирається” з інших
амінокислот. Саме ця функція є визначальною в унікальній
ролі глутамату в катаболізмі інших амінокислот.
19.
НЕПРЯМЕ ДЕЗАМІНУВАННЯ (трансдезамінування)БІЛКИ
БІЛКИ
АМІНОКИСЛОТИ
Цикл сечовини
+
NH4
NADH
NAD+
-кетоглутарат
глутаматдегідрогеназа
амінотрансфераза
глутамат
-кетокислоти
Жири та
кетонові тіла
глюкоза
окиснення
20. Біосинтез амінокислот
Важливе місце в біосинтезі азотовмісних сполукє процес фіксації азоту з подальшою первинною
асиміляцією утвореного аміаку. У більшості
тварин це відбувається за рахунок реакцій, які
каталізуються рядом ферментних систем:
глутаматдегідрогеназною та
глутамінсинтетазною- послідовне включення
двох молекул аміаку (амінокислоти)
карбамоїлфосфатсинтетазною - включення
молекули аміаку (сечовина, піримідини)
21.
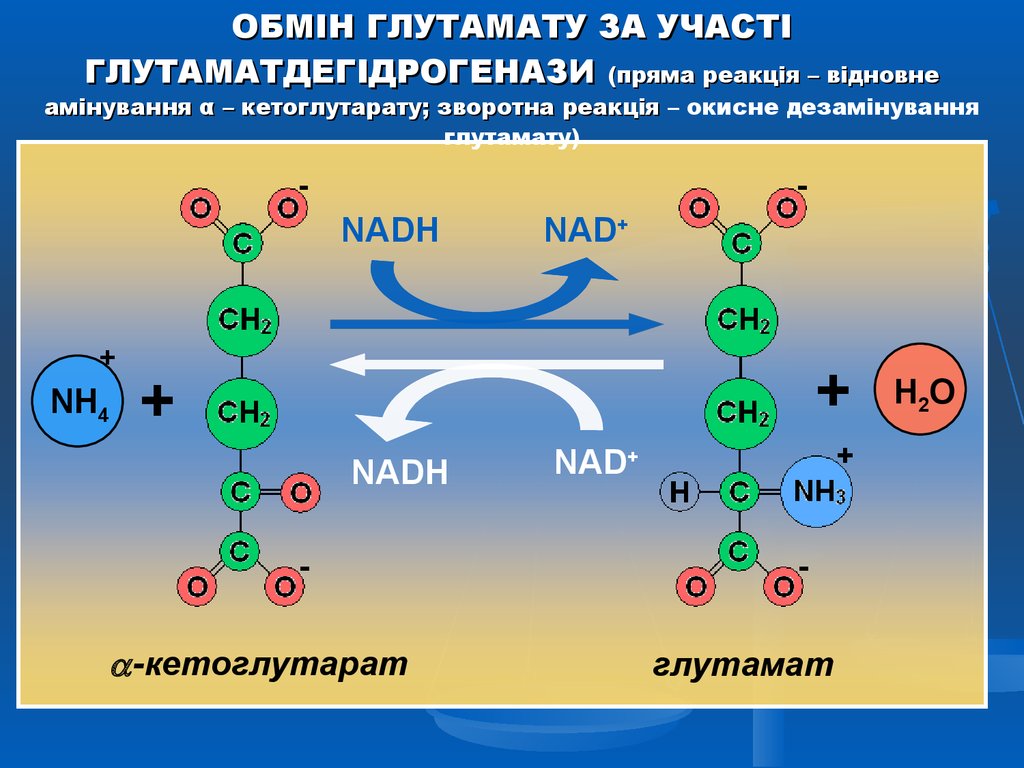
ОБМІН ГЛУТАМАТУ ЗА УЧАСТІГЛУТАМАТДЕГІДРОГЕНАЗИ (пряма реакція – відновне
амінування α – кетоглутарату; зворотна реакція – окисне дезамінування
глутамату)
NADH
+
NH4
NAD+
+
+
NADH
-кетоглутарат
NAD+
глутамат
H2O
22.
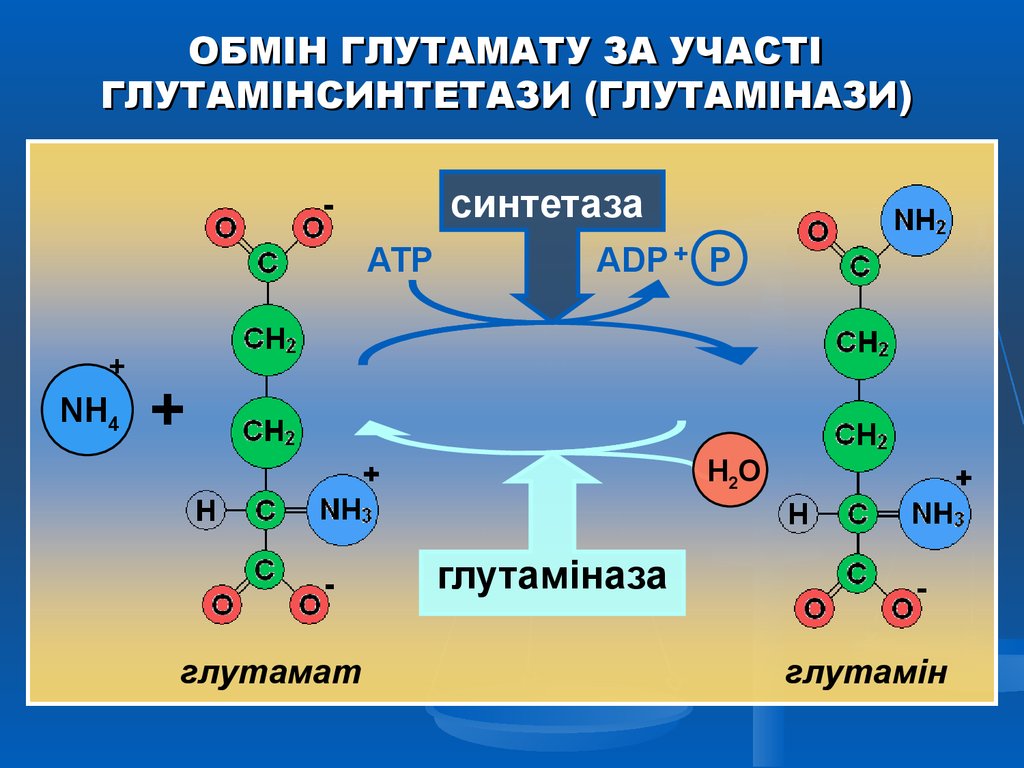
ОБМІН ГЛУТАМАТУ ЗА УЧАСТІГЛУТАМІНСИНТЕТАЗИ (ГЛУТАМІНАЗИ)
синтетаза
АТР
+
NH4
АDР + Р
+
H2O
глутаміназа
глутамат
глутамін
23. Біосинтез окремих амінокислот
Функціонування біосинтетичних процесів пов'язано з так званимиродинами (5).
1.
Родина глутамату – синтез власне глутамату, проліну, аргініну,
аспартату і аспарагіну.
2.
Родина аспартату – синтез власне аспартату, аспарагіну, треоніну,
метіоніну, лізину, ізолейцину.
3.
Родина пірувату - синтез аланіну, валіну, лейцину, ізолейцину.
4.
Родина серину - синтез серину, цистеїну та гліцину.
5.
Родина ароматичних амінокислот та гістидину – синтез триптофану,
фенілаланіну, тирозину та гістидину
24.
БІОСИНТЕЗ ПРОЛІНУ (родина глутамату)COO-
COOH3N+
C
H
глутамат-5-кіназа
H3N+
CH2
C
H
COO-
глу тамілфосфатредуктаза
CH2
АТР
CH2
CH2
ADP
COO-
NADPH
N
H
NADP
ПРОЛІ Н
+
NADPH
-
OOC
H
CH2
NADP+
-глутамілфосфат
піролін-5карбок силатредуктаза
OOC
C
CH2
COO Р
глутамат
-
H3N+
O
C
H
напівальдегід
глутамінової кислоти
H2O
N+
H
піролін-5-карбоксилат
25.
COOH3N+C
N-ацилтрансфераза H3C
амінокислот
H
+ ацетил-KоА
CH2
C
H
CH2
CH2
COO-
COO-
N-ацетилглутамат
глутамат
АТР
ADP
H
N
C
NADPH
H
NADP+
ацетилорнітинтрансаміназа
CH 2
CH 2
CH 2
+
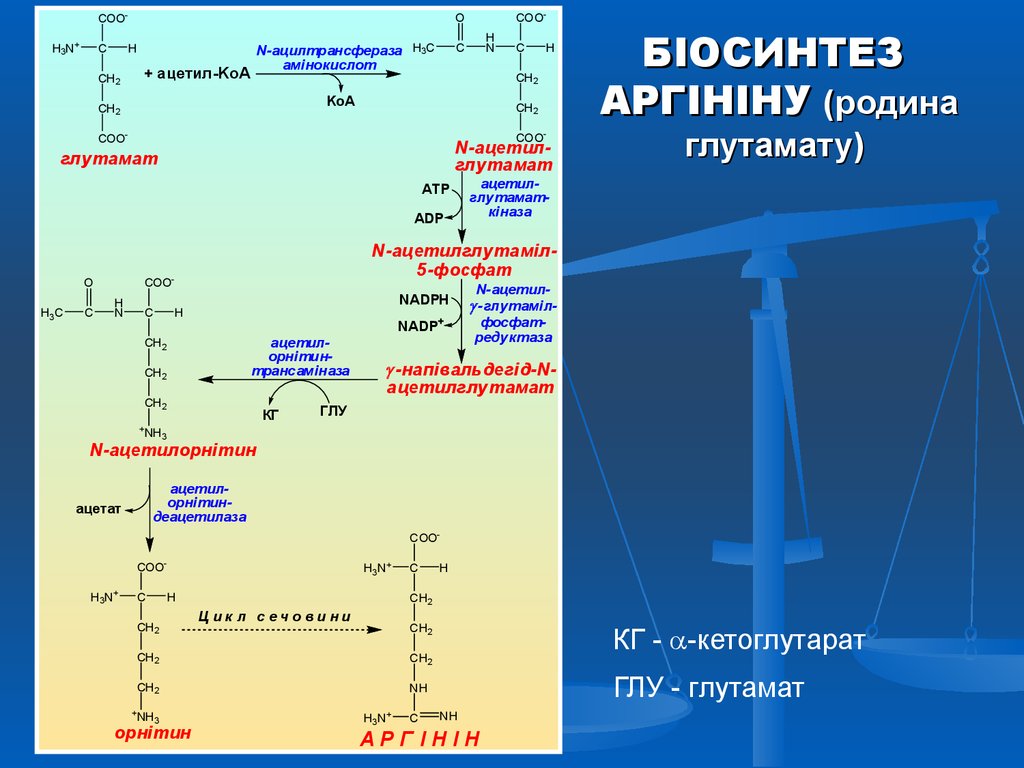
БІОСИНТЕЗ
АРГІНІНУ (родина
глутамату)
ацетилглутаматкіназа
N-ацетилглутаміл5-фосфат
COO-
O
C
H
N
C
KоА
CH2
H3C
COO-
O
КГ
N-ацетил-
-глутамілфосфатредуктаза
-напівальдегід-Nацетилглутамат
ГЛУ
NH 3
N-ацетилорнітин
ацетилорнітиндеацетилаза
ацетат
COOCOOH3N+
C
H3N+
H
CH2
+
C
CH2
Ц ик л сечовини
CH2
CH2
NH
NH3
КГ - -кетоглутарат
CH2
CH2
орнітин
H
H3N+
C
ГЛУ - глутамат
NH
АРГ ІНІН
26.
БІОСИНТЕЗ АСПАРТАТУ Й АСПАРАГІНУ(родина глутамату та аспартату)
COOH3N+
C
COOH
O
+
CH2
COO-
C
аспартаттрансаміназа
CH2
H3N+
C
H
O
CH2
COO-
оксалоацетат
глутамат
COOC
CH2
COO-
COO-
H3N+
C
+
CH2
COO-
CH2
COO-
CH2
H3N+
C
+
COO-
H
аспарагінсинтаза
H3N+
C
CH2
C
+
C
АТР
O
АМР + РРі
+
COO H3N+
H
+
CH2
CH2
COO-
аспартат
глу трат
COO-
H
-кето-
АСПАРТ АТ
O
NH3
C
H
CH2
CH2
COO -
NH3
глутамін
АСПАРАГ ІН
глутамат
27.
COO H3+NC
H
COO -
аспартаткіназа
АТР
CH2
дегідрогеназа
альдегіду
аспарагінової
кислоти
H3+N
C
H
NADPH
CH2
АDР
COO -
NADP+
H 3+N
C
H
CH 2
гомосеринкіназа
АDР
H3+N
C
АТР
гомосерин
COOC
H
(CH 2)2
OH
COO
C
H
(CH 2)4
+
NH3
ЛІЗИН
COO-
C
-
H3+N
CH2 OH
H3+N
H
NADPH
H
CH2
треонінсинтаза
H
H
NADP+
-
+ H 2О
C
CH2
C
COO
гомосеринфосфорна
к ислота
H3+N
H
аспартил-44-напівальдегідфосфат гомосерин- аспартат
CH 2O Р
Рі
C
O
дегідрогеназа
COO
H 3+N
COO Р
аспартат
-
COO -
S
CH3
МЕТІОНІН
CH3
COO-
ТРЕОНІН
H3+N
C
HC
H
CH3
CH2
CH3
ІЗОЛ ЕЙЦИН
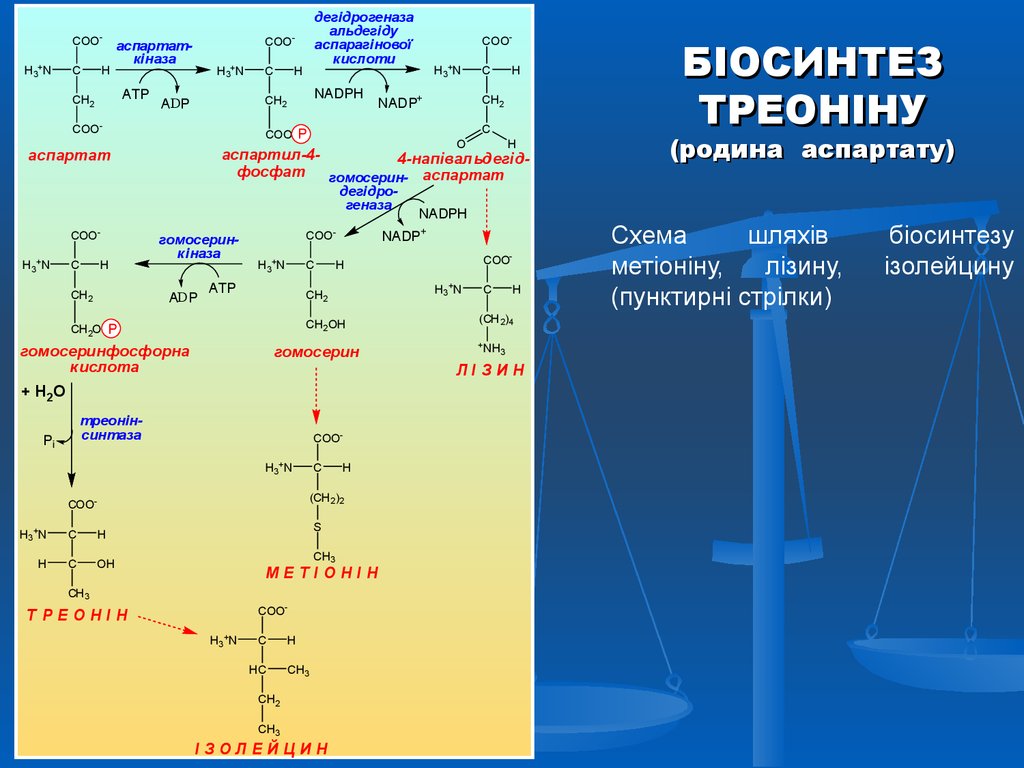
БІОСИНТЕЗ
ТРЕОНІНУ
(родина аспартату)
Схема
шляхів
метіоніну,
лізину,
(пунктирні стрілки)
біосинтезу
ізолейцину
28.
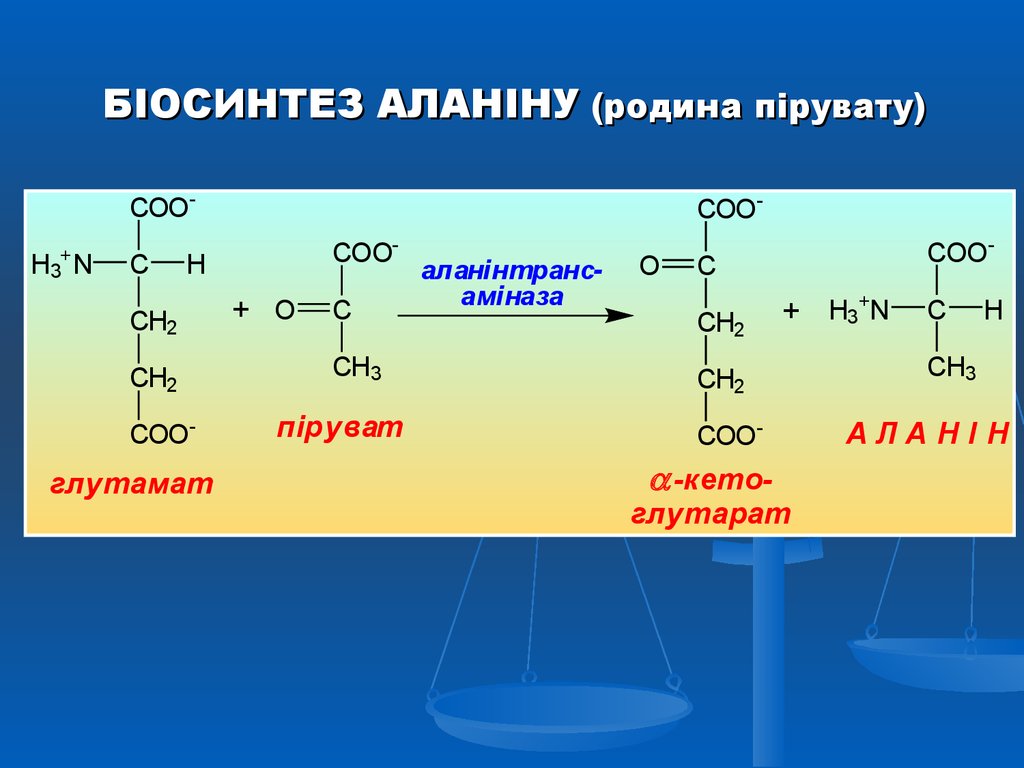
БІОСИНТЕЗ АЛАНІНУ (родина пірувату)COOH3+ N
C
COOCOO-
H
CH2
CH2
COO-
глутамат
+ O
C
CH3
піруват
аланінтрансаміназа
O
COO-
C
CH2
+ H3+N
CH2
COO-
-кето-
глутарат
C
H
CH3
АЛАНІН
29.
БІОСИНТЕЗ ВАЛІНУ ТА ЛЕЙЦИНУ (родинаCOO-
COOCOO-
2
O
C
ацетолактатсинтаза
CH3
H 3C
C
O
C
CO2
OH редуктоізомераза
C
OH
H3C
C
OH
CH3
CH3
2-ацетолактат
піру ват
H
2,3-дигідроізовалеріат
H2O
COOH3+N
C
H
H3C
C
H
CH3
ВАЛІН
COOтрансаміназа
амінокислот
глутамат
-кетоглутарат
H3C
C
O
C
H глутамат
-кетоглутарат
CH3
2-к етоізовалеріат
COOH3+N
C
H
CH2
H3 C
C
H
CH3
ЛЕЙЦИН
пірувату)
30.
--
COO
фосфогліцерат- COO
дегідрогеназа
C OH
C O
+
NAD
CH2 O Р
CH2 OР
NADH
H
3-фосфогліцерат
-
COO
фосфосеринтрансаміназа
Глу
+
H3 N
C
CH2 OР
α-КГ
3-фосфогідроксипіруват
3-фосфосерин
Н2О
фосфосеринфосфатаза
-
+
C
H
серин-гідроксиметилтрансфераза
N5N10-метилентетрагідрофолієва
ГЛІЦИН
кислота
-
-
COO
COO
+
+ H3 N
C
CH2
CH2
CH3
SH
-кето
бутират
H
ЦИСТЕЇ Н
+
H3 N
C
H2 O
OH
СЕРИН
цистатіонінсинтаза
гомоцистеї н
цистатіонін -ліаза
H2 O
NH3
H
CH2
тетрагідрофолієва
кислота
метіонін
O
Пунктирною стрілкою
показане
багатостадійне
перетворення
метіоніну на гомоцистеїн.
-
COO
H
C
(родина серину)
Pi
COO
H3 N
H
-
-
COO
+
H3 N
C
H
H2 C
S
БІОСИНТЕЗ
СЕРИНУ,
ЦИСТЕЇНУ ТА
ГЛІЦИНУ
COO
+
H3 N
H2
C
C
CH2
цистатіонін
H
Пунктирною лінією в
молекулі цистатіоніну
позначений
зв'язок,
що атакується цистатіонін- -ліазою.
Глу – глутамат
КГ - -кетоглутарат
31.
рибозо-5-фосфатІзомеризація,
між молекулярні перебудови в пентозофосфатних шляхах
АТР
АМР
P
O
H
рибозофосфатпірофосфокіназа
O
CH2
O
C
H
C
OH
H
C
OH
O
OH
P
P
OH
5-фосфорибозил-1-пірофосфат
CH2O P
еритрозо-4-фосфат
COO-
+ фосфоенолпіруват
H3+N
з глутаміну
з АТР
Т РИПТ ОФАН
N H3
H 2C
C
H
N
N
H
-
COO
Г ІСТ ИДИН
N+ H3
ФЕ НІЛАЛАНІН
H
CH2
х оризмат
+
C
H2C
C
H
COO-
OH
Т ИРОЗИН
ЗАГАЛЬНА
СХЕМА
БІОСИНТЕЗУ
ГІСТИДИНУ,
ТРИПТОФАНУ,
ФЕНІЛАЛАНІНУ
ТА ТИРОЗИНУ
(РОДИНА
АРОМАТИЧНИХ
АМІНОКИСЛОТ ТА
ГІСТИДИНУ)
32.
RR
C
O
C
H
O-
O
-кетокислота
O
C
O-
O
CH2
N+H3
C
-
C
C
O
C
O-
CH2
CH2
C
C
O -амінокислота
O
CH2
H
C N+H3
O
глутамат
O
O
O-
-кетоглутарат
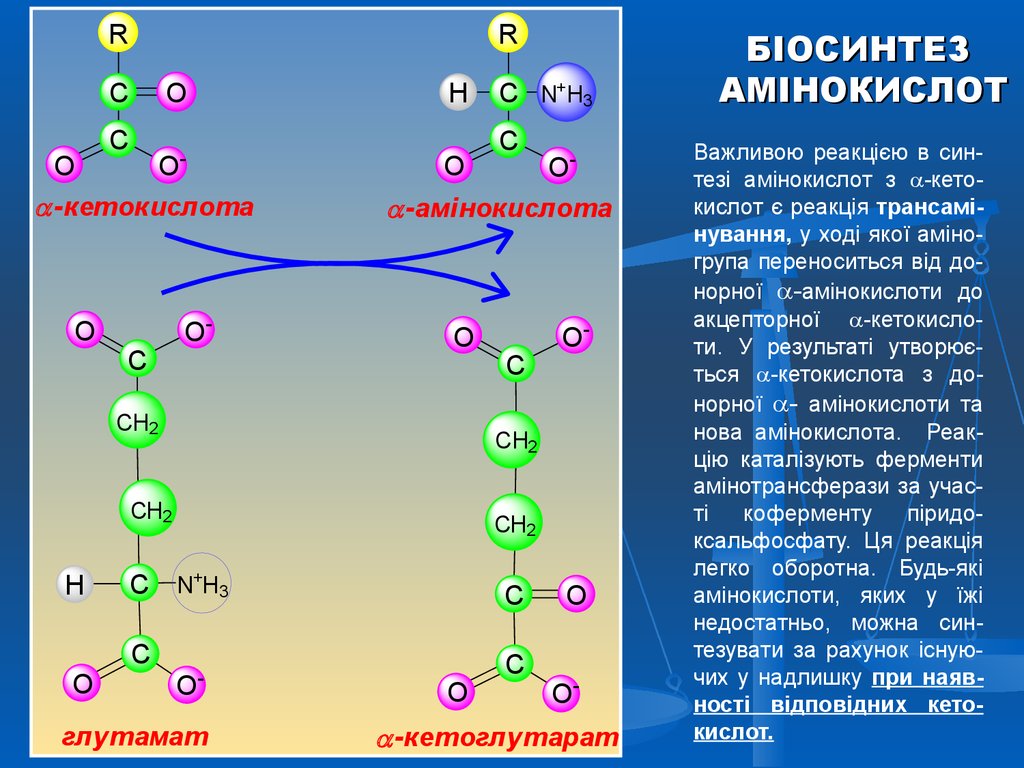
БІОСИНТЕЗ
АМІНОКИСЛОТ
Важливою реакцією в синтезі амінокислот з -кетокислот є реакція трансамінування, у ході якої аміногрупа переноситься від донорної -амінокислоти до
акцепторної -кетокислоти. У результаті утворюється -кетокислота з донорної - амінокислоти та
нова амінокислота. Реакцію каталізують ферменти
амінотрансферази за участі
коферменту
піридоксальфосфату. Ця реакція
легко оборотна. Будь-які
амінокислоти, яких у їжі
недостатньо, можна синтезувати за рахунок існуючих у надлишку при наявності відповідних кетокислот.
33.
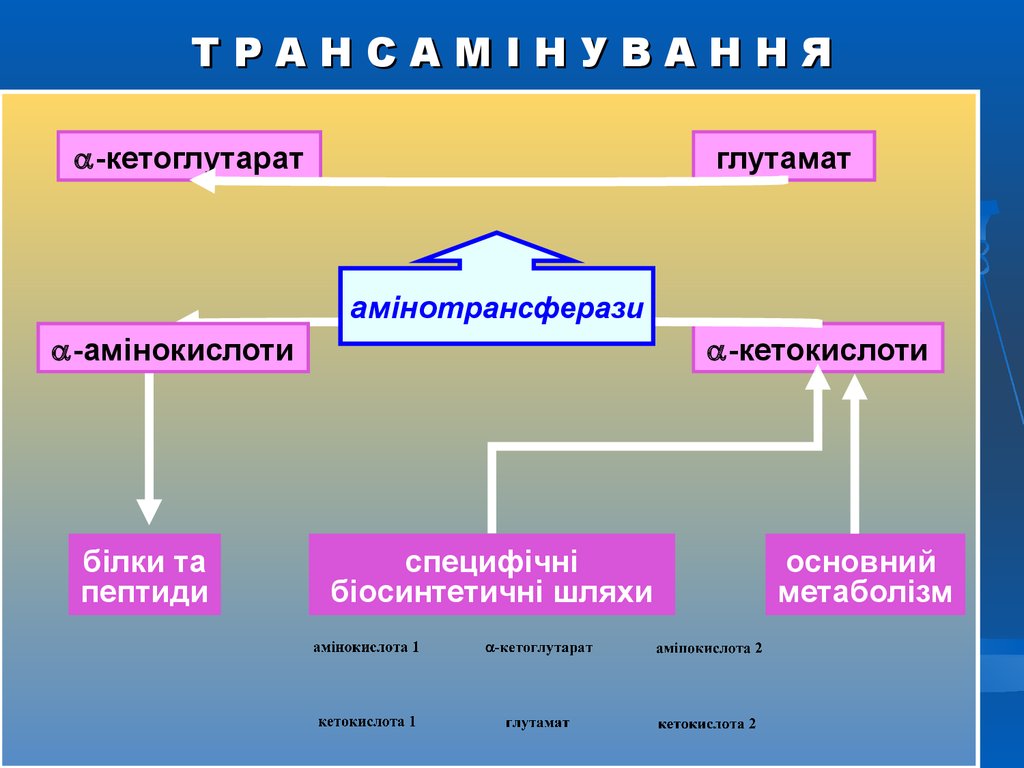
ТРАНСАМІНУВАННЯ-кетоглутарат
глутамат
амінотрансферази
-амінокислоти
білки та
пептиди
-кетокислоти
специфічні
біосинтетичні шляхи
основний
метаболізм
34.
РЕАКЦІЇ ЗА УЧАСТЮ АМІНОТРАНСФЕРАЗ( АЛТ і АСТ )
глутамат
-кетоглутарат
ПІРУВАТ
АЛАНІН
глутамат
ОКСАЛОАЦЕТАТ
-кетоглутарат
АСПАРТАТ
35. Біологічне значення трансамінування
Реакції трансамінування відіграють значну роль в обмініамінокислот. Оскільки цей процес зворотний, ферменти
амінотрансферази функціонують як в процесах катаболізму, так і
біосинтезу амінокислот. Фактично це реакції амфіболічного
типу. Трансамінування – заключний етап синтезу замінних
амінокислот із відповідних -кетокислот, якщо вони в даний
момент необхідні клітинам. В результаті відбувається
перерозподіл
амінного
азоту
в
тканинах
організму.
Трансамінування – перша стадія дезамінування більшості
амінокислот, тобто початковий етап їх катаболізму. Утворені при
цьому кетокислоти окислюються в ЦТК або використовуються
для синтезу глюкози та кетонових тіл. При трансамінуванні
загальна кількість амінокислот у клітині не змінюється.
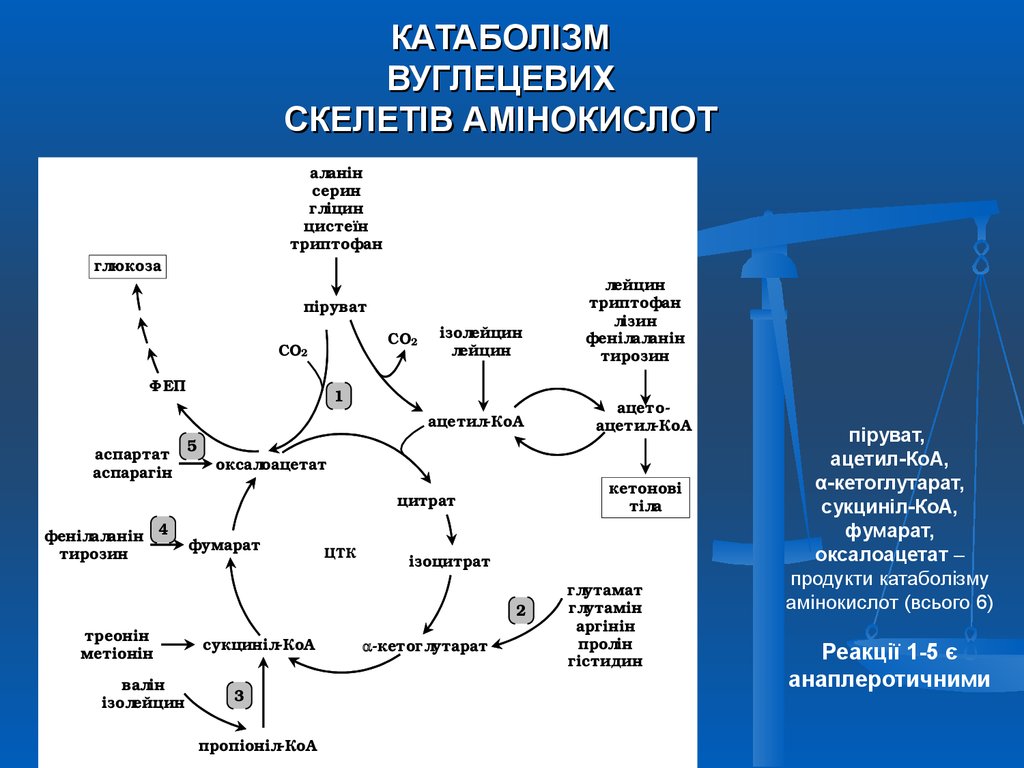
36. КАТАБОЛІЗМ ВУГЛЕЦЕВИХ СКЕЛЕТІВ АМІНОКИСЛОТ
аланін
серин
гліцин
цистеїн
триптофан
глюкоза
піруват
СО2
СО2
Ф ЕП
ізолейцин
лейцин
1
ацетилКоА
аспартат
аспарагін
5
фенілаланін 4
фумарат
тирозин
кетонові
тіла
ЦТК
ізоцитрат
2
валін
ізолейцин
ацето
ацетилКоА
оксалоацетат
цитрат
треонін
метіонін
лейцин
триптофан
лізин
фенілаланін
тирозин
сукцинілКоА
3
пропіонілКоА
кетоглутарат
глутамат
глутамін
аргінін
пролін
гістидин
піруват,
ацетил-КоА,
α-кетоглутарат,
сукциніл-КоА,
фумарат,
оксалоацетат –
продукти катаболізму
амінокислот (всього 6)
Реакції 1-5 є
анаплеротичними
37.
Амінокислоти, які перетворюються в піруват та проміжніпродукти
ЦТК
( -Кетоглутарат,
сукциніл-КоА,
фумарат) і утворюють в кінці оксалоацетат, можуть
використовуватись в процесі глюконеогенезу. Такі
амінокислоти
належать
до
групи
глікогенних
амінокислот (14).
Деякі амінокислоти в процесі катаболізму перетворюються
в ацетоацетат (Ліз, Лей) або ацетил-КоА (Лей) та можуть
використовуватись в синтезі кетонових тіл - кетогенні (2).
Ряд амінокислот використовується і для синтезу глюкози, і
для синтезу кетонових тіл, тому що в процесі їх
катаболізму утворюються 2 продукти – певний метаболіт
цитратного циклу та ацетоацетат (Три, Фен, Тир) або
ацетил-КоА (Іле). Такі амінокислоти називають
змішаними, або гліко-кетогенними(4) .
38.
аспаратГ ЛІ К ОЛІ З
СО 2
фенілаланін
тирозин
оксалоацетат
фосфоенолпіруват
NADH+H+
фумарат
піруват
малат
СО 2
триптофан
аланін
цистеї н
серин
треонін
гліцин
КАТАБОЛІЗМ
ВУГЛЕЦЕВИХ
СКЕЛЕТІВ
АМІНОКИСЛОТ
NADH+H+
фенілаланін*
тирозин*
ацетил-KоА
триптофан*
ізолейцин*
NADH+H +
лізин
лейцин
оксалоцитрат
ацетат
малат
ізоцитрат
FADH2
NADH+H+
FADH2
GTP
сукцинат
СО 2
сукцинілKоА
GTP
NADH+H +
СО 2
-кетоглутарат
СО 2
NADH+H +
ізолейцин*
валін*
метіонін*
піруват, ацетил-КоА,
α-кетоглутарат,
сукциніл-КоА, фумарат,
оксалоацетат – продукти
катаболізму амінокислот
глутамат
пролін
гістидин
аргінін
* амінокислоти
і кетогенні,
і глікогенні
39.
КЛАСИФІКАЦІЯ АМІНОКИСЛОТГлікогенні
амінокислоти
Глікокетогенні
амінокислоти
Кетогенні
амінокислоти
Аланін
Аспарагін
Аспартат
Гліцин
Глутамат
Глутамін
Пролін
Серин
Цистеїн
Аргінін
Гістидин
Валін
Метіонін
Треонін
Тирозин
Ізолейцин
Фенілаланін
Триптофан
Лейцин
Лізин
40. Спадкові порушення катаболізму амінокислот
1.2.
3.
4.
5.
Фенілкетонурія.
Тирозиноз.
Алкаптонурія.
Альбінізм.
Хвороба Паркінсона.
41.
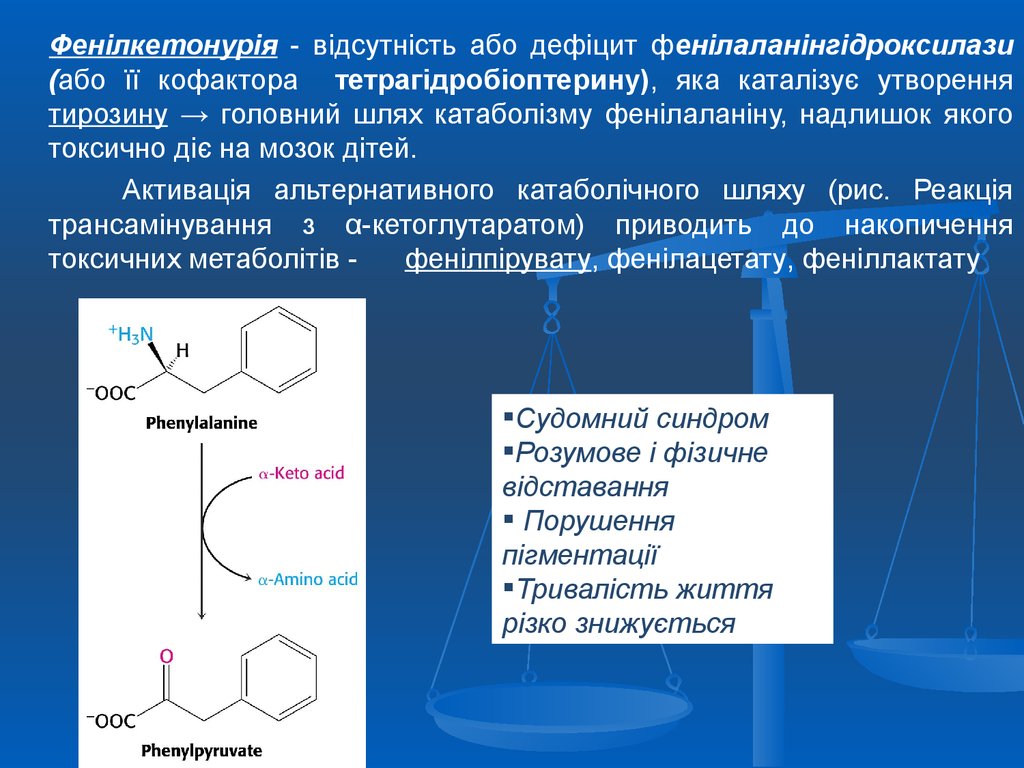
Фенілкетонурія - відсутність або дефіцит фенілаланінгідроксилази(або її кофактора тетрагідробіоптерину), яка каталізує утворення
тирозину → головний шлях катаболізму фенілаланіну, надлишок якого
токсично діє на мозок дітей.
Активація альтернативного катаболічного шляху (рис. Реакція
трансамінування з α-кетоглутаратом) приводить до накопичення
токсичних метаболітів фенілпірувату, фенілацетату, феніллактату
Судомний синдром
Розумове і фізичне
відставання
Порушення
пігментації
Тривалість життя
різко знижується
42.
Тирозиноз (тирозинемія I типу)Причиною захворювання є, вірогідно, дефект ферменту
фумарилацетоацетатгідролази,
що
каталізує
розщеплення
фумарилацетоацетату (проміжний метаболіт обміну тирозину) на
фумарат і ацетоацетат. Гостра форма тирозинозу характерна для
новонароджених. Клінічний прояв – діарея, блювання, затримки в
розвитку. Без лікування діти гинуть у віці 6–8 місяців через
недостатність
печінки,
що
розвивається.
Хронічна
форма
характеризується схожими, але менш вираженими симптомами.
Загибель настає у віці 10 років. Вміст тирозину в крові хворих у
декілька разів перевищує норму.
43.
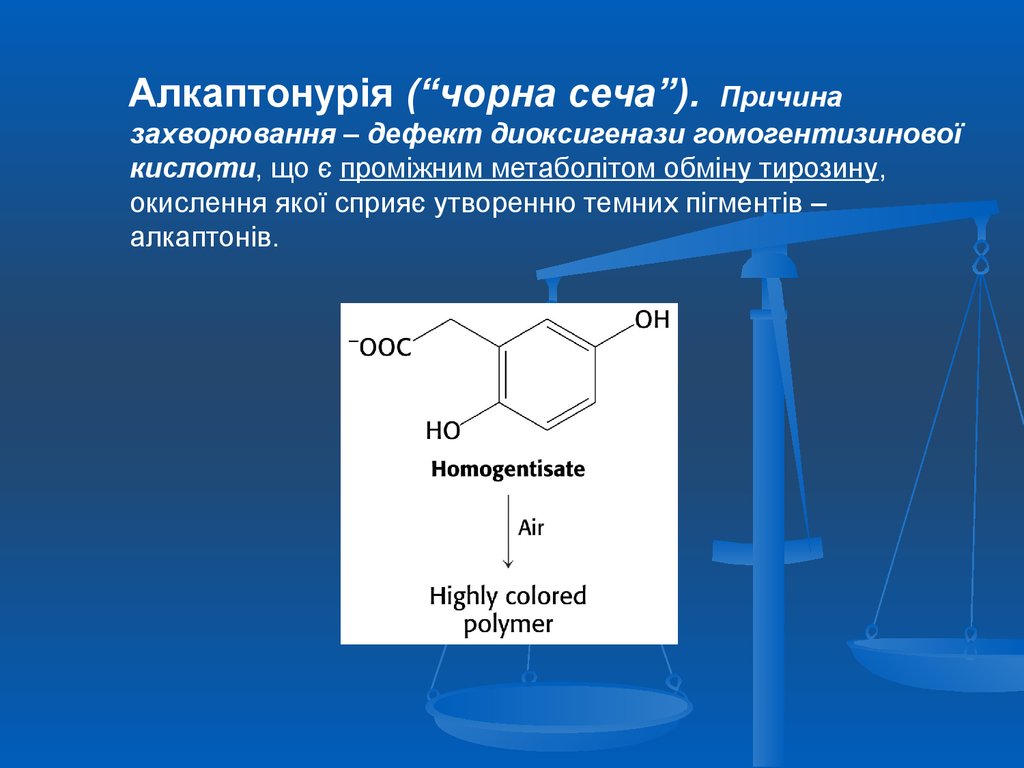
Алкаптонурія (“чорна сеча”).Причина
захворювання – дефект диоксигенази гомогентизинової
кислоти, що є проміжним метаболітом обміну тирозину,
окислення якої сприяє утворенню темних пігментів –
алкаптонів.
44.
Клінічні проявиалкаптонурії
Охроноз – накопичення пігменту окисленої
гомогентизинової кислоти в сполучній тканині
Артрит є частим ускладненням
охронозу при алкаптонурії
Стеноз аортального клапана при
алкаптонурії
Сеча набуває чорного кольору на повітрі
45.
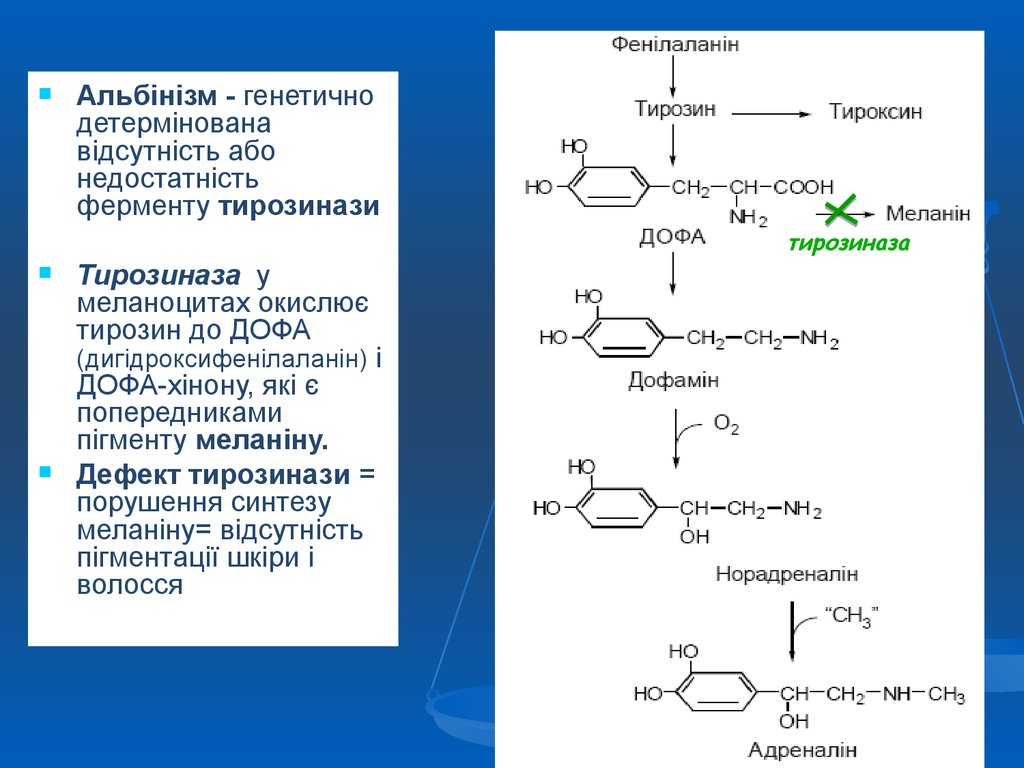
Альбінізм - генетичнодетермінована
відсутність або
недостатність
ферменту тирозинази
тирозиназа
Тирозиназа у
меланоцитах окислює
тирозин до ДОФА
(дигідроксифенілаланін) і
ДОФА-хінону, які є
попередниками
пігменту меланіну.
Дефект тирозинази =
порушення синтезу
меланіну= відсутність
пігментації шкіри і
волосся
46.
Симптоми альбінізму:відсутність
пігментації шкіри і
волосся за рахунок зниження
продукції або відсутність
меланіну
висока чутливість до
сонячного світла
•підвищений
ризик
розвитку раку шкіри
•сонячні опіки
•фотофобія
•зниження гостроти зору
•частота захворювання на
альбінізм становить 1 : 20000.
47.
Хвороба Паркінсона. Захворювання розвивається внаслідок нестачідофаміну в чорній субстанції мозку за рахунок зниження активності
тирозингідроксилази(1), ДОФА - декарбоксилази (2). Це одне з
найпоширеніших неврологічних захворювань (частота – 1 : 200 серед
людей, віком понад 50 років). Недостатній вміст дофаміну призводить
до активуючого впливу базальних гангліїв на кору головного мозку.
Захворювання супроводжується трьома основними симптомами:
акінезія (обмеженість рухів), ригідність (напруження м’язів), тремор
(мимовільне дрижання). Депресивні стани часто пов’язані зі зниженням
у нервових клітинах вмісту дофаміну й норадреналіну.
Гіперсекреція дофаміну в скроневій частці мозку спостерігається під час
шизофренії.
48. Аміак – токсична для організму речовина. Шляхи його виведення
Залежно від форми виведення амінного азоту різнівиди тварин можна розділити на три групи :
амоніотелічні тварини, амінний азот виводиться у
вигляді вільного аміаку. Це – водні хребетні
(костисті риби);
уреотелічні тварини, амінний азот виводиться у
вигляді сечовини. Це – більшість наземних
хребетних тварин.
урикотелічні тварини, амінний азот виводиться у
вигляді сечової кислоти. Це – птахи, змії, ящірки.
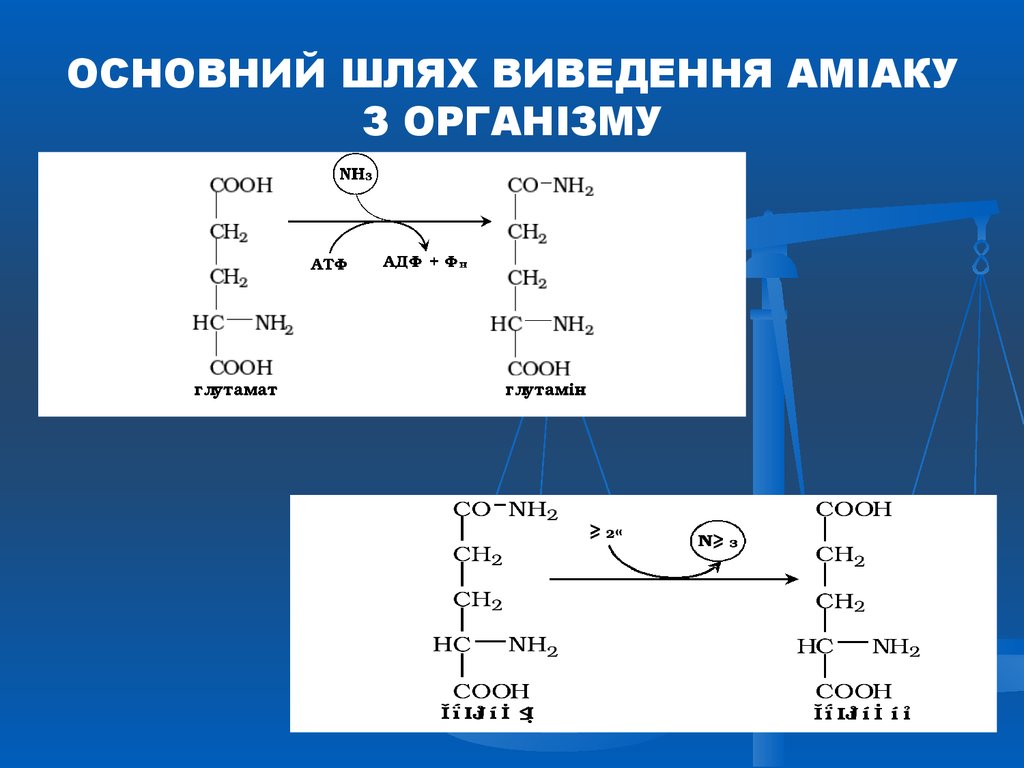
49. ОСНОВНИЙ ШЛЯХ ВИВЕДЕННЯ АМІАКУ З ОРГАНІЗМУ
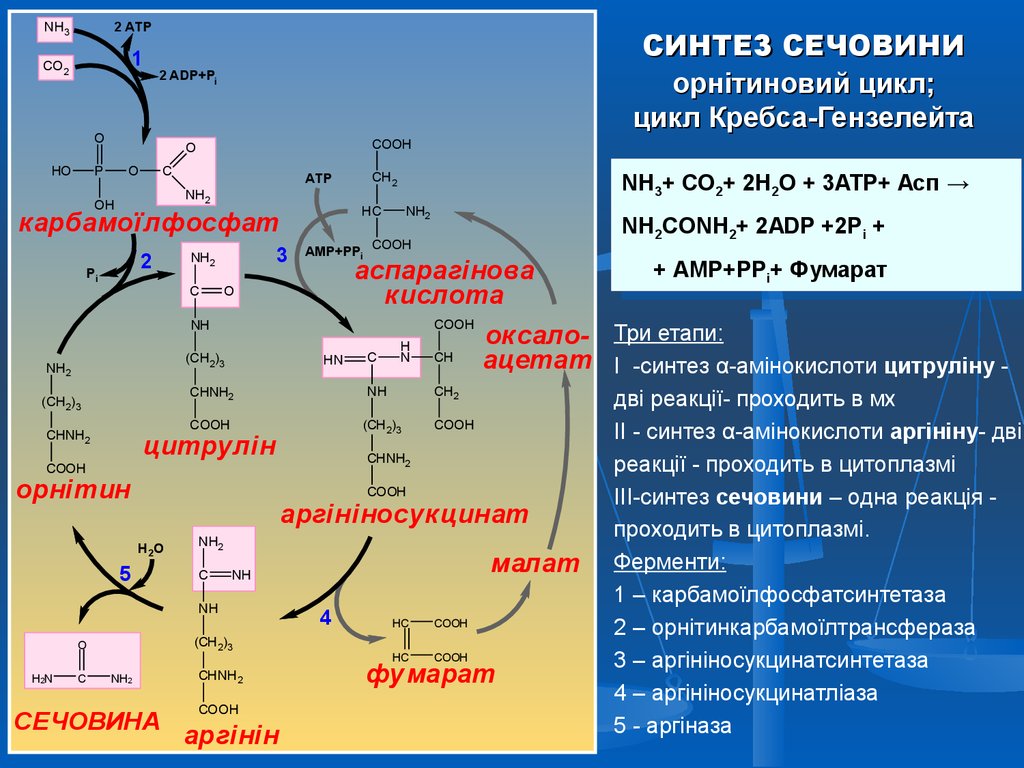
50.
NH32 ATP
1
CO2
2 ADP+Pi
O
HO
СИНТЕЗ СЕЧОВИНИ
орнітиновий цикл;
цикл Кребса-Гензелейта
COOH
O
P
O
C
ATP
NH2
OH
HC
карбамоїлфосфат
2
Pi
3
NH2
C
NH2
аспарагінова
кислота
O
COOH
(CH2)3
HN
COOH
CHNH2
COOH
аргініносукцинат
H2O
5
NH2
C
(CH2)3
O
NH2
СЕЧОВИНА
малат
NH
NH
C
COOH
CHNH2
COOH
H2N
CH
CHNH2
COOH
аргінін
4
HC
COOH
HC
COOH
++АМР+PP
АМР+PPi+i+Фумарат
Фумарат
оксало- Три етапи:
ацетат I -синтез α-амінокислоти цитруліну -
CH2
(CH2)3
цитрулін
орнітин
C
H
N
NH
CHNH2
(CH2)3
NH
2+ 2ADP +2Pi +
NH2CONH
2CONH2+ 2ADP +2Pi +
AМP+PPi COOH
NH
NH2
NH
+ 3ATP+ Асп →
NH3+3+CO
CO2+2+2H
2H2O
2O + 3ATP+ Асп →
CH2
фумарат
дві реакції- проходить в мх
II - синтез α-амінокислоти аргініну- дві
реакції - проходить в цитоплазмі
III-синтез сечовини – одна реакція проходить в цитоплазмі.
Ферменти:
1 – карбамоїлфосфатсинтетаза
2 – орнітинкарбамоїлтрансфераза
3 – аргініносукцинатсинтетаза
4 – аргініносукцинатліаза
5 - аргіназа





























 medicine
medicine chemistry
chemistry








