Similar presentations:
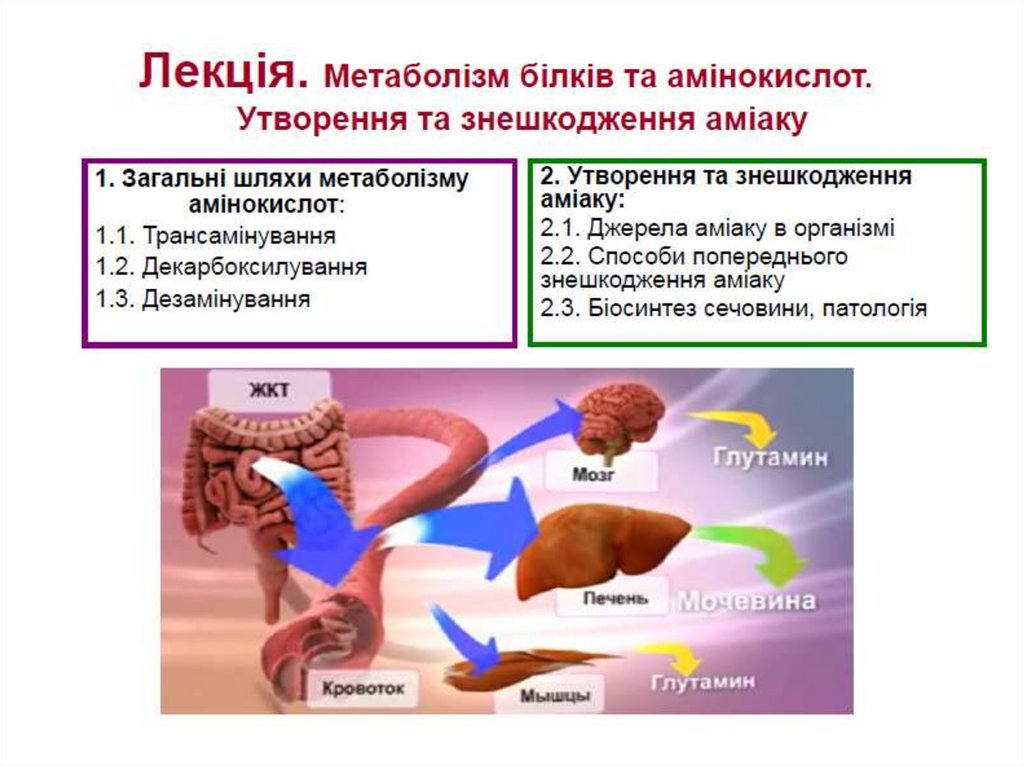
Метаболізм білків та амінокислот. Утворення та знешкодження аміаку
1.
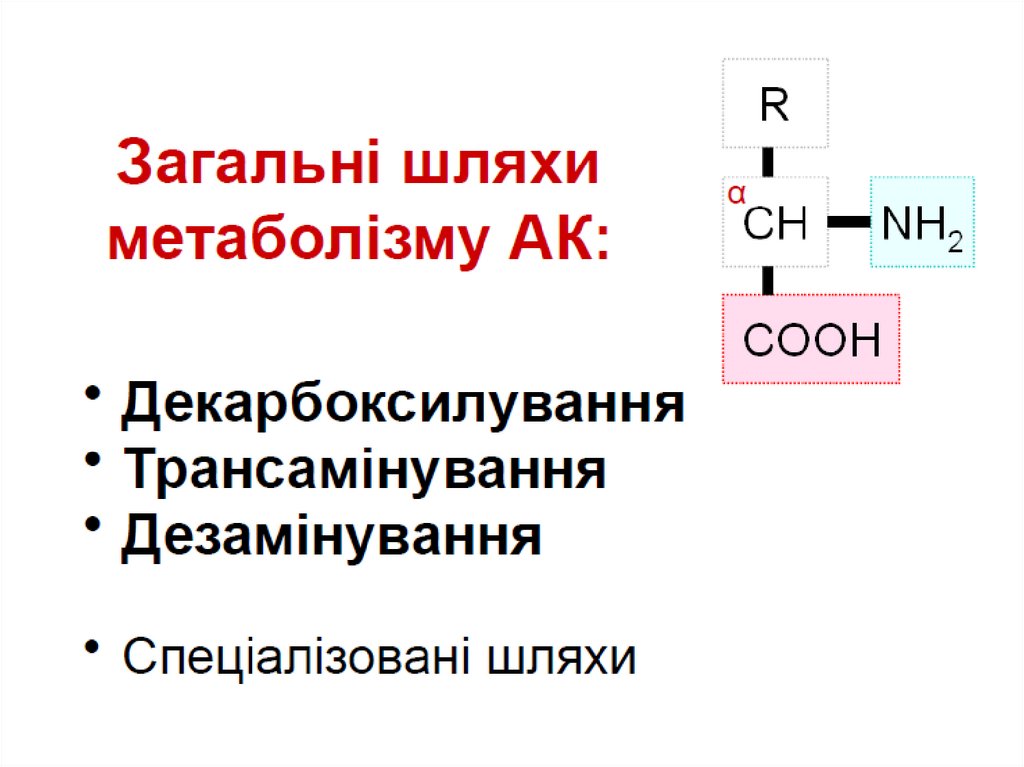
1.Загальні шляхи метаболізмуамінокислот:
1.1. Трансамінування
1.2. Декарбоксилування
1.3. Дезамінування
2. Утворення та знешкодження аміаку:
2.1. Джерела аміаку в організмі
2.2. Способи попереднього
знешкодження аміаку
2.3. Біосинтез сечовини, патологія
2. Список використаної літератури:
• Біологічна і біоорганічна хімія: у 2кн.: підручник. Кн. 1.Біологічна хімія / Б.С. Зіменковський, В.А. Музиченко,
І.В. Ніженковська, Г.О. Сирова; за ред. Б.С.
Зіменковського, І.В. Ніженковської. – 2-е вид., випр. – К.:
ВСВ «Медицина», 2017. – 272с.
• Біологічна і біоорганічна хімія: у 2кн.: підручник. Кн. 2.
Біологічна хімія / Ю.І. Губський, І.В. Ніженковська, М.М.
Корда та ін.; за ред. Ю.І. Губського, І.В. Ніженковської –
3-є вид.– К.: ВСВ «Медицина», 2021. – 544с.
• Bioorganic Chemistry: textbook / Yu. Gubskyi. – 2nd ed. –
Vinnitsa:Nova Knyha, 2019/ - 224p.
• Biological chemistry = Біологічна хімія: textbook / edited
by Yu. Gubsky. – 3nd edition. – Vinnytsia: Nova Knyha,
2020. – 488p.
3.
4.
5.
6.
1/3Розпад
до СО2 та H2O
з утворенням
АТФ
Вивільнення
NH3
утворення
сечовини
Розпад
ендогенних
білків
Синтез
замінних
амінокислот
Всмоктування
екзогенних
амінокислот
2/3
Пул амінокислот –
загальна кількість вільних
амінокислот організму
300-500 г
Синтез білків,
вуглеводів,
ліпідів
Синтез БАР:
катехоламінів
гістаміну,
серотоніну,
ГАМК
Екскреція АК
з сечею
1-2%
Синтез
небілкових
азотвмісних
речовин:
креатину
GSH
нуклеотидів
віт. РР
гему
7.
8.
9.
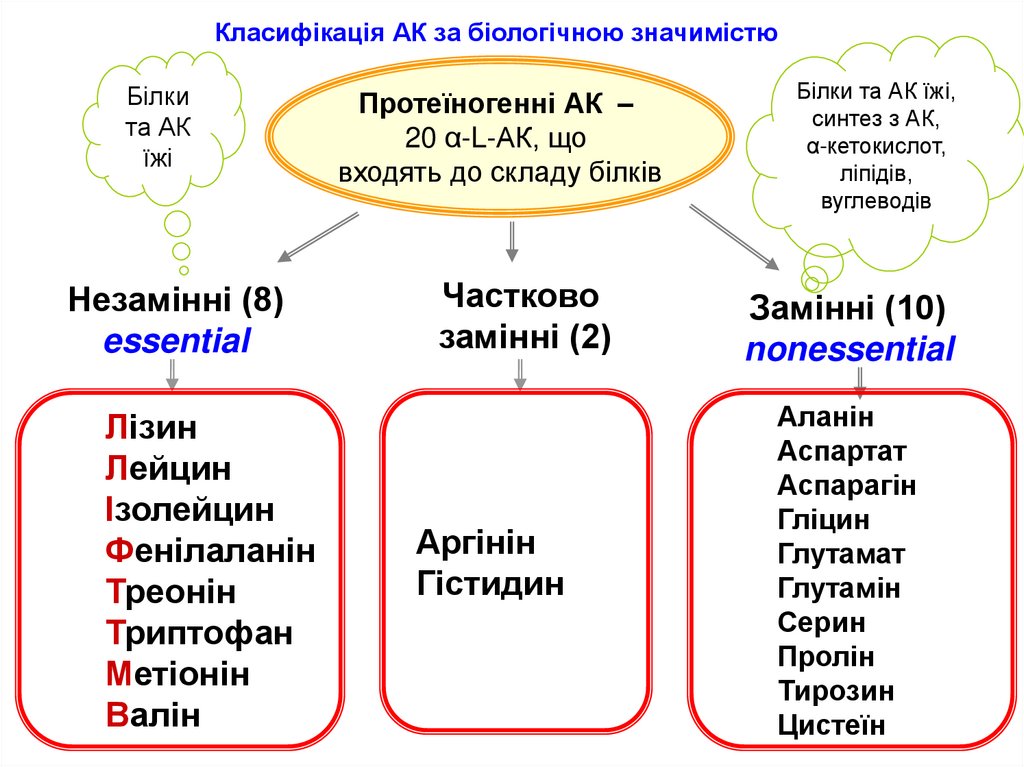
Класифікація АК за біологічною значимістюБілки
та АК
їжі
Незамінні (8)
essential
Лізин
Лейцин
Ізолейцин
Фенілаланін
Треонін
Триптофан
Метіонін
Валін
Протеїногенні АК –
20 α-L-АК, що
входять до складу білків
Частково
замінні (2)
Аргінін
Гістидин
Білки та АК їжі,
синтез з АК,
α-кетокислот,
ліпідів,
вуглеводів
Замінні (10)
nonessential
Аланін
Аспартат
Аспарагін
Гліцин
Глутамат
Глутамін
Серин
Пролін
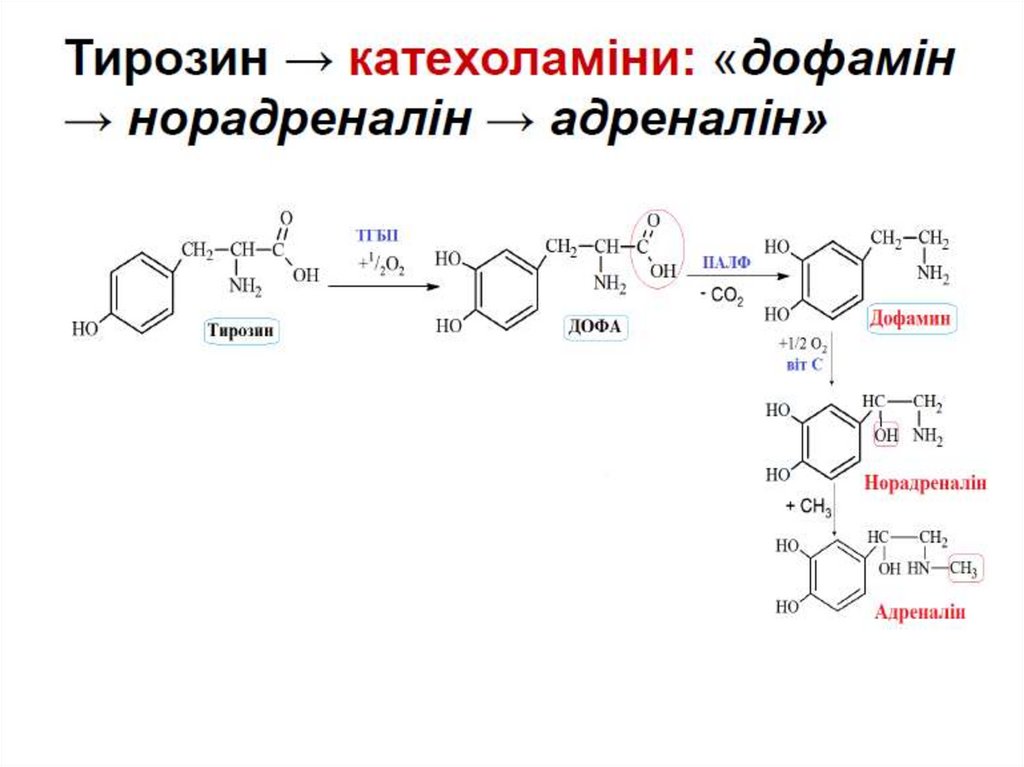
Тирозин
Цистеїн
10.
11.
12.
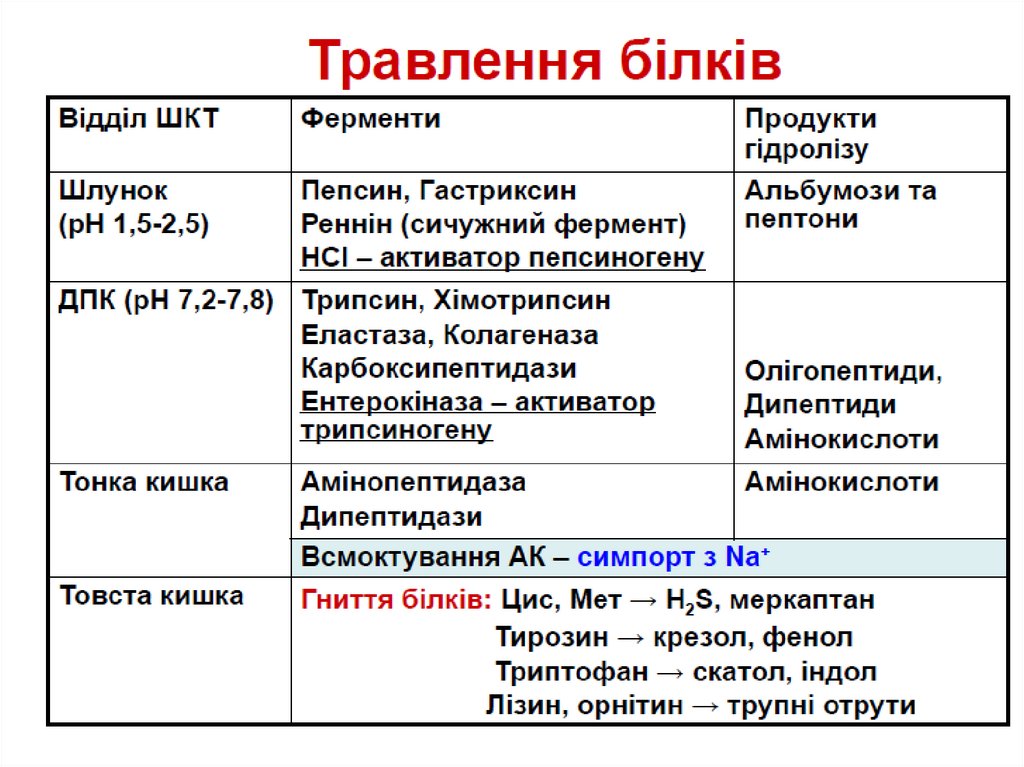
Травлення білківТравлення в шлунку
Ацетилхолін, гістамін і гастрин утворюються у відповідь
на стимуляцію їжею
Комбінація ацетилхоліну, гістаміну і гастрину
викликають звільнення шлункового соку.
Муцин – завжди секретується в шлунку
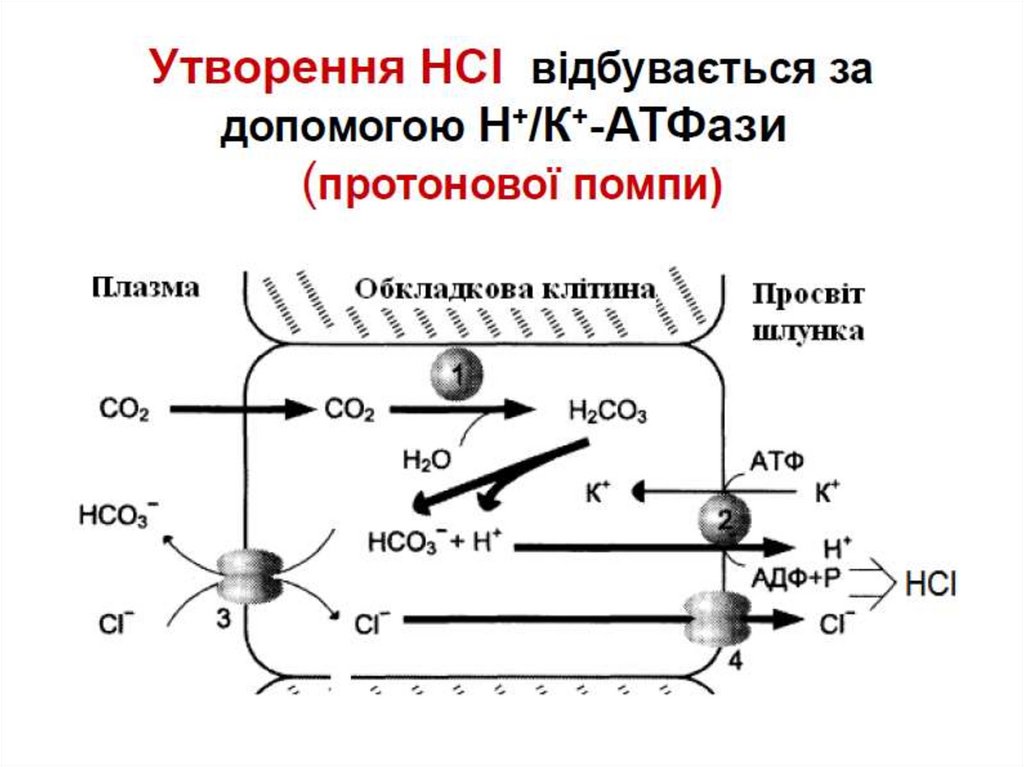
HCl - pH 0.8-2.5 (секретується паріетальними
клітинами)
Пепсиноген (зимоген, секретується основними
клітинами)
Соляна кислота:
Cтворює оптимальне pH
для пепсину
Денатурує білки
Вбиває більшість
бактерій
13.
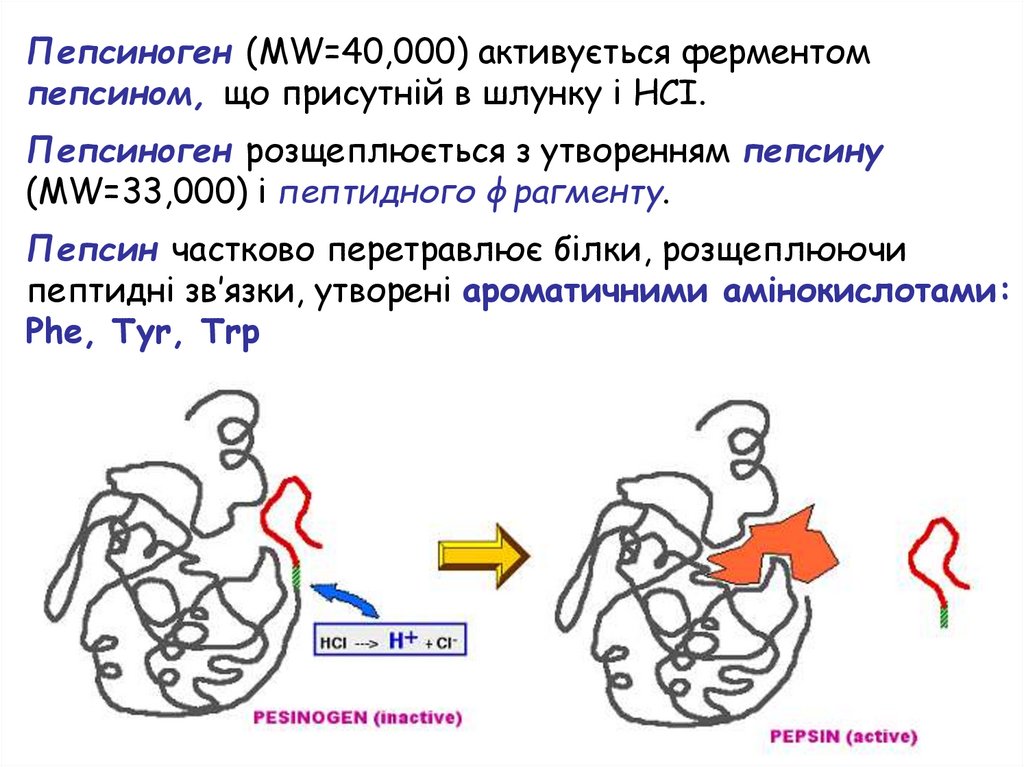
Пепсиноген (MW=40,000) активується ферментомпепсином, що присутній в шлунку і НСІ.
Пепсиноген розщеплюється з утворенням пепсину
(MW=33,000) і пептидного фрагменту.
Пепсин частково перетравлює білки, розщеплюючи
пептидні зв’язки, утворені ароматичними амінокислотами:
Phe, Tyr, Trp
14.
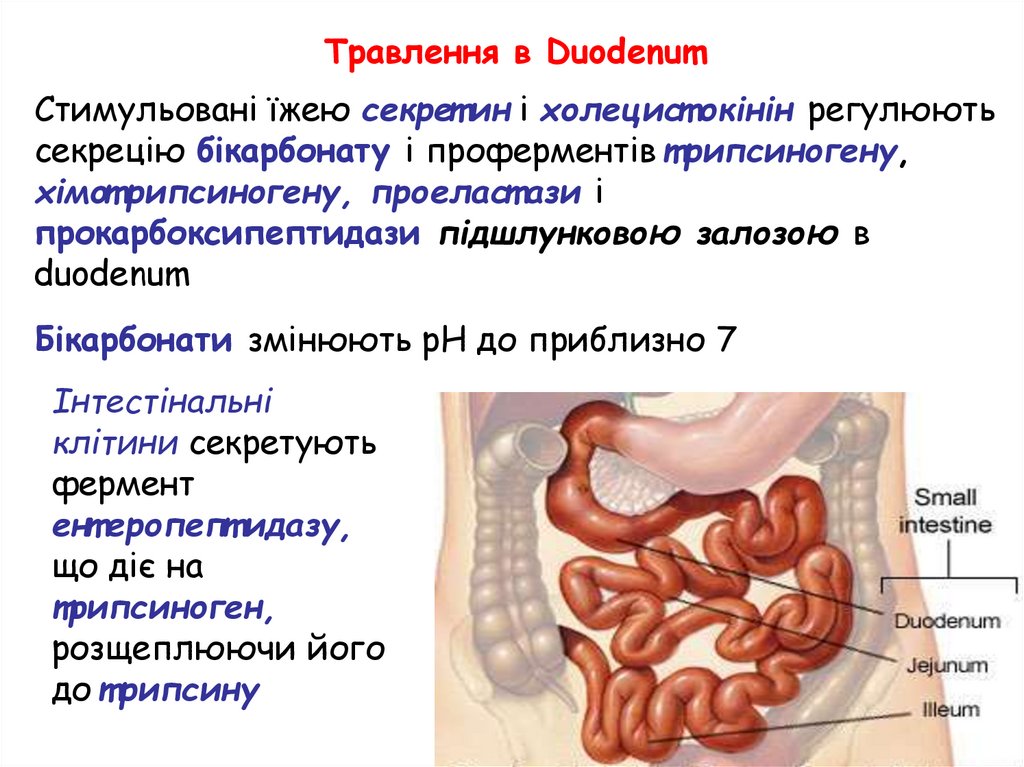
Травлення в DuodenumСтимульовані їжею секрет ин і холецист окінін регулюють
секрецію бікарбонату і проферментів т рипсиногену,
хімот рипсиногену, проеласт ази і
прокарбоксипептидази підшлунковою залозою в
duodenum
Бікарбонати змінюють pH до приблизно 7
Інтестінальні
клітини секретують
фермент
ент еропепт идазу,
що діє на
трипсиноген,
розщеплюючи його
до т рипсину
15.
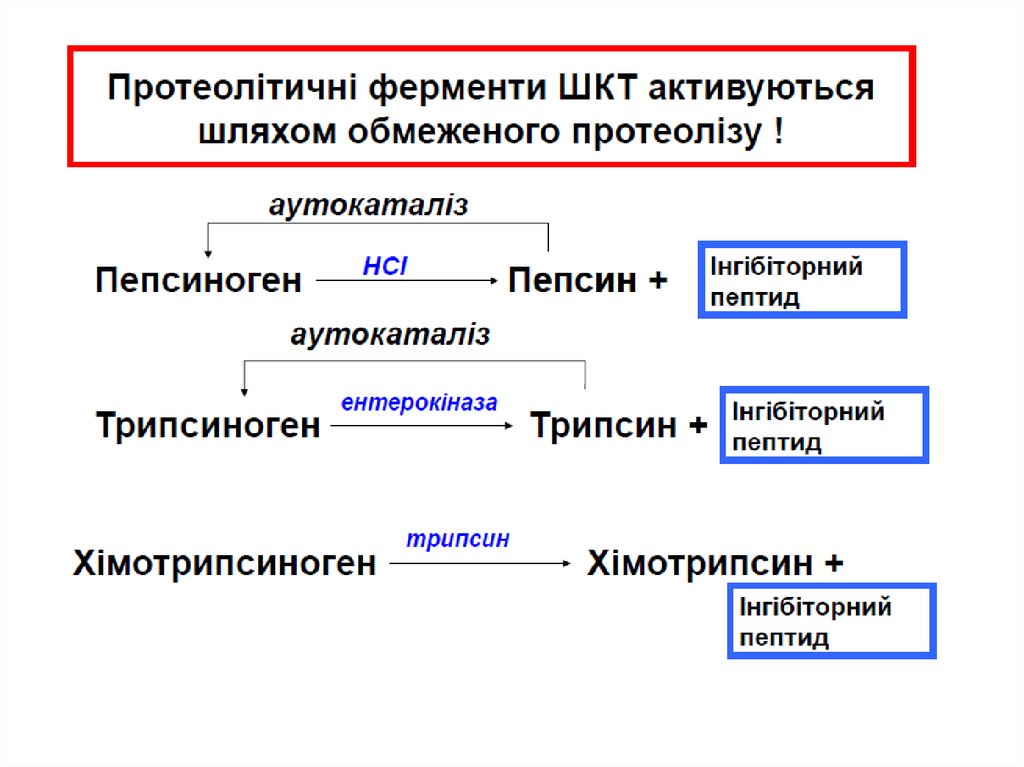
Трипсин перетворює хімотрипсиноген вхімот рипсин, прокарбоксипепт идазу в
карбоксипепт идазу і проеласт азу в еласт азу, і
трипсиногену в т рипсин.
Трипсин, який розщеплює пептидні зв’язки між
лужними амінокислотами Lys і Arg
Хімот рипсин розщеплює зв’язки між
ароматичними амінокислотами Phe, Tyr and Trp
Карбоксипепт идаза відщеплює по одній
амінокислоті з С кінця пептидного ланцюга
Амінопепт идаза секретується в тонкому
кишечнику і відщеплює по одній амінокислоті з N
кінця
16.
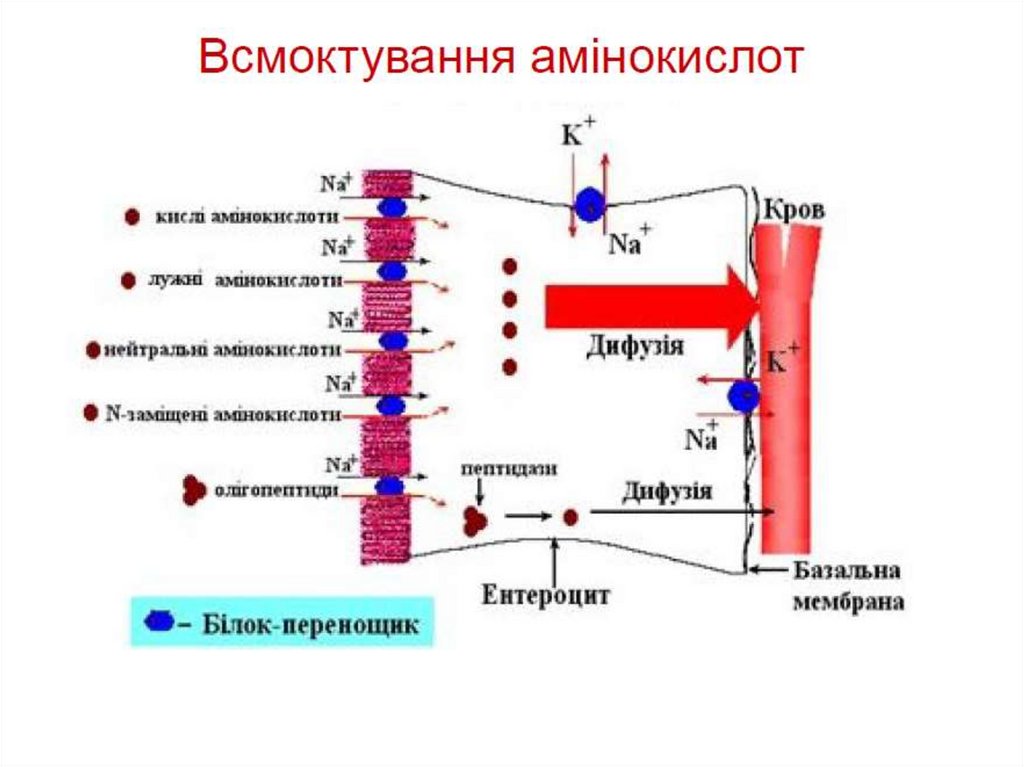
Більшість білків повністю перетравлюються до вільнихамінокислот
Амінокислоти і деколи короткі олігопептиди
абсорбуються вторинним активним транспортом
Амінокислоти транспортуються кров’ю до клітин
організму.
17.
18.
19.
20.
21.
22.
23.
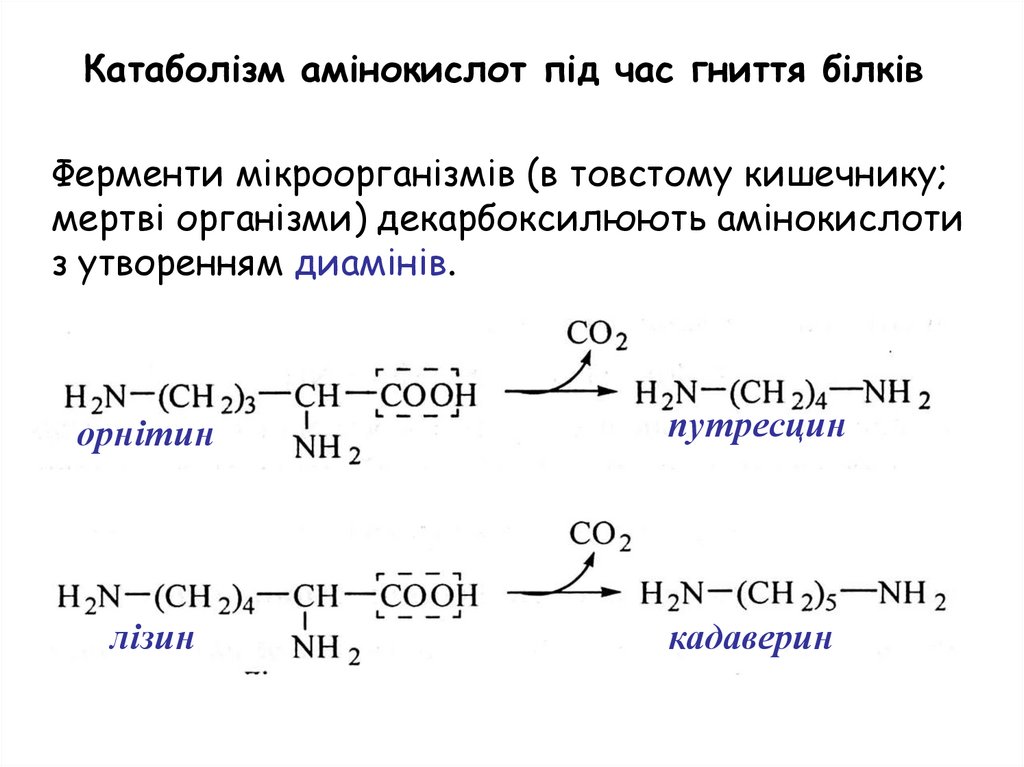
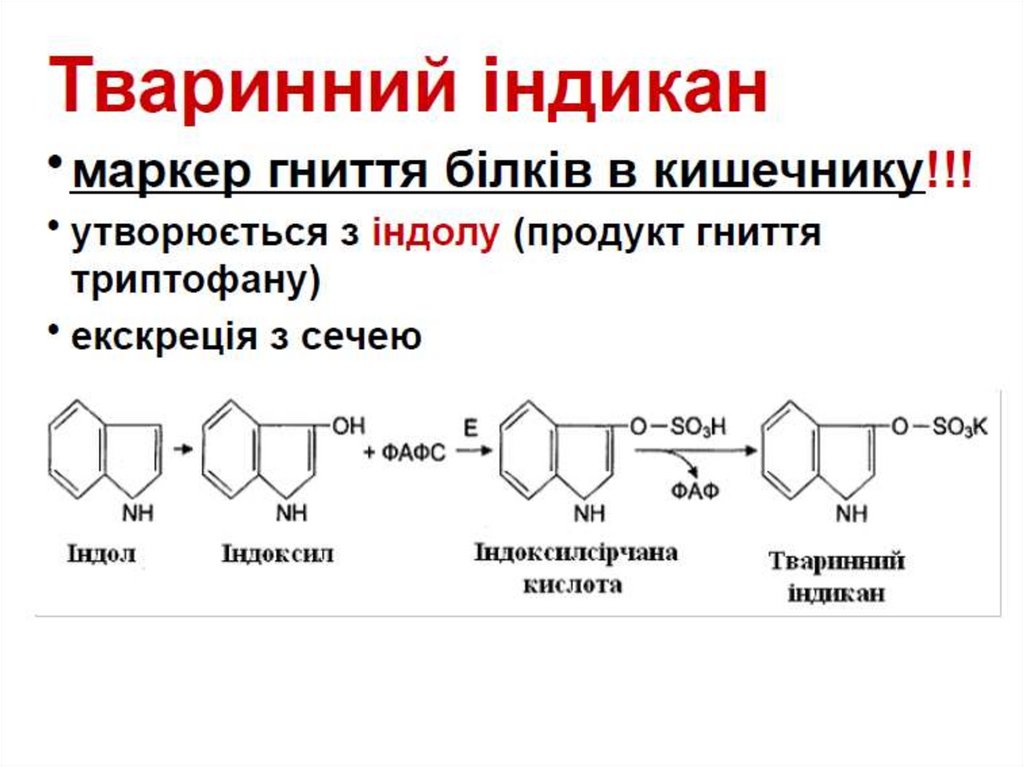
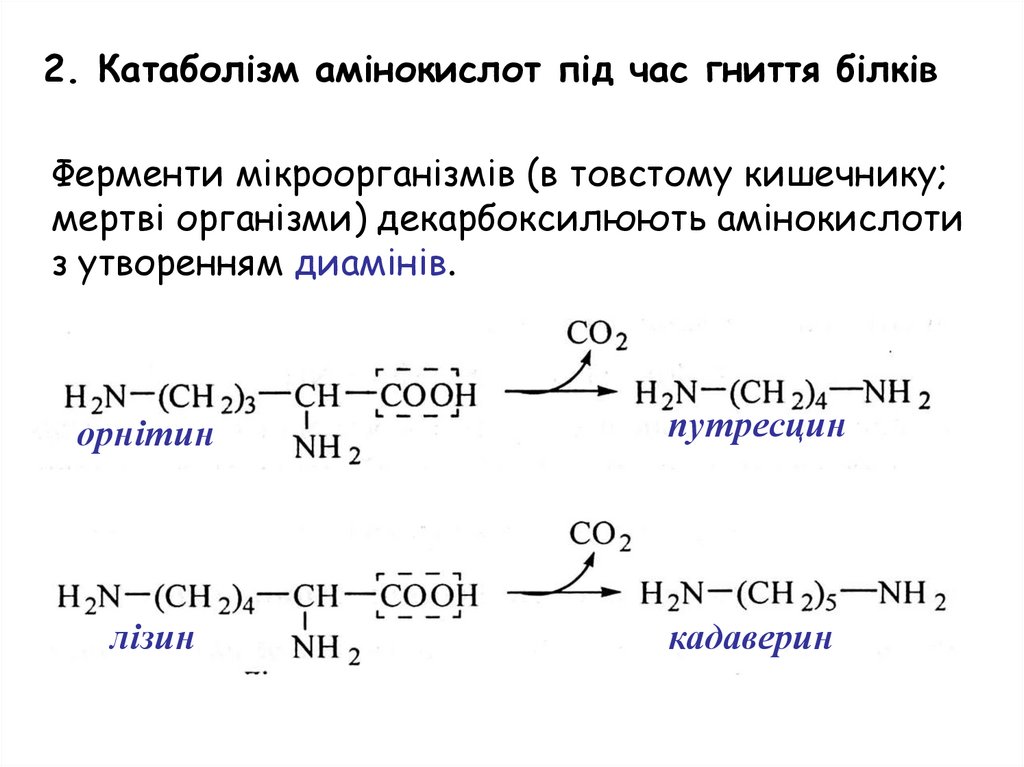
Катаболізм амінокислот під час гниття білківФерменти мікроорганізмів (в товстому кишечнику;
мертві організми) декарбоксилюють амінокислоти
з утворенням диамінів.
орнітин
путресцин
лізин
кадаверин
24.
25.
Шляхи поступлення і використанняамінокислот в тканинах
Джерела амінокислот :
1) всмоктування в кишечнику;
2) розпад білків;
3) синтез з вуглеводів і ліпідів.
Використ ання амінокислот :
1) для синтезу білків;
2) для синтезу інших азотвмісних сполук (креатину,
пуринів, холіну, піримідинів);
3) як джерело енергії;
4) для глюконеогенезу.
26.
ЗАГАЛЬНІ ШЛЯХИ МЕТАБОЛІЗМУАМІНОКИСЛОТ
Доля амінокислот :
1) синтез білків;
2) синтез інших азотвмісних сполук
(креатину, пуринів, холіну, піримідину);
3) джерело енергії;
4) для глюконеогенезу.
27.
28.
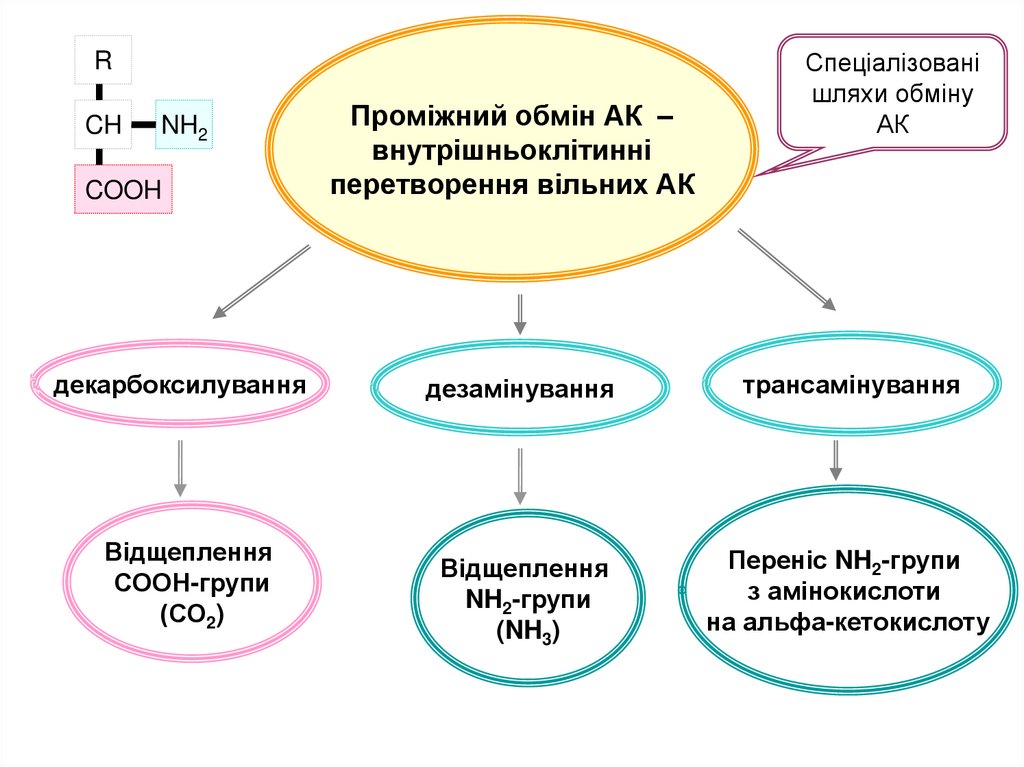
RCH
NH2
COOH
декарбоксилування
Відщеплення
СООН-групи
(СО2)
Проміжний обмін АК –
внутрішньоклітинні
перетворення вільних АК
Спеціалізовані
шляхи обміну
АК
дезамінування
трансамінування
Відщеплення
NH2-групи
(NH3)
Переніс NH2-групи
з амінокислоти
на альфа-кетокислоту
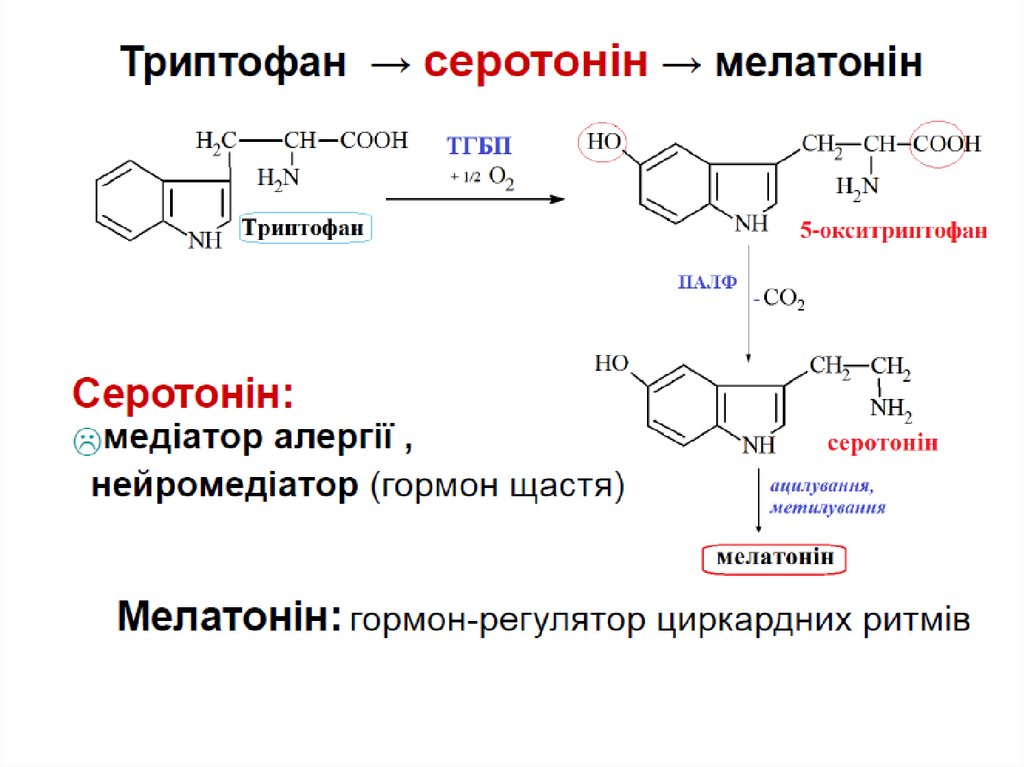
29. Декарбоксилування АК – це процес відщеплення від амінокислоти карбоксильної групи у вигляді СО2 за участі ПАЛФ (віт.В6) та
декарбоксилаз.При цьому утворюються біогенні аміни!!!
α-декарбоксилування
30.
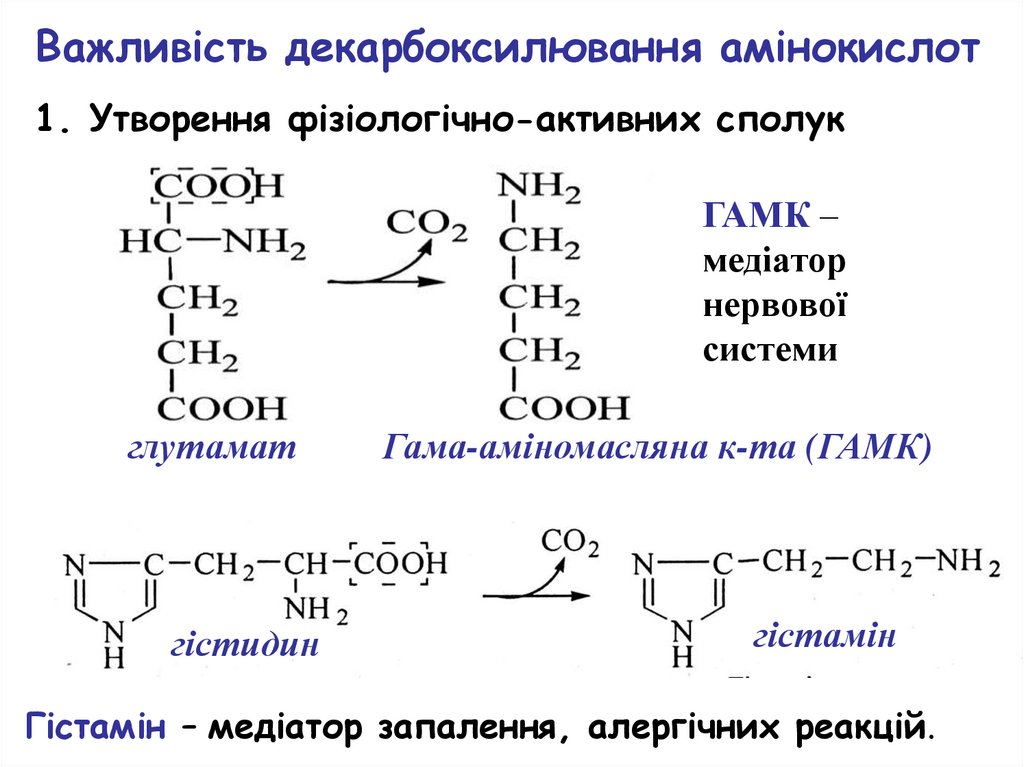
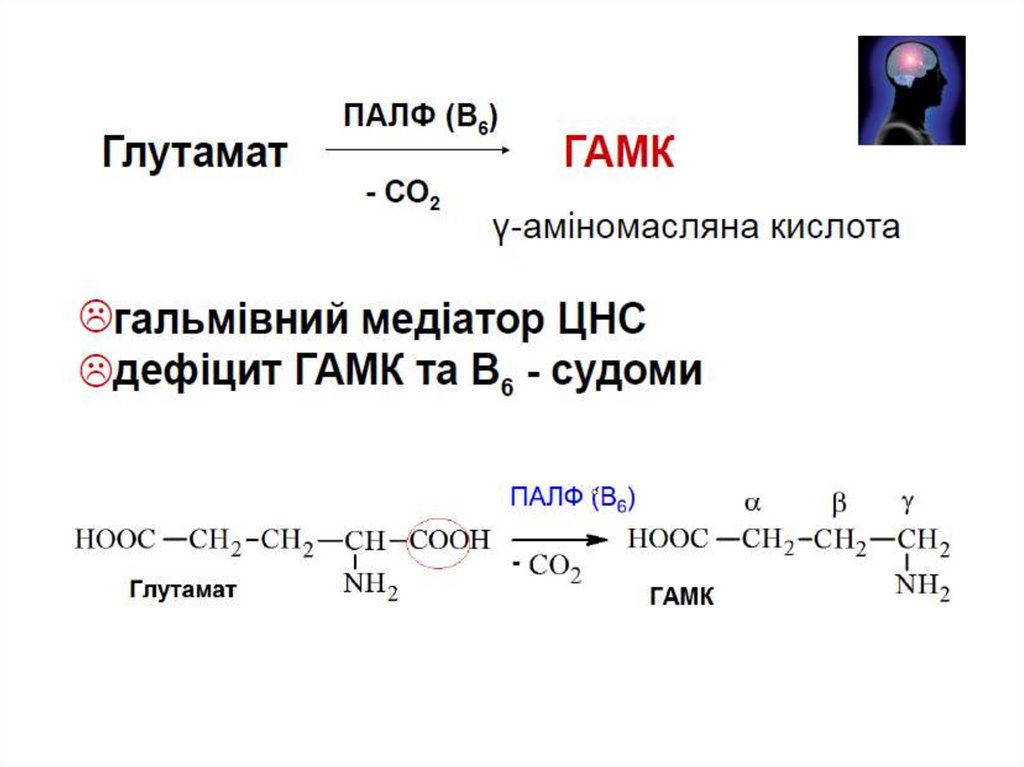
Важливість декарбоксилювання амінокислот1. Утворення фізіологічно-активних сполук
ГАМК –
медіатор
нервової
системи
глутамат
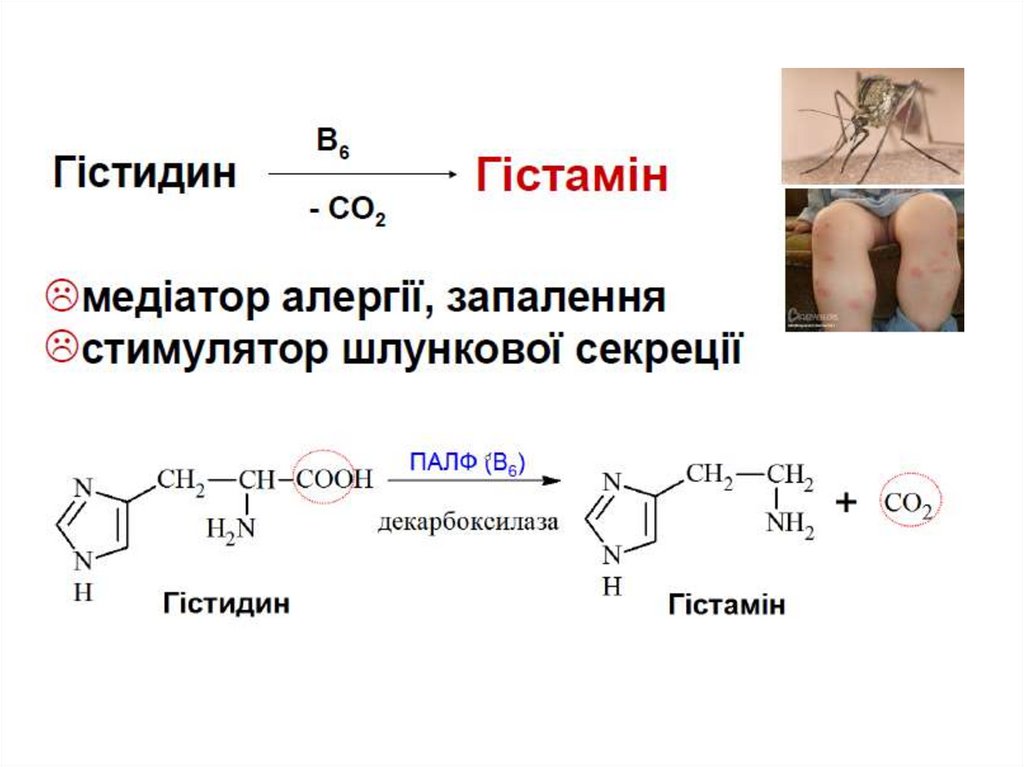
гістидин
Гама-аміномасляна к-та (ГАМК)
гістамін
Гістамін – медіатор запалення, алергічних реакцій.
31.
2. Катаболізм амінокислот під час гниття білківФерменти мікроорганізмів (в товстому кишечнику;
мертві організми) декарбоксилюють амінокислоти
з утворенням диамінів.
орнітин
путресцин
лізин
кадаверин
32.
33.
34.
35.
36.
37.
38.
39.
Трансамінування – це процес переносуаміногрупи (-NH2) з амінокислоти на αкетокислоту за участі ПАЛФ (віт. В6) та
ферментів трансаміназ з утворенням
нової амінокислоти та нової α-кетокислоти.
трансаміназа
Акцепторами NH2-груп виступають:
альфа-кетоглутарат (найчастіше)
піруват
оксалоацетат
Ліз, Тре, Про
не вступають
в трансамінування
40.
41.
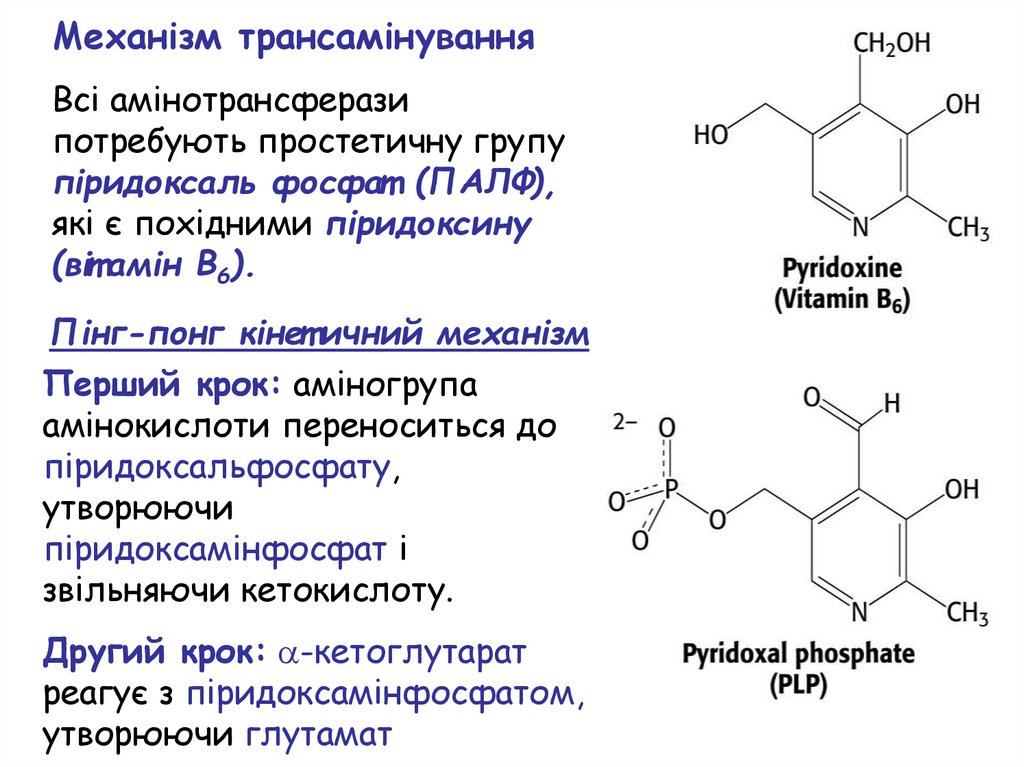
Механізм трансамінуванняВсі амінотрансферази
потребують простетичну групу
піридоксаль фосфат (ПАЛФ),
які є похідними піридоксину
(віт амін B6).
Пінг-понг кінет ичний механізм
Перший крок: аміногрупа
амінокислоти переноситься до
піридоксальфосфату,
утворюючи
піридоксамінфосфат і
звільняючи кетокислоту.
Другий крок: -кетоглутарат
реагує з піридоксамінфосфатом,
утворюючи глутамат
42.
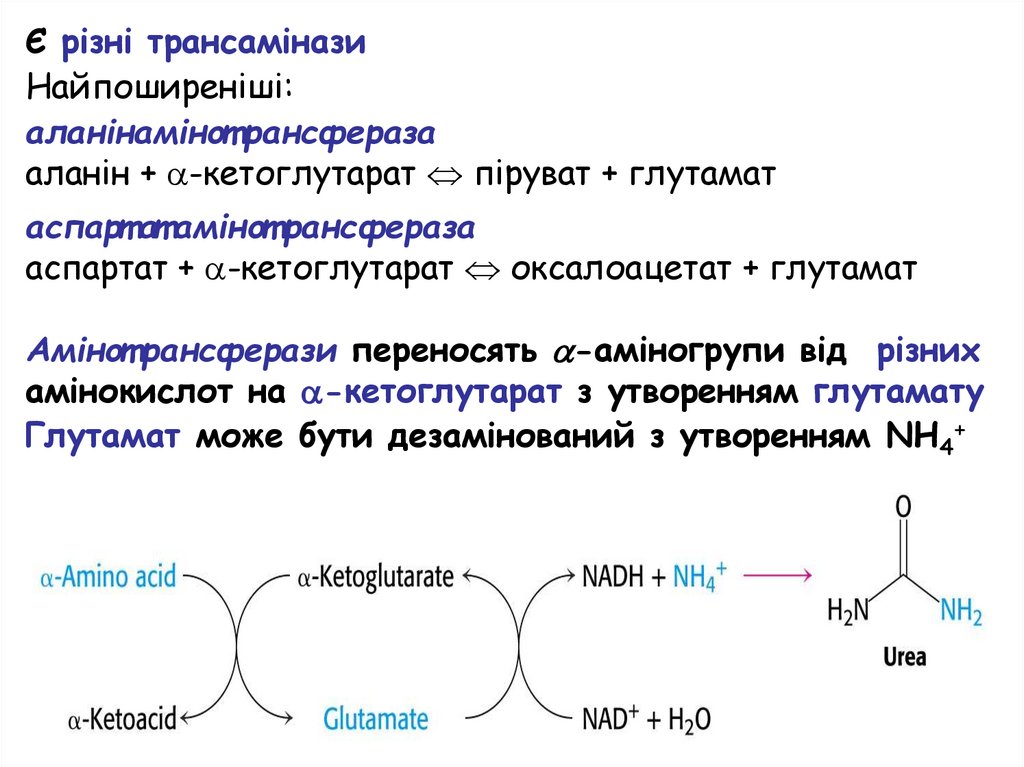
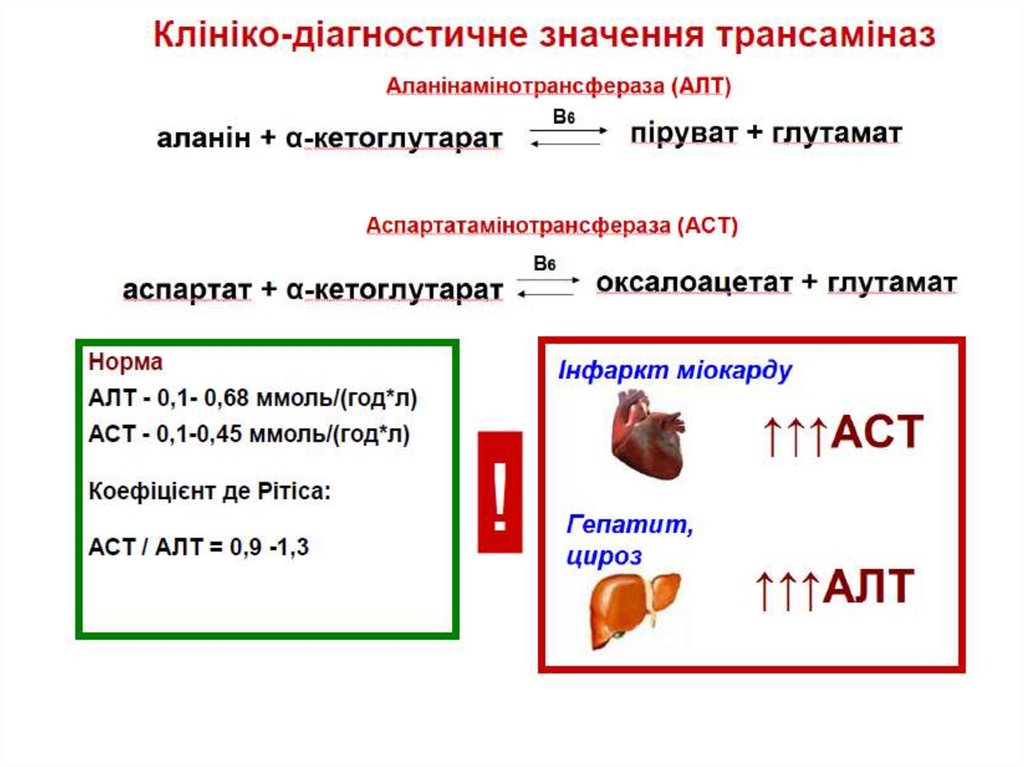
Є різні трансаміназиНайпоширеніші:
аланінамінот рансфераза
аланін + -кетоглутарат піруват + глутамат
аспарт ат амінот рансфераза
аспартат + -кетоглутарат оксалоацетат + глутамат
Амінот рансферази переносять -аміногрупи від різних
амінокислот на -кетоглутарат з утворенням глутамату
Глутамат може бути дезамінований з утворенням NH4+
43.
44.
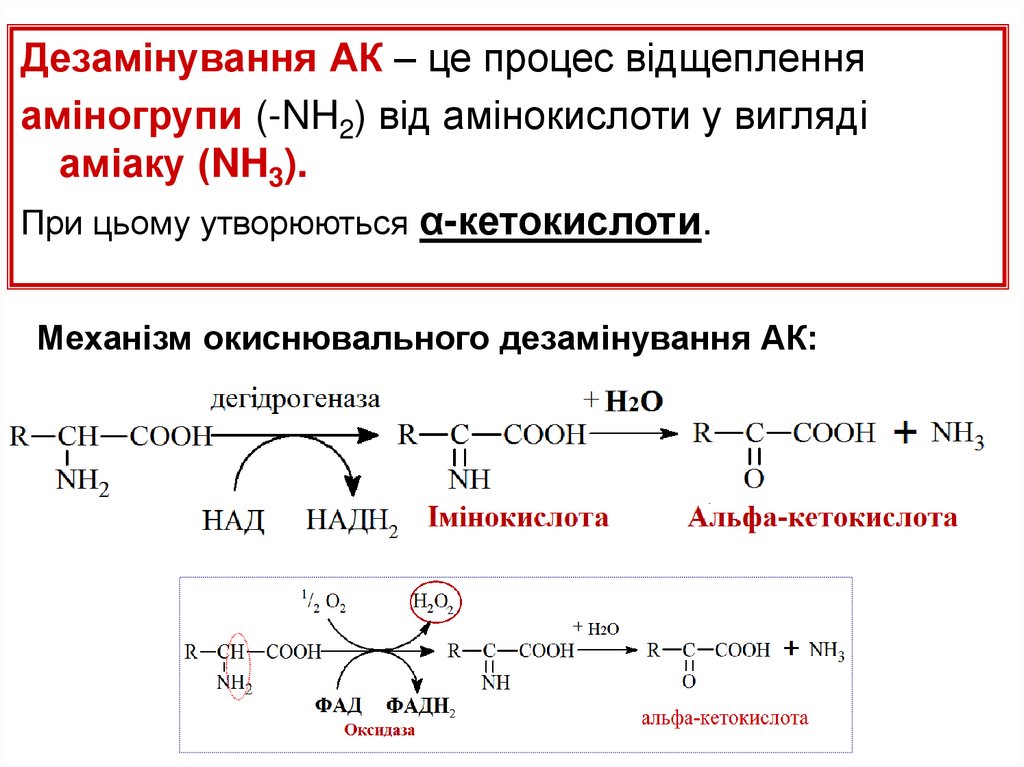
Дезамінування АК – це процес відщепленняаміногрупи (-NH2) від амінокислоти у вигляді
аміаку (NH3).
При цьому утворюються α-кетокислоти.
Механізм окиснювального дезамінування АК:
45.
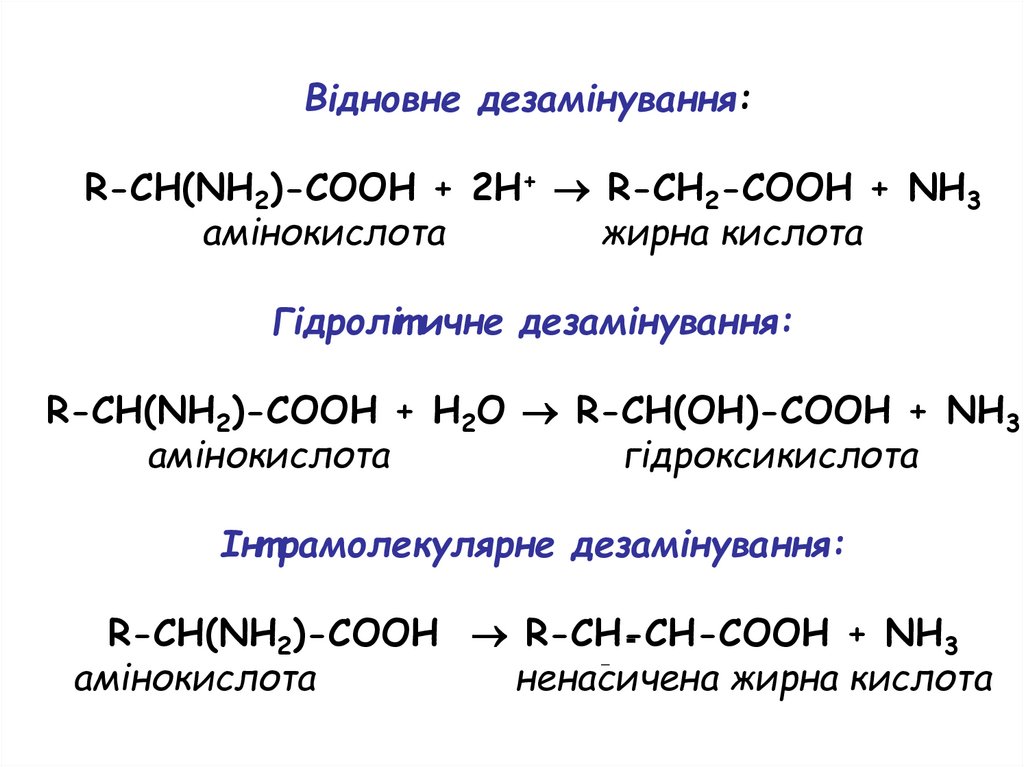
Дезамінування амінокислотДезамінування – виділення
аміногрупи від амінокислоти з
утворенням аміаку.
Чотири типи дезамінування:
- окисне (найбільш важливе),
- відновне,
- гідролітичне, і
- інтрамолекулярне
46.
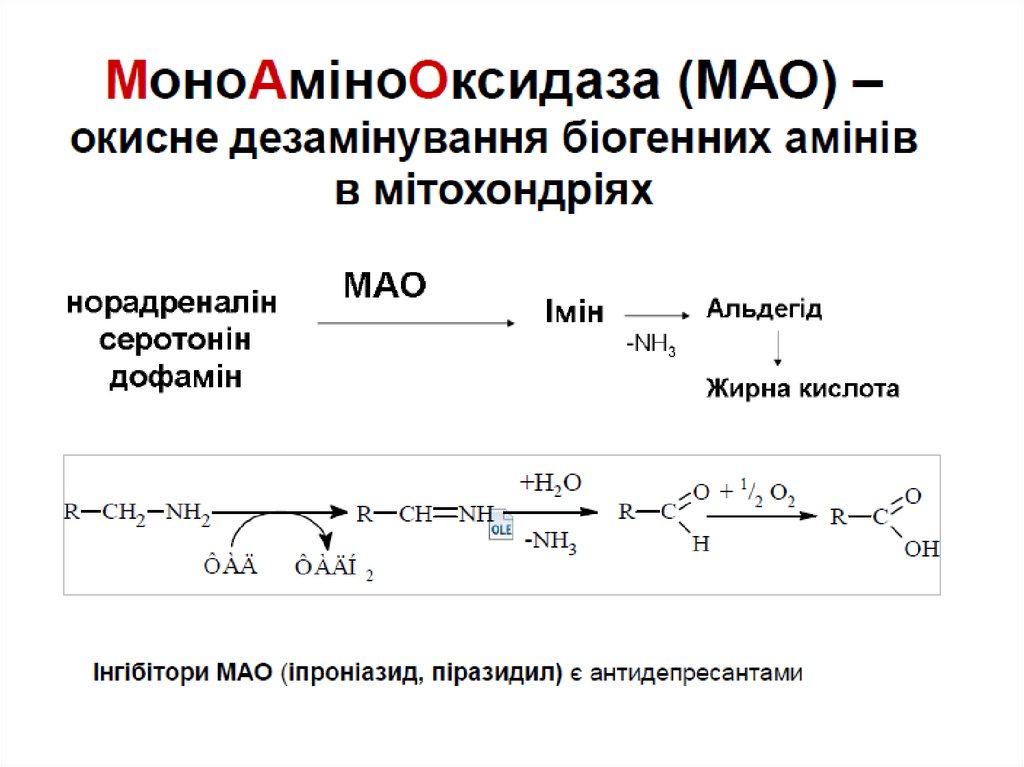
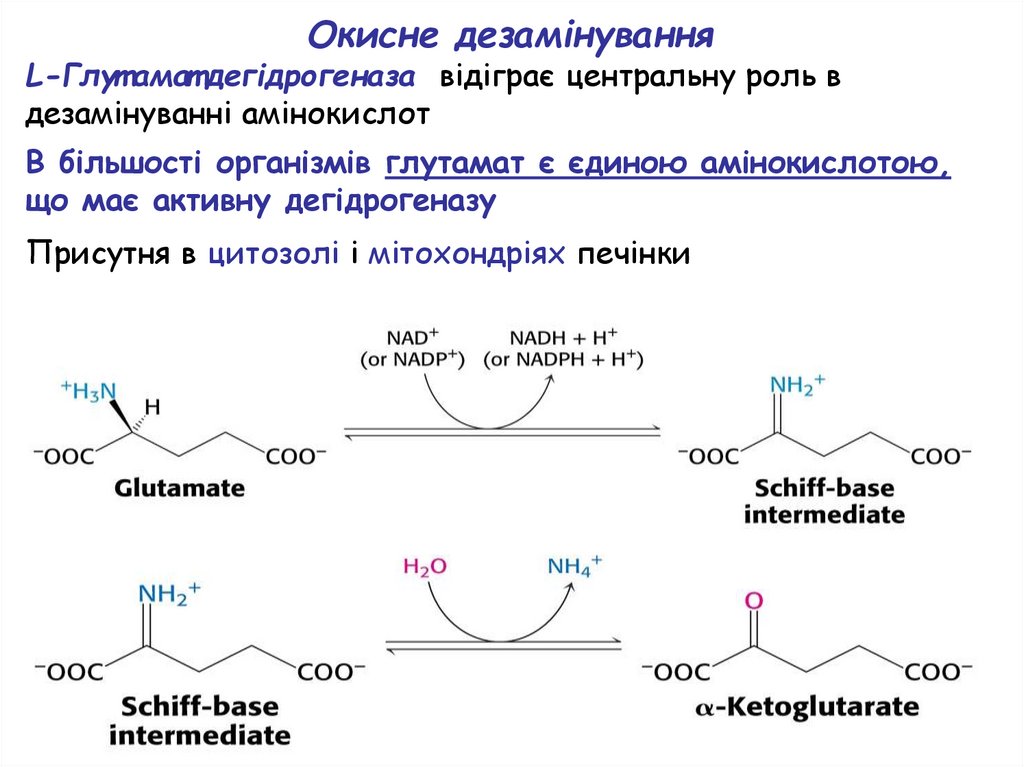
Окисне дезамінуванняL-Глут амат дегідрогеназа відіграє центральну роль в
дезамінуванні амінокислот
В більшості організмів глутамат є єдиною амінокислотою,
що має активну дегідрогеназу
Присутня в цитозолі і мітохондріях печінки
47.
Відновне дезамінування:R-CH(NH2)-COOH + 2H+ R-CH2-COOH + NH3
амінокислота
жирна кислота
Гідроліт ичне дезамінування:
R-CH(NH2)-COOH + H2O R-CH(OH)-COOH + NH3
амінокислота
гідроксикислота
Інт рамолекулярне дезамінування:
R-CH(NH2)-COOH R-CH-CH-COOH + NH3
амінокислота
ненасичена жирна кислота
48.
49.
50.
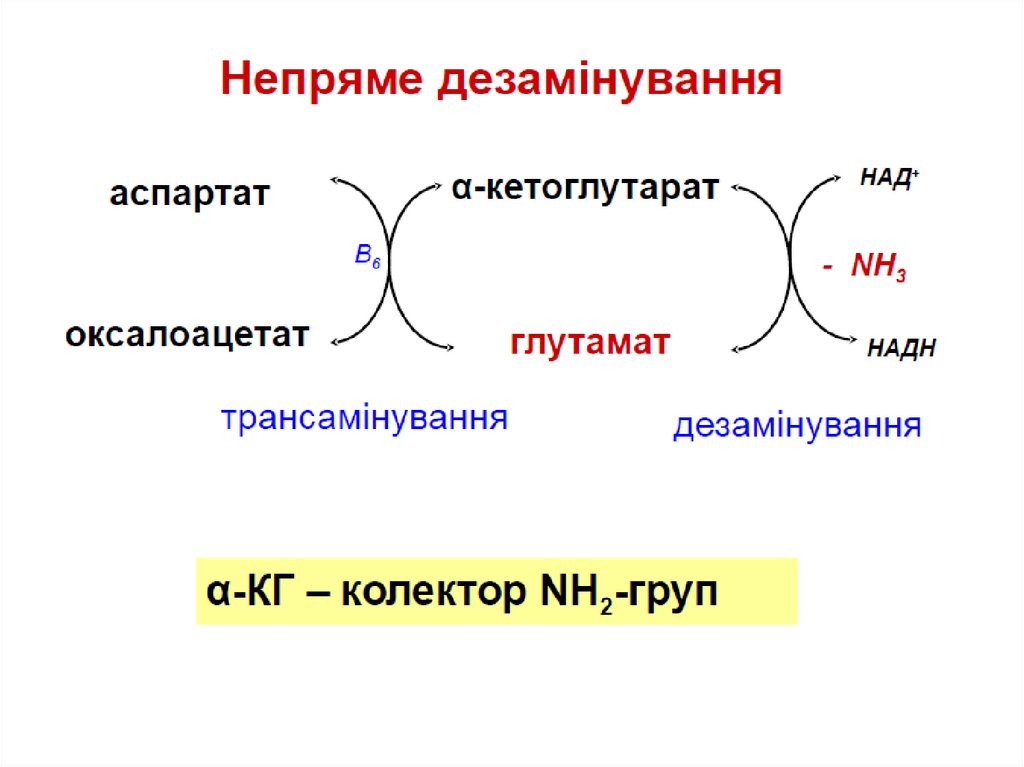
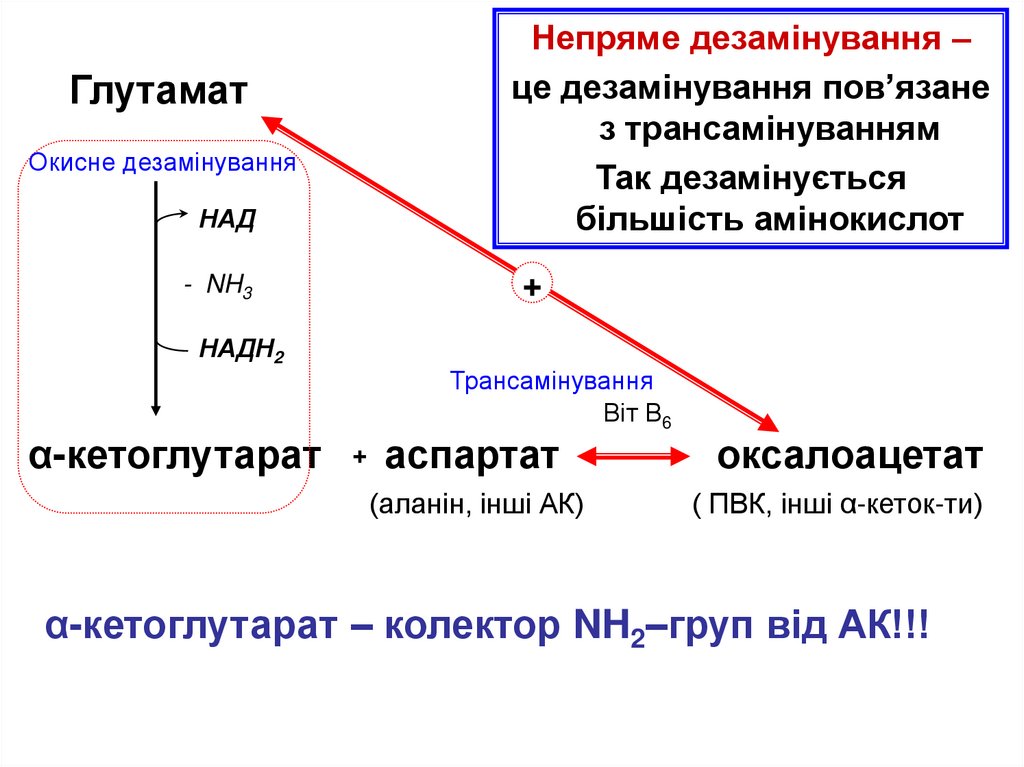
НАДНепряме дезамінування –
це дезамінування пов’язане
з трансамінуванням
Так дезамінується
більшість амінокислот
- NH3
+
Глутамат
Окисне дезамінування
НАДН2
α-кетоглутарат
Трансамінування
Віт В6
+ аспартат
(аланін, інші АК)
оксалоацетат
( ПВК, інші α-кеток-ти)
α-кетоглутарат – колектор NH2–груп від АК!!!
51.
52.
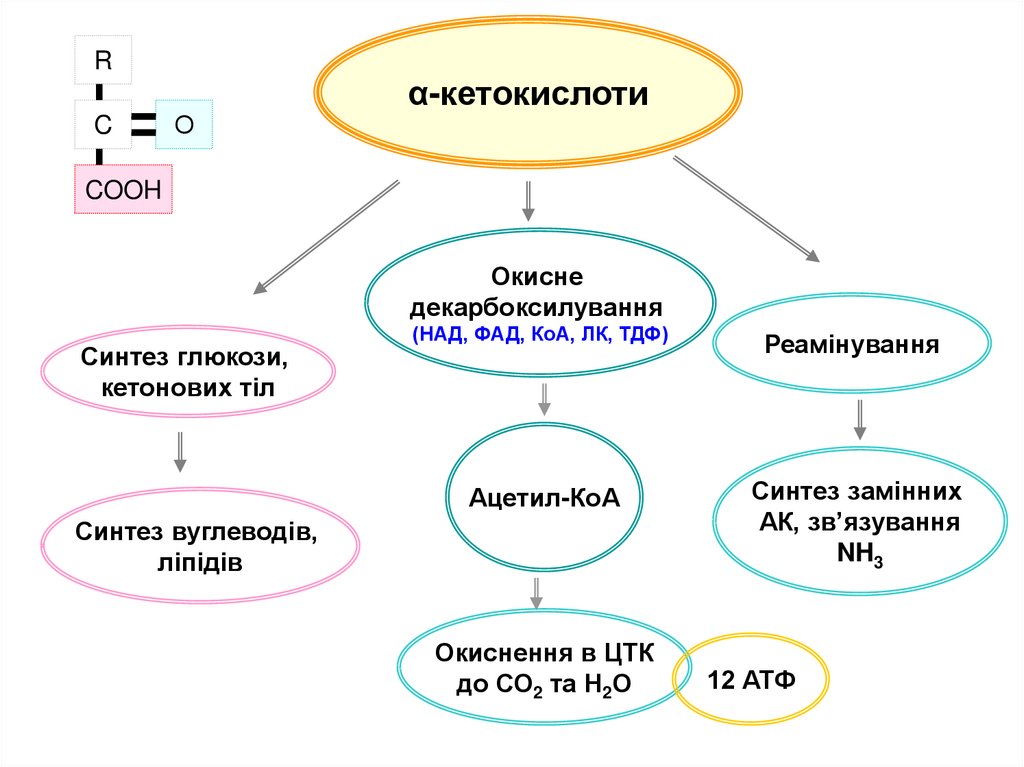
RC
О
α-кетокислоти
COOH
Окисне
декарбоксилування
Синтез глюкози,
кетонових тіл
(НАД, ФАД, КоА, ЛК, ТДФ)
Реамінування
Ацетил-КоА
Синтез замінних
АК, зв’язування
NH3
Синтез вуглеводів,
ліпідів
Окиснення в ЦТК
до СО2 та Н2О
12 АТФ
53.
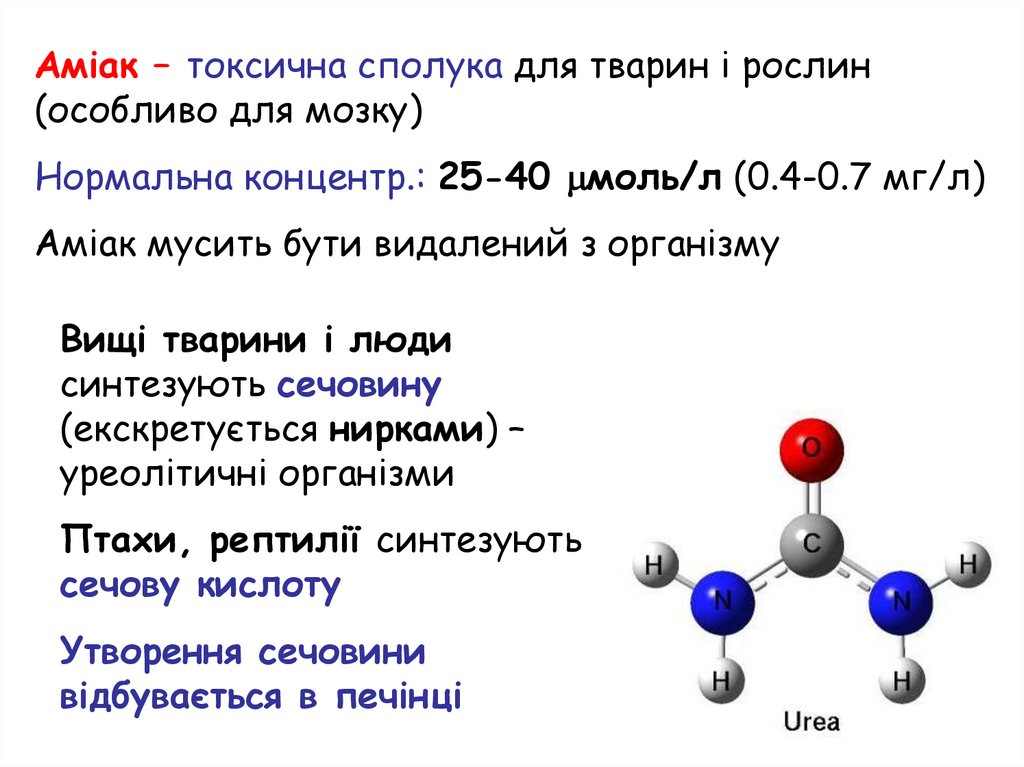
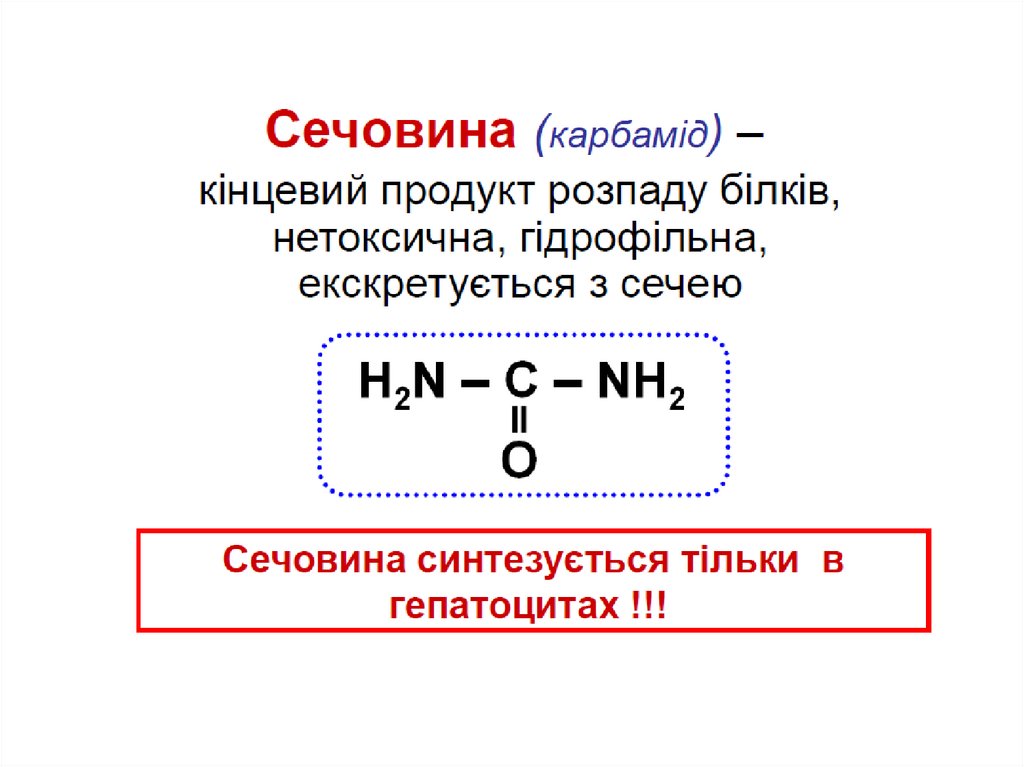
Аміак – токсична сполука для тварин і рослин(особливо для мозку)
Нормальна концентр.: 25-40 моль/л (0.4-0.7 мг/л)
Аміак мусить бути видалений з організму
Вищі тварини і люди
синтезують сечовину
(екскретується нирками) –
уреолітичні організми
Птахи, рептилії синтезують
сечову кислоту
Утворення сечовини
відбувається в печінці
54.
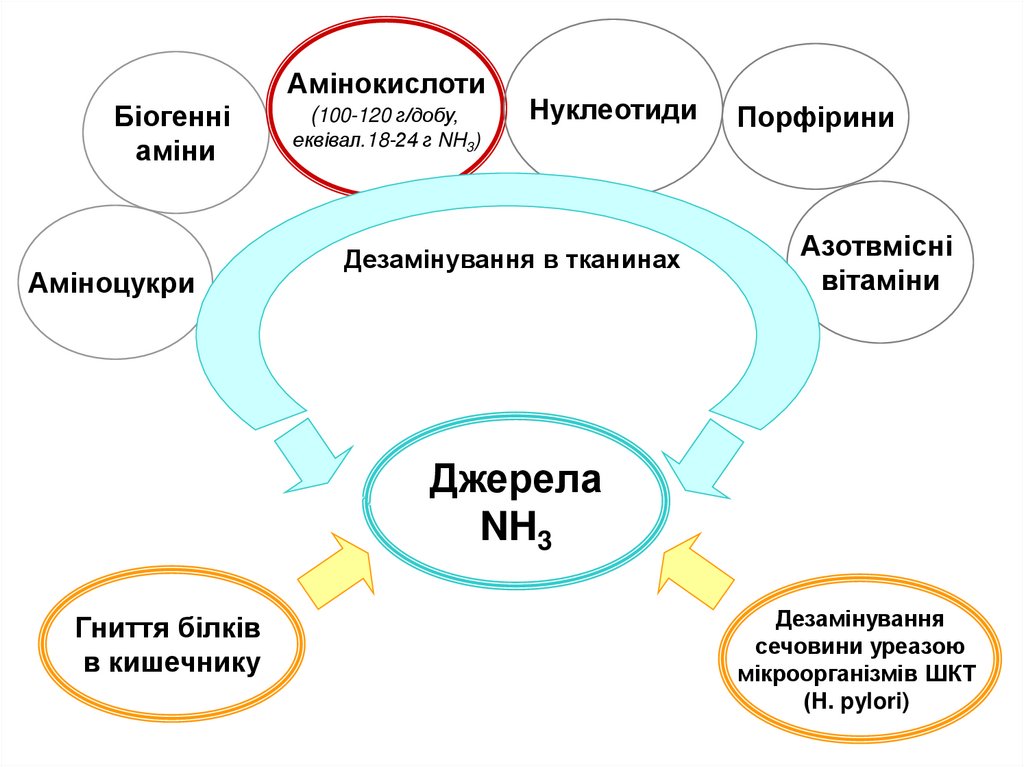
АмінокислотиБіогенні
аміни
Аміноцукри
(100-120 г/добу,
Нуклеотиди
еквівал.18-24 г NH3)
Дезамінування в тканинах
Порфірини
Азотвмісні
вітаміни
Джерела
NH3
Гниття білків
в кишечнику
Дезамінування
сечовини уреазою
мікроорганізмів ШКТ
(Н. pylori)
55.
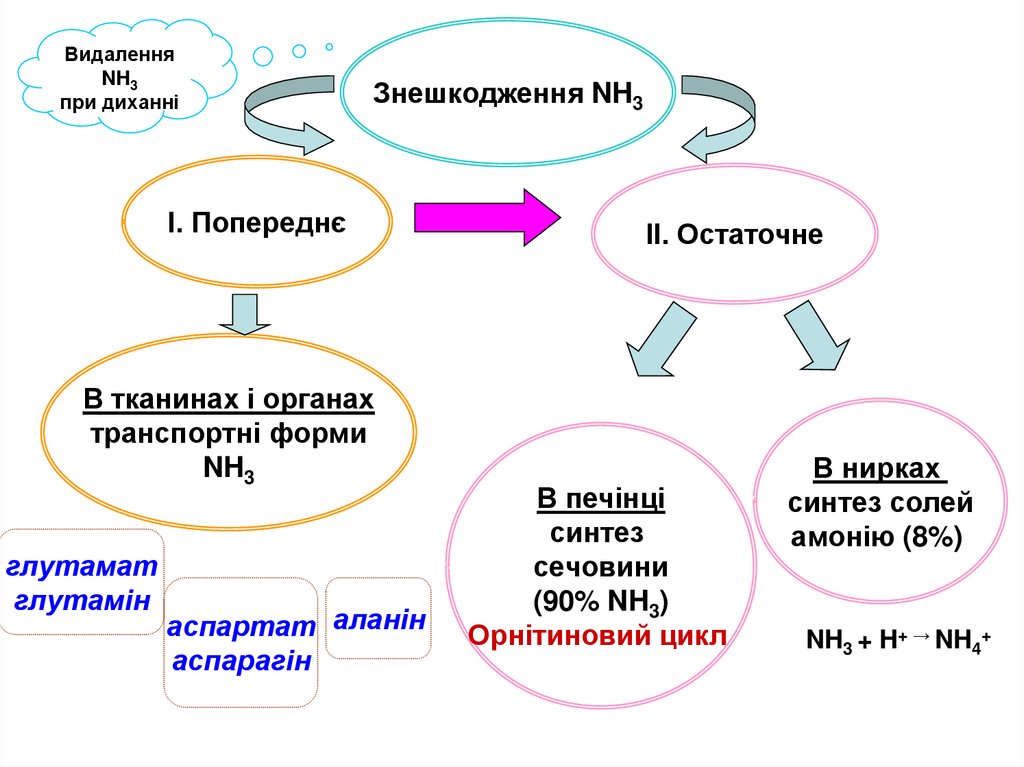
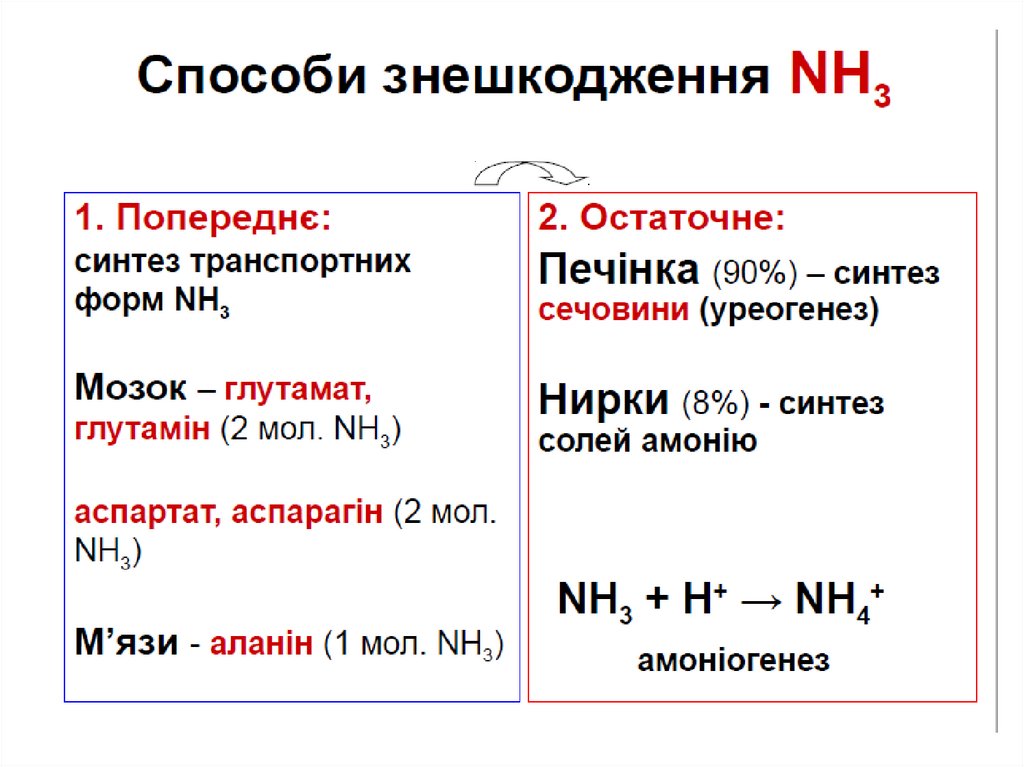
ВидаленняNH3
при диханні
Знешкодження NH3
І. Попереднє
В тканинах і органах
транспортні форми
NH3
глутамат
глутамін
аспартат аланін
аспарагін
ІІ. Остаточне
В печінці
синтез
сечовини
(90% NH3)
Орнітиновий цикл
В нирках
синтез солей
амонію (8%)
NH3 + H+ → NH4+
56.
57.
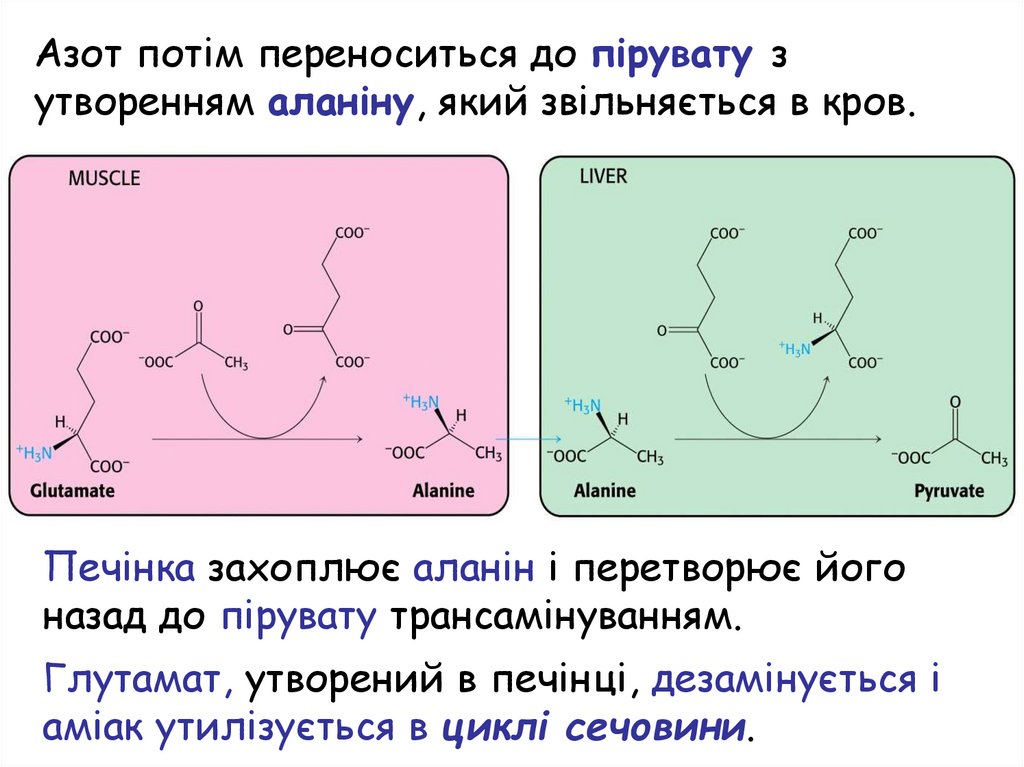
З периферійних тканин азоттранспортується до печінки
Два шляхи транспорту азоту з периферійних
тканин (м’язів) до печінки:
Глутамат не
1. Цикл аланіну. Глутамат
дезамінується в
утворюється шляхом
периферійних
трансамінування
тканинах
58.
Азот потім переноситься до пірувату зутворенням аланіну, який звільняється в кров.
Печінка захоплює аланін і перетворює його
назад до пірувату трансамінуванням.
Глутамат, утворений в печінці, дезамінується і
аміак утилізується в циклі сечовини.
59.
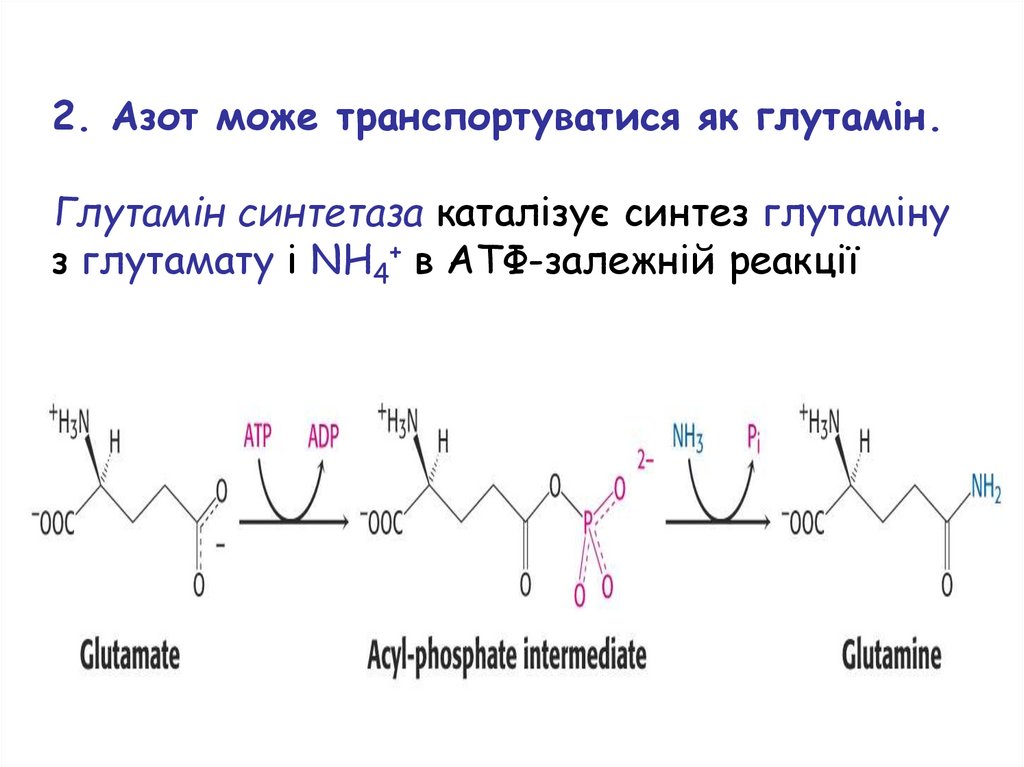
2. Азот може транспортуватися як глутамін.Глутамін синтетаза каталізує синтез глутаміну
з глутамату і NH4+ в ATФ-залежній реакції
60. Транспорт NH3
оксалоацетатα-кетоглутарат
+ NH3
АСТ
В6
НАДН2
НАД
+ АТФ
+ NH3
глутамат
α-кетоглутарат
аспартат
глутамат
+ NH3
піруват
глутамінсинтетаза
+ NH3
АЛТ
В6
+NH3
глутамат
α-кетоглутарат
аланін
+ АТФ
аспарагінсинтетаза
кровотік
глутамін
- NH3
+ Н2О
глутаміназа
глутамат
- NH3
НАД
НАДН2
α-кетоглутарат
аспарагін
- NH3
аланін
+ Н2О
аспарагіназа
АЛТ
В6
аспартат
АСТ
В6
α-кетоглутарат
глутамат
α-кетоглутарат
глутамат
оксалоацетат
піруват
уреогенез
- NH3
- NH3
амоніогенез
61.
62.
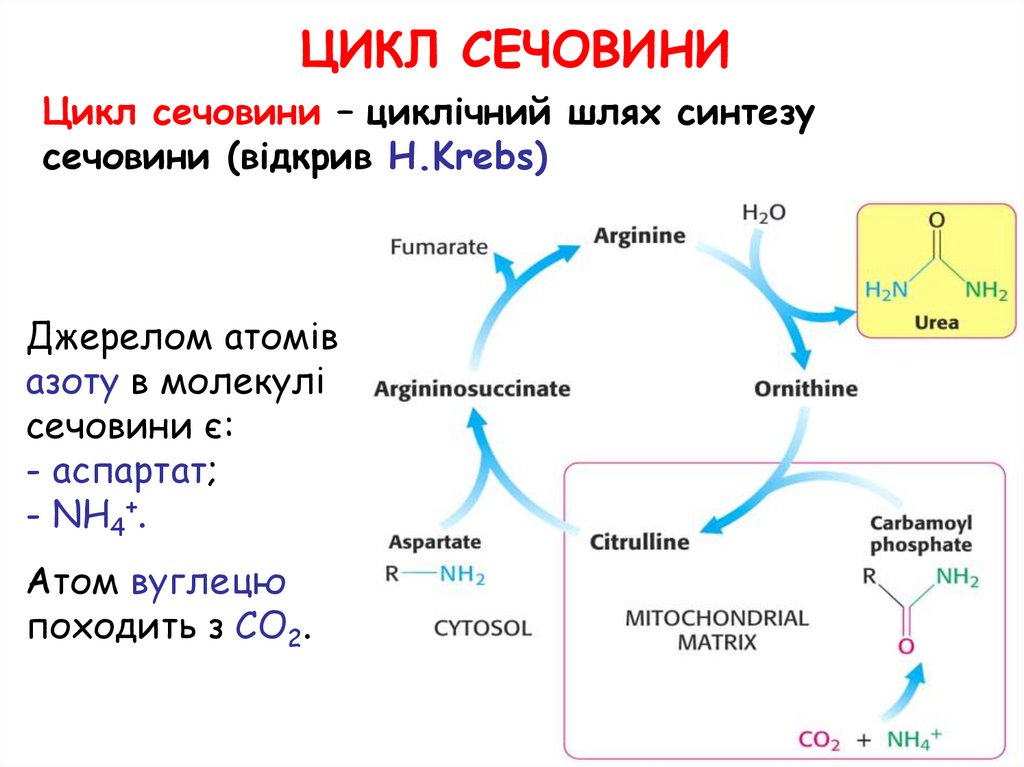
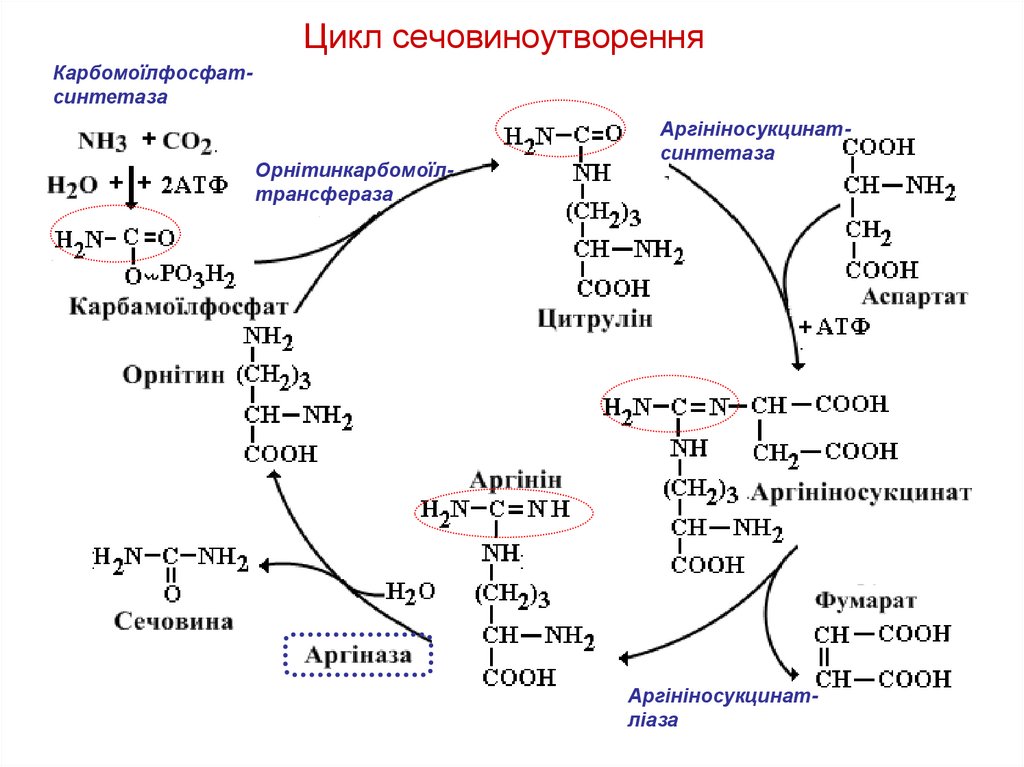
ЦИКЛ СЕЧОВИНИЦикл сечовини – циклічний шлях синтезу
сечовини (відкрив H.Krebs)
Джерелом атомів
азоту в молекулі
сечовини є:
- аспартат;
- NH4+.
Атом вуглецю
походить з CO2.
63.
64.
65.
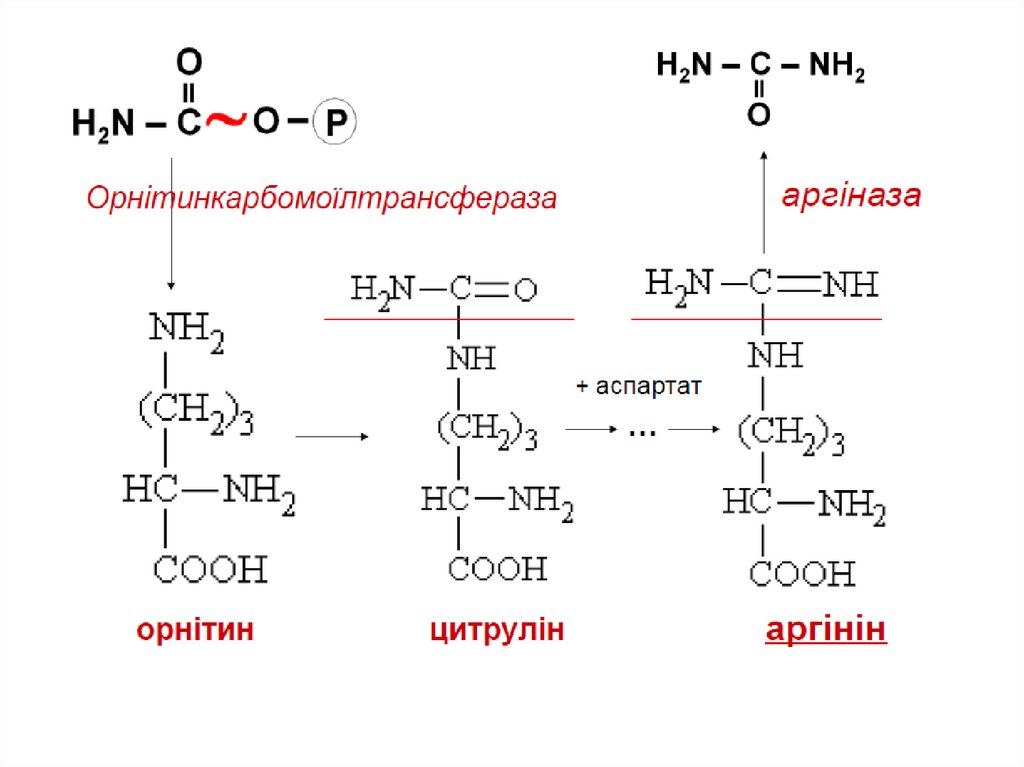
66. Цикл сечовиноутворення
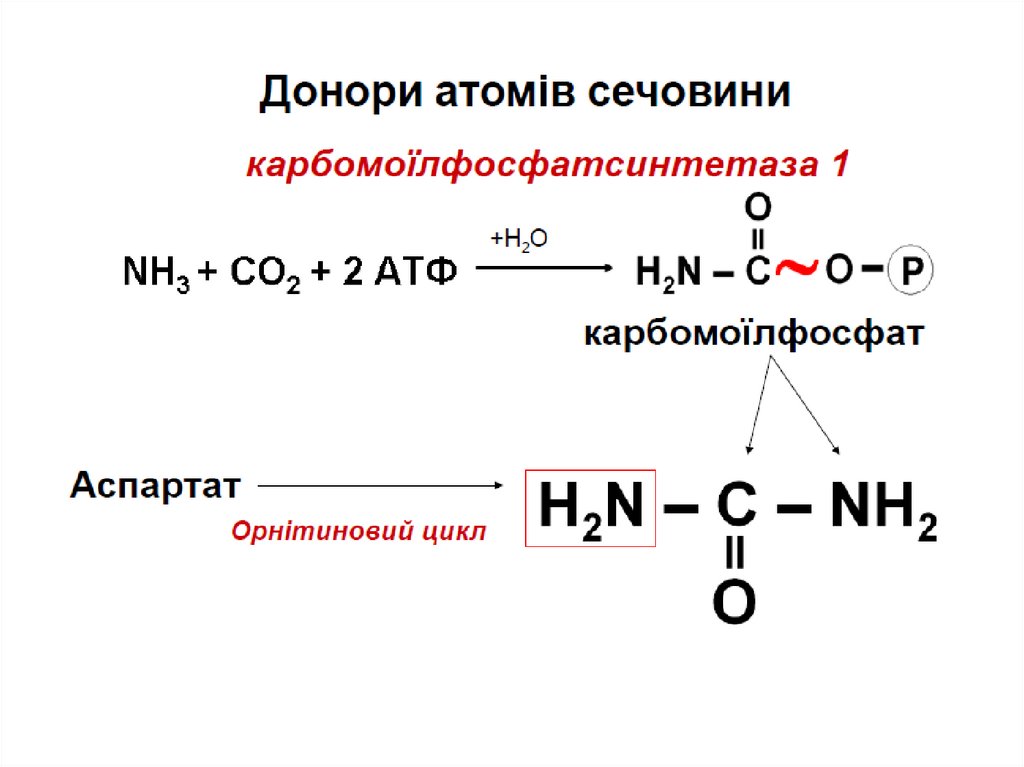
КарбомоїлфосфатсинтетазаОрнітинкарбомоїлтрансфераза
Аргініносукцинатсинтетаза
Аргініносукцинатліаза
67.
Двохколісний велосипед КребсаСечовина
ЦТК
Фумарат
Аргінін
Н2О
Малат
Аргініносукцинат
Орнітин
Карбомоїлфосфат
Цитрулін
НАД
Цикл
фумарової
кислоти
НАДН2
Оксалоацетат
Аспартат
α-кг
глутамат
68.
Зв’язок між циклом сечовини, циклом Кребса ітрансамінуванням оксалоацетату
Фумарат, утворений в циклі сечовини, вступає в
цикл Кребса і перетворюється до оксалоацетату.
Доля оксалоацетату:
(1) Трансамінування до аспартату,
(2) Перетворення в глюкозу,
(3) Конденсація з ацетил CoA з утворенням цитрату,
(4) Перетворення в піруват.
69.
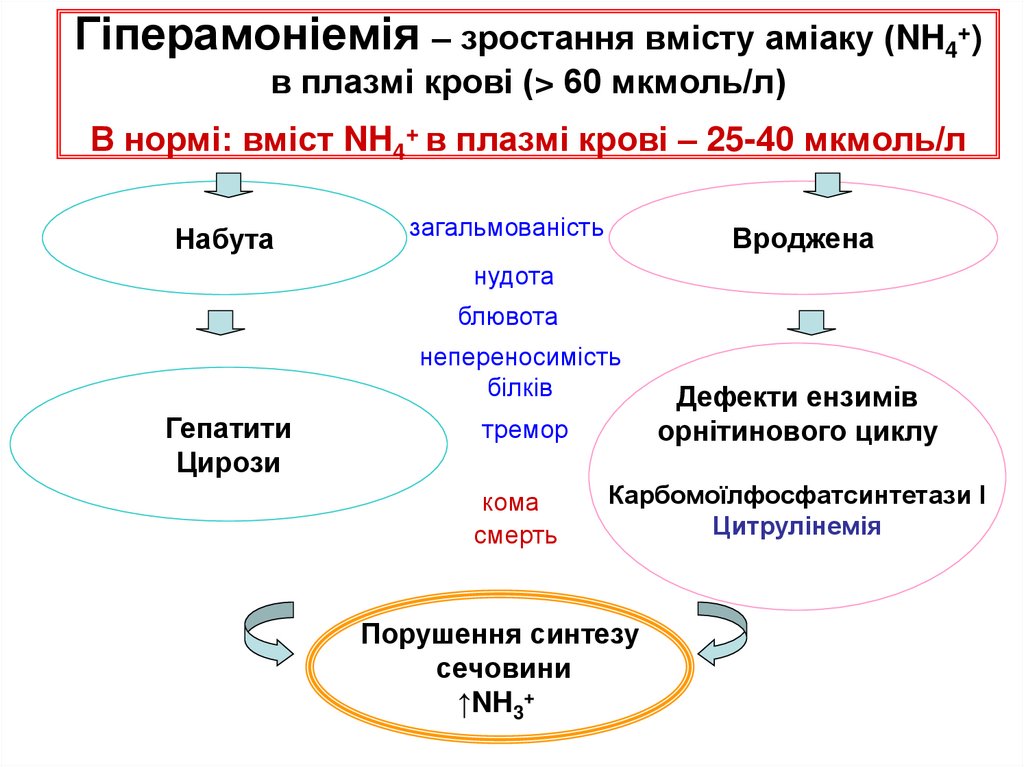
70. Гіперамоніемія – зростання вмісту аміаку (NH4+) в плазмі крові (> 60 мкмоль/л) В нормі: вміст NH4+ в плазмі крові – 25-40
Гіперамоніемія – зростання вмісту аміаку (NH4+)в плазмі крові (> 60 мкмоль/л)
В нормі: вміст NH4+ в плазмі крові – 25-40 мкмоль/л
Набута
загальмованість
Вроджена
нудота
блювота
непереносимість
білків
Гепатити
Цирози
тремор
Дефекти ензимів
орнітинового циклу
кома
смерть
Карбомоїлфосфатсинтетази І
Цитрулінемія
Порушення синтезу
сечовини
↑NH3+
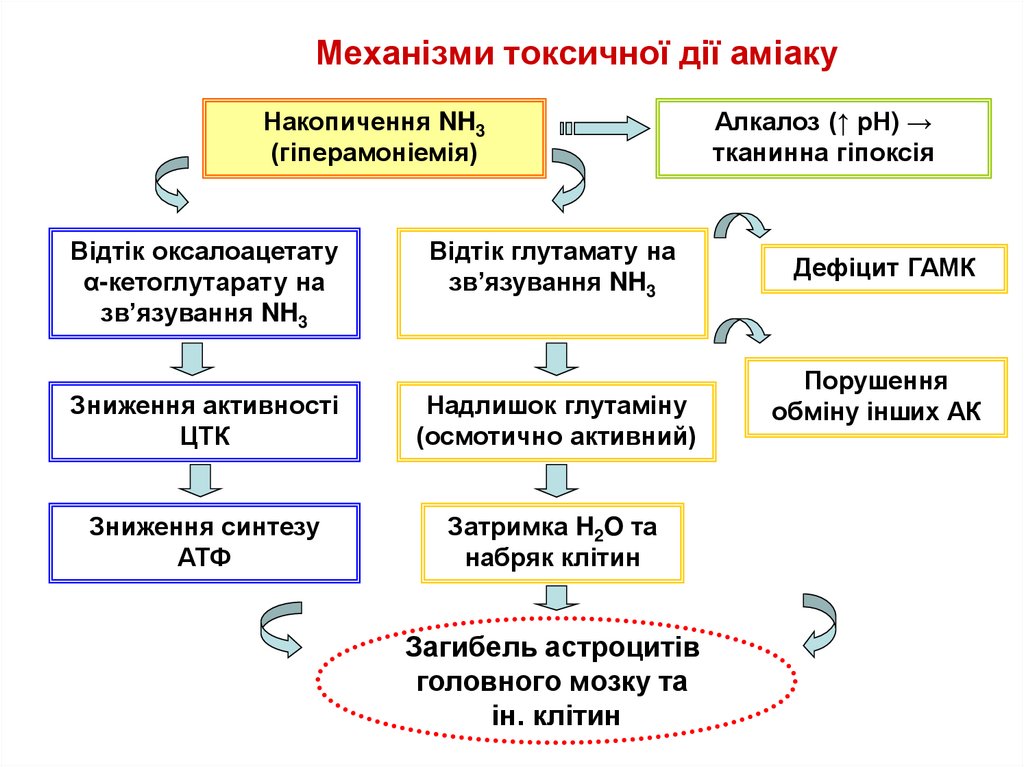
71. Механізми токсичної дії аміаку
Накопичення NH3(гіперамоніемія)
Відтік оксалоацетату
α-кетоглутарату на
зв’язування NH3
Відтік глутамату на
зв’язування NH3
Зниження активності
ЦТК
Надлишок глутаміну
(осмотично активний)
Зниження синтезу
АТФ
Затримка H2O та
набряк клітин
Загибель астроцитів
головного мозку та
ін. клітин
Алкалоз (↑ рН) →
тканинна гіпоксія
Дефіцит ГАМК
Порушення
обміну інших АК
72.
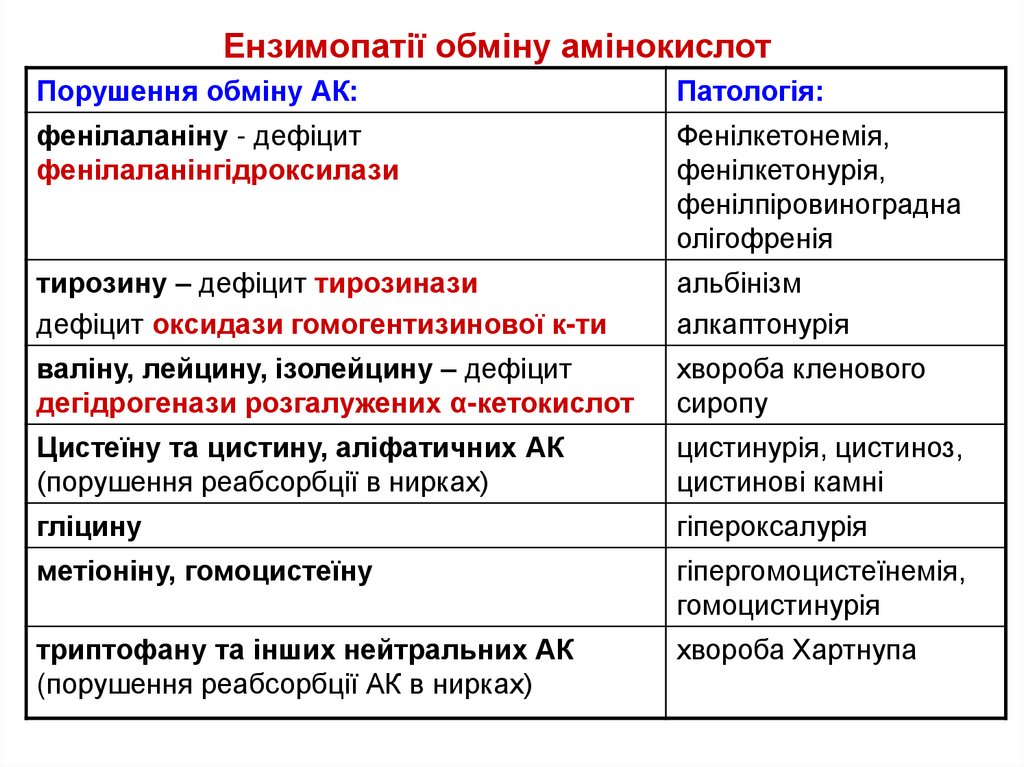
Ензимопатії обміну амінокислотПорушення обміну АК:
Патологія:
фенілаланіну - дефіцит
фенілаланінгідроксилази
Фенілкетонемія,
фенілкетонурія,
фенілпіровиноградна
олігофренія
тирозину – дефіцит тирозинази
дефіцит оксидази гомогентизинової к-ти
альбінізм
алкаптонурія
валіну, лейцину, ізолейцину – дефіцит
дегідрогенази розгалужених α-кетокислот
хвороба кленового
сиропу
Цистеїну та цистину, аліфатичних АК
(порушення реабсорбції в нирках)
цистинурія, цистиноз,
цистинові камні
гліцину
гіпероксалурія
метіоніну, гомоцистеїну
гіпергомоцистеїнемія,
гомоцистинурія
триптофану та інших нейтральних АК
(порушення реабсорбції АК в нирках)
хвороба Хартнупа



























 chemistry
chemistry








