Similar presentations:
Фонд вільних амінокислот
1. Фонд вільних амінокислот
Фонд вільних амінокислот організмускладає приблизно 35 г. Вміст вільних
амінокислот у крові в середньому дорівнює 35 65 мг/дл.
Більша частина амінокислот входить до
складу білків, кількість яких в організмі дорослої
людини нормальної статури складає приблизно
15 кг.
2. Джерела амінокислот
1. Білки корму (екзогенні амінокислоти).2. Білки тканин при розпаді в процесі їх
оновлення (за участі ферментів катепсинів)
– ендогенні амінокислоти.
3. Синтез замінних амінокислот з інших
сполук (ендогенні амінокислоти).
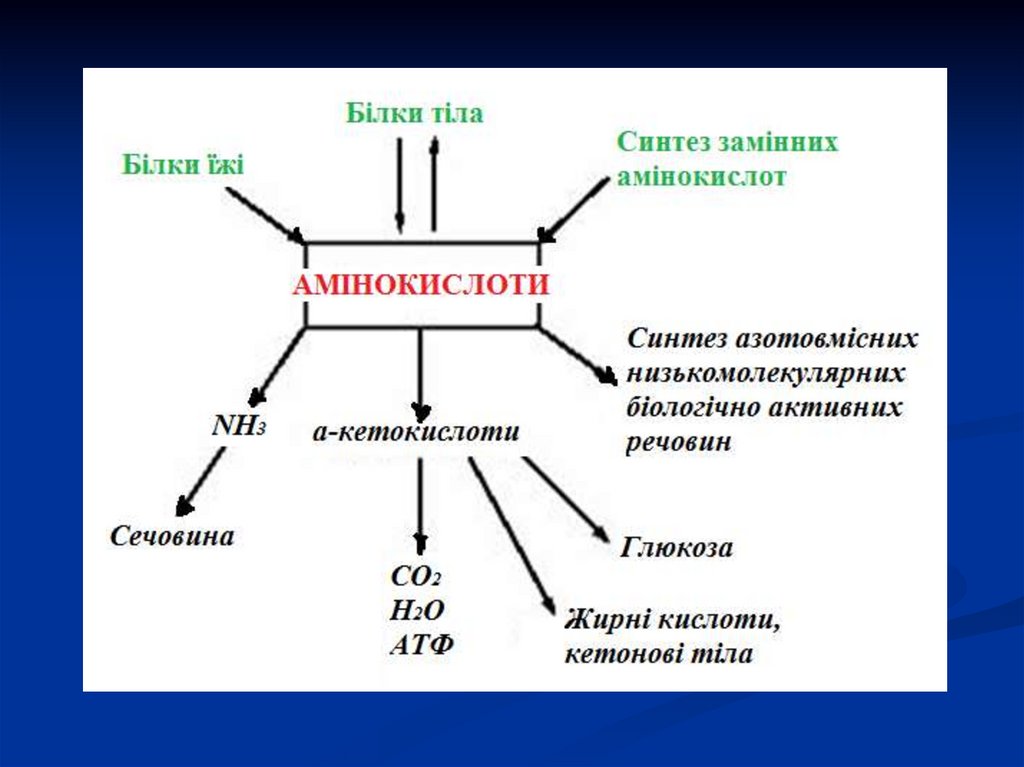
3. Шляхи використання амінокислот в організмі
Біосинтез білків, специфічних для даногоорганізму.
Синтез біологічно активних речовин
(ферментів, гормонів, деяких вітамінів та ін.).
Синтез вуглеводів, ліпідів.
Окиснення для отримання енергії (при
окисненні 1 г білку виділяється 17,1 кДж
енергії).
4.
5. КАТАБОЛІЗМ АМІНОКИСЛОТ
Амінокислоти, які утворилися в результатіперетравлення білків і потрапили в клітини
тканин, підлягають катаболізму та анаболізму, а
також специфічним реакціям, в результаті яких
синтезуються біологічно активні сполуки.
Катаболізм більшості амінокислот починається з
відщеплення
α-аміногрупи.
Амінокислота
втрачає аміногрупу в результаті двох типів
реакцій: трансамінування, дезамінування.
6. Дезамінування
Найбільш розповсюдженим видом перетворенняамінокислот є їх дезамінування з утворенням
кетокислот і амоніаку.
Амоніак є токсичним для ЦНС, тому в організмі
людини і ссавців він перетворюється в нетоксичну
добре розчинну сполуку — сечовину.
Існує декілька шляхів дезамінування:
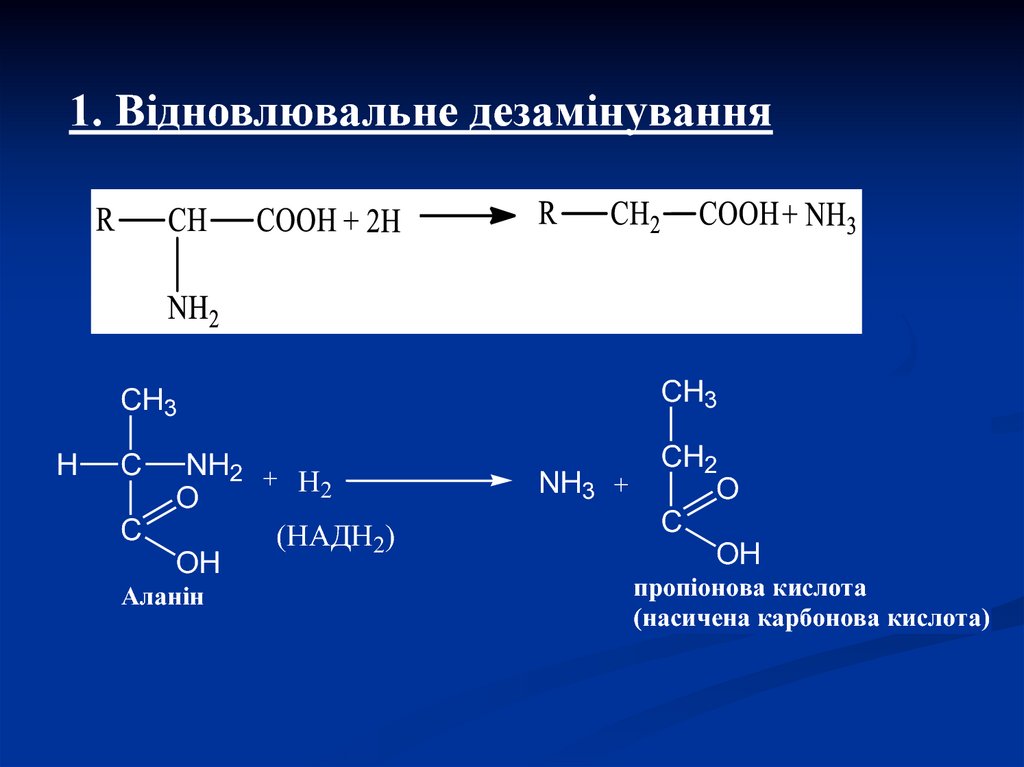
7.
1. Відновлювальне дезамінуванняH
CH3
CH3
C
CH2
O
C
OH
C
NH2 +
Н2
O
(НАДН2)
OH
Аланін
NH3 +
пропіонова кислота
(насичена карбонова кислота)
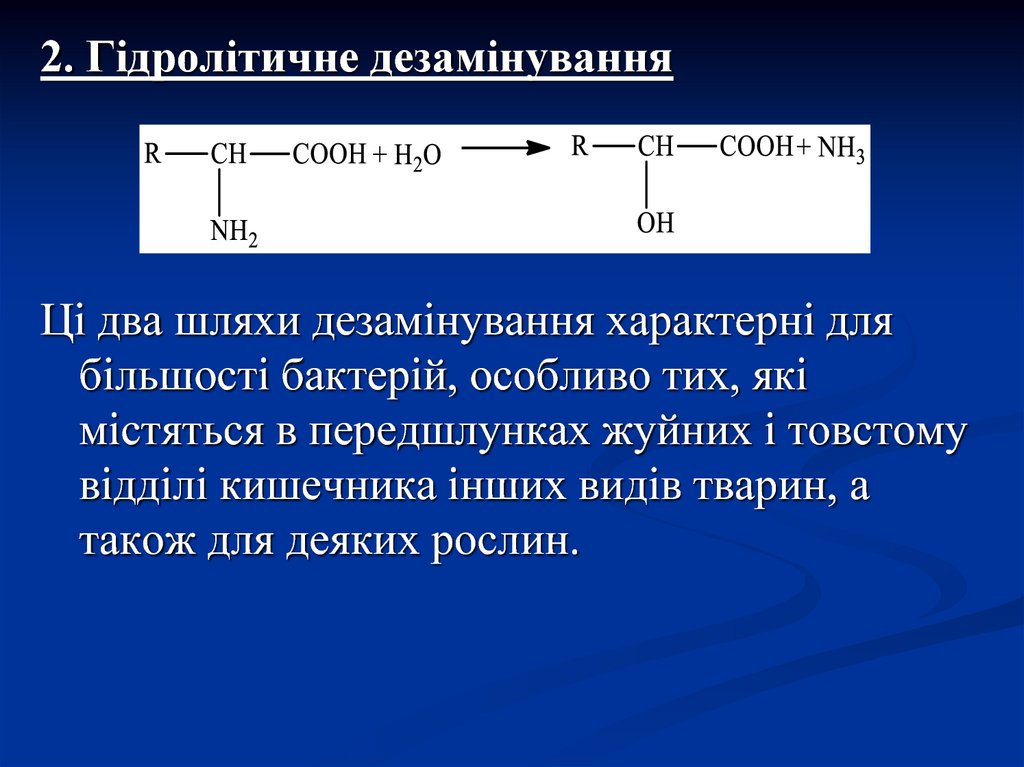
8.
2. Гідролітичне дезамінуванняЦі два шляхи дезамінування характерні для
більшості бактерій, особливо тих, які
містяться в передшлунках жуйних і товстому
відділі кишечника інших видів тварин, а
також для деяких рослин.
9.
3. Внутрішньомолекулярне дезамінуванняЦей вид дезамінування є характерним для деяких
рослин і бактерій, а в тваринному організмі таким
шляхом дезамінується тільки амінокислота гістидин.
Для цього існує і виділений у чистому вигляді фермент
гістидиндезаміназа, яка дезамінує цю амінокислоту з
утворенням амоніаку та уроканінової кислоти. Є
припущення, що реакція відбувається в нирках за
наступною схемою:
10.
OH2N
CH
C
O
OH
CH
CH2
N
NH
Гістидин
В
C
OH + NH3
CH
N
NH
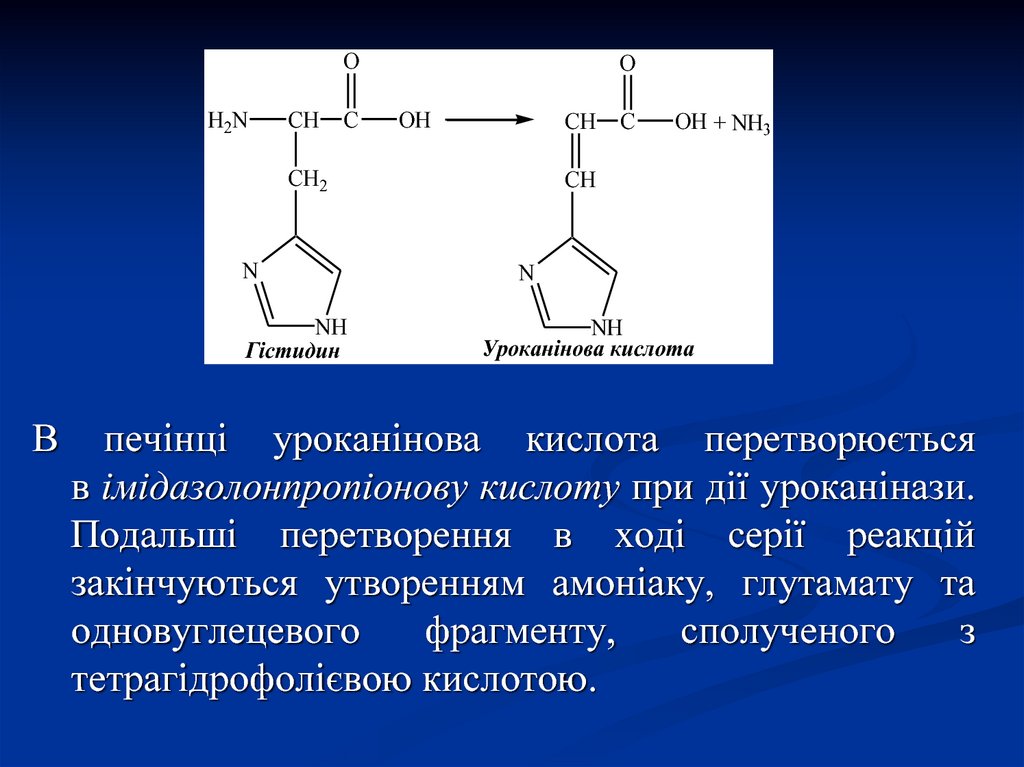
Уроканінова кислота
печінці уроканінова кислота перетворюється
в імідазолонпропіонову кислоту при дії уроканінази.
Подальші перетворення в ході серії реакцій
закінчуються утворенням амоніаку, глутамату та
одновуглецевого
фрагменту,
сполученого
з
тетрагідрофолієвою кислотою.
11.
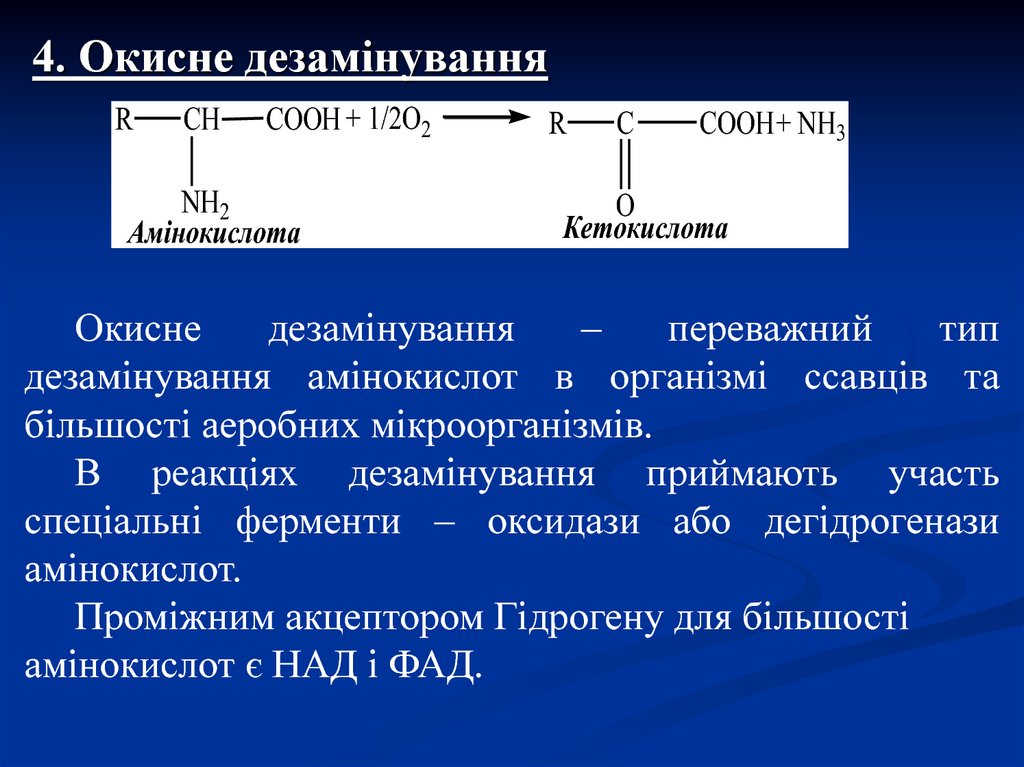
4. Окисне дезамінуванняR
CH
COOH + 1/2O2
NH2
Амінокислота
R
C
COOH + NH3
O
Кетокислота
Окисне
дезамінування
–
переважний
тип
дезамінування амінокислот в організмі ссавців та
більшості аеробних мікроорганізмів.
В реакціях дезамінування приймають участь
спеціальні ферменти – оксидази або дегідрогенази
амінокислот.
Проміжним акцептором Гідрогену для більшості
амінокислот є НАД і ФАД.
12.
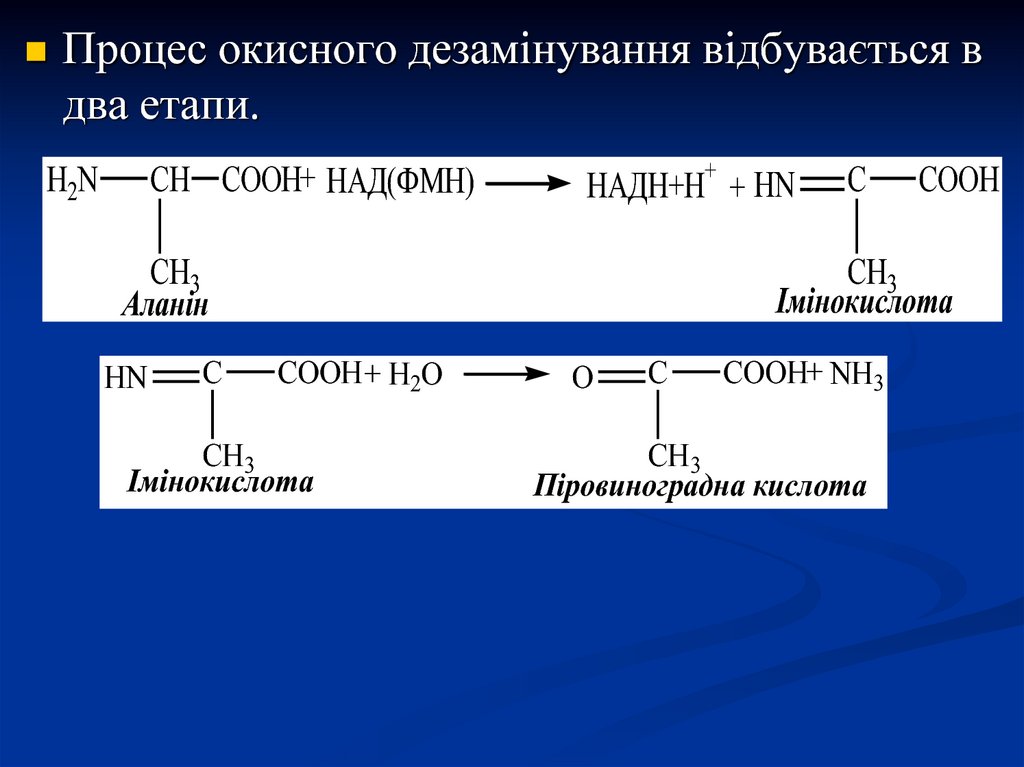
Процес окисного дезамінування відбувається вдва етапи.
CH COOH+ НАД(ФМН)
H2N
+
НАДН+Н + HN
CH3
Аланін
HN
C
C
COOH
CH3
Імінокислота
COOH + H2O
CH3
Імінокислота
O
C
COOH+ NH3
CH3
Піровиноградна кислота
13.
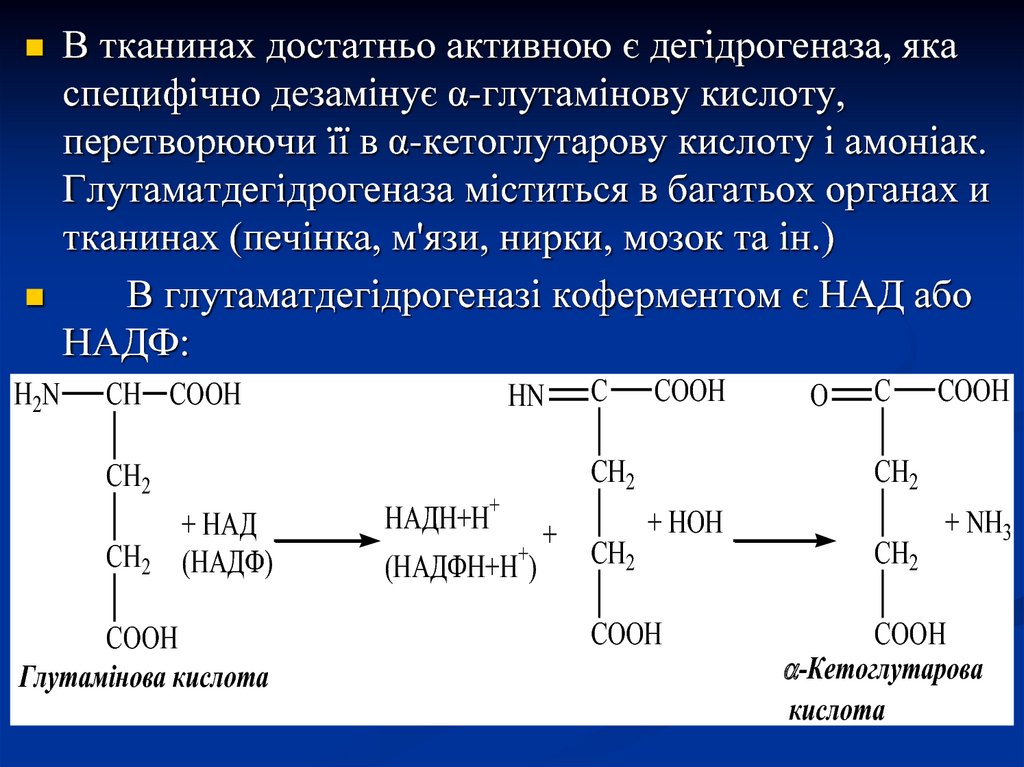
H2NВ тканинах достатньо активною є дегідрогеназа, яка
специфічно дезамінує α-глутамінову кислоту,
перетворюючи її в α-кетоглутарову кислоту і амоніак.
Глутаматдегідрогеназа міститься в багатьох органах и
тканинах (печінка, м'язи, нирки, мозок та ін.)
В глутаматдегідрогеназі коферментом є НАД або
НАДФ:
CH COOH
CH2
CH2
+ НАД
(НАДФ)
COOH
Глутамінова кислота
HN
C
COOH
CH2
НАДН+Н+
+
(НАДФН+Н )
+
CH2
O
C
COOH
CH2
+ HOH
COOH
CH2
+ NH3
COOH
-Кетоглутарова
кислота
14. Трансамінування – непрямий шлях дезамінування
Трансамінування ‒ реакція перенесенняα-аміногрупи з амінокислоти на α-кетокислоту,
в
результаті
чого
утворюються
нова
кетокислота і нова амінокислота. Процес
трансамінування є легко зворотним.
Реакції каталізують ферменти амінотрансферази,
коферментом яких є піридоксальфосфат (ПФ)
— похідне вітаміну В6 (піридоксину).
15.
Найчастіше за все в реакціях трансамінуванняприймають участь амінокислоти, вміст яких у
тканинах значно вище за інших ‒ глутамат, аланін,
аспартат та відповідні їм кетокислоти –
α-кетоглутарат, піруват і оксалоацетат. Основним
донором аміногрупи є глутамат.
Акцептором аміногрупи любої амінокислоти, яка
підлягає трансамінуванню, є α-кетоглутарат.
Приймаючи аміногрупу, він перетворюється в глутамат,
який здатний передавати цю групу любій
α-кетокислоті з утворенням іншої амінокислоти.
16.
COOHCOOH
CH3
CH2
+
CH2
C
COOH
O
COOH
-Кетоглутарат
CH
Аланін
CH2
NH2
Амінотрансфераза
CH3
C
CH2
O
+
CH
NH2
COOH
ПВК
COOH
Глутамінова
кислота
Вступати в реакції трансамінування можуть майже
всі амінокислоти, за винятком лізину, треоніну та
проліну.
17. Специфічність амінотрансфераз
Для амінотрансфераз характерною є субстратнаспецифічність до різних амінокислот. В тканинах
людини виявлено більше 10 різних амінотрансфераз.
Найбільш
розповсюдженими
ферментами
в
більшості тканин ссавців є аланінамінотрансфераза
(АЛТ) і аспартатамінотрансфераза (ACT).
18. Аланінамінотрансфераза
АЛТ (АлАТ) каталізує реакцію трансамінування міжаланіном і α-кетоглутаратом.
Локалізований цей фермент у цитозолі клітин багатьох
органів, але найбільша його кількість виявлена в
клітинах печінки та серцевого м'язу.
19. Аспартатамінотрансфераза
ACT (АсАТ) каталізує реакцію трансамінування міжаспартатом та α-кетоглутаратом аналогічно
попередній.
В результаті утворюються оксалоацетат і глугамат.
ACT
має
як
цитоплазматичну,
так
і
мітохондріальну форми. Найбільша кількість
цього ферменту виявлено в клітинах серцевого
м'язу та печінки.
При інфаркті міокарду відзначають значне
підвищення активності АСТ, а при захворюваннях
печінки збільшується активність АЛТ.
20. Біологічне значення трансамінування
Реакції трансамінування відіграють велику роль вобміні амінокислот. Оскільки цей процес є
зворотним,
ферменти
амінотрансферази
функціонують як в процесах катаболізму, так і
біосинтезу амінокислот. Трансамінування ‒
заключний етап синтезу замінних амінокислот із
відповідних кетокислот, якщо вони в даний момент
необхідні клітинам. В результаті відбувається
перерозподіл амінного Нітрогену в тканинах
організму.
Трансамінування ‒ перша стадія дезамінування
більшості амінокислот, тобто початковий етап їх
катаболізму.
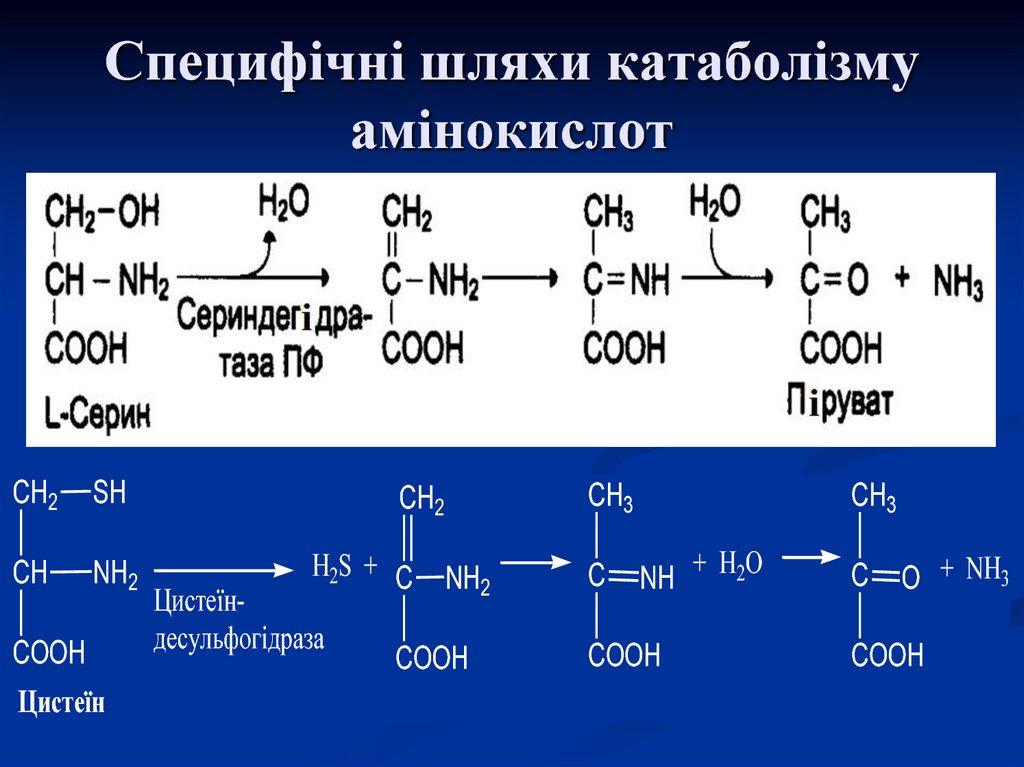
21. Специфічні шляхи катаболізму амінокислот
CH2SH
CH
NH2
COOH
Цистеїн
CH3
CH2
Н2S + C
Цистеїндесульфогідраза
NH2
COOH
C
CH3
NH + Н2О
COOH
C
O + NH3
COOH
22. Синтез креатиніну
Креатин є необхідним для утворення в м'язахвисокоенергетичної сполуки – креатинфосфату.
Синтез креатину проходить у 2 стадії за участі
3 амінокислот: аргініну, гліцину та метионіну.
В нирках утворюється гуанідинацетат при дії
гліцинамідинотрансферази.
23.
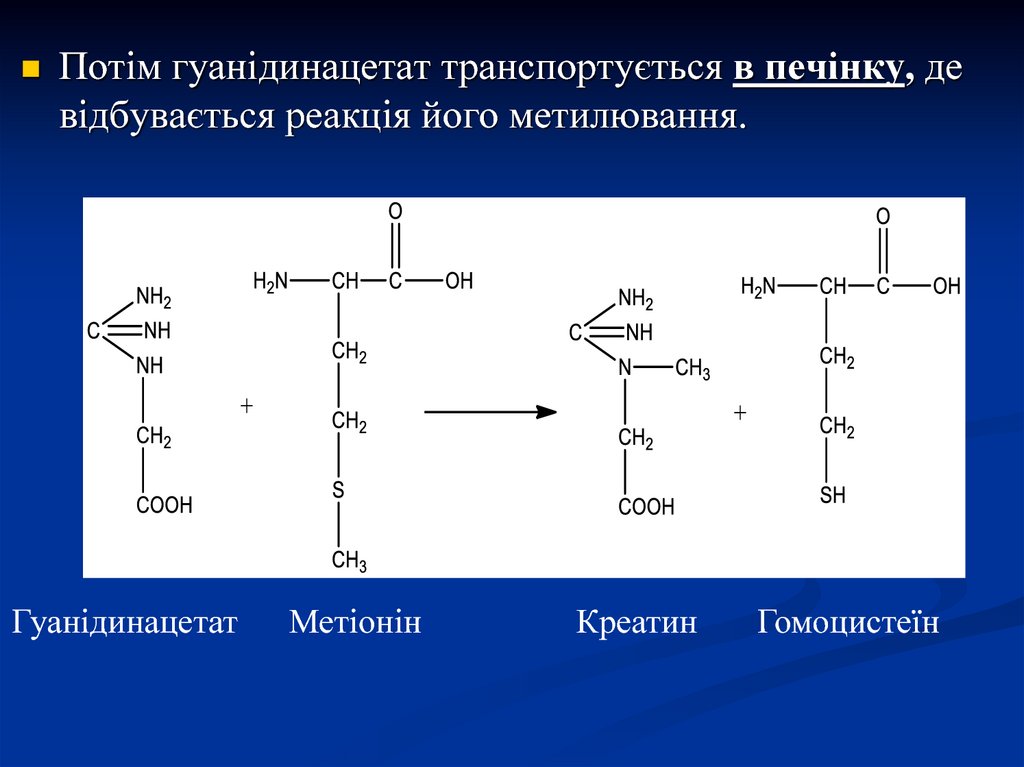
Потім гуанідинацетат транспортується в печінку, девідбувається реакція його метилювання.
Гуанідинацетат
Метіонін
Креатин
Гомоцистеїн
24.
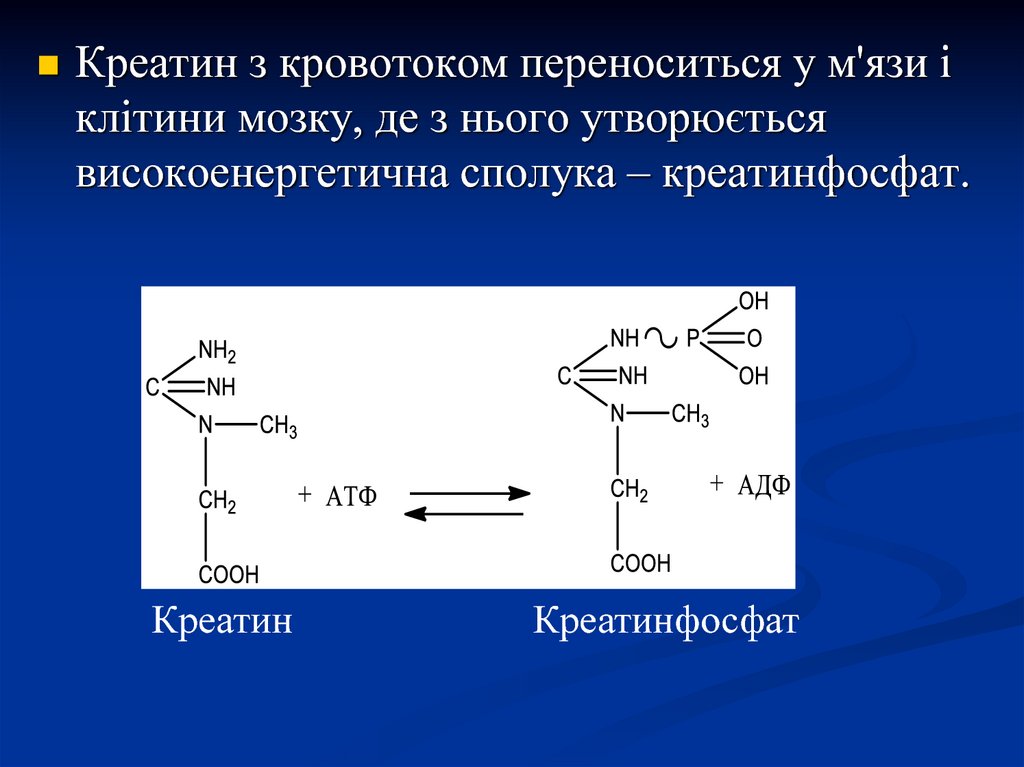
Креатин з кровотоком переноситься у м'язи іклітини мозку, де з нього утворюється
високоенергетична сполука – креатинфосфат.
Креатин
Креатинфосфат
25.
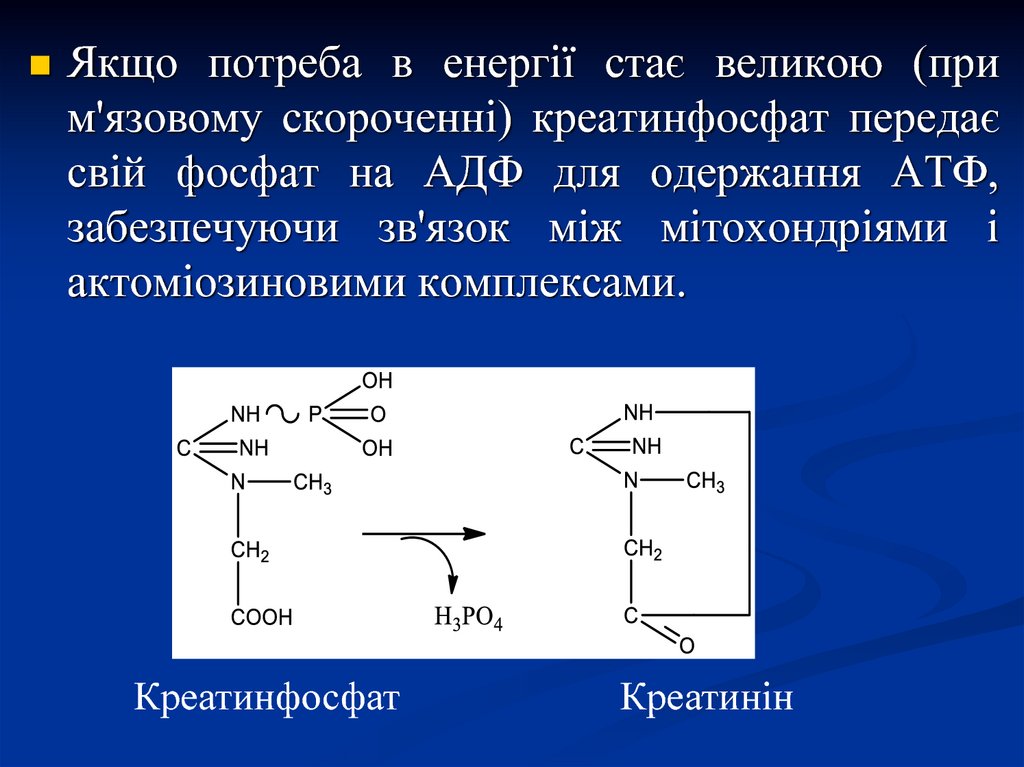
Якщо потреба в енергії стає великою (прим'язовому скороченні) креатинфосфат передає
свій фосфат на АДФ для одержання АТФ,
забезпечуючи зв'язок між мітохондріями і
актоміозиновими комплексами.
Креатинфосфат
Креатинін
26.
Креатинфосфат відіграє важливу роль узабезпеченні енергією м'язу, що працює, в
початковий
період.
В
результаті
неферментативного
дефосфорилування,
головним чином у м'язах, креатинфосфат
перетворюється в креатинін, що виводиться
з сечею. Добове виділення креатиніну в
кожного індивідууму є постійним і
пропорційне загальній м'язовій масі.
27.
Визначення вмісту креатину і креатиніну вкрові
та
сечі
використовується
для
характеристики інтенсивності роботи м'язів у
спортивній
медицині
і
при
деяких
патологічних станах.
Визначення
активності
ферменту
креатинкінази застосовують в медицині для
діагностики інфаркту міокарду, міопатії,
м'язових дистрофій та ін.
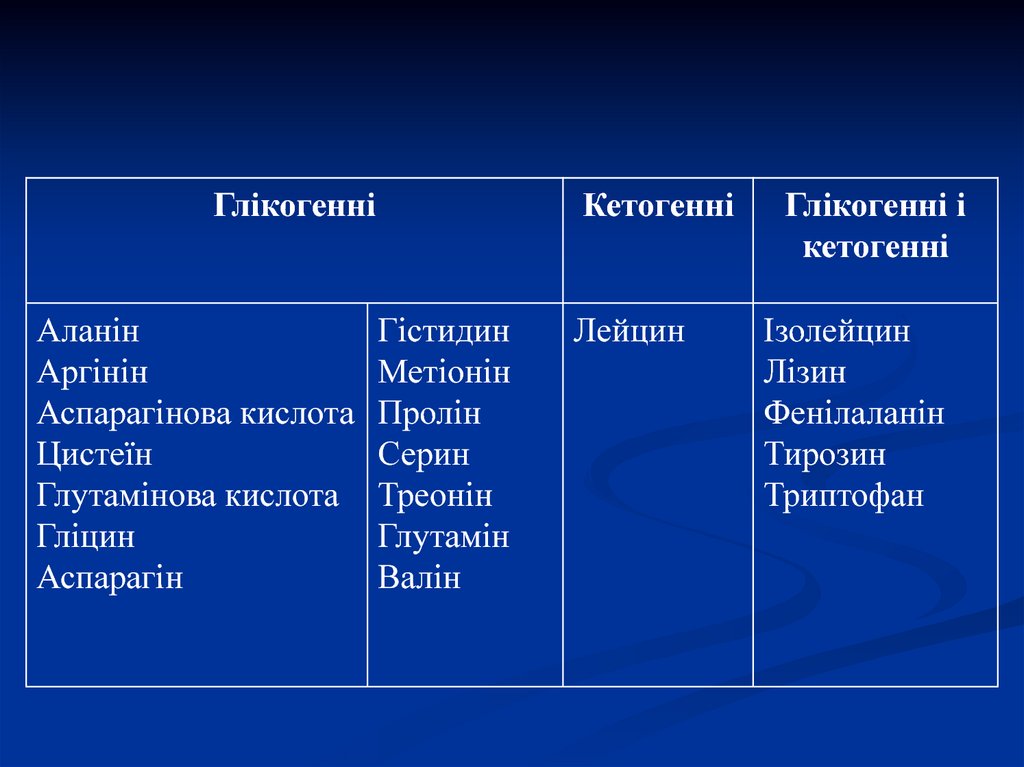
28. Глікогенні і кетогенні амінокислоти
Амінокислоти, які в процесі катаболізмуперетворюються в піруват, оксалоацетат (ЩОК) і
фосфоєнолпіруват, можуть бути використані для
синтезу глюкози (глюконеогенез) і називаються
глиікогенними.
Ті амінокислоти, з яких синтез вуглеводів
неможливий, бо в ході катаболізму вони
перетворюються в ацетоацетат і ацетил-КоА,
називають кетогенними.
29.
ГлікогенніАланін
Аргінін
Аспарагінова кислота
Цистеїн
Глутамінова кислота
Гліцин
Аспарагін
Кетогенні
Гістидин
Метіонін
Пролін
Серин
Треонін
Глутамін
Валін
Лейцин
Глікогенні і
кетогенні
Ізолейцин
Лізин
Фенілаланін
Тирозин
Триптофан
30. ДЕКАРБОКСИЛУВАННЯ АМІНОКИСЛОТ
Процес відщеплення карбоксильної групи амінокислоту вигляді СО2 одержав назву декарбоксилування.
Продукти реакції, що утворилися – біогенні аміни –
мають сильну фармакологічну дію на безліч
фізіологічних функцій людини і тварин.
У
тваринних
тканинах
встановлено
декарбоксилування наступних амінокислот і їх
похідних: тирозину, гістидину, глутамінової кислоти,
5-окситриптофану,
3,4-диоксифенілаланіну
та
цистеїнової кислоти.
31.
Декарбоксилування амінокислот відбувається підвпливом декарбоксилаз, коферментом яких є
переважно
фосфопіридоксаль
(вітамін
В6).
Декарбоксилуванню
підлягають
лише
α-амінокислоти.
При
окисненні
цистеїну
може
утворюватися цистеїнова кислота, яка в результаті
декарбоксилування перетворюється в таурин,
необхідний для синтезу жовчних кислот:
CH2
SH
CH2
SO3H
CH
NH2 + 3O
CH
NH2
COOH
Цистеїн
COOH
Таурин
CH2
SO3H
декарбоксилаза CH
NH2
2
Цистеїнова
кислота
+ CO2
32.
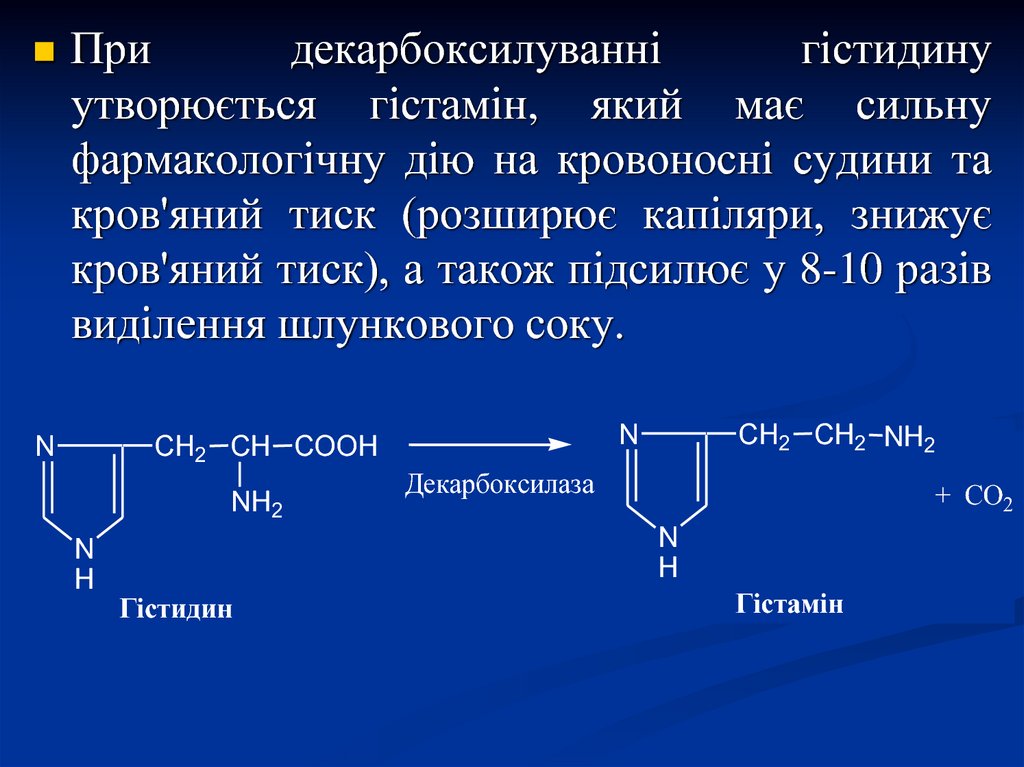
Придекарбоксилуванні
гістидину
утворюється гістамін, який має сильну
фармакологічну дію на кровоносні судини та
кров'яний тиск (розширює капіляри, знижує
кров'яний тиск), а також підсилює у 8-10 разів
виділення шлункового соку.
N
N
CH2 CH COOH
NH2
N
H
CH2 CH2 NH2
Декарбоксилаза
+ СО2
N
H
Гістидин
Гістамін
33. Біологічна роль гістаміну
Багато синтезується в місці запалення: маєсудинорозширюючу дію, прискорює приплив
лейкоцитів і активує захисні сили в боротьбі з
інфекцією.
Утворюється в слизовій шлунку, де активує
секрецію пепсиногену і НСl.
Депонується в тучних клітинах сполучної
тканини
у
вигляді
білково-гепаринового
комплексу.
Більшість протизапальних засобів за механізмом
дії є антигістамінними.
34.
В результаті декарбоксилування глутаміновоїкислоти
утворюється
γ-аміномасляна
кислота, метаболіт, який синтезується в
нервовій
тканині,
необхідний
для
регулювання швидкості проведення нервових
імпульсів (природний транквілізатор):
H2N
CH
COOH
декарбоксилаза
H2N
CH2
CH2
CH2
CH2
CH2
COOH
Глутамінова кислота
+ CO2
COOH
-Аміномасляна кислота
35.
Ворганізмі
аміни
окиснюються
моноамінооксигеназами до альдегідів і
виводяться нирками.
В
результаті
декарбоксилування
амінокислот виділяється третій кінцевий
продукт їх обміну СО2, тобто в результаті
дезамінування
і
декарбоксилування
амінокислот в тканинах утворюється вода,
вуглекислий газ і амоніак. Останній є
отруйною речовиною для організму і
знешкоджується ним.
36. Токсичність амоніаку
Амоніак легко проникає через мембрани в клітини і вмітохондріях змінює напрям реакції, яка каталізується
глутаматдегідрогеназою, в бік утворення глутамату:
α-Кетоглутарат + NADH•Н+ + NH3 → Глутамат + NAD+.
Зменшення концентрації α-кетоглутарату викликає:
пригнічення обміну амінокислот (реакції трансамінування)
і, як наслідок, синтезу з них нейромедіаторів (ацетилхоліну,
дофаміну та ін.);
гіпоенергетичний стан в результаті зниження швидкості
ЦТК.
37.
Підвищення концентрації амоніаку в крові змінює рН улужну сторону (виникає алкалоз). Це, в свою чергу,
підвищує спорідненість гемоглобіну до кисню, що
призводить до гіпоксії тканин, накопиченню СО2 і
гіпоенергетичного стану, від якого головним чином страждає
головний мозок.
Високі концентрації амоніаку стимулюють синтез
глутаміну з глутамату в нервовій тканині (за участі
глутамінсинтетази):
Глутамат + NH3 + АТФ → Глутамін + АДФ + Н3Р04.
Накопичення глутаміну в клітинах нейроглії призводить до
підвищення осмотичного тиску в них, набухання астроцитів і
у великих концентраціях може викликати набряк мозку.
38. Шляхи знезараження амоніаку
Тимчасове знезараження (у всіх тканинах):- утворення амонійних солей;
- утворення амідів дикарбонових амінокислот
(глутаміну та аспарагіну).
Кінцеве (остаточне) знезараження (в печінці):
- синтез сечовини (орнітиновий цикл).
39.
Синтез амонійних солей органічних кислотвідбувається тільки в нирках і займає незначне місце
у всьому процесі детоксикації амоніаку. При
ацидотичних станах організму кількість амонійних
солей, які виводяться із сечею, збільшується. Це
явище
розглядають
як
додаткове
захисне
пристосування при ацидозах різного походження
(кетонемія, цукровий діабет, надлишок в раціоні
силосу та ін.) Механізм цього процесу можна
представити так:
R―COOH + NH4OH → R―COONH4 + H2O
40.
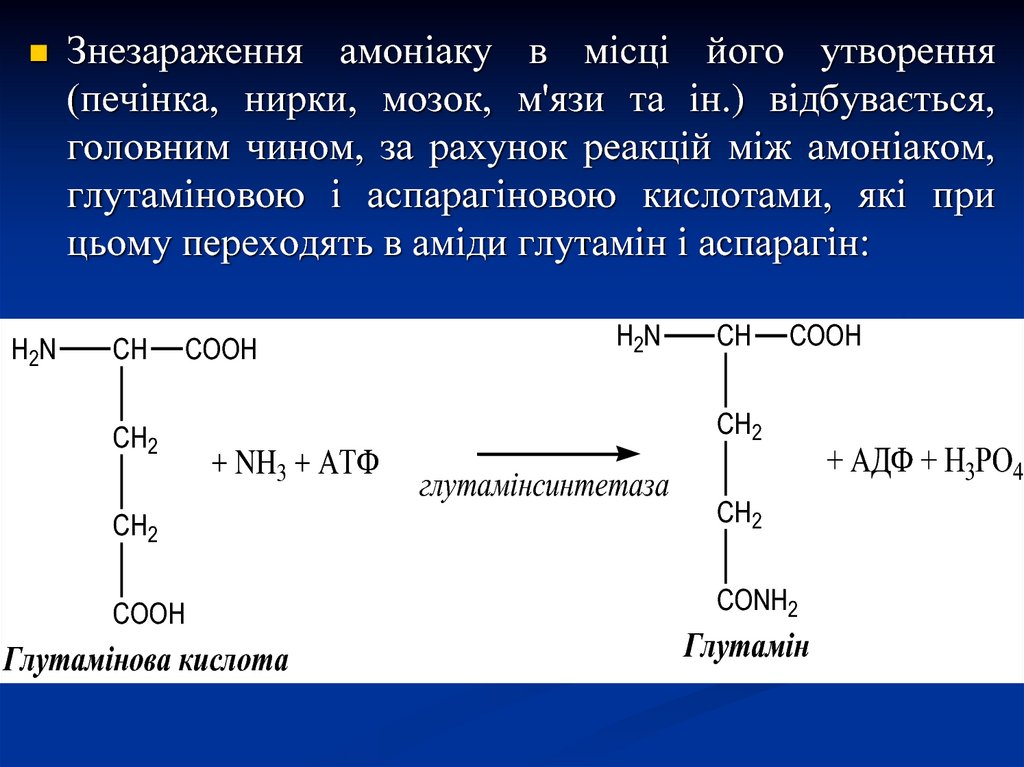
H2NЗнезараження амоніаку в місці його утворення
(печінка, нирки, мозок, м'язи та ін.) відбувається,
головним чином, за рахунок реакцій між амоніаком,
глутаміновою і аспарагіновою кислотами, які при
цьому переходять в аміди глутамін і аспарагін:
CH
COOH
CH2
+ NH3 + АТФ
H2N
CH
COOH
CH2
глутамінсинтетаза
CH2
CH2
COOH
CONH2
Глутамінова кислота
Глутамін
+ АДФ + H3PO4
41.
H2NCH
CH2
COOH
+ NH3 + АТФ
COOH
Аспарагінова кислота
H2N
аспарагінсинтетаза
CH
CH2
COOH
+ АДФ + H3PO4
CONH2
Аспарагін
Амоніак у складі аспарагіну і глутаміну
надходить до печінки, де використовується
для синтезу сечовини.
42.
Глутамін — основний донор Нітрогенув організмі.
Високий рівень глутаміну в крові та легкість його
надходження в клітини обумовлює використання
глутаміну в багатьох анаболічних процесах.
Амідний Нітроген глутаміну необхідний для
синтезу пуринових і піримідинових нуклеотидів,
аспарагіну, амінопохідних вуглеводів та інших
сполук.
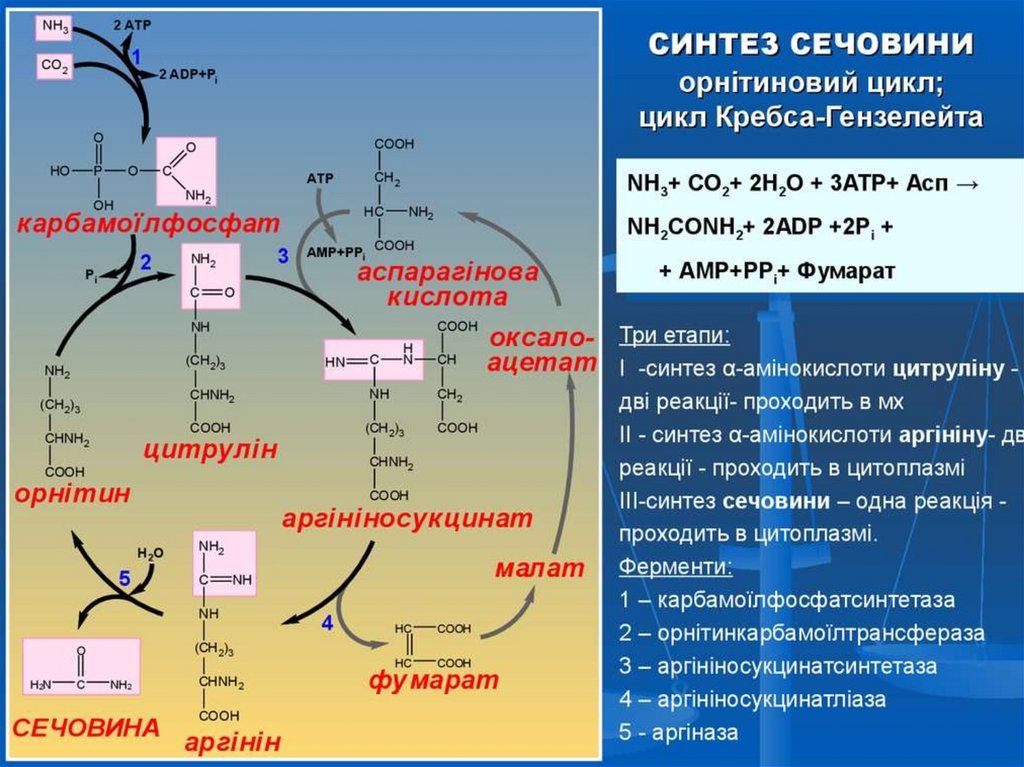
43. Орнітиновий цикл
Сечовина − основний кінцевий продуктазотистого обміну, в складі якого з
організму виділяється до 90% всього
Нітрогену, що виводиться. Екскреція
сечовини в нормі складає − 25 г/добу. При
підвищенні кількості білків, які надходять з
їжею, екскреція сечовини збільшується.
Сечовина синтезується тільки в печінці.
44.
Перша стадія синтезу сечовини заключається вутворенні карбамоїлфосфату за участі АТФ і
N-ацетилглутамінової кислоти, яка є кофактором
карбамоїлфосфатсинтетази і відноситься до підкласу
фосфотрансфераз:
карбамоїлфосфатNH3 + CO2 + H2O + 2АТФ
синтетаза
(або глутамін)
NH2
O
O
P
OH + 2АДФ + H3PO4
O
OH
Карбамоїлфосфат
C
45.
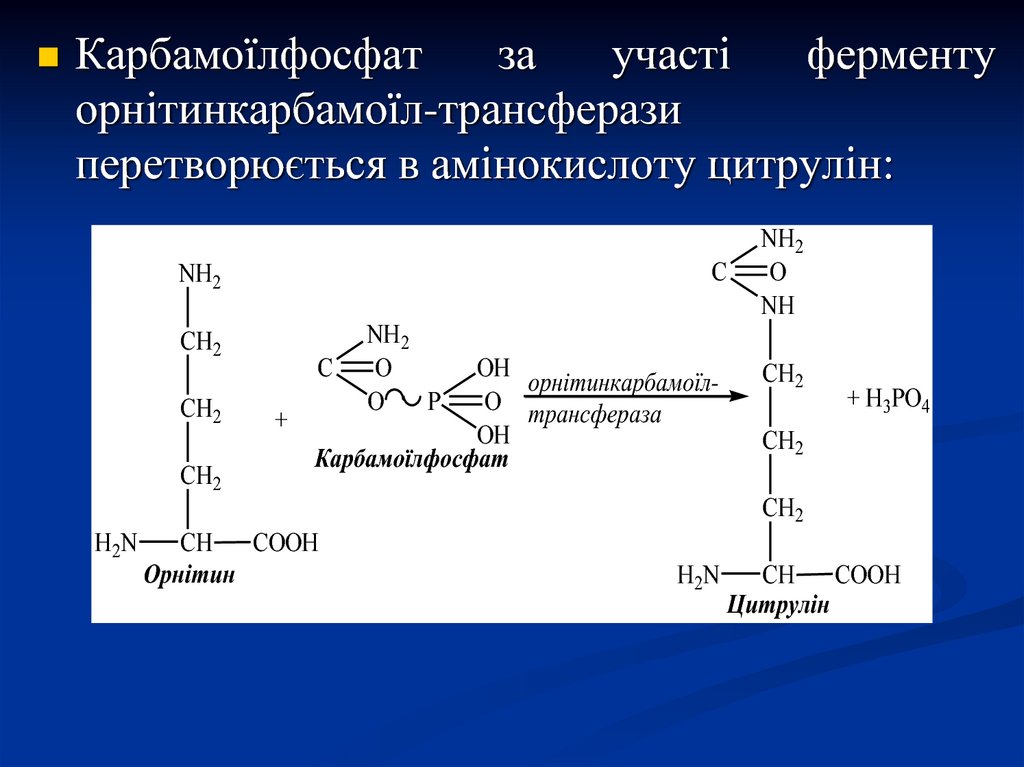
Карбамоїлфосфатза
участі
ферменту
орнітинкарбамоїл-трансферази
перетворюється в амінокислоту цитрулін:
C
NH2
CH2
CH2
CH2
H2N
C
NH2
O
O
P
OH
oрнітинкарбамоїлO трансфераза
+
OH
Карбамоїлфосфат
CH COOH
Орнітин
NH2
O
NH
CH2
+ H3PO4
CH2
CH2
H2N
CH COOH
Цитрулін
46.
CВ присутності ферменту аргінінсукцинатсинтетази
і АТФ цитрулін вступає в реакцію конденсації з
аспарагіновою кислотою, в результаті чого
утворюється аргінінянтарна кислота:
NH2
O
NH
CH2
CH2
CH2
H2N
C
COOH
+
CH2
+ АТФ
H2N
CH
COOH
Аспарагінова кислота
CH
COOH
Цитрулін
аргінінсукцинатсинтетаза
NH2
N
NH
CH2
CH
CH2
COOH
CH2
CH2
H2N
CH
COOH
Аргінінянтарна кислота
COOH
+ АДФ + H3PO4
47.
Аргінінянтарна кислота при дії ферментуаргінінсукцинат-ліази розщеплюється на
аргінін і фумарову кислоту:
C
NH2
N
NH
CH2
CH
COOH
C
CH2
COOH
CH2
CH2
аргінінсукцинатліаза
COOH
CH
+
CH
CH2
CH2
H2N
CH
COOH
Аргінінянтарна кислота
NH2
NH
NH
CH2
H2N
CH
Аргінін
COOH
Фумарова кислота
COOH
48.
Аргінін при дії аргінази перетворюється в орнітин ісечовину. Орнітин може включатися в новий цикл
знезараження амоніаку, а сечовина виділяється із
сечею:
C
NH2
NH
NH
CH2
NH2
+ H2O
CH2
аргіназа
CH2
CH2
CH2
CH2
H2N
CH
Аргінін
+
COOH
H2N
CH
COOH
Орнітин
NH2
C
O
NH2
Сечовина
49.
Фумарова кислота при цьому перетворюється вяблучну і щавлевооцтову, а остання в результаті
трансамінування або відновлювального амінування
може перетворюватися в аспарагінову кислоту.
З усього Нітрогену сечі вміст Нітрогену сечовини у
тварин складає від 80 до 90%, Нітрогену амонійних
солей – до 6%. При надлишковій білковій годівлі
частка Нітрогену сечовини збільшується, а при
недостатній або неповноцінній білковій годівлі ця
величина зменшується до 56-60%. Синтезована
сечовина виділяється з організму переважно в складі
сечі.
50.
У жуйних частина її виділяється із сечею, аінша частина через слинні залози в складі
слини потрапляє в ротову порожнину, а потім
в передшлунки, де і використовується
бактеріями для синтезу амінокислот, які
потім входять до складу бактеріальних білків.
Після перетравлення бактеріями Нітроген
сечовини
(нових
амінокислот)
знову
потрапляє в кров і використовується
тканинами організму тварин.
51. При утворенні сечовини використовується
А) амоніак – одна молекулаБ) СО2 – одна молекула
В) аміногрупа аспарагінової кислоти – одна
молекула
При утворенні однієї молекули сечовини
витрачається три молекули АТФ.
52.
53. Анаболічна фаза обміну білків
Синтез замінних амінокислот.Синтез специфічних білків.
Синтез азотвмісних речовин:
- біогенні аміни;
- гормони білкової і поліпептидної
природи;
- гем та ін.
54. Синтез замінних амінокислот
Вуглецевий скелет замінних амінокислотутворюється з проміжних метаболітів
гліколізу, пентозофосфатного шляху, циклу
трикарбонових кислот.
Шляхи біосинтезу амінокислот:
- пряме (відновлювальне) амінування
α-кетокислот;
- реакції трансамінування.
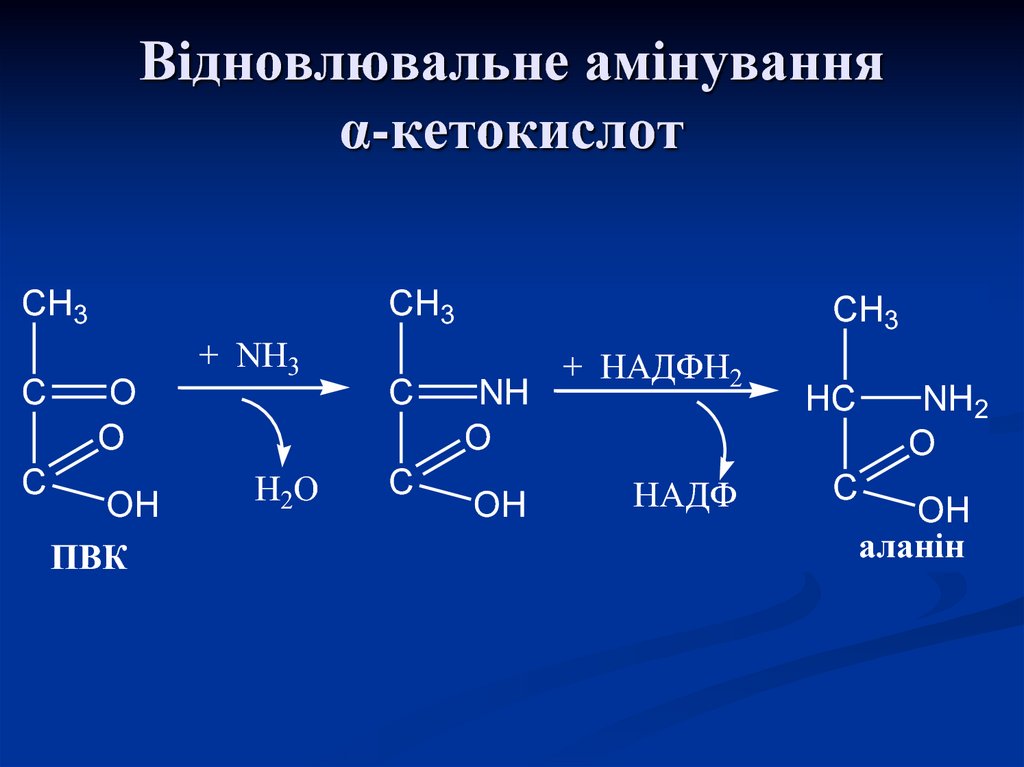
55. Відновлювальне амінування α-кетокислот
CH3C
C
CH3
O
O
OH
ПВК
+ NH3
H2O
C
C
CH3
NH
O
OH
+ НАДФН2
НАДФ
HC
C
NH2
O
OH
аланін
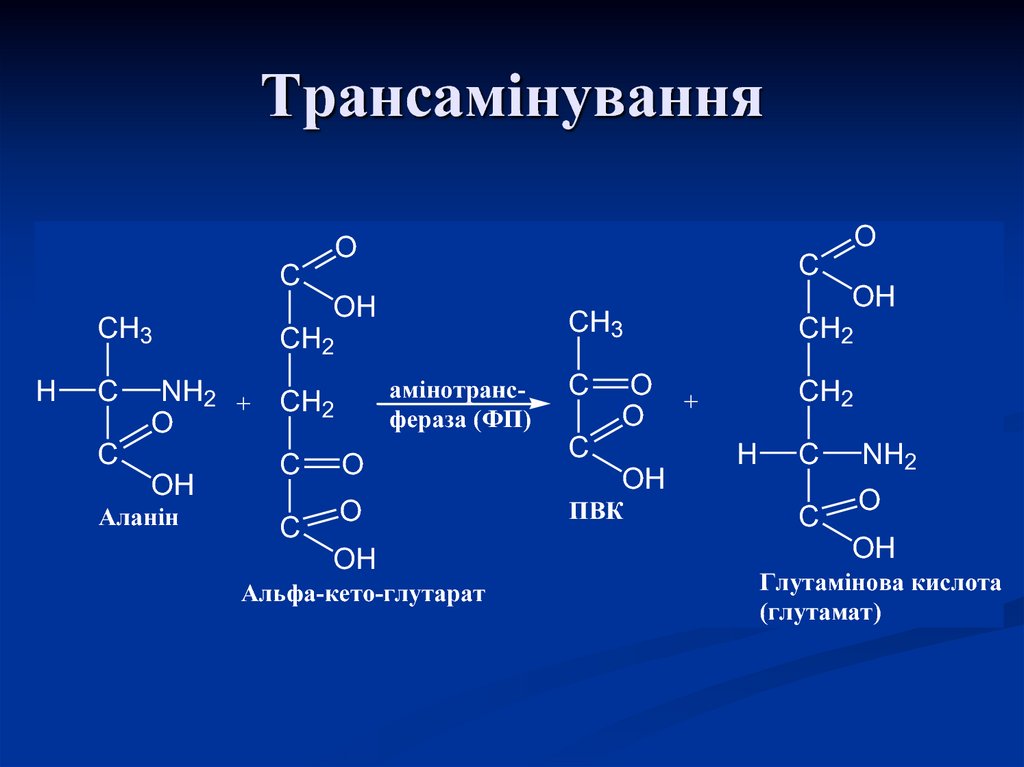
56. Трансамінування
OO
C
C
CH3
H
OH
CH2
амінотрансNH2 + CH
2
фераза (ФП)
O
C
C O
OH
O
Аланін
C
OH
C
Альфа-кето-глутарат
OH
CH3
C
O
O
C
OH
ПВК
CH2
CH2
+
H
C
C
NH2
O
OH
Глутамінова кислота
(глутамат)
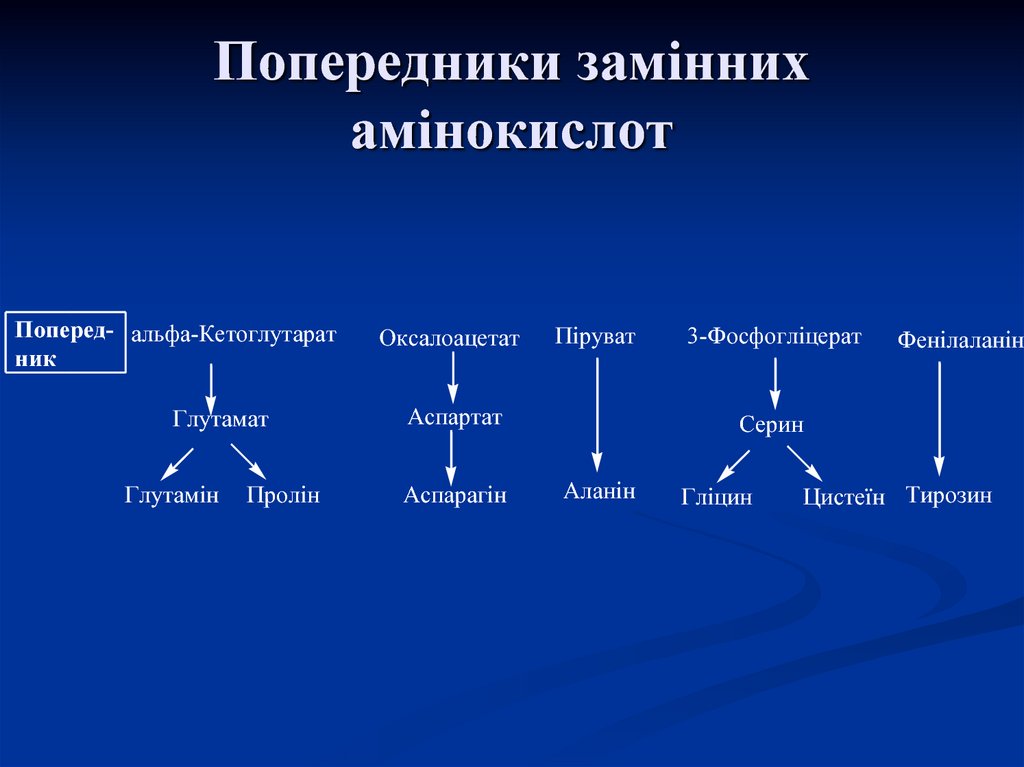
57. Попередники замінних амінокислот
Поперед- альфа-Кетоглутаратник
Глутамат
Глутамін
Пролін
Оксалоацетат
Піруват
Аспартат
Аспарагін
3-Фосфогліцерат
Фенілаланін
Серин
Аланін
Гліцин
Цистеїн Тирозин
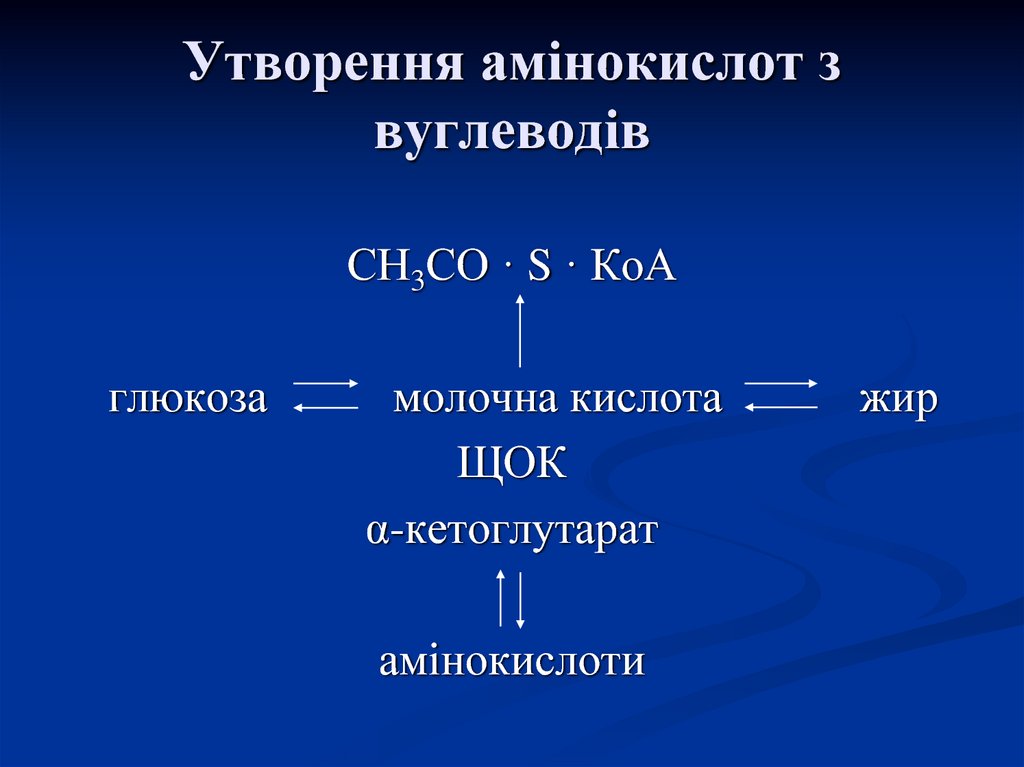
58. Утворення амінокислот з вуглеводів
СН3СО · S · КоАглюкоза
молочна кислота
ЩОК
α-кетоглутарат
амінокислоти
жир






































 chemistry
chemistry








