Similar presentations:
Гiдроксикислоти. Номенклатура
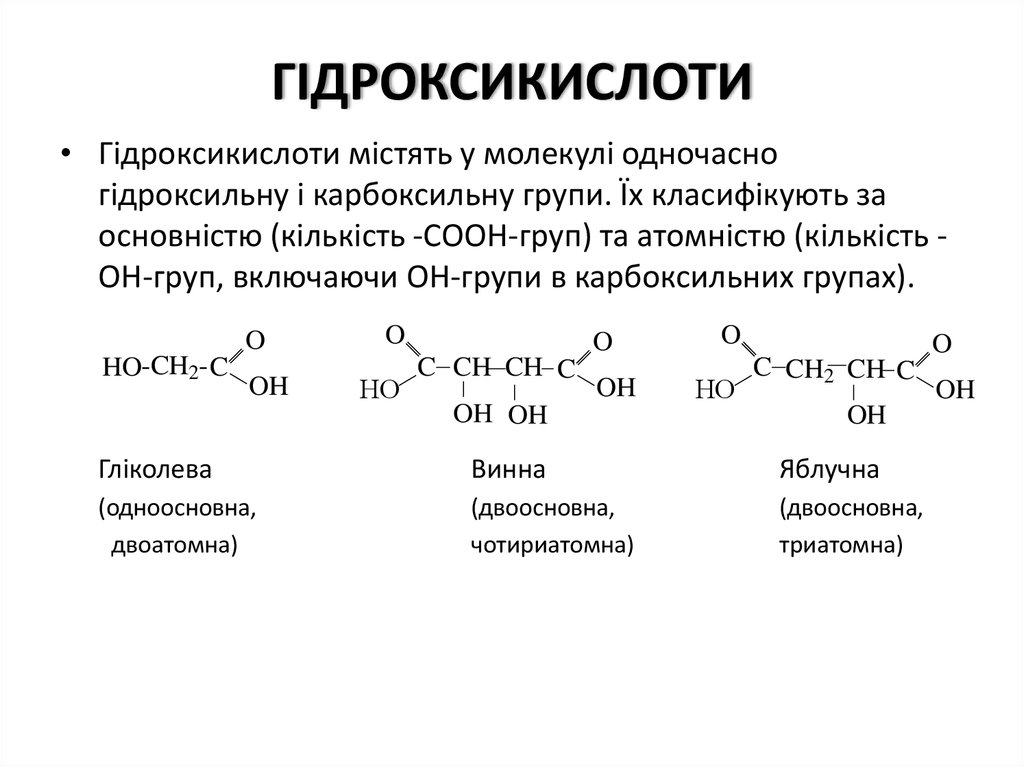
1. ГIДРОКСИКИСЛОТИ
• Гiдроксикислоти мiстять у молекулi одночасногiдроксильну i карбоксильну групи. Їх класифiкують за
основнiстю (кiлькiсть -СООН-груп) та атомнiстю (кiлькiсть ОН-груп, включаючи ОН-групи в карбоксильних групах).
O
HO-CH2- C
OH
O
НО
O
C CH CH C
OH
OH OH
O
НО
C CH2 CH C
OH
Глiколева
Винна
Яблучна
(одноосновна,
двоатомна)
(двоосновна,
чотириатомна)
(двоосновна,
триатомна)
O
OH
2. НОМЕНКЛАТУРА
За номенклатурою (IUPAC) їх назви утворюють з назв вiдповiдних
карбонових кислот додаванням префiкса гiдрокси-.
Нумерацiя головного ланцюга починається з атома вуглецю карбоксильної
групи.
3
2
1
HO-CH2- CH2 C
O
OH
3-Гiдроксипропанова
НО
O
C CH CH C
OH
OH OH
2,3-Дигiдроксибутандiова
Якщо користуються тривіальною назвою кислоти, то положення ОН-групи
позначаються буквами грецького алфавiту , , - тощо.
O
CH3 CH- C
OH
OH
-Гiдроксипропiонатна
O
O
HO-CH2-CH2 CH2 C
OH
-Гiдроксибутиратна
Крiм того, для гiдроксикислот часто застосовують тривiальні назви
(глiколева, молочна, винна, яблучна тощо).
3. Методи одержання
МЕТОДИ ОДЕРЖАННЯ• 1. Гiдролiз галогенозамiщених кислот
• 2. З карбонiльних сполук (альдегiдів, кетонів) через гiдроксинiтрили
можна одержати -гiдроксикислоти.
OH
O
CH3-C
HCN
CH3- C C
Нiтрил -гiдроксипропiонатної кислоти
Н2О
-NH3
OH
CH3- C C
O
OH
2-Гiдроксипропанова ( -Гiдроксипропiонатна)
4. 3. -Гiдроксикислоти зручно отримувати за реакцiєю С.Реформатського (1887).
3. -Гiдроксикислоти зручно отримувати за реакцiєюС.Реформатського (1887).
• Реакцiя Реформатського полягає у взаємодiї естерів галогенозаміщених карбонових кислот з карбонiльними сполуками в
присутностi цинку:
O
R C R
OZnCI
O
Zn
R C CH2 C
CI CH2 C
O C2H5
Н2О
C2H5OH
Zn(OH)CI
OH
R C CH2 C
R
R
O
OH
-Гiдроксикислота
O
O C2H5
5. ФIЗИЧНI ТА ХIМIЧНI ВЛАСТИВОСТІ
• Гiдроксикислоти є сильнiшими кислотами, нiж монокарбоновi,завдяки прояву -I-ефекту НО-групи. Вони мають вищi температури
кипiння i топлення, нiж вiдповiднi незамiщенi кислоти внаслiдок
утворення додаткових водневих зв'язків за участю гiдроксильних груп.
• Для гiдроксикислот характернi хiмiчнi властивостi, як кислот, так i
спиртiв. Як кислоти, вони утворюють солi, естери, амiди тощо, а як
спирти - алкоголяти, етери, галогенопохiднi.
• Взаємний вплив функцiональних груп особливо помiтний у гiдроксикислотах. Так, наприклад, вони легко вiдновлюються до
кислот пiд дiєю НI.
O
CH3 CH-C
OH
OH
2HI
I2 Н2О
O
CH3 CH2 C
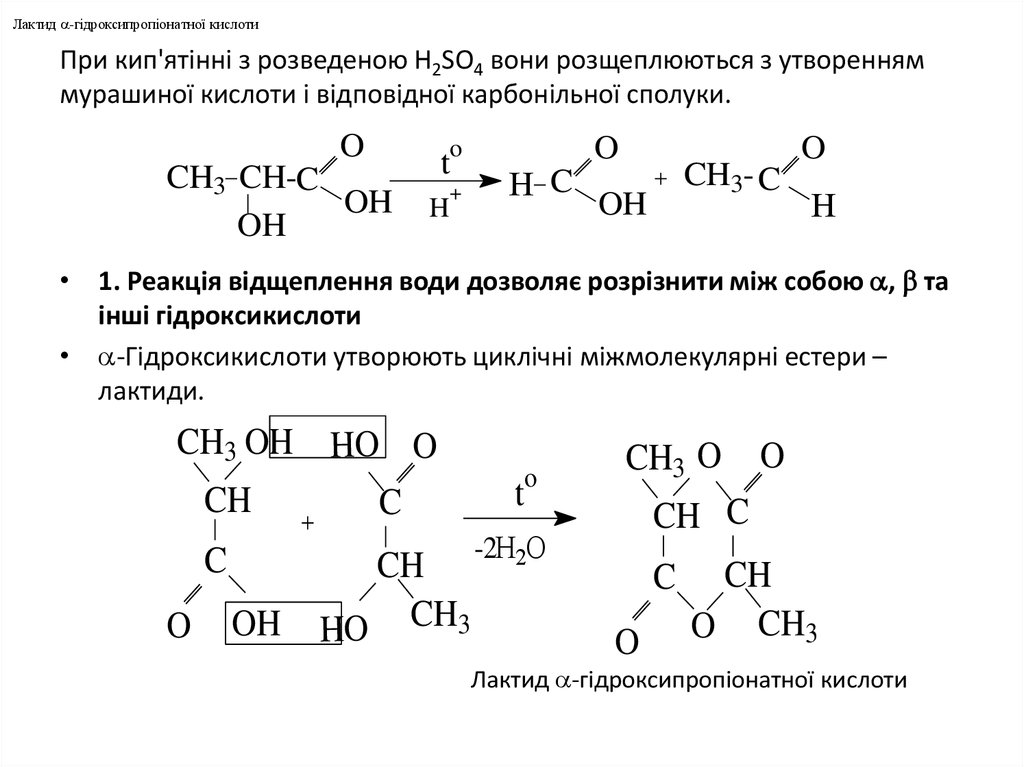
6. При кип'ятiннi з розведеною H2SO4 вони розщеплюються з утворенням мурашиної кислоти і відповідної карбонільної сполуки.
Лактид -гiдроксипропiонатної кислотиПри кип'ятiннi з розведеною H2SO4 вони розщеплюються з утворенням
мурашиної кислоти і відповідної карбонільної сполуки.
O
o
CH3 CH-C
OH
OH
t
+
H
C
O
CH3- C
OH
O
• 1. Реакцiя вiдщеплення води дозволяє розрiзнити мiж собою , та
інші гiдроксикислоти
• -Гiдроксикислоти утворюють циклiчнi мiжмолекулярнi естери –
лактиди.
OH
CH3 OH
CH
C
C
OH
OH
O
O
CH
CH3
o
t
CH3 O
O
CH C
-2Н2О
C
O
CH
O CH3
Лактид -гiдроксипропiонатної кислоти
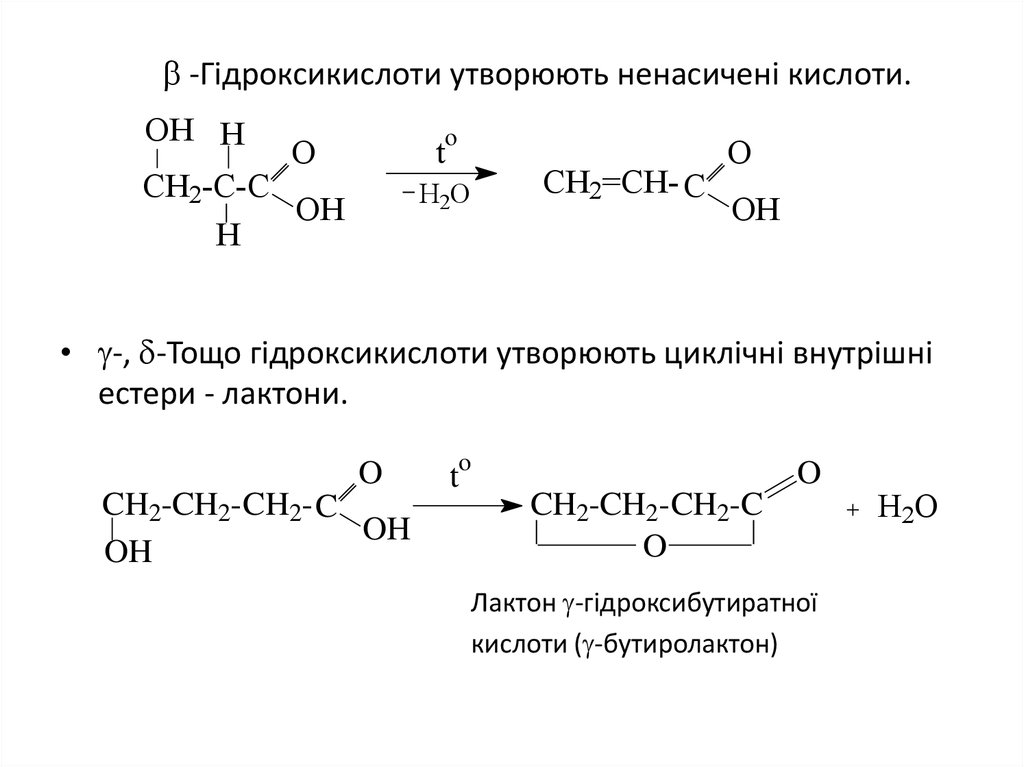
7. -Гiдроксикислоти утворюють ненасиченi кислоти.
-Гiдроксикислоти утворюють ненасиченi кислоти.OH H
o
t
O
CH2-C-C
OH
H
CH2=CH- C
Н2О
O
OH
• -, -Тощо гiдроксикислоти утворюють циклiчнi внутрiшнi
естери - лактони.
O
CH2-CH2-CH2- C
OH
OH
o
t
O
CH2-CH2-CH2-C
O
Лактон -гiдроксибутиратної
кислоти ( -бутиролактон)
Н2О
8. СТЕРЕОIЗОМЕРIЯ ГIДРОКСИКИСЛОТ
• Багато гiдроксикислот здатнi обертати площину поляризації плоскополяризованого свiтла влiво або вправо, тобто проявляють оптичнуактивнiсть .
• Так, молочна кислота може бути правообертаючою (+) та
лівообертаючою (-). Правообертаюча була виділена Ю.Лібіхом у 1847
р. з м’яса. Вона Вона називається м’ясомолочною кислотою і
відноситься до L–ряду. Лівообертаюча D–молочна кислота
утворюється при скисанні молока. D– та L–молочні кислоти є
енантіомарами
COOH
COOH
HO
H
CH3
L-Молочна кислота
OH
H
CH3
D-Молочна кислота
9. Нагадаю, що D- i L-позначення використовуються тiльки для гiдроксикислот, амiнокислот i вуглеводiв.
• Суміш, яка складається з еквiмолярних кiлькостей двохенантіомерів, називається рацемічною сумішшю або
рацематом і позначається (r).
• Рацемат оптично неактивний, тому що його енантiомери
взаємно компенсують обертання поляризованого свiтла.
• Якщо в молекулi сполуки мiститься декiлька асиметричних
атомiв вуглецю, то для гiдрокси- та амiнокислот їх
вiднесення до D- або L- ряду виконується за верхнiм
асиметричним (хiральним) атомом вуглецю, а для
вуглеводiв - за нижнiм.
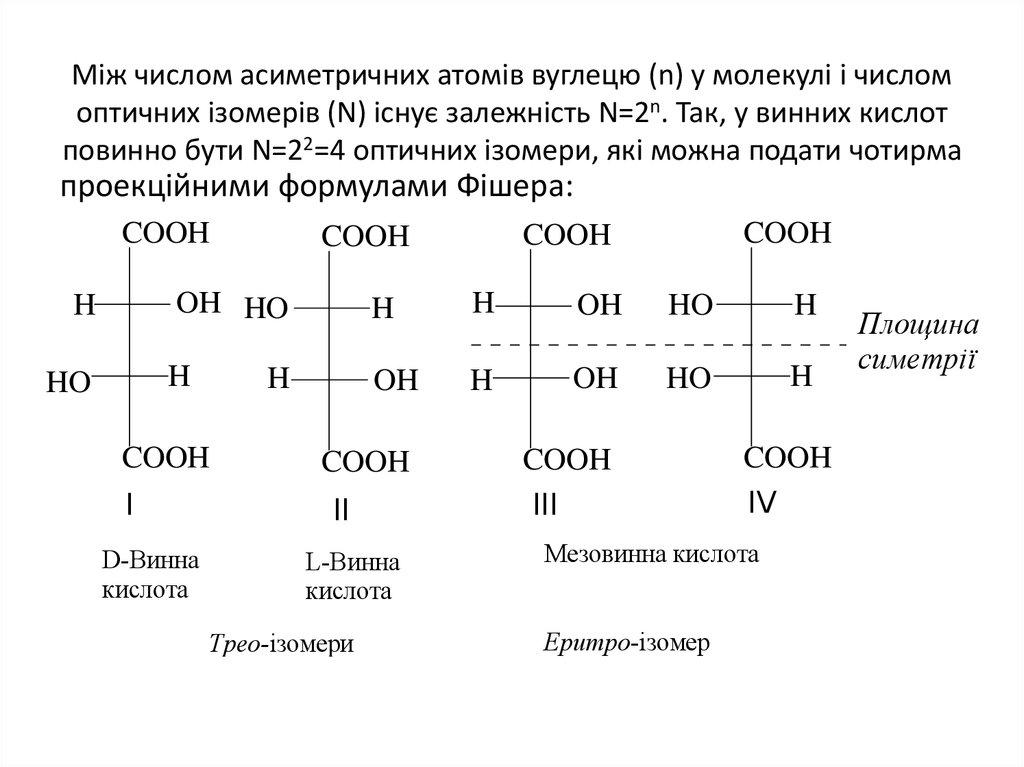
10. Мiж числом асиметричних атомiв вуглецю (n) у молекулi i числом оптичних ізомерів (N) iснує залежнiсть N=2n. Так, у винних
кислотповинно бути N=22=4 оптичних ізомери, які можна подати чотирма
проекційними формулами Фішера:
COOH
H
HO
COOH
COOH
COOH
OH HO
H
H
OH
HO
H
H
OH
H
OH
HO
H
H
COOH
I
D-Винна
кислота
COOH
II
L-Винна
кислота
Трео-ізомери
COOH
III
COOH
IV
Мезовинна кислота
Еритро-ізомер
Площина
симетрії
11. D- та L-винні кислоти є енантіомерами. D-Винна кислота – правообертаюча і утворюється при бродінні виноградного сусла.
Лівообертаюча L-винна кислота також зустрічаєтьсяу природі, її можна одержати окисненням малеїнової або
сорбінової кислот. Еквівалентна суміш D- та L-винних
кислот (рацемічна суміш) називається виноградною
кислотою.
• Виноградна кислота, як і будь-яка рацемічна суміш,
оптично недіяльна тому, що обидва енантіомери
взаємокомпенсують обертання плоскополяризованого
променя світла. Виноградна кислота може бути роздiлена
на енантiомери за допомогою спеціальних методів.
12. Проекційні формули ІІІ і IV мезовинної кислоти, насправді, ідентичні. В цьому легко переконатися, якщо повернути проекцію IV в
площині малюнка на кут 180о. Післяповороту вона співпаде з проекцією ІІІ. Отже слід говорити
не про дві речовини, а про одну, яку називають
мезовинною кислотою.
• Молекула мезовинної кислоти симетрична відносно
площини, яка проходить через її середину (на проекціях
показана пунктиром), а значить мезовинна кислота не
проявляє оптичної активності.
• Сполуки, у яких є асиметричний атом вуглецю, але які
оптично недiяльнi внаслi-док симетрiї молекули,
називаються мезоформами.
• По відношенню до D- та L-винних кислот, мезовинна
кислота є не енантіомером, а діастереоізомером.
13. Познайомимось з іще одним важливим терміном. Якщо однакові замісники біля двох хіральних атомів вуглецю розташовані по різні
боки від головноголанцюга, то такий ізомер називається трео-ізомером,
а якщо по один бік – еритро-ізомером. Отже D- та Lвинні кислоти - трео-ізомери, а мезовинна – еритроізомер.
• .
14. Стереохімія Реакцiй замiщення при асиметричному атомi вуглецю
СТЕРЕОХІМІЯ РЕАКЦIЙ ЗАМIЩЕННЯ ПРИ АСИМЕТРИЧНОМУАТОМI ВУГЛЕЦЮ
• Реакцiї замiщення при асиметричному атомi вуглецю
можуть протiкати з частковою або повною змiною
конфiгурацiї молекул. За iм’ям вченого, який вiдкрив таку
змiну конфiгурацiї (П.I.Вальден, 1895), вона називається
Вальденiвським обертанням i на схемi реакцiї
позначається у виглядi петлi
• Детально вивченi реакцiї SN, для яких К.Iнгольд
сформулював такi правила:
• Замiщення за механiзмом SN2 завжди супроводжується
повною змiною конфiгурацї.
• Замiщення за механiзмом SN1 супроводжується частковою
зміною конфiгурацiї з утворенням рацемiчної сумiшi
(рацемiзацiєю).
15. В окремих випадках реакція заміщення може протікати без зміни конфігурації. Так, при нагріванні галогенопохідних з вологим
твердим аргентум оксидомвідбувається заміна галогену гідроксильною групою
R Cl
AgOH
R OH
AgCI
• Дана реакція протікає за специфічним механізмом, який
забезпечує збереження конфігурації вихідного
галогенопохідного.
• Ці стеричні закономірності протікання реакцій слід
враховувати при синтезі сполук з певною просторовою
конфігурацією.
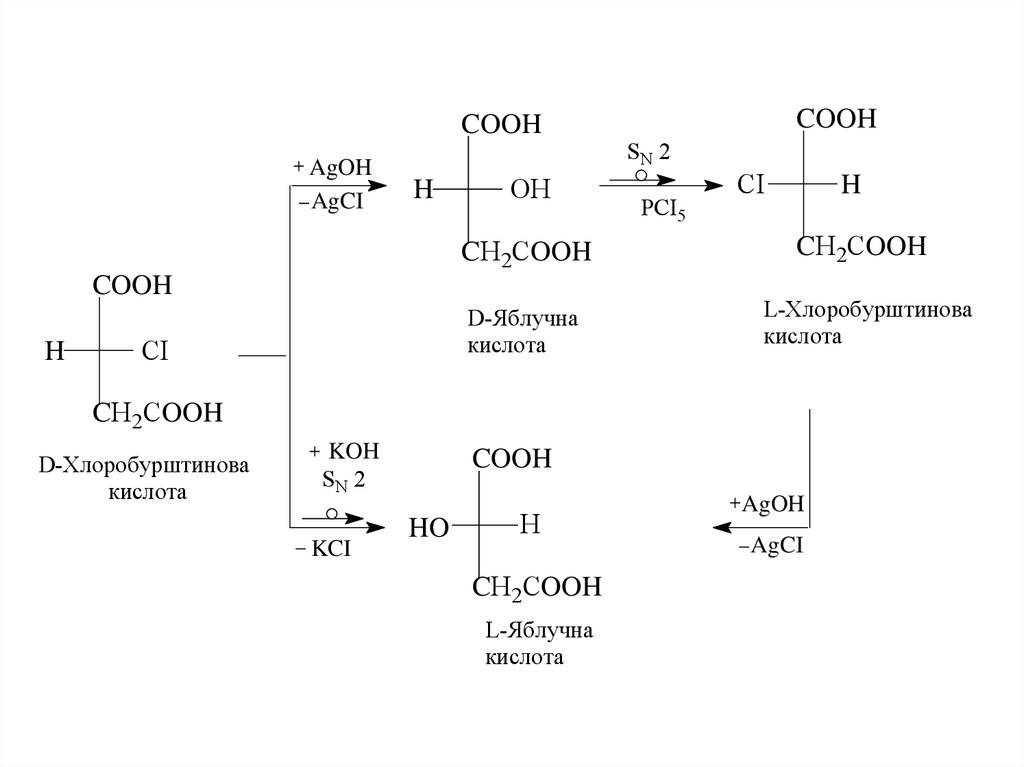
16.
COOHAgOH
AgCI
H
OH
CI
SN 2
РСІ5
CI
H
CН2СOOH
CН2СOOH
D-Яблучна
кислота
L-Хлоробурштинова
кислота
COOH
H
COOH
CН2СOOH
D-Хлоробурштинова
кислота
KOH
SN 2
KCI
COOH
HO
H
CН2СOOH
L-Яблучна
кислота
AgOH
AgCI
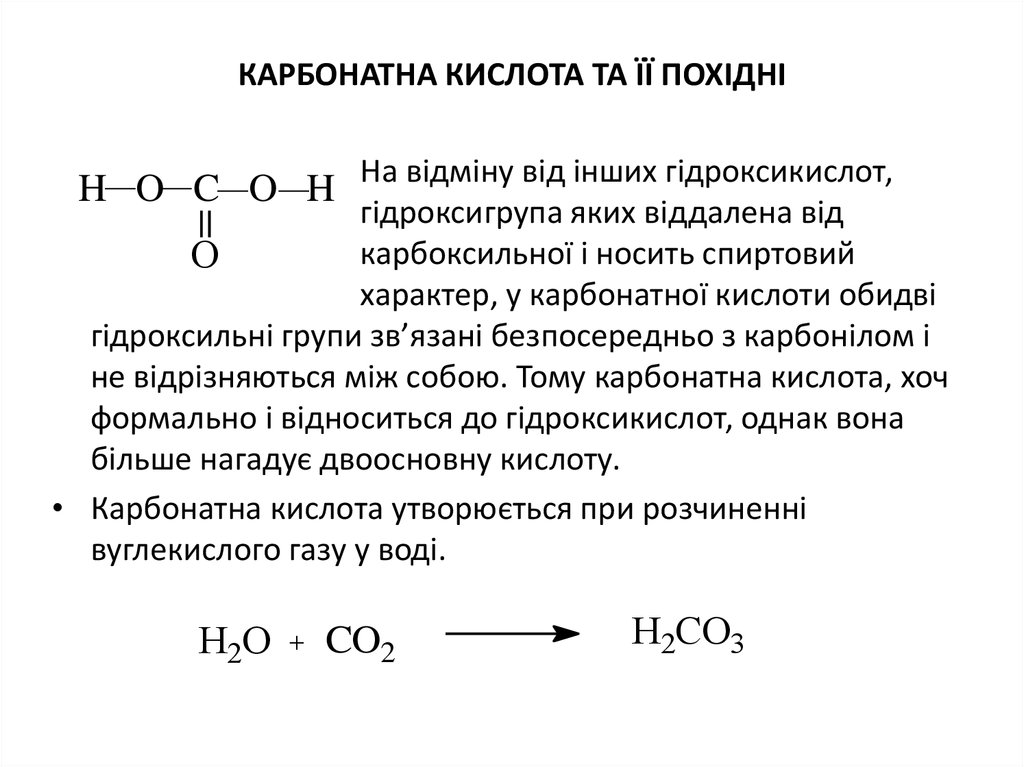
17. Карбонатна кислота та її похідні
КАРБОНАТНА КИСЛОТА ТА ЇЇ ПОХІДНІH O C O H На відміну від інших гідроксикислот,
гідроксигрупа яких віддалена від
карбоксильної і носить спиртовий
О
характер, у карбонатної кислоти обидві
гідроксильні групи зв’язані безпосередньо з карбонілом і
не відрізняються між собою. Тому карбонатна кислота, хоч
формально і відноситься до гідроксикислот, однак вона
більше нагадує двоосновну кислоту.
• Карбонатна кислота утворюється при розчиненні
вуглекислого газу у воді.
Н2О
CO2
Н2CО3
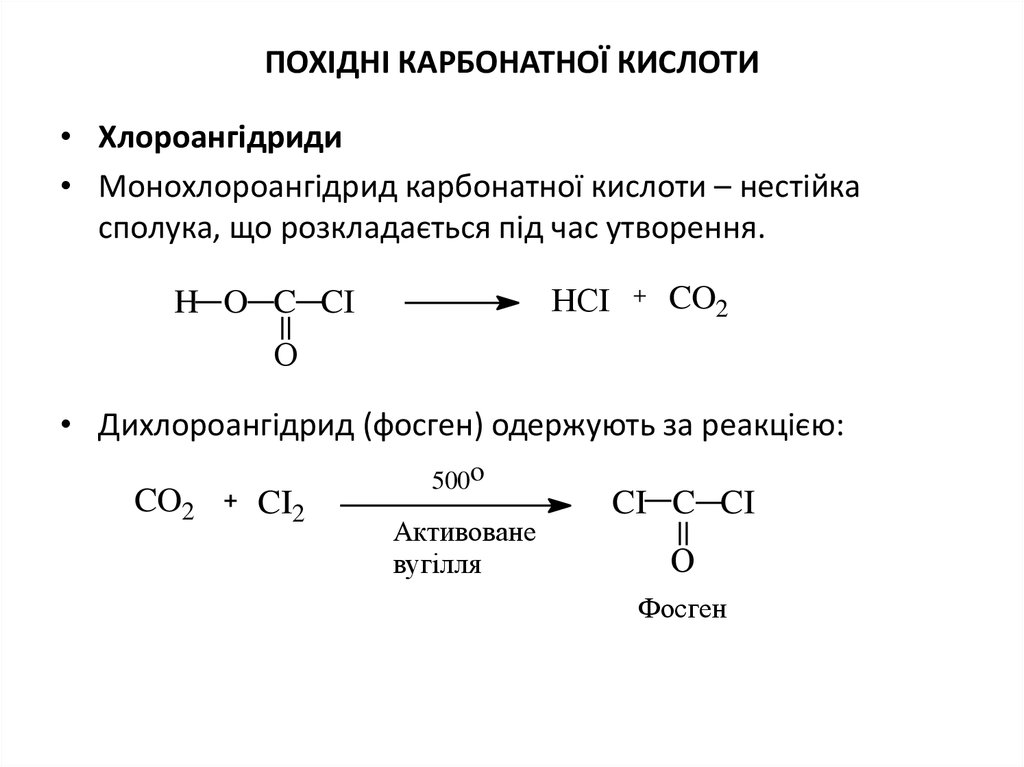
18. Похідні карбонатної кислоти
ПОХІДНІ КАРБОНАТНОЇ КИСЛОТИ• Хлороангідриди
• Монохлороангідрид карбонатної кислоти – нестійка
сполука, що розкладається під час утворення.
НCI
H O C CI
CO2
О
• Дихлороангідрид (фосген) одержують за реакцією:
CO2
CI2
500o
Активоване
вугілля
CI C CI
О
Фосген
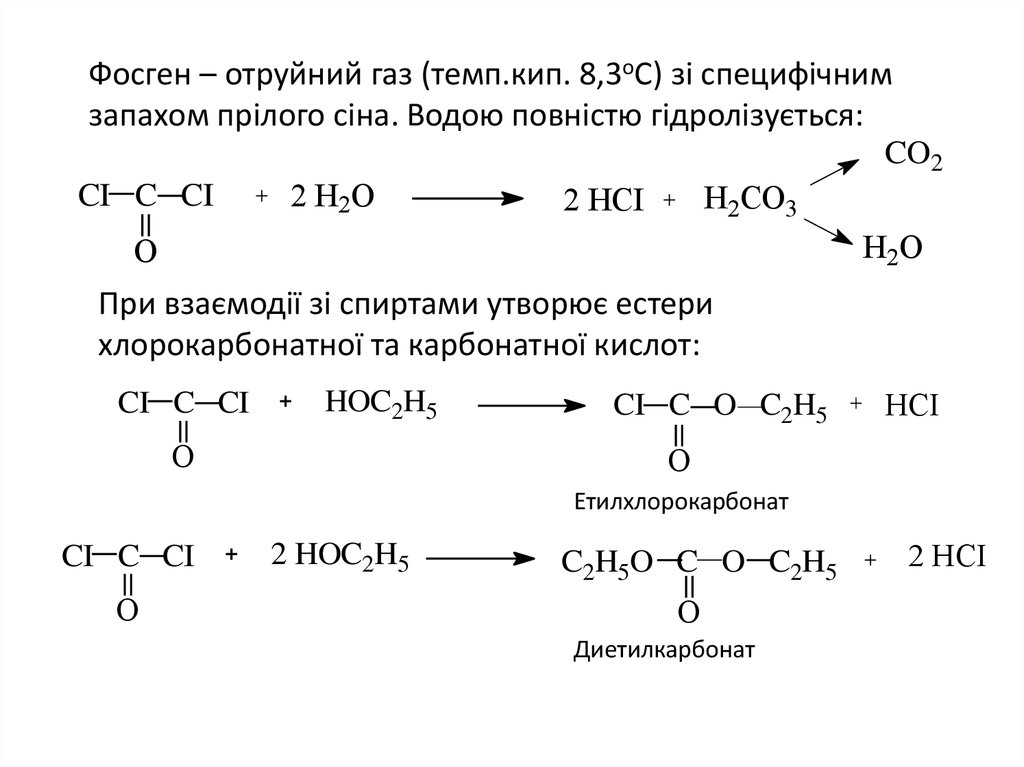
19. Фосген – отруйний газ (темп.кип. 8,3оС) зі специфічним запахом прілого сіна. Водою повністю гідролізується:
CO2CI C CI
2 Н2О
Н2CО3
2 НCI
Н2О
О
При взаємодії зі спиртами утворює естери
хлорокарбонатної та карбонатної кислот:
CI C CI
HOC2H5
О
CI C O C2H5
НCI
О
Етилхлорокарбонат
CI C CI
О
2 HOC2H5
C2H5O C O C2H5
О
Диетилкарбонат
2 НCI
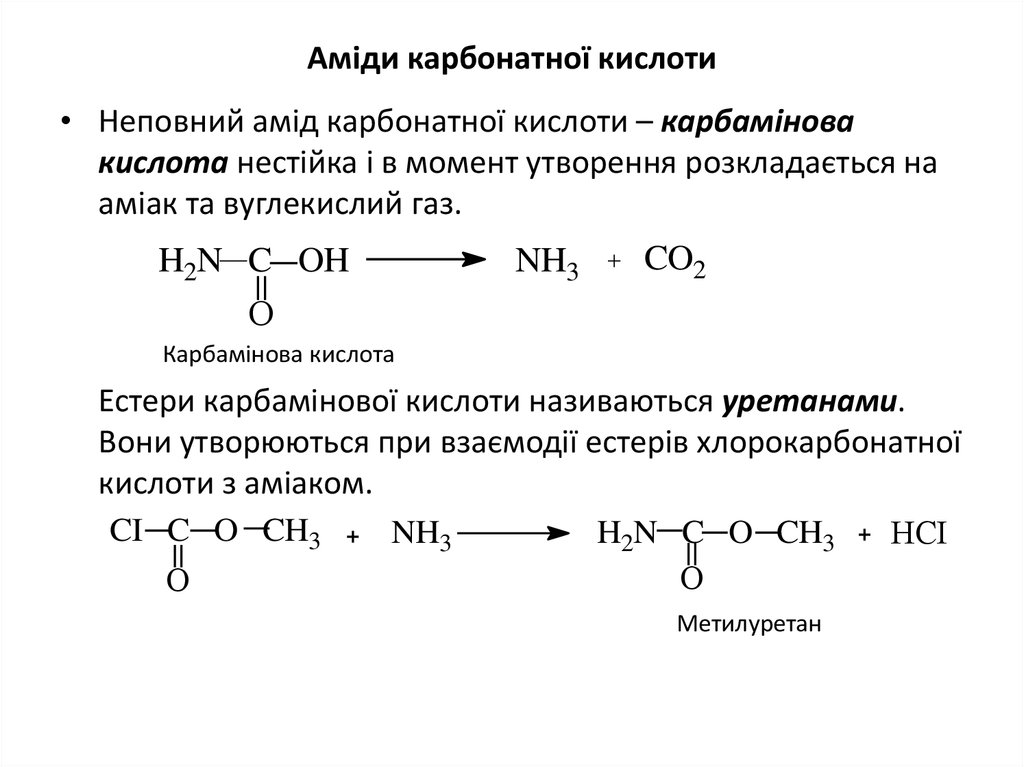
20. Аміди карбонатної кислоти
• Неповний амід карбонатної кислоти – карбаміновакислота нестійка і в момент утворення розкладається на
аміак та вуглекислий газ.
H2N C OH
NH3
CO2
О
Карбамінова кислота
Естери карбамінової кислоти називаються уретанами.
Вони утворюються при взаємодії естерів хлорокарбонатної
кислоти з аміаком.
CI C O CH3
NH3
H2N C O CH3
НCI
О
О
Метилуретан
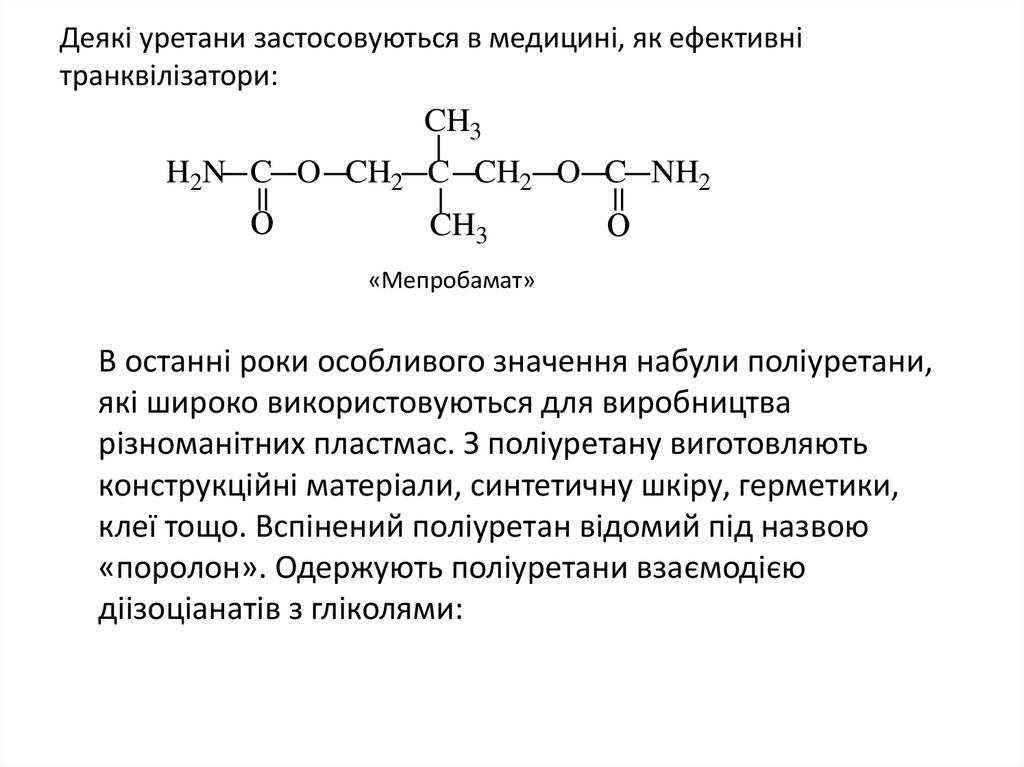
21. Деякі уретани застосовуються в медицині, як ефективні транквілізатори:
Деякі уретани застосовуються в медицині, як ефективнітранквілізатори:
CH3
H2N C O CH2 C CH2 O C NH2
О
CH3
О
«Мепробамат»
В останні роки особливого значення набули поліуретани,
які широко використовуються для виробництва
різноманітних пластмас. З поліуретану виготовляють
конструкційні матеріали, синтетичну шкіру, герметики,
клеї тощо. Вспінений поліуретан відомий під назвою
«поролон». Одержують поліуретани взаємодією
діізоціанатів з гліколями:
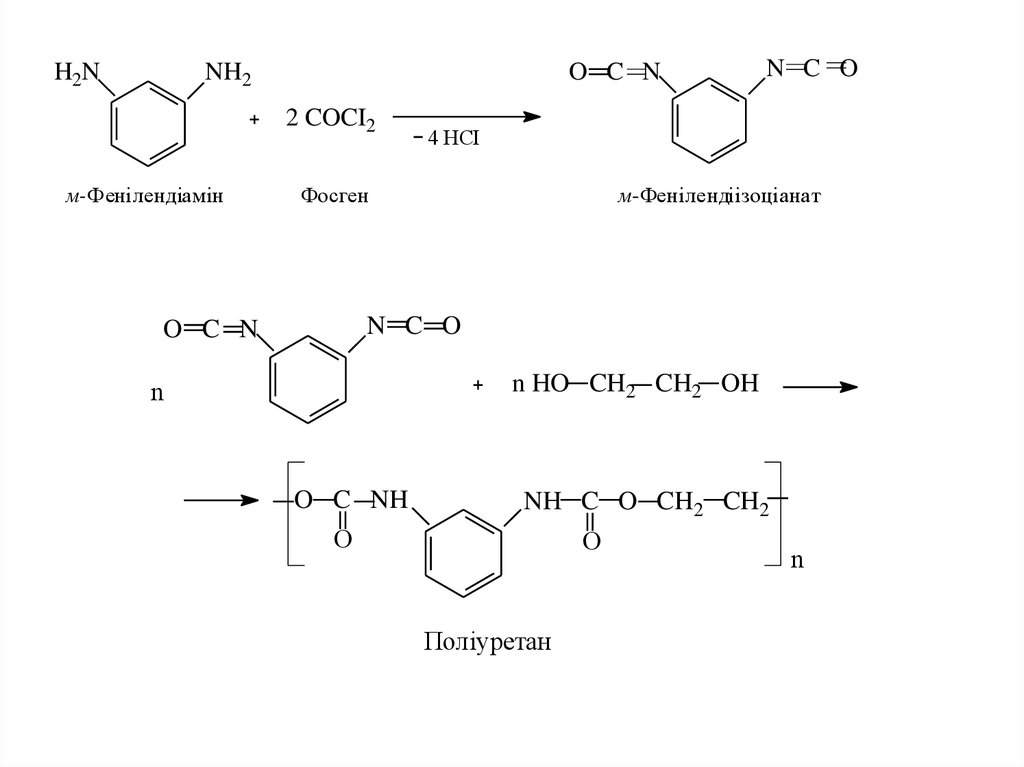
22.
H2NNH2
O C N
2 COCI2
м-Фенілендіамін
N C O
4 НCI
Фосген
м-Фенілендіізоціанат
N C O
O C N
n HO CH2 CH2 OH
n
O C NH
NH C O CH2 CH2
О
О
Поліуретан
n
23. Повний амід карбонатної кислоти називається карбамідом або сечовиною.
• У промисловості карбамід одержують за схемою:CO2
NH4 O C O NH4
2 NH3
О
200o
200 атм.
2 Н2О
Амоній карбонат
H2N C NH2
О
Карбамід
Раніше карбамід одержували
ціанамідним методом:
o
CaC2
N2
1000
Кальцій карбід
Ca N C N
C
Кальцій ціанамід
Ціанамід легко гідролізується з утворенням карбаміду:
Ca N C N
3 Н2О
Ca(OH)2
H2N C NH2
О
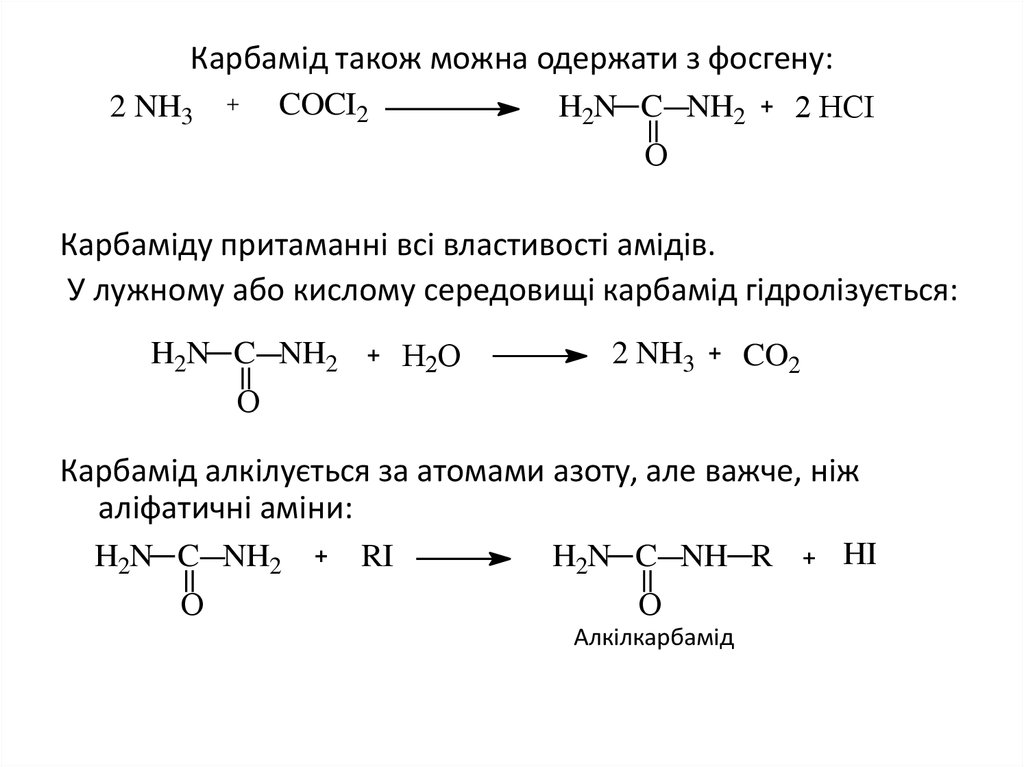
24. Карбамід також можна одержати з фосгену:
COCI22 NH3
H2N C NH2
2 НCI
О
Карбаміду притаманні всі властивості амідів.
У лужному або кислому середовищі карбамід гідролізується:
Н2О
H2N C NH2
2 NH3
CO2
О
Карбамід алкілується за атомами азоту, але важче, ніж
аліфатичні аміни:
H2N C NH2
О
RI
H2N C NH R
О
Алкілкарбамід
HI
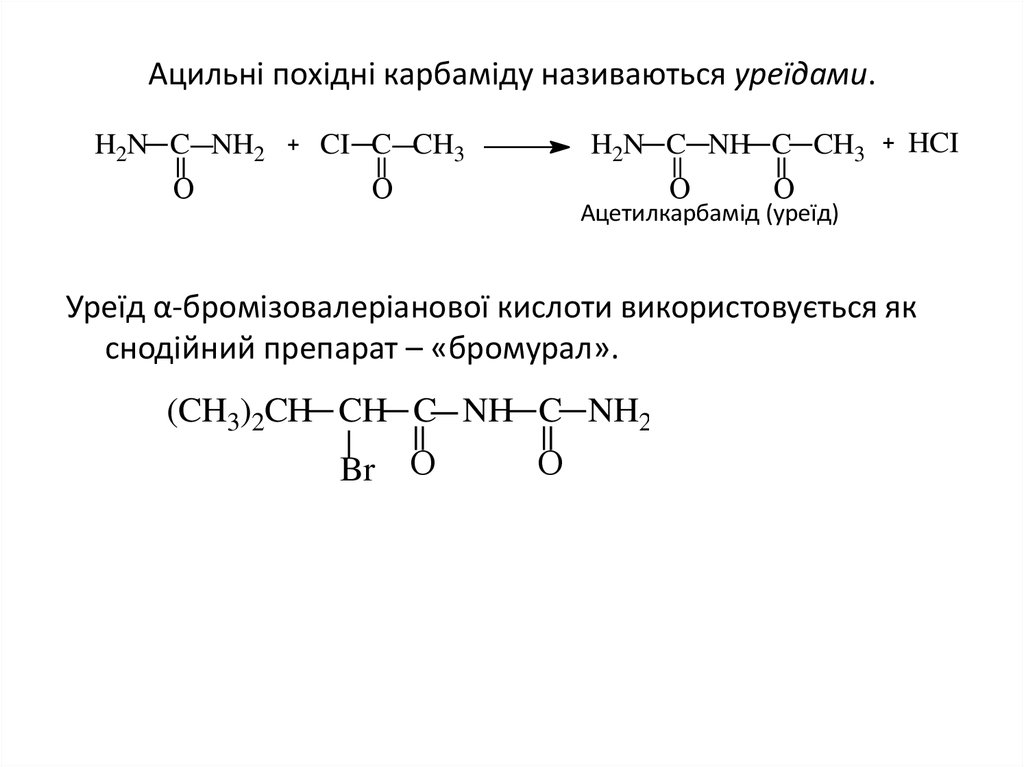
25. Ацильні похідні карбаміду називаються уреїдами.
H2N C NH2О
CI C CH3
H2N C NH C CH3
О
О
HCI
О
Ацетилкарбамід (уреїд)
Уреїд α-бромізовалеріанової кислоти використовується як
снодійний препарат – «бромурал».
(CH3)2CH CH C NH C NH2
Br О
О
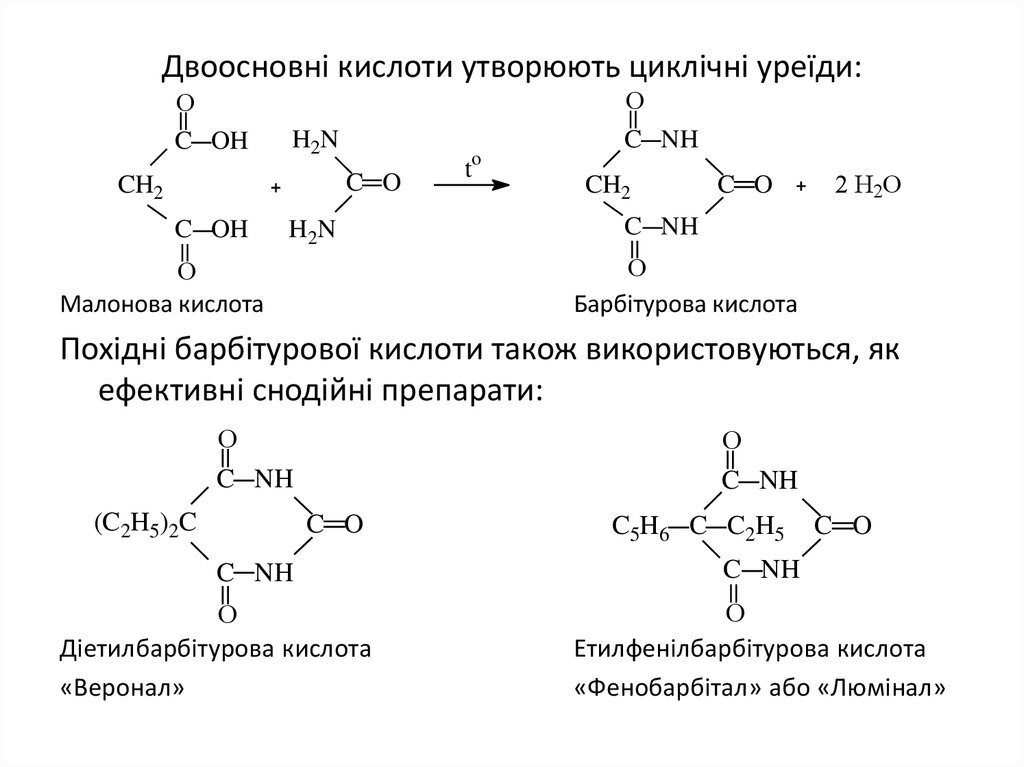
26. Двоосновні кислоти утворюють циклічні уреїди:
ОC OH
H2N
C O
CH2
C OH
H2N
to
О
C NH
CH2
C O
2 Н2О
C NH
О
Барбітурова кислота
О
Малонова кислота
Похідні барбітурової кислоти також використовуються, як
ефективні снодійні препарати:
О
C NH
(C2H5)2C
О
C NH
C O
C NH
О
Діетилбарбітурова кислота
«Веронал»
C5H6 C C2H5
C O
C NH
О
Етилфенілбарбітурова кислота
«Фенобарбітал» або «Люмінал»
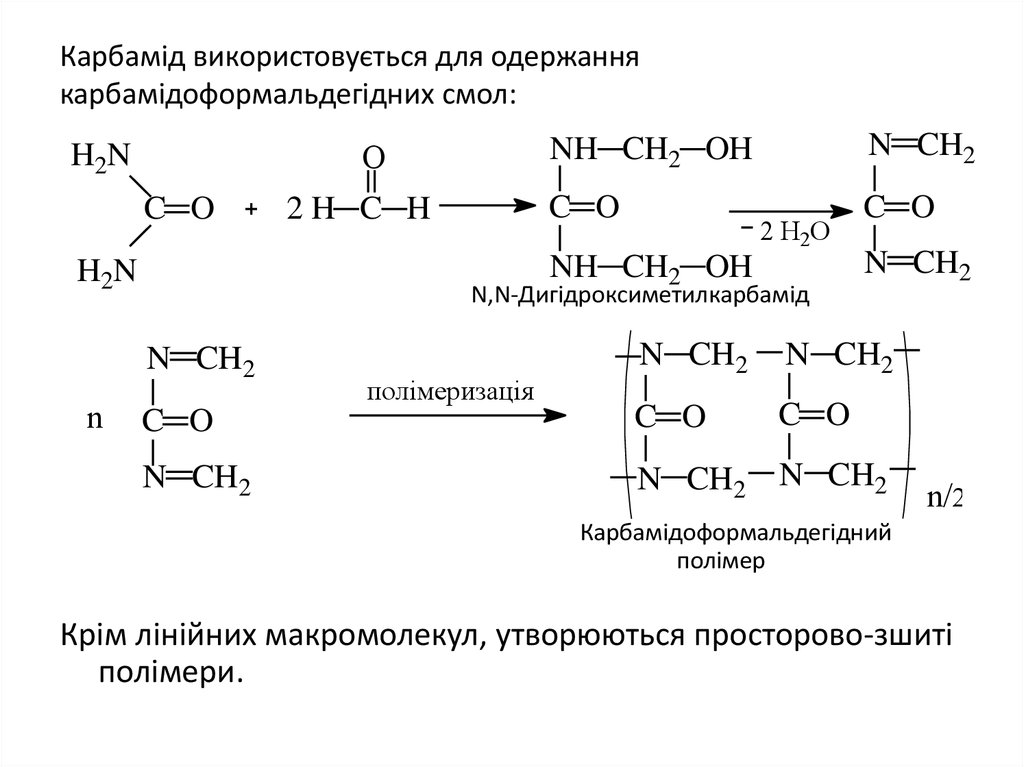
27. Карбамід використовується для одержання карбамідоформальдегідних смол:
ОH2N
C O
N CH2
C O
C O
2 Н2О
NH CH2 OH
H2N
N,N-Дигідроксиметилкарбамід
N CH2
N CH2
N CH2
C O
C O
C O
N CH2
N CH2
N CH2
N CH2
n
2H C H
NH CH2 OH
полімеризація
n/2
Карбамідоформальдегідний
полімер
Крім лінійних макромолекул, утворюються просторово-зшиті
полімери.
28.
• З карбамідоформальдегідної смоли виготовляють посуд,товари широкого вжитку, оздоблювальні матеріали.
• Велика кількість карбаміду використовується як цінне
азотне добриво, що добре засвоюється рослинами.













 chemistry
chemistry








