Similar presentations:
Структурна ізомерія
1. Структурна ізомерія
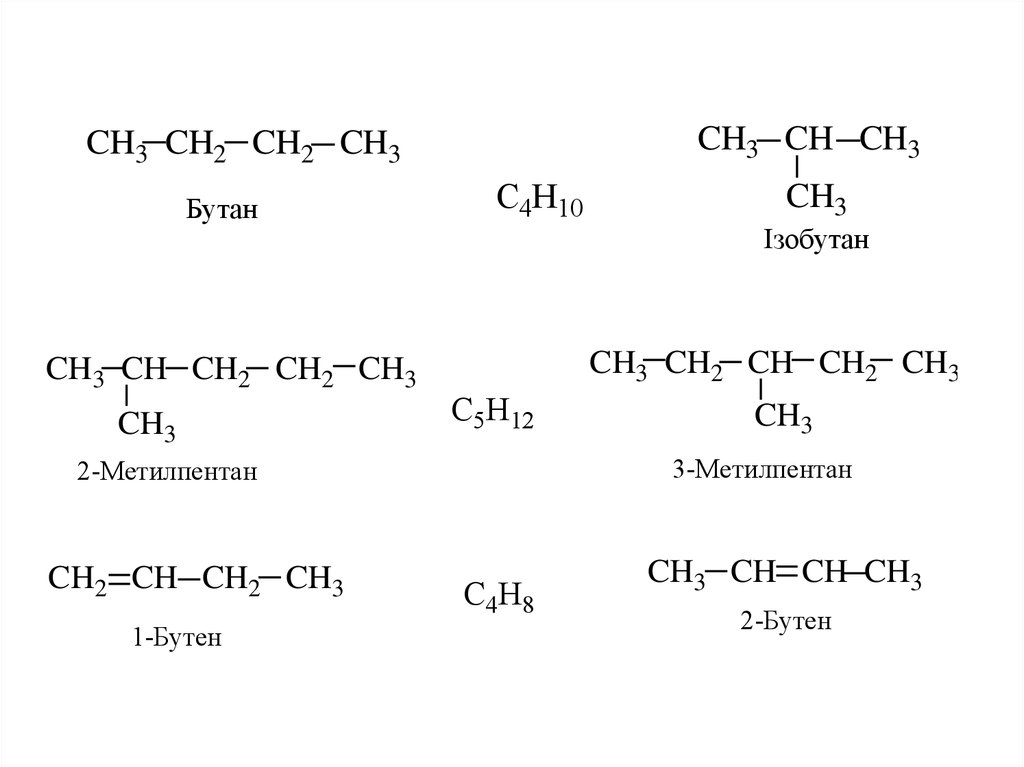
СТРУКТУРНА ІЗОМЕРІЯCH3 CH CH3
CH3 CH2 CH2 CH3
Бутан
CH3 CH CH2 CH2 CH3
CH3
C4H10
Ізобутан
CH3 CH2 CH CH2 CH3
C5H12
1-Бутен
CH3
3-Метилпентан
2-Метилпентан
CH2 CH CH2 CH3
CH3
C4H8
CH3 CH CH CH3
2-Бутен
2.
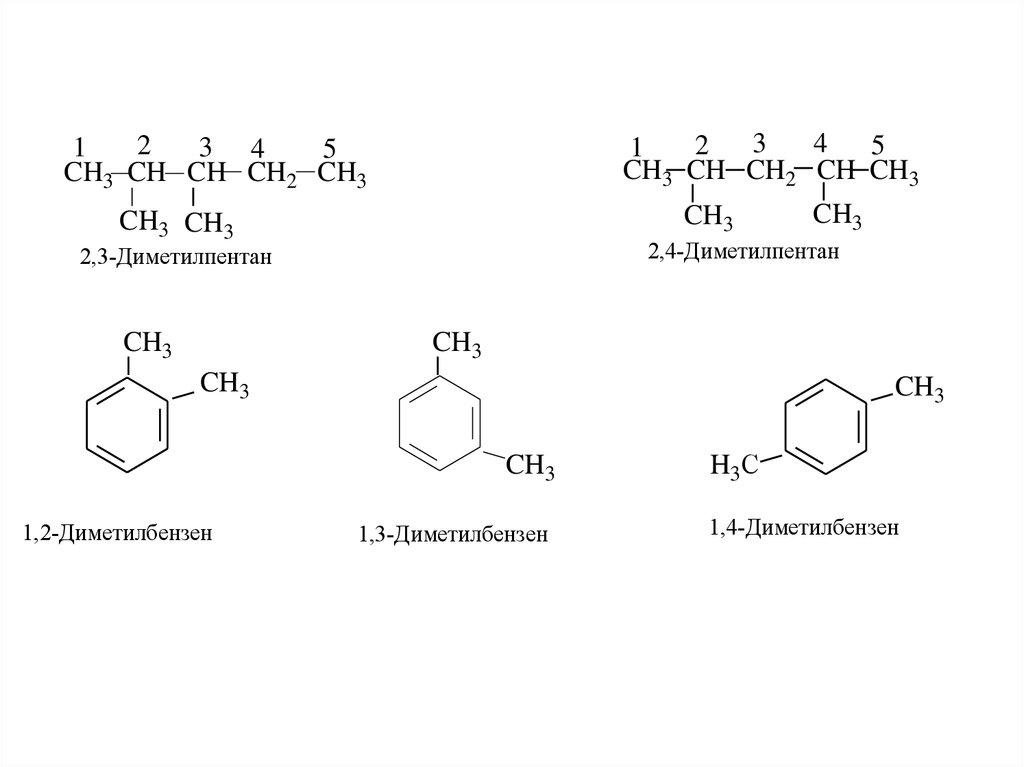
34
2
5
1
CH3 CH CH2 CH CH3
2
1
3 4
5
CH3 CH CH CH2 CH3
CH3
CH3 CH3
2,4-Диметилпентан
2,3-Диметилпентан
CH3
CH3
CH3
CH3
CH3
CH3
1,2-Диметилбензен
1,3-Диметилбензен
H3С
1,4-Диметилбензен
3. Просторова ізомерія (стереоізомерія) Стереоізомерія поділяється на: Геометричну Оптичну Конформаційну.
ПРОСТОРОВА ІЗОМЕРІЯ(СТЕРЕОІЗОМЕРІЯ)
Стереоізомерія поділяється на:
Геометричну
Оптичну
Конформаційну.
4. Геометрична ізомерія (цис-, транс-ізомерія або π-діастереоізомерія)
Геометрична ізомерія (цис-, транс-ізомерія або πдіастереоізомерія)СН3 СН СН СН3
2-Бутен
Н3С
Н
СН3
С
С
Н
С
цис-2-Бутен
Н
транс-2-Бутен
СН3
Н
Н
С
Н3С
Н
Н3С
СН3
цис-1,З-Диметилциклобутан
СН3
Н
Н
Н3С
транс-1,3-Диметилциклобутан
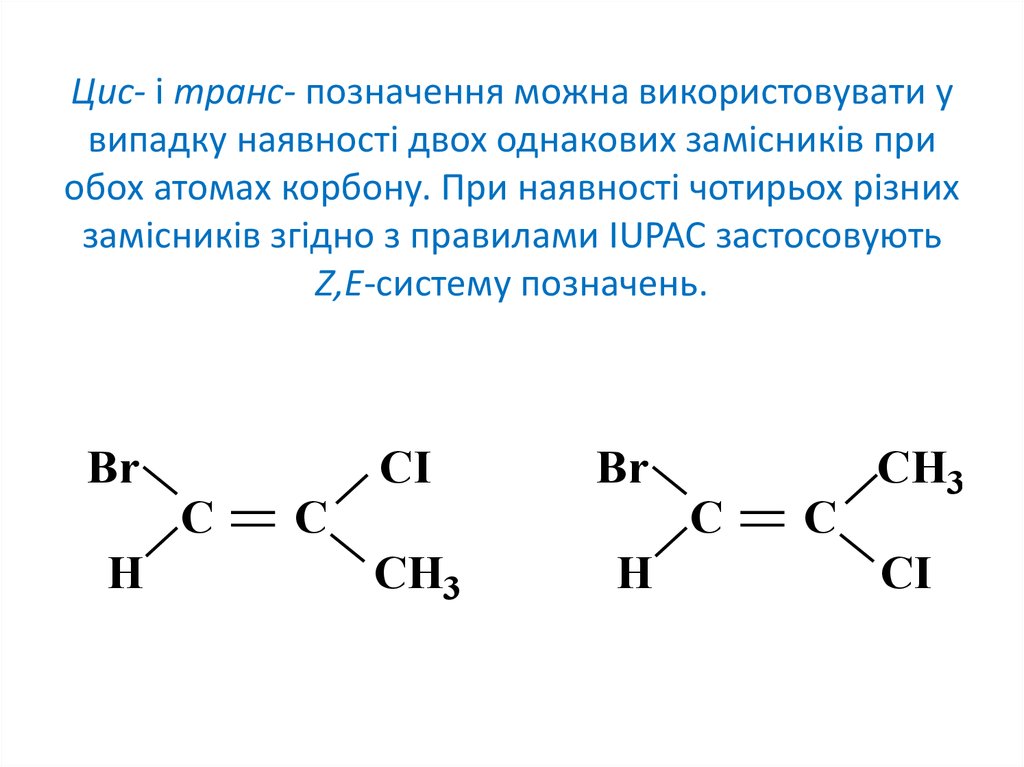
5. Цис- і транс- позначення можна використовувати у випадку наявності двох однакових замісників при обох атомах корбону. При
наявності чотирьох різнихзамісників згідно з правилами IUPAC застосовують
Z,E-систему позначень.
Br
Н
С
С
CI
Br
СН3
Н
С
С
СН3
CI
6. Для цього спочатку визначають старшого замісника при кожному атомі вуглецю. Старшість атома визначається його порядковим
номером вперіодичній системі елементів. Так, наймолодший
замісник водень, за ним ідуть Lі, Ве, С, N, О, F і так
далі. У випадку функціональних груп старшість
визначається природою першого атому (—SО3Н > —
ОН > —NН2 > —СН3), а у випадку їх рівності —
природою другого (—СН2—СН3 < —СН2—NН2 < —
СН2—OH < —CH2—F) і так далі. У випадку груп з
різними типами зв'язків старшість зростає в ряді:
CH2 OH <
C
O
<
H
C
O
<
R
C
O
;
OH
CH2 NH2 < C
NH
H
<
C N
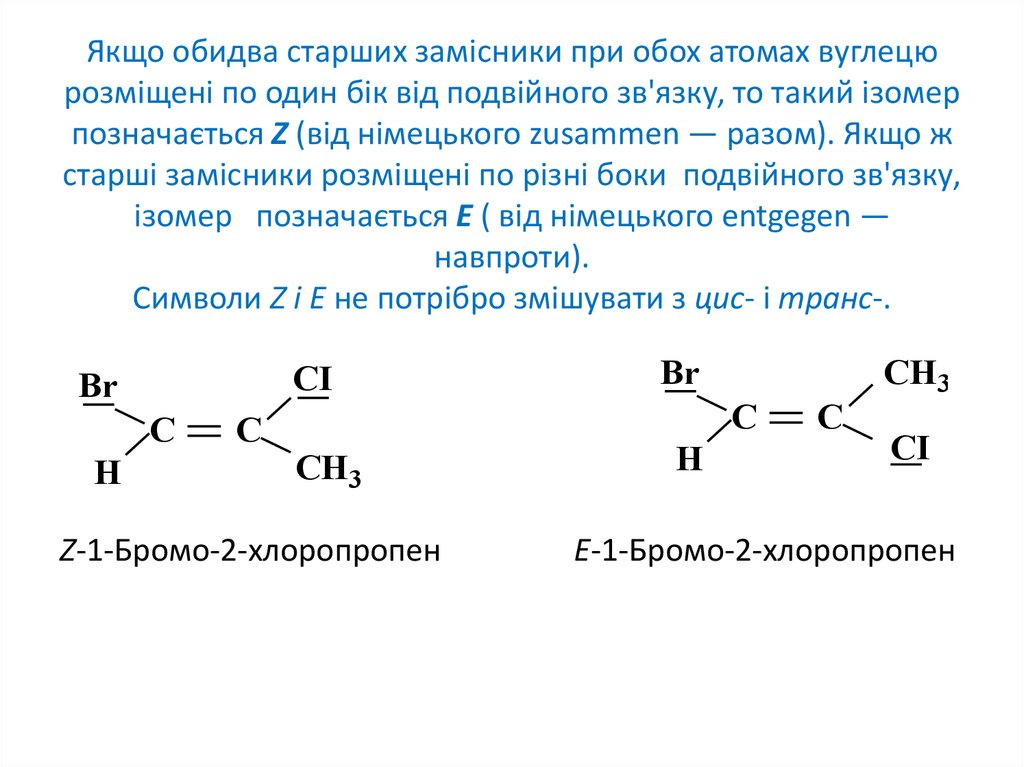
7. Якщо обидва старших замісники при обох атомах вуглецю розміщені по один бік від подвійного зв'язку, то такий ізомер
позначається Z (від німецького zusammen — разом). Якщо жстарші замісники розміщені по різні боки подвійного зв'язку,
ізомер позначається Е ( від німецького entgegen —
навпроти).
Символи Z і Е не потрібро змішувати з цис- і транс-.
CI
Br
С
Н
С
СН3
Z-1-Бромо-2-хлоропропен
Br
С
Н
С
СН3
CI
Е-1-Бромо-2-хлоропропен
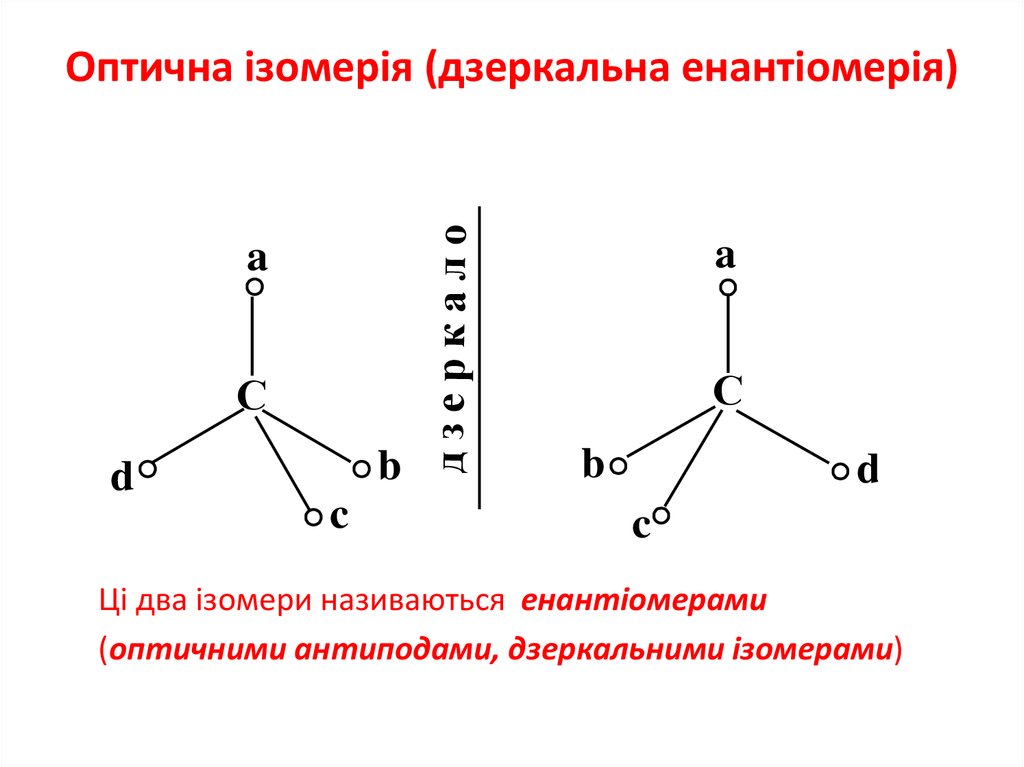
8. Оптична ізомерія (дзеркальна енантіомерія)
aC
d
b
c
дзеркало
Оптична ізомерія (дзеркальна енантіомерія)
a
C
b
d
c
Ці два ізомери називаються енантіомерами
(оптичними антиподами, дзеркальними ізомерами)
9. Енантіомери мають однаковий якісний і кількісний склад, однакову хімічну будову і відрізняються лише просторовим розташуванням
замісників біля асиметричного атомавуглецю — так званою просторовою конфігурацією.
• Речовини, що складаються з асиметричних молекул,
проявляють оптичну активність — їх розчини обертають
площину поляризації плоско-поляризованого проміня світла.
Якщо один енантіомер обертає її за годинниковою стрілкою,
то другий — проти.
• Той оптичний антипод, що обертає площину поляризації за
годинниковою стрілкою називається правообертаючим і
позначається (d) або (+), а той, що проти — лівообертаючим і
позначається (ℓ) або (—).
10. Звичайні структурні формули не дозволяють передати реальну просторову конфігурацію молекули.
Для відображення просторової конфігураціїнайчастіше застосовують
• формули з клиноподібними
зв'язками
• проекційні формули Е.Фішера.
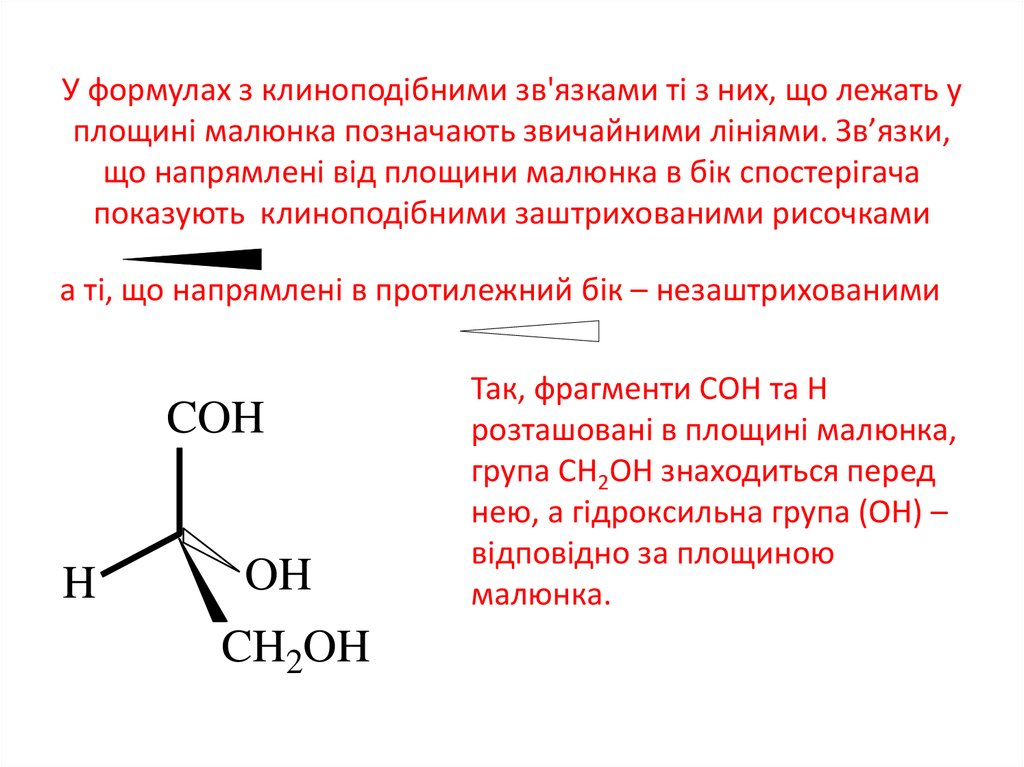
11. У формулах з клиноподібними зв'язками ті з них, що лежать у площині малюнка позначають звичайними лініями. Зв’язки, що
напрямлені від площини малюнка в бік спостерігачапоказують клиноподібними заштрихованими рисочками
а ті, що напрямлені в протилежний бік – незаштрихованими
COH
H
OH
CH2OH
Так, фрагменти СОН та Н
розташовані в площині малюнка,
група СН2ОН знаходиться перед
нею, а гідроксильна група (ОН) –
відповідно за площиною
малюнка.
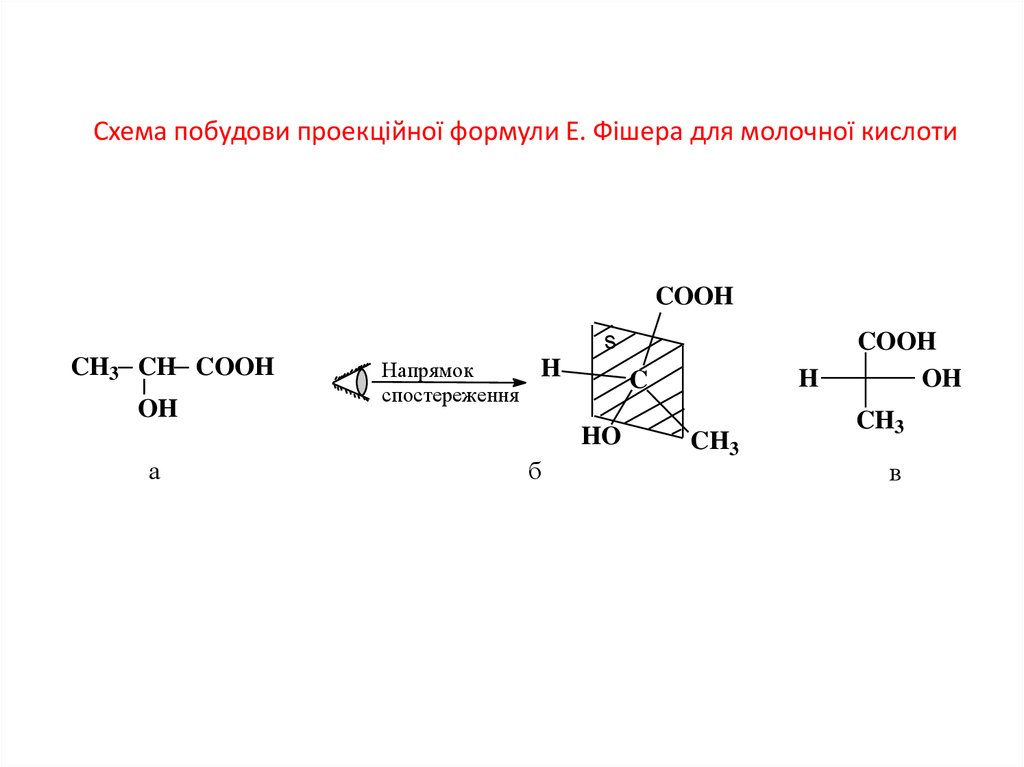
12. Схема побудови проекційної формули Е. Фішера для молочної кислоти
COOHs
CH3 CH COOH
OH
Напрямок
спостереження
H
HO
а
б
H
C
CH3
COOH
OH
CH3
в
13.
• Кожна тетраедрична модель з хіральниматомом вуглецю може бути подана
дванадцятьма проекціями Фішера —
залежно від розміщення замісників
відносно напряму спостереження.
• Для зменшення кількості формул, згідно з
правилами IUPAC, головну функціональну
групу розташовують зверху, а головний
вуглецевий ланцюг — вертикально.
14.
• При використанні фішеровських формул сліддотримуватись певних правил:
• Формули Фішера можна повертати в площині на кут
кратний 180о і не можна повертати на кут 90о, 270о, 450о
тощо.
• У формулах Фішера дозволяється міняти місцями за
годинниковою стрілкою або проти неї три замісники біля
асиметричного атома вуглецю.
• Переміна місцями двох будь-яких замісників веде до
формули антиподу.
b
a
b
c
d
c
a
d
a
c
a
b
d
c
b
d
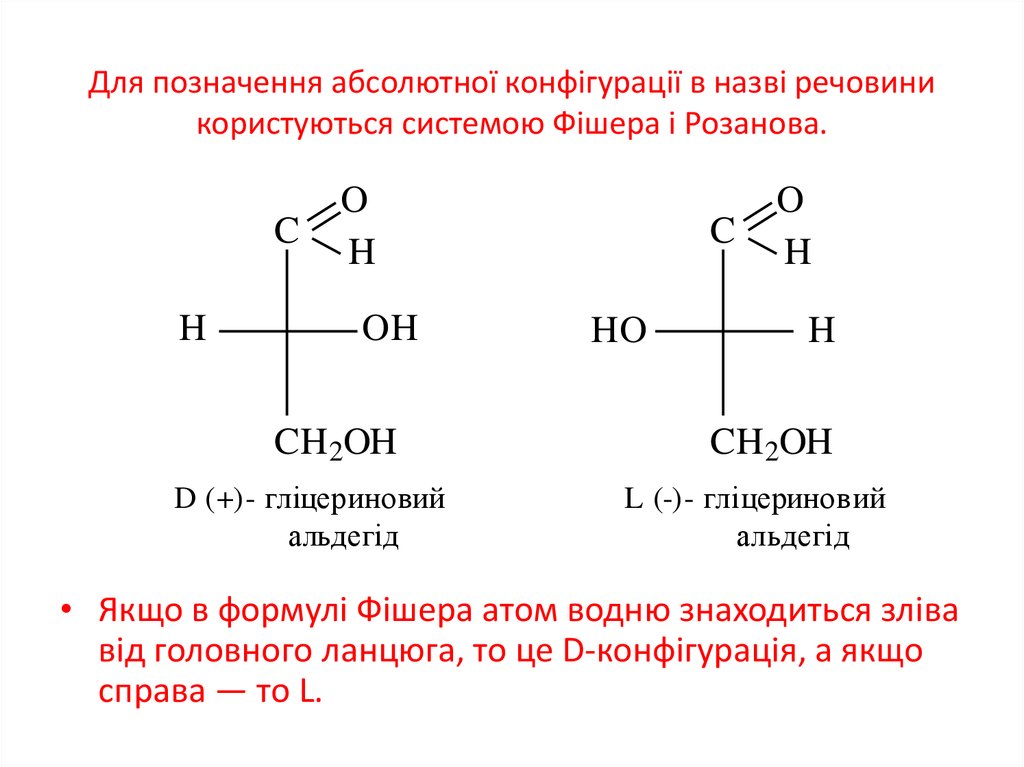
15. Для позначення абсолютної конфігурації в назві речовини користуються системою Фішера і Розанова.
CH
O
H
OH
CH 2OH
D (+)- гліцериновий
альдегід
C
HO
O
H
H
CH2OH
L (-)- гліцериновий
альдегід
• Якщо в формулі Фішера атом водню знаходиться зліва
від головного ланцюга, то це D-конфігурація, а якщо
справа — то L.
16. Універсальна система Р.Кана, К.Інгольда і В.Прелога позначення абсолютної конфігурації молекули
• Нехай старшість замісників зменшується впорядку а>b>c>d. Для застосування R, Sсистеми, молекулу необхідно розмістити в
просторі таким чином, щоб око спостерігача
знаходилося на осі: хіральний центр —
наймолодший замісник (найчастіше це
водень) і так щоб цей наймолодший
замісник був з протилежного боку по
відношенню до ока спостерігача.
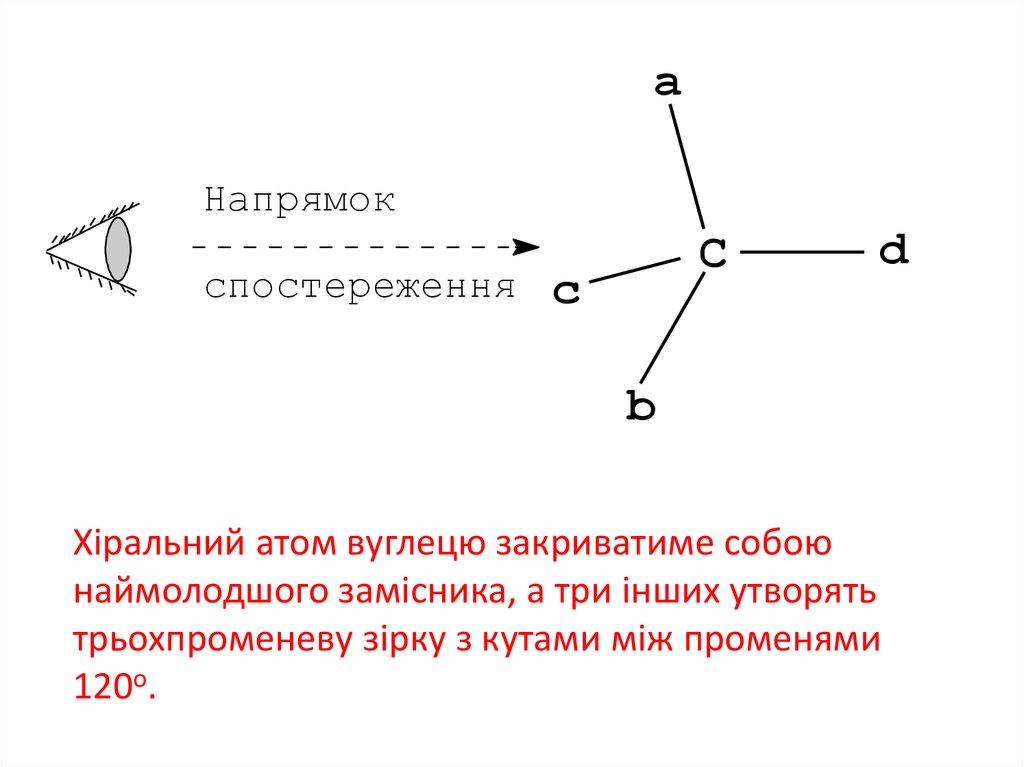
17.
aНапрямок
спостереження
C
c
d
b
Хіральний атом вуглецю закриватиме собою
наймолодшого замісника, а три інших утворять
трьохпроменеву зірку з кутами між променями
120о.
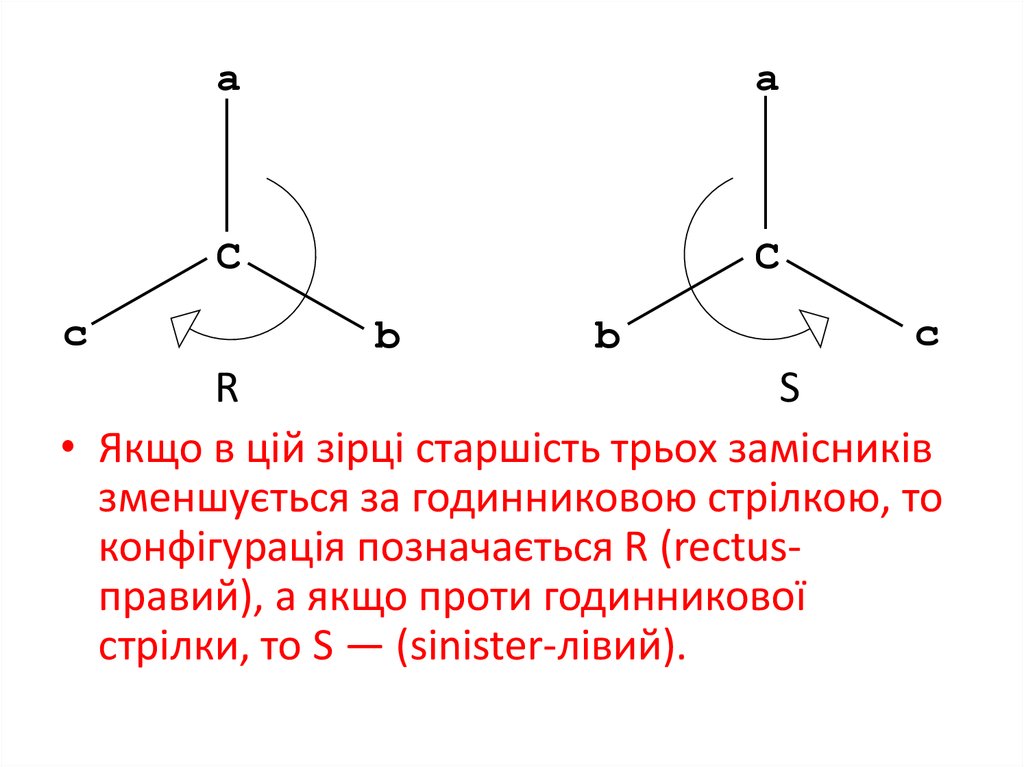
18.
ca
a
C
C
b
b
c
R
S
• Якщо в цій зірці старшість трьох замісників
зменшується за годинниковою стрілкою, то
конфігурація позначається R (rectusправий), а якщо проти годинникової
стрілки, то S — (sinister-лівий).
19. При наявності в молекулі кількох хіральних атомів вуглецю, необхідно розглядати кожен з них окремо.
• Визначити R або S-конфігурацію можна ібезпосередньо на основі проекційної формули
Фішера. Для цього зручно користуватись
“оберненим” принципом В.Потапова.
• “Якщо в проекційній формулі Фішера
старшість трьох найстарших замісників
зменшується за годинниковою стрілкою,
то молекула має S-конфігурацію, а якщо
проти годинникової стрілки, то — R.”
20. Конформаційна (поворотна) ізомерія
• Конформація — певна конфігурація молекули впросторі, яка виникає в результаті обертання
фрагментів молекули навколо ординарного σ-зв'язку.
Ці стереоізомерні структури перебувають у
динамічній рівновазі і відрізняються між собою
стабільністю. Більш стабільні конформації (у яких
молекули перебувають більшу частину часу)
називаються конформерами або поворотними
ізомерами.
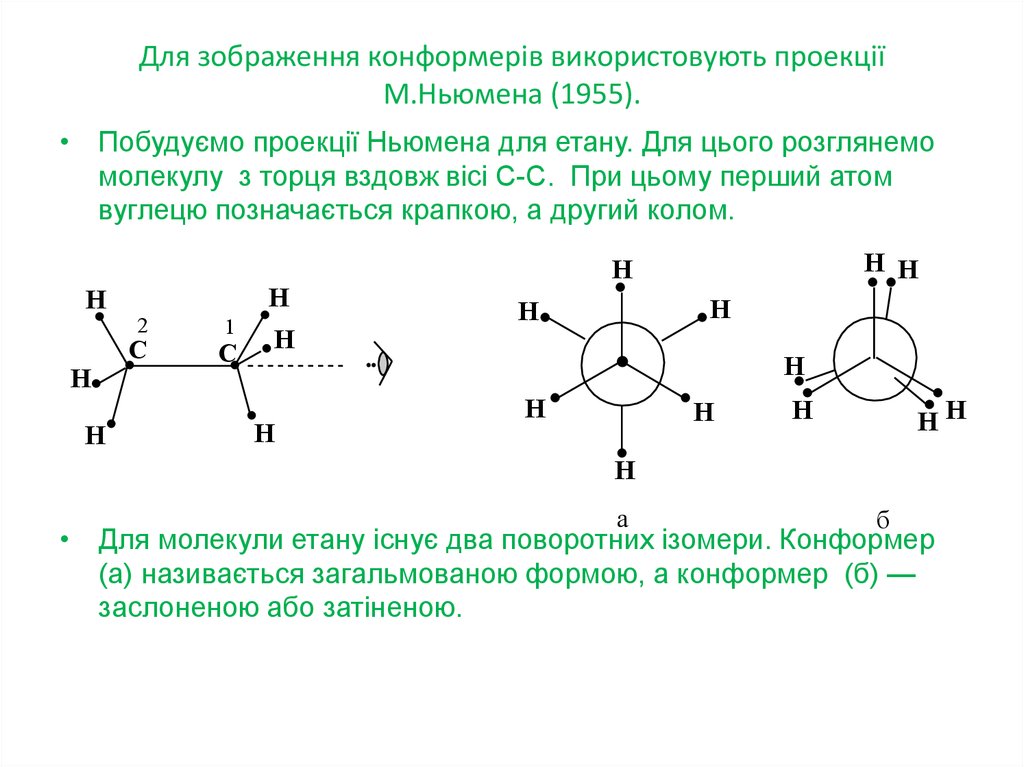
21. Для зображення конформерів використовують проекції М.Ньюмена (1955).
• Побудуємо проекції Ньюмена для етану. Для цього розглянемомолекулу з торця вздовж вісі С-С. При цьому перший атом
вуглецю позначається крапкою, а другий колом.
Н
Н
Н
Н
2
C
1
C
Н
Н
Н Н
Н
Н
Н
Н
Н
Н
Н
НН
Н
а
б
• Для молекули етану існує два поворотних ізомери. Конформер
(а) називається загальмованою формою, а конформер (б) —
заслоненою або затіненою.
22.
• Як структурна, так і просторова ізомерія може бутистатичною і динамічною.
• Якщо ізомери не можуть легко перетворюватись один
в одного, то такий різновид ізомерії відноситься до
статичної. Якщо ж ізомери можуть легко переходити
один в одного і утворюють рівноважну суміш, то такий
тип ізомерії відносять до динамічної. Структурні
ізомери, що перебувають у динамічній рівновазі
називають таутомерами. Характерним прикладом
таутомерії може служити кето-енольна таутомерія:
CH3 C CH3
CH3 C CH2
O
OH
Кетонна форма
Енольна форма
23. Класифікація органічних сполук
КЛАСИФІКАЦІЯ ОРГАНІЧНИХ СПОЛУК• за будовою вуглецевого скелета.
• Ациклічні (аліфатичні) – насичені та
ненасичені,
• Карбоциклічні (аліциклічні та
ароматичні),
• Гетероциклічні.
24. Існує також інший спосіб класифікації - за функціональними групами, оскільки кожен з вищенаведених класів може мати
різноманітні функціональні похідні.• Функціональною групою називається угрупування
атомів, що надає молекулі певних хімічних
властивостей.
25.
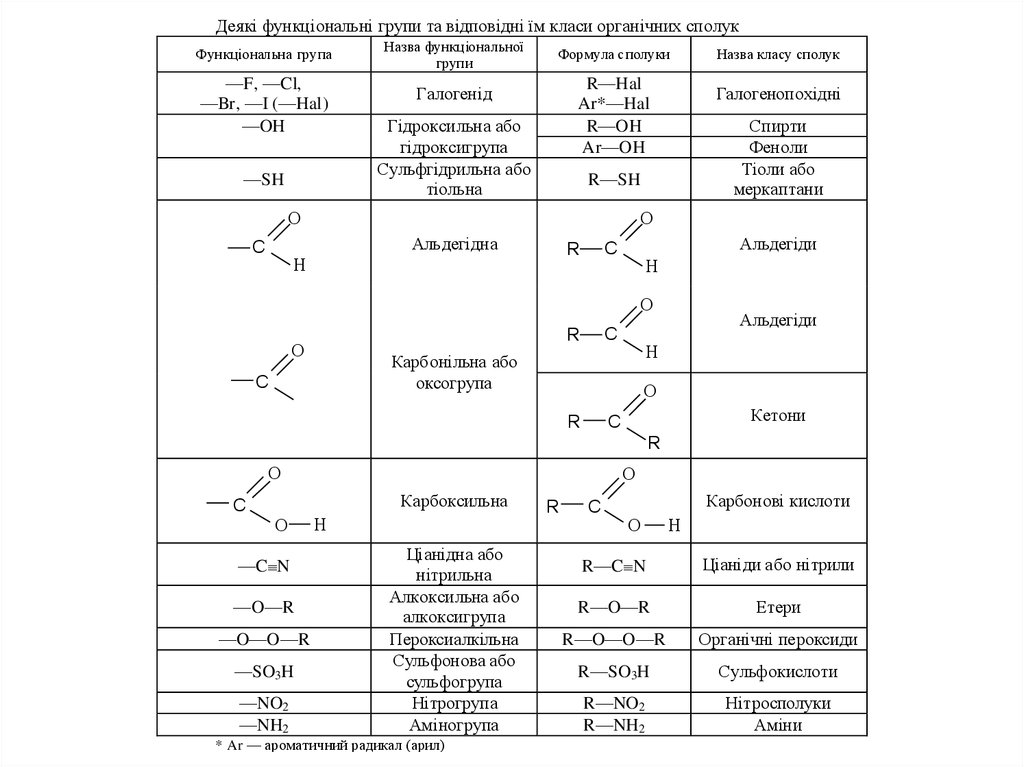
Деякі функціональні групи та відповідні їм класи органічних сполукФункціональна група
—F, —Cl,
—Br, —I (—Hal)
—OH
—SH
Назва функціональної
групи
Формула сполуки
Назва класу сполук
R—Hal
Ar*—Hal
R—OH
Ar—OH
Галогенопохідні
Галогенід
Гідроксильна або
гідроксигрупа
Сульфгідрильна або
тіольна
R—SH
C
Спирти
Феноли
Тіоли або
меркаптани
Альдегідна
Альдегіди
C
R
C
R
Карбонільна або
оксогрупа
C
Альдегіди
R
Кетони
C
R
C
Карбоксильна
—C N
—O—R
—O—O—R
—SO3 H
—NO2
—NH2
Ціанідна або
нітрильна
Алкоксильна або
алкоксигрупа
Пероксиалкільна
Сульфонова або
сульфогрупа
Нітрогрупа
Аміногрупа
* Ar — ароматичний радикал (арил)
R
C
Карбонові кислоти
R—C N
Ціаніди або нітрили
R—O—R
Етери
R—O—O—R
Органічні пероксиди
R—SO3H
Сульфокислоти
R—NO2
R—NH2
Нітросполуки
Аміни













 chemistry
chemistry








