Similar presentations:
Етери. Ізомерія та номенклатура
1. ЕТЕРИ
ЕТЕРИЕтери - це органічнi сполуки, в яких два вуглеводневих залишки
зв’язанi між собою через атом кисню або ще їх можна
розглядати як похідні вуглеводнів, у яких атом водню заміщено
алкоксигрупою. Їх загальна формула R-O-R′.
ІЗОМЕРІЯ ТА НОМЕНКЛАТУРА
Ізомерія етерів залежить від будови вуглеводневих залишків,
зв’язаних з киснем.
За систематичною номенклатурою їх називають за назвою
алкану, з яким зв’язана алкоксигрупа (R-O-). Причому, в основi
назви лежить алкан з найбільшою довжиною вуглецевого
ланцюга. За радикало-функціональною номенклатурою назва
утворюється з двох вуглеводневих залишків з додаванням слова
етер.
2. Назви етерів
CH3 O CH3Номенклатура
РадикалоЗамісникова IUPAC
функціональна
(тривіальна)
Метоксиметан
Диметиловий етер
CH3 O CH2CH3
Метоксіетан
C2H5 O C2H5
Етоксіетан
Структурна формула
2-Метоксипропан
CH3 O CH CH3
Етилметиловий
етер
Діетиловий етер
(етиловий етер)
Ізопропілметиловий етер
CH3
C2H5 O CH2CH2CH3
1-Етоксипропан
CH3 O CH CH2 CH3
2-Метоксибутан
CH3
CH3 CH O CH2 CH2 CH 2 CH 3 1-Ізопропоксибутан
CH3
Етилпропіловий
етер
втор-Бутилметиловий етер
Бутилізопропіловий етер
3. Методи одержання
МЕТОДИ ОДЕРЖАННЯ1.
Міжмолекулярна дегідратація спиртів у присутностi мінеральних
кислот
H2SO4
R OH
HO R
R O R
H2O
Дана реакція є алкілуванням одного спирту іншим. Вона протікає за
умови, що кислота взята не у надлишку, а температура реакції не дуже
висока (120-160о), інакше спирт відщепить воду і перетвориться на
алкен. Алкілуючий агент (протонований спирт або карбокатіон)
утворюється зi спирту при його взаємодії з кислотою:
CH3 CH2 O H
Повільно
H
CH3 CH2 O H
Протон
CH3 CH2
Карбокатіон
H
H2O
Протонований спирт
Швидко
CH3 CH2
H O CH2 CH3
CH3 CH2 O CH2 CH3
H
CH3CH2 O CH2 CH3
H
Діетиловий етер
Вторинні, а тим більше третинні спирти не утворюють етерів. У
присутності кислоти вони дегідратують з утворенням алкенів. Тому
етери третинних спиртів одержують іншим шляхом.
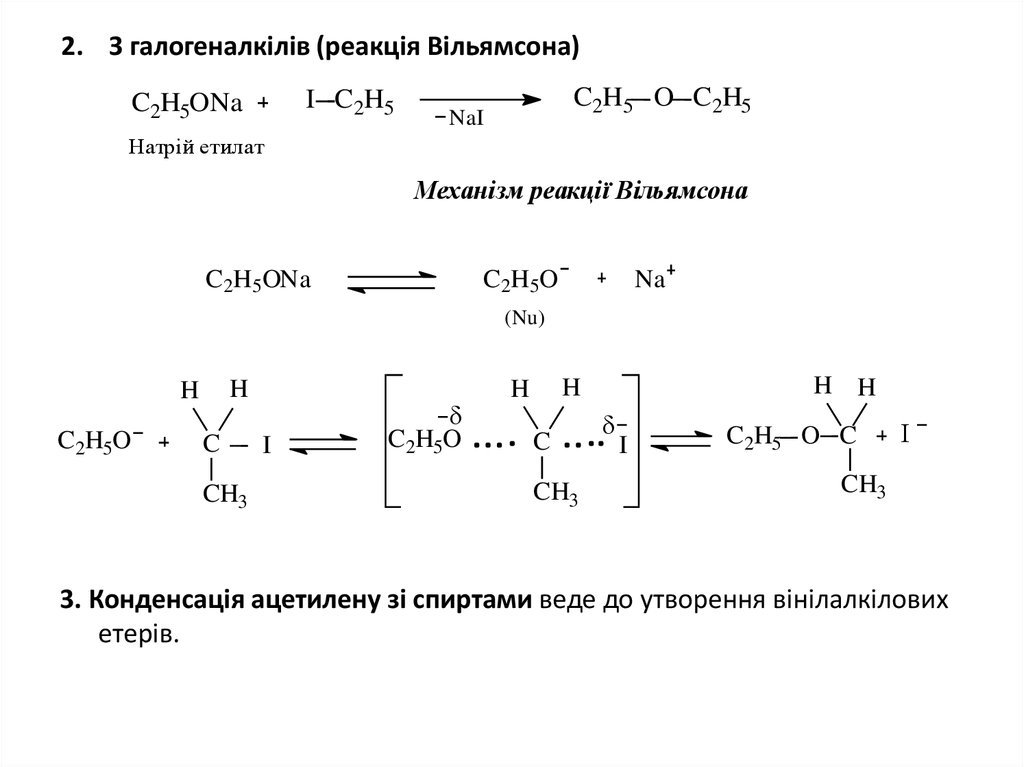
4. 2. З галогеналкілів (реакція Вільямсона)
I C2H5C2H5ONa
C2H5 O C2H5
NaI
Натрій етилат
Механізм реакції Вільямсона
C2H5ONa
C2H5O
Na
(Nu)
H
H
C2H5O
C
CH3
I
C2H5O
H H
H
H
C
CH3
I
C2H5 O C
I
CH3
3. Конденсація ацетилену зi спиртами веде до утворення вінілалкілових
етерів.
5. ФІЗИЧНІ ВЛАСТИВОСТІ
У етерів відсутнi водневi зв’язки, тому вони не розчиняються у водi iмають відносно низькi температури кипіння
С2Н5-ОН, tокип.= 78оС;
С2Н5-О-С2Н5, tо кип. = 34,6оC.
ХІМІЧНІ ВЛАСТИВОСТІ
Етери проявляють сильнішi електронодонорнi властивостi порівняно зi
спиртами, за рахунок неподілених пар
електронів атома кисню. Таке
CH3
O
CH3 збільшення електроно-донорностi
пояснюється електронодонорним
характером алкільних груп, що проявляють +І-ефект. Тому етери є
основами Льюїса і розчиняються у сильних кислотах.
Однак уцілому етери є доволі інертними сполуками: не
гідролізуються, не взаємодіють з лугами, РС5, розведеними
кислотами.
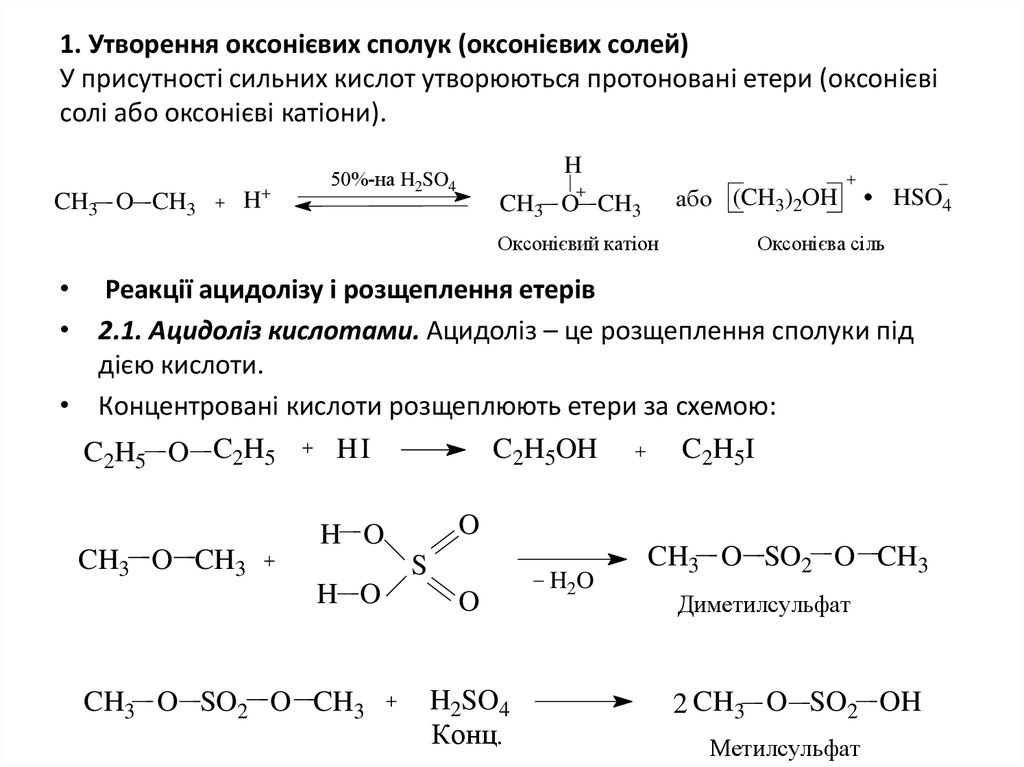
6. 1. Утворення оксонієвих сполук (оксонієвих солей) У присутностi сильних кислот утворюються протонованi етери (оксонієвi солi
або оксонієвi катіони).CH3 O CH3
H
H
50%-на H2SO4
або (CH3)2OH
CH3 O CH3
Оксонієвий катіон
HSO4
Оксонієва сіль
• Реакції ацидолізу i розщеплення етерів
• 2.1. Ацидоліз кислотами. Ацидоліз – це розщеплення сполуки під
дією кислоти.
• Концентрованi кислоти розщеплюють етери за схемою:
C2H5 O C2H5
CH3 O CH3
HI
C2H5OH
O
H O
S
H O
CH3 O SO2 O CH3
C2H5I
O
H2SO4
Конц.
H2O
CH3 O SO2 O CH3
Диметилсульфат
2 CH3 O SO2 OH
Метилсульфат
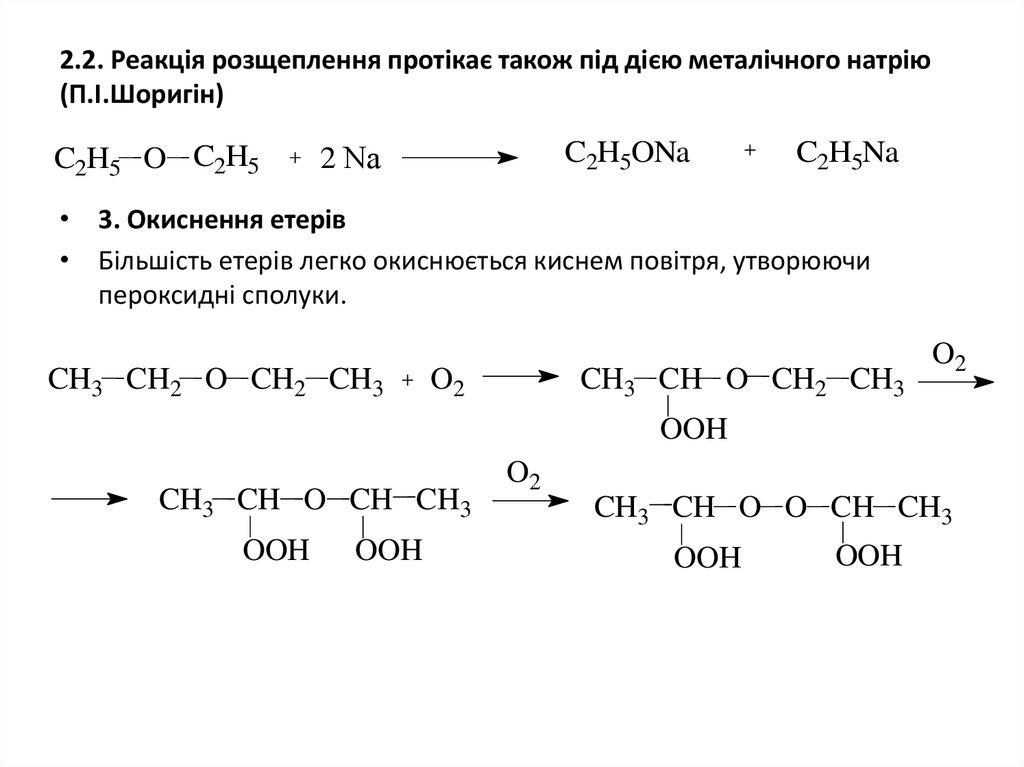
7. 2.2. Реакція розщеплення протікає також під дією металічного натрію (П.І.Шоригін)
C2H5 O C2H52 Na
C2H5ONa
C2H5Na
• 3. Окиснення етерів
• Більшість етерів легко окиснюється киснем повітря, утворюючи
пероксиднi сполуки.
CH3 CH2 O CH2 CH3
O2
CH3 CH O CH2 CH3
O2
OOH
CH3 CH O CH CH3
OOH
OOH
O2
CH3 CH O O CH CH3
OOH
OOH
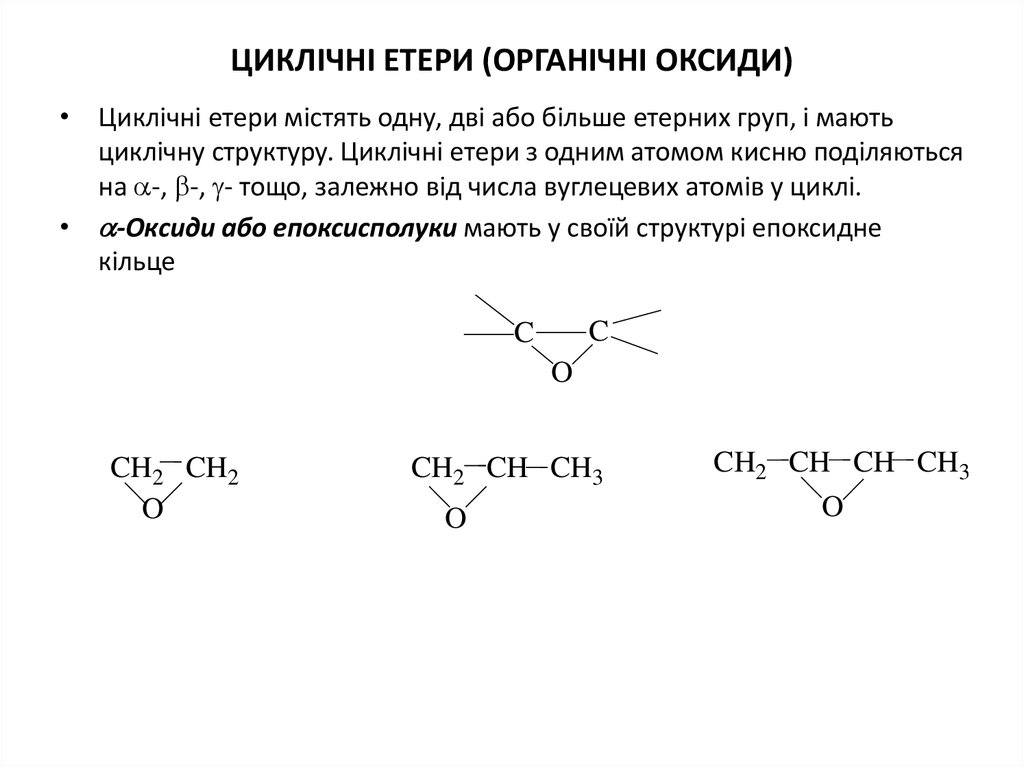
8. ЦИКЛІЧНІ Етери (ОРГАНІЧНІ ОКСИДИ)
ЦИКЛІЧНІ ЕТЕРИ (ОРГАНІЧНІ ОКСИДИ)• Циклічні етери містять одну, дві або більше етерних груп, i мають
циклічну структуру. Циклічнi етери з одним атомом кисню поділяються
на -, -, - тощо, залежно від числа вуглецевих атомів у циклі.
• -Оксиди або епоксисполуки мають у своїй структурi епоксидне
кільце
C
C
O
CH2 CH2
O
CH2 CH CH3
O
CH2 CH CH CH3
O
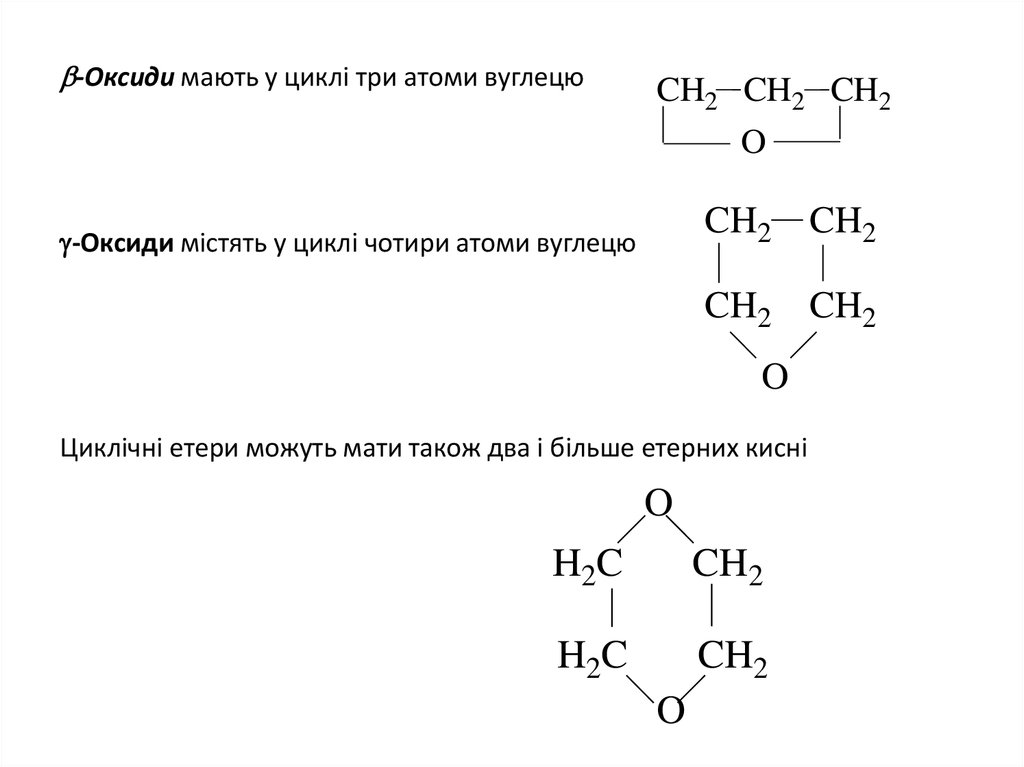
9. -Оксиди мають у циклi три атоми вуглецю
-Оксиди мають у циклi три атоми вуглецюCH2 CH2 CH2
O
CH2 CH2
-Оксиди містять у циклi чотири атоми вуглецю
CH2 CH2
O
Циклічнi етери можуть мати також два і більше етерних кисні
O
H2C
CH2
H2C
CH2
O
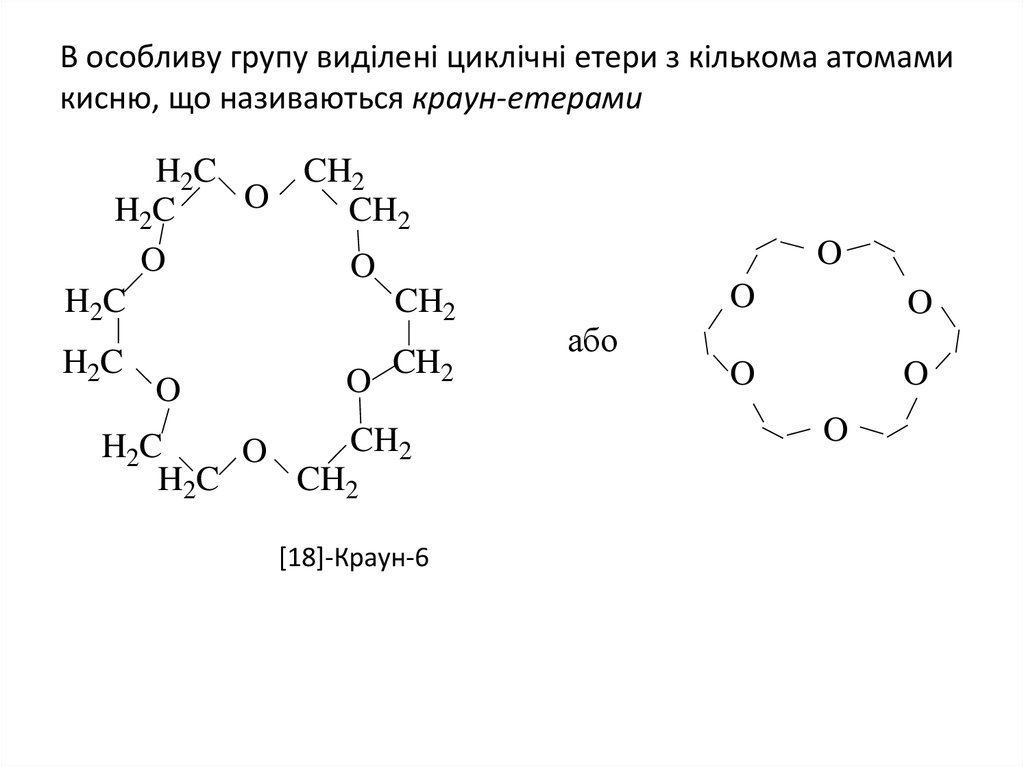
10. В особливу групу виділенi циклічнi етери з кількома атомами кисню, що називаються краун-етерами
H2CCH2
O
H2C
CH2
O
O
H2C
CH2
H2C
O
O
CH2
CH2
H2C
O
H2C
CH2
[18]-Краун-6
O
O
O
O
O
або
O
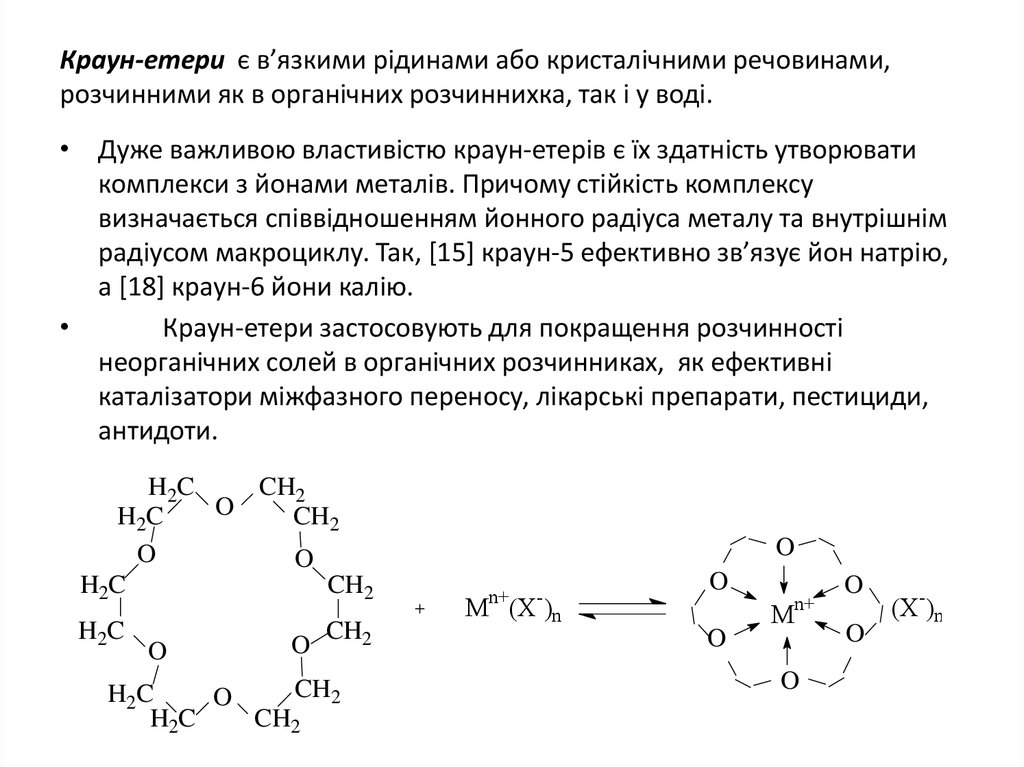
11. Краун-етери є в’язкими рідинами або кристалічними речовинами, розчинними як в органічних розчиннихка, так і у воді.
• Дуже важливою властивістю краун-етерів є їх здатність утворюватикомплекси з йонами металів. Причому стійкість комплексу
визначається співвідношенням йонного радіуса металу та внутрішнім
радіусом макроциклу. Так, [15] краун-5 ефективно зв’язує йон натрію,
а [18] краун-6 йони калію.
Краун-етери застосовують для покращення розчинності
неорганічних солей в органічних розчинниках, як ефективні
каталізатори міжфазного переносу, лікарські препарати, пестициди,
антидоти.
H2C
CH2
O
H2C
CH2
O
O
H2C
CH2
H2C
O
O
CH2
CH2
H2C
O
H2C
CH2
O
n+
-
М (X )n
O
n+
М
O
O
O
O
-
(X )n
12. Одержання епоксидних сполук
ОДЕРЖАННЯ ЕПОКСИДНИХ СПОЛУК• 1. Епоксисполуки одержують з етену або пропену двома шляхами.
– З алкіленхлорогідринів - реакцією дегідрохлорування (див.стор.)
Причому утворення епоксидів можливе лише при трансположеннi СІ та ОН
OH
NaOH
CH2 СН2
HCI
CH2 CH2
O
CI
• 1.2. Окиснення алкенів
• Окиснення етилену ведуть в присутностi срібного каталізатора
2 CH2 CH2
O2
Ag
1,2-1,5 мПа
250-280o
2 CH2 CH2
O
13. ХІМІЧНІ ВЛАСТИВОСТІ ЕПОКСИДНИХ СПОЛУК
0 ,145
нм
• Епоксидне кільце має вигляд правильного трикутника зі значно
деформованими валентними кутами.
Таке угруповання відносно нестійке i
H
H
0,150 нм
полярне. Зв’язок С—О в епоксидному
C
C
кільцi розривається легко i для
o
H
H
61
епоксидів характернi реакції
приєднання з розщепленням кільця.
O
Вони відбуваються за механізмами SN1 або SN2.
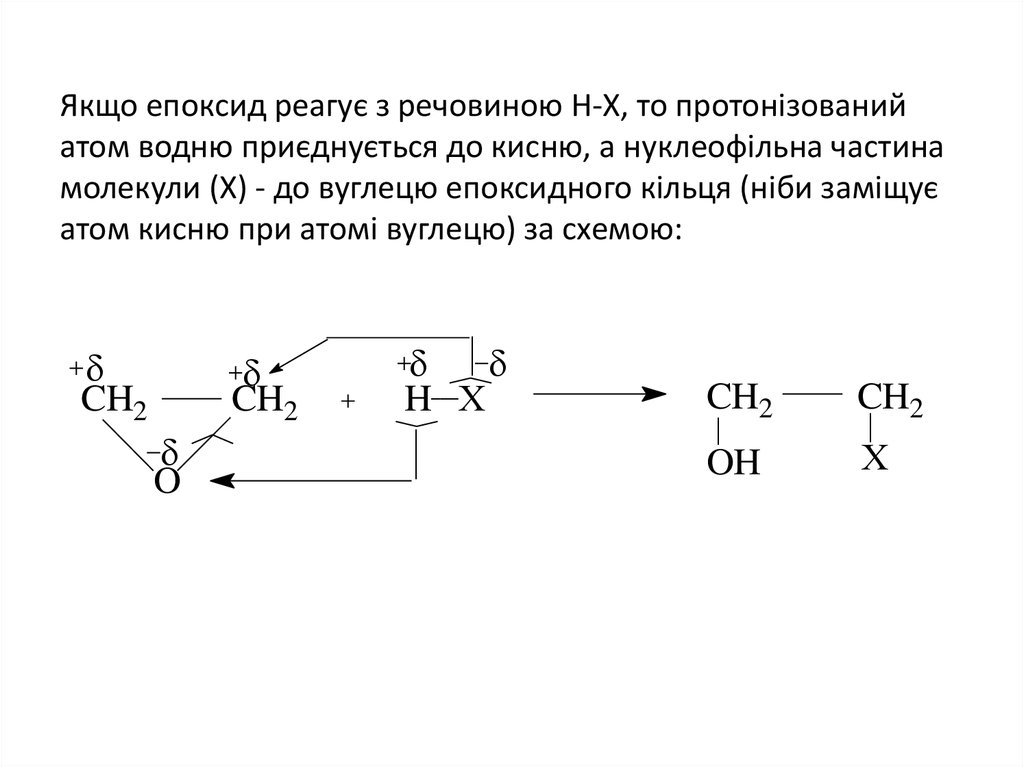
14. Якщо епоксид реагує з речовиною Н-Х, то протонізований атом водню приєднується до кисню, а нуклеофільна частина молекули (Х) -
до вуглецю епоксидного кільця (ніби заміщуєатом кисню при атомi вуглецю) за схемою:
CH2
CH2
O
H X
CH2
CH2
OH
X
15.
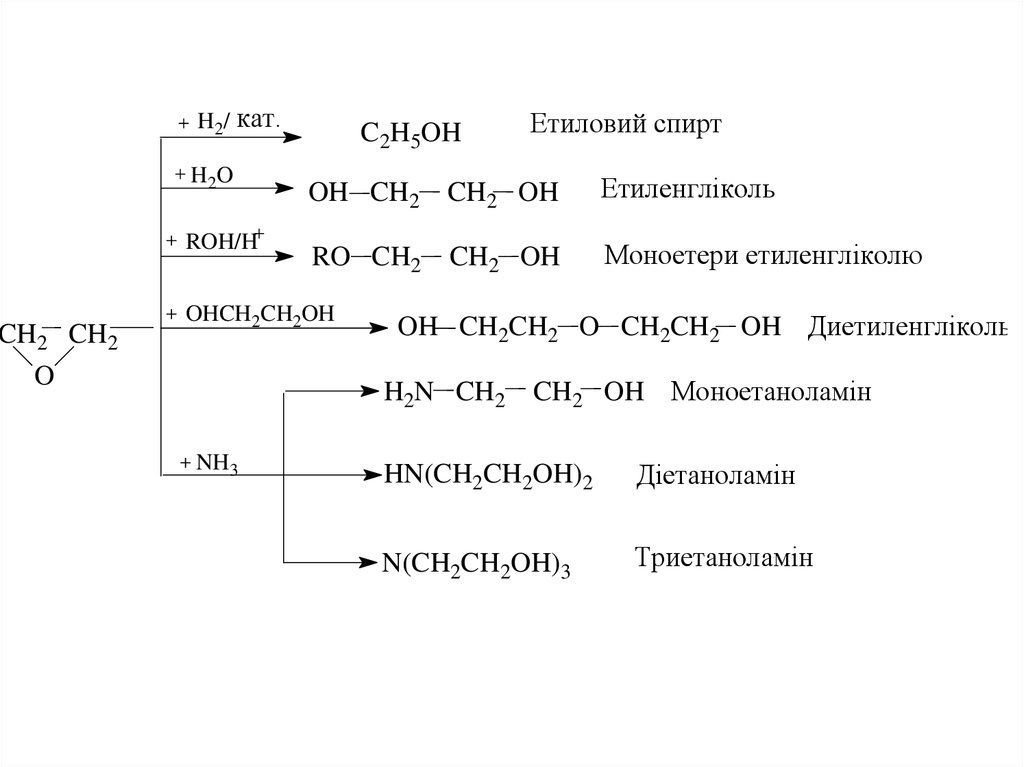
CH2 CH2O
H2/ кат.
H2O
ROH/H
C2H5OH
OH CH2
CH2 OH
Етиленгліколь
RO CH2
CH2 OH
Моноетери етиленгліколю
OHCH2CH2OH
OH CH2CH2 O CH2CH2 OH Диетиленгліколь
H2N CH2
NH3
Етиловий спирт
CH2 OH Моноетаноламін
HN(CH2CH2OH)2
Діетаноламін
N(CH2CH2OH)3
Триетаноламін
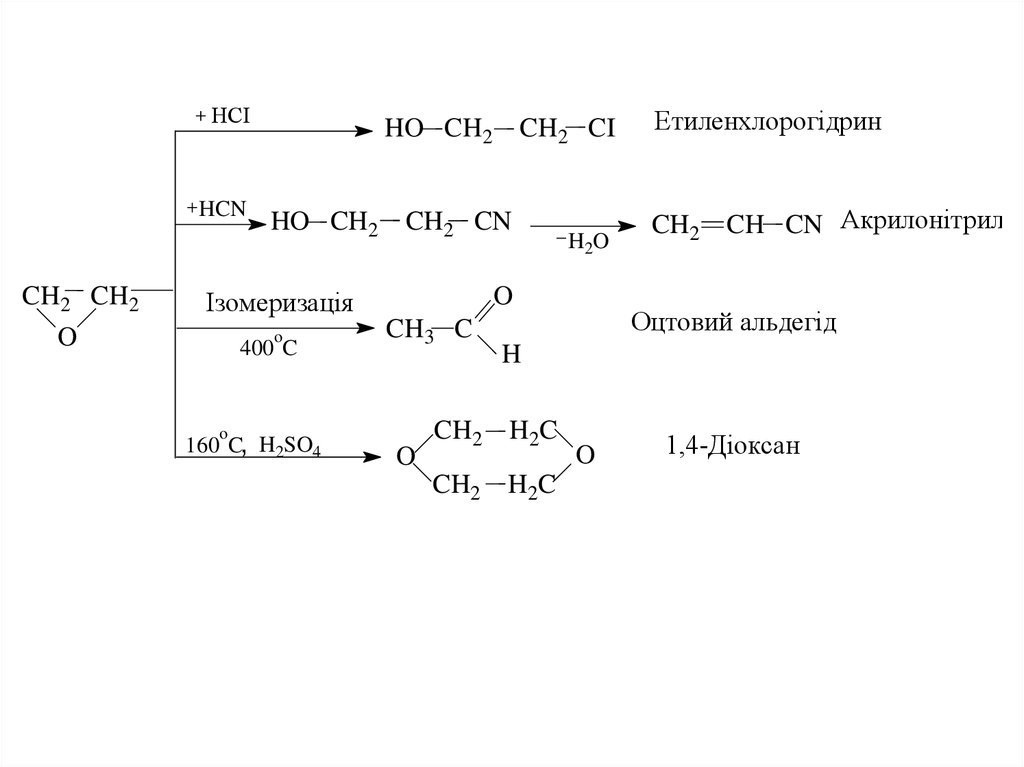
16.
HCIHCN
CH2 CH2
O
HO CH2
HO CH2
CH2 CN
400 C
CH3 C
o
160 C, H2SO4
H2 O
O
Ізомеризація
o
CH2 CI
O
Етиленхлорогідрин
CH2
CH CN Акрилонітрил
Оцтовий альдегід
H
CH2
H 2C
CH2
H 2C
O
1,4-Діоксан
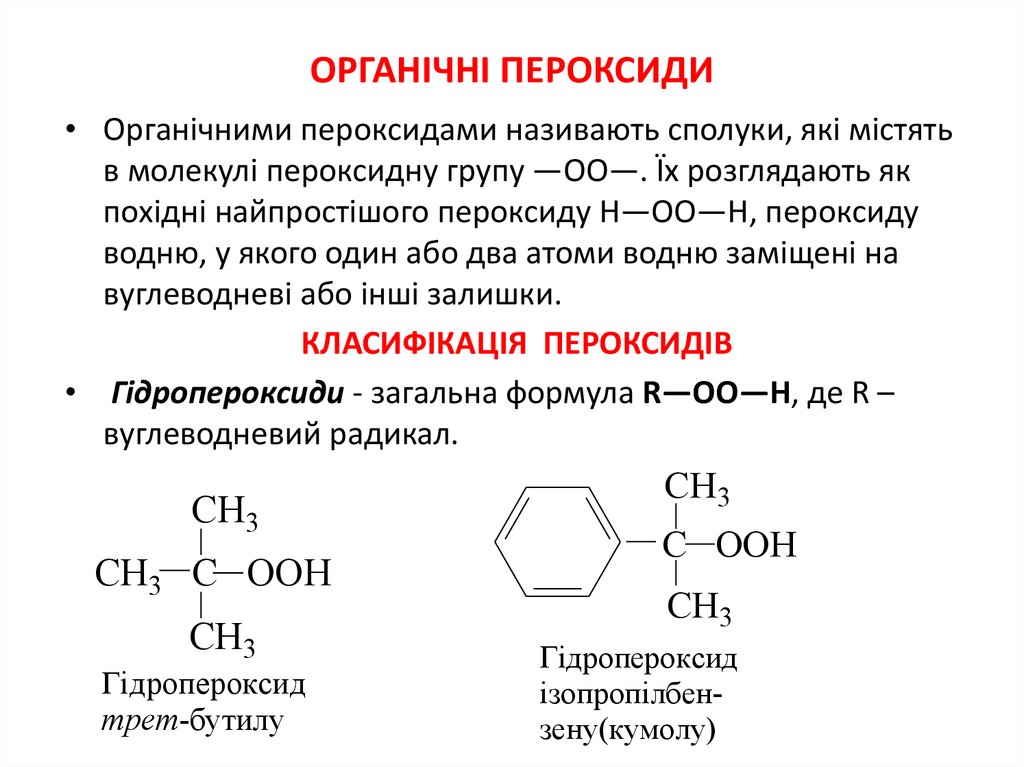
17. ОРГАНІЧНІ ПЕРОКСИДИ
• Органічними пероксидами називають сполуки, якi містятьв молекулі пероксидну групу —ОО—. Їх розглядають як
похіднi найпростішого пероксиду Н—ОО—Н, пероксиду
водню, у якого один або два атоми водню заміщенi на
вуглеводневi або іншi залишки.
КЛАСИФІКАЦІЯ ПЕРОКСИДІВ
• Гідропероксиди - загальна формула R—OO—H, де R –
вуглеводневий радикал.
CH3
CH3 C OOH
CH3
Гідропероксид
трет-бутилу
CH3
C OOH
CH3
Гідропероксид
ізопропілбензену(кумолу)
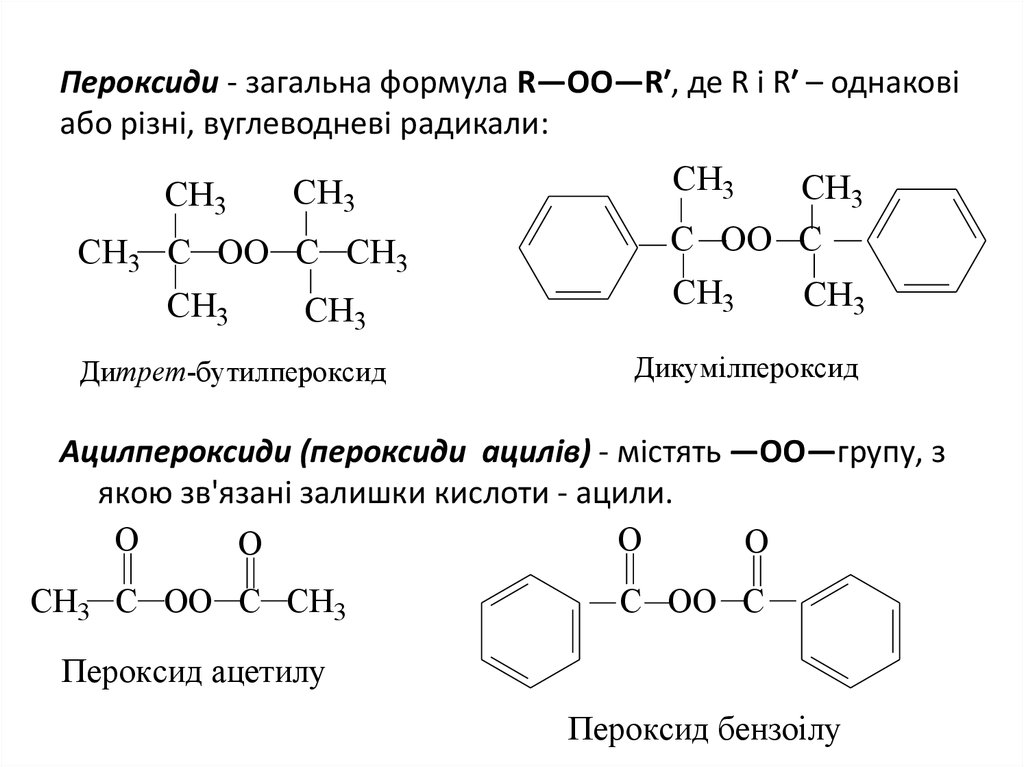
18. Пероксиди - загальна формула R—OO—R′, де R i R′ – однаковi або різні, вуглеводневі радикали:
CH3CH3
CH3 C OO C CH3
CH3
CH3
Дитрет-бутилпероксид
CH3
CH3
C OO C
CH3
CH3
Дикумілпероксид
Ацилпероксиди (пероксиди ацилів) - містять —ОО—групу, з
якою зв'язані залишки кислоти - ацили.
О
О
О
О
CH3 C OO C CH3
C OO C
Пероксид ацетилу
Пероксид бензоілу
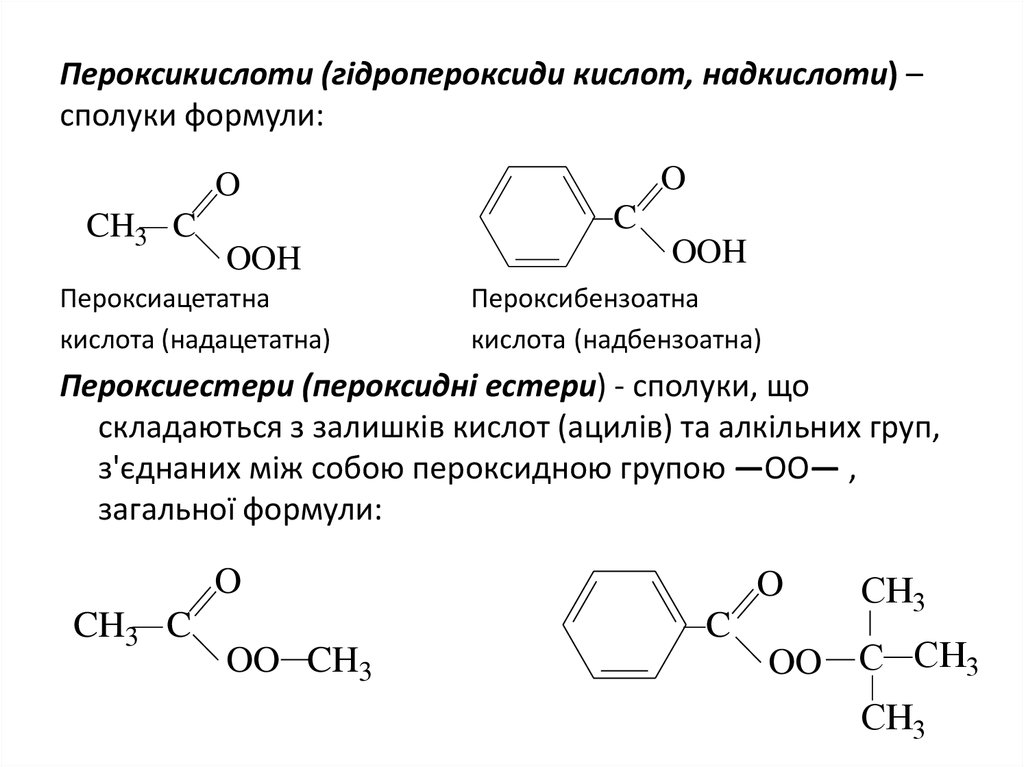
19. Пероксикислоти (гідропероксиди кислот, надкислоти) – сполуки формули:
OO
CH3 C
C
OOH
Пероксиацетатна
кислота (надацетатна)
OOH
Пероксибензоатна
кислота (надбензоатна)
Пероксиестери (пероксиднi естери) - сполуки, що
складаються з залишків кислот (ацилів) та алкільних груп,
з'єднаних між собою пероксидною групою —ОО— ,
загальної формули:
O
CH3 C
O
C
OO CH3
CH3
OO C CH3
CH3
20. Загальною властивістю органічних пероксидів є гомолітичний розпад на вільнi радикали при нагріванні
oR O O R
t
2RO
• Тому їх застосовують для ініціювання реакцій полімеризації,
вулканізації каучуків, затвердіння ненасичених смол тощо.
Сьогодні вони все більше використовуються для модифікації
різноманітних полімерів з метою надання їм специфічних
властивостей, створення полімерних композитів та полімерів
спеціального призначення. Органічнi пероксиди, особливо
гідропероксиди, є проміжними продуктами при окисненнi
вуглеводнів різних класів. Як правило, пероксиди нестійкі i у
більшостi випадків небезпечнi у вжитку (вибухають від удару або
нагрівання). Вони є сильними окиснювачами.







 chemistry
chemistry








