Similar presentations:
Класифікація, будова та номенклатура органічних сполук
1. Лекція
Класифікація, будова таноменклатура органічних сполук.
Василишин Н. А.
2. План
1. Класифікація органічних сполук.2. Номенклатура органічних сполук.
3. Ковалентний зв*язок. Спряжені системи.
Ароматичність.
4. Електронні ефекти. Кислотність та
основність органічних сполук за Бренстедом.
5.Типи реакцій органічних сполук.
6. Спирти.
7. Альдегіди. Кетони.
3. Положення теорії Бутлерова
1. Атоми, що входять до складу молекули органічних сполук,
зв’язані між собою в суворо визначеному порядку, згідно з їх
валентністю. Послідовність зв’язування атомів у молекулі
називається хімічною будовою.
2. Властивості речовини залежать не тільки від того, які
атоми і в якій кількості входять до складу її молекули, але й від
того, в якій послідовності вони зв’язані між собою, тобто від
хімічної будови молекули.
3. Атоми або групи атомів, які утворюють молекулу, як зв’язані
безпосередньо, так і зв’язані через інші атоми, взаємно
впливають одні на одних, від чого залежить реакційна
здатність молекули.
4. Вивчаючи реакційну здатність речовини, можна встановити її
будову, і навпаки, за будовою речовини можна судити про її
властивості.
4.
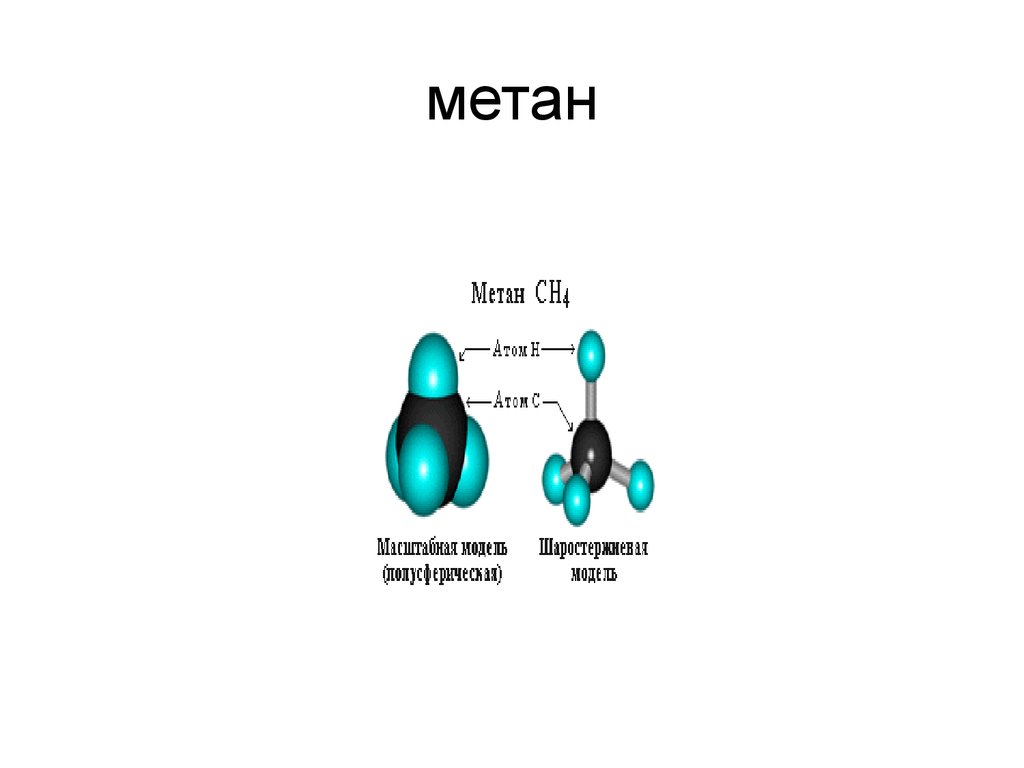
5. метан
6.
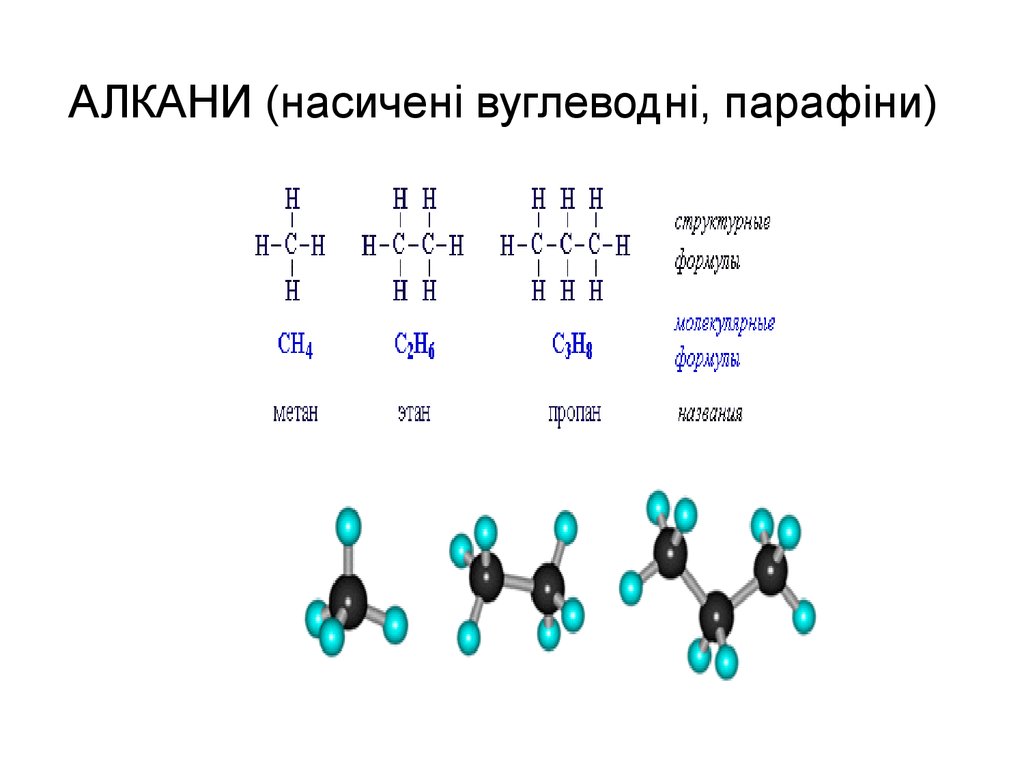
7. АЛКАНИ (насичені вуглеводні, парафіни)
8. Алкани
СН4 Метан
СН3 Метил
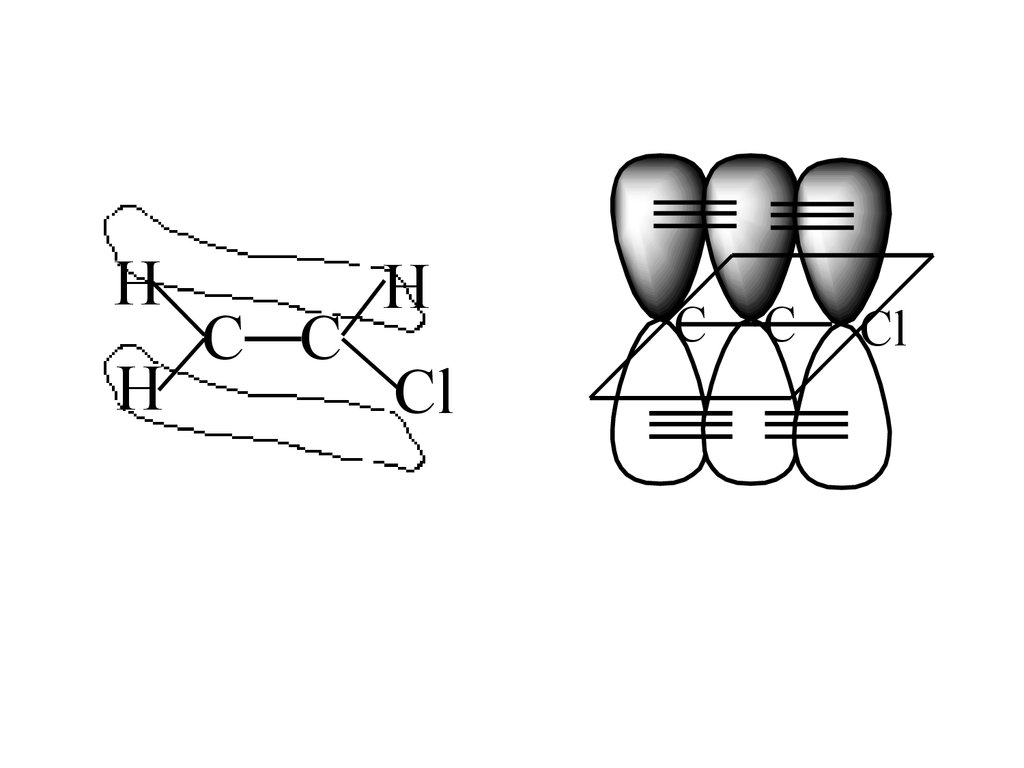
С2Н6 Етан
С2Н5 Етил
С3Н8 Пропан С3Н7 Пропіл
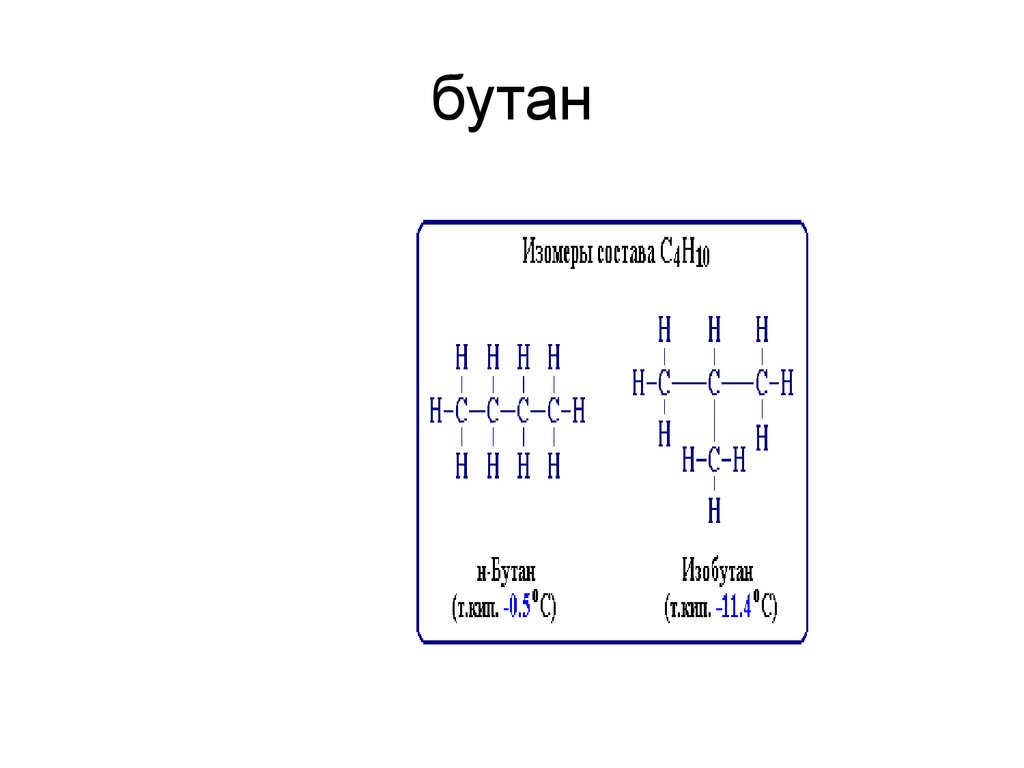
С4Н10 Бутан
С4Н9 Бутил
С5Н12 Пентан С5Н11 Аміл
С6Н14 Гексан
С6Н13 Гексил
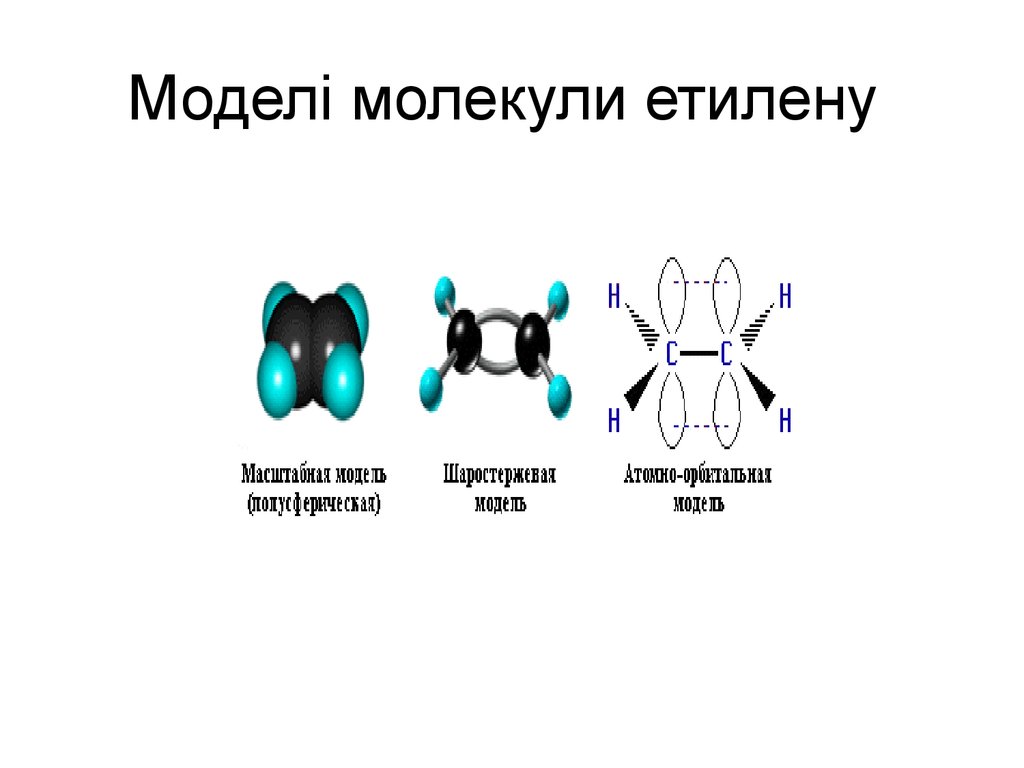
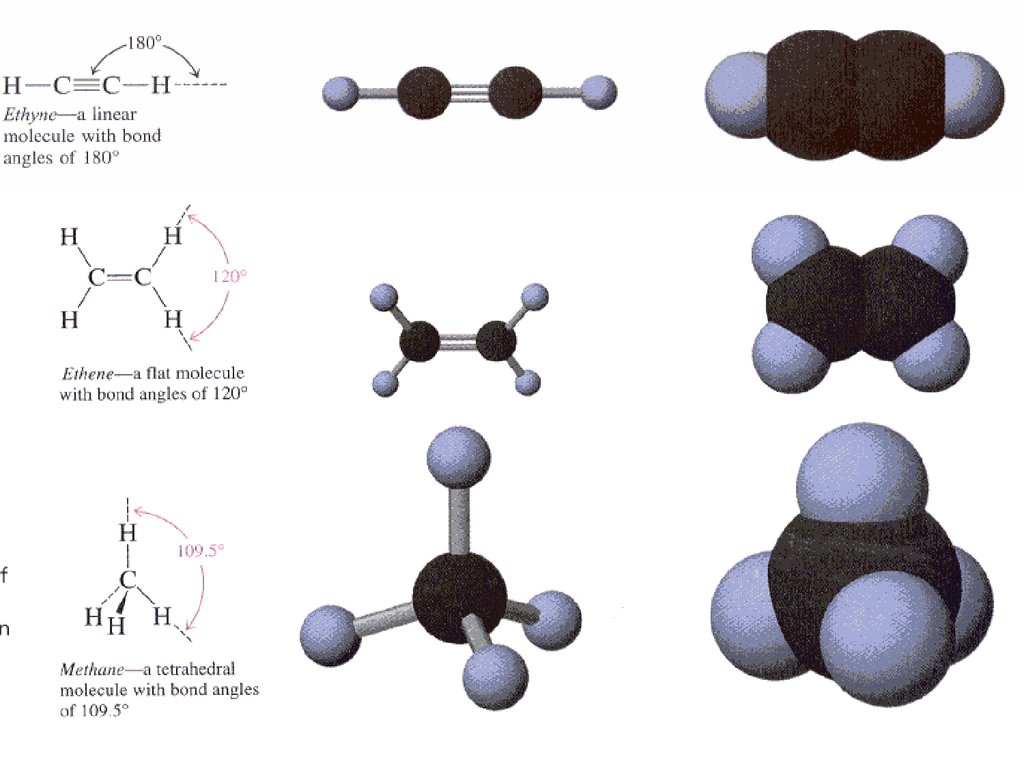
9. Моделі молекули етилену
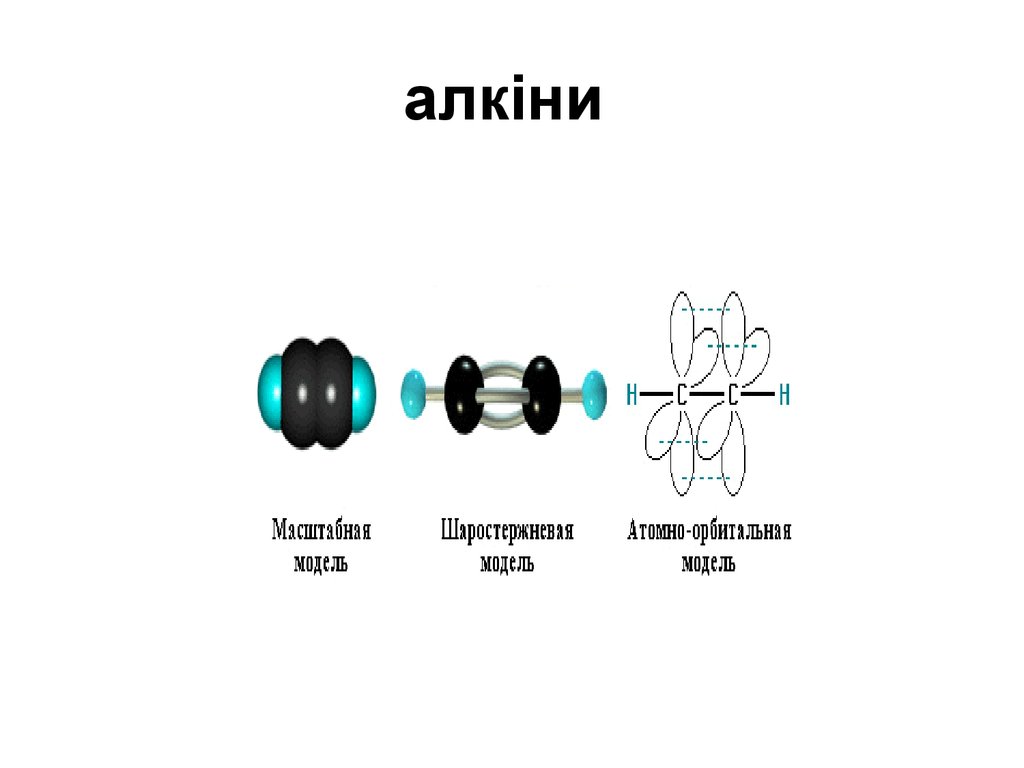
10. алкіни
11. карбоциклічні: аліфатичні циклічні (аліциклічні)
CH2H2C
CH2
Циклопропан
або
CH2
CH2
CH2
CH2
Циклобутан
або
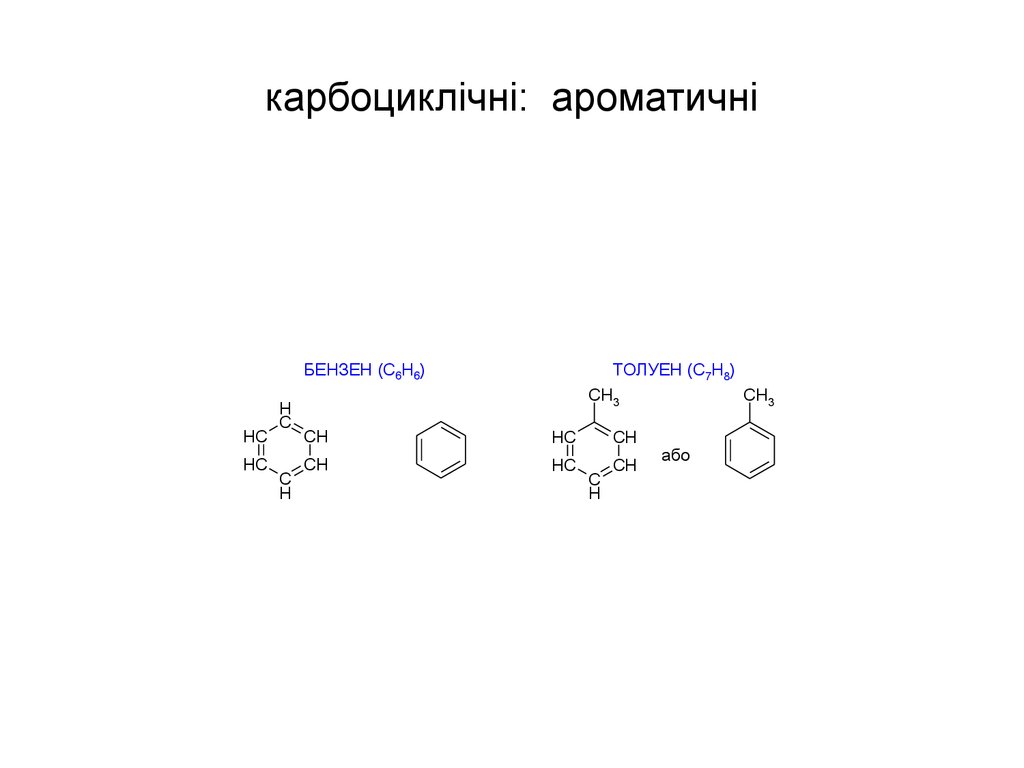
12. карбоциклічні: ароматичні
БЕНЗЕН (С6Н6)HC
HC
H
C
C
H
ТОЛУЕН (С7Н8)
CH3
CH3
CH
HC
CH
CH
HC
CH
C
H
або
13. Всі органічні сполуки можна розглядати як вуглеводні вказаної будови або похідні вуглеводнів, одержані шляхом введення в них функціональ
Всі органічні сполуки можна розглядати як вуглеводнівказаної будови або похідні вуглеводнів, одержані
шляхом введення в них функціональних груп.
Функціональні групи - це замісники
невуглеводневого характеру, що визначають
приналежність сполуки до певного класу і
одночасно її типові хімічні властивості.
14. класи
За природою функціональних груп похіднівуглеводнів діляться на класи:
галогенопохідні R-X, спирти і феноли R-OH,
тіоли R-SH, прості ефіри R-O-R,
аміни R-NH2,
альдегіди і кетони R-COH, R-CO-R,
карбонові кислоти RCOOH,
складні ефіри R-COOR,
аміди R-CONH2
15.
16. Порядок старшинства функціональних груп, що вказуються і в префіксі і в закінченні
Функціональна група
-СОООН
-SO3H
-C N
-HC O
=C=O
-OH
-SH
-NH2
• Закінчення
-ова кислота
-сульфокислота
-нітрил
-аль
-он
-ол
-тіол
-амін
17.
18.
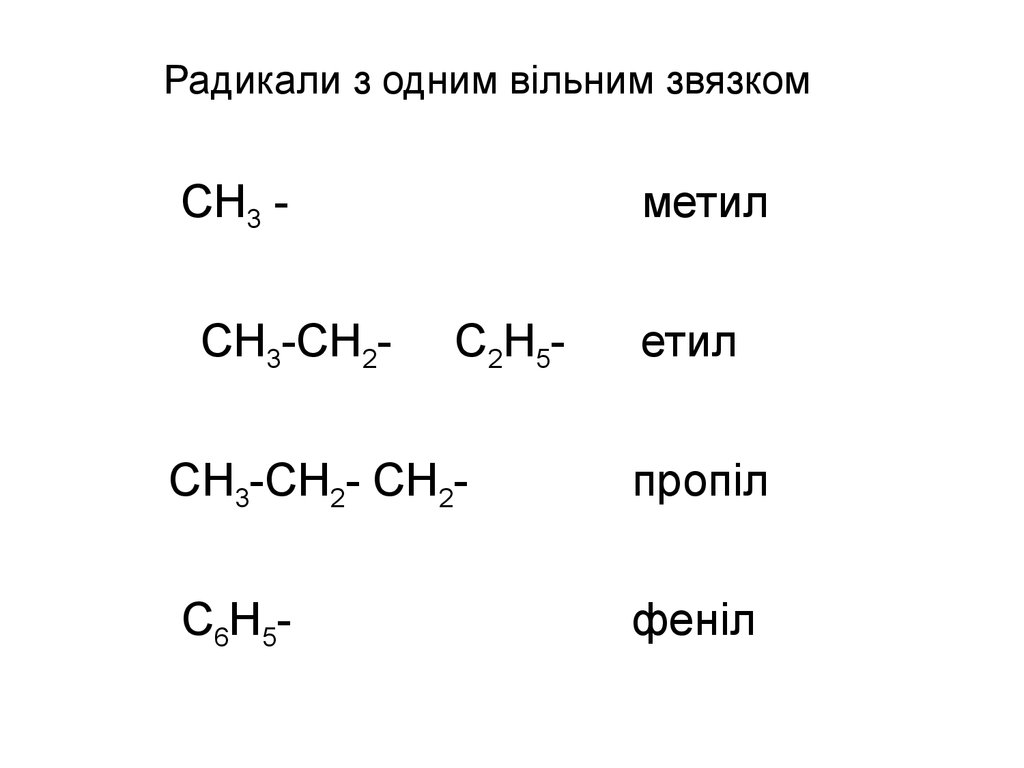
19. Радикали з одним вільним звязком
СН3 СН3-СН2-метил
С2Н5-
етил
СН3-СН2- СН2-
пропіл
С6Н5-
феніл
20. Міжнародна номенклатура (IUPAC).
• Правила сучасної номенклатури булирозроблені у 1957 році на ХІХ конгресі
Міжнародного союзу теоретичної і
прикладної хімії (International Union of
Pure and Applied Chemistry – IUPAC).
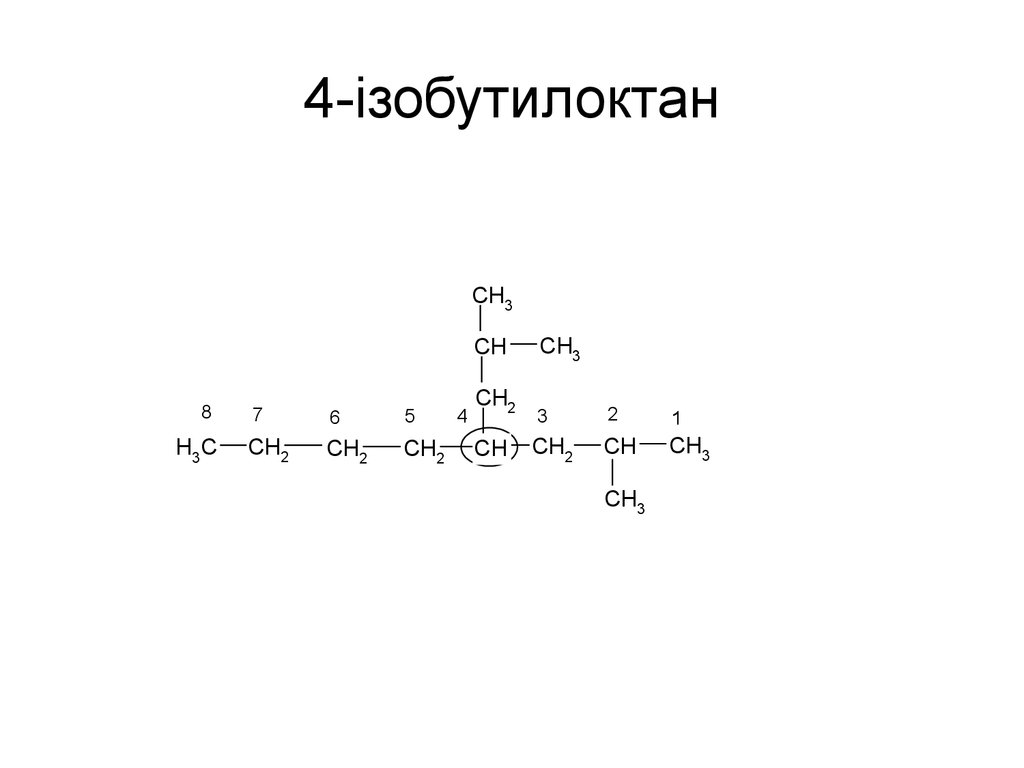
21. 4-iзобутилоктан
CH3CH
8
H3C
7
6
5
CH2
CH2
CH2
4
CH2
CH
CH3
3
2
1
CH2
CH
CH3
CH3
22. Замісникова номенклатура
• Правила номенклатури.• 1. При утворенні
назв
за
замісниковою
номенклатурою органічні сполуки розглядають як
похідні найпростіших вуглеводнів, у молекулі яких
один або декілька атомів Гідрогену замішені на інші
атоми
або
групи
атомів,
які
називаються
замісниками.
2. Визначають, які функціональні групи входять до
складу сполуки і вибирають серед них старшу, якщо
вона є:
– COOH > –SO3H > –COOR > –C(O)Cl > –C(O)NH2 > –
C N > –C(O)H > – >C=O > –OH > –SH > –NH2 > –Hal
(F, Cl, Br, I).
23. Замісникова номенклатура
• 3. Визначають родоначальну структуру молекули. Цеє структурний фрагмент молекули, що лежить в
основі назви.
В ациклічних сполуках – це головний вуглецевий
ланцюг, у карбоциклічних і гетероциклічних – цикл.
За головний вуглецевий ланцюг обирають той,
котрий містить максимальне (у порядку
зменшення
значущості
число:
1) функціональних груп; 2) кратних зв’язків; 3)
атомів Карбону; 4) замісників.
Замісником називають будь-який атом або групу
атомів, котрі не входять до родоначальної структури.
Поняття “замісник” включає у себе функціональну групу
і радикал.
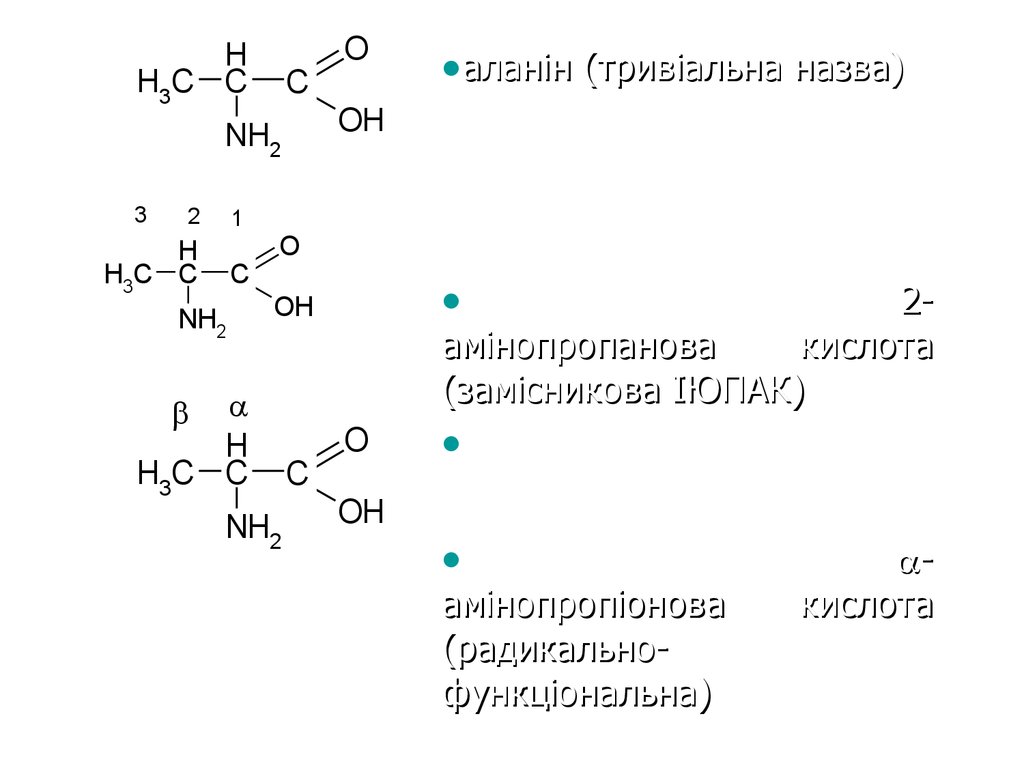
24. назви
25.
HH3C C
C
2
1
H
H3C C
C
NH2
•аланін (тривіальна назва)
OH
NH2
3
O
O
2амінопропанова
кислота
(замісникова ІЮПАК)
OH
H
H3C C
NH2
C
O
OH
амінопропіонова
(радикальнофункціональна)
кислота
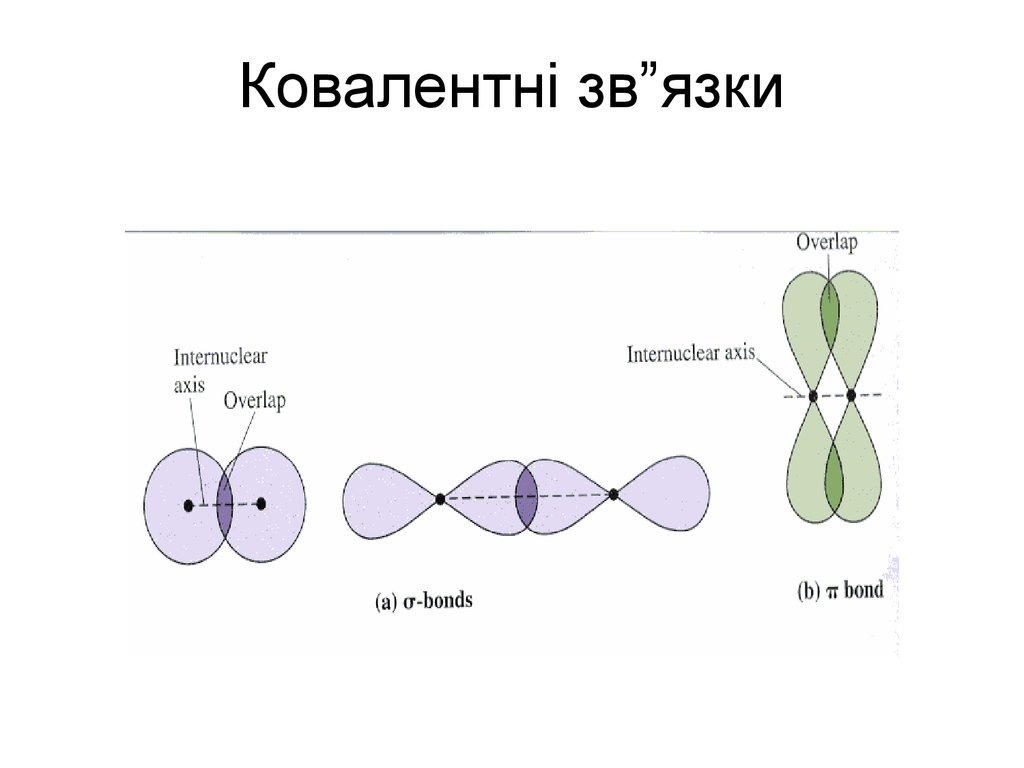
26. Ковалентні зв”язки
27.
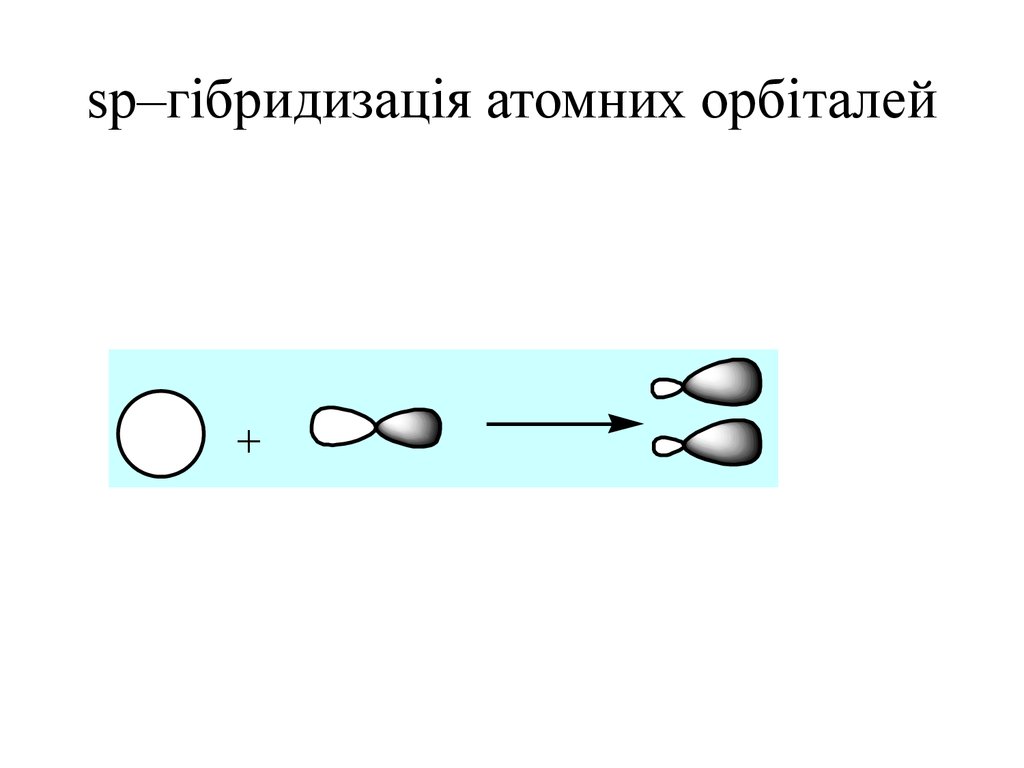
28. sp–гібридизація атомних орбіталей
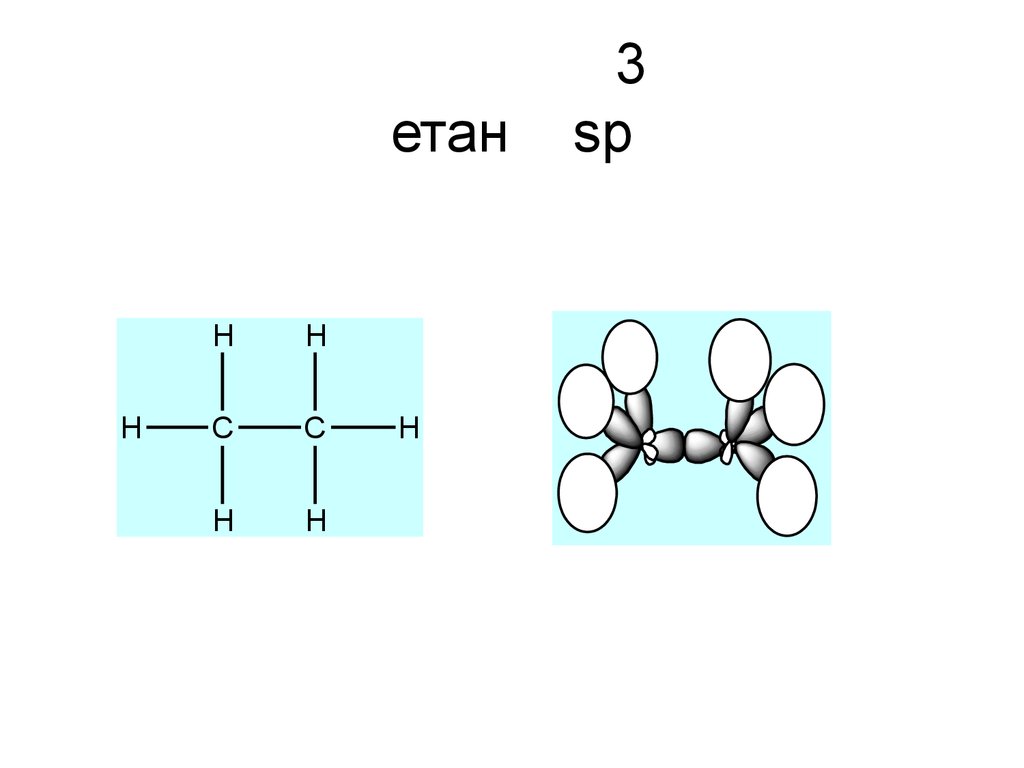
+29. 3 етан sp
етанH
H
H
C
C
H
H
H
3
sp
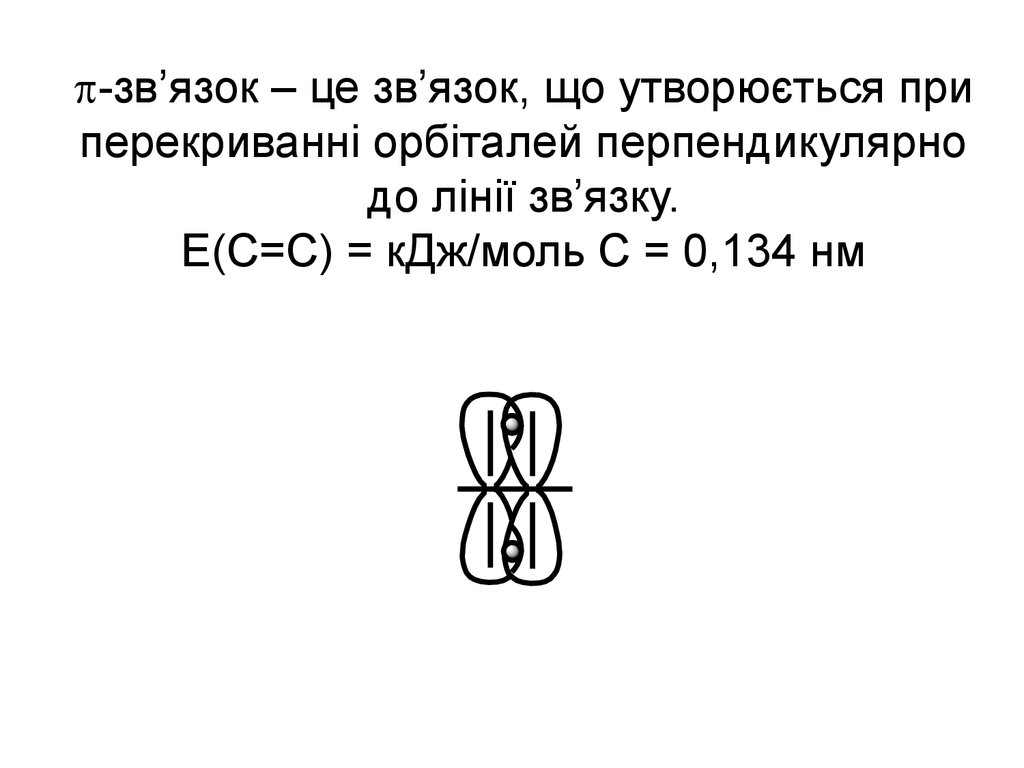
30. -зв’язок – це зв’язок, що утворюється при перекриванні орбіталей перпендикулярно до лінії зв’язку. Е(С=С) = кДж/моль С = 0,134 нм
-зв’язок – це зв’язок, що утворюється приперекриванні орбіталей перпендикулярно
до лінії зв’язку.
Е(С=С) = кДж/моль С = 0,134 нм
31.
32. Електронні ефекти
Характерні риси індукційного ефекту.1. Індукційний ефект впливає на всі атоми насиченого
ланцюга в одному напрямку. При цьому І-ефект може бути
“+” або “–” направленим. Знак визначають по частковому
заряду, який набуває замісник, який викликає даний ефект.
Напрям зсуву заряду позначається прямими стрілками.
Електроноакцепторні замісники викликають –І, а
електронодонорні +І.
І ефект Н=О (умовно) С Н має дипольний момент, 0,3D.
33.
Шкала Полінга(електронегативність атомів)
F > O > Csp > Cl, N > Csp 2, Br > I > Csp 3, S > H
34.
Індуктивний ефект – перерозподіл електронноїгустини вздовж σ-зв’язків:
1) Негативний
δ+
δR? CH2? R'
Максимальним негативним індукційним ефектом володіють такі замісники:
—Hal, —NH2, —OH, —COH, —COOH
б) позитивний ефект:
δδ+
R? CH2? R'
Максимальним позитивним індукційним ефектом володіють алкільні
радикали:
СН3- , С2Н5- і т.д.
35.
Мезомерний ефект – різновид електронного ефекту, щопередається по системі π - зв’язків:
36.
•Передача взаємного впливу атомів,перерозподіл густини в молекулі, що
супроводжується не через систему зв’язків, а через систему, в основному,
- і р (неподільних пар електронів).
спостерігається
в
спряжених
системах,
які
містять
-зв’язки
неподільні електронні пари або -С—Н
зв’язки, віддалені від -елктронів, або
один від одного простим -зв’язком.
37.
HH
C C
H
Cl
C
C
Cl
38. Критерії ароматичності аренів:
• Атоми Карбону в sp2-гібридизованому станіутворюють циклічну систему.
• Атоми Карбону розташовуються в одній
площині (цикл має плоску будову).
• Замкнута система зв'язаних зв'язків містить
4n+2 p-електронів (n – ціле число)
(підпорядкування правилу Хюккеля).
• Цим критеріям повністю відповідає молекула
бензену С6Н6.
39. Ізомерія органічних сполук
ІзомеріяСтруктурна
Статична
1. Ізомерія
вуглецевого
скелету
2. Ізомерія
положення
функціональної
групи
3. Ізомерія
самих функціональних груп
(метамерія)
Динамічна
(таутомерія)
Просторова (Стереоізомерія)
Конфігураційна Конформаційна
(поворотна)
Оптична
Геометрична
1. Енантіомерія
2. Діастереомерія
40. бутан
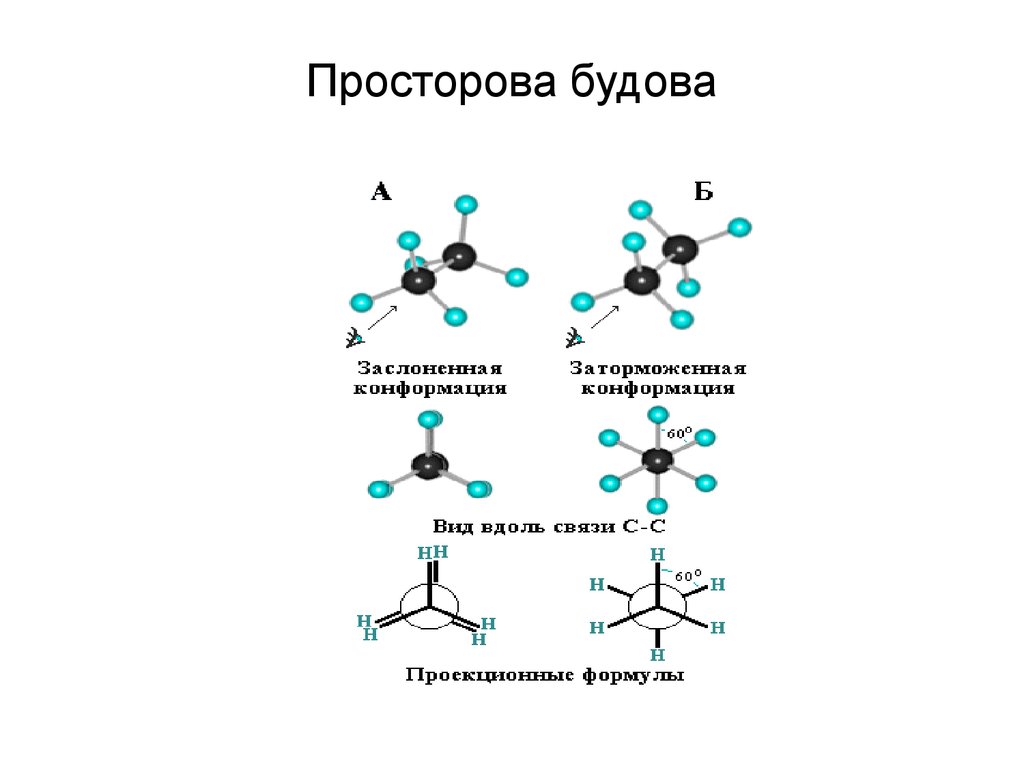
41. Просторова будова
42.
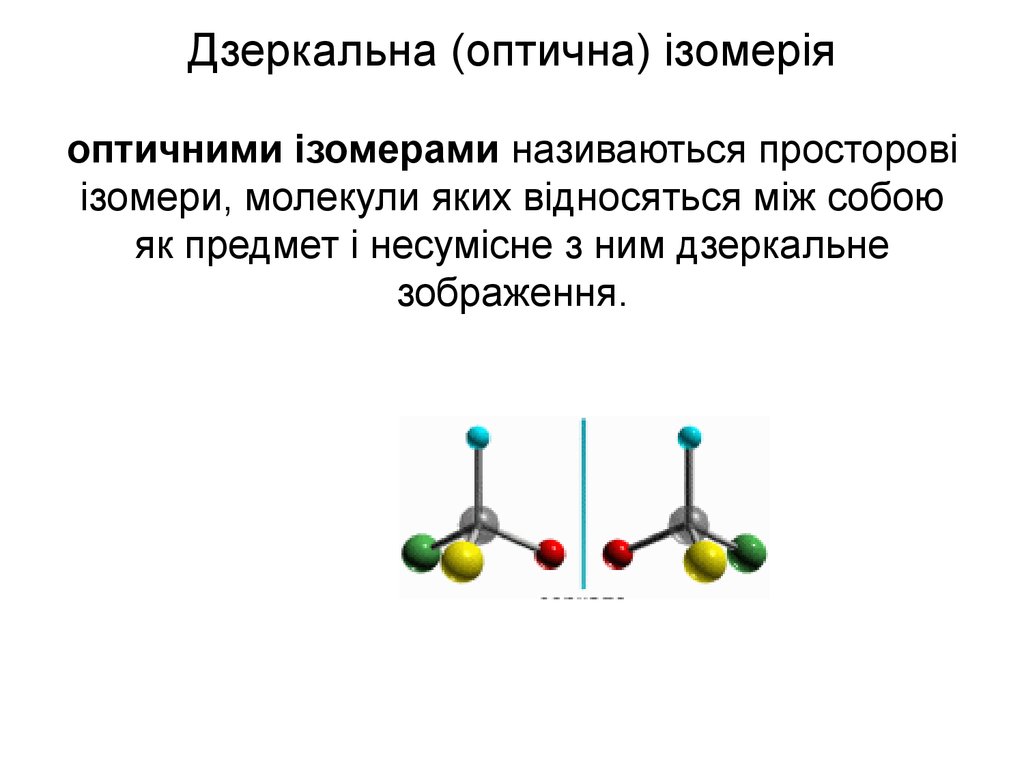
43. Дзеркальна (оптична) ізомерія оптичними ізомерами називаються просторові ізомери, молекули яких відносяться між собою як предмет і несумі
Дзеркальна (оптична) ізомеріяоптичними ізомерами називаються просторові
ізомери, молекули яких відносяться між собою
як предмет і несумісне з ним дзеркальне
зображення.
44.
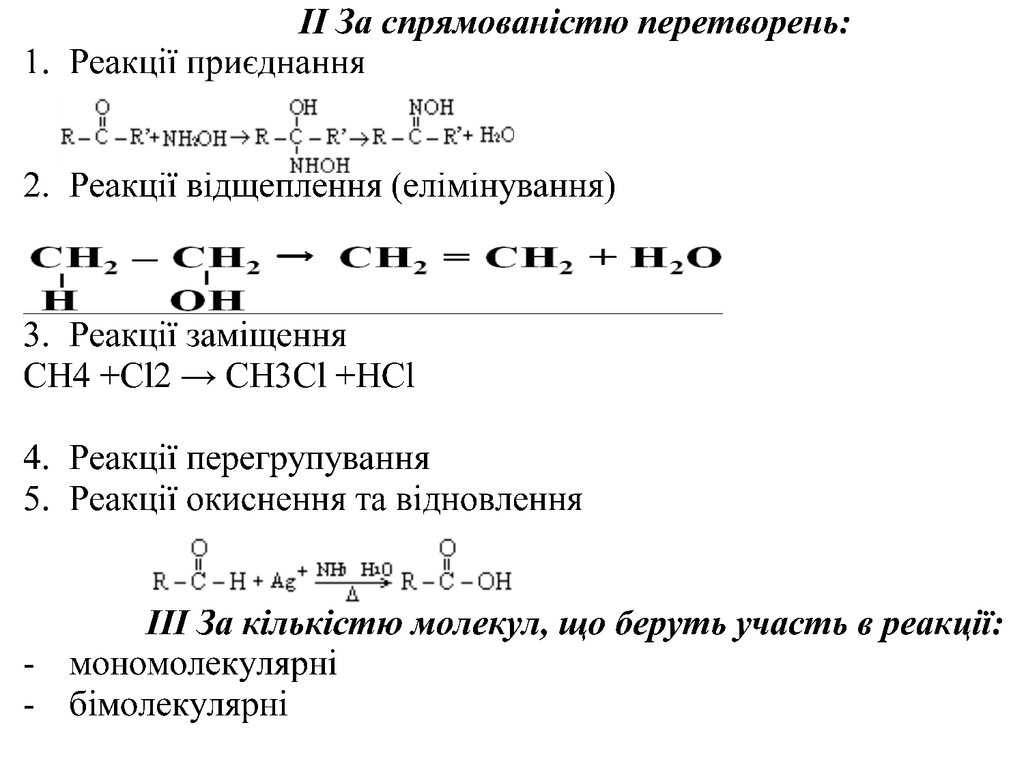
Реакції в біоорганічній хімії:І За механізмом розщеплення хімічних зв’язків:
1. Гетеролітичні:
2. Гомолітичні:
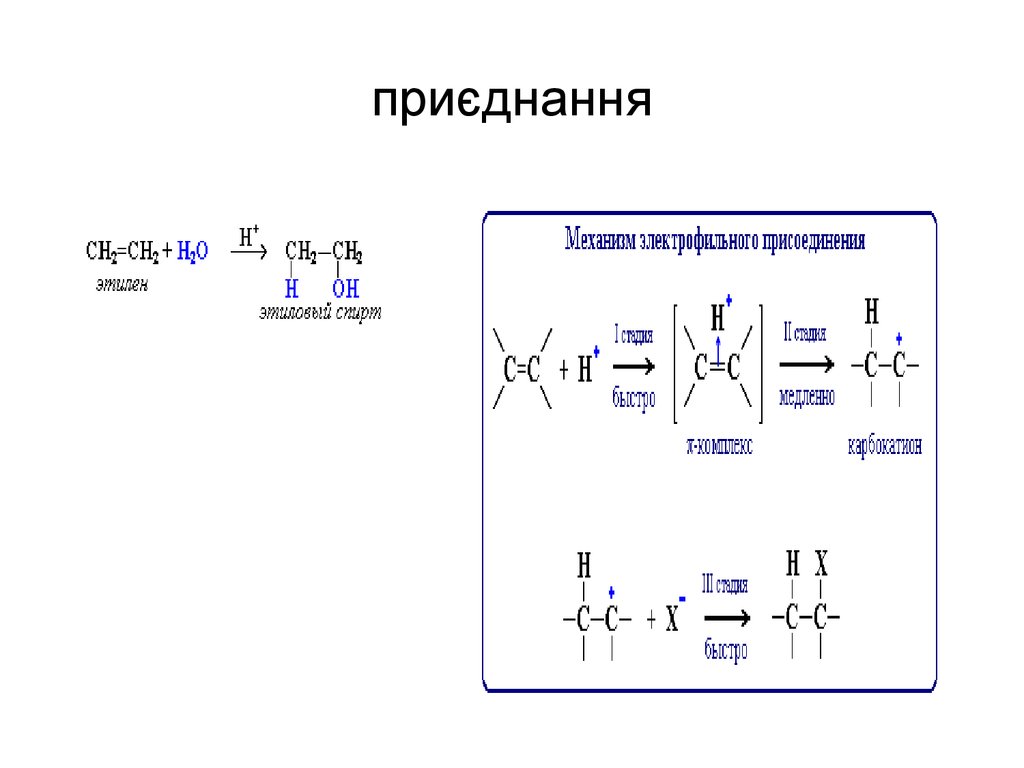
45.
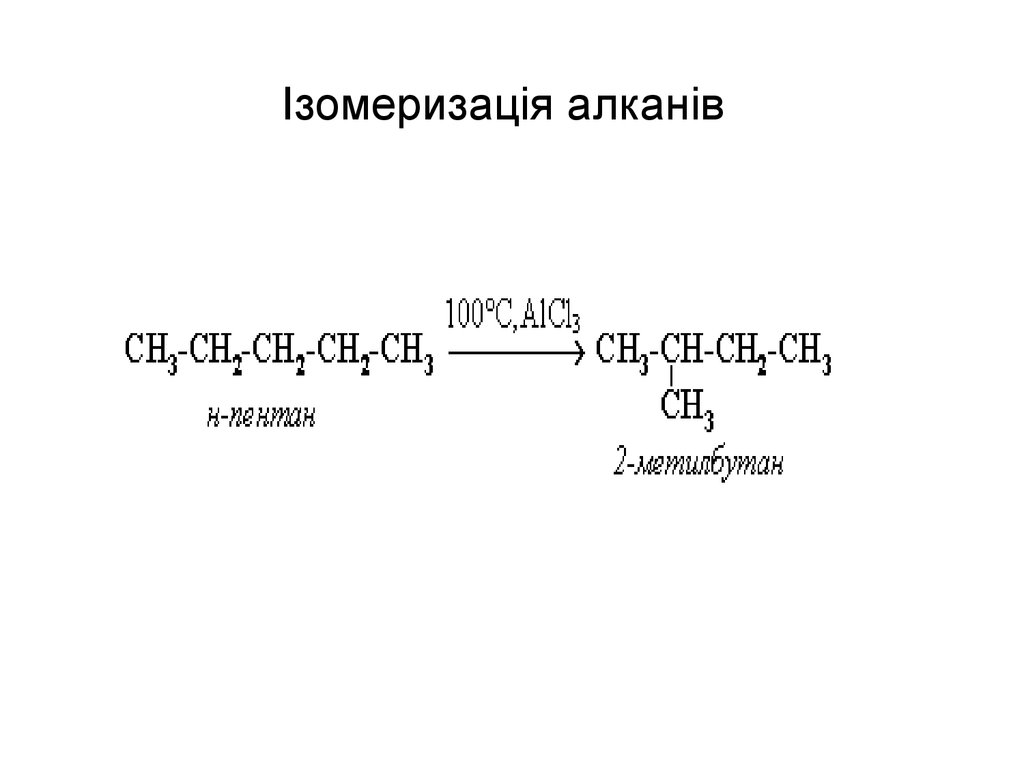
46. приєднання
47. Ізомеризація алканів
48.
49. спирти
за числом гідроксильних груп спирти
поділяються на
–
–
Приклади:
–
двохатомний спирт – eтиленглiколь (етандіол)
HO-СН2–CH2–OH
–
одноатомні (одна група -ОН),
багатоатомні (дві й більше групи -ОН).
триатомний спирт – глiцерин (пропантрiол-1,2,3)
HO-СН2-СН(ОН)–CH2–OH
50. спирти
Залежно від того, з яким атомом
вуглецю (
первинним, вторинним чи третинним
)зв'язана гідроксигрупа, розрізняють
спирти
– первинні R–CH2–OH,
– вторинні R2CH–OH,
– третинні R3C–OH.
51. Номенклатура спиртів
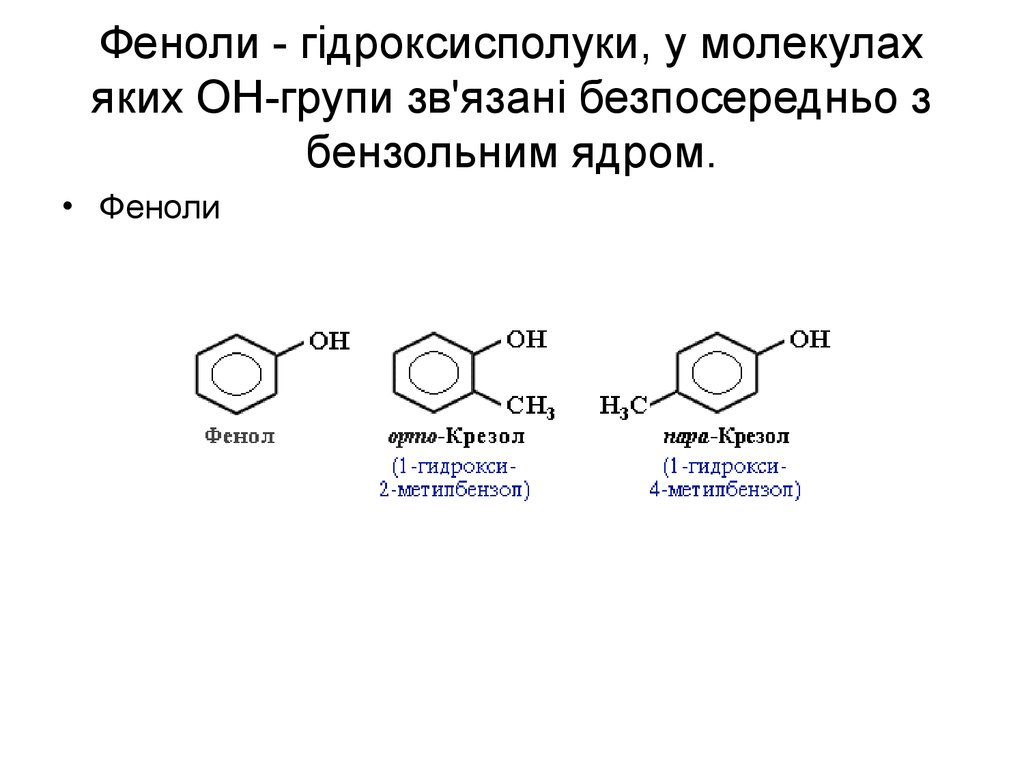
52. Феноли - гідроксисполуки, у молекулах яких ОН-групи зв'язані безпосередньо з бензольним ядром.
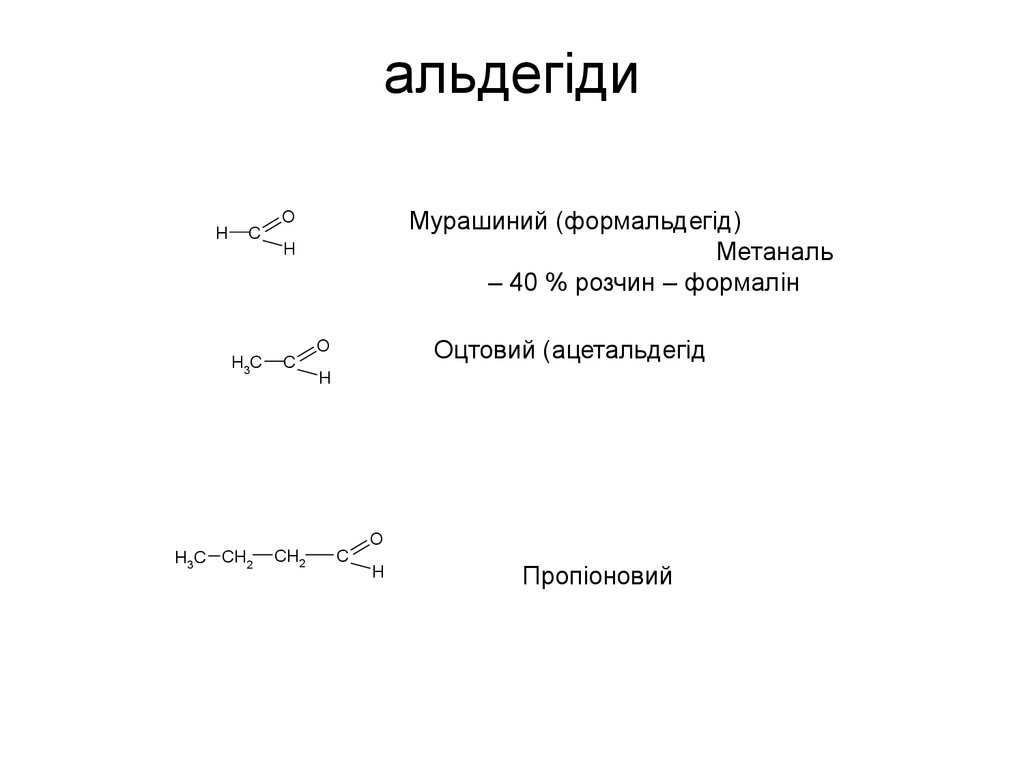
• Феноли53. альдегіди
HC
H3C
H3C CH2
Мурашиний (формальдегід)
Метаналь
– 40 % розчин – формалін
O
H
C
CH2
Оцтовий (ацетальдегід
O
H
C
O
H
Пропіоновий
54.
55. Приєднання води – утворення гідратів альдегідів
OHCH3 - C - H
OH
_
_
O
+
CH3 - C
+ H - OH
H
+
гем-діол
_
хлораль
OH
Cl3C - C - OH
H
_
Cl3 - C
O
+
C
+ H - OH
H
+
хлоралгідрат
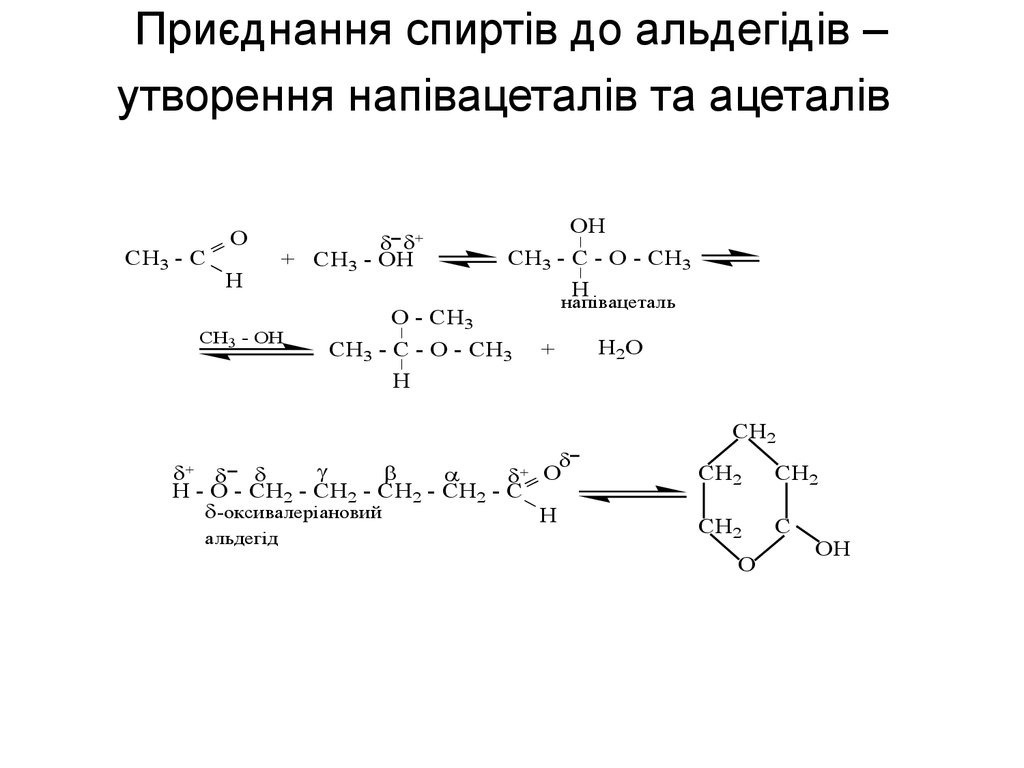
56. Приєднання спиртів до альдегідів – утворення напівацеталів та ацеталів
H+
+ CH3 - OH
CH3 - C - O - CH3
H
O - CH3
CH3 - C - O - CH3
H
_ _
CH3 - OH
OH
_ _
CH3 - C
O
напівацеталь
+
+
+ O
H - O - CH2 - CH2 - CH2 - CH2 - C
-оксивалеріановий
H
альдегід
H2O
CH2
CH2
CH2
CH2
C
O
OH
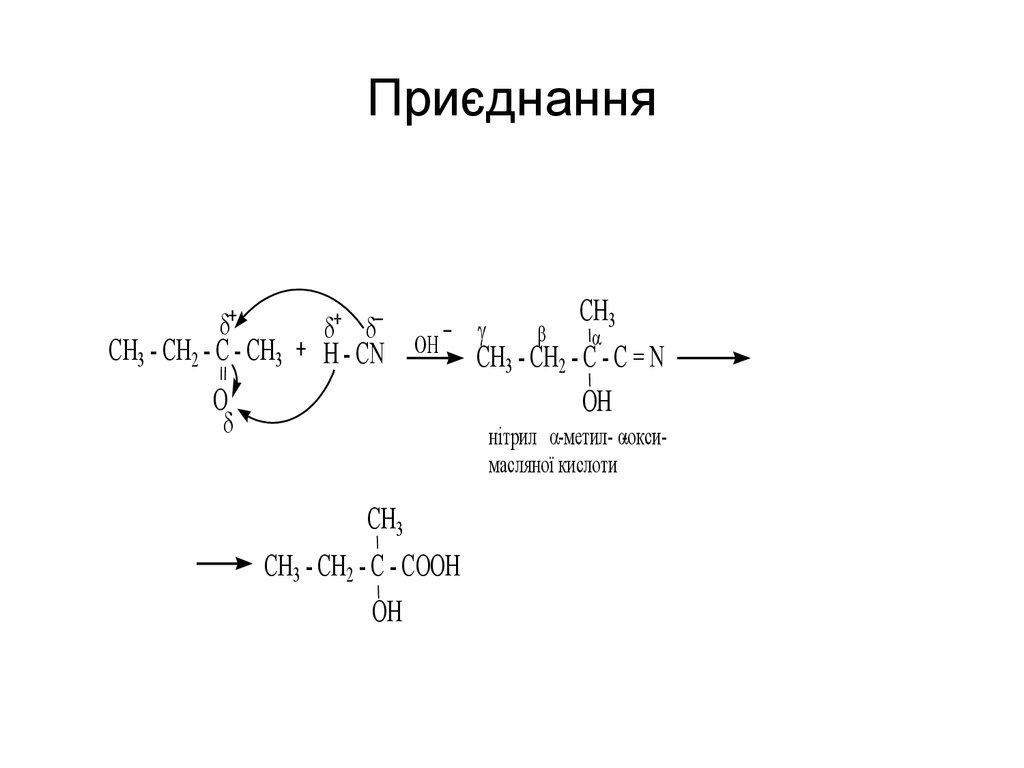
57. Приєднання
CH3 - CH2 - C - CH3H - CN
OH
O
CH3
CH3 - CH2 - C - C = N
OH
нітрил -метил- -оксимасляної кислоти
CH3
CH3 - CH2 - C - COOH
OH
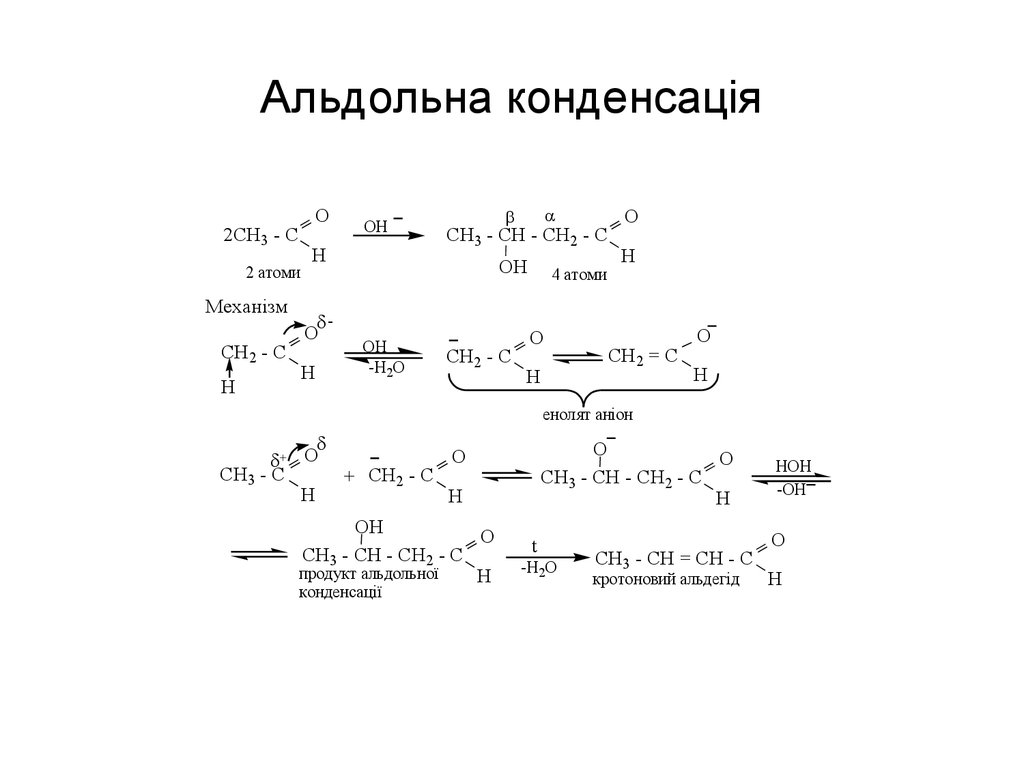
58. Альдольна конденсація
O2CH3 - C
2 атоми
Механізм
CH2 - C
H
OH
H
O
H
CH3 - CH - CH2 - C
OH
OH
-H2O
CH2 - C
4 атоми
O
H
O
H
CH2 = C
O
H
енолят аніон
O
+ O
CH3 - C
+ CH2 - C
H
H
OH
O
CH3 - CH - CH2 - C
продукт альдольної
H
конденсації
O
O
CH3 - CH - CH2 - C
H
t
-H2O
CH3 - CH = CH - C
кротоновий альдегід
HOH
-OH
O
H
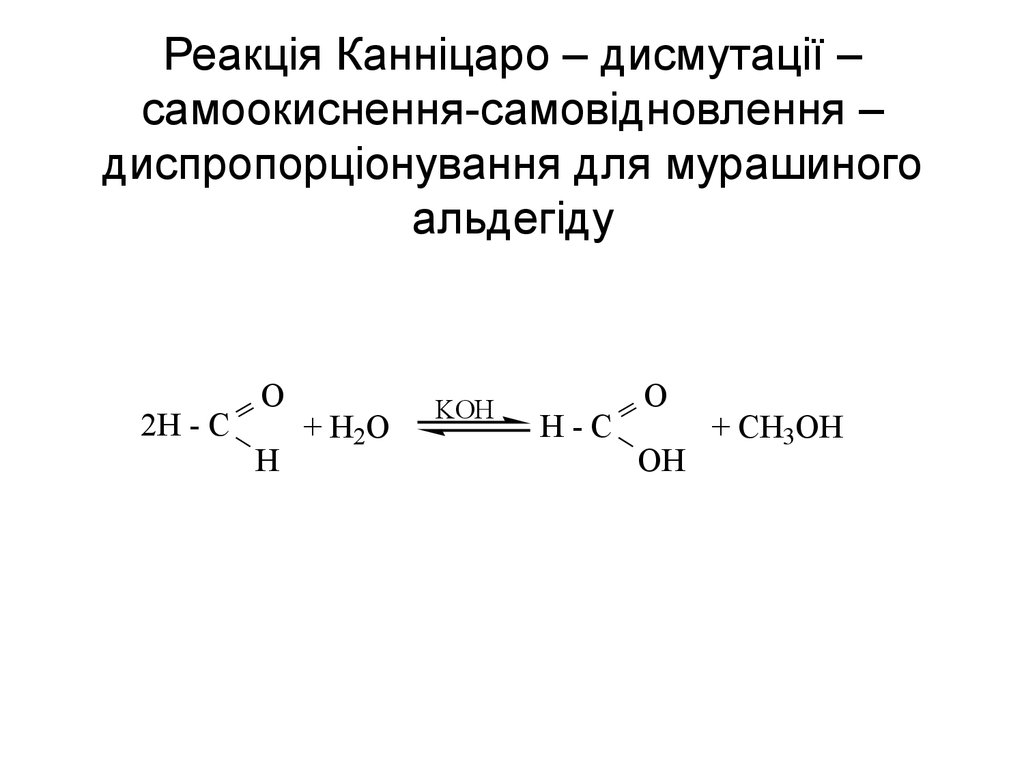
59. Реакція Канніцаро – дисмутації – самоокиснення-самовідновлення – диспропорціонування для мурашиного альдегіду
2H - CO
H
+ H2O
KOH
H-C
O
OH
+ CH3OH
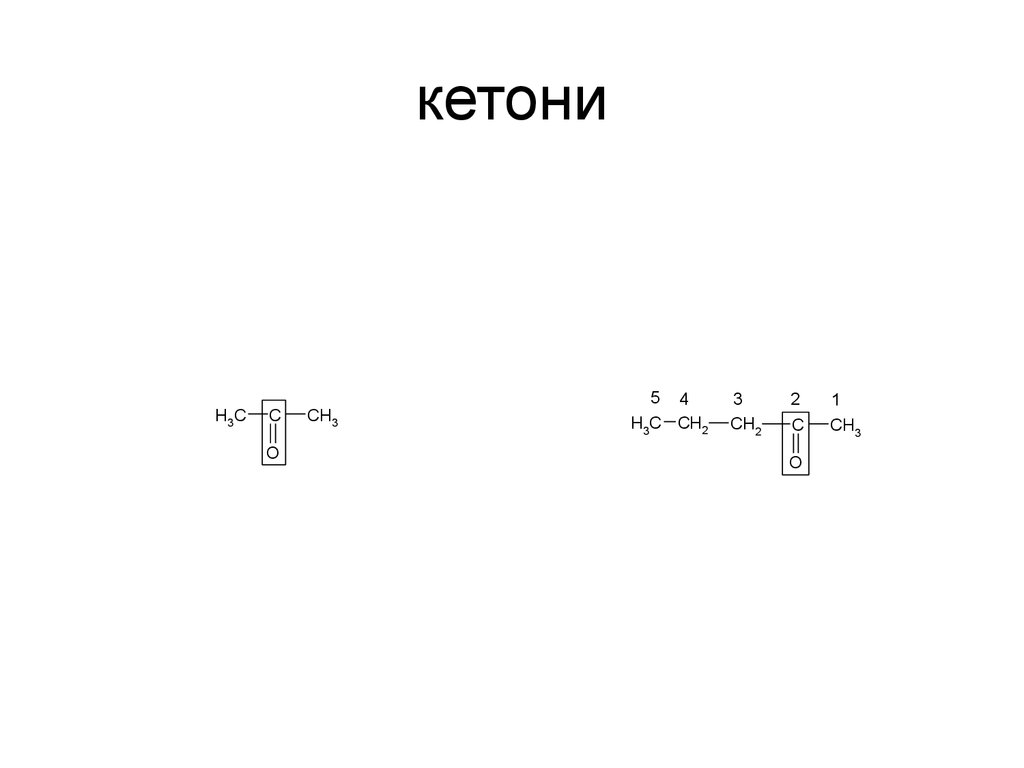
60. кетони
H3CC
O
CH3
5 4
H3C CH2
3
CH2
2
C
O
1
CH3
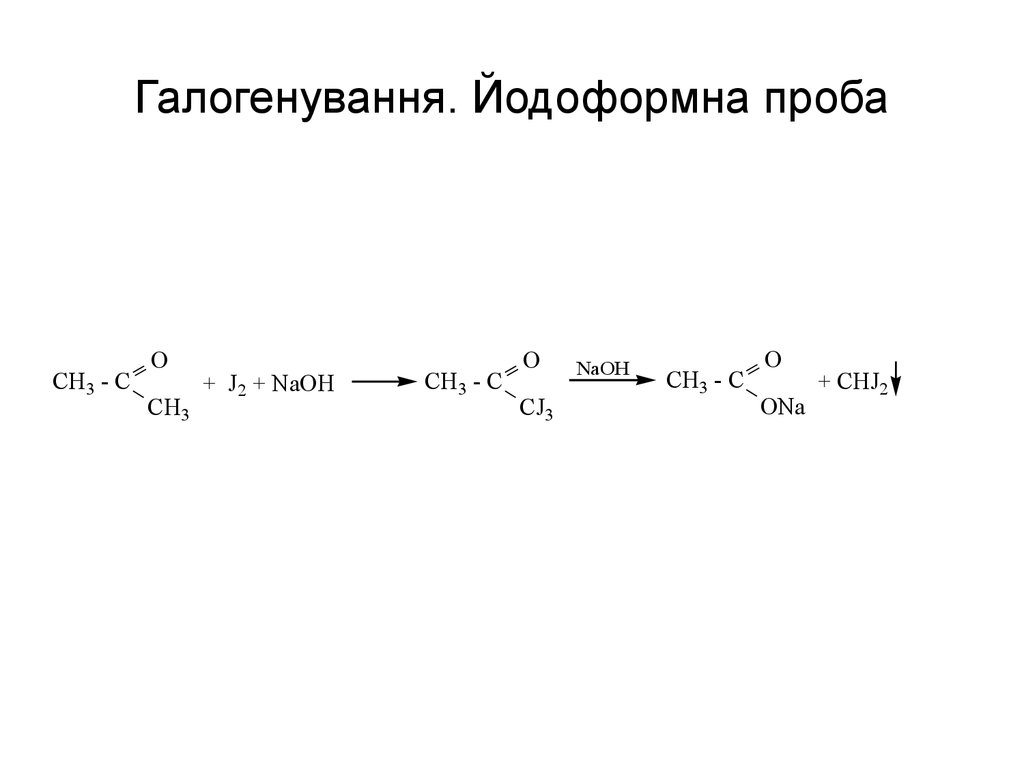
61. Галогенування. Йодоформна проба
CH3 - CO
CH3
+ J2 + NaOH
CH3 - C
O
CJ3
NaOH
CH3 - C
O
ONa
+ CHJ2
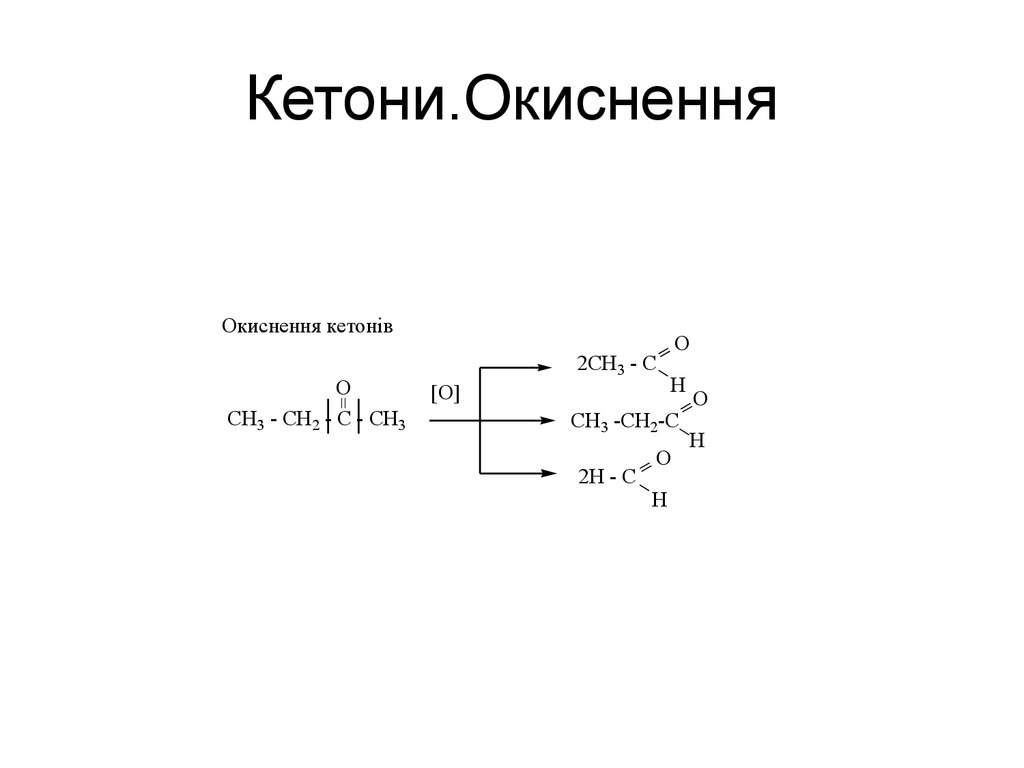
62. Кетони.Окиснення
Окиснення кетонів=
O
CH3 - CH2 - C - CH3
2CH3 - C
[O]
O
H
CH3 -CH2-C
2H - C
O
H
O
H
































 chemistry
chemistry








