Similar presentations:
Функціональні похідні аліфатичних вуглеводнів галогенопохідні вуглеводнів
1. ФУНКЦІОНАЛЬНІ ПОХІДНІ АЛІФАТИЧНИХ ВУГЛЕВОДНІВ ГАЛОГЕНОПОХІДНІ ВУГЛЕВОДНІВ
2.
• Галогенопохідними називаються сполуки,одержані в результаті заміщення одного
або декількох атомів водню в молекулах
вуглеводнів на атоми галогенів (F, Cl, Br, I).
В основу класифікації галогенопохідних
покладений поділ їх на
моногалогенопохідні та
полігалогенопохідні. У свою чергу, кожна
з цих груп, в залежності від типу
вуглеводню, поділяється на насичені та
ненасичені галогенопохідні.
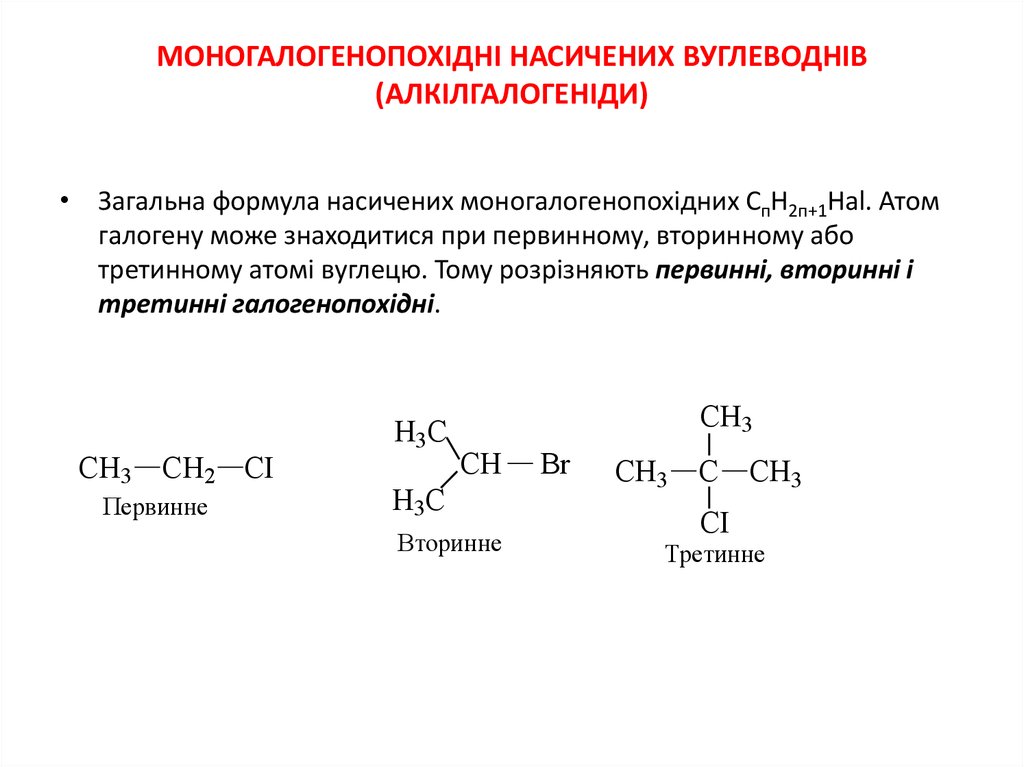
3. МОНОГАЛОГЕНОПОХІДНІ НАСИЧЕНИХ ВУГЛЕВОДНІВ (алкілгалогеніди)
МОНОГАЛОГЕНОПОХІДНІ НАСИЧЕНИХ ВУГЛЕВОДНІВ(АЛКІЛГАЛОГЕНІДИ)
• Загальна формула насичених моногалогенопохідних СпН2п+1Hal. Атом
галогену може знаходитися при первинному, вторинному або
третинному атомі вуглецю. Тому розрізняють первинні, вторинні і
третинні галогенопохідні.
СН3 СН2 СІ
Первинне
Н3С
CH3
СН
Н3С
Вторинне
Br
CH3 C CH3
CI
Третинне
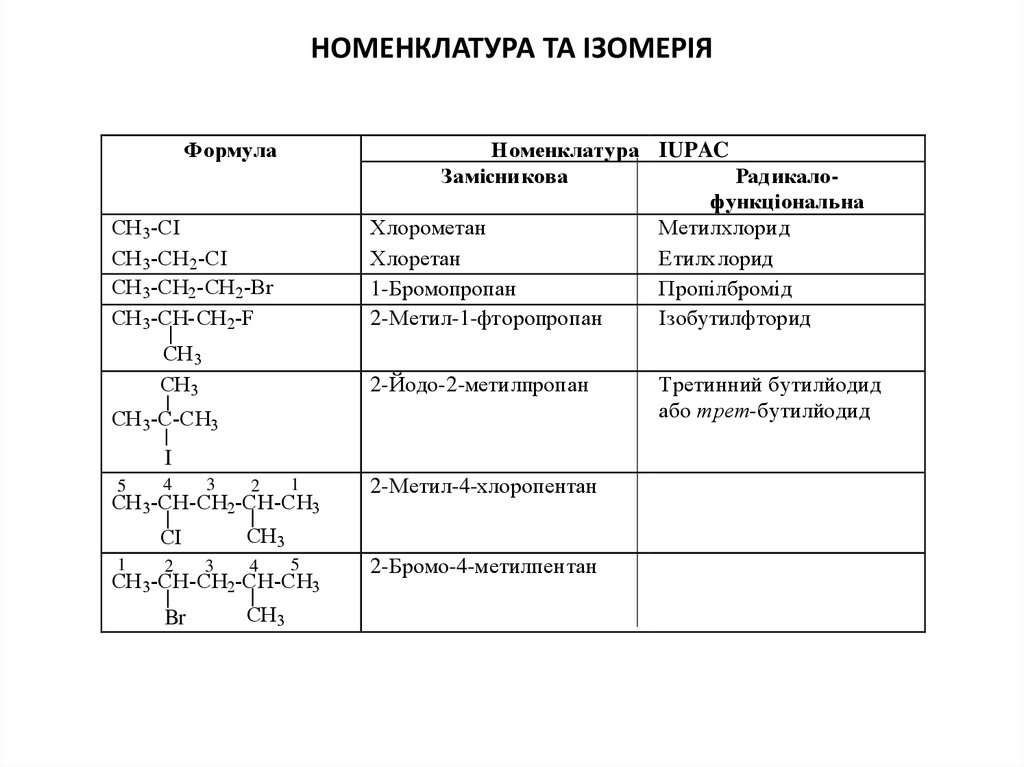
4. НОМЕНКЛАТУРА та ІЗОМЕРІЯ
НОМЕНКЛАТУРА ТА ІЗОМЕРІЯФормула
Номенклатура IUPAC
Замісникова
Радикалофункціональна
Хлорометан
Метилхлорид
Хлоретан
Етилхлорид
1-Бромопропан
Пропілбромід
2-Метил-1-фторопропан
Ізобутилфторид
СН 3-СІ
СН 3-СН2-СІ
СН 3-СН2-СН2-Br
CH 3-CH-CH2-F
CH3
CH3
2-Йодо-2-метилпропан
CH 3-C-CH3
I
5
4
3
2
1
2-Метил-4-хлоропентан
5
2-Бромо-4-метилпентан
CH 3-CH-CH2-CH-CH3
CH3
CI
1
2
3
4
CH 3-CH-CH2-CH-CH3
Br
CH3
Третинний бутилйодид
або трет-бутилйодид
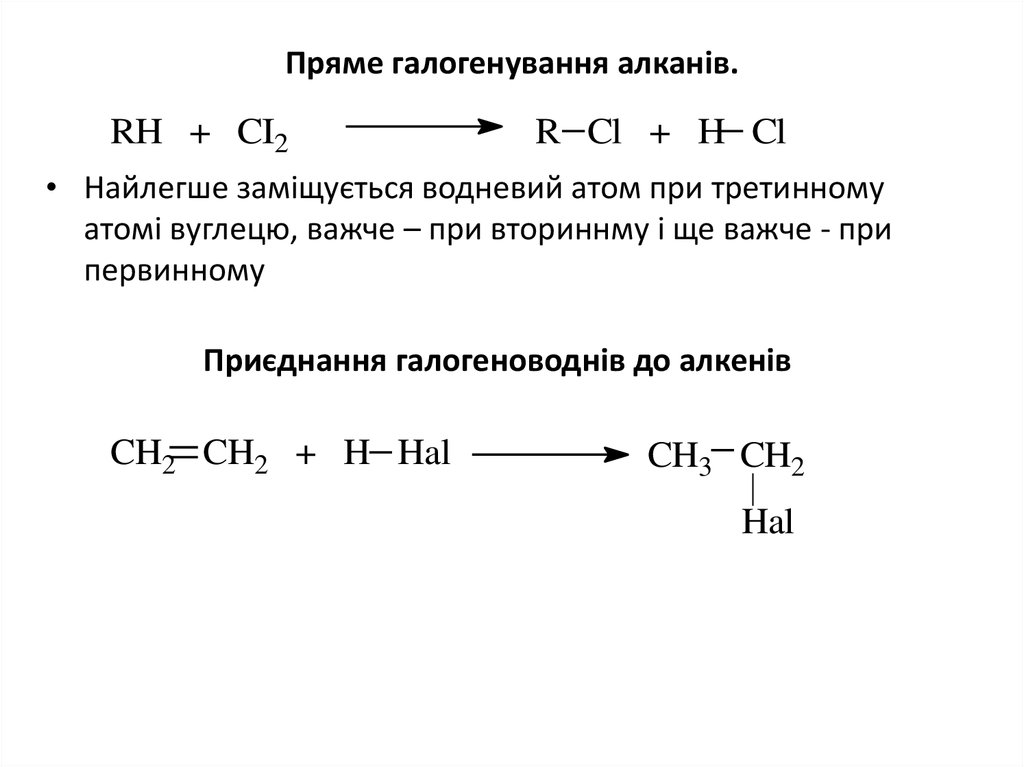
5. СПОСОБИ ОДЕРЖАННЯ
• Галогенопохідні алканів одержують прямимгалогенуванням алканів, приєднанням
галогеноводнів до алкенів і шляхом
заміщення функціональних груп на
галогени.
6. Пряме галогенування алканів.
RH + CI2R Cl + H Cl
• Найлегше заміщується водневий атом при третинному
атомі вуглецю, важче – при вториннму і ще важче - при
первинному
Приєднання галогеноводнів до алкенів
CH2 CH2 + H Hal
CH3 CH2
Hal
7. Заміщення функціональних груп на галогени.
Галогеном легко можна замінювати групу -ОН у спиртах,використовуючи для цього різні галогеновмісні реагенти.
Дія галогеноводнів.
• Заміщення ОН-групи можна здійснювати безпосередньо дією
водного розчину хлороводню, (хлоридною кислотою):
CH3 OH +HCI
CH3 CI H2O
• або бромідної кислоти in statu nascendi (в момент виділення).
KBr + H2SO4
СН3 СН2 OH + KBr + H2SO4
HBr + KHSO4
CH3 CH2Br + KHSO4 + H2O
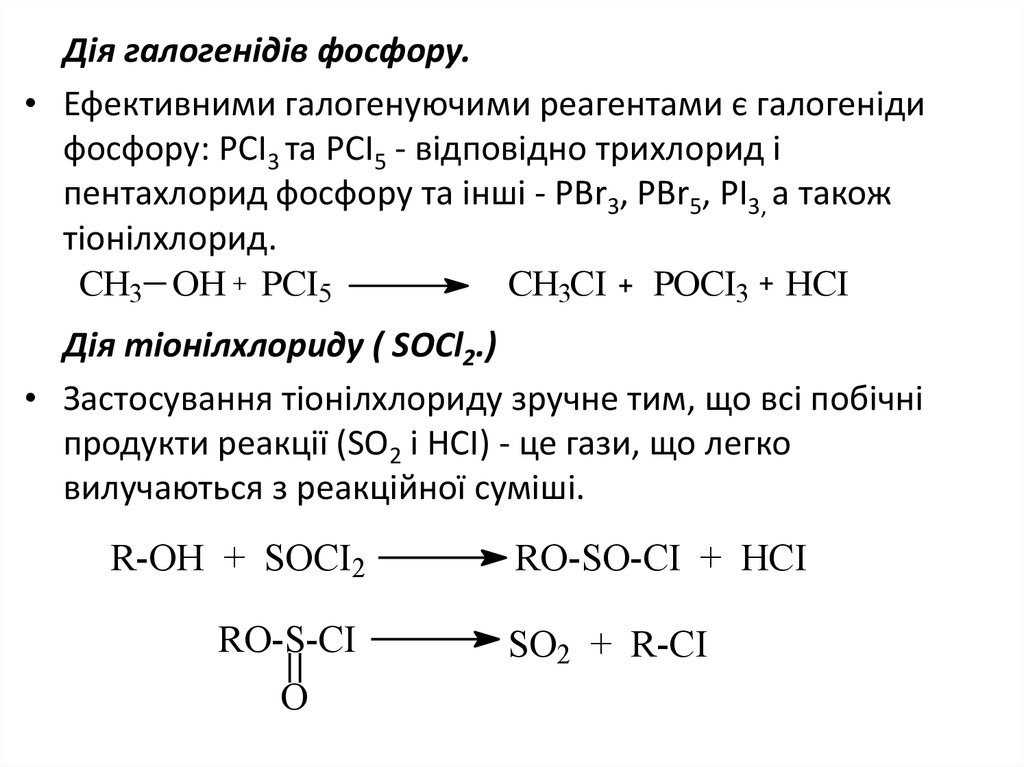
8.
Дія галогенідів фосфору.• Ефективними галогенуючими реагентами є галогеніди
фосфору: РСІ3 та РСІ5 - відповідно трихлорид і
пентахлорид фосфору та інші - PBr3, PBr5, PI3, а також
тіонілхлорид.
CH3 OH PCI5
CH3CI POCI3 HCI
Дія тіонілхлориду ( SOCl2.)
• Застосування тіонілхлориду зручне тим, що всі побічні
продукти реакції (SO2 і НСІ) - це гази, що легко
вилучаються з реакційної суміші.
R-OH + SOCI2
RO-S-CI
O
RO-SO-CI + HCI
SO2 + R-CI
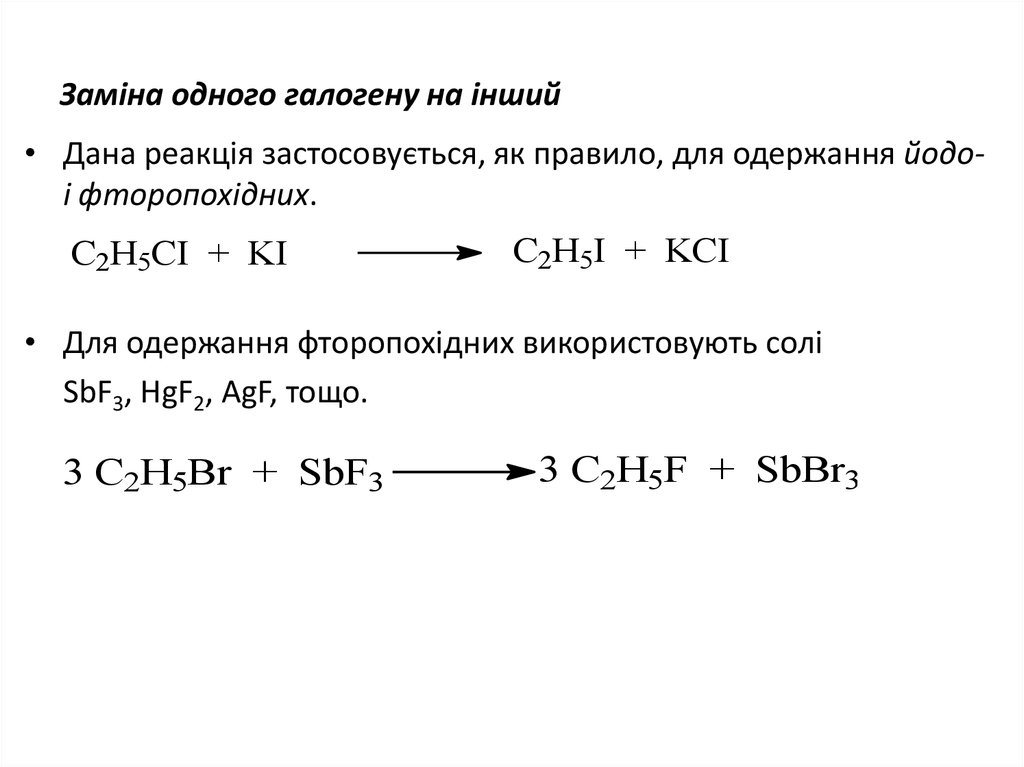
9. Заміна одного галогену на інший
• Дана реакція застосовується, як правило, для одержання йодоі фторопохідних.C2H5CI + KI
C2H5I + KCI
• Для одержання фторопохідних використовують солі
SbF3, HgF2, AgF, тощо.
3 C2H5Br + SbF3
3 C2H5F + SbBr3
10. ФІЗИЧНІ ВЛАСТИВОСТІ .
ФІЗИЧНІ ВЛАСТИВОСТІ.
• Галогеналкіли - це гази або рідини. Зі
збільшенням атомної маси галогену і
молекулярної маси вуглеводневого
залишку зростають їх температура топлення
та кипіння
11. ХІМІЧНІ ВЛАСТИВОСТІ
• Зв’язок С-НаІ у галогеналкілах відрізняється високоюполярністю, оскільки атоми галогенів, крім йоду, мають
більшу електронегативність порівняно з атомом
вуглецю і електронна густина цього зв’язку зсувається в
бік галогену.
• Полярність зв’язку С-НаІ збільшується для галогенів у
ряді I<Br<Cl<F, а поляризовність, навпаки, в цьому ряді
зменшується. Понижена електронна густина на атомі
вуглецю, безпосередньо зв’язаному з галогеном, робить
його привабливим для атаки нуклеофілами, що
визначає високу реакційну здатність галогенопохідних у
реакціях нуклеофільного заміщення SN. Причому,
реакційна здатність галогеналканів зростає в ряді: R-F <
R-Cl < R-Br < R-I.
12. Реакції нуклеофільного заміщення (SN).
• Дія нуклеофільних реагентів (аніонів і нейтральних молекул знеподіленими парами електронів) на галогеналкіли приводить
до заміщення атома галогену.
R—Hal + Nu‾ → R—Nu + Hal‾ .
• Реакція SN відбувається виключно у розчинах, де полярний
розчинник сприяє розриву зв’язку С-НаІ і сольватує йони та
молекули. Швидкість процесу SN залежить від будови
вуглеводневого радикалу, що зв’язаний з галогеном, природи
галогену, активності нуклеофільного реагента, просторової
будови вихідних сполук, стабільності проміжного карбокатіона і
природи розчинника.
• Встановлено, що реакція SN для алкілгалогенідів протікає за
одним з двох механізмамів: SN1 або SN2. Розглянемо ці
механізми на прикладі реакції гідролізу галогенопохідних.
13. Реакція заміщення другого порядку SN2 (бімолекулярна) характерна для пер-винних галогенопохідних.
• Швидкість даної реакції залежить від концентрації двохкомпонентів: алкілгало-генопохідного і нуклеофільного
реагента.
H3C CI + HOH
V = K [R-Hal]
NaOH
CH3OH + HCI
[OH ]
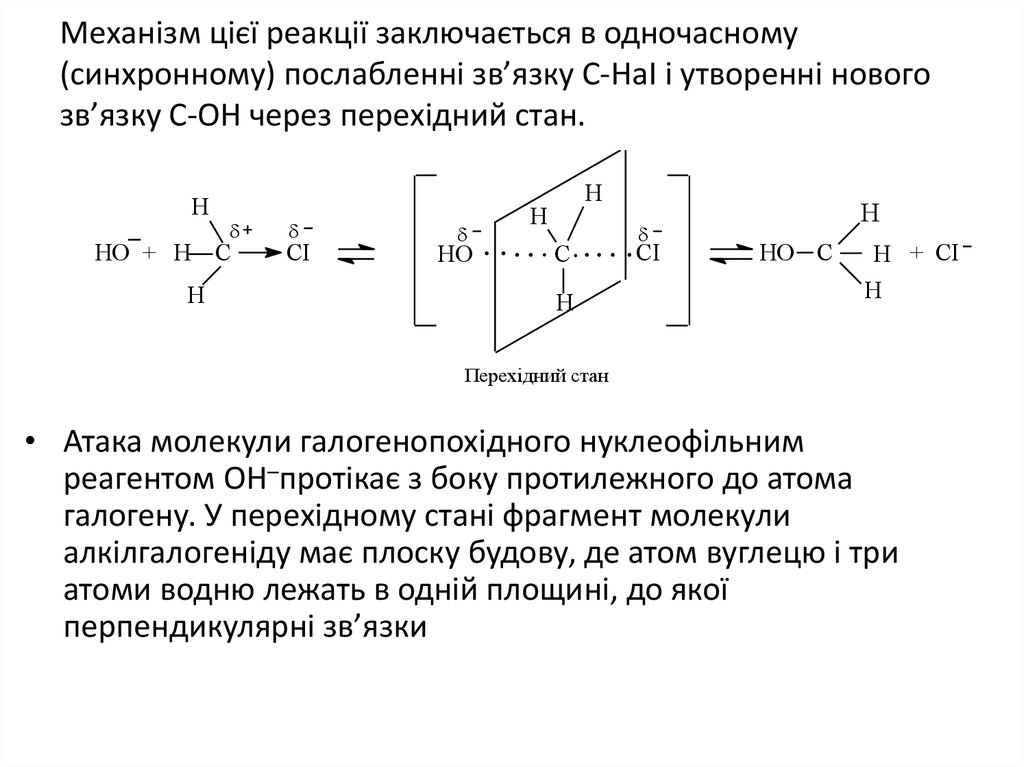
14. Механізм цієї реакції заключається в одночасному (синхронному) послабленні зв’язку С-НаІ і утворенні нового зв’язку С-ОН через
перехідний стан.Н
НО + Н С
Н
СІ
НО
Н
Н
C
Н
СІ
Н
НО C
Н + СІ
Н
Перехідний стан
• Атака молекули галогенопохідного нуклеофільним
реагентом ОН─протікає з боку протилежного до атома
галогену. У перехідному стані фрагмент молекули
алкілгалогеніду має плоску будову, де атом вуглецю і три
атоми водню лежать в одній площині, до якої
перпендикулярні зв’язки
15. Реакція заміщення першого порядку SN1 спостерігається для третинних галогенопохідних
• Поняття «перший порядок» або «мономолекулярнареакція» говорить про те, що швидкість реакції
пропорційна концентрації тільки одного з реагентів
(алкілгалогеніду)
• V=K[R-Hal],
• а від концентрації іншого реагента, тобто нуклеофіла, не
залежить.
• Механізм реакції мономолекулярного нуклеофільного
заміщення SN1 включає дві стадії:
16.
RR C
R
Hal
Повільно
R
R C
R
Hal
Карбокатіон
• Перша стадія - іонізація за рахунок дисоціації зв’язку С-Hal
протікає з малою швидкістю і є лімітуючою стадією всього
процесу. Нагадаємо, що лімітуючою називається
найповільніша стадія процесу і швидкість всього процесу
дорівнює швидкості лімітуючої стадії.
• Нагадаємо, що лімітуючою називається найповільніша
стадія процесу і швидкість всього процесу дорівнює
швидкості лімітуючої стадії.
• В результаті такої дисоціації утворюється доволі стабільний
карбокатіон.
17. Друга стадія - взаємодія карбокатіона з нуклеофільним реагентом протікає швидко.
+R3С
+ :О
Н
Швидко
Н
R3C O H
R3C OH + H+
H
або
R
R C
R
OH
Швидко
R
R C OH
R
Саме тому швидкість процесу визначає перша, повільна стадія –
іонізація. Оскільки в цій стадії приймає участь лише
алкілгалогенід, то її швидкість, а значить і швидкість всього
процесу буде залежити тільки від концентрації алкілгалогеніду
18.
• На реакцію SN2 впливають стеричні (просторові)перешкоди. Так, алкільні групи біля реакційного
центра заважають наближенню нуклеофіла. Тому
третинні алкілгалогеніди не реагують за механізмом
SN2. Чому ж тоді первинні галогеналкіли не реагують
за механізмом SN1? Реалізація механізму SN1
можлива у випадку утворення досить стійких
карбокатіонів. Первинні карбокатіони нестабільні і їх
утворення вимагає високої енергії активації.
Натомість третинні карбокатіони набагато стабільніші
первинних за рахунок прояву +І-еф. алкільних груп та
ефекту гіперкон’югації (σ-,ρ-спряження).
• Для вторинних алкілгалогенідів, залежно від умов,
реакція може протікати як SN1 або SN2 і порядок
реакції дробовий.
• За здатністю до реакції заміщення галогени
розташовуються в ряд: I > Br > Cl.
19. Реакції нуклеофільного заміщення широко застосовуються в органічному синтезі. Реакція гідролізу розглянута вище. До інших
реакцій належать:• Утворення етерів
CH3-CH2-O-CH2-CH3 + NaCI
СН3-СН2-СІ + NaOC2H5
Хлоретан
Етилат натрію
Діетиловий етер
• Утворення естерів
СН3-СН2-СІ + NaO-C-СH3
О
CH3-CH2-O-C-CH3
-NaCI
Етилацетат
О
• Амоноліз (одержання амінів та амонієвих солей) або алкілування
амінів
CH3-CI
Хлорометан
H NH2
+
-
[CH3NH3] CI
Метиламонійхлорид
CH3NH2 + HCI
Метиламін
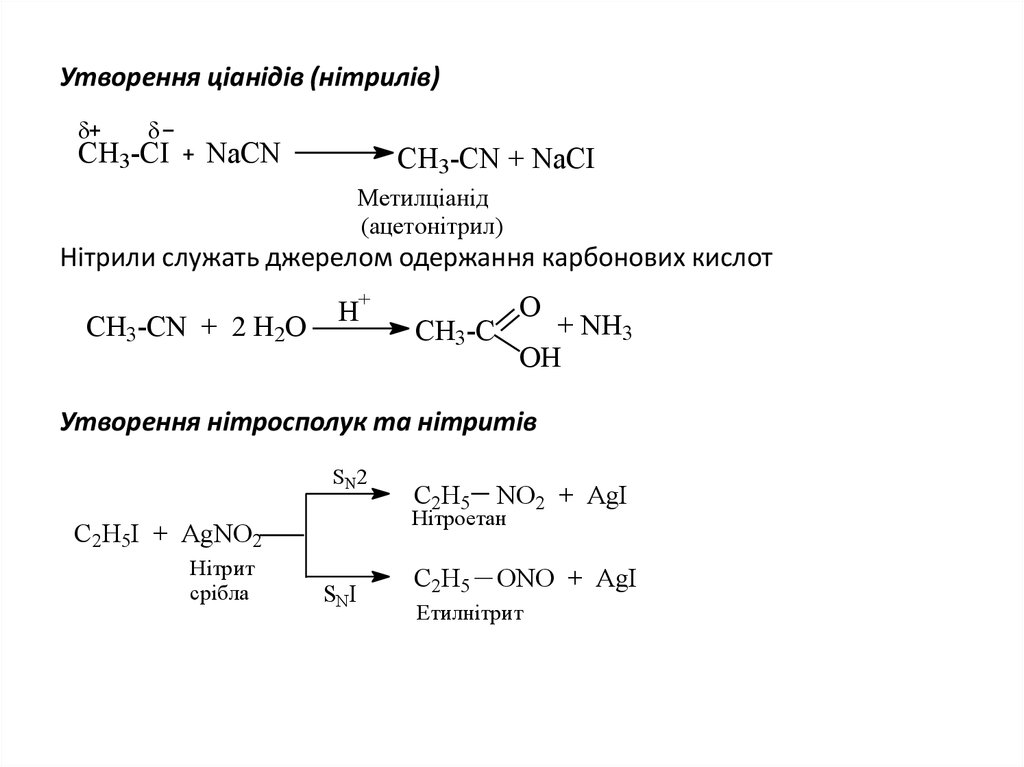
20. Утворення ціанідів (нітрилів)
CH3-CINaCN
CH3-CN + NaCI
Метилціанід
(ацетонітрил)
Нітрили служать джерелом одержання карбонових кислот
СН3-CN + 2 H2О
+
Н
СН3-С
О
+ NH3
ОН
Утворення нітросполук та нітритів
SN2
Нітроетан
С2Н5I + AgNO2
Нітрит
срібла
C2H5 NO2 + AgI
SNI
C2H5 ONO + AgI
Етилнітрит
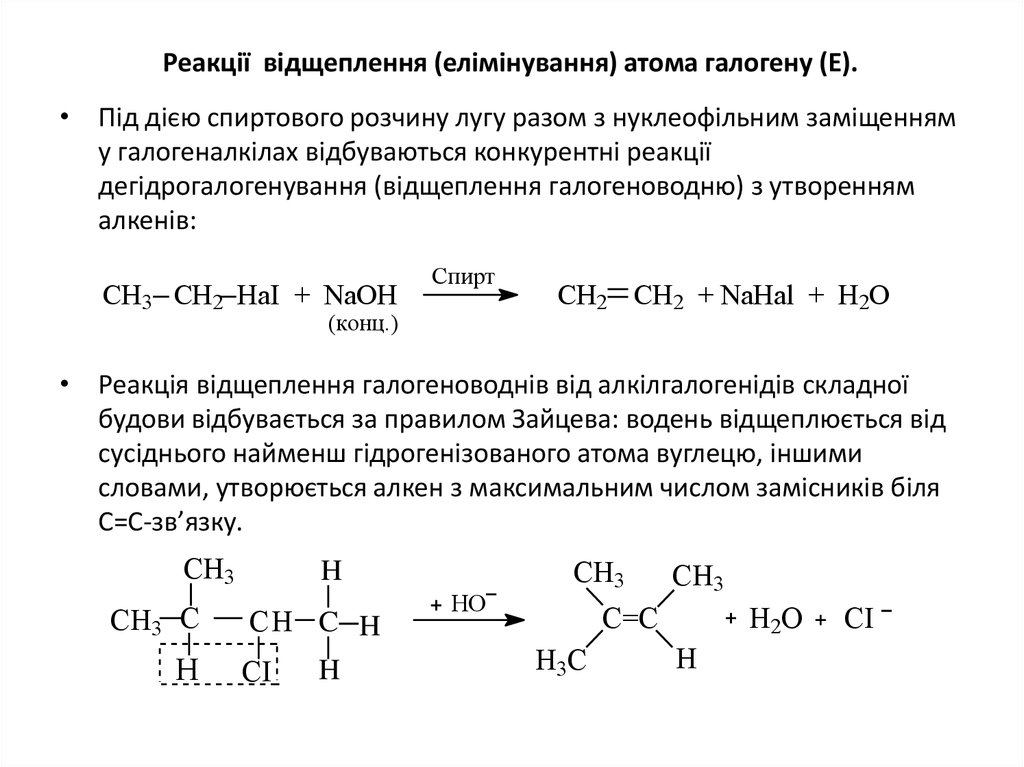
21. Реакції відщеплення (елімінування) атома галогену (Е).
• Під дією спиртового розчину лугу разом з нуклеофільним заміщенняму галогеналкілах відбуваються конкурентні реакції
дегідрогалогенування (відщеплення галогеноводню) з утворенням
алкенів:
СН3 СН2 НаІ + NaOH
Спирт
(конц.)
CH2 CH2 + NaHal + H2O
• Реакція відщеплення галогеноводнів від алкілгалогенідів складної
будови відбувається за правилом Зайцева: водень відщеплюється від
сусіднього найменш гідрогенізованого атома вуглецю, іншими
словами, утворюється алкен з максимальним числом замісників біля
С=С-зв’язку.
СН3
СН3 С
H
H
CH C H
CI
H
HO
СН3
СН3
C=C
Н3С
Н2О
H
CI
22. ДИ- ТА ПОЛІГАЛОГЕНОПОХІДНІ НАСИЧЕНИХ ВУГЛЕВОДНІВ
• У молекулах галогенопохідних можуть бути два, три та більше атоміводного або різних галогенів.
• Галогенопохідні, у яких два атоми галогену знаходяться при одному
атомі вуглецю, називаються гемінальними, наприклад (1,1-похідні). У
випадку перебування атомів галогенів біля сусідніх вуглецевих атомів,
галогенопохідні називаються віцинальними, наприклад (1,2-похідні).
CН3 СНСІ2
1,1-Дихлоретан
(гемінальний)
СІ-СН2СН2-СІ
1,2-Дихлоретан
(віцинальний)
Тривіальні назви: хлороформ СНСІ3, бромоформ СНBr3, йодоформ СНІ3,
чотирихлористий вуглець ССІ4, фреони.
23. Способи одержання
СПОСОБИ ОДЕРЖАННЯ• Галогенування алканів.
СН3 СН3 + 2СІ2
h
CI
CI
CH CH3 + СІ СН2 СН2 СІ + 2НСІ
1,1-Дихлоретан
1,2-Дихлоретан
• Приєднання галогенів або галогеноводнів до алкенів і алкінів
СІ
СН2 СH2
CI2
СІ
СН2 СH2
1,2-Дихлоретан
HC CH
2HCI
H3C CHCI2
СІ СІ
СІ СІ
HC CH
CI2
HC CH
CI2
HC CH
СІ СІ
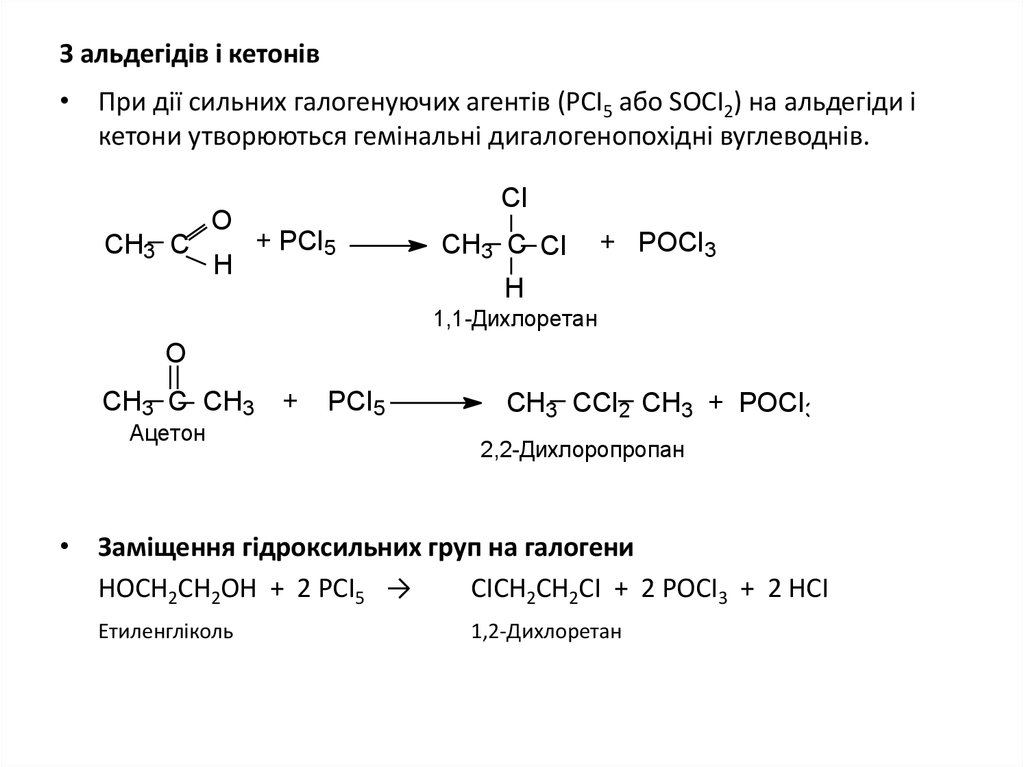
24. З альдегідів і кетонів
• При дії сильних галогенуючих агентів (РСІ5 або SОСІ2) на альдегіди ікетони утворюються гемінальні дигалогенопохідні вуглеводнів.
СН3 С
О
Н
СІ
+ РСІ5
СН3 С СІ
+ РОСІ3
Н
1,1-Дихлоретан
O
СН3 С СН3
Ацетон
+
РСІ5
СН3 ССІ2 СН3 + РОСІ3
2,2-Дихлоропропан
• Заміщення гідроксильних груп на галогени
НОСН2СН2ОН + 2 РСІ5 →
СІСН2СН2СІ + 2 РОСІ3 + 2 НСІ
Етиленгліколь
1,2-Дихлоретан
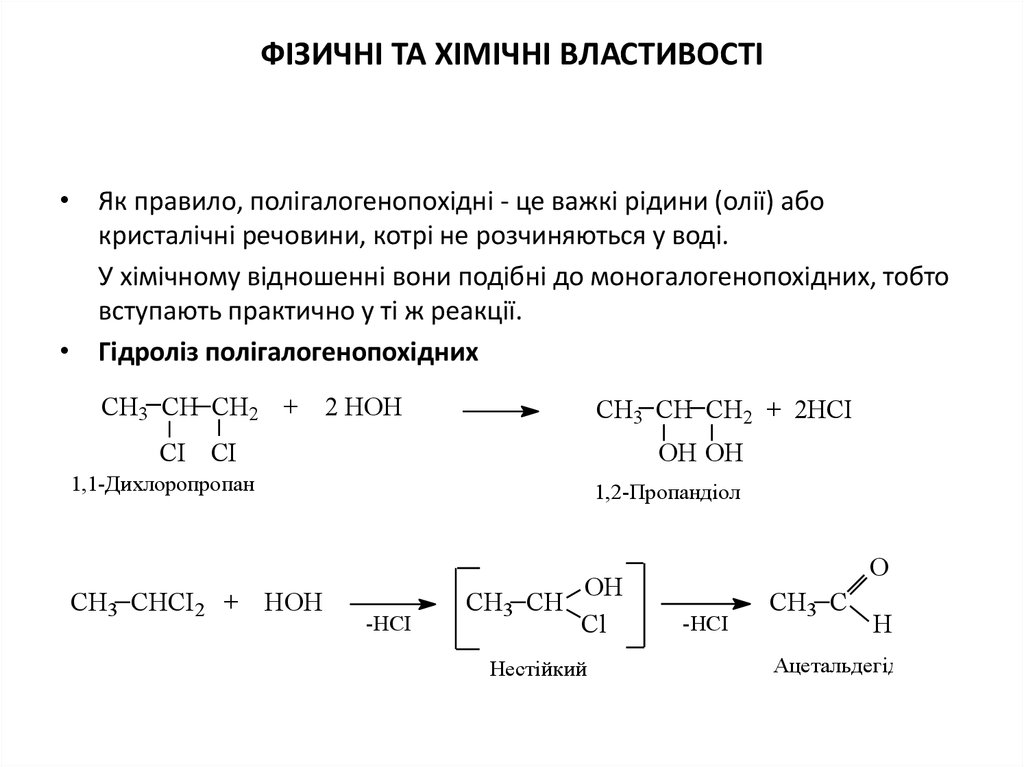
25. ФІЗИЧНІ ТА ХІМІЧНІ ВЛАСТИВОСТІ
• Як правило, полігалогенопохідні - це важкі рідини (олії) абокристалічні речовини, котрі не розчиняються у воді.
У хімічному відношенні вони подібні до моногалогенопохідних, тобто
вступають практично у ті ж реакції.
• Гідроліз полігалогенопохідних
СН3 СН СН2 + 2 НОН
СН3 СН СН2 + 2НСІ
СІ СІ
ОН ОН
1,1-Дихлоропропан
СН3 СНСІ2 + НОН
1,2-Пропандіол
-НСІ
ОН
СН3 СН
Cl
Нестійкий
О
-НСІ
СН3 С
Н
Ацетальдегід
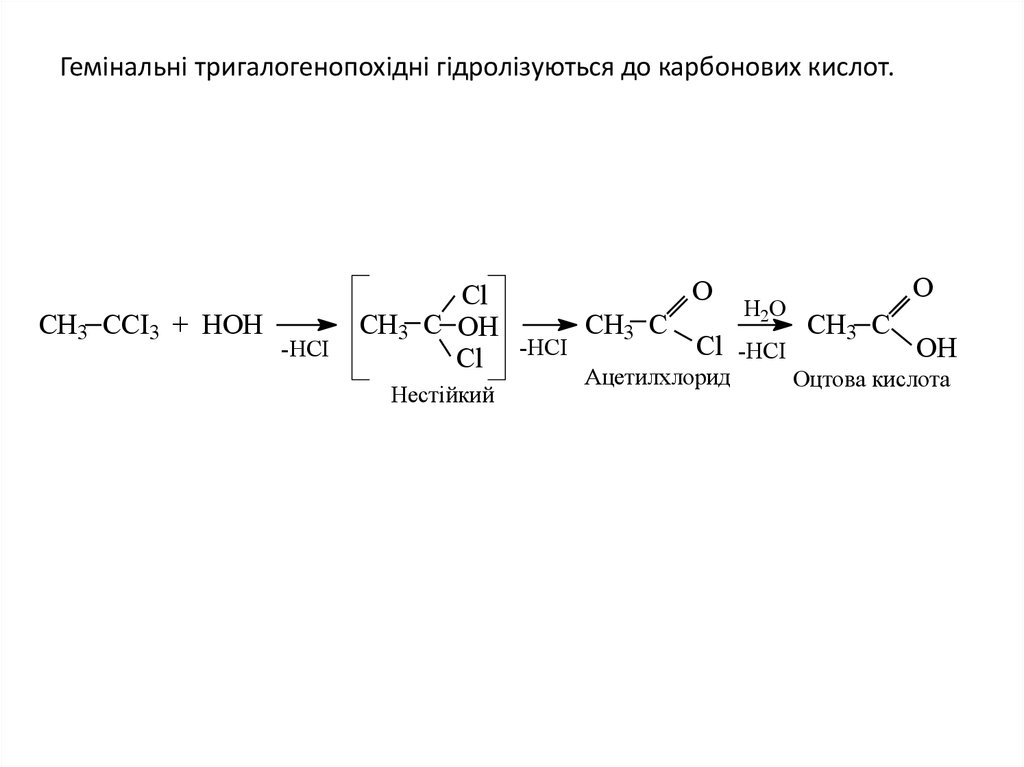
26. Гемінальні тригалогенопохідні гідролізуються до карбонових кислот.
СН3 ССІ3 + НОН-НСІ
О
О
Cl
Н2О
СН3 С ОН
СН3 С
СН3 С
Cl -НСІ
ОН
Cl -НСІ
Нестійкий
Ацетилхлорид
Оцтова кислота
27. Фреони.
• Фреонами називають фторхлоралкани ССІ3F, CHClF2, C2СІ2F4, С2СІF5тощо, які застосовуються як холодоагенти в холодильних установках.
Фреони позначаються марками (номерами), де остання цифра вказує
число атомів фтору, а передостання - атомів водню, причому 1
означає, що водню немає, 2 - один атом водню і так далі. Наприклад,
CF2Cl2 - фреон-12, СНСІF2 - фреон-22, ССІ3F - фреон-11. Їх отримують
шляхом заміни частини атомів хлору у поліхлоропохідних на фтор,
наприклад:
ССІ4 + 2 HF
Sb F5
o
t
CF2CI2 + 2 HCI
Дифтородихлорометан
(Фреон-12)
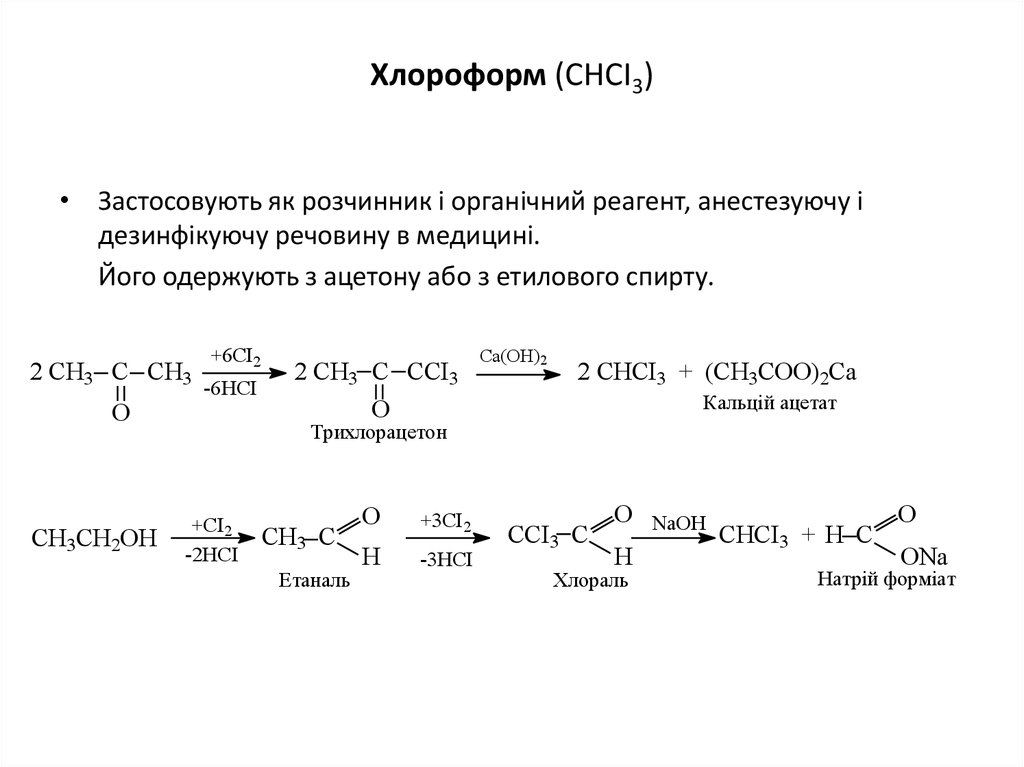
28. Хлороформ (СНСІ3)
• Застосовують як розчинник і органічний реагент, анестезуючу ідезинфікуючу речовину в медицині.
Його одержують з ацетону або з етилового спирту.
2 СН3 С СН3
О
СН3СН2ОН
+6СІ2
-6НСІ
2 СН3 С ССІ3
Са(ОН)2
2 СНСІ3 + (СН3СОО)2Ca
Кальцій ацетат
О
Трихлорацетон
+СІ2
-2НСІ
СН3 С
Етаналь
О
+3СІ2
Н
-3НСІ
ССІ3 С
О NaOH
О
CHCI3 + Н С
Н
ONa
Хлораль
Натрій форміат
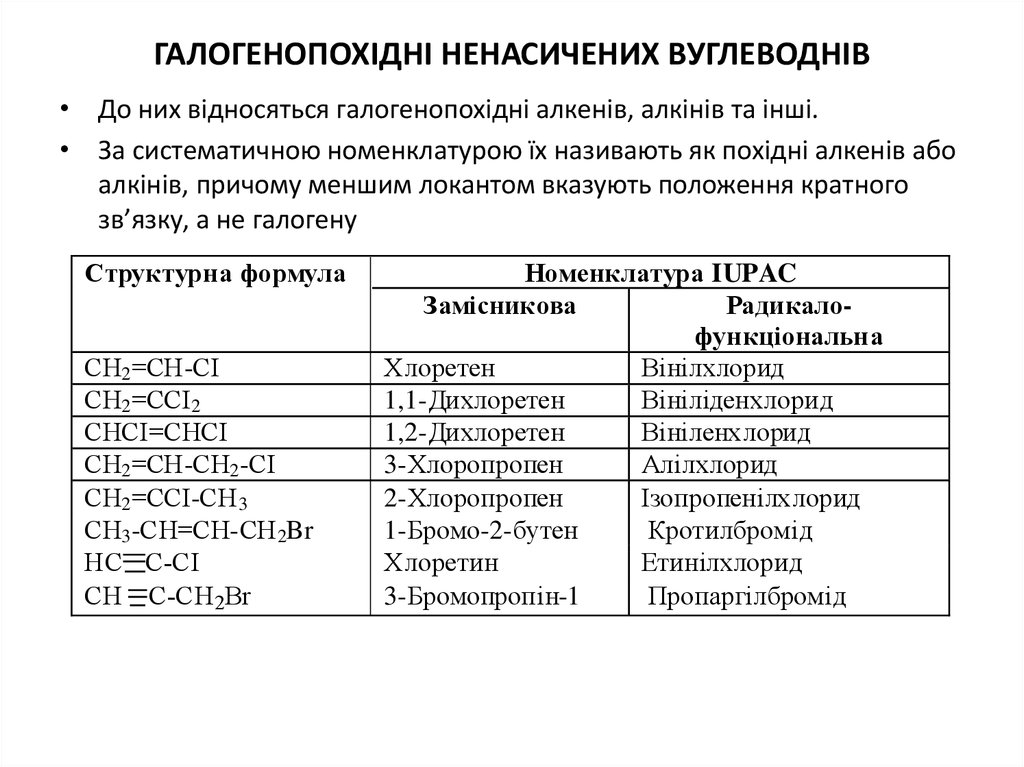
29. ГАЛОГЕНОПОХІДНІ НЕНАСИЧЕНИХ ВУГЛЕВОДНІВ
• До них відносяться галогенопохідні алкенів, алкінів та інші.• За систематичною номенклатурою їх називають як похідні алкенів або
алкінів, причому меншим локантом вказують положення кратного
зв’язку, а не галогену
Структурна формула
СН2 =СН-СІ
СН2 =ССІ2
СНСІ=СНСІ
СН2 =СН-СН2 -СІ
СН2 =ССІ-СН 3
СН3 -СН=СН-СН 2Br
НС С-СІ
СН С-СН 2Br
Номенклатура IUPAC
Замісникова
Радикалофункціональна
Хлоретен
Вінілхлорид
1,1-Дихлоретен
Вініліденхлорид
1,2-Дихлоретен
Вініленхлорид
3-Хлоропропен
Алілхлорид
2-Хлоропропен
Ізопропенілхлорид
1-Бромо-2-бутен
Кротилбромід
Хлоретин
Етинілхлорид
3-Бромопропін-1
Пропаргілбромід
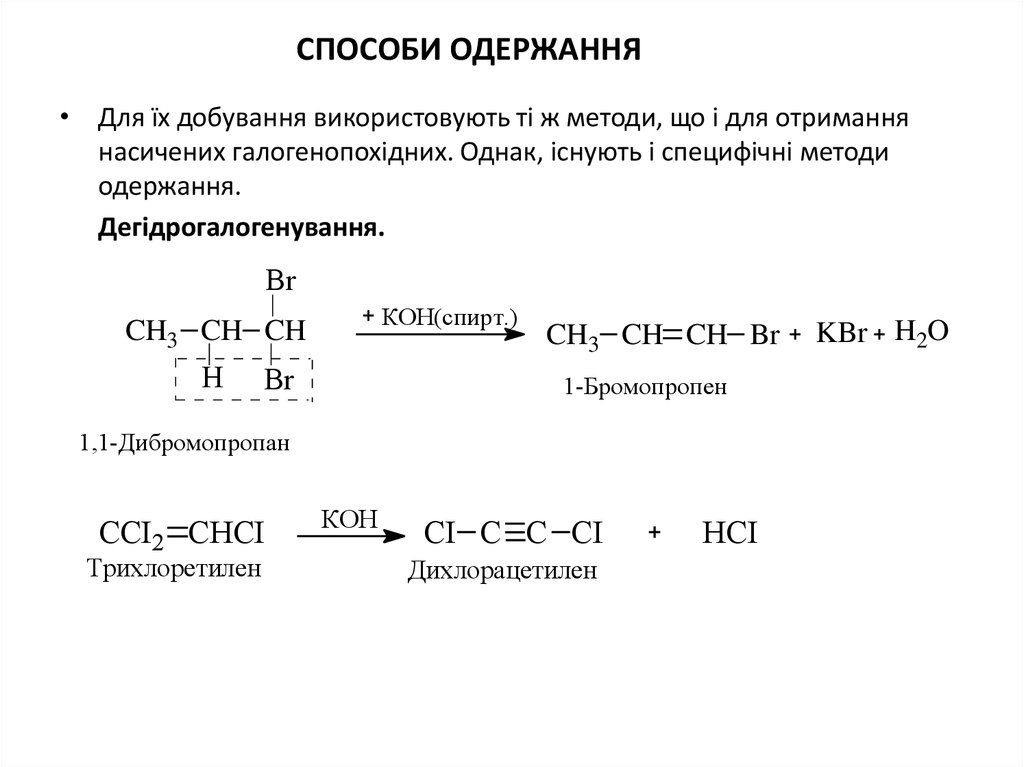
30. СПОСОБИ ОДЕРЖАННЯ
• Для їх добування використовують ті ж методи, що і для отриманнянасичених галогенопохідних. Однак, існують і специфічні методи
одержання.
Дегідрогалогенування.
Br
КОН(спирт.)
CH3 CH CH
H
Br
CH3 CH CH Br
1-Бромопропен
1,1-Дибромопропан
ССІ2 СНСІ
Трихлоретилен
КОН
СІ С С СІ
Дихлорацетилен
НСІ
KBr H2O
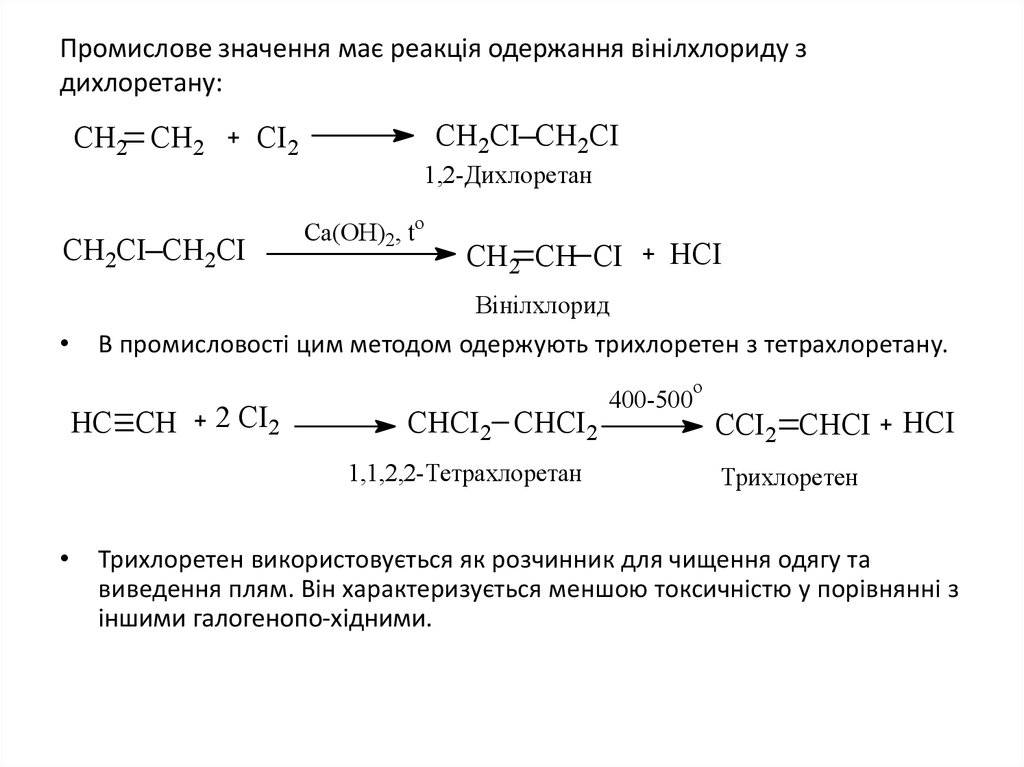
31. Промислове значення має реакція одержання вінілхлориду з дихлоретану:
СH2 СН2СН2СІ СН2СІ
СІ2
1,2-Дихлоретан
СН2СІ СН2СІ
Са(ОН)2, to
СН2 СН СІ
HCI
Вінілхлорид
В промисловості цим методом одержують трихлоретен з тетрахлоретану.
о
HC CH
2 CI2
CHCI2 CHCI2
1,1,2,2-Тетрахлоретан
400-500
CCI2 CHCI
HCI
Трихлоретен
Трихлоретен використовується як розчинник для чищення одягу та
виведення плям. Він характеризується меншою токсичністю у порівнянні з
іншими галогенопо-хідними.
32. Шляхом термічного дегідрогалогенування фреону-22 одержують тетрафторетен:
2 СHF2CIo
700
Фреон-22
(хлородифторометан)
CF2 CF2
2 HCI
Тетрафторетен
Тетрафторетен може полімеризуватися з утворенням
політетрафторетену (тефлону).
n CF2 CF2
CF2 CF2
n
Тефлон
Тефлон характеризується надзвичайно високою хімічною інертністю,
термостійкістю, біосумістністю, аномально низьким коефіціентом
тертя. Він може працювати в найагресивніших середовищах при
температурах до 300о. З нього виготовляють кровяні русла, хімічну
апаратуру, підшипники ковзання, присадки до моторних олив, посуд,
штучні суглоби тощо. Водну емульсію тефлону використовують як
замінник крові під час складних хірургічних операцій.
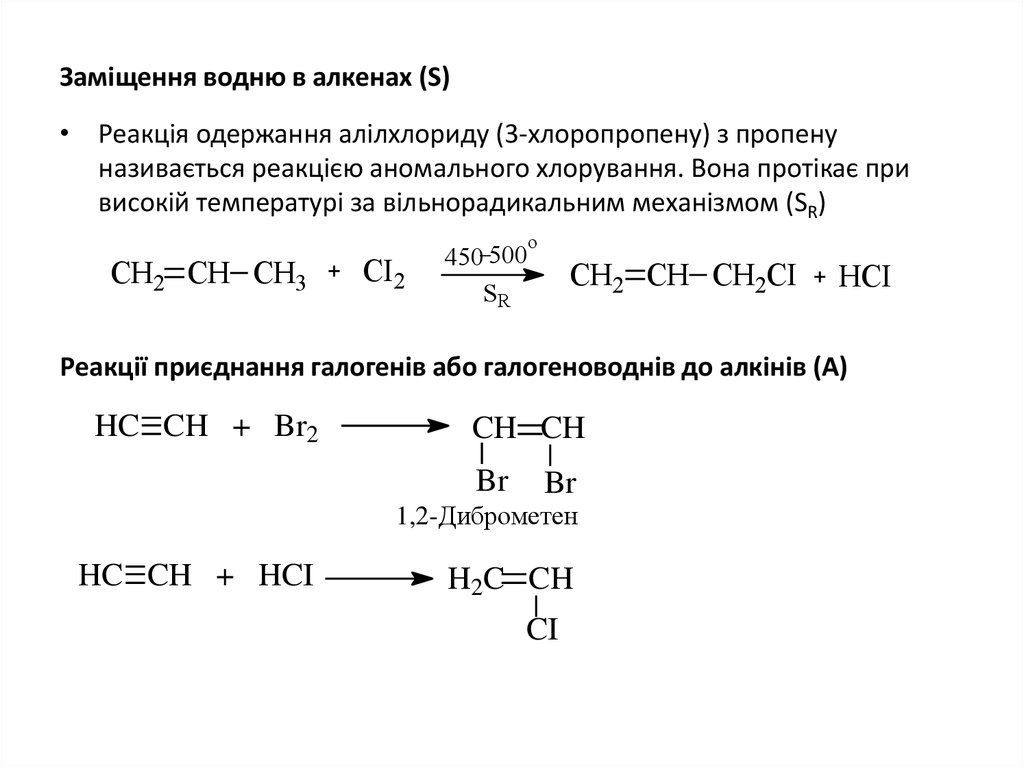
33. Заміщення водню в алкенах (S)
• Реакція одержання алілхлориду (3-хлоропропену) з пропенуназивається реакцією аномального хлорування. Вона протікає при
високій температурі за вільнорадикальним механізмом (SR)
о
СН2 СН СН3
СІ2
450 500
SR
СН2 СН СН2СІ
HCI
Реакції приєднання галогенів або галогеноводнів до алкінів (А)
HC CH + Br2
CH CH
Br
Br
1,2-Диброметен
HC CH + HCI
H2C CH
CI
34. ХІМІЧНІ ВЛАСТИВОСТІ
• Ненасичені галогенопохідні за реакційною здатністю умовно можнарозділити на 3 групи.
• 1. Атом галогену знаходиться безпосередньо при подвійному
зв’язку.
• Для таких галогенопохідних характерна мала реакційна здатність як
атома галогену, так і подвійного зв'язку.
CH2 = CH
CI
або
СН2
СН
СІ
35. 2. Атом галогену знаходиться в α-положенні відносно подвійного зв’язку (алільні галогенопохідні).
• Для таких сполук характерна висока рухливість атома галогену вреакціях заміщення. Реакції протікають в м’яких умовах за
механізмом SN1.
CH2 = CH CH2 СІ
Повільно
CH2 = CH CH2 + OH
CH2 = CH CH2 + СІ
Алільний
карбокатіон
CH2 CH CH2
OH
Аліловий спирт
36. 3. Атом галогену і кратний вуглець-вуглецевий зв’язок ізольовані один від одного.
Прикладом таких галогенопохідних можуть служити сполуки:CH2 C СН СН2 CI
4-Хлоро-1-бутен
CH C СН2 СН2 СН2 Br
5-Бромо-1-пентин
Оскільки атом галогену і кратний зв’язок практично не впливають
один на одного, то хімічні властивості таких сполук аналогічні
властивостям алкенів і насичених галогенопохідних.




















 chemistry
chemistry








