Similar presentations:
Алкіни (ацетиленові вуглеводні)
1. АЛКІНИ
• Алкінами або ацетиленовими вуглеводнями називаються вуглеводні,які мають в молекулі один потрійний зв’язок —С С—.
• Вони утворюють гомологічний ряд загальної формули СnН2n-2. Перший
представник цього ряду – етин (ацетилен).
Структурна формула
Н-С С-Н
СН 3-С СН
СН 3-СН2-С СН
СН 3-С С- СН3
Номенклатура IUPAC
Замісникова
Радикалофункціональна
Етин
Ацетилен
Пропін
Метилацетилен
1-Бутин
Етилацетилен
2-Бутин
Диметилацетилен
СН 3-СН2-СН2-С СН
СН 3-СН-С СН
1-Пентин
3-Метилбутин
СН3
Пропілацетилен
Ізопропілацетилен
Скорочене
зображення
формул
2. Відповідно до замісникової номенклатури (IUPAC) алкіни називають, змінюючи у відповідних алканах суфікс -ан на –ин (ін).
Відповідно до замісникової номенклатури (IUPAC) алкіни називають, змінюючи увідповідних алканах суфікс -ан на –ин (ін).
СН3 СН3
Етан
Н С
С Н
Етин
Головний ланцюг повинен включати потрійний зв’язок. Нумерація головного
ланцюга починається з того кінця, ближче до якого перебуває потрійний зв’язок.
За радикало-функціональною номенклатурою їх називають як похідні ацетилену.
• Назви залишків алкінів утворюють додаванням суфікса –іл до назви
вуглеводня:
СН3 С
Етиніл (ацетиленіл)
СН3 С С
1-Пропініл
3
1
2
2-Пропініл (пропаргіл)
СН С СН2
5
4
3
2
1
СН3 С С СН2 СН2
3-Пентиніл
• У радикалів нумерація головного ланцюга починається з атома
вуглецю, що має вільну валентність.
3. Промислові методи добування 1. Піроліз алканів (метану або нафтових фракцій)
Промислові методи добування1. Піроліз алканів (метану або нафтових фракцій)
2 CH4
1500oC
1c
CH CH + 3 H2
• При піролізі нафтових фракцій, таких як бензин або гас утворюється
також ацетилен.
o
CH3 CH2 CH2 CH2 CH2 CH3
1200 1500 C
3 CH CH + 4 H2
4. 2. З кальцій карбіду (карбідний метод) При спіканні вапна з коксом при 2000ºС, утворюється кальцій карбід (СаС2).
oCaO + 3 C
2000
CaC2 CO
При взаємодії з водою він легко гідролізує:
Ca
C C + 2 HOH
HC = CH + Ca(OH)2
Карбід магнію (Мg2С3 )утворює пропін:
Mg2C3 + 4 H2O
CH3 C CH + 2Mg(OH)2
5. Лабораторні методи добування
• Відщеплення галогеноводню від дигалогеналканів абогалогеналкенів.
• При підвищених температурах у присутності концентрованого розчину
спиртового лугу утворюються алкіни:
СН2 СН2
СІ
СІ
1,2-Дихлоретан
КОН
-НСІ
НС=СН
СІ
Хлоретен
КОН
-НСІ
СН СН
Ацетилен
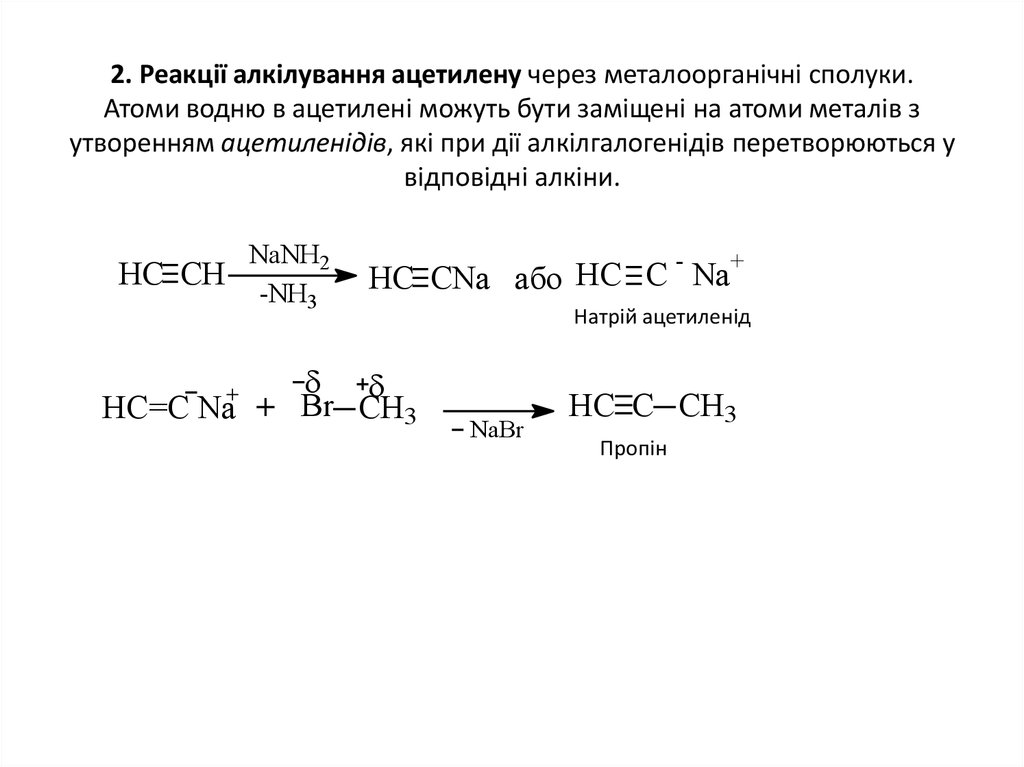
6. 2. Реакції алкілування ацетилену через металоорганічні сполуки. Атоми водню в ацетилені можуть бути заміщені на атоми металів з
утворенням ацетиленідів, які при дії алкілгалогенідів перетворюються увідповідні алкіни.
НС СН
НС=С Na
NaNH2
-NH3
-
+
HC CNa або НС С Na
Br CH3
Натрій ацетиленід
NaBr
HC C CH3
Пропін
7. ФІЗИЧНІ ВЛАСТИВОСТІ
• Алкіни С2-С4- це гази, починаючи з С5- і до С16- рідини, а з С17-твердіречовини. Їх фізичні властивості подібні до властивостей алканів і
алкенів. Значення густин і показників заломлення у алкінів значно
вищі, ніж у алкенів і алканів.
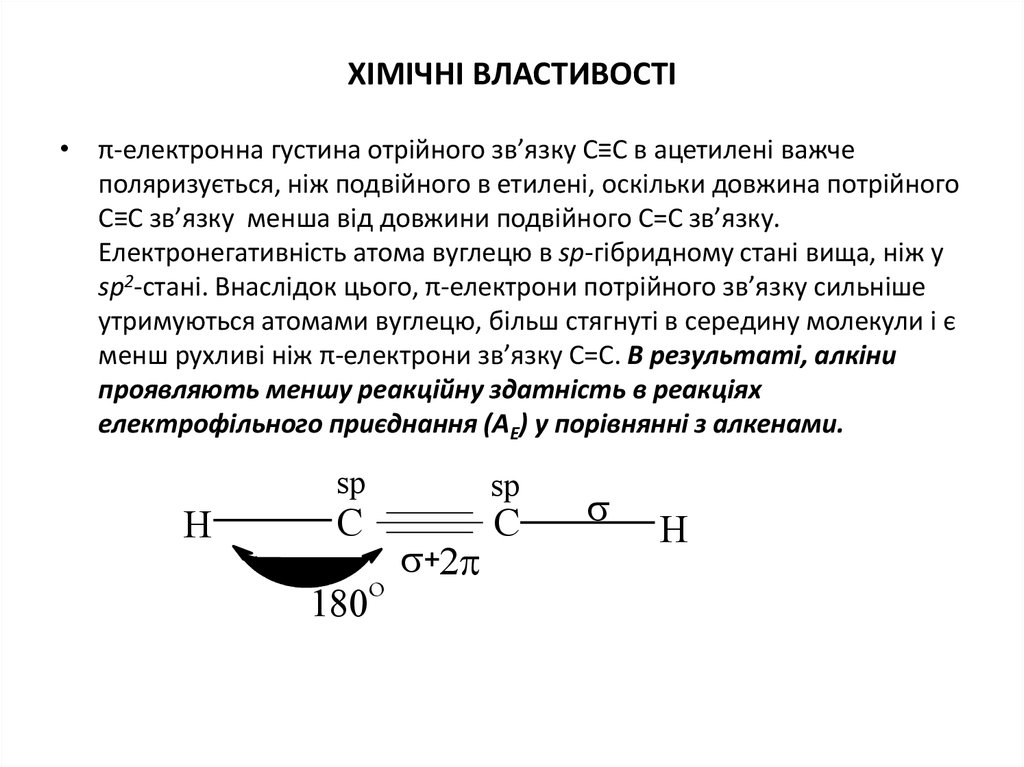
8. ХІМІЧНІ ВЛАСТИВОСТІ
• π-електронна густина отрійного зв’язку С≡С в ацетилені важчеполяризується, ніж подвійного в етилені, оскільки довжина потрійного
С≡С зв’язку менша від довжини подвійного С=С зв’язку.
Електронегативність атома вуглецю в sp-гібридному стані вища, ніж у
sp2-стані. Внаслідок цього, π-електрони потрійного зв’язку сильніше
утримуються атомами вуглецю, більш стягнуті в середину молекули і є
менш рухливі ніж π-електрони зв’язку С=С. В результаті, алкіни
проявляють меншу реакційну здатність в реакціях
електрофільного приєднання (АЕ) у порівнянні з алкенами.
sp
sp
C
C
9.
• В той же час, з боку атомів водню існує деякий дефіцит електронноїгустини, яка зміщена до центру потрійного зв’язку. Внаслідок цього
алкіни отримують можливість вступати в реакції нуклеофільного
приєднання (АN). Причому нуклеофіл атакує молекулу ацетилена з
«торця».
C
C
E
Nu
• В молекулі ацетилену зв’язок С-Н, утворений sp-гібридною орбіталлю
атома С. Відомо, що електронегативність гібридної орбіталі зростає зі
збільшенням у ній частки s-орбіталі: sp3 – 2,5; sp2 – 2,75; sp – 3,2 (за
шкалою Л.Полінга).
Тому в цьому ж ряду зростає і полярніть зв’язку С Н.
Це означає, що атоми вогдню в ацетилені протонізовані значно
більше, ніж в етилені або в етані, про що свідчать значення констант
іонізації цих сполук: рК(ацетилен) = 25; рК (етилен) = 44. Для
порівняння рК (Н2О) = 15,7. Отже ацетилен проявляє кислотні
властивості, хоча являється слабшою кислотою, ніж вода.
10.
• Таким чином для алкінів характерні реакціїприєднання (АЕ та АN), полімеризації,
окиснення, та заміщення за "кислим”
воднем.
11. Реакції приєднання
1. Гідрування.Приєднання водню до потрійного зв’язку протікає в присутності
каталізаторів : Ni, Pt, Pd.
H C C Н + H2
Pd/Pb
H
C=C
H
H
H
H2
CH3 CH3
2. Приєднання електрофільних реагентів (АЕ)
• 2.1. Приєднання галогенів
• Приєднання хлору, йоду до алкінів протікає з меншою швидкістю, ніж
до алкенів і супроводжується утворенням суміші цис- і транспродуктів (переважно транс-):
H C C Н + Br2
H
C=C
Br
Br
H
транс-1,2-Диброметен
Br2
CHBr2 CHBr2
1,1,2,2-Тетраброметан
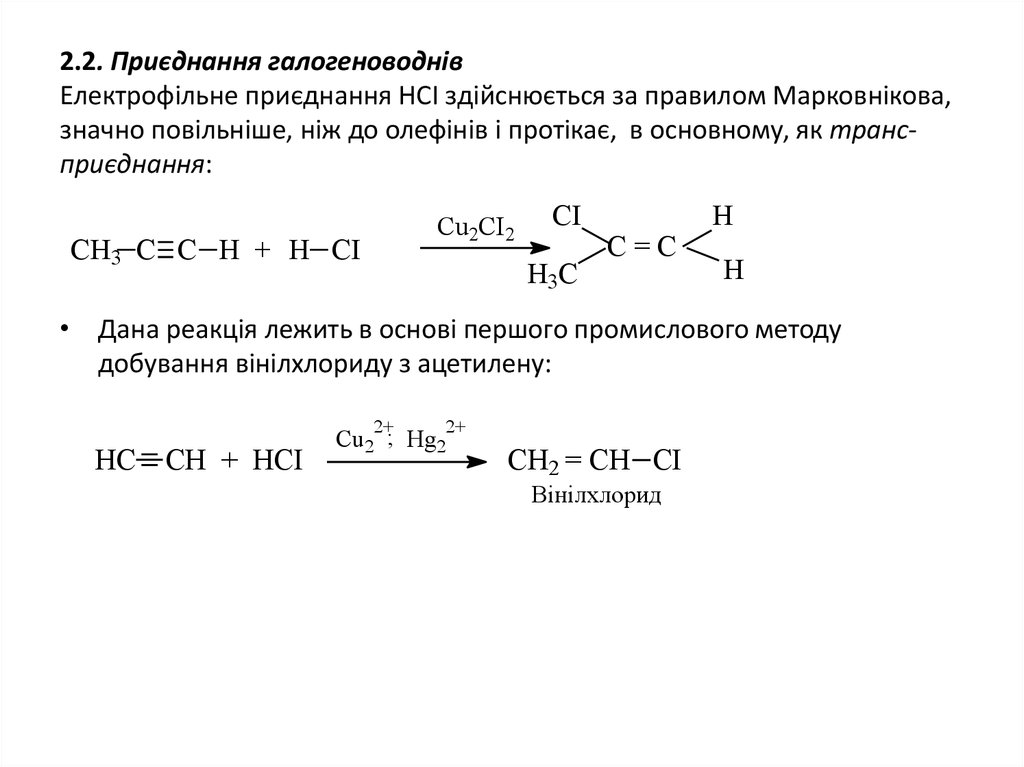
12. 2.2. Приєднання галогеноводнів Електрофільне приєднання НСІ здійснюється за правилом Марковнікова, значно повільніше, ніж до
олефінів і протікає, в основному, як трансприєднання:Сu2CI2
СН3 С С Н + Н СІ
CI
H3C
C=C
H
H
• Дана реакція лежить в основі першого промислового методу
добування вінілхлориду з ацетилену:
2+
HC CH + HCI
2+
Cu2 ; Hg2
CH2 = CH CI
Вінілхлорид
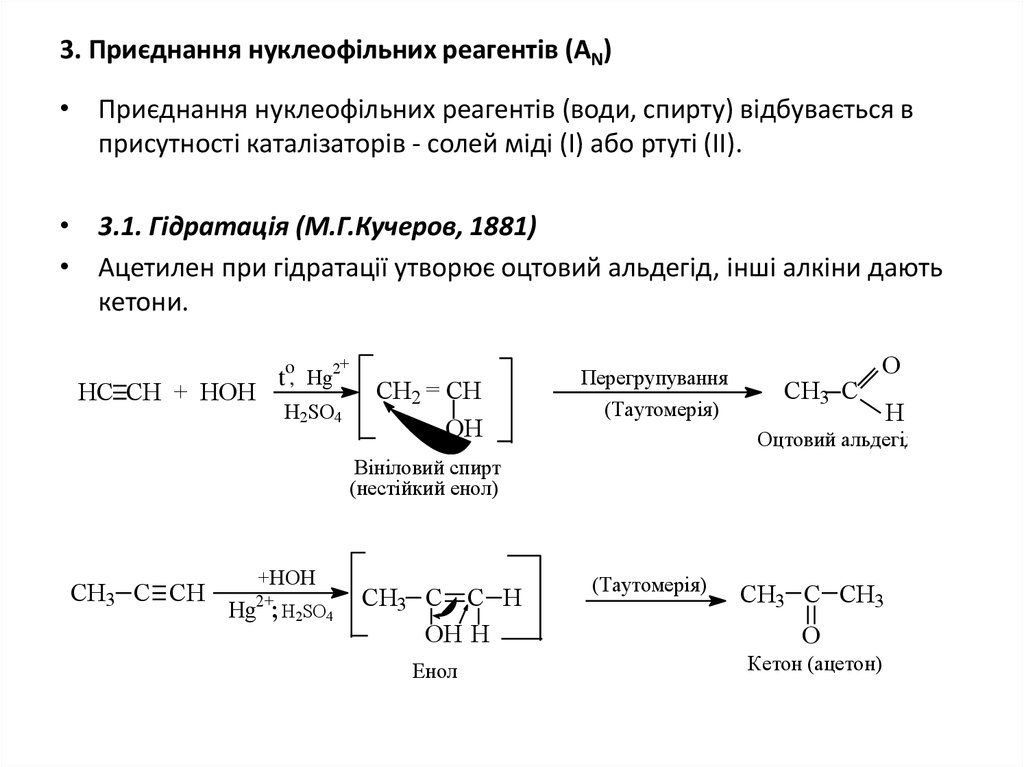
13. 3. Приєднання нуклеофільних реагентів (АN)
• Приєднання нуклеофільних реагентів (води, спирту) відбувається вприсутності каталізаторів - солей міді (І) або ртуті (ІІ).
• 3.1. Гідратація (М.Г.Кучеров, 1881)
• Ацетилен при гідратації утворює оцтовий альдегід, інші алкіни дають
кетони.
+
to, Hg2
HC CH + HOH
H2SO4
CH2 = CH
OH
Перегрупування
(Таутомерія)
CH3 C
O
Оцтовий альдегід
Вініловий спирт
(нестійкий енол)
CH3 C CH
+HOH
2+
Hg ; H2SO4
CH3 C C H
OH H
Енол
H
(Таутомерія)
CH3 C CH3
O
Кетон (ацетон)
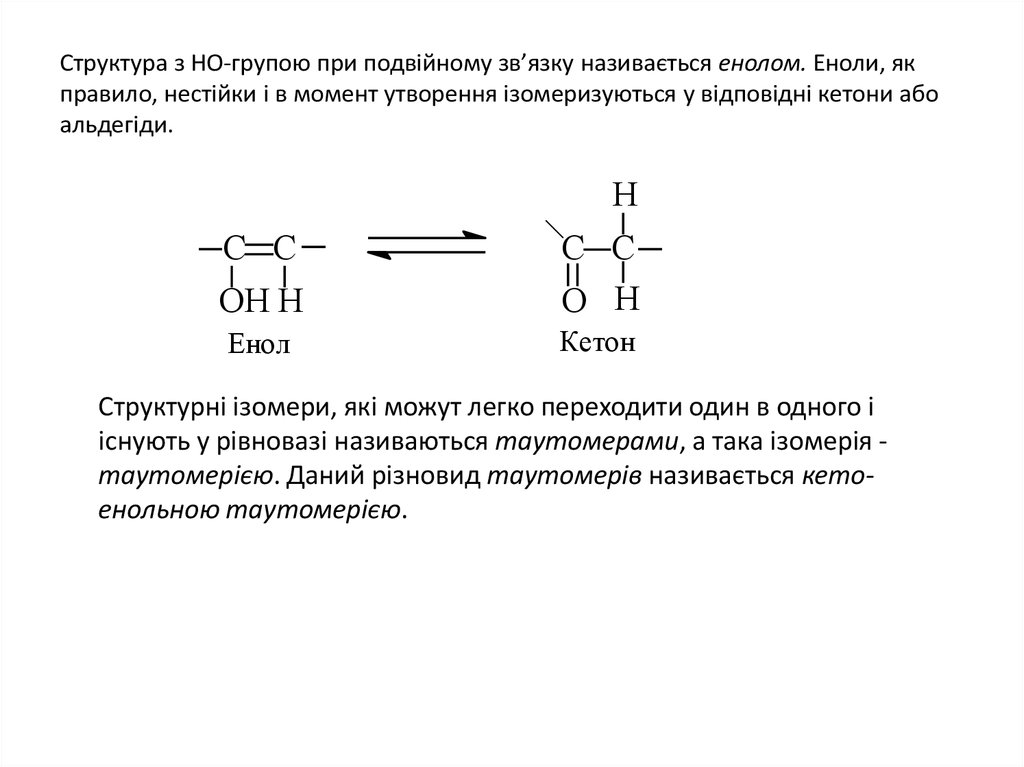
14. Структура з НО-групою при подвійному зв’язку називається енолом. Еноли, як правило, нестійки і в момент утворення
ізомеризуються у відповідні кетони абоальдегіди.
Н
С С
ОН Н
С С
О Н
Енол
Кетон
Структурні ізомери, які можут легко переходити один в одного і
існують у рівновазі називаються таутомерами, а така ізомерія таутомерією. Даний різновид таутомерів називається кетоенольною таутомерією.
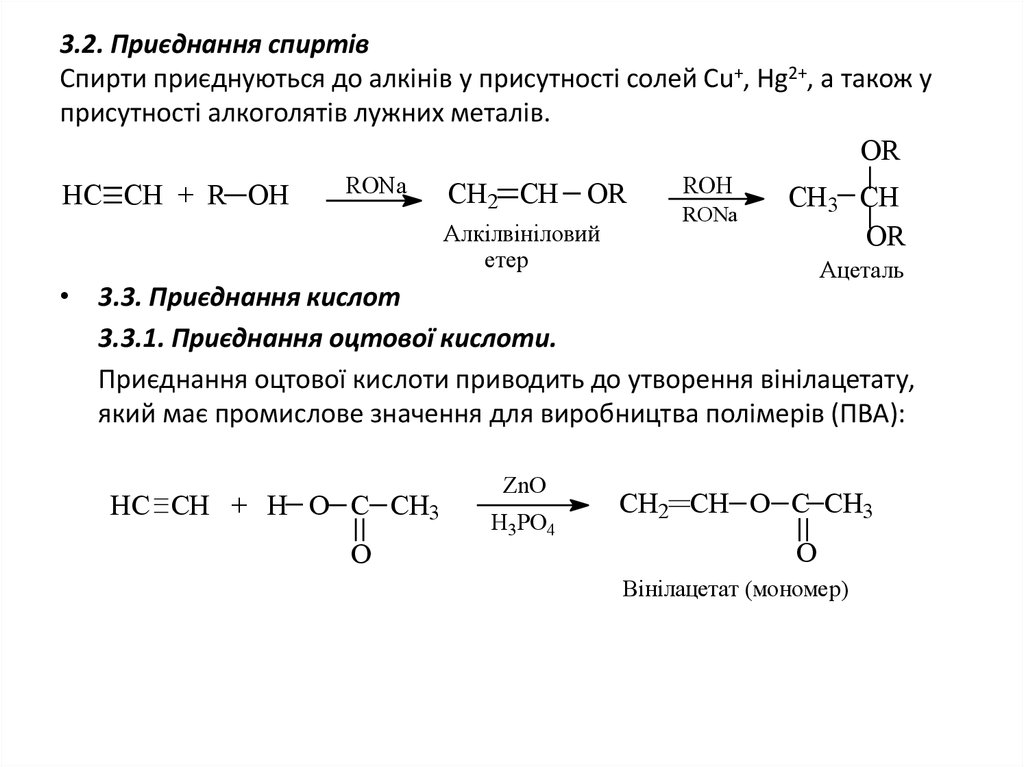
15. 3.2. Приєднання спиртів Спирти приєднуються до алкінів у присутності солей Сu+, Hg2+, а також у присутності алкоголятів лужних
металів.OR
RONa
ROH
CH2 CH OR
HC CH + R OH
CH3 CH
RONa
Алкілвініловий
OR
етер
Ацеталь
• 3.3. Приєднання кислот
3.3.1. Приєднання оцтової кислоти.
Приєднання оцтової кислоти приводить до утворення вінілацетату,
який має промислове значення для виробництва полімерів (ПВА):
HC CH + H O C CH3
O
ZnO
H3PO4
CH2 CH O C CH3
O
Вінілацетат (мономер)
16. 3.3.2. Приєднання ціанідної кислоти У результаті реакції утворюється мономер - акрилонітрил (нітрил акрилової кислоти), який
широко застосовується для синтезу полімерів та каучуків:HC CH
H C N
Cu(CN)2
H2C CH C N
• Реакції 2.2, 3.2 і 3.3 називаються реакціями вінілування ― утворення
вінільних мономерів, які в свою чергу можуть полімеризуватись з
утворенням полімерних матеріалів.
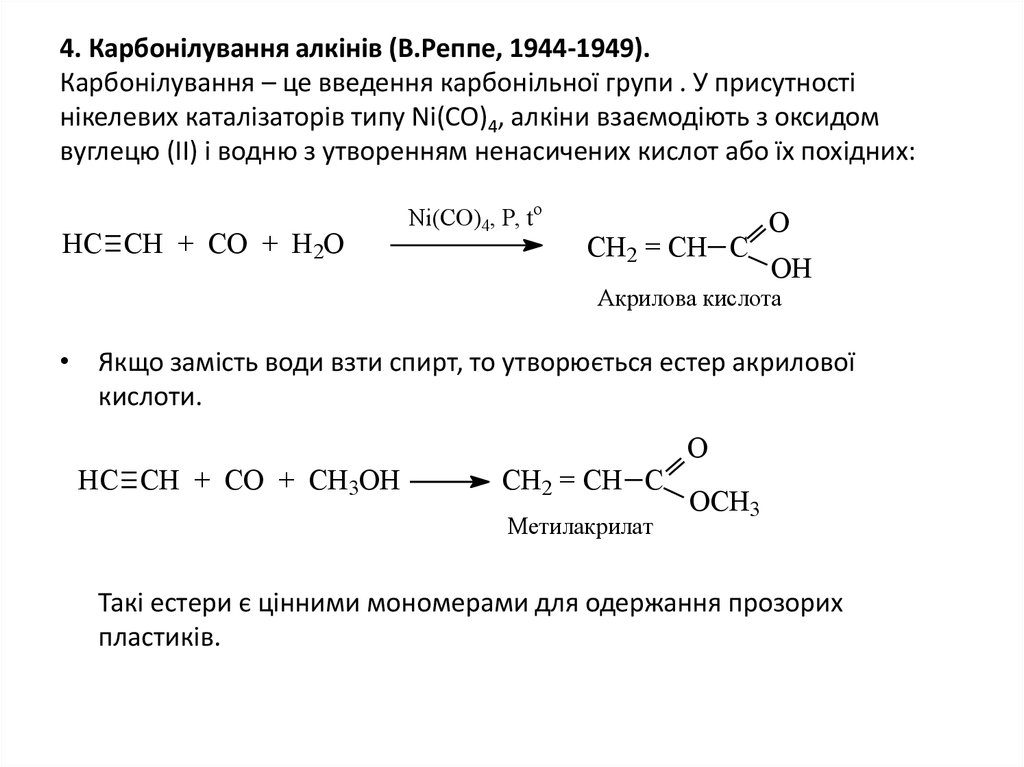
17. 4. Карбонілування алкінів (В.Реппе, 1944-1949). Карбонілування – це введення карбонільної групи . У присутності нікелевих
каталізаторів типу Ni(CO)4, алкіни взаємодіють з оксидомвуглецю (ІІ) і водню з утворенням ненасичених кислот або їх похідних:
HC CH + CO + H2O
Ni(CO)4, P, to
CH2 = CH C
О
ОН
Акрилова кислота
• Якщо замість води взти спирт, то утворюється естер акрилової
кислоти.
О
HC CH + CO + СH3OH
CH2 = CH C
Метилакрилат
ОСН3
Такі естери є цінними мономерами для одержання прозорих
пластиків.
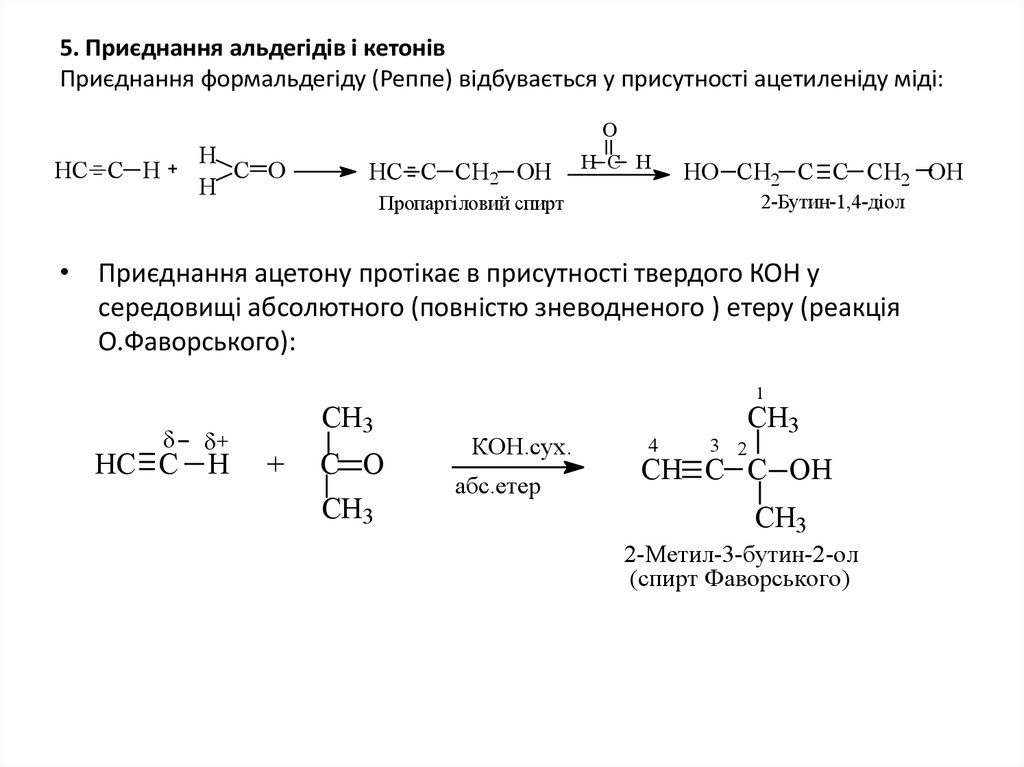
18. 5. Приєднання альдегідів і кетонів Приєднання формальдегіду (Реппе) відбувається у присутності ацетиленіду міді:
OН
С О
Н
HС С Н
НС С СH2 ОН
Н С Н
HO CH2 C C CH2 OH
2-Бутин-1,4-діол
Пропаргіловий спирт
• Приєднання ацетону протікає в присутності твердого КОН у
середовищі абсолютного (повністю зневодненого ) етеру (реакція
О.Фаворського):
НС С Н
СН3
+
С О
СН3
1
КОН.сух.
абс.етер
СН3
4
3 2
СН С C ОН
СН3
2-Метил-3-бутин-2-ол
(спирт Фаворського)
19. Реакції полімеризації
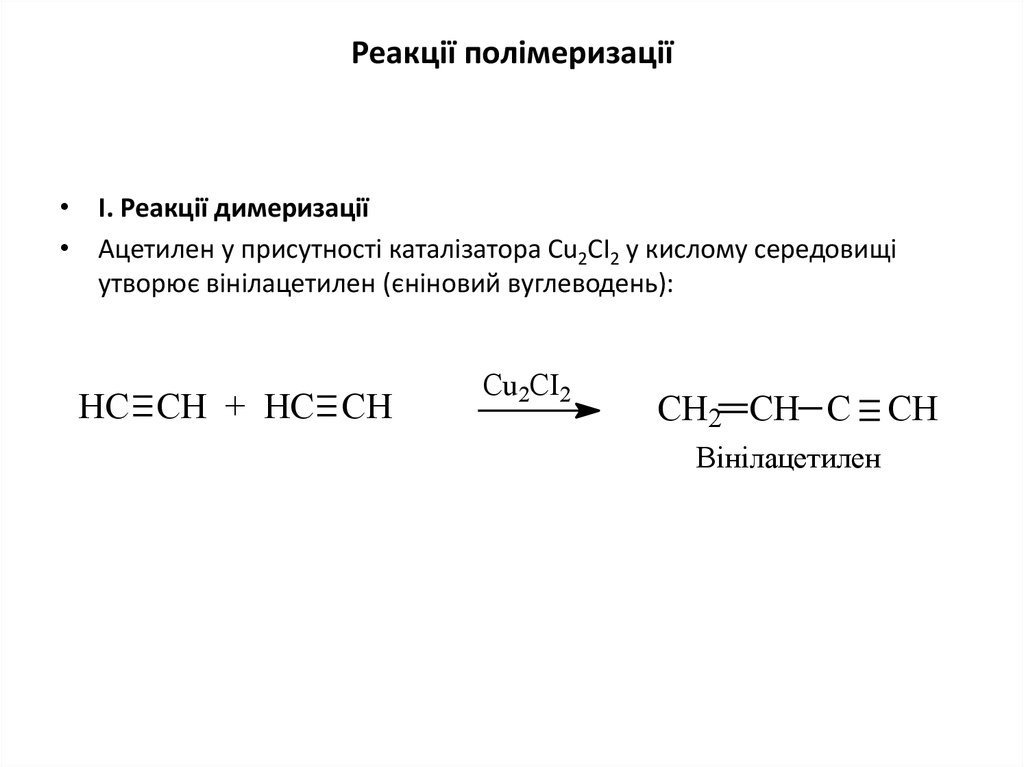
Реакції полімеризації• І. Реакції димеризації
• Ацетилен у присутності каталізатора Сu2СІ2 у кислому середовищі
утворює вінілацетилен (єніновий вуглеводень):
НС СН + НС СН
Cu2CІ2
СН2 СН С СН
Вінілацетилен
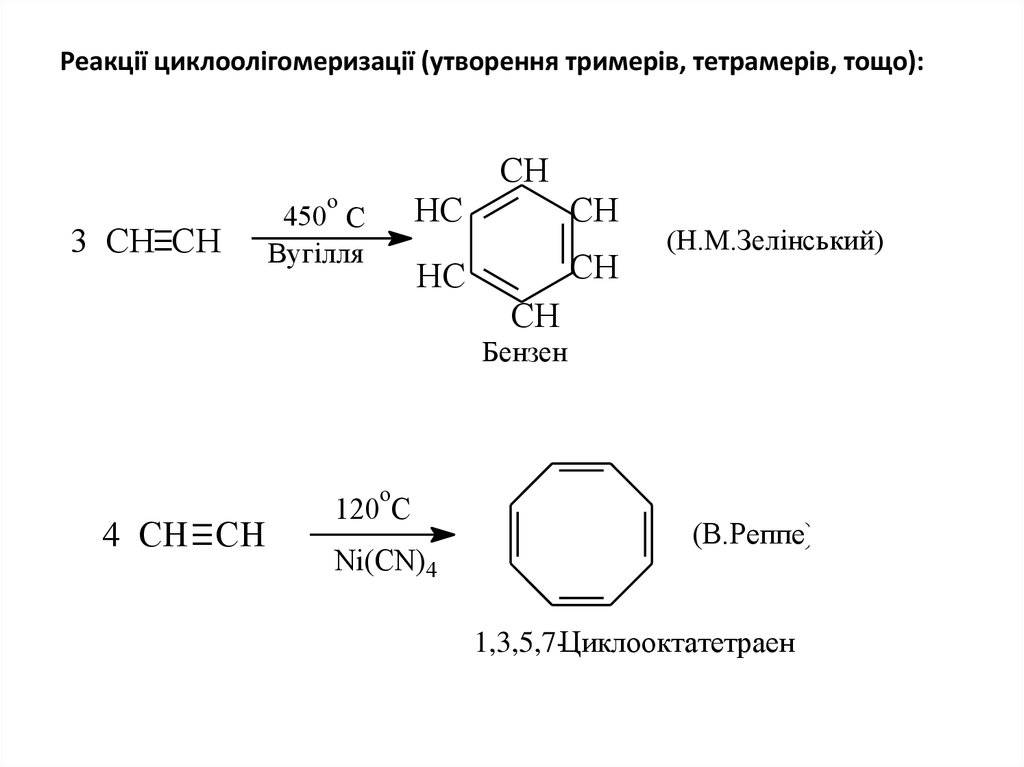
20. Реакції циклоолігомеризації (утворення тримерів, тетрамерів, тощо):
СНо
3 СН СН
450 С
Вугілля
НС
СН
НС
СН
(Н.М.Зелінський)
СН
Бензен
о
4 СН СН
120 С
Ni(CN)4
(В.Реппе)
1,3,5,7-Циклооктатетраен
21. 3. Полімеризація
• У присутності ініціаторів або металоорганічних каталізаторівутворюються спряжені полієни (від грецького поліс - багато).
Макромолекула (від грецького макрос - великий) полієну складається
практично тільки з вуглецевих атомів, з’єднаних між собою спряженими подвійними зв’язками:
Кат.
n СН СН
( СН СН )n
• Ацетилен полімеризується також у присутності солей Сu+ та
окиснювача:
+
n СН СН
Cu
[O]
H С С nН
Карбін
• Вважають, що карбін є третьою алотропною видозміною вуглецю
разом з алмазом та графітом. Причому, карбіну приписують ще і
кумуленову будову макромолекули ...С=С=С=С=С...
22. Окиснення алкінів
• Сильні окиснювачі (КMnO4, K2Cr2O7 у кислому середовищі, озон)окиснюють алкіни за аналогією до алкенів по потрійних зв’язках з їх
розщепленням і утворенням у кінцевому результаті карбонових
кислот:
O
[O]
2R C
R C C R
OH
• Реакції заміщення
• 1. Реакції металування алкінів (заміщення водню на метали) - SE
• Завдяки великій полярності зв’язку С—Н алкіни здатні реагувати з
багатьма металами (заміщення «кислого» водню на метал) з
утворенням ацетиленідів.
СН СН + 2 [Ag(NH3)2]OH
Ag C C Ag + 2H2O + 4NH3
Ацетиленід срібла












 chemistry
chemistry








