Similar presentations:
Вуглеводні. Лекція 11
1.
Лекція 11Вуглеводні.
План
1.Алкани. Хімічні властивості алканів.
2.Алкени. Хімічні властивості.
3.Алкіни. Хімічні властивості.
4.Ароматичні вуглеводні. Будова та хімічні
властивості.
5.Пожежна небезпека вуглеводів.
Галогенпохідні вуглеводнів, їх застосування у
пожежній справі
2.
Алкани (насичені вуглеводні). Хімічні властивостіалканів
Вуглеводні – це найпростіші органічні сполуки, їх
молекули містять лише атоми карбону та
гідрогену. Вуглеводні різняться кількістю атомів карбону, їх
гібридизацією, та послідовністю їх зв’язку.
Вуглеводні, що мають відкритий ланцюг і містять
тільки одинарні, прості зв’язки, звуться
насиченими вуглеводнями або парафінами, за
номенклатурою ІЮПАК – алканами( нормальними).
Найпростіший вуглеводень – метан (CH4).
Загальна формула алканів – CnH2n+2.
Якщо розмістити алкани нормальної будови в ряд, в
якому молекула кожного наступного алкану
збільшується на одну групу –СН2–, то отримаємо
ряд, що зветься гомологічним.
3.
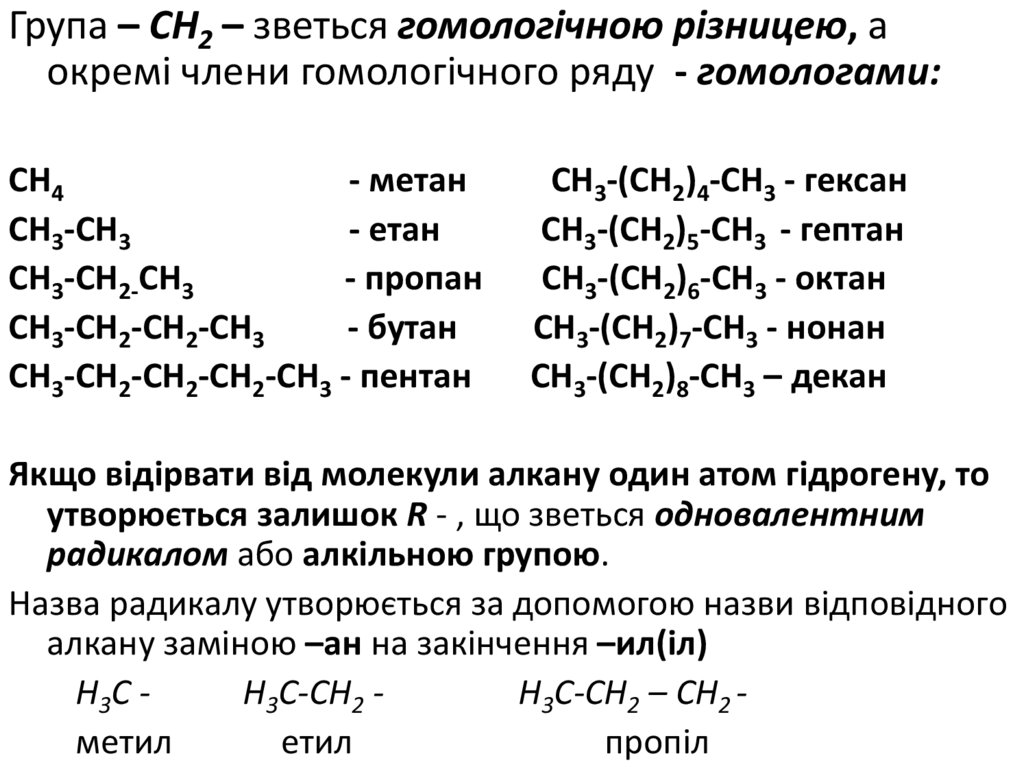
Група – СН2 – зветься гомологічною різницею, аокремі члени гомологічного ряду - гомологами:
СН4
- метан
СН3-СН3
- етан
СН3-СН2-СН3
- пропан
СН3-СН2-СН2-СН3
- бутан
СН3-СН2-СН2-СН2-СН3 - пентан
СН3-(СН2)4-СН3 - гексан
СН3-(СН2)5-СН3 - гептан
СН3-(СН2)6-СН3 - октан
СН3-(СН2)7-СН3 - нонан
СН3-(СН2)8-СН3 – декан
Якщо відірвати від молекули алкану один атом гідрогену, то
утворюється залишок R - , що зветься одновалентним
радикалом або алкільною групою.
Назва радикалу утворюється за допомогою назви відповідного
алкану заміною –ан на закінчення –ил(іл)
Н3С Н3С-СН2 Н3С-СН2 – СН2 метил
етил
пропіл
4.
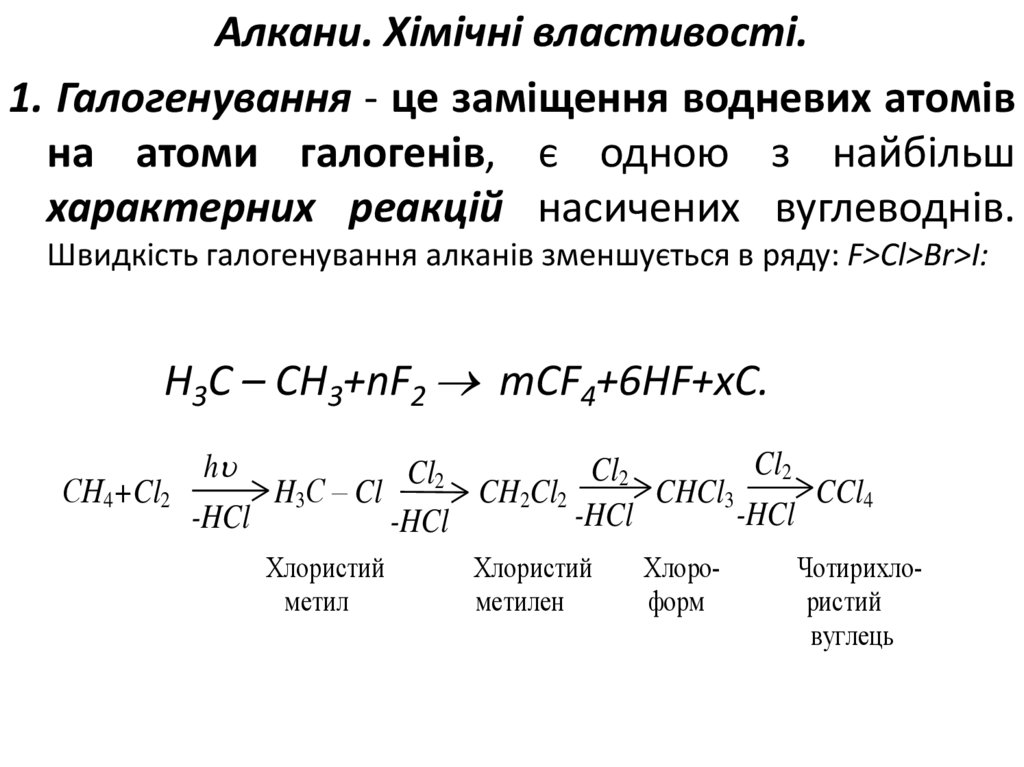
Алкани. Хімічні властивості.1. Галогенування - це заміщення водневих атомів
на атоми галогенів, є одною з найбільш
характерних реакцій насичених вуглеводнів.
Швидкість галогенування алканів зменшується в ряду: F>Cl>Br>I:
Н3С – СН3+nF2 mCF4+6НF+xC.
Cl2
h
Cl2
Cl2
СН4+Cl2
H3C – Cl
CH2Cl2
CHCl3
CCl4
-HCl
-HCl
-HCl
-HCl
Хлористий
метил
Хлористий
метилен
Хлороформ
Чотирихлористий
вуглець
5.
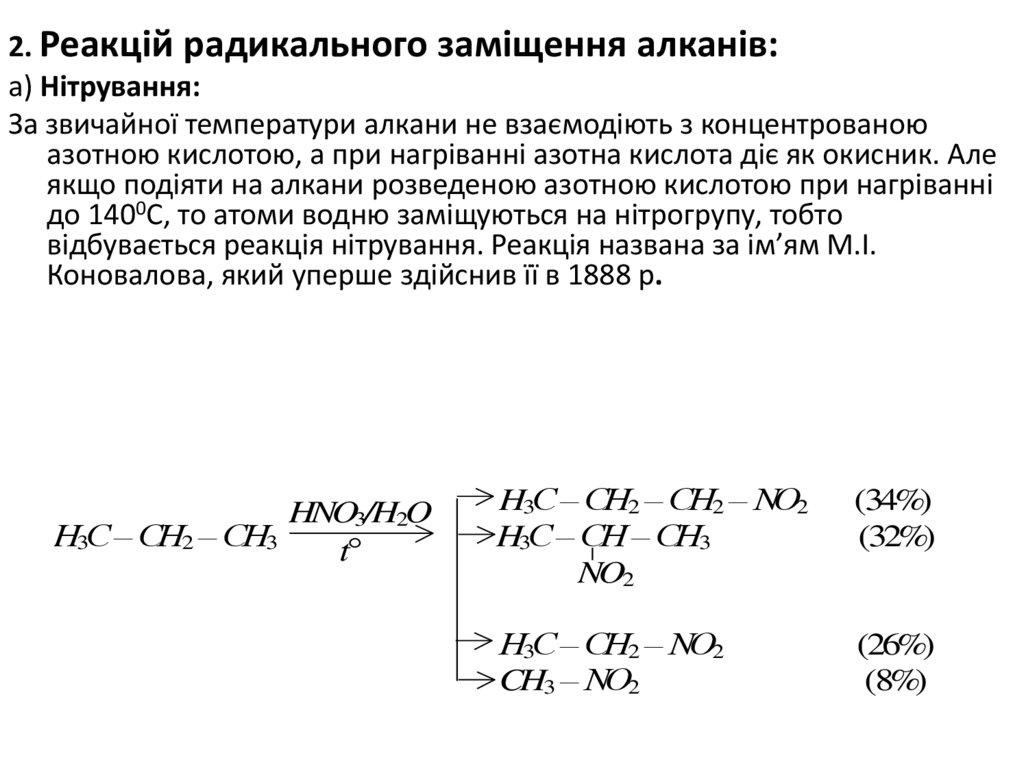
2. Реакцій радикального заміщення алканів:а) Нітрування:
За звичайної температури алкани не взаємодіють з концентрованою
азотною кислотою, а при нагріванні азотна кислота діє як окисник. Але
якщо подіяти на алкани розведеною азотною кислотою при нагріванні
до 1400С, то атоми водню заміщуються на нітрогрупу, тобто
відбувається реакція нітрування. Реакція названа за ім’ям М.І.
Коновалова, який уперше здійснив її в 1888 р.
HNO3/H2O
Н3С – СН2 – СН3
t
H3C – CH2 – CH2 – NO2
H3C – CH – CH3
NO2
(34%)
(32%)
Н3С – СН2 – NO2
CH3 – NO2
(26%)
(8%)
6.
а) Сульфоокисненняh
2 R – H + 2 SO2 + O2
2 R – SO3H
Алкансульфонова
кислота
в) Сульфохлорування
R – H + SO2 + Cl2 R – SO2 – Cl + HCl
Сульфохлорид
Реакція
сульфохлорування
має
широке
практичне
застосування. Алкансульфохлориди, що взаємодіють з лугами
або содою, легко утворюють солі сульфокислот, велику
кількість з яких (С12 – С18) використовують для виготовлення
синтетичних миючих засобів (СМЗ).
7.
3. Горіння:При горінні всіх вуглеводнів утворюються
диоксид вуглеводню і вода:
СnH2n+2 + O2 nCO2 + (n+1)H2О.
4. Алкани можна одержати також гідруванням
алканів і алкінів:
CnH2n
H2+Pt,Pd
CnH 2n+2
8.
Окремі представники алканів.Метан – (СН4) широко застосовується у промисловості як
паливо. При частковій оксидації метану або при
термічному розкладанні отримують сажу, яку
використовують як наповнювач при виробництві гуми:
СН4+О2 С+2Н2О,
1000 С
СН4
С+ 2Н2
Пропан – (С3Н8) використовують як паливо в місцях, де
немає метану, тому що під тиском пропан легко
зріджується й у цьому вигляді легко транспортується та
зберігається.
Бутани – використовують для добування ненасичених
вуглеводнів, з яких отримують різні полімерні
матеріали.
9.
Алкени. Хімічні властивостіНенасичені вуглеводні – це сполуки, що містять
подвійні або потрійні (кратні) карбон - карбонові
зв’язки.
Ненасичені сполуки з подвійним зв’язком загальної
формули CnH2n звуться алкенами або олефінами,
вони утворюють гомологічний ряд, подібний
гомологічному ряду алканів. За номенклатурою
ІUРАС назви алкенів утворюють заміною закінчення
-ан назви відповідного алкану на закінчення –ен,
наприклад,
пропан пропен.
Алкени ряду С2 – С4 за звичайних температур є газами;
починаючи з С5 – рідинами, а з С18 – твердими
речовинами.
10.
1. Приєднання водню до ненасичених сполукназивають гідруванням:
H2C = CH2 + H2
каталізатор
H3C – CH3 + 137 кДж.
2. Галогенірування (Реакційна здатність галогенів різко
зменшується в ряду F2>Cl2>Br2>І2 ):
Н2С = СН2 + Сl2 –– Сl - СН2 - СН2 - Сl.
H2C = CH2
Br - Br
H2C – CH2.
Br Br
3. Реакція з галогеноводнямі (X = Cl, Br, I, F):
R – CH = CH – R + HX R – CH2 – CH – R,
X
11.
4. Алкени легко окиснюються водним розчиномперманганату калію (Реакція Вагнера ):
R – CH = CH – R
KМnO4
H2O
R – CH – CH – R.
OH OH
5. При горінні алкенів також як і алканів утворюється
вуглекислий газ і вода.
(У алкенів, подібно до алканів, зі збільшенням числа атомів карбону знижуються
температура самозаймання, верхня та нижня межі розповсюдження полум’я. )
6. Характерною особливістю багатьох ненасичених сполук
є їх здатність вступати в реакцію полімеризації і
утворювати полімери:
nH2C = CH (-H2C – CH-)n,
R
R
12.
Окремі представники алкенівЕтилен (етен) – (СН2 = СН2) – безбарвний газ, у
промисловості його добувають з газів піролізу й
крекінгу нафти, використовують у виробництві
полімерів, розчинників, антифризів.
Пропілен (пропен) – (СН2 =СН - СН3), його також
виділяють з промислових газів і використовують,
головним чином, у виробництві поліпропілену,
ацетону, синтетичного каучуку, фенолу, гліцерину і
т.д.
Бутени – С4Н8, утворюються в процесі піролізу й
крекінгу продуктів переробки нафти. Бутени
нормальної будови перетворюють на дивініл
(бутадієн – 1,3), ізобутилен використовують для
виробництва ізопрену (мономера ізопренового
каучуку) та високо-октанового палива.
13.
Алкіни. Хімічні властивостіАлкіни – це вуглеводні, що містять потрійний
зв’язок С С і мають загальну формулу CnH2n-2.
Алкіни утворюють гомологічний ряд, який
починається з ацетиену.
За номенклатурою ІUРАС назви алкінів
утворюються заміною в назві відповідного
алкану суфіксу – ан на суфікс –ин(ін).
14.
1.Реакції приєднанняПриєднання відбувається в дві стадії. Спочатку утворюються сполуки
етиленового ряду, а потім насичені вуглеводні або їх похідні.
а)Гідрування:
H2
R–C C–R
Ni
H2
R–C=C–R
Ni
R – CH2 – CH2 – R.
б)Приєднання гідрогалогенів:
+
-
H3C C CH + H+Cl H3C – C = CH2
Пропін
Cl
HCl
2-хлорпропен
Cl
H3C – C – CH3
Cl
2,2-дихлорпропан
в) Галогенування(за правилом Марковникова):
R
R
R – C C – R + Br2 C=C
Br
Br
Br
R
+
C=C
R
Br.
15.
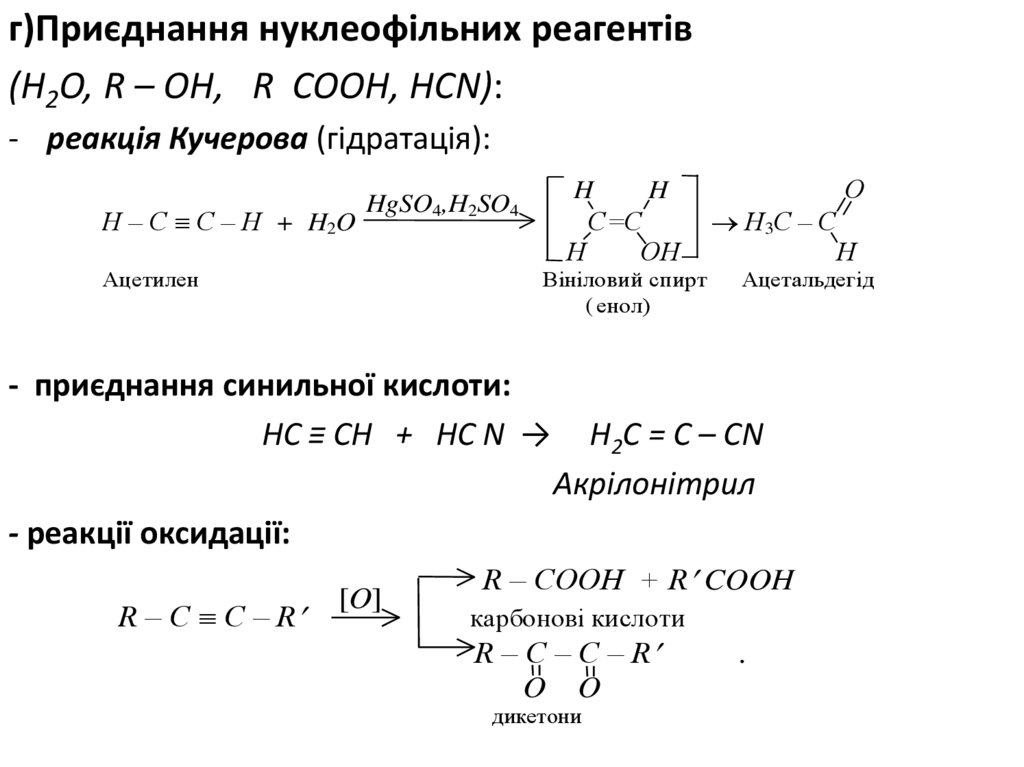
г)Приєднання нуклеофільних реагентів(Н2О, R – ОН, R СООН, НСN):
- реакція Кучерова (гідратація):
H – C C – H + H2O
H
H
С=С
Н
ОН
HgSO4,H2SO4
Ацетилен
Вініловий спирт
( енол)
- приєднання синильної кислоти:
НС ≡ СН + НС N →
О
Н3С – С
Ацетальдегід
H2C = C – CN
Акрілонітрил
- реакції оксидації:
R – C C – R
[O]
R – COOH + R COOH
карбонові кислоти
R – C – C – R
O O
дикетони
Н
.
16.
2. Реакції заміщення:а) утворення ацетиленідів:
Na+NH2-
R – C CH
R – C C – Na +
CH3MgCl
R – C C – MgCl
+
Na OH
R – C C – Na +
+
[Ag (NH3)2ОН
R – C C – Ag +
NH3
+ CH4
H2O
2NH3
б) галогенування:
R – C CH + Cl2
NaOH
R – C C – Cl + NaCl + H2O.
17.
3. Полімеризація:Каталітичним окисенням поступово отримують бутадиин –
2,3 і т.д. аж до карбіну:
НC СН+НС ≡ СН → НС С – С ≡ СН → …[-C C – C C -]n
Бутадиин-1,3
Карбін
Застосування алканів.
З алкінів велике промислове значення має тільки ацетилен,
який є сировиною для виробництва багатьох органічних
сполук. Основні напрямки промислового використання
ацетилену спрямовані на здобуття полімерних матеріалів.
Алкіни – термодинамічно нестійкі сполуки, які за деяких
умов можуть самочинно вибухати.
При контакті з бромом, хлором і фтором ацетилен
самозаймається. При горінні ацетилену та його гомологів
утворюється кіптява, а полум’я сильно світиться
18.
Ароматичні вуглеводніТермін “ароматичні сполуки” виник ще на початку
розвитку органічної хімії, коли органічні речовини
поділяли на аліфатичні (жирні) й ароматичні (що мають
запах).
До ароматичних сполук відносять бензен та інші сполуки,
що подібні до нього за хімічними властивостями. Такі
хімічні властивості мають назву ароматичних .
Бензен – це перший член гомологічного ряду
ароматичних вуглеводнів.
Ароматичні вуглеводні називають за систематичною
номенклатурою як заміщені бензену.
19.
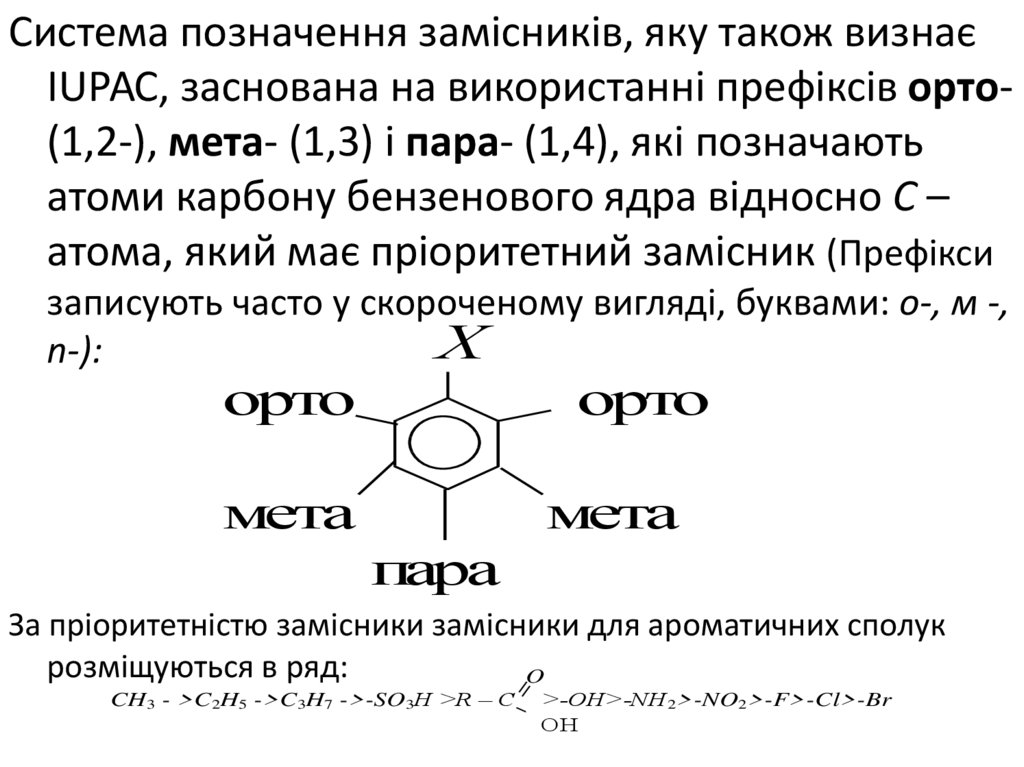
Система позначення замісників, яку також визнаєІUРАС, заснована на використанні префіксів орто(1,2-), мета- (1,3) і пара- (1,4), які позначають
атоми карбону бензенового ядра відносно С –
атома, який має пріоритетний замісник (Префікси
записують часто у скороченому вигляді, буквами: о-, м -,
Х
n-):
орто
орто
мета
мета
пара
За пріоритетністю замісники замісники для ароматичних сполук
розміщуються в ряд:
O
CH3 - >C2H5 ->C3H7 ->-SO3H >R – C
>-OH>-NH2>-NO2>-F>-Cl>-Br
ОН
20.
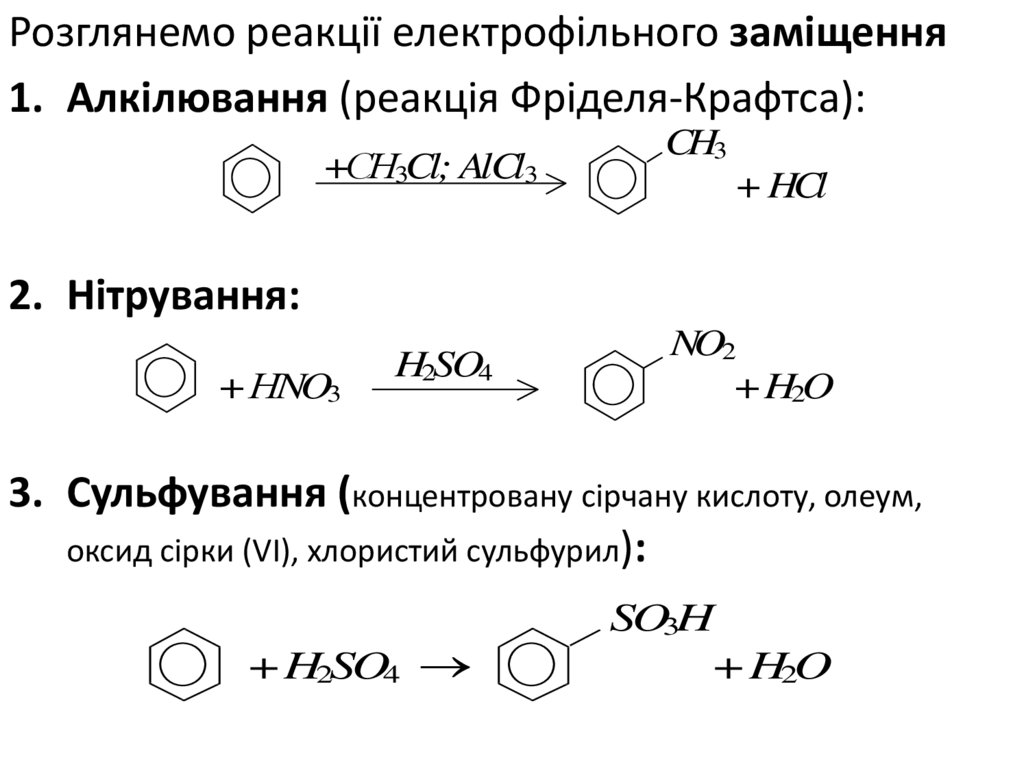
Розглянемо реакції електрофільного заміщення1. Алкілювання (реакція Фріделя-Крафтса):
+СН3Cl; AlCl3
CH3
+ HCl
2. Нітрування:
+ НNO3
H2SO4
NO2
+ H2O
3. Сульфування (концентровану сірчану кислоту, олеум,
оксид сірки (VI), хлористий сульфурил):
+ H2SO4
SO3H
+ H2O
21.
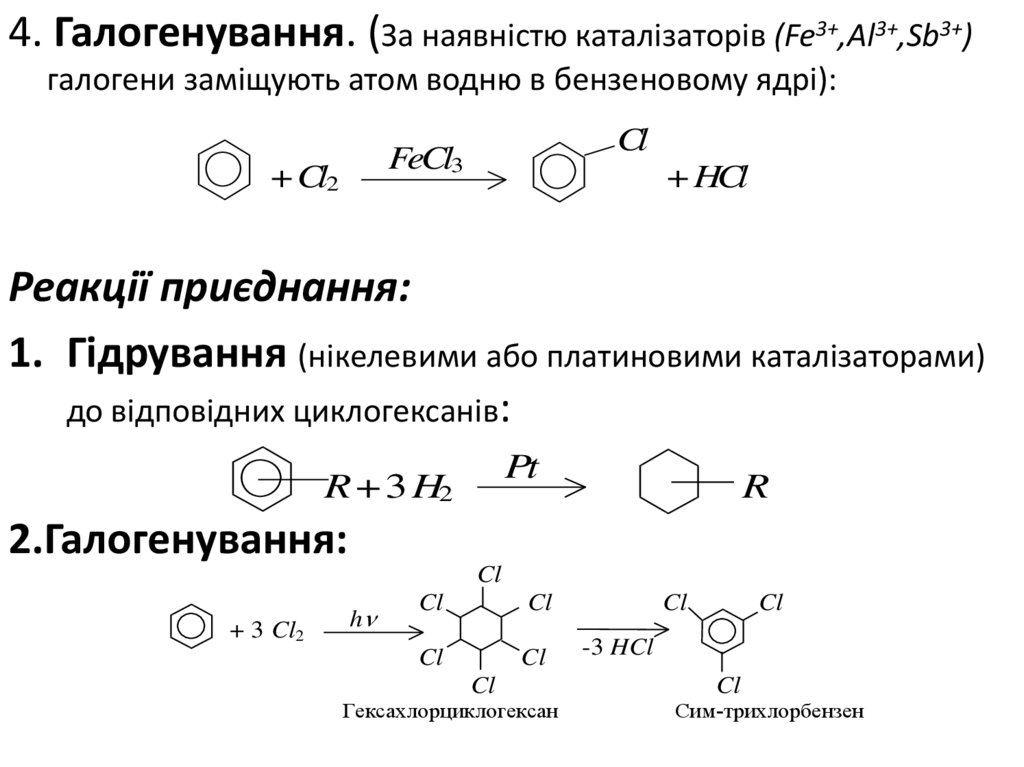
4. Галогенування. (За наявністю каталізаторів (Fe3+,Al3+,Sb3+)галогени заміщують атом водню в бензеновому ядрі):
Cl
FeCl3
+ Cl2
+ HCl
Реакції приєднання:
1. Гідрування (нікелевими або платиновими каталізаторами)
до відповідних циклогексанів:
Pt
R + 3 H2
R
2.Галогенування:
Cl
+ 3 Cl2
h
Cl
Cl
Cl
Cl
Cl
Гексахлорциклогексан
Cl
Cl
-3 HCl
Cl
Сим-трихлорбензен
22.
3. ГорінняАроматичні сполуки мають більші температури самозаймання, ніж
насичені і ненасичені вуглеводні. Внаслідок великого вмісту карбону,
бензол та його гомологи горять сильно кіптявим яскравим полум’ям:
15
+ О2 6 СО2
2
+ 3 Н2О
Галогеновуглеводні – це найпростіші похідні вуглеводнів, в яких один
або кілька атомів водню заміщені на галогени.
Застосування галогенпохідних у пожежній справі
Деякі галогенпохідні вуглеводнів є ефективними інгібіторами горіння. Вже
за наявності у повітрі декількох процентів (або частки процента)
фреонів (хладонів) припиняється процес горіння більшості речовин в
газовій фазі. Але такі речовини у своїй більшості руйнують озоновий
шар атмосфери і тому заборонені до використання.















 chemistry
chemistry








