Similar presentations:
Ароматичні вуглеводні
1.
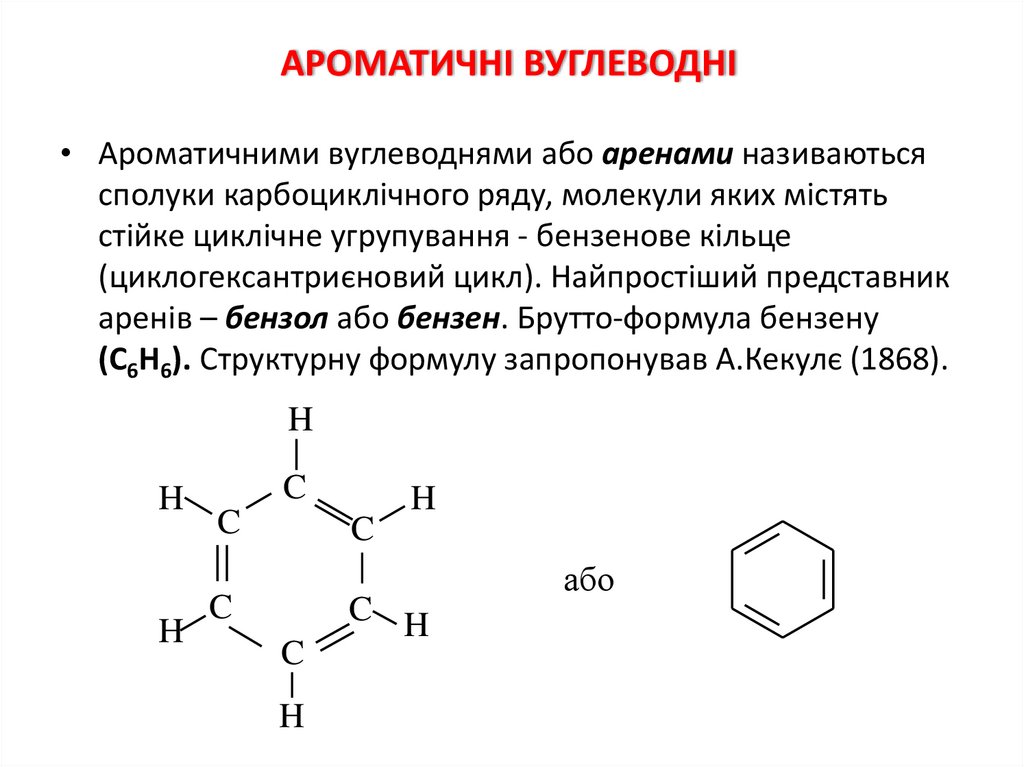
АРОМАТИЧНІ ВУГЛЕВОДНІ• Ароматичними вуглеводнями або аренами називаються
сполуки карбоциклічного ряду, молекули яких містять
стійке циклічне угрупування - бензенове кільце
(циклогексантриєновий цикл). Найпростіший представник
аренів – бензол або бензен. Брутто-формула бензену
(С6Н6). Структурну формулу запропонував А.Кекулє (1868).
H
H
H
C
C
C
C
C
H
H
C H
або
2.
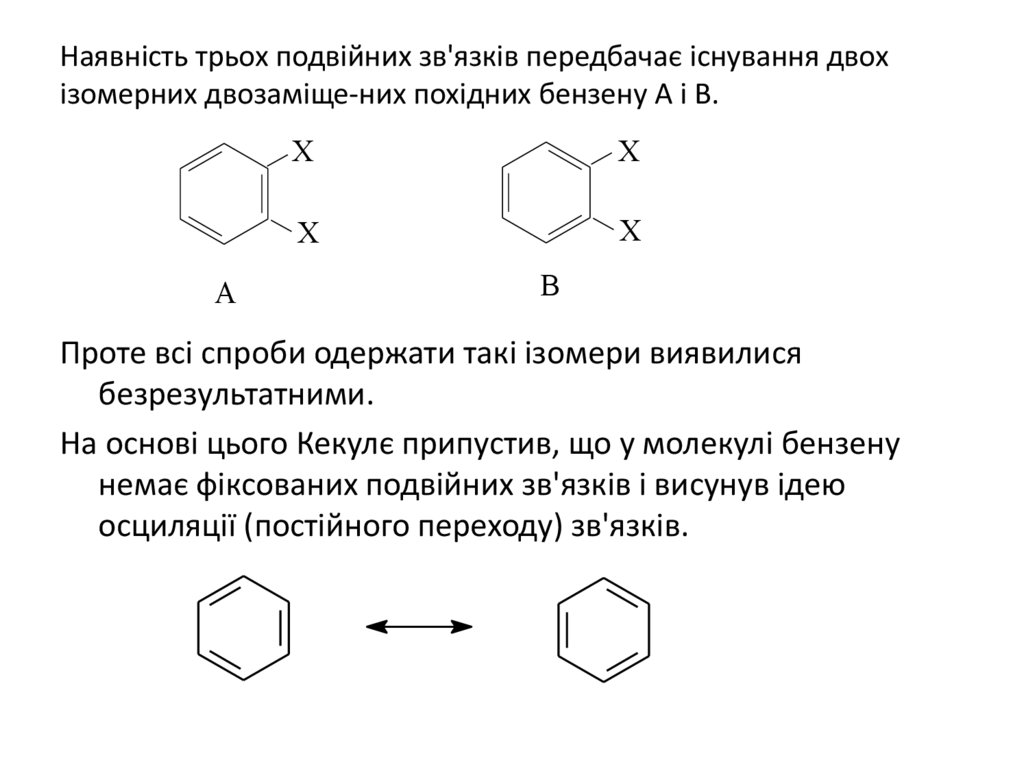
Наявність трьох подвійних зв'язків передбачає існування двохізомерних двозаміще-них похідних бензену А і В.
A
X
X
X
X
B
Проте всі спроби одержати такі ізомери виявилися
безрезультатними.
На основі цього Кекулє припустив, що у молекулі бензену
немає фіксованих подвійних зв'язків і висунув ідею
осциляції (постійного переходу) зв'язків.
3.
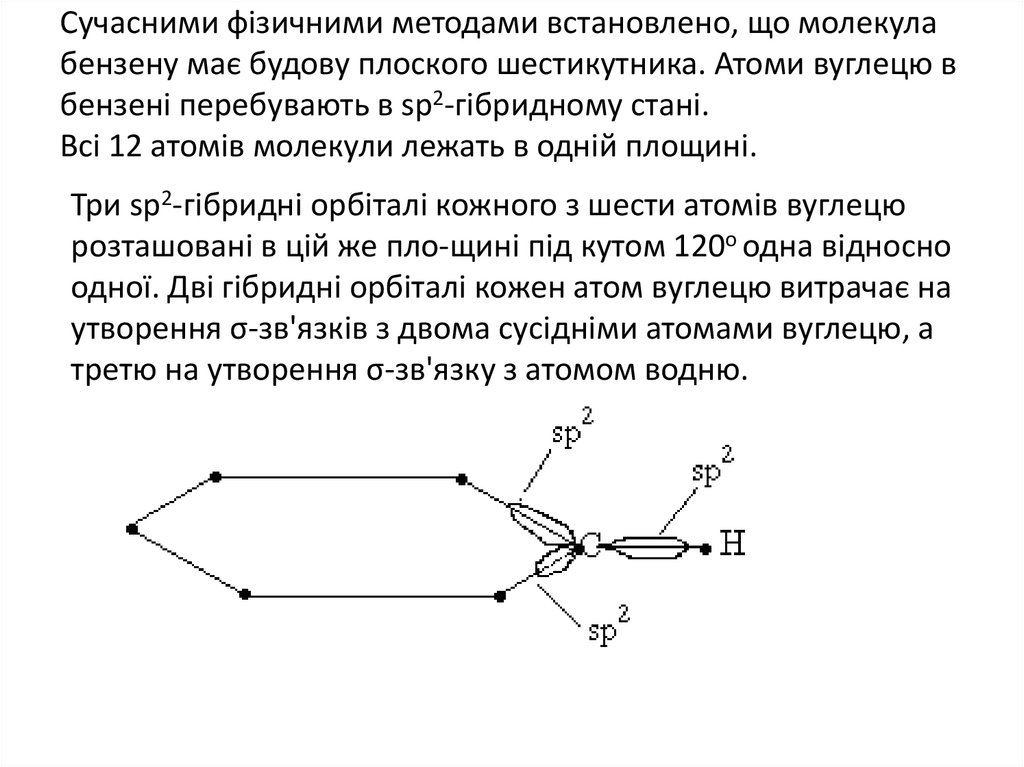
Сучасними фізичними методами встановлено, що молекулабензену має будову плоского шестикутника. Атоми вуглецю в
бензені перебувають в sp2-гібридному стані.
Всі 12 атомів молекули лежать в одній площині.
Три sp2-гібридні орбіталі кожного з шести атомів вуглецю
розташовані в цій же пло-щині під кутом 120о одна відносно
одної. Дві гібридні орбіталі кожен атом вуглецю витрачає на
утворення σ-зв'язків з двома сусідніми атомами вуглецю, а
третю на утворення σ-зв'язку з атомом водню.
4.
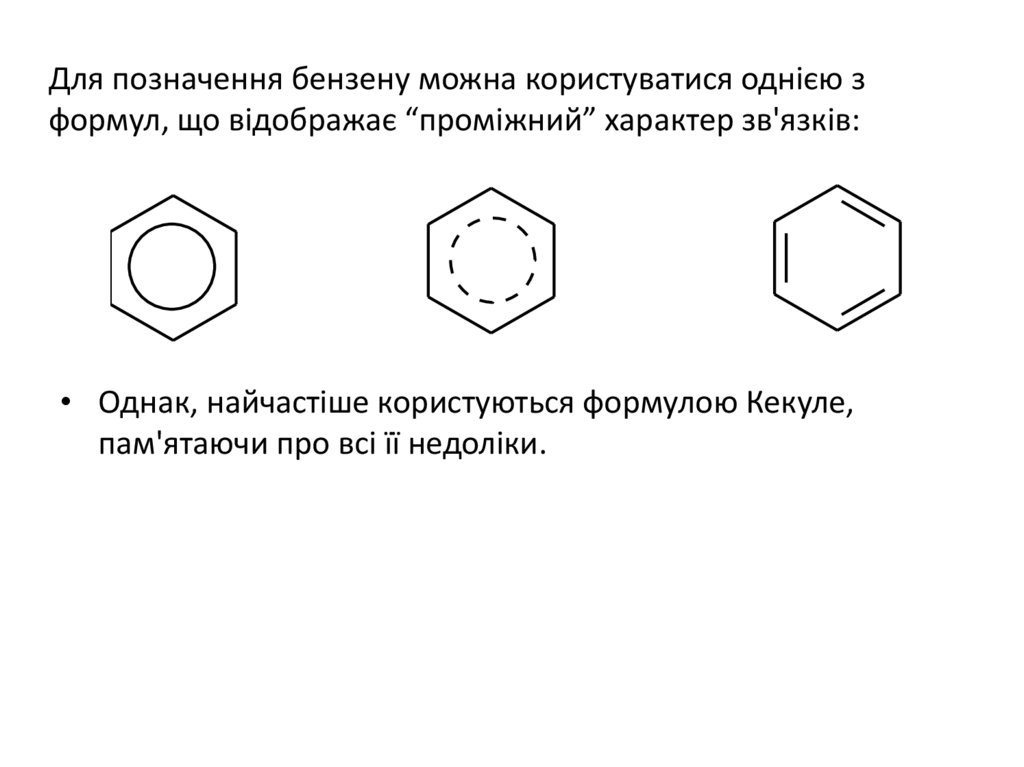
Для позначення бензену можна користуватися однією зформул, що відображає “проміжний” характер зв'язків:
• Однак, найчастіше користуються формулою Кекуле,
пам'ятаючи про всі її недоліки.
5.
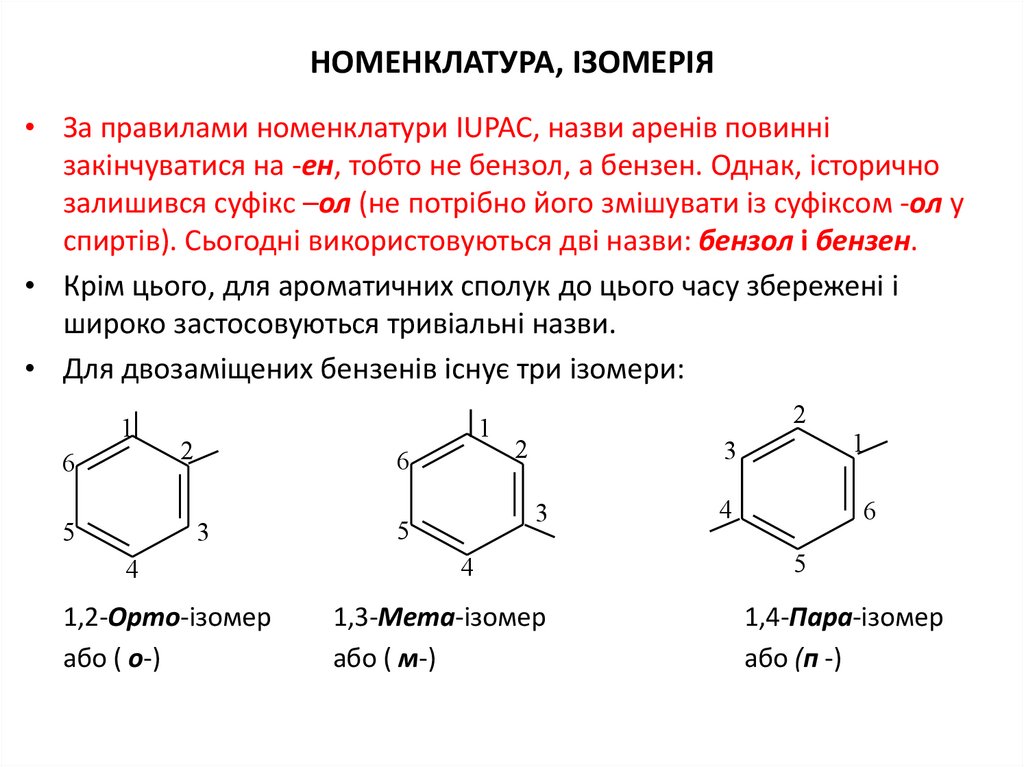
НОМЕНКЛАТУРА, ІЗОМЕРІЯ• За правилами номенклатури IUPAC, назви аренів повинні
закінчуватися на -ен, тобто не бензол, а бензен. Однак, історично
залишився суфікс –ол (не потрібно його змішувати із суфіксом -ол у
спиртів). Сьогодні використовуються дві назви: бензол і бензен.
• Крім цього, для ароматичних сполук до цього часу збережені і
широко застосовуються тривіальні назви.
• Для двозаміщених бензенів існує три ізомери:
1
6
5
1
2
6
3
4
1,2-Орто-ізомер
або ( о-)
2
2
3
5
4
1,3-Мета-ізомер
або ( м-)
3
1
4
6
5
1,4-Пара-ізомер
або (п -)
6.
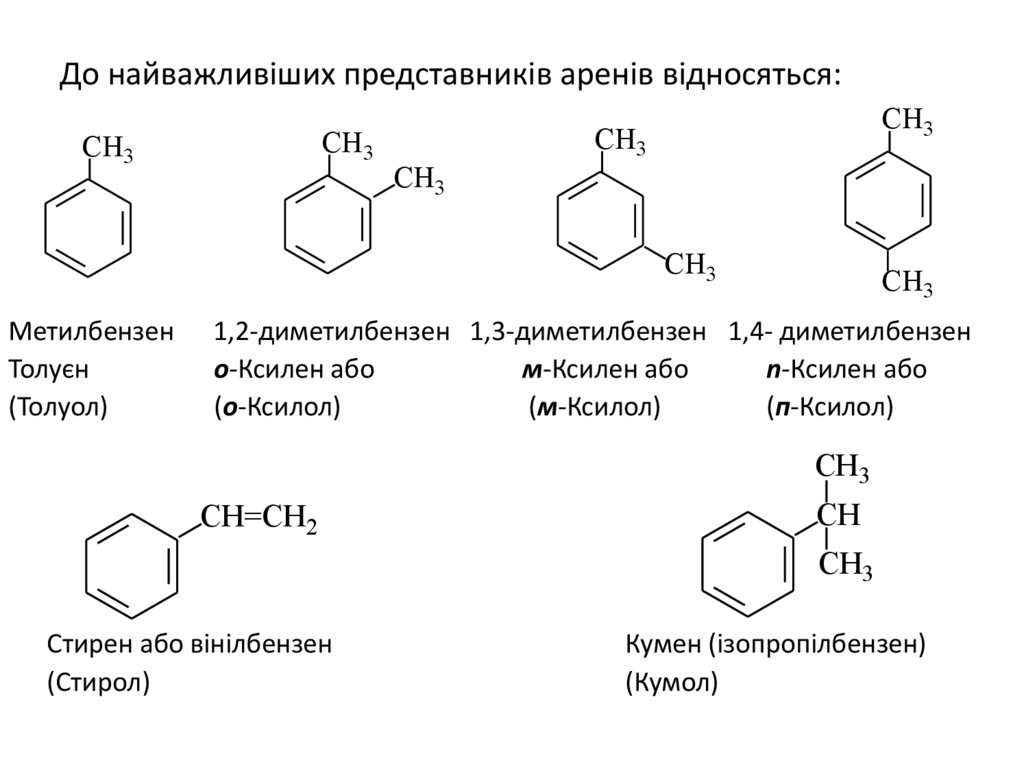
До найважливіших представників аренів відносяться:CH3
CH3
CH3
CH3
CH3
CH3
Метилбензен
Толуєн
(Толуол)
CH3
1,2-диметилбензен 1,3-диметилбензен 1,4- диметилбензен
о-Ксилен або
м-Ксилен або
n-Ксилен або
(о-Ксилол)
(м-Ксилол)
(п-Ксилол)
CH3
CH=CH2
CH
CH3
Стирен або вінілбензен
(Стирол)
Кумен (ізопропілбензен)
(Кумол)
7.
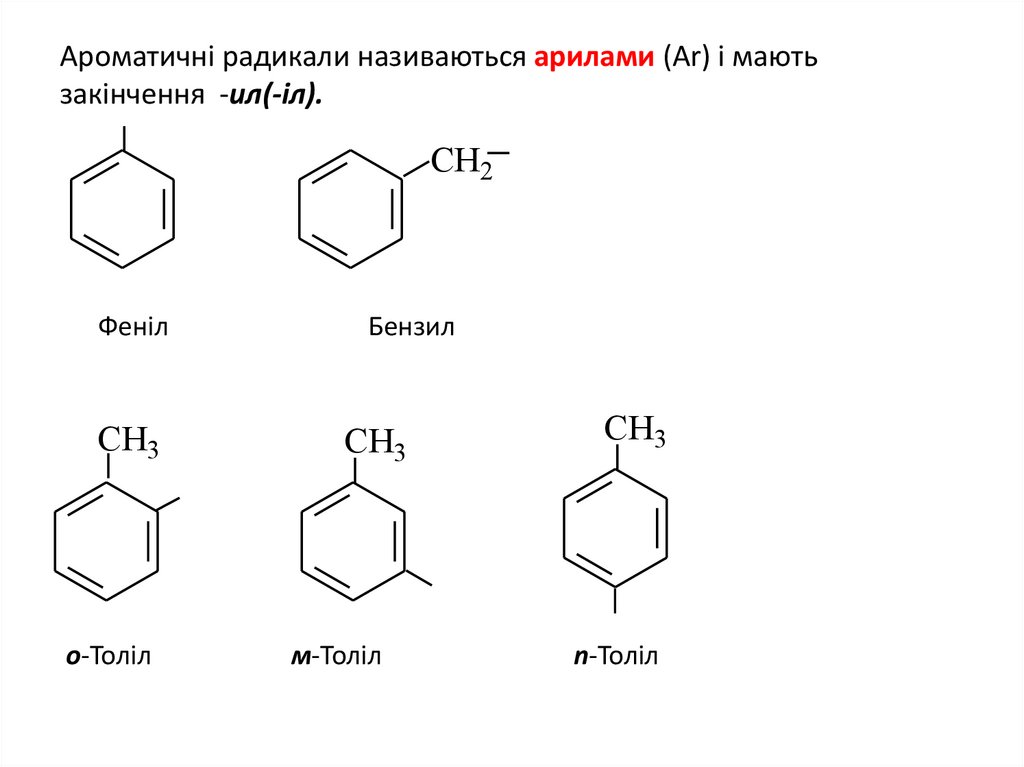
Ароматичні радикали називаються арилами (Ar) і маютьзакінчення -ил(-іл).
CH2
Феніл
CH3
о-Толіл
Бензил
CH3
м-Толіл
CH3
n-Толіл
8.
СПОСОБИ ДОБУВАННЯ• 1. Промислові методи одержання
• 1.1. Коксування кам'яного вугілля
При нагріваанні кам'яного вугілля до 900-1300о без доступу
повітря, утворю-ються такі продукти: кокс, коксовий газ,
кам'яновугільна смола і аміачна вода. В 1 м3 коксового газу
міститься приблизно 30 г бензену і 10 г толуєну. У смолі крім
бензену і толуєну містяться ксилени, феноли, поліциклічні
арени і гетероциклічні сполуки (всього понад 100 компонен-тів
), які за необхідністю вилучають.
• 1.2. Перегонка нафти
Арени можуть бути виділені шляхом розгонки з деяких сортів
нафти (ароматичної), а також шляхом піролізу, каталітичного
крекінгу і риформінгу. Крім того, можлива дегідрогенізація
аліциклічних сполук, виділених з нафти (зворотній каталіз
Зелінського).
9.
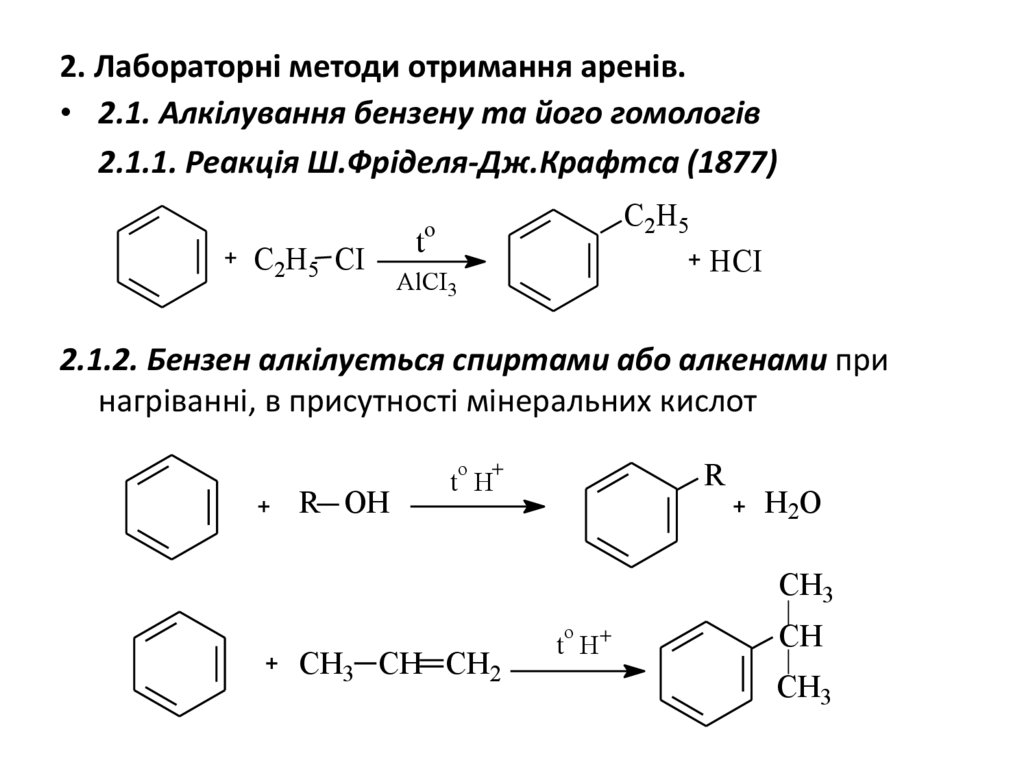
2. Лабораторні методи отримання аренів.• 2.1. Алкілування бензену та його гомологів
2.1.1. Реакція Ш.Фріделя-Дж.Крафтса (1877)
C2H5
o
С2Н5 СІ
t
HCI
AlCI3
2.1.2. Бензен алкілується спиртами або алкенами при
нагріванні, в присутності мінеральних кислот
R
o
R OH
t H
H2O
CH3
o
CH3 CH CH2
t H
CH
CH3
10.
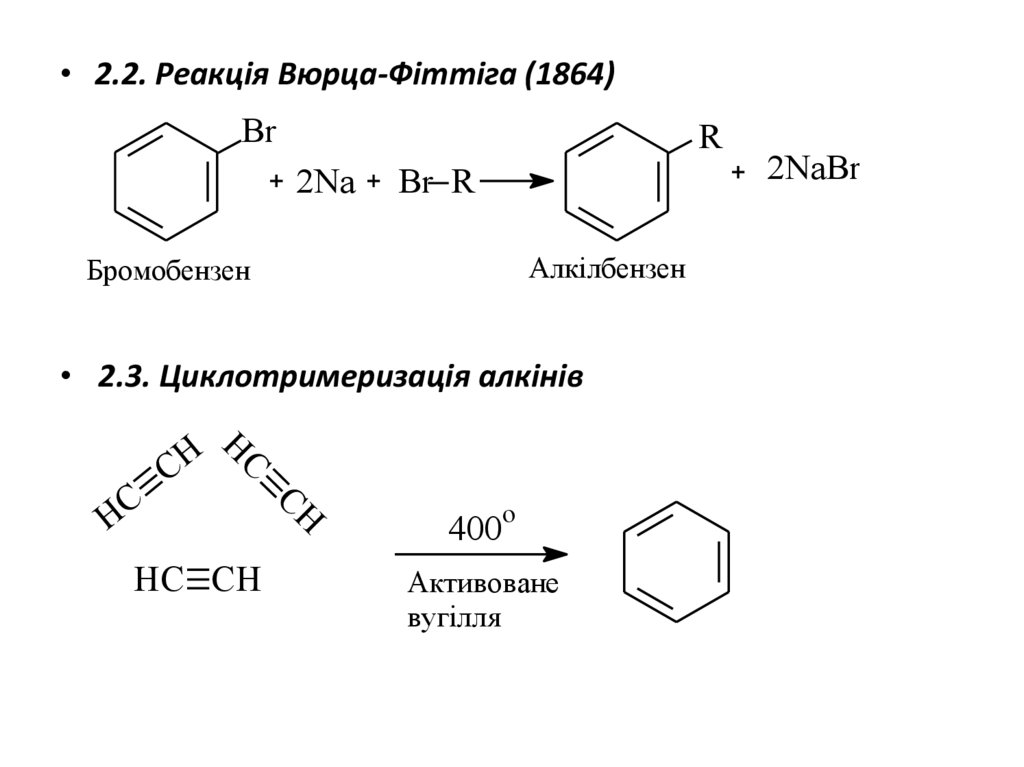
• 2.2. Реакція Вюрца-Фіттіга (1864)Br
R
2Na
Br R
Алкілбензен
Бромобензен
• 2.3. Циклотримеризація алкінів
H
HC
CH C
HC CH
CH
400o
Активоване
вугілля
2NaBr
11.
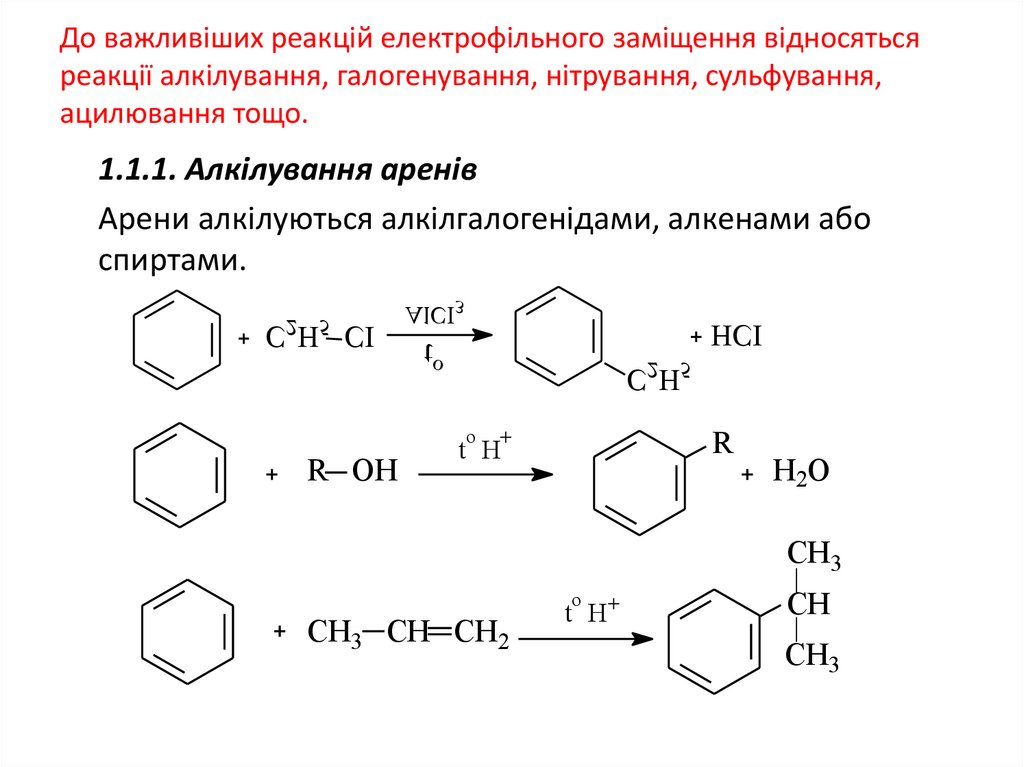
До важливіших реакцій електрофільного заміщення відносятьсяреакції алкілування, галогенування, нітрування, сульфування,
ацилювання тощо.
1.1.1. Алкілування аренів
Арени алкілуються алкілгалогенідами, алкенами або
спиртами.
С2Н5 СІ
AlCI3
HCI
to
C2H5
R
o
R OH
t H
H2O
CH3
o
CH3 CH CH2
t H
CH
CH3
12.
1.1.2. Галогенування аренівCI2
АlCI3
CI
HCI
Хлоробензен
1.1.3. Нітрування аренів
На відміну від алканів, арени не взаємодіють з розведеною
нітратною кислотою. Бензен нітрується концентрованою
нітратною кислотою або нітруючою сумішшю (суміш конц.
HNO3 i H2SO4).
HNO3
(конц.)
H2SO4
NO2
H2O
Нітробензен
13.
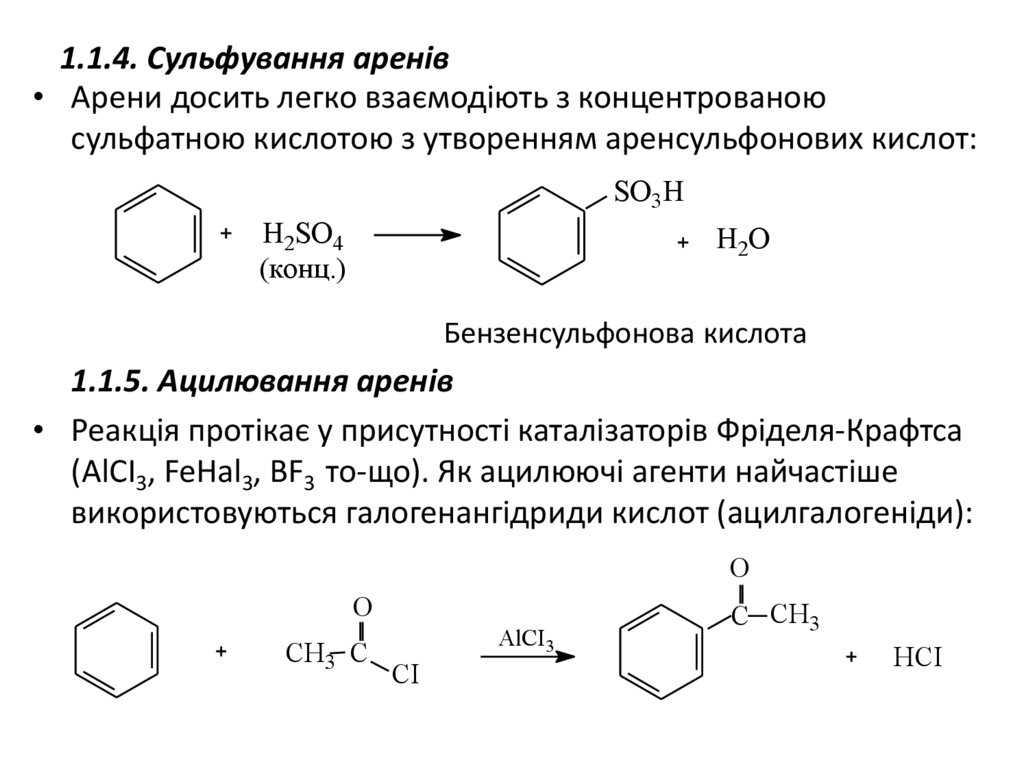
1.1.4. Сульфування аренів• Арени досить легко взаємодіють з концентрованою
сульфатною кислотою з утворенням аренсульфонових кислот:
SO3Н
H2SO4
(конц.)
H2O
Бензенсульфонова кислота
1.1.5. Ацилювання аренів
• Реакція протікає у присутності каталізаторів Фріделя-Крафтса
(AlCI3, FeHal3, BF3 то-що). Як ацилюючі агенти найчастіше
використовуються галогенангідриди кислот (ацилгалогеніди):
O
O
СH3 C
AlCI3
СІ
С CH3
HCI
14.
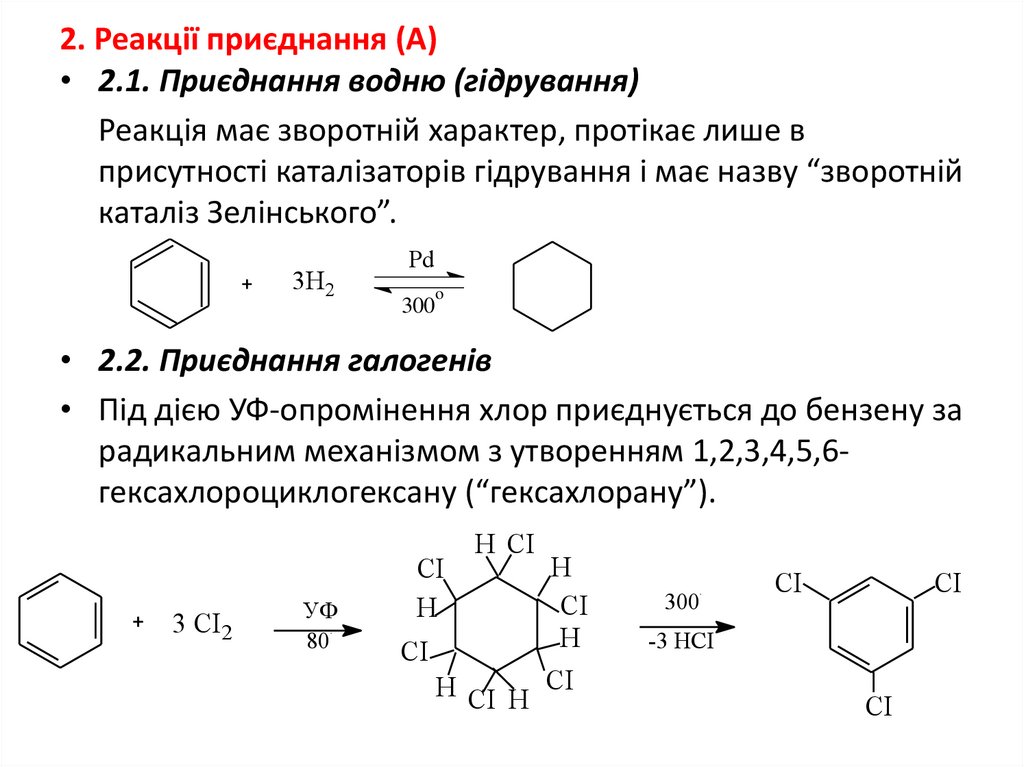
2. Реакції приєднання (А)• 2.1. Приєднання водню (гідрування)
Реакція має зворотній характер, протікає лише в
присутності каталізаторів гідрування і має назву “зворотній
каталіз Зелінського”.
3Н2
Pd
o
300
• 2.2. Приєднання галогенів
• Під дією УФ-опромінення хлор приєднується до бензену за
радикальним механізмом з утворенням 1,2,3,4,5,6гексахлороциклогексану (“гексахлорану”).
3 СІ2
УФ
80
СІ
Н
Н СІ
о
СІ
Н СІ Н
Н
СІ
Н
СІ
300
о
СІ
СІ
-3 НСІ
СІ
15.
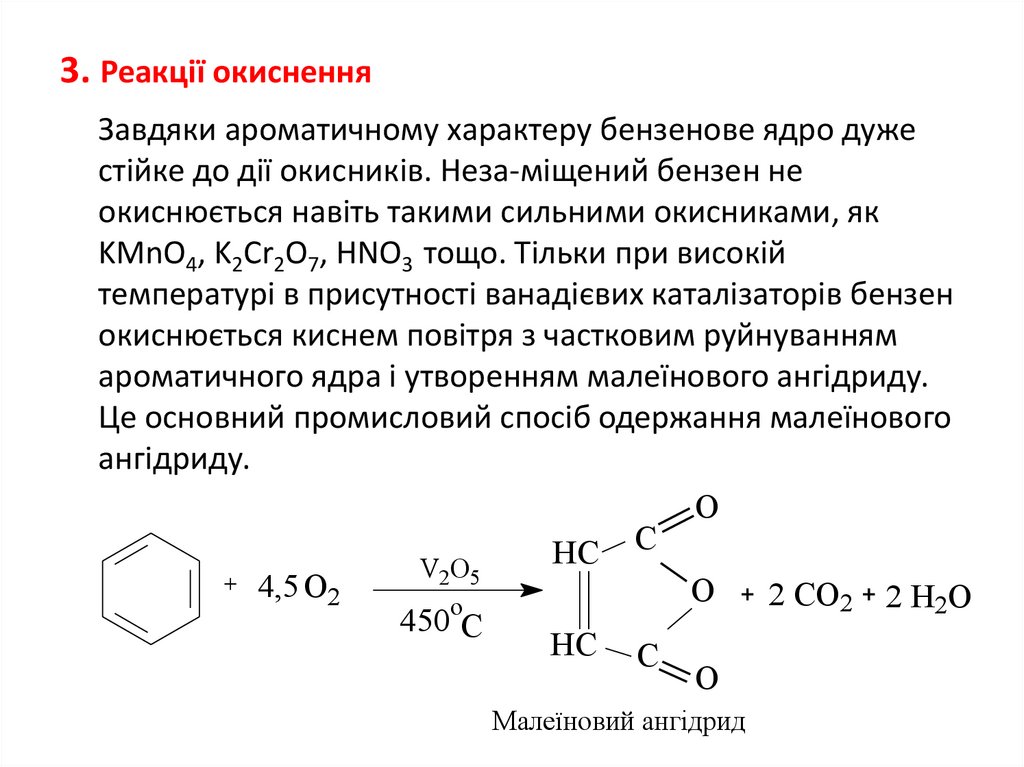
3. Реакції окисненняЗавдяки ароматичному характеру бензенове ядро дуже
стійке до дії окисників. Неза-міщений бензен не
окиснюється навіть такими сильними окисниками, як
KMnO4, K2Cr2O7, HNO3 тощо. Тільки при високій
температурі в присутності ванадієвих каталізаторів бензен
окиснюється киснем повітря з частковим руйнуванням
ароматичного ядра і утворенням малеїнового ангідриду.
Це основний промисловий спосіб одержання малеїнового
ангідриду.
О
C
НС
V2O5
4,5 О2
О
2 СО2 2 Н2О
o
450 С
НС C
О
Малеїновий ангідрид
16.
Але, якщо в бензеновому ядрі є алкільні радикали, то вониокиснюються доволі легко, причому незалежно від природи
алкільного радикала, кінцевим продуктом окиснення завжди є
бензойна кислота:
О
СН3
C OH
KMnO4
Бензойна
кислота
О
R
K2Cr2O7
C OH
17.
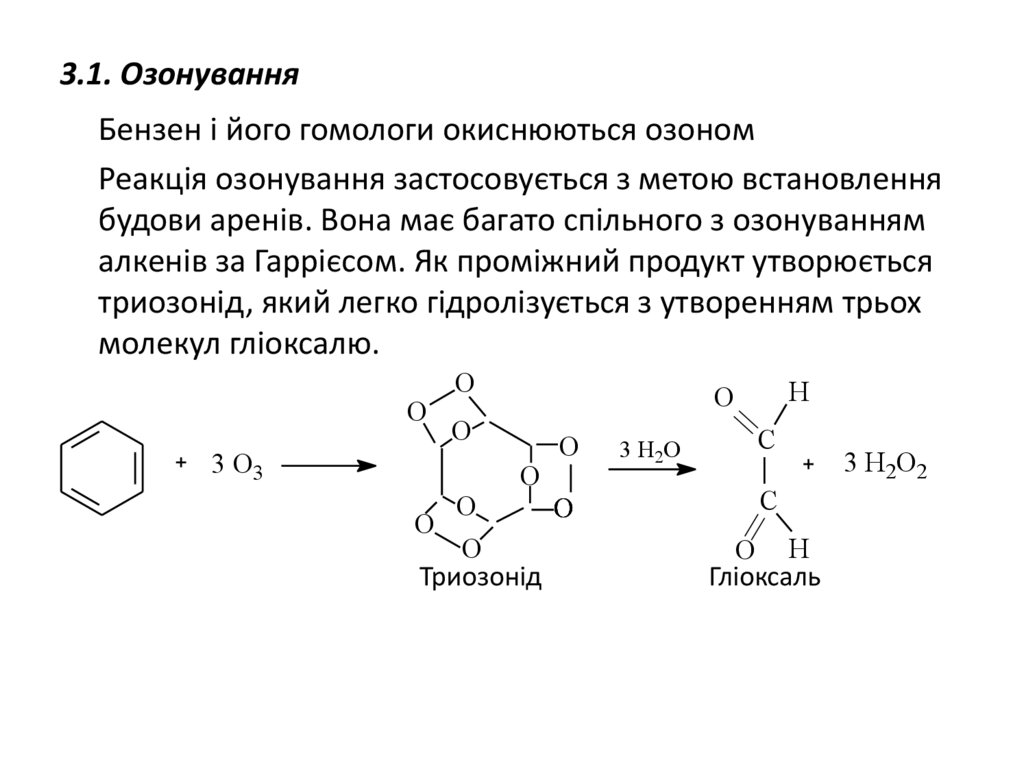
3.1. ОзонуванняБензен і його гомологи окиснюються озоном
Реакція озонування застосовується з метою встановлення
будови аренів. Вона має багато спільного з озонуванням
алкенів за Гаррієсом. Як проміжний продукт утворюється
триозонід, який легко гідролізується з утворенням трьох
молекул гліоксалю.
О
3 О3
О
Н
О
О
О
О
О
О
О
О
Триозонід
3 Н2О
С
С
О Н
Гліоксаль
3 Н2О2
18.
4. Правила орієнтації в реакціях електрофільногозаміщення
• В незаміщеному бензені всі шість атомів карбону рівноцінні,
тому реакції заміщення протікають за участю будь якого з них.
• Якщо ж у бензеновому ядрі є замісник, то рівномірність
розподілу електронної густини порушується і напрям атаки ядра
реагента і сама швидкість його взаємодії з ядром замісника
визначається як природою цього замісника, так і природою
реагента.
• Механізм орієнтуючої дії замісника полягає як у зміні
електронної густини у бензеновому кільці, так і у стабілізації або
дестабілізації ним проміжного σ-комплексу, в основному, за
рахунок прояву І- та М-ефектів.
• За впливом на розподіл електронної густини у бензеновому
ядрі і за своєю орієнтуючою дією всі замісники поділяються на
дві групи:
19.
Замісники І-го роду (Х) – електронодонорні.• До них відносяться
O
O
-NH2; -OH; -OR; -NH-C-R; -O-C-CH3; -CH3 (або будь-який алкіл); -F; -CI; -Br; -I.
• Замісники І-го роду збільшують електронну густину на
бензеновому кільці за раху-нок +І або +М-ефектів. Всі
алкільні групи проявляють +І–ефект, такі групи, як –ОН, NH2, NR2, галогени тощо, хоч характеризуються —І–
ефектом, але проявляють значно сильніший +М-ефект і, в
цілому, також збагачують ядро електронною густиною,
причому, в найбільшій мірі електронна густина зростає на
атомах вуглецю, що знаходяться в орто- та параположенях по відношенню до замісника.
20.
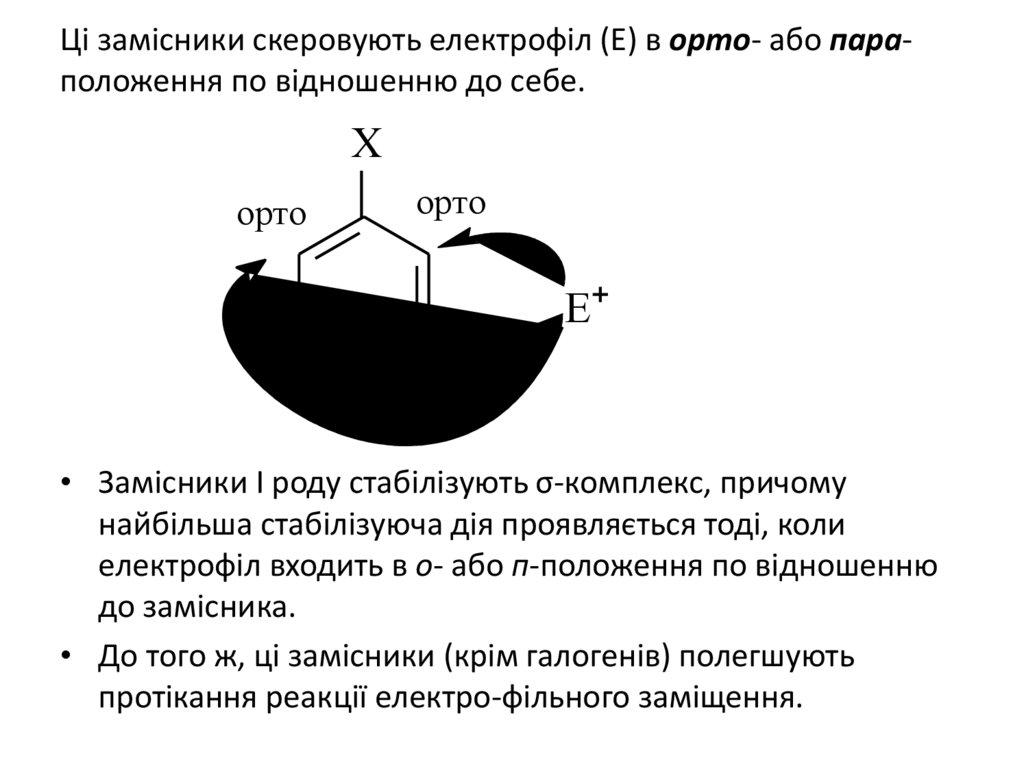
Ці замісники скеровують електрофіл (Е) в орто- або параположення по відношенню до себе.Х
орто
орто
Е
пара
• Замісники І роду стабілізують σ-комплекс, причому
найбільша стабілізуюча дія проявляється тоді, коли
електрофіл входить в о- або п-положення по відношенню
до замісника.
• До того ж, ці замісники (крім галогенів) полегшують
протікання реакції електро-фільного заміщення.
21.
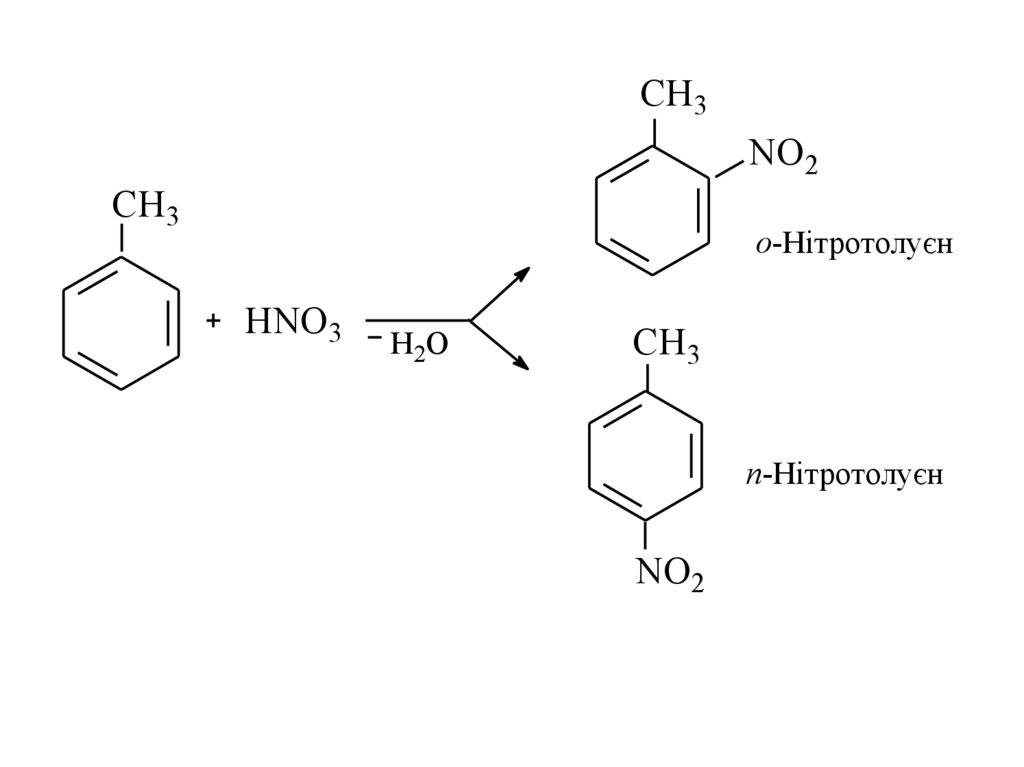
CH3NO2
CH3
о-Нітротолуєн
HNO3
H2O
СН3
п-Нітротолуєн
NO2
22.
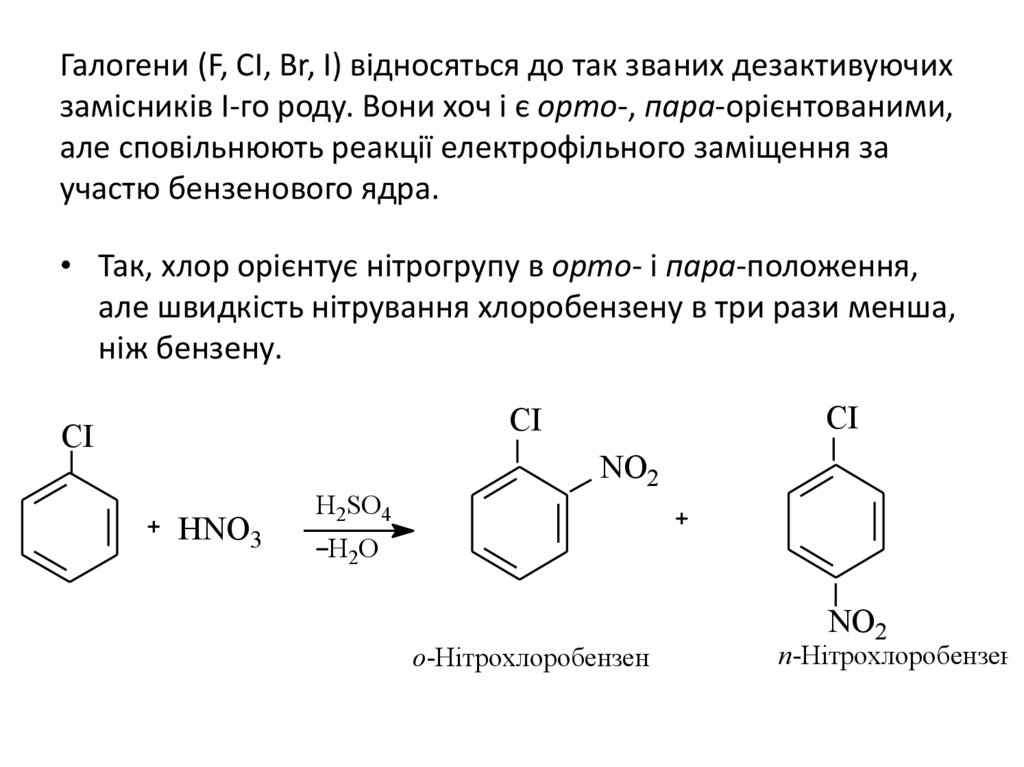
Галогени (F, CI, Br, I) відносяться до так званих дезактивуючихзамісників І-го роду. Вони хоч і є орто-, пара-орієнтованими,
але сповільнюють реакції електрофільного заміщення за
участю бензенового ядра.
• Так, хлор орієнтує нітрогрупу в орто- і пара-положення,
але швидкість нітрування хлоробензену в три рази менша,
ніж бензену.
CI
CI
CI
HNO3
H2SO4
NO2
H2O
о-Нітрохлоробензен
NO2
п-Нітрохлоробензен
23.
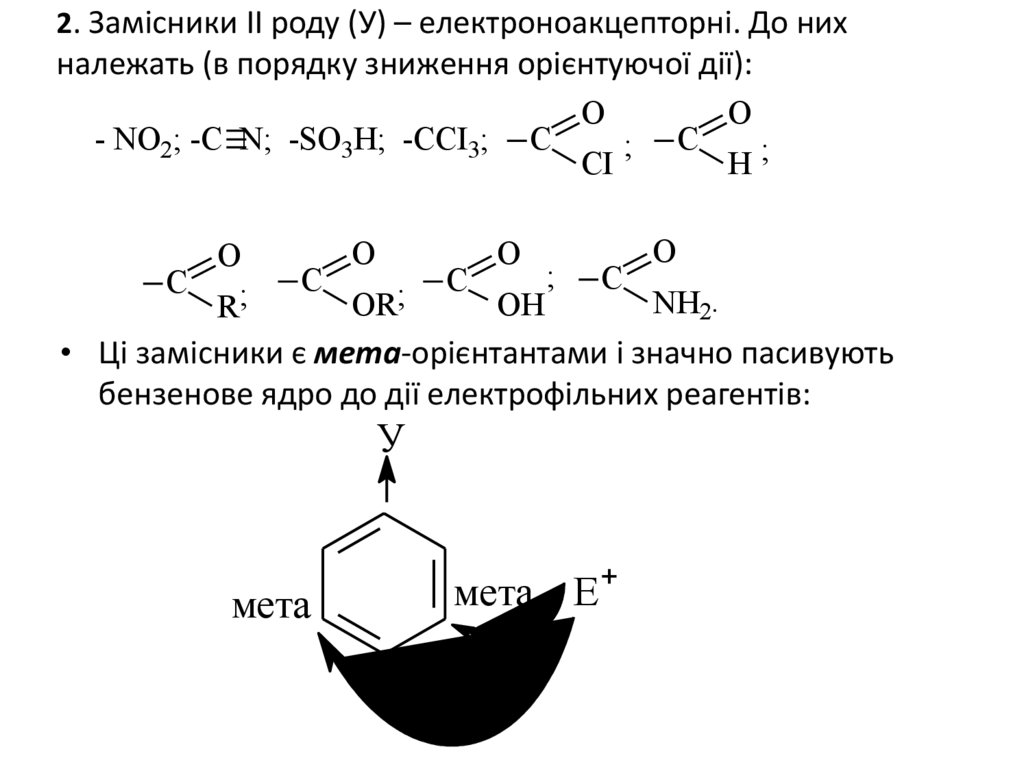
2. Замісники ІІ роду (У) – електроноакцепторні. До нихналежать (в порядку зниження орієнтуючої дії):
О
О
- NO2; -C N; -SO3H; -CCI3; C
; C
CI
H;
О
C
R;
О
О
О
; C
C
;
NH2.
OR
OH
• Ці замісники є мета-орієнтантами і значно пасивують
бензенове ядро до дії електрофільних реагентів:
C
У
мета
мета Е
24.
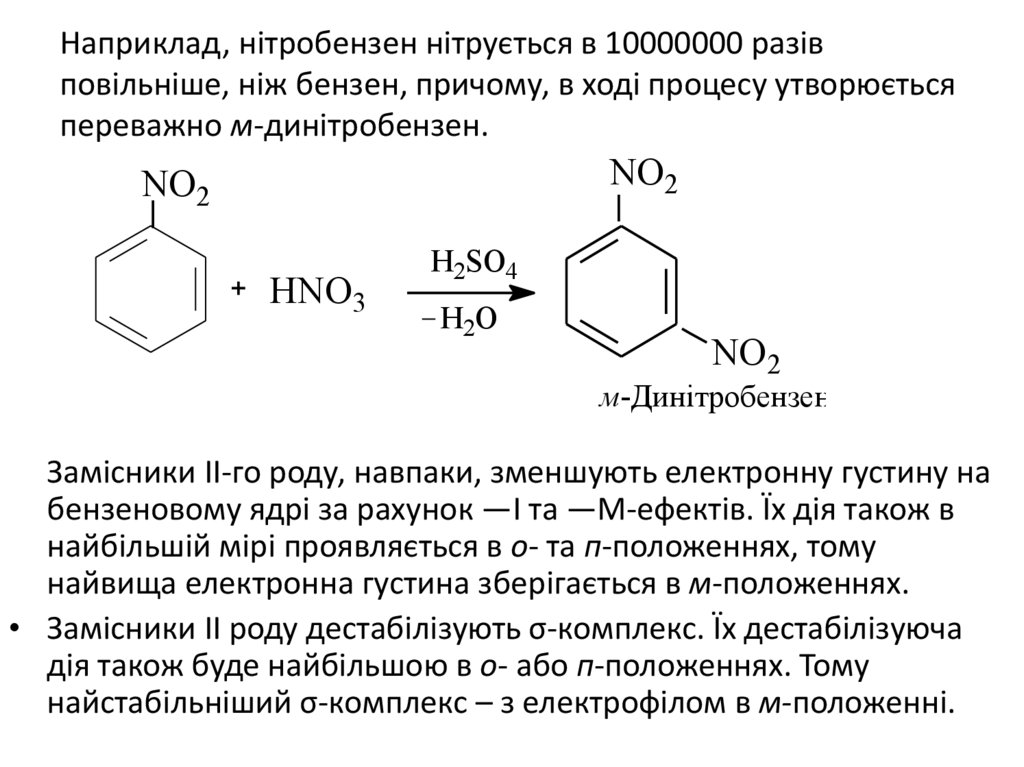
Наприклад, нітробензен нітрується в 10000000 разівповільніше, ніж бензен, причому, в ході процесу утворюється
переважно м-динітробензен.
NO2
NO2
HNO3
H2SO4
H2O
NO2
м-Динітробензен
Замісники ІІ-го роду, навпаки, зменшують електронну густину на
бензеновому ядрі за рахунок —І та —М-ефектів. Їх дія також в
найбільшій мірі проявляється в о- та п-положеннях, тому
найвища електронна густина зберігається в м-положеннях.
• Замісники ІІ роду дестабілізують σ-комплекс. Їх дестабілізуюча
дія також буде найбільшою в о- або п-положеннях. Тому
найстабільніший σ-комплекс – з електрофілом в м-положенні.
25.
5. Найважливіші представники аренів• Бензен. Головними джерелами бензену є: кам'яновугільна
смола, коксовий газ, а також процеси дегідроціклізації
гексану і деметилування толуєну і ксилену.
• Бензен застосовують як розчинник, а також як важливу
сировину в хімічній промисловості. З бензену отримують
стирен (стирол), необхідний для виробництва пластмас і
син-тетичних каучуків типу СКС (кополімер 1,3-бутадієну і
стирену).
• Толуєн отримують з кам'яновугільної смоли, а також
реакцією дегідроциклізації гептану. Це розчинник і
сировина для промислового органічного синтезу.






 chemistry
chemistry








