Similar presentations:
Лекарственные средства – производные пиримидина
1. Лекарственные средства – производные пиримидина
• Пиримидин – шестичленный гетероциклс двумя атомами азота в положении 1,3
• Пиримидин не обладает основными
свойствами т.к. электронная пара
атомов азота участвует в сопряжении с
образованием ароматической системы.
• ЛВ – производные пиримидина
обладают слабыми кислотными
свойствами за счет лактам-лактимной
таутомерии.
2.
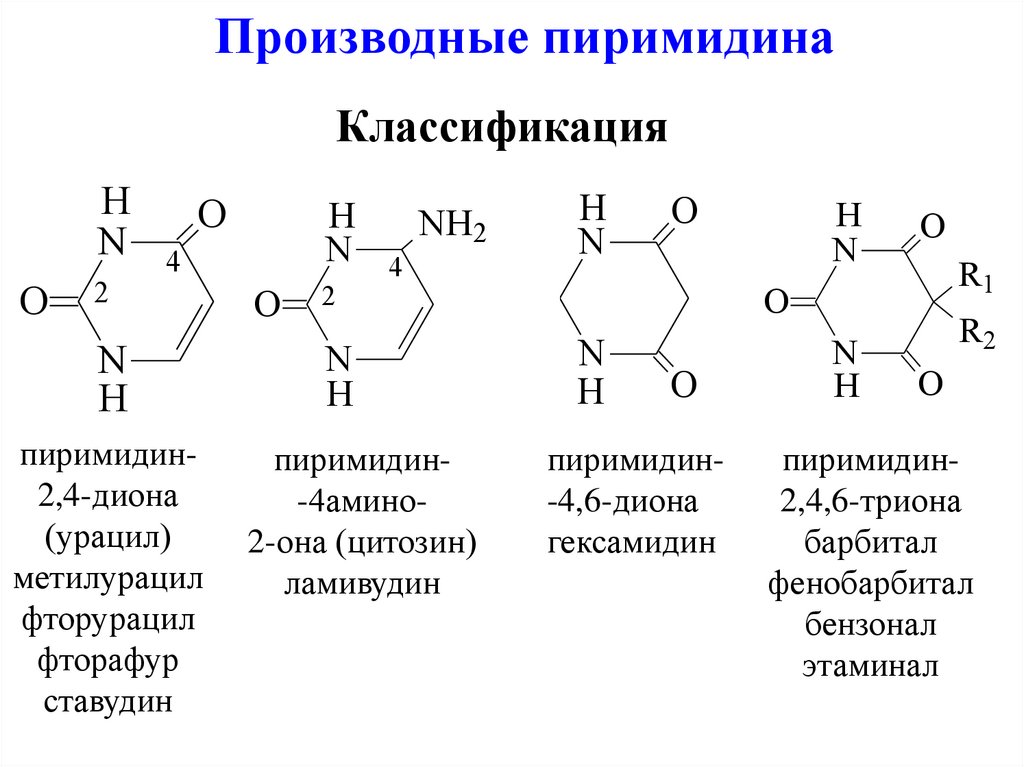
Производные пиримидинаКлассификация
H
N
O
2
O
H
N
4
N
H
пиримидин2,4-диона
(урацил)
метилурацил
фторурацил
фторафур
ставудин
O
2
NH2
4
N
H
пиримидин-4амино2-она (цитозин)
ламивудин
H
N
O
H
N
O
R1
O
N
H
O
пиримидин-4,6-диона
гексамидин
N
H
R2
O
пиримидин2,4,6-триона
барбитал
фенобарбитал
бензонал
этаминал
3.
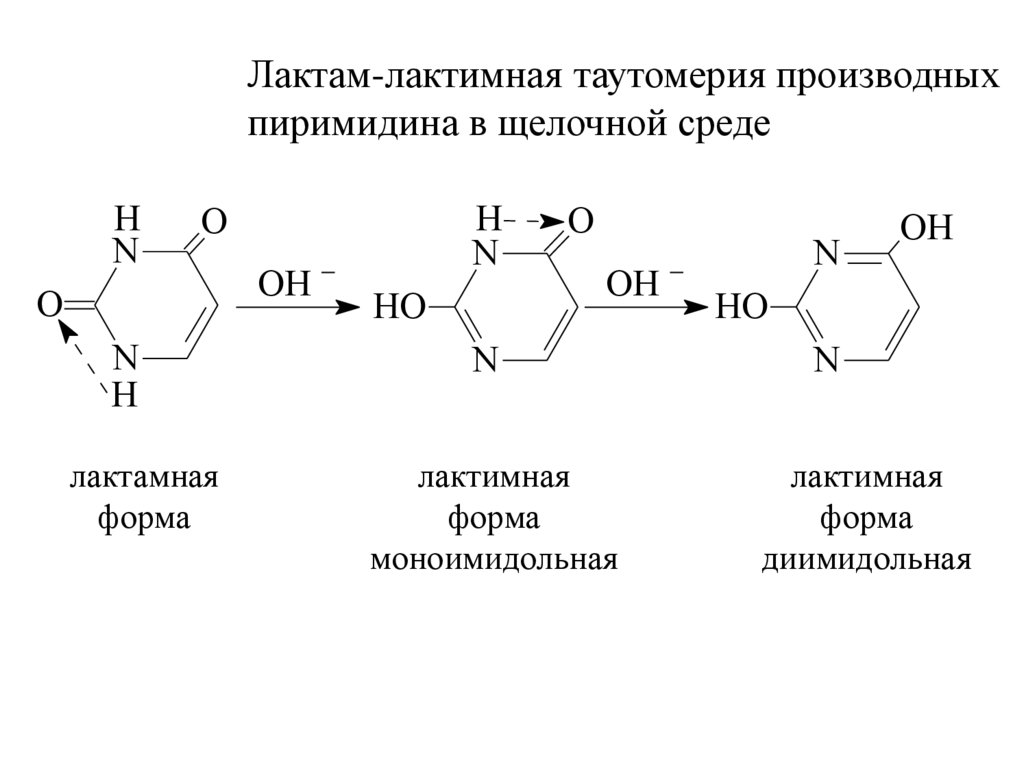
Лактам-лактимная таутомерия производныхпиримидина в щелочной среде
H
N
H
N
O
O
N
H
лактамная
форма
OH
HO
O
OH
N
лактимная
форма
моноимидольная
N
OH
HO
N
лактимная
форма
диимидольная
4.
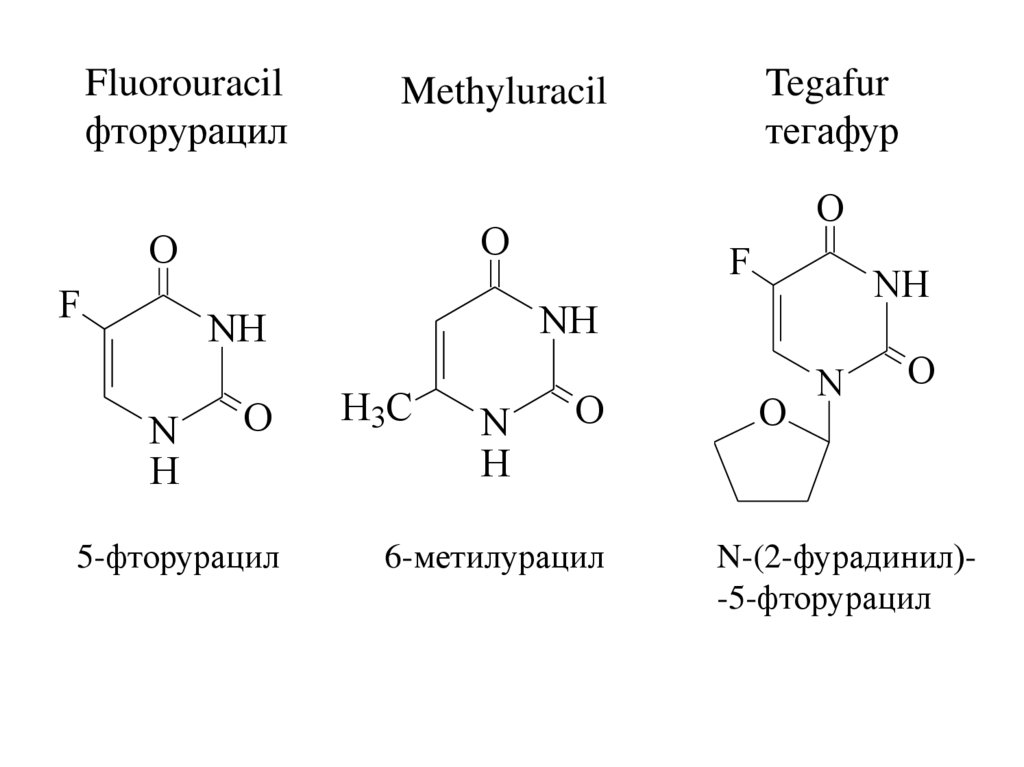
Fluorouracilфторурацил
O
5-фторурацил
F
NH
NH
NH
N
H
O
O
O
F
Tegafur
тегафур
Methyluracil
H 3C
N
H
O
6-метилурацил
O
N
O
N-(2-фурадинил)-5-фторурацил
5.
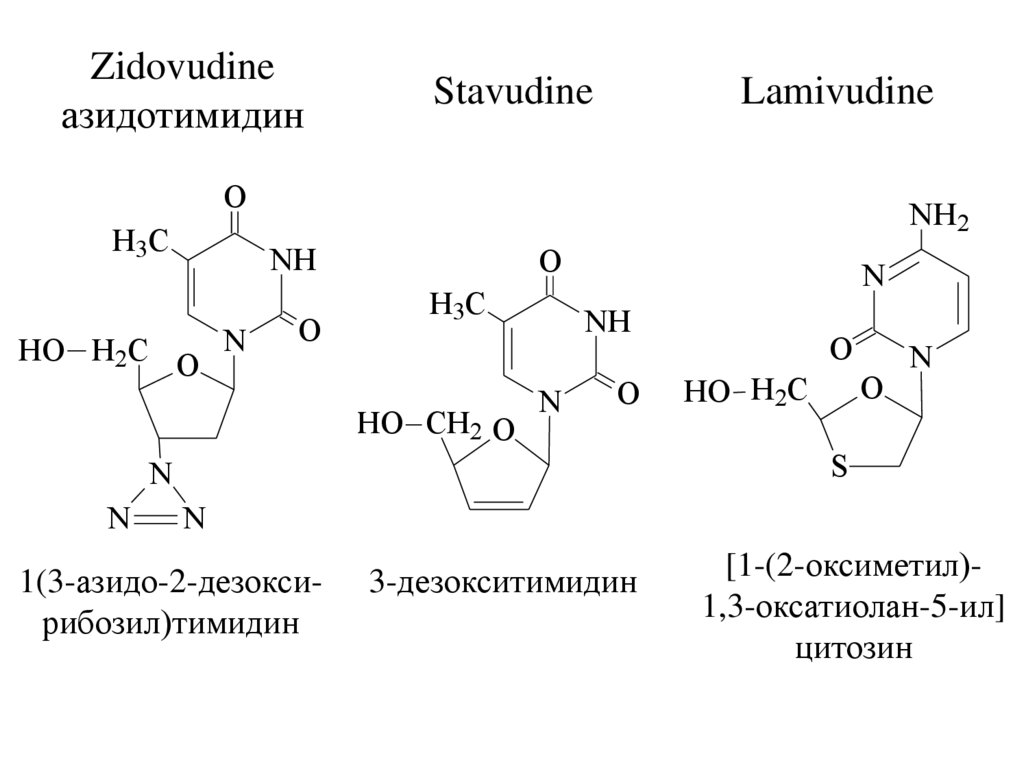
Zidovudineазидотимидин
Stavudine
Lamivudine
O
H 3C
NH2
NH
HO H2C O
N
O
O
H3C
HO CH2 O
N
NH
N
O
O
HO H2C
N
S
N
N
O
N
1(3-азидо-2-дезоксирибозил)тимидин
3-дезокситимидин
[1-(2-оксиметил)1,3-оксатиолан-5-ил]
цитозин
6. Получение – ЛВ данной группы получают синтетически.
• Физико-химические свойства.• Белые (иногда с желтоватым или бледнорозовым оттенком) кристаллические
вещества без запаха. Азидотимидин может
существовать в нескольких полиморфных
модификациях. Мало растворимы в воде и
органических растворителях. Растворимы в
щелочах с образованием лактимной
(кислотной) формы и при этом проявляют
свойства фенолов (реакции Se).
7.
• В химическом отношении ЛВ даннойгруппы вступают в реакции
комплексообразования с солями
тяжелых металлов с образованием
окрашенных осадков. Реакции
протекают в щелочной среде.
• Наличие ароматической системы в
щелочной среде позволяет вступать в
реакции азосочетания, окисления,
замещения и конденсации с
альдегидами.
8.
ПодлинностьКомплексообразование
В щелочной среде образуется кислотная
лактимная форма, которая взаимодействует
с солью тяжелого металла
+
H
N
O
N
R2
O
N
R OH
R1
O
O
R
белый
N
R2
AgNO3
R1
Co/2
OH
N
R
N
R2
OAg
N
+
CoCl2
O
+
CuSO4
N
O
R
N
R2
R1
Cu/2
O
R
N
R2
R1
O
специф.
R1
фиол.
9.
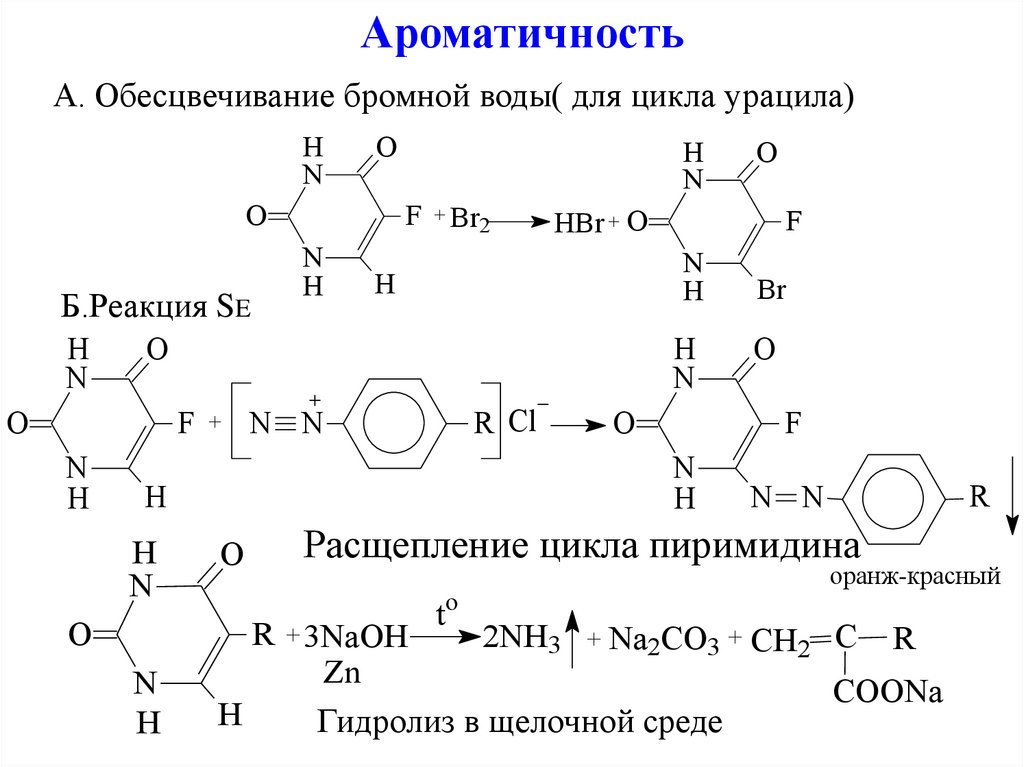
АроматичностьА. Обесцвечивание бромной воды( для цикла урацила)
H
N
O
O
Б.Реакция SE
H
N
F + Br2
N
H
N
H
H
+
R Cl
N N
O
N
H
O
O
Br
O
F
N
H
H
H
N
F
H
N
F
O
HBr + O
O
O
N
H
H
N
R
N N
Расщепление цикла пиримидина
to
оранж-красный
R + 3NaOH
2NH3 + Na2CO3 + CH2 C R
Zn
COONa
H
Гидролиз в щелочной среде
10.
• Фторид-ионы во фторурациле и тегафуреобнаруживают после дегалогенирования
металлическим натрием.
• 2F- + CaCI2 = CaF2 +2CI
белый осадок
• Fe(SCN)3 + 6F- = {FeF6}3- + 3SCNбесцветный
• Красный
• Физико-химические методы.
• УФ- и ИК- спектроскопия. ВЭЖХ. Для
азидотимидина применяется ЯМРНспектроскопия (для точности определения).
11.
• Определение примесей.• Степень чистоты ЛП данной группы
определяют методом ТСХ (отсутствие
промежуточных продуктов синтеза и
посторонних примесей).
• Методом ВЭЖХ определяют
специфические примеси во
фторурациле, зидовудине и др.
• Метод ГЖХ – наличие остаточных
органических растворителей.
12.
• Методы количественногоопределения.
• 1. Кислотно-основное титрование в водной
среде – косвенный вариант после реакции
взаимодействия с серебра нитратом.
• 2. Кислотно-основное титрование в среде
диметилформамида (для усиления кислотных
свойств). Титруют 0,1н раствором натрия
метилата. Индикатор тимоловый синий.
• 3. Окислительно-восстановительные методыброматометрия и иодхлорметрия. Вариант
обратного титрования.
13.
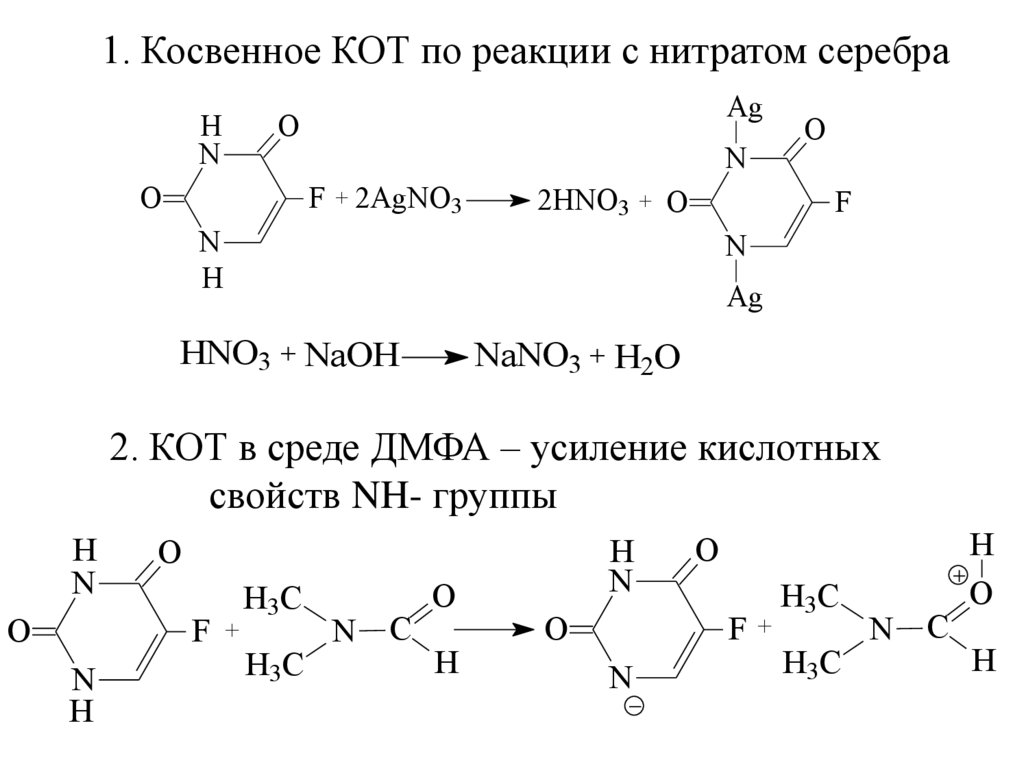
1. Косвенное КОТ по реакции с нитратом серебраH
N
Ag
O
O
N
F + 2AgNO3
2HNO3 + O
O
F
N
H
N
Ag
HNO3 + NaOH
NaNO3 + H2O
2. КОТ в среде ДМФА – усиление кислотных
свойств NH- группы
H
N
O
F
N
H
H
N
O
+
H3C
H3C
N C
O
H
O
O
F
N
+
H3C
H3C
N C
H
O
H
14.
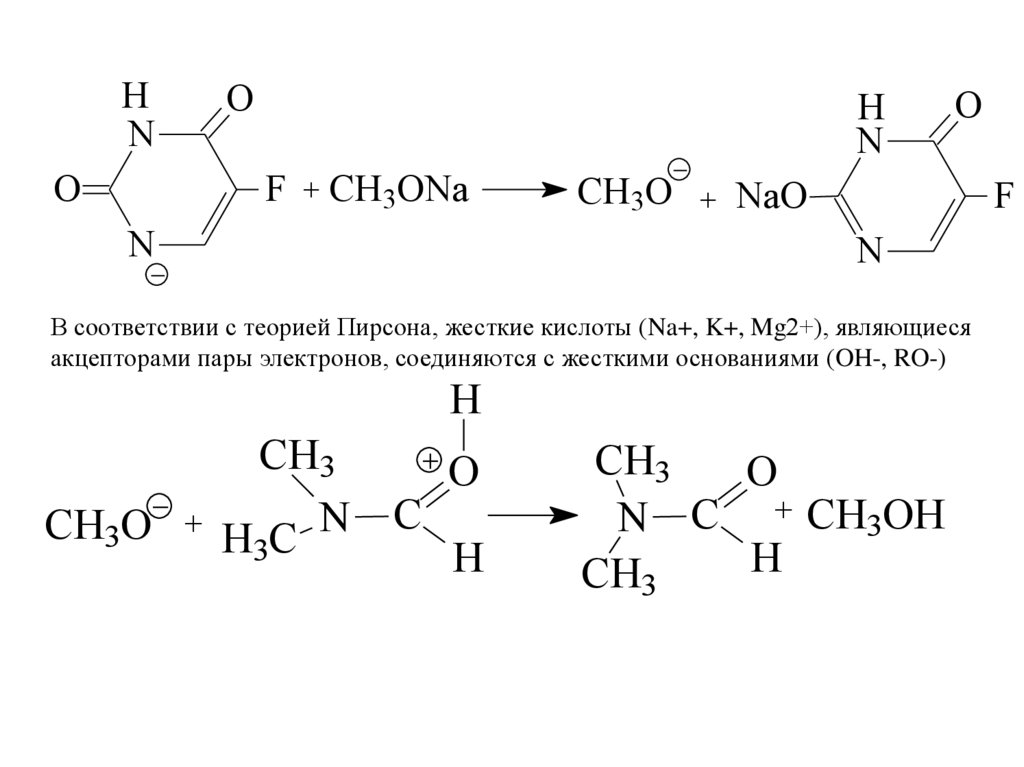
HN
O
O
H
N
F
+
CH3ONa
N
CH3O
+
O
NaO
F
N
В соответствии с теорией Пирсона, жесткие кислоты (Na+, K+, Mg2+), являющиеся
акцепторами пары электронов, соединяются с жесткими основаниями (OH-, RO-)
H
CH3O
+
CH3
O
N C
H3C
H
CH3
O
N C + CH3OH
H
CH3
15.
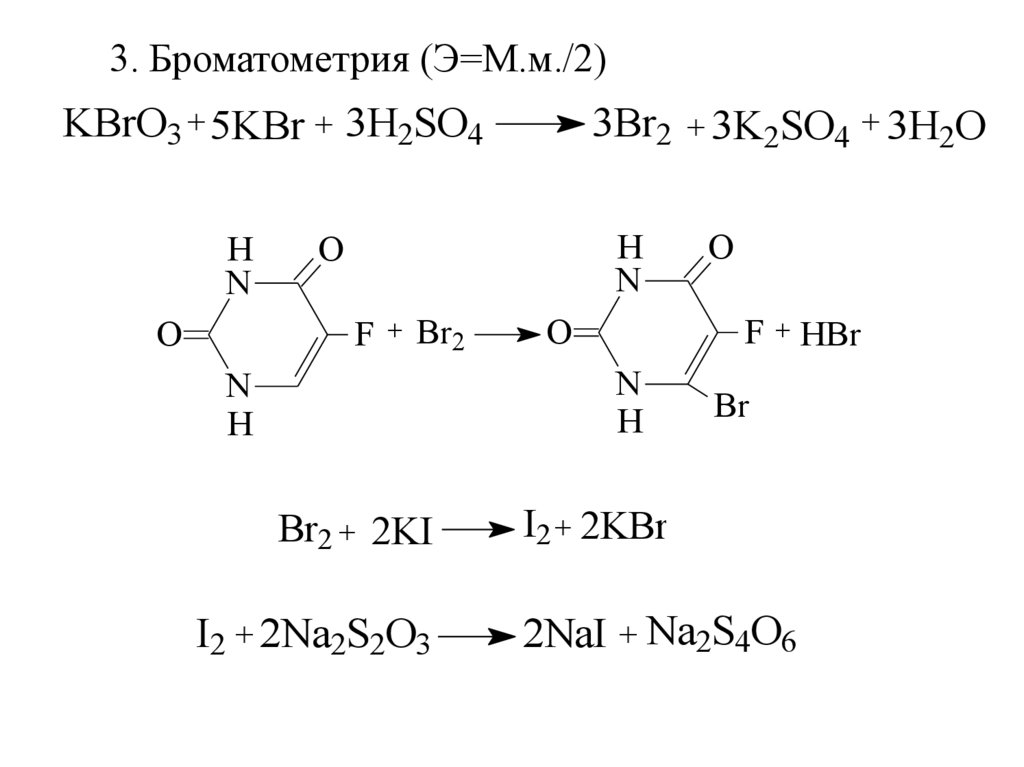
3. Броматометрия (Э=М.м./2)KBrO3 + 5KBr + 3H2SO4
H
N
O
3Br2 + 3K2SO4 + 3H2O
H
N
O
F
+
Br2
O
F + HBr
N
H
N
H
Br2 + 2KI
I2 + 2Na2S2O3
O
Br
I2 + 2KBr
2NaI + Na2S4O6
16.
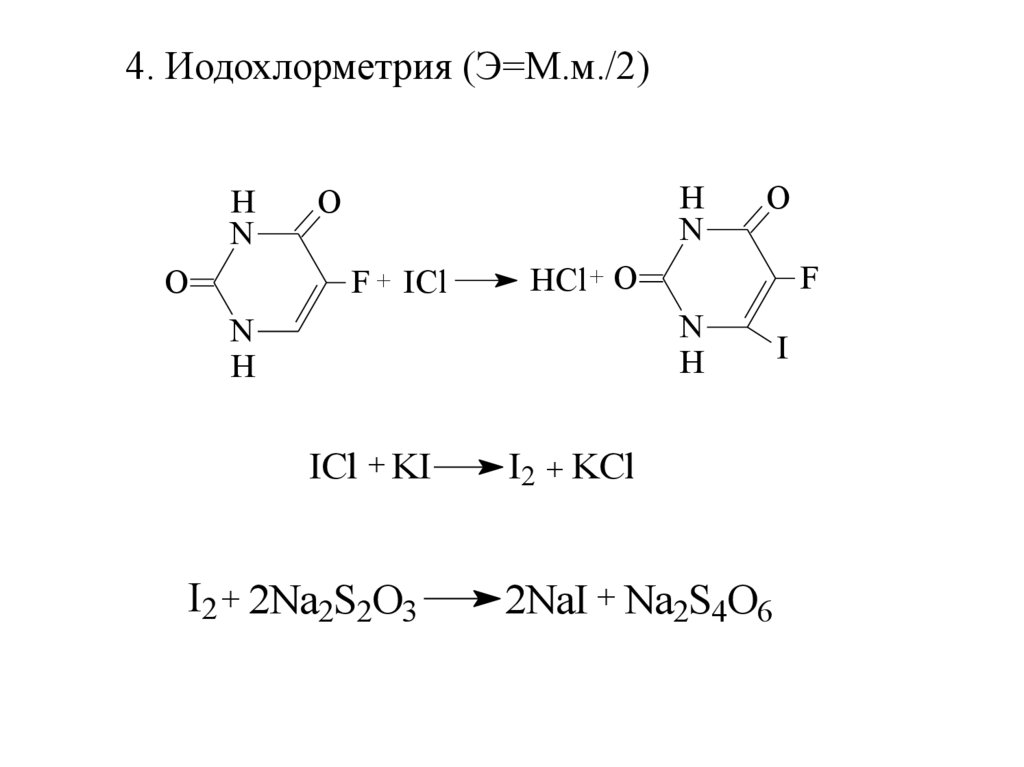
4. Иодохлорметрия (Э=М.м./2)H
N
O
H
N
O
F + ICl
O
HCl + O
F
N
H
N
H
ICl + KI
I2 + 2Na2S2O3
I2 + KCl
2NaI + Na2S4O6
I
17.
• Применение.• Список А. Фторурацил и тегафурпротивоопухолевые средства.
• Список Б. Азидотимидин, ставудин,
ламивудин – в терапии ВИЧ-инфекции.
• Список Б. Метилурацил – стимулятор
лейкопоэза.
• Хранение.
• В хорошо укупоренной таре и
защищенном от света месте.
18.
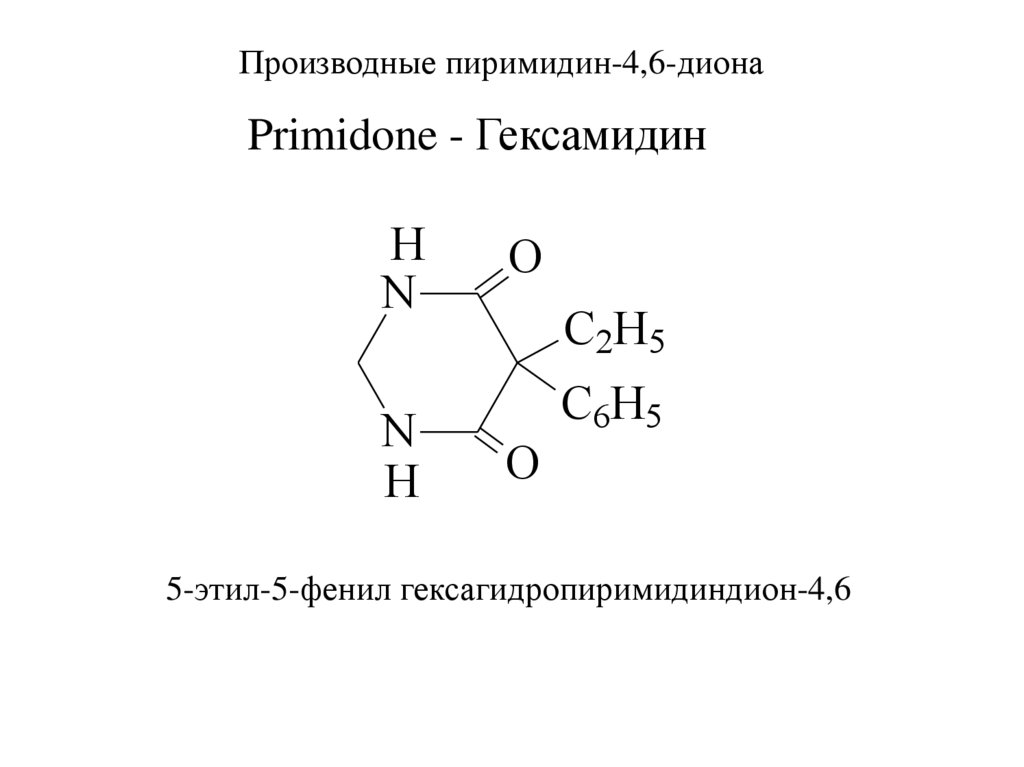
Производные пиримидин-4,6-дионаPrimidone - Гексамидин
H
N
N
H
O
C2H5
C6H5
O
5-этил-5-фенил гексагидропиримидиндион-4,6
19.
• Примидон получают синтетически.• Примидон – представляет собой белый
кристаллический порошок без запаха. Нерастворим в
воде, мало растворим в спирте.
• Примидон обладает очень слабыми кислотными
свойствами, поэтому вступает в реакции
комплексообразования только с сульфатом меди при
определенных условиях.
• При гидролизе в щелочной среде образует аммиак,
натрия карбонат, натриевую соль
фенилэтилуксусной кислоты и формальдегид,
который обнаруживают с хромотроповой кислотой.
20.
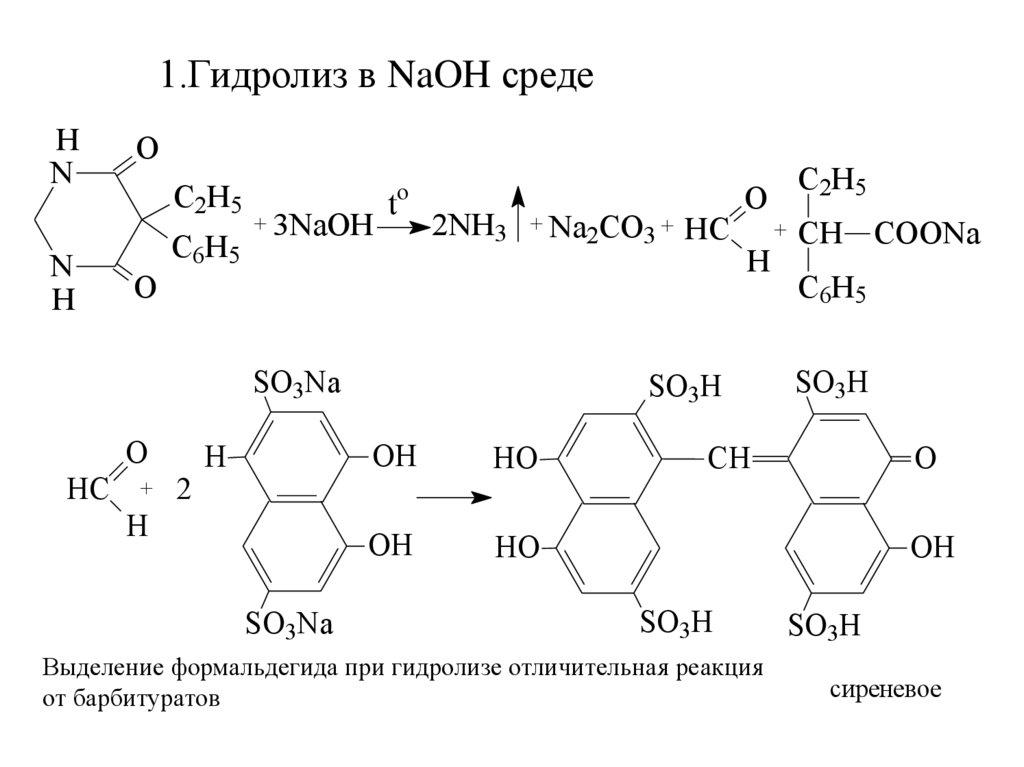
1.Гидролиз в NaOH средеH
N
N
H
O
C2H5
C6H5
o
+ 3NaOH
t
2NH3
+ Na2CO3 +
O
SO3Na
O
HC
HC
+
2
H
H
SO3Na
H
SO3H
OH
HO
OH
HO
C2H5
O
+
CH COONa
C6H5
SO3H
CH
O
OH
SO3H
Выделение формальдегида при гидролизе отличительная реакция
от барбитуратов
SO3H
сиреневое
21.
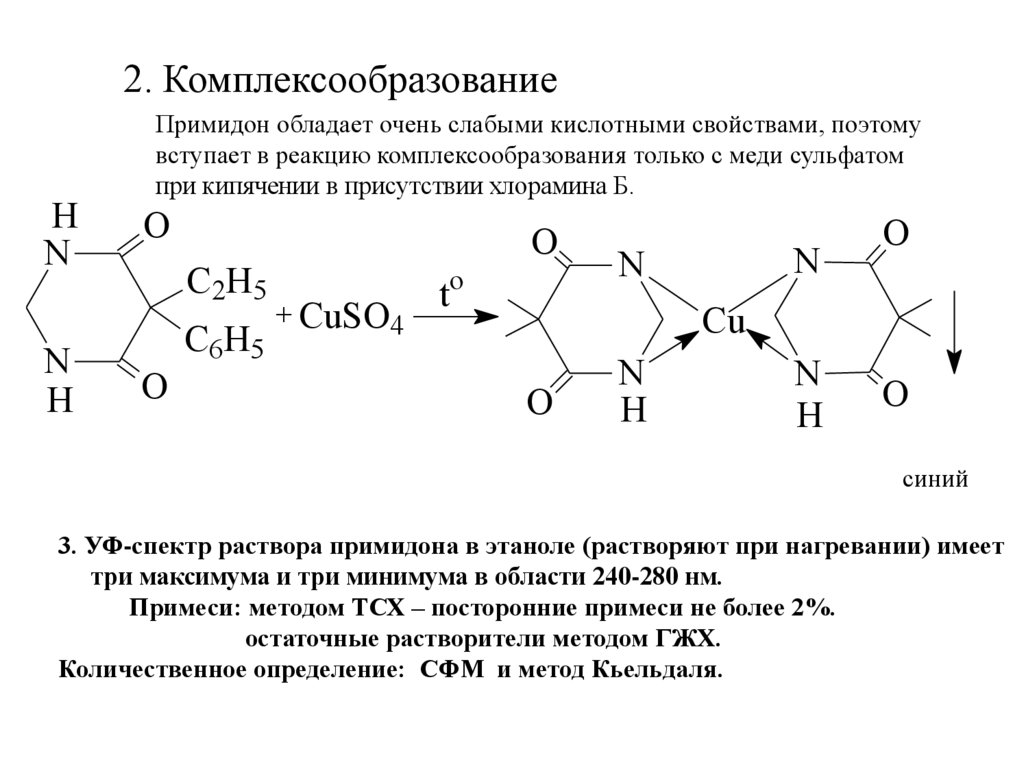
2. КомплексообразованиеH
N
N
H
Примидон обладает очень слабыми кислотными свойствами, поэтому
вступает в реакцию комплексообразования только с меди сульфатом
при кипячении в присутствии хлорамина Б.
O
C2H5
C6H5
O
O
+ CuSO4
o
t
N
N
O
Cu
O
N
H
N
H
O
синий
3. УФ-спектр раствора примидона в этаноле (растворяют при нагревании) имеет
три максимума и три минимума в области 240-280 нм.
Примеси: методом ТСХ – посторонние примеси не более 2%.
остаточные растворители методом ГЖХ.
Количественное определение: СФМ и метод Кьельдаля.
22.
• Применение.• Примидон обладает
противосудорожным действием.
Снотворное действие отсутствует.
• Хранение.
• Список Б. В хорошо укупоренной таре, в
сухом месте, при комнатной
температуре.
23.
DipheninumC
C
O
H
N
N
H
C O
+
NaHCO3
5,5-дифенилгидантоин и NaHCO3 (85:15)
Таутомерия
C
C
O
H
N
N
H
C O
OH
-
O
C
N
C
N
H
OH
24.
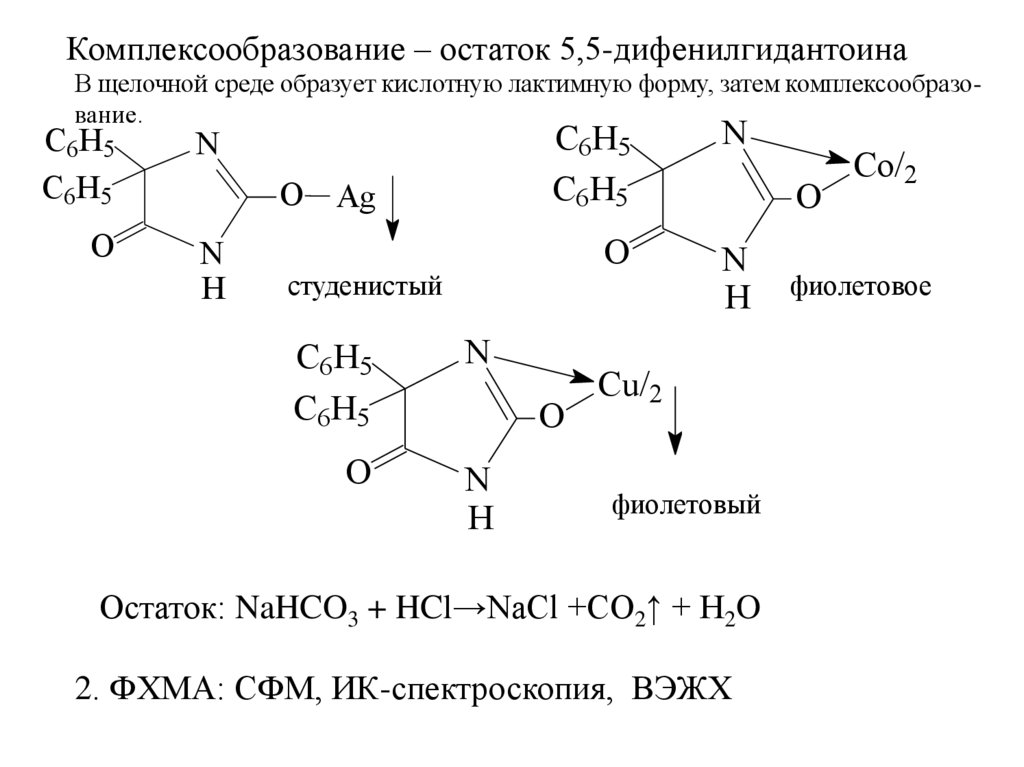
Комплексообразование – остаток 5,5-дифенилгидантоинаВ щелочной среде образует кислотную лактимную форму, затем комплексообразование.
N
C6H5
C6H5
N
Co/2
C6H5
C6H5
O Ag
O
O
N
H
O
студенистый
C6H5
C6H5
N
O
N
H
O
N
H
Cu/2
фиолетовый
Остаток: NaHCO3 + HCl→NaCl +CO2↑ + H2O
2. ФХМА: СФМ, ИК-спектроскопия, ВЭЖХ
фиолетовое
25.
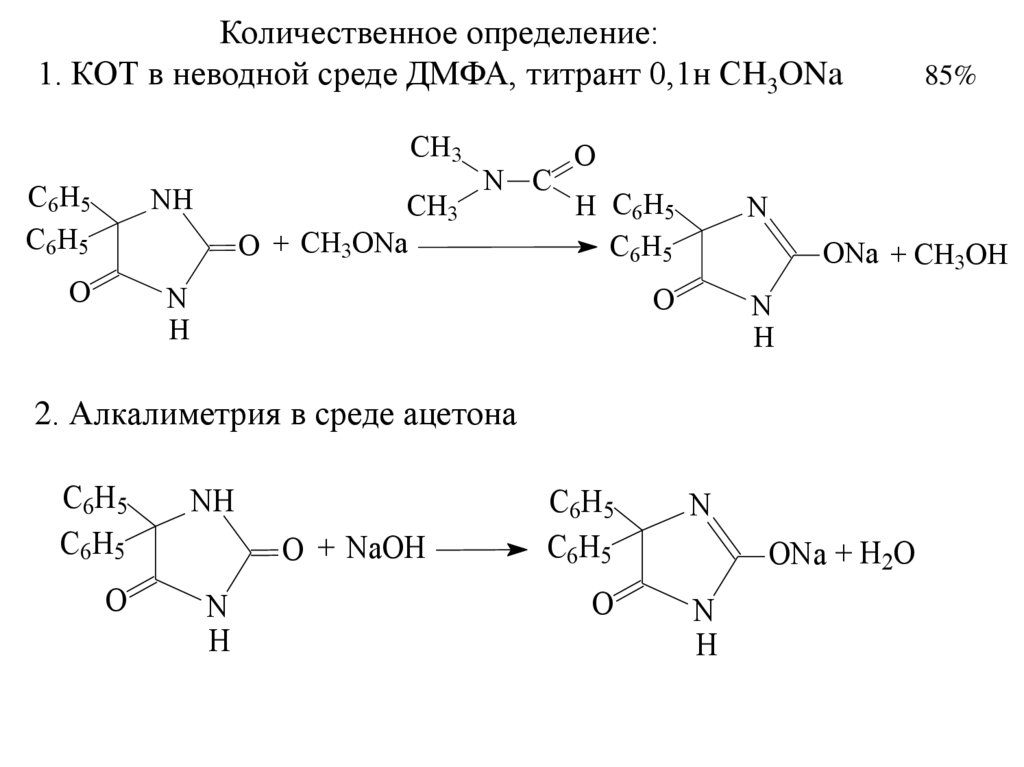
Количественное определение:1. КОТ в неводной среде ДМФА, титрант 0,1н СH3ONa
CH3
C6H5
C6H5
NH
O
N
H
CH3
O + CH3ONa
N C
O
H C6H5
C6H5
N
O
N
H
ONa + CH3OH
2. Алкалиметрия в среде ацетона
C6H5
C6H5
NH
O
N
H
O + NaOH
85%
C6H5
C6H5
N
O
N
H
ONa + H2O
26.
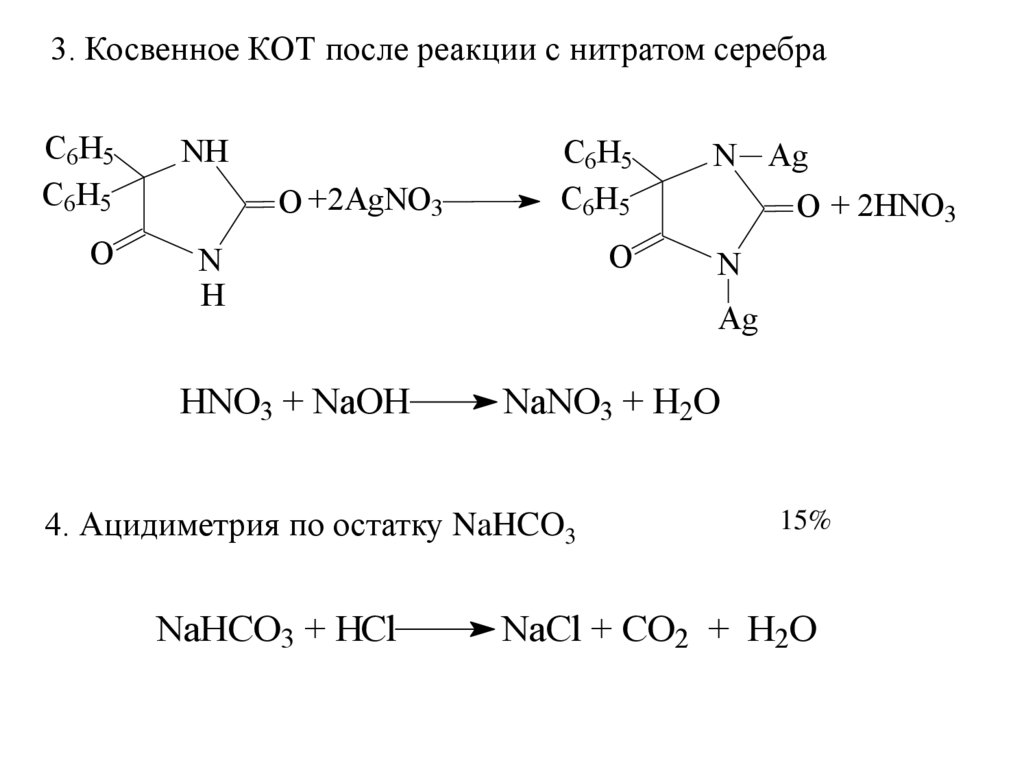
3. Косвенное КОТ после реакции с нитратом серебраC6H5
C6H5
NH
O
N
H
O +2AgNO3
HNO3 + NaOH
C6H5
C6H5
O
O + 2HNO3
N
Ag
NaNO3 + H2O
4. Ацидиметрия по остатку NaHCO3
NaHCO3 + HCl
N Ag
15%
NaCl + CO2 + H2O
27.
• Хранят дифенин ( фенитоин) по спискуБ, в хорошо укупоренной таре и
защищенном от света месте (возможно
взаимодействие с углекислотой
воздуха).
• Применение.
• Дифенин оказывает
противосудорожное и
антиаритмическое действие.












 chemistry
chemistry








