Similar presentations:
Производные пиримидина. Производные пиримидин-2,4,6-триона (Барбитураты)
1. Лекция № 4
Производные пиримидина.Производные пиримидин-2,4,6-триона
(Барбитураты)
2.
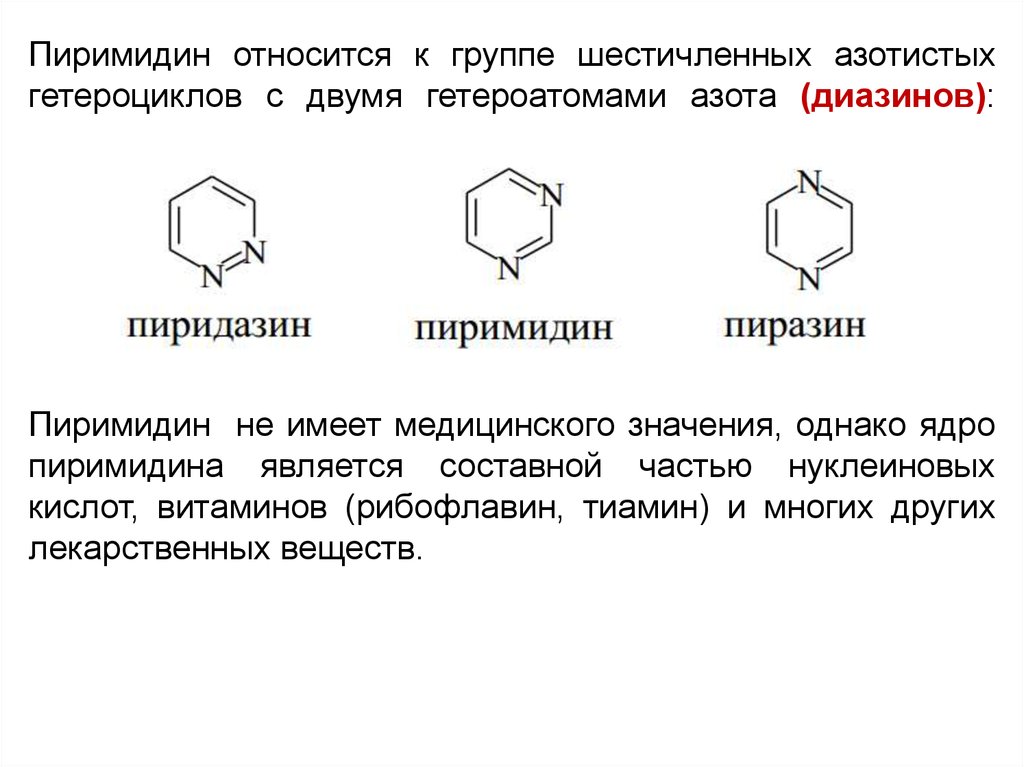
Пиримидин относится к группе шестичленных азотистыхгетероциклов с двумя гетероатомами азота (диазинов):
Пиримидин не имеет медицинского значения, однако ядро
пиримидина является составной частью нуклеиновых
кислот, витаминов (рибофлавин, тиамин) и многих других
лекарственных веществ.
3.
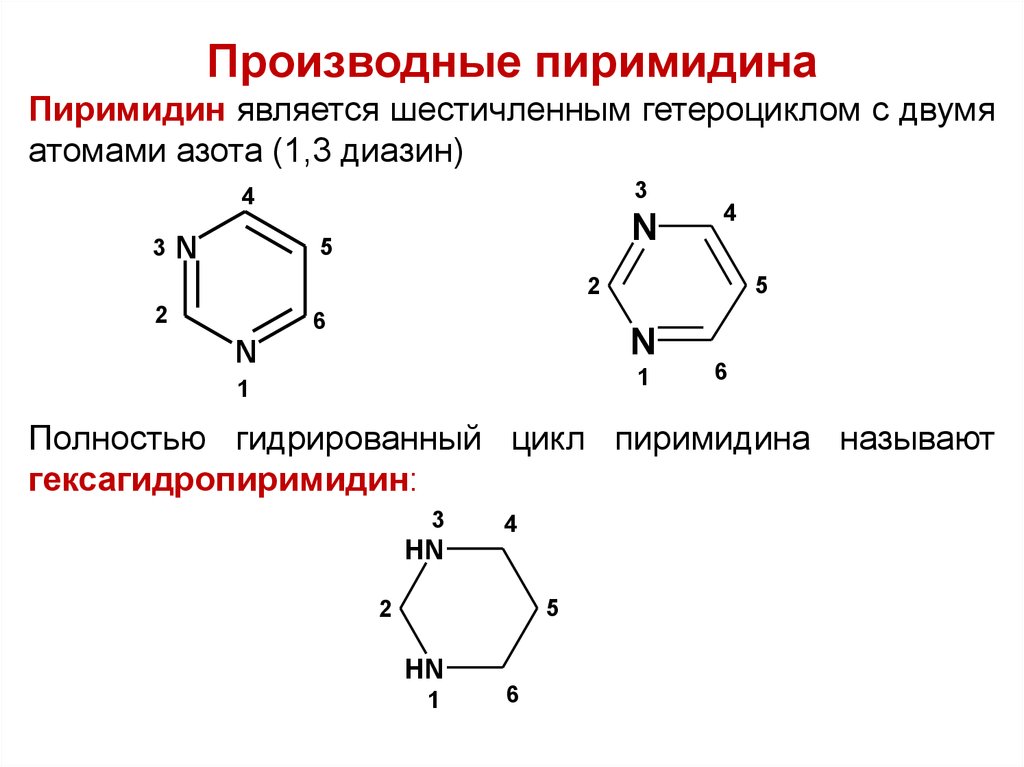
Производные пиримидинаПиримидин является шестичленным гетероциклом с двумя
атомами азота (1,3 диазин)
3
4
3
N
N
5
4
5
2
2
6
N
N
1
1
6
Полностью гидрированный цикл пиримидина называют
гексагидропиримидин:
3
4
HN
5
2
HN
1
6
4.
Большинствосинтетических
лекарственных
средств
производных пиримидина можно разделить на следующие
подгруппы:
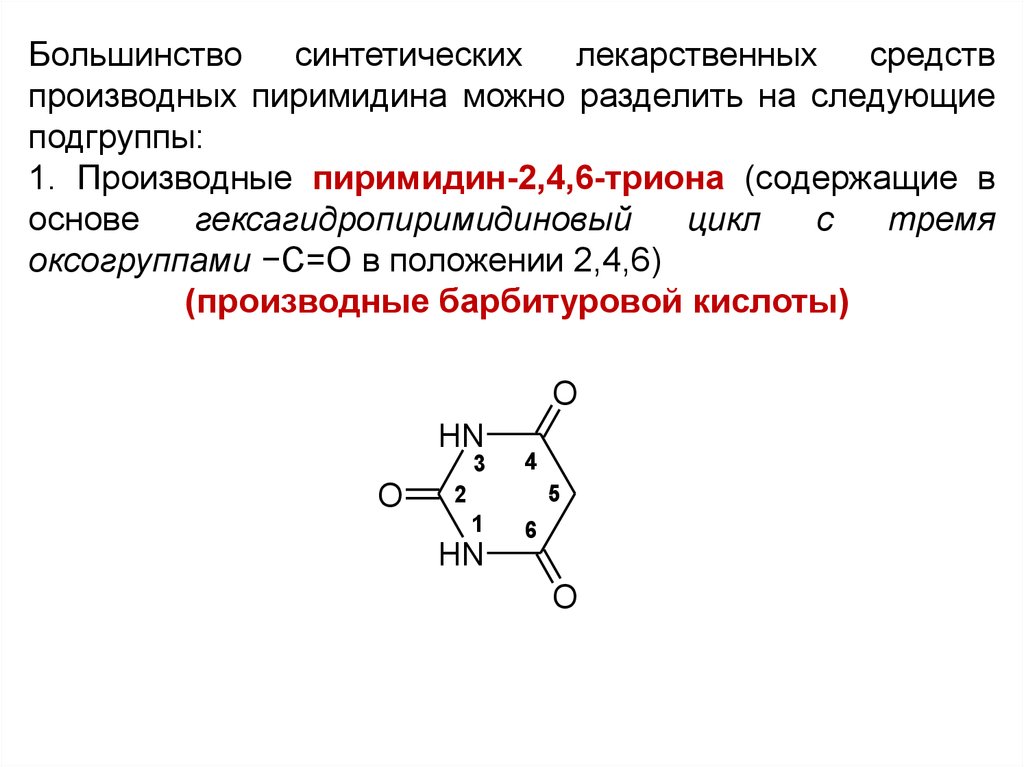
1. Производные пиримидин-2,4,6-триона (содержащие в
основе
гексагидропиримидиновый
цикл
с
тремя
оксогруппами −С=О в положении 2,4,6)
(производные барбитуровой кислоты)
O
HN
3
O
4
5
2
1
HN
6
O
5.
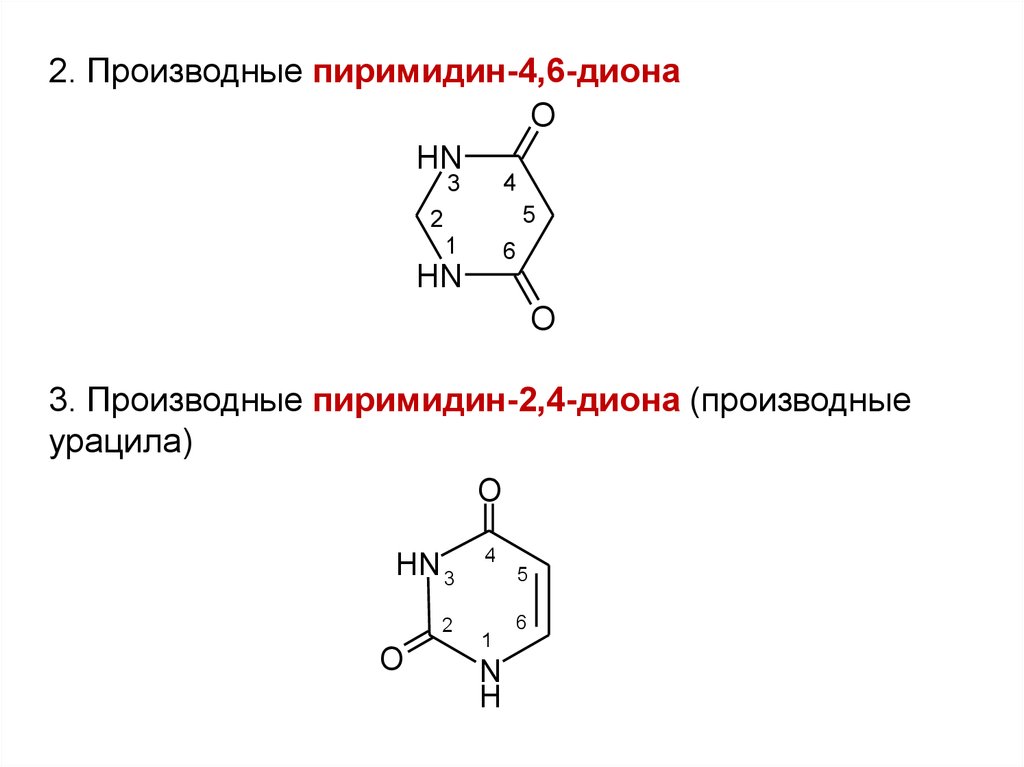
2. Производные пиримидин-4,6-дионаO
HN
4
3
5
2
1
6
HN
O
3. Производные пиримидин-2,4-диона (производные
урацила)
O
HN 3
2
O
4
5
1
N
H
6
6.
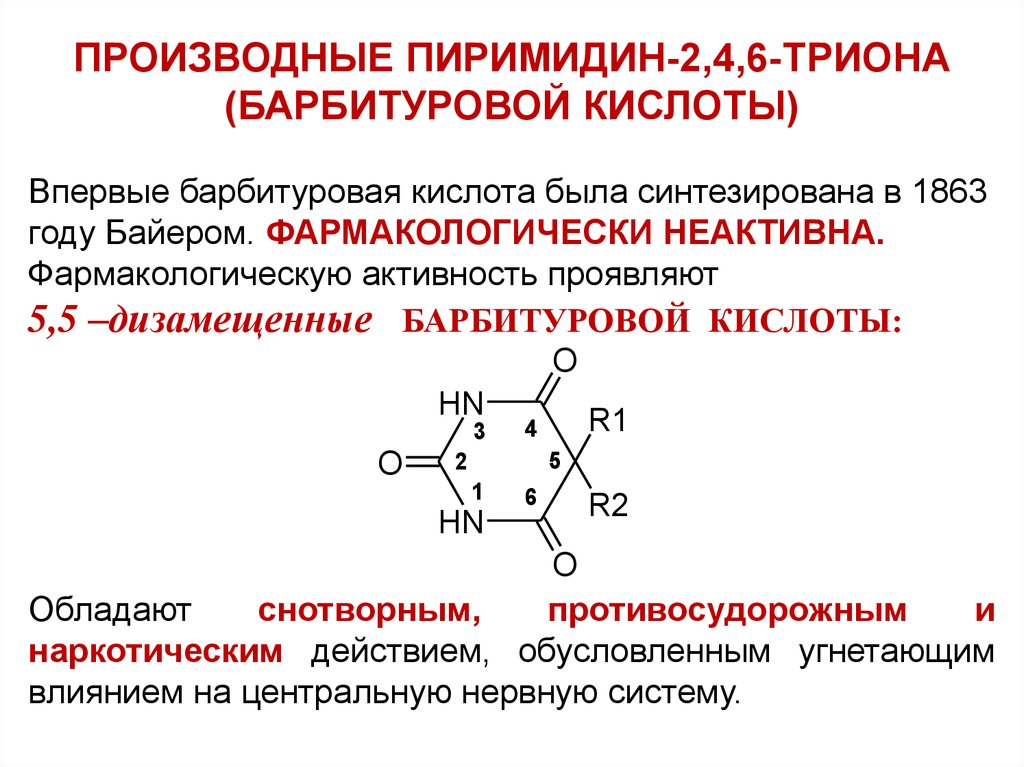
ПРОИЗВОДНЫЕ ПИРИМИДИН-2,4,6-ТРИОНА(БАРБИТУРОВОЙ КИСЛОТЫ)
Впервые барбитуровая кислота была синтезирована в 1863
году Байером. ФАРМАКОЛОГИЧЕСКИ НЕАКТИВНА.
Фармакологическую активность проявляют
5,5 –дизамещенные БАРБИТУРОВОЙ КИСЛОТЫ:
O
HN
3
O
R1
4
5
2
1
HN
6
R2
O
Обладают
снотворным,
противосудорожным
и
наркотическим действием, обусловленным угнетающим
влиянием на центральную нервную систему.
7.
Барбитураты впервые были введены в медицинскуюпрактику в 1903 году, когда барбитал получил рыночное
название Veronal.
Барбитураты подавляют ЦНС.
В малых дозах они действуют как транквилизаторы, а в
больших как снотворные.
Сон с барбитуратами - ненормальный сон, т.к. они
подавляют все виды нормальной активности во время сна.
Более высокие дозы вызывают хирургический наркоз.
По фармакологическому эффекту барбитураты можно
подразделить на:
- снотворные (барбитал, барбитал-натрий, фенобарбитал);
- наркозные (гексенал, тиопентал-натрий);
- противосудорожные (бензонал, фенобарбитал).
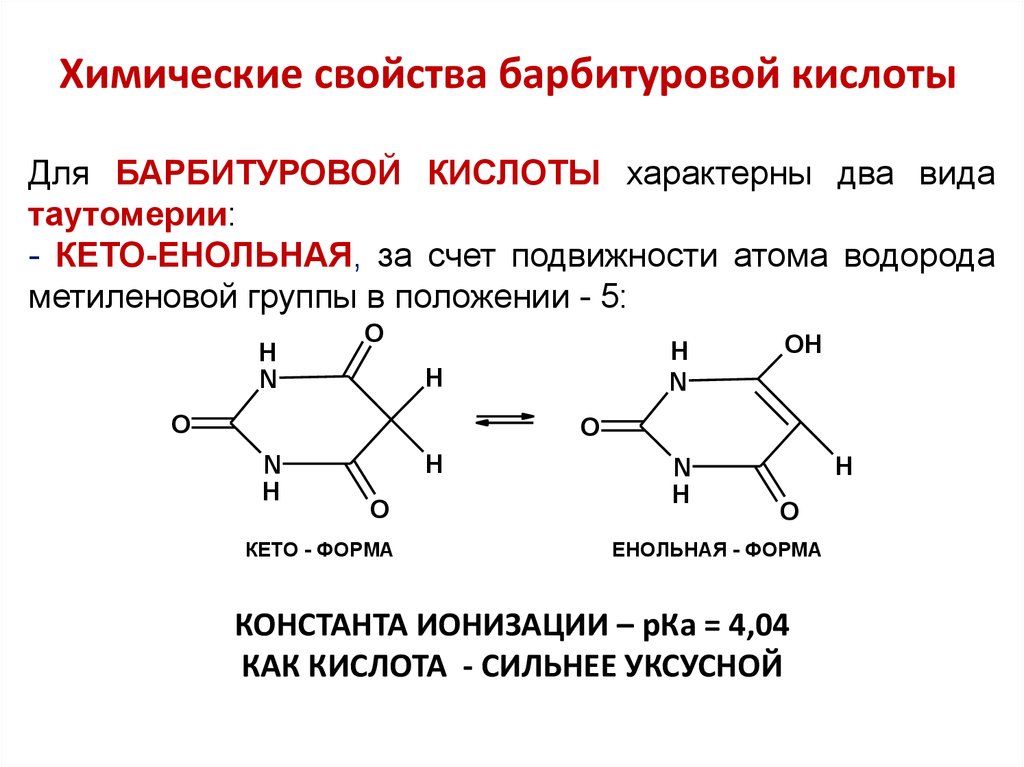
8. Химические свойства барбитуровой кислоты
Для БАРБИТУРОВОЙ КИСЛОТЫ характерны два видатаутомерии:
- КЕТО-ЕНОЛЬНАЯ, за счет подвижности атома водорода
метиленовой группы в положении - 5:
H
N
O
H
N
H
O
OH
O
N
H
H
O
КЕТО - ФОРМА
N
H
H
O
ЕНОЛЬНАЯ - ФОРМА
КОНСТАНТА ИОНИЗАЦИИ – рКа = 4,04
КАК КИСЛОТА - СИЛЬНЕЕ УКСУСНОЙ
9.
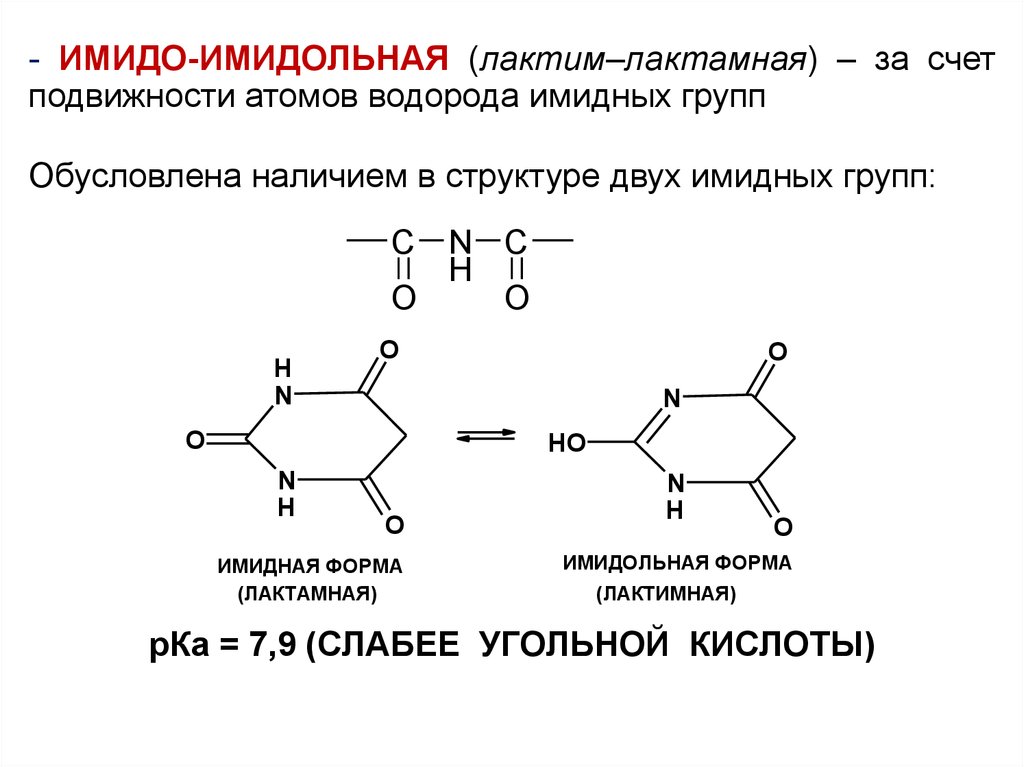
- ИМИДО-ИМИДОЛЬНАЯ (лактим–лактамная) – за счетподвижности атомов водорода имидных групп
Обусловлена наличием в структуре двух имидных групп:
C N C
H
O
O
H
N
O
O
N
O
HO
N
H
O
ИМИДНАЯ ФОРМА
(ЛАКТАМНАЯ)
N
H
O
ИМИДОЛЬНАЯ ФОРМА
(ЛАКТИМНАЯ)
рКа = 7,9 (СЛАБЕЕ УГОЛЬНОЙ КИСЛОТЫ)
10.
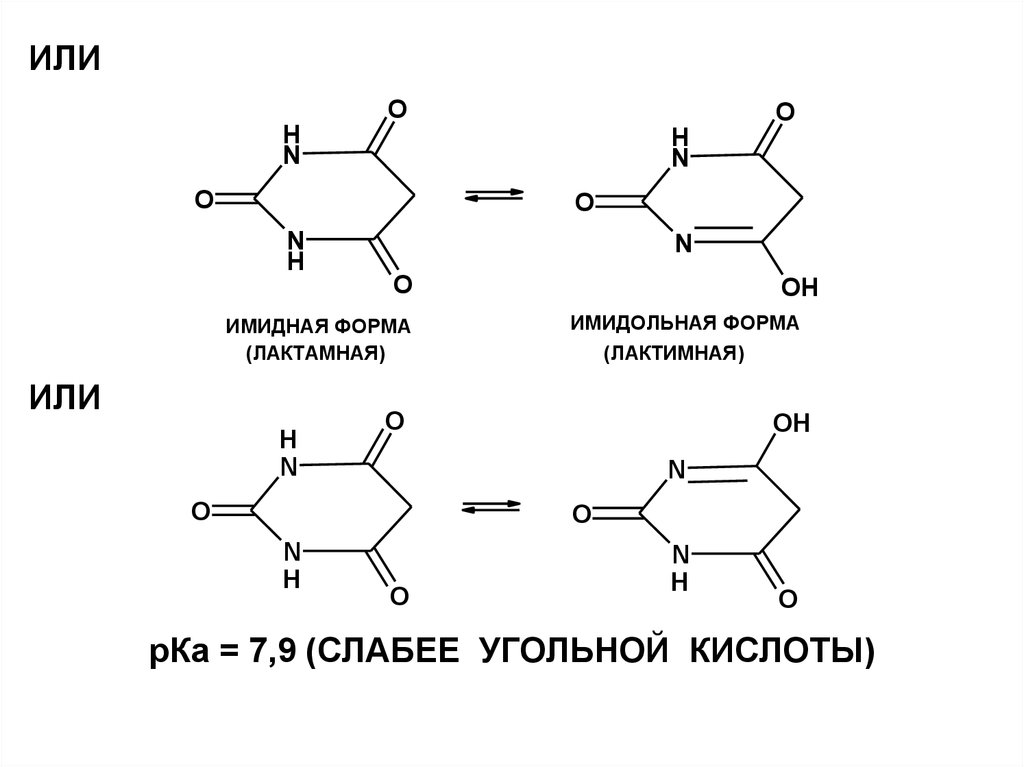
ИЛИO
O
H
N
H
N
O
O
N
H
N
O
ИМИДНАЯ ФОРМА
(ЛАКТАМНАЯ)
ИЛИ
H
N
OH
ИМИДОЛЬНАЯ ФОРМА
(ЛАКТИМНАЯ)
O
OH
N
O
O
N
H
O
N
H
O
рКа = 7,9 (СЛАБЕЕ УГОЛЬНОЙ КИСЛОТЫ)
11.
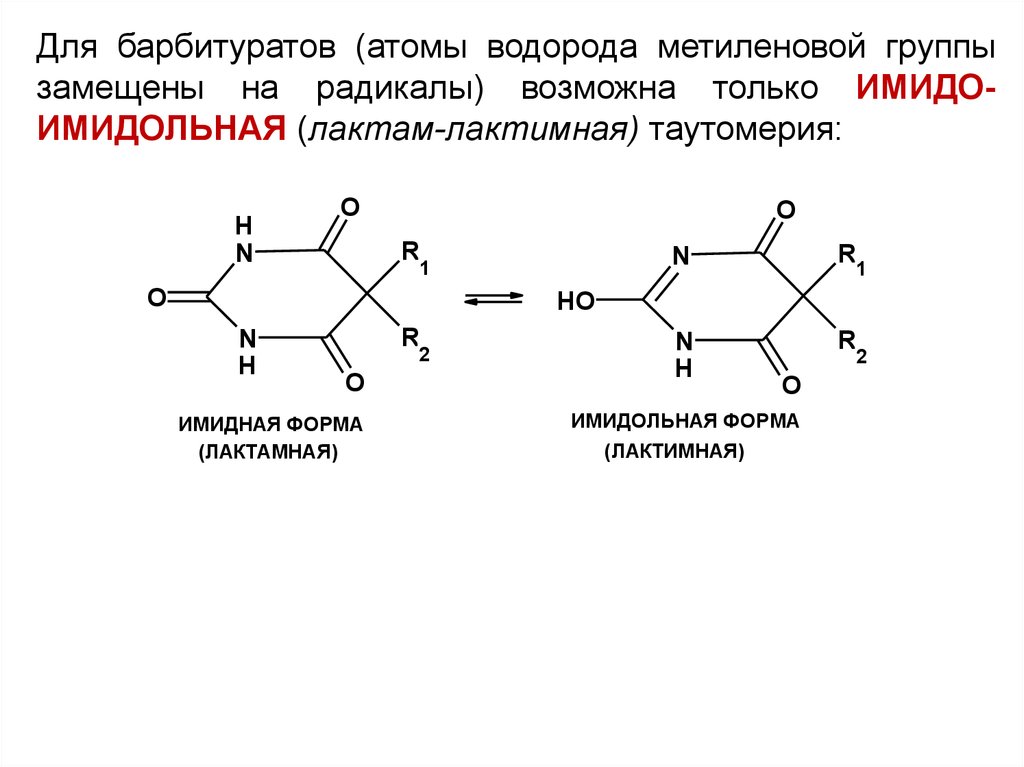
Для барбитуратов (атомы водорода метиленовой группызамещены на радикалы) возможна только ИМИДОИМИДОЛЬНАЯ (лактам-лактимная) таутомерия:
H
N
O
O
R
1
O
N
R
N
H
R
1
HO
N
H
R
2
O
ИМИДНАЯ ФОРМА
(ЛАКТАМНАЯ)
O
ИМИДОЛЬНАЯ ФОРМА
(ЛАКТИМНАЯ)
2
12.
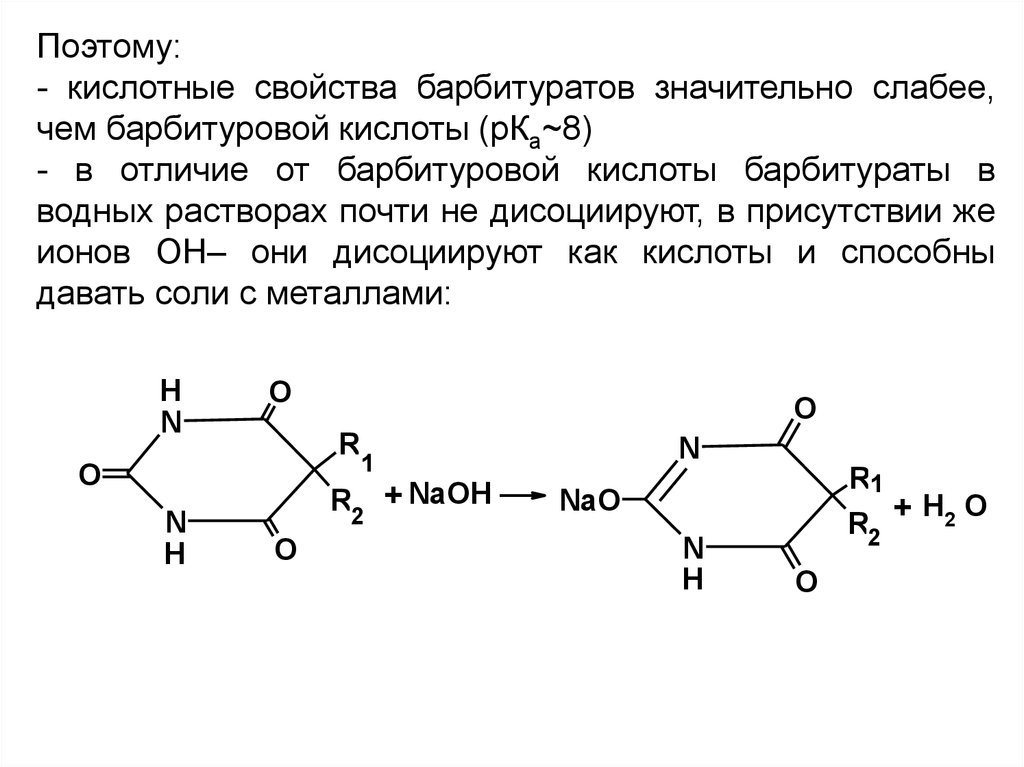
Поэтому:- кислотные свойства барбитуратов значительно слабее,
чем барбитуровой кислоты (рКа~8)
- в отличие от барбитуровой кислоты барбитураты в
водных растворах почти не дисоциируют, в присутствии же
ионов ОН– они дисоциируют как кислоты и способны
давать соли с металлами:
H
N
O
R
O
N
H
O
R2
O
N
1
+ NaOH
R1
NaO
N
H
R2
O
+ H2 O
13.
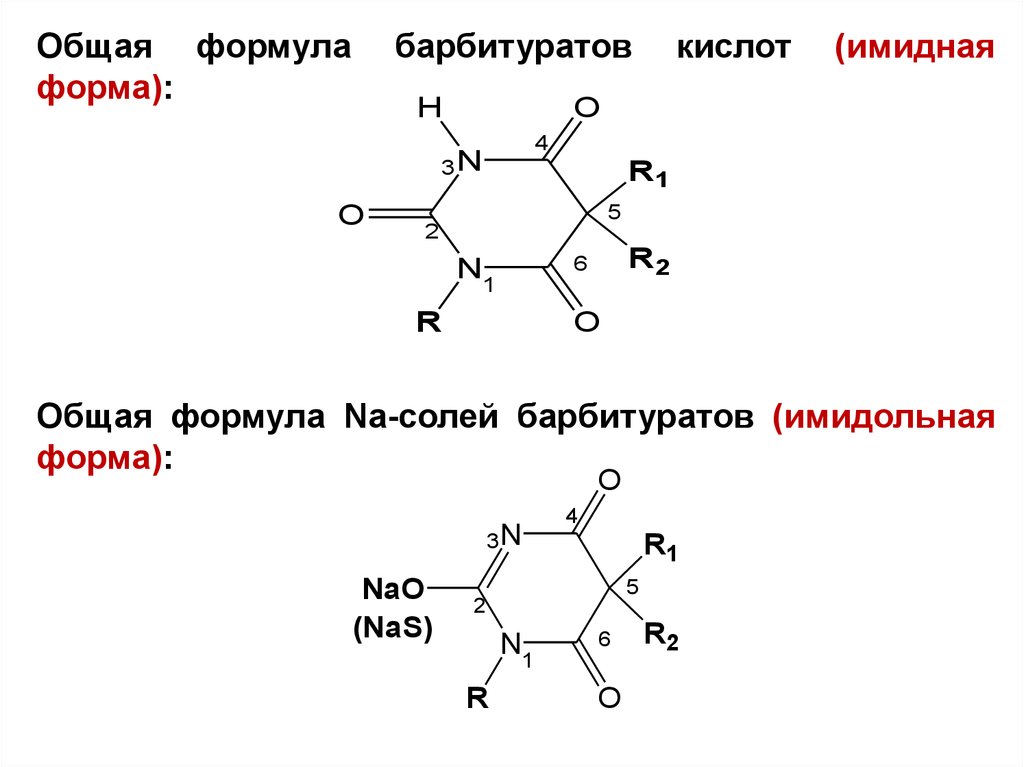
Общая формулаформа):
барбитуратов
H
(имидная
O
4
3N
O
кислот
R1
5
2
R2
6
N1
R
O
Общая формула Na-солей барбитуратов (имидольная
форма):
O
3N
NaO
(NaS)
4
R1
5
2
N1
R
6
O
R2
14.
Связь химической структуры и действия1. Снотворное
действие
проявляют
производные
барбитуровой кислоты, которые в положении 5,5
содержат алкильные или циклические радикалы.
2. Сила и время действия барбитуратов увеличивается при
увеличении длины углеводородной цепи в положении
5,5 до пяти-шести атомов углерода. Дальнейшее
увеличение длины углеводородной цепи приводит к
возникновению возбуждающего действия (судороги).
3. Разветвление
углеводородной
цепи,
наличие
ненасыщенных связей, усиливает фармакологический
эффект и, как правило, сопровождается сокращением
длительности снотворного эффекта.
15.
4. Введение в 5-ое положение фенильного радикалаприводит к появлению противосудорожного действия,
снотворное действие сохраняется(фенобарбитал).
5. Замена водорода в положении 1 остатком ароматической кислоты (например, бензойной) придает препарату
противоэлептическое действие (препарат бензонал).
6. Производные тиобарбитуровой кислоты (в положении 2
содержит атом серы) проявляют более сильное и
кратковременное
действие
по
сравнению
с
кислородсодержащими аналогами.
16.
В последние годы число барбитуратов, применяемых вмедицинской практике, значительно уменьшилось. Это
связано с двумя причинами:
- вызывают привыкание, что приводит к лекарственной
зависимости (наркомании);
- не имеют особых преимуществ перед другими
лекарственными
веществами
подобного
фармакологического действия (например – производные
БЕНЗОДИАЗЕПИНА).
17.
Общий метод синтеза барбитуратов1. Введение заместителей в метиленовую
диэтилового эфира малоновой кислоты:
H2C
COOC2H5
1
1
2
2
R Br
R Br
COOC2H5
2. Конденсация дизамещенных
малоновой кислоты с мочевиной :
NH2
O C
NH2
+
R
C
H5C2OOC
R
2
COOC2H5
R
R
COOC2H5
производных
H
N
1
H5C2OOC
группу
O
R
1
O
N
H
эфира
R
O
2
+ 2 C2H5OH
18.
Общие методы анализа барбитуратовВследствие имидо-имидольной таутомерии барбитураты
являются слабыми кислотами или солями слабых кислот.
Обладая кислыми свойствами, могут образовывать
окрашенные комплексные соли с катионами тяжелых
металлов (Co, Cu, Ag, Hg).
ИДЕНТИФИКАЦИЯ.
1. Общей для всех барбитуратов является реакция с
нитратом кобальта в присутствии хлорида кальция (синефиолетовое окрашивание).
2. Взаимодействие с сульфатом меди приводит к
образованию
различно
окрашенных
комплексных
соединений, что делает испытание более специфичным
19.
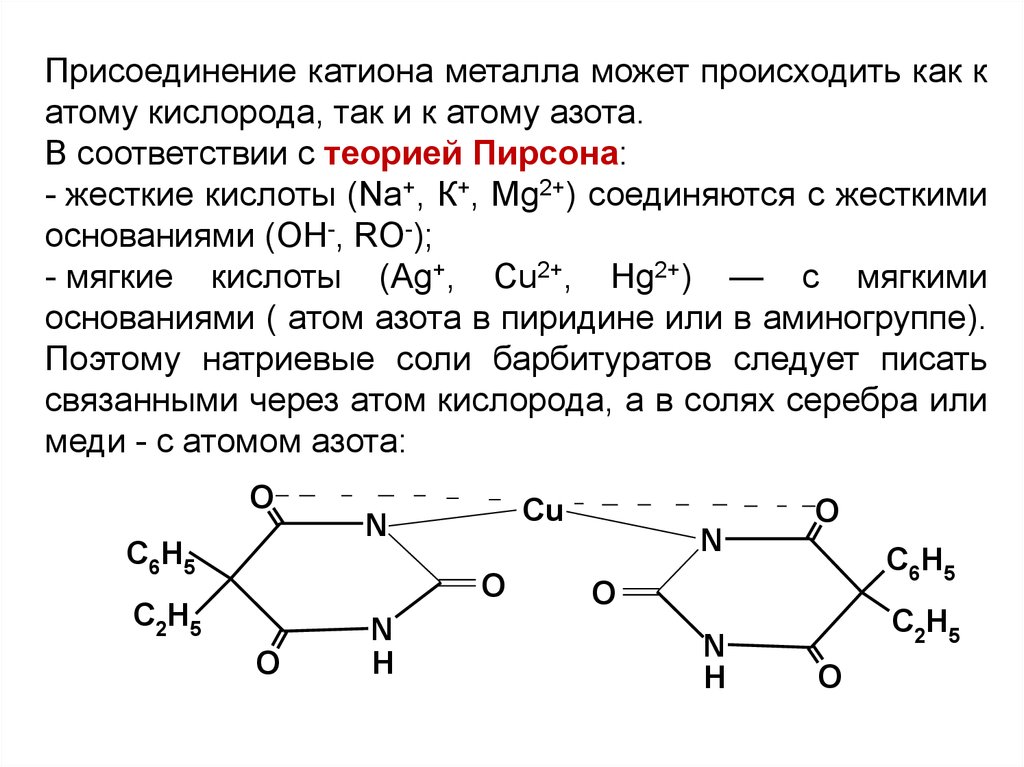
Присоединение катиона металла может происходить как катому кислорода, так и к атому азота.
В соответствии с теорией Пирсона:
- жесткие кислоты (Na+, К+, Mg2+) соединяются с жесткими
основаниями (ОН-, RO-);
- мягкие кислоты (Ag+, Cu2+, Hg2+) — с мягкими
основаниями ( атом азота в пиридине или в аминогруппе).
Поэтому натриевые соли барбитуратов следует писать
связанными через атом кислорода, а в солях серебра или
меди - с атомом азота:
O
C6H5
Cu
N
N
O
C2H5
O
N
H
O
C6H5
O
N
H
C2H5
O
20.
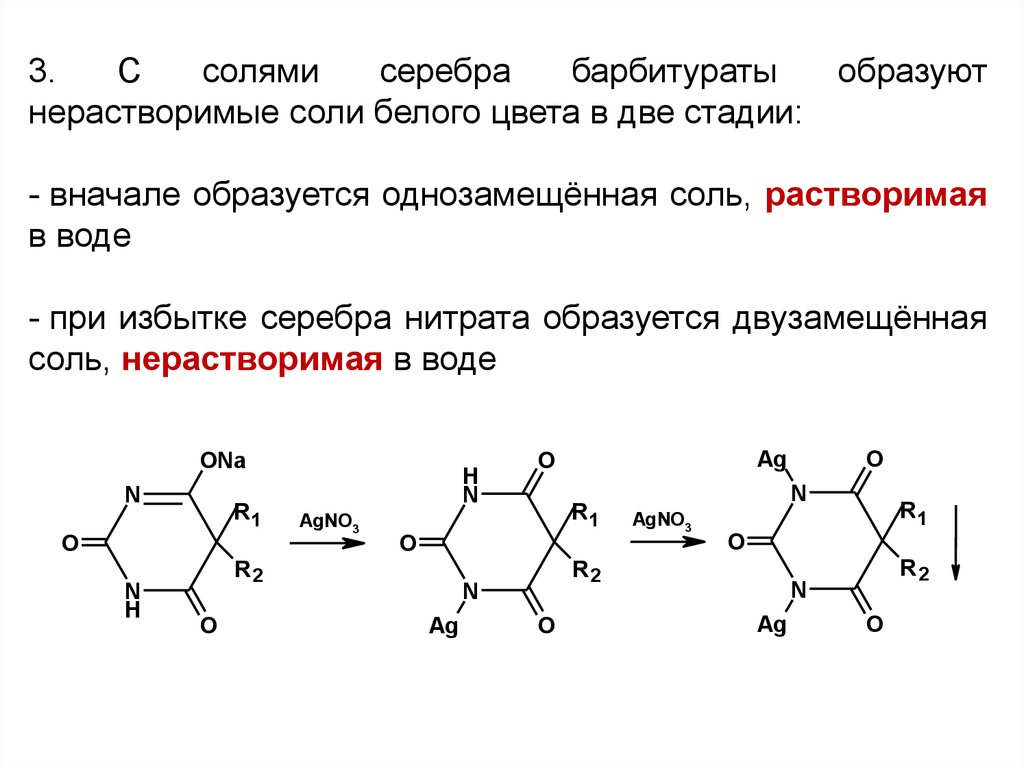
3.С
солями
серебра
барбитураты
образуют
нерастворимые соли белого цвета в две стадии:
- вначале образуется однозамещённая соль, растворимая
в воде
- при избытке серебра нитрата образуется двузамещённая
соль, нерастворимая в воде
ONa
N
R1
O
N
H
H
N
AgNO3
O
R1
O
R2
Ag
N
AgNO3
O
R1
O
R2
N
O
Ag
O
R2
N
Ag
O
21.
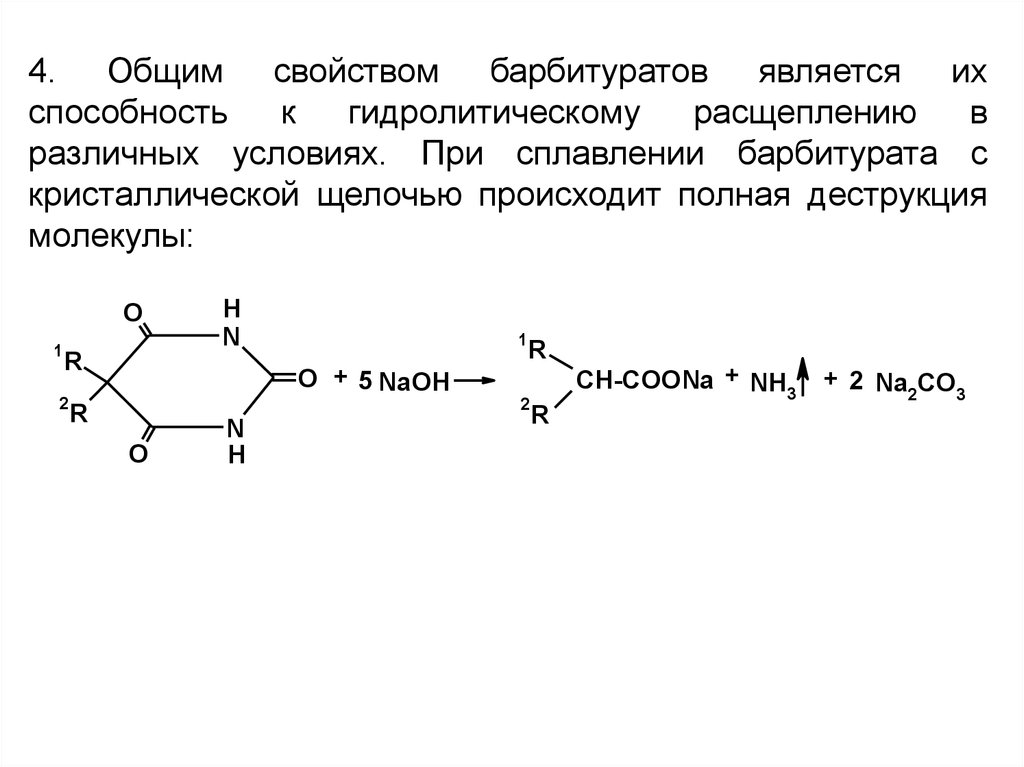
4. Общим свойством барбитуратов является ихспособность
к
гидролитическому
расщеплению
в
различных условиях. При сплавлении барбитурата с
кристаллической щелочью происходит полная деструкция
молекулы:
O
1
H
N
R
2
1
R
CH-COONa + NH3
O + 5 NaOH
2
R
O
N
H
R
+ 2 Na2CO3
22.
Общие методы количественного определениябарбитуратов
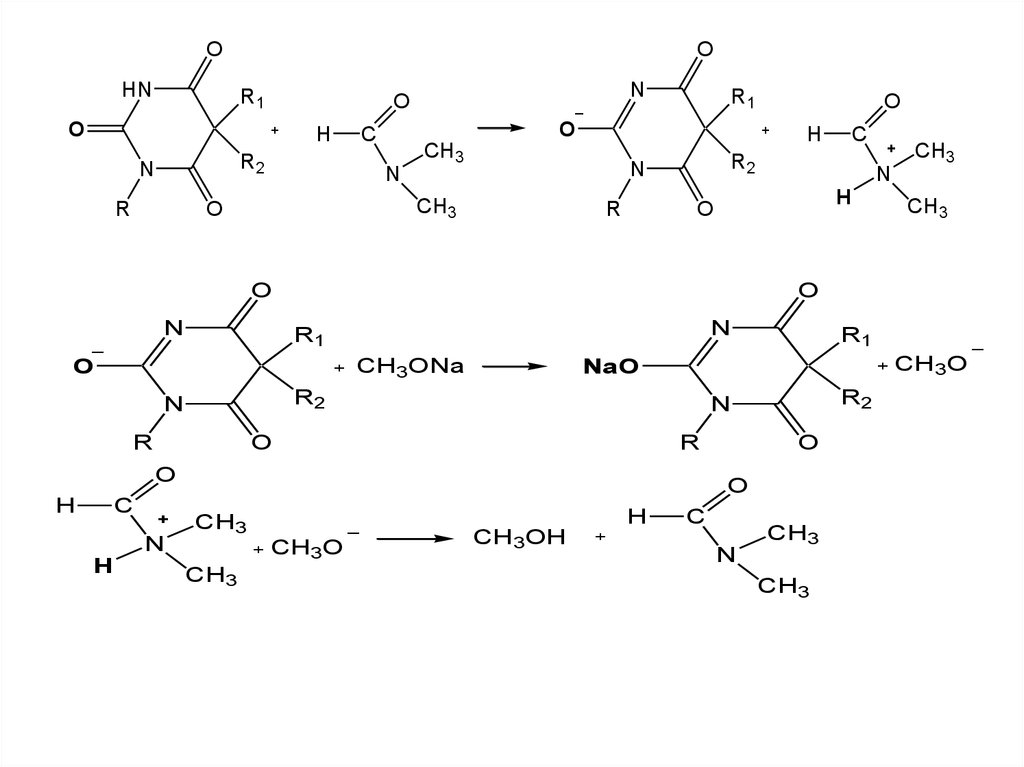
1. Для барбитуратов кислот (имидная форма)
1.1. Метод неводного титрования в среде протофильного
растворителя, который усиливает слабые кислотные
свойства барбитуратов.
Растворитель - диметилформамид (ДМФА)
Титранты: раствор натрия метилата или натрия
гидроксида в смеси метанола и бензола .
Индикатор - тимоловый синий.
Метод основан на способности барбитуратов к
таутомерным
превращениям
и
образованием
имидольной формы, имеющей кислотный характер, по
схеме:
23.
OHN
O
R1
O
O
+
H
N
R
N
N
R
N
H
N
+
CH3ONa
C
N
H
R2
N
R
O
O
CH3
_
+
CH3
CH3
CH3O
H
CH3OH
_
+
R2
O
+
CH3
R1
NaO
O
H
+
O
O
R
C
N
O
R1
N
H
R2
O
_
O
+
CH3
CH3
O
R1
O
C
R2
N
_
C
+
N
CH3
CH3
CH3O
24.
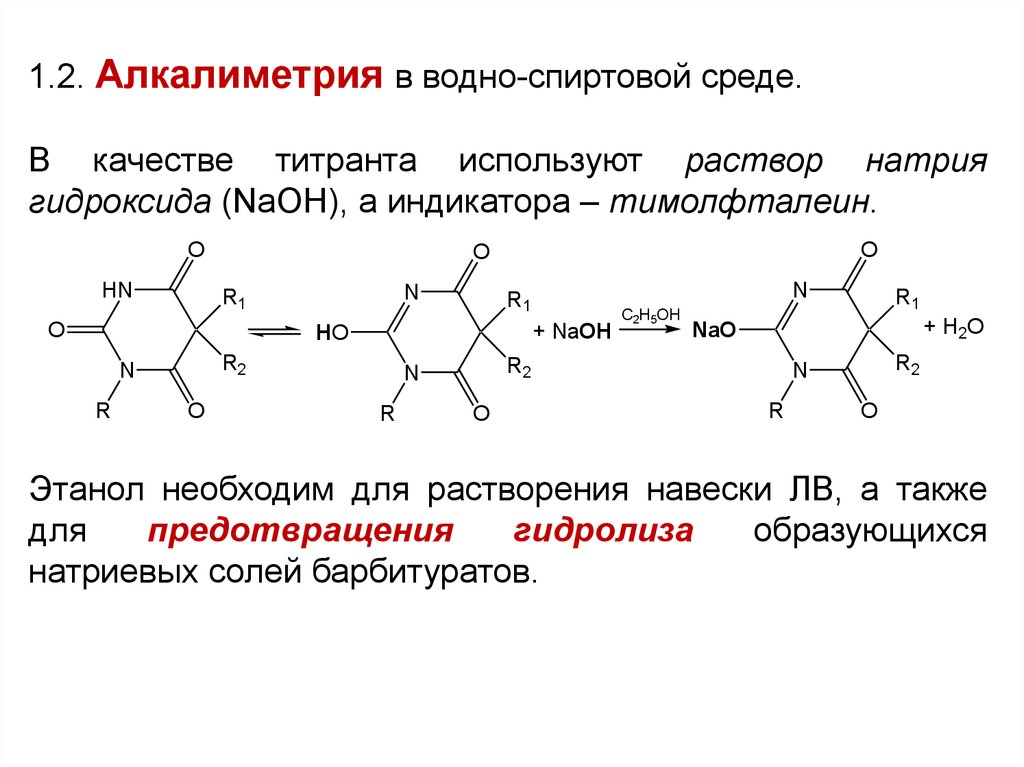
1.2. Алкалиметрия в водно-спиртовой среде.В качестве титранта используют раствор натрия
гидроксида (NaOH), а индикатора – тимолфталеин.
O
HN
O
O
N
R1
O
+ NaOH
HO
R2
N
R
O
N
R1
O
R1
+ H2O
NaO
R2
N
R
C2H5OH
R2
N
R
O
Этанол необходим для растворения навески ЛВ, а также
для
предотвращения
гидролиза
образующихся
натриевых солей барбитуратов.
25.
2. Для Na-солей барбитуратов (имидольная форма)Ацидиметрия.
Na-соли барбитуратов способны гидролизовать в водных
растворах , образуя щелочную среду.
Титрант - раствор хлористооводородной кислоты (HCl)
Cреда - водная.
Индикатор - метиловый оранжевый.
O
N
O
HN
R1
+ HCl
NaO
R
+ NaCl
O
R2
N
O
R1
R2
N
R
O
В расчётах учитывают содержание свободной щёлочи
(% ЛВ - % свободной щелочи)
26.
3. Аргентометрия (без индикатора)Барбитурат растворяется в растворе Na2CO3 и реагирует с
титрантом
AgNO3
с
образованием
растворимой
однозамещенной Ag-соли.
В точке эквивалентности при избытке AgNO3 образуется
нерастворимая двухзамещенная Ag-соль, что указывает
на конец титрования – помутнение раствора.
(уравнения реакций см. выше)
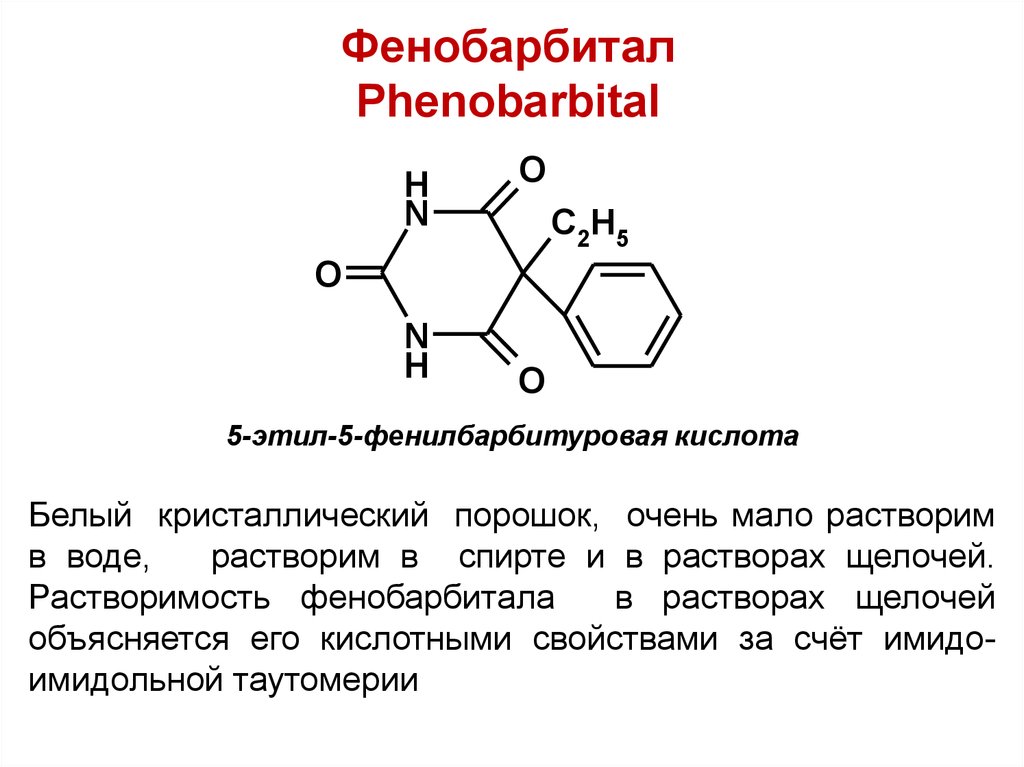
27. Фенобарбитал Phenobarbital
HN
O
C2H5
O
N
H
O
5-этил-5-фенилбарбитуровая кислота
Белый кристаллический порошок, очень мало растворим
в воде,
растворим в спирте и в растворах щелочей.
Растворимость фенобарбитала
в растворах щелочей
объясняется его кислотными свойствами за счёт имидоимидольной таутомерии
28. Подлинность
1. УФ-спектр в буферном растворе с рН=10 имеет полосупоглощения с максимумом при 240нм, в кислом растворе
(рН 2-3) максимумов не имеет.
2. ИК-спектр должен
стандартного образца.
соответствовать
ИК-спектру
3. Общие реакции на барбитураты (см.выше):
3.1. Образует комплексные соли с солями меди(II),
кобальта(II), а также осадки с солями серебра и ртути(II).
3.2. Гидролитическое расщепление - при нагревании с
раствором натрия гидроксида происходит его расщепление
до аммиака и производного уксусной кислоты.
29.
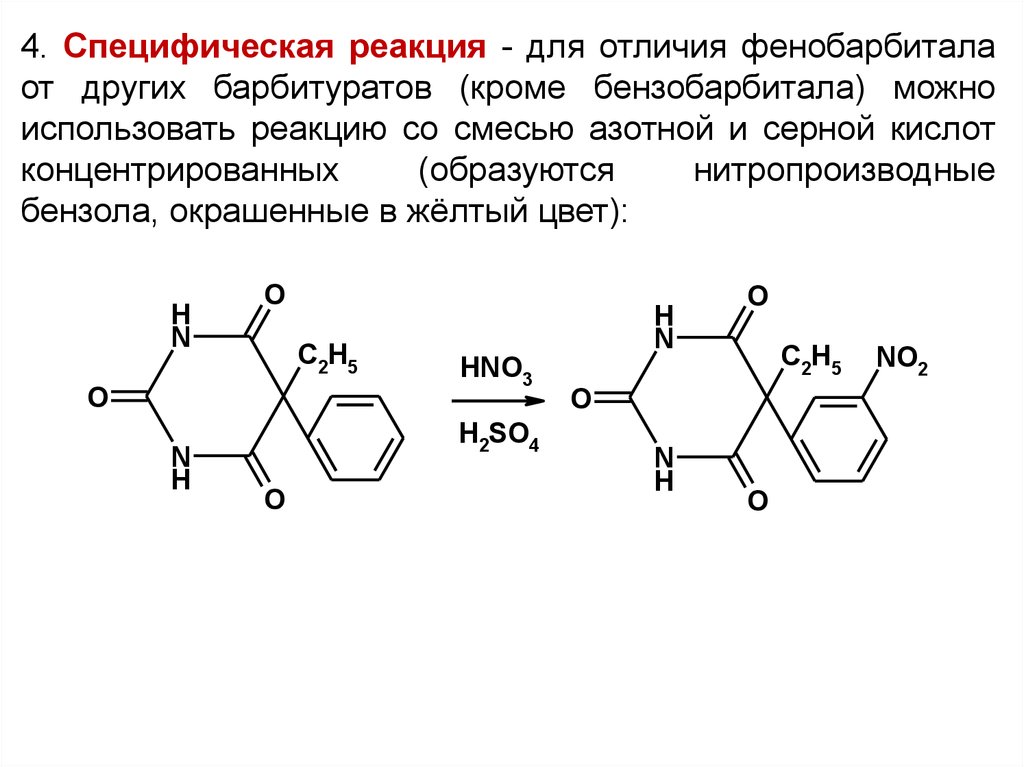
4. Специфическая реакция - для отличия фенобарбиталаот других барбитуратов (кроме бензобарбитала) можно
использовать реакцию со смесью азотной и серной кислот
концентрированных
(образуются
нитропроизводные
бензола, окрашенные в жёлтый цвет):
H
N
O
C2H5
O
N
H
H
N
HNO3
H2SO4
O
O
C2H5
O
N
H
O
NO2
30. Количественное определение
1. Метод неводного титрования в среде ДМФА.2. Алкалиметрия в водно-спиртовой среде - ФС, ФСП и
(ГФ Х)
3. Аргентометрния (в среде натрия карбоната) - European
Pharmacopoeia и BP2009.
4. ВЭЖХ – USP30-NF25.
31.
ПрименениеФенобарбитал оказывает снотворное действие. Однако в
настоящее время он находит большее применение как
противоэпилептическое средство. Также оказывает
седативное и спазмолитическое действие.
Как снотворное средство назначают по 0,1 - 0,2г.
Как противоэпилептическое - начиная с дозы 0,01- 0,02г.
В чистом виде применение фенобарбитала ограничено,
чаще применяется в составе сложных лекарственных
препаратов «ПЕНТАЛГИН», «СЕДАЛГИН», «КАФФЕТИН»
– усиливает действие анальгетиков, уменьшает спазмы
сосудов.
«КОРВАЛОЛ», «ВАЛОКАРДИН» – капли при стенокардии.
ФЕНОБАРБИТАЛ включен в список
НАРКОТИЧЕСКИХ И ПСИХОТРОПНЫХ ПРЕПАРАТОВ
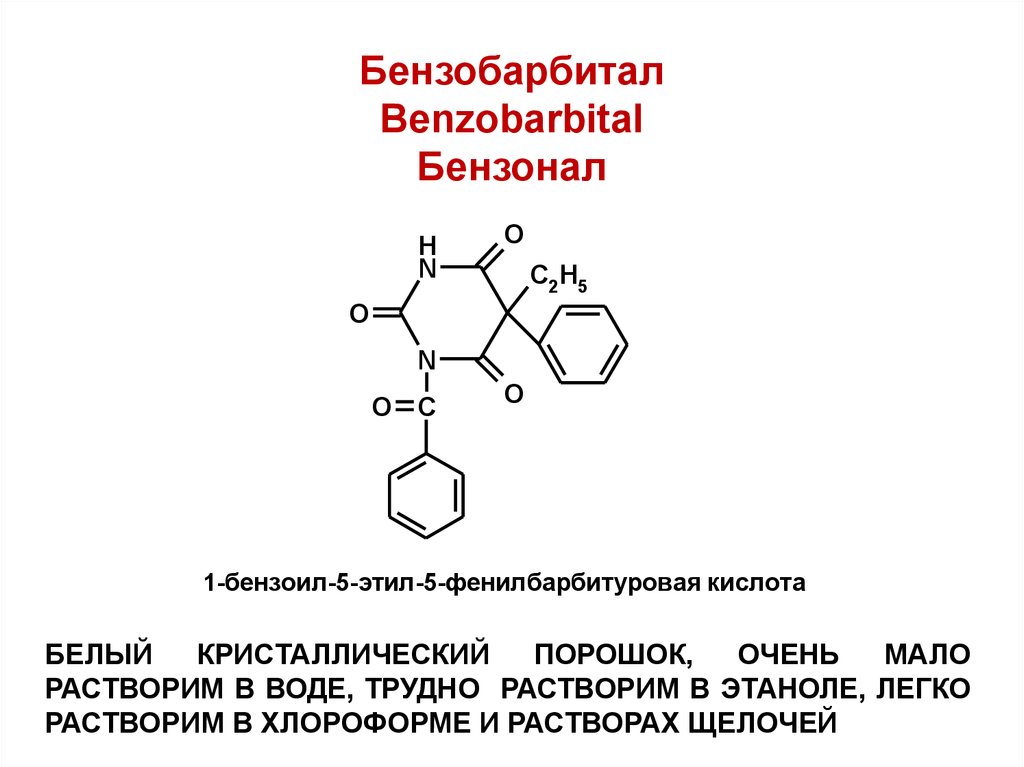
32. Бензобарбитал Benzobarbital Бензонал
HN
O
C2 H5
O
N
O C
O
1-бензоил-5-этил-5-фенилбарбитуровая кислота
БЕЛЫЙ
КРИСТАЛЛИЧЕСКИЙ
ПОРОШОК,
ОЧЕНЬ
МАЛО
РАСТВОРИМ В ВОДЕ, ТРУДНО РАСТВОРИМ В ЭТАНОЛЕ, ЛЕГКО
РАСТВОРИМ В ХЛОРОФОРМЕ И РАСТВОРАХ ЩЕЛОЧЕЙ
33.
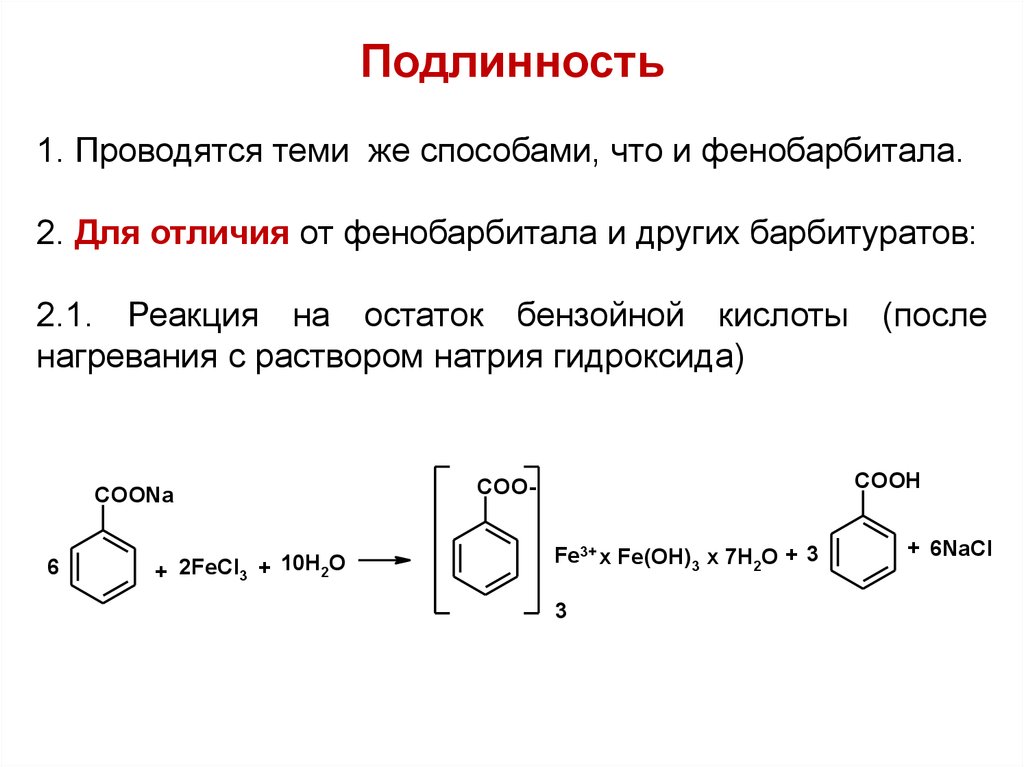
Подлинность1. Проводятся теми же способами, что и фенобарбитала.
2. Для отличия от фенобарбитала и других барбитуратов:
2.1. Реакция на остаток бензойной кислоты (после
нагревания с раствором натрия гидроксида)
COONa
6
+ 2FeCl3 + 10H2O
COOH
COOFe3+ x Fe(OH)3 x 7H2O + 3
3
+ 6NaCl
34.
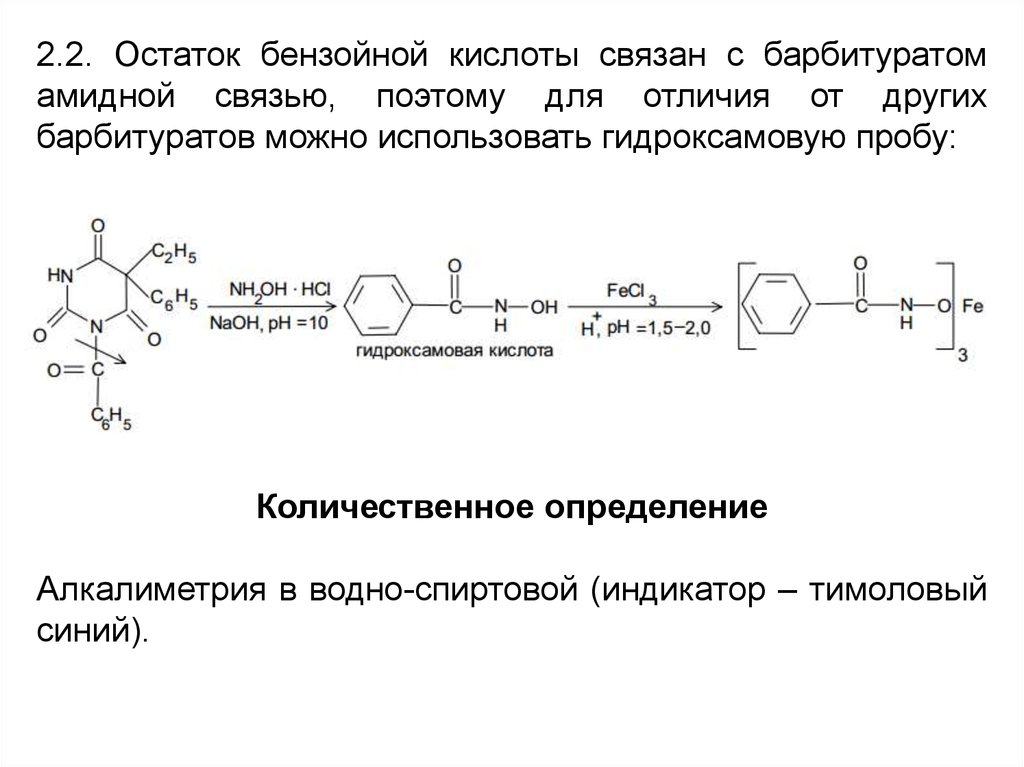
2.2. Остаток бензойной кислоты связан с барбитуратомамидной связью, поэтому для отличия от других
барбитуратов можно использовать гидроксамовую пробу:
Количественное определение
Алкалиметрия в водно-спиртовой (индикатор – тимоловый
синий).
35.
ПрименениеПо
фармакологическому
действию
близок
к
фенобарбиталу.
Однако благодаря введению бензоильного остатка
снотворный эффект значительно слабее. При этом
значительно возрастает его противоэпилептическое
действие.
Форма выпуска – таблетки по 0,05 и 0,1 г.
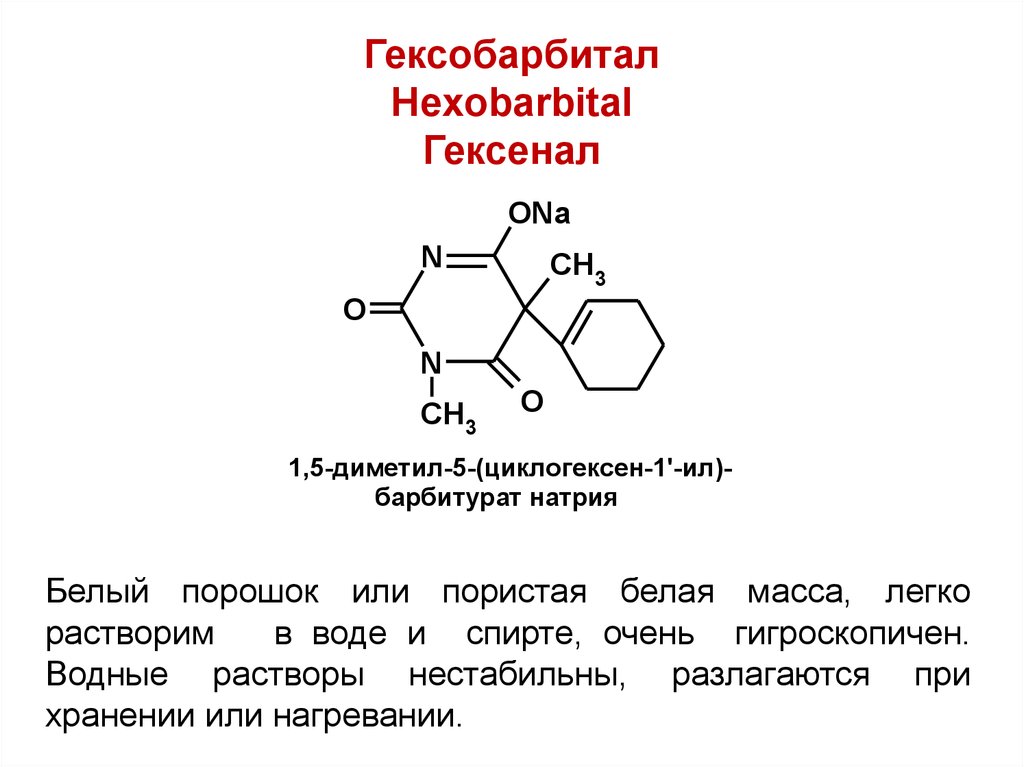
36. Гексобарбитал Hexobarbital Гексенал
ONaN
CH3
O
N
CH3
O
1,5-диметил-5-(циклогексен-1'-ил)барбитурат натрия
Белый порошок или пористая белая масса, легко
растворим
в воде и спирте, очень гигроскопичен.
Водные растворы нестабильны, разлагаются при
хранении или нагревании.
37.
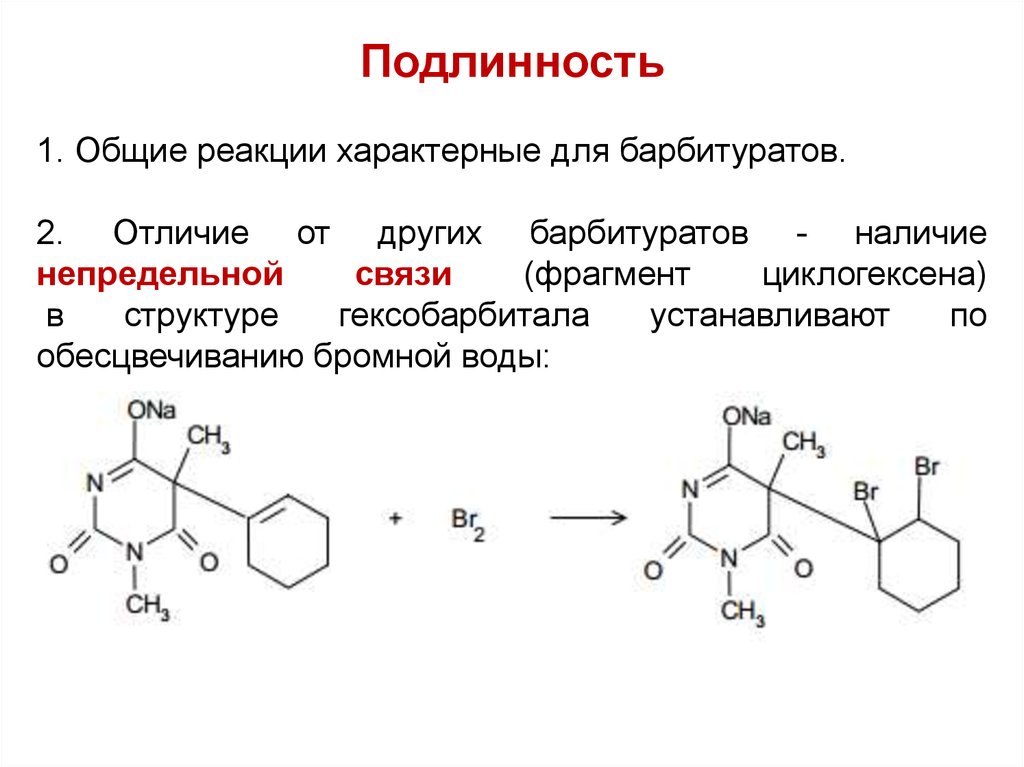
Подлинность1. Общие реакции характерные для барбитуратов.
2. Отличие от других барбитуратов - наличие
непредельной
связи
(фрагмент
циклогексена)
в
структуре
гексобарбитала
устанавливают
по
обесцвечиванию бромной воды:
38.
Количественное определениеАцидиметрия.
ПРЕДСТАВЛЯЕТ СОБОЙ НАТРИЕВУЮ СОЛЬ, ПОЭТОМУ
ТИТРУЕТСЯ
ХЛОРИСТОВОДОРОДНОЙ
КИСЛОТОЙ
(индикатор – метиловый оранжевый).
Броматометрия.
См. выше.
Применение
Для внутривенного наркоза при кратковременных
хирургических вмешательствах.
Выпускают в виде порошка в герметичных флаконах по 1 г.
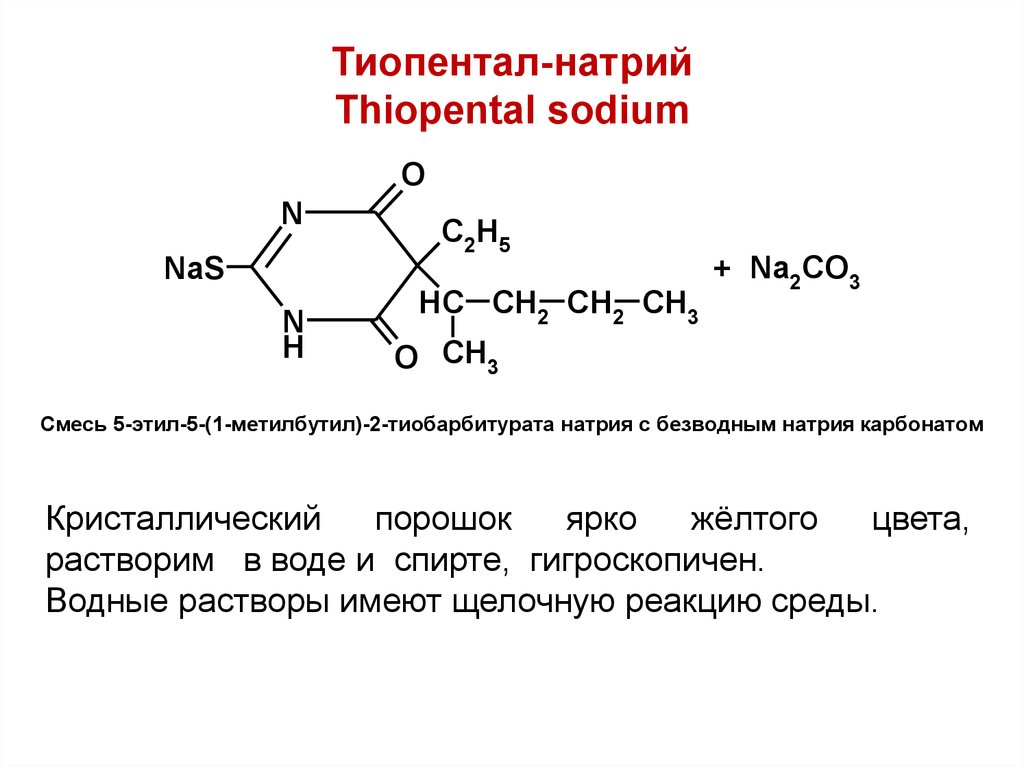
39. Тиопентал-натрий Thiopental sodium
ON
NaS
N
H
C2H5
HC CH2 CH2 CH3
+ Na2CO3
O CH3
Смесь 5-этил-5-(1-метилбутил)-2-тиобарбитурата натрия с безводным натрия карбонатом
Кристаллический
порошок
ярко
жёлтого
цвета,
растворим в воде и спирте, гигроскопичен.
Водные растворы имеют щелочную реакцию среды.
40.
Подлинность1. Общие реакции характерные для барбитуратов:
- при
подкислении
хлористоводородной
кислотой
выпадает осадок;
- сплавление со щелочами – выделяется аммиак и
остаётся сплав красного цвета;
- при взаимодействии с раствором меди(II) сульфата в
карбонатном буферном растворе
появляется жёлтозелёное окрашивание.
2. Атом сульфидной серы можно обнаружить по
черному осадку, образующемуся при кипячении с
раствором свинца ацетата:
Na2S + Pb(CH3COO)2 PbS↓ + 2CH3COONa
41.
Количественное определениеМетод нейтрализации для количественного определения
неприемлем, так как препарат выпускается как смесь
тиопентал-натрия с натрия карбонатом.
Гравиметрия.
Раствор
тиопентал-натрия
хлористоводородной кислотой:
O
N
R
H
N
1
NaS
N
H
R2
O
подкисляют
+ HCl
O
R
1
S
N
H
+ NaCl
R2
O
Полученную
кислотную
форму
(тиопентал-кислоту)
экстрагируют хлороформом, хлороформ отгоняют, остаток
высушивают и взвешивают.
42.
ПрименениеПо
фармакологическому
действию
сходен
с
гексобарбиталом натрия - применяют для внутривенного
наркоза.
Выпускают в виде порошка во флаконах по 0,5 и 1 г.


















 chemistry
chemistry








